1,3-дизаміщені похідні 6,7-дигідро-1н-циклопента[d]піримідин-2,4(3н, 5н)-діону, що проявляють спазмолітичну активність
Номер патенту: 40845
Опубліковано: 27.04.2009
Автори: Пупишева Олена Володимирівна, Мохорт Микола Антонович, Демченко Анатолій Михайлович, Притула Тетяна Павлівна, Кононевич Юрій Миколайович
Формула / Реферат
1,3-дизаміщені похідні 6,7-дигідро-1H-циклопента[d]піримідин-2,4(3H, 5H)-діону, загальної формули:
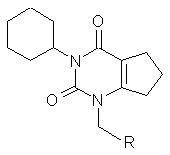 ,
,
де
R=(3-Cl, 4-Cl)-Ph, (4-Br)-Ph, CONHPh, CONHNH-SO2-(4-Me)Ph, CONH-(4-Cl)-Ph, CONH-(4-N-Ac)-Ph, CONH-(3-Cl, 4-OMe)-Ph, що проявляють спазмолітичну активність.
Текст
1,3-дизаміщені похідні 6,7-дигідро-1Hциклопента[d]піримідин-2,4(3H, 5H)-діону, загальної формули: 2 3 40845 Hal O R1 N O 4 O N R2 O N H N 1 R2 R1 2 Сполуку 2 синтезували шляхом взаємодії сполуки 1 з відповідним бензилгалогенідом та карбо O O O O Cl O N O натом калію у диметилформаміді при температурі +120-130°С NaOH,HCl N N O H N O N N O O 1 OH O 4 3 Сполуку 3 синтезовано шляхом взаємодії сполуки 1 з етиловим естером монохлороцтової кислоти та карбонатом калію у диметилформаміді при температурі +120-130°С R1 O R O N H N O Сполуку 4 синтезовано шляхом гідролізу складноестерової групи у сполуці 3 розчином лугу при температурі +70-80°С з наступним підкисленням розчином концентрованої хлороводневої кислоти. N N O N O OH 4 Сполуку 5 одержували шляхом проведення реакції між сполукою 4 та відповідним аміном при O R1 5 N R2 використанні карбонілдиімідазолу для активації карбоксильної групи. 5 40845 H2N N NH2 R N O N N O N N O O HN O Сполуку 6 одержували шляхом нагрівання сполуки 3 з гідразингідратом у етанолі або ізопропанолі [2] Сполуку 7 одержували шляхом реакції сполуки 6 з сульфонілхлоридом у піридині при охолодженні до температури 0°С Приклад 1. Одержання 3-циклогексил-1-(3,4дихлорбензил)-6,7-дигідро-1Нциклопента[[d]піримідин-2,4(3H, 5H)-диону (ІФТ 18) Суміш 2.34г (0.01моль) 3-циклогексил-6,7дигідро-1Н-циклопента[d]піримідин-2,4(3H, 5H)диону, 1.955г (0.01моль) 3,4-дихлорбензилхлориду та 2.76г (0.02моль) карбонату калію перемішують при температурі +120-130°С в 15мл ДМФА на протязі 6-ти годин. Потім суміш охолоджують та вливають в 50мл води. Осад, що утворився, відфільтровують та очищують шляхом кристалізації з ізопропілового спирту. Вихід 3.06г (76%). Тпл. = 141-143°С. 1Н ЯМР (300 MHz, ДМСО-d6) δ : 1.031.18 (m, 1Н, Су), 1.25 (q, 2H, J=12.8Hz, Су), 1.52 (d, 2H, J=12.1Hz, Су), 1.59 (d, 1H, J=12.1Hz, Су), 1.74 (d, 2H, J=12.5Hz, Су), 1.94 (qt, 2H, J=7,5Hz, H-6), 2.34 (q, 2H, J=12.5Hz, Су), 2.56 (t, 2H, J=7.5Hz, H5), 2.81 (t, 2H, J=7.5Hz, H-7), 4.67 (t, 1H, J=11.5Hz, N-CH), 4.95 (s, 2H, N-CH2), 7.22 (dd, 1H, J1=8.4Hz, J2=1.9Hz, Ph), 7.54 (d, 1H, J=1.7Hz, Ph), 7.59 (d, 1H, J=8.4Hz, Ph). Приклад 2. Одержання 1-(4-бромбензил)-3циклогексил-6,7-дигідро-1Hциклопента[d]піримідин-2,4(3H, 5H)-диону (ІФТ 34) Здійснюється аналогічно прикладу 1 з 2.34г (0.01моль) 3-циклогексил-6,7-дигідро-1Hциклопента[d]піримідин-2,4(3H, 5H)-диону, 2.5г 4бромбензил-броміду та 2.76г (0.02моль) карбонату 1 калію. Вихід 3.18г (79%). Тпл.=171-173°С. Н ЯМР (300MHz, ДМСО-d6) δ : 1.03-1.18 (m, 1H, Су), 1.25 (q, 2H, J=12.8Hz, Су), 1.52 (d, 2H, J=12.1Hz, Су), 1.59 (d, 1H, J=12.1Hz, Су), 1.74 (d, 2H, J=12.5Hz, Су), 1.93 (qt, 2H, J=7,5Hz, H-6), 2.32 (q, 2H, J=12.5Hz, Су), 2.55 (t, 2H, J=7.5Hz, H-5), 2.79 (t, 2H, J=7.5Hz, H-7), 4.68 (t, 1H, J=11.5Hz, N-CH), 4.92 (s, 2H, N-CH2), 7.21 (d, 2H, J=8.1Hz, Ph), 7.53 (d, 2H, J=8.4Hz, Ph). Приклад 3. Одержання етил (3-циклогексил2,4-диоксо-2,3,4,5,6,7-гекса-гідро-1Hциклопента[d]піримідин-1-іл) ацетату Суміш 4.686г (0.02моль) 3-циклогексил-2,4диокси-2,3,4,5,6,7-гексагідро-1H-циклопента S Cl O O 3 O O O O O 6 6 HN NH2 7 NH O S O R [d]піримідину, 2.451г (0.02моль) етилового естеру монохлороцтової кислоти та 5.52г (0.04моль) карбонату калію в 30мл N,N-диметилформаміду перемішують при температурі +120-130°С на протязі 6-ти годин, після чого суміш охолоджують та вливають у 100мл води. Продукт одержують у вигляді масла, яке при охолодженні кристалізується, його відфільтровують і промивають декілька разів водою. Вихід 5.13г (80%). Тпл=53-55°С. Приклад 4. Одержання (3-циклогексил-2,4диоксо-2,3,4,5,6,7-гексагідро-1Hциклопента[d]піримідин-1-іл)оцтової кислоти 5.13г (0.016моль) етил (3-циклогексил-2,4диоксо-2,3,4,5,6,7-гексагідро-1Hциклопента[d]піримідин-1-іл) ацетату при нагріванні перемішують у 50мл 20% розчину NaOH до повного розчинення, яке завершується приблизно за 2-3 години. Після чого розчин фільтрують крізь вату для очищення від нерозчинних домішок і підкислюють концентрованим розчином НСl до кислої реакції середовища. Продукт виділяється у вигляді масла, яке зразу кристалізується. Одержують безбарвну кристалічну речовину. Вихід 4.5г (96%). Тпл.=97-99°С. 1Н ЯМР (300MHz, ДМСО-d6) δ : 1.031.18 (m, 1H, Су), 1.24 (q, 2Н, J=12.8Hz, Су), 1.48 (d, 2Н, J=12.1Hz, Су), 1.59 (d, 1H, J=12.1Hz, Су), 1.74 (d, 2H, J=12.5Hz, Су), 1.96 (qt, 2H, J=7,5Hz, H-6), 2.32 (q, 2H, J=12.5Hz, Су), 2.57 (t, 2H, J=7.5Hz, H5), 2.79 (t, 2H, J=7.5Hz, H-7), 4.43 (s, 2H, N-CH2), 4.64 (t, 1H, J=11.5Hz, N-CH), 11.21 (s, 1H, COOH). Приклад 5. Одержання 2-(3-циклогексил-2,4диоксо-2,3,4,5,6,7-гeкcгiдpo-1Hциклoпeнтa[d]пipимiдин-1-iл)-N-фeнiлaцeтaмiдy (ІФТ35) 0.5г (0.0017моль) (3-циклогексил-2,4-диокси2,3,4,5,6,7-гексагідро-1Н-циклопента[d]піримідин-1іл) оцтової кислоти змішують з 0.3243г (0.002моль) N,N'-карбонілдіімідазолу у 4мл висушеного над Р2О5 ацетонітрилу, в результаті чого спостерігається виділення вуглекислого газу. Одержаний розчин витримують 30 хвилин при температурі +70°С, а потім додають 0.1583г (0.0017моль) аніліну. Розчин витримують на ультразвуковій мийці при температурі +70°С на протязі 8-ми годин. Після цього розчинник упарюють у вакуумі, до залишку додають 10мл 5% розчину NaHCO3. Осад, що виділився відфільтровують, на фільтрі промивають декілька разів 5% розчином NaHCO3 та водою. Вихід 0.46г (74%). Тпл.=205-207°С. LC/MS: m/z 7 368.3 [М+Н]+. Приклад 6. Одержання N-(4-хлорфеніл)-2-(3циклогексил-2,4-диоксо-2,3,4,5,6,7-гексагідро-1Hциклопента[d]піримідин-1-іл)ацетаміду (ІФТ 54) Одержується аналогічно прикладу 5 з 0.5г (0.0017моль) (3-циклогексил-2,4-диoкcи-2,3,4,5,6,7гeкcaгiдpo-1H-циклoпeнтa[d]пipимiдин-1-iл) оцтової кислоти, 0.3243г (0.002моль) N,N'карбонілдіімідазолу та 0.217г (0.0017моль) 4хлораніліну. Вихід 0.526г (77%). Тпл.=231-233°С. 1Н ЯМР (400 MHz, ДМСО-d6) δ : 1.11 (m, 1Н, Су), 1.24 (q, 2Н, J=12.8Hz, Су), 1.49 (d, 2H, J=12.1Hz, Су), 1.58 (d, 1H, J=12.1Hz, Су), 1.74 (d, 2H, J=12.5Hz, Су), 1.98 (qt, 2H, J=7,5Hz, H-6), 2.33 (q, 2H, J=12.5Hz, Су), 2.59 (t, 2H, J=7.5Hz, H-5), 2.82 (t, 2H, J=7.5Hz, H-7), 4.55 (s, 2H, N-CH2), 4.65 (t, 1H, J=11.5Hz, N-CH), 7.39 (d, 2H, J=8.7Hz, Ph), 7.60 (d, 2H, J=8.7Hz, Ph), 10.51 (s, 1H, NH). Приклад 7. Одержання N-(3-хлор-4метоксифеніл)-2-(3-циклогексил-2,4-диоксо2,3,4,5,6,7-гексагідро-1H-циклопента[d]піримідин-1іл)ацетаміду (ІФТ 57) Одержується аналогічно прикладу 5 з 0.5г (0.0017моль) (3-циклогексил-2,4-диокси-2,3,4,5,6,7гексагідро-1Н-циклопента[d]піримідин-1-іл) оцтової кислоти, 0.3243г (0.002моль) N,N'карбонілдіімідазолу та 0.268г (0.0017моль) 3-хлор4-метоксианіліну. Вихід 0.624г (85%). Тпл.=2341 236°С. Н ЯМР (300MHz, ДMCO-d6) δ : 1.10 (m, 1H, Су), 1.24 (q, 2H, J=12.8Hz, Су), 1.49 (d, 2H, J=12.1Hz, Су), 1.59 (d, 1H, J=12.1Hz, Су), 1.75 (d, 2H, J=12.5Hz, Су), 1.97 (qt, 2H, J=7,5Hz, H-6), 2.32 (q, 2H, J=12.5Hz, Су), 2.58 (t, 2H, J=7.5Hz, H-5), 2.82 (t, 2H, J=7.5Hz, H-7), 3.82 (s, 3H, OCH3), 4.51 (s, 2H, N-CH2), 4.65 (t, 1H, J=11.5Hz, N-CH), 7.14 (d, 1H, J=8.8Hz, Ph), 7.40 (dd, 1H, J1=8.8Hz, J2=2.4Hz, Ph), 7.76 (d, 1H, J=2.0Hz, Ph), 10.34 (s, 1H, NH). Приклад 8. Одержання N-[4(ацетиламіно)феніл]-2-(3-циклогексил-2,4-диоксо2,3,4,5,6,7-гексагідро-1H-циклопента[d]піримідин-1іл)ацетаміду (ІФТ 55) Одержується аналогічно прикладу 5 з 0.5г (0.0017моль) (3-циклогексил-2,4-диокси-2,3,4,5,6,7гексагідро-1Н-циклопента[d]піримідин-1-іл) оцтової кислоти, 0.3243г (0.002моль) N,N'карбонілдіімідазолу та 0.255г 4ацетиламіноаніліну. Вихід 0.5г (70%). Тпл.=2551 257°С. Н ЯМР (300MHz, ДMCO-d6) δ : 1.11 (m, 1Н, Су), 1.24 (q, 2H, J=12.8Hz, Су), 1.49 (d, 2H, J=12.1Hz, Су), 1.59 (d, 1H, J=12.1Hz, Су), 1.74 (d, 2H, J=12.5Hz, Су), 2.02 (m, 5H, CH3, H-6), 2.30 (q, 2H, J=12.5Hz, Су), 2.59 (t, 2H, J=7.5Hz, H-5), 2.82 (t, 2H, J=7.5Hz, H-7), 4.52 (s, 2H, N-CH2), 4.65 (t, 1H, J=11.5Hz, N-CH), 7.49 (q, 4H, J=4.9Hz, Ph), 9.88 (s, 1H, NH), 10.25 (s, 1H, NH). Приклад 9. Одержання 2-(3-циклогексил-2,4диоксо-2,3,4,5,6,7-гекса-гідро-1Hциклопента[d]піримідин-1-іл)ацетогідразиду До розчину 3.2г (0.01моль) етил (3циклогексил-2,4-диоксо-2,3,4,5,6,7-гекса-гідро-1Hциклопента[d]піримідин-1-іл) ацетату у 30мл етилового спирту додають 0.75г (0.015моль) гідразин гідрату та суміш нагрівають на водяній бані на протязі 4-х годин. Після цього розчинник відгоняють у вакуумі, а до залишку додають 30мл води. 40845 8 Осад відфільтровують та промивають водою. Вихід 2.08г (68 %).Тпл.=155-157°С Приклад 10. Одержання N'-[(3-циклогексил2,4-диоксо-2,3,4,5,6,7-гексагідро-1Hциклопента[d]піримідин-1-іл)ацетил]-4бензенсульфоно-гідразид (ІФТ 36) До розчину 0.5г (0.0016моль) 2-(3-циклогексил2,4-диоксо-2,3,4,5,6,7-гекса-гідро-1Hциклопента[d]піримідин-1-іл)ацетогідразиду у 5мл піридину при охолодженні льодом додають 0.305г (0.0016моль) 4-метилбензолсульфохлориду. Суміш перемішують одну годину при кімнатній температурі та потім виливають в 20мл води. Осад, що виділився, відфільтровують та промивають декілька разів водою. Вихід 0.626г (85%). Тпл.=256258°С. 1Н ЯМР (300MHz, ДМСО-d6) δ : 1.01-1.16 (m, 1H, Су), 1.24 (q, 2Н, J=12.8Hz, Су), 1.42 (d, 2Н, J=12.1Hz, Су), 1.59 (d, 1H, J=12.1Hz, Су), 1.74 (d, 2H, J=12.5Hz, Су), 1.87 (qt, 2H, J=7,5Hz, H-6), 2.28 (q, 2H, J=12.5Hz, Су), 2.36 (s, 3H, PhCH3), 2.39-2.59 (m, 4H, H-5, H-7), 4.26 (s, 2H, N-CH2), 4.60 (m, 1H, N-CH), 7.34 (d, 2H, J=7.3Hz, Ph), 7.68 (d, 2H, J=7.3Hz, Ph), 9.98 (s, 1H, CONH), 10.49 (s, 1H, SO2NH). Приклад 11. Встановлення спазмолітичної активності сполук корисної моделі Спазмолітична активність нових синтезованих сполук досліджувалась оцінюванням величини їх спазмолітичного ефекту в порівнянні з класичним спазмолітиком - дротаверином. Досліджувані сполуки, в залежності від ступеня розчинності, розчиняли в етанолі, диметилсульфоксиді, чи диметилацетаміді з подальшим використанням для приготування робочих розчинів. Вивчення скорочувальної активності судин гладеньких м'язів здійснювали на сегментах грудної аорти щурів обох статей лінії Вістар. Тварини забивались шляхом цервікальної дислокації, яка підтверджена як гуманна, декларацією 3-го Національного конгресу з біоетики. Для експерименту залучали частину аорти, розташовану ближче до розгалуження з більшою щільністю рецепторів. Сегменти судин поміщали в робочу камеру зі стандартним буферним розчином Кребса-Хенслейта (рН 7.4) при постійній температурі +36-37°С. Вихідне тонічне скорочення ізольованих фрагментів судин викликали розчином фенілефрину в концен-6 трації 10 М. Вибір щодо фенілефрину, який є синтетичним замінником біогенного аміну - епінефрину, обумовлений його здатністю взаємодіяти з α адренорецепторами, що співпадає з явищами стимуляції симпатичних нервів, яке призводить до спазму судин. Розчин Кребса був наступного складу в (моль/л): NaCl (133.0), КСl (4.7), MgCl2 (1.05), СаСl2 (2.5), NaH2PO4 (1.38), NaHCO3 (16.3), глюкоза (7.82). Запис скорочень проводився на самописці model 202, Cole-Parmer Instrument Company, USA. Вірогідність відмінностей між кількісними показниками в дослідних і контрольних групах оцінювали за t-критерієм Student. 1,3-дизаміщені похідні циклопента[d]піримідину пригнічували спазм судин, викликаний фенілефрином з різним ступенем активнос 9 40845 ті. Максимальна спазмолітична ефективність сполук під шифром ІФТ-34, 35, 36 не досягала аналогічної препарата порівняння і становила відповідно 77, 84 та 82%. Сполуки ІФТ-18 та 54 знімали спазм судин аорти, ініційований фенілефрином, на рівні дротаверина, а найбільш активною речовиною, яка достовірно ефективніше прототипа пригнічувала спастичний стан судин, виявилась сполука ІФТ-55. Результати проведених досліджень представлені в табл. 1. 10 стовували дистильовану воду, а сполуки, які розчинялись в органічних розчинниках, спочатку емульгували в твіні, а потім з'єднували з 2% розчином крохмалю. Спостереження вели протягом 14 діб від моменту введення речовини, та до періоду відновлення поведінкових реакцій, або до загибелі тестуємих тварин. Згідно отриманих даних по визначенню середньолетальних доз встановлено, що всі тестовані сполуки належать до класу малотоксичних речовин (таблиця 2). Таблиця 1 Таблиця 2 Значення ефективних концентрацій 1,3дизаміщених похідних 6,7-дигідро-1Hциклопента[d]піримідин-2,4(3Н, 5Н)-діону та препарату порівняння (дротаверин) на фоні конструкції судин фенілефрином в концентрації 10-6М/л (n=6) Речовина Дротаверин ІФТ 18 ІФТ 34 ІФТ 35 ІФТ 36 ІФТ 54 ІФТ 55 ІФТ 57 Показники ефективних концентрацій ЕС50, (моль/л) -5.86 -5.36 -4.81 -4.91 -4.52 -5.30 -6.79 -6.02 Приклад 12. Дослідження гострої токсичності Для визначення гострої токсичності найбільш активних сполук ми застосували метод В.Б. Прозоровського (найменших квадратів) [5]. Експеримент проводили на білих мишах обох статей, масою 18-22г. Під час спостереження складали клінічну картину ознак отруєння сполуками. Останні вводили тваринам внутрішньошлунково через металевий зонд, одноразово в геометрично наростаючих дозах. Для розчинних сполук викори Комп’ютерна верстка А. Крулевський Середньосмертельні дози найбільш активних синтезованих міотропних сполук в порівнянні з дротаверином Речовина Дротаверин ІФТ 18 ІФТ 55 ІФТ 57 ЛД50 мг/кг, та довірчі дози 564.0(389.4-743.4) >3160.0 2240.0(1626.4-3042.4) >3980.0 Таким чином, отримані данні вказують на те, що синтезовані сполуки проявляють виражений спазмолітичний ефект, та належать до класу малотоксичних речовин. Джерела інформації: 1. Машковский М.Д. Лекарственные средства. В двух частях. Ч. 1. - М.: Медицина, 1998. - 736 с. 2. Senda S., Hirota К., Маеnо К. // Chem. Pharm. Bull. - 1973. - Vol. 21, №9. - P.1894-1900. 3. Гокина Н.И. О природе электромеханической связи в гладких мышцах мозговых артерий. // Физиолог. ж-л. - 1982. - Т. 28. - №2. - С.119-124. 4. Гурковская А.В., Шуба М.Ф., Бурый В.А. О природе электромеханической связи в гладкомышечных клетках легочной артерии. // Физиолог, жл. СССР. - 1983. - Т. 69. - №8. - С.1065-1073. 5. Беленький М.Л. Элементы качественной оценки фармакологического эффекта. - Л.: - Медгиз. - 1963. - 216с. Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською1,3-disubstituted derivatives of 6,7-dihydro-1h-cyclopenta[d]pyrimidine-2,4(3h,5h)-dione exhibiting antispasmodic activity
Автори англійськоюDemchenko Anatolii Mykhailovych, Kononevych Yurii Mykolaiovych, Prytula Tetiana Pavlivna, Pupysheva Olena Volodymyrivna, Mokhort Mykola Antonovych
Назва патенту російською1,3-дизамещенные производные 6,7-дигидро-1н-циклопента[d]пиримидин-2,4(3н,5н)-диона, которые проявляют спазмолитическую активность
Автори російськоюДемченко Анатолий Михайлович, Кононевич Юрий Николаевич, Притула Татьяна Павловна, Пупишева Елена Владимировна, Мохорт Николай Антонович
МПК / Мітки
МПК: C07D 239/00, A61K 31/517
Мітки: 6,7-дигідро-1н-циклопента[d]піримідин-2,4(3н, проявляють, похідні, 1,3-дизаміщені, спазмолітичну, 5н)-діону, активність
Код посилання
<a href="https://ua.patents.su/5-40845-13-dizamishheni-pokhidni-67-digidro-1n-ciklopentadpirimidin-243n-5n-dionu-shho-proyavlyayut-spazmolitichnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">1,3-дизаміщені похідні 6,7-дигідро-1н-циклопента[d]піримідин-2,4(3н, 5н)-діону, що проявляють спазмолітичну активність</a>
Попередній патент: Органо-неорганічна композиція
Наступний патент: Спосіб виготовлення хліба з використанням хмелевих заквасок
Випадковий патент: Спосіб усунення дефекту різального краю ікла