Похідні 2-піридону, фармацевтична композиція на їх основі, спосіб їх отримання (варіанти)
Номер патенту: 84571
Опубліковано: 10.11.2008
Автори: Нікітідіс Антоніос, Ленн Ганс, Андерссон Мар'яна, Шелін Петтер, Гансен Петер
Формула / Реферат
1. Сполука формули (І)
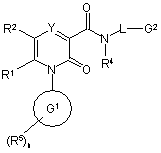 ,
,
де:
Y - CR3a6o N,
R1 - Н або С1-6-алкіл;
R2 - феніл або 5-6-членне гетероароматичне кільце, що містить 1-4-гетероатоми, незалежно вибрані з О, S та N; вказане ароматичне кільце, як варіант, заміщене 1-3 замісниками, вибраними незалежно з групи: ОН, галоген, С1-6-алкіл, С1-6-алкоксил, NR58COR50, COOR51, COR52, CONR53R54 та NR47R48; вказаний алкіл крім того, як варіант, заміщений групою: ОН, С1-6-алкоксил, CN або CO2R49;
R47 тa R48 незалежно репрезентують Н, С1-6-алкіл або С2-6-алканоїл;
R3 - Н або F;
G1 - феніл або 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N;
R5 - Н, галоген, С1-6-алкіл, CN, С1-6-алкоксил, NO2, NR14R15, С1-3-алкіл, заміщений одним або більше атомами F, або С1-3-алкоксил, заміщений одним або більше атомами F;
R14 та R15 незалежно репрезентують Н або С1-3-алкіл; вказаний алкіл крім того, як варіант, заміщений одним або більше атомами F;
n дорівнює цілому числу 1, 2 або 3, а коли n дорівнює 2 або 3, кожну групу R5 вибрано незалежно;
R4 - Н або С1-6-алкіл; вказаний алкіл крім того, як варіант, заміщений ОН або С1-6-алкоксилом;
або R4 та L з'єднані разом так, що група -NR4L є 5-7-членним азациклічним кільцем, що, як варіант, має в собі ще один гетероатом, вибраний з О, S та NR16, а
L - зв'язок, О, S(O)р, NR29 або С1-6-алкіл; вказаний алкіл, як варіант, має в собі гетероатом, вибраний з О, S та NR16; та вказаний алкіл крім того, як варіант, заміщено ОН або ОМе;
G2 - моноциклічна кільцева система, вибрана з групи:
і) феніл або феноксил,
іі) 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N,
ііі) С3-6-насичений або частково ненасичений циклоалкіл, або
iv) С4-7-насичене або частково ненасичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)р та NR17, та, як варіант, крім того має в собі карбоніл; або
G2 - дициклічна кільцева система, у котрій кожне з двох кілець незалежно вибране з групи:
і) феніл,
іі) 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S тa N,
ііі) С3-6-насичений або частково ненасичений циклоалкіл, або
iv) С4-7-насичене або частково ненасичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)P та NR17, та, як варіант, крім того має в собі карбоніл;
а два кільця конденсовані разом, зв'язані безпосередньо або розділені лінкерною групою, вибраною з О, S(O)q або СН2,
вказану моноциклічну або дициклічну кільцеву систему крім того, як варіант, заміщено 1-3 замісниками, незалежно вибраними з групи: CN, ОН, С1-6-алкіл, С1-6-алкоксил, галоген, NR18R19, NO2, OSO2R38, CO2R20, C(=NH)NH2, C(O)NR21R22, C(S)NR23R24, SC(=NH)NH2, NR31C(=NH)NH2, S(O)SR25, SO2NR26R27, С1-3-алкоксил, заміщений одним або більше атомами F, та С1-3-алкіл, заміщений SO2R39, NR56R57, або одним або більше атомами F;
коли L не є зв'язком, G2 може також бути Н;
у кожному вияві р, q, s та t незалежно дорівнюють цілому числу 0, 1 або 2;
R18 та R19 незалежно репрезентують Н, С1-6-алкіл, форміл, С2-6-алканоїл, S(O)tR32 або SO2NR33R34; вказаний алкіл крім того, як варіант, заміщений замісником, вибраним з галогену, CN, С1-4-алкоксилу чи CONR4IR42;
R25 - Н, С1-6-алкіл або С3-6-циклоалкіл; вказаний алкіл крім того, як варіант, заміщений одним або більше замісниками, вибраними незалежно з групи: ОН, CN, CONR35R36, CO2R37, OCOR40, С3-6-циклоалкіл, С4-7-насичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)р та NR43, та феніл або 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N; вказане ароматичне кільце крім того, як варіант, заміщене одним або більше замісниками, вибраними незалежно з галогену, CN, С1-4-алкілу, С1-4-алкоксилу, ОН, CONR44R45,CO2R46,S(O)sR55 тa NHCOCH3;
R32 - Н, С1-6-алкіл або С3-6-циклоалкіл;
R16, R17, R20, R21, R22, R23, R24, R26, R27, R29, R31, R33, R34, R35, R36, R37, R38, R39, R40, R41, R42, R43, R44, R45, R46, R49, R50, R51, R52, R53, R54, R55, R56, R57 та R58 незалежно репрезентують Н або С1-6-алкіл;
та її фармацевтично прийнятні солі.
2. Сполука формули (І) за п. 1, де Y - CR3.
3. Сполука формули (І) за п. 1 або п. 2, де G1 - феніл.
4. Сполука формули (І) за будь-яким з пп. 1-3, де R5 - Сl, СН3, CN або CF3.
5. Сполука формули (І) за будь-яким з пп. 1-4 або її фармацевтично прийнятна сіль для застосування як медикаменту.
6. Сполука формули (І) за будь-яким з пп. 1-4 або її фармацевтично прийнятна сіль для застосування у терапевтично ефективній кількості для лікування чи зменшення ризику хвороби або стану, де гальмування активності еластази нейтрофілів є цілющим.
7. Сполука формули (І) за будь-яким з пп. 1-4 або її фармацевтично прийнятна сіль для застосування у виробництві медикаменту для лікування чи профілактики хвороби або стану людини, де гальмування активності еластази нейтрофілів є цілющим.
8. Сполука формули (І) за будь-яким з пп. 1-4 або її фармацевтично прийнятна сіль для застосування у виробництві медикаменту для лікування чи профілактики запальних хвороб або станів.
9. Фармацевтична композиція, що містить сполуку формули (І), яку визначено у будь-якому з пп. 1-4, або її фармацевтично прийнятну сіль, як варіант, у суміші з фармацевтично прийнятним розріджувачем або носієм.
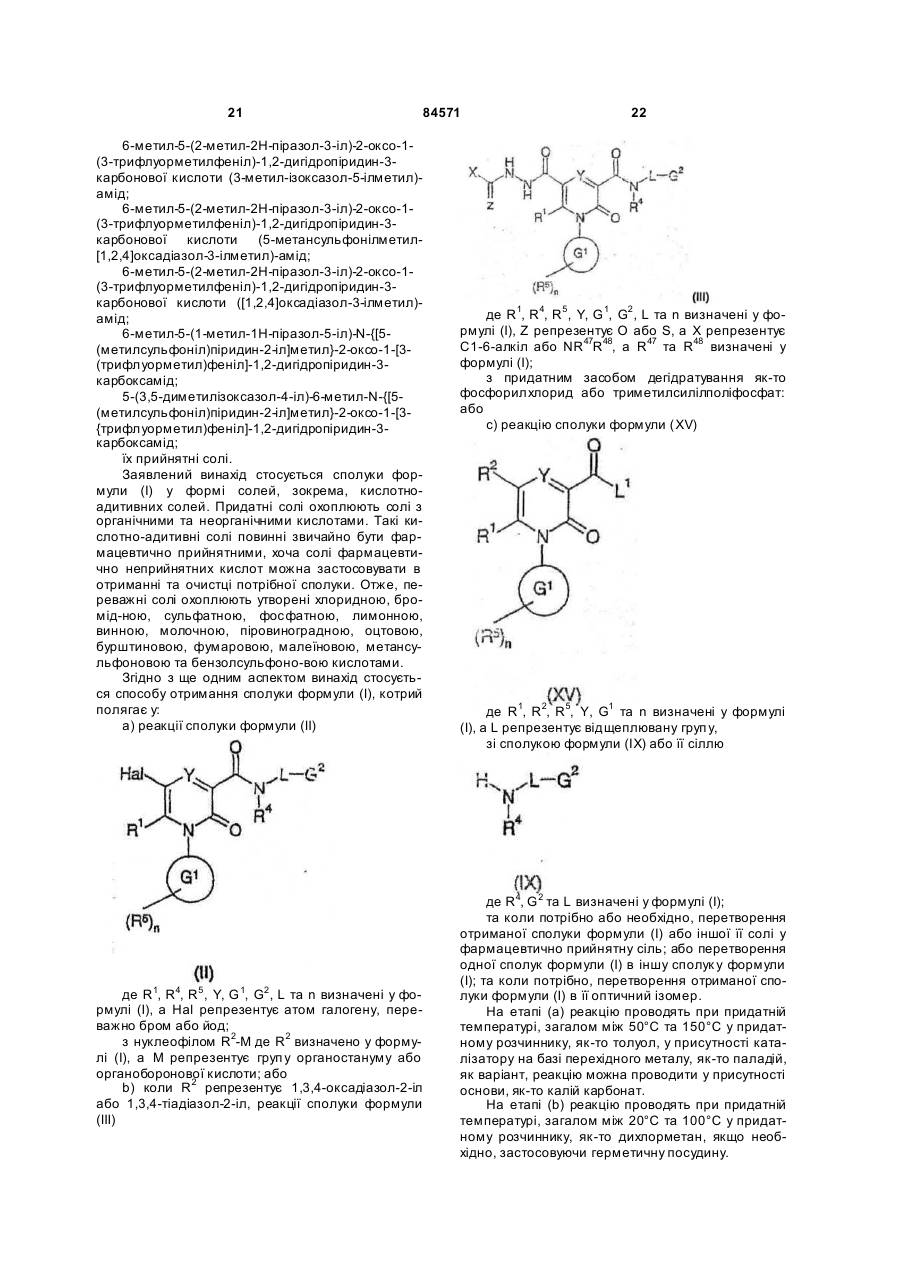
10. Спосіб отримання сполуки формули (І), яку визначено у будь-якому з пп. 1-4, та її оптичних ізомерів, рацематів та таутомерів та фармацевтично прийнятних солей, в якому здійснюють реакцію сполуки формули (II)
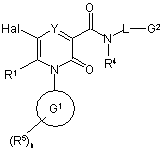 , (ІІ)
, (ІІ)
де R1, R4, R5, Y, G1, G2, L та n визначені у формулі (I), a Hal - атом галогену, переважно бром або йод;
з нуклеофілом R2-M, де R2 визначено у формулі (І), а М - група органостануму або органоборонової кислоти,
та, коли потрібно або необхідно, перетворення отриманої сполуки формули (І) або іншої її солі у фармацевтично прийнятну сіль;
або перетворення одної сполуки формули (І) в іншу сполуку формули (І);
та, коли потрібно, перетворення отриманої сполуки формули (І) в її оптичний ізомер.
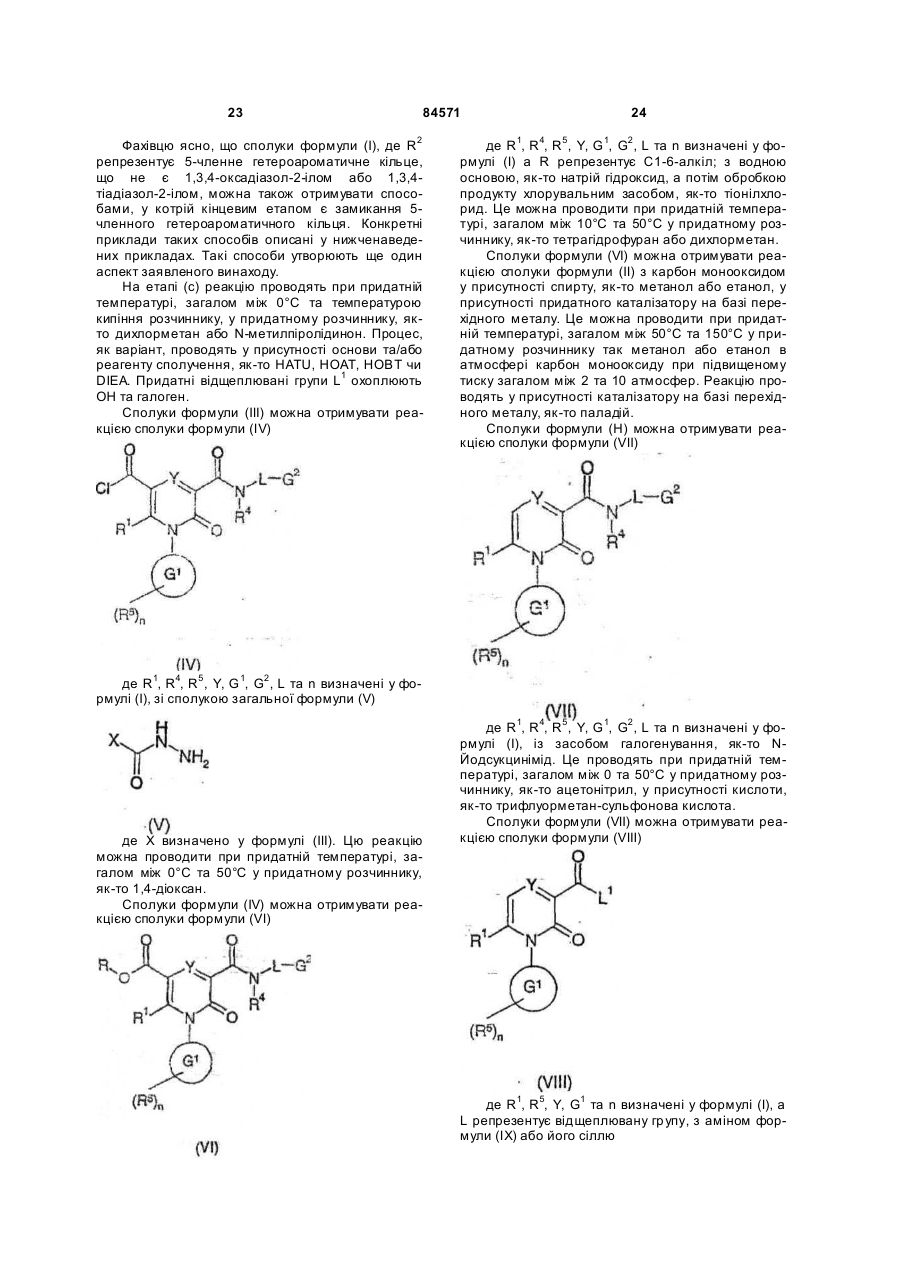
11. Спосіб отримання сполуки формули (І), яку визначено у будь-якому з пп. 1-4, та її оптичних ізомерів, рацематів та таутомерів та фармацевтично прийнятних солей, в якому, коли R2 є 1,3,4-оксадіазол-2-ілом або 1,3,4-тіадіазол-2-ілом, здійснюють реакцію сполуки формули (III)
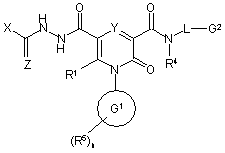 , (ІІІ)
, (ІІІ)
де R1, R4, R5, Y, G1, G2 , L та n визначені у формулі (I), Z - О або S, a X - C1-6-алкіл або NR47R48, a R47 та R48 визначені у формулі (І);
з придатним засобом дегідратування, як-то: фосфорилхлорид або триметилсилілполіфосфат,
та, коли потрібно або необхідно, перетворення отриманої сполуки формули (І) або іншої її солі у фармацевтично прийнятну сіль;
або перетворення одної сполуки формули (І) в іншу сполуку формули (І);
та, коли потрібно, перетворення отриманої сполуки формули (І) в її оптичний ізомер.
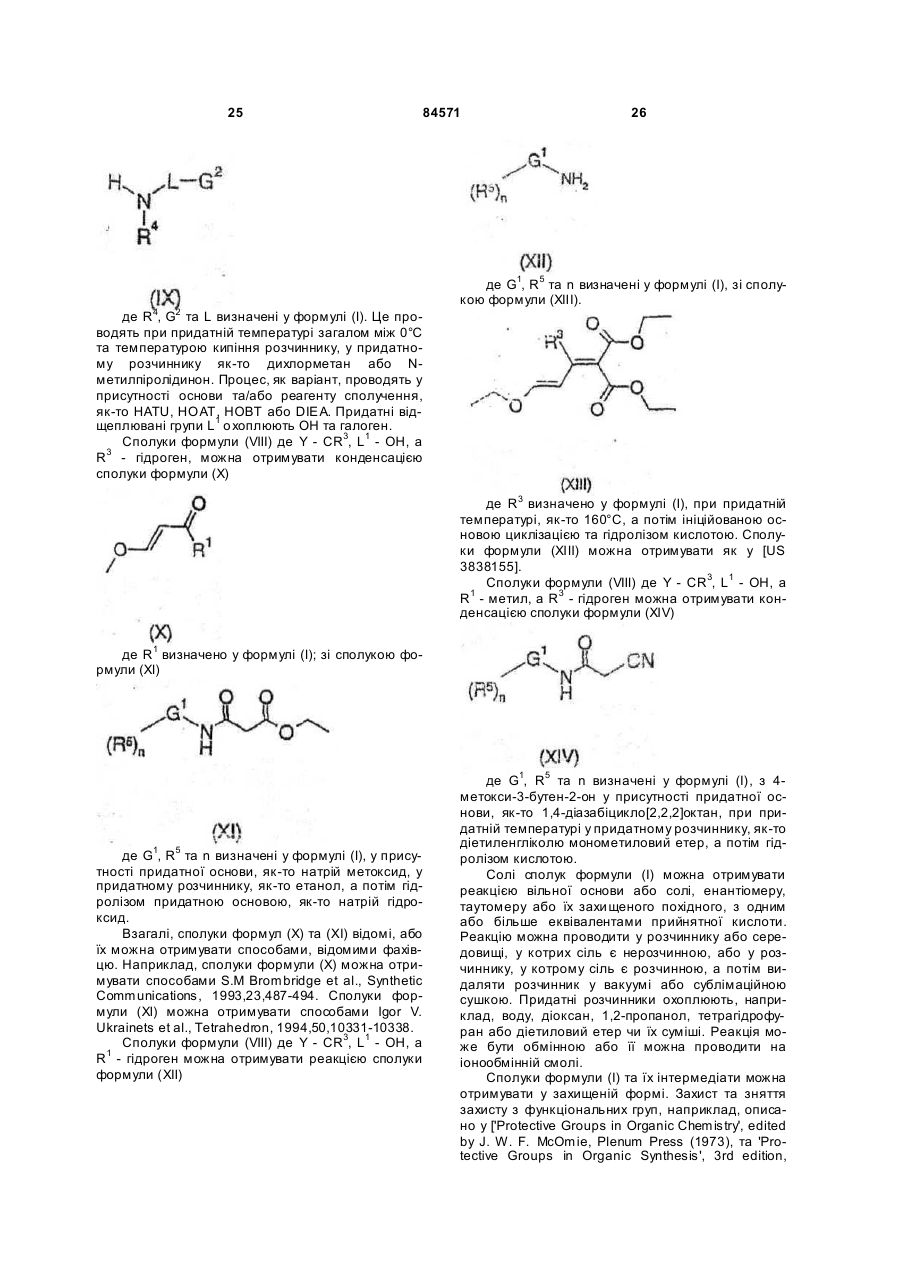
12. Спосіб отримання сполуки формули (І), яку визначено у будь-якому з пп. 1-4, та її оптичних ізомерів, рацематів та таутомерів та фармацевтично прийнятних солей, в якому здійснюють реакцію сполуки формули (XV)
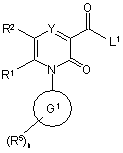 , (XV)
, (XV)
де R1, R2, R5, Y, G1 та n визначені у формулі (І), a L репрезентує відщеплювану групу,
зі сполукою формули (IX) або її сіллю
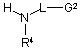 , (ІХ)
, (ІХ)
де R4, G2 та L визначені у формулі (І);
та, коли потрібно або необхідно, перетворення отриманої сполуки формули (І) або іншої її солі у фармацевтично прийнятну сіль;
або перетворення одної сполуки формули (І) в іншу сполуку формули (І);
та, коли потрібно, перетворення отриманої сполуки формули (І) в її оптичний ізомер.
Текст
1. Сполука формули (І) O 2 (19) 1 3 84571 роатоми, незалежно вибрані з О, S(O) P та NR17, та, як варіант, крім того має в собі карбоніл; а два кільця конденсовані разом, зв'язані безпосередньо або розділені лінкерною групою, вибраною з О, S(O)q або СН 2, вказану моноциклічну або дициклічну кільцеву систему крім того, як варіант, заміщено 1-3 замісниками, незалежно вибраними з групи: CN, ОН, С1-6-алкіл, С1-6-алкоксил, галоген, NR18R19, NO2, OSO2R38, CO2R20, C(=NH)NH2, C(O)NR21R22, C(S)NR23R24, SC(=NH)NH2, NR31C(=NH)NH2, 25 26 27 S(O)SR , SO2NR R , С1-3-алкоксил, заміщений одним або більше атомами F, та С1-3-алкіл, заміщений SO2R39, NR56R57 , або одним або більше атомами F; коли L не є зв'язком, G2 може також бути Н; у кожному вияві р, q, s та t незалежно дорівнюють цілому числу 0, 1 або 2; R18 та R19 незалежно репрезентують Н, С1-6-алкіл, форміл, С2-6-алканоїл, S(O)tR32 або SO2NR33R 34; вказаний алкіл крім того, як варіант, заміщений замісником, вибраним з галогену, CN, С1-4алкоксилу чи CONR4IR42; R25 - Н, С1-6-алкіл або С3-6-циклоалкіл; вказаний алкіл крім того, як варіант, заміщений одним або більше замісниками, вибраними незалежно з групи: ОН, CN, CONR35R36, CO2R37, OCOR 40, С3-6циклоалкіл, С4-7-насичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)р та NR43, та феніл або 5-6членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N; вказане ароматичне кільце крім того, як варіант, заміщене одним або більше замісниками, вибраними незалежно з галогену, CN, С1-4-алкілу, С1-4алкоксилу, ОН, CONR44R45,CO 2R46,S(O)sR55 тa NHCOCH3; R32 - Н, С1-6-алкіл або С3-6-циклоалкіл; R16, R17 , R20, R21, R22, R23, R24 , R26, R27, R29 , R31, R33, R34 , R35, R36, R37, R38, R39 , R40, R41, R42 , R43, R44, R45, R46, R49, R50, R51 , R52, R53 , R54, R55 , R56, R57 та R58 незалежно репрезентують Н або С1-6-алкіл; та її фармацевтично прийнятні солі. 2. Сполука формули (І) за п. 1, де Y - CR 3 . 3. Сполука формули (І) за п. 1 або п. 2, де G1 - феніл. 4. Сполука формули (І) за будь-яким з пп. 1-3, де R5 - Сl, СН3, CN або CF3. 5. Сполука формули (І) за будь-яким з пп. 1-4 або її фармацевтично прийнятна сіль для застосування як медикаменту. 6. Сполука формули (І) за будь-яким з пп. 1-4 або її фармацевтично прийнятна сіль для застосування у терапевтично ефективній кількості для лікування чи зменшення ризику хвороби або стану, де гальмування активності еластази нейтрофілів є цілющим. 7. Сполука формули (І) за будь-яким з пп. 1-4 або її фармацевтично прийнятна сіль для застосування у виробництві медикаменту для лікування чи профілактики хвороби або стану людини, де гальмування активності еластази нейтрофілів є цілющим. 8. Сполука формули (І) за будь-яким з пп. 1-4 або її фармацевтично прийнятна сіль для застосуван 4 ня у виробництві медикаменту для лікування чи профілактики запальних хвороб або станів. 9. Фармацевтична композиція, що містить сполуку формули (І), яку визначено у будь-якому з пп. 1-4, або її фармацевтично прийнятну сіль, як варіант, у суміші з фармацевтично прийнятним розріджувачем або носієм. 10. Спосіб отримання сполуки формули (І), яку визначено у будь-якому з пп. 1-4, та її оптичних ізомерів, рацематів та та утомерів та фармацевтично прийнятних солей, в якому здійснюють реакцію сполуки формули (II) O Hal Y R1 N N O L G2 R4 G1 (R5)n , (ІІ) де R1, R4, R5, Y, G1 , G2 , L та n визначені у формулі (I), a Hal - атом галогену, переважно бром або йод; з нуклеофілом R2-M, де R2 визначено у формулі (І), а М - група органостануму або органоборонової кислоти, та, коли потрібно або необхідно, перетворення отриманої сполуки формули (І) або іншої її солі у фармацевтично прийнятну сіль; або перетворення одної сполуки формули (І) в іншу сполук у формули (І); та, коли потрібно, перетворення отриманої сполуки формули (І) в її оптичний ізомер. 11. Спосіб отримання сполуки формули (І), яку визначено у будь-якому з пп. 1-4, та її оптичних ізомерів, рацематів та та утомерів та фармацевтично прийнятних солей, в якому, коли R2 є 1,3,4оксадіазол-2-ілом або 1,3,4-тіадіазол-2-ілом, здійснюють реакцію сполуки формули (III) O O H X N Y L G2 N N H R4 Z N O R1 G1 (R5 )n , (ІІІ) де R , R , R , Y, G1, G2 , L та n визначені у формулі (I), Z - О або S, a X - C1-6-алкіл або NR47R48, a R47 та R48 визначені у формулі (І); з придатним засобом дегідратування, як-то: фосфорилхлорид або триметилсилілполіфосфат, та, коли потрібно або необхідно, перетворення отриманої сполуки формули (І) або іншої її солі у фармацевтично прийнятну сіль; або перетворення одної сполуки формули (І) в іншу сполук у формули (І); та, коли потрібно, перетворення отриманої сполуки формули (І) в її оптичний ізомер. 1 4 5 5 84571 12. Спосіб отримання сполуки формули (І), яку визначено у будь-якому з пп. 1-4, та її оптичних ізомерів, рацематів та та утомерів та фармацевтично прийнятних солей, в якому здійснюють реакцію сполуки формули (XV) O R2 Y R1 N L1 O G1 6 зі сполукою формули (IX) або її сіллю H L G2 N R4 , (ІХ) де R4, G 2 та L визначені у формулі (І); та, коли потрібно або необхідно, перетворення отриманої сполуки формули (І) або іншої її солі у фармацевтично прийнятну сіль; або перетворення одної сполуки формули (І) в іншу сполук у формули (І); та, коли потрібно, перетворення отриманої сполуки формули (І) в її оптичний ізомер. (R5)n , (XV) де R1, R2 , R5, Y, G1 та n визначені у формулі (І), a L репрезентує відщеплювану груп у, Цей винахід стосується нових похідних 2піридону, способів їх отримання, фармацевтичних композицій, що їх містять та їх застосування у терапії. Еластази є можливо найдеструктивнішими ферментами у тілі, що мають здатність розкладати фактично усі компоненти сполучної тканини. Неконтрольоване протеолітичне розкладання еластазами залучено у ряд патологічних станів. Еластаза нейтрофілів людини (hNE), член хімотрипсинової надродини серинових протеаз є ферментом 33кДа, що зберігається у азурофільних гранулах нейтрофілів. У нейтрофілах концентрація NE перевищувала 5мМ та її загальну клітинну кількість оцінено до 3пг. При активації NE швидко вивільняється з гранул в екстрацелюлярний проміжок з деякою частиною, що залишається зв'язаною з мембраною плазми нейтрофіла [дивись Kawabata et al. 2002, Eur. J. Pharmacol. 451, 1-10]. Головною інтрацелюлярною фізіологічною функцією NE є розкладання чужинних органічних молекул, фагоцитованих нейтрофілами, тоді як головною ціллю для екстрацелюлярної еластази є еластин (Janoff & Scherer, 1968, J. Exp. Med. 12&, 1137-1155). NE є унікальною у порівнянні з іншими протеазами (наприклад, протеїназою 3) тим, що вона має здатність розкладати майже усі білки екстрацелюлярного матриксу та ключові білки плазми [дивись Kawabata et al, 2002, Eur. J. Pharmacol. 451,1-10]. Вона розкладає багато білків екстрацелюлярного матриксу, як-то еластин, колагени типів 3 та 4, ламінін, фібронектин, цитокіни, тощо. (Ohbayashi, N., 2002, Expert Opin. Investig. Drags, 11, 965-980). NE є головним загальним медіатором багатьох патологічних змін, спостережених у хронічній хворобі легень, охоплюючи пошкодження епітелію (Stockley, ILA. 1994, Am. J. Resp. Crit. Care Med. 150,109-113). Деструктивну роль NE встановили майже 40 років тому, коли Laurell та Eriksson повідомили про асоціацію хронічної обструкції потоку повітря та емфіземи з нестачею a 1-антитрипсину сироватки (Laurell та Eriksson, 1963, Scand, J. Clin. invest 15,132-140). Далі було визначено, що a 1 антитрипсин є найважливішим ендогенним інгібітором NE людини. Дисбаланс між NE людини та ендогенною антипротеазою, можна вважати, викликає надлишок NE людини у легеневих тканинах, що вважають головним патогенним фактором у хронічній обструктивній хворобі легень (COPD). Надлишкова NE людини показує помітний деструктивний профіль та діяльно приймає участь у деструкції нормальних легеневих структур, а потім незворотному розширенні дихального повітряного простору, як виявлено головним чином при емфіземі. Підвищується приток нейтрофілів у легені, що асоціюється зі збільшеним навантаженням легеневої еластази та емфіземою у мишей з дефіцитом інгібітору a 1-протеїнази (Cavarra et al., 1996, Lab, Invest 75,273-280). Особи з вищими рівнями комплексу інгібітору з NE-a 1-протеазою у бронхоальвеолярній промивній рідині показують значно прискорений спад легеневих функцій у порівнянні з особами з нижчими рівнями (Betsuyaku et al. 2000, Respiration, 67,261-267). Уведення NE людини через трахеї щурам викликає легеневу кровотечу, накопичення нейтрофілів при гострій фазі та емфізематозні зміни при хронічній фазі (Karaki et al, 2002, Am. J. Resp. Crit. Care Med., 166,496-500). Дослідження показали, що гостр у фаз у легеневої емфіземи та легеневу кровотечу, викликану NE у хом'яків, можна інгібувати попереднім лікуванням інгібіторами NE (Fujie et al., 1999, Inflamm. Res. 48,160-167). Нейтрофіл-домінуюче запалення дихальних шляхів та обструкція повітряних шляхів слизом є головними патологічними особливостями COPD, охоплюючи кістозний фіброз та хронічний бронхіт. ΝΕ порушує продукування муцину, призводячи до обструкції повітряних шляхів слизом. ΝΕ, як повідомлено, підвищує експресію головного гена дихального муцину, MUC5AC (Fischer, Bivf & Vo ynow, 2002, Am. J. Respir. Cell Biol., 26,447-452). Аерозольне застосування NE до морських свинок продукує поширене пошкодження епітелію в межах 20 хвилин контакту (Suzuki et al., 1996, Am. J. Resp. Crit Care Med., 153,1405-1411). Крім того NE зменшує частоту циліарного ритму дихального епіте 7 84571 лію людини in vitro (Smallman et al., 1984, Thorax, 39,663-667), що погоджується зі зменшеним мукоциліарним кліренсом, що виявлено у пацієнтів COPD (Carrie et al., 1984, Thorax, 42,126-130). Уведення NE у ди хальні шляхи призводить до гіперплазії слизових залоз у хом'яків (Lucey et al, 1985, Am. Resp. Crit. Care Med., 132,362-366). Роль NE також залучено у гіперсекрецію слизу при астмі. У моделі гострої астми сенсибілізованих алергеном морських свинок інгібітор NE попереджав дегрануляцію бокаловидних клітин та гіперсекрецію слизу (Nadel et al., 1999, Bur. Resp. J., 13,190-196). Також показано, що NE грає роль у патогенезі легеневого фіброзу. Комплекс інгібітору з NE-a 1протеазою підвищується у сироватці пацієнтів з легеневим фіброзом, що корелює з клінічними параметрами у цих пацієнтів (Yamanouchi et al., 1998, Ear. Resp. X 11,120-125). У мишачій моделі легеневого фіброзу людини, інгібітор NE зменшував індукований блеоміцином легеневий фіброз (Taooka et al., 1997, Am. J. Resp. Crit Care Med., 156,260-265). Крім того заявники показали, що миші з дефіцитом NE резистентні до індукованого блеоміцином легеневого фіброзу (Dunsirsore et al., 2001, Chest, 120, 35S-36S). Рівень NE у плазмі було виявлено як підвищений у пацієнтів, у кого прогресує ARDS (респіраторний дистрес-синдром дорослих), що вказує на важливість NE у ранньому патогенезі ARDS. (Donnelly et al., 1995, Am. J. Res. Crit Care Med., 151,428-1433). Антипротеази та комплекси NE з антипротеазою є підвищеними в зоні раку легень (Merchandise et al., 1989, Eur. Resp. J. 2,623-629). Нещодавні дослідження показали, що поліморфізм у регіоні промотеру гена NE асоціюються з розвитком раку легень (Taniguchi et al., 2002, Clin. Cancer Res., 3,1115-1120. Гостре поранення легень, викликане ендотоксином в експериментальних тваринах, асоціюється з підвищеними рівнями NE (Kawabata et al., 1999, Am. J. Resp. Crit. Care, 161,2013-2018). Гостре запалення легень, викликане інтратрахеальною ін'єкцією ліпополісахариду у мишей показало підвищення активності NE у бронхоальвеолярній промивній рідині, що значно інгібує інгібітор NE (Fujie et al., 1999, Eur. J. Pharmacol., 374,117-125; Yasui, et al, 1995, Eur. Resp. J., 8,1293-1299). NE також грає важливу роль в індукованому нейтрофілами підвищенні проникності легеневих мікросудин, спостереженого у моделі гострого поранення легень, викликаного фактором-a некрозу пухлин (TNFa) та форбол-міристат-ацетатом (РМА) у виділених обприсканих легенях кролів (Mya zaki et al., 1998, Am. J. Respir. Crit Care Med., 157,89-94). Роль NE також припущено в індукованому монокротоліном ущільненні легеневих судинних стінок та серцевій гіпертрофії (Molteni et al., 1989, 8 Biochemical Pharmacol. 38, 2411-2419). Інгібітор серинової еластази реверсує індуковану монокротоліном легеневу гіпертензію та реконструкцію у легеневих артеріях щурів (Cowan et al., 20G05 Nature Medicine, 6,698-702). Нещодавні дослідження показали, що серинова еластаза, якою є NE або судинна еластаза, важлива в індукованому сигаретним димом мускуляризації невеликих легеневих артерій у морських свинок (Wright et al., 2002, Am. J. Respir. Crit. Care Med., 166,954-960). NE грає ключову роль в експериментальному церебральному ішемічному пошкодженні (Shimakora et al., 2000, Brain Research, 858,55-60), ішемічно-реперфузійному пошкодженні легень (Kishima et al., 1998, Ana. Thorac. Surg. 65,913-918) та міокардіальній ішемії у серці щура (Tiefenbacher et al., 1997, Eur. J. Physiol., 433, 563-5701. Рівні NE людини у плазмі значно підвищуються вище нормальних при запальних хворобах кишечнику, наприклад, хворобі Крона та виразковому коліті (Adeyemi et al, 1985, Gut, 26,1306-1311). На додаток NE, як припускають, залучено у патогенез ревматоїдного артриту (Adeyemi et al., 1986, Rheumatol. Int., 6, 57). Розвиток індукованого колагеном артриту у мишей пригнічують інгібітором NE (Kakimoto et al., 1995, Cellular Immunol. 165,26-32)*. Отже, NE людини є відомою як одна з найдеструктивніши х серинових протеаз та є залученою у різні запальні хвороби. Важливим ендогенним інгібітором NE людини є a 1-антитрипсин. Дисбаланс між NE людини та антипротеазою, можна вважати, підвищує надлишок NE людини, призводячи до неконтрольованої деструкції тканин. Баланс протеаза/антипротеаза може бути порушеним зниженою придатністю a 1-антитрипсину активацією окисниками як-то сигаретний дим, або у результаті генетичної нездатності продукувати достатні рівні у сироватці. NE людини залучено у стимуляцію або загострення ряду хвороб, як-то легенева емфізема, легеневий фіброз, синдром дихальної недостатності дорослих (ARDS), ішемічнореперфузійне пошкодження, ревматоїдний артрит та легенева гіпертензія. [WO D2/05S543] стосується похідних піридону, що мають спорідненість стосовно канабіноїдного рецептору типу 2. Заявлений винахід стосується нових похідних 2-піридіону, що є інгібіторами нейтрофільної еластази людини та гомологічної серинової протеази як-то протеїназа 3 та панкреатична еластаза, та є тому корисними у терапії. Заявлений винахід стосується сполуки формули (І) 9 84571 де: Υ репрезентує CR3 або N, R1 репрезентує N або С1-6-алкіл; R2 репрезентує феніл або 5-6-членне гетероароматичне кільце, що містить 1-4-гетероатоми, незалежно вибрані з О, S та Ν; вказане ароматичне кільце, як варіант, заміщене 1-3 замісниками, вибраними незалежно з групи: ОН, галоген, С1-6алкіл, С1-6-алкоксил, NR58COR50, COOR51 , COR52, CONR53R54 та NR47R48 ; вказаний алкіл крім того, як варіант, заміщений групою: ОН, С1-6-алкоксил, CN або CO2R49; R47 та R48 незалежно репрезентують N, С1-6алкіл або С2-6-алканоїл; R3 репрезентує N або F; G1 репрезентує феніл або 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та Ν ; R5 репрезентує N, галоген, С1-6-алкіл, CN, С16-алкоксил, NO2, NR14R15 . C1-3-алкіл, заміщений одним або більше F-атомами або С1-3-алкоксил, заміщений одним або більше F-атомами: R14 та R15 незалежно репрезентують N або С13-алкіл; вказаний алкіл крім того, як варіант, заміщений одним або більше F-атомами; n дорівнює цілому числу 1, 2 або 3, а коли n дорівнює 2 або 3, кожну R5-груп у вибрано незалежно; R4 репрезентує N або С1-6-алкіл; вказаний алкіл крім того, як варіант, заміщений ОН або С1-6алкоксилом; або R4 та L з'єднані разом так, що група -NR4L репрезентує 5-7-членне азациклічне кільце, що як варіант, має в собі ще один гетероатом, вибраний з О, S та NR16, а L репрезентує зв'язок, О, S(O)p, NR29 або С1-6алкіл; вказаний алкіл, як варіант, має в собі гетероатом, вибраний з О, S та NR ; та вказаний алкіл крім того, як варіант, заміщено ОН або ОМе; G2 репрезентує моноциклічну кільцеву систему, вибрану з гр упи: і) феніл або феноксил, іі) 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N, ііі) С3-6-насичений або частково ненасичений циклоалкіл, або 10 iv) С4-7-насичене або частково ненасичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)p та NR17, та як варіант, крім того містить карбоніл; або G2 репрезентує дициклічну кільцеву систему, у котрій кожне з двох кілець незалежно вибрано з групи: і) феніл, іі) 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S тa N, ііі) С3-6-насичений або частково ненасичений циклоалкіл, або iv) С4-7-насичене або частково ненасичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)p та NR17, та як варіант, крім того містить карбоніл; та два кільця конденсовані разом, зв'язані безпосередньо, або розділені лінкерною групою, вибраною з О, S(O)q або СН 2, вказану моноциклічну або дициклічну кільцеву систему крім того, як варіант, заміщено 1-3 замісниками, незалежно вибраними з групи: CN, ОН, С1-6-алкіл, С1-6-алкоксил, галоген, NR18R19, NO2, OSO2R38, CO2R20, C(=NH)NH2, C(O)NR21R22, C(S)NR23R24, SC(=NH)NH2, NR31C(=NH)NH2, 25 26 27 S(O)SR , SO2NR R , С1-3-алкоксил, заміщений одним або більше F-атомами, та С1-3-алкіл, заміщений SO2R39, NR56R57 , або одним або більше атомами F; коли L не репрезентує зв'язок, G2 може також репрезентувати Н; При кожній появі р, q, s та t незалежно дорівнюють цілому числу 0, 1 або 2; R18 та R19 незалежно репрезентують Н, С1-6алкіл, форміл, С2-6-алканоїл, S(O)tR32 або SC2NR33R34; вказаний алкіл крім того, як варіант, заміщений замісником, вибраним з групи: галоген, CN, С1-4-алкоксил чи CONR41R42; R25 репрезентує Н, С1-6-алкіл або С3-6циклоалкіл; вказаний алкіл крім того, як варіант, заміщений одним або більше замісниками, вибраними незалежно з групи: ОН, CN, CONR35R36, CO2R37, OCOR 40, С3-6-циклоалкіл, С4-7-насичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)p та NR43, та феніл або 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N; вказане ароматичне кільце крім того, як варіант, заміщене одним або більше замісниками, вибраними незалежно з групи: галоген, CN, С1-4-алкіл, С1-4-алкоксил, OH,CONR44R45 ,CO2R46,S(O)sR55 тa NHCOCH3; R32 репрезентує N, С1-6-алкіл або С3-6циклоалкіл; R16, R17, R20 , R21, R22, R23 , R24, R26 , R27, R 29, R31 , R33, R34 , R35, R36, R37, R38, R39 , R40, R41, R42 , R43, R44, R45 , R46, R49, R50, R51, R52 , R53, R54, R55 , R56, R57,тa R58 незалежно репрезентують N або С1-6алкіл; та її фармацевтично прийнятних солей. Сполуки формули (І) можуть існувати у енантіомерній та/або таутомерній формі. Зрозуміло, що усі енантіомери, діастереомери, рацемати, таутомери та їх суміші охоплені рамками винаходу. 11 84571 Якщо не вказане інше, термін "С1-6-алкіл" означає тут алкіл з лінійним або розгалуженим ланцюгом, що має 1-6 атомів карбону. Приклади таких груп охоплюють метил, етил, н-пропіл, іпропіл. н-бутил, і-бутил, т-бутил, пентил та гексил Терміни "С1-3-алкіл" та "С1-4-алкіл" застосовано аналогічно. Приклади "С1-3-алкілу, заміщеного одним або більше F-атомами", охоплюють флуорметил, дифлуорметил, трифлуорметил, 2,2,2-трифлуоретил, 1,1-дифлуоретил, пе-нтафлуоретил та 3,3,3трифлуорпропіл. Якщо не вказане інше, термін "С1-6-алкоксил" означає тут оксигеновий замісник, зв'язаний з алкілом з лінійним або розгалуженим ланцюгом, що має 1-6 атомів карбону. Приклади таких груп охоплюють метоксил, етоксил, н-пропоксил, іпропоксил, н-бутоксил, і-бутоксил та вторбутоксил. Терміни "С1-3-алкоксил" та "С1-4алкоксил" застосовано аналогічно. Приклади "С1-3-алкоксилу, заміщеного одним або більше F-атомами", охоплюють флуорметоксил, трифлуорметоксил, 2,2,2-трифлуоретокси та 3,3,3-трифлуорпропокси. Якщо не вказане інше, термін "С2-6-алканоїл" означає тут алкіл з лінійним або розгалуженим ланцюгом, що має від 1 до 5 атомів карбону, зв'язаних з молекулою через карбоніл. Приклади таких груп о хоплюють ацетил, пропіоніл та півалоїл. Якщо не вказане інше, термін "галоген" означає тут флуор; хлор, бром та йод. Приклади 5-6-членного гетероароматичного кільця, що містить 1-4-гетероатоми, незалежно вибрані з О, S та N, о хоплюють фуран, тіо фен, пірол, оксазол, 1,2,4-оксадіазол, 1,3,4-оксадіазол, ізоксазол, імідазол, піразол, тіазол, триазол, тіадіазол, піридин, піримідин, піразин та тетразол. Приклади 5-6-членного гетероароматичного кільця, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N, охоплюють фуран, тіофен, пірол, оксазол, 1,2,4-оксадіазол, 1,3,4-оксадіазол, ізоксазол, імідазол, піразол, тіазол, триазол, тіадіазол, піридин, піримідин та піразин. Якщо не вказане інше, термін "С3-6-насичений або частково ненасичений циклоалкіл" означає тут 3-6-членне неароматичне карбоциклічне кільце, що як варіант, містить один або більше подвійних зв'язків. Приклади охоплюють циклопропіл, циклопен-тил. циклопентеніл, циклогексил та циклогексеніл. Термін "5-6-членне насичене або частково ненасичене циклоалкільне кільце" застосовано аналогічно. Якщо не вказане інше, термін "С4-7-насичене або частково ненасичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)P, та NR17, та як варіант, крім того містить карбоніл" означає тут 4-7-членне неароматичне гетероциклічне кільце, що як варіант, містить один або більше подвійних зв'язків, та як варіант, містить карбоніл. Приклади охоплюють тетрагідрофуран, тіолан 1,1-діоксид, тетрагідропіран, 4-оксо-4Н-піран, піролідин, піролін, імідазолідин, дигідро-оксазол, дигідропіразол, 1,3діоксолан, піперидин, піперазин, морфолін, пергідроазепін, піролідон та піперидон. Термін "5-6 12 членне насичене або частково ненасичене гетероциклічне кільце, що містить один гетероатом, вибраний з О, S та NR13 застосовано аналогічно. Приклади "5-7-членного азациклічного кільця, що як варіант, має в собі ще один гетероатом", вибраний з О, S та NR16, охоплюють піролідин, піперидин, морфолін, тіоморфолін та піперазин. У визначенні L, "С1-6-алкіл", вказаний алкіл, як варіант, має в собі гетероатом, вибраний з О, S та NR16 охоплює систему з лінійним або розгалуженим ланцюгом з 1-6 атомами карбону, у котрій будь-які два атоми карбону, як варіант, розділені О, S або NR16. Визначення отже охоплює, наприклад, метилен, етилен, пропілен, гексаметилен, етилетилен, -СН2СН2О-СН2-, -СН2СН2О-СН2СН2-, CH2CH2S- та -CH2CH2S-NR16. Приклади дициклічної кільцевої системи, у котрій два кільця конденсовані разом, зв'язані безпосередньо, або розділені лінкерною групою, вибраною з О, S(O)q або СН2, охоплюють дифеніл, тієнілфеніл, піразолілфеніл, феноксифеніл, фенілциклопропіл, на-фтил, інданіл, хіноліл, тетрагідрохіноліл, бензофураніл, індоліл, ізоіндоліл, індолініл, бен-зофураніл, бензотієніл, індазоліл, бензимідазоліл, бензтіазоліл, пуриніл, ізохіноліл, хроманіл, інденіл, хіназоліл, хіноксаліл, хроманіл, ізохроманіл, 3Н-індоліл, 1Н-індазоліл, хінуклідил, тетрагідронафтил, дигідробензорораніл, морфолін-4-ілфеніл, 1,3-бензодіоксоліл, 1,1-діоксидо-2,3дигідро-1-бензотієніл, 2,3-дигідро-1,4бензодіоксиніл, 1,3-бензодіоксиніл та 3,4дигідроізохроменіл. В одному втіленні Υ у формулі (І) репрезентує CR3. У ще одному втіленні Υ репрезентує N. В одному втіленні R1 у формулі (І) репрезентує С1-4-алкіл. У ще одному втіленні R1 репрезентує СН3. В одному втіленні R2 у формулі (І) репрезентує, як варіант, заміщений феніл. У ще одному втіленні R2 у формулі (І) репрезентує, як варіант, заміщене 5-6-членне гетеро-ароматичне кільце, що містить 1-4-гетероатоми, незалежно вибрані з О, S та N. У ще одному втіленні R2 у формулі (І) репрезентує, як варіант, заміщене 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N. У ще одному втіленні R2 у формулі (І) репрезентує, як варіант, заміщене 5-6-членне гетероаро-матичне кільце, що містить 2 або 3 гетероатоми, незалежно вибрані з О, S та N. У ще одному втіленні R2 у формулі (І) репрезентує, як варіант, заміщені фуран, піридин, піримідин, пірол, тіофен, тіазол, ізоксазол. оксадіазол або тіадіазол. У ще одному втіленні R2 у формулі (І) репрезентує, як варіант, заміщений ізоксазол. В одному втіленні R3 у формулі (І) репрезентує Н. В одному втіленні G1 у формулі (І) репрезентує феніл або піридил. У ще одному втіленні G1 у формулі (І) репрезентує феніл . В одному втіленні R5 у формулі (І) репрезентує галоген, С1-6-алкіл, CN або С1-3-алкіл, заміщений одним або більше F-атомами, у ще одному втіленні R5 у формулі (І) репрезентує СІ, СН3, CN або CF3. 13 84571 В одному втіленні n дорівнює цілому числу 1. У ще одному втіленні G1 у формулі (І) репрезентує феніл, R5 репрезентує CF 3, a n дорівнює цілому числу 1. В одному втіленні R4 репрезентує Н. В одному втіленні L репрезентує С1-6-алкіл. У ще одному втіленні L репрезентує -CH2-. У ще одному втіленні L репрезентує NR29, a R29 репрезентує Н. В одному втіленні G2 репрезентує, як варіант, заміщену моноциклічну кільцеву систему, вибрану з групи: і) феніл, іі) 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N, ііі) 3-6-насичений або частково ненасичений циклоалкіл, або iv) С4-7-насичене або частково ненасичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)p та NR17, та як варіант, крім того містить карбоніл. У ще одному втіленні G2 репрезентує, як варіант, заміщений феніл. У ще одному втіленні G2 репрезентує феніл, заміщений OSO2R38, S(O)SR 25, SO2NR26R27, NR18R19 (де принаймні один з R18 та R19 репрезентує S(O)tR32 чи SO 2NR33R34), або С13-алкіл, заміщений SO2R39. У ще одному втіленні G2 репрезентує феніл, заміщений S(O)SR25, a R25 репрезентує С1-6-алкіл чи С3-6-циклоалкіл, a s дорівнює цілому числу 2. У ще одному втіленні G2 репрезентує, як варіант, заміщену дициклічну кільцеву систему, у котрій кожне з двох кілець незалежно вибрано з групи: і) феніл, іі) 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N, ііі) С3-6-насичений або частково ненасичений циклоалкіл, або iv) С4-7-насичене або частково ненасичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)p та NR, та як варіант, крім того містить карбоніл; та два кільця конденсовані разом, зв'язані безпосередньо, або розділені лінкерною групою, вибраною з О, S(O)q або СН 2. В одному втіленні Υ у формулі (І) репрезентує CR3, a R3 репрезентує Н; R1 репрезентує С1-6алкіл; R2 репрезентує, як варіант, заміщене 5-6членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N; G1 репрезентує феніл; R5 репрезентує галоген, С1-6алкіл, CN або С1-3-алкіл заміщений одним або більше F-атомами; R4 репрезентує Н; L репрезентує С1-6-алкіл; a G2 репрезентує, як варіант, заміщену моноциклічну кільцеву систему, вибрану з групи: і) феніл, іі) 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та Ν, ііі) С3-6-насичений або частково ненасичений циклоалкіл, або 14 iv) С4-7-насичене або частково ненасичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)p та NR17, та як варіант, крім того містить карбоніл. В одному втіленні Υ у формулі (І) репрезентує CR3, a R3 репрезентує Н; R1 репрезентує С1-6алкіл; R2 репрезентує, як варіант, заміщене 5членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N; G1 репрезентує феніл; R5 репрезентує галоген, С1-6алкіл, CN або С1-3-алкіл заміщений одним або більше F-атомами; R4 репрезентує Н; L репрезентує С1-6-алкіл; та G2 репрезентує феніл, заміщений OSO2R38, S(O)SR25, SO2NR26R27 , NR18R19 (де принаймні один з R18 та R19 репрезентує S(O),R32 чи SO2NR33R34 репрезентує S(O) tR32 чи 33 34 SO2NR R ) або С1-3-алкіл, заміщений SO2R39). В одному втіленні Υ у формулі (І) репрезентує CR3, a R3 репрезентує Н; R1 репрезентує метил; R2 репрезентує, як варіант, заміщене 5-членне гетероароматичне кільце, що містить 2 або 3 гетероатоми, незалежно вибрані з О, S та N; G1 репрезентує феніл; R5 репрезентує СІ, СН3, CN або CF3; R4 репрезентує Н; L репрезентує С1-6-алкіл; a G2 репрезентує феніл, заміщений OSO2R38, S(O)SR 25, SO2NR26R27, NR18R19 (де принаймні один з R18 та R19 репрезентує S(O)tR32 чи SO2NR33R34 репрезентує S(O) tR32 чи SO 2NR33R34) або С1-3-алкіл, заміщений SO2R39). В одному втіленні Υ у формулі (І) репрезентує CR3, a R3 репрезентує Н; R1 репрезентує метил; R2 репрезентує, як варіант, заміщене ізоксазольне кільце; G1 репрезентує феніл; R5 репрезентує СІ, СН3, CN або CF3; R+4 репрезентує Н: L репрезентує С1-3-алкіл; a G2 репрезентує феніл, заміщений OSO2R38, S(O) SR25 , SO2NR26R 27, NR18R 19 (де принаймні один з R18 та R19 репрезентує S(O) tR32 чи SO2NR33R34 репрезентує S(O)tR32 чи SO 2NR33R34) або С1-3-алкіл, заміщений SO2R39). В одному втіленні Υ у формулі (І) репрезентує CR3, a R3 репрезентує Н; R1 репрезентує метил; R2 репрезентує, як варіант, заміщене 5-членне гетероароматичне кільце, що містить 2 або 3 гетероатоми, незалежно вибрані з О, S та N; G1 репрезентує феніл; R5 репрезентує СІ, СН3, CN або CF3; R4 репрезентує Н; L репрезентує С1-6-алкіл; a G репрезентує феніл, заміщений S(O)SR25, a R25 репрезентує С1-6-алкіл або С3-6-циклоалкіл, a s дорівнює цілому числу 2. В одному втіленні Υ у формулі (І) репрезентує CR3, a R3 репрезентує Н; R1 репрезентує метил; R2 репрезентує, як варіант, заміщене ізоксазольне кільце; G1 репрезентує феніл; R5 репрезентує СІ, СН3, CN або CF3; R4 репрезентує Н; L репрезентує С1-3-алкіл; a G2 репрезентує феніл, заміщений S(O)SR25 , a R25 репрезентує С1-6-алкіл або С3-6циклоалкіл, a s дорівнює цілому числу 2. В одному втіленні Υ у формулі (І) репрезентує CR3 або N; R1 репрезентує N або С1-6-алкіл; R2 репрезентує феніл або 5-6-членне гетероароматичне кільце, що містить 1-4 гетероатоми, незалежно вибрані з О, S та Ν; вказане ароматичне кільце, як варіант, заміщене 1-3 замісниками, незалежно вибраними з групи: ОН, галоген, С1-6-алкіл, С1-6алкоксил, NCOR50, COOR51, COR 52 , CONR53R 54, a 15 84571 NR47R48; вказаний алкіл крім того, як варіант, заміщений ОН, CN або CO2R; R47 та R48 незалежно репрезентують Н, С1-6-алкіл або С2-6-алканоїл; R3 репрезентує N або F; G1 репрезентує феніл або 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N; R5 репрезентує Н, галоген, С1-6-алкіл, CN, С1-6алкоксил, ΝΟ2, NR14R15, С1-3-алкіл, заміщений одним або більше F-атомами або С1-3-алкоксид, заміщений одним або більше F-атомами; NR14 та R15 незалежно репрезентують N або С1-3-алкіл; вказаний алкіл крім того, як варіант, заміщений одним або більше F-атомами; n дорівнює цілому числу 1, 2 або 3, а коли n репрезентує 2 або 3, кожний R5 вибрано незалежно; R4 репрезентує N або С1-6-алкіл; вказаний алкіл крім того, як варіант, заміщений групою: ОН або С1-3-алкоксил; або R4Ta L з'єднані разом так, що група -NR4 L репрезентує 5-7-членне азациклічне кільце, що як варіант, має в собі гетероатом, вибраний з О, S та NR16; L репрезентує зв'язок О, NR29 або С1-6алкіл; вказаний алкіл, як варіант, має в собі гетероатом, вибраний з О, S та NR16 ; та вказаний алкіл крім того, як варіант, заміщений групою: ОН або ОМе; G2 репрезентує моноциклічну кільцеву систему, вибрану з групи: і) феніл або феноксил, іі) 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N, ііі) С3-6-насичений або частково ненасичений циклоалкіл, або iv) С4-7-насичене або частково ненасичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)p та NR17, та як варіант, крім того містить карбоніл; або G2 репрезентує дициклічну кільцеву систему, у котрій кожне з двох кілець незалежно вибрано з групи: і) феніл, іі) 5-6-членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N, ііі) С3-6-насичений або частково ненасичений циклоалкіл, або iv) С4-7-насичене або частково ненасичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)p та NR17, та як варіант, крім того містить карбоніл; а два кільця конденсовані разом, зв'язані безпосередньо, або розділені лінкерною групою, вибраною з О, S(O)q або СН2; вказану моноциклічну або дициклічну кільцеву систему крім того, як варіант, заміщено 1-3 замісниками, незалежно вибраними з групи: CN, ОН, С1-6-алкіл, С1-6-алкоксил, галоген, NR18R19, NO 2, OSO 2R38, CO2R20, C(=NH)NH2, C(O)NR21R22, C(S)NR23R24, SC(=NH)NH2, 31 NR C(=NH)NH2, S(O)SR25, SO2NR26R27 , С1-3алкоксил, заміщений одним або більше Fатомами, та С1-3-алкіл, заміщений SO2R39 або одним або більше F-атомами; або, коли L не репрезентує зв'язок, G2 може також репрезентувати Н; р, q, s та t незалежно дорівнюють цілому числу 0, 1 або 2; R18 та R19 незалежно репрезентують Н, С1-6-алкіл, форміл, С2-6-алканоїл, S(O)tR32 або 16 SO2R33R34; вказаний алкіл крім того, як варіант, заміщений замісником, вибраним з групи: галоген, CN, С1-4-алкоксил або CONR41R42; R25 репрезентує Н, С1-6-алкіл або С3-6-циклоалкіл; вказаний алкіл крім того, як варіант, заміщений одним або більше замісниками, вибраними незалежно з групи: ОН, CN, CONR35R36, CO2R37, OCOR 40, С3-6циклоалкіл, С4-7 насичене гетероциклічне кільце, що містить один або два гетероатоми, незалежно вибрані з О, S(O)p та NR43, та феніл або 5-6членне гетероароматичне кільце, що містить 1-3 гетероатоми, незалежно вибрані з О, S та N; вказане ароматичне кільце крім того, як варіант, заміщене одним або більше замісниками, вибраними незалежно з групи: галоген, CN, С1-4-алкіл, С1-4алкоксил, ОН, CONR 44R45, CO2R46 , S(O)SR55 та NHCOCH3; R32 репрезентує N, С1-6-алкіл або С36-циклоалкіл; a R16, R17, R20 , R21 , R22, R23, R24, R 26, R27, R29 , R31, R33, R34, R35, R36 , R37, R38, R39 , R40, R41, R42, R43, R44, R45, R46 , R49, R50 , R51, R52 , R53, R54 та R55 незалежно репрезентують N або С1-6-алкіл. Згідно з ще одним аспектом винахід зокрема стосується будь-якої сполуки, яку описано тут у прикладах, її вільної основи або її фармацевтично прийнятної солі. Конкретні сполуки охоплюють: 6-метил-N-4-{метилсульфоніл)бензил-оксо-5феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; 5-[4-(гідроксометил)феніл]-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 5-фуран-3-іл-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 6'-метокси-2-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3трифлуорметилфеніл]-1,6-дигідро-3,3-біпіридин-5карбоксамід; 5-(2-метоксипіримідин-5-іл)-6-метил-N-[4(метилсульфоніл)бензил]-1,2-дигідропіридин-3карбоксамід; 5-[4-(ацетиламіно)феніл]-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 6-метил-2-оксо-5-(1Н-пірол-3-іл)-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 5-фуран-2-іл-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 6-метил-2-оксо-5-тіофен-3-іл-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метанолсульфонілбензиламід; 6-метил-2-оксо-5-тіофен-2-іл-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 5-(3,5-диметилізоксазол-4-іл)-6-метил-2-оксо1-(3-трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 5-{2,4-диметоксипіримідин-5-іл)-6-метил-2оксо-1-(3-трифлуорметилфеніл)-1,2 17 дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 5-{2,4-діоксо-1,2,3,4-тетрагідро-піримідин-5-іл)6-метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 6-метил-5-(5-метил-[1,3,4]оксадіазол-2-іл)-2оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 6-метил-2-оксо-5-{5-пропіл-[1,3,4]оксадіазол-2іл)-1-(3-трифлуорметилфеніл)-1,2-дигідропіридин3-карбонової кислоти 4метансульфонілбензиламід; (5-[5-{4-метансульфоніл-бензилкарбамоїл)-2метил-6-оксо-1-(3-трифлуорметилфеніл)-1,6дигідропіридин-3-іл]-[1,3,4]оксадіазол-2-іл}-оцтової кислоти етиловий естер; 5-(5-ціанометил-[1,3,4]оксадіазол-2-іл)-6метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 5-(5-аміно-[1,3,4]оксадіазол-2-іл)-6-метил-2оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 5-(5-аміно[1,3,4]тіадіазол-2-іл)-6-метил-2-оксо1-(3-трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 5-(5-етиламіно[1,3,4]оксадіазол-2-іл)-6-метил2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 5-(5-N,N-диметиламіно-[1,3,4]оксадіазол-2-іл)6-метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 6-метил-N-[4-(метилсульфоніл)бензил]-2-оксо5-піразин-2-іл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; 6-метил-5-оксазол-2-іл-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 6-метил-5-(1-метил-1Н-імідазол-2-іл)-2-оксо-1(3-трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 6-метил-2-оксо-5-(1Н-піразол-4-іл)-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 6-метил-N-[4-(метилсульфоніл)бензил]-2-оксо5-піримідин-2-іл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; 6-метил-5-(2-метил-2Н-піразол-3-іл)-2-оксо-1(трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 6-метил-5-{3-метилізоксазол-4-іл)-N-[4(метилсульфоніл)бензил]-2-оксо-1-{3(трифлуорметил)феніл}-1,2-дигідропіридин-3карбоксамід; 6-метил-5-(3-метил-[1,2,4]оксадіазол-5-іл)-2оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 6-метил-5-(3-метилізоксазол-5-іл)-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3 84571 18 (трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 5-(3,5-диметилізоксазол-4-іл)-N-[4(ізопропілсульфоніл)бензил]-6-метил-2-оксо-1-[3{трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 5-(3,5-диметилізоксазол-4-іл)-N-[4(етилсульфоніл)бензил)-6-метил-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; N-[4-{циклопропілсульфоніл)бензил]-5-(3,5диметилізоксазол-4-іл)-6-метил-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 1-(3-ціаноофеніл)-5-(3,5-диметилізоксазол-4іл)-6-метил-N-[4-(метилсульфоніл)бензил]-2-оксо1,2-дигідропіридин-3-карбоксамід; 1-(3-хлорфеніл)-5-(3,5-диметилдиметилізоксазол-4-іл)-6-метил-2-оксо-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 5-(3,5-диметилізоксазол-4-іл)-6-метил-2-оксо1-м-толіл-1,2-дигідропіридин-3-карбонової кислоти 4-метансульфонілбензиламід. 5-(5-ізопропіл-[1,3,4]оксадіазол-2-іл)-6-метил2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 6-метил-5-[1,3,4]оксадіазол-2-іл)-2-оксо-1-(3трифлуорметилфеніл)-1,2-піридин-3-карбонової кислоти 4-метансульфонілбензиламід; 5-(5-гідрокси-[1,3,4]оксадіазол-2-іл)-6-метил-2оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 6-метил-5-(5-метил-4Н-[1,2,4]триазол-3-іл)-2оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метилсульфонілбензиламід; 5-{4,5-диметил]-4Н-[1,2,4]триазол-3-іл)-6метил-2-оксо-1-{3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 5-(5-метоксиметил-[1,3,4]оксадіазол-2-іл)-6метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; N-[4-(ізопропілсульфоніл)бензил]-6-метил-5-(5метил-1,3,4-оксадіазол-2-іл)-2-оксо-1-{3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; N-[4(етилсульфоніл)бензил]-6-метил-5-(5метил-1,3,4-оксадіазол-2-іл)-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; N-[4-(циклопропілсульфонт)бензил]-6-метил-5{5-метил-1,3,4-оксадіазол-2-іл)-2-оксо-1-[3{трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 6-метил-5-[1,3,4]оксадіазол-2-іл-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-{пропан-2-сульфоніл)бензиламід; 6-метил-5-[1,3,4]оксадіазол-2-іл-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3 19 карбонової кислоти 4циклопропансульфонілбензиламід; 6-метил-5-(2-метил-1,3-оксазол-4-іл)-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 6-метил-N-[4-(метилсульфоніл)бензил]-5-(1,3оксазол-4-іл)-2-оксо-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід; 5-(2-аміно-тіазол-4-іл)-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 5-(2,5-диметил-1,3-оксазол-4-іл)-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 6-метил-5-(5-метил-1,3-оксазол-4-іл)-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 5-(2-аміно-5-метил-тіазол-4-іл)-6-метил-2-оксо1-(3-трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 5-(2-гідроксиметил-5-метилтіазол-4-іл)-6метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 6-метил-5-(5-метил-[1,2,4]оксадіазол-3-іл)-2оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід; 6-метил-5-[1,2,4]оксадіазол-3-іл-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 6-метил-2-оксо-5-(1Н-тетразол-5-іл)-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 6-метил-5-(4-метил-оксазол-2-іл)-2-оксо-1-(3трифлуорметилфеніл}-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; 5-(4,5-диметил-оксазол-2-іл)-6-метил-2-оксо-1(3-трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід; N-(циклогексилметил)-6-метил-2-оксо-5-феніл1-[3-{трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 6-метил-N-{2-морфолін-4-ілетил)-2-оксо-5феніл-1-[3-{трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; 6-метил-2-оксо-5-фент-N-1Н-1,2,4-триазол-3іл-1-[3-(трифлуорметил)феніл]-1,2-дигідропіридин3-карбоксамід; N-[2-(1Н-індол-3-іл)етил]-6-метил-2-оксо-5феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; 6-метил-2-оксо-5-феніл-N-(1-фенілетил)-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 6-метил-2-оксо-5-феніл-N-(2-фенілетил)-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 6-метил-2-оксо-5-феніл-N-[(2R)-2фенілциклопропіл]-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід; 84571 20 N-(2,3-дигідро-1Н-інден-2-іл)-6-метил-2-оксо-5феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; N-[(1-етилпіролідин-2-іл)метил]-6-метил-2оксо-5-феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; 6-метил-N-(1-нафтилметил)-2-оксо-5-феніл-1[3-(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; N-(1,3-бензодіоксол-5-ілметил)-6-метил-2оксо-5-феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; N-(2-хлор-4-флуорбензил)-6-метил-2-оксо-5феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; 6-метил-2-оксо-5-феніл-N-(2-тієнілметил)-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; N-(2-циклогекс-1-ен-1-ілетил)-6-метил-2-оксо5-феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; 6-метил-2-оксо-N-(4-феноксибензил)-5-феніл1-[3-(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; N-[(2,5-диметил-3-фурил)метил]-6-метил-2оксо-5-феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; N-{2-{4-(аміносульфоніл}феніл]етил}-6-метил2-оксо-5-феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; 6-метил-2-оксо-5-феніл-N-[4-(1Н-піразол-1іл)бензил]-1-[3-{трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; 6-метил-2-оксо-N-фенокси-5-феніл-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; N-[(6-флуор-4Н-1,3-бензодіоксин-8-іл)метил]6-метил-2-оксо-5-феніл-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 6-метил-2-оксо-5-феніл-N-[2-(тетрагідро-2Нпіран-4-етил]-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; 6-метил-2-оксо-5-феніл-N-[3-(1Н-піразол-1іл)пропіл]-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; 6-метил-N-[(1-метил-1Н-піразол-4-іл)метил]-2оксо-5-феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; 6-метил-2-оксо-5-феніл-N-[(1-феніл-1Нпіразол-4-іл)метил]-1-[3-(трифлуорметил)-феніл]1,2-дигідропіридин-3-карбоксамід; N-[(5-метокси-4-оксо-4Н-піран-2-іл)метил]-6метил-2-оксо-5-феніл-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід; N-(3-азепан-1-ілпропіл)-6-метил-2-оксо-5феніл-1-{3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід; N-(4-ціанобензил)-6-метил-2-оксо-5-феніл-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 6-метил-2-оксо-N-[3-(5-оксо-4,5-дигідро-1Нпіразол-4-іл)пропіл]-5-феніл-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 21 84571 6-метил-5-(2-метил-2Н-піразол-3-іл)-2-оксо-1(3-трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти (3-метил-ізоксазол-5-ілметил)амід; 6-метил-5-(2-метил-2Н-піразол-3-іл)-2-оксо-1(3-трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти (5-метансульфонілметил[1,2,4]оксадіазол-3-ілметил)-амід; 6-метил-5-(2-метил-2Н-піразол-3-іл)-2-оксо-1(3-трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти ([1,2,4]оксадіазол-3-ілметил)амід; 6-метил-5-(1-метил-1Н-піразол-5-іл)-N-{[5(метилсульфоніл)піридин-2-іл]метил}-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; 5-(3,5-диметилізоксазол-4-іл)-6-метил-N-{[5(метилсульфоніл)піридин-2-іл]метил}-2-оксо-1-[3{трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід; їх прийнятні солі. Заявлений винахід стосується сполуки формули (І) у формі солей, зокрема, кислотноадитивних солей. Придатні солі охоплюють солі з органічними та неорганічними кислотами. Такі кислотно-адитивні солі повинні звичайно бути фармацевтично прийнятними, хоча солі фармацевтично неприйнятних кислот можна застосовувати в отриманні та очистці потрібної сполуки. Отже, переважні солі охоплюють утворені хлоридною, бромід-ною, сульфатною, фосфатною, лимонною, винною, молочною, піровиноградною, оцтовою, бурштиновою, фумаровою, малеїновою, метансульфоновою та бензолсульфоно-вою кислотами. Згідно з ще одним аспектом винахід стосується способу отримання сполуки формули (І), котрий полягає у: а) реакції сполуки формули (II) де R1, R4, R5 , Y, G 1, G2 , L та n визначені у формулі (І), a Hal репрезентує атом галогену, переважно бром або йод; з нуклеофілом R2-M де R2 визначено у формулі (І), а М репрезентує груп у органостануму або органоборонової кислоти; або b) коли R2 репрезентує 1,3,4-оксадіазол-2-іл або 1,3,4-тіадіазол-2-іл, реакції сполуки формули (III) 22 де R1, R4, R5 , Y, G 1, G2 , L та n визначені у формулі (І), Ζ репрезентує О або S, а X репрезентує С1-6-алкіл або NR47R48, a R47 та R48 визначені у формулі (І); з придатним засобом дегідратування як-то фосфорилхлорид або триметилсилілполіфосфат: або с) реакцію сполуки формули (XV) де R1, R2, R5, Y, G1 та n визначені у формулі (І), a L репрезентує відщеплювану груп у, зі сполукою формули (IX) або її сіллю де R4, G 2 та L визначені у формулі (І); та коли потрібно або необхідно, перетворення отриманої сполуки формули (І) або іншої її солі у фармацевтично прийнятну сіль; або перетворення одної сполук формули (І) в іншу сполук у формули (І); та коли потрібно, перетворення отриманої сполуки формули (І) в її оптичний ізомер. На етапі (а) реакцію проводять при придатній температурі, загалом між 50°С та 150°С у придатному розчиннику, як-то толуол, у присутності каталізатору на базі перехідного металу, як-то паладій, як варіант, реакцію можна проводити у присутності основи, як-то калій карбонат. На етапі (b) реакцію проводять при придатній температурі, загалом між 20°С та 100°С у придатному розчиннику, як-то дихлорметан, якщо необхідно, застосовуючи герметичну посудину. 23 84571 Фахівцю ясно, що сполуки формули (І), де R2 репрезентує 5-членне гетероароматичне кільце, що не є 1,3,4-оксадіазол-2-ілом або 1,3,4тіадіазол-2-ілом, можна також отримувати способами, у котрій кінцевим етапом є замикання 5членного гетероароматичного кільця. Конкретні приклади таких способів описані у нижченаведених прикладах. Такі способи утворюють ще один аспект заявленого винаходу. На етапі (с) реакцію проводять при придатній температурі, загалом між 0°С та температурою кипіння розчиннику, у придатному розчиннику, якто дихлорметан або N-метилпіролідинон. Процес, як варіант, проводять у присутності основи та/або реагенту сполучення, як-то HATU, НОАТ, HOBT чи DIEA. Придатні відщеплювані групи L1 охоплюють ОН та галоген. Сполуки формули (III) можна отримувати реакцією сполуки формули (IV) 24 де R1, R4, R5 , Y, G 1, G2 , L та n визначені у формулі (І) a R репрезентує С1-6-алкіл; з водною основою, як-то натрій гідроксид, а потім обробкою продукту хлорувальним засобом, як-то тіонілхлорид. Це можна проводити при придатній температурі, загалом між 10°С та 50°С у придатному розчиннику, як-то тетрагідрофуран або дихлорметан. Сполуки формули (VI) можна отримувати реакцією сполуки формули (II) з карбон монооксидом у присутності спирту, як-то метанол або етанол, у присутності придатного каталізатору на базі перехідного металу. Це можна проводити при придатній температурі, загалом між 50°С та 150°С у придатному розчиннику так метанол або етанол в атмосфері карбон монооксиду при підвищеному тиску загалом між 2 та 10 атмосфер. Реакцію проводять у присутності каталізатору на базі перехідного металу, як-то паладій. Сполуки формули (Н) можна отримувати реакцією сполуки формули (VII) де R1, R4, R5 , Υ, G 1, G2 , L та n визначені у формулі (І), зі сполукою загальної формули (V) де X визначено у формулі (III). Цю реакцію можна проводити при придатній температурі, загалом між 0°С та 50°С у придатному розчиннику, як-то 1,4-діоксан. Сполуки формули (IV) можна отримувати реакцією сполуки формули (VI) де R1, R4, R5 , Υ, G 1, G2 , L та n визначені у формулі (І), із засобом галогенування, як-то NЙодсукцинімід. Це проводять при придатній температурі, загалом між 0 та 50°С у придатному розчиннику, як-то ацетонітрил, у присутності кислоти, як-то трифлуорметан-сульфонова кислота. Сполуки формули (VII) можна отримувати реакцією сполуки формули (VIII) де R1, R5, Y, G1 та n визначені у формулі (І), a L репрезентує відщеплювану гр упу, з аміном формули (IX) або його сіллю 25 84571 де R4, G2 та L визначені у формулі (І). Це проводять при придатній температурі загалом між 0°С та температурою кипіння розчиннику, у придатному розчиннику як-то дихлорметан або Nметилпіролідинон. Процес, як варіант, проводять у присутності основи та/або реагенту сполучення, як-то HATU, НОАТ, HOBT або DIEA. Придатні відщеплювані групи L1 о хоплюють ОН та галоген. Сполуки формули (VIII) де Υ - CR3, L1 - ОН, a 3 R - гідроген, можна отримувати конденсацією сполуки формули (X) 26 де G1, R5 та n визначені у формулі (І), зі сполукою формули (XIII). де R3 визначено у формулі (І), при придатній температурі, як-то 160°С, а потім ініційованою основою циклізацією та гідролізом кислотою. Сполуки формули (XIII) можна отримувати як у [US 3838155]. Сполуки формули (VIII) де Υ - CR3, L1 - ОН, a R1 - метил, a R3 - гідроген можна отримувати конденсацією сполуки формули (XIV) де R1 визначено у формулі (І); зі сполукою формули (XI) де G1, R5 та n визначені у формулі (І), у присутності придатної основи, як-то натрій метоксид, у придатному розчиннику, як-то етанол, а потім гідролізом придатною основою, як-то натрій гідроксид. Взагалі, сполуки формул (X) та (XI) відомі, або їх можна отримувати способами, відомими фахівцю. Наприклад, сполуки формули (X) можна отримувати способами S.M Brombridge et al., Synthetic Communications, 1993,23,487-494. Сполуки формули (XI) можна отримувати способами Igor V. Ukrainets et al., Tetrahedron, 1994,50,10331-10338. Сполуки формули (VIII) де Υ - CR3, L1 - ОН, a R1 - гідроген можна отримувати реакцією сполуки формули (XII) де G1, R5 та n визначені у формулі (І), з 4метокси-3-бутен-2-он у присутності придатної основи, як-то 1,4-діазабіцикло[2,2,2]октан, при придатній температурі у придатному розчиннику, як-то діетиленгліколю монометиловий етер, а потім гідролізом кислотою. Солі сполук формули (І) можна отримувати реакцією вільної основи або солі, енантіомеру, таутомеру або їх захи щеного похідного, з одним або більше еквівалентами прийнятної кислоти. Реакцію можна проводити у розчиннику або середовищі, у котрих сіль є нерозчинною, або у розчиннику, у котрому сіль є розчинною, а потім видаляти розчинник у вакуумі або сублімаційною сушкою. Придатні розчинники охоплюють, наприклад, воду, діоксан, 1,2-пропанол, тетрагідрофуран або діетиловий етер чи їх суміші. Реакція може бути обмінною або її можна проводити на іонообмінній смолі. Сполуки формули (І) та їх інтермедіати можна отримувати у захищеній формі. Захист та зняття захисту з функціональних груп, наприклад, описано у ['Protective Groups in Organic Chemistry', edited by J. W. F. McOmie, Plenum Press (1973), та 'Protective Groups in Organic Synthesis', 3rd edition, 27 84571 T.W. Greene & P.G.M. Wuts, Wiley-lnterscience (1999)]. Сполуки винаходу та інтермедіати можна виділяти з їх реакційної суміші, а якщо необхідно очищати стандартними способами. Сполуки формули (І) можуть існувати у енантіомерних або діастереоізомерних формах або як їх суміші, усі вони охоплені рамками винаходу. Різні оптичні ізомери можна виділяти розділенням рацемічної суміші сполук звичайними способами, наприклад, фракційною кристалізацією або ВЕРХ. Альтернативно, індивідуальні енантіомери можна отримувати реакцією прийнятних оптично активних ви хідних матеріалів в умовах реакції, що не викликатимуть рацемізації. Інтермедіати можуть також існувати в енантіомерних формах та їх можна використовувати як очищені енантіомери, діастереомери, рацемати або їх суміші. Згідно з ще одним аспектом винаходу запропоновано сполуку формули (І) або її фармацевтично прийнятну сіль, для застосування як медикаменту. Сполуки формули (І) та їх фармацевтично прийнятні солі, є корисними внаслідок вони виявляють фармакологічну активність у тваринах. Сполуки формули (І) мають активність як фармацевтичні засоби, зокрема, як модулятори еластази нейтрофілів людини та гомологічних серинових протеаз, як-то протеїназа 3 та панкреатична еластаза, і як такі є прогностичними як корисні у терапії. Сполуки формули (І) є особливо корисними як інгібітори еластази нейтрофілів людини. Вони можуть отже бути застосовуваними у лікуванні чи профілактиці запальних хвороб та станів. Прикладами цих станів є: синдром дихальної недостатності дорослих (ARDS), кістозний фіброз, легенева емфізема, хронічна обструктивна хвороба легень (COPD) та ішемічно-реперфузійні пошкодження. Сполуки цього винаходу можуть також бути корисними у модуляції ендогенних та/або екзогенних біологічних подразників, котрі викликають та/або посилюють атеросклероз, діабет, інфаркт міокарду; гепатичні розлади, охоплюючи, але без обмеження, цироз, системний червоний вовчак, запальну хворобу лімфоїдного походження, охоплюючи, але без обмеження, Т-лімфоцити, B-лімфоцити, тимоцити; аутоімунні хвороби, кістковий мозок, запалення суглобу (особливо ревматоїдний артрит, остеоартрит та подагра); запалення шлунково-кишкового тракту (особливо запальна хвороба кишечнику, виразковий коліт, панкреатит та гастрит); запалення шкіри (особливо псоріаз, екзема, дерматит); при метастазах чи інвазії пухлин; при хворобі, асоційованій з неконтрольованим розкладанням екстрацелюлярного матриксу, як-то остеоартрит; при хворобі резорбції кісток (якто остеопороз та хвороба Педжета); хворобах, асоційованих з порушеним ангіогенезом; посиленою реконструкцією колагену, асоційованою з діабетом, періодонтальною хворобою (як-то гінгівіт), корнеальне укривання виразками, укривання виразками шкіри, пост-оперативні стани (як-то анастомоз ободової кишки) та загоєння поранень шкіри; деміелінизувальні хвороби центральної та 28 периферійної нервової системи (як-то розсіяний склероз); спорідненій з віком хворобі, як-то деменція, запальних хворобах серцево-судинного походження; грануломатозних хворобах; ниркових хворобах, охоплюючи, але без обмеження, нефрит та поліартерііт; раку; легеневій гіпертензії, отруєнні, контактах шкіри, ук усах комах, ук усах; астмі; риніті; хворобах прогресу ВІЛ; для мінімізації дії відторгнення органу при трансплантації органів, охоплюючи, але без обмеження, органів людини; та заміщувальній терапії інгібіторів протеїнази. Отже, згідно з ще одним аспектом винахід стосується застосування сполуки формули (І) або її фармацевтично прийнятної солі у виробництві медикаменту для лікування чи профілактики хвороб або станів, де корисним є інгібування активності еластази нейтрофілів; та спосіб лікування або зменшення ризику хвороби або стану, де корисним є інгібування активності еластази нейтрофілів, що полягає у застосуванні до особи, яка потерпає від вказаної хвороби або стану або при їх ризику, терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі. Згідно з ще одним аспектом винахід стосується застосування сполуки формули (І) або її фармацевтично прийнятної солі, у виробництві медикаменту для лікування чи профілактики запальних хвороб або станів; та спосіб лікування або зменшення ризику запальної хвороби або стану, що полягає у застосуванні до особи, яка потерпає від вказаної хвороби або стану або при їх ризику, терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі. Загалом, сполуки цього винаходу можна використовувати у лікуванні синдрому дихальної недостатності дорослих (ARDS), кістозного фіброзу, легеневої емфіземи, хронічної обструктивної хвороби легень (COPD), легеневої гіпертензії, астми, риніту, ішемічно-реперфузійного пошкодження, ревматоїдного артриту, остеоартриту, раку, атеросклерозу та пошкодження слизової шлунка. Профілактика, як очікувано, буде особливо доречною для лікування осіб, які постраждали раніше або, як вважають інакше, мають підвищений ризик стосовно розглянутої хвороби або стану. Особи при ризику розвитку конкретної хвороби або стану загалом охоплюють тих, які мають історію хвороби або стану родини, або які ідентифіковані генетичним тестуванням чи скринінгом як особливо чутливі до розвитку хвороби або стану. Для вищезгаданих терапевтичних показань, доза застосовуваної сполуки залежатиме від застосовуваної сполуки, хвороби, яку лікують, режиму застосування, віку, маси та статі пацієнта. Такі фактори може визначити лікар. Однак, загалом, задовільні результати отримують, коли сполуки застосовують до людини при добовому дозуванні між 0,1мг/кг до 100мг/кг (виміряному стосовно активного інгредієнту). Сполуки формули (І) можна використовувати самі по собі або у формі прийнятних фармацевтичних композицій, що містять сполуку винаходу у комбінації з фармацевтично прийнятним розріджувачем, ад'ювантом або носієм. Особливо переважними є композиції, що не містять матеріалу, зда 29 84571 тного викликати шкідливу реакцію, наприклад, алергічну реакцію. Звичайні способи вибору та отримання придатних фармацевтичних композицій описані, наприклад, у ["Pharmaceuticals - The Science of Dosage Form Designs", M.E. Aulton, Churchill Livingstone, 1988]. Згідно з винаходом запропоновано фармацевтичну композицію, що містить переважно менше, ніж 95мас%, а краще менше, ніж 50мас% сполуки формули (І) у суміші з фармацевтично прийнятним розріджувачем або носієм. Нами також запропоновано спосіб отримання таких фармацевтичних композицій, що містять змішані інгредієнти. Сполуки можна застосовувати місцево, наприклад, до легень та/або дихальних шляхів, у формі розчинів, суспензій, ГФА-аерозолів або композицій сухого порошку, наприклад, композицій у пристрої для інгаляції, відомому як Turbuhaler®; або систематично, наприклад, пероральним застосуванням у формі таблеток, пілюль, капсул, сиропів, порошків або гранул; або парентеральним застосуванням, наприклад, у формі стерильних парентеральних розчинів або суспензій; або ректальним застосуванням, наприклад, у формі супозиторієв. Сухі порошкові композиції та стиснені ГФАаерозолі сполук винаходу можна застосовувати пероральною або назальною інгаляцією. Для інгаляції сполуку бажано мілко подрібнити. Мілко подрібнена сполука переважно має середній діаметр частинок менше 10мкм, та може бути суспендованою у суміші пропеленту з диспергатором, як-то С8-С20-жирна кислота або її сіль, (наприклад, олеїнова кислота), жовчна сіль, фосфоліпід, алкілсахарид, перфлуорований або поліетоксилований сур фактант, або інший фармацевтично прийнятний диспергатор. Сполуки винаходу можна також застосовувати інгалятором сухого порошку. Інгалятор може бути одиночно- чи багатодозовим інгалятором, та може бути активованим вдихом інгалятором сухого порошку. Одна можливість полягає у суміші мілко подрібненої сполуки з носієм, наприклад, моно-, ди- або полісахарид, цукровий спирт, або інший поліол. Придатними носіями є цукри, наприклад, лактоза, глюкоза, рафіноза, мелецитоза, лактитол, мальтитол, трегалоза, сахароза, манітол; та крохмаль. Альтернативно мілко подрібнена сполука може бути покритою ще одною речовиною. Суміш порошку можна також розподіляти у тверді желатинові капсули, кожна з яких містить потрібну дозу активної сполуки. Ще одна можливість полягає в обробці мілко подрібненого порошку у сфери, котрі руйнуються при інгаляції. Цим сферонізованим порошком можна заповнювати резервуар для ліків багатодозового інгалятора, наприклад, відомого як Turbuhaler®, у котрій дозувальний елемент вимірює потрібну дозу, котра тоді інгалюється пацієнтом. З цієї системи активну сполуку, з носієм чи без нього, уводять пацієнту. Для перорального застосування активну сполуку можна змішувати з ад'ювантом або носієм, як-то, лактоза, сахароза, сорбітом, манітол; крох 30 маль, наприклад, картопляний крохмаль, кукурудзяний крохмаль або амілопектин; похідне целюлози; зв'язуюче, наприклад, желатин або полівінілпіролідон; та/або змащувач, наприклад, магній стеарат, кальцій стеарат, поліетиленгліколь, віск, парафін, тощо, та тоді пресувати у таблетки. Якщо потрібні покриті таблетки, серцевини, виготовлені як вищезазначено, можуть бути покритими концентрованим цукровим розчин, котрий може містити, наприклад, гуміарабік, желатин, тальк, титан діоксид, тощо. Альтернативно, таблетки можуть бути покритими придатним полімером, розчиненим у легко летючому органічному розчиннику. Для отримання м'яких желатинових капсул сполуку можна змішувати, наприклад, з рослинною олією або поліетиленгліколем. Тверді желатинові капсули можуть містити гранули сполуки з будьякими вищезазначеними ексципієнтами для таблеток. Також рідкими або напівтвердими композиціями ліків можна заповнювати тверді желатинові капсули. Рідкі препарати для перорального застосування можуть бути у формі сиропів або суспензій, наприклад, розчинів, що містять сполуку з цукром та суміш етанолу, води, гліцерину та пропіленгліколю, як варіант, такі рідкі препарати можуть містити барвники, ароматизатори, сахарин та/або карбоксиметилцелюлозу як ущільнювач або інші ексципієнти, відомі фахівцям. Сполуки винаходу можна також застосовувати разом з іншими сполуками, застосовуваними для лікування вищенаведених станів. Наступні приклади ілюструють, але без обмеження, винахід. Спектри 1Н ЯМР та 13С ЯМР реєстрували на спектрометрі Varian Inova 400МГц або Varian Mercury-VX 300МГц. Центральні піки хлороформу-d (δН 7,27млн -1), диметилсульфоксиду-d6 (δН 2,50млн -1), ацетонітрилу-d6 (δН 1,95млн -1) чи метанолу- d64 (δН 3,31млн -1) були використані як внутрішній стандарт. Хроматографію на колонці проводили, застосовуючи силікагель (0,040-0,063, мм, Merck). Якщо не вказане інше, вихідні матеріали були комерційно доступними. Усі розчинники та комерційні реагенти були лабораторного гатунку та були застосовані як отримані. Застосовані такі скорочення: HBTU О-(бензотриазол-1-іл)-N,N,N',N'тетраметилуроній гексафлуорфосфат; HATU О-(7-азабензотриазол-1-іл)- N,N,N',N'тетраметилуроній гексафлуорфосфат; HOBT 1-Гідроксибензотриазол; HOAT 1-Гідрокси-7-азабензотриазол); DIEA Ν,Ν-діізопропілетиламін; NMP 1-N-Ме тил-2-піролідинон; ДМЕ 1,2-Диметоксіетан; ТГФ Тетрагідрофуран; ТФОК Три флуороцтова кислота; ДМФ Ν,Ν-диметилформамід; ДХМ Дихлорметан. Наступний спосіб застосовували для РХ/МСаналізу: Інструмент Agilent, 1100; Колонка Waters Symmetry 2,1´30мм; Mass APCI; Швидкість потоку 31 84571 0,7мл/хвилин; довжина хвилі 254нм; Розчинник А: вода + 0,1% ТФОК; Розчинник В: ацетонітрил + 0,1% ТФОК; Градієнт 15-95%/В 8 хвилин, 95%В 1 хвилину. Аналітичну хроматографію проводили на колонці Symmetry С18, 2,1 ´30мм з розміром частинок 3,5мкм, з сумішшю ацетонітрил/вода/0,1% трифлуороцтова кислота як мобільною фазою з градієнтом від 5% до 95% ацетонітрилу протягом 8 хвилин при швидкості потоку 0,7мл/хвил. Приклад 1 6-Метил-N-[4-(метилсульфоніл)Бензил]-2-оксо-5-феніл-1-[3-{трифлуорметил)феніл]1,2-дигідропіридин-5-карбоксамід a) Етил 3-оксо-3-{[3-(трифлуорметил)феніл]аміно}пропаноат До охолодженого льодом розчину 3трифлуорметил)аніліну (64,5г, 0,40моль) та триетиламіну (60мл) в ацетоні (700мл) додавали краплями етил 3-хлор-3-оксопропаноат (63,6г, 0,42моль) в ацетоні (50мл). Після додавання (приблизно 30 хвилин) перемішування продовжували при кімнатній температурі протягом ночі. Розчинники видаляли та додавали воду (1200мл). Утворений осад відфільтровували, ретельно промивали двічі водою та тоді сушили, отримуючи заголовну сполуку як жовтий порошок (109г, 99%). 1 Н ЯМР (CDCI3): δ 9,52 (1Н, s); 7,87 (1Н, s); 7,78 (1Н, d); 7,46 (1Н, t); 7,39 (1Н, d); 4,29 (2H,q); 3,50 (2H, s); 1,35 (3H, t). XIAT-MC m/z: 276,1 [MH +]. b) 6-Метил-2-оксо-1-[3-(трифлуорметил)феніл]-1,2-дигідропіридин-3-карбонова кислота До розчину етил 3-оксо-3-{[3-(трифлуорметил)феніл]аміно}пропаноату (19,2г, 70ммоль) та натрій метоксиду (7,6г, 140ммоль) у ЕtOН (250мл) додавали 4-метоксибут-3-ен-2-он (90%) (7,72г, 77ммоль). Після додавання реакційну суміш гріли при кипінні під зворотним холодильником протягом 2 годин та тоді охолоджували. Воду (50мл) та 2М NaOH додавали та суміш перемішували при кімнатній температурі протягом ночі. Органічні розчинники видаляли та реакційну суміш екстрагували (промивали) EtOAc. Водні фази підкислювали гідрохлоридною кислотою до pH 3-4, оранжевий осад, що виникав, відфільтровували, промивали водою та сушили. Перекристалізація двічі з суміші гептан/ЕtOAc (4:1), дала заголовну сполуку (12г, 58%) як білий порошок. 1 Н ЯМР (CDCI3): δ 13,68 (1Н, s); 8,54 (1H, d); 7,86 (1H, d); 7,79 (1H, t); 7,55 (1H, brs); 7,48 (1H, d); 6,58 (1H, d); 2,16 (3H, s). XIAT-MC m/z: 298,1 [MH +]. c) 6-Метил-N-[4-(метилсульфоніл)бензил]-2оксо-1-[3-{трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід Суміш 6-метил-2-оксо-1-[3-(трифлуорметил)феніл]-1,2-дигідропіридин-3-карбонової кислоти (7,43г, 25ммоль), HATU (10,5г, 27,5ммоль), НОАТ (3,75г, 27,5ммоль) та DIEA (14,2мл, 82,5ммоль) у NMP (65мл) реагувала протягом 1 години, тоді додавали 4-метидсульфонілбензиламін гідрохлорид (5,8г, 26ммоль). Через 1 годину реакційну суміш повільно виливали у суміш лід-вода з перемішуванням (1л). Отримували порошок, та водну суміш підкислювали до pH 3 лимонною кислотою (0,5М), та перемішування продовжували протягом 32 1 години. Осад відфільтровували, промивали водою та сушили у вакуумі протягом ночі. Перекристалізація з ЕtOAc дала 8,1г (70%).1 Н ЯМР (CDCI3): δ 10,00 (1Н, brt); 8,60 (1Н, d); 7,88 (2Н, d); 7,83 (1Н, d); 7,76 (1Н, t); 7,53 (3Н, m); 7,46 (1Н, d); 6,49 (1Н, d);4,68 (2Н, m); 3,03 (3Н, s); 2,10 (3Н, s). ХІАТ-МС m/z: 465,1 [МН+]. d) 5-Йод-6-метил-N-[4-(метилсульфоніл)бензил]-2-оксо-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід До розчину 6-метил-N-[4-(метилсульфоніл)бензил]-2-оксо-1-[3-(трифлуорметил)феніл]-1,2-дигідропіридин-3-карбоксаміду (200мг, 0,43ммоль) у MeCN (1,5мл) при кімнатній температурі та під аргоном додавали трифлуорметансуль-фонову кислоту (1мл), а потім Nйодсукцинімід (97мг, 0,43ммоль). Через 45 хвилин реакційну суміш розбавляли ДХМ, промивали водним NaHCO3, водним NaS2O3 та водою, сушили натрій сульфатом, та випарювали, отримуючи заголовну сполук у (200мг). 1 Н ЯМР (CDCI3): δ 9,85 (1Н, brt): δ 9,85 (1Н, d); 7,88 (2Н, d); 7,76 (2Н, m); 7,50 (2Н, d); 7,48 (1Н, s); 7,40 (1Н, d); 4,65 (2Н, m); 3,03 (3Н, s); 2,32 (3Н, s). ХІАТ-МС m/z: 591,0 (МН+] e) 6-Метил-N-[4-(метилсульфоніл)бензил]-2оксо-5-феніл-1-[3-{трифлуорметил)феніл]-1,2дигідропіридин-5-карбоксамід Суміш фенілборонової кислоти (25мг, 0,20ммоль), 1,1' біс(дифенілфосфіно)фероцендихлорпаладію (ІІ) (4мг, 0,005ммоль), 5-Йод-6метил-N-[4-(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду (100мг 0,17ммоль), толуолу (1мл), етанолу (99%, 0,25мл) та Na2CO3 (2M, 0,25мл) перемішували при 80°С протягом ночі, концентрували та залишок очищали флеш-хроматографією, отримуючи заголовну сполуку (70мг, 76%). 1 Н ЯМР (CDCI3): δ 10,04 (1Н, brt); 8,64 (1H, s); 7,88 (2H, d); 7,82 (1H, d); 7,76 (1H, t); 7,58 (1H, s); 7,54-7,39 (6H, m), 7,31 (2H, d); 4,69 (2H, m); 3,02 (3Н, s); 2,03 (3Н, s). ХІАТ-МС m/z: 541 [ΜH 4]. Приклад 2 5-Фуран-3-іл-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід Суміш 5-йод-6-метил-N-[4-(метилсульфоніл)бен-зил]-2-оксо-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксаміду (Приклад 1 (d), 0,0413г, 0,07ммоль), фуран-3-боронової кислоти (0,009г, 0,08ммоль), Pd(PPh3)4 (0,004г, 3,46ммоль), ДМЕ (2мл) та Na2CO3 (2мл, 2М) енергійно перемішували під азотом у герметичній посудині при 80°С протягом 2 годин. Ще одну порцію фуран-3боронової кислоти (0,004г) та Pd(PPh3)4 (0,001г) додавали та реакції давали йти протягом ще одної години. Суміші давали охолонути та тоді розподіляли між ЕtOАс та водою. Органічну фазу збирали та водну фазу екстрагували ще одною порцією ЕtOАс (10мл). Комбіновані органічні фази промивали водою, розсолом та сушили натрій сульфатом. Фільтрування та випарювання дали сире масло, котре очищали на силікагелі (гептан: ЕtOАс 2:1 до 1:1 до 1:2), що після випарювання чистих 33 84571 фракцій дало 0,023г (62%) заголовної сполуки як білий твердий продукт. 1 Н ЯМР (ДМСО-d6): δ 9,94 (1Н, t, J 6,0Гц); 8,36 (1Н, s); 7,96-7,73 (7Н, m); 7,54 (2Н, d, J 8,14Гц); 7,46 (1Н, d, J 7,4Гц); 6,73 (1Н, s); 4,59 (2Н, d, J 6,13Гц); 3,17 (3Н, s); 2,06 (3Н, s). XIAT-MC m/z: 5313 [МН+]. Загальним способом з прикладу 1 були отримані сполуки з прикладів 3-6: Приклад 3 5-[4-(гідроксиметил)феніл]-6-метилN-[4-(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід 1 Н ЯМР (CDCI3): δ 10,04 (1Н, brs); 8,64 (1Н, brs); 7,88-7,77 (4Н, m); 7,38-7,47 (6Н, m): 7,32 (2Н, brs); 4,78 (2Н, s) 4,70 (2Н, brs); 3,02 (3Н, s); 2,03 (3Н, s). XIAT-MC m/z: 571 [ΜN+]. Приклад 4 6'-Метокси-2-метил-N-[4(метилсульфоніл)бензил]-6-оксо-1-[3(трифлуорметил)феніл]-1,6-дигідро-3,3'-біпіридинкарбоксамід 1 H ЯМР (CDCI3): δ 10,00 (1Н, t); 8,58 (1Н, s); 8,12 (1Н, d); 7,89-7,74 (4Н, m); 7,58-7,49 (5Н, m); 6,85 (1Н, d); 4,69 (2Н, m); 4,00 (3Н, s); 3,02 (3Н, s); 2,02 (3Н, s). XIAT-MC m/z: 572 [MH +]. Приклад 5 5-(2-Метоксипіримідин-5-іл)-6метил-N-[4-(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1-2-дигідропіридин-3карбоксамід 1 Н ЯМР (CDCI3): δ 9,93 (1Н, brt); 8,56 (1Н, s); 8,51 (2Н, s); 7,89-7,75 (4Н, m); 7,57-7,48 (4Н, m); 4,69 (2Н, m); 4,07 (3Н, s); 3,02 (3Н, s); 2,02 (3Н, s). XIAT-MC m/z: 573 [MH +]. Приклад 6 5-[4-(Ацетиламіно)феніл]-6-метилN-[4-(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід 1 Н ЯМР (CDCI3): δ 10,05 (1Н, brt); 8,61 (1Н, s); 7,89-7,73 (4Н, m); 7,61-7,49 (6Н, m); 7,39 (1Н, s); 7,24(1 N, s) 4,69 (2Н, m); 3,02 (3Н, s); 2,21 (3Н, s); 2,02 (3Н, s). XIAT-MC m/z: 598 [MH +]. Приклад 7 6-Метил-2-оксо-5-(1Н-пірол-3-іл)4{3-трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід Суміш 5-йод-6-метил-N-[4-(метилсульфоніл)бензил]-2-оксо-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксаміду (0,080г, 0,10ммоль), 1-триметилсиліл-1Н-пірол-3-ілборонової кислоти (0,033г, 0,12ммоль), Pd(PPh3)4 (0,005г,-4,34ммоль)3 ДМЕ (2мл) та Na2CO3 (2мл, 2М) енергійно перемішували під азотом у герметичній посудині при 80°С протягом 2 годин. Ще одну порцію 1-триметилсиліл-1Н-пірол-3-іл-боронової кислоти (0,005г} та Pd(PPh3)4 (0,004г) додавали та реакції давали йти протягом ще одної години. Суміші давали охолонути та розподіляли між ЕtOAc та водою. Органічну фазу збирали та водну фазу екстрагували ще одною порцією ЕtOAc. Комбіновані органічні фази промивали водою та розсолом, та тоді сушили натрій сульфатом. Фільтрування та випарювання дали сире масло, котре очищали на силікагелі (гептан : ЕtOAc 2:1®1:1®1:2), що після 34 випарювання чистих фракцій дало 0,08г (80%) інтермедіату як білий твердий продукт. Розчин цього твердого продукту у ТГФ (10мл), що містив тетрабутиламоній флуорид тригідрат (0,025г, 0,08ммоль) перемішували при кімнатній температурі протягом 1 години. Випарювання та очистка на силікагелі (гептан: ЕtOAc 2:1®1:1®1:2) дали 0,02г (47%) заголовної сполуки як білий твердий продукт, котрий темнів при стоянні. 1 Н ЯМР (CDCIg): δ 10,12 (1Н, t, J 5,5Гц); 8,68 (1Н, s); 8,53 (1Н, bs); 7,86 (2Н, d, J 8,3 m); 1,19 (1H, d, J 7,8Гц); 7,73 (1H, t, J 7,8Гц); 7,55 (1Н, s); 7,52 (2H, d, J 8,3Гц); 7,47 (1H, d, J 7,8Гц); 6,87-6,82 (2H, m); 6,28-6,24 (1H, m); 4,74-4,70 (2H, m); 3:00 (3H, s); 2,14 (3H, s). XIAT-MC m/z: 530,1 [MH +]. Загальним способом з прикладу 2 були отримані сполуки з прикладів 8-12: Приклад 8 5-Фуран-2-іл-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід 1 Н ЯМР (CDCІ3): δ 9,96 (1Н, t, J 5,8Гц); 8,85 (1Н, s); 7,89 (2Н, d5 J 8,7Гц); 7,84 (1Н, d, 7,7Гц); 7,77 (1Н, t, J 7,7Гц) 7,56 (1Н, s); 7,54 (2Н, d, J 8,0Гц); 7,48 (1Н, d, J 7,7Гц); 6,55-6,49 (2Н, т); 4,764,64 (2Н, m); 3,03 (3Н, s); 2,23 (3Н, s). Приклад 9 6-Метил-2-оксо-5-тіофен-3-іл-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід 1 Н ЯМР (CDCI5): δ 10,02 (1Н, t J 5,3Гц): 8,65 (1H, s); 7,88 (2Н, d, J 8,2Гц); 7,82 (1H, d, J 7,8Гц); 7,76 (1H, t, J 7,8Гц); 7,57 (1H, s); 7,53 (2Н, 4 J 8,2Гц); 7,49 (1Н, d, J 7,8Гц); 7,46-7,42 (1Н, m); 121125 (1Н, m); 7,10 (1Н, dd, J 5,0Гц та 1,2Гц); 4,754,62 (2Н, m); 3,02 (3Н, s); 2,07 (3Н, s). XIAT- MC m/z: 347 [MH +]. Приклад 10 6-Метил-2-оксо-5-тіофен-2-іл-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід 1 Н ЯМР (CDCI3): δ 9,95 (1Н, t, J 5,8Гц); 8,68 (1 N, s); 7,87 (2H, d, J 8,5Гц); 7,83 (1H, d, J 7,8Гц); 7,75 (1H, t, J 7,8Гц); 7,56 (1H, s); 7,51 (2H, d, J 85Гц); 7,48 (1H, d, J 85Гц); 7,42-739 (1H, m); 7,127,08 (1Н, m); 7,04-7,01 (1Н; m); 4,74-4,62 (2Н, m); 3,01 (3Н, s); 2,11 (3Н, s). XIAT-MC m/z:547 [ΜH4 ]. Приклад 11 5-(3,5-Диметил-ізоксазол-4-іл)-6метил:2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід 1 Н ЯМР (CDCI3): δ 9,93 (1Н, t, J 5,8Гц); 8,41 (1Н, s); 7,86 (2Н, d, J 8,7Гц); 7,82 (1Н, d, J 7,7Гц); 7,76 (1Н, t, J 7,7Гц); 7,54 (1Н, bs); 7,50 (2Н, d, J 8,7Гц); 7,49-7,44 (1Н, m); 4,73-4,60 (2Н, m); 3,01 (3Н, s); 234-2,28 (3Н, ds); 2,20-2,14 (3Н, ds); 1,90 (3Н, s). XIAT-MC m/z: 560,1 [МН+] Приклад 12 5-(2,4-Диметокси-піримідин-5-іл)-6метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4- метансульфонілбензиламід. 1 Н ЯМР (CDCI3): δ 9,98 (1Н, t, J 5,8Гц); 8,49 (1Н, s); 8,16 (1Н, s); 7,87 (2Н, d, J 8,8Гц); 7,83 (1Н, d, J 7,8Гц); 7,76 (1Н, t, J 7,7Гц); 7,58 (1Н, s); 7,52 35 84571 (2Н, d, J 8,2Гц); 7,49 (1Н, s); 4,76-4,60 (2Н, m); 4,07 (3Н, s); 4,02 (3Н, s); 3,02 (3Н, s); 1,91 (3Н, s). XIAT-MC :m/z: 603,1 [МН+]. Приклад 13 5-(2,4-Діоксо-1,2,3,4-тетрагідропіримідин-5-іл)-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідро-піридин-3карбонової кислоти 4-метансульфонілбензиламід Суміш 5-йод-6-метил-N-[4-(метилсульфоніл)бензил]-2-оксо-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксаміду (0,075г, 0,127ммоль), 2,4-ди-трет-бутилокси-піримідин-5боронової кислоти (0,044г, 0,152ммоль), Pd(PPh3)4 (0,010г, 8,69ммоль), ДМЕ (2мл) та натрій карбонату (2мл, 2М водний розчин) енергійно перемішували під азотом у герметичній посудині при 80°С протягом 2 годин. Тоді ще одну порцію 2,4-дитрет-бутилокси-піримідин-5-боронової кислоти (0,010г) та Pd(PPh3)4 (0,004г) додавали. Ще через годину суміші давали охолонути та тоді розподіляли між ЕtOAc та водою. Органічну фазу збирали та водну фазу екстрагували ще одною порцією ЕtOAc. Комбіновані органічні фази промивали водою та розсолом, та сушили натрій сульфатом. Фільтрування та випарювання, а потім очистка на силікагелі (гептан: ЕtOAc 2:1®1:1®1:2) дали 0,060г (69%) захищеного трет-бутилом інтермедіату як білий твердий продукт. До розчину твердого продукту у ТГФ (5мл), додавали одною порцією ТФОК (5мл) та суміш перемішували протягом 30 хвилин. Реакційну суміш концентрували та додавали до залишку ЕtOAc. Отриману суспензію перемішували протягом 10 хвилин та заголовну сполуку збирали фільтруванням. Вихід 0,045г (100%) як білуватий твердий продукт. 1 Н ЯМР(ДМСО-d6): δ 11,31 (1Н, s); 11,13 (1Н, d, J 6,0); 9,91 (1Н, t, J 6,2Гц); 8,24 (1Н, s); 7,90 (1Н, d, J 8,0Гц); 7,86 (2Н, d, J 8,4Гц); 7,81 (1H, d, J 7,8Гц); 7,70 (1H, d, J 7,6Гц); 7,65-7,59 (1H, m); 7,3 (2Н, d, J 8,4Гц); 7,52 (1Н, d, J 6,0Гц); 4,58 (2Н, d, J 6,2Гц); 3,17 (3Н, s); 1,91 (3Н, s). XIAT-MC m/z: 575,1 [МН+]. Приклад 14 6-Метил-5-(5-метил[1,3,4]оксадіазол-2-іл)-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідро-піридин-3карбонової кислоти 4-метансульфонілбензиламід a) Етил 2-метил-5-({[4-(метилсульфоніл)бензил]аміно}карбоніл)-6-оксо-1-(3трифлуорметилфеніл)-1,2-дигідро-піридин-3карбоксилат В автоклав з нержавіючої сталі (100мл) поміщали 5-йод-6-метил-N-[4-(метилсульфоніл)бензил]-2-оксо-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід (108,1мг, 0,28ммоль), паладій(ІІ)ацетат (3,8мг, 0,02ммоль), трифенілфо-сфін (10,3мг, 0,04ммоль), метиламін (2мл, 14,4ммоль) та етанол (6мл). Реакційну суміш перемішували магнітною мішалкою при 100°С під тиском карбон монооксиду 4 атмосфери протягом ночі. Після охолодження розчинник випарювали та залишок очищали препаративною ВЕРХ, отримуючи заголовну сполуку як білий твердий продукт (77,6мг, 79%). 1 Н ЯМР(СОСІ3): 59,73 (1Н, t, J 5,9Гц); 9,20 (1H, m); 7,90 (2H, d; J 8,3Гц);7,85 (1Н, d, J 7,9Гц); 7,78 (1H, t, J 7,8Гц); 7,53 (2H, d, J 83Гц); 7,50 (1H, s); 36 7,42 (1H, d, J8,0Гц); 4,69 (2H, t, J 5,9Гц); 438 (2H, q, J 7,2Гц); 3,03 (1H, s); 2,50 (3Н, s); 1,42 (3Н, t, J 7,2Гц). XIAT-MC m/z: 537 [MH+]. b) 5-(4-Метансульфоніл-бензилкарбамоїл)-2метил-6-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонова кислота До розчину етил 2-метил-5-({[4(метилсульфоніл)бензил]аміно}карбоніл)-6-оксо-1(3-трифлуорметилфеніл)-1,2-дигідро-піридин-3карбоксилату (0,70г, 1,30ммоль) у ТГФ (10мл) та воді (10мл) додавали NaOH (1M, 2мл, 2ммоль), та суміш перемішували протягом 1 години при кімнатній температурі, з моніторингом реакції за допомогою РХ-МС. Спостерігали 20% перетворення та додавали ще одну порцію NaOH (1M, 1мл, 1ммоль), та реакції давали йти протягом ще одної години. Цей процес повторювали до повного перетворення естеру (звичайно 3-4 години). Наслідком реакції є дві сполуки з однаковою масою, у пропорції 95:5. Головний продукт є підзаголовною сполукою, а інший є регіоізомером. Реакційну суміш випарювали для видалення ТГФ, та залишковий водний розчин підкислювали та тоді екстрагували в ЕtOAc. Органічну фазу збирали та сушили натрій сульфатом. Фільтрування та випарювання дали сирий продукт: 0,60г (90%) жовтуватого твердого продукту, котрий застосовували далі без очистки. Порцію продукту очи щали, застосовуючи препаративну ВЕРХ. 1 Н ЯМР (CDCI3): δ 9,90 (1Н, t, J 62Гц); 9,31 (1Н, s); 7,89 (2HS d, J 8,2Гц); 7,84 (1H, d, J 8,0Гц); 7,77 (1H, t, J 8,0Гц); 7,51 (21% d, J 8,5Гц); 4,49 (1H, s); 7,41 (1H, d, J 8,0Гц); 4,92 (1H, bs); 4,78-4,63 (2H, m); 3,01 (3H, s); 2,53 (3H, s). XIAT-MC m/z: 509,2 [MH+]. c) 5-(N'-Ацетил-гідразинокарбоніл)-6-метил-2оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонова кислота Розчин 5-(4-Метансульфоніл-бензилкарбамоїл)-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти (0,071г, 0,14ммоль) у ДХМ (5мл), що містить SOCI2 (5мл), перемішували у герметичній колбі протягом 2 годин та тоді концентрували. Отриманий твердий продукт у 1,4діоксані (5мл, що сушили молекулярними ситами) та ацетил гідразид (0,1г, 1,35ммоль) перемішували протягом 10 хвилин та концентрували. Залишок очищали препаративною ВЕРХ, отримуючи 0,041г (52%) заголовної сполуки як білий твердий продукт. 1 Н ЯМР (ДМСО-d6): δ 10,26 (1Н, s); 9,95 (1Н, s); 9,79 (1Н, t, J 6,0Гц); 8,50 (1Н, s); 7,93(1H, s); 7,937,90 (1H, m); 7,87 (2H, d, J 8,4Гц); 7,82 (1H, d, J 7,7Гц); 7,74 (1H, d, J 80,Гц); 7,55 (2H; d, J 8,3Гц); 4,59 (2H, d, J 6,2Гц); 3,17 (3H, s); 2,18 (3H, s); 1,91, (3H, s). XIAT-MC m/z: 565,2 [MH +]. d) 6-Метил-5-[5-метил-[1,3,4]оксадіазол-2-іл)-2оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід 5-(N'-Ацетил-гідразинокарбоніл)-6-метил-2оксо-1-(3-трифлуорметилфеніл)-1,2 37 84571 дигідропіридин-3-карбонової кислоти 4метанансульфонілбензиламід (0,03г, 0,053ммоль) та TMS-поліфосфат як розчин у ДХМ (отримано як описано у [Synthesis 1982, стосовно 591-592]) (3мл) перемішували у герметичній посудині при 70°С протягом 3 годин. Охолоджений розчин розбавляли ДХМ та промивали водою. Органічну фазу збирали та водну фазу екстрагували ще одною порцією ДХМ. Комбіновану органічну фазу промивали розсолом, сушили натрій сульфатом, фільтрували, та концентрували. Твердий матеріал очищали препаративною ВЕРХ, отримуючи заголовну сполуку як білий твердий продукт (0,019г, 66%). 1 Н ЯМР (ДМСО-d6): δ 9,74 (1Н, t, J 6,2Гц); 8,78 (1Н, s); 8,01 (1Н, s); 7,94 (1Н, d, J 7,8Гц); 7,87 (2Н, d; J 8,1Гц); 7,82 (1Н, t, J 7,7Гц); 7,55 (2Н, d, J 8,3Гц); 4,61 (2Н, d, J 6,2Гц); 3,13 (3Н, s); 2,59 (3Н, s); 243 (3Н, s). XIAT-MC m/z: 547,2 [МН+]. Загальним способом з прикладу 14 були отримані сполуки з прикладів 15-19: Приклад 15 6-Метил-2-оксо-5-{5-пропіл[1,3,4]оксадіазол-2-іл]-1-(3-трифлуорметилфеніл)1,2-дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід 1 Н ЯМР (ДМСО-d6): δ 9,75 (1Н, t, J 6,33Гц); 8,78 (1Н, s); 8,00 (1Н, s); 7,94 (1Н, d, J 8,1Гц); 7,87 (2Н, d, J 8,2Гц); 7,86-7,83 (1Н, m); 7,82 (1Н; t, J 8,4Гц); 7,55 (2Н, d, J 8,4); 4,60 (2Н, d, J 6,1Гц); 3,17 (3Н, s); 2,92 (2Н, t, J 7,3Гц), 2,41 (3Н, s), 1,78 (2Н, секстет, J 7,3Гц); 0,99 (3Н, t, J 7,3Гц). XIAT-MC m/z 575,2 [MH 4 ] Приклад 16 {5-[5-(4-Метансульфонілбензилкарбамоїл)-2-метил-6-оксо-1-(3трифлуорметилфеніл)-1,2-дигідро-піридин-3-іл][1,3,4]оксадіазол-1-іл)-оцтової кислоти етиловий естер 1 Н ЯМР (ДМСО-d6): δ 9,73 (1Н, t, J 6,0Гц); 8,77 (1Н, s); 8,01 (1Н, s); 7,94 (1H, d, J 7,8Гц); 7,87 (2H, d, J 8,1Гц); 7,86-7,80 (2H, m); 7,55 (2H, d, J 8,1); 4,61 (2H, d, J 63Гц); 4,30 (2H, s); 4,17(2H, q, J 7,2Гц); 3,17 (3Н, s); 2,44 (3Н, s); 1,22 (3Н, t, J 7,2Гц). XIAT-MC m/z: 619,2 [MH 4], Приклад 17 5-(5-ціанометил-[1,3,4]оксадіазол2-іл]-2-метил-6-оксо-1-{3-трифлуорметилфеніл]1,2-дипдропіридин-3-карбонової кислоти 4метансульфонілбензиламід 1 Н ЯМР (ДМСО-d6): δ 9,73 (1Н, t, J 6,2Гц); 8,76 (1Н, s); 8,02 (1Н, s); 7,94 (1Н, d, J 7,6Гц); 7,87 (2H, d, J 8,1Гц); 7,86-7,80 (2H, m); 7,55 (2Н, d, J 8,3Гц); 4,70 (2H, s): 4,61 (2Н, d, J 6,1Гц); 3,17 (3H,s); 2,42 (3Н, s). XIAT-MC m/z: 572,2 [MH +]. Приклад 18 5-(5-Аміно-[1,3,4]тіадіазол-2-іл)-6метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідро-піридин-3-карбонової кислоти 4метансульфонілбензиламід 1 Н ЯМР (ДМСО-d6): δ 9,81 (1Н, L J 6,1Гц): 8,71 (1Н, s); 8,00 (1Н, s); 7,94 (1Н, d, J 3,0Гц) 7,88 (2Н, d, J 6,0Гц); 7,86-7,82 (1Н, m), 7,80 (1Н, J, 8,3Гц), 7,56 (2Н, m, J 8,2Гц); 7,29 (2Н, s); 4,62 (2Н, 6,09Гц); 3,18 (3Н, s); 2,40 (3Н, s). XIAT-MC m/z: 548,2 [МН+]. 38 Приклад 19 5-(5-Аміно-[1,3,4]тіадіазол-2-іл)-6метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідро-піридин-3-карбонової кислоти 4метансульфонілбензиламід 1 Н ЯМР (ДМСО-d6): δ 9,83 (1Н, t, J 6,2Гц); 8,46 (1Н, s): 7,99 (1Н, s); 7,92 (1Н, d, J 7,4Гц); 7,87 (2Н, d, J 8,2); 7,83 (1Н, d, J 7,6Гц); 7,79 (1H, d, J 8,0Гц); 7,55 (2H, d, J 8,3Гц); 7,42 (2H, s); 4,60 (2Н, d, J 6,1Гц); 3,17 (3Н, s); 2,21 (3Н, s). XIAT-MC m/z: 564,1 [MH +]. Приклад 20 5-(5-Етиламіно-[1,3,4]оксадіазол-2іл)-6-метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід a) 5-Гідразинокарбоніл-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід Заголовну сполуку було отримано як описано у прикладах 14 (с) та 38 (а). XIAT-MC m/z: 523,2 [МН+]. Час утримання 1,72 хвилин. b) 5-({2-[(Етиламіно)карбоніл]гідразино)карбоніл)-6-метил-N-[4-метилсульфоніл) бензил]-2оксо-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід До 5-гідразинокарбоніл)-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламіду (0,030г, 0,057ммоль) у 1,4-діоксані (10мл) додавали етилізоціанат (0,016г, 0,23ммоль) та суміш перемішували при кімнатній температурі протягом 1 години. Суміш випарювали та залишок очищали препаративною ВЕРХ, отримуючи 0,015г (44%) заголовної сполуки. 1 Н ЯМР (CDCI3): δ 9,96-9,87 (1H, m); 8,82 (1H, s); 7,88 (1H, d, J 8,2Гц); 7,84 (2Н, d, J 7,8Гц); 7,837,80 (1Н, m); 7,77 (1Н, t, J 7,9Гц); 7,52 (1Н, s); 7,47 (2Н, d, J 8,2Гц); 7,47-7,41 (1Н, m); 4,70-4,55 (2Н, m); 3,23 (2Н, q, J 6,8Гц); 3,01 (3Н, s); 2,31 (3Н, s); 1,11 (3H, t, J 7,1Гц). XIAT- MC m/z:594,2 [MH +]. с) 5-(5-Етиламіно-[1,3,4]оксадіазол-2-іл-6метил-2-оксо-1-(3-трифлуорметил феніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід Заголовну сполуку було отримано з 5-({2[(етиламіно)карбоніл]гідразино}карбоніл]-6-метилN-[4-(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду, застосовуючи спосіб, аналогічний описаному у прикладі 14 (d). 1 Н ЯМР (ДМСО-d6): δ 9,78 (1Н, t, J 6,0Гц); 8,69 (1Н, а); 7,99 (1Н, s); 7,93 (1Н, d О 7,5Гц); 7,87 (2Н, d, J 8,5Гц); 7,84 (1Н, d, J 8,0Гц); 7,81-7,75 (2Н, m); 7,55 (2Н, d, J 8,1Гц); 4,60 (2H, d, J 6,4Гц); 3,26 (2H, p, J 6,6Гц); 3,17 (3H, s); 2,3,8 (3Н, s); 1,18 (3Н, t, J 7,1Гц). XIAT-MC m/z: 5763 [MH +]. Приклад 21 5-(5-N,N-Диметиламіно[1,3,4]оксадіазол-2-іл)-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідро-піридин-3карбонової кислоти 4-метансульфонілбензиламід a) 5-({2-[(N,N-Диметиламіно)карбоніл]гідро(метилсульфоніл]бензил]-2-оксо-1-[3 39 84571 (трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід До 5-гідразинокарбоніл-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламіду (0,030г, 0,057ммоль) у ТГФ (10мл) додавали Ν,Νдиметилкарбамоїлхлорид (0,0247г, 0,23ммоль) та суміш перемішували при 50°С протягом 3 годин. Суміш випарювали та залишок очищали препаративною ВЕРХ, отримуючи 0,020г (60%) заголовної сполуки. 1 Н ЯМР (ДМСО-d6): δ 9,92 (1Н, bs); 9,80 (1Н, t, 6,2Гц); 8,50 (1Н, s); 8,48 (1Н, s); 7,94-7,89 (2Н, m); 7,87 (2Н, d, J 8,5Гц); 7,82 (1Н, d, J 8,2Гц); 7,73 (1Н, d, J 7,8Гц); 7,55 (2Н, d, J 8,5Гц); 4,59 (2Н, d, J 6,0Гц); 3,27 (3Н, s); 2,8 (6Н, s); 2,19 (3Н, s). XIAT-MC m/z: 594,1 [MH +]. b) 5-(5-N,N-Диметиламіно-[1,3,4]оксадіазол-2іл)-6-метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідро-піридин-3-карбонової кислоти 4метансульфонілбензиламід Заголовну сполуку було отримано з 5-({2[(N,N-диметиламіно)карбоніл]гідразино}карбоніл)6-метил-N-[4-(метилсульфоніл)бензил]-2-оксо-4-[3трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду, застосовуючи загальний спосіб, описаний у прикладі 14 (d). 1 Н ЯМР (ДМСО-d6): δ 9,79 (1Н, t, J 6,2Гц); 8,69 (1Н, s); 8,00 (1Н, s); 7,93( 1Н, d, J 7,9Гц);7,87 (2Н, d, J 8,4Гц);7,85 (1Н, t, J 7,7Гц); 7,80 (1Н, d, J 7,7Гц); 7,55 (2Н, d, J 8,4Гц); 4,39 (2Н, d, J ,6,2Гц); 3,17 (3Н, s); 3,06 (6Н, s); 2,36 (3Н, s). XIAT-MC m/z: 576,3 [MH +]. Приклад 22 6-Метил-N-[4(метилсульфоніл)бензил]-2-оксо-5-(піразин-2-іл)-1[3-(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід Трис(дибензиліденацетон)дипаладій(0) (1мг) додавали до 5-йод-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду (Приклад 1 (d), 20мг, 0,034ммоль), 2(трибутилстаніл)піразину (25мг, 0,068ммоль) та трифенілфосфін (1,6мг, 0,006ммоль) у толуолі (1,5мл) під аргоном та суміш перемішували у герметичній посудині при 100°С протягом ночі. Після охолодження суміш фільтрували через броунмілерит та випарювали. Залишок розчиняли у толуолі та додавали етер. Осад відфільтровували та сушили у вакуумі (5мг, 27%). 1 Н ЯМР (CDCI3): δ 9,93-9,85 (1Н, m); 8,32-8,77 (2Н, m); 8,68-8,64 (1Н, m); 8,60 (1Н, d, J 14,0Гц); 7,91-7,73 (4Н, m); 7,59-7,46 (4Н, m); 4,76-4,62 (2Н, m); 3,01 (3Н, s); 2,18 (3H, s). XIAT-MC m/2 543,3 [MH +]. Приклад 23 6-Метил-5-оксазол-2-іл)-2-оксо-1(3-трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід 5-Йод-6-метил-N-[4-метилсульфоніл)бензил]2-оксо-1-(3-трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід (0,10г, 0,169ммоль), 2-трибутилстаніл-оксазол (0,12г, 0,33ммоль, що отримували способами з літератури), Pd(PPh3)4 (0,015г, 0,012ммоль) та диметоксіетан (ДМЕ, 2,5мл) та пруток магнітної мішалки поміщали у 40 склянку. Суспензію дегазували та посудину герметизували і далі гріли (100°С) з перемішуванням протягом 4 годин. РХ-МС підтвердила перетворення йодиду у потрібний продукт, та розчинники видаляли у вакуумі. Очистка препаративною ВЕРХ дала заголовну сполуку (0,06г, 67%) як білий твердий продукт після сублімаційної сушки чистих фракцій. 1 Н ЯМР (ДМСО-d6): δ 9,79 (1Н, t, J 6,2Гц); 8,91 (1Н, s); 8,28 (1Н, s); 7,99 91 (1Н, s); 7,93 (1Н, d, J 7,9Гц); 7,87 (2Н, d, J 8,2Гц); 7,85 (1Н, t, J7,9Гц); 7,80 (1Н, d, J 7,8Гц), 7,55 (2Н, d, J 8,2Гц); 7,42 (1Н, s); 4,67-4,55 (2Н, m); 3,17 (3Н, s); 2,46 (1Н, s). XIAT-MC rn/z: 532,2 [MH +]. Приклад 25 6-Метил-5-(1-метил-1Н-імідазол-2іл)-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід 5-Йод-6-метил-N-[4-(метилсульфоніл)бензил]2-оксо-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід (0,06г, 0,1ммоль), 1метил-2-трибутилстаніл-1Н-імідазол (0,11г, 0,5ммоль, що отримували способами з літератури), Pd(PPh3)4 (0,015г, 0,012ммоль), ДМЕ (2мл) та пруток магнітної мішалки поміщали у склянку. Суспензію дегазували та посудину герметизували та далі гріли (100°С) з перемішуванням протягом ночі. РХ-МС підтвердила перетворення йодиду у потрібний продукт, та розчинники видаляли у вакуумі. Очистка препаративною ВЕРХ, дала заголовну сполуку (0,005г, 10%) як білий твердий продукт після сублімаційної сушки чисти х фракцій. 1 Н ЯМР (ДМСО-d6): δ 9,88 (1Н, t, J 6,2Гц); 8,30 (1Н, s); 8,03 (1Н, s); 7,94-7,89 (1H, m); 7,87 (2H, d, J 8,5Гц); 7,85-7,81 (2H, m); 7,55 (2H, d, J 8,5Гц); 7,31 (1H, s); 7,06 (1H, s); 4,66-4,55 (2H, m); 3,58 (3H, s); 3,17 (3H, s); 1,85 (3H, s). XIAT-MC m/z: 545,2 [MH +]. Приклад 26 6-Метил-2-оксо-5-(1Н-піразол-4іл)-1-(3-трифлуорметилфеніл)-1,2-дигідропіридин3-карбонової кислоти 4метансульфонілбензиламід 5-Йод-6-метил-N-[4-(метилсульфоніл)бензил]2-оксо-1-[3-(трифлуорметил)феніл}-1,2дигідропіридин-3-карбоксамід (0,080г, 0,135ммоль), 4-трибутилстаніл-1-тритил-1Нпіразол (0,08г, 0,13ммоль), що отримували способами з літератури), Pd(PPh3)4 (0,020г, 0,017ммоль), ДМЕ (3мл) та пруток магнітної мішалки поміщали у склянку. Реактор дегазували, посудину герметизували та реакцію гріли (95°С) з перемішуванням протягом ночі. РХ-МС показала, що майже увесь вихідний йодид витрачено, отримуючи головний продукт; Сиру суміш випарювали та залишкове масло очищали на силікагелі (гептан: ЕtOAc 1:2), отримуючи 0,060г захищеного тритилом інтермедіату. Інтермедіат розчиняли у ДХМ (3мл) та додавали ТФОК (3мл). Суміш гріли (50°С) з перемішуванням протягом 30 хвилин. Реакцію гасили додаванням метанолу (5мл). Очистка препаративною ВЕРХ дала заголовну сполуку (0,016г, 22%) як білий твердий продукт після сублімаційної сушки чистих фракцій. N ЯМР (ДМСО-d6): δ 9,98 (1Н; t, J 6,2Гц); 8,38 (1Н, s); 7,94 (1Н, s); 7,91 (1Н, d, J 8,1Гц); 7,87 (2Н, 41 84571 d, 18,3Гц); 7,84-7,30 (2Н, m); 7,75 (1Н, d, J 7,9Гц); 7,55 (2Н, d, J 8,4Гц); 5,76 (1Н, s); 4,64-4,55 (2Н, m); 3,17 (3Н, s); 2,06 (3Н, s). XIAT-MC m/z: 531,1 [МН+]. Приклад 27 6-Метил-N-[4(метилсульфоніл)бензил]-2-оксо-5-піримідин-2-іл1-[3-(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід Трис(дибензиліденацетон)-дипаладій(0) (1мг) додавали до 5-йод-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду (20мг, 0,034ммоль), 2-(трибутилстаніл)піримідину (25мг, 0,068ммоль) та трифенілфосфін у (1,9мг, 0,007ммоль) у толуолі (1,6мл) під аргоном та суміш перемішували при 100°С протягом ночі. Після охолодження суміш фільтрували через броунмілерит та випарювали. Залишок очищали препаративною ВЕРХ. Чисті фракції сублімаційно сушили, отримуючи заголовну сполуку (5мг, 27%). 1 H ЯМР (CDCI3): δ 9,91-9,85 (1Н, m); 9,28 (1Н, m); 8,84 (2H, d, J 5,2Гц); 7,90-7,73 (4H, m); 7,577,45 (4H, m); 7,29-7,25 (1H, m); 4,76-4,62 (2H, m); 3,01 (3H, s); 2,40 (3H, s). XIAT-MC rn/z: 543,1 [MH +]. Приклад 28 6-Метил-5-(2-метил-2Н-піразол-3іл)-2-оксо-1-[3-(трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфоніл-бензиламід 5-Йод-6-метил-N-[4-(метилсульфоніл)бензил]2-оксо-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід (0,06г, 0,1ммоль), 1метил-5-триметилстаніл-1Н-піразол (0,07г, 0,3ммоль, що отримували способами з літератури), Pd(PPh3)4 (0,015г, 0,012ммоль), ДМЕ (2мл) та пруток магнітної мішалки поміщали у склянку. Суспензію дегазували та посудину герметизували, та далі гріли (100°С) з перемішуванням протягом ночі. РХ-МС підтвердила перетворення йодиду у потрібний продукт та розчинники видаляли у вакуумі. Очистка на силікагелі (гептан: ЕtOAc 1:2®1:3), дала заголовну сполуку (0,040г, 75%) як білий твердий продукт, котрий далі сублімаційно сушили. 1 Н ЯМР (ДМСО-d6): δ 9,89 (1Н, t, J 6,2Гц); 8,21 (1Н, s); 7,92 (1Н, d, J 7,31Гц), 7,87 (2Н, d, J 8,3Гц); 7,85-7,80 (2Н, m); 7,54 (2Н, d, J 8,3Гц); 7,53 (1Н, d. J 7,8Гц); 6,33 (1Н, d, J 7,8Гц); 4,66-4,55 (2Н, m); 3,72 (3Н, s); 3,17 (3Н, s); 1,82 (3Н, s). XIAT-MC m/z: 545,2 [MH +]. Приклад 29 6-Метил-5-(3-метил-1Н-оксазол-4іл)-N-[4-(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід 5-Йод-6-метил-N-[4-{[метилсульфоніл)бензил]2-оксо-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід (25мг, 0,042ммоль), тетракіс(трифенілфосфін)паладій (2,5мг, 0,0022ммоль) та 3-метил-4(трибутилстаніл)ізоксазол синтезовано, як [описано D. Uchiyama у Heterocycles, 43, 6,1301,1996] (32мг, 0,086ммоль) перемішували у ДМЕ (0,45мл) у заповненій аргоном посудині. Посудину закривали та гріли з перемішуванням при 100°С протягом 24 годин. Реакційну суміш виливали у суміш ети 42 лацетату та води. Суміш струшували, водн у фазу видаляли та органічну фазу сушили натрій сульфатом. Продукт очищали препаративною ВЕРХ. Вихід: 12мг, 0,022ммоль (52%). 1 Н ЯМР (ДМСО-d6): δ 9,91 (1Н, t, J 6,0Гц,): 8,24 (1Н, s); 8,96 (1Н, s); 7,98-7,77 (6Н, m); 7,54 (2Н, 4 J 8,4Гц); 4,59 (2Н, d, J 6,2Гц); 3,17 (3Н, s); 2,21 (3Н, s); 1,88 (3Н, s). 44 XIAT-MC m/z: 546,5 [MH +]. Приклад 30 6-Метил-5-(3-метил[1,3,4]оксадіазол-5-іл)-2-оксо-1-(3трифлуорметил)феніл]-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід 5-йод-6-метил-N-[4-(метилсульфоніл)бензил]2-оксо-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід (0,236г, 0,4ммоль), ацетамід оксим (0,088г, 1,2ммоль), Pd(PPh3)2CI2 (0,014г, 0,020ммоль), триетиламін (0,081г, 0,8ммоль), толуол (15мл) та пруток магнітної мішалки завантажували у сталевий реактор для підвищеного тиску. Реактор дегазували СО, а коли все повітря видалили, створили 4 атмосфери тиску СО та реактор гріли до 95°С. Реакції давали йти протягом ночі. РХ-МС показала, що майже увесь вихідний йодид витрачено, отримуючи головний продукт. Сиру суміш випарювали та залишкове масло розподіляли між ЕtOAc та водою. Органічну фазу збирали та сушили і випарювали. Очистка на силікагелі (гептан чи ЕtOAc 1:2) дала чистий матеріал (0,083г, 38%) як білий твердий продукт. 1 H ЯМР (ДМСО-d6): δ 9,68 (1Н, t, J 6,2Гц); 8,91 (1Н, s); 8,01 (1Н, s); 7,95 (1Н, d, J 8,1Гц); 7,87 (2Н, d, J 8,02Гц); 7,86 (1Н, t, J 7,16Гц); 7,81 (1Н, d, J 7,86Гц); 7,55 (2Н, d, J 8,3Гц); 4,67-4,55 (2Н, m); 3,17 (3Н, s); 2,47 (3Н, s); 2,41 (3Н, s). XIAT-MC m/z: 547,0 [MH +]. Приклад 31 6-Метил-5-[3-метилізоксазол-5-іл)N-[4-(метилсульфоніл)бензил]-2-оксо-1-(3трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід Заголовну сполуку було синтезовано способом з прикладу 29 але починаючи з 5-йод-6-метилN-[4-(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду (50мг, 0,085ммоль), тетракіс(трифенілфосфін}паладію (5мг, 0,0043ммоль) та 3-метил-5-(трибутилстаніл)ізоксазолу синтезовано, як [описано у Tetrahedron, 47, 28, 5111,1991] (63мг, 0,169ммоль) у ДМЕ (0,85мл). Вихід: 15мг, 0,033ммоль (39%). 1 Н ЯМР (ДМСО-d6): δ 9,79 (1Н, t, J=6,0Гц); 8,57 (1Н, s); 7,99 (1Н, s); 7,94-7,79 (5Н, m); 7,55 (2Н, d, J=8,4Гц); 6,67 (1Н, s); 4,60 (2Н, d, J=6,2Гц); 3,17 (3R s); 2,30 (3Н, s): 2,17 (3Н, s). XIAT-MC m/z: 546,4 [MH +]. Сполуки з прикладів 32 до 37 були отримані, застосовуючи способи, аналогічні описаним у прикладах 1 (а) - 1 (d) та 2. Приклад 32 5-(3,5-Диметилізоксазол-4-іл)-N-[4(ізопропілсульфоніл)бензил]-6-метил-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід 1 Н ЯМР (CDCI3): δ 10,12 (1Н, bt,); 8,44 (1H, s); 7,86-7,67 (4H, m); 7,56 (1H, bs); 7,51-7,47 (3H, m); 4,76-4,66 (2H, m); 3,21-3,11 (1H, m,); 2,34 (3H, d, J 43 84571 6,8Гц); 2,20 (3H, d, J 6,8Гц);1,93 (3H, s); 1,27(6H, d, J 7,0Гц). XIAT-MC m/z: 588; [MH +] Приклад 33 5-(3,5-диметилізоксазол-4-іл)-N-[4(етилсульфоніл)бензил]-6-метил-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід 1 Н ЯМР (CDCI3): δ 10,15 (1Н, bt); 8,43 (1Н, s); 7,86-7,83 (3Н, m); 7,78 (1Н, bt,); 7,57 (1Н, bs,); 7,537,47 (3Н, m); 4,73-4,69 (2Н, m); 3,09 (2Н, q, J 7,4Гц); 2,34 (3Н, d, J 6,9Гц); 2,20 (3Н, d, J 6,9Гц); 1,94 (3Н, s); 1,26 (3Н, t, J 7,4Гц). XIAT-MC m/z: 574 [MH +]. Приклад 34 N-[4(Циклопропілсульфоніл)бензил]-5-(3,5диметилізоксазол-4-іл)-6-метил-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід 1 Н ЯМР (CDCI3): δ 10,06 (1Н, bt,); 3,43 (1Н, s); 7,88-7,76 (4Н, s); 7,56 (1Н, bs,) 7,51-7,47 (3Н, m); 4,74-4,63 (2Н, m);); 2,45-2,38 (1Н, m); 2,33 (3Н, d, J 6,7-Гц); 2,19 (3Н, d, J 6,7Гц); 1,92 (3Н, s): 1,35-1,30 (2Н, m); 1,07-0,99 (2Н, m). XIAT-MC m/z: 586 [ΜN 4]. Приклад 35 1-(3-ціанофеніл)-5-(3,5диметилізоксазол-4-іл)-6-метил-N-[4(метилсульфонілбензил)-2-оксо-1,2дигідропіридин-3-карбоксамід 1 Н ЯМР (CDCI3): δ 9,88 (1Н, bt,); 8,44 (1Н, s); 7,90-7,86 (3Н, m); 7,77 (1Н, bt,); 7,62-7,51 (4Н, m); 4,74-4,63 (2Н, m); 3,02 (3Н, s); 2,33 (3Н, d, J 5,7Гц); 2,19 (3Н, d, J 5,5Гц); 1,93 (3Н, s). XIAT-MC m/z: 517 [МН+]. Приклад 36 1-(3-Хлорфеніл)-5-(3,5-диметилізоксазол-4-іл)-6-метил-2-оксо-1,2-дигідропіридин3-карбонової кислоти 4метансульфонілбензиламід 1 Н ЯМР (CDCI3): δ 9,98 (1Н, bt,); 8,42 (1Н, s); 7,88 (2Н, d, J 8,4Гц); 1,51-1,52 (4Н, m); 7,30-7,29 (1Н, m); 7,19-7,17 (1Н, m); 4,68 (2Н, d, J 5,6Гц); 3,02 (3Н, s); 2,32 (3Н, d, J 4,0Гц); 2,18 (3H, d, J 4,2Гц); 1,95 (3Н, s). XIAT-MC m/z: 526 [МН+]. Приклад 37 5-(3,5-Диметил-ізоксазол-4-іл)-6метил-2-оксо-1-м-толіл-1,2-дигідропіридин-3карбонової кислоти 4-метансульфоніл-бензиламід 1 Н ЯМР (CDCI3): δ 10,11 (1Н, bt,); 8,40 (1Н, s);7,87 (2Н, d, J 8,4Гц); 7,54-7,47 (3Н, m); 7,35 (1Н, d, J 7,7Гц); 7,06-7,03 (2H, m); 4,67 (2Н, d, J 5,9Гц); 3,02 (3Н, s); 2,46 (3Н, s); 2,32 (3Н, d, J 2,5Гц); 2,18 (3Н, d, J 3,0Гц); 1,93 (3Н, s). XIAT-MC m/z: 506 [MH +]. Приклад 38 5-(5-ізопропіл-[1,3,4]оксадіазол-2іл)-6-метил-2-оксо-1-[3-трифлуорметилфеніл]-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід а) 5-Гідразинокарбоніл-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідро-піридин-3карбонової кислоти 4-метансульфонілбензиламід Сполуку, отриману у прикладі 14 (b), (0,051г, 0,14ммоль) у ДХМ (5мл) обробляли SOCI2 (5мл), та колбу герметизували і перемішували магнітною мішалкою протягом 2 годин, коли РХ-МС показала, що реакція завершилася. Сиру суміш випарювали у вакуумі, отримуючи інтермедіатний хлорангідрид 44 як жовтий твердий продукт. Твердий продукт розчиняли у 1,4-діоксані (5мл, сушили молекулярними ситами) та додавали гідразин гідрат (0,05г, 1,0ммоль). Суміш перемішували протягом 10 хвилин та РХ-МС показала повне утворення заголовної сполуки. Суміш концентрували у вакуумі та залишок очищали препаративною ВЕРХ, отримуючи заголовну сполуку (0,036г, 70%) як білий твердий продукт після сублімаційної сушки чистих фракцій. XIAT-MC m/z: 523,2 [МН+]. 5-(N1-ізобутирил-гідразинокарбоніл-6-метил-2оксо-1-(3-трифлуорметилфеніл)-1,2-дигідропіридин-3-карбонової кислоти 4-метансульфонілбензиламід Сполуку, отриману на етапі (а) (0,025г, 0,047ммоль) у сухому ТГФ (10мл) перемішували та додавали ізомасляний ангідрид (0,040г, 0,25ммоль). Отриману суміш перемішували протягом 15 хвилин, та РХ-МС показала повне перетворення вихідного матеріалу у потрібний амід. Розчинник випарювали та залишок очищали препаративною ВЕРХ, отримуючи підзаголовну сполуку (0,024г, 85%) як білий порошок після сублімаційної сушки чистих фракцій.. 1 Н ЯМР (flMCO-d6): δ 10,25 (1Н, bs); 9,89 (1Н, bs); 9,79 (1Н, t, J 6,2Гц); 8,50(1 N, s); 7,93 (1H, a); 7,94-7,90 (1H, m); 7,87 (2H, d, J 85Гц); 7,84 (1H, t, J 7,7Гц); 7,74 (1H, d, J 7,7Гц); 7,55 (2H, d, J 8,3Гц); 4,63-4,56 (2H, m); 3,18 (ЗН, s); 2,55-2,49 (1H, ρ, J 6,8Гц);2,13 (3Н, s);1,08.(6H, d, J 6,8Гц). XIAT-MC m/z: 593,2 [MH +]. с) 5-(5-Ізопропіл-[1,3,4]оксадіазол-2-іл)-6метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідро-піридин-3-карбонової кислоти 4метансульфонілбензиламід Сполуку, отриману на етапі (b) (0,02г, 0,034ммоль) у ТМС-поліфосфаті (3мл, PPSE у ДХМ, Synthesis 1982, ст. 591-592) перемішували у герметичній посудині та гріли при 70°С протягом 3 годин. РХ-МС показала повне перетворення лінійного вихідного матеріалу у сполуку з очікуваною молекулярною масою. Охолоджений розчин розбавляли ДХМ (10мл) та промивали водою (10мл). Органічну фазу збирали та водну фазу екстрагували ще одною порцією ДХМ (10мл). Комбіновану органічну фазу промивали розсолом та тоді сушили натрій сульфатом. Фільтрування та випарювання розчину дали білий твердий продукт. Очистка цього матеріалу препаративною ВЕРХ дала чисті фракції, котрі сублімаційно сушили. Заголовну сполуку отримували як білий твердий продукт (0,015г, 77%). 1 Н ЯМР (ДМСО-d6): δ 9,76 (1Н, t, J=6,29Гц); 8,77 (1Н, s); 8,01 (1Н, s): 7,94 (1Н, d, J 7,6Гц); 7,87 (2H, d, J 8,6Гц); 7,84-7,78 (2H, m); 7,55 (2Н, d, J 8,4Гц); 4,65-4,56 (2H, m); 3,30 (1Н, ρ, J 6,3Гц); 3,18 (3H, s); 2,41 (3Н, s); 1,36 (6Н, d, J 7,0Гц). XIAT-MC m/z: 575,2 [MH +]. Приклад 39 6-Метил-5-[1,3,4]оксадіазол-2-іл)2-оксо-1-(3-трифлуорметилфеніл-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід a) 5-[N1-(Форміл-гідразинокарбоніл]-6-метил-2оксо-1-(3-трифлуорметилфеніл)-1,2 45 84571 дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід Сполуку, отриману у прикладі 38 (а) (0:025г, 0,048ммоль) у сухому ТГФ (10мл) перемішували та додавали змішаний формілацетил-ангідрид (0,06г, 0,68ммоль; що отримували способами з літератури). Суміш перемішували протягом 20 хвилин та РХ-МС показала повне перетворення вихідного матеріалу. Випарювання та очистка препаративною ВЕРХ, та далі сублімаційна сушка, дали підзаголовну сполук у (0,022г, 83%) як білий порошок. 1 Н ЯМР (ДМСО-d6): δ 10,43 (1Н, s); 10,13 (1Н, s); 9,79 (1Н, t, J 6,2Гц); 8,52 (1Н, s); 8,11 (1Н, s); 7,93 (1Н, s); 7,94-7,89 (1Н, s); 7,87 (2Н, d, J 8,65Гц); 7,87 (1Н, d, J 8,21); 7,74 (1H, d, J 8,21Гц); 7,55 (2H, d, J 8,21Гц); 4,63-4,54 (2H, m); 3,17 (3Н, s); 2,18 (3Н, s). XIAT-MC m/z: 551,2 [MH+]. b) 6-Метил-5-[1,3,4]оксадіазол-2-іл)-2-оксо-1(3-трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід Заголовну сполуку було отримано способами, описаними у прикладі 33 (с), починаючи з 0,020г (0,036ммоль) сполуки, отриманої на етапі (а). Заголовну сполуку отримували як білий твердий продукт (0,010г, 52%) після очистки препаративною ВЕРХ та сублімаційної сушки чистих фракцій. 1 Н ЯМР (ДМСО-d6): δ 9,74 (1Н, t, J 63Гц); 9,38 (1Н, s); 8,32 (1Н, s); 8,01 (1Н, s); 7,94 (1Н, d, J 7,7Гц); 7,87 (2Н, d, J 8,0Гц); 7,87-7,84 (1Н, m); 7,81 (1Н, d, J 7,3Гц); 7,55 (2Н, d, J 8,0Гц); 4,65-4,55 (2Н, m); 3,17 (3Н, s); 2,45 (3Н, s). XIAT-MC m/z: 533,2 [MH +]. Приклад 40 5-(5-Гідрокси-[1,3,4]оксадіазол-2іл)-6-метил-2-оксо-1-(3трифлуорметилфенілфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфоніл-бензиламід a) N1-[5-(4-Метансульфоніл-бензилкарбамоїл)2-метил-6-оксо-1-{3-трифлуорметилфеніл)-1,6дигідропіридин-3-карбоніл]-гідразинокарбонової кислоти етиловий естер Сполуку, отриману у прикладі 38 (а) (0,025г, 0,048ммоль) у сухому ТГФ (2мл) перемішували та додавали діетил пірокарбонат (0,023г, 0,14ммоль). Посудину герметизували та перемішували при 40°С протягом 3 годин, з моніторингом реакції за допомогою РХ-МС. С уміш випарювали та тоді очищали препаративною ВЕРХ, отримуючи підзаголовну сполуку, (0,023г, 80%) як білий твердий продукт після сублімаційної сушки чисти х фракцій. 1 Н ЯМР (ДМСО-d6): δ 10,23 (1Н, s); 9,79 (1Н, t, J 6,1Гц); 9,23 (1Н, s); 8,47 (1Н, s); 7,94 (1Н, s); 7,94 -7,89 (1Н, d, J 8,2Гц); 7,87 (2Н, d, J 8,4Гц); 7,82 (1Н, d, J 7,7Гц); 7,74 (1Н, d, J 7,8Гц); 7,54 (1Н, d, J 8,4Гц); 4,65-4,55 (2Н, m); 4,14-4,01 (2Н, m); 3,17 (3Н, s); 2,16 (3Н, s); 1,25-1,15 (3Н, m). XIAT-MC m/z: 595,2 [МН+]. b) 5-(5-Гідрокси-[1,3,4]оксадіазол-2-іл)-6метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід Заголовну сполуку було отримано способами, описаними у прикладі 33 (с), починаючи з 0,015г (0,025ммоль) сполуки, отриманої на етапі (а). Час реакції 4 доби. Продукт отримували як білий твер 46 дий продукт (0-008г, 58%) після очистки препаративною ВЕРХ та сублімаційної сушки чистих фракцій. 1 Н ЯМР (ДМСО-d6): δ 12,61 (1Н, bs); 9,73 (1Н, t, J 6,2Гц); 8,63 (1Н, s); 7,99 (1Н, s); 7,93 (1Н, d, J 8,0Гц); 7,87 (2Н, d, J 8,2Гц); 7,85 (1Н, t, J 7,8Гц); 7,78 (1Н, d, J 7,8Гц); 7,55 (2Н, d, J 8,2Гц); 4,64-4,55 (2Н, т); 3,17 (3Н, s); 2,30 (3Н, s). XIAT-MC m/z: 549,1 [МН+]. Приклад 41 6-Метил-5-{5-метил-4Н[1,2,4]триазол-3-іл)-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метилсульфонілбензиламід Сполуку з прикладу 38 (а) (0,017г, 0,0325ммоль), толуол (1мл), NMP (0,5мл), триетиламін (0,5мл), етилацетамідат гідрохлорид (0,030г, 0,24ммоль) та пруток магнітної мішалки поміщали у скляну посудину. Посудину герметизували та суміш гріли з перемішуванням при 100°С протягом ночі. Суміші давали охолонути та тоді концентрували у вакуумі. Очистка препаративною ВЕРХ та далі сублімаційна сушка чистих фракцій, дали заголовну сполуку (0,005г, 28%) як білий твердий продукт. 1 Н ЯМР (ДМСО-d6): δ 13,79 (1Н, bs); 9,89 (1Н, t, J 6,0Гц); 8,99 (1Н, s); 7,97 (1Н, s); 7,90 (1Н, d, J 8,0Гц); 7,87 (2Н, d, J 8,2Гц); 7,83 (1Н, t, J 7,9Гц); 7,78 (1Н, d, J 7,9Гц); 7,55 (2Н, d, J 8,3Гц); 4,67-455 (2Н, m), 3,17 (3Н, s); 2,41 (3Н, s); 2,41 (3Н, s). XIAT-MC m/z: 546,2 [МН+]. Приклад 42 5-(4,5-Диметил-4Н-[1,3,4]триазол3-іл)-6-метил-2-оксо-1-(3-трифлуорметилфеніл)1,2-дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід Розчин РОСІ3 (0,030г, 0,2ммоль) у СНСІ3 (1мл) та піридині (1мл) додавали до N-метилацетаміду (0,015г, 0,2ммоль) та суміш охолоджували у бані лід-вода та перемішували протягом 90 хвилин. До цього розчину додавали розчин 5гідразинокарбоніл-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламіду (Приклад 38 (а), 0,040г, 0,076ммоль) у СНСІ3 (2мл) та суміш перемішували протягом ночі при кімнатній температурі. Очистка препаративною ВЕРХ дала лінійний інтермедіат (0,020г). Цей матеріал суспендували у ЕtOAc (2мл) та гріли (90°С) з перемішуванням протягом 4 годин, отримуючи суміш трьох компонентів. Цю суміш очи щали препаративною ВЕРХ, отримуючи заголовну сполук у (0,003г, 7%) після сублімаційної сушки чисти х фракцій. 1 Н ЯМР (ДМСО-d6): δ 9,89 (1Н, t, J 6,1Гц); 8,29 (1Н, s); 8,04 (1Н, m); 7,94-7,89 (1Н, m); 7,87 (2Н, d, J 8,6Гц); 7,87-7,83 (2Н, m); 7,55 (2Н, d, J 8,3Гц); 4,66-4,55 (2H, m); 3,45 (3Н, s); 3,17 (3Н, s); 2,39 (3Н, s); 1,87 (3Н, s). XIAT-MC m/z: 560,2 [MH +]. Приклад 43 5-(5-метоксиметил[1,3,4]оксадіазол-2-іл)-6-метил-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід 5-[N 1-(2-метоксіацетил)-гідразинокарбоніл]-6метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід 47 84571 Сполуку, отриману у прикладі 38 (а) (0,028г, 0,053ммоль) у сухому ТГФ (2мл) обробляли триетиламіном (0,020г, 0,20ммоль) та 2метоксіацетилхлоридом (0,02 г, 0,18ммоль). Суміш перемішували протягом 5 хвилин та РХ-МС показала повне перетворення вихідного матеріалу у суміш трьох сполук. Реакцію гасили додаванням МеОН, та далі випарювання та очистка препаративною ВЕРХ, дали підзаголовну сполуку (0,015г, 47%) як білий твердий продукт після сублімаційної сушки чистих фракцій. 1 Н ЯМР (ДМСО-d6): δ 1,0,29 (1Н, s); 9,95 (1Н, s); 9,79 (1Н, t, J 63Гц); 8,51 (1Н, s); 7,93 (1Н, s); 7,94-7,89 (1H, m), 7,87 (2H, d, J 8,3Гц); 7,82 (1Н, d, J 7,8Гц); 7,74 (1Н, d, J 7,1Гц); 7,55 (2Н, d, J 7,7Гц); 4,65-4,55 (2Н, m); 3,97 (2Н, s); 3,36 (3Н, s); 3,17 (3Н, s); 2,18 (3H, s). XIAT-MC m/z: 595,2 [МН+]. b) 5-(5-метоксиметил-[1,3,4]оксадіазол-2-іл)-6метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідро-піридин-3-карбонової кислоти 4метансульфонілбензиламід Отримано способами, описаними у прикладі 38 (с), починаючи з 0,015г (0,025ммоль) сполуки, отриманої на етапі (а). Заголовну сполуку (0,011г, 80%) отримували як білий твердий продукт після очистки препаративною ВЕРХ та сублімаційної сушки чистих фракцій. 1 Н ЯМР (ДМСО-d6): δ 9,73 (1Н, t, ,76,1Гц); 8,79 (1Н, s); 8,01 (1Н, s); 7,94 (2Н, d, J 7,9Гц); 7,87 (2H, d, J 8,14Гц); 7,86-7,84 (1H, m); 7,71 (1Н, d, J 7,9Гц); 7,56 (2H, d, J 8,1Гц); 4,75 (2H, s); 4,65-4,55 (2Н, m); 3,39 (3Н, s); 3,17 (3Н, s); 2,45 (3Н, s). XIAT-MC m/z: 577,2 [MH +]. Приклад 44 N-[4-(Ізопропілсульфоніл)бензил]6-метил-5-(5-метил-1,3,4-оксадіазол-2-іл)-2-оксо-1[3-{трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід Заголовну сполуку було отримано способом, аналогічним описаному у прикладі 14. 1 Н ЯМР (CDCI3): δ 9,96 (1Н, m,); 9,08 (1Н, s); 7,89-7,78 (4Н, m); 7,55-7,45 (4Н, m); 4,78-4,65 (2Н, m); 3,20-3,13 (1Н, m,); 2,68 (3Н, s); 2,62 (3Н, s); 1,28 (6Н, d, J 63Гц). XIAT-MC m/z: 575 [MH+] Приклад 45 N-[4-(Етилсульфоніл)бензил]-6метил-5-(5-метил-1,3,4-оксадіазол-2-іл)-2-оксо-1[3-(трифлуорметил) феніл]-1,2-дигідропіридин-3карбоксамід Заголовну сполуку було отримано способом, аналогічним описаному у прикладі 14. 1 Н ЯМР (CDCI3): δ 9,80-9,71 (1Н, m); 9,09 (1H, s); 7,90-7,74 (4H, m); 7,56-7,42 (4H, m); 4,79-4,63 (2H, m); 3,08 (2H, q, J 7,5Гц); 2,64(3Н, s); 2,62 (3Н, s); 1,27 (3Н, t, J 7,4Гц). XIAT-MC m/z: 561,1 [МН+]. Приклад 46 N-[4(Циклопропілсульфоніл)бензил]-6-метил-5-(5метил-1,3,4-оксадіазол-2-іл)-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід Заголовну сполуку було отримано способом, аналогічним описаному у прикладі 14. 1 Н ЯМР (CDCI3): δ 9,74 (1Н, bt,); 9,09 (1Н, s); 7,87-7,77 (4Н, m); 7,54-7,45 (4Н, m); 4,75-4,64 (2Н, 48 m); 2,64 (3Н, s); 2,62 (3Н, s); 2,46-2,39 (1Н, m); 1,35-1,31 (2Н, m); 1,04-0,99 (2Н ,m). XIAT-MC m/z: 573 [MH +]. Приклад 47 6-Метил-5-[1,3,4]оксадіазол-2-іл-2оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4-(пропан-2сульфоніл)-бензиламід Заголовну сполуку (0,025г, 64%) було отримано способом, аналогічним описаному у прикладі 39. 1 H ЯМР (ДМСО-d6): δ 9,75 (1Н, t, J 6,2Гц); 9,38 (1Н, s); 8,82 (1Н, s); 8,02 (1Н, s); 7,94 (1Н, d, J 7,5Гц); 7,89-7,82 (2H, m); 7,80 (2Н, d, J 8,2Гц); 7,56 (2H, d, J 8,2Гц); 4,68-4,56 (2H, m); 3,37 (1Н, p, J 6,8Гц); 2,45 (3Н, s); 1,13 (6Н, d, J 6,2Гц). XIAT-MC m/z: 561,2 [MH +]. Приклад 48 6-метил-5-[1,3,4]оксадіазол-2-іл-2оксо-1-[3-(трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти циклопропансульфонілбензиламід Заголовну сполуку (0,023г, 80%) отримували способом, аналогічним описаному у прикладі 39. 1 Н ЯМР (ДМСО-d6): δ 9,74 (1Н, t, J 6,2Гц); 9,38 (1Н, s); 8,82 (1Н, s); 8,01 (1Н, s); 7,94 (1Н, d, J 7,7Гц); 7,89-7,80 (2Н, m), 7,84 (2Н, d, J 8,2Гц); 7,55 (2Н, d, J 8,2Гц); 4,66-4,56 (2Н, m); 2,84-2,77 (1Н, m); 2,44 (3Н, s); 1,12-1,05 (2Н, m); 1,05-0,97 (2Н, m). XIAT-MC m/z: 559,2 [MH +]. Приклад 50 6-метил-5-(2-метил-1,3-оксазол-4іл)-N-[4-(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід a) 5-(1-Бутоксивініл)-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід 5-Йод-6-метил-N-[4-(метилсульфоніл)бензил]2-оксо-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід (Приклад 1 (d), 101,5мг, 0,17ммоль), біс[1,2біс(дифенілфосфіно)етан]-паладій (0) (16,5мг, 18,3ммоль), н-бутил-вініловий етер (60мкл, 0,46ммоль), триетиламін (0,5мл, 3,6ммоль) та ДМФ (6мл) поміщали у посудину Шленка з прутком для магнітного перемішування. Посудину продували аргоном, герметизували, та гріли при 100°С протягом ночі. Реакційну суміш охолоджували та розподіляли між етилацетатом та водою. Органічний шар сушили натрій сульфатом, фільтр ували та концентрували у вакуумі. Залишок очищали препаративною ВЕРХ, отримуючи заголовну сполуку як білий твердий продукт (27,3мг, 28%). 1 Н ЯМР (CDCI3): δ 9,96 (1Н, t, J 5,8Гц);,8,64 (1Н, s); 7,89 (2Н, d, J 8,3Гц); 7,82 (1Н, d, J 8,0Гц); 7,75 (1Н, t, J 7,8Гц); 7,56-7,50 (3Н, m); 7,46 (1Н, d, J 7,8Гц); 4,69 (2Н, ddd, J 22,1,15,7, 6,2Гц); 4,43 (1Н, d, J 2,6Гц); 4,26 (1Н, d, J 2,6Гц); 3,83 (2.Н, t, J 6,5Гц); 3,03 (3Н, s); 2,11 (3Н, s); 1,74 (2Н, квінтет, J 9,2Гц): 1,46 (2H, секстет, J 9,1Гц) 0,98 (3Н, t, J 7,4Гц). XIAT-MC m/z: 563 [МН+]. b) 5-Ацетил-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3 49 84571 (трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід Водну гідрохлоридну кислоту (2,0М, 50мкл) додавали до розчину 5-(1-бутоксивініл)-6-метил-N[4-(метилсульфонт)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід (38мг, 67,5ммоль) у ДХМ (0,5мл). Після 20 хвилин розчин нейтралізували водним натрій гідрокарбонатом. Реакційну суміш очищали препаративною ВЕРХ, отримуючи заголовну сполуку як білий твердий продукт (17,6мг, 51%). 1 Н ЯМР (CDCI3): δ 9,75 (1Н, t, J 5,7Гц); 9,08 (1Н, s); 7,90 (2Н, d, J 8,3Гц); 7,85 (1Н, d, J 7,9Гц); 7,78 (1Н, t, J 7,9Гц); 7,54 (2Н, d, J 8,3Гц); 7,50 (1Н, s); 7,42 (1Н, d, J 8,0Гц); 4,70 (2Н, t, J 6,0Гц); 3,03 (3Н, s); 2,66 (3Н, s); 2,43 (3Н, s). XIAT-MC m/z: 507 [MH +]. c) 5-Бромацетил-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід Бром (34мкл, 0,66ммоль) у ТГФ (5мл) додавали до розчину 5-ацетил-6-метил-N-{4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду (320мг; 0,63ммоль) у ТГФ (10мл). Через 2 години жовтий колір зник. Реакційну суміш розподіляли між водою та етилацетатом, органічну фазу відокремлювали, випарювали, та залишок хроматографували на силікагелі, застосовуючи етилацетат/гептан (1/1,2/1,4/1) як елюент. Фракції, що містять продукт, комбінували та випарювали, отримуючи заголовну сполуку (150мг, 41%). 1 Н ЯМР (CDCI3): δ 9,67 (1Н, t); 9,00 (1Н, s); 7,89 (2Н d); 7,86 (1Н, d); 7,76 (1Н, t); 7,52 (2H,d); 7,50 (1Н, s); 7,42 (1Н, d); 4,69 (2Н, m); 4,41 (2Н, s); 3,02 (3Н, s); 2,42 (3Н, s). d) 6-метил-5-(2-метил-1,3-оксазол-4-іл)-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід Суміш 5-(бромацетил)-6-метил-N-{4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду (90мг, 0,15ммоль) та ацетаміду (44мг, 0,75ммоль), ксилолу (300мкл) та концентрованої сульфатної кислоти (10мкл) гріли з перемішуванням протягом 3 годин. Реакційну суміш розбавляли водою та CH3CN та очищали препаративною ВЕРХ, отримуючи заголовну сполуку (37мг, 45%). 1 Н ЯМР (CDCI3): δ 10,08 (1Н, t); 8,67 (1H, s); 7,88 (2H, d); 7,82 (1H, d); 7,76 (1H, t); 7,72 (1H, s); 7,54 (1H, s); 7,52 (2H, d); 7,46 (1H, d); 4,69 (2H, m); 3,02 (3Н, s); 2,56 (3Н, s);2,19 (3H, s). XIAT-MC m/z: 546,4 [MH +]. Приклад 51 6-Метил-N-[4(метилсульфоніл)бензил]-5-(1,3-оксазол-4-іл)-2оксо-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід Суміш 5-(бромацетил)-6-метил-N-{4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду (Приклад 50 (с), 100мг, 0,17ммоль), формаміду (135мкл, 3,4ммоль), ксилолу (300мкл) 50 та концентрованої сульфатної кислоти (10мкл) гріли з перемішуванням протягом 2 годин. Реакційну суміш розбавляли водою та CH3CN та очищали препаративною ВЕРХ, отримуючи заголовну сполуку (23мг, 31%). 1 Н ЯМР (CDCI3): δ 9,95 (1Н, t); 8,75 (1Н, s); 7,99 (1Н, d); 7,88 (2Н, d); 7,86 (1Н, d); 7,83 (1Н, d); 7,76 (1Н, t); 7,72 (1Н, s); 7,52 (2Н, d); 7,47 (1Н, d); 4,69 (2Н, m); 3,03 (3Н, s); 2,24 (3Н, s). XIAT-MC m/z: 523,3 [MH +]. Приклад 52 5-(2-Аміно-тіазол-4-іл)-6-метил-2оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід 5-Бромацетил-6-метил-2-оксо-1-{3трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід (Приклад 50 (с), 0,04г, 0,067ммоль), тіосечовину (0,0067г, 0,086ммоль), NaOAc (0,011g, 0,136ммоль), EtOH (2мл) та пруток магнітної мішалки поміщали у тубу, призначену для мікрохвильового синтезу. Посудину герметизували та суміш гріли у мікрохвильовому пристрої СЕМ Discover (100W, 90°С) протягом 20 хвилин, отримуючи повне перетворення вихідного матеріалу у єдиний продукт за даними до РХ-МС. Розчинники випарювали, отримуючи сиру суміш, котру очищали препаративною ВЕРХ, отримуючи заголовну сполуку (0,026г, 66%) як слабко жовтуватий твердий продукт після сублімаційної сушки чисти х фракцій. 1 Н ЯМР (ДМСО-d6): δ 9,92 (1Н, t, J 6,1Гц); 8,64 (1Н, s); 7,94 (1Н, s); 7,90 (1Н, d, J 3,0Гц); 7,87 (2Н, d, J 8,3Гц); 7,81 (1Н, d, J 7,7Гц); 7,75 (1Н, d, J 7,75Гц); 7,54 (2Н, d, J 8,2Гц); 7,11 (2Н, bs); 6,64 (1Н, s); 4,65-4,55 (2Н, m); 3,17 (3Н, s); 2,17 (3Н, s). XIAT-MC m/z: 563 [MH +]. Приклад 53 5-(2,5-Диметил-1,3-оксазол-4-іл)-6метил-N-[4-(метилсульфоніл]бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід а) 6-Метил-N-[4-(метилсульфоніл)бензил]-2оксо-5-пропіоніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід Розчин 5-йод-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду (Приклад 1 (d), 1500мг, 2,5ммоль), біс[1,2-біс(дифенілфосфіно)етан]паладію(0) (230мг, 0,25ммоль), триетиламіну (7,5мл, 54ммоль) та етилпропенілового етеру (900мкл,7,5ммоль) у ДМФ (45мл) гріли при 100°С протягом ночі. Після охолодження реакційну суміш виливали у воду та екстрагували етилацетатом і розчинник видаляли під зменшеним тиском. Сирий продукт тоді розчиняли у ДМФ (25мл) та 2М НСІ (25мл), а тоді перемішували протягом 1,5 годин. Реакційну суміш тоді виливали у водний натрій гідрокарбонат та екстрагували етилацетатом. Екстракти відокремлювали, випарювали під зменшеним тиском, та залишок хроматографували на силікагелі, застосовуючи етилацетат/гептан (2/1, 4/1,10/1) як елюент. Фракції, що містять продукт, комбінували та випарювали, отримуючи заголовну сполуку (1,3г, >99%). 51 1 84571 Н ЯМР (CDCl3): δ 9,76 (1Н, t); 9,06 (1Н, s); 7,39 (2Н, d); 7,84 (1Н, d); 7,76 (1Н, t), 7,52 (2Н, d); 7,49 (1Н, s); 7,40 (1Н, d); 4,68 (2Н, m); 3,02 (3Н, s); 3,00 (2Н, q); 2,39 (3Н, s); 1,22 (3Н, t). b) 5-(2-Бромпропаноїл)-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід Бром (84мкл, 1,61ммоль) у ТГФ (5мл) додавали до розчину 6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-5-пропіоніл-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду (700мг, 1,34ммоль) у ТГФ (10мл). Через 2 години жовтий колір зник. Реакційну суміш розподіляли між водою та етилацетатом, органічну фазу відокремлювали, сушили та випарювали під зменшеним тиском, отримуючи заголовну сполуку (800мг, 99%). 1 Н ЯМР (CDCI3): δ 9,71 (1Н, t); 8,97 (1Н, d); 7,89 (2Н, d); 7,35 (1Н, d); 7,77 (1Н, t); 7,52 (2Н, d); 7,46 (1Н, d); 7,40 (1Н, d); 5,28 (1Н, q); 4,69 (2Н, m); 3,02 (3Н, s); 2,36 (3Н, s); 1,90 (3H, d). c) 5-(2,5-Диметил-1,3-оксазол-4-іл)-6-метил-N[4-(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід Суміш 5-(2-бромпропаноїл)-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду (130мг, 0,22ммоль), ацетаміду (262мг, 4,4ммоль), ксилолу (300мкл) та концентрованої сульфатної кислоти (10мкл) гріли з перемішуванням протягом 2 годин. Реакційну суміш розбавляли водою та CH3CN та очищали препаративною ВЕРХ, отримуючи заголовну сполуку (45мг, 36%). 1 Н ЯМР (CDCI3): δ 10,00 (1Н, t); 8,54 (1Н, s); 7,88 (2Н, d); 7,82 (1Н, d); 7,75 (1Н, t); 7,54 (1Н, d); 7,52 (2Н, d); 7,47 (1Н, d); 4,68 (2Н, m); 3,02 (3Н, s); 2,51 (3Н, s); 2,34 (3Н, s);2,11(3H, s). ХІАТ-МС m/z: 560,4 [ΜN 4]. Приклад 54 6-Метил-5-(5-метил-1,3-оксазол-4іл)-N-[4-(метилсульфоніл]бензил]-2-оксо-1-[3(трифлуорметил)фенілі-1,2-дигідропіридин-3карбоксамід Суміш 5-(2-бромпропаноїл)-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду (Приклад 53 (b), 130мг, 0,22ммоль), формаміду (176мкл, 4,4ммоль), ксилолу (300мкл) та концентрованої сульфатної кислоти (10мкл) гріли з перемішуванням протягом 2 годин. Реакційну суміш розбавляли водою та CH3CN та очищали препаративною ВЕРХ, отримуючи заголовну сполуку (27мг. 23%}. 1 Н ЯМР (CDCI3): δ 10,02 (1Н, t); 8,57 (1Н, d); 7,89 (1Н, s); 7,88 (2Н, d); 7,83 (1Н, d); 7,76(1Н, t); 7,55 (1Н, d); 7,52 (2Н, d); 7,48 (1Н, d); 4,69 (2Н, m); 3,02 (3Н, s); 2,41 (3Н, s); 2,09 (3Н, s). XIAT-MC m/z: 546,3 [MH +]. Приклад 55 5-(2-Аміно-5-метил-тіазол-4-іл)-6метил-2-оксо-1-(3-трифлуорметилфеніл]-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід 52 5-(2-бромпропаноїл)-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід (Приклад 53 (b), 0,04г, 0,067ммоль), тіосечовину (0,0067%, 0,086ммоль), NaOAc (0,011г, 0,136ммоль), ЕtOН (2мл) та пруток магнітної мішалки поміщали у тубу, призначену для мікрохвильового синтезу. Посудину герметизували та суміш гріли у мікрохвильовому пристрої СЕМ Discover (100 W, 90°С) протягом 20 хвилин, отримуючи повне перетворення вихідного матеріалу до єдиного продукту за даними РХ-МС. Розчинники випарювали, отримуючи сиру суміш, котру очи щали препаративною ВЕРХ, отримуючи заголовну сполуку (0,026г, 66%) як слабко жовтуватий твердий продукт після сублімаційної сушки чистих фракцій. 1 Н ЯМР (ДМСО-d6): δ 9,90 (1Н, t, J 6,2Гц); 8,32 (1Н, s); 7,98 (1Н, s); 7,91 (1Н, d, J 7,9Гц); 7,87 (2Н, d, J 8,3Гц); 7,83 (1Н, t, J 7,8Гц); 7,77 (1Н, d, J 7,8Гц); 7,54 (2Н, d, J 8,2Гц); 4,67-4,55 (2Н, m); 3,18 (3Н, s); 2,12 (3Н, s); 1,91 (3Н, s). XIAT-MC m/z: 577,1 [MH +]. Приклад 56 5-(2-Гідроксиметил-5-метилтіазол-4-іл)-6-метил-2-оксо-1-(3трифлуорметилфеніл]-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід 5-(2-Бромпропаноїл)-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід (Приклад 53 (b), 0,06г, 0,10ммоль), 2аміно-2-тіоксоетил півалат (0,022г, 0,125ммоль), ЕtOН (2мл) та пруток магнітної мішалки поміщали у тубу, призначену для мікрохвильового синтезу. Посудину герметизували та суміш гріли у мікрохвильовому пристрої СЕМ Discover (100W, 80°С) протягом 40 хвилин, отримуючи повне перетворення вихідного матеріалу до єдиного продукту за даними РХ-МС. Розчинники випарювали, отримуючи сиру суміш, котру очищали на силікагелі, отримуючи 0,045г (76%) інтермедіату піваліловий естер. Цю сполуку розчиняли у ТГФ (2мл) та воді (2мл). До цього розчину додавали NaOH (0,2ммоль, 0,1мл 2Μ розчину), та суміш перемішували при кімнатній температурі протягом ночі. ТГФ випарювали та водну фазу підкислювали, екстрагували та екстракти випарювали. Очистка препаративною ВЕРХ дала чисті фракції, які сублімаційно сушили, отримуючи заголовну сполуку (0,040г, 68%) як білий твердий продукт. 1 Н ЯМР (ДМСО-d6): δ 9,92 (1Н, t, J 6,2Гц); 8,30 (1Н, s); 8,02 (1Н, s); 7,92-7,88 (1Н, d); 7,87 (2Н, d, J 8,5Гц); 7,88-7,78 (2Н, m); 7,54 (2Н, d, J 8,4Гц); 6,02 (1Н, J 5,8Гц); 4,69 (2Н, d, J 5,8Гц); 4,64-4,54 (2Н, m); 3,17 (3Н, s); 2,34 (3Н, s): 1,89 (3Н, s) XIAT-MC m/z: 592,1 [МН+]. Приклад 57 6-Метил-5-(5-метил[1,3,4]оксадіазол-3-іл)-2-оксо-1-(3трифлуорметилфеніл)-1,2-дигідро-піридин-3карбонової кислоти 4-метансульфоніл-бензиламід a) 5-ціано-6-метил-N-[4(метилсульфоніл]бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід 53 84571 Суміш 5-йод-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксаміду (Приклад 1 (d), 120мг, 0,20ммоль) та купрум(І) ціаніду (66,7мг, 0,74ммоль) у NMP (2,5мл) перемішували протягом ночі при 140°С. Реакційну суміш охолоджували та розподіляли між етилацетатом та водою. Органічний шар сушили натрій сульфатом, фільтрували та концентрували у вакуумі. Залишок спершу очи щали препаративною. ВЕРХ, а тоді флеш-хроматографією, елюючи сумішшю ди хлорметан/метанол (10:0,2), отримуючи заголовну сполуку як білий твердий продукт (24мг, 24%). 1 Н ЯМР (ДМСО-d6): δ 955 (1Н, t, J 6,1Гц); 8,49 (1Н, s); 7,96 (1Н, s); 7,93 (1Н, d, J 7,8Гц); 7,88-7,81 (3Н, m); 7,77 (1H, d, J 8,0Гц); 7,52 (2H, d, J 8,4Гц); 4,56 (2H, d, J 62Гц); 3,16 (3H, s); 2,22 (3H, s). XIAT-MC m/z: 490 [MH +]. b) 5-(N-Гідроксикарбамімідоїл)-6-метил-2-оксо1-(3-трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід 5-Ціано-6-метил-N-[4{метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід (0,040г, 0,082ммоль), гідроксиламін гідрохлорид (0,015г, 0,209ммоль), NaOAc (0,017г, 0,209ммоль), етанол (3мл), воду (0,1мл) та пруток магнітної мішалки поміщали у склянку. Суміш гріли (90°С) протягом ночі. РХ-МС показала суміш 50:50 двох компонентів, один з яких мав очікувану молекулярну масу Продукт виділяли препаративною ВЕРХ, о тримуючи 0,012г (28%) інтермедіату Nгідроксіамідин. 1 Н ЯМР-(ДМСО-d6): δ 9,85 (1Н, t, J 6,2Гц); 9,53 (1Н, s); 8,33 (1Н, s); 7,91 (1Н, d, J 7,6Гц); 7,86 (2H, d, J 8,2Гц); 7,85 (1H s); 7,83 (1Н t, J 7,8Гц); 7,69 (1H, d, J 7,8Гц), 7,54 (2H, d, J 8,3Гц); 5,88 (2H, bs); 4,64-4,55 (2Н, m); 3,17 (3Н, s); 2,07 (3Н, s). 58 XIAT-MC m/z: 523,2 [MH +] с) 6-Метил-5-(5-метил-[1,2,4]оксадіазол-3-іл]-2оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід 5-(N-Гідроксикарбамімідоїл)-6-метил-2-оксо-1(3-трифлуорметилфеніл)-1,2-дигідропіридин-3карбонової кислоти 4-метансульфонілбензиламід (0,011г, 0,021ммоль), оцтовий ангідрид (0,02г, 0,195ммоль), толуол (2мл) та пруток магнітної мішалки поміщали у склянку. Посудин у герметизували та гріли (110°С) з перемішуванням протягом 5 годин. РХ-МС підтвердила витрату вихідного матеріалу та утворення продукту з очікуваною молекулярною масою. Випарювання та очистка препаративною ВЕРХ дала заголовну сполуку (0,004г, 35%) як білий твердий продукт після сублімаційної сушки чисти х фракцій. 1 Н ЯМР (ДМСО-d6): δ 9,77 (1Н, t, J 62Гц); 8,90 (1Н, s); 8,01 (1Н, s); 7,93 (1Н, d, J 7,5Гц); 7,87 (2Н, d, J 8,3Гц); 7,87-7,79 (2Н, Гц); 7,55 (2Н, d, J 8,3Гц); 7,67-7,53 (2Н, m); 3,17 (3Н, s); 2,69 (3Н, s); 2,37 (3Н, s). XIAT-MC m/z: 547,2 [ΜN Приклад 58 6-Метил-5-[1,2,4]оксадіазол-3-іл-2оксо-1-[3-трифлуорметилфеніл)-1,2 54 дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід 5-Ціано-6-метил-N[4(метилсульфоніл)бензил]-1,2-дигідропіридин-3карбоксамід (Приклад 57 (а), 0,040г, 0,082ммоль), гідроксиlanaine гідрохлорид (0,015г, 0,209ммоль), NaOAc (0,017г, 0,209ммоль), етанол (3мл), води (0,1мл) та пруток магнітної мішалки поміщали у склянку. Суміш гріли (90°С) протягом ночі. Розчинники випарювали у вакуумі. Залишок розчиняли у метил-ортоформіаті (3мл) у склянці та додавали пруток магнітної мішалки. Посудину герметизували та гріли (130°С) з перемішуванням протягом 2 годин. РХ-МС підтвердила утворення продукту з очікуваною молекулярною масою. Летючі компоненти видаляли у вакуумі, та залишок очищали препаративною ВЕРХ, отримуючи заголовну сполуку (0,012г, 27%) як білий твердий продукт після сублімаційної сушки чисти х фракцій. 1 Н ЯМР (ДМСО-d 6): δ 9,78 (1Н, s); 9,77 (1Н, t, J 6,2Гц); 8,93 (1Н, s); 8,03 (1Н, s); 7,93 (1Н, d, J 7,7Гц); 7,87 (2H, d, J 8,2Гц); 7,86-7,80 (2H, m); 7,56 (2Н, d, 18,2Гц); 4,05-4,55 (2H,m); 3,17 (3Н, s); 2,39 (3Н, s). XIAT-MC m/z: 533,2-[MH +]. Приклад 59 6-Метил-2-оксо-5-(1Н-тетразол-5іл)-1-[3-трифлуорметил-феніл)-1,2-дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід 5-Ціано-6-метил-N-[4(метилсульфоніл)бензил]-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід (Приклад 57 (а), 0,018г, 0,037ммоль), NaN3 (0,020г, 0,307ммоль), NH4CI (0,016г, 0,307ммоль), NMP (1мл) та пруток магнітної мішалки поміщали у тубу, призначену для мікрохвильового синтезу. Посудину герметизували та суміш гріли у мікрохвильовому пристрої СЕМ Discover (100W, 140°С) протягом 30 хвилин, отримуючи повне перетворення нітрилу за даними РХ-МС. Сиру суміш розчиняли в ацетонітрилі (2мл) та воді (2мл) та очищали препаративною ВЕРХ у кислотних умовах, о тримуючи заголовну сполуку (0,012г, 61%) як бежевий твердий продукт після сублімаційної сушки чистих фракцій. 1 Н ЯМР (ДМСО-d6): δ 9,81 (1Н, t, J 6,1Гц); 8,79 (1Н, bs); 8,02 (1Н, bs); 7,93 (1Н, d, J 7,89Гц); 7,87 (2Н, d, J 8,5Гц); 7,88-7,85 (1Н, m); 7,82 (1Н, d, J 8,2Гц); 7,56 (2Н, 5, J 8,4Гц); 4,67-4,55 (2Н, m); 3,17 (3Н, s); 2,34 (3Н, s). XIAT-MC m/z: 533,2 [МН+]. Приклад 60 6-Метил-5-{4-метил-оксазол-2-іл)2-оксо-1-(3-трифлуорметилфеніл-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід 6-Метил-2-оксо-1-(3-трифлуорметилфеніл)1,2-дигідропіридин-3,5-дикарбонової кислоти 5амід 4-метансульфонілбензиламід [отримано з хлорангідриду 5-(4-метансульфонілбензилкарбамоїл)-2-метил-6-оксо-1-(3трифлуорметилфеніл)-1,6-дигідропіридин-3карбонової кислоти [описано у прикладі 14 (b)] та аміаку] (0,05г, 0,098ммоль), 1-хлорацетон (0,025г, 0,27ммоль), СаСО3 (0,015г, 0,15ммоль), NMP (1,5мл) та пруток магнітної мішалки поміщали у 55 84571 тубу, призначену для мікрохвильового синтезу. Посудину герметизували та суміш гріли у мікрохвильовому пристрої СЕМ Discover (100W, 155°С) протягом 60 хвилин, отримуючи повне перетворення аміду за даними РХ-МС. Сиру суміш розчиняли в ацетонітрилі (2мл) та воді (2мл) та очищали препаративною ВЕРХ, отримуючи заголовну сполуку (0,006г, 11%) як твердий продукт після сублімаційної сушки чистих фракцій. 1 Н ЯМР (ДМСО-d6): δ 9,79 (1Н, t, J 6,1Гц); 8,89 (1Н, s); 7,98 (1Н, bs); 7,97-7,95 (1Н, m); 7,92 (1Н, d, J 7,8Гц); 7,87 (2Н, d, J 8,1Гц); 7,85 (1Н, t, J 7,9Гц); 7,79 (1Н, d, J 7,9Гц); 7,55 (2Н, d, J 8,2Гц); 4,66-4,55 (2Н, m); 3,17 (3Н, s); 2,45 (3Н, s); 2,17 (3Н, s). XIAT-MC m/z: 546,2 [MH +]. Приклад 61 5-(4,5-Диметил-оксазол-2-іл)-6метил-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти 4метансульфонілбензиламід 6-Метил-2-оксо-1-(3-трифлуорметилфеніл)1,2-дигідропіридин-3,5-дикарбонової кислоти 5амід 4-метансульфонілбензиламід (дивись Приклад 60,0,05г, 0,098ммоль), 3-бром-2-бутанон (0,020г, 0,20ммоль), СаСО3 (0,015г, 0,15ммоль), NMP (1,5мл) та пруток магнітної мішалки поміщали у тубу, призначену для мікрохвильового синтезу. Посудину герметизували та суміш гріли у мікрохвильовому пристрої СЕМ Discover (100W, 140°С) протягом 2 годин. Реакцію зупиняли та сиру суміш розчиняли в ацетонітрилі (2мл) та воді (2мл) та очищали препаративною ВЕРХ, отримуючи заголовну сполуку (0,007г, 13%) як світло- оричневий твердий продукт після сублімаційної сушки чистих фракцій. 1 Н ЯМР (ДМСО-d6): δ 9,81 (1Н, t J 6,1Гц); 8,85 (1Н, s); 7,98 (1Н, bs); 7,92 (1Н, d, J 7,8Гц); 7,87 (2Н, d, J 8,1Гц); 7,85 (1Н, t, J 7,8Гц); 7,78 (1Н, d, J 7,9Гц); 7,55 (2Н, d, J 8,2Гц); 4,66-4,55 (2Н, m); 3,17 (3Н, s); 2,44 (3Н, s); 2,33 (3Н, s); 2,17 (3Н, s) XIAT-MC m/z: 560,2 [MH +]. Приклад 63 N-Циклогексилметил)-6-метил-2оксо-5-феніл-1-[3-(трифлуорметил)феніл]-4,2дигідропіридин-3-карбоксамід a) Етил 6-метил-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксилат Суспензію 6-метил-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбонової кислоти (Приклад 1 (b), 13,1г, 43,9ммоль), натрій карбонат (5,2г, 48,3ммоль) та йодетан (10,6г, 67,7ммоль) у N MP (60мл) перемішували при зовнішній температурі протягом 19 годин під азотом. Реакційну суміш розподіляли між етилацетатом та водою. Органічну фазу збирали, промивали водою та розсолом сушили натрій сульфатом, фільтрували та концентрували у вакуумі. Залишок очищали флеш-хроматографією на силікагелі, елюючи сумішшю трет-бутилметиловий етер/метанол (10:0,4), отримуючи заголовну сполук у як світло-коричневий твердий продукт (12,5г, 87%). 1 Н ЯМР (CDCI3): δ 8,21 (1Н, d, J 7,4Гц); 7,75 (1Н, d, J 7,8Гц); 7,68 (1Н, t, J 7,8Гц); 7,49 (1Н, s); 7,42 (1Н, d, J 7,8Гц); 6,25 (1Н, d, J 7,4Гц); 4,36 (2Н, q, J 7,2Гц); 2,03 (3Н, s); 1,37(3H, t, J7,2Гц). XIAT-MC m/z: 326,1 [MH +]. 56 b) Етил 5-йод-6-метил-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксилат N-Йодсукцинімід (6,89г, 30,6ммоль) додавали до розчину етил 6-метил-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксилату (9,9г, 30,5ммоль) у ДХМ (45мл) та ТФОК (38мл) під азотом. Після 19 годин перемішування при зовнішній температурі розчинник концентрували у вакуумі. Насичений водний розчин натрій гідрокарбонату та етилацетат додавали для нейтралізації залишкової ТФОК. Органічну фазу збирали, промивали водою та розсолом, сушили натрій сульфатом, фільтрували та концентрували у вакуумі. Залишок очищали флешхроматографією на силікагелі, елюючи сумішшю ДХМ/метанол (10:0,2), отримуючи заголовну сполуку як жовтий твердий продукт (11,4г, 83%). 1 Н ЯМР (CDCI3): δ 8,52 (1Н, s); 7,76 (1Н, d, J 7,8Гц); 7,69 (1Н, t, J 7,9Гц); 7,46 (1Н, s); 738 (1Н, d, J 7,7Гц); 4,36 (2Н, q, J 7,1Гц); 2,26 (3Н, s); 1,37 (3Н, t, J 7,2Гц). XIAT-MC m/z: 452,0 [МН+]. c) Етил 6-метил-2-оксо-5-феніл-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксилат Етил 5-йод-6-метил-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксилат (2,6г, 5,76ммоль), фенілтрибутилстанан (2,24мг, 6,10ммоль), тетракіс(трифенілфосфін)паладій(0) (17,3мг, 0,02ммоль), толуол (15мл) та безводний ДМЕ (1,5мл) розміщали у посудині Шленка з прутком для магнітного перемішування. Посудину продували аргоном, герметизували та гріли при 100°С протягом ночі. Після охолодження до кімнатної температури суміш розподіляли між етилацетатом та водою. Органічний шар промивали водою та розсолом, сушили натрій сульфатом, фільтр ували та концентрували у вакуумі. Залишок очищали препаративною ВЕРХ, отримуючи заголовну сполуку як білий твердий продукт (0,8г, 35%). 1 Н ЯМР (CDCI3): δ 8,26 (1Н, s); 7,72 (2Н, m); 7,56 (1Н, s); 751-736 (4Н, m); 734-7,28 (2Н,m); 4,37 (2Н, q, J 7,1Гц); 1,97 (3Н, s); 1,37 (3Н, t) XIAT-MC m/z: 402,3 [MH +]. d) 6-Метил-2-оксо-5-феніл-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбонова кислота Водний 2Μ розчин натрій гідроксиду (2,5мл, 5,0ммоль) додавали, до розчину етил 6-метил-2оксо-5-феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксилату (0,85г, 2,12ммоль) у ТГФ (5мл), метанолі (3мл) та воді (1мл). Реакційну суміш перемішували при кімнатній температурі протягом 2 годин та тоді концентрували у вакуумі. Ацетонітрил (3мл) додавали до залишку та розчин підкислювали ТФОК. Утворений твердий продукт збирали фільтруванням, промивали водою та ацетоном та сушили на повітрі, отримуючи заголовну сполуку як білий твердий продукт (0,62г, 78%). 1 Н ЯМР (CDCI3): δ 13,75 (1Н, s); 859 (1H, s); 7,87 (1H, d, 18,1Гц); 7,80 (1H, t, J 7,9Гц); 7,61 (1H, s); 7,54 (1Н, d, J 7,6Гц); 7,51-7,40 (3Н, m); 7,31 (2Н, m); 2,08 (3Н, s). 57 84571 XIAT-MC m/z: 374,2 [MH +]. e) N-(Циклогексилметил)-6-метил-2-оксо-5феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід (Циклогексилметил)амін у NMP (135мкл, 0,3М, 0,04ммоль) додавали до суміші 6-метил-2-оксо-5феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбонової кислоти (12мг, 0,03ммоль), HATU (15мг, 0,04ммоль), НОАТ (7мг. 0,04ммоль) та DIEA (13мг, 0,1ммоль) у NMP (160мкл). Реакційну суміш перемішували протягом 17 годин при кімнатній температурі. Розчинник видаляли у вакуумі та залишок розчиняли в ацетонітрилі/воді, 50/50, до загального об'єму 1,6мл, та очищали, застосовуючи препаративну ВЕРХ, отримуючи заголовну сполуку (7мг, 50%). ЧУ (C18, УФ 220нм), 7,0 хвилин. XIAT-MC m/z: 469,1 [МН+]. Застосовуючи загальний спосіб, описаний у прикладі 63 та прийнятний амін, були отримані сполуки з прикладів 64-90. Приклад 64 6-Метил-N-(2-морфолін-4-ілетил)2-оксо-5-феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід ЧУ (C18, УФ 220нм): 4,6 хвилин. XIAT-MC m/z: 486,2 [МН+]. Приклад 65 6-Метил-2-оксо-5-феніл-N-(1Н1,2,4-триазол-3-іл)-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід ЧУ (C18, УФ 220нм): 52 хвилини. XIAT-MC m/z: 440,2 [МН+]. Приклад 66 N-[2-(1Н-індол-3-іл)етил]-6-метил2-оксо-5-феніл-1-[3-трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм): 6,5 хвилин. XIAT-MC m/z: 316,2 [МН+]. Приклад 67 6-Метил-2-оксо-5-феніл-N-(1фенілетил)-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід ЧУ (C18, УФ220нм): 6,8 хвилин. XIAT-MC m/z: 477,2 [ΜN+]. Приклад 68 6-Метил-2-оксо-5-феніл-N-(2фенілетил)-1-[3-(трифлуорметіл)феніл]-1,2дигідропіридин-3-карбоксамід. ЧУ (С18, УФ 220нм): 6,7 хвилин. ХІАТ-МС m/z: 477,2 [МН+]. Приклад 69 6-Метил-2-оксо-5-феніл-N-[(2R)-2фенілциклопропіл]-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід ЧУ (C18, УФ 220нм);6,9 хвилин. ХІАТ-МС m/z: 489,2 [МН+]. Приклад 70 N-(2,3-Дигідро-1Н-інден-2-іл]-6метил-2-оксо-5-феніл-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм): 6,8 хвилин. ХІАТ-МС m/z: 489,2 [МН+], Приклад 71 N-[(1-Етилпіролідин-2-іл)метил]-6метил-2-оксо-5-феніл-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм): 4,7 хвилин. ХІАТ-МС m/z: 484,2 [MH +]. Приклад 72 6-метил-N-(1-нафтилметил)-2оксо-5-феніл-1-(3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм): 7,0 хвилин. 58 ХІАТ-МС m/z: 513,2 [МН+]. Приклад 73 N-(1,3-Бензодіоксол-5-ілметил)-6метил-2-оксо-5-феніл-1-[3-трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм): 6,5 хвилин. ХІАТ-МС m/z: 507,2 [МН+]. Приклад 74 N-(2-Хлор-4-флуорбензил)-6метил-2-оксо-5-феніл-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм): 7,0 хвилин. ХІАТ-МС m/z: 515,2 [МН+]. Приклад 75 6-Метил-2-оксо-5-феніл-N-(2тієнілметил)-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм): 6,5 хвилин. ХІАТ-МС m/z: 469,1 [MH+J. Приклад 76 N-(2-Циклогекс-1-ен-1-ілетил)-6метил-2-оксо-5-феніл-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм): 7,2 хвилин. XIAT-MC m/z: 481,3 [MH +]. Приклад 77 6-Метил-2-оксо-N-(4феноксибензил)-5-феніл-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід ЧУ (С18, УФ 220нм): 7,3 хвилин. ХІАТ-МС m/z: 555,2 (МН+]. Приклад 78 N-[(2,5-Диметил-3-фурил)метил]6-метил-2-оксо-5-феніл-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід ХІАТ-МС m/z: 481,4 [МН+]. Приклад 79 N-{2-[4(Аміносульфоніл)феніл]етил}-6-метил-2-оксо-5феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм): 5,8 хвилин. ХІАТ- MC m/z: 556,1 [МН+]. Приклад 80 6-Метил-2-оксо-5-феніл-N-[4-(1Нпіразол-1-іл)бензил]-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм): 6,4 хвилин. ХІАТ-МС m/z: 529,1 [МН+]. Приклад 81 6-метил-2-оксо-N-фенокси-5феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм): 6,6 хвилин. ХІАТ-МС m/z: 465,1 [МН+]. Приклад 82 N-[(6-Флуор-4Н-1,3-бензодіоксин8-іл)метил]-6-метил-2-оксо-5-феніл-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід ЧУ (С18, УФ 220нм): 6,6 хвилин. ХІАТ-МС m/z: 539,2 [МН+]. Приклад 83 6-Метил-2-оксо-5-феніл-N-[2(тетрагідро-2Н-піран-4-іл)етил]-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід ЧУ (С18, УФ 220нм); 6,0 хвилин. ХІАТ-МС m/z: 485,2 [МН+]. Приклад 84 6-Метил-2-оксо-5-феніл-N-[3-{1Нпіразол-1-іл)пропіл]-1-[3-(трифлуорметил)феніл]1,2-дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм):5,7 хвилин. ХІАТ-МС m/z: 481,1 [ΜH+]. 59 84571 Приклад 85 6-Метил-N-[(1-метил-1Н-піразол-1іл)метил]-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм): 5,4 хвилин. ХІАТ-МС m/z: 467,2 [МН+]. Приклад 86 6-Метил-2-оксо-5-феніл-N-[(1феніл-1Н-піразол-4-іл)метил]-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід ЧУ (С18, УФ 220нм): 6,5 хвилин. ХІАТ-МС rn/z: 529,1 [МН+]. Приклад 87 N-[(5-Метокси-4-оксо-4Н-піран-2іл)метил]-6-метил-2-оксо-5-феніл-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід ЧУ (С18, УФ 220нм): 5,4 хвилин. ХІАТ-МС m/z: 511,1 [МН+]. Приклад 88 N-(3-Азепан-1-ілпропіл)-6-метил-2оксо-5-феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм):5,0 хвилин. ХІАТ-МС m/z: 512,3 [МН+]. Приклад 89 N-[4-ціанобензил)-6-метил-2-оксо5-феніл-1-[3-(трифлуорметил)феніл]-1,2дигідропіридин-3-карбоксамід ЧУ (С18, УФ 220нм):6,4 хвилин. ХІАТ-МС m/z: 488,2 [МН+]. Приклад 90 6-Метил-2-оксо-N-[3-(5-оксо-4,5дигідро-1Н-піразол-4-іл)пропіл]-5-феніл-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксамід ЧУ (С18, УФ 220нм): 5,0 хвилин. ХІАТ-МС m/z: 497,2 [МН+]. Приклад 91 6-Метил-5-(2-метил-2Н-піразол-3іл)-2-оксо-1-(3-трифлуорметилфеніл)-1,2дигідропіридин-3-карбонової кислоти (3-метилізоксазол-5-ілметил)-амід a) 6-Метил-2-оксо-1-(3-трифлуорметилфеніл)1,2-дигідропіридин-3-карбонової кислоти проп-2ініламід SOCI2 (10мл) додавали одною порцією до розчину 6-метил-2-оксо-1-(3-трифлуорметилфеніл)1,2-дигідропіридин-3-карбонової кислоти (Приклад 1 (b), 1,0г, 3,36ммоль) у ДХМ (10мл). Розчин перемішували магнітною мішалкою протягом 1 години, коли РХ-МС показала повне перетворення. Сиру суміш випарювали у вакуумі, отримуючи інтермедіат хлорангідрид як жовтий твердий продукт. Цей твердий продукт розчиняли у 1,4-діоксані (10мл, що сушили молекулярними ситами) та пропаргіламін (0,23г, 4,17ммоль) та додавали триетиламін (1мл). Суміш перемішували протягом 10 хвилин, та РХ-МС показала повне утворення продукту. Суміш концентрували у вакуумі та залишок очищали на силікагелі, отримуючи підзаголовну сполуку (0,93г, 83%) як жовтуватий твердий продукт після випарювання чистих фракції. 1 Н ЯМР (ДМСО-d6): δ 9,82 (1Н, t, J 7,4Гц);8,36 (1Н, d, J 7,7Гц); 7,91 (1Н, s); 7,90 (1Н, d); 7,82 (1Н, t, J 8,1Гц); 7,73 (1Н, d, J 8,1Гц); 6,63 (1Н, d, J 7,5Гц); 4,10-4,04 (2Н, m); 3,11 (1H, t, J 2,4Гц); 2,02 (3H, s). XIAT-MC m/z: 335,1 [МН+]. 60 b) 6-Метил-2-оксо-1-(3-трифлуорметилфеніл]1,2-дигідропіридин-3-карбонової кислоти (3-метилізоксазоло-ілметил)-амід Сполуку, отриману на етапі (а) (0,050г, 0,15ммоль) розчиняли у ЕtOAc (15мл) з магнітним перемішуванням. До цього розчину додавали Nгідроксіацетимідоїл хлорид (0,15г, 1,6ммоль), воду (0,3мл) та КНСО3 (0,16г, 1,6ммоль). Суміш перемішували протягом 2 діб, коли РХ-МС показала 90% перетворення, реакцію зупиняли та суміш розподіляли між ЕtOAc (25мл) та водою (25мл). Органічні фази промивали (водою, розсолом) та сушили. Фільтрування та випарювання дали сиру суміш, котру очищали хроматографією на силікагелі. Сублімаційна сушка чистих фракцій, дала підзаголовну сполуку (0,031г, 53%) як білий порошок. 1 Н ЯМР (ДМСО-d6): δ 9,86 (1Н, t, J 5,9Гц); 8,37 (1Н, d, 17,6Гц); 7,91 (1Н, s); 7,90 (1Н, d); 7,81 (1Н, t, J 7,9Гц); 7,72 (1Н, d, J 7,7Гц); 6,63 (1Н, d, J 7,6Гц); 6,15 (1Н, s); 4,58 (2Н, d, 5,9Гц); 2,17 (3Н, s); 2,03 (3Н, s). XIAT-MC m/z: 392,2,2 :[МН+]. с) 6-Метил-5-(2-метил-2Н-піразол-3-іл)-2-оксо1-(3-трифлуорметил-феніл)-1,2-дигідропіридин-3карбонової кислоти (3-метил-ізоксазол-5-ілметил)амід Сполуку, отриману на етапі (b) (0,019 г, 0,048ммоль) розчиняли у ДХМ (1,5мл) та ІРА (1,5мл). Пруток магнітної мішалки та Nйодсукцинімід (0,011г, 0,048ммоль) додавали та посудину герметизували та перемішували протягом 90 хвилин при кімнатній температурі. РХ-МС показала повне перетворення вихідного матеріалу. Летючі компоненти видаляли у вакуумі та сирий матеріал очищали на силікагелі, отримуючи 5йодинований інтермедіат (0,014г). Інтермедіат розчиняли у ДМЕ (2,5мл) у склянці та додавали 5триметилстаніл-1-метил-1Н-піразол (0,02г, 0,082ммоль) та Pd(PPh3)4 (0,010г, 8,7ммоль). Посудину герметизували та суміш гріли (130°С) з перемішуванням протягом 1 години. РХ-МС показала повне перетворення йодиду у продукт з очікуваною молекулярною масою. Випарювання та очистка препаративною ВЕРХ, дали заголовну сполуку (0,008г, 35%, два етапи) як білий твердий продукт після сублімаційної сушки чисти х фракцій. 1 Н ЯМР (ДМСО-d6): δ 9,82 (1Н, t, J=6,0Гц); 8,21 (1Н, s); 8,02 (1Н, s); 7,92 (1Н, d, J 7,6Гц); 7,88-7,78 (2Н, m); 7,53 (1Н, d, J 7,9Гц); 6,33 (1Н, d, J 7,9Гц); 6,16 (1Н, s); 4,60 (2Н, d, J 6,1Гц); 3,72 (3Н, s); 2,17 (3Н, s); 1,82 (3Н, s). XIAT-MC m/z: 472,1 [MH +]. Приклад 92 6-Метил-5-(2-метил-2Н-піразол-3іл)-2-оксо-1-(3-трифлуорметилфеніл-1,2дигідропіридин-3-карбонової кислоти (5метансульфонілметил-[1,2,4]оксадіазол-3ілметил)-амід а) 6-Метил-5-(2-метил-2Н-піразол-3-іл)-2-оксо1-(3-трифлуорметилфеніл-1,2-дигідропіридин-3карбонова кислота Етил 5-йод-6-метил-2-оксо-1-[3(трифлуорметил)феніл]-1,2-дигідропіридин-3карбоксилат (Приклад 63 (b), 0,77г, 1,7ммоль), ДМЕ (25мл), 5-триметилстаніл-1-метил-1Н-піразол
ДивитисяДодаткова інформація
Назва патенту англійською2-pyridone derivatives, pharmaceutical composition based thereon, process for the preparation thereof (variants)
Автори англійськоюAndersson Marjana, Hansen Peter, Loenn Hans, Nikitidis Antonios, Sjoelin Petter
Назва патенту російськоюПроизводные 2-пиридона, фармацевтическая композиция на их основе, способ их получения (варианты)
Автори російськоюАндерссон Марьяна, Гансен Петер, Ленн Ганс, Никитидис Антониос, Шелин Петтер
МПК / Мітки
МПК: A61P 29/00, C07D 211/86, A61K 31/4412, C07D 241/08
Мітки: варіанти, 2-піридону, спосіб, основі, отримання, композиція, похідні, фармацевтична
Код посилання
<a href="https://ua.patents.su/33-84571-pokhidni-2-piridonu-farmacevtichna-kompoziciya-na-kh-osnovi-sposib-kh-otrimannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Похідні 2-піридону, фармацевтична композиція на їх основі, спосіб їх отримання (варіанти)</a>