Похідні дигідропіразолопіримідинону
Номер патенту: 96152
Опубліковано: 10.10.2011
Автори: Сунамі Сатосі, Отсукі Сатіє, Такахасі Кейдзі, Сагара Такесі, Йосізумі Такасі, Фуруяма Хідетомо, Нііяма Кендзі, Бамба Макото, Сакамото Тосіхіро, Ямамото Фуюкі, Нісібата Тосіхіде, Хіраі Хіросі
Формула / Реферат
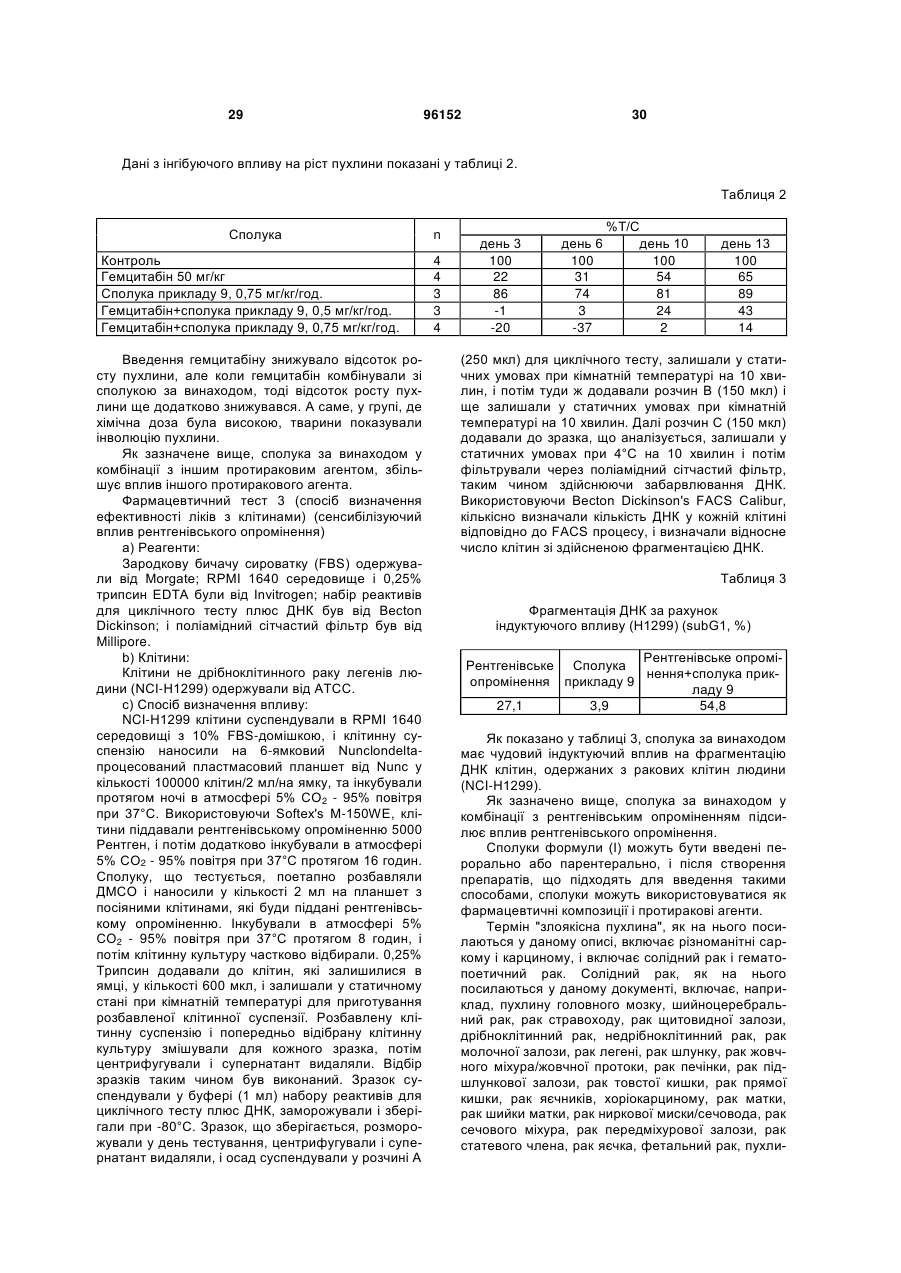
1. Сполука загальної формули (І):
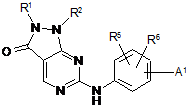 , (І)
, (І)
де А1 вибирають з наступної формули (аа1):
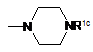
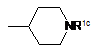 , (аа1)
, (аа1)
R1с являє собою атом водню, нижчу алкенільну групу або групу -Q3-A3(R1d)R1e;
А3 являє собою атом азоту або являє собою метин або 1-вініл-2-іліденову групу, необов'язково заміщену гідроксильною групою, нижчою алкільною групою або гідроксилвмісною нижчою алкільною групою;
Q3 являє собою одинарний зв'язок або нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що складають нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, атомом сірки, карбонільною групою, сульфінільною групою або сульфонільною групою і/або заміщені атомом галогену, ціаногрупою, гідроксильною групою або нижчою алкільною групою;
R1d і R1е являють собою незалежно атом водню, атом галогену, ціаногрупу, гідроксильну групу, нижчу алкільну групу або гідроксилвмісну нижчу алкільну групу або разом утворюють нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що складають нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, атомом сірки, сульфінільною групою, сульфонільною групою, карбонільною групою, вініленовою групою або групою -N(R1f)- і/або заміщені гідроксильною групою або нижчою алкільною групою;
R1f являє собою атом водню, нижчу алкільну групу, галогенвмісну нижчу алкільну групу, нижчу алкенільну групу або нижчу алканоїльну групу;
R1 являє собою нижчу алкенільну групу або нижчу алкінільну групу;
R2 являє собою фенільну, піридильну або тієнільну групу, що може містити групу -Q4-A4(R1g)R1h;
А4 являє собою атом азоту або метинову групу, необов'язково заміщену атомом галогену, гідроксильною групою, нижчою алкільною групою або гідроксинижчою алкільною групою;
Q4 являє собою одинарний зв'язок або нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що складають нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню або карбонільною групою і/або заміщені нижчою алкільною групою;
R1g і R1h являють собою незалежно атом водню, атом галогену, ціаногрупу, гідроксильну групу, нижчу алкільну групу, нижчу алкільну групу, що містить нижчу алкоксигрупу, нижчу алканоїльну групу, нижчу алкоксикарбонільну групу або нижчу алкілсульфонільну групу, або разом утворюють нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що складають нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, атомом сірки, сульфінільною групою, сульфонільною групою, карбонільною групою або групою -N(R1i)- і/або заміщені атомом галогену або нижчою алкільною групою;
R1i являє собою атом водню, нижчу алкільну групу або галогенвмісну нижчу алкільну групу;
R5 і R6 являють собою незалежно атом водню, нижчу алкільну групу або гідроксилвмісну нижчу алкільну групу,
або її сіль.
2. Сполука за п. 1 або її сіль, де R1 являє собою нижчу алкенільну групу.
3. Сполука за п. 2 або її сіль, де R1 являє собою алільну групу.
4. Сполука за п. 1 або її сіль, де R2 являє собою фенільну або піридильну групу, що містить групу -Q4-A4(R1g)R1h.
5. Сполука за п. 1 або її сіль, де R1c являє собою атом водню або групу -Q3-A3(R1d)R1e, і у групі -Q3-A3(R1d)R1e:
(і) А3 являє собою метинову групу, необов'язково заміщену гідроксильною групою або нижчою алкільною групою, Q3 являє собою одинарний зв'язок, і R1d і R1e являють собою незалежно атом водню або нижчу алкільну групу; або
(іі) А3 являє собою метинову групу, необов'язково заміщену гідроксильною групою, або нижчу алкільну групу, Q3 являє собою нижчу алкіленову групу, в якій одна або дві метиленових групи, що утворюють нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, карбонільною групою або сульфонільною групою і/або заміщені гідроксильною групою, і R1d і R1e являють собою незалежно атом водню, атом галогену, ціаногрупу або нижчу алкільну групу.
6. Сполука за п. 1 або її сіль, що являє собою:
3-(2-аліл-6-{[4-(4-метилпіперазин-1-іл)феніл]аміно}-3-оксо-1,2-дигідро-3Н-піразоло[3,4-d]піримідин-1-іл)-N,N-диметилбензамід,
2-аліл-1-[3-(1-гідрокси-1-метилетил)феніл]-6-{[4-(4-метилпіперазин-1-іл)феніл]аміно}-1,2-дигідро-3Н-піразоло[3,4-d]піримідин-3-он,
2-аліл-1-[3-(диметиламінометил)феніл]-6-{[4-(4-метилпіперазин-1-іл)феніл]аміно}-1,2-дигідро-3Н-піразоло[3,4-d]піримідин-3-он,
2-аліл-6-{[3-гідроксиметил-4-(4-метилпіперазин-1-іл)феніл]аміно}-1-піридин-2-іл-1,2-дигідро-3Н-піразоло[3,4-d]піримідин-3-он,
2-аліл-1-(6-амінопіридин-2-іл)-6-[{4-(4-метилпіперазин-1-іл)феніл}аміно]-1,2-дигідро-3Н-піразоло[3,4-d]піримідин-3-он,
2-аліл-1-[6-(1-гідрокси-1-метилетил)піридин-2-іл]-6-{[4-(4-метилпіперазин-1-іл)феніл]аміно}-1,2-дигідро-3Н-піразоло[3,4-d]піримідин-3-он,
2-аліл-6-{[4-(4-етилпіперазин-1-іл)феніл]аміно}-1-[6-(1-гідрокси-1-метилетил)піридин-2-іл]-1,2-дигідро-3Н-піразоло[3,4-d]піримідин-3-он,
6-{[4-(4-ацетилпіперазин-1-іл)феніл]аміно}-2-аліл-1-[6-(1-гідрокси-1-метилетил)піридин-2-іл]-1,2-дигідро-3Н-піразоло[3,4-d]піримідин-3-он,
2-аліл-6-({4-[4-(2-гідроксіетил)піперазин-1-іл]феніл}аміно)-1-[6-(1-гідрокси-1-метилетил)піридин-2-іл]-1,2-дигідро-3Н-піразоло[3,4-d]піримідин-3-он,
2-аліл-1-[6-(2-гідрокси-2-метилпропіл)піридин-2-іл]-6-{[4-(1-метилпіперидин-4-іл)феніл]аміно}-1,2-дигідро-3Н-піразоло [3,4-d]піримідин-3-он,
2-аліл-6-{[4-(4-метилпіперазин-1-іл)феніл]аміно}-1-[6-(2-оксопіролідин-1-іл)піридин-2-іл]-1,2-дигідро-3Н-піразоло[3,4-d]піримідин-3-он,
N-{[6-(2-аліл-6-{[4-(4-метилпіперазин-1-іл)феніл]аміно}-3-оксо-1,2-дигідро-3H-пipaзoлo[3,4-d]пipимiдин-l-iл)пipидин-2-iл]мeтил}-N-мeтилмeтaнcyльфoнaмiд або
1-[6-(1-гідрокси-1-метилетил)піридин-2-іл]-6-{[4-(4-метилпіперазин-1-іл)феніл]аміно}-2-(2-пропініл)-1,2-дигідро-3Н-піразоло[3,4-d]піримідин-3-он.
7. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за п. 1 або її солі і фармацевтично прийнятний носій або розріджувач.
8. Протираковий агент, що містить фармацевтичну композицію за п. 7.
9. Комбінований лікарський препарат для одночасного, роздільного або послідовного введення при лікуванні злоякісної пухлини, що містить два окремих лікарських препарати (а) і (b):
(a) лікарський препарат, що містить, разом з фармацевтично прийнятним носієм або розріджувачем, сполуку зазначеної вище формули (І) або ії фармацевтично прийнятну сіль; і
(b) лікарський препарат, що містить, разом з фармацевтично прийнятним носієм або розріджувачем, один протираковий агент, вибраний з групи, що складається з протиракових алкілувальних агентів, протиракових антиметаболітів, протиракових антибіотиків, протиракових агентів рослинного походження, протиракових координаційних комплексних сполук платини, протиракових похідних камптотецину, протиракових інгібіторів тирозинкінази, моноклональних антитіл, інтерферонів, модифікаторів біологічної чутливості та інших протиракових агентів або їх фармацевтично прийнятних солей, у числі яких протиракові алкілувальні агенти являють собою N-оксид азотистого іприту, циклофосфамід, іфосфамід, мелфалан, бусульфан, мітобронітол, карбоквон, тіотепу, ранімустин, німустин, темозоломід і кармустин;
протиракові антиметаболіти являють собою метотрексат, 6-меркаптопуринрибозид, меркаптопурин, 5-фторурацил, тегафур, доксифлуридин, кармофур, цитарабін, цитарабіну окфосфат, еноцитабін, S-1, гемцитабін, флударабін і пеметрексед динатрію;
протиракові антибіотики являють собою актиноміцин D, доксорубіцин, даунорубіцин, неокарциностатин, блеоміцин, пепломіцин, мітоміцин С, акларубіцин, пірарубіцин, епірубіцин, зиностатин стималамер, ідарубіцин, сиролімус і вальрубіцин;
протиракові агенти рослинного походження являють собою вінкристин, вінбластин, віндезин, етопозид, собузоксан, доцетаксел, паклітаксел і вінорелбін;
протиракові координаційні комплексні сполуки платини являють собою цисплатин, карбоплатин, недаплатин і оксаліплатин;
протиракові похідні камптотецину являють собою іринотекан, топотекан і камптотецин;
протиракові інгібітори тирозинкінази являють собою гефітиніб, іматиніб і ерлотиніб;
моноклональні антитіла являють собою цетуксимаб, бевацизумаб, ритуксимаб, алемтузумаб і трастузумаб;
інтерферони являють собою інтерферон a, інтерферон a-2а, інтерферон a-2b, інтерферон b, інтерферон g-la та інтерферон g-n1,
модифікатори біологічної чутливості являють собою крестин, лентинан, сизофіран, піцибаніл або убенімекс, та
інші протиракові агенти являють собою мітоксантрон, L-аспарагіназу, прокарбазин, дакарбазин, гідроксикарбамід, пентостатин, третиноїн, алефасепт, дарбепоетин альфа, анастрозол, екземестан, бікалутамід, леупрорелін, флутамід, фулвестрант, пегаптаніб октанатрію, денілейкін дифтитокс, алдеслейкін, тиротропін альфа, триоксид миш'яку, бортезоміб, капецитабін і гозерелін.
10. Фармацевтична композиція, що містить, разом з фармацевтично прийнятним носієм або розріджувачем, сполуку за п. 1 або її фармацевтично прийнятну сіль і протираковий агент, вибраний з групи, що складається з протиракових алкілувальних агентів, протиракових антиметаболітів, протиракових антибіотиків, протиракових агентів рослинного походження, протиракових координаційних комплексних сполук платини, протиракових похідних камптотецину, протиракових інгібіторів тирозинкінази, моноклональних антитіл, модифікаторів біологічної чутливості та інших протиракових агентів, для яких визначення кожного протиракового агента таке ж, як визначено у п. 9, або їх фармацевтично прийнятних солей.
11. Сенсибілізатор опромінення, що містить фармацевтичну композицію за п. 7.
12. Сенсибілізатор для протиракового агента, що містить фармацевтичну композицію за п. 7 та протираковий агент, який вибирають з групи, що складається з протиракових алкілувальних агентів, протиракових антиметаболітів, протиракових антибіотиків, протиракових агентів рослинного походження, протиракових координаційних комплексних сполук платини, протиракових похідних камптотецину, протиракових інгібіторів тирозинкінази, моноклональних антитіл, модифікаторів біологічної чутливості та інших протиракових агентів, для яких визначення кожного протиракового агента таке ж, як визначено у п. 9, або їх фармацевтично прийнятних солей.
13. Застосування сполуки за п. 1 або її солі для одержання протиракового агента.
Текст
1. Сполука загальної формули (І): R1 R2 (19) 1 3 метиленових груп, що складають нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню або карбонільною групою і/або заміщені нижчою алкільною групою; 1g 1h R і R являють собою незалежно атом водню, атом галогену, ціаногрупу, гідроксильну групу, нижчу алкільну групу, нижчу алкільну групу, що містить нижчу алкоксигрупу, нижчу алканоїльну групу, нижчу алкоксикарбонільну групу або нижчу алкілсульфонільну групу, або разом утворюють нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що складають нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, атомом сірки, сульфінільною групою, сульфонільною групою, карбонільною групою або гру1i пою -N(R )- і/або заміщені атомом галогену або нижчою алкільною групою; 1i R являє собою атом водню, нижчу алкільну групу або галогенвмісну нижчу алкільну групу; 5 6 R і R являють собою незалежно атом водню, нижчу алкільну групу або гідроксилвмісну нижчу алкільну групу, або її сіль. 1 2. Сполука за п. 1 або її сіль, де R являє собою нижчу алкенільну групу. 1 3. Сполука за п. 2 або її сіль, де R являє собою алільну групу. 2 4. Сполука за п. 1 або її сіль, де R являє собою фенільну або піридильну групу, що містить групу 4 4 1g 1h Q -A (R )R . 1c 5. Сполука за п. 1 або її сіль, де R являє собою 3 3 1d 1e 3 атом водню або групу -Q -A (R )R , і у групі -Q 3 1d 1e A (R )R : 3 (і) А являє собою метинову групу, необов'язково заміщену гідроксильною групою або нижчою алкі3 льною групою, Q являє собою одинарний зв'язок, 1d 1e і R і R являють собою незалежно атом водню або нижчу алкільну групу; або 3 (іі) А являє собою метинову групу, необов'язково заміщену гідроксильною групою, або нижчу алкі3 льну групу, Q являє собою нижчу алкіленову групу, в якій одна або дві метиленових групи, що утворюють нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, карбонільною групою або сульфонільною групою і/або заміщені 1d 1e гідроксильною групою, і R і R являють собою незалежно атом водню, атом галогену, ціаногрупу або нижчу алкільну групу. 6. Сполука за п. 1 або її сіль, що являє собою: 3-(2-аліл-6-{[4-(4-метилпіперазин-1іл)феніл]аміно}-3-оксо-1,2-дигідро-3Н-піразоло[3,4d]піримідин-1-іл)-N,N-диметилбензамід, 2-аліл-1-[3-(1-гідрокси-1-метилетил)феніл]-6-{[4-(4метилпіперазин-1-іл)феніл]аміно}-1,2-дигідро-3Нпіразоло[3,4-d]піримідин-3-он, 2-аліл-1-[3-(диметиламінометил)феніл]-6-{[4-(4метилпіперазин-1-іл)феніл]аміно}-1,2-дигідро-3Нпіразоло[3,4-d]піримідин-3-он, 2-аліл-6-{[3-гідроксиметил-4-(4-метилпіперазин-1іл)феніл]аміно}-1-піридин-2-іл-1,2-дигідро-3Нпіразоло[3,4-d]піримідин-3-он, 2-аліл-1-(6-амінопіридин-2-іл)-6-[{4-(4метилпіперазин-1-іл)феніл}аміно]-1,2-дигідро-3Нпіразоло[3,4-d]піримідин-3-он, 96152 4 2-аліл-1-[6-(1-гідрокси-1-метилетил)піридин-2-іл]-6{[4-(4-метилпіперазин-1-іл)феніл]аміно}-1,2дигідро-3Н-піразоло[3,4-d]піримідин-3-он, 2-аліл-6-{[4-(4-етилпіперазин-1-іл)феніл]аміно}-1[6-(1-гідрокси-1-метилетил)піридин-2-іл]-1,2дигідро-3Н-піразоло[3,4-d]піримідин-3-он, 6-{[4-(4-ацетилпіперазин-1-іл)феніл]аміно}-2-аліл1-[6-(1-гідрокси-1-метилетил)піридин-2-іл]-1,2дигідро-3Н-піразоло[3,4-d]піримідин-3-он, 2-аліл-6-({4-[4-(2-гідроксіетил)піперазин-1іл]феніл}аміно)-1-[6-(1-гідрокси-1метилетил)піридин-2-іл]-1,2-дигідро-3Нпіразоло[3,4-d]піримідин-3-он, 2-аліл-1-[6-(2-гідрокси-2-метилпропіл)піридин-2-іл]6-{[4-(1-метилпіперидин-4-іл)феніл]аміно}-1,2дигідро-3Н-піразоло [3,4-d]піримідин-3-он, 2-аліл-6-{[4-(4-метилпіперазин-1-іл)феніл]аміно}-1[6-(2-оксопіролідин-1-іл)піридин-2-іл]-1,2-дигідро3Н-піразоло[3,4-d]піримідин-3-он, N-{[6-(2-аліл-6-{[4-(4-метилпіперазин-1іл)феніл]аміно}-3-оксо-1,2-дигідро-3H-пipaзoлo[3,4d]пipимiдин-l-iл)пipидин-2-iл]мeтил}-Nмeтилмeтaнcyльфoнaмiд або 1-[6-(1-гідрокси-1-метилетил)піридин-2-іл]-6-{[4-(4метилпіперазин-1-іл)феніл]аміно}-2-(2-пропініл)1,2-дигідро-3Н-піразоло[3,4-d]піримідин-3-он. 7. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за п. 1 або її солі і фармацевтично прийнятний носій або розріджувач. 8. Протираковий агент, що містить фармацевтичну композицію за п. 7. 9. Комбінований лікарський препарат для одночасного, роздільного або послідовного введення при лікуванні злоякісної пухлини, що містить два окремих лікарських препарати (а) і (b): (a) лікарський препарат, що містить, разом з фармацевтично прийнятним носієм або розріджувачем, сполуку зазначеної вище формули (І) або ії фармацевтично прийнятну сіль; і (b) лікарський препарат, що містить, разом з фармацевтично прийнятним носієм або розріджувачем, один протираковий агент, вибраний з групи, що складається з протиракових алкілувальних агентів, протиракових антиметаболітів, протиракових антибіотиків, протиракових агентів рослинного походження, протиракових координаційних комплексних сполук платини, протиракових похідних камптотецину, протиракових інгібіторів тирозинкінази, моноклональних антитіл, інтерферонів, модифікаторів біологічної чутливості та інших протиракових агентів або їх фармацевтично прийнятних солей, у числі яких протиракові алкілувальні агенти являють собою N-оксид азотистого іприту, циклофосфамід, іфосфамід, мелфалан, бусульфан, мітобронітол, карбоквон, тіотепу, ранімустин, німустин, темозоломід і кармустин; протиракові антиметаболіти являють собою метотрексат, 6-меркаптопуринрибозид, меркаптопурин, 5-фторурацил, тегафур, доксифлуридин, кармофур, цитарабін, цитарабіну окфосфат, еноцитабін, S-1, гемцитабін, флударабін і пеметрексед динатрію; протиракові антибіотики являють собою актиноміцин D, доксорубіцин, даунорубіцин, неокарцинос 5 96152 6 татин, блеоміцин, пепломіцин, мітоміцин С, акларубіцин, пірарубіцин, епірубіцин, зиностатин стималамер, ідарубіцин, сиролімус і вальрубіцин; протиракові агенти рослинного походження являють собою вінкристин, вінбластин, віндезин, етопозид, собузоксан, доцетаксел, паклітаксел і вінорелбін; протиракові координаційні комплексні сполуки платини являють собою цисплатин, карбоплатин, недаплатин і оксаліплатин; протиракові похідні камптотецину являють собою іринотекан, топотекан і камптотецин; протиракові інгібітори тирозинкінази являють собою гефітиніб, іматиніб і ерлотиніб; моноклональні антитіла являють собою цетуксимаб, бевацизумаб, ритуксимаб, алемтузумаб і трастузумаб; інтерферони являють собою інтерферон , інтерферон -2а, інтерферон -2b, інтерферон , інтерферон -la та інтерферон -n1, модифікатори біологічної чутливості являють собою крестин, лентинан, сизофіран, піцибаніл або убенімекс, та інші протиракові агенти являють собою мітоксантрон, L-аспарагіназу, прокарбазин, дакарбазин, гідроксикарбамід, пентостатин, третиноїн, алефасепт, дарбепоетин альфа, анастрозол, екземестан, бікалутамід, леупрорелін, флутамід, фулвестрант, пегаптаніб октанатрію, денілейкін дифтитокс, алдеслейкін, тиротропін альфа, триоксид миш'яку, бортезоміб, капецитабін і гозерелін. 10. Фармацевтична композиція, що містить, разом з фармацевтично прийнятним носієм або розріджувачем, сполуку за п. 1 або її фармацевтично прийнятну сіль і протираковий агент, вибраний з групи, що складається з протиракових алкілувальних агентів, протиракових антиметаболітів, протиракових антибіотиків, протиракових агентів рослинного походження, протиракових координаційних комплексних сполук платини, протиракових похідних камптотецину, протиракових інгібіторів тирозинкінази, моноклональних антитіл, модифікаторів біологічної чутливості та інших протиракових агентів, для яких визначення кожного протиракового агента таке ж, як визначено у п. 9, або їх фармацевтично прийнятних солей. 11. Сенсибілізатор опромінення, що містить фармацевтичну композицію за п. 7. 12. Сенсибілізатор для протиракового агента, що містить фармацевтичну композицію за п. 7 та протираковий агент, який вибирають з групи, що складається з протиракових алкілувальних агентів, протиракових антиметаболітів, протиракових антибіотиків, протиракових агентів рослинного походження, протиракових координаційних комплексних сполук платини, протиракових похідних камптотецину, протиракових інгібіторів тирозинкінази, моноклональних антитіл, модифікаторів біологічної чутливості та інших протиракових агентів, для яких визначення кожного протиракового агента таке ж, як визначено у п. 9, або їх фармацевтично прийнятних солей. 13. Застосування сполуки за п. 1 або її солі для одержання протиракового агента. Галузь техніки Даний винахід застосовний у галузі медицини. Точніше кажучи, похідні дигідропіразолопіримідинону за винаходом застосовні у галузі лікування різних злоякісних пухлин як інгібітор кінази, особливо, як інгібітор Weel-кінази. Рівень техніки Клітини мають контролюючий механізм, який полягає у тому, що у випадку, коли ушкоджена їх ДНК, клітини тимчасово зупиняють клітинний цикл і усувають ушкодження ДНК (Cell Proliferation, Vol. 33, pp. 261-274). Приблизно у половині випадків злоякісних пухлин людини ген-супресор злоякісної пухлини р53 зазнав мутації або втрачений, і клітини внаслідок цього втратили їх G1 контролюючу функцію. Незважаючи на це, такі клітини злоякісної пухлини усе ще зберігають їх G2 контролюючу функцію, що залишилася, яка розглядається як єдиний фактор зниження чутливості клітин до протипухлинних агентів, активних стосовно ДНК, і до опромінень. Weel-кіназа являє собою тирозинову кіназу, яка бере участь у G2 контролі клітинного циклу. Weel фосфорилує Cdc2(Cdk1) тирозин 15, що бере участь у просуванні до Μ стадії від G2 стадії у клітинному циклі, внаслідок цього інактивуючи Cdc2 і тимчасово зупиняючи клітинний цикл на G2 стадії (The EMBO Journal, Vol. 12, pp. 75-85). Таким чином, для клітин злоякісної пухлини, що втратили р53 функцію як таку, вважають, що G2 контролююча функція, здійснювана Weel, важлива при усуненні ушкодженої ДНК, для того, щоб уникнути загибелі клітини. Дотепер повідомлялося, що зниження експресії Weel за допомогою впливу на РНК або інгібування Weel сполуками може підвищити чутливість клітин злоякісної пухлини до адріаміцину, рентгенівського опромінення і гаммаопромінення (Cancer Biology & Therapy, Vol. 3, pp. 305-313; Cancer Research, Vol. 61, pp. 8211-8217). Виходячи із зазначеного вище, вважають, що інгібітор Weel може інгібувати G2 контролюючу функцію клітин злоякісної пухлини, що втратили р53, внаслідок цього збільшуючи чутливість клітин до протипухлинних агентів, активних стосовно ДНК, і до опромінень. Як низькомолекулярний інгібітор Weel-кінази відомі, наприклад, сполуки, описані у заявці США 2005/0250836, WO 2003/091255, Cancer Research, Vol 61, pp. 8211-8217, або у Bioorg. & Med. Chem. Lett., Vol. 15, pp. 1931-1935. Однак сполуки, описані у цих посиланнях, досить сильно відрізняються від сполук за винаходом з погляду їх структур. З іншого боку, WO 2004/056786, WO 2005/021532 або WO 2006/091737 розкривають 7 різні сполуки, такі як дигідропіразолопіридини, що досить схожі на сполуки за винаходом з погляду основних конструкцій їх структури. Однак, ці посилання також не розкривають конкретно і не пропонують якого-небудь інгібуючого впливу на Weelкіназу цих сполук, а також і не розкривають сполук за винаходом. Суть винаходу Метою винаходу є одержання нового агента проти злоякісної пухлини, який має інгібуючий вплив на кіназу, зокрема, інгібуючий вплив на Weel-кіназу. У результаті кропітких досліджень автори даного винаходу знайшли, що сполуки загальної формули (І) мають чудовий інгібуючий вплив на кіназу, особливо чудовий інгібуючий вплив на Weelкіназу, і виконали даний винахід: де 1 А вибирають з наступної формули (аа1): 1c R являє собою атом водню, нижчу алкеніль3 3 1d 1e ну групу або групу -Q -A (R )R ; 3 А являє собою атом азоту або являє собою метин або 1-вініл-2-іліденову групу, необов'язково заміщену гідроксильною групою, нижчою алкільною групою або гідроксилвмісною нижчою алкільною групою; 3 Q являє собою одинарний зв'язок або нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що складають нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, атомом сірки, карбонільною групою, сульфінільною групою або сульфонільною групою, і/або заміщені атомом галогену, ціаногрупою, гідроксильною групою або нижчою алкільною групою; 1d 1e R і R являють собою незалежно атом водню, атом галогену, ціаногрупу, гідроксильну групу, нижчу алкільну групу або гідроксилвмісну нижчу алкільну групу, або разом утворюють нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що складають нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, атомом сірки, сульфінільною групою, сульфонільною групою, карбонільною групою, вініле1f новою групою або групою -N(R )-, і/або заміщені гідроксильною групою або нижчою алкільною групою; 1f R являє собою атом водню, нижчу алкільну групу, галогенвмісну нижчу алкільну групу, нижчу алкенільну групу або нижчу алканоїльну групу; 1 R являє собою нижчу алкенільну групу або нижчу алкінільну групу; 96152 8 2 R являє собою фенільну, піридильну або тіє4 4 1g 1h нільну групу, що може містити групу -Q -A (R )R ; 4 А являє собою атом азоту або метинову групу, необов'язково заміщену атомом галогену, гідроксильною групою, нижчою алкільною групою або гідрокси-нижчою алкільною групою; 4 Q являє собою одинарний зв'язок або нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що складають нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню або карбонільною групою, і/або заміщені нижчою алкільною групою; 1g 1h R і R являють собою незалежно атом водню, атом галогену, ціаногрупу, гідроксильну групу, нижчу алкільну групу, нижчу алкільну групу, що містить нижчу алкоксигрупу, нижчу алканоїльну групу, нижчу алкоксикарбонільну групу або нижчу алкілсульфонільну групу або разом утворюють нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що складають нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, атомом сірки, сульфінільною групою, сульфонільною групою, карбонільною групою 1i або групою -N(R )-, і/або заміщені атомом галогену або нижчою алкільною групою; 1i R являє собою атом водню, нижчу алкільну групу або галогенвмісну нижчу алкільну групу; 5 6 R і R являють собою незалежно атом водню, нижчу алкільну групу або гідроксилвмісну нижчу алкільну групу. Сполуки (І) за винаходом мають інгібуючий вплив на кіназу, особливо інгібуючий вплив на Well-кіназу, і внаслідок цього застосовні як лікарські засоби при різних злоякісних пухлинах, таких як рак головного мозку, шийноцеребральний рак, рак стравоходу, рак щитовидної залози, дрібноклітинний рак, недрібноклітинний рак, рак молочної залози, рак легені, рак шлунку, рак жовчного міхура/жовчної протоки, рак печінки, рак підшлункової залози, рак товстої кишки, рак прямої кишки, рак яєчників, хоріокарцинома, рак матки, рак шийки матки, рак ниркової миски/сечовода, рак сечового міхура, рак передміхурової залози, рак статевого члена, рак яєчка, фетальний рак, рак Вільмса, рак шкіри, злоякісна меланома, нейробластома, остеосаркома, пухлина Юїнга, саркома м'яких тканин, гострий лейкоз, хронічний лімфолейкоз, хронічний мієлоцитарний лейкоз, лімфома Ходжкіна. Зокрема, сполуки (І) за винаходом застосовні як лікарські засоби, наприклад, при раку молочної залози, раку легені, раку підшлункової залози, раку товстої кишки, раку яєчників, гострому лейкозі, хронічному лімфолейкозі, хронічному мієлоцитарному лейкозі, лімфомі Ходжкіна. Винахід стосується сполук формули (І) і їх солей, а також способів їх одержання і їх застосування. Значення термінів, використаних у даному описі, описані нижче, і винахід описаний більш докладно нижче. "Атом галогену" означає атом фтору, атом хлору, атом брому і атом йоду. "Нижча алкільна група" означає пряму або розгалужену алкільну групу, що має від 1 до 6 атомів вуглецю, включаючи, наприклад, метильну групу, 9 етильну групу, пропільну групу, ізопропільну групу, бутильну групу, ізобутильну групу, втор-бутильну групу, трет-бутильну групу, пентильну групу, ізопентильну групу, гексильну групу, ізогексильну групу. "Галогенвмісна нижча алкільна група" означає згадану вище нижчу алкільну групу, в якій якенебудь положення, що заміщується, заміщене одним або двома, або декількома, переважно від 1 до 3, однаковими або різними, згаданими вище атомами галогену, включаючи, наприклад, фторметильну групу, дифторметильну групу, трифторметильну групу, 2-фторетильну групу, 1,2дифторетильну групу, хлорметильну групу, 2хлоретильну групу, 1,2-дихлоретильну групу, бромметильну групу, йодметильну групу. "Гідроксилвмісна нижча алкільна група" означає згадану вище нижчу алкільну групу, в якій якенебудь положення, що заміщується, заміщене однією або двома, або декількома, переважно 1 або 2, гідроксильними групами, включаючи, наприклад, гідроксиметильну групу, 2-гідроксіетильну групу, 1гідрокси-1-метилетильну групу, 1,2дигідроксіетильну групу, 3-гідроксипропільну групу. "Нижча алкоксильна група" означає пряму або розгалужену алкоксильну групу, що має від 1 до 6 атомів вуглецю, включаючи, наприклад, метоксильну групу, етоксильну групу, пропоксильну групу, ізопропоксильну групу, бутоксильну групу, вторбутоксильну групу, ізобутоксильну групу, третбутоксильну групу, пентилоксильну групу, ізопентилоксильну групу, гексилоксильну групу, ізогексилоксильну групу. "Нижча алканоїльна група" означає алканоїльну групу, що має згадану вище нижчу алкільну групу, або таку, яка являє собою алканоїльну групу, що має від 2 до 7 атомів вуглецю, включаючи, наприклад, ацетильну групу, пропіонільну групу, бутирильну групу, ізобутирильну групу, валерильну групу, ізовалерильну групу, півалоїльну групу. "Нижча алкіленова група" означає пряму або розгалужену алкіленову групу, що має від 1 до 6 атомів вуглецю, включаючи, наприклад, метиленову групу, етиленову групу, триметиленову групу, тетраметиленову групу, пентаметиленову групу, гексаметиленову групу. "Нижча алкенільна група" означає пряму або розгалужену алкенільну групу, що має від 2 до 6 атомів вуглецю, включаючи, наприклад, вінільну групу, 1-пропенільну групу, алільну групу, ізопропенільну групу, 3-бутенільну групу, 2-бутенільну групу, 1-бутенільну групу, 1-метил-2-пропенільну групу, 1-метил-1-пропенільну групу, 1-етил-1етенільну групу, 2-метил-2-пропенільну групу, 2метил-1-пропенільну групу, 3-метил-2-бутенільну групу, 4-пентенільну групу. "Нижча алкінільна група" означає пряму або розгалужену алкінільну групу, що має від 2 до 6 атомів вуглецю, включаючи, наприклад, етинільну групу, 1-пропінільну групу, 2-пропінільну групу, 3бутинільну групу, 2-бутинільну групу, 1-бутинільну групу, 1-метил-2-пропінільну групу, 1-етил-2пропінільну групу, 1-метил-2-бутинільну групу, 4пентинільну групу. "Нижча алкільна група, що містить нижчу алкоксильну групу" означає згадану вище нижчу алкіні 96152 10 льну групу, в якій яке-небудь з положень, що заміщаються, заміщене однією або двома, або більше, переважно 1 або 2, однаковими або різними, згаданими вище нижчими алкоксильними групами, включаючи, наприклад, метоксиметильну групу, етоксиметильну групу, 2-метоксіетильну групу, 2етоксіетильну групу, 1-метокси-1-метилетильну групу, 1,2-диметоксіетильну групу, 3метоксипропільну групу. "Нижча алкоксикарбонільна група" означає алкоксикарбонільну групу, що має згадану вище нижчу алкоксильну групу, або таку, яка являє собою алкоксикарбонільну групу, що має від 2 до 7 атомів вуглецю, включаючи, наприклад, метоксикарбонільну групу, етоксикарбонільну групу, пропоксикарбонільну групу, ізопропоксикарбонільну групу, бутоксикарбонільну групу, ізобутоксикарбонільну групу, трет-бутоксикарбонільну групу, пентилоксикарбонільну групу. "Нижча алкілсульфонільна група" означає пряму або розгалужену алкілсульфонільну групу, що має від 1 до 6 атомів вуглецю, включаючи, наприклад, метилсульфонільну групу, етилсульфонільну групу, пропілсульфонільну групу, ізопропілсульфонільну групу, бутилсульфонільну групу, втор-бутилсульфонільну групу, ізобутилсульфонільну групу, трет-бутилсульфонільну групу, пентилсульфонільну групу, ізопентилсульфонільну групу, гексилсульфонільну групу, ізогексилсульфонільну групу. "Солі" сполук за винаходом означають звичайні фармацевтично прийнятні солі. Наприклад, у випадку, коли сполуки мають карбоксильну групу, гідроксильну групу або кислотну гетероциклічну групу, таку як тетразолільна група, вони можуть утворювати основно-адитивні солі по карбоксильній групі, гідроксильній групі або кислотній гетероциклічній групі; або у випадку, коли сполуки мають аміногрупу або основну гетероциклічну групу, вони можуть утворювати кислотно-адитивні солі по аміногрупі або основній гетероциклічній групі. Основно-адитивні солі включають, наприклад, солі лужного металу, такі як солі натрію, солі калію; солі лужноземельного металу, такі як солі кальцію, солі магнію; солі амонію; і солі органічного аміну, такі як солі триметиламіну, солі триетиламіну, солі дициклогексиламіну, солі етаноламіну, солі діетаноламіну, солі триетаноламіну, солі прокаїну, солі Ν,Ν'-дибензилетилендіаміну. Кислотно-адитивні солі включають, наприклад, солі неорганічної кислоти, такі як гідрохлориди, сульфати, нітрати, фосфати, перхлорати, солі органічної кислоти, такі як малеати, фумарати, тартрати, цитрати, аскорбати, трифторацетати; і сульфонати, такі як метансульфонати, ізетіонати, бензолсульфонати, п-толуолсульфонати. "Складні ефіри" сполук за винаходом означають звичайні фармацевтично прийнятні складні ефіри по карбоксильній групі, якщо така є, сполук. Вони включають, наприклад, складні ефіри з нижчою алкільною групою, такою як метильна група, етильна група, пропільна група, ізопропільна група, бутильна група, втор-бутильна група, третбутильна група, пентильна група, ізопентильна група, неопентильна група, циклопропільна група, 11 циклобутильна група, циклопентильна група; складні ефіри з аралкільною групою, такою як бензильна група, фенетильна група; складні ефіри з нижчою алкенільною групою, такою як алільна група, 2-бутенільна група; складні ефіри з нижчою алкільною групою, що містить нижчу алкоксильну групу, такою як метоксиметильна група, 2метоксіетильна група, 2-етоксіетильна група; складні ефіри з нижчою алкільною групою, що містить нижчу алканоїлоксигрупу, такою як ацетоксиметильна група, півалоїлоксиметильна група, 1півалоїлоксіетильна група; складні ефіри з нижчою алкільною групою, що містить нижчу алкоксикарбонільну групу, такою як метоксикарбонілметильна група, ізопропоксикарбонілметильна група; складні ефіри з нижчою алкільною групою, що містить карбоксигрупу, такою як карбоксиметильна група; складні ефіри з нижчою алкільною групою, що містить нижчу алкоксикарбонілоксигрупу, такою як 1(етоксикарбонілокси)етильна група, 1(циклогексилоксикарбонілокси)етильна група; складні ефіри з нижчою алкільною групою, що містить карбамоїлоксигрупу, такою як карбамоїлоксиметильна група; складні ефіри з фталідильною групою; складні ефіри з (5-заміщеною-2-оксо-1,3діоксол-4-іл)метильною групою, такою як (5-метил2-оксо-і 1,3-діоксол-4-іл)метильна група. Для того, щоб проілюструвати сполуки за винаходом більш конкретно, переважні приклади з символами, використаними у формулі (І), та інші описані нижче більш докладно. 1 R являє собою нижчу алкенільну групу або нижчу алкінільну групу. 1 "Нижча алкенільна група" для R являє собою, наприклад, переважно, алільну групу, 2-метил-2пропенільну групу, 3-метил-2-бутенільну групу, особливо переважно, алільну групу. 1 "Нижча алкінільна група" для R являє собою, наприклад, переважно, 2-пропінільну групу. У переважних прикладах здійснення винаходу 1 R являє собою, наприклад, нижчу алкенільну групу необов'язково заміщену атомом галогену, більш конкретно, алільну групу, 2-метил-2-пропенільну групу, 3-метил-2-бутенільну групу; більш переважно, алільну групу. В інших переважних прикладах здійснення ви1 находу R являє собою, наприклад, нижчу алкінільну групу, необов'язково заміщену атомом галогену, більш конкретно, 2-пропінільну групу. Особливо нижча алкенільна група, така як алі1 льна група та ін., є переважною для R . 1 R являє собою, наприклад, переважно, алільну групу, 2-метил-2-пропенільну групу, 3-метил-2бутенільну групу, 2-пропінільну групу, більш переважно, алільну , групу. 2 R являє собою фенільну, піридильну або тіє4 4 1g 1h нільну групу, що може мати групу -Q -A (R )R . "Фенільна, піридильна або тієнільна група, що 4 4 1g 1h 2 може мати групу -Q -; A (R )R " для R означає згадану вище незаміщену фенільну, піридильну або тієнільну групу, або згадану вище фенільну, піридильну або тієнільну групу, заміщену групою 4 4 1g 1h Q -A (R )R . Група може бути однаковою або різною, у кількості однієї або двох, або декількох, 96152 12 4 4 1g 1h переважно 1 або 2 груп -Q -A (R )R в якомунебудь заміщуваному положенні у ній. 4 4 1g 1h У групі -Q -A (R )R замісник може бути та4 1 ким, що А являє собою атом азоту, або являє собою метинову групу, необов'язково заміщену атомом галогену, гідроксильною групою, нижчою алкільною групою або гідроксилвмісною нижчою 4 алкільною групою; Q являє собою одинарний зв'язок або нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що складають нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню або карбонільною групою, 1g 1h і/або заміщені нижчою алкільною групою; R і R являють собою незалежно атом водню, атом галогену, ціаногрупу, гідроксильну групу, нижчу алкільну групу, нижчу алкільну групу, що містить нижчу алкоксигрупу, нижчу алканоїльну групу, нижчу алкоксикарбонільну групу або нижчу алкілсульфонільну групу, або разом утворюють нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що утворюють нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, атомом сірки, сульфінільною групою, сульфонільною групою, карбонільною групою або гру1i пою -N(R )-, і/або заміщені атомом галогену або нижчою алкільною групою. "Метанова група, необов'язково заміщена атомом галогену, гідроксильною групою, нижчою алкільною групою або гідроксилвмісною нижчою 4 алкільною групою" для А означає незаміщену метинову групу або метинову групу, що має замісник, вибраний з групи, що складається з атома галогену, гідроксильної групи, нижчої алкільної групи і гідроксилвмісної нижчої алкільної групи. Одна або дві, або декілька метиленових груп, 4 що утворюють нижчу алкіленову групу для Q , можуть бути незалежно замінені атомом кисню або карбонільною групою, і/або заміщені нижчою алкільною групою. 1g 1h Нижча алкіленова група, яку R і R разом утворюють, являє собою, наприклад, переважно, етиленову групу, триметиленову групу, тетраме4 тиленову групу, пентаметиленову групу. Коли "А ", з яким вони зв'язані, являє собою атом азоту, тоді вони утворюють разом з атомом азоту 1азиридинільну групу, 1-азетидинільну групу, 14 піролідинільну групу, піперидинову групу; коли "А " являє собою метинову групу, вони утворюють разом з метиновою групою циклопропільну групу, циклобутильну групу, циклопентильну групу, циклогексильну групу. В основному, більш переважними є 1-піролідинільна група, піперидинова група, циклобутильна група, циклогексильна група. Одна або дві, або декілька метиленових груп, що утворюють згадану вище нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, атомом сірки, сульфінільною групою або сульфонільною групою, карбонільною групою або 1i групою -N(R )-, і/або заміщені атомом галогену або нижчою алкільною групою. Приклади замінених або заміщених груп являють собою, переважно, вибрані з наступної формули (bb3'): 13 1i 1i R у групі -N(R )- являє собою атом водню, нижчу алкільну групу або галогенвмісну нижчу алкільну групу. 1i Нижча алкільна група для R являє собою, наприклад, переважно, метильну групу, етильну групу. 1i Галогенвмісна нижча алкільна група для R являє собою, наприклад, переважно, фторметильну групу, дифторметильну групу. Переважні приклади здійснення винаходу для 4 4 1g 1h групи -Q -A (R )R являють собою, наприклад, такі, що наведені нижче: 4 (і) А являє собою атом азоту, Q являє собою одинарний зв'язок або метиленову групу, необо1g в'язково заміщену нижчою алкільною групою, і R і 1h R являють собою незалежно атом водню, нижчу алкільну групу, нижчу алканоїльну групу, нижчу алкоксикарбонільну групу або нижчу алкілсульфонільну групу; 4 (іі) А являє собою атом азоту або являє собою метинову групу, необов'язково заміщену атомом галогену, гідроксильною групою, нижчою алкільною групою або гідроксилвмісною нижчою 4 алкільною групою, Q являє собою карбонільну 1g 1h групу, і R і R являють собою незалежно атом водню або нижчу алкільну групу; 4 (ііі) А являє собою метинову групу, необов'язково заміщену атомом галогену, гідроксильною групою, нижчою алкільною групою або гідроксилвмісною нижчою ι алкільною групою, Q являє собою одинарний зв'язок або метиленову групу, необо1g 1h в'язково замінену атомом кисню, і R і R являють собою незалежно атом водню, атом галогену, гідроксильну групу, нижчу алкільну групу або нижчу алкоксикарбонільну групу; 4 (iv) А являє собою метинову групу, необов'язково заміщену атомом галогену, гідроксильною групою, нижчою алкільною групою або гідроксилв4 місною нижчою алкільною групою, Q являє собою 1g 1h одинарний зв'язок, і R і R разом утворюють нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що утворюють нижчу алкіленову групу, можуть бути незалежно замінені 1i атомом кисню або групою -N(R )-; або 4 4 (ν) А являє собою атом азоту, Q являє собою 1g 1h одинарний зв'язок, і R і R разом утворюють нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що утворюють нижчу алкіленову групу, можуть бути незалежно замінені 1i карбонільною групою або групою -N(R ); більш переважний вказаний вище (ііі). 4 4 1g 1h Більш конкретно, група -Q -A (R )R являє собою, наприклад, переважно, аміногрупу, диметиламінометильну групу, метилсульфоніламіногрупу, Ν-метил-Ν-метилсульфоніламінометильну групу, карбамоїльну групу, диметилкарбамоїльну групу, метильну групу, 1-фтор-1-метилетильну групу, гідроксиметильну групу, 1-гідрокси-1метилетильну групу, 2-гідрокси-1,1диметилетильну групу, 2-гідрокси-2 96152 14 метилпропільну групу, 2-гідрокси-1,1диметилпропільну групу, метоксигрупу, 2гідроксіетоксигрупу, 1-гідроксициклобутильну групу, 2-оксо-1-піролідинільну або групу 3-метил-2оксоімідазолідин-1-ільну групу, навіть більш переважна 1-гідрокси-1-метилетильна група та ін. Переважні приклади здійснення винаходу для 2 R являють собою, наприклад, феніл або піридил, більш переважна піридильна група, що має групу 4 4 1g 1h Q -A (R )R . Більш конкретно, таким чином, фенільна, піридильна або тієнільна група, що , може мати гру4 4 1g 1h 2 пу -Q -A (R )R для R , являє собою, наприклад, переважно, фенільну групу, 3диметиламінометилфенільну групу, 3диметилкарбамоїл-фенільну групу, 3-(1-гідрокси-1метилетил)фенільну групу, 3-тієнільну групу, 2піридильну групу, 6-аміно-2-піридильну групу, 6-(Nметил-N-метилсульфоніл-амінометил)-2піридильну групу, 6-метил-2-піридильну групу, 6(1-гідрокси-1-метилетил)-2-піридильну групу, 6-(2гідрокси-1,1-диметилетил)-2-піридильну групу, 6(2-гідрокси-2-метилпропіл)-2-піридильну групу, 6(2-гідрокси-1,1-диметилпропіл)-2-піридильну групу, 6-(2-гідроксіетокси)-2-піридильну групу, 6-(1гідроксициклобутил)-2-піридильну групу, 6-(2-оксо1-піролідиніл)-2-піридильну групу або 6-(3-метил2-оксоімідазолідин-1-іл)-2-піридильну групу, більш переважна 6-(1-гідрокси-1-метилетил)-2піридильна група та ін. Переважні приклади здійснення винаходу для 1 2 R і R у формулі (І) являють собою такі, де, на1 приклад, R являє собою нижчу алкенільну або нижчу алкінільну, більш переважно, нижчу алкені2 льну групу, і R являє собою фенільну або піридильну, більш переважно, піридильну групу, що має 4 4 1g 1h групу -Q -A (R )R . А у формулі (І) вибирають з наступної формули (аа1): 1c 1c R у групі -N(R )- являє собою атом водню, 3 3 1d 1e нижчу алкенільну групу або групу -Q -A (R )R . 1c Нижча алкенільна група для R являє собою, наприклад, переважно, вінільну групу, алільну групу. 3 3 1d 1e 1c 3 У групі -Q -A (R )R для R , А являє собою атом азоту, або являє собою метин або 1-вініл-2іліденову групу, необов'язково заміщену гідроксильною групою, нижчою алкільною групою або гід3 роксилвмісною нижчою алкільною групою; Q являє собою одинарний зв'язок або нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що утворюють нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню,атомом сірки, карбонільною групою, сульфінільною групою або сульфонільною групою, і/або заміщені атомом галогену, ціаногрупою, гідроксильною групою або нижчою алкільною групою; 1d 1e R , і R являють собою незалежно атом водню, атом галогену, ціаногрупу, гідроксильну групу, нижчу алкільну групу або гідроксилвмісну нижчу ал 15 кільну групу, або разом утворюють нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що утворюють нижчу алкіленову групу, можуть бути незалежно замінені атомом 1 кисню, атомом сірки, сульфінільною групою, сульфонільною групою, карбонільною групою, віні1f леновою групою або групою -N(R )-, і/або заміщені гідроксильною групою або нижчою алкільною групою. "Метанова або 1-вініл-2-іліденова група, необов'язково заміщена гідроксильною групою, нижчою алкільною групою або гідроксилвмісною ниж3 чою алкільною групою" для А означає незаміщені метинову або 1-вініл-2-іліденову групу, або метинову або 1-вініл-2-іліденову групу, що має замісник, вибраний з групи, яка складається з гідроксильної групи, нижчої алкільної групи і гідроксилвмісної нижчої алкільної групи. Замісник являє собою, переважно, гідроксильну групу, нижчу алкільну групу, таку як метильна група і етильна група. 3 Нижча алкіленова група для Q являє собою, наприклад, переважно, метиленову групу, етиленову групу, триметиленову групу. Одна або дві, або декілька метиленових груп, що утворюють нижчу алкіленову групу для Q , можуть бути незалежно замінені атомом кисню, атомом сірки, карбонільною групою, сульфінільною групою або сульфонільною групою, і/або заміщені атомом галогену, ціаногрупою, гідроксильною групою або нижчою алкільною групою. 1d 1e Атом галогену для R або R являє собою, наприклад, переважно, атом фтору, атом хлору. 1d 1e Нижчий алкіл для R або R являє собою, наприклад, переважно, метильну групу, етильну групу. 1d Гідроксилвмісна нижча алкільна група для R 1e або R являє собою, наприклад, переважно, гідроксиметильну групу, 2-гідроксіетильну групу. 1d 1e Нижча алкіленова група, яку R і R разом утворюють, являє собою, наприклад, переважно, етиленову групу, триметиленову групу, тетраме3 тиленову групу. Коли "А ", з яким вони зв'язані, являє собою атом азоту, тоді вони утворюють разом з атомом азоту 1-азиридинільну групу, 1азетидинільну групу, 1-піролідинільну групу; коли 3 "А " являє собою метинову групу, вони утворюють разом з метиновою групою циклопропільну групу, циклобутильну групу, циклопентильну групу; коли 3 "А " являє собою 1-вініл-2-іліденову групу, тоді вони утворюють разом з 1-вініл-2-іліденовою групою 1-циклобутенільну групу, 1-циклопентенільну групу, 1-циклoгeксенільну групу. В основному, більш переважними є циклопропільна група, циклобутильна група, циклопентильна група. Одна або дві, або декілька метиленових груп, що утворюють згадану вище нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, атомом сірки, сульфінільною групою або сульфонільною групою, карбонільною групою, ві1f ніленовою групою або групою -N(R )-, і/або заміщені гідроксильною групою або нижчою алкільною групою. 1f 1f R у групі -N(R )- являє собою атом водню, нижчу алкільну групу, галогенвмісну нижчу алкіль 96152 16 ну групу, нижчу алкенільну групу або нижчу алканоїльну групу. Переважні приклади здійснення винаходу для 3 3 1d 1e групи -Q -A (R )R являють собою, наприклад, такі як наведені нижче: 3 (і) А являє собою метанову групу, необов'язково заміщену гідроксильною групою або нижчою 3 алкільною групою, Q являє собою одинарний 1d 1e зв'язок, і R і R являють собою незалежно атом водню або нижчу алкільну групу; або 3 (іі) А являє собою метинову групу, необов'язково заміщену гідроксильною групою або нижчою 3 алкільною групою, Q являє собою нижчу алкіленову групу, в якій одна або дві метиленових групи, що утворюють нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, карбонільною групою або сульфонільною групою, і/або 1d 1e заміщені гідроксильною групою, і R і R являють собою незалежно атом водню, атом галогену, ціаногрупу або нижчу алкільну групу; більш переважно вказане вище (і). 3 3 1d 1e Більш конкретно, група -Q -A (R )R являє собою, наприклад, переважно, метильну групу, етильну групу, пропільну групу, ізопропільну групу, трет-бутильну групу, гідроксиметильну групу, 1гідрокси-1-метилетильну групу, 2-гідроксіетильну групу, 2-метоксіетильну групу, 2-етоксіетильну групу, 2-гідрокси-2-метилпропільну групу, 3-фтор2-гідроксипропільну групу, ацетильну групу, пропіонільну групу, 2-метоксіацетильну групу, третбутоксикарбонільну групу, метилсульфонільну групу, 2-(метилсульфоніл)етильну групу; більш переважно, метильну групу, етильну групу, третбутильну групу, 2-гідроксіетильну групу, 2метоксіетильну групу, ацетильну групу; більш переважно, метильну групу. 1c R являє собою, переважно, атом водню або 3 3 1d 1e 3 групу -Q -A (R )R , більш переважно, групу -Q 3 1d 1e A (R )R . Переважні приклади здійснення винаходу для А являють собою, наприклад, 1-піперазинільну групу, 4-метил-1-піперазинільну групу, 4-етил-1піперазинільну групу, 4-ізопропіл-1-піперазинільну групу, 4-трет-бутил-1-піперазинільну групу, 4циклопропіл-1-піперазинільну групу, 4-циклобутил1-піперазинільну групу, 4-циклопропілметил-1піперазинільну групу, 4-(2-гідроксіетил)-1піперазинільну групу, 4-(2-метоксіетил)-1піперазинільну групу, 4-(2-метоксіацетил)-1піперазинільну групу, 4-ацетил-1-піперазинільну групу, 4-метилсульфоніл-1-піперазинільну групу, 4метил-3-оксо-1-піперазинільну групу, 4піперидильну групу, 1-метил-4-піперидильну групу, 1-(2-гідроксіетил)-4-піперидильну групу, 4-гідрокси1-метил-4-піперидильну групу, більш переважно, 4-метил-1-піперазинільну групу, 4-етил-1піперазинільну групу, 4-(2-гідроксіетил)-1піперазинільну групу, 4-ацетил-1-піперазинільну групу, 1-метил-4-піперидильну групу. 5 6 R і R являють собою незалежно атом водню, нижчу алкільну групу або гідроксилвмісну нижчу алкільну групу. Переважні приклади здійснення винаходу для 5 6 R і R являють собою, наприклад, такі, коли вони обидва являють собою атоми водню, або коли 17 який-небудь з них являє собою атом водню, і інший являє собою нижчу алкільну групу, таку як метильна група і етильна група, або гідроксилвмісну нижчу алкільну групу, таку як гідроксиметильна група і 2-гідроксіетильна група. 5 6 1 У сполуці формули (І) R , R і А може бути в якому-небудь заміщуваному положенні сусідньою фенільною групою. Група формули: являє собою, переважно, 4-(4-метил-1піперазиніл)фенільну групу, 3-метил-4-(4-метил-1піперазиніл)фенільну групу, 3 -гідроксиметил-4-(4метил-1-піперазиніл)фенільну групу, 4-(4-етил-1піперазиніл)фенільну групу, 4-(4-(2-гідроксіетил)-1піперазиніл)фенільну групу, 4-(4-ацетил-1піперазиніл)фенільну групу, 4-(1-метил-4піперидил)фенільну групу. Термін "яке-небудь положення, що заміщується," означає положення, що мають заміщувані водень(водні) при атомі(ах) вуглецю, азоту, кисню і/або сірки, де заміщення водню хімічно припустимо і результати заміщення являють собою стабільну сполуку. У сполуках за винаходом заміна метиленової групи(груп), що утворює(ють) нижчу алкіленову групу, різними радикалами, такими як кисень, сірка, сульфініл, сульфоніл, карбоніл, вінілен і заміщений або незаміщений імін, припустима у випадку, коли заміна хімічно припустима і результати заміни являють собою стабільну сполуку. В залежності від типу замісника і від його сольової форми, сполуки за винаходом можуть бути у формі стереоізомерів і таутомерів, таких як оптичні ізомери, діастереомери, геометричні ізомери; і сполуки за винаходом включають усі ці стереоізомери і таутомери і їх суміші. Винахід включає різні кристали, аморфні форми, солі, гідрати і сольвати сполук за винаходом. Крім того, проліки сполук за винаходом знаходяться у межах обсягу винаходу. Приклади сполук формули (І) і їх солей являють собою, наприклад, сполуки і їх солі, описані у прикладах; і більш переважними є наведені нижче сполуки: 3-(2-аліл-6-{[4-(4-метилпіперазин-1іл)феніл]аміно}-3-оксо-1,2-дигідро-3H-піразоло[3,4d]піримідин-1-іл)-N,N-диметилбензамід, 2-аліл-6-{[3-(гідроксиметил)-4-(4метилпіперазин-1-іл)феніл]аміно}-1-(3-тієніл)-1,2дигідро-3H-піразоло[3,4-d]піримідин-3-он, 2-аліл-1-[3-(1-гідрокси-1-метилетил)феніл]-6{[4-(4-метилпіперазин-1-іл)феніл]аміно}-1,2дигідро-3H-піразоло[3,4-d]піримідин-3-он, 2-аліл-1-[3-(диметиламінометил)феніл]-6-{[4(4-метилпіперазин-1-ιіл)феніл]аміно}-1,2-дигідро3H-піразоло[3,4-d]піримідин-3-он, 96152 18 2-аліл-6-{[3-гідроксиметил-4-(4метилпіперазин-1-іл)феніл]аміно}-1-піридин-2-іл1,2-дигідро-3H-піразоло[3,4-d]піримідин-3-он, 2-аліл-1-(6-амінопіридин-2-іл)-6-[{4-(4метилпіперазин-1-іл)феніл]аміно}-1,2-дигідро-3Hпіразоло[3,4-d]піримідин-3-он, 2-аліл-1-[6-(1-гідрокси-1-метилетил)піридин-2іл]-6-{[4-(4-метилпіперазин-1-іл)феніл]аміно}-1,2дигідро-3H-піразоло[3,4-d]піримідин-3-он, 2-аліл-6-{[4-(4-етилпіперазин-1іл)феніл]аміно}-1-[6-(1-гідрокси-1метилетил)піридин-2-іл]-1,2-дигідро-3Hпіразоло[3,4-d]піримідин-3-он, 6-{[4-(4-ацетилпіперазин-1-іл)феніл]аміно}-2аліл-1-[6-(1-гідрокси-1-метилетил)піридин-2-іл]-1,2дигідро-3H-піразоло[3,4-d]піримідин-3-он, 2-аліл-6-({4-[4-(2-гідроксіетил)піперазин-1іл]феніл}аміно)-1-[6-(1-гідрокси-1метилетил)піридин-2-іл]-1,2-дигідро-3Hпіразоло[3,4-d]піримідин-3-он, 2-аліл-1-[6-(2-гідрокси-2-метилпропіл)піридин2-іл]-6-{[4-(1-метилпіперидин-4-іл)феніл]аміно}-1,2дигїдро-3H-піразоло[3,4-d]піримідин-3-он, 2-аліл-6-{[4-(4-метилпіперазин-1іл)феніл]аміно}-1-[6-(2-оксопіролідин-1-іл)піридин2-іл]-1,2-дигідро-3H-піразоло[3,4-d]піримідин-3-он, N-{[6-(2-аліл-6-{[4-(4-метилпіперазин-1іл)феніл]аміно}-3-оксо-1,2-дигідро-3H-піразоло[3,4d]піримідин-1-іл)піридин-2-іл]метил}-Nметилметансульфонамід, 1-[6-(1-гідрокси-1-метилетил)піридин-2-іл]-6{[4-(4-метилпіперазин-1-іл)феніл]аміно}-2-(2пропініл)-1,2-дигідро-3H-піразоло[3,4-d]піримідин3-он і 2-аліл-1-[6-(3-метил-2-оксоімідазолідин-1іл)піридин-2-іл]-6-{[4-(4-метилпіперазин-1іл)феніл]аміно}-1,2-дигідро-3H-піразоло[3,4d]піримідин-3-он. Способи одержання сполук за винаходом описані нижче. Сполуки (І) за винаходом можуть бути одержані, наприклад, відповідно до способів одержання, згаданих нижче, або відповідно до способів, зазначених у прикладах і у прикладах виробничого одержання. Однак, способи одержання для сполук (І) за винаходом не повинні обмежуватися цими прикладами реакцій. Спосіб одержання 1 Сполука загальної формули (II): 1 1p де L являє собою відхідну групу; R являє собою нижчу алкенільну групу або нижчу алкініль2p ну групу; R являє собою фенільну, піридильну 4p або тієнільну групу, що може містити групу -Q 4p 1gp 1hp 4p A (R )R ; Q являє собою одинарний зв'язок або нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що утворюють 19 96152 нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню або необов'язково захищеною карбонільною групою, і/або заміщені нижчою 1gp 1hp алкільною групою; R і R являють собою незалежно атом водню, атом галогену, ціаногрупу, необов'язково захищену гідроксильну групу, нижчу алкільну групу, нижчу алкільну групу, що містить нижчу алкоксигрупу, нижчу алканоїльну групу, нижчу алкоксикарбонільну групу або нижчу алкілсульфонільну групу, або разом утворюють нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що утворюють нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, атомом сірки, сульфінільною групою, сульфонільною групою, необов'язково захищеною кар1ip бонільною групою або групою -N(R )-, і/або заміщені атомом галогену або нижчою алкільною групою, реагує зі сполукою загальної формули (III) або її сіллю: 20 5p 6p групу; R і R являють собою незалежно атом водню, нижчу алкільну групу або нижчу алкільну групу, що містить необов'язково захищену гідроксигрупу, приводячи до утворення сполуки загальної формули (IV): 1р 1p 2p 5p 6p де А , R , R , R i R мають ті ж значення, як зазначено вище, і, необов'язково, захисна група видалена з неї з одержанням сполуки загальної формули (І): , де А 1р вибирають з наступної формули (аар1): 1 ; 1cp R являє собою атом водню, нижчу алкеніль3p 3p 1dp 1ep 3p ну групу або групу -Q -A (R )R ; A являє собою атом азоту або являє собою метинову групу або 1-вініл-2-іліденову групу, що може бути заміщена необов'язково захищеною гідроксильною групою, нижчою алкільною групою або нижчою алкільною групою, що містить необов'язково за3p хищену гідроксигрупу; Q являє собою одинарний зв'язок або нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що утворюють нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, атомом сірки, необов'язково захищеною карбонільною групою, сульфінільною групою або сульфонільною групою, і/або заміщені атомом галогену, ціаногрупою, необов'язково захищеною гідроксильною групою 1dp 1ep або нижчою алкільною групою; R і R являють собою незалежно атом галогену, ціаногрупу, необов'язково захищену гідроксильну групу, нижчу алкільну групу або нижчу алкільну групу, що містить необов'язково захищену гідроксигрупу, або разом утворюють нижчу алкіленову групу, в якій одна або дві, або декілька метиленових груп, що утворюють нижчу алкіленову групу, можуть бути незалежно замінені атомом кисню, атомом сірки, сульфінільною групою, сульфонільною групою, необов'язково захищеною карбонільною групою, 1fp вініленовою групою або групою -N(R )-, і/або заміщені необов'язково захищеною гідроксильною 1fp групою або нижчою алкільною групою; R являє собою іміно-захисну групу, атом водню, нижчу алкільну групу, галогенвмісну нижчу алкільну групу, нижчу алкенільну групу або нижчу алканоїльну 1 2 5 6 де A , R , R , R і R мають ті ж значення, як зазначено вище. 1 Відхідна група L включає, наприклад, атом галогену, такий як атом хлору, атом брому, атом йоду; органічну сульфонільну групу, таку як метилсульфінільну групу, метилсульфонільну групу, етилсульфонільну групу, фенілсульфонільну групу; і органічну сульфонілоксигрупу, таку як метилсульфонілоксигрупу, трифторметилсульфонілоксигрупу, п-толілсульфонілоксигрупу; переважно, атом хлору, метилсульфінільну групу, метилсульфонільну групу. Спосіб одержання являє собою загальний спосіб для одержання сполук формули (І). У вказаній вище реакції, коли реагенти мають аміногрупу, іміногрупу, гідроксильну групу, карбоксильну групу, карбонільну групу або їм подібні, які не беруть участь у реакції, тоді аміногрупа, іміногрупа, гідроксильна група, карбоксильна група і карбонільна група можуть бути придатним чином захищені аміно- або іміно-захисною групою, гідроксил-захисною групою, карбоксил-захисною групою або карбоніл-захисною групою, і після цього реагенти можуть реагувати, і після реакції захисні групи можуть бути видалені. Конкретно не визначена "аміно- або імінозахисна група" може бути якою-небудь групою, що має її функцію. Наприклад, вона включає аралкільну групу, таку як бензильна група, пметоксибензильна група, 3,4-диметоксибензильна група, о-нітробензильна група, п-нітробензильна група, бензгідрильна група, тритильна група; нижчу алканоїльну групу, таку як формільна група, ацетильна група, пропіонільна група, бутирильна група, півалоїльна група; бензоїльну групу; арилалканоїльну групу, таку як фенілацетильна група, феноксіацетильна група; нижчу алкоксикарбоніль 21 ну групу, таку як метоксикарбонільна група, етоксикарбонільна група, пропілоксикарбонільна група, трет-бутоксикарбонільна група; аралкілоксикарбонільну групу, таку як бензилоксикарбонільна група, п-нітробензилоксикарбонільна група, фенетилоксикарбонільна група; нижчу алкілсилільну групу, таку як триметилсилільна група, третбутилдиметилсилільна група; тетрагідропіранільну групу; триметилсилілетоксиметильну групу; нижчу алкілсульфонільну групу, таку як метилсульфонільна група, етилсульфонільна група; арилсульфонільну групу, таку як бензолсульфонільна група, толуолсульфонільна група; і особливо переважно, ацетильну групу, бензоїльну групу, третбутоксикарбонільну групу, триметилсилілетоксиметильну групу, метилсульфонільну групу. Конкретно не визначена "гідроксил-захисна група" може бути якою-небудь групою, що має її функцію. Наприклад, вона включає нижчу алкільну групу, таку як метильна група, етильна група, пропільна група, ізопропільна група, трет-бутильна група; нижчу алкілсилільну групу, таку як триметилсилільна група, трет-бутилдиметилсилільна група; нижчу алкоксиметильну групу, таку як метоксиметильна група, 2-метоксіетоксиметильна група; тетрагідропіранільну групу; триметилсилілетоксиметильну групу; аралкільну групу, таку як бензильна група, п-метоксибензильна група, 2,3диметоксибензильна група, о-нітробензильна група, п-нітробензильна група, тритильна група; ацильну групу, таку як формільна група, ацетильна група; і особливо переважно, метильну групу, метоксиметильну групу, тетрагідропіранільну групу, тритильну групу, триметилсилілетоксиметильну групу, трет-бутилдиметилсилільну групу, ацетильну групу. Конкретно не визначена "карбоксил-захисна група" може бути якою-небудь групою, що має її функцію. Наприклад, вона включає нижчу алкільну групу, таку як метильна група, етильна група, пропільна група, ізопропільна група, трет-бутильна група; галогенвмісну нижчу алкільну групу, таку як 2,2,2-трихлоретильна група; нижчу алкенільну групу, таку як алільна група; аралкільну групу, таку як бензильна група, п-метоксибензильна група, пнітробензильна група, бензгідрильна група, тритильна група; і особливо переважно, метальну групу, етильну групу, трет-бутильну групу, алільну групу, бензильну групу, п-метоксибензильну групу, бензгідрильну групу. Конкретно не визначена "карбоніл-захисна група" може бути якою-небудь групою, що має її функцію. Наприклад, вона включає ацеталі і кеталі, такі як етиленкеталь, триметиленкеталь, диметиленкеталь. Для реакції сполуки формули (II) і сполуки формули (III), як правило, еквімолярна або надлишкова молярна кількість, переважно, від еквімолярної кількості до 1,5 моля сполуки (III) використовується відносно одного моля сполуки (II). Реакція здійснюється звичайно в інертному розчиннику. Інертний розчинник являє собою, наприклад, переважно, толуол, бензол, хлористий метилен, хлороформ, тетрагідрофуран, діоксан, 96152 22 диметилформамід, N-метилпіролідон, диметилсульфоксид і змішані з них розчинники. Переважно, реакція здійснюється у присутності основи. Основа включає, наприклад, органічні основи, такі як триетиламін, діізопропілетиламін, піридин, 4-диметиламінопіридин; і неорганічні основи, такі як гідрокарбонат натрію, карбонат натрію, карбонат калію, карбонат цезію, гідроксид натрію, гідроксид калію. Кількість використовуваної основи може бути звичайно від еквімолярної кількості до надлишкової молярної кількості, переважно, від 1 до 3 молів відносно одного моля сполуки формули (II). Температура реакції може бути, як правило, від 0°С до 200°С, переважно, від 20°Сдо 150°С. Час реакції може бути, як правило, від 5 хвилин до 7 днів, переважно, від 30 хвилин до 24 годин. Після реакції система може бути оброблена звичайним методом з одержанням неочищеного продукту сполуки формули (IV). Одержану таким чином сполуку формули (IV) очищають звичайним методом, або не очищають, необов'язково піддають видаленню захисних груп з аміногрупи, гідроксильної групи, карбоксильної групи і карбонільної групи, на яких вони є, необов'язково, хоча зручно поєднують при цьому одержання сполуки формули (І). Спосіб видалення захисної групи відрізняється в залежності від типу захисної групи і від стабільності наміченої сполуки (І). Наприклад, зняття захисту може бути досягнуте відповідно до способів, описаних у посиланнях [див. Protective Groups in Organic Synthesis, 3rd. Ed., by T. W. Greene, John Wiley & Sons (1999)] або відповідно до способів, подібних до цих. Наприклад, у цьому документі реально застосовний спосіб сольволізу з кислотою або основою, який включає в себе обробку захищеної сполуки кислотою у кількості від 0,01 моля до значної надлишкової кількості, переважно, трифтороцтовою кислотою, мурашиною кислотою або хлористоводневою кислотою, або обробку основою у кількості від еквімолярної до значної надлишкової кількості, переважно, гідроксидом калію або гідроксидом кальцію; і спосіб хімічного відновлення комплексом гідриду металу або каталітичного відновлення з каталізатором паладій на вугіллі або з каталізатором нікель Ренея. Сполуки формули (І) можуть бути легко виділені і очищені яким-небудь звичайним способом виділення. Приклади способу являють собою, наприклад, екстракцію розчинником, перекристалізацію, колонкову хроматографію, препаративну тонкошарову хроматографію. Сполуки можуть бути перетворені в їх фармацевтично прийнятні солі або ефіри звичайним методом; і, навпаки, їх солі або ефіри також можуть бути перетворені у вільні сполуки звичайним методом. "Солі" сполуки формули (III) мають на увазі звичайні солі, використовувані у галузі органічної хімії. Наприклад, коли сполука має аміногрупу або основну гетероциклічну аміногрупу, тоді її солі являють собою кислотно-адитивні солі по аміногрупі або по основній гетероциклічній групі. 23 96152 24 Кислотно-адитивні солі включають, наприклад, солі неорганічної кислоти, такі як гідрохлориди, сульфати, нітрати, фосфати, перхлорати, солі органічної кислоти, такі як малеати, фумарати, тартрати, цитрати, аскорбати, трифторацетати; сульфонати, такі як метансульфонати, ізетіонати, бензолсульфонати, п-толуолсульфонати. Сполуки формул (II) і (III) можуть бути комерційно доступними або можуть бути одержані відповідно до способів, описаних у посиланнях [див. WO 2006/004040, WO 2003/037872; Journal of Medicinal Chemistry, Vol. 48, pp. 2371-2387; Bioorg. & Med. Chem. Lett., Vol. 14, pp. 5793-5797; Journal of the Chemical Society, Perkin Transaction II, Vol. 3, p. 843] або відповідно до способів, подібних до цього, або відповідно до способів, описаних нижче, або відповідно до способів, описаних у прикладах і прикладах виробничого одержання, необов'язково, хоча, можливо, поєднуваних. де Et являє собою етильну групу; L являє собою відхідну групу; Me являє собою метильну гру1p 2p пу; R і R мають ті ж значення, як зазначено вище. Спосіб одержання А являє собою спосіб для одержання сполуки формули (II), в якому відхідна 1 група для L являє собою метилсульфінільну групу, або спосіб для одержання сполуки формули (II1). Відповідно до цього способу одержання, сполука формули (II-1) може бути одержана при реакції сполуки формули (1) і гідразинового похідного формули (2) у присутності основи, з утворенням сполуки формули (3), і після цього введенням гру1p пи R у сполуку (3), з утворенням сполуки (5), і в остаточному підсумку окисненням метилтіогрупи у сполуці (5) до метилсульфінільної групи. На стадії реагування сполуки формули (1) і гідразинового похідного формули (2) у присутності основи з утворенням сполуки формули (3), як правило, від 0,5 моля до надлишкової молярної кількості, переважно, від еквімолярної кількості до 3,0 молів гідразинового похідного (2) застосовують відносно одного моля сполуки (1). Звичайно реакцію здійснюють в інертному розчиннику. Інертний розчинник являє собою, наприклад, переважно, хлористий метилен, хлороформ, тетрагідрофуран, діетиловий ефір, бензол, толуол, диметилформамід або змішані розчинники з них. Переважно, реакцію здійснюють у присутності основи. Основа включає, наприклад, органічні основи, такі як триетиламін, діізопропілетиламін, піридин, 4-диметиламінопіридин; неорганічні основи, такі як гідроксид натрію, гідроксид калію, кар бонат натрію, карбонат калію, гідрокарбонат натрію. Звичайна кількість використовуваної основи складає, переважно, від еквімолярної кількості до надлишкової молярної кількості відносно одного моля сполуки (1). Коли основа являє собою рідину, тоді основа може також служити як розчинник. Температура реакції може бути, як правило, від -78°С до 100°С, переважно, від 20°С до 80°С. Час реакції може бути, як правило, від 5 хвилин до 7 днів, переважно, від 30 хвилин до 24 годин. На стадії реагування сполуки (3) і сполуки (4) з утворенням сполуки (5), звичайно, від 0,5 моля до надлишкової молярної кількості, переважно, від 2,0 молів до 5,0 молів сполуки (4) застосовують відносно одного моля сполуки (3). 2 Відхідна група для L являє собою, переважно, атом галогену, такий як атом хлору, атом брому, атом йоду. Звичайно реакція може здійснюватися в інертному розчиннику, такому як тетрагідрофуран, бензол, толуол, ацетонітрил, диметилформамід, у присутності основи, такої як гідрид натрію, амід натрію, алкоксид натрію, або у розчиннику, такому як метанол, етанол, ацетонітрил, у присутності основи, такої як гідроксид натрію, гідроксид калію, карбонат калію. Звичайно температура реакції складає, переважно, від 0°С до температури кипіння розчинника, використовуваного у реакції; і, звичайно, час реакції складає, переважно, від 1 години до 48 годин. Для стадії окиснення метилтіогрупи у сполуці (5) для одержання сполуки (ΠΙ), застосовним є 25 96152 26 спосіб окиснення метилтіогрупи у метилсульфінільну групу або метилсульфонільну групу, як такий добре відомий у галузі органічної хімії. Звичайно, наприклад, в інертному розчиннику, такому як бензол, толуол, хлористий метилен, хлороформ, тетрагідрофуран, ацетонітрил або диметилформамід, від 0,5 моля до надлишкової молярної кількості, переважно, від еквімолярної кількості до 1,5 моля агента, що окиснює, такого як метахлорпербензойна кислота або оксон, можуть використовуватися відносно одного моля сполуки (5) для окиснення. Температура реакції складає, звичайно, переважно, від 0°С до точки кипіння розчинника, використовуваного у реакції, і, звичайно, час реакції складає, переважно, від 30 хвилин до 8 годин. Сполуки формул (1) і (2) можуть бути комерційно доступними або можуть бути одержані відповідно до відомих способів або відповідно до способів, описаних у прикладах, або відповідно до способів, подібних до них, необов'язково, хоча, можливо, поєднуваних. де Μ являє собою атом металу, що звичайно p зустрічається в органічних сполуках; R являє собою атом водню або іміно-захисну групу; Et, Μ, 1p 2p Me, R i R мають ті ж значення, як зазначено вище. p Іміно-захисна група R являє собою, наприклад, переважно, бензильну групу, параметоксибензильну групу, трет-бутоксикарбонільну групу, бензилокси-карбонільну групу. Спосіб одержання В являє собою спосіб для одержання сполуки формули (II-1). Відповідно до цього способу одержання, сполука формули (II-1) може бути одержана при реакції сполуки формули (1) і гідразинового похідного формули (8) у присутності основи, потім гідролізу одержаної у результаті сполуки і циклізації її з утворенням сполуки формули (9), і після цього при реакції сполуки (9) з металоорганічною сполукою формули (10) у присутності каталізатора для вве2p дення, таким чином, у нього групи R , з утворенням сполуки (5), і, у кінцевому результаті, окисненням метилтіогрупи у сполуці (5) до метилсульфонільної групи. На стадії реакції сполуки формули (1) і гідразинового похідного формули (8) у присутності основи, як правило, використовувана кількість гідразинового похідного (8) може бути від 0,5 моля до надлишкової молярної кількості, переважно, від еквімолярної кількості до 1,5 моля відносно одного моля сполуки (1). Реакція звичайно може здійснюватися у присутності органічної основи, такої як триетиламін, діізопропілетиламін, піридин, 4диметиламінопіридин, або неорганічної основи, такої як гідроксид натрію, гідроксид калію, карбонат натрію, карбонат калію, гідрокарбонат натрію, в інертному розчиннику, такому як хлористий метилен, хлороформ, тетрагідрофуран, діетиловий ефір, бензол, толуол, диметилформамід або змішані з них розчинники. Звичайна кількість використовуваної основи складає, переважно, від еквімолярної кількості до надлишкової молярної кількості відносно одного моля сполуки (1). Коли основа являє собою рідину, тоді основа може також служити як розчинник. Температура реакції може бути, як правило, від -78°С до 200°С, переважно, від 20°С до 100°С. Час реакції може бути, як правило, від 5 хвилин до 7 днів, переважно, від 8 годин до 24 годин. Для стадії гідролізу сполуки, одержаної у попередній реакції, застосовним є спосіб гідролізу карбоксилатів, сам по собі відомий у галузі органічної хімії. Звичайно у розчиннику, такому як метанол, етанол, тетрагідрофуран, діоксан, вода або у змішаному з них розчиннику, сполука може бути оброблена кислотою, такою як хлористоводнева кислота або сірчана кислота, або основою, такою як гідроксид натрію, гідроксид калію або гідроксид кальцію. Звичайно температура реакції складає, переважно, від 50°С до температури кипіння розчинника, використовуваного у реакції; і звичайний час реакції складає, переважно, від 1 години до 48 годин. Після гідролізу одержана у результаті сполука циклізується з одержанням сполуки (9). Для цього реакційне рідке середовище може бути підкислене після гідролізу, при цьому власне циклізація може 27 проходити. У випадку, коли циклізація не відбувається, тоді гідролізована сполука може бути нагріта зі зворотним холодильником у присутності оцтового ангідриду, або гідролізована сполука може бути оброблена тіонілхлоридом для досягнення передбачуваної циклізації сполуки. При циклізації з оцтовим ангідридом кількість використовуваного оцтового ангідриду складає, переважно, надлишкову молярну кількість, і час реакції звичайно складає, переважно, від 1 години до 48 годин. У випадку, коли гідролізована сполука обробляється тіонілхлоридом, кількість використовуваного тіонілхлориду складає, переважно, надлишкову молярну кількість, і час реакції звичайно складає, переважно, від 1 години до 48 годин. Стадія реакції сполуки (9) з металоорганічною сполукою формули (10) у присутності каталізатора 2p для введення, таким чином, у нього групи R , з утворенням сполуки (5), може здійснюватися з використанням галоїдної сполуки, що має групу 2p R , замість металоорганічної сполуки формули (10). Коли використовується така галоїдна сполука, тоді як каталізатор переважним є комплекс йодид міді(І)-діамін. Стадія окиснення метилтіогрупи у сполуці (5) з одержанням сполуки (II-1) може бути здійснена таким же методом, як і стадія окиснення метилтіогрупи у сполуці (5) з одержанням сполуки (II-1) у способі одержання А. Сполука формули (8) може бути комерційно доступною або може бути одержана відповідно до відомих способів, або відповідно до способів, описаних у прикладах, або відповідно до подібних до них способів, необов'язково, хоча, можливо, поєднуваних. Приклади фармацевтичного тесту для сполук за винаходом показані нижче. Фармацевтичний тест 1 (інгібуючий вплив на Weel-кіназу) (1) Очищення Weel-кінази: кДНК Weel-кінази з глутатіон-S-трансферазою (GST), приєднаною по її аміно-кінцю, була введена у бакуловірусний експресійний вектор, щоб сконструювати рекомбінантний бакуловірус, яким були інфіковані клітини комах клітинної лінії Sf9 для досягнення високого рівня експресії у них. Інфіковані клітини діставали і солюбілізували, і потім білок GST-міченої Weel-кінази адсорбували на глутатіонову колонку і елюювали з колонки глутатіоном, і активну фракцію знесолювали на колонці, що знесолює, одержуючи очищений фермент. (2) Визначення активності Weel-кінази: При визначенні активності Weel-кінази як субстрат використовували синтетичний пептид Полі(Lуs,Туr)гідробромід (Lys:Tyr (4:1)), придбаний у фірми Sigma. Кількість реакційної суміші складала 21,1 мкл; і склад реакційного буфера був наступним: 50 мМ Трис-НСІ буфера (рН 7,4)/10 мМ хлориду магнію/1 мМ дитіотреїтолу. Очищену Weel-кіназу, 2,5 мкг субстратного пептиду, 10 мкМ неміченого адено33 зинтрифосфату (АТФ) і 1 мкКюрі [- Р]-міченого АТФ (2500 Кюрі/ммоль або більше) додавали до нього та інкубували при 30°С протягом 30 хвилин. 96152 28 Далі 10 мкл 350 мМ фосфатного буфера додавали до реакційної суміші для зупинки реакції. Субстратами пептид адсорбували на Р81 паперовий фільтр 96-ямкового планшета, потім промивали декілька разів 130 мМ фосфатним буфером, і його радіоактивність підраховували за допомогою рі33 динного сцинтиляційного лічильника, [- Р]мічений АТФ купували у фірми Amersham Bioscience. Для додавання тестової сполуки у реакційну систему, сполуку розбавляли диметилсульфоксидом (ДМСО) для приготування серії розведень. 1,1 мкл розчину кожного розведення додавали до реакційної системи. Як контроль 1,1 мкл ДМСО додавали до реакційної системи. Як видно з таблиці 1, сполуки за винаходом демонструють чудову Weel-інгібуючу активність. Таблиця 1 Сполука Приклад 1 Приклад 2 Приклад 3 Приклад 4 Приклад 5 Приклад 9 Приклад 18 Приклад 20 Приклад 21 Weel-інгібуючий вплив (ІС50, нМ) 7 7,6 13 18 20 11 8,8 6,3 17 Фармацевтичний тест 2 (інгібуючий вплив на ріст пухлини) Клітини раку людини товстої кишки WiDr (одержані від АТСС) були імплантовані підшкірно на спині F344/N Jcl-rnu безтимусних щурів. Через вісім днів після імплантації їм внутрішньовенно вводили гемцитабін (50 мг/кг, Gemzar injection, EliLilly); і через 24 години тестову сполуку розчиняли у розчиннику (5% глюкоза) і вводили їм за допомогою безперервної внутрішньовенної ін'єкції протягом 8 годин. Об'єм пухлини (0,5(найбільший діа2 метр)(найменший діаметр) ) визначали на 0, 3, 6, 10 і 13 дні. День 0 означає день, в який вводили гемцитабін. Відносний об'єм пухлини являє собою відносну величину, яка розрахована на підставі того, що об'єм пухлини дорівнює 1 у 0 день. Відсоток росту пухлини (%Т/С) визначали відповідно до наступної формули: Коли зміна об'єму пухлини, рахуючи від 0 дня у групі, яка піддавалася введенню тестової сполуки, складала більше, ніж 0 (>0): %Т/С=[(зміна об'єму пухлини у випадку тестових сполук на 3, 6, 10, 13 день)/(зміна об'єму пухлини у контролі на 3, 6, 10, 13 день)]100. Коли зміна об'єму пухлини, рахуючи від 0 дня у групі, яка піддавалася введенню тестової сполуки, складала менше, ніж 0 (65%) додавали до розчину у толуолі (20 мл) 898 мг 2аліл-6-(метилтіо)-1-піридин-2-іл-3H-піразоло[3,4d]піримідин-3-ону і перемішували протягом 30 хвилин. 1,60 мл Ν,Ν-діізопропілетиламіну, 800 мг [5-аміно-2-(4-метилпіперазин-1-іл)феніл]метанолу і 10 мл тетрагідрофурану додавали до реакційного рідкого середовища і перемішували протягом ночі. Водний насичений розчин гідрокарбонату натрію додавали до реакційного рідкого середовища і екстрагували змішаним розчином хлороформ/ізопропанол (80/20). Цей екстракт сушили 51 над безводним сульфатом магнію, розчинник видаляли упарюванням, і залишок очищали за допомогою стандартної колонкової хроматографії на силікагелі (гексан/етилацетат = від 50/50 до 0/100). Одержану у результаті кристалічну речовину перекристалізовували з етанолу, одержуючи 941 мг зазначеної у заголовку сполуки у вигляді білої кристалічної речовини. 1 Н-ЯМР (400 МГц, CDCl3) : 8,84 (1Н, с), 8,53 (1Н, д, J=4,8 Гц), 7,91 (1Н, дд), 7,88 (1Н, дд, J=8,8, 7,6 Гц), 7,87 (1Н, д, J=7,6 Гц), 7,64 (1H, с), 7,33 (1Н, д, J=8,8 Гц), 7,26 (1Н, дд, J=8,8, 4,8 Гц), 7,19 (1Н, д, J=8,8 Гц), 5,68 (1Н, ддд, J=17,2, 10,4, 5,6 Гц), 5,50 (1Н, с), 5,01 (1Н, д, 10,4 Гц), 4,91 (1Н, д, J=17,2 Гц), 4,79 (2Н, с), 4,79 (2Н, д, J=5,6 Гц), 3,01 (4Н, м), 2,62 (4Н, м), 2,37 (3H, с). + ESI-MS. Знайдено: m/z[M+H] 472. Приклад 6 Одержання 2-аліл-1-(6-амінопіридин-2-іл)-6{[3-метил-4-(4-метилпіперазин-1-іл)феніл]аміно}1,2-дигідро-3H-піразоло[3,4-d]піримідин-3-ону 1) Одержання ди-трет-бутил {6-[2-аліл-6(метилтіо)-3-оксо-1,2-дигідро-3H-піразоло[3,4d]піримідин-1-іл]-2-піридиніл}іміддикарбоксилату: 2,00 г зазначеної у заголовку сполуки одержували у вигляді білої твердої речовини таким же способом, як і у прикладі 5-1, для якої, однак, дитрет-бутил (6-бромпіридин-2-іл)іміддикарбоксилат використовували замість 2-йодпіридину, використаного у прикладі 5-1. 1 Н-ЯМР (400 МГц, CDCl3) : 8,92 (1Н, с), 7,92 (1Н, т, J=8,0 Гц), 7,80 (1Н, д, J=8,8 Гц), 7,35 (1Н, д, J=7,8 Гц), 5,63 (1Н, ддт, J=17,1, 10,2, 6,3 Гц), 5,03 (1Н, дд, J=10,2, 1,0 Гц), 5,00 (1Н, дд, J=17,1, 1,2 Гц), 4,82 (2Н, д, J=6,3 Гц), 2,58 (3H, с), 1,51 (18Н, с). + ESI-MS. Знайдено: m/z[M+H] 515. 2) Одержання 2-аліл-1-(6-амінопіридин-2-іл)-6{[3-метил-4-(4-метилпіперазин-1-іл)феніл]аміно}1,2-дигідро-3H-піразоло[3,4-d]піримідин-3-ону: 53 мг м-хлорпербензойної кислоти (>65%) додавали до розчину у толуолі (2 мл) 103 мг ди-третбутил {6-[2-аліл-6-(метилтіо)-3-оксо-2,3-дигідро1Н-піразоло[3,4-d]піримідин-1-іл]-2піридиніл}іміддикарбоксилату і перемішували протягом 30 хвилин. 0,105 мл Ν,Νдіізопропілетиламіну і 49 мг 3-метил-4-(4метилпіперазин-1-іл)аніліну додавали до реакційного рідкого середовища і перемішували протягом ночі. Водний насичений розчин гідрокарбонату натрію додавали до реакційного рідкого середовища, туди ж додавали етилацетат для екстракції, одержаний у результаті екстракт промивали насиченим сольовим водним розчином і сушили над безводним сульфатом магнію. Розчинник видаляли упарюванням, залишок очищали за допомогою стандартної колонкової хроматографії на силікагелі (гексан/етилацетат = від 1/1 до 0/1). Після концентрування одержували 93,2 мг білої твердої речовини. 2 мл трифтороцтової кислоти додавали до одержаної сполуки, перемішували, і туди ж додавали насичений розчин гідрокарбонату натрію, екстрагували етилацетатом, промивали сольовим водним розчином і сушили над безводним суль 96152 52 фатом магнію. Розчинник видаляли упарюванням при зниженому тиску, одержуючи 51,8 мг зазначеної у заголовку сполуки у вигляді білої твердої речовини. 1 Н-ЯМР (400 МГц, CDCl3) : 8,81 (1Н, с), 7,60 (1H, т, J=7,8 Гц), 7,52 (1H, с), 7,34 (1Н, дд, J=8,8, 2,4 Гц), 7,00 (1Н, д, J=8,3 Гц), 6,43 (1Н, д, J=7,8 Гц), 5,71 (1Н, ддт, J=16,8, 10,2, 5,9 Гц), 5,06 (1Н, дд, J=10,2, 1,0 Гц), 5,00 (1Н, дд, J=16,8, 1,2 Гц), 4,71 (2Н, д, J=5,9 Гц), 4,58 (2Н, с), 2,95 (4Н, т, J=4,6 Гц), 2,66 (4Н, с), 2,42 (3H, с), 2,31 (3H, с). + ESI-MS. Знайдено: m/z[M+H] 412. Приклад 7 Одержання 2-аліл-1-(6-амінопіридин-2-іл)-6{[4-(4-метилпіперазин-1-іл)феніл]аміно}-1,2дигідро-3H-піразоло[3,4-d]піримідин-3-ону 966 мг зазначеної у заголовку сполуки одержували у вигляді жовтої твердої речовини тим же способом, як і у прикладі від 6-1 до 6-2, для якої, однак, 4-(4-метилпіперазин-1-іл)анілін використовували замість 3-метил-4-(4-метилпіперазин-1іл)аніліну, використаного у прикладі 6-2. 1 Н-ЯМР (400 МГц, CDCl3) : 8,80 (1Н, с), 7,59 (1Н, т, J=7,8 Гц), 7,39 (1H, ушир.с), 6,91 (2H, д, J=8,8 Гц), 6,42 (1Н, д, J=8,3 Гц), 5,71 (1Н, ддт, J=17,1, 10,2, 5,9 Гц), 5,06 (1Н, дд, J=10,2, 1,0 Гц), 5,00 (1Н, дд, J=17,1, 1,0 Гц), 4,70 (2Н, д, J=5,9 Гц), 4,57 (2Н, с), 3,20 (4Н, т, J=5,1 Гц), 2,61 (4Н, т, J=4,9 Гц), 2,38 (3H, с). + ESI-MS. Знайдено: m/z[M+H] 458. Приклад 8 Одержання 2-аліл-1-{6[(диметиламіно)метил]піридин-2-іл}-6-{[4-(4метилпіперазин-1-іл)феніл]аміно}-1,2-дигідро-3Hпіразоло[3,4-d]піримідин-3-ону 1) Одержання 2-аліл-1-[6-(гідроксиметил)-2піридиніл]-6-(метилтіо)-1,2-дигідро-3Hпіразоло[3,4-d]піримідин-3-ону: 3,40 г зазначеної у заголовку сполуки одержували у вигляді білої твердої речовини тим же способом, як і у прикладі 5-1, для якої, однак, (6бромпіридин-2-іл)метанол використовували замість 2-йодопіридину, використаного у прикладі 51. 1 Н-ЯМР (400 МГц, CDCl3) : 8,94 (1Н, с), 7,91 (1H, т, J=7,8 Гц), 7,78 (1H, дд, J=8,0, 0,7 Гц), 7,27 (1Н, д, J=7,8 Гц), 5,76-5,66 (1Н, м), 5,07 (1H, дд, J=10,2, 1,0 Гц), 4,95 (1Н, дд, J=17,1, 1,0 Гц), 4,844,77 (4Н, м), 2,58 (3H, с). + ESI-MS. Знайдено: m/z[M+H] 330. 2) Одержання гідрохлориду 2-аліл-1-{6[(диметиламіно)метил]-2-піридиніл}-6-(метилтіо)1,2-дигідро-3H-піразоло[3,4-d]піримідин-3-ону: 1,16 мл триетиламіну і 0,451 мл метансульфонілхлориду додавали до розчину у тетрагідрофурані (20 мл) 1,37 г сполуки, одержаної на наведеній вище стадії 1, і перемішували протягом 30 хвилин, і потім 6 мл 2,0M розчину диметиламіну у тетрагідрофурані додавали до реакційного рідкого середовища і перемішували протягом 8 годин. Воду додавали до реакційного рідкого середовища і екстрагували етилацетатом. Цей екстракт промивали насиченим сольовим водним розчином, сушили над безводним сульфатом магнію і концентрували при зниженому тиску. 10 мл етилацетату і 53 1,5 мл 4н розчину хлористоводневої кислоти у діоксані додавали до одержаного у результаті залишку, потім розчинник концентрували при зниженому тиску, і залишок кристалізували з метанолу/діетилового ефіру, одержуючи 1,50 г зазначеної у заголовку сполуки у вигляді білої твердої речовини. 1 Н-ЯМР (400 МГц, ДМСО-d6) : 8,17 (1Н, с), 7,36 (1Н, т, J=7,8 Гц), 7,21 (1Н, д, J=7,8 Гц), 6,76 (1Н, д, J=7,3 Гц), 4,92 (1Н, ддт, J=17,1, 10,2, 6,0 Гц), 4,26 (1Н, дд, J=10,2, 1,5 Гц), 4,14 (1Н, дд, J=17,1, 1,5 Гц), 4,00 (2Н, дт, J=6,0, 1,3 Гц), 3,75 (2Н, с), 2,14 (6Н, с), 1,78 (3H, с). + ESI-MS. Знайдено: m/z[M+H] 357. 3) Одержання 2-аліл-1-{6[(диметиламіно)метил]піридин-2-іл}-6-{[4-(4метилпіперазин-1-іл)феніл]аміно}-1,2-дигідро-3Hпіразоло[3,4-d]піримідин-3-ону: 65 мг м-хлорпербензойної кислоти додавали до розчину в Ν,Ν-диметилформаміді (2 мл) 100 мг сполуки, одержаної на наведеній вище стадії 2, і перемішували при кімнатній температурі протягом 15 хвилин. Реакційне рідке середовище промивали водним насиченим розчином гідрокарбонату натрію і сушили над безводним сульфатом натрію. Розчинник видаляли упарюванням при зниженому тиску, одержуючи неочищений 2-аліл-1-{6[(диметиламіно)метил]піридин-2-іл}-6(метилсульфініл)-1,2-дигідро-3H-піразоло[3,4d]піримідин-3-он у вигляді білої твердої речовини. 40 мг 4-(4-метилпіперазин-1-іл)аніліну і 0,1 мл Ν,Ν-діізопропілетиламіну додавали у зазначеному порядку до розчину у диметилсульфоксиді/толуолі (1/10, 10 мл) 40 мг згаданої вище сполуки, і перемішували при 120°С протягом 15 годин. Розчинник видаляли упарюванням при зниженому тиску, туди ж додавали воду, екстрагували етилацетатом і сушили над безводним сульфатом натрію. Розчинник видаляли упарюванням при зниженому тиску, залишок розділяли і очищали за допомогою стандартної колонкової хроматографії на силікагелі (етилацетат), одержуючи 8,4 мг зазначеної у заголовку сполуки у вигляді жовтої твердої речовини. 1 Н-ЯМР (400 МГц, CDCl3) : 8,82 (1Н, с), 7,82 (1H, т, J=7,8 Гц), 7,74 (1H, д, J=7,8 Гц), 7,47 (2H, д, J=8,8 Гц), 7,39 (1Н, д, J=7,3 Гц), 6,92 (2Н, д, J=6,3 Гц), 5,74-5,63 (1Н, м), 5,00 (1Н, дд, J=10,2, 1,0 Гц), 4,89 (1Н, дд, J=17,1, 1,0 Гц), 4,80 (2Н, д, J=5,9 Гц), 3,64 (2Н, с), 3,22 (4Н, т, J=4,9 Гц), 2,64 (4Н, д, J=4,4 Гц), 2,39 (3H, с), 2,34 (6Н, с). + ESI-MS. Знайдено: m/z[M+H] 500. Приклад 9 Одержання 2-аліл-1-[6-(1-гідрокси-1метилетил)піридин-2-іл]-6-{[4-(4-метилпіперазин-1іл)феніл]аміно}-1,2-дигідро-3H-піразоло [3,4d]піримідин-3-ону 96152 54 1) Одержання 2-(6-бром-2-піридиніл)-2пропанолу: В атмосфері азоту 30 мл 3М метилмагніййодиду у діетиловому ефірі додавали до 300 мл розчину у діетиловому ефірі 8,72 г метил 6бромпіридин-2-карбоксилату. Воду і 2н хлористоводневу кислоту додавали до реакційного рідкого середовища, і екстрагували етилацетатом. Цей екстракт промивали водним насиченим розчином гідрокарбонату натрію і насиченим сольовим водним розчином, і сушили над безводним сульфатом магнію. Розчинник видаляли упарюванням при зниженому тиску, одержуючи 8,51 г неочищеного 2-(6-бром-2-піридиніл)-2-пропанолу у вигляді жовтої маслоподібної речовини. 1 Н-ЯМР (400 МГц, CDCl3) : 7,56 (1Н, т, J=7,8 Гц), 7,38 (1Н, дд, J=7,8, 1,0 Гц), 7,36 (1Н, дд, J=7,8, 1,0 Гц), 1,55 (6Н, с). + ESI-MS. Знайдено: m/z[M+H] 216, 218. 2) Одержання 2-аліл-1-[6-(1-гідрокси-1метилетил)-2-піридиніл]-6-(метилтіо)-1,2-дигідро3H-піразоло[3,4-d]піримідин-3-ону: 12,89 г зазначеної у заголовку сполуки одержували тим же способом, як у прикладі 5-1, для якої, однак, сполуку, одержану у наведеній вище реакції, використовували замість 2-йодпіридину, використаного у прикладі 5-1. 1 Н-ЯМР (400 МГц, CDCl3) : 8,95 (1Н, с), 7,91 (1H, т, J=8,0 Гц), 7,76 (1H, д, J=7,3 Гц), 7,40 (1Н, дд, J=7,8, 1,0 Гц), 5,70 (1Н, ддт, 3=17,1, 10,2, 6,3 Гц), 5,06 (1Н, дд, J=10,2, 1,0 Гц), 4,93 (1Н, дд, 3=17,1, 1,2 Гц), 4,81 (2Н, д, 3=6,3 Гц), 2,59 (4Н, с), 1,59 (6Н, с). + ESI-MS. Знайдено: m/z[M+H] 358. 3) Одержання 2-аліл-1-[6-(1-гідрокси-1метилетил)піридин-2-іл]-6-{[4-(4-метилпіперазин-1іл)феніл]аміно}-1,2-дигідро-3H-піразоло[3,4d]піримідин-3-ону: 817 мг м-хлорпербензойної кислоти (>65%) додавали до розчину у толуолі (20 мл) 1,10 г одержаного вище продукту і перемішували протягом 20 хвилин. 1,61 мл Ν,Ν-діізопропілетиламіну і 706 мг 4-(4-метилпіперазин-1-іл)аніліну додавали до реакційного рідкого середовища і перемішували протягом ночі. Водний насичений розчин гідрокарбонату натрію додавали до реакційного рідкого середовища, екстрагували етилацетатом, промивали насиченим сольовим водним розчином і сушили над безводним сульфатом магнію. Розчинник видаляли упарюванням і залишок очищали за допомогою стандартної колонкової хроматографії на силікагелі (гексан/етилацетат = від 1/1 до 0/1, етилацетат/етанол = 98/2). Після концентрування проводили перекристалізацію з етилацетату, одержуючи 1,20 г зазначеної у заголовку сполуки у вигляді жовтої твердої речовини. 55 Н-ЯМР (400 МГц, CDCl3) : 8,83 (1Н, с), 7,86 (1Н, дд, J=8,0, 7,8 Гц), 7,75 (1Н, д, 3=7,3 Гц), 7,49 (1Н, ушир.с), 7,48 (2Н, д, J=9,0 Гц), 7,34 (1Н, д, 3=1 А Гц), 6,93 (2Н, д, J=9,0 Гц), 5,70 (1Н, ддт, 3=17,2, 10,0, 6,5 Гц), 5,04 (1Н, д. J=10,0 Гц), 4,94 (1Н, д, 3=17,2 Гц), 4,74 (2Н, д, J=6,5 Гц), 3,26 (4Н, т, J=4,8 Гц), 2,73 (4Н, ушир.с), 2,44 (3H, с), 1,59 (6Н, с). + ESI-MS. Знайдено: m/z[M+H] 501. Приклад 10 Одержання 2-аліл-6-{[4-(4-етилпіперазин-1іл)феніл]аміно}-1-[6-(1-гідрокси-1метилетил)піридин-2-іл]-1,2-дигідро-3Hпіразоло[3,4-d]піримідин-3-ону 50,3 мг зазначеної у заголовку сполуки одержували у вигляді жовтої твердої речовини тим же способом, як і у прикладі від 9-1 до 9-3, для якої, однак, 4-(4-етил-1-піперазиніл)анілін використовували замість 4-(4-метилпіперазин-1-іл)аніліну, використаного у прикладі 9-3. 1 Н-ЯМР (400 МГц, CDCl3) : 8,83 (1Н, с), 7,85 (1H, т, J=7,8 Гц), 7,76 (1Н, д, J=7,8 Гц), 7,46 (2Н, д, J=8,8 Гц), 7,34 (1Н, д, J=8,3 Гц), 6,93 (2Н, д, J=8,8 Гц), 5,76-5,64 (1Н, м), 5,04 (1Н, дд, J=10,2, 1,0 Гц), 4,94 (1Н дд, J=17,1, 1,0 Гц), 4,75 (2Н, д, J=6,3 Гц), 4,00 (1Н, ушир.с), 3,23 (4Н, т, J=4,9 Гц), 2,65 (4Н, т, J=4,9 Гц), 2,51 (2Н, кв, J=7,3 Гц), 1,59 (6Н, с), 1,16 (3H, т, J=7,3 Гц). + ESI-MS. Знайдено: m/z[M+H] 515. Приклад 11 Одержання 6-{[4-(4-ацетилпіперазин-1іл)феніл]аміно}-2-аліл-1-[6-(1-гідрокси-1метилетил)піридин-2-іл]-1,2-дигідро-3Hпіразоло[3,4-d]піримідин-3-ону 66,4 мг зазначеної у заголовку сполуки одержували у вигляді жовтої твердої речовини тим же способом, як і у прикладі від 9-1 до 9-3, для якої, однак, 4-(4-ацетил-1-піперазиніл)анілш використовували замість 4-(4-метилпіперазин-1-іл)аніліну, використаного у прикладі 9-3. 1 Н-ЯМР (400 МГц, CDCl3) : 8,84 (1Н, с), 7,87 (1H, т, J=7,8 Гц), 7,74 (1H, д, J=8,8 Гц), 7,50 (2H, д, J=8,8 Гц), 7,36 (1Н, д, J=8,3 Гц), 6,94 (2Н, д, J=8,8 Гц), 5,76-5,65 (1Н, м), 5,04 (1Н, д, J=10,2 Гц), 4,94 (1Н, д, J=17,1 Гц), 4,74 (2Н, д, J=5,9 Гц), 4,03-3,95 (1Н, м), 3,80 (2Н, т, J=4,9 Гц), 3,65 (2Н, т, J=5,1 Гц), 3,17 (2Н, т, J=4,9 Гц), 3,14 (2Н, т, J=5,1 Гц), 2,16 (3H, с), 1,59 (6Н, с). + ESI-MS. Знайдено: m/z[M+H] 529. Приклад 12 Одержання 2-аліл-6-({4-[4-(2гідроксіетил)піперазин-1-іл]феніл}аміно)-1-[6-(1гідрокси-1-метилетил)піридин-2-іл]-1,2-дигідро-3Hпіразоло[3,4-d]піримідин-3-ону 40 мг зазначеної у заголовку сполуки одержували у вигляді жовтої твердої речовини тим же способом, як і у прикладі від 9-1 до 9-3, для якої, однак, 2-[4-(4-амінофеніл)-1-піперазиніл]етанол використовували замість 4-(4-метилпіперазин-1іл)аніліну, використаного у прикладі 9-3. 1 Н-ЯМР (400 МГц, CDCl3) : 8,83 (1Н, с), 7,86 (1H, т, J=7,8 Гц), 7,75 (1H, д, J=7,8 Гц), 7,47 (2H, д, J=8,8 Гц), 7,34 (1Н, д, J=8,3 Гц), 6,93 (2Н, д, J=8,8 Гц), 5,76-5,65 (1Н, м), 5,04 (1Н, д, J=10,2 Гц), 4,94 (1Н, д, J=17,1 Гц), 4,74 (2Н, д, J=6,3 Гц), 4,03-3,95 (1Н, м), 3,69 (2Н, т, J=5,1 Гц), 3,22 (4Н, т, J=4,9 Гц), 1 96152 56 2,73 (4Н, т, J=4,6 Гц), 2,65 (2Н, т, J=5,4 Гц), 1,59 (6Н, с). + ESI-MS. Знайдено: m/z[M+H] 531. Приклад 13 Одержання 2-аліл-1-[6-(1гідроксициклобутил)піридин-2-іл]-6-{[4-(4метилпіперазин-1-iл)феніл]аміно}-1,2-дигідро-3Hпiразоло[3,4-d]піримiдин-3-ону 1) Одержання 1-(6-бром-2піримідиніл)циклобутанолу: В атмосфері азоту при -10°С додавали по краплях 10,8 мл 2,66М розчину н-бутиллітію у гексані до 16 мл 0,9М розчину н-бутилмагнійхлориду у тетрагідрофурані, і туди ж додавали розчин у толуолі (60 мл) 9,48 г 2,6-дибромпіридину по краплях при 0°С або нижче. Реакційне рідке середовище перемішували протягом 1,5 години, потім охолоджували у бані з сухим льодом в ацетоні і 5,0 г циклобутанону додавали туди ж при -50°С або нижче. Після перемішування протягом 10 хвилин додавали воду і 2н хлористоводневу кислоту до реакційного рідкого середовища, і органічний шар відділяли, промивали водним насиченим розчином гідрокарбонату натрію і насиченим сольовим водним розчином, і потім сушили над безводним сульфатом магнію. Після концентрування при зниженому тиску залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат = від 20/1 до 4/1), одержуючи 5,30 г зазначеної у заголовку сполуки у вигляді жовтої маслоподібної речовини. 1 Н-ЯМР (400 МГц, CDCl3) : 7,60 (1Н, т, J=7,8 Гц), 7,52 (1Н, дд, J=7,8, 1,0 Гц), 7,40 (1Н, дд, J=7,8, 1,0 Гц), 2,53-2,48 (4Н, м), 2,12-2,01 (1Н, м), 1,911,82 (1Н, м). + ESI-MS. Знайдено: m/z[M+H] 228, 230. 2) Одержання 2-аліл-1-[6-(1гідроксициклобутил)-2-піридиніл]-6-(метилтіо)-1,2дигідро-3H-піразоло[3,4-d]піримідин-3-ону: 1,44 г зазначеної у заголовку сполуки одержували тим же способом, як і у прикладі 9-2, для якої, однак, сполуку, одержану у наведеній вище реакції, використовували замість 2-(6-бром-2піридиніл)-2-пропанолу, використаного у прикладі 9-2. 1 Н-ЯМР (400 МГц, CDCl3) : 8,94 (1Н, с), 7,95 (1Н, т, J=8,0 Гц), 7,77 (1Н, д, J=7,8 Гц), 7,54 (1Н, д, J=7,8 Гц), 5,70 (1Н, ддт, J=17,1, 10,2, 6,3 Гц), 5,07 (1Н, д, J=10,2 Гц), 4,94 (1Н, д, J=17,1 Гц), 4,80 (2Н, д, J=6,3 Гц), 2,58 (3H, с), 2,56-2,50 (4Н, м), 2,152,03 (1Н, м), 1,97-1,84 (1Н, м). + ESI-MS. Знайдено: m/z[M+H] 370. 3) Одержання 2-аліл-1-[6-(1гідроксициклобутил)піридин-2-іл]-6-{[4-(4метилпіперазин-1-іл)феніл]аміно}-1,2-дигідро-3Hпіразоло[3,4-d]піримідин-3-ону: 80,8 мг зазначеної у заголовку сполуки одержували у вигляді жовтої твердої речовини таким же способом, як і у прикладі 9-3, для якої, однак, сполуку, одержану у наведеній вище реакції, використовували замість 2-аліл-1-[6-(1-гідрокси-1метилетил)-2-піридиніл]-6-(метилтіо)-1,2-дигідро3H-піразоло[3,4-d]піримідин-3-ону, використаного у прикладі 9-3. 57 Н-ЯМР (400 МГц, CDCl3) : 8,83 (1Н, с), 7,90 (1Н, т, J=7,8 Гц), 7,77 (1H, д, J=7,8 Гц), 7,48 (2H, дд, J=12,2, 8,3 Гц), 7,48 (1Н, ушир.с), 6,93 (2Н, д, J=9,3 Гц), 5,70 (1Н, тдд, J=5,9, 17,1, 10,0 Гц), 5,04 (1Н, дд, J=10,0, 1,2 Гц), 4,94 (1Н, дд, J=17,1, 1,0 Гц), 4,73 (2Н, д, J=5,9 Гц), 4,20 (1Н, с), 3,24 (4Н, т, J=4,6 Гц), 2,65 (4Н, ушир.с), 2,53 (4Н, т, J=8,0 Гц), 2.41 (3H, с), 2,14-2,06 (1Н, м), 1,96-1,84 (1Н, м). + ESI-MS. Знайдено: m/z[M+H] 513. Приклад 14 Одержання 2-аліл-1-[6-(2-гідрокси-2метилпропіл)піридин-2-іл]-6-{[4-(4-метилпіперазин1-іл)феніл]аміно}-1,2-дигідро-3H-піразоло[3,4d]піримідин-3-ону 1) Одержання 1-(6-бромпіридин-2-іл)-2метилпропан-2-олу: В атмосфері азоту 400 мл тетрагідрофурану, що містить 31 мл діізопропіламіну, охолоджували у бані з сухим льодом в ацетоні і 82,7 мл 2,66М розчину н-бутиллітію у гексані додавали туди ж, і 50 мл тетрагідрофурану, що містить 34,4 г 6бромпіколіну, по краплях додавали туди ж при 70°С або нижче. Після додавання 29,4 мл ацетону додавали туди ж при -60°С або нижче. Після ι перемішування протягом 35 хвилин додавали воду до реакційного рідкого середовища і органічний розчинник концентрували при зниженому тиску. Цей концентрат екстрагували діетиловим ефіром, промивали насиченим сольовим водним розчином і сушили над безводним сульфатом магнію. Після концентрування при зниженому тиску залишок очищали за допомогою перегонки, одержуючи 27,60 г зазначеної у заголовку сполуки у вигляді безбарвної маслоподібної речовини. 1 Н-ЯМР (400 МГц, CDCl3) : 7,50 (1Н, т, J=7,6 Гц), 7,37 (1H, д, J=7,8 Гц), 7,12 (1Н, д, J=7,8 Гц), 2,91 (2Н, с), 1,23 (6Н, с). + ESI-MS. Знайдено: m/z[M+H] : 230, 232. 2) Одержання 2-аліл-1-[6-(2-гідрокси-2метилпропіл)піридин-2-іл]-6-(метилтіо)-1,2-дигідро3H-піразоло[3,4-d]піримідин-3-ону: 20,70 г зазначеної у заголовку сполуки одержували тим же способом, як і у прикладі 9-2, для якої, однак, сполуку, одержану у вказаній вище реакції, ι використовували замість 2-(6-бром-2піридиніл)-2-пропанолу, використаного у прикладі 9-2. 1 Н-ЯМР (400 МГц, CDCl3) : 8,93 (1Н, с), 7,84 (1Н, т, J=7,8 Гц), 7,71 (1H, д, J=8,3 Гц), 7,15 (1Н, д, J=7,3 Гц), 5,67 (1Н, ддт, J=16,8, 10,2, 6,3 Гц), 5,05 (1Н, дд, J=10,2, 1,0 Гц), 4,93 (1Н, дд, J=16,8, 1,2 Гц), 4,77 (2Н, д, J=6,3 Гц), 2,97 (2Н, с), 2,58 (3H, с), 1,25 (6Н, с). + ESI-MS. Знайдено: m/z[M+H] 372. 3) Одержання 2-аліл-1-[6-(2-гідрокси-2метилпропіл)піридин-2-іл]-6-{[4-(4-метилпіперазин1-іл)феніл]аміно}-1,2-дигідро-3H-піразоло[3,4d]піримідин-3-ону: 1,06 г зазначеної у заголовку сполуки одержували у вигляді жовтої твердої речовини таким же способом, як і у прикладі 9-3, для якої, однак, сполуку, одержану у наведеній вище реакції, використовували замість 2-аліл-1-[6-(1-гідрокси-1метилетил)-2-піридиніл]-6-(метилтіо)-1,2-дигідро1 96152 58 3H-піразоло[3,4-d]піримідин-3-ону, використаного у прикладі 9-3. 1 Н-ЯМР (400 МГц, CDCl3) : 8,82 (1Н, с), 7,79 (1Н, т, J=7,8 Гц), 7,66 (1H, ушир.с), 7,45 (2H, д, J=8,8 Гц), 7,08 (1Н, д, J=7,8 Гц), 6,93 (2Н, д, J=8,8 Гц), 5,78-5,62 (1Н, м), 5,13-4,94 (2Н, м), 4,63 (2Н, с), 3,23 (4Н, т, J=4,6 Гц), 2,98 (2Н, с), 2,64 (4Н, c), 2,40 (3H, с), 1,24 (6Н, с). + ESI-MS. Знайдено: m/z[M+H] 515. Приклад 15 Одержання 2-аліл-1-[6-(2-гідрокси-2метилпропіл)піридин-2-іл]-6-{[4-(1-метилпіперидин4-іл)феніл]аміно}-1,2-дигідро-3H-піразоло[3,4d]піримідин-3-ону 36,8 мг зазначеної у заголовку сполуки одержували у вигляді жовтої твердої речовини таким же способом, як і у прикладі з 14-1 по 14-3, для якої, однак, 4-(1-метилпіперидин-4-іл)анілін використовували замість 4-(4-метилпіперазин-1іл)аніліну, використаного у прикладі 14-3. 1 Н-ЯМР (400 МГц. CDCl3) : 8,85 (1Н, с), 7,897,76 (2H, ушир.м), 7,80 (1Н, т, J=7,8 Гц), 7,52 (2Н, д, J=8,3 Гц), 7,22 (2Н, д, J=8,3 Гц), 7,10 (1Н, д, J=7,8 Гц), 5,77-5,64 (1Н, ушир.м), 5,08 (1Н, д, J=9,8 Гц), 5,01 (1Н, д, J=17,6 Гц), 4,71-4,58 (2Н, ушир.м), 3,05 (2Н, д, J=11,2 Гц), 2,99 (2Н, с), 2,56-2,45 (1Н, м), 2,38 (3H, с), 2,21-2,07 (2Н, м), 1,95-1,81 (4Н, м), 1,24 (6Н, с). + ESI-MS. Знайдено: m/z[M+H] 514. Приклад 16 Одержання 2-аліл-1-[6-(2-гідрокси-1,1,2триметилпропіл)піридин-2-іл]-6-{[4-(4метилпіперазин-1-іл)феніл]аміно}-1,2-дигідро-3Hпіразоло[3,4-d]піримідин-3-ону 1) Одержання 2-(6-бромпіридин-2-іл)-2метилпропіонату: В атмосфері азоту 100 мл тетрагідрофурану, що містить 14 мл діізопропіламіну, охолоджували у бані з сухим льодом в ацетоні, і 38 мл 2,66М розчину н-бутиллітію у гексані додавали туди ж для одержання діізопропіламіду літію. Цей одержаний розчин по краплях додавали до 100 мл тетрагідрофурану, що містить 4,55 мл 6-бромпіколіну і 6,06 мл діетилкарбонату, при -60°С або нижче. Після перемішування протягом 20 хвилин 6,23 мл метилйодиду додавали туди ж і підігрівали до кімнатної температури. Воду додавали до реакційного рідкого середовища, екстрагували діетиловим ефіром, промивали насиченим сольовим водним розчином і сушили над безводним сульфатом магнію. Після концентрування при зниженому тиску залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат = від 100/0 до 8/1), одержуючи 10,72 г зазначеної у заголовку сполуки у вигляді безбарвної маслоподібної речовини. 1 Н-ЯМР (400 МГц, CDCl3) : 7,49 (1Н, т, J=7,8 Гц), 7,33 (1Н, дд, J=7,8, 1,0 Гц), 7,22 (1H, дд, J=7,8, 1,0 Гц), 4,16 (2H, кв, J=7,0 Гц), 1,59 (6Н, с), 1,20 (3H, т, J=7,1 Гц), 0,00 (1Н, д, J=3,4 Гц). + ESI-MS. Знайдено: m/z[M+H] 272, 274. 2) Одержання 3-(6-бромпіридин-2-іл)-2,3диметилбутан-2-олу: В атмосфері азоту 13 мл 2М розчину метилмагніййодиду у діетиловому ефірі додавали до роз 59 чину у діетиловому ефірі (20 мл) 2,72 г етил 2-(6бромпіридин-2-іл)-2-метилпропіонату, при цьому використовуючи охолодження льодяною банею. Реакційне рідке середовище перемішували при кімнатній температурі протягом 3 годин, і потім туди додавали воду і водний 10% розчин фосфорної кислоти, екстрагували діетиловим ефіром, промивали водним насиченим розчином гідрокарбонату натрію і насиченим сольовим водним розчином, потім сушили над безводним сульфатом магнію. Після концентрування при зниженому тиску залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат = від 9/1 до 8/1), одержуючи 1,47 г зазначеної у заголовку сполуки у вигляді безбарвної маслоподібної речовини. 1 Н-ЯМР (400 МГц, CDCl3) : 7,53 (1Н, т, J=7,8 Гц), 7,35 (1Н, д, J=7,3 Гц), 7,31 (1Н, д, J=7,8 Гц), 1,38 (6Н, с), 1,09 (6Н, с). + ESI-MS. Знайдено: m/z[M+H] 258, 260. 3) Одержання 2-аліл-1-[6-(2-гідрокси-1,1,2триметилпропіл)піридин-2-іл]-6-{[4-(4метилпіперазин-1-іл)феніл]аміно}-1,2-дигідро-3Hпіразоло[3,4-d]піримідин-3-ону: 74,5 мг зазначеної у заголовку сполуки одержували у вигляді жовтої твердої речовини таким же способом, як і у прикладі з 9-2 по 9-3, в якій, однак, сполуку, одержану у вказаній вище реакції, використовували замість 2-(6-бром-2-піридил)-2пропанолу, використаного у прикладі 9-2. 1 Н-ЯМР (400 МГц, CDCl3) : 8,82 (1Н, с), 7,81 (1Н, т, J=7,9 Гц), 7,81 (1Н, ушир.с), 7,45 (2Н, д, J=8,4 Гц), 7,30 (1Н, с), 6,93 (2Н, д, J=9,2 Гц), 5,71 (1Н, с), 5,08 (2Н, с), 4,63 (2Н, с), 3,24 (4Н, с), 2,66 (4Н, с), 2,41 (3H, с), 1,47 (6Н, с), 1,09 (6Н, с). + ESI-MS. Знайдено: m/z[M+H] 543. Приклад 17 Одержання 2-аліл-6-{[4-(4-метилпіперазин-1іл)феніл]аміно}-1-[6-(2-оксопіролідин-1-іл)піридин2-іл]-1,2-дигідро-3H-піразоло[3,4-d]піримідин-3-ону При охолодженні льодом 0,012 мл триетиламіну і 12,4 мг хлорангідриду 4-хлормасляної кислоти додавали до розчину у тетрагідрофурані (1 мл) 20 мг сполуки, одержаної у прикладі 7, 2-аліл1-(6-амінопіридин-2-іл)-6-{[4-(4-метилпіперазин-1іл)феніл]аміно}-1,2-дигідро-3H-піразоло[3,4d]піримідин-3-ону, і перемішували при кімнатній температурі протягом 1 години. Воду додавали до реакційної суміші, екстрагували хлороформом і органічний шар промивали насиченим сольовим водним розчином, і сушили над безводним сульфатом натрію. Розчинник видаляли упарюванням при зниженому тиску, одержаний у результаті залишок розчиняли в 1 мл Ν,Ν-диметилформаміду і туди ж додавали 5 мг трет-бутоксиду калію, і перемішували при кімнатній температурі протягом 30 хвилин. До реакційної суміші додавали насичений розчин хлориду амонію, екстрагували етилацетатом і органічний шар промивали насиченим сольовим розчином, і сушили над безводним сульфатом натрію. Розчинник видаляли упарюванням при зниженому тиску і одержаний у результаті залишок очищали за допомогою препаративної тонкошарової хроматографії (хлороформ/метанол = 10/1), 96152 60 одержуючи 5 мг зазначеної у заголовку сполуки у вигляді жовтої твердої речовини. 1 Н-ЯМР (400 МГц, CDCl3) : 8,82 (1Н, с), 8,34 (1H, д, J=8,0 Гц), 7,85 (1Н, т, J=8,0 Гц), 7,58 (1H, д, J=8,0 Гц), 7,49-7,34 (1Н, ушир.м), 7,46 (2Н, д, J=8,8 Гц), 6,92 (2Н, д, J=8,8 Гц), 5,68 (1Н, ддт, J=17,1, 10,2, 5,9 Гц), 5,04 (1Н, дд, J=10,2, 1,0 Гц), 4,94 (1Н, дд, J=17,1, 1,0 Гц), 4,76 (2Н, д, J=5,9 Гц), 4,13-4,04 (2Н, м), 3,30-3,20 (4Н, м), 2,76-2,61 (6Н, м), 2,42 (3H, с), 2,21-2,09 (2Н, м). + ESI-MS. Знайдено: m/z[M+H] 526. Приклад 18 Одержання N-{[6-(2-аліл-6-{[4-(4метилпіперазин-1-іл)феніл]аміно}-3-оксо-1,2дигідро-3H-піразоло[3,4-d]піримідин-1-іл)піридин-2іл]метил}-N-метилметансульфонаміду 1) Одержання 2-аліл-1-[6(гідроксиметил)піридин-2-іл]-6-{[4-(4метилпіперазин-1-іл)феніл]аміно}-1,2-дигідро-3Hпіразоло[3,4-d]піримідин-3-ону: 1,36 г імідазолу і 1,81 г третбутил(хлор)диметилсилану додавали до розчину в Ν,Ν-диметилформаміді (30 мл) 3,29 г сполуки, одержаної у прикладі 8-1, і перемішували протягом ночі. Воду додавали до реакційного рідкого середовища і екстрагували діетиловим ефіром. Цей екстракт промивали насиченим сольовим водним розчином і сушили над безводним сульфатом магнію. Після концентрування при зниженому тиску одержаний у результаті залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат = від 9/1 до 4/1), і розчинник видаляли упарюванням при зниженому тиску. 40 мл толуолу і 3,20 г м-хлорпербензойної кислоти (>65%) додавали до залишку і перемішували протягом 30 хвилин. 5,20 мл Ν,Ν-діізопропілетиламіну і 2,29 г 4-(4-метилпіперазин-1-іл)аніліну додавали до реакційного рідкого середовища і перемішували протягом ночі. Водний насичений розчин гідрокарбонату натрію додавали до реакційного рідкого середовища і екстрагували етилацетатом. Цей екстракт сушили над безводним сульфатом магнію, розчинник видаляли упарюванням, залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/етанол = від 100/1 до 100/3), і розчинник видаляли упарюванням при зниженому тиску. 50 мл 4н хлористоводневої кислоти додавали до залишку і перемішували, і потім розчин підлуговували за допомогою 4н водного розчину гідроксиду натрію. Цей розчин екстрагували змішаним розчином хлороформ/ізопропанол (80/20), сушили над безводним сульфатом магнію, розчинник видаляли упарюванням і залишок кристалізували з етилацетату, одержуючи 3,78 г зазначеної у заголовку сполуки у вигляді жовтої кристалічної речовини. 1 Н-ЯМР (400 МГц, CDCl3) : 8,83 (1Н, с), 7,86 (1H, т, J=6,0 Гц), 7,75 (1Н, д, J=8,2 Гц), 7,46 (2H, д, J=8,6 Гц), 7,40 (1Н, ушир.с), 7,22 (1Н, д, J=7,6 Гц), 6,92 (2Н, д, J=9,0 Гц), 5,71 (1Н, ддт, J=16,8, 10,2, 5,9 Гц), 5,06 (1Н, д, J=10,2 Гц), 4,96 (1Н, д, J=16,8 Гц), 4,81 (2Н, д, J=5,5 Гц), 4,71 (1Н, д, J=5,9 Гц), 3,23 (4Н, ушир.с), 3,14 (1Н, т, J=5,5 Гц), 2,64 (4Н, ушир.с), 2,40 (3H, с). + ESI-MS. Знайдено: m/z[M+H] 473.
ДивитисяДодаткова інформація
Назва патенту англійськоюDihydropyrazolopyrimidinone derivatives
Автори англійськоюSakamoto Toshiro, Sunami Satoshi, Yamamoto Fuyuki, Niiyama Kenji, Bamba Makoto, Takahashi Keiji, Furuyama Hidetomo, Sagara Takeshi, Otsuki Sachie, Nishibata Toshihide, Yoshizumi Takashi, Hirai Hiroshi
Назва патенту російськоюПроизводные дигидропиразолопиримидинона
Автори російськоюСакамото Тосихиро, Сунами Сатоси, Ямамото Фуюки, Ниияма Кендзи, Бамба Макото, Такахаси Кейдзи, Фуруяма Хидетомо, Сагара Такеси, Отсуки Сатие, Нисибата Тосихиде, Йосизуми Такаси, Хираи Хироси
МПК / Мітки
МПК: A61K 31/519, A61P 35/00, C07D 487/04, A61P 43/00
Мітки: похідні, дигідропіразолопіримідинону
Код посилання
<a href="https://ua.patents.su/33-96152-pokhidni-digidropirazolopirimidinonu.html" target="_blank" rel="follow" title="База патентів України">Похідні дигідропіразолопіримідинону</a>
Попередній патент: Конструкція для приєднання хвостовика
Наступний патент: Біоцидний картридж
Випадковий патент: Картридж-іонізатор установки для очищення питної води