Спосіб лікування дефіциту уваги з гіперактивністю (adhd) та застосування 4-[2-(4-метилфенілсульфаніл)феніл]піперидину для виробництва лікарського засобу
Формула / Реферат
1. Спосіб лікування дефіциту уваги з гіперактивністю (ADHD), при якому вводять пацієнтові, який потребує цього, терапевтично ефективну кількість 4-[2-(4-метилфенілсульфаніл)феніл]піперидину і його кислотно-адитивних солей (сполука І).
2. Спосіб за п. 1, де сполука І являє собою адитивну сіль НВr.
3. Спосіб за п. 2, де сполука І характеризується піками на порошковій рентгенограмі (XRPD) при приблизно 6,08, 14,81, 19,26 і 25,38°2q.
4. Спосіб за будь-яким з пп. 1-3, де сполуку І вводять в дозі 5-60 мг/день.
5. Застосування 4-[2-(4-метилфенілсульфаніл)феніл]піперидину і його кислотно-адитивних солей (сполука І) для виробництва лікарського засобу для лікування дефіциту уваги з гіперактивністю (ADHD).
6. Застосування за п. 5, де сполука І являє собою адитивну сіль НВr.
7. Застосування за п. 6, де сполука І характеризується піками на порошковій рентгенограмі (XRPD) при приблизно 6,08, 14,81, 19,26 і 25,38°2q.
8. Застосування за будь-яким з пп. 5-7, де вказаний лікарський засіб призначений для введення в дозі 5-60 мг/день.
Текст
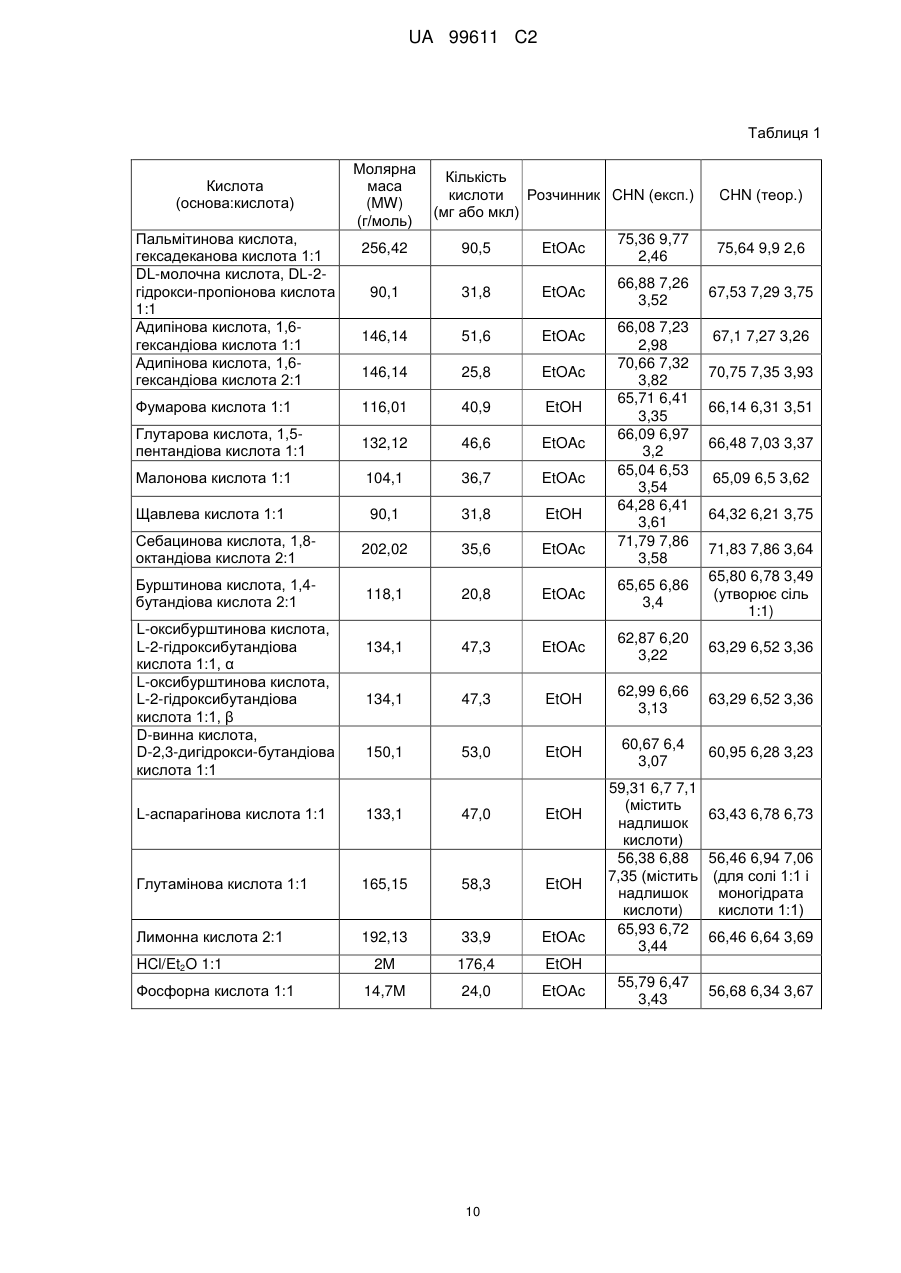
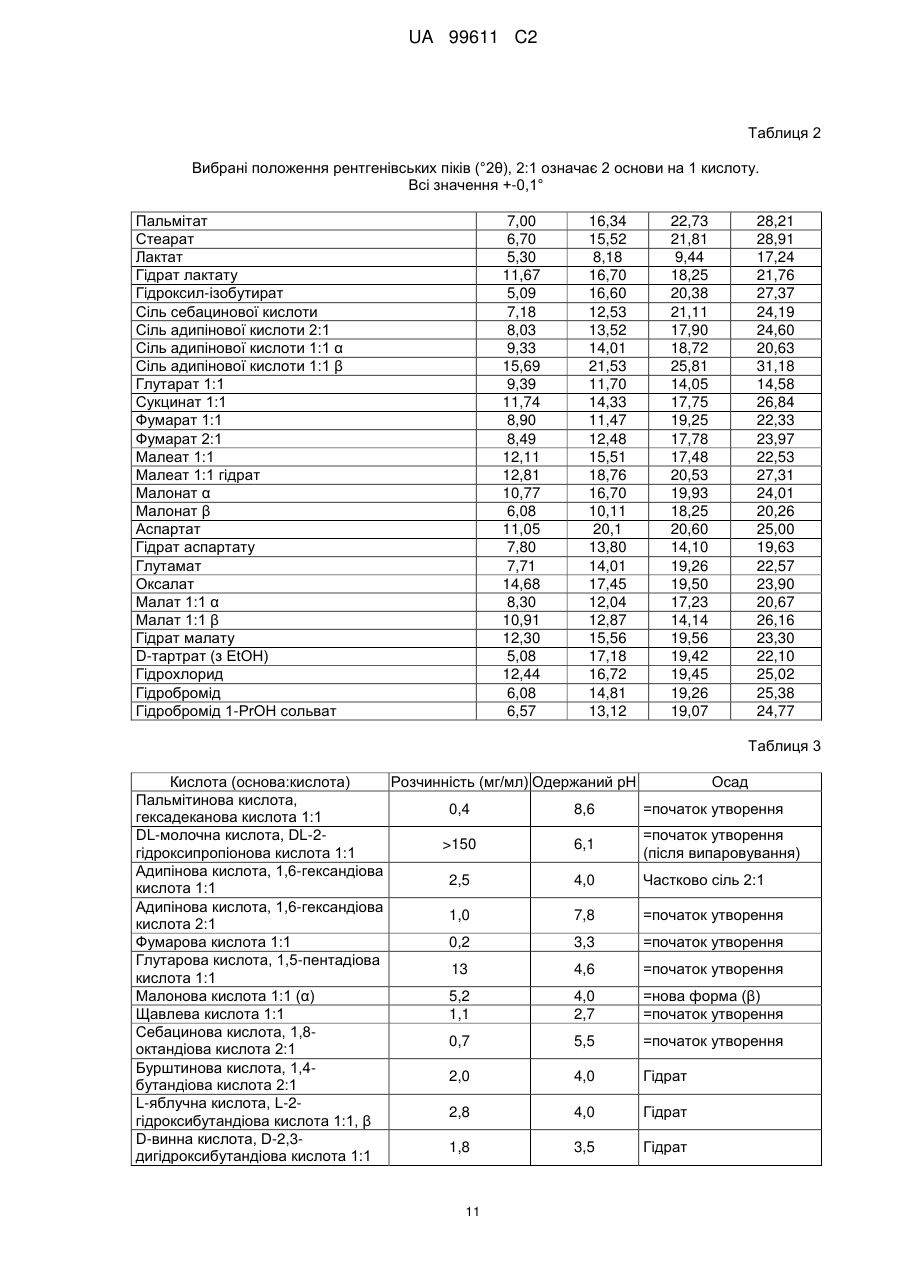
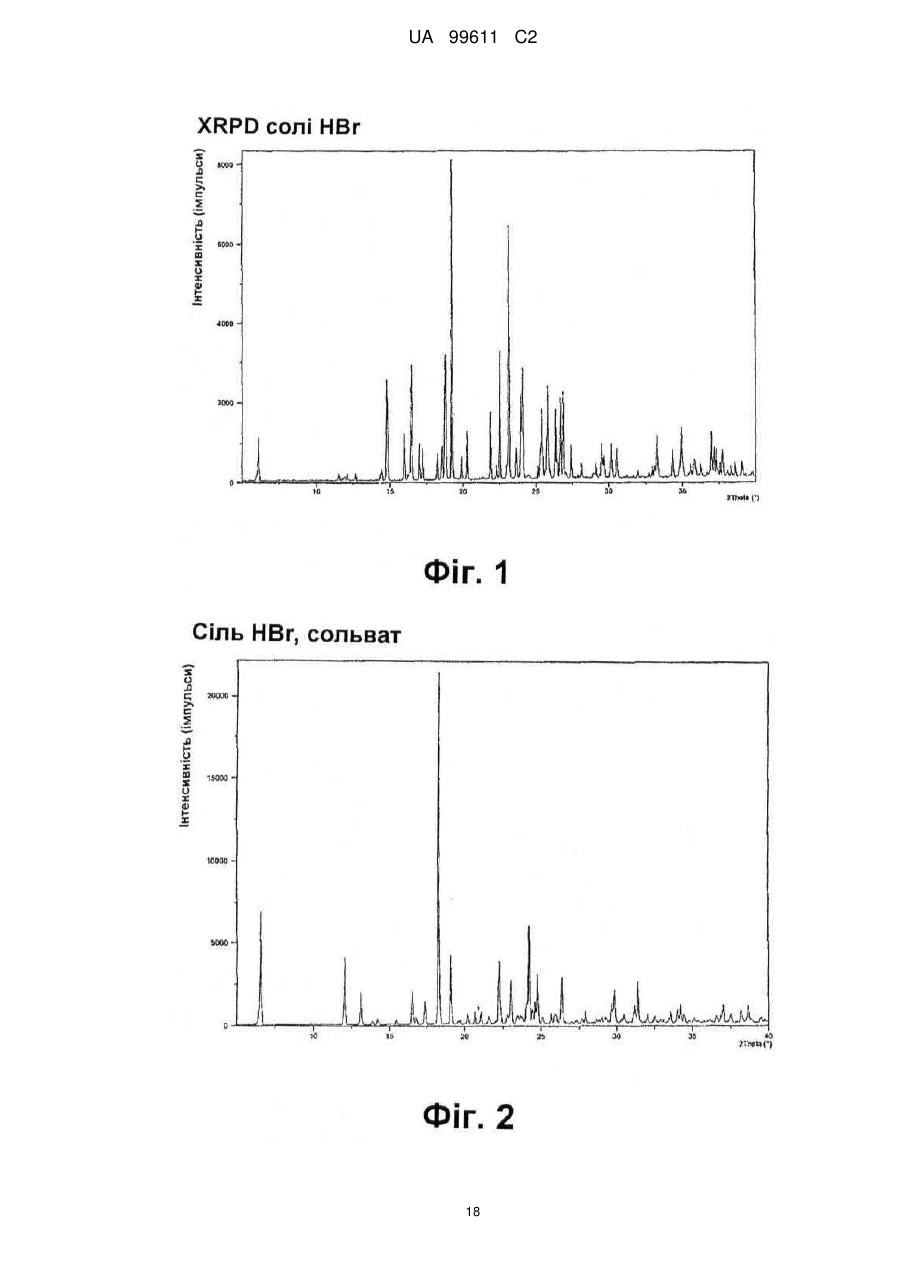
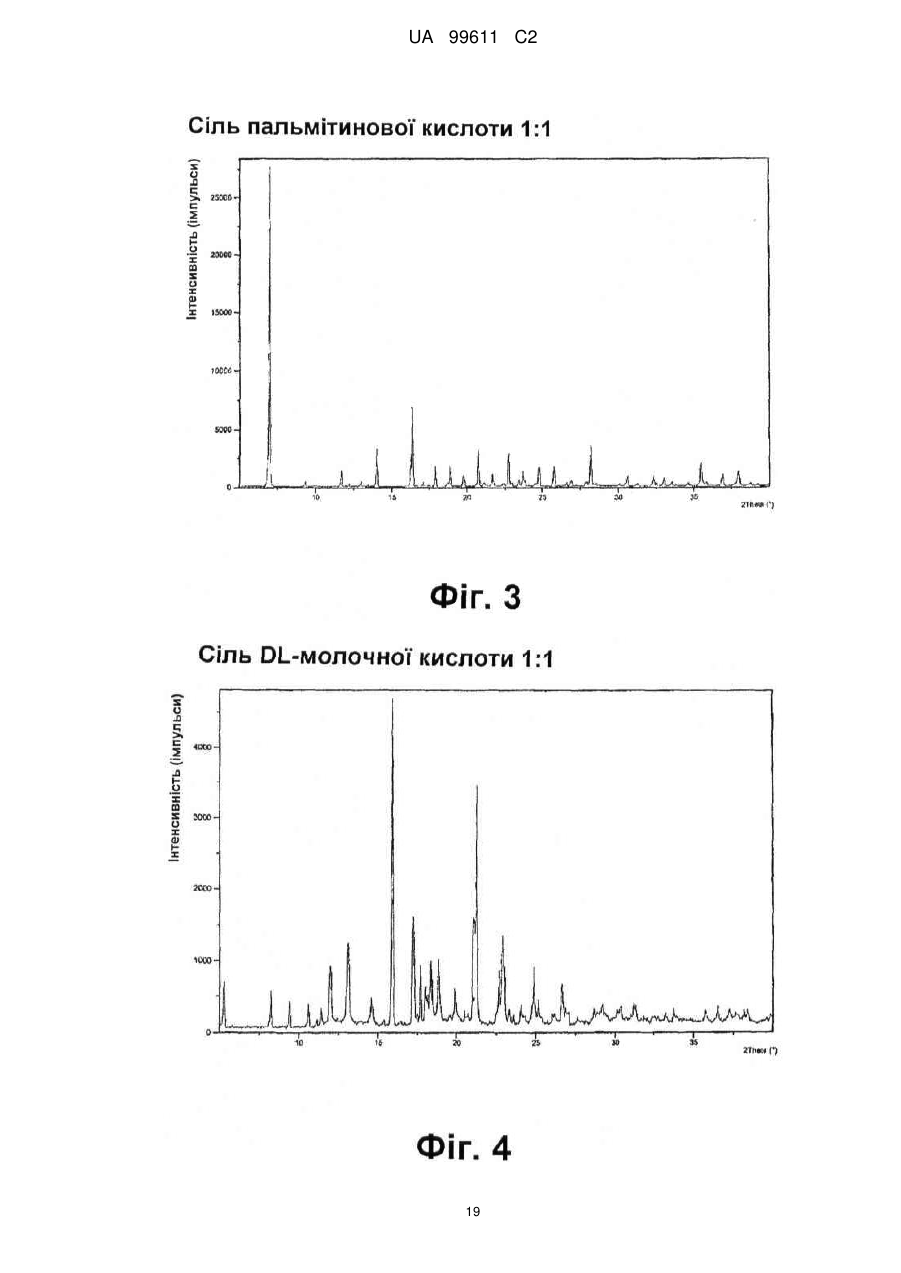
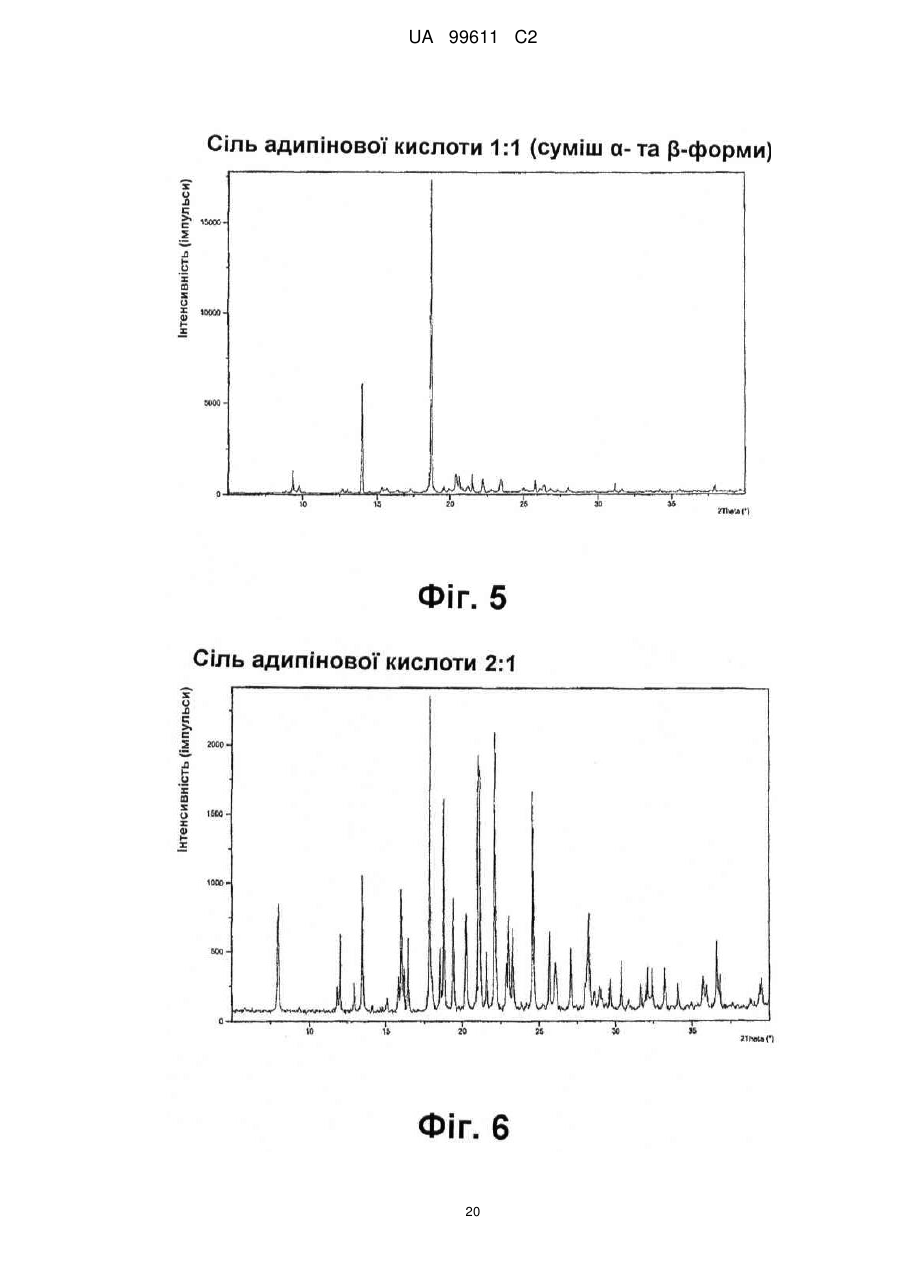
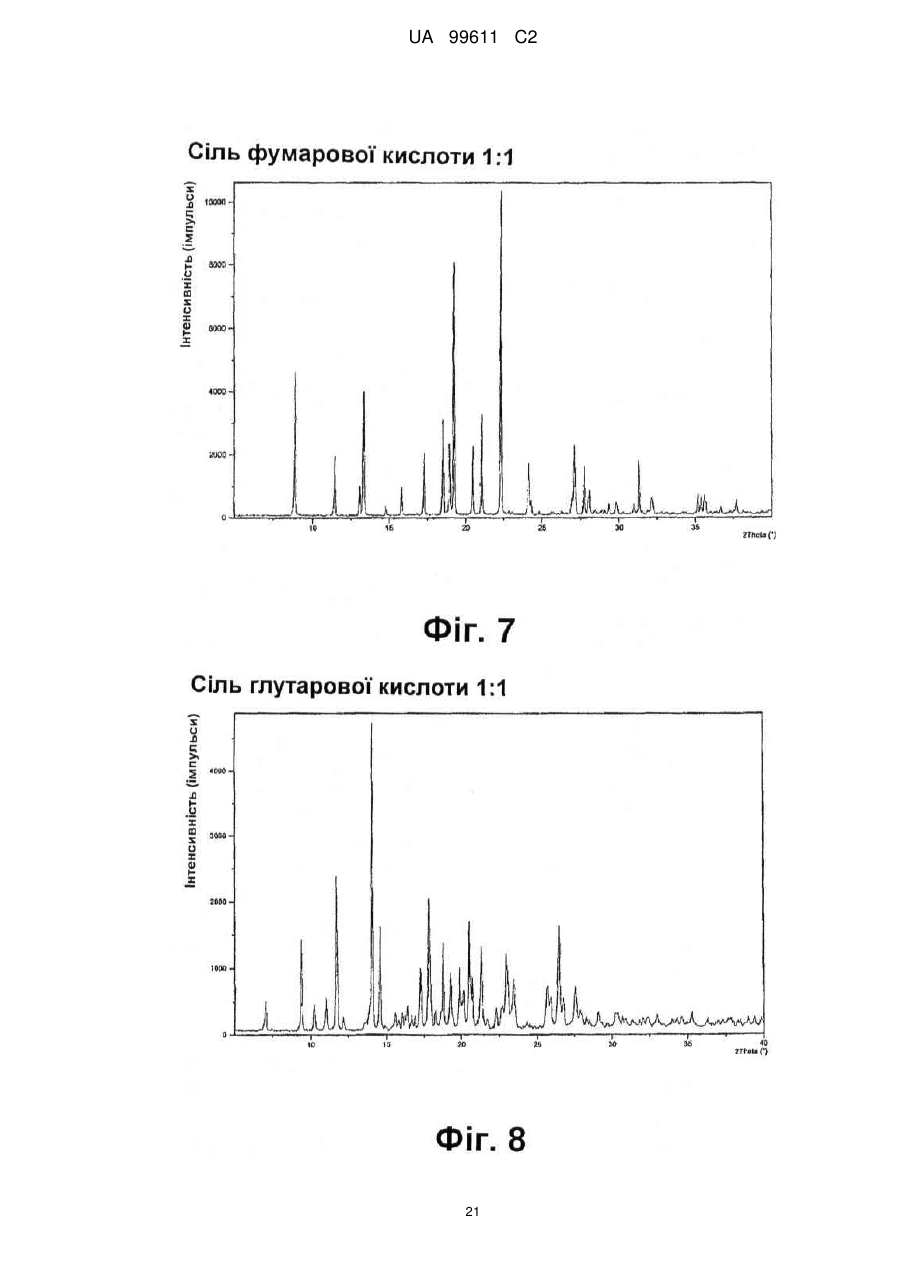
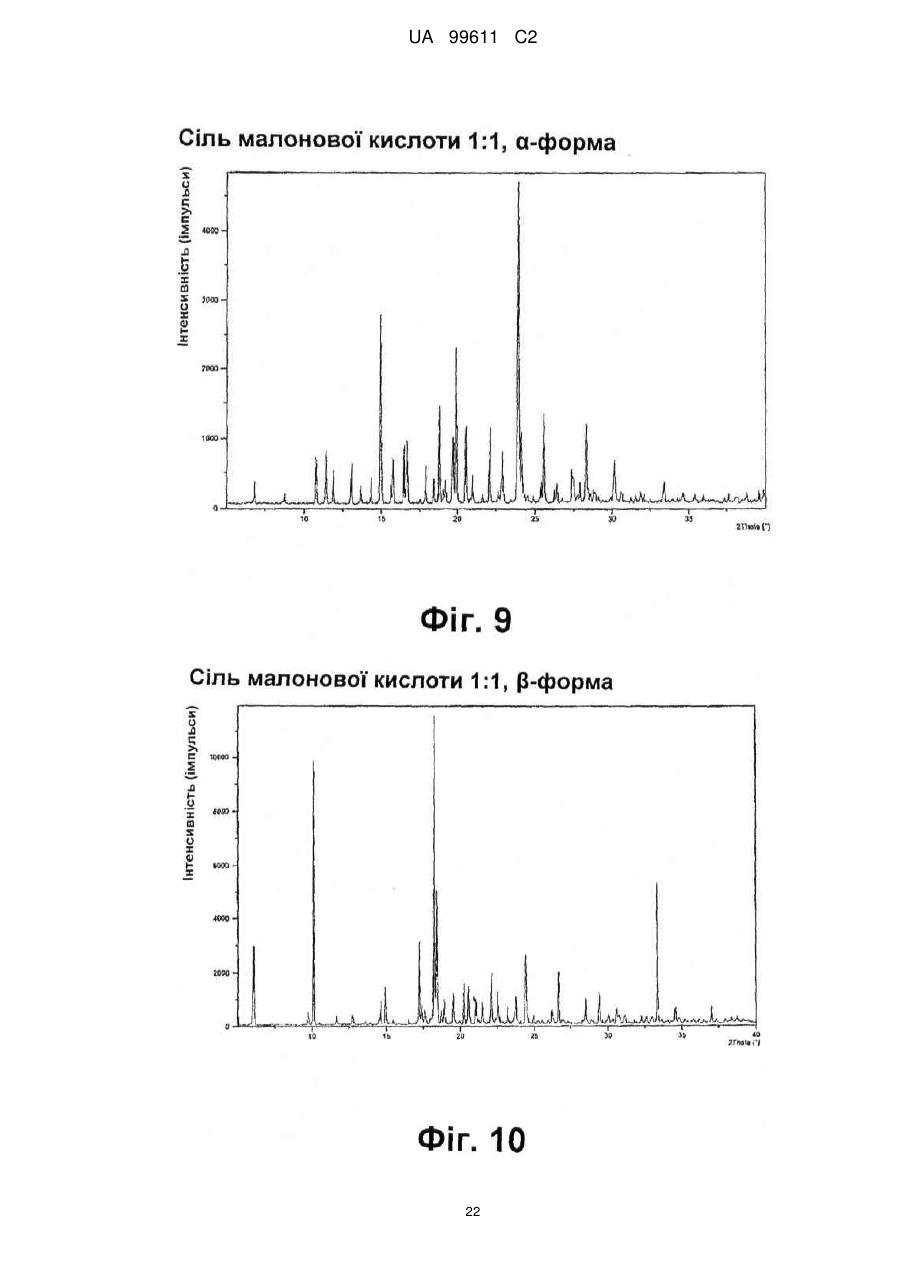
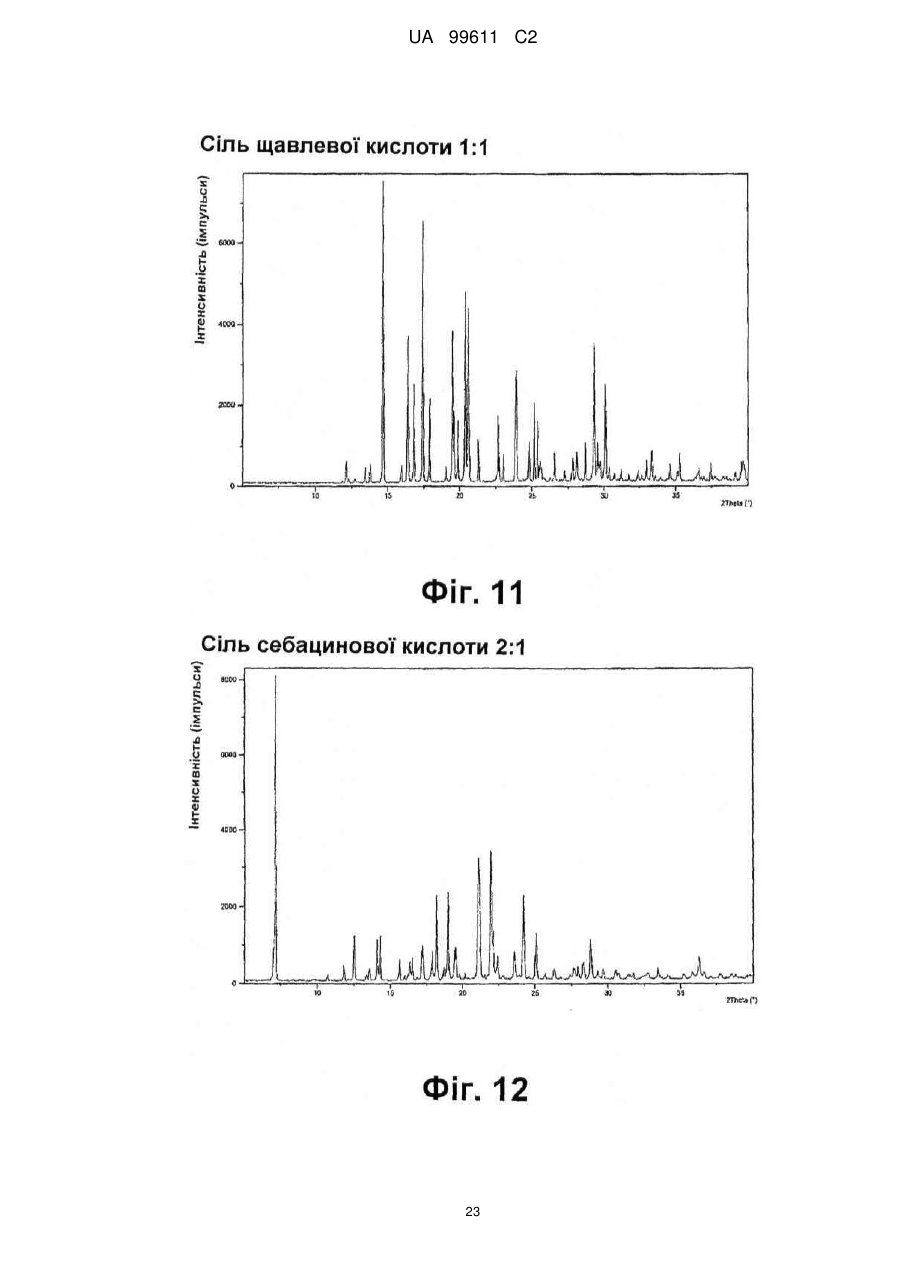
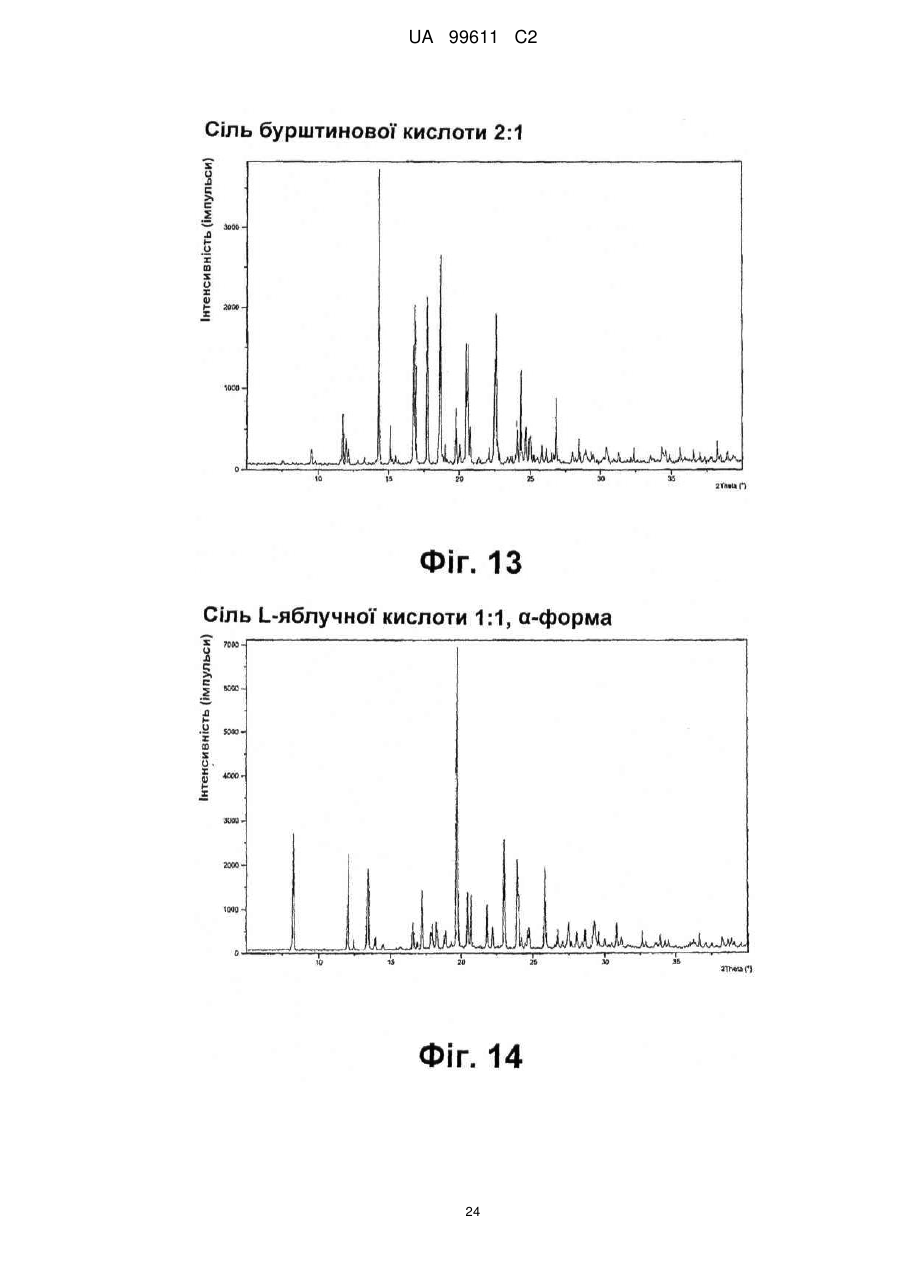
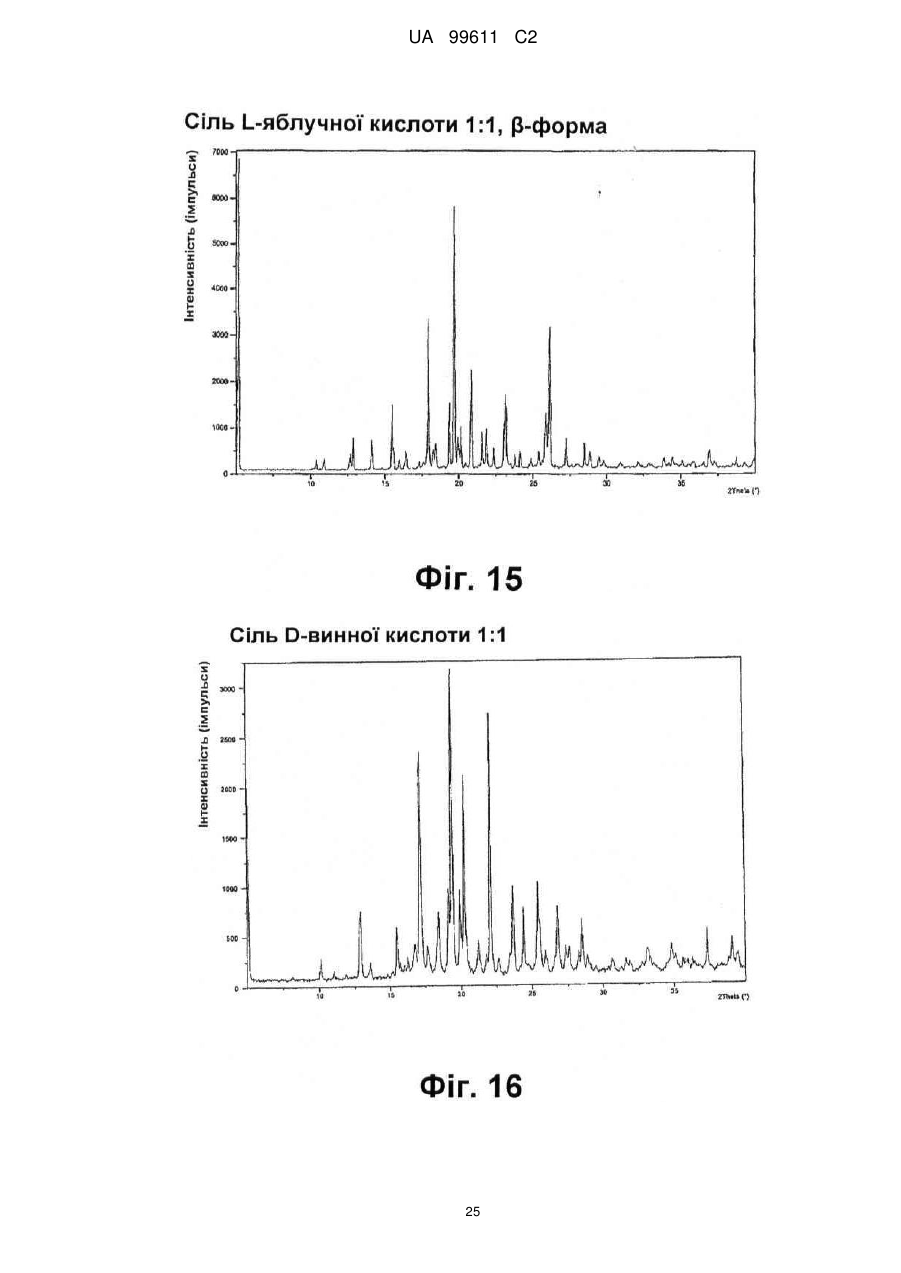
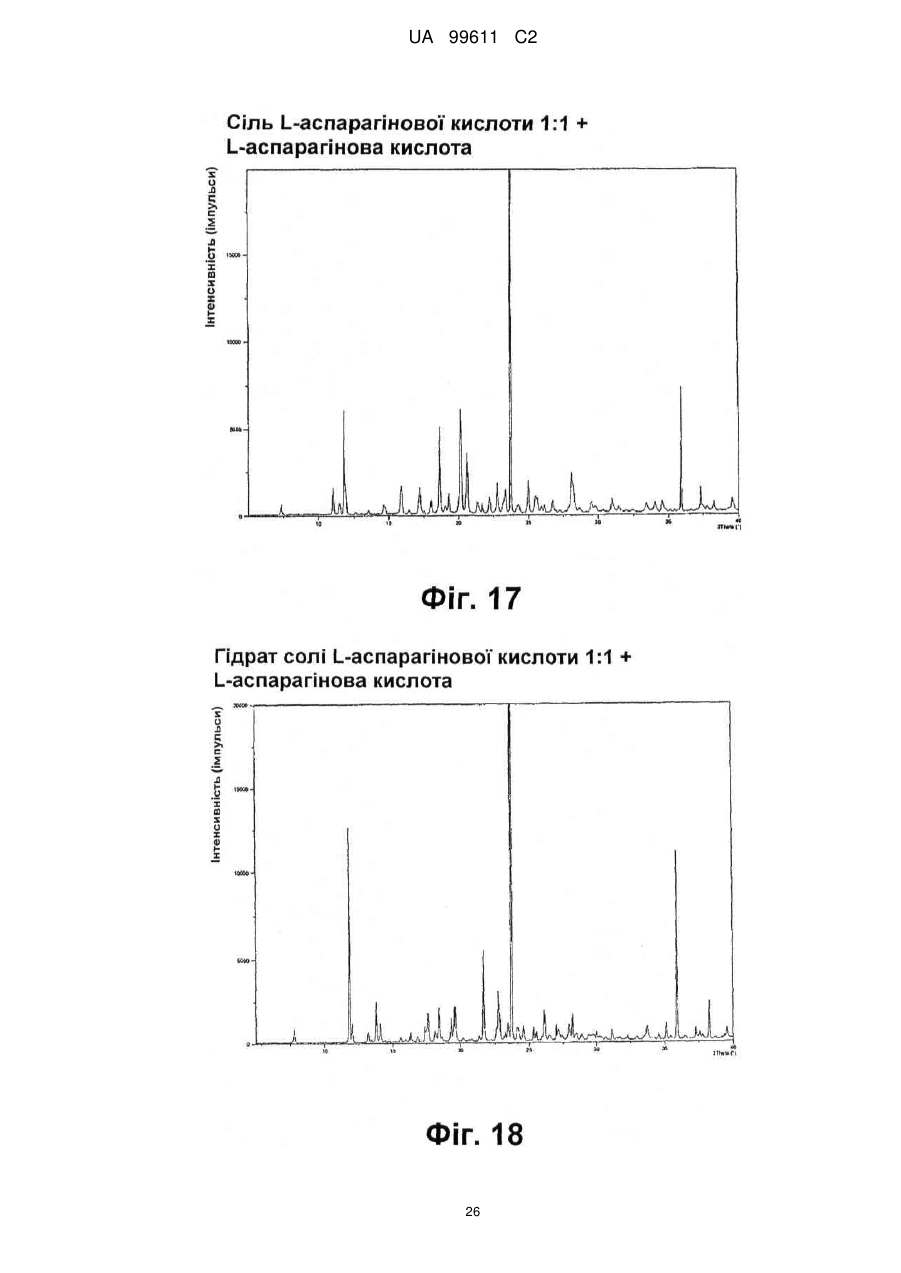
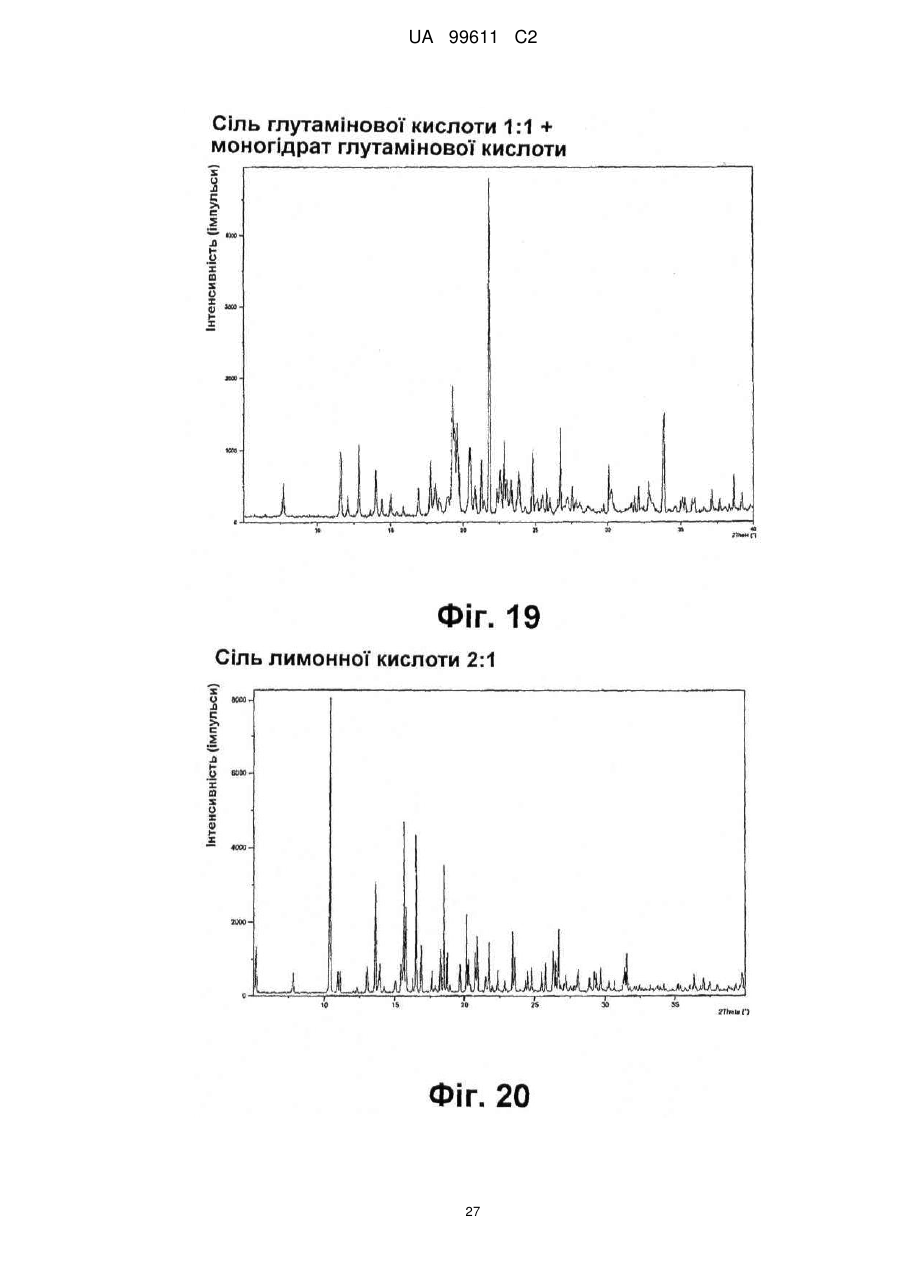
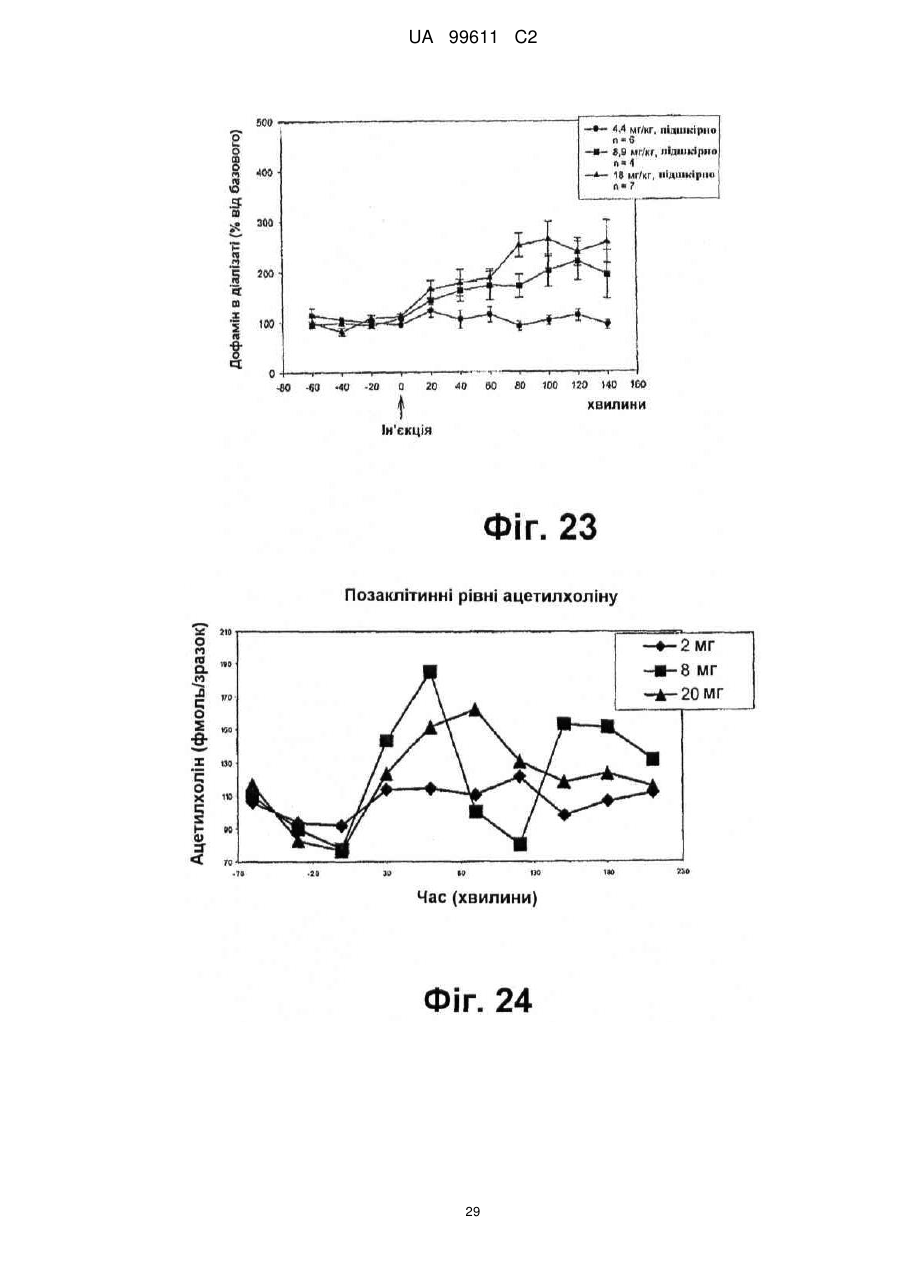
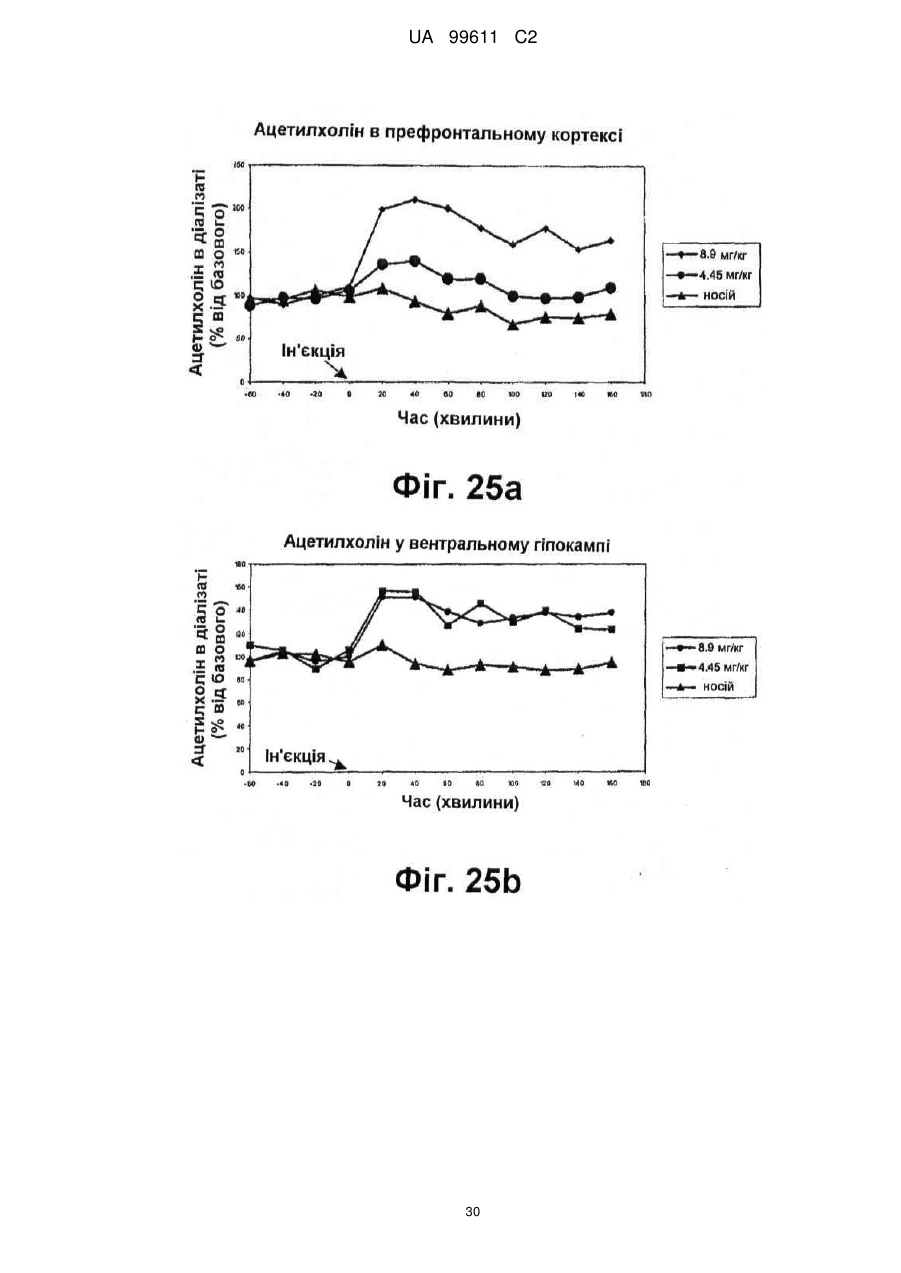
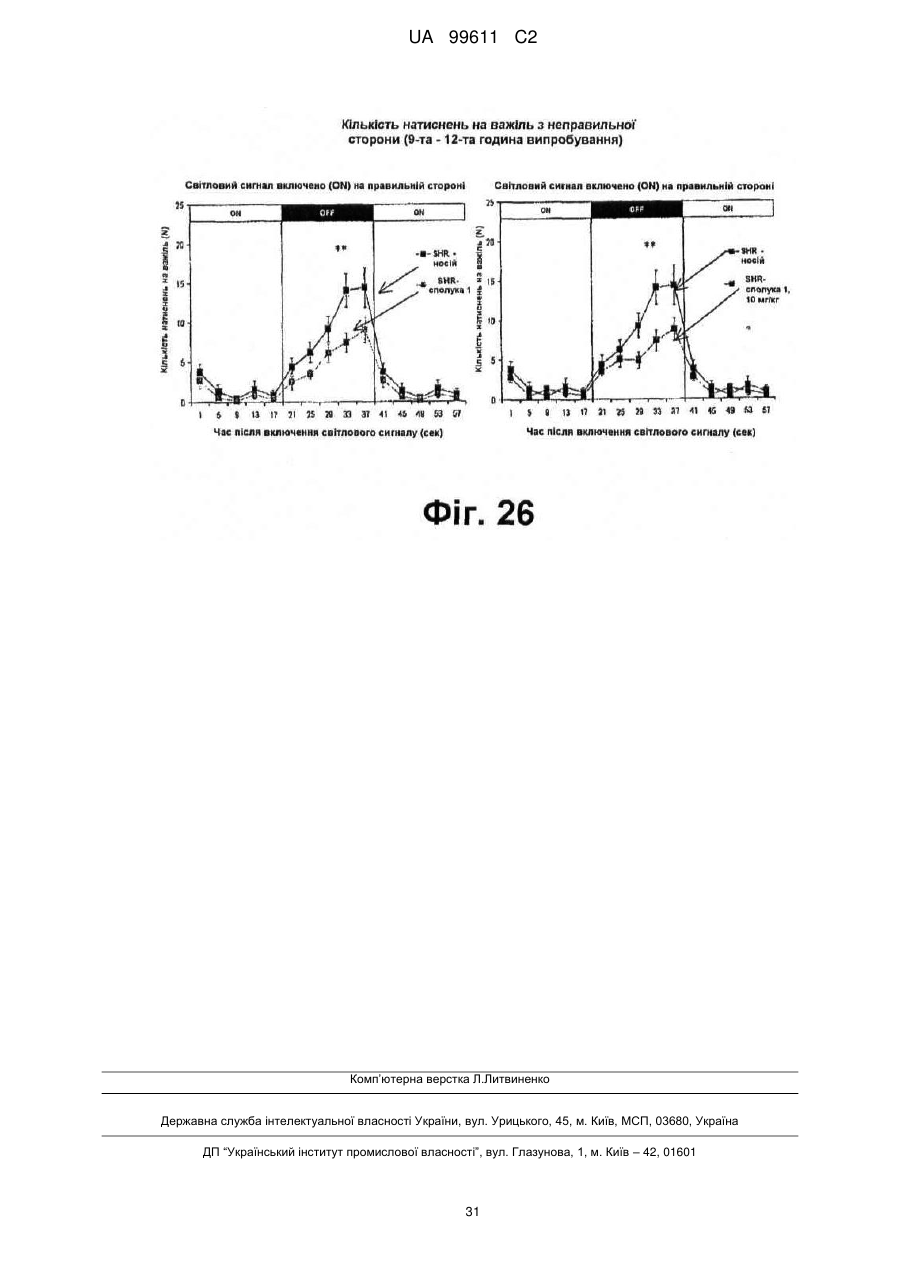
Реферат: Описується застосування 4-[2-(4-метилфенілсульфаніл)феніл]піперидину і його кислотноадитивних солей для лікування дефіциту уваги з гіперактивністю (ADHD), ендогенної депресії, резистентної депресії або резидуальних симптомів депресії. UA 99611 C2 (12) UA 99611 C2 UA 99611 C2 5 10 15 20 25 30 35 40 45 50 55 Сполука 4-[2-(4-метилфенілсульфаніл)феніл]піперидин розкрита в міжнародній патентній заявці WO 03/029232. Наголошується, що дана сполука є інгібітором переносника серотоніну, має афінність до рецептора серотоніну 2C (5-НТ2С) і як така є корисною при лікуванні розладів настрою, таких як велика депресія і тривога. Проте, як показано в наведених прикладах, даній сполуці притаманний більш широкий фармакологічний профіль, який визначає можливість застосування цієї сполуки при лікуванні також інших розладів, для лікування яких існує виражена потреба. Цей фармакологічний профіль розкритий також в WO 07/144006, де він описується у поєднанні з даними про застосування цієї сполуки при лікуванні інших захворювань. Цей винахід в одному варіанті здійснення відноситься до способу лікування дефіциту уваги з гіперактивністю (ADHD), ендогенної депресії (меланхолії), резистентної (стійкої до лікування) депресії або резидуальних (залишкових) симптомів депресії, де вказаний спосіб включає введення пацієнтові, що потребує цього, терапевтично ефективної кількості 4-[2-(4метилфенілсульфаніл)феніл]піперидину і його кислотно-адитивних солей (сполука I). У одному варіанті здійснення цей винахід відноситься до застосування 4-[2-(4метилфенілсульфаніл)феніл]піперидину і його кислотно-адитивних солей (сполука I) для виробництва лікарського засобу для лікування дефіциту уваги з гіперактивністю (ADHD), ендогенної депресії, резистентної депресії або резидуальних симптомів депресії. У одному варіанті здійснення цей винахід відноситься до 4-[2-(4метилфенілсульфаніл)феніл]піперидину і його кислотно-адитивних солей (сполука I) для застосування при лікуванні дефіциту уваги з гіперактивністю (ADHD), ендогенної депресії, резистентної депресії або резидуальних симптомів депресії. Стислий опис ілюстративних матеріалів Фіг. 1: Рентгенограма адитивної солі HBr сполуки I. Фіг. 2: Рентгенограма сольвату адитивної солі HBr сполуки I. Фіг. 3: Рентгенограма адитивної солі пальмітинової кислоти сполуки I. Фіг. 4: Рентгенограма адитивної солі DL-молочної кислоти сполуки I. Фіг. 5: Рентгенограма адитивної солі адипінової кислоти (1:1) сполуки I (α+β форма). Фіг. 6: Рентгенограма адитивної солі адипінової кислоти (2:1) сполуки I. Фіг. 7: Рентгенограма адитивної солі фумарової кислоти (1:1) сполуки I. Фіг. 8: Рентгенограма адитивної солі глутарової кислоти (1:1) сполуки I. Фіг. 9: Рентгенограма адитивної солі малонової кислоти (1:1) сполуки I, α-форма. Фіг. 10: Рентгенограма адитивної солі малонової кислоти сполуки I, β-форма. Фіг. 11: Рентгенограма адитивної солі щавлевої кислоти (1:1) сполуки I. Фіг. 12: Рентгенограма адитивної солі себацинової кислоти (2:1) сполуки I. Фіг. 13: Рентгенограма адитивної солі бурштинової кислоти (2:1) сполуки I. Фіг. 14: Рентгенограма адитивної солі L-яблучної кислоти (1:1) сполуки I, α-форма. Фіг. 15: Рентгенограма адитивної солі L-яблучної кислоти (1:1) сполуки I, β-форма. Фіг. 16: Рентгенограма адитивної солі D-винної кислоти (1:1) сполуки I. Фіг. 17: Рентгенограма адитивної солі L-аспарагінової кислоти (1:1) сполуки I в суміші з Lаспарагіновою кислотою. Фіг. 18: Рентгенограма гідрату адитивної солі L-аспарагінової кислоти (1:1) сполуки I в суміші з L-аспарагіновою кислотою. Фіг. 19: Рентгенограма адитивної солі глутамінової кислоти (1:1) сполуки I в суміші з моногідратом глутамінової кислоти. Фіг. 20: Рентгенограма адитивної солі лимонної кислоти (2:1) сполуки I. Фіг. 21: Рентгенограма кислотно-адитивної солі HCl сполуки I. Фіг. 22: Рентгенограма адитивної солі фосфорної кислоти (1:1) сполуки I. Фіг. 23: Рівні дофаміну в префронтальній корі головного мозку при введенні сполуки I. Фіг. 24: Рівні ацетилхоліну в префронтальній корі головного мозку при введенні сполуки I. Фіг. 25a+b: Рівні ацетилхоліну в префронтальній корі головного мозку і у вентральному гіпокампі при введенні сполуки I. Фіг. 26: Вплив сполуки I на прояви дефіциту уваги і імпульсність поведінки у щурів I SHR. Цей винахід відноситься до застосування сполуки I, яка являє собою 4-[2-(4метилфенілсульфаніл)феніл]піперидин, і її фармацевтично прийнятних солей. Структура 4-[2(4-метилсульфаніл)феніл]піперидину є наступною: 1 UA 99611 C2 5 10 15 20 25 30 35 40 45 50 Фармакологічний профіль сполуки I представлений в прикладах, але може бути стисло описаний наступним чином. Сполука інгібує зворотне захоплення серотоніну і норепінефрину; вона інгібує рецептори серотоніну 2A, 2C і 3 і інгібує адренергічний рецептор α-1. У одному варіанті вказаними кислотно-адитивними солями є солі кислот, які не є токсичними. Вказані солі включають солі, отримані з органічних кислот, таких як малеїнова, фумарова, бензойна, аскорбінова, бурштинова, щавлева, біс-метилен-саліцилова, метансульфонова, етандисульфонова, оцтова, пропіонова, винна, саліцилова, лимонна, глюконова, молочна, яблучна, малонова, мигдальна, корична, цитраконова, аспарагінова, стеаринова, пальмітинова, ітаконова, гліколева, пара-амінобензойна, глутамінова, бензолсульфонова, теофілін-оцтова кислоти, а також з 8-галогентеофілінів, наприклад, 8бромтеофіліну. Вказані солі можуть бути також отримані з неорганічних кислот, таких як бромистоводнева, сірчана, сульфамінова, фосфорна і азотна кислоти. У одному варіанті здійснення цього винаходу сполука I являє собою адитивну сіль HBr. У одному варіанті здійснення цього винаходу сполука I являє собою адитивну сіль DLмолочної кислоти і, зокрема, 1:1 сіль. У одному варіанті здійснення цього винаходу сполука I являє собою адитивну сіль Lаспарагінової кислоти і, зокрема, 1:1 сіль. У одному варіанті здійснення цього винаходу сполука I являє собою адитивну сіль глутамінової кислоти і, зокрема, 1:1 сіль. У одному варіанті здійснення цього винаходу сполука I являє собою адитивну сіль глутарової кислоти і, зокрема, 1:1 сіль. У одному варіанті здійснення цього винаходу сполука I являє собою адитивну сіль малонової кислоти і, зокрема, 1:1 сіль, яка, як було виявлено, існує в двох поліморфних модифікаціях, α і β, де форма β вважається за найбільш стабільну, у зв'язку з її пониженою розчинністю. У одному варіанті здійснення цього винаходу сполука I представлена в очищеній формі. Термін "очищена форма" в тексті цього опису використовується для позначення того, що сполука по суті не містить інших сполук або інших форм, наприклад, поліморфів вказаної сполуки, як один з прикладів. Лікарські форми для перорального введення і, зокрема, пігулки і капсули, часто розглядаються пацієнтами і фахівцями медичного профілю як переважні для вживання у зв'язку з легкістю їх введення і, отже, легше досяжною згодою пацієнтів дотримуватися режиму лікування. У разі пігулок і капсул, переважно, щоб їх активні інгредієнти були кристалічними. У одному варіанті здійснення цього винаходу сполука I є кристалічною. Кристали, використовувані згідно з цим винаходом, можуть існувати у вигляді сольватів, наприклад, це можуть бути кристали, в яких молекули розчинника утворюють частину кристалічної структури. Вказаний сольват може бути утворений з води, і в цьому випадку сольвати часто носять назву гідратів. Альтернативно, вказані сольвати можуть бути утворені з інших розчинників, таких як, наприклад, етанол, ацетон або етилацетат. Точна кількість сольвату часто визначається умовами. Так, наприклад, гідрати звичайно втрачають воду в міру підвищення температури або при зниженні відносної вологості. Сполуки, які не змінюються або змінюються лише в незначній мірі при зміні умов, наприклад, при зміні вологості, в основному розглядаються як більш відповідні для використання у фармацевтичних композиціях. Слід зазначити, що кислотно-адитивна сіль HBr не утворює гідрати при осадженні з води, тоді як інші сполуки, такі як адитивні солі бурштинової, яблучної і винної кислот, утворюють їх. Деякі сполуки є гігроскопічними, тобто вони можуть абсорбувати воду при дії на них вологи. Гігроскопічність в основному розглядається як небажана властивість для сполук, які розглядають з точки зору їх включення до складу фармацевтичних композицій, зокрема, до складу сухих композицій, таких як пігулки або капсули. У одному варіанті здійснення цей винахід відноситься до кристалів з низькою гігроскопічністю. У разі пероральних лікарських форм, що містять кристалічні активні інгредієнти, буде корисно, якщо такі кристали добре виражені. У контексті цього опису термін "добре виражені", 2 UA 99611 C2 5 10 15 20 25 30 35 40 45 50 55 60 зокрема, означає, що добре визначена стехіометрія, а саме співвідношення між іонами, що формують сіль, визначається невеликими цілими числами, як 1:1, 1:2, 2:1, 1:1:1 і тому подібне. У одному варіанті здійснення сполуки цього винаходу є добре вираженими кристалами. Розчинність активного інгредієнта є також важливою для вибору лікарської форми, оскільки вона може мати безпосередній вплив на біодоступність. Стосовно лікарських форм для перорального введення в основному вважається, що більш висока розчинність активного інгредієнта є корисною, оскільки при цьому підвищується біодоступність. Деякі пацієнти, зокрема немолоді пацієнти, можуть зазнавати труднощі при ковтанні пігулок, і, в зв'язку з цим, пероральні краплинні розчини можуть бути відповідною альтернативою, що дозволяє уникнути необхідності ковтати пігулки. Для обмеження об'єму перорального краплинного розчину необхідно, щоб розчин мав високу концентрацію активного інгредієнта, що знов-таки потребує високої розчинності даної сполуки. Як показано в таблиці 3, адитивні солі DL-молочної кислоти, L-аспарагінової кислоти, глутамінової кислоти, глутарової кислоти і малонової кислоти мають виключно високу розчинність. Кристалічні форми впливають на здатність сполуки до фільтрування і до переробки. Голчасті кристали важче піддаються обробці в процесі виробництва, за рахунок того, що в цьому випадку стадія фільтрування ускладнюється і стає витратною за часом. Точна кристалічна форма кожної конкретної солі може залежати, наприклад, від умов, в яких дана сіль була осаджена. Так, кислотно-адитивна сіль HBr сполуки I утворює сольватовані кристали голчастої форми при осадженні з етанолу, оцтової кислоти і пропанолу, проте, у тому випадку, коли вказану кислотно-адитивну сіль HBr осаджують з води, утворюються негідратовані кристали, які не мають голчастої форми, але які забезпечують досягнення прекрасної здатності отриманої сполуки до фільтрування. У таблиці 3 також показані кінцеві значення pH, тобто значення pH в насиченому розчині солі. Ця властивість враховується у зв'язку з її важливістю, оскільки при зберіганні ніколи не вдається повністю уникнути вологи, а накопичення вологи приводить до зниження pH усередині або на поверхні пігулки, що містить сіль з низьким кінцевим значенням pH солі, що, у свою чергу, може знизити термін придатності. Крім того, сіль з низьким кінцевим значенням pH може сприяти процесу корозії устаткування в процесі виробництва, якщо пігулки отримують вологою грануляцією. Наведені в таблиці 3 дані указують на те, що адитивні солі HBr, HCl і адипінової кислоти можуть бути найкращими в даному аспекті. У одному варіанті здійснення сполука I є адитивною сіллю HBr в кристалічній формі, особливо в очищеній формі. У іншому варіанті здійснення вказана сіль HBr має піки на порошковій рентгенограмі (XRPD) при приблизно 6,08°, 14,81°, 19,26° і 25,38° 2θ, і, зокрема, вказана сіль HBr характеризується порошковою рентгенограмою (XRPD), наведеною на фіг. 1. У одному варіанті здійснення сполука I є адитивною сіллю DL-молочної кислоти (1:1) в кристалічній формі, зокрема, в очищеній формі. У іншому варіанті здійснення вказана адитивна сіль DL-молочної кислоти має піки на порошковій рентгенограмі (XRPD) при приблизно 5,30°, 8,81°, 9,44° і 17,24° 2θ, і, зокрема, вказана адитивна сіль DL-молочної кислоти характеризується порошковою рентгенограмою (XRPD), наведеною на фіг. 4. У одному варіанті здійснення сполука I є адитивною сіллю L-аспарагінової кислоти (1:1) в кристалічній формі, зокрема, в очищеній формі. У іншому варіанті здійснення вказана адитивна сіль L-аспарагінової кислоти є несольватованою і має піки на порошковій рентгенограмі (XRPD) при приблизно 11,05°, 20,16°, 20,60° і 25,00° 2θ, і, зокрема, вказана сіль L-аспарагінової кислоти, коли вона змішана з L-аспарагіновою кислотою, характеризується порошковою рентгенограмою (XRPD), наведеною на фіг. 17. У одному варіанті здійснення вказана адитивна сіль Lаспарагінової кислоти є гідратом, зокрема, в очищеній формі. У іншому варіанті здійснення вказаний гідрат адитивної солі L-аспарагінової кислоти має піки на XRPD при приблизно 7,80°, 13,80°, 14,10°, 19,63° 2θ, і, зокрема, вказаний гідрат адитивної солі L-аспарагінової кислоти, коли він змішаний з L-аспарагіновою кислотою, характеризується порошковою рентгенограмою (XRPD), наведеною на фіг. 18. У одному варіанті здійснення сполука I є адитивною сіллю глутамінової кислоти (1:1) в кристалічній формі, зокрема, в очищеній формі. У іншому варіанті здійснення вказана адитивна сіль глутамінової кислоти має піки на XRPD при приблизно 7,71°, 14,01°, 19,26° і 22,57° 2θ, і, зокрема, вказана сіль глутамінової кислоти, коли вона змішана з моногідратом глутамінової кислоти, характеризується порошковою рентгенограмою (XRPD), наведеною на фіг. 19. У одному варіанті здійснення сполука I є адитивною сіллю малонової кислоти (1:1) в кристалічній формі, зокрема, в очищеній формі. У іншому варіанті здійснення вказана адитивна сіль малонової кислоти знаходиться в α-формі і має піки на XRPD при приблизно 10,77°, 16,70°, 19,93° і 24,01° 2θ, або вказана адитивна сіль малонової кислоти знаходиться в β-формі і має 3 UA 99611 C2 5 10 15 20 25 30 35 40 45 50 55 60 піки на XRPD при приблизно 6,08°, 10,11°, 18,25° і 20,26° 2θ, і, зокрема, вказана адитивна сіль малонової кислоти характеризується порошковою рентгенограмою (XRPD), наведеною на фіг. 9 або фіг. 10. У одному варіанті здійснення сполука I є адитивною сіллю глутарової кислоти (1:1) в кристалічній формі, зокрема, в очищеній формі. У іншому варіанті здійснення вказана адитивна сіль глутарової кислоти має піки на XRPD при приблизно 9,39°, 11,70°, 14,05° і 14,58° 2θ, і, зокрема, вказана адитивна сіль глутарової кислоти характеризується порошковою рентгенограмою (XRPD), наведеною на фіг. 8. Унікальний фармакологічний профіль сполуки I робить її придатною для лікування захворювань, додаткових до вказаних у WO 03/029232. Рецептори 5-НТ2С локалізовані, наприклад, на дофамінергічних нейронах, активація яких приводить до тонічної інгібуючої дії на вивільнення дофаміну, тоді як антагоністи 5-НТ2С впливатимуть у напрямку підвищення рівня дофаміну. Дані, представлені в Прикладі 2E, показують, що сполука I, фактично, призводить до доза-залежного підвищення позаклітинних рівнів дофаміну в префронтальній корі головного мозку. На підставі цього положення можна висловити гіпотезу, згідно якої антагоністи 5-НТ2С особливо добре підходять для лікування депресії, непіддатливої до лікування селективними інгібіторами зворотного захоплення серотоніну [Psychopharmacol. Bull., 39, 147-166, 2006]. Ця гіпотеза знаходить підтримку у вигляді результатів декількох клінічних випробувань, які демонструють, що комбінація міртазипіну і SSRI перевершує за досягнутим ефектом введення SSRI самого по собі при лікуванні депресії у пацієнтів з неадекватною клінічною реакцією (стійка до лікування депресія, TRD, або резистентна депресія) [Psychother. Psychosom., 75, 139-153, 2006]. Міртазапін є також антагоністом 5-НТ2 і 5-НТ3, і це вказує на те, що сполуки, що здійснюють інгібування зворотного захоплення серотоніну в поєднанні з антагонізмом до 5-НТ2 і 5-НТ3, такі як сполука I, корисні для лікування TRD, тобто вони будуть підвищувати швидкість ремісії у пацієнтів, що мають стійку до лікування депресію. Дані, представлені в Прикладах 2F і 2G, показують, що сполука I практично здійснює підвищення позаклітинного рівня ацетилхоліну в префронтальній корі головного мозку і у вентральному гіпокампі. Є давно відоме клінічне підтвердження того, що підвищення рівнів ацетилхоліну в головному мозку є шляхом лікування хвороби Альцгеймера і когнітивних порушень в цілому, як, наприклад, за допомогою використання інгібіторів ацетилхолін-естерази при лікуванні хвороби Альцгеймера. На підставі цього вважають, що сполуки цього винаходу будуть корисними при лікуванні хвороби Альцгеймера і когнітивних порушень, а також розладів настрою, таких як депресія, що пов'язана з хворобою Альцгеймера і когнітивними порушеннями. Частина пацієнтів з депресією реагуватимуть на лікування антидепресантами, такими як, наприклад, SSRI, в тому сенсі, що їх стан буде покращуватися згідно зі шкалами, що відповідають клінічній депресії, такими як MADRD і HAMD, але при цьому інші симптоми, такі як порушення сну і когнітивні порушення, залишатимуться. У цьому контексті даних пацієнтів називають частково реагуючими. В результаті обговорюваної вище дії на рівні ацетилхоліну очікується, що сполуки цього винаходу будуть корисними при лікуванні когнітивних порушень на додаток до депресії. Клінічні дослідження показали, що сполука празосин, яка є антагоністом адренергічного рецептора α-1, зменшує порушення сну [Biol. Psychiatry, 61, 928-934, 2007]. Більш того, також вважається, що антагонізм стосовно 5-HT2A і 5-HT2C сполук цього винаходу має седативну поліпшуючу сон дію [Neuropharmacol, 33, 467-471, 1994], в зв'язку з цим, сполука I є корисною для лікування частково реагуючих пацієнтів або, іншими словами, лікування пацієнтів з депресією сполукою І буде зменшувати частину частково реагуючих пацієнтів. Дефіцит уваги з гіперактивністю (ADHD) належить до найбільш поширених нервових розладів з біхевіоральним компонентом. ADHD визначається тріадою соціальних і комунікативних порушень з наявністю обмеженого повторюваного або стереотипного характеру поведінки. Зазвичай ADHD починається в дитинстві або підлітковому віці, хоча його симптоми можуть залишатися і пізніше, виявляючись в дорослому стані. Атомоксетин є в даний час єдиним препаратом не стимулюючого типу, дозволеним Управлінням США по контролю за лікарськими препаратами і харчовими продуктами (FDA), для лікування ADHD [Drugs, 64, 205222, 2004]. Атомоксетин є інгібітором зворотного захоплення норепінефрину, який також сприяє підвищенню рівня дофаміну в префронтальній корі головного мозку. Було висловлено припущення, що підвищення рівня вказаних нейротрансмітерів опосередковує терапевтичний ефект атомоксетину при лікуванні ADHD [Eur. Neuropsychopharmacol., 12, suppl. 3, 418, 2002]. Дане положення підтримує ідею про можливість застосування сполуки I при лікуванні ADHD. Крім того, сполуки цього винаходу можуть надавати седативний ефект за рахунок описаного вище антагонізму у відношенні адренергічного рецептора α-1 і 5-НТ2, який є сприятливим для лікування ADHD. Як показано в Прикладі 3, результати досліджень, проведених на щурах, 4 UA 99611 C2 5 10 15 20 25 30 35 40 45 50 55 60 показують, що сполука I знижує гіперактивність, імпульсивність і дефіцит уваги. Ендогенна депресія є конкретним підтипом депресії, яка часто пов'язана з важкою депресією; даний тип депресії часто позначається як меланхолійна депресія. Ендогенна депресія пов'язана з тривогою, страхом перед майбутнім, безсонням і втратою апетиту. Було показано, що сполуки, які інгібують зворотне захоплення як серотоніну, так і норепінефрину, такі як, наприклад, венлафаксин, особливо ефективні при лікуванні пацієнтів з важкою депресією і ендогенною депресією [Depres. Anxiety, 12, 50-54, 2000]. Як обговорювалося вище, сполуки, що демонструють антагонізм відносно 5-НТ2С, підвищують рівень дофаміну, так що, як очікується, такі сполуки будуть ефективними при лікуванні ендогенної депресії [Psychоpharm. Bull., 39, 147166, 2006]. Крім того, антагонізм у відношенні адренергічного рецептора α-1 і 5-НТ2 сполук цього винаходу буде, як очікується, сприяти нормалізації сну, оскільки вказані сполуки корисні для лікування ендогенної депресії. Цей винахід в одному варіанті здійснення відноситься до способу лікування ADHD, ендогенної депресії, резистентної депресії або резидуальних симптомів депресії, при цьому вказаний спосіб включає введення пацієнтові, що потребує цього, терапевтично ефективної кількості 4-[2-(4-метилфенілсульфаніл)феніл]піперидину і його кислотно-адитивних солей (сполука I). У одному варіанті здійснення цього винаходу вказаний пацієнт, який підлягає лікуванню відповідно до будь-якого з перелічених вище захворювань, раніше вже був продіагностований як такий, що має вказане захворювання. У одному варіанті здійснення сполуки цього винаходу вводять в кількості від приблизно 0,001 до приблизно 100 мг/кг маси тіла в день. Типове дозування при пероральному введенні знаходиться в діапазоні від приблизно 0,001 до приблизно 100 мг/кг маси тіла на день, переважно, від приблизно 0,01 до приблизно 50 мг/кг маси тіла на день при введення однієї або декількох доз, наприклад, 1-3 доз. Точне дозування визначатиметься частотою і способом введення, статтю, віком, масою і загальним станом здоров'я суб'єкта, якого піддають лікуванню, природи і тяжкості стану, що лікують, наявності будь-яких супутніх захворювань, що також підлягають лікуванню, та інших чинників, відомих фахівцям в даній галузі. Типове дозування при пероральному введенні для дорослих складає 1-100 мг/день сполуки цього винаходу, наприклад, 1-30 мг/день, 5-25 мг/день або 5-60 мг/день. У типовому випадку таке дозування може бути досягнуте при введенні 0,1-60 мг, наприклад, 0,1-50 мг, 1-25 мг, 1-35 мг, і, зокрема, таких доз, як 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 або 60 мг сполуки I один раз або двічі на день. У цьому описі термін "терапевтично ефективна кількість" сполуки означає кількість, достатню для лікування, ослаблення або часткового припинення клінічних проявів даного захворювання і його ускладнень в результаті терапевтичної інтервенції, що включає введення вказаної сполуки. Кількість, адекватна для досягнення цієї мети, визначається як "терапевтично ефективна кількість". Даний термін також охоплює такі кількості, які є достатніми для лікування, ослаблення або часткового припинення клінічних проявів вказаного захворювання і його ускладнень в ході лікування, що включає введення вказаної сполуки. Ефективні кількості, адекватні для досягнення кожної з таких цілей, залежатимуть від тяжкості захворювання або пошкодження, а також від маси і загального стану здоров'я суб'єкта. Зрозуміло, що визначення відповідних дозувань може проводитися в рамках рутинних експериментів шляхом побудови матриці значень і тестування різних точок цієї матриці, що може без зусиль зробити звичайний навчений лікар. Термін "лікування" і використовувані в цьому описі всі його похідні форми означають комплекс заходів, направлених на ведення пацієнта і догляд за ним з метою боротьби з таким станом, який визначається захворюванням або розладом. Даний термін, в контексті його застосування, охоплює повний спектр лікування, що проводиться для конкретного стану, від якого страждає пацієнт, наприклад, введення активної сполуки з метою ослаблення прояву симптомів або ускладнень, затримки розвитку захворювання, розладу або патологічного стану, ослаблення або полегшення симптомів або ускладнень і/або для лікування або повного усунення захворювання, розладу або патологічного стану, а також для профілактики вказаного патологічного стану, де вказану профілактику слід розуміти як систему ведення і догляду за пацієнтом з метою боротьби із захворюванням, патологічним станом або розладом, і де вказана профілактика включає введення активних сполук для попередження початку появи симптомів або ускладнень. При цьому профілактичний (превентивний) і терапевтичний (лікувальний) підходи в лікуванні є двома окремими аспектами цього винаходу. Пацієнт, що підлягає лікуванню, є переважно ссавцем, зокрема людиною. Цей винахід в одному варіанті здійснення відноситься до застосування 4-[2-(4 5 UA 99611 C2 5 10 15 20 25 30 35 40 45 50 55 60 метилфенілсульфаніл)феніл]піперидину і його кислотно-адитивних солей (сполука I) для виробництва лікарського засобу для лікування ADHD, ендогенної депресії, резистентної депресії або резидуальних симптомів депресії. Цей винахід в одному варіанті здійснення відноситься до 4-[2-(4-метилфенілсульфаніл)феніл]піперидину і його кислотно-адитивних солей (сполука I) для використання при лікуванні ADHD, ендогенної депресії, резистентної депресії або резидуальних симптомів депресії. Сполуки цього винаходу можуть вводитися самі по собі у вигляді чистої сполуки або у поєднанні з фармацевтично прийнятними носіями або ексципієнтами, у вигляді одиничної дози або множинних доз. Фармацевтичні композиції цього винаходу можуть бути виготовлені з використанням фармацевтично прийнятних носіїв або розріджувачів, а також будь-яких інших відомих ад’ювантів і ексципієнтів, відповідно до традиційних процедур, таких як ті, що описані в керівництві Remington: The Science and Practice of Pharmacy, 19 Edition, Gennaro, Ed., Mack Publishing Co, Easton, PA, 1995. Фармацевтичні композиції можна спеціально приготувати для введення будь-яким відповідним способом, таким як пероральний, ректальний, назальний, пульмональний, місцевий (включаючи букальний і під'язиковий), трансдермальний, інтрацистернальний, внутрішньочеревинний, вагінальний і парентеральний (включаючи підшкірний, внутрішньом'язовий, інтратекальний, внутрішньовенний і внутрішньошкірний) спосіб, при цьому пероральний спосіб є переважним. Слід враховувати, що переважний спосіб залежатиме від загального стану здоров'я і віку суб'єкта, якого треба лікувати, природи стану, який треба лікувати, і вибраного активного інгредієнта. Фармацевтичні композиції для перорального введення включають тверді лікарські форми, такі як капсули, пігулки, драже, пілюлі, пастили, порошки і гранули. Коли це доцільно, їх можна одержувати з покриттями. Рідкі лікарські форми для перорального введення включають розчини, емульсії, суспензії, сиропи і еліксири. Фармацевтичні композиції для парентерального введення включають стерильні водні і неводні відповідні розчини, дисперсії, суспензії або емульсії для ін'єкцій, так само як і стерильні порошки для розведення в стерильних розчинах або дисперсіях для ін'єкції перед використанням. Інші відповідні для введення форми включають супозиторії, спреї, мазі, креми, гелі, засоби для інгаляції, шкірні пластири, імплантати тощо. Зручно вводити сполуки за винаходом в одиничній лікарській формі, що містить вказані сполуки в кількості приблизно від 0,1 до 50 мг, наприклад, 1 мг, 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 або 35 мг сполуки I. Для парентеральних способів введення, таких як внутрішньовенне, інтратекальне, внутрішньом'язове і подібне введення, як правило, дози складають порядку приблизно половини дози, вживаної для перорального введення. Для парентерального введення можна застосовувати розчини сполуки за винаходом в стерильному водному розчині, водному пропіленгліколі, водному вітаміні E або кунжутній або арахісовій олії. Такі водні розчини треба відповідним чином забуферити, якщо це необхідно, і спочатку зробити рідкий розчинник ізотонічним за допомогою достатньої кількості сольового розчину або глюкози. Водні розчини є, зокрема, придатними для внутрішньовенного, внутрішньом'язового, підшкірного і внутрішньочеревинного введення. Всі вживані стерильні водні середовища легко одержати за загальноприйнятими способами, відомими фахівцям в даній галузі. Придатні фармацевтичні носії включають інертні тверді розріджувачі або наповнювачі, стерильний водний розчин і різні органічні розчинники. Прикладами твердих носіїв є лактоза, каолін, сахароза, циклодекстрин, тальк, желатин, агар, пектин, гуміарабік, стеарат магнію, стеаринова кислота і нижчі алкілові етери целюлози. Прикладами рідких носіїв є сироп, арахісова олія, оливкова олія, фосфоліпіди, жирні кислоти, аміни жирних кислот, поліоксіетилен і вода. Фармацевтичні композиції, одержані об'єднанням сполуки за винаходом і фармацевтично прийнятних носіїв, потім легко вводяться в різноманітних лікарських формах, відповідних до описаних способів введення. Склади за цим винаходом, придатні для перорального введення, можуть бути виготовлені у вигляді окремих одиниць, таких як капсули або пігулки, кожна з яких містить заздалегідь зумовлену кількість активного інгредієнта, і які можуть включати підхожий ексципієнт. Крім того, придатні для перорального введення склади можуть бути у формі порошку або гранул, розчину або суспензії у водній або неводній рідині, або у формі рідкої емульсії типу "олія у воді" або 6 UA 99611 C2 5 10 15 20 25 30 35 40 45 50 55 60 "вода в олії". Якщо твердий носій використовують для перорального введення, препарат може бути пігулкою, наприклад, у формі порошку або гранул, поміщених в тверду желатинову капсулу, або у формі пастилки або пігулки для розсмоктування. Кількість твердого носія може мінятися, але зазвичай вона становить від приблизно 25 мг до приблизно 1 г. Якщо використовують рідкий носій, препарат може бути у формі сиропу, емульсії, м'якої желатинової капсули або стерильної придатної для ін'єкції рідини, такій як водна або неводна рідка суспензія або розчин. Пігулки можна одержувати змішуванням активного інгредієнта із звичайними ад'ювантами і/або розріджувачами з подальшим пресуванням суміші в звичайній таблетувальній машині. Приклади ад'ювантів або розріджувачів включають: кукурудзяний крохмаль, картопляний крохмаль, тальк, стеарат магнію, желатин, лактозу, камедь тощо. Будь-які інші ад'юванти або добавки, зазвичай вживані для таких цілей, такі як барвники, ароматизатори, консерванти тощо, можна використовувати, за умови, що вони є сумісними з активними інгредієнтами. Капсули, що містять сполуку за цим винаходом, можна одержати перемішуванням порошку, який містить вказану сполуку з мікрокристалічною целюлозою і стеаратом магнію, і поміщенням вказаного порошку в тверду желатинову капсулу. Необов'язково, вказану капсулу можна забарвлювати за допомогою відповідного пігменту. Як правило, капсули міститимуть 0,25-20 % сполуки за цим винаходом, наприклад, 0,5-1,0 %, 3,0-4,0 %, 14,0-16,0 % сполуки за цим винаходом. Ці концентрації можна використовувати для зручної доставки 1, 5, 10, 15, 20 і 25 мг сполуки за цим винаходом в одиничній дозованій формі. Розчини для ін'єкцій можна одержати розчиненням активного інгредієнта і можливих добавок в частині розчинника для ін'єкції, переважно стерильній воді, доведенням розчину до бажаного об'єму, стерилізацією цього розчину і наповненням ним відповідних ампул або флаконів. Можна додавати будь-які відповідні добавки, загальноприйняті в даній галузі, такі як агенти ізотонічності, консерванти, антиоксиданти тощо. Сполука I може вводитися або сама по собі, або у комбінації з іншою терапевтично активною сполукою, при цьому дві такі сполуки можуть вводитися або одночасно, або послідовно. Приклади терапевтично активних сполук, які можуть бути з перевагою об'єднані із сполукою I, включають седативні або снодійні засоби, такі як бензодіазепіни; протисудомні препарати, такі як ламотригін, вальпроєва кислота, топірамат, габапентин, карбамазепін; засоби для корекції настрою, такі як препарати літію; дофамінергічні лікарські засоби, такі як агоністи дофаміну і ліводопа; лікарські засоби, вживані для лікування ADHD, такі як атомоксетин; психостимулятори, такі як модафініл, кетамін, метилфенідат і амфетамін; інші антидепресанти, такі як міртазапін, міансерин і бупропріон; гормони, такі як T3, естроген, дегідроізоандростерон і тестостерон; атипові антипсихотичні засоби, такі як оланзапін і арипіпразол; типові антипсихотичні засоби, такі як галоперидол; лікарські засоби для лікування хвороби Альцгеймера, такі як інгібітори холін-естерази і мемантин, фолат; S-аденозилметіонін; імуномодулятори, такі як інтерферони; опіати, такі як бупренорфіни; антагоністи рецептора 1 ангіотензину II (антагоністи AT1); інгібітори АХЕ; статини і антагоніст альфа1-адренергічного рецептора, такий як празозин. Сполуку I можна одержувати за процедурою, описаною у WO 2003/029232 або у WO 2007/144006. Для утворення різних солей передбачається додавання відповідної кислоти до вільної основи з подальшим осадженням. Осадження можна викликати, наприклад, охолоджуванням, видаленням розчинника, додаванням іншого розчинника або їх суміші. Всі посилання, включаючи публікації, патентні заявки і патенти, процитовані в цьому описі, включені в цей опис шляхом посилання в повному їх обсязі і в тому ступені, мовби для кожного посилання було вказано окремо і конкретно, що воно включено шляхом посилання і наведено в його повному обсязі в цьому описі (до максимального ступеня, що допускається законом), незалежно від будь-якого окремо наданого включення конкретних документів, зробленого будьде в цьому описі винаходу. Застосування форм однини і схожих об'єктів посилання в контексті опису винаходу слід тлумачити як такі, що охоплюють як єдине, так і множинне число, якщо в цьому описі нема інших вказівок або якщо контекст явно не суперечить цьому. Наприклад, вираз "сполука" слід розуміти як вказівку на різноманітні сполуки цього винаходу або на конкретний описаний аспект, якщо нема інших вказівок. Якщо нема інших вказівок, всі точні значення, представлені в цьому описі, є репрезентативними для відповідних приблизних значень (наприклад, можна вважати, що всі приклади точних значень, представлені відносно конкретного чинника або вимірювання, також відносяться до відповідного приблизного значення, модифікованого за допомогою слова 7 UA 99611 C2 5 10 15 20 25 30 35 40 45 50 55 60 "приблизно", коли це доцільно). Опис будь-якого аспекту або аспекту винаходу з використанням таких термінів, як "що містить", "що має", "що включає" або "що охоплює" по відношенню до елементу або елементів, призначений для надання основи для схожого аспекту або аспекту цього винаходу, який "складається з", "по суті складається з", цього конкретного елементу або елементів або "по суті містить" їх, якщо нема інших вказівок або якщо контекст явно не суперечить цьому (наприклад, композицію, описану в цьому описі винаходу, як таку, що містить конкретний елемент, слід також розуміти як опис композиції, що складається з цього елементу, якщо нема інших вказівок або якщо контекст явно не суперечить цьому). Приклади Аналітичні методи Порошкові рентгенограми (XRPD) вимірюють на дифрактометрі PANalytical X'Pert PRO XRay з використанням радіоактивного випромінювання CuKα1. Зразки вимірювали в режимі відбиття в 2θ-діапазоні 5-40° з використанням пристрою для детекції X'celerator. Елементний склад (CHN) вимірювали на апараті Elementar Vario EL від Elementar. Приблизно 4 мг зразка використовували для кожного вимірювання, і результати дані як середні значення двох вимірювань. Приклад 1a. Сіль HBr сполуки I До 442 г етилового естеру 4-(2-п-толілсульфанілфеніл)піперидин-1-карбонової кислоти у вигляді оливи, що перемішували і слабо нагрівали (приблизно 45 °C), додавали 545 мл 33 % мас. HBr в AcOH (5,7 M, 2,5 екв.). Це перемішування давало екзотермічний ефект у 10 °C. Після закінчення додавання реакційну суміш нагрівали до 80 °C і залишали на 18 годин. Відбирали зразок і аналізували за допомогою ВЕРХ і, якщо не відбувалося завершення реакції, було необхідним додавати іще 33 % мас. HBr в AcOH. У іншому випадку суміш охолоджували до 25 °C, примушуючи осідати продукт, гідробромід 4-(2-п-толілсульфанілфеніл)піперидину. Через одну годину при 25 °C до густої суспензії додали 800 мл діетилового етеру. Перемішування продовжували ще годину перед тим, як продукт виділяли фільтрацією, промивали 400 мл діетилового етеру і висушували під вакуумом при 40 °C протягом ночі. Гідробромід сполуки I виділяли у вигляді білої твердої речовини. Приклад 1b. HBr сіль сполуки I 2-(4-Толілсульфаніл)фенілбромід У реакторі при перемішуванні в атмосфері азоту продували азотом N-метил-піролідон (NMP) (4,5 л) протягом 20 хвилин. Додавали 4-метилбензолтіол (900 г, 7,25 моль) і потім 1,2дибромбензол (1709 г, 7,25 моль). Нарешті додавали трет-бутоксид калію (813 г, 7,25 моль) як останній реагент. Реакція була екзотермічною, приводячи до підвищення температури реакційної суміші до 70 °C. Потім реакційну суміш нагрівали до 120 °C протягом 2-3 годин. Реакційну суміш охолоджували до кімнатної температури. Додавали етилацетат (4 л) і водний розчин хлориду натрію (15 %, 2,5 л). Суміш перемішували протягом 20 хвилин. Водну фазу відокремлювали і проводили екстракцію іншою порцією етилацетату (2 л). Водну фазу відокремлювали і органічні фази об'єднували і промивали розчином хлориду натрію (15 %, 2,5 л). Органічну фазу відокремлювали, висушували за допомогою сульфату натрію і випаровували при зниженому тиску до червоної оливи, що містить 20-30 % NMP. Оливу розводили до подвоювання об'єму метанолом і суміш кип'ятили зі зворотним холодильником. Додавали більше метанолу, поки не одержували прозорий червоний розчин. Продукт поволі охолоджували до кімнатної температури при внесенні затравки. Продукт кристалізувався у вигляді не зовсім білих кристалів, їх виділяли фільтрацією, промивали метанолом і висушували при 40 °C у вакуумній печі до постійної маси. Етил-4-гідрокси-4-(2-(4-толілсульфаніл)феніл)піперидин-1-карбоксилат У реакторі при перемішуванні в атмосфері азоту суспендували 2-(4толілсульфаніл)фенілбромід (600 г, 2,15 моль) в гептані (4,5 л). Додавали при кімнатній температурі 10 M BuLi в гексані (235 мл, 2,36 моль) протягом 10 хвилин. Виявили тільки невеликий екзотермічний ефект. Суспензію перемішували протягом 1 години при температурі навколишнього середовища і потім охолоджували до -40 °C. 1-Карбетокси-4-піперидон (368 г, 2,15 моль), розчинений в THF (1,5 л), додавали при такій швидкості, щоб підтримувати температуру реакції нижче -40 °C. Коли реакція дійшла до завершення, реакційну суміш нагрівали до 0 °C і додавали 1M HCl (1 л), підтримуючи температуру нижче 10 °C. Відокремлювали кислу водну фазу і проводили екстракцію етилацетатом (1 л). Органічні фази об'єднували і проводили екстракцію розчином хлориду натрію (15 %, 1 л). Органічну фазу сушили над сульфатом натрію і випаровували до напівкристалічної маси. Її суспендували в етиловому етері (250 мл) і відокремили фільтруванням. Висушували у вакуумній печі при 40 °C 8 UA 99611 C2 5 10 15 20 25 30 35 40 45 50 55 до постійної маси. Етил-4-(2-(4-толілсульфаніл)феніл)піперидин-1-карбоксилат Трифтороцтову кислоту (2,8 кг, 24,9 моль) і триетилсилан (362 г, 3,1 моль) завантажували в реактор з ефективною мішалкою. Етил-4-гідрокси-4-(2-(4-толілсуль-фаніл)феніл)піперидин-1карбоксилат (462 г, 1,24 моль) додавали частинами через насипну лійку. Реакція була слабо екзотермічною. Температура піднімалася до 50 °C. Після закінчення додавання реакційну суміш нагрівали до 60 °C протягом 18 годин. Реакційну суміш охолоджували до кімнатної температури. Додавали толуол (750 мл) і воду (750 мл). Виділяли органічну фазу і проводили екстракцію водної фази іншою порцією толуолу (750 мл). Органічні фази об'єднували, промивали розчином хлориду натрію (15 %, 500 мл) і висушували над сульфатом натрію. Сульфат натрію відокремлювали фільтруванням, фільтрат випаровували при зниженому тиску до червоної оливи, яку переробляли далі на наступній стадії. Гідробромід 4-(2-(4-толілсульфаніл)феніл)піперидину Неочищений етил-4-(2-(4-толілсульфаніл)феніл)піперидин-1-карбоксилат у вигляді червоної оливи з прикладу 3 змішували в реакторі з мішалкою з бромистоводневою кислотою в оцтовій кислоті (40 %, 545 мл, 3,11 моль). Суміш нагрівали при 80 °C протягом 18 годин. Реакційну суміш охолоджували до кімнатної температури. Під час охолоджування продукт викристалізовувався. Через 1 годину при кімнатній температурі до реакційної суміші додавали етиловий етер (800 мл) і суміш перемішували протягом ще однієї години. Продукт відокремлювали фільтруванням, промивали етиловим етером і висушували у вакуумній печі при 50 °C до постійної маси. Приклад 1c. Перекристалізація солі HBr сполуки I Суміш з 10,0 г солі HBr сполуки I, наприклад, одержаної так, як описано вище, нагрівали для кип'ятіння із зворотним холодильником в 100 мл H2O. Суміш ставала прозорою і повністю розчинялася при 80-90 °C. До прозорого розчину додавали 1 г активованого вугілля і продовжували кип'ятіння із зворотним холодильником протягом 15 хвилин, перш ніж профільтрувати і залишити для спонтанного охолоджування до кімнатної температури. Під час охолоджування відбувалося осадження білої твердої речовини і суспензію перемішували протягом 1 години при кімнатній температурі. Фільтрацією і висушуванням у вакуумі при 40 °C протягом ночі одержували 6,9 г (69 %) кислотно-адитивної солі HBr сполуки I. Дивися XRPD на фігурі 1. Елементний аналіз: 3,92 % N, 59,36 % C, 6,16 % H (теоретично: 3,85 % N, 59,34 % C, 6,09 % H). Приклад 1d. Одержання маточних розчинів вільної основи До суміші з 500 мл етилацетату і 200 мл H2O додавали 50 г солі HBr сполуки I, одержуючи двофазну суспензію. До цієї суспензії додавали приблизно 25 мл конц. NaOH, що приводило до утворення прозорого двофазного розчину (pH вимірювали як 13-14). Розчин енергійно перемішували протягом 15 хвилин і відокремлювали органічну фазу. Органічну фазу промивали 200 мл H2O, сушили над Na2SO4, фільтрували і випаровували у вакуумі при 60 °C, одержуючи вихід вільної основи у 38 г (99 %) у вигляді майже безбарвної оливи. Розчиненням 10 г оливи і доведенням об'єму до 150 мл з використанням етилацетату одержували 0,235 M маточний розчин в етилацетаті, з якого використовували аліквоти по 1,5 мл (100 мг вільної основи). Розчиненням 10 г оливи і доведенням об'єму до 100 мл з використанням 96 % об. EtOH одержували 0,353 M маточний розчин в EtOH, з якого використовували аліквоти по 1,0 мл (100 мг вільної основи). Приклад 1e. Утворення солей з використанням маточних розчинів вільної основи Дані аліквоти поміщали в пробірки і при перемішуванні додавали відповідну кількість кислоти, як вказано в таблиці 1. Якщо кислота була рідкою, її додавали нерозчиненою, в інших випадках її розчиняли в даному розчиннику перед додаванням. Після змішування і осадження перемішування продовжували протягом ночі і осад збирали фільтрацією. Перед висушуванням у вакуумі при 30 °C відбирали невеликий контрольний зразок і висушували при кімнатній температурі без вакууму. Цю процедуру включали для тестування сольватів. Деякі результати представлені в таблиці 1. Рентгенограми XRPD показані на фігурах 1-22, а вибрані положення піків наведені в таблиці 2. У таблиці 3 показані розчинності сполук за цим винаходом у воді разом з pH одержаного насиченого розчину. У колонці "осад" показано, чи є осад, виділений після визначення розчинності, ідентичним розчиненій сполуці, що є показником формування гідратів. 9 UA 99611 C2 Таблиця 1 Кислота (основа:кислота) Пальмітинова кислота, гексадеканова кислота 1:1 DL-молочна кислота, DL-2гідрокси-пропіонова кислота 1:1 Адипінова кислота, 1,6гександіова кислота 1:1 Адипінова кислота, 1,6гександіова кислота 2:1 Молярна маса (MW) (г/моль) Кількість кислоти Розчинник CHN (експ.) (мг або мкл) CHN (теор.) 256,42 90,5 EtOAc 75,36 9,77 2,46 75,64 9,9 2,6 90,1 31,8 EtOAc 66,88 7,26 3,52 67,53 7,29 3,75 146,14 51,6 EtOAc 146,14 25,8 EtOAc Фумарова кислота 1:1 116,01 40,9 EtOH Глутарова кислота, 1,5пентандіова кислота 1:1 132,12 46,6 EtOAc Малонова кислота 1:1 104,1 36,7 EtOAc Щавлева кислота 1:1 90,1 31,8 EtOH Себацинова кислота, 1,8октандіова кислота 2:1 202,02 35,6 EtOAc Бурштинова кислота, 1,4бутандіова кислота 2:1 118,1 20,8 EtOAc 65,65 6,86 3,4 65,80 6,78 3,49 (утворює сіль 1:1) 134,1 47,3 EtOAc 62,87 6,20 3,22 63,29 6,52 3,36 134,1 47,3 EtOH 62,99 6,66 3,13 63,29 6,52 3,36 150,1 53,0 EtOH 60,67 6,4 3,07 60,95 6,28 3,23 L-оксибурштинова кислота, L-2-гідроксибутандіова кислота 1:1, α L-оксибурштинова кислота, L-2-гідроксибутандіова кислота 1:1, β D-винна кислота, D-2,3-дигідрокси-бутандіова кислота 1:1 L-аспарагінова кислота 1:1 133,1 47,0 EtOH Глутамінова кислота 1:1 165,15 58,3 EtOH Лимонна кислота 2:1 192,13 33,9 EtOAc 2M 176,4 24,0 EtOAc 67,1 7,27 3,26 70,75 7,35 3,93 66,14 6,31 3,51 66,48 7,03 3,37 65,09 6,5 3,62 64,32 6,21 3,75 71,83 7,86 3,64 59,31 6,7 7,1 (містить 63,43 6,78 6,73 надлишок кислоти) 56,38 6,88 56,46 6,94 7,06 7,35 (містить (для солі 1:1 і надлишок моногідрата кислоти) кислоти 1:1) 65,93 6,72 66,46 6,64 3,69 3,44 EtOH 14,7M 66,08 7,23 2,98 70,66 7,32 3,82 65,71 6,41 3,35 66,09 6,97 3,2 65,04 6,53 3,54 64,28 6,41 3,61 71,79 7,86 3,58 HCl/Et2O 1:1 Фосфорна кислота 1:1 10 55,79 6,47 3,43 56,68 6,34 3,67 UA 99611 C2 Таблиця 2 Вибрані положення рентгенівських піків (°2θ), 2:1 означає 2 основи на 1 кислоту. Всі значення +-0,1° Пальмітат Стеарат Лактат Гідрат лактату Гідроксил-ізобутират Сіль себацинової кислоти Сіль адипінової кислоти 2:1 Сіль адипінової кислоти 1:1 α Сіль адипінової кислоти 1:1 β Глутарат 1:1 Сукцинат 1:1 Фумарат 1:1 Фумарат 2:1 Малеат 1:1 Малеат 1:1 гідрат Малонат α Малонат β Аспартат Гідрат аспартату Глутамат Оксалат Малат 1:1 α Малат 1:1 β Гідрат малату D-тартрат (з EtOH) Гідрохлорид Гідробромід Гідробромід 1-PrOH сольват 7,00 6,70 5,30 11,67 5,09 7,18 8,03 9,33 15,69 9,39 11,74 8,90 8,49 12,11 12,81 10,77 6,08 11,05 7,80 7,71 14,68 8,30 10,91 12,30 5,08 12,44 6,08 6,57 16,34 15,52 8,18 16,70 16,60 12,53 13,52 14,01 21,53 11,70 14,33 11,47 12,48 15,51 18,76 16,70 10,11 20,1 13,80 14,01 17,45 12,04 12,87 15,56 17,18 16,72 14,81 13,12 22,73 21,81 9,44 18,25 20,38 21,11 17,90 18,72 25,81 14,05 17,75 19,25 17,78 17,48 20,53 19,93 18,25 20,60 14,10 19,26 19,50 17,23 14,14 19,56 19,42 19,45 19,26 19,07 28,21 28,91 17,24 21,76 27,37 24,19 24,60 20,63 31,18 14,58 26,84 22,33 23,97 22,53 27,31 24,01 20,26 25,00 19,63 22,57 23,90 20,67 26,16 23,30 22,10 25,02 25,38 24,77 Таблиця 3 Кислота (основа:кислота) Розчинність (мг/мл) Одержаний pH Пальмітинова кислота, 0,4 8,6 гексадеканова кислота 1:1 DL-молочна кислота, DL-2>150 6,1 гідроксипропіонова кислота 1:1 Адипінова кислота, 1,6-гександіова 2,5 4,0 кислота 1:1 Адипінова кислота, 1,6-гександіова 1,0 7,8 кислота 2:1 Фумарова кислота 1:1 0,2 3,3 Глутарова кислота, 1,5-пентадіова 13 4,6 кислота 1:1 Малонова кислота 1:1 (α) 5,2 4,0 Щавлева кислота 1:1 1,1 2,7 Себацинова кислота, 1,80,7 5,5 октандіова кислота 2:1 Бурштинова кислота, 1,42,0 4,0 бутандіова кислота 2:1 L-яблучна кислота, L-22,8 4,0 гідроксибутандіова кислота 1:1, β D-винна кислота, D-2,31,8 3,5 дигідроксибутандіова кислота 1:1 11 Осад =початок утворення =початок утворення (після випаровування) Частково сіль 2:1 =початок утворення =початок утворення =початок утворення =нова форма (β) =початок утворення =початок утворення Гідрат Гідрат Гідрат UA 99611 C2 L-аспарагінова кислота 1:1 Глутамінова кислота 1:1 Лимонна кислота 2:1 Фосфорна кислота 1:1 HCl HBr 5 10 15 20 25 30 35 40 45 50 39 >35 0,5 6,0 4,5 2,4 4,3 4,6 4,7 2,0 6,8 7,0 Гідрат =початок утворення ? =початок утворення =початок утворення Приклад 2A. Інгібування зворотного захоплення серотоніну (5-HT) і норадреналіну (NE) Аліквоти досліджуваної сполуки і препарат кортикальних синаптосом щура попередньо 3 3 інкубували протягом 10 хв./37 °C, а потім додавали [ H]NE або [ H]5-HT (кінцева концентрація 10 нМ). Неспецифічне захоплення визначали у присутності 10 мкМ талсупраму або циталопраму, а загальне захоплення визначали у присутності буфера. Аліквоти інкубували протягом 15 хвилин 3 3 при 37 °C. Після інкубації [ H]NE або [ H]5-HT, поглинені синаптосомами, відокремлювали фільтрацією через Unifilter GF/C, заздалегідь просочений в 0,1 % PEI, протягом 30 хвилин, з використанням програми Tomtec Cell Harvester. Фільтри промивали і підраховували в лічильнику Wallac MicroBeta. При NET сполука I демонструє значення IC50 23 нM. При SERT сполука I демонструє значення IC50 8 нM. Приклад 2B. Антагонізм стосовно 5-HT2A Сполуку І досліджували щодо афінності до рецепторів серотоніну і знайшли, що вони виявляють антагоністичний профіль з афінністю до рецепторів 5-HT2A (Ki 54 нМ). Афінітет (X-logIC ) розрахували за рівнянням Y=100/(1+10 50 ), де Y позначає відсоток зв’язування, а X позначає концентрацію сполуки. 5 концентрацій сполуки (1, 10, 30, 100, 1000 нМ) використовували для обчислення значення IC50. Ki обчислювали з рівняння Чена-Прусоффа Ki=(IC50/(1+([L]/Kd)). Афінність визначали на MDL Pharmaservices, номер за каталогом 271650. У клітинах ссавців, що експресують рецептори 5-HT2A людини, сполука І показала конкурентні антагоністичні властивості. Сполуки зв'язуються з рецепторами 5-HT2A з Ki
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the treatment of adhd and use of 4-[2-(4-methylphenylsulfanyl)-phenyl]piperidine for the production of medicinal agent
Автори англійськоюStensbol, Tine, Bryan, Miller, Silke
Назва патенту російськоюСпособ лечения дефицита внимания с гиперактивностью (adhd) и применение 4-[2-(4-метилфенилсульфанил)фенил]пиперидина для производства лекарственного средства
Автори російськоюСтенсбьол Тине Брайан, Миллер Зилке
МПК / Мітки
МПК: A61K 31/451, C07D 211/20, A61P 25/28, A61P 25/24
Мітки: засобу, застосування, уваги, лікарського, лікування, дефіциту, 4-[2-(4-метилфенілсульфаніл)феніл]піперидину, гіперактивністю, виробництва, adhd, спосіб
Код посилання
<a href="https://ua.patents.su/33-99611-sposib-likuvannya-deficitu-uvagi-z-giperaktivnistyu-adhd-ta-zastosuvannya-4-2-4-metilfenilsulfanilfenilpiperidinu-dlya-virobnictva-likarskogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування дефіциту уваги з гіперактивністю (adhd) та застосування 4-[2-(4-метилфенілсульфаніл)феніл]піперидину для виробництва лікарського засобу</a>
Попередній патент: Гетероариламідні аналоги як антагоністи p2x7
Наступний патент: Інгібітори шляху хеджхога
Випадковий патент: Препарат - трансдермальна терапевтична система флоредерм для місцевого застосування