Похідні 7-азаіндолу як селективні інгібітори бета-гідроксистероїду дегідрогенази 1 типу
Номер патенту: 102379
Опубліковано: 10.07.2013
Автори: Роше Дід'є, Шутц Юрген, Карніато Деніс, Халлакоу-Бозек Софі
Формула / Реферат
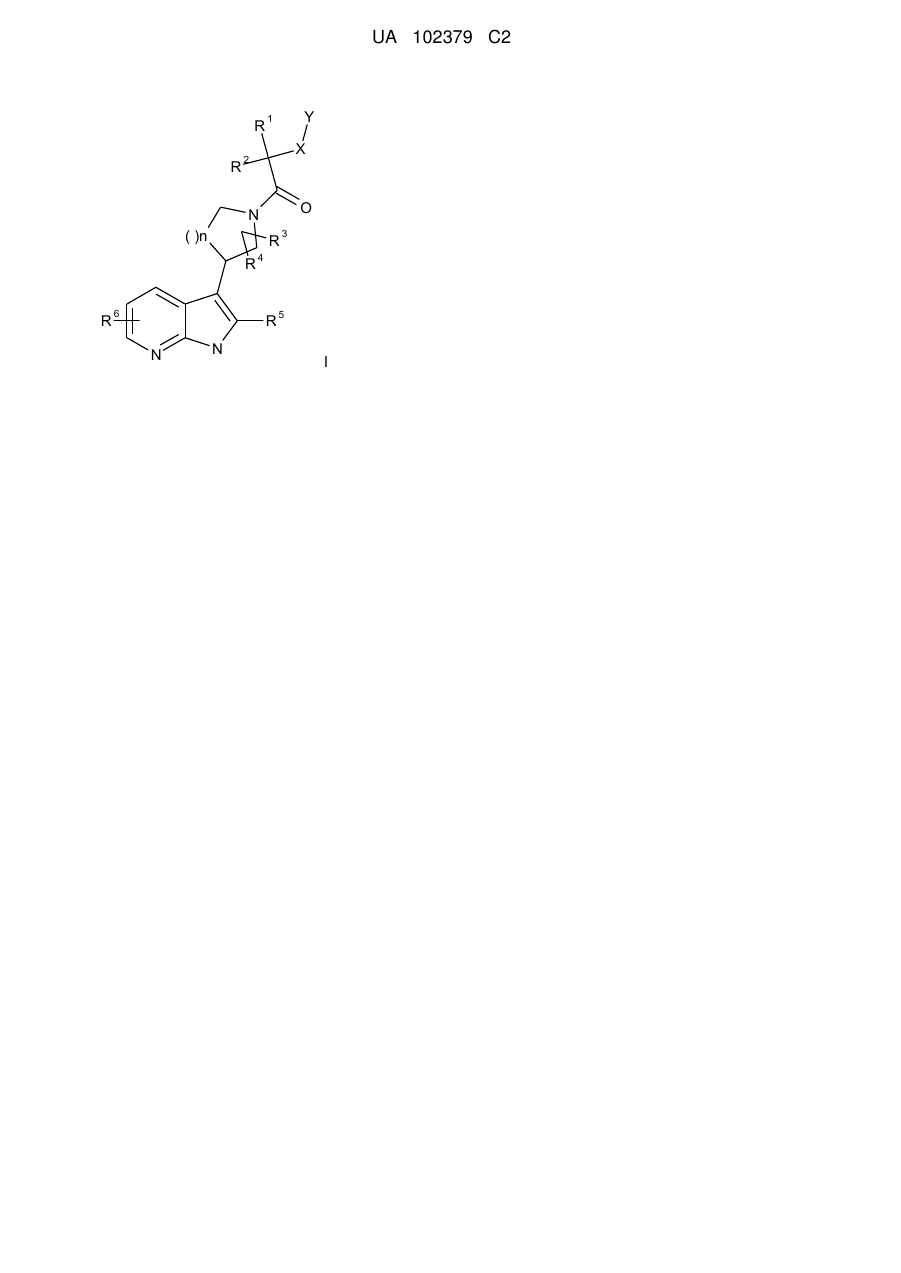
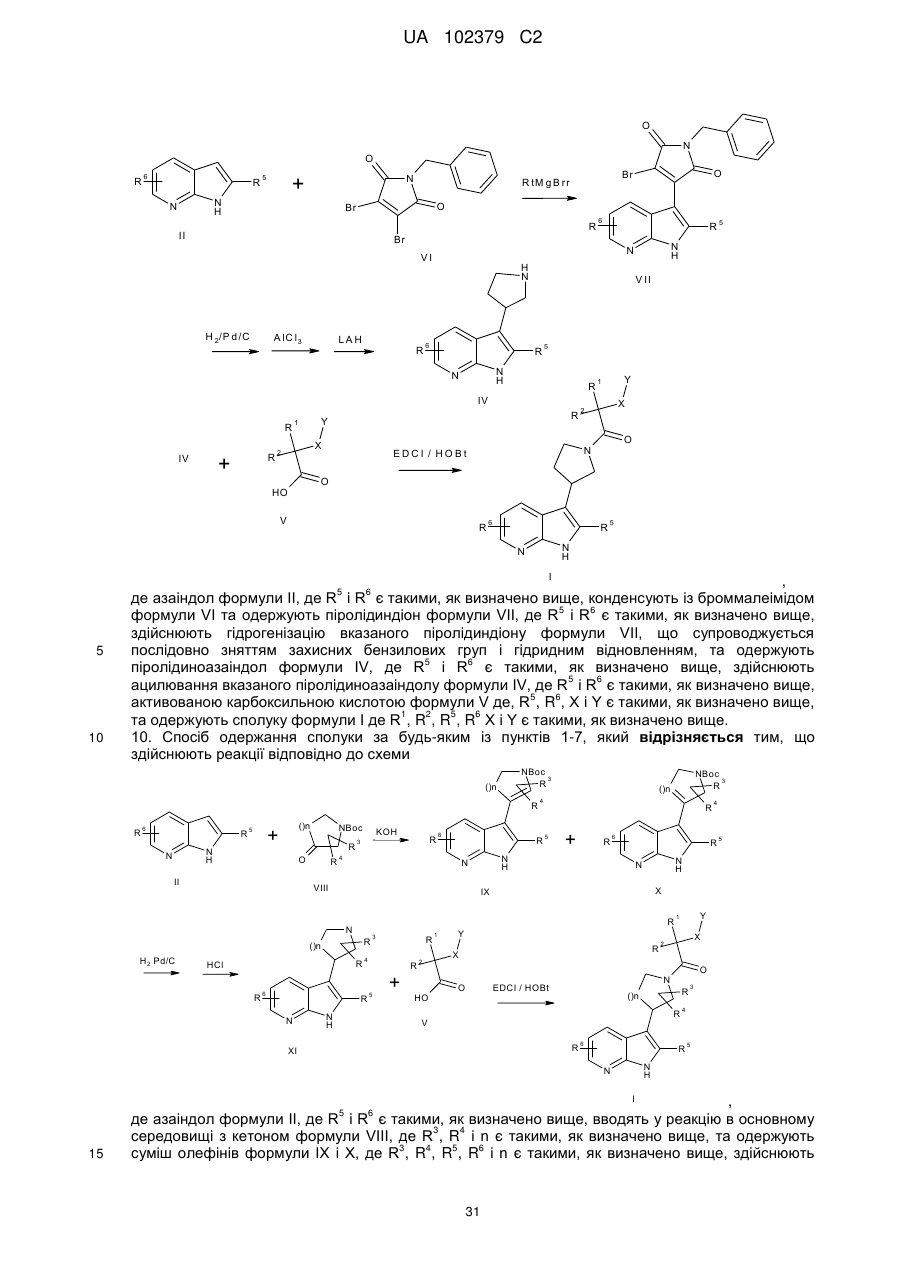
1. Сполука формули І
 , I
, I
де
Rl, R2 являють собою незалежно один від одного Н, алкіл, циклоалкіл, галогеналкіл, Ar, гетероарил або гетероциклоалкіл,
R3, R4 являють собою незалежно один від одного Н, алкіл, Hal або ОН,
R5, R6 являють собою незалежно один від одного Н, алкіл, галогеналкіл або Hal,
X являє собою -(С)m, -О-, -S-, -S(O)- або -S(O)2,
Υ являє собою алкіл, алкоксіалкіл, циклоалкіл, арилокси, гетероарилокси, феніл або гетероарил, необов'язково моно-, ди- або тризаміщений Hal, алкіл, С1-4алкілокси, трифторметил, трифторметокси, С1-4алкілоксикарбоніл, С1-4алкілкарбоніл або R7R8С1-4алкілокси,
R7, R8 являють собою незалежно один від одного С1-4алкіл або С4-7циклоалкіл,
n має значення 1 або 2, і
m має значення 0 або 1,
або її фізіологічно прийнятні солі, похідні, сольвати й стереоізомери, включаючи їх суміші у будь-яких співвідношеннях.
2. Сполука за п. 1, де
Rl, R2 являють собою незалежно один від одного Н, алкіл, циклоалкіл, галогеналкіл, Аr, гетероарил або гетероциклоалкіл,
R3, R4 являють собою незалежно один від одного Н, алкіл, Hal або ОН,
R5, R6 являють собою незалежно один від одного Н, алкіл, галогеналкіл або Hal,
X являє собою -(С)m, -О-, -S-, -S(O)- або -S(O)2,
Υ являє собою алкіл, алкоксіалкіл, циклоалкіл, арилокси, гетероарилокси, феніл або гетероарил, необов'язково моно-, ди- або тризаміщений Hal, алкіл, С1-4алкілокси, трифторметил, трифторметокси, С1-4алкілоксикарбоніл, С1-4алкілкарбоніл або R7R8NС1-4алкілокси,
R7, R8 являють собою незалежно один від одного С1-4алкіл або С4-7циклоалкіл,
n має значення 1, і
m має значення 0 або 1,
або її фізіологічно прийнятні солі, похідні, сольвати й стереоізомери, включаючи їх суміші у будь-яких співвідношеннях.
3. Сполука за п. 1, де
Rl, R2 являють собою незалежно один від одного алкіл, циклоалкіл, галогеналкіл, Ar, гетероарил або гетероциклоалкіл,
R3, R4 являють собою незалежно один від одного Н, алкіл, Hal або ОН,
R5, R6 являють собою незалежно один від одного Н, алкіл, галогеналкіл або Hal,
X являє собою -(С)m, -О-, -S-, -S(O)- або -S(O)2,
Υ являє собою алкіл, алкоксіалкіл, циклоалкіл, арилокси, гетероарилокси, феніл або гетероарил, необов'язково моно-, ди- або тризаміщений Hal, алкіл, С1-4алкілокси, трифторметил, трифторметокси, С1-4алкілоксикарбоніл, С1-4алкілкарбоніл або R7R8NС1-4алкілокси,
R7, R8 являють собою незалежно один від одного С1-4алкіл або С4-7циклоалкіл,
n має значення 1, і
m має значення 0 або 1,
або її фізіологічно прийнятні солі, похідні, сольвати й стереоізомери, включаючи їх суміші у будь-яких співвідношеннях.
4. Сполука за п. 1, де
Rl, R2 являють собою незалежно один від одного алкіл, циклоалкіл, галогеналкіл, Ar, гетероарил або гетероциклоалкіл,
R3, R4 являють собою незалежно один від одного Н, алкіл, Hal або ОН,
R5, R6 являють собою незалежно один від одного Η або Hal,
X являє собою -(С)m, -О-, -S-, -S(O)- або -S(O)2,
Υ являє собою алкіл, алкоксіалкіл, циклоалкіл, арилокси, гетероарилокси, феніл або гетероарил, необов'язково моно-, ди- або тризаміщений Hal, алкіл, С1-4алкілокси, трифторметил, трифторметокси, С1-4алкілоксикарбоніл, С1-4алкілкарбоніл або R7R8NС1-4алкілокси,
R7, R8 являють собою незалежно один від одного С1-4алкіл або С4-7циклоалкіл,
n має значення 1, і
m має значення 0 або 1,
або її фізіологічно прийнятні солі, похідні, сольвати й стереоізомери, включаючи їх суміші у будь-яких співвідношеннях.
5. Сполука за п. 1, де
Rl, R2 являють собою незалежно один від одного алкіл, циклоалкіл, галогеналкіл, Ar, гетероарил або гетероциклоалкіл,
R3, R4 являють собою незалежно один від одного Н, алкіл, Hal або ОН,
R5, R6 являють собою незалежно один від одного Н,
X являє собою -(C)m,
Υ являє собою арилокси, гетероарилокси, феніл або гетероарил, необов'язково моно-, ди- або тризаміщений Hal, алкіл, С1-4алкілокси, трифторметил, трифторметокси, С1-4алкілоксикарбоніл, С1-4алкілкарбоніл або R7R8NС1-4алкілокси,
R7, R8 являють собою незалежно один від одного С1-4алкіл або С4-7циклоалкіл,
n має значення 1, і
m має значення 0,
і її фізіологічно прийнятні солі, похідні, сольвати й стереоізомери, включаючи їх суміші у будь-яких співвідношеннях.
6. Сполука за п. 1, де
Rl, R2 являють собою незалежно один від одного Н, алкіл, циклоалкіл, галогеналкіл, Ar, гетероарил або гетероциклоалкіл,
R3, R4 являють собою незалежно один від одного Н, алкіл, Hal або ОН,
R5, R6 являють собою незалежно один від одного Н, алкіл, галогеналкіл або Hal,
X являє собою -(C)m, -О-, -S-, -S(O)- або -S(O)2,
Υ являє собою алкіл, алкоксіалкіл, циклоалкіл, арилокси, гетероарилокси, феніл або гетероарил, необов'язково моно-, ди- або тризаміщений Hal, алкіл, С1-4алкілокси, трифторметил, трифторметокси, С1-4алкілоксикарбоніл, С1-4алкілкарбоніл або R7R8NС1-4алкілокси,
R7, R8 являють собою незалежно один від одного С1-4алкіл або С4-7циклоалкіл,
n має значення 2, і
m має значення 0 або 1,
або її фізіологічно прийнятні солі, похідні, сольвати й стереоізомери, включаючи їх суміші у будь-яких співвідношеннях.
7. Сполука за п. 1, яку вибирають із групи, що містить:
a) (2-фторофеніл)-[3-(1H-піроло[2,3-b]піридин-3-іл)піролідин-1-іл]метанон,
b) (4-метокси-2-метилфеніл)-[3-(1H-піроло[2,3-b]піридин-3-іл)піролідин-1-іл]метанон,
c) (циклогексил)-[3-(1H-піроло[2,3-b]піридин-3-іл)піролідин-1-іл]метанон,
d) (піридин-3-іл)-[3-(1H-піроло[2,3-b]піридин-3-іл)піролідин-1-іл]метанон,
e) [3-(1H-піроло[2,3-b]піридин-3-іл)-піролідин-1-іл]-о-толілметанон,
f) (2-метил-2-феніл-1)-[3-(1H-піроло[2,3-b]піридин-3-іл)піролідин-1-іл]пропан-1-он,
g) (4-диметиламінофеніл)-[3-(1H-піроло[2,3-b]піридин-3-іл)піролідин-1-іл]метанон,
h) (1-фенілциклопропіл)-[3-(1H-піроло[2,3-b]піридин-3-іл)піролідин-1-іл]метанон,
і) 2-(4-хлорфеніл)-2-метил-1-[3-(1H-піроло[2,3-b]піридин-3-іл)піролідин-1-іл]пропан-1-он,
j) 2-метил-2-фенокси-1-[3-(1H-піроло[2,3-b]]піридин-3-іл)піролідин-1-іл]пропан-1-он,
k) 1-(4-хлорофеніл)циклобутил-[3-(1H-піроло[2,3-b]піридин-3-іл)піролідин-1-іл]метанон,
l) 2-(4-хлорофенокси)-2-метил-1-[4-(1Н-піроло[2,3-b]піридин-3-іл)піперидин-1-іл]пропан-1-он,
m) 2-метил-1-[4-(1H-піроло[2,3-b]піридин-3-іл)піперидин-1-іл]-2-[4-(5-трифторметилпіридин-2-іл)піперазин-1-іл]пропан-1-он,
n) 4-(4-фторофенокси)-3,3-диметил-1-[4-(1H-піроло[2,3-b]піридин-3-іл)піперидин-1-іл]бутан-1-он,
о) 2-(4-хлорофеніл)-2-метил-1-[4-(1Н-піроло[2,3-b]піридин-3-іл)піперидин-1-іл]пропан-1-он,
р) [1-(4-хлорофеніл)циклопропіл]-[4-(1Н-піроло[2,3-b]піридин-3-іл)піперидин-1-іл]метанон,
q) 4-(4-фторофенокси)-3,3-диметил-1-[3-(1H-піроло[2,3-b]піридин-3-іл)-піролідин-1-іл]бутан-1-он,
r) [1-(4-фторофенокси)циклопропіл]-[3-(1H-піроло[2,3-b]піридин-3-іл)піролідин-1-іл]метанон,
s) [1-(4-хлорофеніл)циклопропіл]-[3-(1H-піроло[2,3-b]піридин-3-іл)піролідин-1-іл]метанон,
t) 2-(4-хлоробензолсульфоніл)-1-[3-(1H-піроло[2,3-b]піридин-3-іл)піролідин-1-іл]етанон;
або її фізіологічно прийнятні солі, похідні, сольвати й стереоізомери, включаючи їх суміші у будь-яких співвідношеннях.
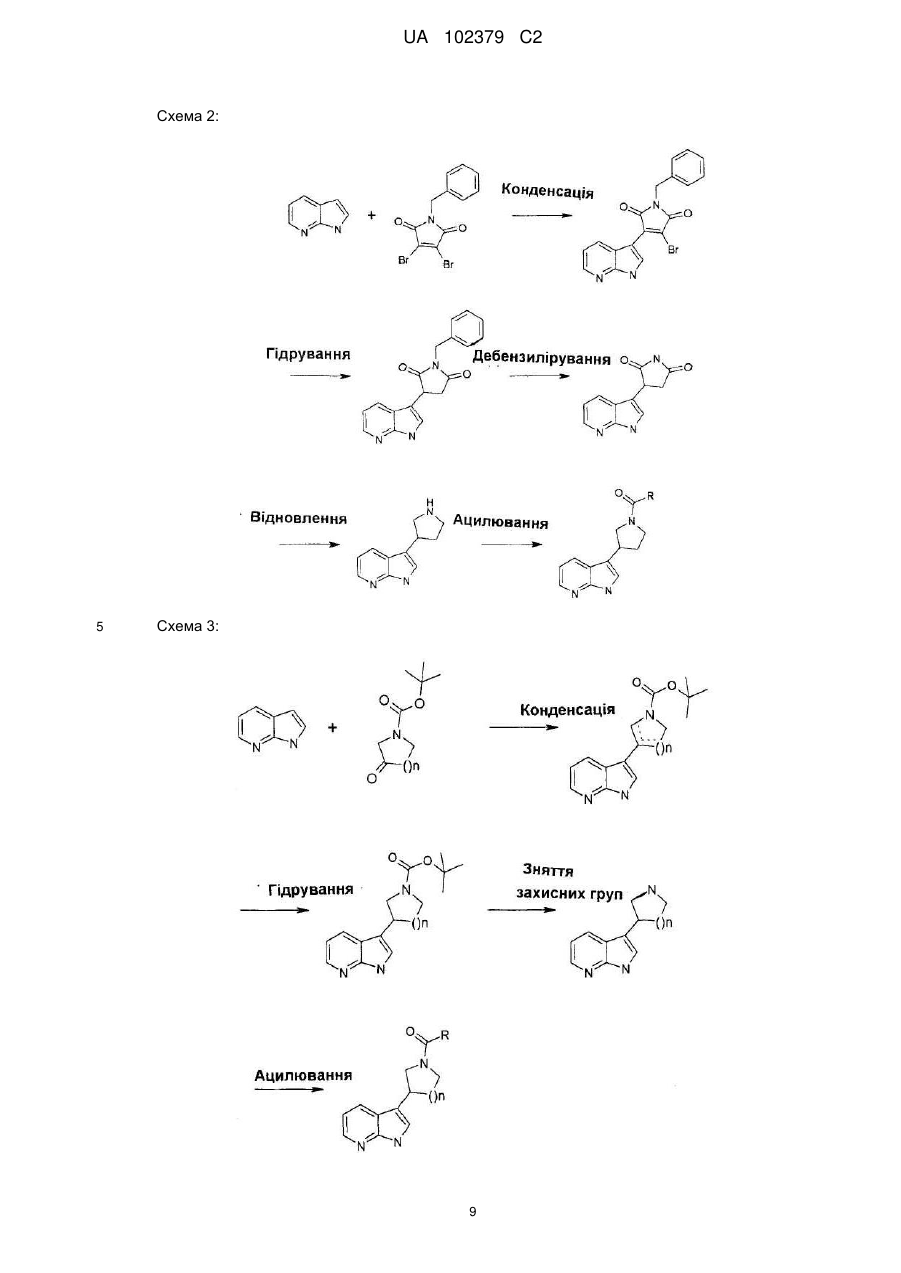
8. Спосіб одержання сполуки за будь-яким із пунктів 1-7, який відрізняється тим, що здійснюють реакції відповідно до схеми
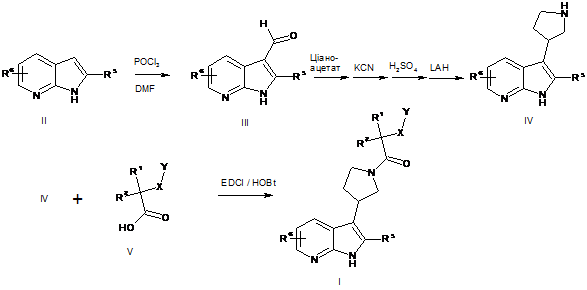 ,
,
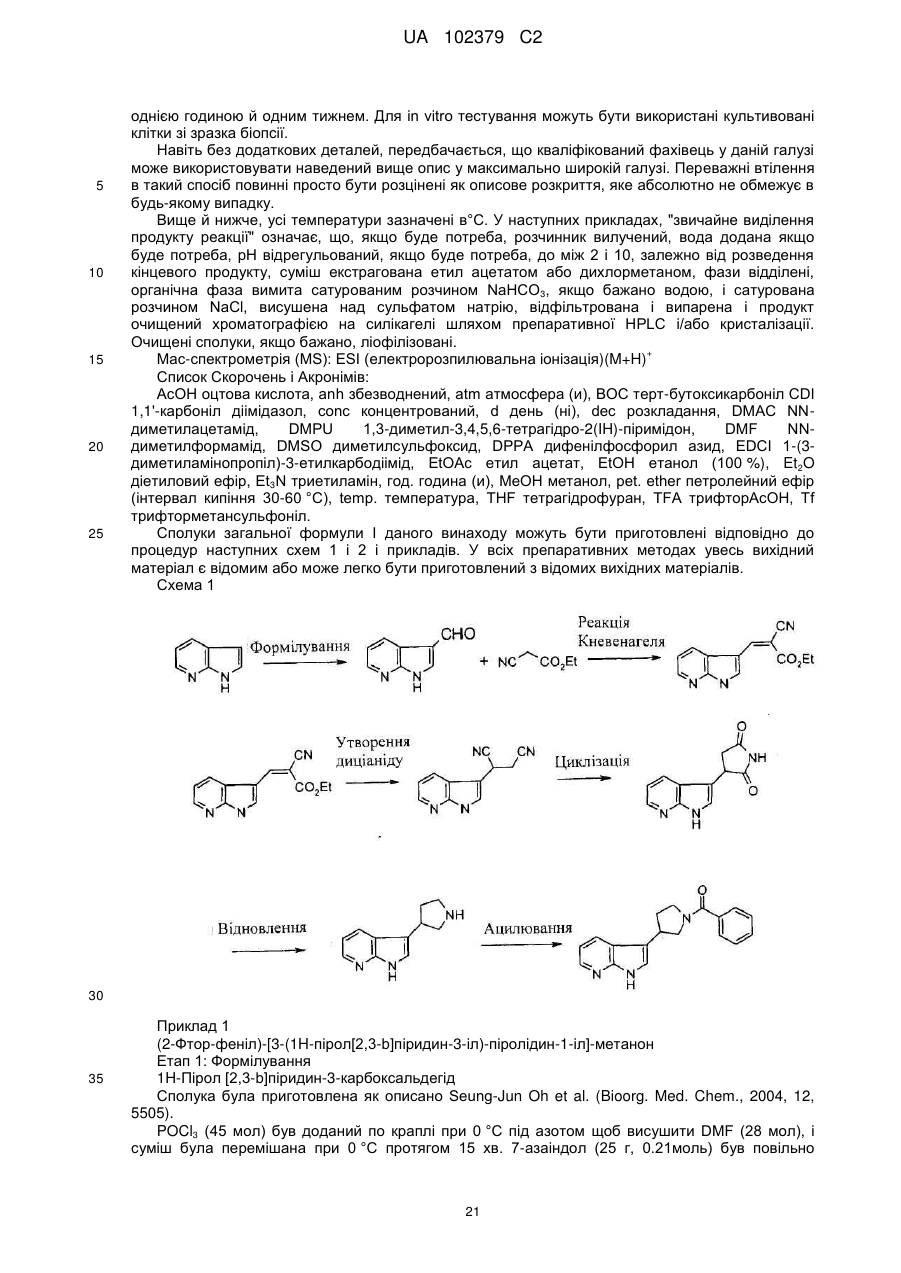
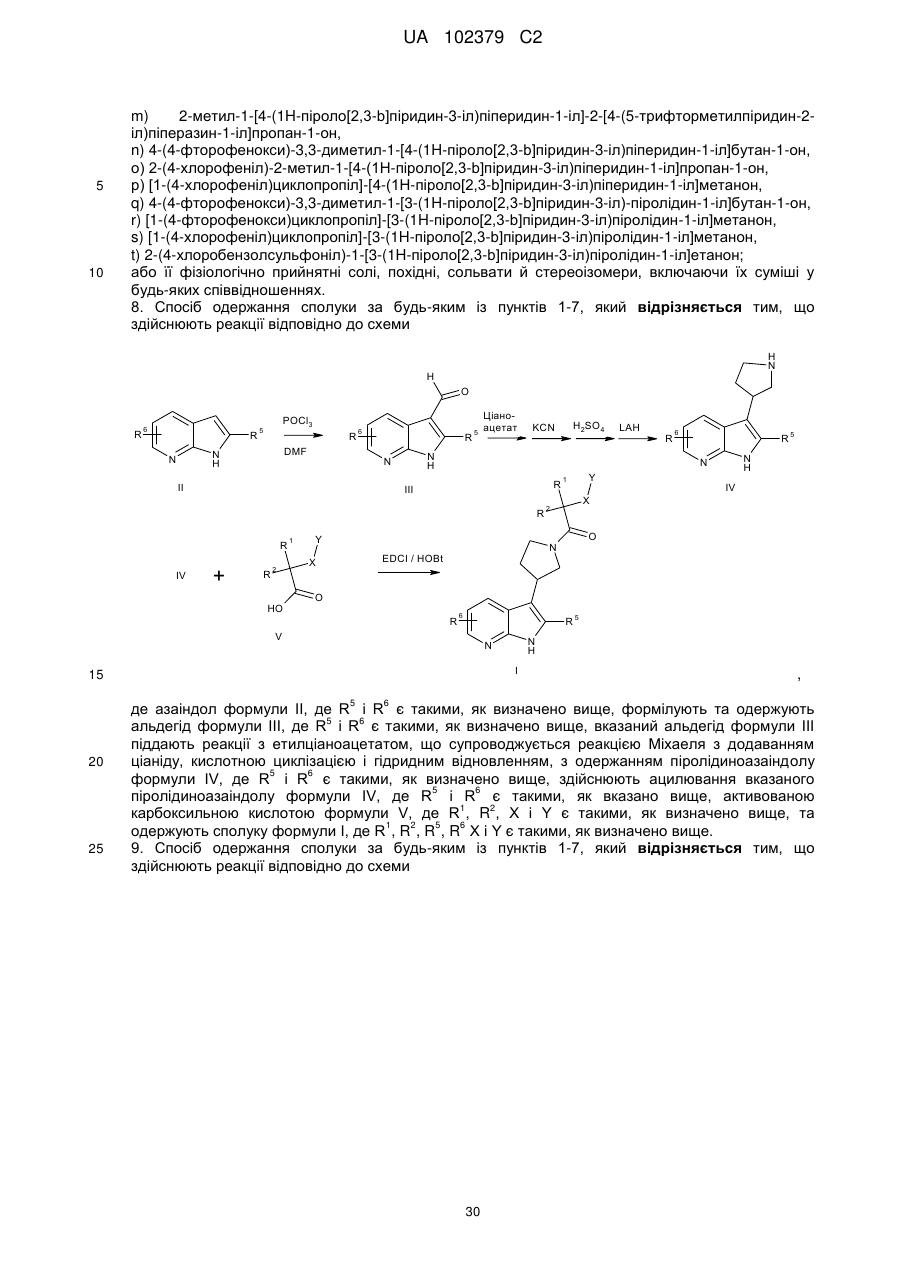
де азаіндол формули II, де R5 і R6 є такими, як визначено вище, формілують та одержують альдегід формули III, де R5 і R6 є такими, як визначено вище, вказаний альдегід формули III піддають реакції з етилціаноацетатом, що супроводжується реакцією Міхаеля з додаванням ціаніду, кислотною циклізацією і гідридним відновленням, з одержанням піролідиноазаіндолу формули IV, де R5 і R6 є такими, як визначено вище, здійснюють ацилювання вказаного піролідиноазаіндолу формули IV, де R5 і R6 є такими, як вказано вище, активованою карбоксильною кислотою формули V, де R1, R2, X і Υ є такими, як визначено вище, та одержують сполуку формули І, де R1, R2, R5, R6 X і Υ є такими, як визначено вище.
9. Спосіб одержання сполуки за будь-яким із пунктів 1-7, який відрізняється тим, що здійснюють реакції відповідно до схеми
 ,
,
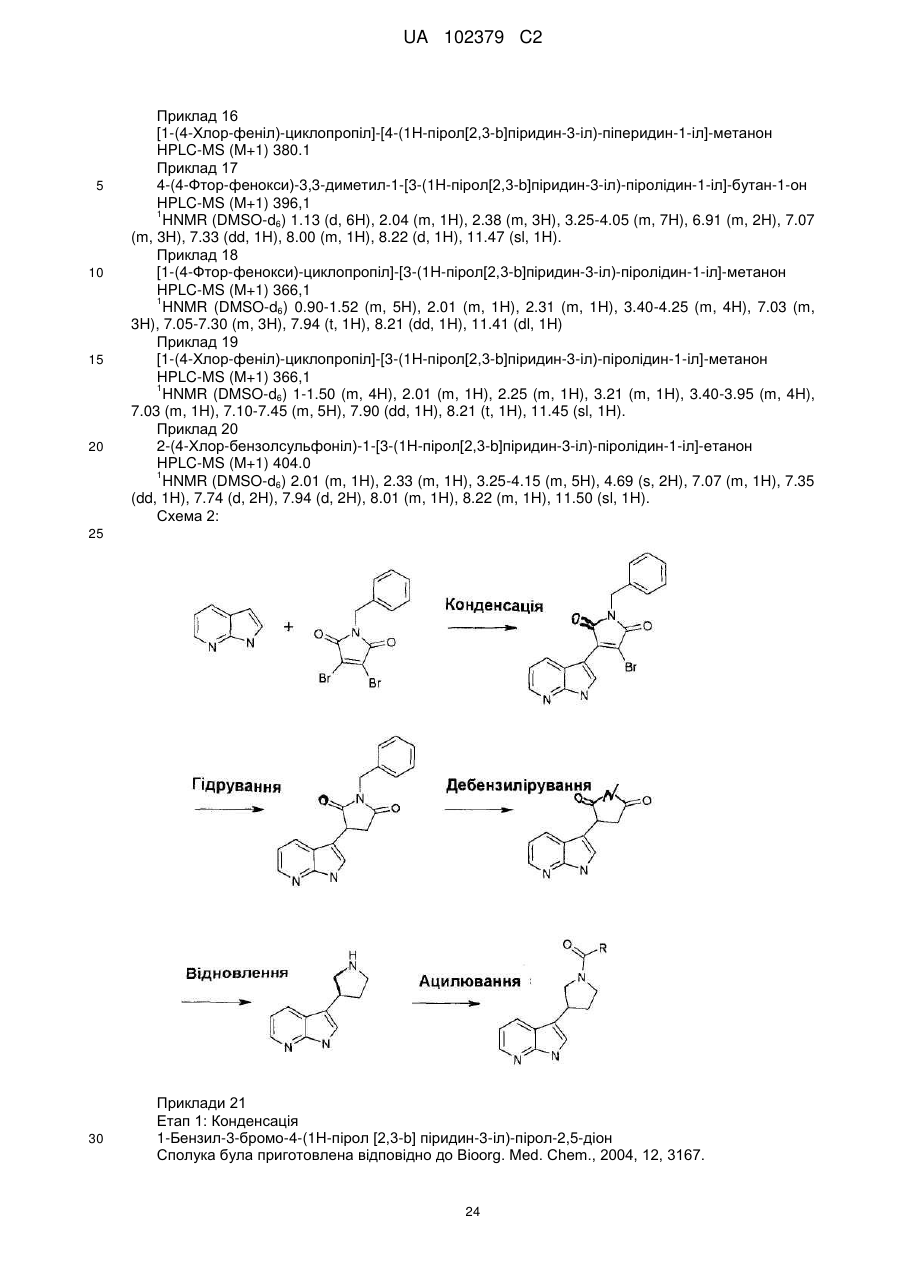
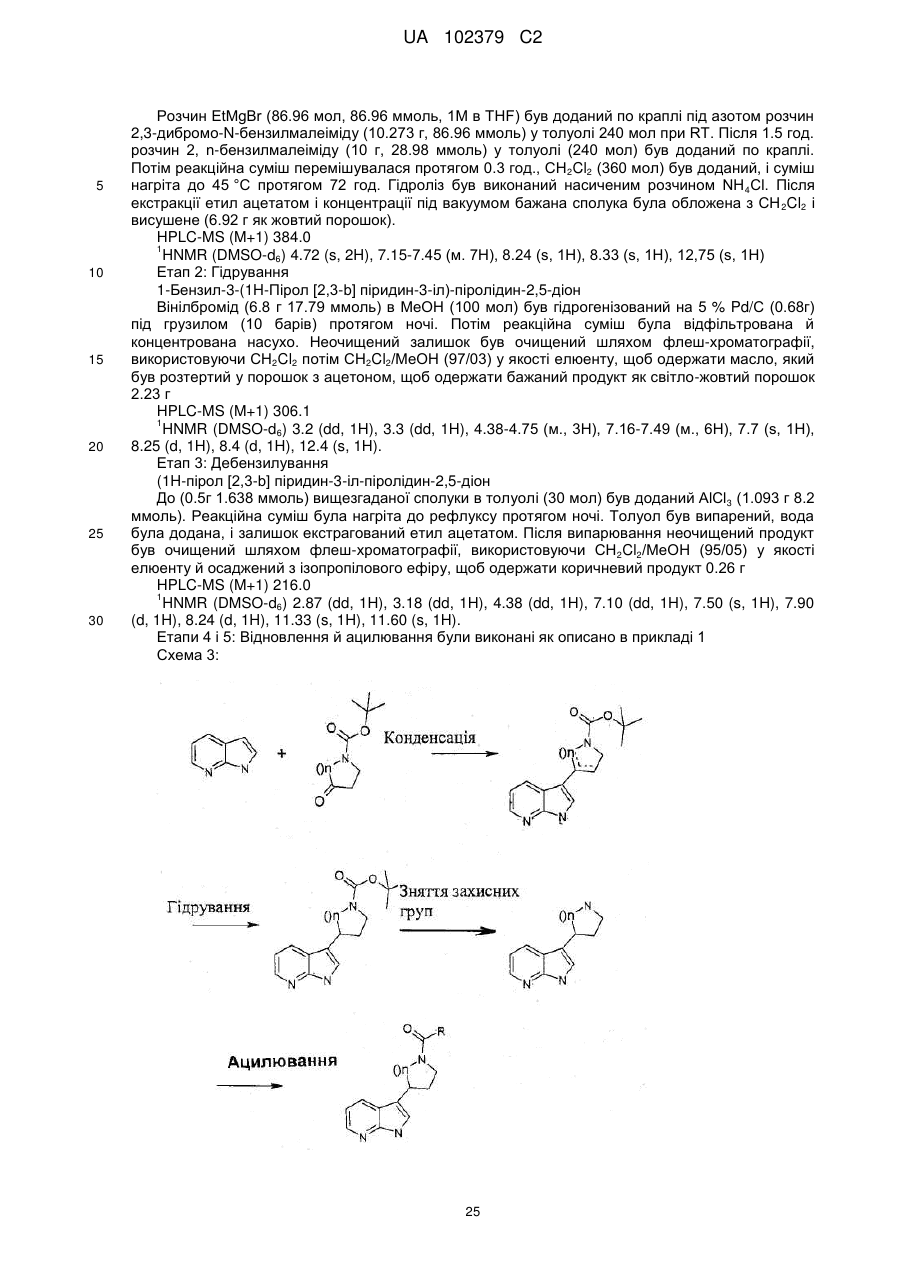
де азаіндол формули II, де R5 і R6 є такими, як визначено вище, конденсують із броммалеімідом формули VI та одержують піролідиндіон формули VII, де R5 і R6 є такими, як визначено вище, здійснюють гідрогенізацію вказаного піролідиндіону формули VII, що супроводжується послідовно зняттям захисних бензилових груп і гідридним відновленням, та одержують піролідиноазаіндол формули IV, де R5 і R6 є такими, як визначено вище, здійснюють ацилювання вказаного піролідиноазаіндолу формули IV, де R5 і R6 є такими, як визначено вище, активованою карбоксильною кислотою формули V де, R5, R6, X і Υ є такими, як визначено вище, та одержують сполуку формули І де R1, R2, R5, R6 X і Υ є такими, як визначено вище.
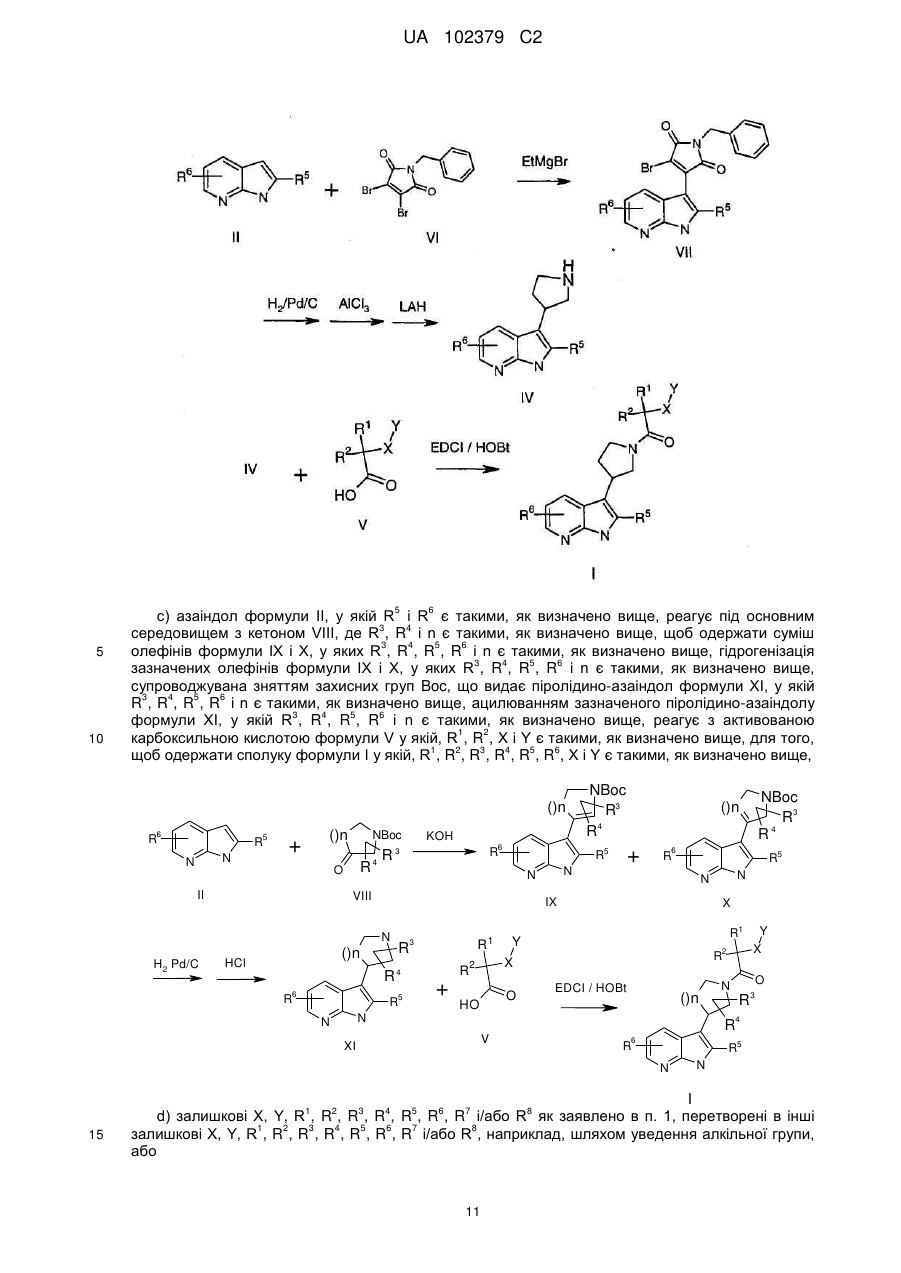
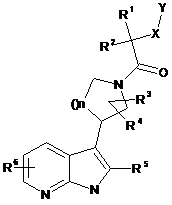
10. Спосіб одержання сполуки за будь-яким із пунктів 1-7, який відрізняється тим, що здійснюють реакції відповідно до схеми
 ,
,
де азаіндол формули II, де R5 і R6 є такими, як визначено вище, вводять у реакцію в основному середовищі з кетоном формули VIII, де R3, R4 і n є такими, як визначено вище, та одержують суміш олефінів формули IX і X, де R3, R4, R5, R6 і n є такими, як визначено вище, здійснюють гідрогенізацію вказаних олефінів формули IX і X, де R3, R4, R5, R6 і n є такими, як визначено вище, що супроводжується послідовно зняттям захисних груп Вос, та одержують піролідиноазаіндол формули XI, де R3, R4, R5, R6 і n є такими, як визначено вище, здійснюють ацилювання вказаного піролідиноазаіндолу формули XI, де R3, R4, R5, R6 і n є такими, як визначено вище, активованою карбоксильною кислотою формули V, у якій R1, R2, X і Υ є такими, як визначено вище, та одержують сполуку формули І, де R1, R2, R3, R4, R5, R6, X і Υ є такими, як визначено вище.
11. Спосіб одержання сполуки за будь-яким із пунктів 1-7, який відрізняється тим, що
залишкові X, Y, R1, R2, R3, R4, R5, R6, R7 і/або R8, як заявлено в п. 1, перетворюють в інші залишкові X, Y, R1, R2, R3, R4, R5, R6, R7 і/або R8, наприклад, шляхом уведення алкільної групи.
12. Спосіб одержання солі сполуки за будь-яким із пунктів 1-7, який відрізняється тим, що сполуку формули І ізолюють і/або обробляють кислотою або основою та одержують її сіль.
13. Застосування сполуки за будь-яким із пунктів 1-7 як 11β-HSD1-інгібітора.
14. Застосування сполуки за будь-яким із пунктів 1-7 для приготування лікарського засобу.
15. Застосування сполуки за будь-яким із пунктів 1-7 для приготування лікарського засобу для лікування і/або запобігання хворобам, які викликані, опосередковані і/або репродуковані високими рівнями кортизолу.
16. Застосування сполуки за будь-яким із пунктів 1-7 для приготування лікарського засобу для лікування і/або запобігання одній або більше хворобам або патологічним станам, вибраним із групи, яка складається із таких, як метаболічний синдром, цукровий діабет, особливо інсулінонезалежний цукровий діабет, преддіабет, резистентність до інсуліну, низька толерантність до глюкози, гіперглікемія, ожиріння й пов'язані з вагою порушення, розлади ліпідного обміну, такі як дисліпідемія, гіперліпідемія, гіпертригліцеридемія, гіперхолестеринемія, низькі рівні HDL або високі рівні LDL, глаукома, остеопороз, опосередковані глюкокортикоїдом ефекти на нейронну функцію, такі як порушення когнітивних функцій, занепокоєння або депресія, нейродегенеративна хвороба, імунні розлади, такі як туберкульоз, проказа або псоріаз, артеріальна гіпертензія, атеросклероз і його ускладнення, васкулярний рестеноз, серцево-судинні хвороби, панкреатит, ретинопатія, невропатія й нефропатія.
17. Фармацевтична композиція, яка відрізняється тим, що вона містить терапевтично ефективну кількість одної або більше сполук за будь-яким із пунктів 1-7.
18. Фармацевтична композиція за п. 17, яка відрізняється тим, що вона містить одну або більше додаткових сполук, вибраних із групи, що складається з фізіологічно прийнятних наповнювачів, допоміжних речовин, допоміжних лікарських речовин, розріджувачів.
19. Спосіб одержання фармацевтичної композиції, який відрізняється тим, що одну або більше сполук за будь-яким із пунктів 1-7 і одну або більше сполук, які вибирають із групи, що складається із твердих, рідких або напіврідких наповнювачів, допоміжних засобів, допоміжних лікарських речовин, розріджувачів, носіїв, перетворюють в придатну форму дозування.
Текст
Реферат: Даний винахід стосується похідних 7-азаіндолу формули І як селективних інгібіторів ензиму бета-гідроксистероїду дегідрогенази типу 1 (11-HSD-1) і використання таких сполук для лікування й запобігання метаболічному синдрому, цукровому діабету, резистентності до інсуліну, ожирінню, розладу ліпідного обміну, глаукомі, остеопорозу, когнітивним розладам, занепокоєнню, депресії, імунним розладам, артеріальній гіпертензії й іншим хворобам і патологічним станам. UA 102379 C2 (12) UA 102379 C2 R R Y 1 X 2 O N ( )n R R R 6 4 R N N 3 5 I UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 Область техніки винаходу Даний винахід відноситься до похідних 7-азаіндолу в якості селективних інгібіторів ензиму бета-гідроксистероїду дегідрогенази 1 типу (11β-HSD-1) і до застосування таких сполук для лікування й запобігання метаболічного синдрому, цукрового діабету, резистентності до інсуліну, ожиріння, розладу ліпідного обміну, глаукоми, остеопорозу, когнітивних розладів, занепокоєння, депресії, імунологічних порушень, артеріальної гіпертензії й інших захворювань і станів. Рівень техніки винаходу Гідроксистероїди дегідрогенази (HSDs) регулюють утримання й активацію рецепторів стероїдних гормонів шляхом перетворення стероїдних гормонів у їхні пасивні метаболіти. З недавнього огляду, див. Nobel і ін., Eur. J. Biochem. 2001, 268: 4113-4125. Там існують численні класи HSDs. 11-Бета-гідроксистероїди дегідрогенази (11β-HSDs) каталізують взаємоперетворення активних глюкокортикоїдів (таких як кортизол і кортикостерон), і їхніх інертних форм (таких як кортизон і 11-дегідрокортикостерон). Ізоформ бетагідроксистероїд дегідрогенази 1 типу (11β-HSD1) широко експресований у печінці, жировій тканині, головному мозку, легені й іншої глюкокортикоїдної тканини, у той час як експресія ізоформа 2 (11β-HSD2) обмежена тканинами, які експресують мінералокортикоїдний рецептор, такими як нирка, кишка й плацента. У такому випадку інгібування 11β-HSD2 пов'язане із серйозними побічними ефектами, такими як артеріальна гіпертензія. Надлишок кортизолу пов'язаний із численними порушеннями активності, включаючи діабет, ожиріння, дисліпідемію, резистентність до інсуліну й артеріальну гіпертензію. Уведення 11βHSD1 інгібіторів зменшує рівень кортизолу й інших 110β-гідроксистероїдів у цільових тканинах, таким чином, зменшуючи ефекти надлишкової кількості кортизолу й інших 11βгідроксистероїдів. Таким чином, 11β-HSD1 являє собою потенційну мету для терапії, пов'язану із численними порушеннями активності, які можуть бути поліпшені шляхом ослаблення глюкокортикоїдної дії. Таким чином, інгібування 11β-HSD1 може бути використане для запобігання, лікування або регуляції хвороб, опосередкованих надзвичайно високими рівнями кортизолу й інших 11 β-гідроксистероїдів, таких як діабет, ожиріння, артеріальна гіпертензія або дисліпідемія. Інгібування 11β-HSD1 активності в головному мозку, наприклад, до знижених рівнів кортизолу, може також бути корисним для лікування або ослаблення занепокоєння, депресії, когнітивного розладу або вікової когнітивної дисфункції (Seckl, і ін. Endocrinology, 2001, 142: 1371-1376). Кортизол являє собою важливий і добре розпізнаваний протизапальний гормон, який також діє як антагоніст на дію інсуліну в печінці, так, щоб чутливість до інсуліну була зменшена, приводячи до підвищеного глюконеогенезу й підвищеного рівня глюкози в печінці. Пацієнти, які вже мають порушену толерантність до глюкози, мають більшу ймовірність розвитку діабету 2 типу в присутності надзвичайно високих рівнів кортизолу (Long et al., J. Exp. Med. 1936, 63: 465490; Houssay, Endocrinology 1942, 30: 884-892). Крім того, було доведено, що 11β-HSD1 відіграє важливу роль у регулюванні локального глюкокортикоїдного ефекту й виробленню глюкози в печінці (Jamieson і ін., J. Endocrinol. 2000, 165: 685-692). В Walker, et al., J. Clin. Endocrinol. Metab. 1995, 80: 3155-3159, повідомлялося, що введення неспецифічного 11β-HSD1 інгібітору карбеноксолону привело до поліпшеної печіночної чутливості до інсуліну в людей. Крім того, передбачуваний механізм дії 11β-HSD1 у лікуванні діабету був заснований на різних експериментах, які проводилися на мишах і пацюках. Ці дослідження показали, що рівні mRNA і активності двох ключових ензимів у печіночному виробленні глюкози, фосфоенолпіруват карбоксикінази (PEPCK) і глюкозо-6-фосфатази (G6Pase) було зменшено після введення 11β-HSD1 інгібіторів. Крім того, рівні глюкози крові й печіночне вироблення глюкози, як було показано, було зменшено в 11β-HSD1 нокаутних мишей. Додаткові дані, зібрані із застосуванням цієї моделі мишачого нокауту, також підтверджують, що інгібування 11β-HSD1 не буде викликати гіпоглікемію, тому що основні рівні PEPCK і G6Pase є відрегульованими незалежно від глюкокортикоїдів (Kotelevtsev et al., Proc. Natl. Acad. Sci. USA 1997, 94: 1492414929). Таким чином, уведення терапевтично ефективної кількості 11β-HSD1 інгібітору є ефективним при лікуванні, контролі й поліпшенні симптомів діабету, особливо не-інсуліно залежного діабету (NIDDM, цукровий діабет 2 типу), і введення терапевтично ефективної кількості 11β-HSD1 інгібітору на регулярній основі припиняє або запобігає приступу діабету, особливо в людей. Ефект підвищених рівнів кортизолу також спостерігається в пацієнтів, які мають Синдром Кушинга, який являє собою порушення обміну речовин, що характеризується високими рівнями кортизолу в кровотоці. У пацієнтів із Синдромом Кушинга часто розвивається NIDDM. 1 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 Надмірні рівні кортизолу були пов'язані з ожирінням, можливо через збільшений печіночний глюконеогенез. Черевне ожиріння тісно пов'язане з порушенням толерантності до глюкози, діабетом, гіперінсулінемією, гіпертригліцеридемією і іншими факторами метаболічного синдрому, такими як високий кров'яний тиск, підвищення VLDL і зниження HDL (Montague і ін., Diabetes, 2000, 49: 883-888). У суб'єктів, страждаючих ожирінням, 11β-HSD-1 активність у жировій тканині помітно збільшена й позитивно корельована з масою тіла. Було також повідомлено, що інгібування 11β-HSD1 у пре-адипоцитах (стромальні клітки) привело до зниження норми диференціювання в адипоцитах. Прогнозовано, що це в результаті приведе до зменшеного збільшення в об'ємі (можливому скороченню) чепцевих жирових відкладань, що може привести до зменшеного центрального ожиріння (Bujalska і ін., Lancet 1997, 349: 12101213). Таким чином, уведення ефективної кількості 11β-HSD1 інгібітору корисно при лікуванні або боротьбі з ожирінням. Довгострокове лікування 11β-HSD1 інгібітором також корисно при відстрочці або запобіганні симптомів ожиріння, особливо якщо пацієнт використовує 11β-HSD1 інгібітор у комбінації з контрольованою дієтою й вправами. Зменшуючи резистентність до інсуліну й підтримуючи глюкозну сироватку при нормальних концентраціях, сполуки даного винаходу також корисні у лікуванні й запобіганні захворювань, які супроводжуються діабетом 2 типу й резистентністю до інсуліну, включаючи метаболічний синдром, ожиріння, реактивну гіпоглікемію й діабетичну дисліпідемію. Інгібування 11β-HSD1 у зрілих адипоцитах, як очікувалося, знижує секрецію інгібітору 1 активатора плазміногелю (PAI-1), який являє собою незалежний серцево-судинний фактор ризику, як повідомляється в Halleux і ін., J; Clin. Endocrinol. Metab. 1999, 84: 4097-4105. Крім того, кореляція, як було показано, існувала між глюкокортикоїдною активністю й певними серцево-судинними факторами ризику. Це припускає, що скорочення глюкокортикоїдних ефектів було б вигідно в лікуванні або запобіганні певних серцево-судинних хвороб (Walker і ін., Hypertension 1998, 31: 891-895; і Fraser і ін., Hypertension 1999, 33: 1364 1368). Так як артеріальна гіпертензія й дисліпідемія сприяють розвитку атеросклерозу, і інгібування 11β-HSD1 активності й скорочення кількості кортизолу вигідно в лікуванні або контролюванні артеріальної гіпертензії, уведення терапевтично ефективної кількості 11β-HSD1 інгібітору даного винаходу може також бути особливо вигідним у лікуванні, контролюванні або вповільненні симптому або запобіганні атеросклерозу. 11β-HSD1 був також залучений у процесі контролю апетиту й тому, як уважаються, відіграє додаткову роль у пов'язаних з вагою захворюваннях. Відомо, що видалення надниркової залози зменшує ефект голодування для збільшення як приймання їжі так і експресії гіпоталамічного нейропептиду Y. Це означає, що глюкокортикоїди відіграють певну роль в активуванні приймання їжі і що інгібування 11β-HSD1 у головному мозку може збільшити насичення, що приведе в результаті до зменшеного раціону харчування (Woods et al., Science 1998, 280: 13781383). Іншим можливим терапевтичним ефектом, пов'язаним з модуляцією 11β-HSD1, є той, який пов'язаний з різними панкреатичними продуктами харчування. Повідомляється, що інгібування 11β-HSD1 у мишачих панкреатичних β-клітках збільшення глюкози стимулювало секрецію інсуліну (Davani і ін., Дж. Байол. Chem. 2000, 275: 34841-34844). З попереднього відкриття випливає, що глюкокортикоїди, як раніше було знайдено, були відповідальні за зменшену панкреатичну секрецію інсуліну in vivo (Billaudel і ін., Hulum. Metab. Res. 1979, 11: 555-560). Таким чином, було припущено, що інгібування 11β-HSD1 привело б до інших сприятливих впливів у лікуванні діабету крім передбачуваних ефектів на печінку й зменшенні жиру. Надмірні рівні кортизолу в головному мозку можуть також привести до нейронної втрати або дисфункції задопомогою потенціювання нейротоксинів. Уведення ефективної кількості 11βHSD1 інгібітору приводить до зменшення, поліпшення, контролю або запобігання когнітивного порушення, зв'язаного зі старінням і нейронною дисфункцією. Когнітивне порушення було зв'язано зі старінням і зайвими рівнями кортизолу в головному мозку (див. J. R. Seckl і B. R. Walker, Endocrinology, 2001, 142: 1371 1376, і посилання, наведені там). 11β-HSD1 також регулює глюкокортикоїдну активність у головному мозку й у такий спосіб сприяє нейротоксичності (Rajan і ін., Neuroscience 1996, 16:65-70; Seckl і ін., Necroendocrinol. 2000, 18: 49-99). Навантаження і/або глюкокортикоїди, як відомо, впливають на когнітивну функцію (de Quervain і ін., Nature 1998, 394: 787-790), і неопубліковані результати вказують на значне поліпшення пам'яті в пацюків, яких лікували неспецифічним 11β-HSD1 інгібітором. Ці повідомлення, на додаток до відомих ефектів глюкокортикоїдів у головному мозку, припускають, що інгібування 11β-HSD1 у головному мозку може мати позитивний терапевтичний ефект проти занепокоєння, депресії й пов'язаних із цим патологічних станів (Tronche і ін., Nature Genetics 2 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 1999, 23: 99-103). 11β-HSD1 реактивує 11-дегідрокортикостерон до кортикостерону в гіпокампальних клітках, і може підсилювати дія нейротоксичності кинази, приводячи до вікових погіршень навчання. Таким чином, селективні інгібітори 11β-HSD1, як уважається, захищають проти гіпокампального зниження функції з віком (Yau і ін., Proc Natl. Acad. Sci. USA 2001, 98: 4716-4721). Таким чином, була висунута гіпотеза, що інгібування 11β-HSD1 у людському головному мозку захищає від шкідливих опосередкованих глюкокортикоїдом ефектів на нейронну функцію, таких як когнітивні порушення, депресія, і підвищений апетит. Крім того, 11β-HSD1, як уважаються, відіграє роль в імуномодуляції, засновану на загальному сприйнятті, що глюкокортикоїди пригнічують імунну систему. Існує, як відомо, динамічна взаємодія між імунною системою й HPA (гіпоталамічною гіпофізарною наднирковозалозною) системою (Rook, Baillier's Clin. Endocrinol. Metab. 2000, 13: 576-581), і глюкокортикоїди допомагають балансувати між клітино-опосередкованими реакціями й гуморальними реакціями. Збільшена глюкокортикоїдна активність, яка може бути викликана навантаженням, пов'язана з гуморальною реакцією і як таке, інгібування 11β-HSD1 може привести до зміни реакції на засновану на клітці реакцію. На певних стадіях захворювання, таких як туберкульоз, проказа й псоріаз, і навіть при умовах надмірної напруги, висока глюкокортикоїдна активність міняє імунну реакцію на гуморальну реакцію, у той час коли фактично заснована на клітці реакція може бути більш вигідною для пацієнта. Інгібування 11β-HSD1 активності й супутнє скорочення глюкокортикоїдних рівнів з іншої сторони міняє імунну реакцію на засновану на клітці реакцію (D. Mason, Immunology Today, 1991, 12: 57-60, і G.A.Vt. Rook, Baillier's Clin. Endocrinol. Metab., 1999, 13: 576-581). Із цього випливає, що альтернативною користю 11β-HSD1 інгібування було б підтримка тимчасової імунної реакції в комбінації з імунізацією, щоб гарантувати, що буде отримана заснована на клітці реакція. Останні описи припускають, що рівні глюкокортикоїдних цільових рецепторів і HSDs пов'язані зі сприйнятливістю до глаукоми (J. Stokes і ін., Invest. Ophthalмоль. 2000, 41: 16291638). Крім того, недавно було повідомлено про зв'язок між інгібуванням 11β-HSD1 і зниженням внутрішньоочного тиску (Walker і ін., poster P3-698 at the Endocrine society meeting June 12-15, 1999, San Diego). Було показано, що введення неспецифічного 11β-HSD1 інгібітору карбеноксолону привело до скорочення внутрішньоочного тиску на 20 % у нормальних пацієнтів. В оці 11β-HSD1 експресований винятково в базальних клітках рогівкового епітелію, непігментованому епітелії рогової оболонки (ділянка вироблення води), війковому мускулі, і запиральному м'язі й розширювальному м'язі мускулів райдужної оболонки. На відміну від цього, віддалений ізоензим 11-гідроксистероїд дегідрогенази 2 типу ("11β-HSD2") є надзвичайно експресований у непігментованому війковому епітелії й рогівковому ендотелії. Ніякі HSDs не були знайдені в трабекулярній мережі, яка являє собою ділянка відтоку. Таким чином, було висунуте припущення, що 11β-HSD1 відіграє роль у виробленні води, і інгібування 11β-HSD1 активності корисно в скороченні внутрішньоочного тиску при лікуванні глаукоми. Глюкокортикоїди також відіграють істотну роль у кістяковому розвитку й функціонуванні, але шкідливі для такого розвитку й функціонування коли присутні в надлишку. Викликана глюкокортикоїдом втрата кісткової маси частково отримана з ослаблення поліферації остеобласта й синтезу колагену, як повідомляється в C. H. Kim і ін., J. Endocrinol. 1999, 162: 371 379. Було повідомлено, що шкідливі дії глюкокортикоїдів на формування кісткових вузлів можуть бути зменшені введенням карбеноксолону, який є неспецифічним 11β-HSD1 інгібітором (C. G. Bellows і ін., Bone 1998, 23: 119-125). Додаткові повідомлення припускають, що 11β-HSD1 можливо є відповідальним за забезпечення збільшених рівнів активного глюкокортикоїда в остеокласті, і в такий спосіб у збільшенні резорбції кістки (M. S. Cooper і ін., Bone 2000, 27: 375381). Ці дані припускають, що інгібування 11β-HSD1 може мати сприятливі дії проти остеопорозу за допомогою одного або більш механізмів, які можуть діяти паралельно. Інгібітори 11β-HSD1 відомі, наприклад, з WO0410629, WO03065983, WO04089896, WO04089380, WO04065351, WO04033427 або WO04041264. У недавньому огляді див. M. Wamil і J.R.Seckl (Drug Discovery Today; Червень 2007, сторінки 504-520) і C.D.Boyle, T.J.Kowalski і L.Zhang (Annual reports in medicinal chemistry; 2006, 41, 127-140). Однак, похідні 7-азаіндолу є не розкритими в якості активних 11β-HSD1 інгібіторів. 3-заміщені-гетероциклоалкіл-7-азаіндоли розкриті, наприклад, в WO2004106346 і WO2004106298 у якості зв'язувальних речовин допаміну D2, D3, рецепторів D4 і діючих у якості 5-HT1A агоністів або часткових агоністів. 7-азаіндолони розкриті в WO2006099268, WO2006044504, WO2005013894 у якості антагоністів для рецепторів CGRP. 5-ацил-7азаіндоли розкриті в WO2005085244 для інгібування JNK3. 2-арил і 7-азаіндоли заявлені в якості інгібіторів Itk. Азаіндол-3-піперидини розкриті в WO2003082867 у якості антагоністів гістамінового H 1 3 UA 102379 C2 5 10 рецептора. Однак, жодна з вищезгаданих публікацій не охоплює ні похідні 7-азаіндолу даного винаходу, ні застосування розкритих сполук у якості 11β-HSD1 інгібіторів. WO2007050381 розкриває певні 3-(N-ацил-піперидин-4-іл)-7-азаіндоли в якості модуляторів рецептора ORL-1. Сполуки є корисними для лікування, запобігання або поліпшення рецептора ORL-1 опосередкованого порушенням. Таким чином, тому що як і раніше, існує постійна потреба в ефективній терапії, переважне завдання даного винаходу складається в тому, щоб забезпечити нові фармацевтично активні сполуки для лікування хвороб, таких як цукровий діабет, ожиріння, глаукома, остеопороз, когнітивні розлади, імунні розлади, депресія, артеріальна гіпертензія, і інших. Цитата будь-якого посилання в цьому описі не є допущенням того, що посилання являє собою рівень техніки цього опису. Короткий опис винаходу На диво було знайдено, що сполуки даного винаходу є дуже активними 11β-HSD1 інгібіторами. Тому, втіленням даного винаходу є сполуки формули I, R1 Y X 2 R ()n R R 6 20 25 30 35 40 45 50 4 3 I R5 R 15 O N N N у якій 1 2 R , R являють собою незалежно один від одного H, A, циклоалкіл, галогеналкіл, Ar, гетероарил або гетероциклоалкіл, 3 4 R , R являють собою незалежно один від одного H, A, Hal або ОН, 5 6 R , R являють собою незалежно один від одного H, A, галогеналкіл або Hal, X являє собою -(C)m-, -O-, -S-, -S(O)- або -S(O)2-, Y являє собою A, алкоксиалкіл, циклоалкіл, арилокси, гетероарилокси, феніл або гетероарил не обов'язково моно- ди- або тризаміщений Hal, A, C1-4алкилокси, трифторметил, трифторметокси, C1-4алкілоксикарбоніл, C1-4алкілкарбоніл, 7 8 або R R NC1-4алкілокси 7 8 R , R являють собою незалежно один від одного C 1-4алкіл або C4-7циклоалкіл, n має значення 1 або 2, і m має значення 0 або 1, і її фізіологічно прийнятні солі, похідні, проліки, сольвати й стереоізомери, включаючи їх суміші у всіх співвідношеннях. Привілейованим втіленням даного винаходу є сполуки згідно з формулою I, 1 2 R , R являють собою незалежно один від одного H, A, циклоалкіл, галогеналкіл, Ar, гетероарил або гетероциклоалкіл, 3 4 R , R являють собою незалежно один від одного H, A, Hal або ОН, 5 6 R , R являють собою незалежно один від одного H, A, галогеналкіл або Hal, X являє собою -(C)m-, -O-, -S-, -S(O)- або -S(O)2-, Y являє собою A, алкоксиалкіл, циклоалкіл, арилокси, гетероарилокси, феніл або гетероарил не обов'язково моно- ди- або тризаміщений Hal, A, C1-4алкілокси, трифторметил, 7 8 трифторметокси, C1-4алкілоксикарбоніл, C1-4алкілкарбоніл, або R R NC1-4алкілокси 7 8 R , R являють собою незалежно один від одного C 1-4алкіл або C4-7циклоалкіл, n має значення 1, і m має значення 0 або 1, і її фізіологічно прийнятні солі, похідні, проліки сольвати й стереоізомери, включаючи їх суміші у всіх співвідношеннях. Привілейованим втіленням даного винаходу є сполуки згідно з формулою I, у якій 1 2 R , R являють собою незалежно один від одного A, циклоалкіл, галогеналкіл, Ar, гетероарил або гетероциклоалкіл, 3 4 R , R являють собою незалежно один від одного H, A, Hal або ОН, 5 6 R , R являють собою незалежно один від одного H, A, галогеналкіл або Hal, X являє собою -(C)m-, -O-, -S-, -S(O)- або -S(O)2-, 4 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 Y являє собою A, алкоксиалкіл, циклоалкіл, арилокси, гетероарилокси, феніл або гетероарил не обов'язково моно- ди- або тризаміщений Hal, A, C1-4алкілокси, трифторметил, 7 8 трифторметокси, C1-4алкілоксикарбоніл, C1-4алкілкарбоніл, або R R NC1-4алкілокси 7 8 R , R являють собою незалежно один від одного C 1-4алкіл або C4-7циклоалкіл, n має значення 1, і m має значення 0 або 1, і її фізіологічно прийнятні солі, похідні, проліки, сольвати й стереоізомери, включаючи їх суміші у всіх співвідношеннях. Додатковим переважним втіленням даного винаходу є сполуки згідно з формулою I, у якій 1 2 R , R являють собою незалежно один від одного A, циклоалкіл, галогеналкіл, Ar, гетероарил або гетероциклоалкіл, 3 4 R , R являють собою незалежно один від одного H, A, Hal або ОН, 5 6 R , R являють собою незалежно один від одного H або Hal, X являє собою -(C)m-, -O-, -S-, -S(O)- або -S(O)2-, Y являє собою A, алкоксиалкіл, циклоалкіл, арилокси, гетероарилокси, феніл або гетероарил не обов'язково моно- ди- або тризаміщений Hal, A, C1-4алкілокси, трифторметил, 7 8 трифторметокси, C1-4алкілоксикарбоніл, C1-4алкілкарбоніл, або R R NC1-4алкілокси 7 8 R , R являють собою незалежно один від одного C1-4алкіл або C4-7циклоалкіл, n має значення 1, і m має значення 0 або 1, і її фізіологічно прийнятні солі, похідні, проліки, сольвати й стереоізомери, включаючи їх суміші у всіх співвідношеннях. Додаткове переважне втілення даного винаходу являє собою сполуки згідно з формулою I, у якій 1 2 R , R являють собою незалежно один від одного A, циклоалкіл, галогеналкіл, Ar, гетероарил або гетероциклоалкіл, 3 4 R , R являють собою незалежно один від одного H, A, Hal або ОН, 5 6 R , R являють собою незалежно один від одного H, X являє собою -(C)m-, Y являє собою арилокси, гетероарилокси, феніл або гетероарил не обов'язково моно- диабо тризаміщений Hal, A, C1-4алкілокси, трифторметил, трифторметокси, C1-4алкілоксикарбоніл, 7 8 C1-4алкілкарбоніл, або R R NC1-4алкілокси 7 8 R , R являють собою незалежно один від одного C 1-4алкіл або C4-7циклоалкіл, n має значення 1, і m має значення 0, і її фізіологічно прийнятні солі, похідні, проліки, сольвати й стереоізомери, включаючи їх суміші у всіх співвідношеннях. Додаткове переважне втілення даного винаходу являє собою сполуки згідно з формулою I, у якій 1 2 R , R являють собою незалежно один від одного Н, A, циклоалкіл, галогеналкіл, Ar, гетероарил або гетероциклоалкіл, 3 4 R , R являють собою незалежно один від одного H, A, Hal або ОН, 5 6 R , R являють собою незалежно один від одного H, А, галогеналкіл або Hal, X являє собою -(C)m-, -O-, -S-, -S(O)- або -S(O)2-, Y являє собою А, алкоксиалкіл, циклоалкіл, арилокси, гетероарилокси, феніл або гетероарил не обов'язково моно- ди- або тризаміщений Hal, A, C1-4алкілокси, трифторметил, 7 8 трифторметокси, C1-4алкілоксикарбоніл, C1-4алкілкарбоніл, або R R NC1-4алкілокси 7 8 R , R являють собою незалежно один від одного C 1-4алкіл або C4-7циклоалкіл, n має значення 2, і m має значення 0 або 1, і її фізіологічно прийнятні солі, похідні, проліки, сольвати й стереоізомери, включаючи їх суміші у всіх співвідношеннях. Інше особливо переважне втілення даного винаходу являє собою сполуки згідно з формулою I, обрані із групи, що складається з a) (2-Фтор-феніл)-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон b) (4-Метокси-2-метилфеніл)-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон c) (Циклогексил)-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон d) (Піридин-3-іл)-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон e) [3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-o-толіл-метанон f) (2-Метил-2-феніл-1)-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-пропан-1-он 5 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 g) 4-Диметиламінофеніл)-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон h) (1-Феніл-циклопропіл)-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон i) 2-(4-Хлорфеніл)-2-метил-1-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-пропан-1-он j) 2-Метил-2-фенокси-1-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-пропан-1-он k) (1-4(Хлор-феніл)циклобутил-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон l) 2-(4-Хлор-фенокси)-2-метил-1-[4-(1H-пірол[2,3-b]піридин-3-іл)-піперидин-1-іл]-пропан-1-он m) 2-Метил-1-[4-(1H-пірол[2,3-b]піридин-3-іл)-піперидин-1-іл]-2-[4-(5-трифторметил-піридин2-іл)-піперазин-1-іл]-пропан-1-он n) 4-(4-Фтор-фенокси)-3,3-диметил-1-[4-(1H-пірол[2,3-b]піридин-3-іл)-піперидин-1-іл]-бутан-1он o) 2-(4-Хлор-феніл)-2-метил-1-[4-(1H-пірол[2,3-b]піридин-3-іл)-піперидин-1-іл]-пропан-1-он p) [1-(4-Хлор-феніл)-циклопропіл]-[4-(1H-пірол[2,3-b]піридин-3-іл)-піперидин-1-іл]-метанон q) 4-(4-Фтор-фенокси)-3,3-диметил-1-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-бутан-1он r) [1-(4-Фтор-фенокси)-циклопропіл]-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон s) [1-(4-Хлор-феніл)-циклопропіл]-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон t) 2-(4-Хлор-бензолсульфоніл)-1-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-етанон і її фізіологічно прийнятні солі, похідні, проліки, сольвати й стереоізомери, включаючи їх суміші у всіх співвідношеннях. Специфікація, яка використовується тут для того, щоб визначити сполуки, особливо сполуки, згідно з винаходом, в основному заснована на правилах IUPAC-організації по хімічних сполуках і особливо органічним сполукам. Термін "гідроксил" означає ОН групу. Терміни "Алкіл" або "A", так само як інші групи, які мають приставку "алк", такі як алкеніл, алкокси й алканоїл, означають вуглецеві ланцюги, які можуть бути лінійними або розгалуженими, і їх комбінації, якщо вуглецевий ланцюг не визначений інакше. Приклади алкільних груп включають метил, етил, пропіл, ізопропіл, бутил, сек- і терт-бутил, пентил, гексил, гептил, октил, ноніл, і т.п. У тих випадках, де зазначене кількість атомів вуглецю дозволять, наприклад, від C3-C10, термін алкіл також містить у собі циклоалкільні групи, і комбінації лінійних або розгалужених алкільних ланцюгів, об'єднаних із циклоалкільними структурами. У тих випадках, коли число атомів вуглецю не визначене, C 1-C6 є заданим. Особливо кращий C1-C4алкіл. Радикал C1-C4алкіл являє собою, наприклад, метил, етил, пропіл, ізопропіл, бутил, ізобутил, терт-бутил. "Циклоалкіл" являє собою підмножину алкілу й розуміється в значенні насиченого моноциклічного вуглеводню, і щодо терміна "C3-9 циклоалкіл", що має 3-9 атомів вуглецю. Приклади циклоалкілу включають циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, і т.п. Циклоалкільна група в основному є моноциклічною, якщо не заявлене що-небудь інше. Циклоалкільні групи є насиченими, якщо або інакше не визначене. Радикал C4-C8циклоалкіл являє собою, наприклад, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил. Терміни "Арил" або "Ar" означають моно- або багатоциклічну систему ароматичного ядра, що містить атоми вуглецевих циклів. Переважні арили є моноциклічними або біциклічними 6-10 членних систем ароматичних ядер. Приклади "арильних" груп включають, але не обмежені наступними, феніл, 2-нафтил, 1-нафтил, біфеніл, інданіл, так само як їхні заміщені похідні. Самим переважним арилом є феніл. Термін "алкілокси" означає алкоксильні групи прямої або розгалуженої конфігурації. "C 1C4алкілокси" означає алкоксильні групи прямої або розгалуженої конфігурації, які мають позначене число атомів вуглецю. Термін, що використовується тут, "арилокси" переважно відноситься до групи AO-, у якій A являє собою арил як визначено вище. C 1-C4алкілокси являє собою, наприклад, метокси, етокси, пропокси, ізопропокси й т.п. Термін "арилокси" означає алкоксильні групи моно - або поліциклічну систему ароматичного ядра, що містить циклічні атоми вуглецю. Термін, що використовується тут, "арилокси" переважно відноситься до групи Aro-, у якій Ar являє собою арил як визначено вище. Приклади "арилокси" груп включають, але не обмежені наступними, фенілокси, 2-нафтилокси, 1нафтилокси, біфенілокси, інданілокси так само як їхні заміщені похідні. Самою кращою арилокси є фенілокси. "Гетероарил" або "Het" означають ароматичну або частково ароматичну гетероциклічну сполуку, яка містить, принаймні, одне ядро гетероатома обраного з O, S і N. Гетероарили в такий спосіб включають гетероарили, конденсовані в інші види ядер, такі як арили, циклоалкіли й гетероциклічні сполуки, які не є ароматичними. Приклади гетероарильних груп включають: 6 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 піроліл, ізоксазоліл, ізотіазоліл, піразоліл, піридил, оксазоліл, оксадіазоліл, тіадіазоліл, тіазоліл, імідазоліл, триазоліл, тетразоліл, фураніл, триазиніл, тіеніл, піримідил, бензисоксазоніл, бензоксазоніл, бензотіазоліл, бензотіадіазоліл, дигідробензофураніл, індолініл, піридазиніл, індазоліл, ізоксазоліл, ізоіндоліл, дигідробензотіеніл, індолизиніл, цинолініл, фталазиніл, квіназолініл, нафтиридиніл, карбазоліл, бенздіоксиніл, бензодіоксоліл, квіноксалініл, пуриніл, фуразаніл, тіофеніл, ізобензилфураніл, бензімідазоліл, бензофураніл, бензотіеніл, квіноліл, індоліл, ізоквіноліл, дибензофураніл, і т.п. Для гетероциклічних і гетероарильних груп, ядра й системи ядер, що містять від 3-15 атомів, включені, формуючи 1-3 ядра. Термін, що використовується тут, "карбоніл" або "карбонільна частина " переважно відноситься до групи C=O. Термін, що використовується тут, "алкілкарбоніл" переважно відноситься до групи AC(O)-, у якій A являє собою алкіл як визначено тут. Термін, що використовується тут, "алкоксикарбоніл" або "алкілоксикарбоніл" переважно відноситься до групи AOC(O)-, у якій A являє собою алкіл як визначено тут. Гетероциклоалкіл являє собою моно-, бі- або трициклічний вуглеводень, що містить від 3 до 18 кільцевих атомів переважно від 3 до 7 ядрових атомів, і містить один або більше, переважно 1-3 гетероатомів обраних з O, N, або S. Гетероциклоалкіл являє собою, наприклад, піролідиніл, піперидиніл, піперазиніл, морфолініл, індолінілметил, імідазолінілметил і 2-аза-біцикло [2.2.2] октаніл. Термін, що використовується тут, "алкоксиалкіл" переважно відноситься до групи AOA-, у якій A являє собою алкіл як визначено тут. Алкоксиалкіл відноситься до вуглеводневого ланцюга, перерваного атомом кисню. Термін, що використовується тут, "гетероарилокси" переважно відноситься до групи Heto-, у якій Het являє собою гетероарил як визначено тут. Термін "Hal" відноситься до фтору (F), хлору (Cl), брому (Br) або йоду (I). Бром і фтор є в основному кращими. Фтор є найбільше кращим у тих випадках, коли галогени є заміщеними на алкільну (галогеналкільну) або алкоксильну групу (наприклад. CF3 і CF3O). Термін, що використовується тут, "галогеналкіл" переважно відноситься до алкільної групи як визначено вище, що містить, принаймні один атом вуглецю, заміщений принаймні одним галогеном, галоген буде таким як визначено тут. Приклади розгалужених або утворюючих прямий ланцюг "C1-C6 галогеналкільних" груп, корисні в даному винаході, включають, але не обмежені наступними, метил, етил, пропіл, ізопропіл, ізобутил і n-бутил, заміщені незалежно одним або більш галогенами, наприклад, фтором, хлором, бромом і йодом. Термін "склад", а саме фармацевтичний склад, призначений, щоб охопити продукт, що включає активний компонент (и), і інертний компонент (и), які становлять носій, так само як будь-який продукт, який виходить у результаті, прямо або побічно, комбінування, комплексне утворювання або агрегації будь-яких двох або більше компонентів, або дисоціації одного або більшої кількості компонентів, або інших типів реакцій або взаємодій одного або більшої кількості компонентів. Відповідно, фармацевтичні сполуки даного винаходу охоплюють будьякий склад, отриманий шляхом змішування сполуки даного винаходу й фармацевтично прийнятного носія. Терміни "уводять" і "уведення" сполуки необхідно розуміти в значенні надання сполуки винаходу або проліки сполуки винаходу для індивідуальних потреб. Термін, що використовується тут, "ефективна кількість" означає кількість ліків або фармацевтичного агента, які виявлять біологічну або лікарську реакцію тканини, системи, тварини або людини, яка буде шуканою, наприклад, дослідником або практикуючим лікарем. Крім того, термін "терапевтично ефективна кількість" означає будь-яка кількість, яка, у порівнянні з відповідним суб'єктом, який не одержав таку кількість, приведе в результаті до поліпшеного лікування, виліковування, запобігання, або поліпшенню стану хвороби, розладу або побічного ефекту, або зменшення в нормі проходження хвороби або розладу. Термін також включає у свої рамки кількості, ефективні для активізації нормальної фізіологічної функції. Сполуки структурної формули I можуть містити один або більш асиметричних центрів і можуть у такий спосіб проявлятися в якості рацематів і рацемічних сумішей, одинарних енантиомерів, діастереоізомерних сумішей і окремих діастереомерів. У даному винаході мається на увазі охопити всі такі ізомерні форми сполук структурної формули I. Деякі зі сполук, які описані тут, містять олефінові подвійні зв'язки, і якщо не визначено інакше, мається на увазі, що включають і E і Z геометричні ізомери. Деякі зі сполук, описаних тут, можуть існувати як таутомери, такі як таутомери кетоенолу. Окремі таутомери, так само як їх суміші, охоплені в межах сполук структурної формули I. Сполуки структурної формули I можуть бути розділені на окремі діастереоізомери шляхом, 7 UA 102379 C2 5 10 15 наприклад, фракційної кристалізації з підходящого розчинника, наприклад метанолу; або етил ацетату або їх суміші, або за допомогою хіральної хроматографії із застосуванням оптично активної нерухомої фази. Абсолютна стереохімія може бути визначена шляхом рентгенівської кристалографії кристалічних продуктів або кристалічних проміжних продуктів, які є отриманими, якщо буде потреба, з реактивом, що містять асиметричний центр відомої абсолютної конфігурації. Альтернативно, будь-який стереоізомер сполуки загальної структурної формули I може бути отриманий шляхом стереоспецифічного синтезу із застосуванням оптично чистих вихідних матеріалів або реактивів відомої абсолютної конфігурації. У різному аспекті винаходу фармацевтичний склад адресований I, включаючи сполуки у відповідності зі структурною формулою I, або ії фармацевтично прийнятну сіль або сольват, у комбінації з фармацевтично прийнятним носієм. Термін "сольват" означає гідрат, алкоголят, або інший сольват кристалізації. Сполуки можуть бути приготовлені загальними способами згідно зі схемами 1-3, показаними нижче. У всіх способах приготування весь вихідний матеріал є відомим, або може бути легко приготовлений з відомих вихідних матеріалів. Схема 1 20 8 UA 102379 C2 Схема 2: 5 Схема 3: 9 UA 102379 C2 5 10 Таким чином, додаткове втілення даного винаходу являє собою спосіб приготування сполук даного винаходу, що характеризується тим, що 5 6 a) азаіндол формули II, у якій R і R є такими, як визначено вище, формілують для 5 6 одержання альдегіду формули III, у якій R і R є такими, як визначено вище, зазначений альдегід формули III реагує з етилціаноацетатом, що супроводжується реакцією Майкла ціанідом, кислотною циклізацією й гідридним відновленням для одержання піролідино-азаіндол 5 6 формули IV, у якій R і R є такими, як визначено вище, ацилювання зазначеного піролідино5 6 азаіндолу формули IV, у якій R і R є такими, як визначено вище, з активованої карбоксильною 1 2 кислотою формули V, у якій R , R , X і Y є такими, як визначено вище, виконано для того, щоб 1 2 5 6 одержати сполуку формули I, у якій, R , R , R , R X і Y є такими, як визначено вище, 5 15 20 6 b) азаіндол формули II, у якій R і R є такими, як визначено вище, конденсований із бром5 6 малеімідом VI для одержання піролідиндіону формули VII, у якій R і R є такими, як визначено вище, гідрогенізація зазначеного піролідиндіону формули VII, що супроводжується послідовно зняттям захисних бензилових груп і гідридним відновленням, робить піролідино-азаіндол 5 6 формули IV, у якій R і R є такими, як визначено вище, ацилювання зазначеного піролідино5 6 азаіндолу формули IV, у якій R і R є такими, як визначено вище, з активованою карбоксильною 1 2 кислотою формули V у якій, R , R , X і Y є такими, як визначено вище, виконане для того, щоб 1 2 5 6 одержати сполуку формули I у якій, R , R , R , R X і Y є такими, як визначено вище, 10 UA 102379 C2 5 5 10 6 c) азаіндол формули II, у якій R і R є такими, як визначено вище, реагує під основним 3 4 середовищем з кетоном VIII, де R , R і n є такими, як визначено вище, щоб одержати суміш 3 4 5 6 олефінів формули IX і X, у яких R , R , R , R і n є такими, як визначено вище, гідрогенізація 3 4 5 6 зазначених олефінів формули IX і X, у яких R , R , R , R і n є такими, як визначено вище, супроводжувана зняттям захисних груп Boc, що видає піролідино-азаіндол формули XI, у якій 3 4 5 6 R , R , R , R і n є такими, як визначено вище, ацилюванням зазначеного піролідино-азаіндолу 3 4 5 6 формули XI, у якій R , R , R , R і n є такими, як визначено вище, реагує з активованою 1 2 карбоксильною кислотою формули V у якій, R , R , X і Y є такими, як визначено вище, для того, 1 2 3 4 5 6 щоб одержати сполуку формули I у якій, R , R , R , R , R , R , X і Y є такими, як визначено вище, ()n 6 R5 R N N + ()n NBoc R O II 6 N R 6 R R1 3 R 4 5 R 6 N N R + X O HO X 2 R X 2 Y R1 Y EDCI / HOBt ()n N N O N R 3 4 R V XI 6 R5 R N 15 R5 R IX ()n HCl N NBoc R3 4 R ()n + R5 R VIII N H2 Pd/C KOH R3 4 NBoc R3 R4 N I 1 2 3 4 5 6 7 8 d) залишкові X, Y, R , R , R , R , R , R , R і/або R як заявлено в п. 1, перетворені в інші 1 2 3 4 5 6 7 8 залишкові X, Y, R , R , R , R , R , R , R і/або R , наприклад, шляхом уведення алкільної групи, або 11 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 e) сполука формули I є ізольованою і/або оброблена кислотою або основою для того, щоб одержати її сіль. Усі неочищені продукти були піддані стандартній хроматографії, використовуючи суміші розчинників, що містять метанол, етанол, ізопропіловий спирт, n-гексан, циклогексан або бензиновий ефір, відповідно. Для додаткового детального опису виробничих процесів, будь ласка дивіться також приклади й наступний загальний опис переважних умов. Фізіологічно прийнятна сіль сполуки згідно з формулою I може також бути отримана шляхом ізолювання і/або оброблювання сполуки формули I отриманої шляхом описаної реакції з кислотою або основою. Сполуки формули I і також вихідні матеріали для їхнього приготування приготовлені способами як описано в прикладах або способами, які відомі самі по собі, як описано в літературі (наприклад у стандартних роботах, таких як Houben-Weyl, Methoden der Organischen Chemie [Methods of Organic Chemistry], Georg Thieme Verlag, Stuttgart; Organic Reactions, John Wiley & Sons, Inc., New York), щоб бути точним при реакційних умовах, які є відомими й підходящими для згаданих реакцій. Тут також можуть бути застосовані варіанти, які відомі самі по собі, але не згадані тут в особливих деталях. Вихідні матеріали для необхідного процесу можуть, якщо бажано, також бути сформованими in situ, не ізолюючи їх від реакційної суміші, але замість цього негайно перетворюючи їх далі в сполуки формули I. З іншого боку, можливо виконати реакцію поетапно. Переважно реакція сполук виконана в присутності підходящого розчинника, який переважно є інертним при відповідних реакційних умовах. Приклади підходящих розчинників являють собою вуглеводні, такі як гексан, петролейний ефір, бензол, толуол або ксилол; хлоровані вуглеводні, такі як трихлоретилен, 1,2-дихлоретан, тетрахлорметан, хлороформ або дихлорметан; спирти, такі як метанол, етанол, ізопропіловий спирт, n-пропанoл, n-бутанол або терт-бутанол; ефіри, такі як діетиловий ефір, дііизопропіловий ефір, тетрагідрофуран (THF) або діоксан; гліколеві ефіри, такі як монометил етилен гліколю або моноетиловий ефір або диметиловий ефір етилен гліколю (простий диметиловий ефір діетиленгліколю); кетони, такі як ацетон або бутанoн; аміди, такі як ацетамід, диметилацетамід, диметилформамід (DMF) або NМетил піролідинон (NMP); нітрили, такі як ацетонітрил; сульфоксиди, такі як диметил сульфоксид (DMSO); нітро сполуки, такі як нітрометан або нітробензол; складні ефіри, такі як етил ацетат, або суміші згаданих розчинників або суміші з водою. Полярні розчинники є в основному кращими. Приклади для підходящих полярних розчинників являють собою хлоровані вуглеводні, спирти, гліколеві ефіри, нітрили, аміди й сульфоксиди або їх суміші. Більш кращими є аміди, особливо диметилформамід (DMF). Як зазначено вище, температура реакції становить між приблизно -100 °C і 300 °C, залежно від етапу реакції й використовуваних умов. Час реакції перебуває в основному в діапазоні між декількома хвилинами й декількома днями, залежно від реактивності відповідних сполук і відповідних реакційних умов. Підходящий час реакції є без турботи визначеним методами, відомими в даній галузі, наприклад, моніторинг реакції. На основі реакційних температур, які дані вище, підходящий час реакції в основному лежить у діапазоні між 10 хвилинами й 48 годинами. Основа формули I може бути перетворена в асоційовану сіль приєднання кислоти використовуючи кислоту, наприклад, шляхом реакції еквівалентної кількості основи й кислоти в кращому інертному розчиннику, такому як етанол, за яким іде випарювання. Підходящими кислотами для цієї реакції є, зокрема ті, які дають фізіологічно прийнятні солі. Таким чином, можливо використовувати неорганічні кислоти, наприклад, такі як сірчана кислота, сірчиста кислота, дитіонова кислота, азотна кислота, галогенводневі, такі як соляна кислота або бромистоводнева кислота, фосфорні кислоти, такі як, наприклад, ортофосфорна кислота, сульфамінова кислота, крім того органічні кислоти, зокрема аліфатичні, ациклічні, араліфатичні, ароматичні або гетероциклічні моноосновні або багатоосновні карбоксильні, сульфонові або сірчані кислоти, наприклад мурашина кислота, оцтова кислота, пропіонова кислота, гексанова кислота, октанова кислота, деканова кислота, гексадеканова кислота, октадеканова кислота, триметилоцтова кислота, діетилоцтова кислота, малонова кислота, бурштинова кислота, пімелінова кислота, фумарова кислота, малеїнова кислота, молочна кислота, винна кислота, яблучна кислота, лимонна кислота, глюконова кислота, аскорбінова кислота, нікотинова кислота, ізонікотинова кислота, метан- або етансульфонова кислота, етандисульфонова кислота, 2-гідроксиетансульфонова кислота, бензолсульфонова кислота, триметоксибензойна кислота, адамантанкарбонова кислота, p-толуолсульфонова кислота, гліколева кислота, ембонова кислота, хлорфеноксиоцтова кислота, аспарагінова кислота, глутамінова кислота, 12 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 пролін, гліоксилова кислота, пальмітинова кислота, парахорфеноксіізомасляна кислота, циклогексанкарбонова кислота, 1-фосфат глюкози, нафталінмоно- і -дисульфонова кислоти або лаурилсірчана кислота. Солі з фізіологічно неприйнятними кислотами, наприклад, пікрати, можуть використовуватися для того, щоб ізолювати і/або очистити сполуки формули I. З іншого боку, сполуки формули I можуть бути перетворені у відповідні солі металів, зокрема солі лужних металів або солі лужноземельних металів, або у відповідні солі амонію, використовуючи основи (наприклад гідроксид натрію, гідроксид калію, карбонат натрію або карбонат калію). Підходящими солями є крім того заміщені солі амонію, наприклад диметил-, діетил- і солі діізопропіламонію, солі моноетанол-, діетанол- і діізопропанoламонію, солі циклогексил- і дициклогексиламонію, солі дибензилетилендіамонію, крім того, наприклад, солі з аргініном або лізином. Якщо бажано, вільні основи формули I можуть бути виділені з їхніх солей обробкою сильними посновами, такими як гідроксид натрію, гідроксид калію, карбонат натрію або карбонат калію, доти, поки ніякі додаткові кислотні групи не будуть присутні в молекулі. У випадках, де сполуки формули I мають вільні кислотні групи, солеутворення аналогічно може бути досягнуто обробкою основами. Підходящими основами є гідроксиди лужних металів, гідроксиди лужноземельних металів або органічні основи у формі первинних, вторинних або третинних амінів. Кожний етап реакції, описаний тут, може не обов'язково супроводжуватися однією або більш методикою обробки і/або методикою виділення. Такі підходящі процедури відомі з рівня техніки, наприклад, зі стандартних робіт, таких як Houben-Weyl, Methoden der organischen Chemie [Methods of Organic Chemistry], Georg-Thieme-Verlag, Stuttgart). Приклади для таких процедур включають, але не обмежені випаром розчинника, дистиляцією, кристалізацією, кристалізацією з розпадом на частини, процедури екстракції, процедури миття, процедури дигенерування, процедури фільтрації, хроматографії, хроматографії HPLC і процедури висушування, особливо процедури висушування у вакуумі і/або підвищення температури. Сполуки, описані тут, являють собою селективні інгібітори 11β-HSD1 ензиму. Таким чином, даний винахід відноситься до застосування сполук даного винаходу в якості інгібування активності редуктази 11 β-гідроксистероїд дегідрогенази 1, який є відповідальним за перетворення кортизону в кортизол. 11β-HSD1 інгібітори структурної формули I в основному мають константу інгібування IC50 менше ніж приблизно 500 нМ, і переважно менше ніж приблизно 100 нМ. В основному, IC50 відношення 11β-HSD2 до 11β-HSD1 сполуки становить принаймні приблизно два або більше, і переважно приблизно десять або більше. Навіть більш кращими є сполуки з IC50 відношенням 11β-HSD2 до 11β-HSD1 приблизно 20 або більше. Наприклад, сполуки даного винаходу ідеально демонструють константу інгібування IC50 проти 11β-HSD2 більше ніж приблизно 1000 нМ, і переважно більше ніж 5000 нМ. Даний винахід включає застосування 11β-HSD1 інгібітору для лікування, контролю, поліпшення стану, запобігання, відстрочки початку або зменшення ризику розвитку хвороб і патологічних станів, які описані тут, за допомогою надлишку або нерегульованої кількості кортизолу і/або інших кортикостероїдів у пацієнта, що відноситься до ссавців, особливо людей, шляхом уведення ефективної кількості сполуки структурної формули I або його фармацевтично прийнятної солі або сольвату. Інгібування 11β-HSD1 ензиму обмежує перетворення кортизону, який, як правило, є інертним, у кортизол, який може викликати, або посприяти ознакам цих хвороб і патологічних станів, якщо є присутнім у надмірній кількості. Таким чином, краще втілення даного винаходу являє собою застосування сполуки даного винаходу в якості 11β-HSD1 інгібітору. Додаткове краще втілення даного винаходу являє собою застосування сполуки даного винаходу для приготування лікарського засобу. Додаткове краще втілення даного винаходу являє собою застосування сполуки даного винаходу для приготування лікарського засобу для лікування і/або запобігання хвороб, які викликані, опосередковані і/або репродуковані високими рівнями кортизолу. Додаткове краще втілення даного винаходу являє собою застосування сполуки даного винаходу для приготування лікарського засобу для лікування і/або запобігання однієї або більше хвороб або патологічних станів, обраних із групи, яка складається з таких, як метаболічний синдром, цукровий діабет, особливо інсуліннезалежний цукровий діабет, преддіабет, резистентність до інсуліну, низька толерантність до глюкози, гіперглікемія, ожиріння й пов'язані з вагою порушення, розладу ліпідного обміну, такі як дисліпідемія, гіперліпідемія, гіпертригліцеридемія, гіперхолестеринемія, низькі рівні HDL або високі рівні LDL, глаукома, 13 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 остеопороз, опосередковані глюкокортикоїдом ефекти на нейронну функцію, такі як порушення когнітивних функцій, занепокоєння або депресія, нейродегенеративна хвороба, імунні розлади, такі як туберкульоз, проказа або псоріаз, артеріальна гіпертензія, атеросклероз і його ускладнення, васкулярний рестеноз, серцево-судинні хвороби, панкреатит, ретинопатія, невропатія й нефропaтія. В іншому аспекті винаходу, спосіб лікування патологічного стану, обраного з групи, яка складається з таких, як: гіперглікемія, низька толерантність до глюкози, резистентність до інсуліну, ожиріння, розлади ліпідного обміну, дисліпідемія, гіперліпідемія, гіпертригліцеридемія, гіперхолестеринемія, низькі рівні HDL, високі рівні LDL, атеросклероз і його ускладнення, васкулярний рестеноз, панкреатит, черевне ожиріння, нейродегенеративна хвороба, ретинопатія, нефропaтія, невропатія, Метаболічний Синдром, артеріальна гіпертензія й інші патологічні стани і розлади, де резистентність до інсуліну являє собою компонент, який у пацієнта, що відноситься до ссавців і який потребує такого лікування є виявленим, включає введення пацієнтові сполуки у відповідності зі структурною формулою I у кількості, яка є ефективною для лікування зазначеного патологічного стану. В іншому аспекті винаходу спосіб відстрочки початку патологічного стану обраного із групи, що складається з таких, як гіперглікемія, низька толерантність до глюкози, резистентність до інсуліну, ожиріння, розлади ліпідного обміну, дисліпідемія, гіперліпідемія, гіпертригліцеридемія, гіперхолестеринемія, низькі рівні HDL, високі рівні LDL, атеросклероз і його ускладнення, васкулярний рестеноз, панкреатит, черевне ожиріння, нейродегенеративна хвороба, ретинопатія, нефропaтія, невропатія, Метаболічний Синдром, артеріальна гіпертензія й інші патологічні стани й розлади, де резистентність до інсуліну являє собою компонент, який у пацієнта, що відноситься до ссавців і який потребує такого лікування є виявленим, включає введення пацієнтові сполуки у відповідності зі структурною формулою I у кількості, яка є ефективною для відстрочки початку патологічного стану. Додаткове краще втілення даного винаходу являє собою фармацевтичний склад, який відрізняється тим, що він містить терапевтично ефективну кількість одного або більш сполук згідно з винаходом. Додаткове втілення даного винаходу являє собою фармацевтичний склад, який відрізняється тим, що він додатково містить одну або більш додаткових сполук, обраних із групи, що складається з фізіологічно прийнятних наповнювачів, допоміжних речовин, допоміжних лікарських речовин, розріджувачів, носіїв і фармацевтично активних агентів за винятком сполук згідно з винаходом. Додаткове краще втілення даного винаходу являє собою набір (комплект), який складається з окремих пакетів a) терапевтично ефективна кількість одної або більш сполук згідно з винаходом і b) терапевтично ефективна кількість одного або більш додаткових фармацевтично активних агентів за винятком сполук згідно з винаходом. Сполуки структурної формули I можуть бути використані в комбінації з одними або більш іншими ліками в лікуванні, запобіганні, ослабленні або поліпшенні стану хвороб або патологічних станів, для яких сполуки структурної формули I або інші ліки мають користь. Як правило, комбінація ліків є більш безпечною або більш ефективною, ніж один препарат поодинці, або комбінація є більш безпечною або більш ефективною, ніж це очікувалося б на основі сукупних властивостей окремих ліків. Такі інші ліки можуть бути застосовані шляхом способу застосування й у кількості, звичайно використовуваній одночасно або послідовно зі сполукою структурної формули I. Коли сполука структурної формули I використовується одночасно з одним або більш іншими ліками, продукт комбінації, що містить такі інші ліки і сполука структурної формули I є кращими. Проте, комбінаційна терапія також включає методи лікування, у яких сполуки структурної формули I і одним або більш інших ліків уводять у різних порядках суперпозицій. Передбачається, що при використанні в комбінації з іншими активними компонентами, сполука даного винаходу або інший активний компонент або обоє можуть використовуватися ефективно в більш низьких дозах, ніж тоді, коли кожний використовується поодинці. Відповідно, фармацевтичні склади даного винаходу включають ті, які містять один або більш інших активних компонентів, у добавок до сполуки структурної формули I. Приклади інших активних компонентів, які можна вводити в комбінації зі сполукою структурної формули I, або ж уводяться окремо або в той же самий фармацевтичній склад, включають, але не обмежені такими як: інгібітори дипептидилпептидази IV (DP-IV); агенти, поліпшуючі чутливість до інсуліну, включаючи агоністи PPARγ, такі як глітазони (наприклад, троглітазон, піоглітазон, енглітазон, MCC-555, росиглітазон, і їм подібні) і інші ліганди PPAR, включаючи подвійні агоністи PPARα/γ такі як KRP-297, і агоністи PPARα, такі як гемфіброзил, клофібрат, фенофібрат і 14 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 безафібрат, і бігуаніди, такі як метформін і фенформін; інсулін або імітатори інсуліну; сульфосечовини й інші засоби, що підсилюють секрецію інсуліну, такі як толбутамід, гліпізид, меглітинід і зв'язані матеріали; інгібітори α-глюкозидази, такі як акарбоза;антагоністи рецептора глюкагону, такі як розкриті в WO 98/04528, WO 99/01423, WO 00/39088 і WO 00/69810; GLP-1, аналоги GLP-1, і агоністи рецептора GLP-1, такі як розкриті в WO 00/42026 і WO 00/59887; GIP, імітатори GIP, такі як розкриті в WO 00/58360, і агоністи рецептора GIP; PACAP, імітатори PACAP, і агоністи рецептора 3 PACAP, такі як розкриті в WO 01/23420; агенти зниження холестерину, такі як інгібітори редуктази HMG-CoA (ловастатин, симвастатин, правастатин, церивастанин, флувастатин, аторвастатин, ітавастатин, розувастатин, і інші відповідні), секвестранти жовчних кислот (холестирамін, колестипол, і діалкілуміноалкіл похідні перехресно зшитого декстрану), нікотиновий спирт, нікотинова кислота або її сіль, інгібітори абсорбції холестерину, такі як езетиміб і бета-ситостерин, ацил CoА: інгібітори холестерин ацилтрансфераза, такі як, наприклад, авазиміб, і антиоксиданти, такі як пробукол; агоністи PPARδ, такі як розкриті в WO 97/28149; сполуки антиожиріння, такі як фенфлурамін, декстенфлурамін, фентермін, сибутрамін, орлістат, антагоністи нейропептиду Y1 або Y5, зворотні агоністи й антагоністи рецептора CB , адренергічні агоністи рецепторів, агоністи рецептора меланокортину, зокрема агоністи рецептора 4 меланокортину, антагоністи греліну, і антагоністи рецептора меланіноконцентрувального гормону (MCH); інгібітори переносника клубової жовчної кислоти; агенти призначені для використання в збуджених патологічних станах крім глюкокортикоїдів, такі як аспірин, нестероїдні протизапальні ліки, азулфідин, і інгібітори селективного циклооксигеназа-2; інгібітори протеїнтирозинфосфатази 1B (PTP-1B); протигіпертонічні засоби включаючи ті, які діють на ангіотензин або системи реніну, такі як ангіотензин, що перетворює інгібітори ензиму, антагоністи рецептора ангіотензину II або інгібітори реніну, такі як каптоприл, цилазаприл, еналаприл, фозиноприл, лізиноприл, квінаприл, раміприл, зофеноприл, кандесартан, цилексетил, епросартан, ірбесартан, лосартан, тазосартан, телмісатран, і валзартан; і інгібітори транспозиційних протеїнів холестерилових ефірів (CETP). Вищезгадані комбінації включають сполуки структурної формули I, або їх фармацевтично прийнятну сіль або сольват, з одним або більш іншими активними сполуками. Не обмежуючі приклади включають комбінації сполук структурної формули I із двома або більше активними сполуками, обраними з таких як бігуаніди, сульфоналсечовина, інгібітори HMG-CoA редуктази, агоністи PPAR, інгібітори PTP-1B, інгібітори DP-IV і сполуки антиожиріння. В іншому аспекті винаходу розкритий спосіб зниження ризику розвитку патологічних станів обраних із групи, що складається з таких як гіперглікемія, низька толерантність до глюкози, резистентність до інсуліну, ожиріння, розлади ліпідного обміну, дисліпідемія, гіперліпідемія, гіпертригліцеридемія, гіперхолестеринемія, низькі рівні HDL, високі рівні LDL, атеросклероз і його ускладнення, васкулярний рестеноз, панкреатит, черевне ожиріння, нейродегенеративна хвороба, ретинопатія, нефропaтія, невропатія, Метаболічний Синдром, артеріальна гіпертензія й інші патологічні стани й розлади, де резистентність до інсуліну являє собою компонент у пацієнта, що відноситься до ссавців і який потребує такого лікування, який включає введення пацієнтові сполуки у відповідності зі структурною формулою I у кількості, яка є ефективною для зниження ризику розвитку зазначеного патологічного стану. В іншому аспекті винаходу розкритий спосіб лікування патологічного стану, який обраний із групи, що складається з таких як гіперглікемія, низька толерантність до глюкози, резистентність до інсуліну, ожиріння, розлади ліпідного обміну, дисліпідемія, гіперліпідемія, гіпертригліцеридемія, гіперхолестеринемія, низькі рівні HDL, високі рівні LDL, атеросклероз і його ускладнення, васкулярний рестеноз, панкреатит, черевне ожиріння, нейродегенеративна хвороба, ретинопатія, нефропaтія, невропатія, Метаболічний Синдром, артеріальна гіпертензія й інші патологічні стани й розлади, де резистентність до інсуліну являє собою компонент у пацієнта, що відноситься до ссавців і який потребує такого лікування, яке включає введення пацієнтові ефективної кількості сполуки, яку визначено в структурній формулі I і сполуки, обраної із групи, що складається з таких як: інгібітори дипептидилпептидази IV (DP-IV); агенти поліпшуючі чутливість до інсуліну, обрані із групи, що складається з агоністів PPARγ, агоністів PPARα двійних агоністів PPARα/γ, і бігуаніди; інсулін або імітатори інсуліну; сульфосечовини й інші засоби, що підсилюють секрецію інсуліну, інгібітори α-глюкозидази; антагоністи рецептора глюкагону; GLP-1, аналоги GLP-1 і агоністи рецептора GLP-1; GIP, імітатори GIP і агоністи рецептора GIP; PACAP, імітатори PACAP і агоністи рецептора 3 PACAP; агенти зниження холестерину, обрані з групи, що складається з таких як інгібітори редуктази HMG-CoA, секвестранти, нікотиновий спирт, нікотинова кислота або її сіль, інгібітори абсорбції холестерину, ацил CoA: інгібітори холестерин ацилтрансферази і антиоксиданти; агоністи PPARδ; сполуки антиожиріння, інгібітори переносника клубової жовчної кислоти; протизапальні 15 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 засоби крім глюкокортикоїдів; інгібітори протеїнтирозинфосфатази 1B (PTP-1B); і протигіпертонічні засоби, включаючи ті, які діють на ангіотензин або системи реніну, такі як ангіотензин, що перетворює інгібітори ензиму, антагоністи рецептора ангіотензину II або інгібітори реніну, такі як каптоприл, цилазаприл, еналаприл, фозиноприл, лізиноприл, квінаприл, раміприл, зофеноприл, кандесартан, цилексетил, епросартан, ірбесартан, лосартан, тазосартан, телмісатран, і валзартан; зазначені сполуки вводяться пацієнтові в кількості, яка є ефективною для того, щоб лікувати зазначений патологічний стан. Інгібітори дипептидилпептидази IV, які можуть бути об'єднані зі сполуками структурної формули I включають ті, які розкриті в WO 03/004498, WO 03/004496; EP 1,258,476; WO 02/083128; WO 02/062764; WO 03/00025; WO 03/002530; WO 03/002531; WO 03/002553; WO 03/002593; WO 03/000180; і WO 03/000181. Специфічні сполуки інгібітору DP-IV включають тіазолідид ізолейцину; NVP-DPP728; P32/98; і LAF 237. Сполуки проти ожиріння, які можуть бути об'єднані зі сполуками структурної формули I, містять у собі фенфлурамін, дексфенфлурамін, фентермін, сибутрамін, орлістат, антагоністи нейропептиду Y1 або Y 5, атагоністи або інверсивні агоністи канабіноїдного CB1 рецептора, агоністи рецепторів меланокортину, більш конкретно агоністи рецепторів меланокортину-4, антагоністи греліну й антагоністи рецептора меланін-концентрувального гормону, що концентрує (MCH). Для огляду сполук проти ожиріння, які можуть бути об'єднані зі сполуками структурної формули I, див. S. Chaki і ін., "Recent advances in feeding suppressing agents: potential therapeutic strategy for the treatment of obesity", Expert Opin. Ther. Patents. 11: 1677-1692 (2001) and D. Spanswick and K. Lee, "Emerging antiobesity drugs", Expert Opin. Emerging Drugs, 8: 217-237 (2003). Антагоністи нейропептиду Y5, які можуть бути об'єднані зі сполуками структурної формули I, містять у собі такі, які описані в U.S. Patent No. 6,335,345 і WO 01/14376; і деякі сполуки, ідентифіковані як GW 59884A; GW 569180A; LY366377; і CGP-71683A. Антагоністи канабіноїдного CB1 рецептора, які можуть бути об'єднані зі сполуками структурної формули I, містять у собі такі, які описані в PCT Publication WO 03/007887; U.S. Patent No. 5,624,941, такі як римонабант; PCT Publication WO 02/076949, такі як SLV-319; U.S. Patent No. 6,028,084; PCT Publication WO 98/41519; PCT Publication WO 00/10968; PCT Publication WO 99/02499; U.S. Patent No. 5,532,237; і U.S. Patent No. 5,292,736. Агоністи рецептора меланокортину, які можуть бути об'єднані зі сполуками структурної формули I, містять у собі такі, які описані в WO 03/009847; WO 02/068388; WO 99/64002; WO 00/74679; WO 01/70708; і WO 01/70337, також як і описані в J.D. Speake і ін., "Recent advances in the development of melanocortin-4 receptor agonists", Expert Opin. Ther. Patents, 12: 1631-1638 (2002). В іншому аспекті винаходу, розкритий спосіб лікування патологічного стану, обраного із групи, яка складається з таких як гіперхолестеринемія, атеросклероз, низькі рівні HDL, високі рівні LDL, гіперліпідемія, гіпертригліцеридемія, і дисліпідемія, у пацієнта який у пацієнта, що відноситься до ссавців і який потребує такого лікування, який включає введення пацієнтові терапевтично ефективної кількості сполуки яка визначена в структурній формулі I і інгібітору редуктази HMG-CoA. Більш докладно, в іншому аспекті винаходу розкритий спосіб лікування патологічного стану, обраного із групи, що складається з таких як гіперхолестеринемія, атеросклероз, низькі рівні HDL, високі рівні LDL, гіперліпідемія, гіпертригліцеридемія й дисліпідемія, у пацієнта, що відноситься до ссавців, і який потребує такого лікування, де інгібітор редуктази HMG-CoA являє собою статин. Ще більш докладно, в іншому аспекті винаходу розкритий спосіб лікування патологічного стану, обраного із групи, що складається з таких як гіперхолестеринемія, атеросклероз, низькі рівні HDL, високі рівні LDL, гіперліпідемія, гіпертригліцеридемія й дисліпідемія, у пацієнта, що відноситься до ссавців і який потребує такого лікування, де інгібітор редуктази HMG-CoA являє собою статин, обраний із групи, що складається з таких як ловастатин, симвастатин, правастатин, церивастатин, флувастатин, аторвастатин, ітивастатин і розувастатин. В іншому аспекті винаходу, розкритий спосіб зниження ризику розвитку патологічного стану, обраного із групи, що складається з таких як гіперхолестеринемія, атеросклероз, низькі рівні HDL, високі рівні LDL, гіперліпідемія, гіпертригліцеридемія й дисліпідемія, і ускладнення таких патологічних станів, який включає введення пацієнтові, що відноситься до ссавців і який потребує такого лікування терапевтично ефективної кількості сполуки яка визначена в структурній формулі I і інгібітору редуктази HMG-CoA. В іншому аспекті винаходу, розкритий спосіб для того, щоб відстрочити початок або зменшити ризик розвитку атеросклерозу в пацієнтові-людині, який потребує такого лікування, 16 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 яке включає введення зазначеному пацієнтові ефективної кількості сполуки яка визначена в структурній формулі I і інгібітору редуктази HMG-CoA. Більш докладно, розкритий спосіб для того, щоб відстрочити початок або зменшити ризик атеросклерозу, що розвивається, у пацієнтові-людині, який потребує такого лікування, де інгібітор редуктази HMG-CoA являє собою статин. Ще більш докладно, розкритий спосіб для того, щоб відстрочити початок або зменшити ризик атеросклерозу, що розвивається, у пацієнтові-людині, який потребує такого лікування, де інгібітор редуктази HMG-CoA являє собою статин, обраний із групи, що складається з таких як: ловaстатин, симвастатин, правaстатин, церивaстатин, флувaстатин, аторвaстатин, ітавaстатин і розувaстатин. Ще більш докладно, розкритий спосіб для того, щоб відстрочити початок або зменшити ризик атеросклерозу, що розвивається, у пацієнтові-людині, який потребує такого лікування, де статин являє собою симвaстатин. В іншому аспекті винаходу розкритий спосіб для того, щоб відстрочити початок або зменшити ризик атеросклерозу, що розвивається, у пацієнтові-людині, який потребує такого лікування, де інгібітор редуктази HMG-CoA являє собою статин і додатково включає введення інгібітору абсорбції холестерину. Більш докладно, в іншому аспекті винаходу розкритий спосіб для того, щоб відстрочити початок або зменшити ризик атеросклерозу, що розвивається, у пацієнтові-людині, який потребує такого лікування, де інгібітор редуктази HMG-CoA являє собою статин, і інгібітор абсорбції холестерину являє собою гезетиміб. В іншому аспекті винаходу розкритий фармацевтичний склад, який включає сполуку згідно зі структурною формулою I, сполука обрана із групи, що складається з таких як: інгібітори DP-IV; агенти поліпшуючі чутливість до інсуліну, обрані із групи, що складається з агоністів PPARα, агоністів PPARγ, подвійних агоністів PPARα/γ, і бігуаніди; інсулін або імітатори інсуліну; сульфосечовини й інші засоби, що підсилюють секрецію інсуліну, інгібітори ос-глюкозидази; антагоністи рецептора глюкагону; GLP-1, аналоги GLP-1 і агоністи рецептора GLP-1; GIP, імітатори GIP і агоністи рецептора GIP; PACAP, імітатори PACAP, і агоністи рецептора 3 PACAP; агенти зниження холестерину, обрані із групи, що складається з таких як інгібітори редуктази HMG-CoA, секвестранти, нікотиновий спирт, нікотинова кислота або ії сіль, інгібітори абсорбції холестерину, ацил CoA: інгібітори холестерин ацилтрансфераза і антиоксиданти; агоністи PPARδ; сполуки антиожиріння, інгібітори переносника клубової жовчної кислоти; протизапальні засоби крім глюкокортикоїдів; інгібітори протеїнтирозинфосфатази 1B (PTP-1B); і протигіпертонічні засоби, включаючи ті, які діють на ангіотензин або системи реніну, такі як ангіотензин, що перетворює інгібітори ензиму, антагоністи рецептора ангіотензину II або інгібітори реніну, такі як; інгібітори транпозиційного протеїну холестерилового ефіру (CETP); і фармацевтично прийнятний носій. Додаткове втілення даного винаходу являє собою процес для виробництва зазначених фармацевтичних сполук, який відрізняється тим, що одна або більше сполук згідно з винаходом і одна або більш сполук, обраних із групи, що складається із твердих, рідких або напіврідких наповнювачів, допоміжних засобів, допоміжних лікарських речовин, розріджувачів носіїв і фармацевтично активних агентів крім сполук згідно з винаходом, є перетвореними в підходящу форму дозування. Фармацевтичні сполуки даного винаходу можуть бути введені яким-небудь чином, яким вони досягнуть наміченого призначення. Наприклад, уведення може бути оральним, парентеральним, зовнішнім, черевним, внутрішньовенним, внутрішньом'язовим, інгаляційним, назальним, внутрішньосуглобним, інтраспінальним, транстрахеальним, трансокулярним, підшкірним, внутрішньоочеревинним, трансдермальним, або ротовим шляхом. Альтернативно, або одночасно, уведення може бути оральним шляхом. Дозування введення буде залежати від віку, здоров'я і ваги реципієнта, типу паралельного лікування, якщо такі мають місце, частоти лікування і природи бажаного ефекту. Парентеральне введення є кращим. Оральне введення є особливо кращим. Підходящі форми дозування включають, але не обмежені такими як капсули, таблетки, окатиші, драже, напівтверді частки, порошки, гранули, супозиторії, мазі, креми, лосьйони, інгалянти, ін'єкційні розчини, припарки, гелі, стрічки, очні краплі, розчин, сиропи, аерозолі, суспензії, емульсії, які можуть бути зроблені згідно зі способами, які відомі в даній галузі, наприклад, як описано нижче: таблетки: змішування активного інгредієнта/тів і допоміжних речовин, пресування зазначеної суміші в таблетки (пряме пресування), не обов'язково гранулювання частини суміші перед пресуванням. 17 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 капсули: змішування активного інгредієнта/тів і допоміжних речовин для одержання рідкого порошку, не обов'язково гранулюючи порошок, заповнюють порошком /гранулятом відкриті капсули, закупорюють капсули. напівтверді частки (мазі, гелі, креми): розчинення/диспергування активного інгредієнта/тів у водному або жирному носії; наступне змішування водної/ жирної фази з додатковою жирною/ водною фазою, гомогенізація (тільки крему). супозиторії(ректальні й вагінальні): розчинення/диспергування активного інгредієнта/тів у матеріалі носія, перетвореному в рідину шляхом нагрівання (ректальні: матеріал носія звичайно віск; піхвові: носій звичайно нагрітий розчин гелеоподібного агента), відливання зазначеної суміші в супозиторні форми, нормалізація й витяг супозиторія з форм. аерозолі: диспергування/розчинення активного агента/тів у пропеленту, бутилювання зазначеної суміші в аерозольний інгалятор. В основному, не хімічні шляхи для виробництва фармацевтичних складів і/або фармацевтичних препаратів включають етапи обробки на підходящих механічних засобах, відомих у даній галузі, які переміщають одне або більш сполук згідно з винаходом у форму дозування, що підходить для введення пацієнтові який потребує такого лікування. Звичайно, переміщення однієї або більш сполук згідно з винаходом у таку форму дозування включає додавання однієї або більш сполук, обраних із групи, що складається з носіїв, наповнювачів, допоміжних речовин і фармацевтично активних компонентів крім сполук згідно з винаходом. Підходящі етапи обробки включають, але не обмежені такими як комбінування, розмелювання, змішування, гранулювання, розчинення, диспергування, гомогенізація, відливання і/або пресування відповідних активних і неактивних компонентів. Механічні засоби для виконання зазначених етапів обробки відомі в даній галузі, наприклад з Ullmann's Encyclopedia of Industrial Chemistry, 5th Edition. Щодо цього, активні компоненти являють собою переважно принаймні одну сполуку згідно із цим винаходом і одну або більш додаткових сполук крім сполук згідно з винаходом, які демонструють коштовні фармацевтичні властивості, переважно ті фармацевтичні активні агенти крім сполук згідно з винаходом, які розкриті тут. Особливо підходящими для орального використання є таблетки, пігулки, таблетки з покриттям, капсули, порошки, гранули, сиропи, соки або краплі, що підходять для ректального використання, є свічі, що підходять для парентерального використання, є розчини, переважно засновані на маслі або водяні розчини, крім того суспензії, емульсії або імплантуючі домішки, що й підходять для зовнішнього використання, є мазі, креми або порошки. Нові сполуки можуть також бути ліофізованими й продуктом реакції використання ліофізату, наприклад, для приготування ін'єкційних препаратів. Позначені препарати можуть бути стерилізованими і/або містити допоміжні речовини, такі як змащення, консерванти, стабілізатори і/або змочувальні агенти, емульгатори, солі для зміни осмотичного тиску, буферні речовини, барвники, ароматизатори і/або безліч додаткових активних компонентів, наприклад, один або більш вітамінів. Підходящі наповнювачі являють собою органічні або неорганічні речовини, які є підходящими для черевного (наприклад орального), парентерального або зовнішнього введення й не реагують із новими сполуками, наприклад вода, рослинні олії, бензилові спирти, алкілен гліколі, поліетилен гліколі, гліцерин триацетат, желатин, вуглеводи, такі як лактоза, сахароза, маніт, сорбітол або крохмаль (крохмаль кукурудзи, крохмаль пшениці, крохмаль рису, картопляний крохмаль), целюлозні препарати і/або фосфати кальцію, наприклад трикальційфосфат або вторинний кислий фосфат кальцію, стеарат магнію, тальк, желатин, трагакант, метил целюлоза, гідроксипропілметил целюлоза, карбоксиметилцелюлоза натрію, полівініл піролідон і/або вазелін. Якщо бажано, для покращення розпадання таблеток можуть бути додані, такі як вищезгадані крохмалі й також карбоксиметилкрохмаль, поперечно зшитий полівініл піролідон, агар, або альгінова кислота або її сіль, така як альгінат натрію. Допоміжні речовини включають, без обмеження регулюючі потік речовини й змащення, наприклад, кварц, тальк, стеаринову кислоту або її солі, такі як стеарат магнію або стеарат кальцію і/або поліетилен гліколь. Ядра драже забезпечені підходящими покриттями, які, якщо бажано, є стійкими до шлункових соків. Із цією метою можуть використовуватися концентровані розчини сахариду, які можуть не обов'язково містити гумміарабік, тальк, полівініл піролідон, поліетилен гліколь і/або діоксид титану, летучі розчини й підходящі органічні розчинники або розчинюючі суміші. Щоб одержати 18 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 покриття, стійкі до шлункових соків або забезпечити форму дозування, що забезпечує перевага тривалої дії, таблетка, драже або пігулка можуть містити компонент внутрішнього дозування й зовнішнього дозування, останній може перебувати у формі оболонки як раніше. Ці два компоненти можуть бути відділені ентеросолюбільним шаром, який служить для опору розпаду в животі й дозволяє внутрішньому компоненту проходити неушкодженим у дванадцятипалу кишку або бути відстроченим у виході. Безліч матеріалів можуть бути використані для таких ентеросолюбільних шарів або покриттів, використовуються матеріали, що включають багато полімерних кислот і суміші полімерних кислот з такими матеріалами як шелак, ацетиловий спирт, розчини підходящих целюлозних препаратів, такі як фталат ацетилцелюлози, ацетат целюлози або фталат гідроксипропіметилцелюлози. Барвники або пігменти можуть бути додані до таблеток або покриттів драже, наприклад, для ідентифікації або щоб характеризувати комбінації доз активних сполук. Підходящі речовини носії являють собою органічні або неорганічні речовини, які є підходящими для черевного (наприклад, орального) або парентерального введення або зовнішнього нанесення й не реагують із новими сполуками, наприклад вода, рослинні олії, бензилові спирти, поліетилен гліколі, желатин, вуглеводи, такі як лактоза або крохмаль, стеарат магнію, тальк і вазелін. Зокрема таблетки, покриті таблетки, капсули, сиропи, суспензії, емульсії або свічі використовуються для черевного введення, розчини, переважно масляні або водяні розчини, крім того суспензії, емульсії або імплантуючі домішки, використовуються для парентерального введення, і мазі, креми або порошки використовуються для зовнішнього нанесення. Нові сполуки можуть також бути ліофілізовані і отримані ліофізати можуть використовуватися, наприклад, для виробництва ін'єкційних препаратів. Позначені препарати можуть бути стерилізованими і/або можуть містити наповнювачі, такі як змащення, консерванти, стабілізатори і/або змочувальні агенти, емульгатори, солі для впливу на осмотичний тиск, буферні речовини, барвники, приправи і/або ароматизатори. Вони можуть, якщо бажано, також містити одну або більш додаткових активних сполук, наприклад, один або більш вітамінів. Інші фармацевтичні препарати, які можуть бути використані орально, включають капсули щільної посадки, зроблені з желатину, так само як м'які, запечатані капсули, зроблені з желатину й пластифікатору, такого як гліцерин або сорбітол. Капсули щільної насадки можуть містити активні сполуки у формі гранул, які можуть бути змішані з наповнювачами, такими як лактоза, зв'язувальні речовини, такі як крохмалі, і/або змащення, такі як тальк або стеарат магнію й, не обов'язково, стабілізатори. У м'яких капсулах активні сполуки переважно розчинені або суспендовані в підходящих рідинах, таких як жирні масла, або рідкий парафін. Крім того, можуть бути додані стабілізатори. Рідкі форми, у яких нові сполуки даного винаходу можуть бути впроваджені для введення орально, включають водяні розчини, відповідно приправлені сиропи, водні або масляні суспензії, і приправлені емульсії з харчовими маслами, такими як бавовняне масло, кунжутне масло, кокосове масло або арахісове масло, так само як еліксири й подібні фармацевтичні середовища. Підходящі диспергувальні або суспендуючі агенти для водних суспензій включають синтетичні й натуральні гуми, такі як трагакант, гуміарабік, альгінат, декстран, карбоксиметилцелюлоза натрію, метилцелюлоза, полівінілпіролідон або желатин. Підходящі сполуки для парентерального введення включають водяні розчини активних сполук у водорозчинній формі, наприклад, водорозчинні солі й лужні розчини. Крім того, можуть бути введені суспензії активних сполук у якості відповідних масляних ін'єкційних суспензій. Підходящі ліпофільні розчинники або середовища для ліків включають жирні масла, наприклад, кунжутне масло, або складні ефіри синтетичної жирної кислоти, наприклад, етил олеат або тригліцериди або поліетилен гліколь-400 (сполуки є розчинними в PEG-400). Водні ін'єкційні суспензії можуть містити речовини, які збільшують в'язкість суспензії, включаючи, наприклад, карбоксиметилцелюлозу натрію, сорбітол, і/або декстран, не обов'язково, суспензія може також містити стабілізатори. Для введення як інгаляційного розпилення можна використовувати розпилювачі, у яких активний компонент або розчинений або суспендований у газ пропелент або суміші газу пропеллена (наприклад CO2 або хлорфторвуглецю). Активний компонент корисно використовується тут у тонкодисперсній формі, коли один або більш додаткових фізіологічно прийнятних розчинників можуть бути присутніми, наприклад етанол. Розчини для інгаляції можуть бути введені за допомогою звичайних інгаляторів. Можливі фармацевтичні препарати, які можуть використовуватися ректально, включають, наприклад, супозиторії, які складаються з комбінації одного або більше активних сполук з підставою супозиторія. Підходящими основами супозиторія є, наприклад, натуральні або 19 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 синтетичні тригліцериди, або парафінові вуглеводні. Крім того, також можливо використовувати желатинові ректальні капсули, які складаються з комбінації активних сполук з основою. Можливі основні матеріали включають, наприклад, рідкі тригліцериди, поліетилен гліколі, або парафінові вуглеводні. В медицині сполуки даного винаходу будуть використовуватися у формі фармацевтично прийнятних солей. Інші солі можуть, однак, бути корисними в готуванні сполук згідно з винаходом або їх фармацевтично прийнятних солей. Підходящі фармацевтично прийнятні солі сполук цього винаходу включають солі, одержані шляхом додавання кислоти, які можуть, наприклад бути сформованими шляхом змішування розчину сполуки згідно з винаходом з розчином фармацевтично прийнятної кислоти, такої як соляна кислота, сірчана кислота, метансульфонова кислота, фумарна кислота, малеїнова кислота, бурштинова кислота, оцтова кислота, бензойна кислота, щавлева кислота, лимонна кислота, винна кислота, вугільна кислота або фосфорна кислота. Крім того, коли сполуки винаходу мають у собі кислотну частину, їх підходящі фармацевтично прийнятні солі можуть включати солі лужного металу, наприклад, солі калію або натрію; солі лужноземельного металу, наприклад, солі кальцію або магнію; і солі сформовані з підходящими органічними підставами, наприклад, четвертинна амонієва соль. Даний винахід включає у свій об'єм проліки сполук даного винаходу вказані вище. В основному, такі проліки будуть функціональними похідними сполук даного винаходу, які є без зусиль конвертованими in vivo у необхідну сполуку даного винаходу. Загальноприйняті методи для селекції й препарати підходящих похідних проліків описані, наприклад, в Design of Prodrugs, ed. H. Bundgaard, Elsevier, 1985. Фармацевтичні препарати можуть бути використані в якості медикаментів для людській і ветеринарній медицині. Термін, що використовується тут, "ефективна кількість" означає кількість препарату або фармацевтичного агента, яка виявить біологічну або лікувальну реакцію тканини, системи, тварини або людини, яка буде знайдена, наприклад, дослідником або практикуючим лікарем. Крім того, термін "терапевтично ефективна кількість" означає будь-яка кількість, яка, у порівнянні з відповідним суб'єктом, який не одержав таку кількість, приведе в результаті до поліпшення лікування, зціленню, запобіганню, або поліпшенню стану хвороби, розладу, або побічного ефекту, або зменшенню в нормі розвитку хвороби або розладу. Термін також включає у свої рамки кількості, які є ефективними для поліпшення нормальної фізіологічної функції. Вказана терапевтично ефективна кількість одної або більше сполук згідно з винаходом є відомими для кваліфікованого фахівця або може бути легко визначена стандартними способами, відомими в даній галузі. Речовини згідно з винаходом в основному вводять за аналогією з комерційними препаратами. Як правило дози, що підходять, які є терапевтично ефективними, лежать у діапазоні між 0.0005 мг і 1000 мг, переважно між 0.005 мг і 500 мг і особливо між 0.5 і 100 мг за одну дозу. Щоденна доза становить переважно між приблизно 0.001 і 10 мг/кг маси тіла. Фахівці в даній галузі зможуть без зусиль оцінити, що рівні дози можуть змінюватися залежно від конкретної сполуки, ваги симптомів і сприйнятливості суб'єкта до побічних ефектів. Деякі з конкретних сполук є могутнішими в порівнянні з іншими. Переважні дозування для даної сполуки є без зусиль визначними фахівцем у даній галузі за допомогою безлічі способів. Кращий спосіб полягає в тому, щоб виміряти фізіологічну дієвість даної сполуки. Реципієнт, або пацієнт можуть бути з будь-яких різновидів відносно до ссавців, наприклад, примат sp., особливо люди; гризуни, включаючи мишей, пацюків і хом'яків; кролики; коні, жуйні тварини, собаки, тварини із сімейства котячих і т.д. Моделями, що представляють інтерес для експериментальних досліджень, є тварини, що забезпечуюють модель для лікування людської хвороби. Конкретна доза для окремого пацієнта залежить, проте, від безлічі факторів, наприклад, від ефективності використовуваних конкретних сполук, від віку, маси тіла, загального стану здоров'я, статі, виду дієти, від часу й шляху введення, від норми екскреції, типу введення й форми дозування, яка буде вводитися, фармацевтичної комбінації й серйозності специфічного розладу, до якого має відношення терапія. Спеціальна терапевтично ефективна доза для окремого пацієнта може без зусилля бути визначеною шляхом звичайного експериментування, наприклад, доктором або практикуючим лікарем, який консультує або бере участь у терапевтичному лікуванні. У випадку багатьох розладів сприйнятливість специфічної клітки для лікування з обумовленими сполуками може бути визначена шляхом in vitro тестування. Типово посів клітки об'єднаний з обумовленою сполукою при змінних концентраціях на час, який є достатнім для того, щоб дозволити активним агентам показати відповідну реакцію, звичайно приблизно між 20 UA 102379 C2 5 10 15 20 25 однією годиною й одним тижнем. Для in vitro тестування можуть бути використані культивовані клітки зі зразка біопсії. Навіть без додаткових деталей, передбачається, що кваліфікований фахівець у даній галузі може використовувати наведений вище опис у максимально широкій галузі. Переважні втілення в такий спосіб повинні просто бути розцінені як описове розкриття, яке абсолютно не обмежує в будь-якому випадку. Вище й нижче, усі температури зазначені в°C. У наступних прикладах, "звичайне виділення продукту реакції" означає, що, якщо буде потреба, розчинник вилучений, вода додана якщо буде потреба, pН відрегульований, якщо буде потреба, до між 2 і 10, залежно від розведення кінцевого продукту, суміш екстрагована етил ацетатом або дихлорметаном, фази відділені, органічна фаза вимита сатурованим розчином NaHCO3, якщо бажано водою, і сатурована розчином NaCl, висушена над сульфатом натрію, відфільтрована і випарена і продукт очищений хроматографією на силікагелі шляхом препаративної HPLC і/або кристалізації. Очищені сполуки, якщо бажано, ліофілізовані. + Мас-спектрометрія (MS): ESI (електророзпилювальна іонізація)(M+H) Список Скорочень і Акронімів: AcOH оцтова кислота, anh збезводнений, atm атмосфера (и), BOC терт-бутоксикарбоніл CDI 1,1'-карбоніл діімідазол, conc концентрований, d день (ні), dec розкладання, DMAC NNдиметилацетамід, DMPU 1,3-диметил-3,4,5,6-тетрагідро-2(IH)-піримідон, DMF NNдиметилформамід, DMSO диметилсульфоксид, DPPA дифенілфосфорил азид, EDCI 1-(3диметиламінопропіл)-3-етилкарбодіімід, EtOAc етил ацетат, EtOH етанол (100 %), Et2O діетиловий ефір, Et3N триетиламін, год. година (и), MeOH метанол, pet. ether петролейний ефір (інтервал кипіння 30-60 °C), temp. температура, THF тетрагідрофуран, TFA трифторAcOH, Tf трифторметансульфоніл. Сполуки загальної формули I даного винаходу можуть бути приготовлені відповідно до процедур наступних схем 1 і 2 і прикладів. У всіх препаративних методах увесь вихідний матеріал є відомим або може легко бути приготовлений з відомих вихідних матеріалів. Схема 1 30 35 Приклад 1 (2-Фтор-феніл)-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон Етап 1: Формілування 1H-Пірол [2,3-b]піридин-3-карбоксальдегід Сполука була приготовлена як описано Seung-Jun Oh et al. (Bioorg. Med. Chem., 2004, 12, 5505). POCl3 (45 мол) був доданий по краплі при 0 °C під азотом щоб висушити DMF (28 мол), і суміш була перемішана при 0 °C протягом 15 хв. 7-азаіндол (25 г, 0.21моль) був повільно 21 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 доданий. Тоді реакційна суміш була перемішана до RT і потім при 80 °C протягом 24 годин. Після завершення реакції реакційна суміш була розлита в лід, нейтралізована охолодженим розчином NaОН 1N, екстрагована етилацетатом потім CH2Cl2/MeOH (90/10), отлужена розчином NaОН 1N, і екстрагована знову CH2Cl2/MeOH (90/10). Органічні фази були висушені над Na2SO4 і концентровані досуха, щоб одержати жовтогарячу тверду речовину (16.3 г). HPLC-MS (M+1) 147.1 1 HNMR (DMSO-d6) 7.30 (dd, 1H), 8.36-8.43 (m, 2H), 8.49 (s, 1H), 9.94 (s, 1H), 12.82 (s, 1H). Етап 2: Реакція Кневенагеля 2-Ціано-3-(1H-пірол[2,3-b]піридин-3-іл)-складний метиловий ефір акрилової кислоти 7-азаіндол-3-карбоксальдегід (3.36г, 22.99 ммоль) був узятий в 60 мол метанолу й охолоджений до 0 °C. Піперидин (2.5 мол, 25.28 ммоль) був доданий за яким іде етил ціаноацетат (2.23 мол, 25.27 ммоль). Реакція була перемішана при RT протягом 5 годин, потім концентрована гашена водою й відфільтрована щоб одержати жовтий твердий продукт (4.07 г). HPLC-MS (M+1) 228.0 1 HNMR (DMSO-d6) 3.85 (s, 3H), 7.33 (dd, 1H), 8.42 (d, 1H), 8.55 (d, 1H), 8.60 (s, 1H), 8.65 (s, 1H). Етап 3: Утворення диціаніду 2-(1H-пірол[2,3-b]піридин-3-іл)-сукцинонітрил Ціаноефір (4.42 г, 19.45 ммоль) був узятий у метанолі (60 мол) і воді (12 мол). Ціанід калію (2.53 г, 38.85 ммоль) був доданий. Реакційна суміш була дефлегмована протягом 2.5 годин. Реакційна маса була концентрована потім гашена водою, екстрагована етил ацетатом, висушена над Na2SO4. Очищення шляхом колонкової хроматографії, використовуючи CH2Cl2/MeOH (95/05) у якості елюенту дало коричнюватий твердий продукт (2.67 г). HPLC-MS (M+1) 197.0 1 HNMR (DMSO-d6) 3.46 (d, 2H), 5.02 (s, 1H), 7.18 (dd, 1H), 7.63 (s, 1H), 8.17 (d, 1H), 8.32 (d, 1H), 11.93 (s, 1H). Етап 4: Циклізація 3-(1H-пірол [2,3-b] піридин-3-іл-піролідин-2,5-діон Диціанід (0.64г, 3.26 ммоль) був узятий в (3 мол) кристалізованій оцтовій кислоті й Сірчана кислота (0.64 мол) була додана по краплі. Реакційна суміш була нагріта при 120 °C протягом 1.5 годин. Суміш була концентрована й гашена водою, за яким іде екстракція етил ацетатом. Органічний шар був концентрований насухо й залишок очищений шляхом колонкової хроматографії, використовуючи гептан/етил ацетат (10/90), потім етил ацетат у якості елюенту, щоб одержати жовтогарячу тверду речовину (0.368г). HPLC-MS (M+1) 216.1 1 HNMR (DMSO-d6) 2.87 (dd, 1H), 3.18 (dd, 1H), 4.38 (dd, 1H), 7.10 (dd, 1H), 7.50 (s, 1H), 7.90 (d, 1H), 8.24 (d, 1H), 11.33 (s, 1H), 11.60 (s, 1H.) Етап 5: Відновлення 3-Піролідин-3-іл-1H-пірол [2,3-b] піридин LAH (0.211г, 5.5 ммоль) був узятий в RB флязі й охолоджений до 0-5 °C, сухий THF (10 мол), був повільно доданий за яким іде діон (0.25г, 1.1 ммоль). Реакційна суміш була нагріта до рефлюкса протягом усієї ночі, гашена водою, 15 %-им NaОН і водою. Отриманий продукт був екстрагований етил ацетатом і концентрований, щоб одержати масло (187 мг) як неочищений продукт, який був використаний у наступному етапі без додаткового очищення. 1 HNMR (DMSO-d6) 1.78 (m, 2H), 2.15 (m, 2H), 2.7-3.05 (m, 2H), 3.2-3.45 (m, 3H), 7.03 (dd, 1H), 7.29 (s, 1H), 8.01 (d, 1H), 8.21 (d, 1H), 11.37 (s, 1H). Етап 6: Ацилювання (2-Фтор-феніл)-[3-(1H-пірол [2,3-b] піридин-3-іл)-піролідин-1-іл]-метанон Попередній амін (0.2г 1.08 ммоль) був розчинений в DMF (3 мол) і охолоджений до 0 °C. Потім HOBT (0.0432г 0.318 ммоль), EDCI (0.303г 1.59 ммоль) були додані за якими ішли триетиламін (0.44мол) і 2-фторбензойна кислота (0.178г 1.27 ммоль). Суміш була перемішана при RT протягом усієї ночі, погашена 20 мол 10 % розчину бікарбонату натрію й екстрагована етил ацетатом. Етил ацетат був концентрований і бездомішковий; продукт отриманий шляхом колонкової хроматографії як від білої твердої речовини (0.050 г). HPLC-MS (M+1) 310.1 1 HNMR (CDCl3) 2-2.5 (m, 2H), 3.4-4 (m, 4H), 4.2 (m, 1H), 7-7.5 (m, 6H), 7.9 (dd, 1H), 8.30 (s, 1H), 11.25 (s, 1H). Наступні сполуки були зроблені подібним способом як описано в прикладі 1 Приклад 2 4-Метокси-2-метилфеніл)-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон 22 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 55 60 HPLC-MS (M+1) 336.0 1 HNMR (CdCl3) 2-2.5 (m, 2H), 2.3 (s, 3H), 3.2-4 (m, 4H), 3.8 (s, 3H), 4.25 (m, 1H), 6.75 (m, 2H), 7.1-7.3 (m, 3H), 8.0 (dd, 1H), 8.35 (s, 1H), 10.6 (sl, 1H). Приклад 3 (Циклогексил)-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон HPLC-MS (M+1) 298.3 1 HNMR (CDCl3) 1-2.5 (m, 13H), 3.4-3.9 (m, 4H), 4.1 (m, 1H), 7.1-7.3 (m, 2H), 8.15 (dd, 1H), 8.35 (s, 1H), 10.8 (sl, 1H). Приклад 4 (Піридин-3-іл)-[3-(1H-пірол[2,3-b]піридин-1-іл]-метанон HPLC-MS (M+1) 293.1 1 HNMR (MeOD) 2.1-2.5 (m, 2H), 3.6-4 (m, 4H), 4.2 (m, 1H), 7.1 (dd, 1H), 7.3 (d, 1H), 7.5 (m, 1H), 7.9-8.3 (m, 3H), 8.65 (dd, 1H), 8.8 (s, 1H). Приклад 5 [3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-o-толіл-метанон HPLC-MS (M+1) 306.3 1 HNMR (CDCl3) 2.1-2.5 (m, 2H), 3.5 (s, 3H), 3.3-4.2 (m, 5H), 7.1-7.5 (m, 6H), 8.15-8.3 (m, 2H). Приклад 6 (2-Метил-2-феніл-1)-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-пропан-1-он HPLC-MS (M+1) 334.1 1 HNMR (DMSO-d6) 1.5 (s, 6H), 1.6-2.2 (m, 2H), 2.6-2.9 (m, 1H), 3.1-3.9 (m, 4H), 6.9-7.5 (m, 7H), 7.9 (dd, 1H), 8.2 (s, 1H). Приклад 7 (4-Диметиламінофеніл)-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон HPLC-MS (M+1) 335.1 Приклад 8 (1-Феніл-циклопропіл)-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон HPLC-MS (M+1) 332.2 1 HNMR (DMSO-d6) 0.75-1.4 (m, 4H), 1.8-2.2 (m, 2H), 3.1-3.9 (m, 5H), 6.9-7.4 (m, 7H), 7.9 (dd, 1H), 8.2 (s, 1H). Приклад 9 2-(4-Хлорфеніл)-2-метил-1-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-пропан-1-он HPLC-MS (M+1) 368.0 1 HNMR (CDCl3) 1.5 (m, 6H), 1.7-2.3 (m, 2H), 2.8-4.1 (m, 5H), 6.9-7.5 (m, 6H), 7.9 (dd, 1H), 8.30 (s, 1H), 9.6 (s, 1H). Приклад 10 2-Метил-2-фенокси-1-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-пропан-1-он HPLC-MS (M+1) 350.2 Приклад 11 (1-4(Хлор-феніл)циклобутил-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон HPLC-MS (M+1) 380.0 1 HNMR (MeOD) 1.8-2.5 (m, 6H), 2.7-3.25 (m, 4H), 3.5-4 (m, 3H), 6.9-7.5 (m, 6H), 8.0 (dd, 1H), 8.15 (sl, 1H). Наступні сполуки були отримані подібним способом як описано в прикладі 1 використовуючи 3-піперидин-4-іл-1H-пірол[2,3-b]піридин замість 3-піролідин-3-іл-1H-пірол[2,3-b]піридину Приклад 12 2-(4-Хлор-фенокси)-2-метил-1-[4-(1H-пірол[2,3-b]піридин-3-іл)-піперидин-1-іл]-пропан-1-он HPLC-MS (M+1) 398.1 1 HNMR (DMSO-d6) 1.1-1-9 (m, 4H), 1.61(s, 6H), 2.65-3.2 (m, 3H), 4.6 (d, 2H), 6.8-7.1 (m, 4H), 7.39 (d, 2H), 7.69 (d, 1H), 8.16 (d, 1H), 11.33 (s, 1H). Приклад 13 2-Метил-1-[4-(1H-пірол[2,3-b]піридин-3-іл)-піперидин-1-іл]-2-[4-(5-трифторметил-піридин-2іл)-піперазин-1-іл]-пропан-1-он HPLC-MS (M+1) 501.2 Приклад 14 4-(4-Фтор-фенокси)-3,3-диметил-1-[4-(1H-пірол[2,3-b]піридин-3-іл)-піперидин-1-іл]-бутан-1-он HPLC-MS (M+1) 410.2 Приклад 15 2-(4-Хлор-феніл)-2-метил-1-[4-(1H-пірол[2,3-b]піридин-3-іл)-піперидин-1-іл]-пропан-1-он HPLC-MS (M+1) 382.1 23 UA 102379 C2 5 10 15 20 Приклад 16 [1-(4-Хлор-феніл)-циклопропіл]-[4-(1H-пірол[2,3-b]піридин-3-іл)-піперидин-1-іл]-метанон HPLC-MS (M+1) 380.1 Приклад 17 4-(4-Фтор-фенокси)-3,3-диметил-1-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-бутан-1-он HPLC-MS (M+1) 396,1 1 HNMR (DMSO-d6) 1.13 (d, 6H), 2.04 (m, 1H), 2.38 (m, 3H), 3.25-4.05 (m, 7H), 6.91 (m, 2H), 7.07 (m, 3H), 7.33 (dd, 1H), 8.00 (m, 1H), 8.22 (d, 1H), 11.47 (sl, 1H). Приклад 18 [1-(4-Фтор-фенокси)-циклопропіл]-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон HPLC-MS (M+1) 366,1 1 HNMR (DMSO-d6) 0.90-1.52 (m, 5H), 2.01 (m, 1H), 2.31 (m, 1H), 3.40-4.25 (m, 4H), 7.03 (m, 3H), 7.05-7.30 (m, 3H), 7.94 (t, 1H), 8.21 (dd, 1H), 11.41 (dl, 1H) Приклад 19 [1-(4-Хлор-феніл)-циклопропіл]-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-метанон HPLC-MS (M+1) 366,1 1 HNMR (DMSO-d6) 1-1.50 (m, 4H), 2.01 (m, 1H), 2.25 (m, 1H), 3.21 (m, 1H), 3.40-3.95 (m, 4H), 7.03 (m, 1H), 7.10-7.45 (m, 5H), 7.90 (dd, 1H), 8.21 (t, 1H), 11.45 (sl, 1H). Приклад 20 2-(4-Хлор-бензолсульфоніл)-1-[3-(1H-пірол[2,3-b]піридин-3-іл)-піролідин-1-іл]-етанон HPLC-MS (M+1) 404.0 1 HNMR (DMSO-d6) 2.01 (m, 1H), 2.33 (m, 1H), 3.25-4.15 (m, 5H), 4.69 (s, 2H), 7.07 (m, 1H), 7.35 (dd, 1H), 7.74 (d, 2H), 7.94 (d, 2H), 8.01 (m, 1H), 8.22 (m, 1H), 11.50 (sl, 1H). Схема 2: 25 30 Приклади 21 Етап 1: Конденсація 1-Бензил-3-бромо-4-(1H-пірол [2,3-b] піридин-3-іл)-пірол-2,5-діон Сполука була приготовлена відповідно до Bioorg. Med. Chem., 2004, 12, 3167. 24 UA 102379 C2 5 10 15 20 25 30 Розчин EtMgBr (86.96 мол, 86.96 ммоль, 1M в THF) був доданий по краплі під азотом розчин 2,3-дибромо-N-бензилмалеіміду (10.273 г, 86.96 ммоль) у толуолі 240 мол при RT. Після 1.5 год. розчин 2, n-бензилмалеіміду (10 г, 28.98 ммоль) у толуолі (240 мол) був доданий по краплі. Потім реакційна суміш перемішувалася протягом 0.3 год., CH 2Cl2 (360 мол) був доданий, і суміш нагріта до 45 °C протягом 72 год. Гідроліз був виконаний насиченим розчином NH 4Cl. Після екстракції етил ацетатом і концентрації під вакуумом бажана сполука була обложена з CH 2Cl2 і висушене (6.92 г як жовтий порошок). HPLC-MS (M+1) 384.0 1 HNMR (DMSO-d6) 4.72 (s, 2H), 7.15-7.45 (м. 7H), 8.24 (s, 1H), 8.33 (s, 1H), 12,75 (s, 1H) Етап 2: Гідрування 1-Бензил-3-(1H-Пірол [2,3-b] піридин-3-іл)-піролідин-2,5-діон Вінілбромід (6.8 г 17.79 ммоль) в MeOH (100 мол) був гідрогенізований на 5 % Pd/C (0.68г) під грузилом (10 барів) протягом ночі. Потім реакційна суміш була відфільтрована й концентрована насухо. Неочищений залишок був очищений шляхом флеш-хроматографії, використовуючи CH2Cl2 потім CH2Cl2/MeOH (97/03) у якості елюенту, щоб одержати масло, який був розтертий у порошок з ацетоном, щоб одержати бажаний продукт як світло-жовтий порошок 2.23 г HPLC-MS (M+1) 306.1 1 HNMR (DMSO-d6) 3.2 (dd, 1H), 3.3 (dd, 1H), 4.38-4.75 (м., 3H), 7.16-7.49 (м., 6H), 7.7 (s, 1H), 8.25 (d, 1H), 8.4 (d, 1H), 12.4 (s, 1H). Етап 3: Дебензилування (1H-пірол [2,3-b] піридин-3-іл-піролідин-2,5-діон До (0.5г 1.638 ммоль) вищезгаданої сполуки в толуолі (30 мол) був доданий AlCl3 (1.093 г 8.2 ммоль). Реакційна суміш була нагріта до рефлуксу протягом ночі. Толуол був випарений, вода була додана, і залишок екстрагований етил ацетатом. Після випарювання неочищений продукт був очищений шляхом флеш-хроматографії, використовуючи CH2Cl2/MeOH (95/05) у якості елюенту й осаджений з ізопропілового ефіру, щоб одержати коричневий продукт 0.26 г HPLC-MS (M+1) 216.0 1 HNMR (DMSO-d6) 2.87 (dd, 1H), 3.18 (dd, 1H), 4.38 (dd, 1H), 7.10 (dd, 1H), 7.50 (s, 1H), 7.90 (d, 1H), 8.24 (d, 1H), 11.33 (s, 1H), 11.60 (s, 1H). Етапи 4 і 5: Відновлення й ацилювання були виконані як описано в прикладі 1 Схема 3: 25 UA 102379 C2 5 10 15 20 25 30 35 40 45 50 Приклади 22 Етап 1: Конденсація 5-(1H-пірол[2,3-b]піридин-3-іл)-3,4-дигідро-2H-піридин-1-карбонової кислоти терт-бутиловий складний ефір і 5-(1H-пірол[2,3-b]піридин-3-іл)-3,6-дигідро-2H-піридин-1-карбонової кислоти терт-бутиловий складний ефір 7-азаіндол (0.5г, 4.23 ммоль) і N-Boc-піперидин-3-он (2.1 г, 10.5 ммоль) і 2M KOH в MeOH (11 мол) були нагріті до 60 °C протягом 17 год. Потім реакційна суміш була концентрована у вакуумі, відреагована в етил ацетаті, і органічна фаза була вимита водою й морською водою, висушена над сульфатом магнію й концентрована насухо. Залишок був розтертий у порошок із сумішшю хлориду метилену й гептану. Осад був відфільтрований і висушений, щоб одержати суміш ~75/25 бажаних продуктів як світло-жовта тверда речовина (0.356 г). Вихідний розчин був очищений шляхом флеш-хроматографії, використовуючи гептан/етил ацетат від 60/40 до 40/60 у якості елюенту, щоб одержати суміш ~ 65/35 бажаних продуктів як світло-жовтий порошок (0.455 г) 1 HNMR (DMSO-d6) основний продукт 1.51 (d, 9H), 1.92 (м., 2H), 2.44 (м., 2H), 3.57 (м., 2H), 7.14 (м., 1H), 7.36 (dd, 1H), 7.49 (d, 1H), 8.05 (м., 1H), 8.25 (d, 1H), 11.64 (sl, 1H). побічний продукт 1.46 (s, 9H), 2.30 (м., 2H), 3.52 (м., 2H), 4.24 (sl, 2H), 6.31 (м., 1H), 7.11 (м., 1H), 7.56 (sl, 1H), 8.20 (м., 2H), 11.75 (sl, 1H). Етап 2: Гідрування 3-(1H-пірол[2,3-b]піридин-3-мул)-піперидин-1-карбонової кислоти терт-бутиловий складний ефір Суміш вищезгаданих ізомерів (0.428г 1.43 ммоль) у суміші 1/1 MeOH/THF (10 мол) була гідрогенізована на Pd(OH)2/C 10-20 % (0.01г) під грузилом (10 барів) протягом 4 год. Потім реакційна суміш була відфільтрована й концентрована насухо. Нечищений залишок був очищений шляхом флеш-хроматографії, використовуючи гептан/етил ацетат 60/40 у якості елюенту, щоб одержати бажаний продукт як масляна тверда речовина (0.17г). 1 HNMR (DMSO-d6) 1.43 (s, 9H), 1.75-1.85 (м., 3H), 2.04 (dl, 1H), 2.89 (м., 3H), 3.93 (dl, 1H), 4.1 (sl, 1H), 7.06 (dd, 1H), 7.40 (s, 1H), 8.01 (м., 1H), 8.23 (м., 1H), 11.45 (sl, 1H). Етап 3: Зняття захисних груп 3-піперидин-3-іл-1H-пірол [2,3-b] піридин До вищезгаданої сполуки (93 мг, 0.31 ммоль) у діоксані (1 мол) було додано 0.232 мол 4M розчину HCl у діоксині. Реакційна суміш була перемішана при RT протягом 2 год. і концентрована насухо. Залишок був очищений шляхом флеш-хроматографії, використовуючи CH2Cl2/MeOH/NH3 (90/10/3) у якості елюенту, щоб одержати бажаний продукт як масляна тверда речовина (10 мг). 1 HNMR (DMSO-d6) 1.55-1.75 (м., 3H), 2.02 (sl, 1H), 2.88 (м., 2H), 2.9-3.1 (м., 2H), 3.75 (sl, 1H), 7.04 (dd, 1H), 7.25 (s, 1H), 7.99 (d, 1H), 8.18 (dd, 1H), 11.40 (sl, 1H). Етапи 4: Ацилювання були виконані як описано в прикладі 1 Приклад 23: Аналізи - Виміру констант інгібування Людський рекомбінант 11бета-гідроксистероїд дегідрогенази типу 1 (11бета-HSD1) і (11бетаHSD2) ензими типу 2 були експресовані в мишачій кишковій паличці й мікросомні фракції печінки пацюка були придбаний в TEBU. Аналізи 11бета-HSD1 ензиму були виконані в 96 лунках пластин мікротитратора в сумарному об'ємі 100 утримуючому 30 мМ буфер Hepes, pН 7,4 з 1 мМ EDTA, суміш субстрату кортизону/NADPH (200 нМ / 200 мкM), G-6-P (1 мМ) і інгібітори в послідовних розчиненнях. Реакції були ініційовані додаванням 10 мкл 11бета-HSD1 (3 мкг) з Кишкової Палички, або в якості мікросомних фракцій печінки пацюків і мишей (2,5 мкг). Після змішування, пластини струшували в спливання 150 хвилин при 37 °C. Реакції були завершені з 10 мкл стоп-розчином кислоти-18бета гліцирретинової. Визначення рівнів кортизолу в 11 бета-HSD1 препаратах були перевірені HTRF (HTRF аналіз кортизолу з Cis bio international). Активність виражена в % контролю або концентрації для інгібування 50 % активності ензиму (IC50). Цей аналіз був так само застосований до 11бета-HSD2 ензиму, кортизолу, NAD і карбеноксолон використовувалися як підстава, кофактор і інгібітор, відповідно. 55 26 UA 102379 C2 Інгібування Інгібування Інгібування Інгібування Селективна Приклад людського мишачого щурячого людського норма No. 11-бета HSD-1 11-бета HSD-1 11-бета HSD-1 11-бета HSD-2 людського IC50 (µM) IC50 (µM) IC50 (µM) IC50 (µM) HSD2/HSD1 Ін. 3 0.54 0.95 0.51 Ін. 5 0.36 60 % of Ctrl при 1 µM Ін. 6 0.025 0.23 0.051 > 10 > 400 Ін. 7 0.17 0.043 > 10 Ін. 8 0.050 0.048 > 10 > 200 Ін. 9 0.0098 0.92 > 10 > 1000 Ін. 11 0.0073 1.7 Ін. 13 1.14 Ін. 14 0.11 86 % Ctrl при 1 µM 85 % Ctrl при 1 µM Ін.17 0.016 2.1 Ін.20 0.029 5 10 15 20 25 30 Приклад 24: Ін'єкційні ампули Розчин 100 г активної сполуки даного винаходу й 5 г двонатрієвого гідрогенфосфату були доведені до pН 6.5 в 3 л двічі дистильованої води із застосуванням 2N соляної кислоти, стерильно відфільтровані, розподілені в ін'єкційні ампули, ліофілізовані в стерильних умовах і стерильно запечатані. Кожна ін'єкційна ампула містить 5 мг активної сполуки. Приклад 25: Супозиторії Суміш 20 г активної сполуки даного винаходу конденсована з 100 г лецитину сої й 1400 г масла какао, розлиті у форми й залишені прохолоджуватися. Кожний супозиторій містить 20 мг активної сполуки. Приклад 26: Розчин Розчин 1 г активної сполуки даного винаходу, 9.38 г NaН2PO4 • 2 H2O, 28.48 г Na2HPO4 • 12 H2O і 0.1 г хлориду бензалконію приготовлений в 940 мол двічі-дистильованої води. Він доведений до pН 6.8, доданий до 1 л і стерилізується опроміненням. Цей розчин може використовуватися у формі очних крапель. Приклад 27: Мазь 500 мг активної сполуки даного винаходу змішані з 99.5 г вазеліну при стерильних патологічних станах. Приклад 28: Таблетки Суміш 1 кг активної сполуки даного винаходу, 4 кг лактози, 1.2 кг картопляного крохмалю, 0.2 кг тальку й 0.1 кг стеарату магнію стиснута, щоб дати таблетки в загальноприйнятому виді таким чином, щоб кожна таблетка містила 10 мг активної сполуки. Приклад 29: Покриті таблетки Аналогічно до попереднього прикладу, таблетки натиснуті й тоді покриті в загальноприйнятому виді, використовуючи покриття сахарози, картопляного крохмалю, тальку, tragacanth і барвника. Приклад 30: Капсули 2 кг активної сполуки даного винаходу розподілені у тверді капсули желатину в загальноприйнятому виді таким чином, щоб кожна капсула містила 20 мг активної сполуки. 27 UA 102379 C2 ФОРМУЛА ВИНАХОДУ 1. Сполука формули І R R Y 1 X 2 O N R ()n R R 5 10 15 20 25 30 35 40 45 6 3 4 R5 N N ,I де 1 2 R , R являють собою незалежно один від одного Н, алкіл, циклоалкіл, галогеналкіл, Ar, гетероарил або гетероциклоалкіл, 3 4 R , R являють собою незалежно один від одного Н, алкіл, Hal або ОН, 5 6 R , R являють собою незалежно один від одного Н, алкіл, галогеналкіл або Hal, X являє собою -(С)m, -О-, -S-, -S(O)- або -S(O)2, Υ являє собою алкіл, алкоксіалкіл, циклоалкіл, арилокси, гетероарилокси, феніл або гетероарил, необов'язково моно-, ди- або тризаміщений Hal, алкіл, С1-4алкілокси, 7 8 трифторметил, трифторметокси, С1-4алкілоксикарбоніл, С1-4алкілкарбоніл або R R С1-4алкілокси, 7 8 R , R являють собою незалежно один від одного С 1-4алкіл або С4-7циклоалкіл, n має значення 1 або 2, і m має значення 0 або 1, або її фізіологічно прийнятні солі, похідні, сольвати й стереоізомери, включаючи їх суміші у будь-яких співвідношеннях. 2. Сполука за п. 1, де 1 2 R , R являють собою незалежно один від одного Н, алкіл, циклоалкіл, галогеналкіл, Аr, гетероарил або гетероциклоалкіл, 3 4 R , R являють собою незалежно один від одного Н, алкіл, Hal або ОН, 5 6 R , R являють собою незалежно один від одного Н, алкіл, галогеналкіл або Hal, X являє собою -(С)m, -О-, -S-, -S(O)- або -S(O)2, Υ являє собою алкіл, алкоксіалкіл, циклоалкіл, арилокси, гетероарилокси, феніл або гетероарил, необов'язково моно-, ди- або тризаміщений Hal, алкіл, С1-4алкілокси, трифторметил, трифторметокси, С1-4алкілоксикарбоніл, С1-4алкілкарбоніл або 7 8 R R NС1-4алкілокси, 7 8 R , R являють собою незалежно один від одного С1-4алкіл або С4-7циклоалкіл, n має значення 1, і m має значення 0 або 1, або її фізіологічно прийнятні солі, похідні, сольвати й стереоізомери, включаючи їх суміші у будь-яких співвідношеннях. 3. Сполука за п. 1, де 1 2 R , R являють собою незалежно один від одного алкіл, циклоалкіл, галогеналкіл, Ar, гетероарил або гетероциклоалкіл, 3 4 R , R являють собою незалежно один від одного Н, алкіл, Hal або ОН, 5 6 R , R являють собою незалежно один від одного Н, алкіл, галогеналкіл або Hal, X являє собою -(С)m, -О-, -S-, -S(O)- або -S(O)2, Υ являє собою алкіл, алкоксіалкіл, циклоалкіл, арилокси, гетероарилокси, феніл або гетероарил, необов'язково моно-, ди- або тризаміщений Hal, алкіл, С1-4алкілокси, трифторметил, трифторметокси, С1-4алкілоксикарбоніл, С1-4алкілкарбоніл або 7 8 R R NС1-4алкілокси, 7 8 R , R являють собою незалежно один від одного С 1-4алкіл або С4-7циклоалкіл, n має значення 1, і m має значення 0 або 1,
ДивитисяДодаткова інформація
Назва патенту англійською7-azaindole derivatives as selective inhibitors of the beta-hydroxysteroiddehydrogenase type 1
Автори англійськоюCarniato, Denis, Schutz, Jurgen, Roche, Didier, Hallakou-Bozec, Sophie
Назва патенту російськоюПроизводные 7-азаиндола как селективные ингибиторы бета-гидроксистероида дегидрогеназы 1 типа
Автори російськоюКарниато Денис, Шутц Юрген, Роше Дидье, Халлакоу-Бозек Софи
МПК / Мітки
МПК: A61K 31/33, C07D 471/04, A61P 25/00
Мітки: дегідрогенази, 7-азаіндолу, селективні, типу, бета-гідроксистероїду, похідні, інгібітори
Код посилання
<a href="https://ua.patents.su/34-102379-pokhidni-7-azaindolu-yak-selektivni-ingibitori-beta-gidroksisterodu-degidrogenazi-1-tipu.html" target="_blank" rel="follow" title="База патентів України">Похідні 7-азаіндолу як селективні інгібітори бета-гідроксистероїду дегідрогенази 1 типу</a>
Попередній патент: Бурова коронка з обертальними різцями
Наступний патент: Вбираюча прокладка
Випадковий патент: Спосіб діагностики загрози дестабілізації перебігу ішемічної хвороби серця при негоспітальній пневмонії в осіб, інфікованих chlamydophila pneumoniae