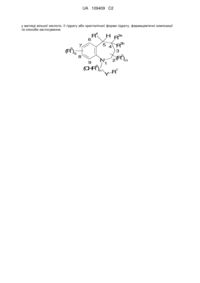
Транс-4-[[(5s)-5-[[[3,5-біс(трифторометил)феніл]метил]-(2-метил-2н-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1н-1-бензоазепін-1-іл]метил]циклогексанкарбонова кислота
Номер патенту: 109409
Опубліковано: 25.08.2015
Автори: Чень Сіньчао, Ремік Дейвід Майкл, Педерсен Стівен Уейн, Франк Скотт Алан
Формула / Реферат
1. Сполука, яка являє собою транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2Н-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1Н-1-бензоазепін-1-іл]метил]циклогексанкарбонову кислоту, або гідрат чи фармацевтично прийнятна сіль згаданої сполуки.
2. Сполука за п. 1, яка являє собою гідрат транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2Н-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1Н-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти.
3. Сполука, яка являє собою кристалічну форму гідрату транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2Н-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1Н-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти, яку характеризує порошкова рентгенодифрактограма, одержана із застосуванням джерела СuKa (λ=1,54056 Å), що включає такі піки:
a) при 2q 7,5, 9,2, 10,7 та 15,5±0,2; або
b) при 2q 7,5, 9,2, 10,7, 13,8, 15,0, 15,5 та 19,5±0,2; або
c) при 2q 7,5, 9,2, 10,7, 13,8, 11,3, 15,0, 15,5, 17,7, 19,5 та 25,1±0,2.
4. Сполука, яка являє собою кристалічну форму гідрату транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти, яку характеризує спектр ЯМР у твердому стані, який включає такі піки відносно адамантану (d=29,5 млн-1):
a) 175,6, 168,0, 61,1, 21,2 та 18,3±0,2 млн-1; або
b) 175,6, 168,0, 145,6, 144,8, 61,1, 45,0, 21,2 та 18,3±0,2 млн-1; або
c) 175,6, 168,0, 145,6, 144,8, 139,9, 136,3, 61,1, 53,0, 49,8, 45,0, 21,2 та 18,2±0,2 млн-1.
5. Сполука, яка являє собою транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонову кислоту, або фармацевтично прийнятна сіль згаданої сполуки.
6. Композиція, яка містить транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонову кислоту або її фармацевтично прийнятну сіль та молекулу для утворення сольвату, вибрану з-посеред води, метанолу, етанолу, ізопропанолу, мурашиної кислоти або оцтової кислоти.
7. Композиція за п. 6, яка відрізняється тим, що транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонова кислота або її фармацевтично прийнятна сіль та згадана молекула для утворення сольвату містяться у молярному співвідношенні від приблизно 1:0,3 до приблизно 1:1±0,2 (кислота або сіль:молекула для утворення сольвату).
8. Сполука, яка являє собою транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонову кислоту у вигляді кристалічної форми напівсольвату з етанолом напівсолі з трет-бутиламіном, яку характеризує порошкова рентгенодифрактограма, одержана із застосуванням джерела СuKa (λ=1,54056 Å), яка включає такі піки:
a) при 2q 5,5, 9,0, 14,3, 22,0 та 22,5±0,2; або
b) при 2q 5,5, 9,0, 14,3, 17,5, 18,2, 19,4, 20,6, 22,0 та 22,5±0,2; або
с) при 2q 5,5, 9,0, 13,2, 13,6, 14,3, 15,2, 17,5, 18,2, 19,4, 19,8, 20,6, 22,0 та 22,5±0,2.
9. Сполука, яка являє собою транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2Н-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1Н-1-бензоазепін-1-іл]метил]циклогексанкарбонову кислоту у вигляді кристалічної форми сольвату з мурашиною кислотою, яку характеризує порошкова рентгенодифрактограма, одержана із застосуванням джерела СuKa (λ=1,54056 Å), яка включає такі піки:
a) при 2q 15,4, 16,9, 18,2 та 18,6±0,2; або
b) при 2q 15,4, 15,7, 16,9, 18,2, 18,6, 19,5, 22,8, (25,7 та 25,5)±0,2; або
c) при 2q 13,0, 13,9, 15,4, 15,7, 16,9, 16,4, 18,2, 18,6, 19,5, 20,8, 22,8, (25,7 та 25,5)±0,2.
10. Сполука, яка являє собою транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1Н-1-бензоазепін-1-іл]метил]циклогексанкарбонову кислоту у вигляді кристалічної форми сольвату з оцтовою кислотою, яку характеризує порошкова рентгенодифрактограма, одержана із застосуванням джерела СuKa (λ=1,54056 Å), яка включає такі піки:
a) при 2q 12,9, 15,1, 18,4, 19,4 та 20,8±0,2; або
b) при 2q 12,9, 13,8, 15,1, 16,4, 17,8, 18,4, 19,4, 20,1 та 20,8±0,2; або
c) при 2q 11,0, 12,9, 13,8, 15,1, 15,6, 16,4, 17,8, 18,4, 19,4, 20,1, 20,8 та 21,7±0,2.
11. Сполука, яка являє собою тpaнс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1Н-1-бензоазепін-1-іл]метил]циклогексанкарбонову кислоту у вигляді кристалічної форми сольвату з етанолом солі з трет-бутиламіном, яку характеризує порошкова рентгенодифрактограма, одержана із застосуванням джерела СuKa (λ=1,54056 Å), яка включає такі піки:
a) при 2q 5,6, 11,3, 12,6 та 17,9±0,2; або
b) при 2q 5,6,8,0, 11,3, 12,6, 17,9, 20,4 та 24,1±0,2.
12. Сполука за п. 1, фармацевтично прийнятна сіль якої утворена із катіоном, вибраним з-поміж катіонів натрію, калію, магнію, кальцію, цинку або тpет-бутиламонію.
13. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-5 та пп. 10-12, а також щонайменше один із фармацевтично прийнятних носія, наповнювача або розріджувача.
14. Застосування сполуки за будь-яким із пп. 1-5 та пп. 10-12 для виготовлення лікарського засобу для лікування дисліпідемії.
15. Застосування сполуки за будь-яким із пп. 1-5 та пп. 10-12 для виготовлення лікарського засобу для лікування атеросклерозу.
16. Спосіб синтезу транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1Н-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти або її фармацевтично прийнятної солі, в якому здійснюють деестерифікацію сполуки формули II:
 , II
, II
де R вибирають з групи, яку складають С1-4-алкіл, С1-4-галогеноалкіл, С3-6-циклоалкіл, С1-4-алкіл-С3-6-циклоалкіл, феніл та С1-5-алкілфеніл, із одержанням сполуки формули І або її фармацевтично прийнятної солі:
 I.
I.
17. Спосіб за п. 16, в якому здійснюють конденсацію сполуки формули III
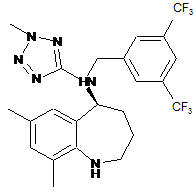 III
III
зі сполукою
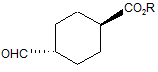 , з одержанням сполуки формули І або її фармацевтично прийнятної солі.
, з одержанням сполуки формули І або її фармацевтично прийнятної солі.
18. Сполука, яка має структурну формулу:
 , II
, II
де R вибирають з групи, яку складають С1-4-алкіл, С1-4-галогеноалкіл, С3-6-циклоалкіл, С1-4-алкіл-С3-6-циклоалкіл, феніл та С1-5-алкілфеніл.
19. Сполука, яка має структурну формулу
 III.
III.
Текст
Реферат: Описана сполука формули: CF3 N N N N N CF3 N CO2H , яка є транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбоновою кислотою, UA 109409 C2 (12) UA 109409 C2 у вигляді вільної кислоти, її гідрату або кристалічної форми гідрату, фармацевтичні композиції та способи застосування. 4 R H 3a R 6 5 3 5 4 Rb 3 7 ( )q R 2 8 N 9 6 ( H )n C R 1 R m 2( ) 1 Y R UA 109409 C2 5 10 15 Цей винахід стосується транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил]-(2-метил-2Hтетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1іл]метил]циклогексанкарбонової кислоти, її фармацевтично прийнятних солей та кристалічних форм цієї сполуки, а також їх приготування, і методів лікування із застосуванням цієї сполуки. Із дисліпідемією пов'язаний неабиякий фактор ризику виникнення серцево-судинних захворювань (ССЗ). Низький вміст холестерину ліпопротеїнів високої густини (HDL-c) у плазмі крові поряд зі звичайним або підвищеним вмістом холестерину низької густини (LDL-c) становлять значний фактор ризику виникнення атеросклерозу та пов'язаної з цим ішемічної хвороби серця. Білок-носій складного ефіру холестерилу (або холестерину) (CETP) являє собою глікопротеїн, який сприяє обміну складних ефірів холестерилу у складі HDL на тригліцериди у складі ліпопротеїнів, багатих на тригліцериди. Кінцевий результат прояву активності CETP полягає у зменшенні рівня холестерину HDL і підвищенні натомість рівня холестерину LDL. За припущенням, цей ефект стосовно розподілу ліпопротеїнів є проатерогенним (таким, що сприяє розвитку атеросклерозу) – зокрема, для тих осіб, кого на підставі ліпідограми слід віднести до групи підвищеного ризику виникнення ССЗ. В WO 2006/002342 розкриті деякі прийнятні для лікування серцево-судинних захворювань 1 6 сполуки, структура яких відповідає наведеній нижче формулі, а замісники R -R розкриті у згаданій заявці. 6 R 4 H R3a 5 4 7 5 (R )q 2 N 9 6 (CHR )n 25 30 35 3b 3 8 20 R 1 2 (R )m Y R 1 Незважаючи на наведене вище, зберігається велика потреба у ефективних сполуках, здатних лікувати серцево-судинні захворювання, зокрема атеросклероз та/або дисліпідемію. Існує потреба у створенні сполук, ефективних у лікуванні серцево-судинних захворювань при пероральному введенні лікувальної дози, і стійких у кислому середовищі, яке існує, наприклад, у шлунку. Крім того, ці сполуки повинні мати достатньо високу біодосяжність та/або здатність завдавати впливу при пероральному застосуванні, щоб при однократному введенні до організму забезпечувати більш ефективне лікування. Цей винахід спрямований на задоволення цих потреб і пропонує сполуку, придатну для лікування серцево-судинних захворювань, в тому числі, але без обмеження ними, дисліпідемії та атеросклерозу. Цим винаходом запропонована сполука, що виявляє надзвичайно корисні і непередбачені властивості. Фізичні та фармакологічні властивості сполуки, представленої у формулі винаходу, роблять її особливо прийнятною для введення до складу таблеток, призначених для перорального застосування. Згадані особливо сприятливі властивості охоплюють, але без обмеження ними, підвищену стійкість, розчинність та/або біодосяжність. Цим винаходом запропонована сполука, яка являє собою транс-4-[[(5S)-5-[[[3,5біс(трифторометил)феніл]метил]-(2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонову кислоту (формула відповідає назві у вказівнику РЖ Chemical Abstracts), тут і надалі скорочено BCCA, яка має будову за формулою I, зображеною нижче, а також фармацевтично прийнятна сіль цієї сполуки. N CF3 N N N N CF3 N CO2H 40 I 1 UA 109409 C2 5 10 15 20 25 30 35 40 45 50 55 Сполука, позначена як BCCA, може являти собою кислоту як таку (в цьому описі – вільна кислота BCCA) або її фармацевтично прийнятну сіль у формі сольвату (в цьому описі – сольват BCCA) та/або гідрату (в цьому описі – гідрат BCCA). До згаданих сольватів належать сольвати, утворені водою (це і є гідрат), метанолом, етанолом, мурашиною кислотою, оцтовою кислотою та ізопропанолом. Цим винаходом запропонована сполука, що являє собою BCCA, її фармацевтично прийнятну сіль або гідрат та/або сольват. У одному з варіантів здійснення цього винаходу згадана сполука BCCA запропонована у формі вільної кислоти. У деяких інших варіантах здійснення цього винаходу BCCA запропонована у формі гідрату BCCA або сольвату BCCA (як у формі вільної кислоти, так і її солі) у кристалічній формі. У ще деяких варіантах здійснення винаходу запропонована BCCA у формі гідрату BCCA або сольвату BCCA в аморфному твердому стані. Цим винаходом запропонована сполука, що являє собою кристалічну форму гідрату BCCA, яку характеризує порошкова рентгенодифрактограмма від джерела CuKα (λ=1,54056 Å), яка включає такі піки: a) при 2θ 7,5, 9,2, 10,7 та 15,5 0,2; b) при 2θ 7,5, 9,2, 10,7, 13,8, 15,0, 15,5 та 19,5 0,2; або c) при 2θ 7,5, 9,2, 10,7, 13,8, 11,3, 15,0, 15,5, 17,7, 19,5 та 25,1 0,2. У іншому варіанті здійснення цим винаходом запропонована сполука, що являє собою кристалічну форму гідрату BCCA, яку характеризує ЯМР спектр у твердому стані, який включає -1 -1 такі піки відносно адамантану (δ=29,5 млн ): a) 175,6, 168,0, 61,1, 21,2 та 18,3 0,2 млн ; b) -1 175,6, 168,0, 145,6, 144,8, 61,1, 45,0, 21,2 та 18,3 0,2 млн , або c) 175,6, 168,0, 145,6, 144,8, -1 139,9, 136,3, 61,1, 53,0, 49,8, 45,0, 21,2 та 18,2 0,2 млн . У ще деяких варіантах здійснення цього винаходу BCCA запропонована кристалічна форма гідрату BCCA, яку характеризує щонайменше одне з двох: a) порошкова рентгенодифрактограма від джерела CuKα (λ=1,54056 Å), яка включає такі піки: при 2θ 7,5, 9,2, 10,7 та 15,5 0,2, або b) ЯМР спектр у твердому стані, який включає піки відносно адамантану -1 -1 (δ=29,5 млн ): 175,6, 168,0, 61,1, 21,2 та 18,3 0,2 млн . Цим винаходом запропонована сполука, що являє собою кристалічну форму напівсольвату із етанолом напівсолі BCCA з трет-бутиламіном, яку характеризує порошкова рентгенодифрактограма від джерела CuKα (λ=1,54056 Å), яка включає такі піки: a) при 2θ 5,5, 9,0, 14,3, 22,0 та 22,5 0,2, або b) при 2θ 5,5, 9,0, 14,3, 17,5, 18,2, 19,4, 20,6, 22,0 та 22,5 0,2, або c) при 2θ 5,5, 9,0, 13,2, 13,6, 14,3, 15,2, 17,5, 18,2, 19,4, 19,8, 20,6, 22,0 та 22,5 0,2. Цим винаходом запропонована сполука, що являє собою кристалічну форму сольвату BCCA із мурашиною кислотою, яку характеризує порошкова рентгенодифрактограма від джерела CuKα (λ=1,54056 Å), яка включає такі піки: a) при 2θ 15,4, 16,9, 18,2 та 18,6 0,2, або b) при 2θ 15,4, 15,7, 16,9, 18,2, 18,6, 19,5, 22,8, 25,7, та 25,5 0,2, або c) при 2θ 13,0, 13,9, 15,4, 15,7, 16,9, 16,4, 18,2, 18,6, 19,5, 20,8, 22,8, 25,7 та 25,5 0,2. Цим винаходом запропонована сполука, що являє собою кристалічну форму сольвату BCCA із оцтовою кислотою у кристалічному стані, яку характеризує порошкова рентгенодифрактограма від джерела CuKα (λ=1,54056 Å), яка включає такі піки: a) при 2θ 12,9, 15,1, 18,4, 19,4 та 20,8 0,2, або b) при 2θ 12,9, 13,8, 15,1, 16,4, 17,8, 18,4, 19,4, 20,1 та 20,8 0,2, або c) при 2θ 11,00, 12,9, 13,8, 15,1, 15,6, 16,4, 17,8, 18,4, 19,4, 20,1, 20,8 та 21,7 0,2. Цей винахід пропонує сполуку, що являє собою кристалічну форму сольвату із ізопропанолом солі BCCA з трет-бутиламіном, яку характеризує порошкова рентгенодифрактограма від джерела CuKα (λ=1,54056 Å), яка включає такі піки: a) при 2θ 5,6, 11,3, 12,6 та 17,9 0,2, або b) при 2θ 5,6, 8,0, 11,3, 12,6, 17,9, 20,4 та 24,1 0,2. У іншому варіанті здійснення цього винаходу запропонована BCCA або її фармацевтично прийнятна сіль у вигляді сольвату, де сольват обраний з-посеред сольватів, утворених водою (відповідний сольват зветься також гідратом), метанолом, етанолом, ізопропанолом, мурашиною кислотою або оцтовою кислотою. Мольне співвідношення BCCA:сольват може становити від приблизно 1:0,3 до приблизно 1:1, за варіантом, якому віддається більша перевага, від приблизно 1:0,5 до приблизно 1:1 0,2 (вказано співвідношення BCCA або сіль:сольват). До сольватів, яким віддається перевага, належать сольвати, утворені водою, ізопропанолом та етанолом. У іншому варіанті здійснення винаходу запропонована BCCA або її фармацевтично прийнятна сіль. Катіони фармацевтично прийнятної солі, яким віддають перевагу, обирають зпоміж катіонів натрію, калію, магнію, кальцію, цинку та трет-бутиламіну (тобто третбутиламонію). Більшу перевагу віддають катіонам натрію, кальцію та трет-бутиламіну. Цей винахід пропонує по суті чисту BCCA у вигляді вільної кислоти BCCA або її фармацевтично прийнятних солей, гідрату BCCA, сольвату BCCA (або гідрату BCCA) та 2 UA 109409 C2 5 10 15 20 25 30 кристалічної форми сольвату солі BCCA (будь-яка з них позначається в описі як "згадана форма BCCA"). У контексті цього документу термін "практично чистий" означає композицію, яка містить більш ніж 80 % (мас.) згаданої форми BCCA, за варіантом, якому віддається перевага, композиція містить більш ніж 95 % (мас.) згаданої форми ВССА і за варіантом, якому віддають найбільшу перевагу, композиція містить згаданої форми BCCA більш ніж 98 % (мас.). За варіантом, якому віддають особливу перевагу, цим винаходом запропонований у кристалічній формі практично чистий гідрат BCCA. Цим винаходом запропонована фармацевтична композиція, яка містить BCCA або її фармацевтично прийнятну сіль, а також щонайменше один з фармацевтично прийнятних носіїв, наповнювачів або розріджувачів. У окремих варіантах здійснення винаходу фармацевтична композиція містить практично чисту BCCA у формі вільної кислоти BCCA або її фармацевтично прийнятної солі, сольвату BCCA, сольвату солі BCCA або кристалічної форми гідрату BCCA. За варіантом, якому віддають особливу перевагу, фармацевтична композиція містить кристалічну форму практично чистого гідрату BCCA. Цим винаходом запропонований метод лікування пацієнта, хворого на серцево-судинне захворювання, при цьому метод включає введення ефективної кількості BCCA до організму пацієнта. За варіантами, яким надається перевага, метод включає введення BCCA у вигляді гідрату BCCA. За іншими варіантами метод включає введення BCCA у вигляді кристалічної форми сольвату BCCA або кристалічної форми гідрату BCCA. Цим винаходом запропоновано застосування BCCA (у вигляді вільної кислоти BCCA або її фармацевтично прийнятної солі, сольвату солі BCCA, кристалічної форми гідрату BCCA або кристалічної форми сольвату BCCA), яка відповідає цьому винаходу, для виготовлення лікарського засобу для лікування серцево-судинних захворювань, у тому числі, але без обмеження ними, дисліпідемії та атеросклерозу. Цим винаходом запропонована BCCA (у вигляді вільної кислоти BCCA, сольвату солі BCCA, гідрату BCCA або кристалічної форми сольвату BCCA за цим винаходом) як лікарський засіб. Цим винаходом також запропоновано BCCA (у вигляді вільної кислоти BCCA, сольвату солі BCCA, гідрату BCCA, кристалічної форми сольвату BCCA та кристалічної форми за цим винаходом) для застосування у терапії. Цим винаходом запропоновано BCCA (у вигляді вільної кислоти BCCA, гідрату BCCA, сольвату солі BCCA або кристалічної форми сольвату BCCA за цим винаходом) для застосування у лікуванні серцево-судинних захворювань, в тому числі, але без обмеження ними, дисліпідемії та атеросклерозу. Цим винаходом запропонована сполука, яка має наведену нижче будову: CF3 N N N N N CF3 N 35 40 45 CO2 R , II де R обирають з-поміж таких груп: C1-4-алкіл; C3-6-циклоалкіл; C1-4-алкіл-C3-6-циклоакіл; феніл, а також C1-5-алкілфеніл – для одержання сполуки формули I або її фармацевтично прийнятної солі. За варіантом, якому віддається перевага, перелік груп R охоплює C1-4-алкіл; C14-галогеноалкіл; C3-6-циклоалкіл; C1-4-алкіл-C3-6-циклоалкіл; феніл, а також C 1-5-алкілфеніл. За варіантом, якому віддається особлива перевага, перелік груп R охоплює метил, етил, феніл або бензил. Термін "C1-4-алкіл" або "C1-5-алкіл" у контексті цього опису означає, зокрема, алкільний ланцюг прямої або розгалуженої будови, який містить відповідно 1-4 та 1-5 атомів вуглецю. Термін "галогеноалкіл" стосується алкільної групи, яка містить один або більшу кількість атомів галогену, приєднаних до одного або більшої кількості атомів вуглецю. Як зазначено вище, алкільна група може мати пряму або розгалужену будову ланцюга. До галогенів, яким віддається перевага, належать фтор, хлор та бром. Особлива перевага віддається фтору. У іншому варіанті здійснення винаходу запропонована сполука, яка являє собою: 3 UA 109409 C2 CF3 N N N N N CF3 N H 5 , III або її фармацевтично прийнятна сіль. Цим винаходом запропонований спосіб одержання BCCA. деестерифікацію сполуки, будову якої подано нижче формулою II: CF3 N N N N N Цей спосіб включає CF3 N CO2R 10 15 20 25 , II де R обирають з-поміж таких груп: C1-4-алкіл; C1-4-галогеноалкіл; C3-6-циклоалкіл; C1-4-алкілC3-6-циклоалкіл; феніл, а також C1-5-алкілфеніл - для одержання сполуки формули I або її фармацевтично прийнятної солі, тобто для одержання BCCA, або її фармацевтично прийнятної солі. За варіантом, якому віддається перевага, перелік груп R охоплює C 1-4 алкіл, феніл, а також C1-5-алкілфеніл. За варіантом, якому віддається особлива перевага, перелік груп R охоплює метил, етил, феніл або бензил. Спосіб може також включати відщеплення захисною групи від замісника (карбоксильної групи) біля циклогексильної групи. Приклади різноманітних функціональних груп для захисту органічних кислот, методи одержання захищених кислот, а також методи зняття захисту з кислот можна знайти у "Protecting Groups in Organic Synthesis" ("Захисні групи у органічному синтезі"), 3rd Ed. Greene T.W., Wuts P.G.M., Eds., John Wiley and Sons, New York, 1999. Фахівцю у цій галузі буде зрозуміло, що поряд із власне карбоновою кислотою і захищеною карбоновою кислотою, замість них можна використовувати також і інші функціональні групи, які можна легко перетворити на карбонову кислоту. Подібні функціональні групи, препаративні методики їх одержання і перетворення на карбонові кислоти можна знайти у "Comprehensive Organic Transformations: A Guide to Functional Group Preparations" ("Вичерпний огляд модифікації структури у органічній хімії. Препаративні методи хімії функціональних груп: Довідник") by Larock R.C., Wiley VCH, 1999 та "March's Advanced Organic Chemistry, Reactions, Mechanisms and Structure" ("Поглиблений курс органічної хімії. Реакції, механізми, структура"), Smith M.B., and March J., Wiley-Interscience, 6th Ed. 2007. За ще одним варіантом, цим винаходом запропонований спосіб, який відповідає наведеному вище опису і додатково включає стадію конденсації сполуки за поданою нижче формулою III CF3 N N NN N CF3 30 N H III 4 UA 109409 C2 CO2R OHC 5 10 15 20 25 30 35 зі сполукою , де R відповідає наведеному вище визначенню, для одержання сполуки формули I або її фармацевтично прийнятної солі. Як зазначалося вище, карбонова кислота, складний ефір або захищена кислота, відображені як CO 2R в структурній формулі безпосередньо вище, можуть бути замінені на функціональні групи, які можуть бути перетворені в карбонову кислоту або захищену кислоту. За варіантом, якому віддається перевага, сполука, яку використовують у ролі ефективного інгібітора CETP, має бути хімічно і термічно стійкою, достатньо розчинною для полегшення введення в композицію та полегшення введення до організму, та зберігати достатню активність. Крім того, такі сполуки повинні мати достатньо високу біодосяжність для того, щоб забезпечувати у живих тканинах (in vivo) потрібну кількість сполуки для ефективного лікування. До цього часу невідомо про будь-які дослідження або прогнози стосовно наявності таких властивостей у BCCA. Гідрат BCCA можна зберігати при температурі навколишнього середовища з незначним або дуже малим погіршенням властивостей. За даними калориметрії з диференційним скануванням, згадана кристалічна форма гідрату BCCA має початок десольватації та/або топлення при температурі вище ніж приблизно 50C, що дає змогу застосовувати до згаданої речовини стандартні виробничі процеси, такі як розмелення. Крім того, сама BCCA, сольват із ізопропанолом солі BCCA з трет-бутиламіном, напівсольват із етанолом напівсолі BCCA з третбутиламіном та кристалічна форма гідрату BCCA не гігроскопічні за умови зберігання при температурі навколишнього середовища. До того ж фармацевтично прийнятні солі BCCA, такі як солі кальцію та цинку, практично не виявляють гігроскопічних властивостей в умовах зберігання при температурі навколишнього середовища. BCCA у вигляді вільної кислоти, солі, сольвату або кристалічної форми гідрату можна одержати за наведеними нижче способами, які загалом проілюстровані на схемах 1-4, та більш конкретно викладені у наведених нижче препаративних методиках і Прикладах. У цьому описі вжиті такі наведені нижче скорочення: ACN означає ацетонітрил; AcOH означає оцтову кислоту; (S)-BINAP означає S-(-)-2,2’-біс(дифенілфосфіно)-1,1’-динафтил; CBZCl означає бензилхлороформіат; "спол." означає сполуку; Bn означає бензил; DMF означає диметилформамід; Δ (велика "дельта") означає нагрівання; DI вода означає деіонізовану воду; екв. означає еквівалент; ербумін означає трет-бутиламін (або сіль трет-бутиламонію), 2,2диметилетиламін або 2метил-2-пропіламін; IPA означає ізопропіловий спірт (ізопропанол); M означає моль/л; MTBE означає метил-трет-бутиловий простий ефір; н означає нормальний розчин (моль-екв/л), PPTS означає пірідінію п-толуолсульфонат; TFA означає трифторооцтову кислоту; THF означає тетрагідрофуран; КТ означає кімнатну температуру. Якщо не зазначено протилежне, пойменування і нумерацію сполук, які подано у прикладах, здійснено за допомогою прикладних пакетів CHEMDRAW ULTRA AUTONOM, версія 7.0.1 або Symyx Draw, версія 3.2. 5 UA 109409 C2 5 10 15 20 25 30 35 Препаративні методики Всі реакції у неводному середовищі виконували у атмосфері сухого азоту, якщо не зазначено інше. Також, якщо не зазначено протилежне, використовували реагенти і зневоднені розчинники, які наявні у продажу, у тому вигляді як вони надходять від постачальників, без жодних спроб подальшого очищення або висушування. Видалення розчинників здійснювали за допомогою роторного випаровувача виробництва Buchi із залишковим тиском близько 28 3 мм.рт.ст. (3,73310 Па), який створювали за допомогою вакуум-насосу виробництва KNF із тефлоновим захистом робочих поверхонь. Колонкову флеш-хроматографію виконували на силікагелі "Kieselgel" 60 меш. Спектри протонного ЯМР одержували за допомогою спектрометру ядерного магнітного резонансу Bruker AC, 300 МГц, і одержували дані у вигляді хімічних зсувів -1 ("дельта") у млн відносно внутрішнього стандарту – тетраметилсилану. Мас-спектроскопічний аналіз із іонізацією при атмосферному тиску (API-MS) виконували на одному з масспектрометрів: Finnegan LCQ Duo Ion Trap або PESciex API 150EX, застосовуючи іонізацію електророзпиленням (ESI) або хімічну іонізацію при атмосферному тиску (APCI). РХВЕ (рідинну хроматографію високої ефективності) здійснювали на колонці WAT046980 розміром 3,9150 мм, заповненій носієм Waters Symmetry C18 фракції 5 мкм. Система елюенту передбачала градієнтне елюювання сумішшю складу (0,1 % TFA у H2O)/(0,1 % TFA у CH3CN) у пропорції від 95:5 до 0:100 впродовж 10 хв із подальшим ізократичним елююванням 0,1 %TFA у CH3CN впродовж 15 хв. Витрата елюенту складала 1 мл/хв. Фракції реєстрували в УФ-світлі при довжині хвилі 254 нм або 220 нм. Вибрані фізичні властивості (згідно наведеного вище переліку), подані у препаративних методиках і Прикладах, порівнювали зі зразками відомого складу і будови з метою ідентифікації і оцінювання чистоти. Препаративна методика 1 Метил-2-(трет-бутоксикарбоніламіно)-3,5-диметилбензоат (3) До реакційної колби місткістю 22 л, спорядженої механічним перемішувачем, зворотним холодильником, обігрівальним кожухом, додавальною лійкою місткістю 5 л та насадкою для продування N2, завантажують 2-аміно-3,5-диметилбензолкарбонову кислоту (2) (705 г, 4,27 моль, 1,0 екв, виготовлену у відповідності до методик, викладених у Chemische Berichte 1992, 125(4), 849-855), та гідроксид натрію (8,08 кг, 8,46 моль). Темний розчин, що утворився, при перемішуванні нагрівають до 45C. Завантажують у додавальну лійку розчин ди-третбутилдикарбонату (1,92 кг, 9,08 моль) у 1,4-діоксані (2,75 л, 22,7 моль). Додають розчин ди-третбутилдикарбонату у колбу, і перемішують протягом ночі, підтримуючи температуру реакції, приблизно 45C. Завантажують у додавальну лійку додаткову порцію розчину ди-третбутилдикарбонату (0,961 кг, 4,27 моль) у 1,4–діоксані (500 мл), і при перемішуванні повільно додають вміст лійки у колбу, та підтримують температуру реакції, приблизно 45C. По завершенні перебігу реакції додають краплями диметилсульфат (607,1 мл, 6,40 моль); перемішують протягом ночі, дозволяючи реакційній суміші охолонути до кімнатної температури. Суспензію, що утворилася, фільтрують, збираючи осад, і промивають його на фільтрі водою 6 UA 109409 C2 5 10 15 20 25 30 35 40 45 50 55 (22 л). Висушують у вакуумі (50C), одержуючи сполуку, вказану у заголовку, у вигляді неочищеної речовини (748 г). Препаративна методика 2 Метил-2-(трет-бутоксикарбоніл(4-етокси-4-оксобутил)аміно)-3,5-диметилбензоат (4) До реакційної колби місткістю 22 л, спорядженої механічним перемішувачем, кожухом для обігріву, зворотним холодильником та насадкою для продування N 2, завантажують DMF (10 л), етил-4-бромобутират (1,07 кг, 787,8 мл, 5,32 моль), карбонат цезію (2,92 кг, 22,5 моль) та метил2-(трет-бутоксикарбоніламіно)-3,5-диметилбензоату (1000,0 г, 3,54 моль). Нагрівають суміш, що утворилася, приблизно до 55C, і перемішують протягом 48 год. Охолоджують, осад відфільтровують, і промивають на фільтрі MTBE (24 л). Поєднують фільтрат з MTBE, яким промивали осад, у колбі місткістю 50 л, і охолоджують до температури приблизно 5C або нижче. Додають воду (6 л) аби щоб загасити реакцію. Розділяють шари, що утворилися. Водний шар промивають MTBE (3 л), органічні шари поєднують, і промивають одержаний органічний розчин насиченим розчином хлориду натрію (ропою) (23 л). Висушують органічний розчин Na2SO4, фільтрують, і твердий осад на фільтрі промивають MTBE, одержуючи 1,582 кг сполуки, вказаної у заголовку. Препаративна методика 3 Трет-бутил-4-етил-7,9-диметил-5-оксо-2,3,4,5-тетрагідро-1H-бензо[b]азепін-1,4дикарбоксилат (5A) та трет-бутил-4-метил-7,9-диметил-5-оксо-2,3,4,5-тетрагідро-1Hбензо[b]азепін-1,4-дикарбоксилат (5B) До реакційної колби місткістю 22 л, спорядженої механічним перемішувачем, термопарою, додавальною лійкою місткістю 5 л, насадкою для продування N2 і зануреної у баню для охолодження, завантажують метил-2-(трет-бутоксикарбоніл(4-етокси-4-оксобутил)аміно)-3,5диметилбензоату (700 г, 1,78 моль), розчиненого у THF (3,5 л), і охолоджують до температури приблизно 5C або нижче. Завантажують у додавальну лійку 1 M розчин трет-бутоксиду калію у THF (KOt-Bu: 3,56 моль, 1 M), та додають його краплями до охолодженого розчину субстрату у THF, підтримуючи температуру реакційної суміші, приблизно 5C. По додаванні всього розчину дозволяють реакційній суміші нагрітися до температури навколишнього середовища. По завершенні реакції охолоджують суміш до температури 10C або нижче, і повільно додають 2,5 M розчин HCl до одержання суміші зі значенням pH 3 або нижче. Додають MTBE (4 л), і перемішують, після чого відокремлюють шар органічних продуктів від водного шару. Водний шар екстрагують MTBE (2 л). Поєднують органічні шари, і послідовно промивають двома порціями ропи (23 л). Висушують органічний шар Na2SO4, фільтрують, і промивають твердий осад на фільтрі MTBE. Поєднані фільтрати згущують у вакуумі, одержуючи суміш сполук, вказаних у заголовку, у вигляді помаранчевого рідкого масла (670 г). Препаративна методика 4 7,9-Диметил-3,4-дигідро-1H-бензо[b]азепін-5(2H)-он гідрохлорид (6) До реакційної колби місткістю 5 л, спорядженої механічним перемішувачем, кожухом для обігріву, термопарою, насадкою для продування N2 і тефлоновою перепускною лінією, завантажують суміш трет-бутил-4-етил-7,9-диметил-5-оксо-2,3,4,5-тетрагідро-1H-бензо[b]азепін1,4-дикарбоксилату та трет-бутил-4-метил-7,9-диметил-5-оксо-2,3,4,5-тетрагідро-1Hбензо[b]азепін-1,4-дикарбоксилату (1286 г, 3,56 моль), розчинених в IPA (2 л), і суміш, що утворилася, нагрівають до 50C. До окремої реакційної колби місткістю 12 л, спорядженої механічним перемішувачем, кожухом для обігріву, термопарою, насадкою для продування N 2 із газопромивною системою, додають 5н розчин NaOH (1 л) і H 2O (3 л). Потім додають у колбу місткістю 12 л концентровану HCl (1,87 л, 21,8 моль), і нагрівають до 50C. Переливають вміст колби 5 л до колби 12 л через перепускну лінію при продуванні колби струменем N 2, який витісняє гази з реакційної суміші. По додаванні всіх розчинів реакційну суміш нагрівають до 80C, та продовжують продувати систему N 2. По завершенні реакції дозволяють реакційній суміші охолонути до температури приблизно 20C або нижче. Додають MTBE (4 л), і доводять значення pH до 7, додаючи водний розчин NaOH. Реакційну суміш, що утворилася, переносять до колби місткістю 22 л для розшарування, і розділяють шари. Водний шар екстрагують MTBE (22 л). Органічну промивну рідину поєднують, промивають ропою (2 л), висушують MgSO 4, фільтрують, і промивають осад на фільтрі MTBE. Фільтрат згущують до утворення темного рідкого масла. Залишок розчиняють у IPA (беручи 8-разовий об'єм), і переносять до колби місткістю 12 л, спорядженої механічним перемішувачем, термопарою, додавальною лійкою місткістю 1 л і насадкою для продування N2. У додавальну лійку заливають концентровану HCl (765 мл), і додають краплями до розчину в IPA протягом принаймні 1 год. Суспензію, що утворилася, перемішують протягом 1-2 год., фільтрують, промивають осад на фільтрі 7 UA 109409 C2 5 10 15 20 25 30 35 40 45 50 55 охолодженим IPA (3500 мл), і висушують твердий продукт протягом ночі у сушильній шафі при температурі приблизно 50C, одержуючи 561 г сполуки, вказаної у заголовку. Препаративна методика 5 Бензил-7,9-диметил-5-оксо-2,3,4,5-тетрагідро-1H-бензо[b]азепін-1-карбоксилат (7) До реакційної колби місткістю 22 л, спорядженої механічним перемішувачем, термопарою, додавальною лійкою місткістю 3 л, захисним екраном, насадкою для продування N 2, яка занурена у баню для охолодження, завантажують 7,9-диметил-3,4-дигідро-1H-бензо[b]азепін5(2H)-он гідрохлорид (1000 г, 4,43 моль). Додають 2-метилтетрагідрофуран (6 44 кг, 7,5 л, 74,5 моль), і перемішують не зовсім білу суспензію. Охолоджують до температури 5-15C. У додавальну лійку поміщують розчин Na2CO3 (1,12 кг, 3 моль) у воді (2,5 л, 138,8 моль), і додають цей розчин краплями до реакційної суміші протягом принаймні 25 хв. У додавальну лійку місткістю 2 л поміщують бензилхлороформіат (91,59 кг, 8 86 моль), і додають краплями до реакційної суміші, підтримуючи температуру приблизно 15C або нижче. Переносять суміш, що утворилася, до колби, спорядженої зворотним холодильником, нагрівають до температури 2525C, і перемішують протягом приблизно 50 год. Охолоджують приблизно до 15C, потому додають розчин HCl (5 M), до pH приблизно 5. Розділяють шари, що утворилися. Водний шар екстрагують метилтетрагідрофураном (4 л); органічні шари поєднують, і промивають водою (4 л). Шар органічних продуктів згущують при температурі приблизно 40C. Додають IPA (4 л), і згущують до об'єму 2 л. Залишок переносять до колби місткістю 12 л, спорядженої механічним перемішувачем, термопарою, кожухом для обігріву, зворотним холодильником, додавальною лійкою місткістю 2 л та насадкою для продування N2. Нагрівають вміст колби до 70-80C, і додають гептан (5 л). Повільно охолоджують протягом ночі до КТ, і, якщо осад не з'явився, додають зародковий кристал, щоб стимулювати кристалізацію сполуки, вказаної у заголовку. Охолоджують суспензію, відділяють тверду речовину фільтруванням, промивають на фільтрі холодним гептаном, і висушують у вакуумі при температурі 50C, одержуючи 1,316 г сполуки, вказаної у заголовку. Препаративна методика 6 Суміш (Z)-бензил-7,9-диметил-5-(2-метил-2H-тетразол-5-іліміно)-2,3,4,5-тетрагідро-1Hбензо[b]азепін-1-карбоксилату (8A) та (E)-бензил-7,9-диметил-5-(2-метил-2H-тетразол-5іламіно)-2,3-дигідро-1H-бензо[b]азепін-1-карбоксилату (8B) До реакційної колби місткістю 12 л, спорядженої механічним перемішувачем, кожухом для обігріву, термопарою, зворотним холодильником, насадкою Діна-Старка та насадкою для введення N2, завантажують бензил-7,9-диметил-5-оксо-2,3,4,5-тетрагідро-1H-бензо[b]азепін-1карбоксилат (920 г, 2,84 моль) і толуол (400 мл). У насадку Діна-Старка додають толуол (500 мл), і розпочинають перемішування. Додають 2-метил-5-амінотетразол (563,8 г, 69 моль) і PPTS (364,8 г, 0,5 моль), і нагрівають реакційну суміш до кипіння зі зворотним холодильником. Додають холодну воду (5 л), і виливають реакційну масу в насичений водний розчин NaHCO 4 (850 г), контролюючи pH таким чином, щоб суміш не набувала кислої реакції. Розділяють два шари, і промивають водний шар толуолом (4 л). Органічні шари поєднують, і промивають водою (24 л), висушують над NaSO4, фільтрують, і промивають осад на фільтрі толуолом. Згущують фільтрат у вакуумі при температурі близько 55C, одержуючи 1,186 кг суміші сполук, вказаних у заголовку. Препаративна методика 7 (S)-бензил-7,9-диметил-5-(2-метил-2H-тетразол-5-іламіно)-2,3,4,5-тетрагідро-1Hбензо[b]азепін-1-карбоксилат (9) До автоклаву вносять суміш (Z)-бензил-7,9-диметил-5-(2-метил-2H-тетразол-5-іліміно)2,3,4,5-тетрагідро-1H-бензо[b]азепін-1-карбоксилату та (E)-бензил-7,9-диметил-5-(2-метил-2Hтетразол-5-іламіно)-2,3-дигідро-1H-бензо[b]азепін-1-карбоксилату (4,04 г, 10 ммоль), S-(-)-2,2’біс(дифенілфосфіно)-1,1’-бінафтилу((S)-BINAP; 60 мг, 96,3 мкмоль), KI (415 мг, 24 ммоль, причому додавання KI не є обов'язковим), а також дихлоро-біс((1,2,5,6 ета)-1,5циклооктадієн)діірідій (Ir2Cl2(COD)2: 927 мг, 40,2 мкмоль). Витісняють повітря з автоклаву струменем азоту. Підтримуючи всередині атмосферу азоту, додають знекиснений толуол (50 мл, 472,8 ммоль), і герметизують автоклав. Нагрівають до 100C під тиском H2 500 6 фунт/кв.дюйм (3,4510 Па) протягом 66 год. Охолоджують реакційну суміш до КТ, і стравлюють тиск. Відфільтровують осад, і збирають органічний розчин. Промивають фільтрат водою (225 мл), висушують Na2SO4, і фільтрують. Збирають фільтрат, і згущують у вакуумі, одержуючи сполуку, вказану у заголовку (3,99 г, чистота (вміст основної речовини (ОР)) 88,7 % {енантіомерний надлишок за даними РХВЕ/HPLC}). Препаративна методика 8 8 UA 109409 C2 5 10 15 20 25 30 35 40 45 (S)-бензил-5-((3,5-біс(трифторометил)бензил)(2-метил-2H-тетразол-5-іл)аміно)-7,9-диметил2,3,4,5-тетрагідро-1H-бензо[b]азепін-1-карбоксилат (10) У скляну посудину додають (S)-бензил-7,9-диметил-5-(2-метил-2H-тетразол-5-іламіно)2,3,4,5-тетрагідро-1H-бензо[b]азепін-1-карбоксилат (100 мг, 246 мкмоль), NaH (23 мг, 60 % суспензія у мінеральній олії; 575,1 мкмоль) та THF (9,2 мл, 24,6 ммоль). (Як альтернативний варіант, замість NaH та THF можна застосувати розчин трет-бутоксиду калію у DMF). Перемішують реакційну суміш при КТ протягом 10 хв. Додають краплями протягом 30 хв 3,5біс(трифторометил)бензилбромід (173,8 мг, 566,2 мкмоль). Зачекавши приблизно 19 год., додають NaH (10 мг, 60 % суспензія у мінеральній олії), і перемішують ще протягом 1 год. Для розшарування додають EtOAc (50 мл) та ропу (225 мл), і збовтують. Збирають органічні шари, і висушують Na2SO4. Розчин фільтрують, і згущують фільтрат, одержуючи рідке масло. Для розшарування продуктів додають ACN (50 мл) та гептан (225 мл), і збовтують. Збирають шар CAN, висущують, і згущують, одержуючи сполуку, вказану у заголовку (189 мг), у вигляді рідкого масла. Препаративна методика 9 (S)-N-(3,5-біс(трифторометил)бензил)-7,9-диметил-N-(2-метил-2H-тетразол-5-іл)-2,3,4,5тетрагідро-1H-бензо[b]азепін-5-амін (11) До реакційної колби місткістю 1 л вносять форміат амонію (39,0 г, 618,0 ммоль) та 10 % Pd/C (3,91 г), а також (S)-бензил-5-((3,5-біс(трифторометил)бензил)(2-метил-2H-тетразол-5-іл)аміно)7,9-диметил-2,3,4,5-тетрагідро-1H-бензо[b]азепін-1-карбоксилат (39,1 г, 61,8 ммоль), розчиненого у MeOH (391 мл, 966 моль). Суспензію, що утворилася, перемішують при КТ, контролюючи перебіг реакції за допомогою РХВЕ. По завершенні реакції масу фільтрують, збираючи осад, і промивають його на фільтрі MeOH (100 мл). Поєднують фільтрат і органічні промивальні розчини, і висушують Na2SO4. Потому фільтрують, і згущують фільтрат до сухого залишку. Залишок розчиняють у MeOH (92 мл), і вносять зародкові кристали сполуки, вказаної у заголовку. Охолоджують, і залишають на ніч, одержуючи 14,03 г (45,5 % від теорії) сполуки, вказаної у заголовку, із чистотою (вмістом ОР) 99,92 % (ЕН {енантіомерний надлишок} за даними РХВЕ). Препаративна методика 10 (Транс)-метил-4-(((S)-5-((3,5-біс(трифторометил)бензил)(2-метил-2H-тетразол-5-іл)аміно)7,9-диметил-2,3,4,5-тетрагідро-1H-бензо[b]азепін-1-іл)метил)циклогексанкарбоксилат (12) До реакційної колби, спорядженої механічним перемішувачем, термопарою або термометром і насадкою для введення N2, завантажують (S)-N-(3,5-біс(трифторометил)бензил)7,9-диметил-N-(2-метил-2H-тетразол-5-іл)-2,3,4,5-тетрагідро-1H-бензо[b]азепін-5-амін (5 г, 10,03 ммоль), а також триацетоксиборогідрид натрію (3,19 г, 15,05 ммоль) та ацетонітрил (40 мл). Колбу з суспензією, що утворилася, занурюють у баню з льодом для охолодження до температури припблизно 5C або нижче, і потім додають (транс)-метил-4формілциклогексанкарбоксилат (2,99 г, 17,57 ммоль; виготовлений по суті за методиками, викладеними у: Houpis I.N. et al, Tetrahedron Let. 1993, 34(16), 2593-2596, та JP49048639), розчинений у THF (10 мл); останній розчин додають за допомогою шприца, підтримуючи температуру реакційної суміші приблизно 5C або нижче. Потім дозволяють реакційній масі нагрітися до КТ, і перемішують протягом ночі. Додають NH 4Cl у вигляді насиченого 50 % водного розчину (25 мл), збовтують, і відділяють водний шар від органічного шару. pH органічного шару має становити приблизно 5,5. Підігрівають органічний розчин приблизно до 45C, і додають воду (16 мл). Вносять зародковий кристал сполуки, вказаної у заголовку, і охолоджують приблизно до 35C. Одержану тверду речовину відділяють фільтрацією, і промивають ACN. Висушують, одержуючи 5,80 г сполуки, вказаної у заголовку. Схема 3. Альтернативний спосіб синтезу BCCA 9 UA 109409 C2 5 10 15 20 Препаративна методика 12 Метил-7,9-диметил-5-оксо-2,3,4,5-тетрагідро-1H-1-бензоазепін-1-карбоксилат Стадія 1. Викачують повітря з реактора місткістю 3000 л, вкритого зсередини склом, до залишкового тиску -0,08 МПа або менше, потім заповнюють N2 до нормального атмосферного тиску, і так повторюють тричі. В атмосфері N2 при перемішуванні завантажують до реактора 2,4диметиланілін (300,0 кг) і триетиламін (873,0 кг). Підігрівають суміш до температури 70-75C, після чого додають етил-4-бромобутират (604,0 кг) зі швидкістю 20-25 кг/год., використовуючи як додатковий проміжний резервуар бак місткістю 500 л, підтримуючи температуру суміші 70-75C. Перемішують реакційну суміш при 70-75C протягом 2 год., після чого розпочинають контроль ступеня перебігу реакції за допомогою газової хроматографії (ГХ). Реакцію вважають завершеною, якщо вміст 2,4-диметиланіліну у двох послідовно забраних пробах не перевищує 3 %, і при цьому вміст побічного продукту (етил-4-((2,4-диметилфеніл)(3(пропіонілокси)пропіл)аміно)-бутаноату) не перевищує 10 %. П'ятдесят шість годин по тому вміст побічного продукту вже є меншим за 10 %, але вміст 2,4-диметиланіліну все ще залишається вищим за 3 %, і до реакційної суміші додають додаткову порцію етил-4-бромобутирату (6,0 кг); втім, ще 17,5 год. по тому вміст 2,4диметиланіліну все ще залишається вищим за 3 %, однак реакцію зупиняють. Охолоджують реакційну суміш до 15-25C, і перекачують у два реактори місткістю по 5000 л, вкриті зсередини склом. До кожного реактору додають воду (1200,0 кг) і толуол (1044,0 кг). Перемішують суміш протягом однієї години, і витримують ще годину, перш ніж розшаровувати продукти. Поєднують органічні фази, відібрані з обох реакторів, і двічі промивають їх водою (21200,0 кг). Забирають пробу органічної фази, щоб пересвідчитись, що вміст триетиламіну не 10 UA 109409 C2 5 10 15 20 25 30 35 40 45 50 55 перевищує 23 %. Згущують органічну фазу при 50-60C під зниженим тиском (залишковий тиск -0,08 МПа або менше) доти, доки летка фракція вже не відходитиме і ваговий відсоток триетиламіну знизиться до менш ніж 0,1 %, а вміст води за Фішером (KF) не перевищуватиме 1 %. Охолоджують суміш до 20-30C, і продукт, що утворився (етил-4-[(2,4-диметилфеніл)аміно]бутаноат), безпосередньо вводять у стадію 2. Обладнання для газової хроматографії (ГХ). Колонка: HP-5, розміри 30 м (довжина)0,32 мм (внутрішній діаметр, ВД)0,25 мкм (товщина плівки), або еквівалентна колонка; газ-носій: гелій; об'ємна витрата 1,90 мл/хв; тривалість циклу: 22,5 хв; Програма: початкова температура 50C (при вмиканні); час початку відліку 2,00 хв; Градіенти: №1 – Швидкість набору температури 20; кінцева температура 260C; час кінця відліку 10,00; градієнт №2: 0,0 (при вимиканні); температура на вході 250C; температура реєстрації 300C. Час утримання: 1) (13,56 хв) етил-4-[(2,4-диметилфеніл)аміно]бутаноат; 2) (17,40 хв) етил-4((2,4-диметилфеніл)(3-(пропіонілокси)пропіл) аміно)бутаноат; 3) (8,38 хв) 2,4-диметиланілін. Стадія 2. До реактора місткістю 2000 л, вкритого зсередини склом, завантажують толуол (742,0 кг) та етил-4-[(2,4-диметилфеніл)аміно]бутаноат (171,0 кг). Перемішуючи, додають порціями карбонат натрію (77,0 кг). Встановивши і підтримуючи температуру 20-25C, додають метилхлороформіат (96,2 кг) зі швидкістю 18 кг/год. Перемішують реакційну суміш при 20-25C принаймні одну годину, і контролюють ступінь перебігу реакції за допомогою ГХ. Реакцію вважають завершеною, якщо вміст етил-4-[(2,4-диметилфеніл)аміно]бутаноату менше ніж 1 %. Перекачують суміш до реактора місткістю 5000 л, вкритого зсередини склом, і промивають реактор місткістю 2000 л толуолом (75 кг). Додають розчин, що містить NaOH (87,2 кг), метанол (934,0 кг) і воду (1482,0 кг), зі швидкістю 360-400 кг/год., підтримуючи температуру 20-25C. Після цього нагрівають суміш до 55-65C, і перемішують, підтримуючи температуру 55-60C. Годину по тому здійснюють контроль проби за допомогою РХВЕ для визначення рівня вмісту етил-4-[(2,4-диметилфеніл)аміно]бутаноату. Охолоджують суміш до 20-30C, витримують годину, і розділяють шари. Водну фазу згущують при 40-50C під зниженим тиском (залишковий тиск 0,09 МПа або менше) до припинення відходження фракції метанолу (загалом 929 кг). Охолоджують суміш до 15-25C, додають воду (256,5 кг), і перемішують протягом 0,5 год., після чого екстрагують дихлорометаном (2342,0 кг). Охолоджують до 0-5C і, підтримуючи температуру на цьому рівні, додають концентровану HCl (269,0 кг) зі швидкістю 40-50 кг/год. до встановлення pH 1-2. Нагрівають суміш до 15-25C, і перемішують протягом 1 год., підтримуючи температуру на цьому рівні. Розділяють шари, екстрагують водну фазу дихлорометаном (2684,0 кг), і поєднують органічні шари. Органічну фазу двічі промивають 0,5 % розчином HCl (2342,0 кг) і згодом конц. HCl (23,4 кг). Органічну фазу згущують зі зниженим тиском (залишковий тиск -0,08 МПа або менше; 40-50C) доти, доки летка фракція вже не відходитиме. До залишку (4-[(2,4-диметилфеніл)-метоксикарбоніламіно]бутанової кислоти) (Препаративна методика 11) додають дихлорометан, і безпосередньо вводять продукт у подальшу стадію. Вихід 190,0 кг (407,4 кг розчину), або 98,5 % від теорії; чистота (вміст ОР) 97,8 %. РХВЕ. Колонка: Waters XTerra MS C18; розмір 4,6150 мм, фракція 3,5 мкм; реєстрація 230 нм; об'ємна витрата елюенту 1,0 мл/хв; темп. 25C; ізократична рухома фаза: A – ACN; B – H2O+0,1 % H3PO4 (мас.). Час утримання: (13,86 хв) 4-[(2,4-диметилфеніл)метоксикарбоніламіно]бутанова кислота. Стадія 3. Викачують повітря з реактора місткістю 3000 л, вкритого зсередини склом, до залишкового тиску -0,08 МПа або менше, потому заповнюють N2 до нормального атмосферного тиску, і так повторюють тричі. Завантажують всередину дихлорометан (1900,0 кг), 4-[(2,4диметилфеніл)-метоксикарбоніламіно]бутанову кислоту (190,0 кг) та DMF (11,4 кг), і все перемішують. Охолоджують суміш до температури від 0C до -5C і, підтримуючи цю температуру, додають тіонілхлорид (85,3 кг) зі швидкістю 18 кг/год. Реакційну суміш перемішують при температурі від 0C до -5 C. Годину по тому контролюють ступінь перебігу реакції за допомогою РХВЕ, щоб перевірити, що вміст 4-[(2,4диметилфеніл)метоксикарбоніламіно]бутанової кислоти не перевищує 1 %. Протягом відбору проб пробу змішують з метанолом, і піддають аналізу методом РХВЕ. Згущують реакційну суміш при температурі 40-45C при нормальному атмосферному тиску доти, доки летка фракція вже не відходитиме, і охолоджують до 15-25C. Після цього згущують залишок при температурі 40-45C зі зниженим тиском (залишковий тиск -0,08 МПа або менше) до припинення відходження леткої фракції. Залишок розводять дихлорометаном (1031,0 кг). Додають дрібними порціями розчин безводного гексагідрату хлориду алюмінію (287,2 кг) у дихлорометані (1030,0 кг) при температурі 30-35C. Перемішують при 35-45C ще протягом 2 год., після чого 11 UA 109409 C2 5 10 15 20 25 30 35 40 45 50 55 розпочинають контроль ступеня перебігу реакції за допомогою РХВЕ доти, доки вміст метил7,9-диметил-5-оксо-2,3,4,5-тетрагідро-1H-1-бензоазепін-1-карбоксилату перевищить 80 %. (Забирають пробу, змішують її з метанолом і піддають аналізу методом РХВЕ). Реакцію гасять сумішшю води (1140,0 кг) і льоду (570,0 кг), і перемішують протягом 1 год., підтримуючи температуру 0-10C. Підігрівають суміш до 15-25C, перемішують 0,5 год., витримують ще 0,5 год., і розділяють шари. Органічну фазу промивають водою (2814,0 кг). До органічної фази додають силікагель (380,0 кг), і перемішують протягом 1 год. Суміш фільтрують, шар осаду на фільтрі промивають дихлорометаном (339,0 кг), і поєднують фільтрати. Згущують одержаний фільтрат при температурі 40-45C під зниженим тиском (залишковий тиск -0,08 МПа або менше) до одержання залишку об'ємом 150-200 л. До залишку додають гептан (190,0 кг), охолоджують суміш до 15-20C проточною водою, і потім охолоджують ропою до температури 0-5C. Для кристалізації перемішують массу при цій температурі. Суспензію фільтрують; твердий осад з фільтру висушують при 35-40C у сушильній камері, одержуючи 80,9 кг майже білої з сірим відтінком речовини. Чистота (вміст ОР за даними РХВЕ) 97,9 %. Зберігають у сухому місці, захищеному від впливу повітря, в атмосфері азоту. Порядок роботи при РХВЕ: той самий, що для стадії 2. Час утримання: 14,71 хв (метил 7,9диметил-5-оксо-2,3,4,5-тетрагідро-1H-1-бензоазепін-1-карбоксилат). Препаративна методика 13 Метил-5,5-диметокси-7,9-диметил-2,3,4,5-тетрагідро-1H-1-бензоазепін-1-карбоксилат Стадія 4. До розчину метил-7,9-диметил-5-оксо-2,3,4,5-тетрагідро-1H-1-бензоазепін-1карбоксилату (1000 г; 1,00 екв.; 4,04 моль) у метанолі (2,50 л) і триметоксиметану (965,55 г; 995,42 мл; 9,10 моль), у реакційній колбі, спорядженій механічним перемішувачем, при температурі навколишнього середовища, у атмосфері азоту додають катіоніт Amberlyst™ 15 (100 г). Нагрівають реакційну суміш до 50C, і підтримують цю температуру протягом 1 год. За годину реакція завершується. Реакційну масу охолоджують до температури навколишнього середовища, відфільтровують бісер катіоніту Amberlyst, і промивають метанолом (500 мл). За допомогою перепускної трубки додають розчин до 0,1 M розчину KOH (1 л) при механічному перемішуванні, із подальшим розведенням H2O (1500 мл). Перемішують суспензію протягом 20 хв, і фільтрують крізь поліпропіленову тканину на керамічному фільтрі діаметром 32 см. Шар осаду на фільтрі промивають водою (41 л), і віджимають на фільтрі до сухого стану. Осад висушують у вакуумній сушильній шафі протягом ночі при 60C. Потім подрібнюють грудки, і продовжують сушити при 60C протягом ще однієї ночі. Вихід неочищеного продукту після висушування 1235 г. Цей продукт розчиняють у 5 об'ємах гептану (6 л), нагрівають до 70C, і перемішують протягом 15 хв при 70C. Охолоджують розчин до 55C; при цій температурі вносять зародкові кристали. Продовжують повільне охолодження; кристалізація продукту розпочинається при приблизно 45C. Продовжують повільне охолодження до кімнатної температури, потім залишають суспензію на ніч, не припиняючи перемішування. Суспензію продукту фільтрують крізь поліпропіленову тканину. Шар осаду на фільтрі промивають гептаном (2500 мл), і віджимають на фільтрі до сухого стану, після чого витримують у вакуумній сушильній шафі при 45C до повного висушування (~4 діб). Вихід 766 г, чистота (вміст ОР за даними РХВЕ) 99,9 %. РХВЕ. Колонка: Zorbax Bonus-RP, розмір 504,6 мм, фракція 1,8 мкм; об'ємна витрата елюенту 2 мл/хв, 40C; градієнт: 10-30 % ACN впродовж 12 хв, до 95 % при 14 хв, витримка 2 хв, повторне врівноваження системи елюенту – 10 ммоль/л розчин ацетату NH4. Час утримання: 13,77 хв. Препаративна методика 14 Метил-(5S)-7,9-диметил-5-[(2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-1H-1бензоазепін-1-карбоксилат Стадія 5. Забезпечують сухість реактора для гідрогенізації сушкою сухим N 2 впродовж 1-2 год. До реактора завантажують 2-метил-2H-тетразол-5-амін (52,0 г), метил-5,5-диметокси-7,9диметил-2,3,4,5-тетрагідро-1H-1-бензоазепін-1-карбоксилат (140,0 г), Ir2Cl2(COD)2 (0,080 г), TBAI (1,76 г), (1S)-(+)-10-камфорсульфонову кислоту (2,2 г), а також (S)-дифторфос (difluorphos) 4 (0,163 г). Подають до реактора азот під тиском 5 фунт/кв.дюйм (3,4510 Па). Протягом 75 хв додають 600 мл толуолу крізь систему введення азоту, розпорскуючи його струменем N 2. Двічі 5 продувають реактор азотом під тиском 20 фунт/кв.дюйм (1,3810 Па), не дозволяючи тиску 4 впасти нижче за 5 фунт/кв.дюйм (3,4510 Па). Подають до реактора водень під тиском 500 6 фунт/кв.дюйм (3,4510 Па), і повільно нагрівають до 115C. Витримують при цій температурі протягом ночі. Охолоджують до 50C, і забирають пробу на аналіз РХВЕ. Для виконання аналізу 12 UA 109409 C2 5 10 15 20 25 30 35 40 45 50 55 РВХЕ у хоральному варіанті пробу розводять толуолом, промивають розчином бікарбонату натрію, висушують над Na2SO4, і розводять гептаном з домішкою етанолу. Виливають толуольний розчин у ділильну лійку, і додають 140 мл етилацетату, маючи на меті кількісне перенесення реакційної суміші у ділильну лійку, і утримання речовин у розчиненому стані в протягом всіх маніпуляцій. Промивають розчин 420 мл 1 M розчину NaOH (шар органічних продуктів при цьому виглядає каламутним, натомість водний шар прозорий). Розділяють шари, і промивають органічний шар водою (420 мл). Відгоняють з органічного розчину при атмосферному тиску до 1,5 об'ємів толуолу (при загальній кількості кубового розчину у 2,5 об'єми). Охолоджують розчин до 60C, і повільно протягом 3 хв додають 700 мл гептану (~5 об'ємів), підтримуючи температуру 60C; прозорий розчин, що утворився, гріють при 60C протягом ночі при механічному перемішуванні (150 об/хв). Вже за 15 хв утворюється суспензія. Зранку суспензію охолоджують, фільтрують, збирають осад, і висушують у вакуумній сушильній шафі при 60C протягом 3 год. Вихід 126,97 г; чистота (вміст ОР за даними РХВЕ) 99,4 %; ЕН (за даними хіральної РХВЕ) 94,6 %. РХВЕ. Колонка: Zorbax Bonus-RP, розмір 504,6 мм, фракція 1,8 мкм; об'ємна витрата елюенту 2 мл/хв, 40C; градієнт: 10-30 % ACN впродовж 12 хв, до 95 % при 14 хв, витримка 2 хв, повторне врівноваження системи елюенту – 10 ммоль/л розчин ацетату NH4. Час утримання: 11,36 хв. Хіральна РХВЕ. Колонка: Chiralpak IA, розмір 2504,6 мм, об'ємна витрата елюенту 2 мл/хв, 40C; градієнт: 5 % IPA впродовж 11 хв, до 50 % IPA при 12 хв, витримка до 15 хв, повернення до 5 % IPA при 15,1 хв, витримка протягом 20 хв. Час утримання: 11,48 хв. Препаративна методика 15 (5S)-7,9-диметил-N-(2-метил-тетразол-5-іл)-2,3,4,5-тетрагідро-1H-1-бензоазепін-5-амін Стадія 6. До тефлонової колби місткістю 250 мл при механічному перемішуванні вносять метил-(5S)-7,9-диметил-5-[(2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-1H-1бензоазепін-1-карбоксилат (20,1 г), NaOH (12,10 г) та етанол (80 мл). Суміш у колбі барботують азотом протягом 10 хвилин, нагрівають до кипіння (85C), і кип'ятять близько 5,5 год. Охолоджують до кімнатної температури у бані з холодною водою. Повільно при кімнатній температурі додають розведену водою оцтову кислоту (17,5 мл кислоти/53 мл води), і переносять до колби місткістю 500 мл приблизно посередині додавання кислоти (все додавання потребує ~30 хв). Вносять зародок (5S)-7,9-диметил-N-(2-метил-тетразол-5-іл)-2,3,4,5тетрагідро-1H-1-бензоазепін-5-аміну (приблизно 5 мг). Нагрівають до 50C (поступово підвищуючи температуру протягом приблизно 15 хвилин). Додають 54 мл води протягом 30 хвилин. Наступного дня охолоджують у водяній бані, фільтрують, і промивають водним розчином метанолу (суміш метанол:вода 1:1; 230 мл). Вологий шар осаду висушують у вакуумі при 60 °C, одержуючи 13,99 г (5S)-7,9-диметил-N-(2-метил-тетразол-5-іл)-2,3,4,5-тетрагідро-1H1-бензоазепін-5-аміну. Аналіз РХВЕ: вміст ОР 99,4 %, час утримання 4,84 хв. Хіральна РХВЕ: енантіомерна чистота 98,5 %. РХВЕ. Колонка: Zorbax SB-C8, розмір 754,6 мм, фракція 3,5 мкм, об'ємна витрата елюенту 2 мл/хв, 40 °C; реєстрація при 225 нм; градієнт: від 5 % ацетонітрилу (ACN) впродовж 2 хв, до 95 % ACN за 10 хв, витримка 1 хв. Хіральна РХВЕ. Колонка: Chiralpak AD-H, розмір 1504,6 мм, фракція 5 мкм, об'ємна витрата елюенту 1 мл/хв, 30 °C; ізократичне елюювання сумішшю 50 % етанолу в гептані. Препаративна методика 16 (5S)-N-[3,5-біс(трифторометил)бензил]-7,9-диметил-N-(2-метил-2H-тетразол-5-іл)-2,3,4,5тетрагідро-1H-1-бензоазепін-5-амін Стадія 7. Всі розчини, що беруть участь у цій стадії, перш ніж додати до реакційної суміші знекиснюють введенням під поверхню кожного розчину N2. До колби місткістю 250 мл, спорядженої насадкою для введення азоту, вносять (5S)-7,9-диметил-N-(2-метил-тетразол-5іл)-2,3,4,5-тетрагідро-1H-1-бензоазепін-5-амін (5,00 г, 18,36 ммоль) і толуол (15,00 мл). Протягом 30 хвилин додають краплями 0,5 M толуоловий розчин калію гексаметилдисилазіду (38,55 мл, 19,28 ммоль). При цьому температура підвищується до 21,5 °C. Перемішують реакційну массу протягом 30 хвилин. Протягом ще 30 хвилин додають 1 M толуоловий розчин 1-(хлорометил)-3,5-біс(трифторометил)бензолу (25,7 мл, 25,71 ммоль). При цьому температура підвищується до 25,5 C. Перемішують реакційну массу при кімнатній температурі протягом 16 год. Реакційну суміш промивають водою (220 мл). Водні шари поєднують, і екстрагують толуолом (125 мл). Поєднують толуолові шари, згущують до сухості, і рекристалізують залишок із 92 мл 60 % водного розчину 1-пропанолу. Кристалічний продукт, що утворився, перемішують протягом 2 год. при 0C, фільтрують, і промивають на фільтрі 10 мл 50 % водного 13 UA 109409 C2 5 10 15 20 25 30 35 40 45 50 55 розчину 1-пропанолу. Одержаний продукт висушують у вакуумі при 45 °C. Вихід 7,735 г; чистота (вміст ОР за даними РХВЕ) 98,3 %; час утримання: 10,62 хв. РХВЕ за градієнтною схемою. Колонка: Zorbax Bonus RP, розмір 4,6150 см, фракція 5 мкм, об'ємна витрата елюенту 2 мл/хв; реєстрація при 225 нм; темп. колонки 40C; розчинник A – вода; розчинник B – ACN; градієнт: старт (0 хв) – 85 % A, 15 % B; 12 хв – 10 % A, 90 % B; 13 хв – 10 % A, 90 % B; 13,5 хв – 85 % A, 15 % B. Препаративна методика 17 Метил-транс-4-{[(5S)-5-{[3,5-біс(трифторометил)бензил](2-метил-2H-тетразол-5-іл)аміно}7,9-диметил-2,3,4,5-тетрагідро-1H-1-бензоазепін-1-іл]метил}циклогексанкарбоксилат Стадія 12. Суспензію (5S)-N-[3,5-біс(трифторометил)бензил]-7,9-диметил-N-(2-метил-2Hтетразол-5-іл)-2,3,4,5-тетрагідро-1H-1-бензоазепін-5-аміну (3,40 г, 6,82 ммоль), натрію триацетоксиборогідрату (3,01 г, 13,64 ммоль) у ACN (28 мл) охолоджують до температури від 10C до -12C у бані з суміші льоду і ацетону, і протягом 30 хв додають розчин (транс)-4формілциклогексанкарбоксилату (2,03 г, 11,93 ммоль) у толуолі (18,5 мл), використовуючи для цього шприц-насос (0,66 мл/хв). Перемішування реакційної маси на бані з сумішшю льоду і ацетону продовжують протягом 2 год. До реакційної суміші додають 44 мл 10 % (мас.) водного розчину NH4Cl, і перемішують 30 хв при кімнатній температурі. Зупиняють перемішувач, при цьому утворюються два шари. Їх розділяють, і згущують органічний шар до певного об'єму. До залишку додають 24 мл етанолу, і згущують до сухого стану (або до певного об'єму). Додають 24 мл етанолу, 2 мл води, і нагрівають до 60 °C (суспензія при цьому ще не розчиняється). Додають по краплинах 2 мл води, дозволяють суспензії охолонуть до кімнатної температури. Перемішують впродовж ночі при кімнатній температурі, охолоджують суспензію до -10 °C протягом 0,5 год., і фільтрують. Осад на фільтрі промивають 3 мл водного розчину етанолу (EtOH:вода = 4:1) при температурі -10C. Твердий продукт висушують протягом ночі у вакуумній сушильній шафі при 50C; одержують 4,24 г метил-транс-4-{[(5S)-5-{[3,5біс(трифторометил)бензил](2-метил-2H-тетразол-5-іл)аміно}-7,9-диметил-2,3,4,5-тетрагідро-1H1-бензоазепін-1-іл]метил}циклогексанкарбоксилату у вигляді безбарвної твердої речовини. Чистота (вміст ОР за даними РХВЕ) 99,75 %. Аналіз РХВЕ. Колонка: Zorbax Bonus RP, розмір 150 мм4,6 мм, фракція 3,5 мкм; 30C; УФ реєстрація при 260 нм; об'ємна витрата елюенту 2,0 мл/хв, градієнт: A – 0,05 % TFA у H2O; B – 0,05 % TFA у ACN; старт (0 хв) 95 % A до 0 % A (30 хв); 95 % A (30,5 хв – 35 хв). Метил-транс-4{[(5S)-5-{[3,5-біс(трифторометил)бензил](2-метил-2H-тетразол-5-іл)аміно}-7,9-диметил-2,3,4,5тетрагідро-1H-1-бензоазепін-1-іл]метил}циклогексанкарбоксилат виходить із часом утримування 23,33 хв; цис-ізомер – із часом утримування 23,05 хв. Препаративна методика 18 Адукт бісульфіту натрію і (транс)-метил-4-формілциклогексанкарбоксилату Стадія 8. Круглодонну колбу місткістю 12 л із трьома горловинами, занурену у охолоджувальну ванну, споряджають механічним перемішувачем, термопарою з цифровим індікатором, насадкою для введення азоту і хлоркальцієвою трубкою. До колби завантажують (транс)-4-метоксикарбонілциклогексанкарбонову кислоту (450 г). Слідом завантажують до колби дихлорометан (2,25 л), і перемішують в атмосфері азоту. З додавальної лійки у колбу додають оксалілхлорид (364 г), розведений CH2Cl2 (100 мл), при температурі навколишнього середовища. Реакційну масу перемішують протягом 10 хвилин при кімнатній температурі. При тій самій температурі додають у колбу з додавальної лійки каталітичну кількість DMF (1,82 г), розчинену у CH2Cl2 (10 мл). Перемішують реакційну масу при температурі 20C або нижче протягом 2 год. Перебіг реакції контролюють за допомогою ГХ (колонка: DBI, 30 м0,25 мм, плівка 0,5 мм); пробу забирають з перемішуваного розчину при температурі 20C або нижче. Час утримання (Retention time, Rt) (транс)-4-хлорокарбонілциклогексанкарбоксилату = 7,3 хв; Rt (транс)-4-метоксикарбонілциклогексанкарбонової кислоти = 7,75 хв. Реакцію вважають завершеною, коли у реакційній суміші залишиться менш ніж 3,0 % вихідного реагенту – (транс)4-метоксикарбонілциклогексанкарбонової кислоти. Стадія 9. Згущують реакційну суміш під зниженим тиском при температурі 35C або нижче. Поряд із леткою фракцією дистилляту збирають надлишок оксалілхлориду; щоб уникнути потрапляння кислотних випарів у вакуумну систему, застосовують уловлювач із їдким лугом. До залишку додають THF (2900 мл), і випаровують разом. Залишок розводять THF (4,5 л), і додають 2,6-лутидин (321 г). Розчин переносять у автоклав для гідрогенізації. До реакційної суміші вносять 5 % Pd на активованому вугіллі (45 г) у вигляді суспензії у THF (500 мл). Подають 5 5 до реактора азот під тиском 20-30 фунт/кв.дюйм (1,3810 -2,0710 Па), повторюючи операцію 5 5 двічі або тричі. Подають до реактора водень під тиском 20-30 фунт/кв.дюйм (1,3810 -2,0710 14 UA 109409 C2 5 10 15 20 25 30 35 40 45 50 55 Па), повторюючи операцію двічі або тричі. Перемішують реакційну масу у атмосфері водню (під 5 5 тиском 50-60 фунт/кв.дюйм (3,4510 -4,1410 Па)) при температурі 30-35 °C протягом 15 год. Коли 15 год. спливуть, випускають водень назовні (у місцеву вентиляційну систему), і подають 5 5 до реактора азот під тиском 20-30 фунт/кв.дюйм (1,3810 -2,0710 Па), повторюючи операцію двічі або тричі. Перебіг реакції контролюють за допомогою ГХ Rt (транс)-метил-4формілциклогексанкарбоксилату = 6,46 хв; Rt (транс)-4-хлорокарбонілциклогексанкарбоксилату = 7,3 хв. Реакцію вважають завершеною, коли у реакційній суміші залишиться менш ніж 1,0 % (транс)-4-хлорокарбонілциклогексанкарбоксилату. Реакційну суміш фільтрують крізь шар целіту у атмосфері азоту. Згущують, випаровуючи більшу частину розчинника (THF) зі зниженим тиском при температурі 35C або нижче. Залишок розводять MTBE (1,8 л), і переносять у ділильну лійку. Промивають органічний розчин водою (2,25 л), і розділяють шари. Водну фазу екстрагують MTBE (21,8 л), і всі органічні фази поєднують. Промивають 0,5н водним розчином соляної кислоти (12,25 л). Промивають органічну фазу насиченим водним розчином бікарбонату натрію (12,5 л). Промивають органічну фазу ропою (12,5 л). Після цього висушують органічну фазу сульфатом магнію, і фільтрують суміш крізь фільтр із скловолоконною набивкою. Фільтрат згущують зі зниженим тиском при температурі бані 35C або нижче. Одержують цільову речовину у вигляді безбарвного рідкого масла, яке використовують надалі без очищення. Стадія 10. До скляної посудини, що містить 0,49 г бісульфіту натрію, додають 1 мл води. Ставлять посудину всередину ультразвукової ванни для розчинення бісульфіту натрію. Додають у посудину 5 мл THF; утворюється система з двох рідких фаз, без осаду. Цю двофазну систему з THF та водного розчину бісульфіту натрію переносять у колбу місткістю 50 мл, що містить (транс)-4-формілциклогексанкарбоксилат (1 г, 5,88 ммоль), із стрижнем для магнітного перемішувача всередині. (Примітка: (транс)-4-формілциклогексанкарбоксилат містить лише близько 80 % основної речовини – саме тому використовують лише 0,8 еквівалентів NaHSO 3). Розводять реакційну суміш додатково 5 мл THF, і не пізніше як за хвилину утворюється дуже густа кристалічна маса. Кристалічну масу, що утворилася, нагрівають до кипіння. Розводять суміш THF порціями 35 мл. Кристали за структурою дуже пухкі. Суспензію перемішують при кімнатній температурі декілька годин, потому фільтрують, промивають 20 мл THF, і підсушують на фільтрі протягом години (вихід 1,27 г). Висушують протягом ночі у вакуумній сушильній шафі при 40C, одержуючи 1,19 г адукту бісульфіту натрію і (транс)-метил-4формілциклогексанкарбоксилату у вигляді безбарвної твердої речовини. Препаративна методика 19 (Транс)-4-формілциклогексанкарбоксилат Стадія 11. До суміші карбонату натрію (5,06 г, 47,72 ммоль), толуолу (17 мл) і води (33 мл) додають адукт бісульфіту натрію і (транс)-метил-4-формілциклогексанкарбоксилату (3,92 г, 11,93 ммоль), і перемішують при кімнатній температурі. Після перемішування протягом 1 год. при кімнаній температурі розділяють шари, і промивають шар толуолу 15 мл води. Цей толуоловий розчин, що містить (транс)-4-формілциклогексанкарбоксилат, використовують на стадії 12. Приклад 1 Транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонова кислота, аморфна тверда речовина У колбу вносять (транс)-метил-4-(((S)-5-((3,5-біс(трифторометил)бензил)(2-метил-2Hтетразол-5-іл)аміно)-7,9-диметил-2,3,4,5-тетрагідро-1H-бензо[b]азепін-1іл)метил)циклогексанкарбоксилат (149 мг). Додають MeOH (6 мл) та 1,0н розчин NaOH (3,0 мл). Суміш, що утворилася, нагрівають до приблизно 60C. Перебіг реакції контролюють методом хроматографії у тонкому шарі (ХТШ). По закінченні 7 год. з початку реакції, або ж коли увесь вихідний складний ефір зазнає перетворення, охолоджують реакційну суміш приблизно до 0C, і гасять реакцію, додаючи 1н розчин HCl. Розводять суміш EtOAc (60 мл), послідовно промивають водою (20 мл), ропою (20 мл), і висушують Na2SO4. Фільтрують, і згущують фільтрат. Залишок очищують флеш-хроматографією (елюент – CH2Cl2). Розчинник видаляють, одержуючи сполуку, вказану у заголовку (125 мг), у вигляді білої твердої речовини. Приклад 2 Транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонова кислота, аморфна тверда речовина 15 UA 109409 C2 5 10 15 20 25 30 35 40 45 50 55 60 До тригорлої колби місткістю 500 мл, спорядженої механічним перемішувачем, додавальною лійкою і термопарою, вливають воду (265 мл), і охолоджують у бані з льодом. У другій колбі розчиняють BCCA (22,0 г) у 40 мл ацетону, і додають цей розчин з додавальної лійки до тригорлої колби. Колбу споліскують ще 4 мл ацетону, і додають у додавальну лійку змивний ацетон. Краплями додають вміст додавальної лійки до колби, і потім одержану суміш перемішують, підтримуючи температуру в межах 0-1C. Відділяють осад, що утворився, двічі промивають на фільтрі водою, і висушують протягом ночі при 40C, одержуючи 22,3 г сполуки у вигляді білого порошку. Приклад 3 Гідрат транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти· З колби, спорядженої механічним перемішувачем, термопарою або термометром і насадкою для введення N2, витісняють повітря азотом; слідом за цим, підтримуючи всередині колби надлишковий тиск азоту, додають (транс)-метил-4-(((S)-5-((3,5-біс(трифторометил)бензил)(2метил-2H-тетразол-5-іл)аміно)-7,9-диметил-2,3,4,5-тетрагідро-1H-бензо[b]азепін-1іл)метил)циклогексанкарбоксилат (1,0 кг, 1,53 моль), MeOH (10 л) та 2 M розчин NaOH (1,53 л, 3,06 моль). Суміш, що утворилася, нагрівають до кипіння (близько 68C). Після 4-годинного кип'ятіння дозволяють реакційній масі охолонути до КТ, і залишають перемішуватися протягом ночі. Суміш фільтрують, збираючи фільтрат. Додають водний розчин метанолу (MeOH:вода=1:1 (за вагою); 500 мл), і потому повільно додають оцтову кислоту (260 мл), щоб ініціювати осаджування продукту. Відділяють тверду речовину, що утворилася у вигляді суміші, яка складається з BCCA, гідрату BCCA та сольвату BCCA·з метанолом. Висушують тверду речовину у сушильній шафі при 40C. До колби місткістю 2 л, спорядженої зворотним холодильником, термопарою, нагрівальним кожухом і механічним перемішувачем, вносять BCCA у вигляді твердої речовини (109 г), MeOH (900 мл) і воду (10 мл). Суспензію, що утворилася, нагрівають до кипіння у атмосфері азоту. Після повного розчинення твердої речовини вимикають обігрів, і дозволяють реакційній масі охолонути до температури навколишнього середовища. Якщо це бажано, можна додати зародковий кристал гідрату BCCA. Відділяють тверду речовину. Промивають послідовно водним розчином метанолу (MeOH:вода=9:1 (за об'ємом); 100 мл) і водою (1 л). Тверду речовину висушують у вакуумі при температурі приблизно 40C, одержуючи 100 г білої твердої речовини. Надалі знов збовтують речовину з сумішшю ізопропанол-вода (1:1 (за об'ємом); 1 л). Відділяють тверду речовину, що утворилася, промивають водою (500 мл), і висушують протягом ночі у вакуумі при 40 °C, одержуючи 60 г сполуки, вказаної у заголовку. Результати аналізу: . вода 2,53 % (за Фішером); елементний аналіз: C31H36F6N6O2 H2O; обчислено (%): C 56,70; H 5,83; N 12,80; знайдено (%): C 56,59; H 5,28; N 12,55. ЯМР у твердому стані 13 Спектри ЯМР C кристалічного гідрату BCCA у твердому стані одержано за допомогою техніки твердофазного ЯМР (solid-state NMR, або SSNMR) із крос-поляризацією та/або обертанням під "магічним кутом" (ЯМР CP/MAS) і записано на ЯМР спектрометрі Bruker Avance II, 400 МГц, що працює на частоті атомів вуглецю, яка становить 100,622 МГц, і обладнаний зондом подвійного резонансу Bruker 4 мм (K299552). Застосовували повне пригнічення побічних смуг (TOSS) разом із крос-поляризацією: схему розрізнення SPINAL64 (95,4 ват) та імпульс КП протонів модельного профілю a RAMP100. Параметри накопичування сигналу були такими: ширина РЧ імпульсу протона (90°) 2,50 мкс, час контакту 1,5 мс, період повторення імпульсів 20 с, частота обертання (MAS) 5 кГц, спектральна ширина 30 кГц, тривалість накопичування 34 мс, 13 кількість проходжень спектром 3844. Одержано такий набор резонансних частот C SSNMR гідрату BCCA: 175,6, 168,0, 145,6, 144,8, 143,5, 139,9, 136,3, 132,8, 132,1, 129,2, 127,3, 126,2, -1 122,7, 121,0, 61,1, 53,0, 49,8, 45,0, 40,2, 38,7, 31,4, 30,4, 29,0, 27,8, 27,0, 21,2, 18,3; 0,2 млн . -1 Хімічні зсуви відліковували від сигналу адамантану (δ=29,5 млн ), одержанного у окремому експерименті. Приклад 4 Кристалічна форма транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2Hтетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1іл]метил]циклогексанкарбонової кислоти· гідрату та сольвату із етанолом До посудини завантажують (транс)-метил-4-(((S)-5-((3,5-біс(трифторометил)бензил)(2метил-2H-тетразол-5-іл)аміно)-7,9-диметил-2,3,4,5-тетрагідро-1H-бензо[b]азепін-1іл)метил)циклогексанкарбоксилат (12,95 кг), EtOH (129,5 л) та 2 M розчин NaOH (9,9 л, 2 екв.). Перемішують суспензію, що утворилася, приблизно 10 хв, потім нагрівають реакційну суміш до 16 UA 109409 C2 5 10 15 20 25 30 35 40 45 50 55 приблизно 40-45C, і витримують 6 год. Перебіг реакції контролюють за допомогою РХВЕ. Додають оцтову кислоту (3,75 кг), після цього воду (15,5 л), і насамкінець вносять зародок кристалічної форми гідрату BCCA. Після перемішування протягом приблизно 2 год. охолоджують реакційну суміш до КТ, і перемішують ще протягом 2 год. Відділяють тверду речовину, що утворилася, промивають водним етанолом (EtOH:вода=1:1, 226 л), і висушують протягом ночі, одержуючи сполуку, вказану у заголовку (15,87 кг, масса вологої речовини), у вигляді суміші сольвату з етанолом і гідрату. Приклад 5 Кристалічна форма гідрату транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1іл]метил]циклогексанкарбонової кислоти До посудини завантажують транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1іл]метил]циклогексанкарбонову кислоту (15,87 кг) і воду (158,8 л). Перемішують суспензію, що утворилася, протягом 2 год. при КТ. Потім фільтрують суспензію, що утворилася, для відділення твердої речовини. Висушують тверду речовину протягом ночі. Тверду речовину, що утворилася, розчиняють у MeOH при нагріванні до 65-70C впродовж 2 год. до утворення прозорого розчину. Прозорий розчин фільтрують, і фільтрат охолоджують до температури 0-5C, щоб ініціювати кристалізацію. Відділяють кристали, що утворилися, і висушують протягом ночі. Кристалічну речовину збовтують із водою (158,8 л), і перемішують при КТ протягом приблизно 2 год. Відділяють кристалічну речовину; висушують у глибокому вакуумі при 40-45C, одержуючи тверду речовину із відсотком вологи від 2,7 до 3,1 (за даними метода Фішера). Приклад 6 Кристалізація гідрату транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2Hтетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1іл]метил]циклогексанкарбонової кислоти До колби місткістю 250 мл, спорядженої механічним перемішувачем, вносять етанол (100 мл), (транс)-метил-4-(((S)-5-((3,5-біс(трифторометил)бензил)(2-метил-2H-тетразол-5-іл)аміно)7,9-диметил-2,3,4,5-тетрагідро-1H-бензо[b]азепін-1-іл)метил)циклогексанкарбоксилат (10,0 g, 15,32 ммоль) та 2 M розчин NaOH (15,0 мл, 30,0 ммоль). Суспензію, що утворилася, нагрівають приблизно до 40C, і перемішують при цій температурі протягом приблизно 4 год. Дозволяють реакційній суміші охолонути до КТ. Додають оцтову кислоту (2,7 мл, 45,4 ммоль), і підігрівають до 40C. Протягом 2,5 год. повільно додають воду (40 мл) для утворення густої білої суспензії. Нагрівання продовжують ще протягом 1,5 год., і дозволяють суспензії охолонути до КТ. Відділяють тверду речовину фільтруванням, і послідовно промивають водним етанолом (EtOH:вода=1:1, 20 мл) і водою (20 мл). Суспендують тверду речовину у воді (70 мл); відділяють тверду речовину фільтруванням, і промивають водою (220 мл). Операцію завішування у воді і відмивання повторюють ще двічі. Відділяють тверду сполуку, що утворилася, і висушують при 60C, одержуючи сполуку, вказану у заголовку, у вигляді білої твердої речовини (6,1 г). Приклад 7 Кристалізація гідрату транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2Hтетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1іл]метил]циклогексанкарбонової кислоти До сцинтиляційного флакона вносять BCCA (60 мг), і додають 1,5 мл MeOH. Нагрівають прозорий розчин приблизно до 45C. Додають 1,5 молярних еквіваленти мурашиної кислоти у 100 мкл води; при цьому утворюється біла суспензія. До суспензії дають 0,5 мл MeOH, і обережно нагрівають до приблизно 55C. Зачекавши декілька годин, охолоджують суспензію до КТ, відділяють білу кристалічну речовину вакуум-фільтруванням, і висушують його на повітрі. ЯМР аналіз розчину цієї кристалічної твердої речовини не виявляє присутності вільної мурашиної кислоти. Подальший аналіз кристалічної форми можливий методом диференційної термографії (термогравіметричного аналізу), яким виявлено, що кристалічна форма характеризується вмістом летких речовин (втратою ваги при нагріванні від 38C до 133 °C) 2,6 %; за даними термогравіметрії з масс-спектром (TGA-MS), леткою речовиною є вода, а втрата ваги відбувається при 81C. Диференційна термографія / Термогравіметричний аналіз Диференційну термографію / термогравіметричний аналіз (DTA/TGA) здійснювали на установці Mettler Toledo (моделі TGA/SDTA 851). Проби нагрівали у герметичних алюмінієвих посудинах з малим отвором; температуру підіймали від 25С до 300-350C зі швидкістю 10 C/хв, проганяючи крізь посудину струмінь азоту з об'ємною швидкістю 50 мл/хв. Термопару для 17 UA 109409 C2 5 10 TGA градуювали за допомогою еталонних індій-алюмінієвих сплавів (Т. топл. = 156,6C та 660,3C). Градуювання терезів і гир здійснювали за допомогою еталонів, наданих постачальником обладнання, і перевіряли контрольною дегідратацією дигідрату цитрату натрію. Рентгеноструктурний спектральний аналіз (XRD) Дифрактограми XRD (дебаєграми) реєстрували за допомогою рентгенівського дифрактометра Bruker-AXS D4 Endeavor, використовуючи джерело рентгенівських променів CuK (=1,54056 Å, живлення: 40 кВ, 50 мА), і детектор Vantec. Сигнал накопичували у діапазоні кутів 2θ 4-40° з інкрементом 2θ у 0,009° і періодом кроку накопичення 0,5 секунд. Обробка даних: метод "універсальної обробки сигналів" (Universal Signal Processing, USP); застосовували поправку на зсув сигналу, обравши за реперні сигнали піки 2θ 8,853° та 17,759° внутрішнього еталону. Нижче у таблиці 1 подані головні піки 2θ. Таблиця 1 Кут (2-θ), 7,5 9,2 10,7 10,9 11,3 12,2 12,4 12,7 13,8 15,0 15,5 16,5 16,7 17,7 18,5 18,7 19,0 19,5 20,5 20,7 21,0 21,7 21,8 22,1 22,7 25,1 26,9 15 20 25 Інтенсивність I/I0, % 28,7 20,6 50,7 24,5 43,5 13,8 21,9 17,6 49,8 64,7 100,0 22,6 25,7 33,1 32,9 33,2 28,0 54,5 12,8 13,6 23,7 18,8 15,1 23,7 12,4 32,6 10,6 Відстань d, ангстрем 11,83 9,62 8,28 8,09 7,82 7,26 7,11 6,95 6,41 5,90 5,70 5,37 5,32 5,00 4,80 4,75 4,66 4,54 4,32 4,30 4,23 4,09 4,08 4,02 3,92 3,55 3,31 Загальновідомим у кристалографії є той факт, що для будь-якої певної кристалічної форми відносні інтенсивності дифракційних піків варіюють залежно від переважної орієнтації, яка, у свою чергу, обумовлена певними факторами, такими як морфологія кристалу. За наявності переважної орієнтації інтенсивності піків змінюються, проте координати характеристичних піків певної поліморфної модифікації залишаються незмінними. (Див., наприклад, The United States Pharmacopeia (Державна Фармакопея США) #23, National Formulary #18, pages 1843-1844, 1995). Крім того, відомим у кристалографії є той факт, що для будь-якої певної кристалічної форми кутові положення дифракційних максимумів так само можуть дещо варіювати. Наприклад, кутові положення максимумів здатні зазнавати зсуву під впливом коливань температури, при якій здійснюється аналіз проби, фізичного зсуву самого матеріалу проби, а також залежно від того, наявний чи відсутній внутрішній еталон. У даному випадку слід зважати на коливання кутового положення максимуму (2 ) в межах ±0,2, і усвідомлювати, що такі 18 UA 109409 C2 5 10 15 20 25 30 можливі варіації не є перешкодою для однозначної ідентифікації кристалічних солей за цим винаходом. Одним із загальновідомих з літератури і загальновживаних методів відшукання кристалічних форм є так званий "метод Фінка". Згідно з алгоритмом Фінка, для первинного пошуку використовують чотири найінтенсивніші лінії, згодом чотири найближчі за інтенсивністю лінії і так далі. Приклад 8 Транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти·сольват із метанолом Суспендують BCCA (4 грами) у 4 мл метанолу, і доводять до кипіння. Додають ще приблизно 50 мл метанолу, доки залишиться незначна суспензія. Охолоджують суміш до кімнатної температури, і витримують протягом доби. Твердий продукт відділяють вакуумфільтруванням, і зберігають у герметичній посудині разом із метанолом, щоб захистити метастабільну кристалічну форму від впливу вологи. Приклад 9 Сольват транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти· із етанолом Суспендують BCCA (3 грами) у 10 мл етанолу протягом декількох годин. Твердий продукт відділяють вакуум-фільтруванням, і зберігають у герметичній посудині разом із етанолом, щоб захистити метастабільну кристалічну форму від впливу вологи. Приклад 10 Сольват транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти· із мурашиною кислотою Розчиняють BCCA у 7 мл ізопропанолу. До розчину додають мурашину кислоту (3 мл). Згодом додають воду (4 мл) при кімнатній температурі до появи легкої каламуті. Суспензію нагрівають до 70C, і витримують протягом 6 год. із подальшим охолодженням до кімнатної температури. Твердий продукт відділяють вакуум-фільтруванням, і висушують на повітрі. Реєструють спектр XRD (дебаєграму) відповідно до опису, наведеного у прикладі 7. Нижче у таблиці 2 подано перелік піків, одержаних із дебаєграми. Таблиця 2 Кут (2-θ), 6,3 9,3 9,9 10,7 11,1 11,5 12,2 12,7 13,0 13,9 14,4 14,9 15,4 15,7 16,4 16,9 18,2 18,6 19,5 19,9 20,3 20,8 Інтенсивність I/I0, % 3,5 17,7 16,5 8,5 16 4,9 11,6 5,7 30,5 32,7 1,3 13,2 94,8 51,8 33,8 69,1 62,3 100 39,9 22,2 84 34,3 19 Відстань d, ангстрем 13,94968 9,51672 8,88574 8,26542 7,96996 7,66788 7,26781 6,9724 6,79403 6,34956 6,15366 5,93156 5,73681 5,64135 5,40178 5,25235 4,86504 4,76188 4,54984 4,46884 4,37738 4,25735 UA 109409 C2 Таблиця 2 Кут (2-θ), 21,2 21,8 22,1 22,3 22,8 23,5 23,9 24,4 25,7 26,3 26,9 27,4 27,7 28,1 28,8 29,3 29,6 30,1 30,5 31,1 31,5 32,1 32,8 33,3 33,7 34,1 35,0 35,2 36,2 37,1 37,6 38,1 38,5 38,8 39,1 39,5 25,5 5 10 Інтенсивність I/I0, % 25,3 28,9 21,7 12,9 42,2 1,6 10,5 26,9 54,3 13,3 28,1 3 7,9 18,9 0,3 4,7 9,5 9,9 2,2 17,2 6 3 1,4 8,4 2,4 1,9 3,6 5,2 8,8 5,3 4,4 1 1,8 4,4 6,1 0,5 47,3 Відстань d, ангстрем 4,18 4,0714 4,02645 3,98942 3,89217 3,78509 3,72471 3,64202 3,46701 3,38649 3,31071 3,25174 3,21293 3,17584 3,09618 3,04676 3,01312 2,97021 2,92929 2,87149 2,83836 2,78284 2,725 2,68817 2,65549 2,62877 2,56476 2,54651 2,4816 2,41971 2,38904 2,35966 2,33689 2,31826 2,30101 2,27748 3,49258 Приклад 11 Транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти·сольват із оцтовою кислотою Суспендують транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонову кислоту (1,5 г) у 10 мл гептану. Нагрівають суспензію до 50C. Додають 1 мл оцтової кислоти, при цьому суспензія перетворюється на прозорий розчин. Додають ще 10 мл гептану, і охолоджують до кімнатної температури. Твердий продукт відділяють вакуум-фільтруванням, і висушують на повітрі. Реєструють спектр XRD (дебаєграму) відповідно до опису, наведеного у прикладі 7. Нижче у таблиці 3 подано перелік піків, одержаних із дебаєграми. 20 UA 109409 C2 Таблиця 3 Кут(2-θ), 6,1 7,4 7,7 9,1 9,5 10,3 10,6 11,0 11,3 12,0 12,3 12,6 12,9 13,8 14,1 14,6 14,9 15,1 15,6 16,1 16,4 16,6 17,8 18,4 18,6 19,0 19,4 19,6 20,1 20,8 21,1 21,4 21,7 22,2 22,7 23,3 24,2 24,9 25,5 25,8 26,2 26,6 26,9 27,6 27,9 28,9 29,6 30,2 30,6 31,3 32,1 32,7 33,0 Інтенсивність I/I0, % 13,9 5,5 3,9 36,1 7,2 7,2 9,9 49,7 9,4 17,1 8,7 11,4 69,1 59,9 12,0 18,4 42,7 64,5 47,5 25,3 60,8 15,5 62,9 100,0 25,0 22,8 70,3 36,3 54,0 68,0 42,1 17,2 52,5 31,5 40,3 14,1 23,9 33,2 40,1 10,4 19,8 29,0 8,1 9,9 11,3 8,0 5,4 5,4 4,3 5,5 6,1 5,2 7,2 21 Відстань d, ангстрем 14,44535 11,91759 11,43266 9,71543 9,26358 8,56123 8,35606 8,03505 7,85127 7,34832 7,15849 6,99570 6,84536 6,42263 6,28300 6,04828 5,93036 5,85341 5,68615 5,48924 5,40742 5,33346 4,99156 4,82513 4,75791 4,67246 4,57246 4,51720 4,40286 4,26852 4,19902 4,15565 4,08624 3,99752 3,90975 3,81432 3,66935 3,56724 3,49233 3,44753 3,39235 3,34914 3,31407 3,23104 3,19103 3,08812 3,01802 2,95795 2,91735 2,85866 2,78825 2,73423 2,71300 UA 109409 C2 Таблиця 3 Кут(2-θ), 33,9 34,3 35,0 35,7 36,1 36,3 36,7 37,0 37,3 37,7 38,5 39,3 5 10 15 20 25 30 35 40 Інтенсивність I/I0, % 5,1 3,5 7,1 3,2 3,9 3,8 3,4 4,4 3,3 4,2 4,6 4,1 Відстань d, ангстрем 2,63900 2,61366 2,56146 2,51192 2,48827 2,47610 2,44761 2,42813 2,40594 2,38107 2,33422 2,28755 Приклад 12 Транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти·сіль натрію До пляшки місткістю 500 мл додають гідрат транс-4-[[(5S)-5-[[[3,5біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти (20,16 г) та етанол SDA 3A (4,5 % метанолу) (200,94 мл). Перемішують стрижнем магнітної мешалки, повільно додаючи 1н розчин гідроксиду натрію (31,95 г). Повинен утворитися прозорий розчин. Використовують сушильну установку з розпилюванням (Niro SD Micro Spray Dryer), і застосовують газ-осушувач із об'ємною витратою до 32,5 кг/год., тиск 2,8 бар, газ-розпилювач із об'ємною витратою до 2,0 кг/год., тиск 0,3 бар, із авторегульованою температурою на вході 115C. Як тільки встановиться температура на вході 115C, і відповідна температура на виході (109C), розпочинають подавати суміш етанолу з водою (83:17 за вагою). При встановленому у положення 3.0 перемикачі "pump setting" на стінки і на вихід камери не повинно потрапляти жодних краплин. Вичікують до встановлення термічної рівноваги, тобто температури на виході 104C. Перемикають систему з режиму впорску водно-етанольної суміші (при кімнатній температурі) у режим сушіння зразку з впорском розчину у водно-етанольній суміші. Після висушування розпилюванням вага зразку становить 13,51 г. Приклад 13 Транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти·сіль магнію Розчиняють транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти сіль натрію (2 грами) у 5 мл метанолу. Розчиняють ацетат магнію (335 мг) у 20 мл води. Розчин ацетату магнію додають краплями до розчину натрієвої солі BCCA із енергійним перемішуванням при кімнатній температурі, а потім підвищують температуру до 65C. При цьому випадає осад. При підвищеній температурі додають ще 10 мл води. Охолоджують суспензію до кімнатної температури, відділяють твердий продукт вакуум-фільтруванням, і промивають водою. Висушують продукт у вакуумній сушильній шафі при кімнатній температурі. Сіль кальцію і цинку BCCA можна одержати за методикою, подібною до методики одержання магнієвої солі BCCA. Сіль калію можна одержати за методикою, подібною до методики одержання натрієвої солі BCCA. Приклад 14 Транс -4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти· із трет-бутиламіном, сольват із ізопропиловим спиртом (1:1:1) Круглодонну колбу з трьома горловинами місткістю 1 л споряджають механічним перемішувачем, терморегулятором, додавальною лійкою і кожухом для обігріву. Суспендують транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти гідрат (50 22 UA 109409 C2 5 10 15 г) у гептані (500 мл). Нагрівають суспензію до 69,1C, і додають трет-бутиламін (5,57 г) у вигляді розчину в ізопропіловому спирті (70 мл), після чого ополіскують ще 5 мл ізопропілового спирту. Одразу після додавання утворюється розчин. Під час додавання температура знижується до 63C, однак знов підвищується до 69C, як тільки додавання буде завершено. Додають на кінчику шпатлі зародкові кристали солі транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1іл]метил]циклогексанкарбонової кислоти з трет-бутиламіном. Розпочинається утворення суспензії, при цьому перемішування при 69C триває. Розпочинають охолодження реакційної маси до 55C. Приблизно за годину утворюється густа суспензія. Охолодження продовжують до температури 45C. За годину температуру суспензії знижують до 35C. Приблизно 2 год. по тому вимикають обігрів, і дозволяють масі охолодитися до температури навколишнього середовища. Приблизно 3 год. по тому суспензію фільтрують (температура при цьому дорівнює 21C), і промивають 100 мл гептану. Осад висушують у вакуумі протягом приблизно 1,5 год. Сушать протягом уїк-енду у вакуумі при 33C. Одержують вихід 55,9 г. Реєструють спектр XRD (дебаєграму) відповідно до опису, наведеного у прикладі 7. Нижче у таблиці 4 подано перелік піків, одержаних із дебаєграми. Таблиця 4 Кут (2-θ), 5,6 8,0 8,9 10,9 11,3 11,5 12,3 12,6 12,8 13,5 14,4 15,2 15,7 16,0 16,2 16,5 16,9 17,3 17,9 19,0 19,4 19,8 20,0 20,4 20,6 20,9 21,2 21,6 22,5 22,7 22,9 23,4 24,1 24,4 25,4 25,7 26,2 Інтенсивність I/I0, % 44,1 25,8 14,1 7,3 49,2 2,6 1,9 50,1 2,2 5,5 9,4 3,5 1,7 3,0 6,6 9,5 1,4 1,7 100,0 2,6 9,2 18,4 4,3 31,4 10,7 7,4 2,6 16,3 15,6 10,1 4,9 14,3 32,8 2,7 17,6 2,8 2,2 23 Відстань d, ангстрем 15,66139 11,06129 9,90002 8,08475 7,84359 7,67967 7,19816 7,01593 6,88749 6,52796 6,14491 5,81628 5,62539 5,54451 5,45377 5,38135 5,22767 5,11298 4,95461 4,67047 4,56973 4,47579 4,43314 4,34849 4,30398 4,25624 4,18059 4,11389 3,94560 3,92057 3,88729 3,79936 3,69727 3,64309 3,50430 3,46139 3,40048 UA 109409 C2 Таблиця 4 Кут (2-θ), 26,5 27,4 27,7 28,4 28,8 29,0 30,0 30,3 30,7 31,1 31,5 32,0 32,3 32,5 33,3 34,2 34,5 34,8 35,9 36,2 36,6 37,1 37,3 37,7 38,0 38,3 38,8 40,0 5 10 15 20 Інтенсивність I/I0, % 3,9 1,7 3,4 2,2 1,9 10,9 1,7 2,2 3,6 2,7 1,8 1,6 1,8 3,5 2,7 2,5 1,7 1,6 1,4 2,0 2,7 1,2 1,7 1,2 1,5 2,0 2,8 1,4 Відстань d, ангстрем 3,36314 3,25294 3,21470 3,13589 3,09670 3,07330 2,97494 2,94722 2,91172 2,87130 2,83951 2,79091 2,77270 2,74970 2,69165 2,62286 2,59477 2,57771 2,49750 2,48053 2,45071 2,42094 2,40638 2,38295 2,36721 2,34975 2,31827 2,25835 Приклад 15 Напівсіль транс -4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти·із трет-бутиламіном, напівсольват із етанолом (2:1:1) у кристалічній формі Суспендують транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти гідрат (50,5 г) у гептані (404,00 мл) при механічному перемішуванні. Додають етанол (25,25 мл), і нагрівають до 55C. Утворюється прозорий розчин. Додають трет-бутиламін (2,81 г) при 55C. Для того, щоб спонукати систему до кристалізації, вносять зародок транс-4-[[(5S)-5[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти напівсолі з третбутиламіном напівсольвату із етанолом (2:1:1). Підтримують температуру, яка становить 50C. За лічені хвилини утворюється вельми густа суспензія, при цьому температура підвищується до 60C. Перемішування продовжують, при цьому охолоджують знов до 50C. Приблизно 5,5 год. по тому вимикають обігрів, і дозволяють масі охолодитися до температури навколишнього середовища. Приблизно 3 год. по тому суспензію фільтрують, споліскують колбу порцією маточного розчину, і промивають шар осаду 100 мл гептану. Висушують протягом ночі у вакуумі при 45C. Вихід 50,9 г. Реєструють спектр XRD (дебаєграму) відповідно до опису, наведеного у прикладі 7. Нижче у таблиці 5 подано перелік піків, одержаних із дебаєграми. 24 UA 109409 C2 Таблиця 5 Кут (2-θ), 4,4 5,5 7,0 9,0 10,5 11,0 13,2 13,6 14,3 14,7 15,2 16,4 17,1 17,5 18,2 19,4 19,8 20,0 20,6 21,3 22,0 22,5 22,8 23,6 24,2 24,5 25,2 25,5 26,0 26,5 26,8 27,4 28,2 29,0 29,8 30,3 30,8 31,3 31,6 31,9 32,2 32,5 32,8 33,1 33,4 33,6 33,9 34,3 34,9 35,3 35,9 36,2 36,6 Інтенсивність I/I0, % 7,9 100,0 11,1 68,2 2,8 6,7 14,6 15,4 91,3 6,5 19,3 7,7 8,5 47,8 56,5 42,7 13,6 16,8 36,0 4,7 66,4 60,2 8,5 10,5 8,0 9,1 3,0 11,9 4,9 10,1 8,5 7,4 3,6 10,2 2,6 1,7 2,8 1,8 2,2 2,0 1,3 2,1 2,8 2,6 4,0 2,1 1,3 2,6 1,9 3,5 1,6 1,2 2,0 25 Відстань d, ангстрем 19,89438 15,98834 12,56184 9,80480 8,37905 8,03163 6,72015 6,51691 6,16773 6,03809 5,81709 5,38980 5,16503 5,06441 4,87353 4,58173 4,47894 4,44358 4,31170 4,16561 4,04259 3,95496 3,89683 3,76398 3,66760 3,63014 3,53057 3,48459 3,42535 3,36294 3,32729 3,24977 3,16032 3,07299 2,99108 2,94967 2,90463 2,85529 2,83127 2,80658 2,77693 2,75134 2,72867 2,70617 2,68312 2,66202 2,64016 2,61178 2,57048 2,54278 2,50187 2,47774 2,45291 UA 109409 C2 Таблиця 5 Кут (2-θ), 37,1 37,5 37,9 38,5 5 10 15 20 25 30 35 Інтенсивність I/I0, % 3,7 1,6 2,0 2,5 Відстань d, ангстрем 2,42008 2,39905 2,37147 2,33798 Приклад 16 Гідрат транс-4-[[(5S)-5-[[[3,5-біс(трифторометил)феніл]метил](2-метил-2H-тетразол-5іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1H-1-бензоазепін-1-іл]метил]циклогексанкарбонової кислоти Стадія 13 зі схеми 3. До (транс)-метил-4-(((S)-5-((3,5-біс(трифторометил)бензил)(2-метил2H-тетразол-5-іл)аміно)-7,9-диметил-2,3,4,5-тетрагідро-1H-бензо[b]азепін-1іл)метил)циклогексанкарбоксилату (12,95 кг) при кімнатній температурі додають 2 M розчин NaOH (9,9 л), і перемішують реакційну масу протягом 10 хвилин. Надалі перемішують при температурі 40-45C впродовж 6 год. Перебіг реакції контролюють за допомогою РХВЕ. До реакційної суміші додають спочатку оцтову кислоту (3,75 кг), за нею воду (1,2 об'єми), вносять зародок гідрату BCCA, і перемішують протягом 2 год. при температурі 40-45C. До реакційної суміші додають воду (2,8 об'ємів), і перемішують ще протягом 2 год. при температурі 40-45 °C. Охолоджують реакційну масу до кімнатної температури, перемішують протягом 2 год., і фільтрують. Тверду речовину на фільтрі промивають водним етанолом (EtOH:вода=1:1, 22 об'єми), і висушують протягом ночі на фільтр-пресі. Одержують 15,87 кг твердої речовини, яку використовують на стадії 2. До твердої речовини, одержаної на стадії 1, додають метанол, і перемішують протягом 2 год. при температурі 65-70C до одержання прозорого розчину. Освітлюють до повної прозорості, фільтруванням розчину крізь прес-фільтрувальний елемент, і переносять до другого реактора, перемішують протягом 2 год. при температурі 0-5C, відділяють осад фільтруванням, і висушують протягом ночі на фільтр-пресі. Збовтують рекристалізовану тверду речовину у воді (10 об'ємів) при кімнатній температурі протягом 2 год., відділяють осад фільтруванням, і висушують на фільтр-пресі. Висушують у сушильному шкафу у глибокому вакуумі при 40-45C, одержуючи тверду речовину із відсотком вологи від 2,7 до 3,1 (за даними метода Фішера). Таким чином одержують 11,80 кг продукту. Вміст вологи (аналіз методом Фішера): 3,16 %. Мас-спектр (ES-API): у режимі реєстрації позитивних йонів – 639,30; у режимі реєстрації негативних йонів – 637,20. Хімічна стійкість Нижче у таблиці 5 подано перелік відомостей про хімічну стійкість вільної кислоти BCCA, а також зразків, одержаних за відібраними прикладами 31, 89, 153 та 175, наведеними у WO 06/002342, які нижче наведені як сполуки 13, 14, 15 та 16 відповідно. Подані нижче дані свідчать, що вільна кислота BCCA має сприятливі властивості, а саме відзначається підвищеною стійкістю у кислому водному середовищі – значно вищою, ніж у сполук 13, 14 та 16. Така підвищена стійкість вільної кислоти BCCA досі не була предметом дослідження; її також неможливо передбачити з розгляду даних WO 06/002342. 26 UA 109409 C2 Таблиця 6 Стійкість до дії кислот Спол. Хімічна будова H3C N Залишок у 0,1н HCl, 40C† 24 8 год. год. CF3 N N N Прикл. 1 Назва N H3C CF3 BCCA, вільна кислота 97,3 91,3 N CH3 CO2H H3C N CF3 N N N N H3C CF3 13 F3C N (4-{5-[(3,5-біс-трифторометил-бензил)-(2-метил2H-тетразол-5-іл)аміно]-7-метил-8трифторометил-2,3,4,5-тетрагідро14,5 бензо[b]азепін-1-ілметил}-циклогексил)оцтова кислота 0 CO2H CF3 N N H3C N N N H3C CF3 14 F3C N (S)-4-{5-[(3,5-біс-трифторометил-бензил)-(2метил-2H-тетразол-5-іл)аміно]-7-метил-8трифторометил-2,3,4,5-тетрагідробензо[b]азепін-1-ілметил}бензен-карбонова кислота 52 13,4 CO2H H3C N CF3 N N N N H3C CF3 15 F3C N CH3 (S)-(4-{5-[3,5-біс-трифторометил-бензил)-(2метил-2H-тетразол-5-іл)аміно]-7,9-диметил-8трифторометил-2,3,4,5-тетрагідро100,4 99,1 бензо[b]азепін-1-ілметил}циклогексил)оцтова кислота CO2H 27 UA 109409 C2 Таблиця 6 Стійкість до дії кислот Спол. Хімічна будова H3C N N H3C CF3 16 F3C Залишок у 0,1н HCl, 40C† 24 8 год. год. CF3 N N N Назва N CH3 (S)-4-{5-[(3,5-біс-трифторметилбензил)-2-метил2H-тетразол-5-іл)аміно]-7-метил-8трифторометил-2,3,4,5-тетрагідро37,8 13,4* бензо[b]азепін-1-іл}циклогексан-карбонова кислота CO2H † Відсоток речовини, яка зберігається незмінною; кожну сполуку досліджували окремо, згідно методики, наведеної безпосередньо нижче. * Відсоток, який зберігається після контакту протягом 16 год. 5 10 15 20 25 30 35 Приготування проби: 1) Концентрат сполуки: 0,9 мг/мл у ACN; 2) 100 мкл концентрату + 700 мкл ACN+1 мл активного середовища (0,1н HCl, 50 ммоль/л фосфатного буферу (PO 4), pH 8, і 0,3 % H2O2); 3) Пробірки поміщують у нагрітий (40C) автоматичний прилад для вводу проб, вводять проби з інтервалом у 4 год. протягом 16 год. або 24 год. Робочі характеристики автоматичного приладу для вводу проб і умови проведення хроматографії Колонка: Alltech Alltima Phenyl, 3 мкм, розмір 4,6150 мм, або Waters XTerra MS C18, 3,5 мкм, розмір 4,6150 мм; температура колонки: 50C, об'єм впорску проби: 10 мкл. Реєстрація: УФ, 226, 254 або 266 нм (залежно від сполуки) Об'ємна витрата елюенту: 1,5 мл/хв. Рухома фаза: 0,1 % TFA у суміші 50 % води/50 % ACN (% ACN може потребувати уточнення, щоб час утримання сполуки складав ~5 хв); кінцева конц. сполуки у пробі 0,05 мг/мл; вміст ACN 44 %. Порівняльне дослідження фармакокінетики сполук-інгібіторів CETP при внутрішньовенному (ВВ) та пероральному (ПО) надходженні на самцях щурів лінії Sprague Dawley Це дослідження мало на меті визначення фармакокінетичних параметрів, в тому числі біодосяжності при пероральному надходженні, після введення одного внутрішньовенного болюсу (доза 1 мг/кг) або введення пероральної дози (3 мг/кг) досліджуваної сполуки до організму щурів-самців лінії Sprague Dawley (n=4) в умовах перехресного плану експерименту. Основою при внутрішньовенному введенні є 20 % мікроемульсія ПАР солютолу (Solutol HS 15) у дистильованій воді (80 %). Основою при пероральному введенні є розчин: розчин такого складу: Повідон USP 10 % /лаурилсульфат натрію (SLS) 0,5 % /стандартизована (QS) дистильована вода. У групі тварин, які одержували дозу внутрішньовенно, забирали зразки крові у моменти часу 0,08 год., 0,25 год., 0,5 год., 1 год., 2 год., 5 год., 8 год., 12 год. та 24 год. після введення дози. У групі тварин, які одержували дозу перорально, забирали зразки крові у моменти часу 0 год., 0,25 год., 0,5 год., 1 год., 2 год., 5 год., 8 год., 12 год. та 24 год. після надходження дози. Плазму готували центрифугуванням зразків крові, охолоджували, заморожували доти, доки настане час відсилати зразки у пакунку з "сухим льодом" на біоаналітичний аналіз до лабораторії Bioanalytical Systems, Inc. (BASi; West Lafayette, шт. Індіана, США). Концентрації BCCA у плазмі визначали за даними рідинної хроматографії з тандемною мас-спектрометрією (РХ/МС/МС); фармакокінетичні параметри обчислювали за допомогою атестованої для цієї мети прикладної програми (Watson, версія 7.1). При оцінюванні біодосяжності BCCA можна використовувати також і інші основи, такі як 1 % (маса/об'єм) натрієвої солі карбоксиметилцелюлози, 0,25 % (маса/об'єм) полісорбату 80 (Tween 80) та 0,05 % піногасника Dow Corning Antifoam 1510-US (0,05 % розчин у дистильованій воді) або 1 % (маса/об'єм) натрієвої солі карбоксиметилцелюлози, 0,5 % (маса/об'єм) розчин лаурилсульфат натрію і 28
ДивитисяДодаткова інформація
Назва патенту англійськоюTrans-4-[[(5s)-5-[[[3,5-bis(trifluoromethyl)phenyl]methyl] (2-methyl-2h-tetrazol-5-yl)amino]-2,3,4,5-tetrahydro-7,9-dimethyl-1h-1-benzazepin-1-yl]methyl]-cyclohexanecarboxylic acid
Автори англійськоюChen, Xinchao, Frank, Scott, Alan, Remick, David, Michael, Pedersen, Steven, Wayne
Автори російськоюЧень Синьчао, Франк Скотт Алан, Ремик Дейвид Майкл, Педерсен Стивен Уэйн
МПК / Мітки
МПК: C07D 403/12, A61P 9/10, A61K 31/55
Мітки: транс-4-[[(5s)-5-[[[3,5-біс(трифторометил)феніл]метил]-(2-метил-2н-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1н-1-бензоазепін-1-іл]метил]циклогексанкарбонова, кислота
Код посилання
<a href="https://ua.patents.su/36-109409-trans-4-5s-5-35-bistriftorometilfenilmetil-2-metil-2n-tetrazol-5-ilamino-2345-tetragidro-79-dimetil-1n-1-benzoazepin-1-ilmetilciklogeksankarbonova-kislota.html" target="_blank" rel="follow" title="База патентів України">Транс-4-[[(5s)-5-[[[3,5-біс(трифторометил)феніл]метил]-(2-метил-2н-тетразол-5-іл)аміно]-2,3,4,5-тетрагідро-7,9-диметил-1н-1-бензоазепін-1-іл]метил]циклогексанкарбонова кислота</a>
Попередній патент: Пакувальний матеріал, який містить ділянки, що намагнічуються, та спосіб його обробки
Наступний патент: Спосіб одержання нітрильних сполук з етиленненасичених сполук
Випадковий патент: Спосіб безперервного хемілюмінесцентного аналізу оксиду азоту та озону