Спосіб одержання 3-аміно-5,7-диметил-4,5,6,7-тетрагідро-2н-піразоло[3,4-d]піримідин-4,6-діону
Номер патенту: 81738
Опубліковано: 25.01.2008
Автори: Черненко Віталій Миколайович, Десенко Сергій Михайлович, Афанасіаді Людмила Михайлівна
Формула / Реферат
Спосіб одержання 3-аміно-5,7-диметил-4,5,6,7-тетрагідро-2Н-піразоло-[3,4-d]піримідин-4,6-діону формули
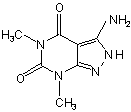 ,
,
що включає взаємодію 1,3-N,N-диметилбарбітурової кислоти з хлороксидом фосфору і конденсацію одержаного продукту з гідразингідратом у розчиннику при кипінні, який відрізняється тим, що 1,3-N,N-диметилбарбітурову кислоту піддають взаємодії з формілуючою сумішшю хлороксиду фосфору і додатково диметилформаміду, взятих у молярному співвідношенні 2,7:1,1, послідовно витримують реакційну суміш 50-60 хвилин при кімнатній температурі 20-25 °С, 50-60 хвилин- при 95±5 °С і 50-60 хвилин - при 110±5 °С, після чого перед конденсацією реакційну суміш піддають взаємодії з гідрохлоридом гідроксиламіну.
Текст
Спосіб одержання 3-аміно-5,7-диметил4,5,6,7-тетрагідро-2Н-піразоло-[3,4-d]піримідин4,6-діону формули 2 UA (54) СПОСІБ ОДЕРЖАННЯ D]ПІРИМІДИН-4,6-ДІОНУ ОПИС (19) ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ 3 81738 [пат. США 3.624.205, С07С 51/25, 51/16]; як інгібітори ксантин - оксидази їх описано у [Хім. Фарм. Журнал, 16, №6, 650(1982)]; як лікарські препарати, що покращують загальну серцеву функцію, мозковий кровообіг, церебральну циркуляцію [Пат. Яп. 62.077.387, CO7D 487/04] і інш. Наявність аміногрупи вказує на можливість широкого використання сполуки у препаративному органічному синтезі при рішенні низки практичних задач, в тому числі, при одержанні азометинів з широким діапазоном галузей їх використання, анілідів і азобарвників, як інтермедіатів синтезу складних гетероциклічних сполук різного призначення. Однак внаслідок складності технології одержання 3-аміно-5,7-диметил-4,5,6,7тетрагідро-2Н-піразоло[3,4-d]піримідин-4,6-діону сполука не знаходить широкого використання у препаративній хімії і обмежено застосовується як реактив у невеликих кількостях у лабораторних дослідженнях. Відомий спосіб одержання структурного аналога 3-N,N-диметиламіно-5,7-диметил-4,5,6,7тетрагідро-2Н-піразоло[3,4-d]піримідин-4,6-діону [B.Kokel, J. Heterocycl. Chem., 31, 1185 (1994)] формули І O H3C CH3 N H3C N NH N N O CH3 I Спосіб складається із 5 реакційних стадій і здійснюється за схемою: S + HN(CH3 ) Cl S бензол N O PCI5 CCI 4 N O N N2H4*H2O N O CH3 CI CH3 O H3C H3C O CI +N H3C CI CI H3C POCI3 N H3C O O H3C H3C O CH3 Cl Cl CH3 N N O N N NHNH2 CH3 CH3 NH N N CH3 У розчин тіофосгену у сухому бензолі пропускають газоподібний диметиламін упродовж двох годин, після чого суміш переганяють у вакуумі для виділення диметилтіофосгену. Диметилтіофосген, що утворився на першій стадії, у сухому ССl4 кип’ятять 1-2 години з РСl5, розчинник випарюють повністю. Оскільки сіль N,Nдиметилфосгеніум хлориду, що утворилася в процесі реакції, нестійка і при нагріванні до 150°С розкладається, її зберігають у вакуум - ексікаторі. 4 Одночасно кип'ятять 1,3-N,Nдиметилбарбітурову кислоту в хлороксиді фосфор у упродовж 2 годин, суміш охолоджують і обережно виливають на льод невеликими порціями. Осад 1,3-диметил-6-хлорурацилу, що утворився, відфільтровують і промивають водою до нейтральної реакції на лакмус. Одержаний на третій стадії 1,3-диметил-6хлорурацил розчиняють в ізопропіловому спирті, краплями додають гідразингідрат, суміш кип'ятять 30 хвилин. Осад 1,3-диметил-6-гідразиноурацилу, що випав при охолодженні, відфільтровують, сушать і використовують у наступній реакції. На останній стадії перемішують суміш приблизно еквімолярних кількостей 1,3-диметил-6гідразиноурацилу і N,N-диметилфосгеніум хлориду у сухому хлороформі і залишають стояти при кімнатній температурі 3 години, потім нагрівають до повного припинення виділення хлороводню (5-6 годин). Після охолодження розчинник (хлороформ) випарюють у вакуумі, маслянисту речовину змішують з водою і КНСО3, додаючи останній повільно до повного виділення СО2. Залишок 3N,N-диметиламіно-5,7-диметилпіразоло[3,4d]піримідин відфільтровують, промивають водою, сушать у вакуумі. Вихід технічного продукту складає 80%. Температура плавлення після перекристалізації із води 265°С. Структуру сполуки І 3-N,N-диметиламіно-5,7диметилпіразоло-[3,4-d]піримідину підтверджено ЯМР'Н спектром ДМСО-d6: 3.10 (с, 6Н,), 3.15 (с, 3Н,), 3.27 (с, 3Н,) 11.90 (1H, у.с.) і елементним аналізом. Недоліками відомого способу є багатостадійність (5 стадій) і тривалість технологічного процесу (загальний час реакції складає 26-28 годин) проведення реакції проводять у зневодненому середовищі: усі речовини повинні бути ретельно висушені, апаратуру для синтезу треба захистити від вологи хлоркальцієвими трубками. До недоліків способу слід віднести також використання легколетких газоподібних продуктів (диметиламін), отруйних та легкозаймистих (тіофосген і бензол) речовин. У процесі реакції утворюється лакриматор диметилтіофосген, що викликає подразнюючий ефект слизової оболонки очей і гортані і приводить до сильного виділення сльози, подразнювального кашлю і отруєння. Газоподібні продукти, що виділяються - НСl, СО2, треба видаляти з реакційного середовища і утилізувати, бо вони забруднюють атмосферу. Сушіння проміжних і кінцевого продуктів необхідно проводити у вакуумі, зберігання - у вакуум ексикаторах, що суттєво ускладнює проведення технологічного процесу. Слід відмітити, що ви хід кінцевого продукту приведено лише на останній стадії без урахування виходів проміжних продуктів на кожній технологічній стадії. Судячи з джерел інформації, спосіб не знайшов широкого практичного застосування. Відомий спосіб одержання 3-аміно-4,5,6,7тетрагідро-2Н-піразоло-[3,4-d]піримідин-4,6-діону [Н. Fujito, H. Mazume, J. Heterocycl. Chem., 28, 1039 (1991)] формули II 5 O 81738 NH2 HN NH N N H O II Спосіб одержання сполуки II реалізується за схемою: NH2CN H3C-S + H3C-S CS2 + SO 2(OCH3)2 NCN + K2CO 3 або KOH ДМСО NC H3COOC NCCH2COOCH3 S-CH3 K NCN 10%HCI O HN O O NH2 NH N N H N2H4*H2 O O CN основа NC HN N H S-CH3 H3COOC NCN S II На першій стадії змішують сірковуглець і ціанамід у метанолі, додають метанольний розчин гідроксиду калію краплями при температурі реакційної маси -2-0°С. При цій же температурі, постійно охолоджуючи розчин, суміш витримують 3 години, потім додають краплями диметилсульфат і реакційну масу залишають на 12 годин при кімнатній температурі. Осад N біс(метилтіо)метиленціанаміду, що утворився, відфільтровують, перекристалізовують із діізопропілового ефіру. Вихід цього продукту складає 53%. На другій стадії суміш N біс(метилтіо)метиленціанаміду, метилціанацетату, карбонату калію у співвідношенні 1:1,5:2 перемішують у диметилсульфоксиді при кімнатній температурі упродовж 4 годин; потім порціями виливають у 10% НСl при інтенсивному перемішуванні і охолодженні льодом. Осад, що випав, відфільтровують і перекристалізовують із метанолу. Одержують 6-ціан- b -метоксикарбонилa -метилтіоетилиденсечовину з т. пл. 203°С, вихід складає 93%. Одержану на другій стадії 6-ціан- b метоксикарбонил- a -метилтіоетилиденсечовину розчиняють у 10% NaOH при перемішуванні при кімнатній температурі упродовж 2 годин. Суміш нагрівають 10 хвилин при 70°С, а після охолодження підкислюють 10% НСl. Осад, що випав при цьому, відфільтровують, перекристалізовують із метанолу. Одержують 6метилтіоурацил-5-карбонітрил з виходом 80%. Т. пл. 307°С. На останній стадії суміш 6-метилтіоурацил-5карбонітрилу і гідразингідрату у воді нагрівають 1 годину. Надлишок гідразингідрату і воду видаляють випарюванням при зниженому тиску; залишок перекристалізовують із суміші бензолу з метанолом. Одержують 3-аміно-4,5,6,7-тетрагідро-2Н-піразоло[3,4-d]піримідин-4,6-діон з т. пл.>370°С, вихід складає 86%. 6 Сумарний вихід 3-аміно-4,5,6,7-тетрагідро-2Нпіразоло[3,4-d]піримідин-4,6-діону з урахуванням виходів на всі х технологічних стадіях складає 34%. До недоліків указаного способу одержання сполуки формули II слід віднести багатостадійність (4 стадії), тривалість (32-35 годин) процесу проведення синтезу і тривале витримування реакційної маси при низьких температурах, для чо го необхідно використовува ти низькотемпературні охолоджуючі агенти (льод, вуглекислоту, зріджений азот), що ускладнює проведення реакції і потребує уваги при роботі з ними. Недоліками способу є також необхідність перекристалізацій проміжних продуктів на кожній технологічній стадії і використання легколетких (сірковуглець), отруйних (диметилсульфат, метанол), легкозаймистих і вогненебезпечних речовин (бензол, метанол), що приводить до утворення шкідливих технологічних стоків, які не регенеруються і не утилізуються. Крім того, диметилсульфат - канцероген, який викликає захворювання шкіри, очей, органів дихання (смертельна концентрація пари складає 0,5мг/л при експозиції 10 хвилин). Диметилсульфоксид хімічна речовина, що легко дифундує через шкіряні покриви. В якості прототипу вибрано перший із наведених аналогів, як найбільш близький за технічною суттю. В основу винаходу поставлено задачу розробки простого і доступного способу одержання 3-аміно-5,7-диметил-4,5,6,7-тетрагідро2Н-піразо-ло[3,4-d]піримідин-4,6-діону, що дозволяє зменшити кількість технологічних стадій, тривалість синтезу, підвищити вихід кінцевого продукту, а також уникнути використання вогненебезпечних, отруйних реагентів. Рішення поставленої задачі забезпечується тим, що у способі одержання 3-аміно-5,7-диметил4,5,6,7-тетрагідро-2Н-піразоло[3,4-d]піримідин-4,6діону, що включає взаємодію 1,3-N,Nдиметилбарбітурової кислоти з хлороксидом фосфор у конденсацію одержаного продукту з гідразингідратом у розчиннику при кипінні, згідно винаходу, 1,3-N,N-диметилбарбітурову кислоту піддають взаємодії з формілюючою сумішшю хлороксиду фосфор у і диметилформаміду, взятих у співвідношенні 2,7:1,1М, послідовно видержують реакційну суміш 50-60 хвилин при кімнатній температурі 20-25°С, 50-60 хвилин - при 95±5°С і 50-60 хвилин - при 110±5°С, після чого перед конденсацією реакційну суміш піддають взаємодії з гідрохлоридом гідроксиламіну. У способі одержання 3-аміно-5,7-диметил4,5,6,7-тетрагідро-2Н-пір-азоло[3,4-d]піримідин4,6-діону склад формілюючої суміші експериментально було встановлено таким чином (на 1М 1,3-диметилбарбітурової кислоти беруть суміш хлороксиду фосфор у і диметилформаміду у співвідношенні 2,7:1,1М), щоб реакція формулювання пройшла повністю з максимальним виходом без додаткових затрат вихідних реактивів. При зміні співвідношення реагентів формілюючої суміші хлороксиду фосфору (1М) : 7 81738 диметилформамід (1М), реакція формілювання проходить не повністю, утворюються смолисті, важко ідентифіковані напівпродукти, із реакційної маси частково можна виділити і вихідні реагенти. Хлороксид фосфору в реакції формілювання використовується не тільки як одна із складових частин формілюючої суміші, але і як розчинник, середовище, в якому процес формілювання протікає найбільш благоприємно. У процесі синтезу було підібрано температурно-часовий режим реакції утворення 6хлор-5форміл-1,3-диметилурацилу. Так, взаємодія 1,3-N,N-диметилбарбітурової кислоти з формілюючою сумішшю упродовж 50-60 хвилин при кімнатній температурі дозволяє повністю провести реакцію формілювання з утворенням 5формілпохідного 1,3-диметилбарбітурової кислоти. При зменшенні часу реакції до 45 хвилин або зміні кількісного складу формілюючої суміші процес формілювання не проходить або проходить не повністю (див. табл. 1). При подальшому підвищенні температури до 95±5°С формільне похідне утворює з хлороксидом фосфор у "комплекс", при розкладанні якого відбувається реакція приєднання НСl за атомом вуглецю амідної С=О-групи у положенні 6-форміл1,3-диметилбарбітурової кислоти з утворенням відповідного хлоргідрину. На даній стадії реакції температура реакційної маси повинна складати не менше 90°С, інакше заміна атому хлору не відбувається. При підвищенні температури до 110°С спостерігається бурхливе скипання реакційної маси з виділенням НСl (див. табл.2). Видержка реакційної маси при температурі 95±5°С упродовж 50-60 хвилин повністю забезпечує проходження реакції з максимальним виходом цільового продукту. Подальше підвищення температури до 110±5°С і видержка при цій температурі упродовж 50-60 хвилин приводить до відщеплення (елімінування) води з утвореного хлоргідрина за рахунок водовіднімальних властивостей хлороксиду фосфору з утворенням 6-хлор-5форміл-1,3-диметил-урацилу. Підвищення температури реакційної маси вище 115°С не можливо, тому що температура кипіння РОСl3 складає 108°С. При зменшенні часу елімінування до 40 хвилин з видержкою реакційної маси при 110±5°С реакція відщеплення води проходить не до кінця, у реакційній масі виявляються напівпродукти, що не прореагували (див. табл. 2). Обробка 1,3-диметилбарбітурової кислоти указаним складом формілюючої суміші в оптимальному температурно-часовому режимі дозволяє прискорити реакцію утворення 6-хлор5форміл-1,3-диметилурацилу, який взаємодією з гідрохлоридом гідроксиламіну у тому ж реакційному реакторі дає 6-хлор-1,3диметилурацил-5-карбонітрил. У способі, що заявляється, виключається виділення проміжних продуктів, що приводить до значного скорочення тривалості процесу, зменшення стадій і одержання кінцевого продукту без застосування вогненебезпечних, отруйних, легколетких, подразнювальних речовин. Усі рідкі розчинники, 8 що використовуються у способі, що заявляється, розбавляються водою і утилізуються. Указані переваги способу, що заявляється, забезпечують ви хід кінцевого продукту 72-80%. Спосіб, що заявляється, складається із двох стадій і здійснюється за схемою: O H3C N O N CH3 O H 3C 1)PO CI 3/ ДМФА 2)NH 2OH*HCI O O O CN H 3C N 2H4*H 2O N N CH3 CI O NH 2 N NH N N CH 3 I На першій стадії одержують 6-хлорзаміщене 1,3-диметилурацил-5-карбонітрилу при обраному температурно - часовому режимі: шляхом формілювання 1,3-N,N-диметилбарбітурової кислоти сумішшю хлороксиду фосфору і диметилформаміду при кімнатній температурі протягом 50-60 хвилин, утворення хлоргідрину при температурі 95±5°С протягом 50-60 хвилин, елімінування (відщеплення води) протягом 50-60 хвилин при температурі 110±5°С з наступною взаємодією утвореного 6-хлор-5форміл-1,3диметилурацилу з гідрохлоридом гідроксиламіну. На другій стадії 6-хлор-1,3-Диметилурацил-5карбонітрил, одержаний на першій стадії, конденсують з гідразингідратом у спиртовому середовищі, процес проводять 1 годину до повного проходження реакції і утворення 3-аміно5,7-диметил-4,5,6,7-тетрагідро-2Н-піразоло[3,4d]піримідин-4,6-діону. Загальна тривалість технологічного процесу за способом, що заявляється, складає приблизно 6-7 годин. Вихід кінцевого продукту складає 7280%. У таблиці 1 показано вплив концентрації формілюючої суміші та температурно - часових характеристик на перебіг реакції формілювання на стадії утворення 6-хлор-5-форміл-1,3диметилурацилу. У таблиці 2 наведено обґрунтування температурно-часових характеристик при утворенні хлоргідрину та елімінуванні на стадії синтезу 6-хлор-5-форміл-1,3-диметилурацилу. У таблиці 3 представлено порівняльні характеристики способу, що заявляється, і способу-прототипу. Нижче наведено приклад конкретного виконання одержання 3-аміно-5,7-диметил-4,5,6,7тетрагідро-2Н-піразоло [3,4-d]піримідин-4,6-діону. Приклад. Одержання 3-аміно-5,7-диметил4,5,6,7-тетрагідро-2Н-пір-азоло[3,4-d]піримідин4,6-діону. У тригорлій колбі, що обладнана зворотнім холодильником і змішувачем, містять 250мл (2,7моль) хлороксиду фосфор у і при перемішуванні краплями додають 85мл (1,1 моль) диметилформаміду при температурі 20-25°С. Суміш видержують 30 хвилин, додають при інтенсивному перемішуванні 156г (1 моль) 1,3диметилбарбітурової кислоти і дають видержку при кімнатній температурі впродовж 60 хвилин. Після цього реакційну масу нагрівають 60 хвилин при 95°С і 60 хвилин при 115°С. Після закінчення 9 81738 видержки до реакційної суміші при 100°С додають 156г (2,0 моль) (порціями 1-2г) гідрохлоридом гідроксиламіну. Після закінчення додавання суміш при перемішуванні виливають до 5л холодної води; осад, що утворився, відфільтровують і сушать. Вихід 6-хлор-1,3-диметилурацил-5карбонітрилу 180г (90%). Тпл. 170-171°С. На другій стадії у круглодонну колбу із зворотнім холодильником поміщають 180г (0,9 моль) 6-хлор-1,3-диметилурацил-5-карбонітрилу і 90мл (1,8 моль) гідразингідрату в 1,5л етилового спирту. Суміш кип'ятять на водяній бані 1 годину, охолоджують і додають 1л води. Спирт відганяють на роторному випарнику і використовують у наступних синтезах. Осад, що випав, відфільтровують і перекристалізовують із оцтової кислоти. Вихідні дані: Вихід 72-80%, Тпл. 300°С. Елементний аналіз - знайдено %: N 35,90. C7H9N5O2. Обчислено %: N35,88. Структура 3-аміно-5,7-диметил-4,5,6,7тетрагідро-2Н-піразоло-[3,4-d]піримідин-4,6-діону підтверджена також спектральними даними. Спектри ядерного магнітного резонансу (ЯМР Н1) виміряно на спектрометрі VARIAN Mercury VX200 (200МГц) у розчинах дейтеродиметилсульфоксиду (ДМСО-dб ), внутрішній стандарт - тетраметилсилан; d (м. ч.): 11.57 (1Н, у.с, NH), 6.26 (2Н, у.с, NH2), 3.23 (3Н, с, СН3), 3.11 (3Н, с, СН3). Як видно з таблиць 1-3, спосіб, що заявляється, має низку суттєви х переваг у порівнянні зі способом-прототипом і дозволяє: - зменшити тривалість технологічного процесу до 6-7 годин за рахунок зменшення кількості стадій реакції до 2 (у способі - прототипі - 5); - підвищити вихід чистого кінцевого продукту реакції до 72-80% (у способі - прототипі указано лише вихід те хнічного продукту на кінцевій стадії 80% без урахування виходів на усі х те хнологічних стадіях); - забезпечити відсутність отруйних, токсичних, легкозаймистих речовин і лакриматорів, що робить спосіб доступним і технологічним в умовах лабораторії і виробництва; - значно зменшити кількість шкідливих стоків за рахунок регенерації і утилізації розчинника; - здешевити вартість кінцевого продукту за рахунок використання доступної і дешевої сировини, що випускаються вітчизняною промисловістю. Спосіб, що заявляється, знаходиться на стадії лабораторної розробки і може бути здійснений у виробничих умовах. 10 3 4 2,7 2,7 1,1 1,1 Етап утворення 6-хлор-5форміл-1,3диметилурацилу Утворення хлоргідрину 45 50-60 Температура реакці °С 50-60 95±5 50-60 85 50-60 110 40 50-60 50-60 95±5 110±5 95 50-60 125 40 Елімінування Час реакції, хвилин 110±5 Кількість стадій Стадії синтезу Спосіб, що 1. Синтез 6-хлор-1,3заявляється диметилурацил-5-карбонітрилу 2. Синтез 3-аміно-5,7-диметил4,5,6,7-тетрагідро-2Н-піразоло [3,4-d] піримідин-4,6-діону Спосіб - 1. Утворення диметилтіофосген прототип 2. Синтез солі N,Nдиметилфосгеніумхлориду 3. Синтез 1,3-диметил-6хлорурацилу 4. Синтез 1,3-диметил-6гідразиноурацилу 5. Синтез 3-N,N-диметиламіно5,7-диметил-4,5,6,7тетрагідро-2Н-піразоло[3,4d]піримідин-4,6-діону Таблиця 1 №№ Формілююча суміш на 1 моль 1,3диметилбарбітурової кислоти РОСl3, моль ДМФА, моль 20-25 15 Час реакції, хвилина Температура реакції, °C 1 2,7 1,1 50-60 20-25 2 1,0 1,0 50-60 20-25 Результат реакції Формілювання проходить повністю Формілювання проходить не повністю з утворенням Триваліст процесу година 2 6-7 5 26-28
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of 3-amino-5,7-dimethyl-4,5,6,7-tetrahydro-2н-pyrrazolo-[3,4-d]pyrimidine-4,6-dione
Автори англійськоюChernenko Vitalii Mykolaiovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюСпособ получения 3-амино-5,7-диметил-4,5,6,7-тетрагидро-2н-пиразоло[3,4-d]пиримидин-4,6-диона
Автори російськоюЧерненко Виталий Николаевич, Десенко Сергей Михайлович, Дэсэнко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 231/10, C07D 231/04, A61K 31/519, C07D 487/04
Мітки: спосіб, 3-аміно-5,7-диметил-4,5,6,7-тетрагідро-2н-піразоло[3,4-d]піримідин-4,6-діону, одержання
Код посилання
<a href="https://ua.patents.su/5-81738-sposib-oderzhannya-3-amino-57-dimetil-4567-tetragidro-2n-pirazolo34-dpirimidin-46-dionu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 3-аміно-5,7-диметил-4,5,6,7-тетрагідро-2н-піразоло[3,4-d]піримідин-4,6-діону</a>
Попередній патент: Спосіб та піч для одержання заліза прямим відновленням
Наступний патент: Протисудомний лікарський засіб на основі карбамазепіну та тіотриазоліну
Випадковий патент: Спосіб приготування біологічно активного муміє









