1н-індазол-3-карбоксамідні сполуки як інгібітори глікогенсинтаза-кінази 3-бета
Номер патенту: 112564
Опубліковано: 26.09.2016
Автори: Омбрато Розелла, Манчіні Франческа, Каццолла Нікола, Алісі Марія Алессандра, Драгоне Патріція, Мауджері Катеріна, Фурлотті Гвідо
Формула / Реферат
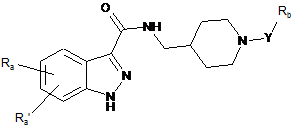
1. 1Н-індазол-3-карбоксамідні сполуки, що мають наступну загальну формулу (І):
 , (І)
, (І)
у якій
Ra та Ra’, що є однаковими або відрізняються один від іншого, являють собою атом водню; атом галогену; гідроксигрупу; С1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну та С1-С6алкоксигрупу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідроксигрупа, -NH2 та С1-С3алкоксигрупа; карбоциклічне або гетероциклічне кільце, аліфатичне або ароматичне, що включає від 3 до 12 членів, необов'язково заміщене одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідроксигрупа, C1-С6алкіл, С1-С6алкоксигрупа, -NR1R2, -C(O)OH, -C(O)OR1 та -C(O)NR1R2;
Y являє собою зв'язок, С1-С6алкільну, С2-С6алкенільну або С2-С6алкінільну групу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідроксигрупа, -NH2 та С1-С3алкоксигрупа;
Rb являє собою С1-С6алкоксигрупу; -С(О)ОН; -C(O)OR1; -NO2; -NHC(O)R1;
R1 та R2 незалежно являють собою атом водню, С1-С4алкільну групу, С2-С4алкенільну групу, С2-С4алкінільну групу та фенільну групу;
або їх солі приєднання з фармакологічно прийнятними органічними та неорганічними кислотами та основами.
2. 1Н-індазол-3-карбоксамідні сполуки за п. 1, у яких Ra та Ra', що є однаковими або відрізняються один від іншого, являють собою атом водню; атом галогену, вибраний з хлору, брому та йоду; гідроксигрупу; С1-С6алкільну та С1-С6алкоксигрупу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідроксигрупа, -NH2, або С1-С3алкоксигрупа; карбоциклічне або гетероциклічне кільце, насичене або ненасичене, що має від 4 до 10 членів, необов'язково заміщене одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідроксигрупа, С1-С6алкіл, С1-С6алкоксигрупа, -NR1R2, -C(O)OH, -C(O)OR1 та -C(O)NR1R2; та R1 та R2 незалежно являють собою атом водню, С1-С4алкільну групу, С2-С4алкенільну групу, С2-С4алкінільну групу та фенільну групу.
3. 1Н-індазол-3-карбоксамідні сполуки за п. 2, у яких Ra та Ra', що є однаковими або відрізняються один від іншого, являють собою атом галогену, вибраний з хлору або брому; гідроксигрупу; С1-С6алкільну групу; С1-С6алкоксигрупу або карбоциклічне або гетероциклічне кільце, насичене або ненасичене, що має від 5 до 6 членів, необов'язково заміщене одним або більшою кількістю замісників, вибраних з групи, що складається з таких як: галоген, гідроксигрупа, С1-С6алкіл, С1-С6алкоксигрупа, -NR1R2 та -СООН; та R1 та R2 незалежно являють собою атом водню, С1-С4алкільну групу, С2-С4алкенільну групу, С2-С4алкінільну групу та фенільну групу.
4. 1Н-індазол-3-карбоксамідні сполуки за п. 3, у яких Ra та Ra', що є однаковими або відрізняються один від іншого, являють собою атом брому, гідроксигрупу; С1-С3алкоксигрупу або ненасичене карбоциклічне або гетероциклічне кільце, що має 6 членів, необов'язково заміщене одним або двома замісниками, вибраними з групи, що складається з таких як: галоген, гідроксигрупа, С1-С3алкіл, С1-С3алкоксигрупа, -NR1R2 та -СООН; та R1 та R2 незалежно являють собою атом водню, С1-С4алкільну групу, С2-С4алкенільну групу, С2-С4алкінільну групу та фенільну групу.
5. 1H-індазол-3-карбоксамідні сполуки за будь-яким з попередніх пунктів, у яких Y являє собою зв'язок, С1-С6алкільну групу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідроксигрупа, -NH2 та С1-С3алкоксигрупа.
6. 1Н-індазол-3-карбоксамідні сполуки за п. 5, у яких Y являє собою С1-С6алкільну групу.
7. 1Н-індазол-3-карбоксамідні сполуки за п. 6, у яких Y являє собою С1-С3алкільну групу.
8. 1 Н-індазол-3-карбоксамідні сполуки за будь-яким з попередніх пунктів, у яких Rb являє собою С1-С6алкоксигрупу; -С(О)ОН; -C(O)OR1; -NHCOR1.
9. 1Н-індазол-3-карбоксамідні сполуки за п. 8, у яких Rb являє собою С1-С6алкоксигрупу; -С(О)ОН.
10. 1Н-індазол-3-карбоксамідні сполуки за п. 9, у яких Rb являє собою С1-С3алкоксигрупу, -С(О)ОН.
11. 1H-індазол-3-карбоксамідні сполуки за будь-яким з попередніх пунктів, у яких R1 та R2 незалежно являють собою С1-С3алкільну групу.
12. Застосування 1Н-індазол-3-карбоксамідних сполук, що мають наступну загальну формулу (І)
 , (I)
, (I)
у якій
Ra та Ra', що є однаковими або відрізняються один від іншого, являють собою атом водню; атом галогену; гідроксигрупу; С1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну та С1-С6алкоксигрупу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідроксигрупа, -NH2 та С1-С3алкоксигрупа; карбоциклічне або гетероциклічне кільце, аліфатичне або ароматичне, що включає від 3 до 12 членів, необов'язково заміщене одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідроксигрупа, С1-С6алкіл, С1-С6алкоксигрупа, -NR1R2, -C(O)OH, -C(O)OR1 та -C(O)NR1R2;
Y являє собою зв'язок, С1-С6алкільну, С2-С6алкенільну або С2-С6алкінільну групу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідроксигрупа, -NH2 та С1-С3алкоксигрупа;
Rb являє собою С1-С6алкоксигрупу; -С(О)ОН; -C(O)OR1; -NO2; -NHC(O)R1;
R1 та R2 незалежно являють собою атом водню, С1-С4алкільну групу, С2-С4алкенільну групу, С2-С4алкінільну групу та фенільну групу;
або їх солей приєднання з фармакологічно прийнятними органічними та неорганічними кислотами та основами;
для лікування захворювання, що виникає з неконтрольованої активації та/або надекспресії GSK-3b, вибраного з групи, що складається з таких як: (і) інсулінорезистентні розлади; (іі) нейродегенеративні захворювання; (ііі) розлади настрою; (iv) шизофренічні розлади; (v) ракові розлади; (vi) запалення, (vii) розлади, пов'язані із зловживанням психоактивними речовинами; (viii) епілептичні напади; та (іх) невропатичний біль.
13. Застосування 1Н-індазол-3-карбоксаміду за п. 12, у якому зазначені інсулінорезистентні розлади вибирають з групи, що складається з таких як: діабет типу 2, синдром X, ожиріння та синдром полікістозу яєчників.
14. Застосування 1Н-індазол-3-карбоксаміду за п. 12, у якому зазначені нейродегенеративні захворювання вибирають з групи, що складається з таких як: хвороба Паркінсона, хвороба Альцгеймера, хвороба Гентінгтона та спінальні нейродегенеративні розлади.
15. Застосування 1Н-індазол-3-карбоксаміду за п. 14, у якому зазначені спінальні нейродегенеративні розлади вибирають з групи, що складається з таких як: аміотрофічний бічний склероз, розсіяний склероз, спінальна м'язова атрофія та нейродегенерація через ураження спинного мозку.
16. Застосування 1Н-індазол-3-карбоксаміду за п. 12, у якому зазначені розлади настрою вибирають з групи, що складається з таких як: біполярні розлади та депресивні розлади.
17. Застосування 1Н-індазол-3-карбоксаміду за п. 16, у якому зазначені біполярні розлади вибирають з групи, що складається з таких як: біполярний І, біполярний II, циклотимія та неспецифічний біполярний розлад (BD-NOS).
18. Застосування 1Н-індазол-3-карбоксаміду за п. 16, у якому зазначені депресивні розлади вибирають з групи, що складається з таких як: глибокий депресивний розлад (MDD), атипова депресія (AD), меланхолічна депресія, психотична глибока депресія (PMD), кататонічна депресія, післяпологова депресія (PPD), сезонний афективний розлад (SAD), дистимія та неспецифічний депресивний розлад (DD-NOS).
19. Застосування 1Н-індазол-3-карбоксаміду за п. 12, у якому зазначені розлади, пов'язані із зловживанням психоактивними речовинами, вибирають з групи розладів, пов'язаних із зловживанням психостимулянтами.
20. Застосування 1Н-індазол-3-карбоксаміду за п. 12, у якому зазначені шизофренічні розлади вибирають з групи, що складається з таких як: параноїдальна шизофренія, гебефренічна шизофренія, кататонічна шизофренія, звичайна шизофренія, залишкова шизофренія та недиференційована шизофренія.
21. Застосування 1Н-індазол-3-карбоксаміду за п. 12, у якому зазначені ракові розлади вибирають з групи, що складається з таких як: рак передміхурової залози, підшлункової залози, яєчників та рак ободової та прямої кишки та MLL-асоційована лейкемія.
22. Спосіб лікування патологічного стану, що виникає з неконтрольованої активації та/або надекспресії GSK-3b, вибраного з групи, що складається з таких як: (і) інсулінорезистентні розлади; (іі) нейродегенеративні захворювання; (ііі) розлади настрою; (iv) шизофренічні розлади; (v) ракові розлади; (vi) запалення, (vii) розлади, пов'язані із зловживанням психоактивними речовинами; (viii) епілептичні напади; та (іх) невропатичний біль, шляхом введення людині, яка потребує такого лікування, ефективної кількості 1Н-індазол-3-карбоксаміду, що має наступну загальну формулу (І):
 , (І)
, (І)
у якій
Ra та Ra', що є однаковими або відрізняються один від іншого, являють собою атом водню; атом галогену; гідроксигрупу; С1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну та С1-С6алкоксигрупу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідроксигрупа, -NH2 та С1-С3алкоксигрупа; карбоциклічне або гетероциклічне кільце, аліфатичне або ароматичне, що включає від 3 до 12 членів, необов'язково заміщене одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідроксигрупа, С1-С6алкіл, С1-С6алкоксигрупа, -NR1R2, -C(O)OH, -C(O)OR1 та -C(O)NR1R2;
Y являє собою зв'язок, С1-С6алкільну, С2-С6алкенільну або С2-С6алкінільну групу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідроксигрупа, -NH2 та С1-С3алкоксигрупа;
Rb являє собою С1-С6алкоксигрупу; -С(О)ОН; -C(O)OR1; -NO2; -NHC(O)R1;
R1 та R2 незалежно являють собою атом водню, С1-С4алкільну групу, С2-С4алкенільну групу, С2-С4алкінільну групу та фенільну групу;
або його солей приєднання з фармакологічно прийнятними органічними та неорганічними кислотами та основами.
23. Фармацевтична композиція, що включає ефективну кількість щонайменше однієї сполуки формули (І) за будь-яким з попередніх пп. 1-11, її солі з фармакологічно прийнятною органічною або неорганічною кислотою або основою та щонайменше один інертний фармакологічно прийнятний ексципієнт.
Текст
Реферат: Даний винахід стосується 1Н-індазол-3-карбоксамідних сполук як інгібіторів глікогенсинтазакінази 3-бета (GSK-3) та їх застосування у лікуванні GSK-3-пов'язаних розладів, таких як, наприклад, (і) інсулінорезистентні розлади; (іі) нейродегенеративні захворювання; (ііі) розлади настрою; (iv) шизофренічні розлади; (v) ракові розлади; (vi) запалення, (vii) розлади, пов'язані із зловживанням психоактивними речовинами; (viii) епілептичні напади; та (іх) невропатичний біль. R b O N H R a N R' a N H NY UA 112564 C2 (12) UA 112564 C2 UA 112564 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ВИНАХОДУ Даний винахід відноситься до 1H-індазол-3-карбоксамідних сполук, що діють як інгібітори глікоген-синтаза-кінази 3 бета (GSK-3β) та до їх застосування у лікуванні GSK-3β-зв'язаних розладів, таких як: (i) інсуліно-резистентні розлади; (ii) нейродегенеративні захворювання; (iii) розлади настрою; (iv) шизофренічні розлади; (v) ракові розлади; (vi) запалення, (vii) розлади, пов'язані із зловживанням психоактивними речовинами; (viii) епілептичні напади; та (ix) невропатичний біль. РІВЕНЬ ТЕХНІКИ Протеїнкінази складають велике сімейство структурно зв'язаних ферментів, які переносять фосфатні групи з високоенергетичних донорських молекул (таких як аденозин- трифосфат, АТФ) до специфічних субстратів, звичайно білків. Після фосфорилювання, субстрат піддається функціональній зміні, шляхом якої кінази можуть модулювати різні біологічні функції. Загалом, протеїнкінази можуть бути розділені на декілька груп у відповідності із субстратом, який фосфорилюється. Наприклад, серін/треонін кіназа фосфорилює гідроксильну групу на бічному ланцюзі серінової або треонінової амінокислоти. Глікоген-синтаза-кінази 3 (GSK-3) являють собою конститутивно активні багатофункціональні ферменти, досить нещодавно відкриті, що належать до серін/треонін кіназної групи. Людські GSK-3 кодуються двома різними та незалежними генами, які ведуть до GSK-3α та GSK-3β білків, з молекулярними масами приблизно 51 та 47 кДа, відповідно. Дві ізоформи мають майже ідентичні послідовності у їх кіназних доменах, у той час як зовні кіназного домену, їх послідовності суттєво відрізняються (Benedetti et al., Neuroscience Letters, 2004, 368, 123-126). GSK-3α являє собою багатофункціональну протеїн-серін-кіназу та GSK-3β являє собою серінтреонін-кіназу. Було знайдено, що GSK-3β широко експресуються у всіх тканинах, з широко розповсюдженою експресією у мозку дорослих, що передбачає фундаментальну роль у нейрональних сигнальних шляхах (Grimes and Jope, Progress in Neurobiology, 2001, 65, 391-426). Інтерес у глікоген-синтаза-кіназах 3 виникає з їх ролі у різних фізіологічних шляхах, таких як, наприклад, метаболізм, клітинний цикл, генна експресія, ембріональний розвиток, онкогенез та нейропротекція (Geetha et al., British Journal Pharmacology, 2009, 156, 885-898). GSK-3β спочатку була ідентифікована завдяки її ролі у регулюванні глікоген-синтази для перетворення глюкози у глікоген (Embi et al., Eur J Biochem, 1980, 107, 519-527). GSK-3β показала високий ступінь специфічності до глікоген-синтази. Діабет типу 2 був першим хворобливим станом, пов'язаним з GSK-3β, завдяки її негативному регулюванню деяких аспектів інсулінового сигнального шляху. У зазначеному шляху 3-фосфоінозитид-залежна протеїн-кіназа 1 (PDK-1) активує PKB, який у свою чергу інактивує GSK-3β. Ця інактивація GSK-3β веде до дефосфорилювання та активації глікогенсинтази, що сприяє синтезу глікогену (Cohen et al., FEBS Lett., 1997, 410, 3-10). Більше того, селективні інгібітори GSK-3β, як очікується, посилюють інсулінове сигналювання у скелетних м'язах перед-діабетичних інсулін-резистентних щурів, таким чином роблячи GSK-3β привабливою ціллю для лікування інсулінової резистентності у скелетних м'язах у переддіабетичному стані (Dokken et al., Am J. Physiol. Endocrinol. Metab., 2005, 288, E1188-E1194). Також знайдено, що GSK-3β є потенційною лікарською ціллю у інших патологічних станах через інсуліно-резистентні розлади, такі як синдром X, ожиріння та синдром полікистозу яєчників (Ring DB et al., Diabetes, 2003, 52: 588-595). Було знайдено, що GSK-3β залучена у аномальне фосфорилювання патологічного тау (tau) у хворобі Альцгеймера (Hanger et al., Neurosci. Lett., 1992, 147, 58-62; Mazanetz and Fischer, Nat Rev Drug Discov., 2007, 6, 464-479; Hong and Lee, J. Biol. Chem., 1997, 272, 19547-19553). Більше того, доведено, що рання активація GSK-3β, спричинена аполіпопротеїном ApoE4 та βамілоїдом, могла б привести до апоптозу та тау гіперфосфорилювання (Cedazo-Minguez et al., Journal of Neurochemistry, 2003, 87, 1152-1164). Серед інших аспектів хвороби Альцгеймера, було повідомлене про значимість активації GSK-3β на молекулярному рівні (Hernandez and Avila, FEBS Letters, 2008, 582, 3848-3854). Більше того, було продемонстровано, що GSK-3β залучена у генезис та підтримання нейродегенеративних змін, пов'язаних з хворобоюПаркінсона (Duka T. et al., The FASEB Journal, 2009; 23, 2820-2830). Відповідно до цих експериментальних спостережень, інгібітори GSK-3β можуть знайти застосування у лікуванні невропатологічних наслідків та когнітивного дефіциту та дефіциту уваги, пов'язаних з тауопатіями; хвороби Альцгеймера; хвороби Паркінсона; хвороби Гентінгтона (залучення GSK-3β у такі дефіцити та захворювання розкрите у Meijer L. et al., 1 UA 112564 C2 5 10 15 20 25 30 35 40 45 50 55 60 TRENDS Pharm Sci, 2004; 25, 471-480); деменції, такої як, не обмежуючись наведеними, судинна деменція, післятравматична деменція, деменція, спричинена менінгітом та подібних; гострого інсульту; травматичних уражень; цереброваскулярних інсультів; травми головного мозку та спинного мозку; периферичних невропатій; ретинопатій та глаукоми (залучення GSK3β у такі стани розкрите у WO 2010/109005). Лікування спінальних нейродегенеративних розладів, таких як бічний аміотрофічний склероз, розсіяний склероз, спінальна м'язова атрофія та нейродегенерація через ураження спинного мозку, як також було виявлене у деяких дослідженнях, пов'язане з інгібуванням GSK3β, таких як, наприклад, у Calderó J. et al., "Lithium prevents excitotoxic cell death of motoneurons in organotypic slice cultures of spinal cord", Neuroscience. 2010 Feb 17;165(4):1353-69, Léger B. et al., "Atrogin-1, MuRF1, and FoXO, as well as phosphorylated GSK-3beta and 4E-BP1 are reduced in skeletal muscle of chronic spinal cord-injured patients", Muscle Nerve, 2009 Jul; 40(1):69-78, та Galimberti D. et al., "GSK3β genetic variability in patients with Multiple Sclerosis", Neurosci Lett. 2011 Jun 15; 497(1):46-8. Крім того, GSK-3β пов'язана з розладами настрою, такими як біполярні розлади, депресія та шизофренія. Інгібування GSK-3β може бути важливою терапевтичною ціллю стабілізаторів настрою, та регулювання GSK-3β може бути залучене у терапевтичні ефекти інших лікарських засобів, що використовуються у психіатрії. Дисрегульована GSK-3β у розладі настрою, біполярному розладі, депресії та шизофренії могла мати множинні ефекти, які могли ослабляти нейрональну пластичність, такі як модулювання нейрональної архітектури, нейрогенез, генна експресія та здатність нейронів відповідати на стресові, потенційно летальні стани (Jope and Roh, Curr. Drug Targets, 2006, 7, 1421-1434). Роль GSK-3β у розладі настрою висвітлена дослідженням літію та вальпроату (Chen et al., J. Neurochem., 1999, 72, 1327-1330; Klein and Melton, Proc. Natl. Acad. Sci. USA, 1996, 93, 84558459), обидва з яких є інгібіторами GSK-3β та використовуються для лікування розладів настрою. Також існують повідомлення з генетичної області, що підтримують роль GSK-3β у хворобливій фізіології біполярного розладу (Gould, Expert. Opin. Ther. Targets, 2006, 10, 377392). Повідомлялося про зниження AKT1 білкових рівнів та їх фосфорилювання GSK-3β при Серіні-9 у периферичних лімфоцитах та мізках індивідуумів з шизофренією. Відповідно, ця знахідка підтримує свідчення того, що зміни у AKT1-GSK-3β сигналюванні роблять свій внесок у патогенез шизофренії (Emamian et al., Nat Genet, 2004, 36, 131-137). Крім того, роль GSK-3β у раку є загально визнаним явищем. Потенціал невеликих молекул, які інгібують GSK-3β, доведений для деяких специфічних лікувань раку (Jia Luo, Cancer Letters, 2009, 273, 194-200). GSK-3β експресія та активація пов'язані з прогресування раку передміхурової залози (Rinnab et al., Neoplasia, 2008, 10, 624633) та інгібування GSK3b також запропоноване як специфічна ціль для раку підшлункової залози (Garcea et al., Current Cancer Drug Targets, 2007, 7, 209-215) та раку яєчників (Qi Cao et al., Cell Research, 2006, 16 671-677). Сильне інгібування GSK-3β у раку клітин ободової та прямої кишки активує p53-залежний апоптоз та антагонізує ріст пухлини (Ghosh et al., Clin Cancer Res 2005, 11, 4580-4588). Визначення функціональної ролі GSK-3β у MLL-асоційованій лейкемії дає висновок, що GSK-3β інгібування може бути багатообіцяючою терапією, яка є селективною для трансформованих клітин, які залежать від HOX надекспресування (Birch et al., Cancer Cell, 2010, 17, 529-531). GSK-3β залучена у численні запальні сигнальні шляхи, наприклад, серед інших GSK-3β інгібування, як показано, спричиняє секрецію протизапального цитокіну IL-10. У відповідності з цією знахідкою, GSK-3β інгібітори могли б бути корисними у регулюванні пригнічення запалення (G. Klamer et al., Current Medicinal Chemistry, 2010, 17(26), 2873-2281, Wang et al., Cytokine, 2010, 53, 130-140). GSK-3β інгібування, як також показано, пом'якшують викликану кокаїном поведінку у мишей. Введення кокаїну мишам, при попередньому лікуванні інгібітором GSK-3β, показало, що фармакологічне інгібування GSK3 зменшувало як гострі поведінкові реакції на кокаїн, так і тривалі нейроадаптації, викликані повторним введення кокаїну (Cocaine-induced hyperactivity and sensitization are dependent on GSK3, Miller JS et al. Neuropharmacology. 2009 Jun; 56(8):111623, Epub 2009 Mar 27). Роль GSK-3β у розвитку деяких форм епілептичних нападів продемонстрована у деяких дослідженнях, які роблять висновок про те, що інгібування GSK-3β може бути шляхом для лікування епілепсії (Novel glycogen synthase kinase 3 and ubiquitination pathways in progressive 2 UA 112564 C2 5 10 15 20 25 30 35 40 45 myoclonus epilepsy, Lohi H et al., Hum Mol Genet. 2005 Sep 15;14(18):2727-36 та Hyperphosphorylation and aggregation of Tau in laforin-deficient mice, an animal model for Lafora disease, Puri R et al., J Biol Chem. 2009 Aug 21;284(34):22657-63). Взаємозв'язок між GSK-3β інгібуванням та лікуванням невропатичного болю продемонстрований у Mazzardo-Martins L. et al., "Glycogen synthase kinase 3-specific inhibitor ARA014418 decreases neuropathic pain in mice: evidence for the mechanisms of action", Neuroscience. 2012 Dec 13; 226, та Xiaoping Gu et al., "The Role of Akt/GSK3β Signaling Pathway in Neuropathic Pain in Mice", Poster A525, Anesthesiology 2012 October 13-17, 2012 Washington. Огляд стосовно GSK-3β, її функцій, її терапевтичного потенціалу та її можливих інгібіторів представлений у "GSK-3β: role in therapeutic landscape and development of modulators" (S. Phukan et al., British Journal of Pharmacology (2010), 160, 1-19). WO 2004/014864 розкриває 1H-індазол-3-карбоксамідні сполуки як інгібітори селективних циклін-залежних кіназ (CDK). Такі сполуки, як визначено, є корисними у лікуванні раку через механізм, опосередкований CDK2, та нейродегенеративних захворювань, зокрема хвороби Альцгеймера, через механізм, опосередкований CDK5, та як противірусний та протигрибковий засіб, через механізм, опосередкований CDK7, CDK8 та CDK9. Циклін-залежні кінази (CDK) являють собою серін/треонін кінази, спочатку виявлені за їх роль у регулюванні клітинного циклу. CDK є також залученими у регулювання транскрипції, мРНК процесинг та диференціацію нервових клітин. Такі кінази активуються тільки після їх взаємодії та зв'язування з регуляторними субодиницями, а саме циклінами. Більше того, 1H-індазол-3-карбоксамідні сполуки також описані як знеболюючі засоби у лікуванні хронічного та невропатичного болю (дивись, наприклад, WO 2004/074275 та WO 2004/101548) та як антагоністи 5-HT4 рецептору, корисні у лікуванні шлунково-кишкових розладів, розладів центральної нервової системи та серцево-судинних розладів (дивись, наприклад, WO 1994/10174). КОРОТКИЙ ОПИС ВИНАХОДУ Так як тільки нещодавно GSK-3β було відкрито як фармакологічну ціль, існує велика необхідність у пошуку сполук, які селективно інгібують GSK-3β. Заявник неочікувано виявив нові 1H-індазол-3-карбоксамідні сполуки відповідно до наступної формули (I). Заявник неочікувано виявив, що зазначені нові сполуки формули (I) здатні інгібувати GSK-3β та мають дуже високу афінність до GSK-3β у порівнянні з іншими кіназами. Таким чином, зазначені сполуки здатні селективно інгібувати GSK-3β. Відповідно, сполуки у відповідності з даним винаходом є корисними для лікування патологічних станів, що виникають з неконтрольованої активації та/або надекспресії GSK-3β, вибраних з групи, що включають (i) інсуліно-резистентні розлади, такі як діабет типу 2, синдром X, ожиріння та синдром полікистозу яєчників; (ii) нейродегенеративні захворювання, такі як хвороба Паркінсона, хвороба Альцгеймера, хвороба Гентінгтона та спінальні нейродегенеративні розлади;; (iii) розлади настрою, такі як біполярні розлади та депресивні розлади; (iv) шизофренічні розлади; (v) ракові розлади, такі як рак передміхурової залози, підшлункової залози, яєчників та рак ободової та прямої кишки та MLL-асоційована лейкемія; (vi) запалення; (vii) розлади, пов'язані із зловживанням психоактивними речовинами; (viii) епілептичні напади; та (ix) невропатичний біль. Далі, у першому аспекті, даний винахід відноситься до 1H-індазол-3-карбоксамідних сполук, що мають наступну загальну формулу (I) Rb O NH N Y Ra N Ra' 50 N H (I) у якій Ra та Raʼ, що є однаковими або відрізняються один від іншого, являють собою атом водню; атом галогену; гідрокси групу; C1-C6 алкільну, C2-C6 алкенільну, C2-C6 алкінільну та C1-C6 алкокси групу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідрокси група, -NH2 та C1-C3 алкокси група; карбоциклічне або гетероциклічне кільце, аліфатичне або ароматичне, що включає від 3 до 12 членів, 3 UA 112564 C2 5 10 необов'язково заміщене одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідрокси група, C1-C6 алкіл, C1-C6 алкокси група, -NR1R2, -C(O)OH, -C(O)OR1 та C(O)NR1R2; Y являє собою зв'язок, C1-C6 алкільну, C2-C6 алкенільну або C2-C6 алкінільну групу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідрокси група, -NH2, та C1-C3 алкокси група; Rb являє собою C1-C6 алкокси групу; -C(O)OH; -C(O)OR1; -NO2; -NHC(O)R1; R1 та R2 незалежно являють собою атом водню, C1-C4 алкільну групу, C2-C4 алкенільну групу, C2-C4 алкінільну групу, та фенільну групу; та їх солей приєднання з фармакологічно прийнятними органічними та неорганічними кислотами та основами. У другому аспекті, даний винахід відноситься до застосування 1H-індазол-3-карбоксамідних сполук, що мають наступну загальну формулу (I) Rb O NH N Y Ra N Ra' 15 20 25 30 35 40 45 50 N H (I) у якій Ra та Raʼ, що є однаковими або відрізняються один від іншого, являють собою атом водню; атом галогену; гідрокси групу; C1-C6 алкільну, C2-C6 алкенільну, C2-C6 алкінільну та C1-C6 алкокси групу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідрокси група, -NH2 та C1-C3 алкокси група; карбоциклічне або гетероциклічне кільце, аліфатичне або ароматичне, що включає від 3 до 12 членів, необов'язково заміщене одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідрокси група, C1-C6 алкіл, C1-C6 алкокси група, -NR1R2, -C(O)OH, -C(O)OR1 та C(O)NR1R2; Y являє собою зв'язок, C1-C6 алкільну, C2-C6 алкенільну або C2-C6 алкінільну групу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідрокси група, -NH2 та C1-C3 алкокси група; Rb являє собою C1-C6 алкокси групу; -C(O)OH; -C(O)OR1; -NO2; -NHC(O)R1; R1 та R2 незалежно являють собою атом водню, C1-C4 алкільну групу, C2-C4 алкенільну групу, C2-C4 алкінільну групу та фенільну групу; та їх солей приєднання з фармакологічно прийнятними органічними та неорганічними кислотами та основами; для лікування захворювання, що виникає з неконтрольованої активації та/або надекспресії GSK-3β, вибраних з групи, що складається з таких як: (i) інсуліно-резистентні розлади, такі як діабет типу 2, синдром X, ожиріння та синдром полікистозу яєчників; (ii) нейродегенеративні захворювання, такі як хвороба Паркінсона, хвороба Альцгеймера, хвороба Гентінгтона та спінальні нейродегенеративні розлади; (iii) розлади настрою, такі як біполярні розлади та депресивні розлади; (iv) шизофренічні розлади; (v) ракові розлади, такі як рак передміхурової залози, підшлункової залози, яєчників та рак ободової та прямої кишки та MLL-асоційована лейкемія; (vi) запалення; (vii) розлади, пов'язані із зловживанням психоактивними речовинами; (viii) епілептичні напади; та (ix) невропатичний біль. У додатковому аспекті, даний винахід відноситься до способу лікування патологічного стану, що виникає з неконтрольованої активації та/або надекспресії GSK-3β, вибраного з групи, що складається з таких як: (i) інсуліно-резистентні розлади, такі як діабет типу 2, синдром X, ожиріння та синдром полікистозу яєчників; (ii) нейродегенеративні захворювання, такі як хвороба Паркінсона, хвороба Альцгеймера, хвороба Гентінгтона та спінальні нейродегенеративні розлади; (iii) розлади настрою, такі як біполярні розлади та депресивні розлади; (iv) шизофренічні розлади; (v) ракові розлади, такі як рак передміхурової залози, підшлункової залози, яєчників та рак ободової та прямої кишки та MLL-асоційована лейкемія; (vi) запалення; (vii) розлади, пов'язані із зловживанням психоактивними речовинами; (viii) епілептичні напади; та (ix) невропатичний біль, шляхом введення людині, яка потребує такого лікування, ефективної кількості 1H-індазол-3-карбоксаміду, що має наступну загальну формулу (I) 4 UA 112564 C2 Rb O NH N Y Ra N Ra' 5 10 15 20 25 30 35 40 45 50 N H (I) у якій Ra та Raʼ, що є однаковими або відрізняються один від іншого, являють собою атом водню; атом галогену; гідрокси групу; C1-C6 алкільну, C2-C6 алкенільну, C2-C6 алкінільну та C1-C6 алкокси групу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідрокси група, -NH2, та C1-C3 алкокси група; карбоциклічне або гетероциклічне кільце, аліфатичне або ароматичне, що включає від 3 до 12 членів, необов'язково заміщене одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідрокси група, C1-C6 алкіл, C1-C6 алкокси група, -NR1R2, -C(O)OH, -C(O)OR1 та C(O)NR1R2; Y являє собою зв'язок, C1-C6 алкільну, C2-C6 алкенільну або C2-C6 алкінільну групу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідрокси група, -NH2 та C1-C3 алкокси група; Rb являє собою C1-C6 алкокси групу; -C(O)OH; -C(O)OR1; -NO2; -NHC(O)R1; R1 та R2 незалежно являють собою атом водню, C1-C4 алкільну групу, C2-C4 алкенільну групу, C2-C4 алкінільну групу та фенільну групу; та його солей приєднання з фармакологічно прийнятними органічними та неорганічними кислотами та основами. Даний винахід також включає проліки, стереоізомери та енантіомери сполук формули (I) описаних вище. ДЕТАЛЬНИЙ ОПИС ДАНОГО ВИНАХОДУ По всьому даному опису та наступним пунктам формули винаходу, "C 1-6 алкіл", як передбачається, показує лінійну або розгалужену алкільну групу, що має від 1 до 6 атомів вуглецю, таку як метил, етил, пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, нпентил, втор-пентил, 3-пентил, ізо-пентил, нео-пентил, н-гексил, втор-гексил та нео-гексил. По всьому даному опису та наступним пунктам формули винаходу, "C1-4 алкіл", як передбачається, показує лінійну або розгалужену алкільну групу, що має від 1 до 4 атомів вуглецю, таку як метил, етил, пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил та трет-бутил. По всьому даному опису та наступним пунктам формули винаходу, "C1-3 алкіл", як передбачається, показує лінійну або розгалужену алкільну групу, що має від 1 до 3 атомів вуглецю, таку як метил, етил, пропіл та ізопропіл. По всьому даному опису та наступним пунктам формули винаходу, "C 2-6 алкеніл", як передбачається, показує лінійну або розгалужену алкільну групу, що має від 2 до 6 атомів вуглецю та щонайменше один подвійний зв'язок, таку як етеніл (вініл), 1-пропеніл, 2-пропеніл (аліл), ізопропеніл, бутеніл, пентеніл та гексеніл. По всьому даному опису та наступним пунктам формули винаходу, "C 2-4 алкеніл", як передбачається, показує лінійну або розгалужену алкільну групу, що має від 2 до 4 атомів вуглецю та щонайменше один подвійний зв'язок, таку як етеніл (вініл), 1-пропеніл, 2-пропеніл (аліл), ізопропеніл та бутеніл. По всьому даному опису та наступним пунктам формули винаходу, "C 2-6 алкініл", як передбачається, показує лінійну або розгалужену алкільну групу, що має від 2 до 6 атомів вуглецю та щонайменше один потрійний зв'язок, таку як етиніл, 1-пропініл, 2-пропініл (пропаргіл), бутиніл, пентиніл та гексиніл. По всьому даному опису та наступним пунктам формули винаходу, "C 2-4 алкініл", як передбачається, показує лінійну або розгалужену алкільну групу, що має від 2 до 4 атомів вуглецю та щонайменше один потрійний зв'язок, таку як етиніл, 1-пропініл, 2-пропініл (пропаргіл) та бутиніл. По всьому даному опису та наступним пунктам формули винаходу, "C 1-6 алкокси", як передбачається, показує лінійну або розгалужену алкокси групу, що має від 1 до 6 атомів вуглецю, таку як метокси, етокси, н-пропокси, ізо-пропокси, н-бутокси, трет-бутокси, н-пентокси, втор-пентокси, ізопентокси та н-езилокси група. По всьому даному опису та наступним пунктам формули винаходу, "C 1-3 алкокси", як передбачається, показує лінійну або розгалужену алкокси групу, що має від 1 до 3 атомів вуглецю, таку як метокси, етокси, н-пропокси та ізо-пропокси група. 5 UA 112564 C2 5 10 15 20 25 30 35 40 45 50 55 60 У відповідності з кращим варіантом втілення даного винаходу, значення R a, Raʼ, Rb та Y формули (I), представленої вище, розкриті у цьому описі нижче. Переважно, Ra та Raʼ, що є однаковими або відрізняються один від іншого, являють собою атом водню; атом галогену, вибраний з хлору, брому та йоду; C 1-C6 алкільну та C1-C6 алкокси групу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідрокси група, -NH2, або C1-C3 алкокси група; карбоциклічне або гетероциклічне кільце, аліфатичне або ароматичне, що має від 4 до 10 членів, необов'язково заміщене одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідрокси група, C1-C6 алкіл, C1-C6 алкокси група, -NR1R2, -C(O)OH, -C(O)OR1 та C(O)NR1R2. Більш переважно, Ra та Raʼ, що є однаковими або відрізняються один від іншого, являють собою атом галогену, вибраний з хлору та брому; гідрокси групу; C 1-C6 алкільну групу; C1-C6 алкокси групу; або карбоциклічне або гетероциклічне кільце, аліфатичне або ароматичне, що має від 5 до 6 членів, необов'язково заміщене одним або більшою кількістю замісників, вибраних з групи, що складається з таких як: галоген, гідрокси група, C 1-C6 алкіл, C1-C6 алкокси група, -NR1R2 та -C(O)OH. Головним чином, зазначене карбоциклічне або гетероциклічне кільце, аліфатичне або ароматичне, що має 5 або 6 членів, вибирають з таких як: феніл, піридин, піримідин, піразин, піридазин, пірол, фуран, тіофен, оксазол, ізоксазол, тіазол, ізотіазол, 2H-піран, циклогексил, циклопентил, піперидин, піперазин. Навіть більш переважно, Ra та Raʼ, що є однаковими або відрізняються один від іншого, являють собою атом брому; гідрокси групу; C1-C3 алкокси групу; або ароматичне карбоциклічне або гетероциклічне кільце, що має 6 членів, необов'язково заміщене одним або двома замісниками, вибраними з групи, що складається з таких як: галоген, гідрокси група, C1-C3 алкіл, C1-C3 алкокси група, -NR1R2 та –C(O)OH. У кращому варіанті втілення, зазначене карбоциклічне або гетероциклічне кільце, аліфатичне або ароматичне, що має 6 членів, вибирають з таких як: феніл, піридин, піримідин, піразин, піридазин, 2H-піран, циклогексил, піперидин, піперазин. У навіть більш кращому варіанті втілення, зазначене карбоциклічне або гетероциклічне кільце, аліфатичне або ароматичне, що має 6 членів, вибирають з таких як: феніл, піридин, піримідин, 2H-піран, циклогексил. У навіть більш кращому варіанті втілення, зазначене карбоциклічне або гетероциклічне кільце, аліфатичне або ароматичне, що має 5 членів, вибирають з таких як: оксазол та ізоксазол. Переважно, Y являє собою зв'язок, C1-C6 алкільну групу, необов'язково заміщену одним або більшою кількістю замісників, вибраних з групи, що включає такі як: галоген, гідрокси група, NH2, та C1-C3 алкокси група. Більш переважно, Y являє собою C1-C6 алкільну групу. Навіть більш переважно, Y являє собою C1-C3 алкільну групу. Переважно, Rb являє собою C1-C6 алкокси групу; -C(O)OH; -C(O)OR1 або -NHCOR1. Більш переважно, Rb являє собою C1-C6 алкокси групу або -C(O)OH. Навіть більш переважно, Rb являє собою C1-C3 алкокси групу або -C(O)OH. Переважно, R1 та R2 незалежно являють собою атом водню, C1-C4 алкільну групу або фенільну групу. Більш переважно, R1 та R2 незалежно являють собою C1-C3 алкільну групу. Навіть більш переважно, R1 та R2 обидва являють собою метильну групу. Сполуки у відповідності з даним винаходом переважно використовують як солі з фармакологічно прийнятними органічними та неорганічними кислотами або основами. Переважно, фармакологічно прийнятні органічні кислоти вибирають з групи, що складається з таких як: щавлева, малеїнова, метансульфонова, паратолуолсульфонова, бурштинова, лимонна, яблучна, винна та молочна кислота. Переважно, фармакологічно прийнятні органічні основи вибирають з групи, що складається з таких як: трометамін, лізин, аргінін, гліцин, аланін та етаноламін. Переважно, фармакологічно прийнятні неорганічні кислоти вибирають з групи, що складається з таких як: соляна, бромистоводнева, фосфорна та сірчана кислота. Переважно, фармакологічно прийнятні неорганічні основи вибирають з групи, що складається з таких як: гідроксид або карбонат лужного або лужноземельного металів, таких як натрій, калій та кальцій. Даний винахід також включає проліки, стереоізомери та енантіомери сполук формули (I), описаних вище. 6 UA 112564 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як використано у цьому описі, термін "проліки" відноситься до агенту, який перетворюється у вихідний лікарський засіб in vivo шляхом деякого фізіологічного хімічного процесу (наприклад, проліки при приведенні до фізіологічного pH перетворюються у бажану лікарську форму). Проліки часто є корисними, тому що, у деяких випадках, вони можуть бути легше введені, ніж вихідний лікарський засіб. Наприклад, вони можуть бути біодоступними шляхом перорального введення, в той час як вихідні сполуки ні. Проліки також можуть мати покращену розчинність у фармакологічних композиціях у порівнянні з вихідним лікарським засобом. Приклад проліків, без обмеження, включає сполуку даного винаходу, де вона вводиться у вигляді складного ефіру ("проліки") для полегшення переходу через клітинну мембрану, де розчинність у воді не є бажаною, але потім проліки метаболічно гідролізуються до карбонової кислоти всередині клітини, де розчинність у воді є бажаною. Проліки мають багато корисних властивостей. Наприклад, проліки можуть бути більш розчинними у воді, ніж кінцевий лікарський засіб, таким чином, полегшуючи внутрішньовенне введення лікарського засобу. Проліки також можуть мати вищий рівень пероральної біодоступності, ніж кінцевий лікарський засіб. Після введення, ці проліки ферментативно або хімічно розщеплюються для доставки кінцевого лікарського засобу у кров або тканину. Складноефірні проліки сполук, розкриті у цьому описі, специфічно розглянуті. Складний ефір може бути утворений з функціональної групи карбонової кислоти, зв'язаної зі сполукою формули (I), представленої вище, шляхом введення у реакцію зі спиртом або фенолом. Альтернативно, складний ефір може бути утворений з гідроксильної функціональної групи, зв'язаної зі сполукою формули (I), представленої вище, шляхом введення у реакцію з карбоновою кислотою або амінокислотою. Не передбачаючи введення обмеження, складний ефір може являти собою алкільний складний ефір, арильний складний ефір або гетероарильний складний ефір. Термін алкіл приймає значення, в основному зрозуміло спеціалістам, кваліфікованим у даній галузі техніки, та відноситься до лінійного, розгалуженого або циклічного алкільних залишків. C1−6алкільні складні ефіри є особливо корисними, коли алкільна частина складного ефіру має від 1 до 6 атомів вуглецю та включає, не обмежуючись наведеними, метил, етил, пропіл, ізопропіл, н-бутил, втор-бутил, ізо-бутил, трет-бутил, ізомери пентилу, ізомери гексилу, циклопропіл, циклобутил, циклопентил, циклогексил, та їх комбінації, що мають 1-6 атомів вуглецю. Сполуки даного винаходу у відповідностіз формулою (I), представленою вище, можуть бути використані для лікування патологічного стану, що виникає з неконтрольованої активації та/або надекспресії GSK-3β, вибраного з групи, що складається з таких як: (i) інсуліно-резистентні розлади; (ii) нейродегенеративні захворювання; (iii) розлади настрою; (iv) шизофренічні розлади; (v) ракові розлади; (vi) запалення; (vii) розлади, пов'язані із зловживанням психоактивними речовинами; та (viii) епілептичні напади; та (ix) невропатичний біль. Головним чином, інсуліно-резистентні розлади являють собою діабет типу 2, синдром X, ожиріння та синдром полікистозу яєчників. Головним чином, гострі та хронічні нейродегенеративні захворювання являють собою хворобу Паркінсона, хворобу Альцгеймера, хворобу Гентінгтона та спінальні нейродегенеративні розлади. Переважно, спінальні нейродегенеративні розлади являють собою аміотрофічний бічний склероз, розсіяний склероз, спінальну м'язову атрофію та нейродегенерацію через ураження спинного мозку. Головним чином, розлади настрою являють собою біполярні розлади та депресивні розлади. Переважно, біполярні розлади являють собою біполярний I, біполярний II розлад, циклотимію та біполярний неспецифічний розлад (BD-NOS). Переважно, депресивні розлади являють собою глибокий депресивний розлад (MDD), атипову депресію (AD), меланхолічну депресію, психотичну глибоку депресію (PMD), кататонічну депресію, післяпологову депресію (PPD), сезонний афективний розлад (SAD), дистимію, та неспецифічний депресивний розлад (DD-NOS). Головним чином, шизофренічні розлади являють собою параноїдальну шизофренію, гебефренічну шизофренію, кататонічну шизофренію, звичайну шизофренію, залишкову шизофренію та недиференційовану шизофренію. Головним чином, ракові розлади являють собою рак передміхурової залози, підшлункової залози, яєчників та рак ободової та прямої кишки та MLL-асоційовану лейкемію. Головним чином, розлади, пов'язані із зловживанням психоактивними речовинами, являють собою розлади, пов'язані із зловживанням психостимулянтами. Як правило, 1H-індазол-3-карбоксамідні сполуки у відповідності з формулою (I), корисні у 7 UA 112564 C2 5 10 15 20 25 30 даному винаході, вводять у формі фармацевтичної композиції. Відповідно, додатковий аспект даного винаходу відноситься до фармацевтичної композиції, що включає щонайменше одну сполуку формули (I), як описано вище, та щонайменше один інертний фармакологічно прийнятні ексципієнт. Переважно, фармацевтичну композицію даного винаходу одержують у підходящих лікарських формах, що включають ефективну кількість щонайменше однієї сполуки формули (I), як описано вище, її солі з фармакологічно прийнятною органічною або неорганічною кислотою або основою, або її проліків, та щонайменше один інертний фармакологічно прийнятний ексципієнт. Приклади підходящих лікарських форм включають таблетки, капсули, покриті таблетки, гранули, розчини та сиропи для перорального введення; розчини, помаду та мазь для місцевого застосування; лікарські пластири для крізьшкірного введення; супозиторії для ректального введення та ін'єкційні стерильні розчини. Інші підходящі лікарські форми включають лікарські форми з уповільненим вивільненням та лікарські форми на основі ліпосом для перорального, ін'єкційного або крізьшкірного введення. Лікарські форми також можуть містити інші традиційні інгредієнти такі як: консерванти, стабілізатори, поверхнево-активні речовини, буфери, солі для регулювання осмотичного тиску, емульгатори, підсолоджувачі, барвники, ароматизатори та подібні. Кількість 1H-індазол-3-карбоксаміду у відповідності з формулою (I) або її фармакологічно прийнятної солі приєднання кислоти у фармацевтичній композиції даного винаходу може варіюватися у широкому інтервалі в залежності від відомих факторів, наприклад, типу патології, серйозності хвороби, маси тіла пацієнта, лікарської форми, вибраного шляху введення, кількості введень на день та ефективності вибраної 1H-індазол-3-карбоксамідної сполуки у відповідності з формулою (I). Однак, спеціаліст, кваліфікований у даній галузі техніки, може визначити оптимальну кількість легким та рутинним способом. Як правило, кількість сполуки формули (I) або її фармакологічно прийнятної солі приєднання кислоти у фармацевтичній композиції даного винаходу буде такою, щоб забезпечити рівень введення від 0,0001 до 100 мг/кг/день. Переважно, рівень введення становить від 0,001 до 50 мг/кг/день, та навіть більш переважно від 0,01 до 10 мг/кг/день. Лікарські форми фармацевтичної композиції даного винаходу можуть бути одержані за технологіями, які є відомими хіміку-фармацевту, та включають змішування, гранулювання, пресування, розчинення, стерилізацію та подібне. Необмежуючі приклади сполук формули (I), які є корисними у відповідності до даного винаходу, являють собою сполуки наступної таблиці 1. Таблиця 1 IUPAC назва Структура H3C 1 O O [4-({[(5-метокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1іл]оцтова кислота NH O N N H OH N CH3 O 2 5-метокси-N-{[1-(2-метоксиетил)піперидин-4-іл]метил}-1H-індазол-3карбоксамід O CH3 NH N O N N H OH 3 [4-({[(5-метокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1іл]пропіонова кислота CH3 O NH O N N H 8 N O UA 112564 C2 Таблиця 1 IUPAC назва Структура CH3 O 4 N-{[1-(2-метоксиетил)піперидин-4іл]метил}-5-(піридин-3-іл)-1H-індазол-3карбоксамід O NH N N N N H CH3 CH3 5 N-{[1-(2-метоксиетил)піперидин-4іл]метил}-5-(4-метоксипіридин-3-іл)-1Hіндазол-3-карбоксамід O O O NH N N N N H CH3 O 6 F 5-(2-фторфеніл)-N-{[1-(2метоксиетил)піперидин-4-іл]метил}-1Hіндазол-3-карбоксамід O NH N N N H CH3 O 7 N-{[1-(2-метоксиетил)піперидин-4іл]метил}-5-(6-метилпіридин-3-іл)-1Hіндазол-3-карбоксамід H3C O NH N N N N H CH3 F 8 O F 5-(2,3-дифторфеніл)-N-{[1-(2метоксиетил)піперидин-4-іл]метил}-1Hіндазол-3-карбоксамід O NH N N N H CH3 O 9 O N-{[1-(2-метоксиетил)піперидин-4іл]метил}-5-феніл-1H-індазол-3карбоксамід NH N N N H O 10 N-{[1-(2-метоксиетил)піперидин-4іл]метил}-5-(5-метилпіридин-3-іл)-1Hіндазол-3-карбоксамід CH3 CH3 O O NH N N N N H CH3 O 11 5-(4-гідроксифеніл)-N-{[1-(2метоксиетил)піперидин-4-іл]метил}-1Hіндазол-3-карбоксамід HO O NH N N H 9 N UA 112564 C2 Таблиця 1 IUPAC назва Структура CH3 CH3 12 O O N-{[1-(2-метоксиетил)піперидин-4іл]метил}-5-(4-метоксифеніл)-1Hіндазол-3-карбоксамід O NH N N N H CH3 O 13 N-{[1-(2-метоксиетил)піперидин-4іл]метил}-5-(4-метилфеніл)-1H-індазол3-карбоксамід H3C O NH N N N H CH3 O 14 O N-{[1-(2-метоксиетил)піперидин-4іл]метил}-5-(2-метоксипіридин-3-іл)-1Hіндазол-3-карбоксамід NH N N N O N H H3C CH3 CH3 15 N-{[1-(2-метоксиетил)піперидин-4іл]метил}-5-(6-метоксипіридин-3-іл)-1Hіндазол-3-карбоксамід O O O NH N N N N H CH3 O 16 O N-{[1-(2-метоксиетил)піперидин-4іл]метил}-5-(2-метилфеніл)-1H-індазол3-карбоксамід NH N N CH3 N H CH3 O 17 4-[3-({[1-(2-метоксиетил)піперидин-4іл]метил}карбамоїл)-1H-індазол-5іл]бензойна кислота O O HO NH N N N H CH3 CH3 O 18 5-(2-етокси-4,5-дифторфеніл)-N-{[1-(2метоксиетил)піперидин-4-іл]метил}-1Hіндазол-3-карбоксамід F O O NH N F N N H O O Br 19 OH 5-бром-N-{[1-(2-метоксиетил)O DCC/HOBt піперидин-4-іл]метил}-1H-індазол-3N N CH3 + карбоксамід N H H2N DMF / r.t. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА 10 O NH Br N N H CH3 N UA 112564 C2 1 5 10 15 20 H-ЯМР спектроскопія: внутрішній стандарт = Тетраметилсилан; ДМСО-d6 = дейтерований диметил-сульфоксид; (s) = синглет; (d) = дуплет; (t) = триплет; (br) = широкий; (dd) = дуплет дуплетів; (dt) = дуплет триплетів; (ddd) = дуплет дуплетів дуплетів;(dtd) = дуплет триплетів дуплетів; (m) = мультиплет; J = константа взаємодії; δ = хімічний зсув (у ppm). Одержання сполук формули (I) Сполуки формули (I) можуть бути одержані за способами, відомими спеціалістам, кваліфікованим у даній галузі техніки, наприклад, шляхом наступних способів A-D. 1-Гідроксибензотриазол (HOBt, 7,40 г, 54,8 ммоль) та N, N’-дициклогексилкарбодіімід (DCC, 11 г, 53,3 ммоль) додають до розчину підходящої заміщеної 1H-індазол-3-карбонової кислоти (сполука i, 12 г, 49,8 ммоль) у ДМФА (200 мл) при 0 °C. Через 1 годину, розчин підходящого 1заміщеного [піперидин-4-іл]метанаміну (сполука ii, 10 г, 58,1 ммоль) у ДМФА (100 мл) додають при цій же температурі. Зазначену суміш перемішують при 0 °C впродовж 2 годин потім її залишать досягати кімнатної температури впродовж ночі. Зазначену суміш розводять за допомогою AcOEt далі тверду речовину видаляють фільтруванням. Цей розчин екстрагують три рази за допомогою соляної кислоти (HCl) 2н. pH кислотної фази підвищують (приблизно 13) за допомогою 5н NaOH та розчин екстрагують три рази за допомогою дихлорметану (ДХМ). Органічну фазу сушать за допомогою безводного Na2SO4. Розчинник відфільтровують, випарюють при зниженому тиску та залишок відповідним чином очищують. Наприклад, сполука (19) може бути одержана у відповідності зі способом A як описано нижче. 25 30 35 1-Гідроксибензотриазол (HOBt, 7,40 г, 54,8 ммоль) та N, N’-дициклогексилкарбодіімід (DCC, 11 г, 53,3 ммоль) додають до розчину 5-бром-1H-індазол-3-карбонової кислоти (сполука iii, 12 г, 49,8 ммоль) у ДМФА (200 мл) при 0 °C. Через 1 годину, розчин 1-[1-(2-метоксиетил)піперидин-4іл]метанаміну (сполука iv, 10 г, 58,1 ммоль) у ДМФА (100 мл) додають при цій же температурі. Зазначену суміш перемішують при 0 °C впродовж 2 годин потім її залишать досягати кімнатної температури впродовж ночі. Зазначену суміш розводять за допомогою AcOEt далі тверду речовину видаляють фільтруванням. Цей розчин екстрагують три рази за допомогою 2н HCl. pH кислотної фази підвищують (приблизно 13) за допомогою 5н NaOH та розчин екстрагують три рази за допомогою ДХМ. Органічну фазу сушать за допомогою безводного Na2SO4. Розчинник відфільтровують, випарюють при зниженому тиску та залишок очищують за допомогою флеш хроматографії (SiO2, CHCl3/MeOH=85/15). Сполуку (19), отриману таким чином, очищують як розкрито у Таблиці 2, отримуючи 9,5 г твердої речовини. 11 UA 112564 C2 5 10 До суспензії підходящої сполуки (v) (2,13 г; 0,0061 моль) у толуолі (50 мл) додають краплинним способом розчин 1-(1-бензилпіперидин-4-іл)метанаміну (сполука vi; 2,52 г; 0,012 моль), отриманого як описано у WO 94/10174, та триетиламін (TEA; 3,2 мл; 0,023 моль) у толуолі (10 мл). Зазначену реакційну суміш нагрівають при зрошенні впродовж 12 годин, та потім фільтрують. Розчинник видаляють шляхом випарювання при зниженому тиску та залишок переносять у етилацетат. Органічну фазу переносять у ділильну лійку, промивають насиченим NaHCO3 розчином та водою, відділяють та сушать над Na2SO4. Отриманий продукт (vii) кристалізують відповідним чином. 25 Розчин підходящого N-[(1-бензилпіперидин-4-іл)метил]-1H-індазол-3-карбоксаміду (сполука vii; 0,506 г; 1,34 ммоль) у абсолютному етанолі (8 мл) та льодяної оцтової кислоти (0,8 мл) гідрогенізують у мікрореакторній проточній системі (H-Cube) використовуючи CartCart Pd/C 10 % як картридж. Встановлюють наступні ключові параметри H-Cube: температура 80°; тиск 10 бар; потік 1 мл/хвилину. Через три години, цей розчин концентрують за допомогою зниженого тиску, розбавлять водою та переносять у ділильну лійку. Водну фазу потім промивають етилацетатом, роблять лужним за допомогою 1н NaOH та екстрагують етилацетатом. Органічні шари збирають, сушать над Na2SO4 та розчинник видаляють шляхом випарювання при зниженому тиску. Отриману таким чином тверду речовину сушать у печі під вакуумом, що приводить до одержання 0,27 г бажаного заміщеного N-(піперидин-4-ілметил)-1H-індазол-3-карбоксаміду (viii), який використовують без будь-якого додаткового очищення. 30 До розчину сполуки (viii) (0,75 ммоль; 215 мг) у метил-етил-кетоні (MEK; 9 мл), що перемішують при 85 °C, додають краплинним способом підходящу галогеновану сполуку (ix; 15 20 12 UA 112564 C2 5 1,05 екв.) та триетиламін (TEA; 210 мкл; 2 екв.). Зазначену реакційну суміш нагрівають при зрошенні впродовж 8 годин, потім охолоджують та розбавляють етилацетатом. Органічний шар промивають насиченим NH4Cl розчином та водою. Органічну фазу відділяють та сушать над Na2SO4. Розчинник видаляють шляхом випарювання при зниженому тиску, та продукт (I) очищують як описано нижче. Наприклад, сполука (2) може бути одержана у відповідності зі способом B як описано нижче: 10 15 20 25 Розчин N-[(1-бензилпіперидин-4-іл)метил]-5-метокси-1H-індазол-3-карбоксаміду (сполука x; 0,506 г; 1,34 ммоль) у абсолютному етанолі (8 мл) та льодяну оцтову кислоту (0,8 мл) гідрогенізують у мікрореакторній проточній системі (H-Cube), використовуючи CartCart Pd/C 10 % як картридж. Встановлюють наступні ключові параметри H-Cube: температура 80°; тиск 10 бар; потік 1 мл/хвилину. Через три години, цей розчин концентрують за допомогою зниженого тиску, розбавлять водою та переносять у ділильну лійку. Водну фазу потім промивають етилацетатом, роблять лужним за допомогою 1н NaOH та екстрагують етилацетатом. Органічні шари збирають, сушать над Na2SO4 та розчинник видаляють шляхом випарювання при зниженому тиску. Отриману таким чином тверду речовину сушать у печі під вакуумом, що приводить до одержання 0,27 бажаного 5-метокси-N-(піперидин-4-ілметил)-1H-індазол-3-карбоксаміду (xi), який використовують без будь-якого додаткового очищення. 1 H ЯМР (ДМСО-d6-300 MГц): δ 13,43 (br. s., 1H), 8,27 (t, J=6,13 Гц, 1H), 7,56 (d, J=2,01 Гц, 1H), 7,51 (dd, J=0,55, 8,96 Гц, 1H), 7,06 (dd, J=2,47, 9,06 Гц, 1H), 6,81 (br. s., 1H), 3,81 (s, 3H), 3,19 (t, J=6,22 Гц, 2H), 3,04 (d, J=5,12 Гц, 2H), 2,93 (s, 3H), 2,85 (d, J=11,34 Гц, 2H), 2,38 (t, J=6,77 Гц, 2H), 1,91 (t, J=10,61 Гц, 2H), 1,45-1,72 (m, 3H), 1,04-1,34 (m, 2H). + + [M.M.+H ] розраховано 289,1665; [M.M.+H ] знайдено 289,1648. 30 35 До розчину сполуки (xi) (0,75 ммоль; 215 мг) у метил-етил-кетоні (MEK; 9 мл), що перемішують при 85 °C, додають краплинним способом 1-хлор-2-метокси-етан (xii; 1,05 екв.) та триетиламін (TEA; 210 мкл; 2 екв.). Зазначену реакційну суміш нагрівають при зрошенні впродовж 8 годин, потім охолоджують та розбавляють етилацетатом. Органічний шар промивають насиченим NH4Cl розчином та водою. Органічну фазу відділяють та сушать над Na2SO4. Розчинник видаляють шляхом випарювання при зниженому тиску, та сполуку (2) очищують як описано нижче у Таблиці 2. 13 UA 112564 C2 5 Тіоніл-хлорид (SOCl2; 9,3 мл; 0,128 моль) додають до суспензії підходящої заміщеної 1Hіндазол-3-карбонової кислоти (сполука i; 2,36 г; 0,0123 моль) у толуолі (77 мл), та зазначену реакційну суміш нагрівають при зрошенні впродовж 4 годин. Розчинник видаляють шляхом випарювання при зниженому тиску та залишок двічі поглинають толуолом, що приводить до одержання 2,13 г бажаного продукту (xiii) 2,10-заміщеного 7H, 14H-піразино[1,2-b:4,5-b']дііндазол-7,14-діону. 10 15 До суспензії сполуки (xiii) (5,2 ммоль) у толуолі (40 мл) краплинним способом додають розчин підходящого аміну (ii; 2,1 екв.) та триетиламін (TEA; 3,6 екв.; 2,6 мл). Зазначену реакційну суміш нагрівають при зрошенні впродовж 8 годин, потім охолоджують та перемішують у 2н HCl (20 мл) впродовж 8 годин. Цю суспензію переносять у ділильну лійку та водну фазу відділяють та роблять лужною за допомогою 1н NaOH. Розчинник видаляють шляхом випарювання при зниженому тиску, та продукт (I) очищують як описано нижче. 20 25 30 Розчин продукту (xiv), зручно заміщеної арилборної кислоти (сполука xv), [1,1′біс(дифенілфосфіно)фероцен]-дихлор-паладій(II) [Pd(dppf)Cl2], карбонат цезію у 1,4-діоксані та воді (співвідношення 3:1) піддають мікрохвильовому опроміненню. Програмні установки є наступними: - 3'; T1=160 °C, T2=130 °C; максимальна потужність 300 Вт - 45'; T1=160 °C, T2=130 °C; максимальна потужність 300 Вт - 5'; T1=20 °C, T2=15 °C. Після одного циклу мікрохвильового випромінювання, розчинники видаляють шляхом випарювання при зниженому тиску та зазначену реакційну суміш розводять за допомогою розчину хлороформу та метанолу у співвідношенні 2:1 та фільтрують. 14 UA 112564 C2 5 10 15 20 25 Отримані таким чином продукти (I) очищують як описано нижче. Способи очищення Сполуки формули (I), отримані у відповідності з одним із попередньо розкритих способів AD, можуть бути очищені за однією з наступних технологій (a) - (c). (a) Флеш хроматографія на силікагелі. Флеш хроматографію проводять на системі Biotage Flash Master Personal на 20-45 мкM кремнеземовому картриджі або Grace Reveleris флеш хроматографічній системі з 40 мкM кремнеземовим картриджем. Потік = 60 мл/хвил. Розчинники, використовувані як елюенти, являють собою метанол та хлороформ. (b) Кристалізація Різні кристалізаційні розчинники використовують в залежності від сполуки, що очищують. Розчинники представлені у наступній Таблиці 2. (c) Препаративна РХ/МС система. РХ/МС система складається з Waters 2767 Sample manager, Waters 2478 dual λ absorbance detector та Waters Micromass ZQ одно квадрупольного мас-спектрометра з джерелом (ESI) електророспилювальної іонізації. Використовувана колонка являє собою X-Bridge Prep C18 5 мкм з 19 × 10мм (Waters) попередньою колонкою. Збір фракцій проводять за допомогою TM системи програмного забезпечення MassLynx v. 4.1. Довжину хвилі детектування встановлюють 230 нм та температуру до 25 °C. Зразок розчиняють (50 мг/мл) у ДМСО/CH3CN у 1:1 співвідношенні. Рухома фаза наступна: канал A=CH3CN+0,1 % мурашиної кислоти (Елюент A) канал B=H2O+0,1 % мурашиної кислоти (Елюент B) потік = 40 мл/хвил. градієнт = мінімальний та максимальний відсоток елюенту A, що досягається у 15 хвилинні інтервали, показаний у наступній Таблиці 2. У наступній Таблиці 2 показані як спосіб одержання, так і спосіб очищення для кожної сполуки формули (I), як перераховано у Таблиці 1, та маса моноізотопу для кожної сполуки. Таблиця 2 N° 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 Одержання спосіб B B B D D D D D D D D D D D D D D D A Спосіб очищення (b) (b) (b) (c) (c) (c) (c) (c) (c) (c) (c) (c) (c) (c) (c) (c) (c) (c) (b) Параметри або розчинник, що використовують для очищення AcOEt EtOH/AcOEt EtOH абс./AcOEt 2 – 40 2 – 40 10 – 45 2 –27 15 – 50 10 – 45 10 – 45 10 – 34 15 – 43 20 – 55 10 – 34 10 – 34 20-55 10-34 20-55 ТГФ/H2O 30 MM: маса моноізотопу AcOEt: етилацетат EtOH: етанол EtOH абс.: абсолютний етанол 15 MM знайдено + [M+H ] MM розраховано + [M+H ] 347,1677 347,2080 361,1856 394,2241 424,2350 411,2196 408,2397 429,2105 393,2290 424,2350 409,2247 423,2400 407,2449 424,2340 424,2343 407,2453 437,2190 473,2360 395,1064 347,1729 347,2083 361,1876 394,2238 424,2343 411,2191 408,2394 429,2097 393,2285 424,2343 409,2234 423,2391 407,2442 424,2343 424,2343 407,2447 437,2189 473,2364 395,1077 UA 112564 C2 ТГФ: тетрагідрофуран H2O: вода Таблиця 3 N° 1 2 3 4 5 6 7 8 9 10 11 12 13 14 1 H-ЯМР піки ДМСО-d6; δ 13,95 (br. s., 2H), 8,24 (t, J=6,06 Гц, 1H), 7,38-7,62 (m, 2H), 6,86-7,13 (m, 1H), 3,81 (s, 3H), 3,18 (t, J=6,16 Гц, 2H), 2,94 (d, J=11,10 Гц, 2H), 2,74 (s, 2H), 1,99 (t, J=10,90 Гц, 2H), 1,45-1,66 (m, 3H), 1,11-1,35 (m, 2H) ДМСО-d6; δ 13,41 (br. s., 1H), 8,25 (t, J=6,07 Гц, 1H), 7,56 (d, J=2,50 Гц, 1H), 7,51 (d, J=9,06 Гц, 1H), 7,06 (dd, J=2,50, 9,05 Гц, 1H), 3,81 (s, 3H), 3,41 (t, J=5,97 Гц, 2H), 3,23 (s, 3H), 3,19 (t, J=6,26 Гц, 2H), 2,85 (d, J=11,56 Гц, 2H), 2,43 (t, J=5,97 Гц, 2H), 1,79-2,06 (m, 2H), 1,48-1,73 (m, 3H), 0,99-1,39 (m, 2H) ДМСО-d6; δ 8,24 (t, J=6,04 Гц, 1H), 7,46-7,61 (m, 2H), 7,03 (dd, J=2,60, 8,70 Гц, 1H), 3,81 (s, 3H), 3,18 (t, J=6,31 Гц, 2H), 2,83 (d, J=11,25 Гц, 2H), 2,40-2,48 (m, 2H), 2,05-2,16 (m, 2H), 1,78-1,94 (m, 2H), 1,49-1,68 (m, 3H), 1,12-1,29 (m, 2H) ДМСО-d6; δ 13,71 (br. s., 1H), 8,90 (dd, J=0,82, 2,47 Гц, 1H), 8,58 (dd, J=1,56, 4,67 Гц, 1H), 8,42-8,44 (m, 1H), 8,40 (t, J=6,00 Гц, 1H), 8,09 (ddd, J=1,65, 2,42, 8,00 Гц, 1H), 7,70-7,81 (m, 2H), 7,51 (ddd, J=0,82, 4,76, 7,96 Гц, 1H), 3,37-3,44 (m, 2H), 3,14-3,24 (m, J=5,90, 5,90 Гц, 5H), 2,84 (d, J=11,53 Гц, 2H), 2,43 (t, J=6,04 Гц, 2H), 1,82-1,99 (m, 2H), 1,47-1,74 (m, 3H), 1,09-1,29 (m, 2H) ДМСО-d6; δ 13,66 (br. s., 1H), 8,47 (d, J=5,85 Гц, 1H), 8,33-8,42 (m, 2H), 8,24 (dd, J=0,91, 1,65 Гц, 1H), 7,66 (dd, J=0,91, 8,60 Гц, 1H), 7,53 (dd, J=1,65, 8,60 Гц, 1H), 7,19 (d, J=5,67 Гц, 1H), 3,48 (s, 3H), 3,38-3,45 (m, 2H), 3,15-3,25 (m, 5H), 2,88 (d, J=11,34 Гц, 2H), 2,48 (t, J=6,00 Гц, 2H), 1,98 (t, J=10,89 Гц, 2H), 1,47-1,73 (m, 3H), 1,09-1,31 (m, 2H) ДМСО-d6; δ 13,55 (s, 1H), 8,25-8,40 (m, 2H), 7,70 (dd, J=0,73, 8,78 Гц, 1H), 7,50-7,63 (m, 2H), 7,38-7,49 (m, 1H), 7,28-7,38 (m, 2H), 3,40 (t, J=5,95 Гц, 2H), 3,12-3,25 (m, J=6,60 Гц, 5H), 2,84 (d, J=11,34 Гц, 2H), 2,42 (t, J=6,04 Гц, 2H), 1,82-1,99 (m, 2H), 1,46-1,72 (m, 3H), 1,06-1,28 (m, 2H) ДМСО-d6; δ 13,68 (br. s., 1H), 8,77 (d, J=1,83 Гц, 1H), 8,32-8,43 (m, 2H), 7,98 (dd, J=2,47, 7,96 Гц, 1H), 7,73 (d, J=1,28 Гц, 2H), 7,37 (d, J=8,05 Гц, 1H), 3,41 (t, J=5,95 Гц, 2H), 3,23 (s, 5H), 2,85 (d, J=11,34 Гц, 2H), 2,53 (s, 3H), 2,43 (t, J=5,95 Гц, 2H), 1,79-2,01 (m, 2H), 1,44-1,74 (m, 3H), 1,07-1,33 (m, 2H) ДМСО-d6; δ 13,09 (s, 1H), 8,23-8,42 (m, 2H), 7,72 (dd, J=0,82, 8,69 Гц, 1H), 7,55 (td, J=1,76, 8,74 Гц, 1H), 7,24-7,49 (m, 3H), 3,40 (t, J=6,04 Гц, 2H), 3,22 (s, 3H), 3,18 (d, J=6,40 Гц, 2H), 2,84 (d, J=11,53 Гц, 2H), 2,42 (t, J=5,95 Гц, 2H), 1,82-2,02 (m, 2H), 1,41-1,71 (m, 3H), 1,061,31 (m, 2H) ДМСО-d6; δ 13,65 (br. s., 1H), 8,40 (t, J=1,28 Гц, 1H), 8,36 (t, J=6,13 Гц, 1H), 7,65-7,75 (m, 4H), 7,44-7,53 (m, 2H), 7,32-7,41 (m, 1H), 3,40 (t, J=6,04 Гц, 2H), 3,12-3,27 (m, J=6,00, 6,00 Гц, 5H), 2,84 (d, J=11,34 Гц, 2H), 2,42 (t, J=6,04 Гц, 2H), 1,83-1,97 (m, 2H), 1,49-1,71 (m, 3H), 1,09-1,31 (m, 2H) ДМСО-d6; δ 13,71 (br. s., 1H), 8,49 (d, J=1,65 Гц, 1H), 8,43 (dd, J=0,91, 1,65 Гц, 1H), 8,40 (t, J=6,13 Гц, 1H), 8,30 (d, J=2,74 Гц, 1H), 7,78 (dd, J=1,60, 8,70 Гц, 1H), 7,73 (dd, J=0,90, 8,70 Гц, 1H), 7,62 (dd, J=1,83, 2,74 Гц, 1H), 3,94 (s, 3H), 3,40 (t, J=6,04 Гц, 2H), 3,10-3,26 (m, 5H), 2,84 (d, J=11,53 Гц, 2H), 2,43 (t, J=5,95 Гц, 2H), 1,82-2,00 (m, 2H), 1,44-1,73 (m, 3H), 1,051,31 (m, 2H) ДМСО-d6; δ 13,53 (br. s., 1H), 9,52 (br. s., 1H), 8,32 (t, J=6,13 Гц, 1H), 8,29 (t, J=1,28 Гц, 1H), 7,63 (d, J=1,28 Гц, 2H), 7,49 (d, J=8,78 Гц, 2H), 6,87 (d, J=8,60 Гц, 2H), 3,40 (t, J=5,95 Гц, 2H), 3,22 (s, 3H), 3,15-3,21 (m, 2H), 2,84 (d, J=11,53 Гц, 2H), 2,42 (t, J=5,95 Гц, 2H), 1,91 (t, J=10,61 Гц, 2H), 1,43-1,72 (m, 3H), 1,03-1,33 (m, 2H) ДМСО-d6; δ 13,20 (s, 1H), 8,18-8,40 (m, 2H), 7,49-7,73 (m, 4H), 6,88-7,10 (m, 2H), 3,81 (s, 3H), 3,40 (t, J=5,95 Гц, 2H), 3,22 (s, 5H), 2,84 (d, J=11,34 Гц, 2H), 2,42 (t, J=5,95 Гц, 2H), 1,79-2,01 (m, 2H), 1,43-1,74 (m, 3H), 1,09-1,29 (m, 2H) ДМСО-d6; δ 13,62 (br. s., 1H), 8,29-8,41 (m, 2H), 7,63-7,74 (m, 2H), 7,57 (d, J=8,05 Гц, 2H), 7,29 (d, J=7,87 Гц, 2H), 3,40 (t, J=5,95 Гц, 2H), 3,22 (s, 5H), 2,84 (d, J=11,34 Гц, 2H), 2,42 (t, J=5,95 Гц, 2H), 2,36 (s, 3H), 1,80-2,02 (m, 2H), 1,43-1,70 (m, 3H), 1,05-1,31 (m, 2H) ДМСО-d6; δ 8,24-8,38 (m, 2H), 8,18 (dd, J=1,83, 4,94 Гц, 1H), 7,76 (dd, J=1,83, 7,32 Гц, 1H), 7,62-7,69 (m, 1H), 7,46-7,58 (m, 1H), 7,11 (dd, J=4,94, 7,14 Гц, 1H), 3,89 (s, 3H), 3,40 (t, J=5,95 Гц, 2H), 3,22 (s, 5H), 2,84 (d, J=11,53 Гц, 2H), 2,42 (t, J=6,04 Гц, 2H), 1,82-1,97 (m, 2H), 1,471,72 (m, 3H), 1,06-1,29 (m, 2H) 16 UA 112564 C2 Таблиця 3 N° 15 16 17 18 19 5 10 15 20 25 30 35 1 H-ЯМР піки ДМСО-d6; δ 13,36 (s, 1H), 8,47 (dd, J=0,73, 2,56 Гц, 1H), 8,26-8,37 (m, 2H), 8,01 (dd, J=2,60, 8,60 Гц, 1H), 7,70 (dd, J=1,00, 8,80 Гц, 1H), 7,65 (dd, J=1,80, 8,80 Гц, 1H), 6,93 (dd, J=0,73, 8,60 Гц, 1H), 3,91 (s, 3H), 3,40 (t, J=6,04 Гц, 2H), 3,22 (s, 5H), 2,84 (d, J=11,34 Гц, 2H), 2,42 (t, J=6,04 Гц, 2H), 1,80-2,01 (m, 2H), 1,47-1,74 (m, 3H), 1,02-1,35 (m, 2H) ДМСО-d6; δ 13,59 (s, 1H), 8,34 (t, J=6,13 Гц, 1H), 8,06 (dd, J=1,56, 0,82 Гц, 1H), 7,65 (dd, J=0,73, 8,60 Гц, 1H), 7,39 (dd, J=1,65, 8,60 Гц, 1H), 7,35-7,20 (m, 1H), 3,40 (t, J=5,95 Гц, 2H), 3,22 (s, 5H), 2,84 (d, J=11,53 Гц, 2H), 2,42 (t J=6,04 Гц, 2H), 2,23 (s, 3H), 1,90 (t, J=10,61 Гц, 2H), 1,50-1,70 (m, 3H), 1,10-1,30 (m, 2H) ДМСО-d6; δ 13,72 (br.s, 1H), 8,49-8,29 (m, 1H), 8,33 (t, J=6,04 Гц, 1H), 7,83-8,03 (m, 2H), 7,787,62 (m, 2H), 7,51-7,61 (m, 2H), 3,41 (t, J=6,04 Гц, 2H), 3,22 (s, 5H), 2,84 (d, J=11,34 Гц, 2H), 2,43 (t J=5,95 Гц, 2H), 1,91 (t, J=10,70 Гц, 2H), 1,71-1,53 (m, 3H), 1,31-1,11 (m, 2H) ДМСО-d6; δ 13,56 (s, 1H), 8,36-8,16 (m, 2H), 7,72-7,52 (m, 1H), 7,50 (dd, J=8,78,1,65 Гц 1H), 7,41 (dd J=11,53, 9,33 Гц, 1H), 7,25 (dd J=12,99, 7,14 Гц, 1H), 4,05 (q, J=6,95 Гц, 2H), 3,40 (t, J=5095 Гц, 2H), 3,29-3,09 (m, 5H), 2,83 (d J=11,34 Гц, 2H), 2,42 (t, J=5,95 Гц, 2H), 2,00-1,80 (m, 2H), 1,70-1,50 (m, 3H), 1,24 (s, 5H) ДМСО-d6; δ 13,74 (br. s., 1H), 8,42 (t, J=6,07 Гц, 1H), 8,31 (dd, J=1,83, 0,67 Гц, 1H), 7,61 (dd, J=8,70, 0,70 Гц, 1H), 7,53 (dd, J=8,70, 1,70 Гц, 1H), 3,41 (t, J=5,97 Гц, 2H), 3,22 (s, 3H), 3,133,21 (m, 2H), 2,78-2,94 (m, 2H), 2,30-2,47 (m, 2H), 1,82-2,09 (m, 2H), 1,39-1,77 (m, 3H), 1,081,30 (m, 2H) ДМСО: диметилсульфоксид Сполуки 20-44 одержують як описано у цьому описі нижче. Синтез сполуки 20 - Етил [4-({[(5-бром-6-метокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]ацетат 20a) Етил [4-(амінометил)піперидин-1-іл]ацетат До перемішуваного розчину N-[фенілметиліден]-1-(піперидин-4-іл)метанаміну (22 г, 0,109 моль (отриманого як описано у WO2004/101548) у абсолютному етанолі (150 мл) додають етил бромацетат (12 мл, 0,109 моль) та карбонат калію (33 г, 0,24 моль). Цей розчин нагрівають при зрошенні впродовж 8 годин, потім охолоджують та концентрують шляхом випарювання розчиннику при зниженому тиску. Зазначену реакційну суміш розводять за допомогою 3н HCl (150 мл) та перемішують при кімнатній температурі впродовж 2 годин. Кислий розчин потім промивають етилацетатом та роблять лужним шляхом додавання Na 2CO3. Водну фазу екстрагують трьома порціями дихлорметану, які знову об'єднують та сушать над Na2SO4. Розчинник видаляють шляхом випарювання при зниженому тиску та отриманий продукт етил [4(амінометил)піперидин-1-іл]ацетат 20a використовують як такий без будь-якого додаткового очищення. MS: 201 m/z (M+H+). 1-Гідроксибензотриазол (HOBt, 2,43 г, 14,2 ммоль) та N, N’-дициклогексилкарбодіімід (DCC, 2,93 г, 14,2 ммоль) додають до розчину 5-бром-6-метокси-1H-індазол-3-карбонової кислоти (3,5 г, 12,9 ммоль) у ДМФА (40 мл) при 0 °C. Через 1 годину, розчин сполуки 20a (2,6 г, 12,9 ммоль) у ДМФА (25 мл) додають при цій же температурі. Зазначену суміш перемішують при 0 °C впродовж 2 годин залишають досягти кімнатної температури впродовж ночі. Зазначену суміш розводять за допомогою EtOAc та тверду речовину видаляють фільтруванням. Цей розчин екстрагують три рази соляною кислотою (HCl) 2н. pH кислотної фази підвищують (приблизно 13) за допомогою 5н NaOH та цей розчин екстрагують три рази за допомогою дихлорметану (ДХМ). Органічну фазу сушать над безводним Na2SO4 та розчинник відфільтровують та випарюють при зниженому тиску, забезпечуючи одержання 1,6 г (3,5 ммоль, 27 % вихід) етил [4-({[(5-бром-6метокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]ацетату (сполука 20). 1 H ЯМР (300MГц, ДМСО-d6) δ = 13,46 (br. s., 1H), 8,35 (t, J=6,2 Гц, 1H), 8,30 (s, 1H), 7,12 (s, 1H), 4,07 (q, J=7,3 Гц, 2H), 3,93 (s, 3H), 3,16 (s, 4H), 2,81 (d, J=11,0 Гц, 2H), 2,19-2,03 (m, 2H), 1,70-1,44 (m, 3H), 1,31-1,04 (m, 5H) + MS: 453 m/z (M+H) . Синтез сполуки 21 {4-[({[6-метокси-5-(піридин-3-іл)-1H-індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтової кислоти форміату гідрат Розчин сполуки 20 (200 мг, 0,44 ммоль), піридин-3-ілборонової кислоти (217 мг, 1,77 ммоль), [1,1′-біс(дифенілфосфіно)фероцен]-дихлор-паладій(II) [Pd(dppf)Cl2] (81 мг, 0,11 ммоль) та карбонат цезію (575 мг, 1,76 ммоль) у 1,4-діоксані та воді (співвідношення 3:1, 8 мл) піддають 17 UA 112564 C2 5 10 15 20 25 30 35 40 45 50 55 60 мікрохвильовому опроміненню як описано нижче: Період часу = 3"; T1=160 °C, T2=130 °C; максимальна потужність 300 Вт Період часу = 45"; T1=160 °C, T2=130 °C; максимальна потужність 300 Вт Період часу = 5"; T1=20 °C, T2=15 °C. Після одного циклу мікрохвильового випромінювання, розчинники видаляють шляхом випарювання при зниженому тиску та зазначену реакційну суміш розводять за допомогою розчину метанолу (20 мл), фільтрують над целітом та сушать під вакуумом. Сирий продукт відфільтровують на кремнеземовому картриджі та промивають хлороформом та метанолом у співвідношенні 1:1. Отриману тверду речовину розчиняють у ДМСО та очищують за допомогою препаративної ВЕРХ (канал A=CH3CN+0,1 % мурашиної кислоти; канал B=H2O+0,1 % мурашиної кислоти: потік = 40 мл/хвил.; градієнт = 2 % - 40 % елюенту A за 15 хвилин), забезпечуючи одержання {4-[({[6-метокси-5-(піридин-3-іл)-1H-індазол-3іл]карбоніл}аміно)метил]піперидин-1-іл}оцтової кислоти форміату гідрату 21 (67 мг, 36 % вихід). 1 H ЯМР (300MГц, ДМСО-d6) δ = 13,44 (br. s., 1H), 8,66 (dd, J=0,9, 2,4 Гц, 1H), 8,54 (dd, J=1,8, 4,8 Гц, 1H), 8,42 (t, J=6,2 Гц, 1H), 8,01 (s, 1H), 7,91-7,85 (m, 1H), 7,45 (ddd, J=0,9, 4,8, 7,8 Гц, 1H), 7,13 (s, 1H), 3,86 (s, 3H), 3,41 (br. s., 1H), 3,30-3,00 (m, 6H), 2,54 (s, 2H), 1,73 (d, J=11,0 Гц, 3H), 1,52-1,28 (m, 2H) + MS: 424 m/z (M+H) . Синтез сполуки 22 {4-[({[6-метокси-5-(5-метоксипіридин-3-іл)-1H-індазол-3іл]карбоніл}аміно)метил]піперидин-1-іл}оцтової кислоти гідрат {4-[({[6-метокси-5-(5-метоксипіридин-3-іл)-1H-індазол-3-іл]карбоніл}аміно)метил]-піперидин1-іл}оцтової кислоти гідрат 22 отримують у відповідності з процедурою, описаною для сполуки 21, виходячи з (5-метоксипіридин-3-іл)боронової кислоти та використовуючи наступні препаративні ВЕРХ параметри для очищення: канал A=CH3CN+0,1 % мурашиної кислоти; канал B=H2O+0,1 % мурашиної кислоти: потік = 40 мл/хвил.; градієнт = 10 % - 45 % елюенту A за 15 хвилин. Вихід: 33 мг, 17 %. 1 H ЯМР (300MГц, ДМСО-d6) δ = 13,46 (br. s., 1H), 8,42 (t, J=6,0 Гц, 1H), 8,26 (dd, J=2,0, 6,8 Гц, 2H), 8,02 (s, 1H), 7,43 (dd, J=1,6, 2,7 Гц, 1H), 7,13 (s, 1H), 3,88 (s, 3H), 3,86 (s, 3H), 3,98 (br. s., 1H), 3,30-3,01 (m, 6H), 2,66-2,53 (m, 2H), 1,73 (d, J=10,6 Гц, 3H), 1,40 (q, J=11,6 Гц, 2H) + MS: 454 m/z (M+H) . Синтез сполуки 23 {4-[({[5-(2,3-дифторфеніл)-6-метокси-1H-індазол-3іл]карбоніл}аміно)метил]піперидин-1-іл}оцтової кислоти гідрат {4-[({[5-(2,3-дифторфеніл)-6-метокси-1H-індазол-3-іл]карбоніл}аміно)-метил]піперидин-1іл}оцтової кислоти гідрат 23 отримують у відповідності з процедурою, описаною для сполуки 21, виходячи з (2,3-дифторфеніл)боронової кислоти та використовуючи наступні препаративні ВЕРХ параметри для очищення: канал A=CH 3CN+0,1 % мурашиної кислоти; канал B=H2O+0,1 % мурашиної кислоти: потік = 40 мл/хвил.; градієнт = 15 % - 50 % елюенту A за 15 хвилин. Вихід: 48 мг, 24 %. 1 H ЯМР (300MГц, ДМСО-d6) δ = 13,50 (br. s., 1H), 8,42 (t, J=6,0 Гц, 1H), 7,97 (s, 1H), 7,53-7,36 (m, 1H), 7,33-7,16 (m, 2H), 7,13 (s, 1H), 4,13 (br. s., 1H), 3,84 (s, 3H), 3,30-3,08 (m, 6H), 2,65-2,53 (m, 2H), 1,72 (d, J=11,0 Гц, 3H), 1,40 (q, J=11,7 Гц, 2H) + MS: 459 m/z (M+H) . Синтез сполуки 24-4-[4-({[(5-метокси-1H-індазол-3-іл)карбоніл]аміно}метил)-піперидин-1іл]бутанова кислота 24a) Трет-бутил 4-({[(5-метокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1карбоксилат Трет-бутил4-({[(5-метокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-карбоксилат 24a отримують у відповідності з процедурою, описаною для сполуки 20, з 5-метокси-1H-індазол3-карбонової кислоти та трет-бутил 4-(амінометил)піперидин-1-карбоксилату. Вихід: 35,2 г, 96 %. + MS: 389 m/z (M+H) . 24b)5-Метокси-N-(піперидин-4-ілметил)-1H-індазол-3-карбоксаміду гідрохлорид 2 M HCl у Et2O (1,8 л) додають до розчину сполуки 24a (92,8 г, 0,24 моль) у MeOH (500 мл). Зазначену суміш перемішують впродовж 3 годин при кімнатній температурі, потім отриману тверду речовину відфільтровують та сушать, що приводить до одержання 5-метокси-N(піперидин-4-ілметил)-1H-індазол-3-карбоксаміду гідрохлориду 24b (61,1 г, 89 % вихід). + MS: 289 m/z (M+H) . 24c) Етил 4-[4-({[(5-метокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]бутаноат Суміш сполуки 24b (8 г, 24,6 ммоль) та карбонату калію (17 г, 123 ммоль) у ацетоні (250 мл) нагрівають при зрошенні впродовж 1 години, потім краплинним способом додають етил 4 18 UA 112564 C2 5 10 15 20 25 30 35 40 45 50 55 60 хлорбутаноат (3,62 мл, 25,9 ммоль). Зазначену суміш нагрівають при зрошенні впродовж ночі, потім охолоджують та фільтрують. Отриману тверду речовину сушать та очищують за допомогою препаративної ВЕРХ (канал A=CH3CN+0,1 % мурашиної кислоти; канал B=H2O+0,1 % мурашиної кислоти: потік = 40 мл/хвил.; градієнт = 10 % - 45 % елюенту A за 15 хвилин), забезпечуючи одержання 0,9 г (9 % вихід) етил 4-[4-({[(5-метокси-1H-індазол-3іл)карбоніл]аміно}метил)піперидин-1-іл]бутаноату 24c. + MS: 403 m/z (M+H) . До розчину сполуки 24c (744 мг, 1,85 ммоль) у MeOH (10 мл) додають водний розчин NaOH (1 M, 3,7 мл). Цей розчин нагрівають при зрошенні впродовж ночі, потім органічний розчинник видаляють під вакуумом, залишок розводять за допомогою H2O та pH доводять до 5 шляхом додавання 1 M HCl. Зазначену суміш тримають при 4 °C впродовж ночі, потім отриману тверду речовину відфільтровують, промивають свіжою водою та сушать під вакуумом, що приводить до одержання 4-[4-({[(5-метокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]бутанової кислоти 24 (72 мг, 10 % вихід). 1 H ЯМР (300MГц, ДМСО-d6) δ = 13,54 (br. s., 1H), 11,25 (br. s., 1H), 8,46 (t, J=6,1 Гц, 1H), 7,55 (d, J=2,3 Гц, 1H), 7,52 (d, J=8,9 Гц, 1H), 7,05 (dd, J=2,3, 8,9 Гц, 1H), 3,80 (s, 3H), 3,37 (d, J=12,2 Гц, 2H), 3,23 (t, J=6,1 Гц, 2H), 3,00-2,89 (m, 2H), 2,81 (t, J=11,4 Гц, 2H), 2,32 (t, J=7,1 Гц, 2H), 2,011,70 (m, 5H), 1,64-1,41 (m, 2H) + MS: 375 m/z (M+H) . Синтез сполуки 25 {4-[({[5-(Піримідин-5-іл)-1H-індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтової кислоти гідрат 25a) Трет-бутил 4-({[(5-бром-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-карбоксилат Трет-бутил4-({[(5-бром-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-карбоксилат 25a отримують у відповідності з процедурою, описаною для сполуки 20, з 5-бром-1H-індазол-3карбонової кислоти та трет-бутил 4-(амінометил)піперидин-1-карбоксилату. Вихід: 40,6 г, 87 % + MS: 437 m/z (M+H) . 25b) 5-Бром-N-(піперидин-4-ілметил)-1H-індазол-3-карбоксаміду гідрохлорид 5-Бром-N-(піперидин-4-ілметил)-1H-індазол-3-карбоксаміду гідрохлорид 25b отримують у відповідності з процедурою, описаною для сполуки 24b, виходячи зі сполуки 25a. Вихід: 23,8 г, 76 %. + MS: 337 m/z (M+H) . 25c) Етил [4-({[(5-бром-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]ацетат Суміш сполуки 25b (2 г, 5,4 ммоль) та карбонату калію (2,3 г, 16,6 ммоль) у ДМФА (45 мл) перемішують впродовж 1 години при 70 °C. Розчин етил бромацетату (0,89 мл, 8 ммоль) у ДМФА (5 мл) додають краплинним способом. Через 3 години при 70 °C зазначену реакційну суміш охолоджують, розбавлять водою та екстрагують три рази за допомогою EtOAc. Об'єднані органічні фази сушать над Na2SO4 та концентрують під вакуумом. Сирий продукт очищують шляхом флеш хроматографії (кремнезем, CHCl3:MeOH 95:5), забезпечуючи одержання 710 мг (31 % вихід) етил [4-({[(5-бром-1H-індазол-3-іл)карбоніл]аміно}-метил)піперидин-1-іл]ацетату 25c. 1 H ЯМР (300MГц, ДМСО-d6) δ = 13,74 (s, 1H), 8,43 (t, J=6,0 Гц, 1H), 8,32 (dd, J=0,6, 1,9 Гц, 1H), 7,61 (dd, J=0,6, 8,9 Гц, 1H), 7,53 (dd, J=1,9, 8,9 Гц, 1H), 4,07 (q, J=7,1 Гц, 2H), 3,20 (t, J=6,4 Гц, 2H), 3,17 (s, 2H), 2,81 (d, J=11,2 Гц, 2H), 2,22-2,03 (m, 2H), 1,72-1,46 (m, 3H), 1,31-1,08 (m, 5H). + MS: 423 m/z (M+H) . 4-[({[5-(Піримідин-5-іл)-1H-індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтової кислоти гідрат 25 отримують у відповідності з процедурою, описаною для сполуки 21, зі сполуки 25c та піримідин-5-ілборонової кислоти. Продукт очищують шляхом кристалізації у MeOH. Вихід: 43 мг, 18 %. 1 H ЯМР (300MГц, ДМСО-d6) δ = 13,90 (br. s., 1H), 9,20 (s, 1H), 9,15 (s, 2H), 8,54 (t, J=6,0 Гц, 1H), 8,48 (s, 1H), 8,00-7,56 (m, 2H), 4,63 (br. s., 1H), 3,45-3,01 (m, 6H), 2,60 (t, J=11,3 Гц, 2H), 1,76 (d, J=11,3 Гц, 3H), 1,44 (q, J=11,3 Гц, 2H) + MS: 395 m/z (M+H) . Синтез сполуки 26 {4-[({[5-(3,5-Диметилізоксазол-4-іл)-1H-індазол-3іл]карбоніл}аміно)метил]піперидин-1-іл}оцтової кислоти гідрат {4-[({[5-(3,5-Диметилізоксазол-4-іл)-1H-індазол-3-іл]карбоніл}аміно) метил]піперидин-1іл}оцтової кислоти гідрат 26 отримують у відповідності з процедурою, описаною для сполуки 21, зі сполуки 25c та (3,5-диметилізоксазол-4-іл)боронової кислоти. Продукт очищують шляхом кристалізації у MeOH. Вихід: 55 мг, 23 %. 1 H ЯМР (300MГц, ДМСО-d6) δ = 13,84 (br. s., 1H), 8,50 (t, J=5,9 Гц, 1H), 8,10 (s, 1H), 7,72 (d, 19 UA 112564 C2 5 10 15 20 25 30 35 40 45 50 55 60 J=8,6 Гц, 1H), 7,40 (dd, J=1,5, 8,8 Гц, 1H), 4,10 (br. s., 1H), 3,36-3,03 (m, 6H), 2,60 (t, J=11,2 Гц, 2H), 2,41 (s, 3H), 2,22 (s, 3H), 1,75 (d, J=11,2 Гц, 3H), 1,42 (q, J=11,4 Гц, 2H) + MS: 412 m/z (M+H) . Синтез сполуки 27 {4-[({[5-(2,3-дихлорфеніл)-1H-індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтової кислоти гідрат {4-[({[5-(2,3-Дихлорфеніл)-1H-індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтової кислоти гідрат 27 отримують у відповідності з процедурою, описаною для сполуки 21, зі сполуки 25c та (2,3-дихлорфеніл)боронової кислоти та використовуючи наступні препаративні ВЕРХ параметри для очищення: канал A=CH3CN+0,1 % мурашиної кислоти; канал B=H2O+0,1 % мурашиної кислоти: потік = 40 мл/хвил.; градієнт = 20 % - 55 % елюенту A за 15 хвилин. Вихід: 42 мг, 15 %. 1 H ЯМР (300MГц, ДМСО-d6) δ = 13,81 (br. s., 1H), 8,50 (t, J=6,0 Гц, 1H), 8,17 (dd, J=0,9, 1,6 Гц, 1H), 7,78-7,60 (m, 2H), 7,54-7,34 (m, 3H), 4,08 (br. s., 1H), 3,38-2,96 (m, 6H), 2,58 (t, J=11,0 Гц, 2H), 1,74 (d, J=11,0 Гц, 3H), 1,42 (q, J=11,6 Гц, 2H) + MS: 461 m/z (M+H) . Синтез сполуки 28 - {4-[({[5-(3-Фторфеніл)-1H-індазол-3-іл]карбоніл}аміно)-метил]піперидин1-іл}оцтової кислоти гідрат {4-[({[5-(3-Фторфеніл)-1H-індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтової кислоти гідрат 28 отримують у відповідності з процедурою, описаною для сполуки 21, зі сполуки 25c та (3-фторфеніл)боронової кислоти та використовуючи наступні препаративні ВЕРХ параметри для очищення: канал A=CH3CN+0,1 % мурашиної кислоти; канал B=H2O+0,1 % мурашиної кислоти: потік = 40 мл/хвил.; градієнт = 15 % - 50 % елюенту A за 15 хвилин. Вихід: 87 мг, 36 %. 1 H ЯМР (300MГц, ДМСО-d6) δ = 13,71 (br. s., 1H), 8,45 (t, J=6,0 Гц, 1H), 8,41 (s, 1H), 7,86-7,66 (m, 2H), 7,63-7,41 (m, 3H), 7,19 (dddd, J=2,4, 2,6, 6,5, 9,0 Гц, 1H), 4,75 (br. s., 1H), 3,34-3,07 (m, 6H), 2,64-2,53 (m, 2H), 1,75 (d, J=11,0 Гц, 3H), 1,42 (q, J=11,5 Гц, 2H) + MS: 411 m/z (M+H) . Синтез сполуки 29 {4-[({[5-(2,3-дифторфеніл)-1H-індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтова кислота {4-[({[5-(2,3-дифторфеніл)-1H-індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтову кислоту 29 отримують у відповідності з процедурою, описаною для сполуки 21, виходячи зі сполуки 25c та (2,3-дифторфеніл)боронової кислота та використовуючи наступні препаративні ВЕРХ параметри для очищення: канал A=CH 3CN+0,1 % мурашиної кислоти; канал B=H2O+0,1 % мурашиної кислоти: потік = 40 мл/хвил.; градієнт = від 15 до 50 % елюенту A за 15 хвилин. Вихід: 20 мг, (11,7 %). 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,68 (br. s., 1H), 8,51 (t, J=6,1 Гц, 1H), 8,35 (d, J=0,6 Гц, 1H), 7,74 (dd, J=0,7, 8,8 Гц, 1H), 7,61 (td, J=1,7, 8,7 Гц, 1H), 7,51-7,25 (m, 3H), 3,33-3,10 (m, 6H), 2,642,53 (m, 2H), 1,74 (d, J=10,5 Гц, 3H), 1,54-1,29 (m, 2H) Синтез сполуки 30 {4-[({[5-(5-метоксипіридин-3-іл)-1H-індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтова кислота {4-[({[5-(5-метоксипіридин-3-іл)-1H-індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтову кислоту 30 отримують у відповідності з процедурою, описаною для сполуки 21, виходячи зі сполуки 25c та (5-метоксипіридин-3-іл)боронової кислоти та використовуючи наступні препаративні ВЕРХ параметри для очищення: канал A=CH3CN+0,1 % мурашиної кислоти; канал B=H2O+0,1 % мурашиної кислоти: потік = 40 мл/хвил.; градієнт = від 2 до 40 % елюенту A за 15 хвилин. Вихід: 47 мг (27,8 %). 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,73 (br. s., 1H), 8,54-8,49 (m, 1H), 8,48 (d, J=1,6 Гц, 1H), 8,44-8,39 (m, 1H), 8,30 (d, J=2,7 Гц, 1H), 7,81-7,76 (m, 1H), 7,76-7,69 (m, J=0,7 Гц, 1H), 7,61 (dd, J=1,8, 2,7 Гц, 1H), 3,93 (s, 3H), 3,29-3,12 (m, 6H), 2,69-2,55 (m, 2H), 1,75 (d, J=11,0 Гц, 3H), 1,581,27 (m, 2H) Синтез сполуки 31 - [4-({[(5-етил-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]оцтова кислота. Суміш продукту 25c (170 мг, 0,4 ммоль), вініл-боронової кислоти пінаколінового складного ефіру (0,53 ммоль), [1,1′-біс(дифенілфосфіно)фероцен]-дихлор-паладію (II) (50 мг, 0,06 ммоль), насиченого розчину карбонату натрію (1,7 мл) у суміші толуол/етанол (співвідношення 1:1, 10 мл) нагрівають у мікрохвильовій печі при 150 °C, 500Вт впродовж 2 год. Після фільтрування через целіт, розчинники видаляють при зниженому тиску та сирий продукт елююють через силікагелевий картридж сумішшю хлороформ/метанол із співвідношенням 1:1. Розчинники видаляють при зниженому тиску та отриману сиру проміжну речовину розчиняють у етанолі (20 мг/мл) та гідрогенують на 10 % Pd/C картриджі при 30 °C, 1 мл/хвил. у Thales Nano H-CUBE гідрогенізатор, що забезпечує одержання [4-({[(5-етил-1H-індазол-3 20 UA 112564 C2 5 10 15 20 25 30 35 40 45 50 55 60 іл)карбоніл]аміно}метил)піперидин-1-іл]оцтової кислоти 31, що очищують використовуючи наступні препаративні ВЕРХ параметри: канал A=CH3CN+0,1 % мурашиної кислоти; канал B=H2O+0,1 % мурашиної кислоти: потік = 40 мл/хвил.; градієнт = 10-45 % елюенту A за 15 хвилин. Вихід 170 мг, (41,0 %). 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,48 (br. s., 1H), 8,38 (t, J=6,1 Гц, 1H), 7,97 (s, 1H), 7,52 (d, J=8,6 Гц, 1H), 7,28 (dd, J=1,6, 8,6 Гц, 1H), 4,38 (br. s., 1H), 3,33-3,09 (m, 6H), 2,73 (q, J=7,5 Гц, 2H), 2,65-2,53 (m, 2H), 1,83-1,60 (m, 3H), 1,54-1,31 (m, 2H), 1,23 (t, J=7,5 Гц, 3H) Синтез сполуки 32 - {4-[({[5-(пропан-2-іл)-1H-індазол-3-іл]карбоніл}аміно)-метил]піперидин-1іл}оцтова кислота {4-[({[5-(пропан-2-іл)-1H-індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтову кислоту 32 отримують у відповідності з процедурою, описаною для сполуки 31, виходячи із 1-метилетиленборонової кислоти пінаколінового складного ефіру. Вихід = 33 мг (7,7 %). 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,45 (br. s., 1H), 8,38 (t, J=6,1 Гц, 1H), 8,10-7,86 (m, 1H), 7,52 (dd, J=0,5, 8,6 Гц, 1H), 7,32 (dd, J=1,6, 8,8 Гц, 1H), 4,65 (br. s., 1H), 3,29-3,13 (m, 6H), 3,02 (квінт, J=6,8, 13,7 Гц, 1H), 2,57 (t, J=11,3 Гц, 2H), 1,73 (d, J=10,8 Гц, 3H), 1,55-1,32 (m, 2H), 1,26 (d, J=7,0 Гц, 6H) Синтез сполуки 33 {4-[({[5-(3,6-дигідро-2H-піран-4-іл)-1H-індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтова кислота {4-[({[5-(3,6-дигідро-2H-піран-4-іл)-1H-індазол-3-іл]карбоніл}аміно)метил]піперидин-1іл}оцтову кислоту 33 отримують у відповідності з процедурою, описаною для сполуки 31 (без стадії гідрогенування), виходячи з 4-метил-3,6-дигідро-2H-піраніл-боронової кислоти пінаколінового складного ефіру. Вихід = 150 мг (37,7 %). 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,65 (br. s., 1H), 8,44 (t, J=5,9 Гц, 1H), 8,15 (s, 1H), 7,71-7,47 (m, 2H), 6,27 (br. s., 1H), 5,78-4,52 (m, 1H), 4,25 (d, J=2,2 Гц, 2H), 3,86 (t, J=5,3 Гц, 2H), 3,34-3,05 (m, 6H), 2,68-2,54 (m, 4H), 1,74 (d, J=10,9 Гц, 3H), 1,42 (q, J=11,5 Гц, 2H). Синтез сполуки 34 - [4-({[(5-циклогексил-1H-індазол-3-іл)карбоніл]аміно}-метил)-піперидин-1іл] оцтова кислота [4-({[(5-циклогексил-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]оцтову кислоту 34 отримують у відповідності з процедурою, описаною для сполуки 31, виходячи з циклогексенілборонової кислоти пінаколінового складного ефіру. Вихід = 158 мг (39,6 %). 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,48 (br. s., 1H), 8,38 (t, J=6,0 Гц, 1H), 7,98 (s, 1H), 7,51 (d, J=8,8 Гц, 1H), 7,30 (dd, J=1,2, 8,7 Гц, 1H), 4,67 (br. s., 1H), 3,24 (d, J=4,8 Гц, 6H), 2,68-2,53 (m, 3H), 1,96-1,58 (m, 8H), 1,54-1,14 (m, 7H) Синтез сполуки 35 - [4-({[(5-пентил-1H-індазол-3-іл)карбоніл]аміно}метил)-піперидин-1іл]оцтова кислота [4-({[(5-пентил-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]оцтову кислоту 35 отримують у відповідності з процедурою, описаною для сполуки 31, виходячи з 5-пентилборонової кислоти пінаколінового складного ефіру. Вихід = 176 мг (45,6 %). 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,49 (br. s., 1H), 8,38 (t, J=5,9 Гц, 1H), 7,95 (s, 1H), 7,51 (dd, J=0,7, 8,6 Гц, 1H), 7,25 (dd, J=1,5, 8,8 Гц, 1H), 3,20 (s, 6H), 2,69 (t, J=7,4 Гц, 2H), 2,59 (t, J=11,1 Гц, 2H), 1,86-1,15 (m, 11H), 0,93-0,77 (m, 3H). Синтез сполуки 36-5-метокси-N-[(1-{3-[(фенілкарбоніл)аміно]пропіл}піперидин-4-іл)метил]1H-індазол-3-карбоксамід 36a) трет-бутил {3-[4-({[(5-метокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1іл]пропіл}карбамат Розчин сполуки 24b (1,37 г, 4,36 ммоль) у ДМФА (45 мл) та триетиламін (1,3 мл, 9,5 ммоль) перемішують при 80 °C впродовж 1 год. та потім обробляють за допомогою трет-бутил(3бромпропіл)карбамату (1,7 г, 7,1 ммоль). Зазначену суміш перемішують впродовж ночі при цій же температурі. Реакційну суміш потім охолоджують до кімнатної температури та розчинник видаляють шляхом випарювання при зниженому тиску. Сирий трет-бутил {3-[4-({[(5-метокси-1Hіндазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]пропіл}-карбамат 36a використовують для наступної стадії без додаткових очищень. + РХ-МС: 446,3 (M+H) . 36b) N-{[1-(3-амінопропіл)піперидин-4-іл]метил}-5-метокси-1H-індазол-3-карбоксамід Розчин сирого трет-бутил {3-[4-({[(5-метокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]пропіл}карбамату 36a (приблизно 1,8 г) у CH2Cl2 (15 мл) обробляють за допомогою трифтороцтової кислоти (7 мл) при кімнатній температурі впродовж ночі. Цей розчин потім виливають у воду (50 мл) та промивають за допомогою CH 2Cl2 (3 × 20 мл). Кислу фазу підлужують та концентрують при зниженому тиску. Твердий залишок екстрагують сумішшю CH3Cl/CH3OH у співвідношенні 8/2 (3 × 20 мл) та розчинник випарюють при зниженому тиску. 21 UA 112564 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сирий N-{[1-(3-амінопропіл)піперидин-4-іл]метил}-5-метокси-1H-індазол-3-карбоксамід 36b використовують на наступних стадіях без додаткових очищень. + РХ-МС: 346,2 (M+H) . До розчину сирого N-{[1-(3-амінопропіл)піперидин-4-іл]метил}-5-метокси-1H-індазол-3карбоксаміду 36b (приблизно 350 мг, 1 ммоль) у ДМСО (1,5 мл) та CH 2Cl2 (10 мл) додають бензоїл-хлорид (71 мкл, 0,61 ммоль). Цей розчин потім перемішують при кімнатній температурі впродовж 2 год. Зазначену суміш потім додають до води (20 мл) та екстрагують за допомогою CH2Cl2 (3 × 10 мл). Об'єднані органічні фази концентрують при зниженому тиску та сирий продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш CHCl3/CH3OH=9:1 як елюент. Отримують 5-метокси-N-[(1-{3-[(фенілкарбоніл)аміно]пропіл}піперидин-4-іл)метил]-1H-індазол-3-карбоксамід 36 (71 мг). 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,43 (s, 1H), 8,59-8,47 (t, J=5,31 Гц, 1H), 8,38-8,24 (t, J=6,04 Гц, 1H), 7,90-7,74 (m, 2H), 7,61-7,35 (m, 5H), 7,10-6,99 (dd, J=9,15, 2,56 Гц, 1H), 3,89-3,69 (s, 3H), 3,39-3,12 (m, 6H), 3,11-2,94 (m, 2H), 2,25-1,89 (m, 2H), 1,83-1,53 (m, 5H), 1,36-1,12 (d, J=11,34 Гц, 2H) + РХ-МС: 450,25 (MH ) Синтез сполуки 37-N-({1-[3-(бутаноїламіно)пропіл]піперидин-4-іл}метил)-5-метокси-1Hіндазол-3-карбоксамід N-({1-[3-(бутаноїламіно)пропіл]піперидин-4-іл}метил)-5-метокси-1H-індазол-3-карбоксамід 37 отримують у відповідності з процедурою, описаною для сполуки 36, виходячи з бутаноїлхлориду. Вихід = 75 мг (36,8 %). 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,44 (s, 1H), 8,41-8,26 (t, J=6,11 Гц, 1H), 7,89-7,69 (t, J=5,12 Гц, 1H), 7,58-7,54 (d, J=2,31, 1H), 7,53-7,47 (dd, J=8,92, 0,66 Гц, 1H), 7,11-6,96 (dd, J=9,08, 2,48 Гц, 1H), 3,80 (s, 3H), 3,52-2,77 (m, 10H), 2,10-1,92 (t, J=7,27 Гц, 2H), 1,81-1,12 (m, 9H), 0,91-0,77 (t, J=7,27, 3H) РХ-МС: 416,27 (MH+) Синтез сполуки 38-N-[(1-{3-[(2E)-бут-2-еноїламіно]пропіл}піперидин-4-іл)метил]-5-метокси1H-індазол-3-карбоксамід N-[(1-{3-[(2E)-бут-2-еноїламіно]пропіл}піперидин-4-іл)метил]-5-метокси-1H-індазол-3карбоксамід 38 отримують у відповідності з процедурою, описаною для сполуки 36, виходячи з (2E)-бут-2-еноїл-хлориду. Вихід = 45 мг (51,4 %). 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,44 (s, 1H), 8,45-8,25 (m, 1H), 8,00-7,75 (m, 1H), 7,60-7,53 (d, J=2,40 Гц, 1H), 7,53-7,47 (d, J=8,90 Гц, 1H), 7,09-7,01 (dd, J=2,70, 2,30 Гц, 1H), 6,67-6,50 (m, 1H), 5,75-6,00 (m, 1H), 3,80 (s, 3H), 3,50-1,00 (m, 20H) РХ-МС: 414,25 (M-H+) Синтез сполуки 39-5-метокси-N-({1-[3-(пропанoїл-аміно)пропіл]піперидин-4-іл}метил)-1Hіндазол-3-карбоксамід 5-метокси-N-({1-[3-(пропанoїламіно)пропіл]піперидин-4-іл}метил)-1H-індазол-3-карбоксамід 39 отримують у відповідності з процедурою, описаною для сполуки 36, виходячи з пропанoїлхлориду. Вихід = 90 мг (68,8 %). 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,28 (s, 1H), 8,17-8,00 (m, 1H), 7,65-7,55 (m, 1H), 7,58-7,54 (d, J=2,20 Гц, 1H), 7,52-7,45 (d, J=9,20 Гц, 1H), 7,10-7,00 (dd, J=9,15, 2,60 Гц, 1H), 3,81 (s, 3H), 3,30-2,85 (m, 8H), 2,11-2,00 (q, J=7,70 Гц, 2H), 1,80-1,52 (m, 6H), 1,40-1,15 (m, 3H), 1,03-0,95 (t, J=7,70 Гц, 3H) РХ-МС: 402,25 (M-H+) Синтез сполуки 40-N-({1-[3-(бут-2-иноїламіно)пропіл]піперидин-4-іл}метил)-5-метокси-1Hіндазол-3-карбоксамід N-({1-[3-(бут-2-иноїламіно)пропіл]піперидин-4-іл}метил)-5-метокси-1H-індазол-3-карбоксамід 40 отримують у відповідності з процедурою, описаною для сполуки 36, виходячи з 2-бутиноїлхлориду. Вихід = 17 мг (17,1 %). 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,34 (s, 1H), 8,52-8,42 (t, J=5,31 Гц, 1H), 8,27-8,18 (t, J=6,04 Гц, 1H), 7,56-7,52 (d, J=2,20 Гц, 1H), 7,52-7,47 (d, J=8,78 Гц, 1H), 7,05-6,99 (dd, J=8,96, 2,38 Гц, 1H), 3,80 (s, 3H), 3,21-3,13 (t, J=6,40 Гц, 2H), 3,11-3,01 (q, J=6,59 Гц, 2H), 2,87-2,75 (d, J=11,34 Гц, 2H), 2,30-2,18 (t, J=6,95 Гц, 2H), 1,94 (s, 3H), 1,88-1,73 (t, J=10,61 Гц, 2H), 1,70-1,45 (m, 5H), 1,301,10 (m, 2H) РХ-МС: 412,23 (M-H+) Синтез сполуки 41 [4-({[(5-бром-6-гідрокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]оцтова кислота До розчину сполуки 20 (200 мг, 0,44 ммоль) у CH 2Cl2 (15 мл), охолодженого до -78 °C, повільно додають розчин 1M BBr3 у CH2Cl2 (2,2 мл, 2,2 ммоль) (приблизно 1 год.). Зазначену 22 UA 112564 C2 5 10 15 20 25 суміш залишають досягти кімнатної температури та перемішують при цій температурі впродовж 2 днів. Зазначену суміш потім виливають у насичений розчин NaHCO 3 та екстрагують за допомогою CH2Cl2 (3 × 100 мл). Основну фазу підкислюють за допомогою 1 н. HCl та концентрують при зниженому тиску. Залишок потім обробляють за допомогою ДМСО (6 мл) та [4-({[(5-бром-6-гідрокси-1H-індазол-3-іл)карбоніл]аміно}-метил)піперидин-1-іл]оцтову кислоту 41 очищують, використовуючи наступні препаративні ВЕРХ параметри: канал A=CH 3CN+0,1 % мурашиної кислоти; канал B=H2O+0,1 % мурашиної кислоти: потік = 40 мл/хвил.; градієнт = 1045 % елюенту A за 15 хвилин. Вихід 36 мг. 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,27 (br. s., 1H), 12,53-8,62 (m, 0H), 8,39 (t, J=6,0 Гц, 1H), 8,27-8,14 (m, 1H), 7,08 (s, 1H), 6,74-3,42 (m, 2H), 3,34-3,07 (m, 6H), 2,62 (t, J=11,2 Гц, 2H), 1,74 (d, J=11,0 Гц, 3H), 1,42 (q, J=11,7 Гц, 2H) Синтез сполуки 42 [4-({[(5-бром-6-метокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]оцтова кислота [4-({[(5-бром-6-метокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]оцтову кислоту 42 отримують шляхом стадії очищення, описаної у одержанні сполуки 41. Вихід 35 мг. 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,66 (br. s., 1H), 8,45 (t, J=6,1 Гц, 1H), 8,30 (s, 1H), 7,15 (s, 1H), 6,80-4,69 (m, 1H), 3,93 (s, 3H), 3,33-3,10 (m, 6H), 2,64 (t, J=11,2 Гц, 2H), 1,75 (d, J=10,9 Гц, 3H), 1,43 (q, J=11,6 Гц, 2H) Синтез сполуки 44 - етил [4-({[(5-метокси-1H-індазол-3-іл)-карбоніл]аміно}-метил)піперидин1-іл]ацетат Етил [4-({[(5-метокси-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]ацетат отримують у відповідності з процедурою, описаною для сполуки 25c, виходячи з 5-метокси-N-(піперидин-4ілметил)-1H-індазол-3-карбоксаміду гідрохлориду 24b (65 %). 1 H ЯМР (300 MГц, ДМСО-d6) δ = 13,54 (s, 1H), 8,30 (t, J=6,06 Гц, 1H), 7,56 (s, 1H), 7,51 (d, J=8,91 Гц, 1H), 7,05 (d, J=8,91 Гц, 1H), 4,00 (q, J=7,13 Гц, 2H), 3,81 (s, 3H), 3,34 (s, 2H), 3,17-3,24 (m, 2H), 2,81-2,95 (m, 4H), 1,50-1,75 (m, 3H), 1,16-1,36 (m, 2H), 1,11 (t, J=7,13 Гц, 3H) РХ-МС: 375,2 (M-H+) У наступній Таблиці 1A підсумовані хімічна назва та структура описаних вище сполук 20-44. Таблиця 1А IUPAC назва Структура CH3 O N Етил [4-({[(5-бром-6-метокси-1H20 індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]ацетат O NH O N Br H3C NH O OH N O {4-[({[6-метокси-5-(піридин-3-іл)-1Hіндазол-3-іл]карбоніл}аміно)метил] 21 піперидин-1-іл}оцтової кислоти форміату гідрат O NH N NH N O CH3 23 UA 112564 C2 Таблиця 1А IUPAC назва Структура OH N O {4-[({[6-метокси-5-(5-метоксипіридин-3іл)-1H-індазол-3-іл]карбоніл}аміно)CH3 22 метил]піперидин-1-іл}оцтової кислоти O гідрат NH O N NH N O CH3 OH N O {4-[({[5-(2,3-дифторфеніл)-6-метокси1H-індазол-3-іл]карбоніл}аміно)23 метил]піперидин-1-іл}оцтової кислоти гідрат NH O F F N NH O CH3 OH O N 4-[4-({[(5-метокси-1H-індазол-3-іл)24 карбоніл]аміно}метил)піперидин-1-іл]бутанова кислота NH O H3C N O NH O Етил 4-[4-({[(5-метокси-1H-індазол-324c іл)карбоніл]аміно}метил)піперидин-1іл]бутаноат CH3 NH N O O CH3 N O N H N {4-[({[5-(Піримідин-5-іл)-1H-індазол-325 іл]карбоніл}аміно)метил]піперидин-1іл}оцтової кислоти гідрат O OH O NH N N N H 24 N UA 112564 C2 Таблиця 1А IUPAC назва Структура O Етил [4-({[(5-бром-1H-індазол-3-іл)25c карбоніл]аміно}метил)піперидин-1іл]ацетат NH Br CH3 N O N O N H N O CH3 OH O NH O {4-[({[5-(3,5-Диметилізоксазол-4-іл)-1H26 індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтової кислоти гідрат H C 3 N N N H Cl O Cl OH O {4-[({[5-(2,3-дихлорфеніл)-1H-індазол-327 іл]карбоніл}аміно)метил]піперидин-1-іл} оцтової кислоти гідрат NH N N N H F O OH O {4-[({[5-(3-фторфеніл)-1H-індазол-328 іл]карбоніл}аміно)метил]піперидин-1-іл} оцтової кислоти гідрат NH N N N H F O F OH O {4-[({[5-(2,3-дифторфеніл)-1H-індазол29 3-іл]карбоніл}аміно)метил]піперидин-1іл}оцтова кислота NH N N N H OH N O {4-[({[5-(5-метоксипіридин-3-іл)-1H30 індазол-3-іл]карбоніл}аміно)метил]піперидин-1-іл}оцтова кислота CH3 O O NH N NH N 25 UA 112564 C2 Таблиця 1А IUPAC назва Структура O OH O [4-({[(5-етил-1H-індазол-331 іл)карбоніл]аміно}метил)піперидин-1іл]оцтова кислота NH N H3C N N H O CH3 {4-[({[5-(пропан-2-іл)-1H-індазол-3-іл]32 карбоніл}аміно)метил]піперидин-1-іл}оцтова кислота OH O NH N H3C N N H O O {4-[({[5-(3,6-дигідро-2H-піран-4-іл)-1H33 індазол-3-іл]карбоніл}аміно)метил] піперидин-1-іл}оцтова кислота N NH OH O N N H O [4-({[(5-циклогексил-1H-індазол-3-іл) 34 карбоніл]аміно}метил)піперидин-1-іл] оцтова кислота N NH OH O N N H CH3 O [4-({[(5-пентил-1H-індазол-3-іл) 35 карбоніл]аміно}метил)піперидин-1-іл] оцтова кислота N NH OH O N N H CH3 O O NH O 5-метокси-N-[(1-{336 [(фенілкарбоніл)аміно]пропіл}піперидин4-іл)метил]-1H-індазол-3-карбоксамід NH N N N H CH3 N-({1-[3-(бутаноїламіно)пропіл] 37 піперидин-4-іл}метил)-5-метокси-1Hіндазол-3-карбоксамід O O NH O N NH CH3 N N H CH3 N-[(1-{3-[(2E)-бут-2-еноїламіно]пропіл} 38 піперидин-4-іл)метил]-5-метокси-1Hіндазол-3-карбоксамід O O NH O N N N H 26 NH CH3 UA 112564 C2 Таблиця 1А IUPAC назва Структура 5-метокси-N-({1-[3-(пропанoїламіно) 39 пропіл]піперидин-4-іл}метил)-1Hіндазол-3-карбоксамід O O CH3 NH O NH N CH3 N N H O CH3 N-({1-[3-(бут-2-иноїламіно)пропіл] 40 піперидин-4-іл}метил)-5-метокси-1Hіндазол-3-карбоксамід NH O N O NH N N H CH3 Br O [4-({[(5-бром-6-гідрокси-1H-індазол-341 іл)карбоніл]аміно}метил)піперидин-1-іл] HO оцтова кислота NH N H O NH O CH3 10 15 20 OH N N O NH O CH3 N O N N H 5 O H3C N H етил [4-({[(5-метокси-1H-індазол-3-іл)44 карбоніл]аміно}метил)піперидин-1-іл] ацетат OH N N Br [4-({[(5-бром-6-метокси-1H-індазол-342 іл)карбоніл]аміно}метил)піперидин-1-іл] оцтова кислота O O Фармакологічні властивості Фармакологічні властивості сполук формули (I), корисних у даному винаході, оцінюють за способами, описаними у наступних розділах. Випробування I - Активність на GSK-3β людини (випробування in vitro) Активність на GSK-3β людини оцінюють, використовуючи наступні способи (відповідно до Meijer et al., Chem. Biol., 2003-10:1255-1266). У першому скринінговому дослідженні, сполуки випробують у двох повторах при концентрації 10 мкM. Рекомбінантний фермент GSK-3β людини інкубують впродовж 90 хвилин при 22 °C у присутності сполук або носія у реакційному буфері, що містить АТФ плюс 100 нM нефосфорильований специфічний субстратний пептид (Ulight-CFFKNIVTPRTPPPSQGK-амід). Субстратне фосфорилювання вимірюють за допомогою LANCE технології (PerkinElmer, CT, USA). Результати, представлені у наступній Таблиці 4, виражають у вигляді відсотку інгібування контрольної специфічної активності, отриманої у присутності випробовуваної сполуки (як % інгібування при 10 мкM). У другому випробуванні, ті самі сполуки досліджують при п'яти концентраціях у інтервалі від 100 мкM до 10 нM з десятиразовими розведеннями у двох повторах. Сполуки 1-15 випробовують, використовуючи те саме перше випробування, сполуки 16-41 випробовують у іншому випробуванні на основі зв'язування та заміщення AlexaFluor® 647 міченого, АТФконкурентного кіназного інгібіторного каркасу, використовуючи LanthaScreen™ TR-FRET технологію Eu кіназний випробувальний пакет у відповідності до інструкцій виробника (Life Technologies, Italy). Результати двох випробувань є порівняними. 27 UA 112564 C2 5 IC50 значення (концентрація, що спричиняє половину максимального інгібування контрольної специфічної активності), представлені у Таблиці 4, визначають шляхом нелінійного регресійного аналізу кривих інгібування, створених з середніми значеннями повторів, використовуючи обробку кривої рівняння Хіла. IC50 значення (концентрація, що спричиняє половину максимального інгібування контрольної специфічної активності), представлені у Таблиці 4, визначають шляхом нелінійного регресійного аналізу кривих інгібування, створених з середніми значеннями повторів, використовуючи обробку кривої рівняння Хіла. Таблиця 4 Сполука N° 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 18 24 25 25b 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 % Інгібування [10 мкM] 92 85 94 71 IC50 [мкM] 0,67 0,87 0,69 0,03 0,05 0,07 0,06 0,02 0,20 0,03 0,89 0,56 0,56 1,40 0,05 0,58 1,06 1,03 0,22 0,53 0,91 0,10 0,11 0,03 0,02 0,96 3,91 1,04 1,07 2,04 3,42 0,97 0,78 0,95 0,88 10 15 20 Результати показали, що сполуки у відповідності з даним винаходом мають непогану інгібіторну активність у зазначеному випробуванні: при 10 мкM % інгібування більше, ніж 70 % та IC50 отримують з менше, ніж 4,00 мкM кожної сполуки. Більшість сполук показали IC 50 значення нижче, ніж 1,50 мкM. Випробування II – Селективність на GSK-3β (випробування in vitro) (a) Сполуки 1 та 2 випробовують по відношенню до панелі 60 кіназ для того, щоб оцінити її селективність. Випробування вибирають, беручи до уваги відмінність досліджуваних сімейств. Випробовувані кінази є типовими представниками наступних кіназних підсімейств: - протеїн-серін/треонін кінази; - протеїн-тирозин кінази; 28
ДивитисяДодаткова інформація
Назва патенту англійською1h-indazole-3-carboxamide compounds as glycogen synthase kinase 3 beta inhibitors
Автори англійськоюAlisi, Maria Alessandra, Cazzolla, Nicola, Dragone, Patrizia, Furlotti, Guido, Maugeri, Caterina, Ombrato, Rosella, Mancini, Francesca
Автори російськоюАлиси Мария Алессандра, Каццолла Никола, Драгонэ Патриция, Фурлотти Гвидо, Мауджэри Катерина, Омбрато Розэлла, Манчини Франческа
МПК / Мітки
МПК: C07D 405/14, C07D 401/12, C07D 401/14, A61K 31/454, A61K 31/4545
Мітки: сполуки, 1н-індазол-3-карбоксамідні, 3-бета, інгібітори, глікогенсинтаза-кінази
Код посилання
<a href="https://ua.patents.su/36-112564-1n-indazol-3-karboksamidni-spoluki-yak-ingibitori-glikogensintaza-kinazi-3-beta.html" target="_blank" rel="follow" title="База патентів України">1н-індазол-3-карбоксамідні сполуки як інгібітори глікогенсинтаза-кінази 3-бета</a>
Попередній патент: Водонепроникне та паропроникне взуття, зокрема, але не виключно, захисного або йому подібного типу
Наступний патент: Біциклічні похідні дигідроізохінолін-1-ону
Випадковий патент: Спосіб очищення відходів тари від фосфіну на об'єктах транспорту












