Амідзаміщені індазоли як інгібітори полі(adp-рибоза)полімерази (parp)
Номер патенту: 97658
Опубліковано: 12.03.2012
Автори: Онторія Онторія Хесус Марія, Шультц-Фадемрехт Карстен, Джоунс Філіп, Скарпеллі Ріта
Формула / Реферат
1. Сполука формули І:
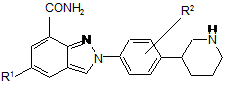 , (I)
, (I)
де:
R1 представляє водень або фтор; і
R2 представляє водень або фтор;
або її фармацевтично прийнятні солі, стереоізомери або таутомери.
2. Сполука за п. 1 формули II:
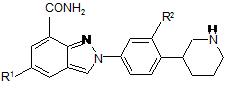 , (II)
, (II)
де:
R1 і R2 мають значення, визначені у п. 1;
або її фармацевтично прийнятні солі, стереоізомери або таутомери.
3. Сполука за п. 1 формули III:
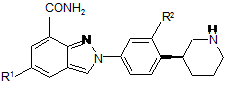 , (III)
, (III)
де:
R1 і R2 мають значення, визначені в п. 1;
або її фармацевтично прийнятні солі або таутомери.
4. Сполука за п. 1 формули IV:
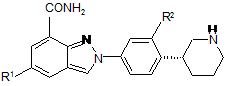 , (IV)
, (IV)
де:
R1 і R2 мають значення, визначені в п. 1;
або її фармацевтично прийнятні солі або таутомери.
5. Сполука за будь-яким з пунктів 1-4, де
R1 являє собою водень, і
R2 представляє водень або фтор.
6. Сполука за п. 1, вибрана з:
2-(4-піперидин-3-ілфеніл)-2Н-індазол-7-карбоксаміду;
2-{4-[(3R)-пiпepидин-3-iл]фeнiл}-2H-iндaзoл-7-кapбoкcaмiдy;
2-{4-[(3S)-піперидин-3-іл]феніл}-2Н-індазол-7-карбоксаміду;
5-фтор-2-(4-піперидин-3-ілфеніл)-2Н-індазол-7-карбоксаміду;
5-фтор-2-{4-[(3S)-піперидин-3-іл]феніл}-2Н-індазол-7-карбоксаміду;
5-фтор-2-{4-[(3R)-пiпepидин-3-іл]феніл}-2Н-індазол-7-карбоксаміду;
5-фтор-2-(3-фтор-4-піперидин-3-ілфеніл)-2Н-індазол-7-карбоксаміду;
5-фтop-2-{3-фтop-4-[(3R)-піпepидин-3-iл]фeнiл}-2H-iндaзoл-7-кapбoкcaмiдy;
5-фтор-2-{3-фтор-4-[(3S)-піперидин-3-іл]феніл}-2Н-індазол-7-карбоксаміду;
і їх фармацевтично прийнятних солей, таутомерів або стереоізомерів.
7. Сполука за п. 6, вибрана з
2-{4-[(3R)-піперидин-3-іл]феніл}-2Н-індазол-7-карбоксаміду;
2-{4-[(3S)-піперидин-3-іл]феніл}-2Н-індазол-7-карбоксаміду;
і їх фармацевтично прийнятних солей або таутомерів.
8. Сполука за будь-яким з пп. 1-7 або її фармацевтично прийнятна сіль, стереоізомер або таутомер для лікування або запобігання станам, які можуть полегшуватися шляхом інгібування полі(АDР-рибоза)полімерази (PARP).
9. Фармацевтична композиція, яка містить сполуку за будь-яким з пунктів 1-7 або її фармацевтично прийнятну сіль, таутомер або стереоізомер у комбінації з фармацевтично прийнятним носієм.
10. Фармацевтична комбінація, яка містить сполуку за будь-яким з пунктів 1-7 або її фармацевтично прийнятну сіль, стереоізомер або таутомер і протираковий агент, для одночасного, окремого або послідовного введення.
11. Застосування сполуки за будь-яким з пп. 1-7 або її фармацевтично прийнятної солі, стереоізомера або таутомеру для виробництва лікарського засобу для лікування або запобігання станам, які можуть полегшуватися шляхом інгібування полі(АDР-рибоза)полімерази (PARP).
12. Застосування сполуки за будь-яким з пп. 1-7 або її фармацевтично прийнятної солі, стереоізомера або таутомеру для виробництва лікарського засобу для запобігання або лікування раку, запальних захворювань, реперфузійних ушкоджень, ішемічних станів, інсульту, ниркової недостатності, серцево-судинних захворювань, судинних захворювань, інших ніж серцево-судинні, діабету, нейродегенеративних захворювань, ретровірусної інфекції, ушкодження сітківки або старіння шкіри і УФ-індукованого ушкодження шкіри.
13. Застосування сполуки за будь-яким з пп. 1-7 або її фармацевтично прийнятної солі, стереоізомера або таутомеру як хіміо- і/або радіосенсибілізатора для лікування раку.
14. Спосіб запобігання або лікування раку, запальних захворювань, реперфузійних ушкоджень, ішемічних станів, інсульту, ниркової недостатності, серцево-судинних захворювань, судинних захворювань, інших ніж серцево-судинні, діабету, нейродегенеративних захворювань, ретровірусної інфекції, ушкодження сітківки або старіння шкіри і УФ-індукованого ушкодження шкіри, в якому пацієнту, який потребує цього, вводять ефективну кількість сполуки за п. 1 або композиції, що містить сполуку за п. 1.
Текст
Реферат: Даний винахід стосується сполук формули (І) і їх фармацевтично прийнятних солей, стереоізомерів або таутомерів, які є інгібіторами полі(АDР-рибоза)полімерази (PARP) і корисні, таким чином, при лікуванні раку, запальних захворювань, реперфузійних ушкоджень, ішемічних станів, інсульту, ниркової недостатності, серцево-судинних захворювань, судинних захворювань, інших ніж серцево-судинні, діабету, нейродегенеративних захворювань, ретровірусної інфекції, ушкодження сітківки або старіння шкіри й УФ-індукованого ушкодження шкіри, і як хіміо- і/або радіосенсибілізатори для лікування раку. CONH2 R2 H N N N R1 UA 97658 C2 (12) UA 97658 C2 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується амідзаміщених індазолів, які є інгібіторами ферменту полі(АDРрибоза)полімерази (PARP), раніше відомого як полі(АDР-рибоза)синтаза і полі(АDРрибозил)трансфераза. Сполуки даного винаходу корисні як монотерапевтичні засоби при пухлинах зі специфічними дефектами в ДНК-репараційних шляхах і як підсилювачі деяких ДНКушкоджувальних агентів, таких як протиракові агенти, і при радіотерапії. Далі, сполуки даного винаходу корисні для зниження некрозу клітин (при інсульті й інфаркті міокарда), зменшення запалення й ушкодження тканин, лікування ретровірусних інфекцій і захисту від токсичних ефектів хіміотерапії. Полі(АDР-рибоза)полімераза (PARP) складає надсімейство вісімнадцяти білків, що містять PARP каталітичні домени (Bioessays (2004) 26:1148). Дане сімейство білків містить PARP-1, PARP-2, PARP-3, танкіразу-1, танкіразу-2, vaultPARP і TiPARP. PARP-1, основний член сімейства складається з трьох головних доменів: аміно (ІЧ)-кшцевого ДНК-зв'язувального домену (DBD), що містить два цинкових пальці, автомодифікаційного домену і карбокси (С)кінцевого каталітичного домену. + PARP є ядерними і ендоплазматичними ферментами, які розщеплюють NAD на нікотинамід і ADP-рибозу, утворюючи довгі і розгалужені ADP-рибозні полімери в цільових білках, включаючи топоізомерази, гістони і сам PARP (Biochem. Biophys. Res. Commun. (1998) 245:110). Полі(АDР-рибозилування) залучене у кілька біологічних процесів, що включають репарацію ДНК, генну транскрипцію, розвиток клітинного циклу, загибель клітин, хроматинові функції і геномну стабільність. Було показано, що каталітична активність PARP-1 і PARP-2 швидко стимулюється розривами ДНК нитки (див. Pharmacological Research (2005) 52:25-33). У відповідь на ДНК ушкодження PARP-1 зв'язується з однонитковим і двонитковим розривами ДНК. У нормальних фізіологічних умовах існує мінімальна активність PARP, однак, після ушкодження ДНК відбувається негайна активація PARP аж до 500-разової. Як PARP-1, так і PARP-2 виявляють розриви ДНК нитки, діючи як сенсори розривів, даючи швидкі сигнали зупинки транскрипції і залучаючи ферменти, необхідні для репарації ДНК у місці ушкодження. Оскільки радіотерапія і багато які хіміотерапевтичні підходи до терапії раку основані на індукуванні ушкодження ДНК, інгібітори PARP є корисні як хіміо- і радіо сенсибілізатори для лікування раку. Повідомлялося, що інгібітори PARP є ефективні в радіо сенсибілізації гіпоксичних пухлинних клітин (патенти США 5032617, 5215738 і 5041653). Більшість біологічних ефектів PARP стосується даного процесу полі(АDР-рибозилування), що впливає на властивості і функцію цільових білків; PAR олігомерів, які, при відщіпленні від полі(АDР-рибозилованих) білків, викликають різні ефекти в клітинах; фізичної асоціації PARP з ядерними білками, з утворенням функціональних комплексів; і зниження клітинного рівня їх + субстрату NAD (Nature Review (2005) 4:421-440). Крім того, що вона залучена в репарацію ДНК, PARP також може діяти як медіатор загибелі клітин. Його надлишкова активація в таких патологічних станах, як ішемія і реперфузійне + ушкодження, може приводити в результаті до істотного виснаження міжклітинного NAD , що + може привести до порушення декількох NAD залежних метаболічних шляхів і в результаті до загибелі клітин (див. Pharmacological Research (2005) 52:44-59). В результаті активації PARP + + рівні NAD значно знижуються. Велика активація PARP веде до сильного виснаження NAD у клітинах, що страждають від масивного ушкодження ДНК. Короткий період напіврозпаду полі(АDР-рибози) приводить в результаті до швидкої швидкості обертання, оскільки, як тільки утворюється полі(АDР-рибоза), вона швидко розкладається під дією конститутивно активної полі(АDР-рибоза)глікогідролази (PARG). PARP і PARG утворюють цикл, який перетворює + + величезну кількість NAD у ADP-рибозу, викликаючи падіння рівня NAD і АТР до менше ніж 20% нормального рівня. Такий сценарій особливо шкідливий під час ішемії, коли нестача кисню вже негативно позначається на виході клітинної енергії. Передбачається, що наступне продукування вільних радикалів під час реперфузії є головною причиною ушкодження тканин. Частина падіння рівня АТР, який є типовим у багатьох органах під час ішемії і реперфузії, може + бути пов'язана з виснаженням рівня NAD внаслідок обороту полі(АБР-рибози). Таким чином, очікується, що інгібування PARP збереже рівень клітинної енергії, сприяючи, тим самим, виживанню ішемічних тканин після інсульту. Отже, сполуки, які є інгібіторами PARP, корисні при лікуванні станів, які є результатом PARP опосередковуваної загибелі клітин, включаючи неврологічні стани, такі як інсульт, травма і хвороба Паркінсона. Було продемонстровано, що інгібітори PARP є корисними для специфічного знищення пухлин з дефіцитом BRCA-1 і BRCA-2 (Nature (2005) 434:913-916 і 917-921; і Cancer Biology&Therару (2005) 4:934-936). 1 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 Було показано, що інгібітори PARP підсилюють ефективність протиракових лікарських препаратів (Pharmacological Research (2005) 52:25-33), включаючи сполуки платини, такі як цисплатин і карбоплатин (Cancer Chemother Pharmacol (1993) 33:157-162 і Моl Cancer Ther (2003) 2:371-382). Було показано, що інгібітори PARP збільшують протипухлинну активність інгібіторів топоізомерази І, таких як іринотекан і топотекан (Моl Cancer Ther (2003) 2:371-382; і Clin Cancer Res (2000) 6:2860-2867), і це було продемонстровано на in vivo моделях (J Natl Cancer Inst (2004) 96:56-67). Було показано, що інгібітори PARP відновлюють сприйнятливість до цитотоксичних антипроліферативних дій темозоломіду (TMZ) (див. Curr Med Chem (2002) 9:1285-1301 і Med Chem Rev Online (2004) 1:144-150). Це було продемонстровано на ряді in vitro моделей (Br J Cancer (1995) 72:849-856; Br J Cancer (1996) 74:1030-1036; Моl Pharmacol (1997) 52:249-258; Leukemia (1999) 13:901-909; Glia (2002) 40:44-54; і Clin Cancer Res (2000) 6:2860-2867 і (2004) 10:881-889) і in vivo моделях (Blood (2002) 99:2241-2244; Clin Cancer Res (2003) 9:5370-5379 і J Natl Cancer Inst (2004) 96:56-67). Було показано, що інгібітори PARP запобігають появі некрозу, що викликається селективними N3-аденінметилюючими агентами, такими як МеОSО 2(СН2)лекситропсин (Me-Lex) (Pharmacological Research (2005) 52:25-33). Було показано, що інгібітори PARP діють як сенсибілізатори радіації. Повідомлялося, що інгібітори PARP є ефективними в радіосенсибілізації (гіпоксичних) пухлинних клітин і ефективними в запобіганні видужуванню пухлинних клітин від потенційно летального (Br. J. Cancer (1984) 49 (Suppl. VI) 34-42; і Int. J. Radial Вiol. (1999) 75:91-100) і сублетального (Clin. Oncol. (2004) 16(1):29-39) ушкодження ДНК після лікування опроміненням, приблизно, під впливом їх здатності запобігати повторному з'єднанню розриву ДНК нитки й ушкодженню деяких сигнальних шляхів ушкодження ДНК. Було показано, що інгібітори PARP є корисними при лікуванні гострих і хронічних захворювань міокарда (див. Pharmacological Research (2005) 52:34-43). Наприклад, було продемонстровано, що разові ін'єкції інгібіторів PARP знижують розмір інфаркту, що викликається ішемією і реперфузією серцевого або скелетного м'яза у кроликів. У даних дослідженнях одна ін'єкція 3-амінобензаміду (10 мг/кг) за одну хвилину до оклюзії або за одну хвилину до реперфузії викликає аналогічні зниження розміру інфаркту в серце (32-42%), тоді як 1,5-дигідроксіізохінолін (1 мг/кг), ще один інгібітор PARP, знижує розмір інфаркту в порівнянному ступені (38-48%). Дані результати роблять обґрунтованим припущення, що інгібітори PARP можуть попередньо не допустити ішемічного серця або реперфузійного ушкодження скелетної м'язової тканини (PNAS (1997) 94:679-683). Повідомлялося також про аналогічні знахідки на свинях (Enr. J. Pharmacol. (1998) 359:143-150 і Ann. Thorac. Surg. (2002) 73:575-581 і на собаках (Shock. (2004) 21:426-32). Було продемонстровано, що інгібітори PARP є корисними при лікуванні деяких судинних захворювань, септичного шоку, ішемічного ушкодження і нейротоксичності (Biochim. Biophys. Acta (1989) 1014:1-7; J. Clin. Invest. (1997) 100: 723-735). Кисневе радикальне ушкодження ДНК, яке веде до розривів ниток у ДНК, які згодом розпізнаються за допомогою PARP, є головним чинником, що сприяє таким хворобливим станам, як показано дослідженнями інгібітору PARP (J. Neuroschi. Res. (1994) 39:38-46 і PNAS (1996) 93:4688-4692). Було продемонстровано також, що PARP відіграє роль у патогенезі геморагічного шоку (/WAS (2000) 97:10203-10208). Було продемонстровано, що інгібітори PARP є корисними при лікуванні запальних захворювань (див. Pharmacological Research (2005) 52:72-82 і 83-92). Було також продемонстровано, що ефективна ретровірусна інфекція клітин ссавців блокується інгібуванням активності PARP. Було показано, що таке інгібування інфекцій рекомбінантного ретровірусного вектора відбувається в численних типах клітин (J. Virology, (1996) 70(6) 3992-4000). Таким чином, інгібітори PARP були розроблені для застосування в антивірусній терапії і при лікуванні раку (WO 91/18591). Експерименти in vitro і in vivo продемонстрували, що інгібітори PARP можуть застосовуватися при лікуванні або запобіганні аутоімунних захворювань, таких як діабет типу І і діабетичні ускладнення (Pharmacological Research (2005) 52:60-71). Були припущення, що інгібування PARP затримує настання ознак старіння у фібробласах людини (Biochem. Biophys. Res. Comm. (1994) 201(2):665-672 і Pharmacological Research (2005) 52:93-99). Це може бути пов'язане з тією роллю, яку PARP відіграє при контролі тіловимірних функцій (Nature Gen., (1999) 23(1):76-80). Переважна більшість інгібіторів PARP, відомих дотепер, взаємодіють з нікотинамідзв'язувальним доменом ферменту і поводяться як конкурентні інгібітори відносно + NAD (Expert Opin. Ther. Patents (2004) 14:1531-1551). Структурні аналоги нікотинаміду, такі як бензамід і похідні, були серед перших сполук, досліджуваних як інгібітори PARP. Однак дані 2 UA 97658 C2 5 10 15 20 25 30 35 40 молекули мають слабку інгібуючу активність і роблять інші дії, не пов'язані з інгібуванням PARP. Таким чином, існує потреба в розробці сильних інгібіторів PARP ферменту. Структурно родинні інгібітори PARP були раніше описані. У WO 1999/59973 описані амідзаміщені бензольні кільця, конденсовані з 5-членними гетероароматичними кільцями; у WO 2001/85687 описані амідзаміщені індоли; у WO 1997/04771, WO 2000/26192, WO 2000/32579, WO 2000/64878, WO 2000/68206, WO 2001/21615, WO 2002/068407, WO 2003/106430 і WO 2004/096793 розкриті амідзаміщені бензоімідазоли; у WO 2000/29384 розкриті амідзаміщені бензоімідазоли й індоли; і в ЕР 0879820 розкриті амідзаміщені бензоксазоли. В даний час на здивування виявлено, що амідзаміщені індазоли даного винаходу виявляють особливо високі рівні інгібування активності полі(АDР-рибоза)полімерази (PARP). Таким чином, сполуки даного винаходу є особливо корисними як інгібітори PARP-1 і/або PARP-2. Вони показують також особливо хороші рівні клітинної активності, демонструючи хороші антипроліферативні ефекти в клітинних лініях з дефіцитом BRCA-1 і BRCA-2. Даний винахід надає сполуки формули І: де: 1 R представляє водень або фтор; і 2 R представляє водень або фтор; або їх фармацевтично прийнятні солі, стереоізомери або таутомери. 1 В одному варіанті здійснення R представляє водень. 1 У ще одному варіанті здійснення R представляє фтор. 2 У ще одному варіанті здійснення R представляє водень. 2 У ще одному варіанті здійснення R представляє фтор. 1 2 У ще одному варіанті здійснення R представляє водень, і R представляє водень або фтор. 1 2 У ще одному варіанті здійснення R представляє фтор, і R представляє водень або фтор. 1 2 У ще одному варіанті здійснення R представляє водень, і R представляє водень. 1 2 У ще одному варіанті здійснення R представляє водень, і R представляє фтор. 1 2 У ще одному варіанті здійснення R представляє фтор, і R представляє фтор. 1 2 У ще одному варіанті здійснення R представляє водень або фтор, і R представляє водень. 1 2 У ще одному варіанті здійснення R представляє водень або фтор, і R представляє фтор. Даний винахід також надає сполуки формули II: де: 1 2 R і R мають значення, визначені вище; або їх фармацевтично прийнятні солі, стереоізомери або таутомери. Даний винахід також надає сполуки формули III: де: 1 2 R і R мають значення, визначені вище; або їх фармацевтично прийнятні солі або таутомери. 3 UA 97658 C2 Даний винахід також надає сполуки формули IV: 5 10 15 20 25 30 35 40 45 50 де: 1 2 R і R мають значення, визначені вище; або їх фармацевтично прийнятні солі або таутомери. Переважні радикали відносно формул II, III і IV мають значення, визначені вище для формули І mutatis mutandis. В обсяг даного винаходу також включені N-оксиди сполук формули І вище. Звичайно такі Nоксиди можуть утворюватися на будь-якому доступному атомі азоту. N-оксиди можуть утворюватися загальноприйнятими засобами, такими як реакція сполуки формули І з оксоном в присутності вологого оксиду алюмінію. В обсяг даного винаходу також включені проліки сполук формули І вище. Звичайно такі проліки є функціональними похідними сполук формули І, які здатні вільно перетворюватися in vivo у необхідну сполуку формули І. Загальноприйняті способи вибору й одержання прийнятних пролікарських похідних описані, наприклад, у «Design of Prodrugs», ed. H. Bundgaard, Elsevier, 1985. Проліками може бути фармалогічно неактивна похідна біологічно активної речовини («вихідні ліки» або «вихідна молекула»), яке вимагає перетворення в організмі для вивільнення активного лікарського засобу, і яке має поліпшені властивості доставки в порівнянні з вихідною молекулою лікарського засобу. Перетворення in vivo може бути, наприклад, результатом деякого метаболічного процесу, такого як хімічний або ферментний гідроліз карбонового, фосфорного або сульфатного ефіру, або відновлення або окислювання чуттєвої функціональної групи. Даний винахід містить сольвати сполук формули І і їх солі, наприклад, гідрати. Сполуки даного винаходу можуть мати асиметричні центри, хіральні осі і хіральні площини (як описано у: Е. L. Eliel and S. Η. Wilen, у Stereochemistry of Carbon Compounds, John Wiley & Sons, New York, 1994, стор. 1119-1190), й існують як рацемати, рацемічні суміші й індивідуальні діастереомери, із усіма можливими ізомерами і їх сумішами, включаючи оптичні ізомери, при цьому всі такі стереоізомери включені в обсяг даного винаходу. На додаток, сполуки, описані в даному описі, можуть існувати у вигляді таутомерів і мається на увазі, що обидві таутомерні форми охоплюються обсягом винаходу, навіть якщо зображена тільки одна таутомерна структура. Сполуки можуть існувати в різних ізомерних формах, усі з яких охоплюються даним винаходом. Сполуки можуть існувати у вигляді ряду різних поліморфних форм. Як використано в даному описі, С1-6алкіл представляє розгалужену, лінійну і циклічну насичену аліфатичну вуглеводневу групу, що містить 1, 2, 3, 4, 5 або 6 атомів вуглецю. Наприклад, «С1-6алкіл», зокрема містить метил, етил, н-пропіл, ізопропіл, н-бутил, трет-бутил, ізобутил, пентил, гексил, циклопропіл, циклобутил, циклопентил і циклогексил, і т. д. Переважними алкільними групами є метил і етил. Конкретними сполуками в обсязі даного винаходу є: 3-{4-[7-(амінокарбоніл)-2Н-індазол-2-іл]феніл}піперидинійхлорид; 2-{4-[(3R)-піперидин-3-іл]феніл}-2Н-індазол-7-карбоксамід; 2-{4-[(3S)-піперидин-3-іл]феніл}-2Н-індазол-7-карбоксамід; трифторацетат 3-{4-[7-(амінокарбоніл)-5-фтор-2Н-індазол-2-іл]феніл}піперидинію; трифторацетат 5-фтор-2-(3-фтор-4-піперидин-3-ілфеніл)-2Н-індазол-7-карбоксаміду; трифторацетат 3-{4-[7-(амінокарбоніл)-2Н-індазол-2-іл]феніл}піперидинію; 5-фтор-2-(4-піперидин-3-ілфеніл)-2Н-індазол-7-карбоксамід; (3S)-3-{4-[7-(амінокарбоніл)-2Н-індазол-2-іл]феніл}піперидинійхлорид; (3R)-3-{4-[7-(амінокарбоніл)-2Н-індазол-2-іл]феніл}піперидинійхлорид; (R)-5-фтор-2-(4-піперидин-3-ілфеніл)-2Н-індазол-7-карбоксамід; (S)-5-фтор-2-(4-піперидин-3-ілфеніл)-2Н-індазол-7-карбоксамід; (R)-5-фтор-2-{3-фтор-4-піперидин-3-ілфеніл}-2Н-індазол-7-карбоксамід; 4 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 (S)-5-фтор-2-{3-фтор-4-піперидин-3-ілфеніл}-2Н-індазол-7-карбоксамід; і їх фармацевтично прийнятні солі, вільні основи або таутомери. Надаються також стереоізомери даних сполук. Конкретною сполукою даного винаходу є: 3-{4-[7-(амінокарбоніл)-2Н-індазол-2іл]феніл}піперидинійхлорид; або його фармацевтично прийнятні вільні основи або таутомери. Надаються також стереоізомери даної сполуки. Конкретною сполукою даного винаходу є: 2-{4-[(3R)-піперидин-3-іл]феніл}-2Н-індазол-7карбоксамід; або його фармацевтично прийнятна сіль, вільна основа або таутомер. Надаються також стереоізомери даної сполуки. Конкретною сполукою даного винаходу є: 2-{4-[(3S)-піперидин-3-іл]феніл}-2H-індазол-7карбоксамід; або його фармацевтично прийнятна сіль, вільна основа або таутомер. Надаються також стереоізомери даної сполуки. Конкретною сполукою даного винаходу є: трифторацетат 3-{4-[7-(амінокарбоніл)-5-фтор-2Hіндазол-2-іл]феніл}піперидинію; або його фармацевтично прийнятна вільна основа або таутомер. Надаються також стереоізомери даної сполуки. Конкретною сполукою даного винаходу є: трифторацетат 5-фтор-2-(3-фтор-4-піперидин-3ілфеніл)-2Н-індазол-7-карбоксаміду; або його фармацевтично прийнятна вільна основа або таутомер. Надаються також стереоізомери даної сполуки. Конкретною сполукою даного винаходу є: 4-метилбензолсульфонат (3S)-3-{4-[7(амінокарбоніл)-2Н-індазол-2-іл]феніл}піперидинію; або його фармацевтично прийнятна вільна основа або таутомер. Надаються також стереоізомери даної сполуки. У даний винахід включена вільна основа сполук формули І, а також його фармацевтично прийнятні солі і стереоізомери. Сполуки даного винаходу можуть бути протоновані по атому(атомам) N аміну і/або N вмісного гетероциклічного фрагмента з утворенням солі. Термін «вільна основа» стосується амінних сполук у несольовій формі. Фармацевтично прийнятні солі, що входять в обсяг винаходу містять не тільки солі, приведені як приклади конкретних сполук, описаних у даному описі, але і всі типові фармацевтично прийнятні солі вільної форми сполук формули І. Вільна форма конкретної солі сполук, описаних у даному описі, може бути виділена з використанням відомих у даній галузі методів. Наприклад, вільна форма може бути регенерована шляхом обробки солі розведеним водяним розчином прийнятної основи, таким як розведений водяний NaOH, карбонат калію, аміак і бікарбонат натрію. Вільні форми можуть трохи відрізнятися від їх відповідних сольових форм за їхніми деякими фізичними властивостями, такими як розчинність у полярних розчинниках, але для цілей винаходу солі кислот і основ в інших відносинах фармацевтично еквівалентні їх відповідним вільним формам. Фармацевтично прийнятні солі даних сполук можуть бути синтезовані із сполук даного винаходу, які містять основний або кислотний фрагмент, за допомогою загальноприйнятих хімічних способів. Звичайно солі основних сполук одержують або шляхом іонообмінної хроматографії, або взаємодії вільної основи зі стехіометричними кількостями або з надлишком бажаної солеутворювальної неорганічної або органічної кислоти в прийнятному розчиннику або різних комбінаціях розчинників. Аналогічним чином, солі кислотних сполук можуть бути утворені взаємодією з відповідною неорганічною або органічною основою. Таким чином, фармацевтично прийнятні солі сполук даного винаходу містять нетоксичні солі сполук даного винаходу, одержані шляхом взаємодії основної розглянутої сполуки з неорганічною, органічною кислотою або полімерною кислотою. Наприклад, загальноприйняті нетоксичні солі містять солі, одержані з неорганічних кислот, таких як хлористоводнева, бромистоводнева, йодистоводнева, сірчана, сірчиста, сульфамінова, фосфорна, фосфориста, азотна й аналогічні, а також солі, одержані з органічних кислот, таких як оцтова, пропіонова, бурштинова, гліколева, стеаринова, молочна, яблучна, винна, лимонна, аскорбінова, памова, малеїнова, гідроксималеїнова, фенілоцтова, глутамінова, бензойна, саліцилова, сульфанілова, 2-ацетокси-бензойна, фумарова, толуолсульфонова, метансульфонова, етандисульфонова, щавлева, ізетіонова, пальмітинова, глюконова, аскорбінова, фенілоцтова, аспарагінова, корична, піровиноградна, етансульфонова, етандисульфонова, валеріанова, трифтороцтова й аналогічні. Приклади прийнятних полімерних солей включають солі, одержані з полімерних кислот, таких як дубильна кислота, карбоксиметилцелюлозу. Перевалено, фармацевтично прийнятна сіль даного винаходу містить 1 еквівалент сполуки формули (І) і 1,2 або 3 еквіваленти неорганічної або органічної кислоти. В одному варіанті здійснення фармацевтично прийнятна сіль даного винаходу містить 2 еквіваленти сполуки формули (І) і 1 еквівалент неорганічної або органічної кислоти. Більш конкретно, фармацевтично прийнятними солями даного винаходу є трифторацетатна, хлоридна або тозилатна солі. Більш конкретно, фармацевтично прийнятними солями даного винаходу є трифторацетат або хлорид. В одному 5 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіанті здійснення сіллю є трифторацетат. У ще одному варіанті здійснення сіллю є хлорид. У ще одному варіанті здійснення сіллю є тозилат. Термін «толуолсульфонова кислота» може використовуватися взаємозамінно з 4метилбензолсульфоновою кислотою, і толуолсульфонати також можуть називатися тозилатами. Коли сполука даного винаходу є кислотною, прийнятні «фармацевтично прийнятні солі» стосуються солей, одержаних з фармацевтично прийнятних нетоксичних основ, включаючи неорганічні й органічні основи. Солі, одержані з неорганічних основ, містять солі алюмінію, амонію, кальцію, міді, заліза[3], заліза[2], літію, магнію, марганцевисті солі, солі марганцю, калію, натрію, цинку й аналогічні. Особливо переважними є солі амонію, кальцію, магнію, калію і натрію. Солі, одержані з фармацевтично прийнятних органічних нетоксичних основ, включають солі первинних, вторинних і третинних амінів, заміщених амінів, включаючи природні заміщені аміни, циклічні аміни й основні іонообмінні смоли, такі як солі аргініну, лізину, бетаїну, кофеїну, 1 холіну, N,N -дибензилетилендіаміну, етиламіну, діетиламіну, 2-діетиламіноетанолу, 2диметиламіноетанолу, етаноламіну, діетаноламіну, етилендіаміну, N-етилморфоліну, Nетилпіперидину, глюкаміну, глюкозаміну, гістидину, гідрабаміну, ізопропіламіну, лізину, метилглюкаміну, морфоліну, піперазину, піперидину, поліамінових смол, прокаїну, пуринів, теоброміну, триетиламіну, триметиламіну, трипропіламіну, трометаміну, дициклогексиламіну, бутиламіну, бензиламіну, фенілбензиламіну, трометаміну й аналогічні. Одержання фармацевтично прийнятних солей, описаних вище, й інших типових фармацевтично прийнятних солей більш докладно описане Berg et al (1977) у J. Pharm. Sci., 'Pharmaceutical Salts', 66:1-19. Також слід зазначити, що сполуки даного винаходу є потенційно внутрішніми солями або цвитеріонами, оскільки у фізіологічних умовах депротонований кислотний фрагмент у сполуці, такий як карбоксильна група, може бути аніонним, і даний електронний заряд може потім врівноважуватися зсередини проти катіонного заряду протонованого або алкільованого основного фрагмента, такого як четвертинний атом азоту. Сполуки винаходу можуть використовуватися в способі лікування людей або тварин за допомогою терапії. Винахід надає сполуки для застосування при лікуванні або запобіганні станів, які можуть полегшуватися інгібуванням полі(АDР-рибоза)полімерази (PARP) (див., наприклад, Nature Review Drug Discovery (2005) 4:421-440). Таким чином, даний винахід надає сполуку формули І для застосування у виробництві лікарських засобів для лікування або запобігання станів, які можуть полегшуватися за рахунок інгібування полі(АDР-рибоза)полімерази (PARP). Даний винахід також надає спосіб лікування або запобігання станів, які можуть полегшуватися інгібуванням полі(АDР-рибоза)полімерази (PARP), який включає уведення пацієнту, що потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І. Інгібітори (PARP) даного винаходу корисні при лікуванні захворювань, конкретно зазначених у WO 2005/082368. Сполуки винаходу корисні при лікуванні запальних захворювань, що включають стани, які є результатом відторгнення органа-трансплантата, таких як: хронічні запальні захворювання суглобів, включаючи артрит, ревматоїдний артрит, остеоартрит і захворювання кісток, пов'язані з підвищеною кістковою резорбцією; запальні захворювання кишечнику, такі як ілеїт, виразковий коліт, синдром Баррета і хвороба Крона: запальні захворювання легенів, такі як астма, синдром респіраторного дистресу дорослих і хронічна обструктивна хвороба дихальних шляхів; запальні захворювання очей, включаючи дистрофію роговиці, трахому, онхоцеркоз, увеїт, симпатикофтальміт і ендофтальміт; хронічні запальні захворювання ясен, що включають гінгівіт і періодонтит; туберкульоз; лепра; запальні захворювання нирок, що включають уремічні ускладнення, гломерулонефрит і нефроз; запальні захворювання шкіри, що включають склеродерматит, псоріаз і екзему; запальні захворювання центральної нервової системи, що включають хронічні демієлінізуючі захворювання нервової системи, розсіяний склероз, пов'язану зі СНІД нейродегенерацію і хворобу Альцгеймера, інфекційний менінгіт, енцефаломієліт, хворобу Паркінсона, хворобу Хангтингтона, аміотрофічний бічний склероз і вірусний або аутоімунний енцефаліт; діабетичні ускладнення, що включають, але не обмежені ними, імунний складний васкуліт, системний червоний вовчак (SLE); запальні захворювання серця, такі як кардіоміопатія, ішемічна хвороба серця, гіперхолестеринемія й атеросклероз; а також численні інші захворювання, що можуть мати значні запальні компоненти, включаючи прееклампсію, хронічну печіночну недостатність, травму головного і спинного мозку і синдром 6 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 множинної дисфункції органів (MODS) (множинна недостатність органів (MOF)). Запальним захворюванням може бути також системне запалення організму, прикладом якого є грампозитивний або грамнегативний шок, геморагічний або анафілактичний удар, або шок, що викликається хіміотерапією раку у відповідь на прозапальні цитокіни, наприклад, шок, пов'язаний із прозапальними цитокінами. Такий шок може бути викликаний, наприклад, хіміотерапевтичним агентом, що вводиться як лікувальний засіб від раку. Таким чином, даний винахід надає сполуки формули І для застосування у виробництві лікарських засобів для лікування або запобігання запальних захворювань. Даний винахід також надає спосіб лікування або запобігання запальних захворювань, який включає уведення пацієнту, що потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І. Сполуки даного винаходу можуть бути також корисні при лікуванні і запобіганні реперфузійних ушкоджень, що є результатом епізодів або подій, які природно відбуваються, і під час хірургічних процедур, таких як реперфузійне ушкодження кишкового тракту; міокардіальне реперфузійне ушкодження; реперфузійне ушкодження, що є результатом кардіопульмонарної операції зі штучним кровообігом, відбудовної операції аневризми аорти, операції каротидної ендартеректомії або геморагічного шоку; і реоксогенаційне ушкодження, що є результатом трансплантації органів, таких як серце, легені, печінка, нирки, підшлункова залоза, кишечник і роговиця. Таким чином, даний винахід представляє сполуки формули І для застосування у виробництві лікарського засобу для лікування або запобігання реперфузійних ушкоджень. Даний винахід також надає спосіб лікування або запобігання реперфузійних ушкоджень, що включає уведення пацієнту, який потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І. Сполуки даного винаходу також можуть бути корисні при лікуванні або запобіганні ішемічних станів, що включають стани, які є результатом трансплантації органів, таких як стабільна ангіна, нестабільна ангіна, ішемія міокарда, гепатична ішемія, мезентеріальна артеріальна ішемія, ішемія кишкового тракту, критична ішемія кінцівок, хронічна критична ішемія кінцівок, церебральна ішемія, гостра серцева ішемія, ішемічна хвороба нирок, ішемічна хвороба печінки, ішемічний розлад сітківки, септичний шок і ішемічна хвороба центральної нервової системи, така як тромбоз або крововилив (або емболія) або церебральна ішемія. Таким чином, даний винахід надає сполуку формули І для застосування у виробництві лікарського засобу для лікування або запобігання ішемічних станів. Даний винахід також надає спосіб лікування або запобігання ішемічних станів, що включає уведення пацієнту, який потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І. Даний винахід надає сполуку формули І для застосування у виробництві лікарського засобу для лікування або запобігання удару. Даний винахід також надає спосіб лікування або запобігання удару, що включає уведення пацієнту, який потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І. Сполуки даного винаходу можуть бути також корисні при лікуванні або запобіганні хронічної або гострої ниркової недостатності. Таким чином, даний винахід надає сполуку формули І для застосування у виробництві лікарського засобу для лікування або запобігання ниркової недостатності. Даний винахід також надає спосіб лікування або запобігання ниркової недостатності, що включає уведення пацієнту, який потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І. Сполуки даного винаходу можуть бути також корисні при лікуванні або запобіганні судинних захворювань, інших ніж серцево-судинні захворювання, таких як закупорка периферичних артерій, облітеруючий тромбоангіт, хвороба і феномен Рейнода, акроціаноз, еритромелалгія, венозний тромбоз, варикозні вени, артеріовенозна фістула, лімфодема і жировий набряк. Таким чином, даний винахід надає сполуку формули І для застосування у виробництві лікарського засобу для лікування або запобігання судинних захворювань, інших ніж серцевосудинні захворювання. Даний винахід представляє також спосіб лікування або запобігання судинних захворювань, інших ніж серцево-судинні захворювання, що включає уведення пацієнту, який потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І. Сполуки даного винаходу можуть бути також корисні при лікуванні або запобіганні серцевосудинних захворювань, таких як хронічна серцева недостатність, атеросклероз, застійна 7 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 серцева недостатність, циркуляторний шок, кардіоміопатія, пересадження серця, інфаркт міокарда і серцева аритмія, така як атріальна фібриляція, суправентрикулярна тахікардія, часті регулярні скорочення передсердь і пароксизмальна атріальна тахікардія. Таким чином, даний винахід надає сполуки формули І для застосування у виробництві лікарського засобу для лікування або запобігання серцево-судинних захворювань. Даний винахід також надає спосіб лікування або запобігання серцево-судинних захворювань, що включає уведення пацієнту, який потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І. Сполуки даного винаходу також можуть бути корисні при лікуванні і запобіганні цукрового діабету, включаючи діабет типу І (інсулін-залежний цукровий діабет), діабет типу II (інсуліннезалежний цукровий діабет), діабет, пов'язаний з вагітністю, аутоімунний діабет, інсулінопатію, діабет внаслідок хвороби підшлункової залози, діабет, пов'язаний з іншими хворобами ендокринної системи (такими як синдром Кашинга (Cushing), акромегалія, феохромоцитома, глюкагонома, первинний альдостеронізм або соматостатинома), синдром інсулінорезистентності типу А, синдром інсулінорезистентності типу В, ліпатрофічний діабет і діабет, що викликаний 3-клітинними токсинами. Сполуки даного винаходу можуть бути також корисні при лікуванні або запобіганні діабетичних ускладнень, таких як діабетична катаракта, глаукома, ретинопатія, нефропатія (така як мікроалюмінурія і прогресивна діабетична нефропатія), поліневропатія, гангрена ніг, атеросклеротична хвороба коронарної артерії, захворювання периферичної артерії, некетотична гіперглікемічно-гіперосмолярна кома, мононейропатія, автономна нейропатія, виразки стопи, проблеми суглобів і ускладнення шкіри або слизистої мембрани (такі як інфекція, плямистість шкіри, грибкова інфекція або ліпофільний некробіоз), гіперліпідемія, гіпертензія, синдром інсулінорезистентності, хвороба коронарної артерії, ретинопатія, діабетична нейропатія, полінейропатія, мононейропатія, автономна нейропатія, виразки стопи, проблеми суглобів, грибкові інфекції, бактеріальні інфекції і кардіоміопатія. Таким чином, даний винахід надає сполуки формули І для застосування у виробництві лікарського засобу для лікування або запобігання діабету. Даний винахід також надає спосіб лікування або запобігання діабету, що включає уведення пацієнту, який потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І. Сполуки даного винаходу можуть бути також корисні при лікуванні і запобіганні раку, включаючи солідні пухлини, такі як фібросаркома, міксосаркома, ліпосаркома, хондр осаркома, остеогенна саркома, хордома, ангіосаркома, ендотеліосаркома, лімфангіосаркома, димфангіоендотеліосаркома, синовіома, мезотеліома, пухлина Евінга, лейоміосаркома, рабдоміосаркома, рак ободової кишки, колоректальний рак. рак нирок, рак підшлункової залози, рак кісток, рак грудей, рак яєчників, рак передміхурової залози, езофагеальний рак, рак шямку, рак ротової порожнини, рак носової порожнини, рак горла, сквамозна клітинна карцинома, базальна клітинна карцинома, аденокарцинома, карцинома потових залоз, карцинома сальних залоз, сосочкова карцинома, сосочкова аденокарцинома, цистаденокарцинома, медулярна карцієнома, бронхогенна карцинома, ренальна клітинна карцинома, гепатома, карцинома жовчної протоки, хоріокарцинома, семінома, ембріональна карцинома, пухлина Уїлмса, цервикальний рак, матковий рак, тестикулярний рак, дрібноклітинна легенева карцинома, карцинома сечового міхура, рак легенів, епітеліальна карцинома, рак шкіри, меланома, нейробластома і ретинобластома; види раку крові, такі як гостра лімфобласна лейкемія («ALL»), гостра лімфобласна В-клітинна лейкемія, гостра лімфобласна Т-клетинна лейкемія, гостра мієлобласна лейкемія («AML»), гостра промієлоцитна лейкемія («APL»), гостра монобласна лейкемія, гостра еритролейкемічна лейкемія, гостра мегакаріобласна лейкемія, гостра мієломоноцитна лейкемія, гостра нелімфоцитна лейкемія, гостра недиференційована лейкемія, хронічна мієлоцитна лейкемія («CML»), хронічна лімфоцитна лейкемія («CLL»), лейкемія волосяних клітин і множинна мієлома; гострі і хронічні лейкемії, такі як лімфобласна, мієлогенна, лімфоцитна, мієлоцитна лейкемії; лімфоми, такі як хвороба Ходжкіна, неходжкінська лімфома, множинна мієлома, макроглобулінемія Вальденстрома, захворювання важкого ланцюга (поліпептидного ланцюга великої молекулярної маси) і червона або справжня поліцитемія; види раку ЦНС і головного мозку, такі як гліома, пілоцитна астроцитома, астроцитома, анапластична астроцитома, гліобластома мультиформна, медулобластома, краніофарингіома, епендимома, пінеалома, гемангіобластома, акустична нейрома, олігодендрогліома, менінгіома, вестибулярна шванома, аденома, метастатична пухлина головного мозку, менінгіома, спінальна пухлина і медулобластома. 8 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таким чином, даний винахід надає сполуки формули І для застосування у виробництві лікарського засобу для лікування або запобігання раку. Даний винахід також надає спосіб лікування або запобігання раку, що включає уведення пацієнту, який потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І. Сполуки даного винаходу також можуть застосовуватися при лікуванні раку, який відчуває дефіцит залежної від гомологічної рекомбінації (HR) ДНК DSB відбудовної активності (див. WO 2006/021801). HR залежний ДНК DSB відбудовний шлях відновлює двониткові розриви (DSB) ДНК через гомологічні механізми, реформуючи безупинну ДНК спіраль (Nat. Genet. (2001) 27(3):247-254). Компоненти HR залежного ДНК DSB відбудовного шляху включають, але не обмежуються ними, ATM (NM-000051), RAD51 (NM-002875), RAD51 LI (NM-002877), RAD51 С (NM-002876), RAD51L3 (NM-002878), DMC1 (NM-007068), XRCC2 (NM7005431), XRCC3 (NM-005432), RAD52 (NM002879), RAD54L (NM-003579), RAD54B (NM-012415), BRCA-1 (NM-007295), BRCA-2 (NM000059), RAD5O (NM-005732), MREI ΙΑ (ΝΜ-005590), NBS1 (NM-002485), ADPRT (PARP-1), ADPRTL2, (PARP02) CTPS, RPA, RPA1, RPA2, RPA3, XPD, ERCC1, XPF, MMS19, RAD51, RAD51p, RAD51C, RAD51D, DMC1, XRCCR, XRCC3, BRCA-1, BRCA-2, RAD52, RAD54, RAD50, MRE11, NB51, WRN, BLMKU70, RU80, ATM, ATRCHK1, CHK2, FANCA, FANCB, FANCC, FANCD1, FANCD2, FANCE, FANCF, FANCG, FANCC, FANCD1, FANCD2, FANCE, FANCF, FANCG, RAD1 і RAD9. Інші білки, залучені в HR залежний ДНК DSB відбудовний шлях, містять регуляторні фактори, такі як EMSY (Cell (2003) 115:523-535). Рак, який відчуває дефіцит HR залежного ДНК DSB відновлення, може містити або складатися з однієї або декількох ракових клітин, які мають знижену або позбавлені здатності відновлювати DSB цим шляхом в порівнянні з нормальними клітинами, тобто активність HR залежного ДНК DSB відбудовного шляху може бути зниженою або зруйнованою в одній або декількох ракових клітинах. Активність одного або більше компонентів HR залежного ДНК DSB відбудовного шляху може руйнуватися в одній або декількох ракових клітинах індивідуума, у якого існує рак з дефіцитом HR залежного ДНК DSB відновлення. Компоненти HR залежного ДНК DSB відбудовного шляху повністю охарактеризовані в літературі (див., наприклад, Science (2001) 291:1284-1289) і містять компоненти, перелічені вище. Даний винахід надає сполуку формули І для застосування у виробництві лікарського засобу для лікування або запобігання раку з дефіцитом HR залежної ДНК DSB відбудовної активності. Даний винахід також надає спосіб лікування або запобігання раку з дефіцитом HR залежної ДНК DSB відбудовної активності, який включає уведення пацієнту, який потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І. В одному варіанті здійснення ракові клітини відчувають дефіцит HR залежної ДНК DSB відбудовної активності одного або більше фенотипів, вибраних з ATM (NM-000051), RAD51 (NM002875), RAD51 LI (NM-002877), RAD51 С (NM-002876), RAD51L3 (NM-002878), DMC1 (NM007068), XRCC2 (NM7005431), XRCC3 (NM-005432), RAD52 (NM-002879), RAD54L (NM-003579), RAD54B (NM-012415), BRCA-1 (NM-007295), BRCA-2 (NM-000059), RAD5O (NM-005732), MREI 1A (NM-005590), NBS1 (NM-002485), ADPRT (PARP-1), ADPRTL2, (PARP02) CTPS, RPA, RPA1, RPA2, RPA3, XPD, ERCC1, XPF, MMS19, RAD51, RAD51p, RAD51C, RAD51D, DMC1, XRCCR, XRCC3, BRCA-1, BRCA-2, RAD52, RAD54, RAD50, MRE11, NB51, WRN, BLMKU70, RU80, ATM, ATRCHK1, CHK2, FANCA, FANCB, FANCC, FANCD1, FANCD2, FANCE, FANCF, FANCG, FANCC, FANCD1, FANCD2, FANCE, FANCF, FANCG, RAD1 і RAD9. Згідно з ще одним варіантом здійснення ракові клітини відчувають дефіцит BRCA-1 і/або BRCA-2 фенотипу. Ракові клітини з даним фенотипом можуть відчувати дефіцит BRCA-1 і/або BRCA-2, тобто експресія і/або активність BRCA-1 і/або BRCA-2 можуть знижуватися або зникати в ракових клітинах, наприклад, під дією мутації або поліморфізму в кодуючій нуклеїновій кислоті або під дією ампліфікації, або мутації поліморфізму в гені, кодуючому регуляторний фактор, наприклад, EMSY гені, який кодує BRCA-2 регуляторний фактор (Cell (2003) 115:523-535). BRCA-1 і/або BRCA-2 є відомими супресорами пухлин, чиї алелі дикого типу часто відсутні в пухлинах гетерозиготних носіїв (Oncogene, (2002) 21(58):8981-93; Trends Моl. Med., (2002) 8(12):571-6). Добре охарактеризована асоціація BRCA-1 і/або BRCA-2 мутацій з раком грудей (Exp Clin Cancer Res., (2002). Відомо, що ампліфікація EMSY гену, який кодує BRCA-2 зв'язувальний фактор, пов'язана з раком грудей і яєчників. Носії мутацій BRCA-1 і/або BRCA-2 також випробують підвищений ризик раку яєчників, простати і підшлункової залози. У даній галузі добре відома детекція варіацій у BRCA-1 і/або BRCA-2 і описана, наприклад у ЕР 699754, ЕР 705903, Genet. Test (1992) 1:75-83; Cancer Treat Res (2002) 107:29-59; Neoplasm (2003) 9 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 50(4):246-50; Ceska Gynecol (2003) 68(1):11-16). Визначення ампліфікації BRCA-2 зв'язувального фактора EMSY описане в Cell 115:523-535. Інгібітори PARP були продемонстровані як такі, що є корисними для специфічного знищення пухлин з дефіцитом BRCA-1 і BRCA-2 (Nature (2005) 434:913-916 і 917-920). Таким чином, даний винахід надає сполуку формули І для застосування у виробництві лікарського засобу для лікування або запобігання пухлин з дефіцитом BRCA-1 aбо BRCA-2. Даний винахід також надає спосіб лікування або запобігання пухлин з дефіцитом BRCA-1 або BRCA-2, який включає уведення пацієнту, який потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І. В одному варіанті здійснення інгібітори PARP даного винаходу можуть застосовуватися в профілактичній терапії для усунення клітин з BRCA-2-дефіцитом (див. Cancer Res. (2005) 65:10145). Сполуки даного винаходу також можуть бути корисні при лікуванні або запобіганні нейродегенеративних захворювань, включаючи пов'язану з розширенням поліглутаміну нейродегенерацію, хворобу Хангтингтона, хворобу Кеннеді, спиноцеребральну атаксію, дентато-рубро-палідо-льюїсову атрофію (DRPLA), пов'язану з агрегацією білка нейродегенерацію, хворобу Макадо-Джозефа (Machado-Joseph), хворобу Альцгеймера, хворобу Паркінсона, аміотрофічний бічний склероз, спонгіформну енцефалопатію, пов'язане з пріоном захворювання і розсіяний склероз (MS). Таким чином, даний винахід надає сполуку формули І для застосування у виробництві лікарського засобу для лікування або запобігання нейродегенеративних захворювань. Даний винахід представляє також спосіб лікування або запобігання нейродегенеративних захворювань, який включає уведення пацієнту, який потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І. Сполуки даного винаходу також можуть бути корисні при лікуванні або запобіганні ретровірусної інфекції (патент США № 5652260), ретинальних ушкоджень (Curr. Eye Res. (2004), 29:403), старіння шкіри й УФ-індукованого ушкодження шкіри (патент США № 5589483 і Biochem. Pharmacol (2002) 63:921). Сполуки винаходу також корисні при лікуванні або запобіганні передчасного старіння і відстрочки настання вікової клітинної дисфункції (Pharmacological Research (2005) 52:93-99). Сполуки даного винаходу можуть уводитися ссавцям, переважно людям, або як така, або в комбінації з фармацевтично прийнятними носіями, ексципієнтами, розріджувачами, ад'ювантами, наповнювачами, буферами, стабілізаторами, консервантами, лубрикантами, у фармацевтичній композиції відповідно до стандартної фармацевтичної практики. Сполуки даного винаходу можуть уводитися суб'єкту будь-яким зручним способом уведення, будь то системно/периферично або місцево в залежності від бажаної дії, що включає, але не обмежується ними, оральний (наприклад, з переварюванням); топічний або місцевий (включаючи, наприклад, трансдермальний, інтраназальний, окулярний, защічний і під'язичний); легеневий (наприклад, шляхом інгаляційної або інсуфляційної терапії з використанням, наприклад аерозолю, наприклад, через рот або ніс); ректальний; вагінальний; парентеральний (наприклад, ін'єкцією, включаючи підшкірну, індрадермальну, внутрішньом'язову, внутрішньовенну, внутрішньоартеріальну, внутрішньосерцеву, інтратекальну (усередину синовіальної піхви сухожилля), інтраспінальну, інтракапсулярну, субкапсулярну, внутрішньоочну, інтраперитоніальну, внутрішньотрахейну, субкутикулярну, внутрішньосуглобну, субарахноїдальну і інтрастернальну); і за допомогою імплантування базового трансплантата (наприклад, підшкірно або внутрішньом'язово). Суб'єктом може бути міжрасовий гібрид, тварина, хребетна тварина, ссавець, гризуни (наприклад, морські свинки, хом'яки, щури, миші), мишачі (наприклад, миша), собачі (наприклад, собака), котячі (наприклад, кішки), кінські (наприклад, кінь), примати, мавпоподібні (наприклад, мавпи), мавпи (наприклад, мармозетки, бабуїни), людиноподібні мавпи (наприклад, горили, шимпанзе, орангутанги, гібони) або людина. Винахід також надає фармацевтичні композиції, що містять одну або більше сполук даного винаходу і фармацевтично прийнятний носій. Фармацевтичні композиції, що містять активний інгредієнт, можуть бути у формі, прийнятній для орального застосування, наприклад, у вигляді таблеток, пастилок, водяних або масляних суспензій, диспергованих порошків або гранул, емульсій, твердих або м'яких капсул або сиропів або еліксирів. Композиції, призначені для орального застосування, можуть бути одержані відповідно до будь-якого методу, відомим в галузі виробництва фармацевтичних композицій, і такі композиції можуть містити один або більше агентів, вибраних із групи, що складається з підсолоджувальних, смакових або ароматизуючих агентів, забарвлювальних агентів і консервантів, для того, щоб одержати 10 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтично м'які і приємні на смак препарати. Таблетки містять активний інгредієнт у суміші з нетоксичними фармацевтично прийнятними ексципієнтами, що є прийнятними для одержання таблеток. Даними ексципієнтами можуть бути, наприклад, інертні розріджувачі, такі як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; гранулюючі або дезінтегруючі агенти, наприклад, мікрокристалічна целюлоза, натрійкроскармелоза, кукурудзяний крохмаль або альгінова кислота; зв'язувальні агенти, наприклад крохмаль, желатин, полівінілпіролідон або камедь акації, і лубриканти, наприклад, стеарат магнію, стеаринова кислота або тальк. Таблетки можуть бути непокритими або можуть бути покриті відомими способами для маскування неприємного смаку або для затримки дезінтеграції й абсорбції в шлунково-кишковому тракті, тим самим, забезпечуючи уповільнену дію протягом більш тривалого періоду. Наприклад, можна використовувати розчинний у воді маскуючий смак матеріал, такий як гідроксипропілметилцелюлоза або гідроксипропілцелюлоза, або затримуючий час дії матеріал, такий як етилцелюлоза, ацетатбутират целюлози. Рецептури для орального застосування можуть бути також представлені у вигляді твердих желатинових капсул, в яких активний інгредієнт змішаний з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або у вигляді м'яких желатинових капсул, в яких активний інгредієнт змішаний з розчинним у воді носієм, таким як поліетиленгліколь або масляне середовище, наприклад, арахісове масло, рідкий парафін або оливкова олія. Водяні суспензії містять активний інгредієнт у суміші з ексципієнтами, що прийнятні для одержання водяних суспензій. Такими ексципієнтами є суспендуючі агенти, наприклад, натрійкарбоксиметилцелюлоза, метилцелюлоза, гідроксипропілметилцелюлоза, альгінат натрію, полівінілпіролідон, камедь трагаканту і камедь акації; диспергуючими або змочувальними агентами можуть бути природні фосфатиди, наприклад, лецитин, або продукти конденсації алкіленоксиду з жирними кислотами, наприклад, стеарат поліоксіетилену, або продукти конденсації етиленоксиду з аліфатичними спиртами з довгим ланцюгом, наприклад, гептадекаетиленоксицетанол, або продукти конденсації етиленоксиду з частковими ефірами, одержаними з жирних кислот і гекситу, такі як моноолеат поліоксіетиленсорбіту, або продукти конденсації етиленоксиду з частковими ефірами, одержаними з жирних кислот і ангідридів гекситу, наприклад, поліетиленсорбітанмоноолеат. Водяні суспензії також можуть містити один або більше консервантів, наприклад етил або н-пропіл п-гідроксибензоат, один або більше забарвлювальних агентів, один або більше смакових агентів і один або більше підсолоджувальних агентів, таких як цукроза, або сахарин аспартам. Масляні суспензії можуть бути сформовані шляхом суспендування активного інгредієнта в рослинній олії, наприклад, арахісовому маслі, оливковій олії, кунжутній або кокосовій олії, або в мінеральній олії, такій як рідкий парафін. Масляні суспензії можуть містити загущувальний агент, наприклад, бджолиний віск, твердий парафін або цетиловий спирт. Можуть додаватися підсолоджувальні агенти, такі як агенти, представлені вище, і смакові або ароматизуючі агенти із забезпеченням приємного на смак орального препарату. Дані композиції можуть бути консервовані шляхом додавання анти-оксиданту, такого як бутильований гідроксіанізол або альфа-токоферол. Дисперговані порошки і гранули, прийнятні для одержання водяної суспензії шляхом додавання води, надають активний інгредієнт у суміші з диспергуючим або змочувальним агентом, суспендуючим агентом і одним або більше консервантами. Прийнятні диспергуючі або змочувальні агенти і суспендуючі агенти представлені прикладами агентів, приведених вище. Також можуть бути присутні додаткові ексципієнти, наприклад, підсолоджувальні, смакові й забарвлювальні агенти. Дані композиції можуть бути консервовані шляхом додавання антиоксиданту, такого як аскорбінова кислота. Фармацевтичні композиції винаходу можуть бути також у формі емульсій олія-у-воді. Масляною фазою може бути рослинна олія, наприклад, оливкова олія або арахісове масло, або мінеральна олія, наприклад, рідкий парафін або їх суміші. Прийнятними емульгуючими агентами можуть бути природні фосфатиди, наприклад, соєвий лецитин, і складні ефіри або часткові ефіри, одержані з жирних кислот і ангідридів гекситу, наприклад, сорбітанмоноолеат, і продукти конденсації вказаних часткових ефірів з етиленоксидом, наприклад, поліоксіетиленсорбітанмоноолеат. Емульсії можуть містити також підсолоджувальні, смакові агенти, консерванти й антиоксиданти. Сиропи й еліксири можуть бути складені в композицію з підсолоджувальними агентами, наприклад, гліцерином, пропіленгліколем, сорбітом або цукрозою. Такі рецептури можуть містити також пом'якшуючий або заспокійливий засіб, консервант, що додає смак або аромат і забарвлює агенти і антиоксидант. 11 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 Фармацевтичні композиції можуть бути у формі стерильних ін'єктованих водяних розчинів. Серед прийнятних носіїв і розчинників, що можуть бути використані, знаходяться вода, розчин Рингера й ізотонічний розчин хлориду натрію. Стерильним ін'єктованим препаратом може бути також стерильна ін'єктована мікроемульсія олія-у-воді, в якій активний інгредієнт розчинений у масляній фазі. Наприклад, активний інгредієнт може бути спочатку розчинений у суміші соєвої олії і лецитину. Масляний розчин потім уводять у суміш води і гліцерину і переробляють з утворенням мікроемульсії. Ін'єктовані розчини або мікроемульсії можуть уводитися в кровоток пацієнта шляхом ін'єкції місцевого болюса. Альтернативно, може бути сприятливим уводити розчин або мікроемульсію таким чином, щоб підтримувати постійну циркулюючу концентрацію розглянутої сполуки. Для того, щоб підтримувати таку постійну концентрацію, можна використовувати пристрій безупинного внутрішньовенного доставляння. Прикладом такого пристрою є внутрішньовенний насос Deltec CADD-PLUS® модель 5400. Фармацевтичні композиції можуть бути у формі стерильної ін'єктованої водяної або маслянистої суспензії для внутрішньом'язового і підшкірного уведення. Дана суспензія може бути складена в композицію відповідно до відомих в даній галузі методів з використанням таких прийнятних диспергуючих або змочувальних агентів і суспендуючих агентів, які приведені вище. Стерильним ін'єктованим препаратом може бути також стерильний ін'єктований розчин або суспензія в нетоксичному парентерально прийнятному розріджувачі або розчиннику, наприклад, у вигляді розчину в 1,3-бутандіолі. На додаток, як розчинник або суспендуюче середовище звичайно використовують стерильні, фіксовані олії. Для даної мети можна використовувати будь-яку м'яку фіксовану олію, включаючи синтетичні моно- або дигліцериди. На додаток, при одержанні ін'єктованих препаратів знаходять застосування жирні кислоти, такі як олеїнова кислота. Сполуки формули І також можуть уводитися у формі супозиторіїв для ректального уведення. Дані композиції можуть бути одержані шляхом змішання лікарського засобу з прийнятним неподразнювальним ексципієнтом, який є твердим при звичайних температурах, але рідким при температурі прямої кишки, і, отже, буде розплавлятися в прямій кишці, вивільняючи лікарський засіб. Такі матеріали включають масло-какао, гліцеринований желатин, гідровані рослинні олії, суміші поліетиленгліколів з різними молекулярними масами і поліетиленгліколевих ефірів жирних кислот. Для місцевого застосування використовують креми, мазі, желе, розчини або суспензії й ін., що містять сполуку формули І. (Для цілей даного винаходу місцеве застосування передбачає полоскання рота і горла). Сполуки даного винаходу можуть уводитися у вигляді інтраназальної форми за допомогою місцевого застосування прийнятних інтраназальних носіїв і доставних засобів, або трансдермальними шляхами з використанням форм трансдермальних шкірних пластирів, добре відомих фахівцям у даній галузі. Щоб бути уведеним у формі трансдермальної системи доставки, уведення дози буде скоріше безупинним, ніж не переривчастим, у всьому режимі дозування. Сполуки даного винаходу також можуть доставлятися у вигляді супозиторіїв з використанням основ, таких як масло-какао, гліцеринований желатин, гідровані рослинні олії, суміші поліетиленгліколів з різними молекулярними масами і поліетиленгліколевих ефірів жирних кислот. Коли сполуку відповідно до даного винаходу вводять суб'єкту, обираний рівень доз буде залежати від множини факторів, що включають, але не обмежених ними, активність конкретної сполуки, тяжкість симптомів в індивідуумів, шлях уведення, час уведення, швидкість виведення сполуки, тривалість лікування, інші лікарські засоби, сполуки і/або матеріали, використовувані в комбінації, і вік, стать, маса, стан, загальний стан здоров'я і попередня медична історія хвороби пацієнта. Кількість сполуки і шлях уведення в остаточному підсумку віддаються на розсуд лікаря, хоча звичайно доза повинна бути достатньою для досягнення локальних концентрацій у ділянці дії, які забезпечують досягнення бажаного ефекту, не викликаючи істотних пагубних або шкідливих побічних ефектів. Уведення in vivo можна проводити у вигляді однієї дози безупинно або переривчасто (наприклад, у вигляді розділених доз з відповідними інтервалами) протягом курсу лікування. Методи визначення найбільш ефективних засобів і дози уведення добре відомі фахівцям у даній галузі і будуть варіювати в залежності від рецептури, використовуваної для терапії, мети терапії, клітин мішені, що піддаються лікуванню, і суб'єкта, що піддається лікуванню. Можна здійснювати одноразове або множинне уведення з урахуванням рівня і характеру дози, обираних лікарем. 12 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 Звичайно, що прийнятна доза активної сполуки знаходиться в інтервалі приблизно від 100 мкг до приблизно 250 мг на кілограм маси тіла суб'єкта на день. Коли активною сполукою є сіль, складний ефір, проліки або аналогічні, уводжувальна кількість обчислюється на основі вихідної сполуки і тому фактично використовувана маса збільшується пропорційно. Дані сполуки корисні також у комбінації з протираковими агентами або хіміотерапевтичними агентами. Сполуки даного винаходу можуть бути також корисні як хіміо- і радіосенсибілізатори для лікування раку. Вони корисні при лікуванні ссавців, які раніше піддавалися або піддаються в даний час лікуванню від раку. Такі попередні лікування включають попередню хіміотерапію, радіаційну терапію, хірургію або імунотерапію, таку як вакцини від раку. Таким чином, даний винахід надає комбінацію сполуки формули І і протиракового агента для одночасного, окремого або послідовного уведення. Даний винахід також надає комбінацію сполуки формули І, радіаційної терапії і ще одного хіміотерапевтичного агента для одночасного, окремого або послідовного уведення. Даний винахід також надає сполуку формули І для застосування у виробництві лікарського засобу для застосування як доповнення в терапії раку або для потенціювання пухлинних клітин шляхом комбінації з іонізуючою радіацією або хіміотерапевтичними агентами. Даний винахід також надає застосування сполуки формули І у виробництві лікарського засобу для застосування як доповнення в терапії раку або для потенціювання пухлинних клітин шляхом комбінації з іонізуючою радіацією й іншими хіміотерапевтичними агентами. Сполуки також можуть застосовуватися в комбінації з іонізуючою радіацією й іншими хіміотерапевтичними агентами. Даний винахід також надає спосіб хіміотерапії або радіотерапії, що включає уведення пацієнту, який потребує цього, ефективної кількості сполуки формули І або композиції, що містить сполуку формули І, у комбінації з іонізуючою радіацією або хіміотерапевтичними агентами. Сполуки також можуть уводитися в комбінації з іонізуючою радіацією й іншими хіміотерапевтичними агентами. У комбінаційній терапії сполуки даного винаходу можуть уводитися до (наприклад, за 5 хвилин, 15 хвилин, 30 хвилин, 45 хвилин, 1 годину, 2 години, 4 години, 6 годин, 12 годин, 24 години, 48 годин, 72 години, 96 годин, 1 тиждень, 2 тижні, 3 тижні, 4 тижні, 5 тижнів, 6 тижнів, 8 тижнів або 12 тижнів), паралельно з або послідовно після (наприклад, через 5 хвилин, 15 хвилин, 30 хвилин, 45 хвилин, 1 годину, 2 години, 4 години, 6 годин, 12 годин, 24 години, 48 годин, 72 години, 96 годин, 1 тиждень, 2 тижні, 3 тижні, 4 тижні, 5 тижнів, 6 тижнів, 8 тижнів або 12 тижнів) уведення іншого протиракового агента суб'єкту, який потребує цього. У різних варіантах здійснення розглянуті сполуки і ще один протираковий агент уводять із проміжком у 1 хвилину, 10 хвилин, 30 хвилин, менш ніж 1 годину, 1-2 години, 2-3 години, 3-4 години, 4-5 години, 5-6 годин, 6-7 годин, 7-8 годин, 8-9 годин, 9-10 годин, 10-11 годин, 11-12 годин, не більш, ніж 24 годин, або не більш, ніж 48 годин. Сполуки даного винаходу й інший протираковий агент можуть діяти додатково або синергічно. Синергічна комбінація даних сполук і ще одного протиракового агента може дати можливість застосування більш низьких доз одного або обох даних агентів і/або менш частих доз однієї або обох розглянутих сполук й інших протиракових агентів, і/або уведення агентів менш часто, що може знизити будь-яку токсичність, пов'язану з уведенням агентів суб'єкту, не знижуючи при цьому ефективність агентів при лікуванні раку. На додаток, синергічний ефект може приводити в результаті до поліпшеної ефективності даних агентів при лікуванні раку і/або до зниження будь-яких пагубних або небажаних побічних ефектів, пов'язаних з використанням кожного агента окремо. Приклади протиракових агентів або хіміотерапевтичних агентів для застосування в комбінації зі сполуками даного винаходу можна знайти в Cancer Principles and Practice of th Oncology by V. Т., Devita and S. Hellman (editors). 6 edition (February 15, 2001), Lippincott Williams&Wilkins Publishers. Фахівець у даній галузі на підставі конкретних характеристик лікарських засобів і ракового захворювання, про які йдеться, зможе розрізнити які сполучення або комбінації агентів будуть корисні. Такі протиракові агенти включають, але не обмежуються ними, наступні: інгібітори HDAC, модулятори естрогенових рецепторів, модулятори андрогенових рецепторів, модулятори ретиноїдних рецепторів, цитотоксичні/цитостатичні агенти, антипроліферативні агенти, інгібітори преніл-протеїн-трансферази, інгібітори HMG-Co редуктази, інгібітори ВІЛ протеази, інгібітори зворотної транскриптази й інші інгібітори ангіогенезису, інгібітори клітинної проліферації і сигналізуючі виживання, індукуючі апоптоз агенти й агенти, які заважають контрольним точкам клітинного циклу. Дані сполуки особливо корисні, коли уводяться разом з радіаційною терапією. 13 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 Приклади «інгібіторів HDAC» містять субероїланілідгідроксамову кислоту (SAHA), LAQ824, LBH589, PXD101, MS275, FK228, вальпроєву кислоту, масляну кислоту і СІ-994. «Модулятори естрогенових рецепторів» стосуються сполук, що перешкоджають або інгібують зв'язування естрогену з рецептором незалежно від механізму. Приклади модуляторів естрогенових рецепторів включають, але не обмежуються ними, тамоксифен, ралоксифен, ідоксифен, LY353381, LY117081, тореміфен, фулвестрант, 4-[7-(2,2-диметил-1-оксопропокси-4метил-2-[4-[2-(1-піперидиніл)етокси]феніл]-2Н-1-бензопіран-3-іл]феніл-2,2-диметилпропаноат, 4,4'-дигідроксибензофенон-2,4-динітрофенілгідразон і SH646. «Модулятори андрогенових рецепторів» стосуються сполук, що перешкоджають або інгібують зв'язування андрогенів з рецептором, незалежно від механізму. Приклади модуляторів андрогенових рецепторів включають фінастерид й інші інгібітори 5α-редуктази, нілутамід, флутамід, бікалютаміїд, ліарозол і абіратеронацетат. «Модулятори ретиноїдних рецепторів» стосуються сполук, що перешкоджають або інгібують зв'язування ретиноїдів з рецептором, незалежно від механізму. Приклади таких модуляторів ретиноїдних рецепторів включають бексаротен, третиноїн, 13-цис-ретиноєву кислоту, 9-цисретиноєву кислоту, α-дифторметилорнітин, ILX23-7553, транс-N-(4'-гідроксифеніл)ретинамід і N4-карбоксифенілретинамід. «Цитотоксичні/цитостатичні агенти» стосуються сполук, що викликають загибель клітин або інгібують клітинну проліферацію, насамперед шляхом безпосереднього втручання у функціонування клітин або інгібують або перешкоджають мітозу клітин, що включають алкілуючі агенти, фактори некрозу пухлини, інтеркалятори, активовані гіпоксією сполуки, інгібітори мікротрубочок, мікротрубочки-стабілізуючі агенти, інгібітори мітотичних кінезинів, інгібітори кіназ, залучених у мітотичне прогресування, антиметаболіти, модифікатори біологічної відповідної реакції; гормональні/антигормональні терапевтичні агенти, гематопоетичні фактори росту, націлені на моноклональні антитіла терапевтичні агенти, інгібітори топоізомерази, інгібітори протеасомів і інгібітори убіквітинлігази. Приклади цитотоксичних агентів включають, але не обмежуються ними, циклофосфамід, хлорамбуцилкармустин (BCNU), ломустин (CCNU), бусульфан, треосульфан, сертенеф, кахектин, іфосфамід, тасонермін, лонідамін, карбоплатин, алтретамін, преднімустин, дибромдульцитол, ранімустин, фотемустин, недаплатин, ароплатин, оксаліплатин, темозоломід, метилметансульфонат, прокарбазин, дакарбазин, гептаплатин, естрамустин, імпросульфантозилат, трофосфамід, німустин, диброспідійхлорид, пумітепу, лобаплатин, сатраплатин, профіроміцин, цисплатин, ірофульвен, дексифосфамід, цисаміндихлор(2-метилпіридин)платину, бензилгуанін, глуфосфамід, GPX100, тетрахлорид (транс,транс,транс)-біс-му-(гексан-1,6-діамін)-му-[діамінплатину(II)]біс[діамін(хлор)платини(ll)], діаризидинілспермін, триоксид миш'яку, 1-(11-додециламіно-10-гідроксіундецил)-3,7диметилксантин, зорубіцин, ідарубіцин, даунорубіцин, бісантрен, мітоксантрон, пірарубіцин, пінафід, валрубіцин, амрубіцин, доксорубіцин, епірубіцин, пірарубіцин, антинеопластон, 3'дезаміно-3'-морфоліно-13-дезоксо-10-гідроксикарміноміцин, анаміцин, галарубіцин, елінафід, MEN10755 і (див. WO 00/50032). аміно-3-азиридиніл-4-метилсульфонілдаунорубіцин (див. WO 00/50032). Додаткові приклади включають інгібітори Raf кінази (такі як Вау43-9006) й інгібітори mTOR (такі як Wyeth's CCI-779 і Ariad AP23573). Додатковими прикладами є інгібітори РІ3K (наприклад, LY294002). В одному варіанті здійснення сполуки даного винаходу можуть застосовуватися в комбінації з алкілуючими агентами. Приклади алкілуючих агентів включають, але не обмежуються ними, азотні гірчиці: циклофосфамід, іфосфаїд, трофорфамід і хлорамбуцил; нітрозосечовини: карму стин (BCNU) і ломустин (CCNU); алкілсульфонати: бусульфан і треосульфан; триазени: дакарбазин, прокарбазин і темозоломід; платиновмісні комплекси: цисплатин, карбоплатин, ароплатин і оксаліплатин. В одному з варіантів здійснення алкілуючим агентом є дакарбазин. Дакарбазин може уводитися суб'єкту в дозах в інтервалі приблизно від 150 мг/кв. м (площі поверхні тіла суб'єкта) до приблизно 250 мг/кв. м. У ще одному варіанті здійснення дакарбазин уводиться внутрішньовенно суб'єкту один раз на день протягом п'яти послідовних днів у дозі в інтервалі приблизно 150 мг/кв. м до приблизно 250 мг/кв. м. В одному варіанті здійснення алкілуючим агентом є прокарбазин. Прокарбазин може уводитися суб'єкту в дозах в інтервалі приблизно від 50 мг/кв. м (площі поверхні тіла суб'єкта) до приблизно 100 мг/кв. м. У ще одному варіанті здійснення прокарбазин уводиться внутрішньовенно суб'єкту один раз на день протягом п'яти послідовних днів у дозі в інтервалі приблизно 50 мг/кв. м до приблизно 100 мг/кв. м. 14 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 У ще одному з варіантів здійснення алкілуючим агентом є темозолоамід. Темозоломід може уводитися суб'єкту в дозах в інтервалі приблизно від 150 мг/кв. м (площі поверхні тіла суб'єкта) до приблизно 200 мг/кв. м. У ще одному варіанті здійснення темозоломід уводиться тварині орально один раз на день протягом п'яти послідовних днів у дозі в інтервалі приблизно 150 мг/кв. м до приблизно 200 мг/кв. м. Приклади антимітотичних агентів включають: алоколхіцин, халіхондрин В, колхіцин, похідні колхиціну, долстастин 10, мейтанзин, ризоксин, тіоколхіцин і тритилцистеїн. Прикладом активованого гіпоксією сполуки є тирапазамін. Приклади інгібіторів протеамосому включають, але не обмежуються ними, лактацистін, бортезоміб, епоксоміцин і пептидні альдегіди, такі як MG132, MG115 і PSI. Приклади інгібіторів мікротрубочок/мікротрубочки-стабілізуючих агентів, включають паклітаксел, сульфат віндезину, вінкристин, вінбласин, вінорелбін, 3',4'-дидегідро-4'-дезокси-8'норвінкалеукобласин, доцетаксол, ризоксин, доластатин, ізетіонат мівобуліну, ауристатин, цемадотин, RPR109881, BMS184476, вінфлунін, криптофіцин, 2,3,4,5,6-пентафтор-N-(3-фтор-4метоксифеніл)бензолсульфонамід, ангідровінбласин, N,N-диметил-L-валіл-L-валіл-N-метил-Lваліл-L-проліл-L-пролін-т-бутиламід, TDX258, епотилони (див., наприклад, патенти №№ США 6284781 і 6288237) і BMS188797. Деякими прикладами інгібіторів топоізомерази є топотекан, гікаптамін, іринотекан, лубітекан, ексатекан, гіметекан, дифломотекан, силілкамптотецини, 9-амінокамптотецин, камптотецин, криснатол, мітоміцин С, 6-етоксипропіоніл-3',4'-О-екзобензиліденхартреузин, 9-метокси-N,N-диметил-5-нітропіразоло[3,4,5-k1]акридин-2-(6Н)пропанамін, 1-аміно-9-етил-5-фтор-2,3-дигідро-9-гідрокси-4-метил-1H,12Hбензо[dе]пірано[3',4':b,7]індолізино[1,2b]хінолін-10,13-(9Н,15H)діон, луртотекан, 7-[2(N-iзопропіламіно)етил]-(20S)камптотецин, BNP1350, BNP11100, BN80915, BN80942, етопозидфосфат, теніпозид, собузоксан, 2'-диметиламіно-2'-дезоксиетопозид, GL331, N-[2-(диметиламіно)етил]-9-гідрокси-5,6-диметил-6Н-пиридо[4,3-b]карбазол-1-карбоксамід, азулакрин, (5а,5а,8аа,9b)-9-[2-[N-[2-(диметиламіно)етил]-N-метиламіно]етил]-5-[4-гідрокси-3,5диметоксифеніл]-5,5а,6,8,8а,9-гексогідрофуро(3',4':6,7)нафто(2,3-d)-1,3-діоксол-6-він, 2,3-(метилендиоксит)-5-метил-7-гідрокси-8-метоксибензо[с]фенантридиний, 6,9-бic[(2-aмiнoeтил)aмiнo]бeнзo[g]iзoxiнoлiн-5,10-дioн, 5-(3-амінопропіламіно)-7,10-дигідрокси-2-(2-гідроксіетиламінометил)-6H-піразоло[4,5,1dе]акридин-6-він, N-[1-[2-(діетиламіно)етиламіно]-7-метокси-9-оксо-9H-тиоксантен-4-илметил]формамід, N-(2-(диметиламіно)етил)акридин-4-карбоксамід, 6-[[2-(диметиламіно)етил]аміно]-3-гідрокси-7H-индено[2,1-с]хінолін-7-він і димесна; некамптотецинові інгібітори топоізомерази, такі як індолокарбазоли; і подвійні інгібітори топоізомерази-І і II, такі як бензофеназини, XR20 115761MLN 576 і бензопірідоіндоли. В одному варіанті здійснення інгібітором топоізомерази є іринотекан. Іринотекан може уводитися суб'єкту в дозах в інтервалі приблизно від 50 мг/кв. м (площі поверхні тіла суб'єкта) до приблизно 150 мг/кв. м. У ще одному варіанті здійснення іринотекан уводиться внутрішньовенно суб'єкту один раз на день протягом п'яти послідовних днів у дозі в інтервалі приблизно 50 мг/кв. м до приблизно 150 мг/кв. м у 1-5 дні, потім знову внутрішньовенно один раз на день протягом п'яти послідовних днів у 28-32 дні в дозі в інтервалі приблизно від 50 мг/кв. м до близько 150 мг/кв. м, потім знову внутрішньовенно один раз на день протягом п'яти послідовних днів у 55-59 дні в дозі в інтервалі приблизно від 50 мг/кв. м до близько 150 мг/кв. м. Приклади інгібіторів мітотичних кінезинів і, зокрема, мітотичного кінезину KSP людини, описані в публікаціях заявок РСТ WO 01/30768, WO 01/98278, WO 02/056880, WO 03/050064, WO 03/050122, WO 03/049527, WO 03/049679, WO 03/049678, WO 03/039460, WO 03/079973, WO 03/099211, WO 2004/039774, WO 03/105855, WO 03/106417, WO 2004/087050, WO 2004/058700, WO 2004/058148 і WO 2004/037171, і заявках США 2004/132830 і 2004/132719. В одному варіанті здійснення інгібітори мітотичних кінозинів включають, але не обмежуються ними, інгібітори KSP, інгібітори MKLP1, інгібітори CENP-E, інгібітори МСАК, інгібітори Kif14, інгібітори Mphosph1 і інгібітори Rab6-KIFL. «Інгібітори кінази, залучені в мітотичне прогресування», включають, але не обмежуються ними, інгібітори авроракінази, інгібітори Polo-подібних кіназ (PLK) (зокрема інгібітори PLK-1), інгібітори bub-1 й інгібітори bub-R1. 15 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 «Антипроліферативні агенти» включають антисмислові РНК і ДНК олігонуклеотиди, такі як G3139, ODN698, RVASKRAS, GEM231 і INX3001, і антиметаболіти, такі як еноцитабін, кармофур, тегафур, пентостатин, доксифлуридин, триметрексат, флударабін, капецитабін,галоцитабін, цитарабінокфосфат, гідрат фостеавіннатрію, ралтитрексед, палтитрексид, емітефур, тіазофурин, децитабін, нолатрексед, пеметрексед, нелзарабін, 2'-дезокси-2'-метіоіденцитидин, 2'-фторметилен-2'-дезоксицитидин, N-[5-(2,3-дигідробензофурил)сульфоніл]-N'-(3,4-дихлорфеніл)сечовину, N6-[4-дезокси-4-[N2-[2(Е),4(Е)-тетрадекадієноїл]гліциламіно]-L-гліцеро-В-Lманогептопіранозил]аденін, аплідин, ектеїнасцидин, троксицитабін, 4-[2-аміно-4-оксо-4,6,7,8-тетрагідро-3Н-пірімідино[5,4-b][1,4]тіазин-6-(S)-етил]-2,5-тієноїл-Lглутамінову кислоту, аміноптерин, 5-фторурацил, аланозин, 11-ацетил-8-(карбамоїлоксиметил)-4-форміл-6-метоксі-14-окса-1,11діазатетрацикло(7.4.1.0.0)тетрадека-2,4,6-триєн-9-іловий ефір оцтової кислоти, швайнсонін, ломотрексол, дексразоксан, метіоніназу, 2'-ціано-2'-дезокси-N4-пальмітоїл-1-В-D-арабінофукранозилцитозин і 3-амінопіридин-2-карбоксіальдегідтіосемікарбазон. Приклади терапевтичних агентів, націлених на моноклональні антитіла, містять такі терапевтичні агенти, які є цитотоксичними або агентами радоізотопами, що приєднуються до специфічних ракових клітин або специфічних моноклональних антитіл клітин мішені. Приклади включають Веххаr. «Інгібітори HMG-CoA редуктази» стосуються інгібіторів 3-гідрокси-3-метилглутарил-СоА редуктази. Приклади інгибіторів HMG-CoA редуктази, які можуть використовуватися, ® включають, але не обмежуються ними, ловастатин (MEVACOR ; див. патенти США №№ ® 4231938, 4294926 і 4319039), симвастатин (ZOCOR ; див. патенти США №№ 4444784, 4820850 і ® 4916239), правастатин (PRAVACHOL ; див. патенти США №№ 4346227, 4537859, 4410629, ® 5030447 і 5180589), флувастатин (LESCOL ; див. патенти США №№ 5354772, 4911165, ® 4929437, 5189164, 5118853, 5290946 і 5356896) і аторвастатин (LIPITOR ; див. патенти США №№ 5273995, 4681893, 5489691 і 5342952). Структурні формули даних і додаткових інгібіторів HMG-Co редуктази, які можуть використовуватися в даних способах, описані на сторінці 87 публікації М. Yalpani, «Cholesterol Lowing Drugs», Chemistry & Industry, crop. 85-89 (5 лютого 1996 p. і в патентах США №№ 4782084 і 4885314. Термін «інгібітор HMG-CoA редуктази», використовуваний у даному описі, містить усі фармацевтично прийнятні форми лактонів і відкритих кислот (тобто, в яких лактонове кільце розкривається з утворенням вільної кислоти), а також сольові й ефірні форми сполук, що мають інгібуючою HMG-Co редуктазо активністю, і, отже, застосування таких солей, складних ефірів, відкритих-кислотних і лактонових форм охоплюється обсягом даного винаходу. «Інгібітор преніл-протеїн-трансферази» стосується сполуки, яка інгібує будь-який один фермент або будь-яке сполучення ферментів преніл-протеїн-трансферази, включаючи фарнезил-протеїн-трансферазу (FРТаза), геранілгераніл-протеїн-трансферазу типу І (GGPTaзaI) і геранілгераніл-протеїн-трансферазу типу II (GGPTaзa-II, яка називається також Rab GGPTaзою). Приклади інгібіторів преніл-протеїн-трансферази можна знайти в наступних публікаціях і патентах: WO 96/30343, WO 97/18813, WO 97/21701, WO 97/23478, WO 97/38665, WO 98/28980, WO 98/29119, WO 95/32987, патент США № 5420245, патент США № 5523430, патент США № 5532359, патент США № 5510510, патент США № 5589485, патент США № 5602098, європейської патентної публікації 0618221, європейської патентної публікації 0675112, європейської патентної публікації 0604181, європейської патентної публікації 0696593, WO 94/19357, WO 95/08542, WO 95/11917, WO 95/12612, WO 95/12572, WO 95/10514, патент США № 5661152, WO 95/10515, WO 95/10516, WO 95/24612, WO 95/34535, WO 95/25086, WO 96/05529, WO 96/06138, WO 96/06193, WO 96/16443, WO 96/21701, WO 96/21456, WO 96/22278, WO 96/24611, WO 96/24612, WO 96/05168, WO 96/05169, WO 96/00736, патент США № 5571792, WO 96/17861, WO 96/33159, WO 96/34850, WO 96/34851, WO 96/30017, WO 96/30018, WO 96/30362, WO 96/30363, WO 96/31111, WO 96/31477, WO 96/31478, WO 96/31501, WO 97/00252, WO 97/03047, WO 97/03050, WO 97/04785, WO 97/02920, WO 97/17070, WO 97/23478, WO 97/26246, WO 97/30053, WO 97/44350, WO 98/02436 і патенті США № 5532359. Наприклад, що 16 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 стосується ролі інгібітору преніл-протеїн-трансферази на ангіогенез, див. European J. of Cancer (1999), 35(9) 1394-1401. Термін «інгібітори ангіогенезу» стосується сполук, які інгібують утворення нових кровоносних судин незалежно від механізму. Приклади інгібіторів ангіогенезу включають, але не обмежуються ними, інгібітори тирозинкінази, такі як інгібітори рецепторів тирозинкінази Flt-1 (VEGFR1) і Flk-1/KDR (VEGFR2), інгібітори факторів росту епідермального походження, фібробласного або тромбоцитного походження, інгібітори ММР (інгібітори матриксної металопротеази), блокатори інтегрину, інтерферон-α, інтерлейкін-12, пентозанполісульфат, інгібітори циклооксигенази, включаючи нестероїдні протизапальні засоби (NSAID), такі як аспірин і ібупрофен, а також селективні інгібітори циклооксигенази-2, такі як целекоксиб і рофекоксиб (PNAS (1992) 89:7384; JNCI (1982) 69:475; Arch. Opthalmol. (1990) 108:573; Anat. Rec. (1994) 238:68; FEBS Letters (1995) 372:83; Clin. Orthop. (1995) 313:76; J. Моl. Endocrinol. (1996) 16:107; Jpn. J. Pharmacol. (1997) 75:105; Cancer Res. (1997) 57:1625 (1997); Cell (1998) 93:705; Intl. Jj. Моl. Med. (1998) 2:715; J. Biol. Chem. (1999) 274:9116)), стероїдні протизапальні засоби (такі як кортикостероїди, мінералокортикоїди, дексаметазон, преднізон, преднізолон, метилпред, бетаметазон), карбоксіамідотриазол, комбрестатин а-4, скваламін, 6-Охлорацетилкарбоніл)фумагілол, талідомід, ангіостатин, тропонін-1, антагоністи ангіотензину II (див. J. Lab. Clin. Med. (1985) 105:141-145) і антитіла до VEGF (див. Nature Biothechnology (1999) 17:963-968; Kіm et al (1993) Nature 362:841-844; WO 00/44777; і WO 00/61186). Інші терапевтичні агенти, які модулюють або інгібують ангіогенез і також можуть застосовуватися в комбінації зі сполуками даного винаходу, містять агенти, які модулюють або інгібують коагуляцію і системи фібринолізу (див. огляд у Clin. Chem. La. Med. (2000) 38:679-692). Приклади таких агентів, які модулюють або інгібують коагуляцію і шляхи фібринолізу, включають, але не обмежуються ними, гепарин (див. Thromb. Haemost. (1998) 80:10-23), низькомолекулярні гепарини й інгібітори карбоксипептидази U (відомі також як інгібітори активованого активним тромбіном інгібітору фібринолізу [TAFIa]) (див. Thrombosis Res. (2001) 101:329-354). Інгібітори TAFIa описані в публікації РСТ WO 03/013526 і заявці США № 60/349925 (поданої 18 січня 2002 p.). «Агенти, які заважають або перешкоджають контрольним точкам клітинного циклу», стосуються сполук, які інгібують протеїнкінази, які перетворюють сигнали контрольної точки клітинного циклу, сенсибілізуючи, тим самим, ракові клітини до ДНК ушкоджувальних агентів. Такі агенти містять інгібітори ATR, ATM, Chk1 і Chk2 кінази й інгібітори cdk і cdc кінази, і конкретними прикладами їх є 7-гідроксистауроспорин, стауроспорин, флавопіридол, CYC202 (циклацель) і BMS-387032. «Інгібітори клітинної проліцерації і сигнального шляху виживання» стосуються фармацевтичних агентів, які інгібують рецептори клітинної поверхні і каскади сигнальної трансдукції вниз по потоку рецепторів поверхні. Такі агенти містять інгібітори інгібіторів EGFR (наприклад, гефітиніб і ерлотиніб), інгібітори ERB-2 (наприклад, трастузумаб), інгібітори IGFR (наприклад, інгібітори, описані у WO 03/059951), інгібітори цитокінових рецепторів, інгібітори MET, інгібітори РI3K (наприклад, LY294002), серин/треонінкінази (включаючи, але, не обмежуючись ними, інгібітори Akt, такі, як описано в WO 03/086404, WO 03/086403, WO 03/086394, WO 03/086279, WO 02/083675, WO 02/083139, WO 02/083140 і WO 02/083138), інгібітори Raf кінази (наприклад, BAY-43-9006), інгібітори МЕK (наприклад, СІ-1040 і PD-098059) й інгібітори mTOR (наприклад, Wyeth CCI-779 і Ariad AP23573). Такі агенти містять інгібуючі сполуки з малою молекулою й антагоністи антитіл. «Індукуючі апоптоз агенти» містять активатори членів сімейства TNF рецепторів (включаючи TRAIL рецептори). В одному варіанті здійснення сполуки даного винаходу корисні при лікуванні раку в комбінації з одним або більше, зокрема одним, двома або трьома агентами, вибраними з темозоломіду, цисплатину, карбоплатину, оксаліплатину, іринотекану і топотекану. Сполуки даного винаходу можуть бути корисні при лікуванні раку в комбінації з будь-яким ® одним або декількома наступними терапевтичними агентами: абарелікс (Plenaxis depot ); ® ® ® альдеслейкін (Prokine ); альдеслейкін (Proleukin ); алемтозумаб (Campath ); алітретиноїн ® ® ® ® (Panretin ); алопуринол (Zyloprim ); альтретамін (Hexalen ); аміфостин (Ethyol ); анастрозол ® ® ® ® (Arimidex ); триоксид миш'яку (Trisenox ); аспарагіназа (Elspar ); азацитидин (Vidaza ); ® ® ® бевакузимаб (Avastin ); бексаротен у капсулах (Targretin ); бексаротен гель (Targretin ); ® ® ® блеоміцин (Blenoxame ); бортезоміб (Velcade ); бусульфан внутрішньовенний (Busulfex ); ® ® ® бусульфан оральний (Myleran ); калустерон (Methosarb ); капецитабін (Xeloda ); карбоплатин ® ® ® ® (Paraplatin ); кармустин (BCNU , BiCNU ); кармустин (Gliadel ); кармустин з поліфепрозаном 20 ® ® ® Імплантат (Gliadel Wafer ); целекоксиб (Celebrex ); цетуксимаб (Erbitux ); хлорамбуцил 17 UA 97658 C2 ® 5 10 15 20 25 30 35 40 45 50 55 ® ® ® ® (Leukeran ); цисплатин (Platinol ); кладрибін (Leustatin , 2-Cd ); клофарабін (Clolar ); ® ® ® циклофосфамід (Cytoxan , Neosar ); циклофосфамїд (Cytoxan Injection ); циклофосфамід ® ® ® (Cytoxan у таблетках ); цитарабін (Cytosar-U ); цитарабін у ліпосомах (DepoCyt ); дакарбазин ® ® ® (DTIC-Dome ); дактиноміцин, актиноміцин D (Cosmegen ); дарбепоетин альфа (Aranesp ); ® ® даунорубіцин у ліпосомах (DaunoXome ); даунорубіцин, дауноміцин (Daunorubicin ); ® ® ® даунорубіцин, дауноміцин (Cerubidine ); денлейкін дифтитокс (Ontal ); дексразоксан (Zinecard ); ® ® ® ® доцетаксел (Taxotere ); доксорубіцин (Adriamycin PFS ); доксорубіцин (Adriamycin , Rubex ); ® ® доксорубіцин (Adriamycin PFS для ін'єкції ); доксорубіцин у ліпосомах (Doxil ); ® ® дромостанолонпропіонат (Dromostanolone ); дромостанолонпропіонат (Masterone для ін'єкцій ); ® ® ® розчин еліота В (Elliot's В Solution( ); епірубіцин (Еllеnсе ); епоетин альфа (epogen ); ерлотиніб ® ® ® ® (Tarceva ); етамустин (Emcyt ); етопозидфосфат (Etopophos ); етопозид, VP-16 (Vepesid ); ® ® ексеместан (Aromasin ); філграстим (Neupogen ); флоксуридин (внутрішньоартеріальний) ® ® ® ® (FUDR ); флударабін (Fludara ); фторурацил, 5-FU (Adrucil ); фулвестрант (Faslodex ); ® ® ® гефітиніб (Iressa ); гемцитабін (Gemzar ); гемтузумаб озогаміцин (Mylotar ); гозерелінацетат ® ® ® (Zoladex Implant ); гозерелінацетат (Zoladex ); гістрелінацетат (Histrelin implant ); ® ® ® гідроксисечовина (Hydrea ); ібритумомаб тіуксетан (Zevalin ); ідарубіцин (Idamycin ); іфосфамід ® ® ® (IFEX ); іматинібмезилат (Gleevec ); інтерферон альфа 2а (Roferon А ); інтерферон альфа 2b ® ® ® ® (Intron А ); іринотекан (Camptosar ); леналідомід (Revlimid ); летрозол (Femara ); лейковорин ® ® ® ® (Wellcovorin ), Leucovorin ); лейпролідацетат (Eligard ); левамізол (Ergamisol ); ломустин, CCNU ® ® ® (CeeBU ); меклоретамін, азотна гірчиця (Mustargen ); мегестролацетат (Megace ); мелфалан, L® ® ® ® PAM (Alkeran ); меркаптопурин, 6-MP (Purinethol ); месна (Mesnex ); месна (Mesnex tabs ); ® ® ® метотресат (Methotrexate ); метоксален (Uvadex ); мітоміцин С (Mutamycin ); мітотан ® ® ® (Lysodren ); мітоксантрон (Novantrone ); нандролон фенпропіонат (Durabolin-50 ); неларабін ® ® ® ® (Arranon ); нофетумомаб (Verluma ); опрелвекін (Neumega ); оксаліплатин (Eloxatin ); ® ® ® паклітаксел (Рахеnе ); паклітаксел (Taxol ); паклітакселпротеїн-зв'язані частинки (Abraxane ); ® ® ® паліфермін (Kepivance ); памідронат (Aredia ); пегадемаза (Adagen (Pegademase бичача) ); ® ® ® пегаспаргаза (Oncaspar ); пегфілграстим (Neulasta ); пеметрексед двонатрієвий (Alimta ); ® ® ® пентостатин (Nipent ); піпоброман (Vercyte ); плікаміцин, мітраміцин (Mithracin ); портимер ® ® ® ® натрієвий (Photofrin ); прокарбазин (Matulane ); хінакрин (Atabribe ); расбуриказа (Elitek ); ® ® ® ® ритуксимаб (Rituxan ); сарграмостин (Leukine ); сарграмостим (Prokine ); сорафеніб (Nexavar ); ® ® ® ® стрептозоцин (Zanosar ); сунітинібмалеат (Sutent ); тальк (Sclerosol ); тамоксифен (Nolvadex ); ® ® ® темозоломід (Temodar ); теніпозид, VM-26 (Vumon ); тестолактон (Teslac ); тіогуанін, 6-TG ® ® ® (Thioguanine®); тіотепа (Thioplex ); топотекан (Hycamtin ); тореміфен (Fareston ); тозитумомаб ® ® ® (Bexxar ); тозитутомомаб/І-131 тозитумомаб (Веххаr ); трастузумаб (Herceptin ); третиноїн, ® ® ® ATRA (Vesanoid ); урацилова гірчиця (Uracil Mustard у капсулах ); валрубіцин (Valstar ); ® ® ® ® вінбласин (Velban ); вінкристин (Oncovin ); вінорелбін (Navelbine ); вориностат (Zolinza ); ® ® ® золдронат (Zometa ); нілотиніб (Tasigna ) і дасатиніб (Sprycel ). Винахід охоплює також комбінації з NSAID, які є селективними інгібіторами СОХ-2. Для цілей даного винаходу NSAID, які є селективними інгібіторами СОХ-2, визначаються як NSAID, які мають специфічність у відношенні інгібування СОХ-2 в порівнянні з СОХ-1 щонайменше 100кратною, обмірюваною за ступенем ІС50 у відношенні СОХ-2 в порівнянні з ІС50 у відношенні СОХ-1, оціненою за допомогою клітинного або мікросомного аналізу. Такі сполуки містять, але не обмежуються ними, сполуки, розкриті в патентах США №№ 5474995, 5861419, 6001843, 6020343, 5409944, 5436265, 5536752, 5550142, 5604260, 5698584, 5710140, WO 94/15932, 5344991, 5134142, 5380738, 5393790, 5466823, 5633272 і 5932598, усі з який включені в даний опис за допомогою посилання. Інгібіторами СОХ-2, які особливо корисні в даному способі лікування, є 5-хлор-3-(4метилсульфоніл)феніл-2-(2-метил-5-піридиніл)піридин; або його фармацевтично прийнятна сіль. Сполуки, які описані як специфічні інгібітори СОХ-2 і, отже, корисні в даному винаході, ® ® містять, але не обмежуються ними, парекоксиб, CELEBREX і BEXTRA або його фармацевтично прийнятну сіль. Інші приклади інгібіторів ангіогенезу містять, але не обмежуються ними, ендостатин, україн, ранпимазу, ІМ862, 5-метокси-4-[2-метил-3-(3-метил-2-бутеніл)оксираніл]-1-оксаспіро[2,5]окт-6ил(хлорацетил)карбамат, ацетилдинаналін, 5-аміно-1-[[3,5-дихлор-4-(4хлорбензоїл)феніл]метил]-1Н-1,2,3-триазол-4-карбоксамід, СМ101, скваламін, комбретастатин, RPI4610, NX31838, сульфатований манопентаозфосфат, 7,7-(карбоніл-біс[іміно-N-метил-4,2піролокарбоніліміно[N-метил-4,2-пірол]карбоніліміно]-біс-(1,3-нафталіндисульфонат) і 3-[(2,4диметилпірол-5-іл)метилен]-2-індолінон (SU5416). 18 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовуваний вище термін «блокатори інтегрину» стосується сполук, які селективно антагонізують, інгібують або протидіють зв'язуванню фізіологічного ліганду з α νβ3 інтегрином, зі сполуками, які селективно антагонізують, інгібують або протидіють зв'язуванню фізіологічного ліганду з ανβ5 інтегрином, до сполук, які селективно антагонізують, інгібують або протидіють зв'язуванню фізіологічного ліганду як з ανβ3, так і з ανβ5 інтегрином, і до сполук, що антагонізують, інгібують або протидіють активності конкретного інтегрину(інтегринів), експресованих у капілярних ендотеліальних клітинах. Даний термін стосується також антагоністів ανβ6, ανβ8, α1β1, α2β1, α5β1, α6β1 і α6β4 інтегринів. Даний термін стосується також антагоністів будь-якого сполучення, ανβ3, ανβ5, ανβ6, ανβ8, α1β1, α2β1, α5β1, α6β1 і α6β4 інтегринів. Деякі конкретні приклади інгібіторів тирозинкінази містять Ν-(трифторметилфеніл)-5метилизоксазол-4-карбоксамід, 3-[(2,4-диметилпірол-5-іл)метиліденіл]індолін-2-він, 17-(аліламіно)-17-деметоксигелданаміцин, 4-(3-хлор-4-фторфеніламіно)-7-метокси-6-[3-(4-морфолінил)пропоксил]хіназолін, N-(3-етинілфеніл)-6,7-біс(2-метоксіетокси)-4-хіназолінамін, ВІВХ1382, 2,3,9,10,11,12-гексагі дро-10-(гідроксиметил)-10-гідрокси-9-метил-9,12-епокси-1Ндііндоло[1,2,3-fg:3',2',1'-k1]піроло[3,4-і][1,6]-бензодіазоцин-1-він, SH268, геністеїн, STI571, СЕР2563, 4-(3-хлорфеніламіно)-5,6-диметил-7Н-піроло[2,3-d]піримідинметансульфонат, 4-(3-бром-4-гідроксифеніл)аміно-6,7-диметоксихіназолін, 4-(4'-гідроксифеніл)аміно-6,7-диметоксихіназолін, SU6668, STI571A, М-4-хлорфеніл-4-(4-піридилметил)-1-фталазинамін і EMD121974. В одному з варіантів здійснення сполуки даного винаходу є корисними при лікуванні або запобіганні появи некрозу, індукованого селективними N3-аденінметилюючими агентами, такими як МеОSО2(СН2)-лекситропсин (Me-Lex). Комбінації зі сполуками, іншими ніж протиракові сполуки, також охоплюються даними способами. Наприклад, комбінації сполук даного винаходу з PPAR-γ (тобто PPAR-гама) агоністами і PPAR-δ (тобто PPAR-дельта) агоністами корисні при лікуванні деяких злоякісних пухлин. PPAR-γ і PPAR-α є пероксисом-проліфератор-активованими рецепторами γ і α. Про експресію PPAR-γ у ендотеліальних клітинах і його залученні в ангіогенез повідомлялося в літературі (див. J. Cardiovasc. Pharmacol. (1998) 31:909-913; J. Вiol. Chem. (1999) 274:9116-9121; Invest. Ophthalmol Vis. Sci. (2000) 41:2309-2317). Трохи пізніше було показано, що PPAR-γ інгібує ангіогенну відповідну реакцію на VEGF in vitro і троглітазон, і росиглітазонмалеат інгібує розвиток ретинальної неоваскуляризації у мишей. (Ach. Ophthalmol. (2001) 119:709-717). Приклади PPAR-γ агоністів і PPAR-γ/α агоністів містять, але не обмежуються ними, тіазолідиндіони (такі як DRF2725, CS-011, троглітазон, росиглітазон і піоглітазон), фенофібрат, гемфіброзил, клофібрат, GW2570, SB219994, AR-H039242, JTT-501, МСС-555, GW2331, GW409544, ΝΝ2344, KRP297, ΝΡ0110, DRF4158, NN622, GI262570, PNU182716, DRF552926, 2[(5,7-дипропіл-3-трифторметил-1,2-бензизоксазол-6-іл)окси]-2-метилпропіонову кислоту (описана в USSN 09/782856) і 2(R)-7-(3-(2-xлоp-4-(4-фторфенокси)фенокси)пропоксі)-2етилхроман-2-карбонову кислоту (описана в USSN 60/235708 і 60/244697). Ще одним варіантом здійснення даного винаходу є застосування описаних у даному винаході сполук у комбінації з противірусними агентами (такими як аналоги нуклеозиду, що містять ганцикловір, для лікування раку. Див. WO 98/04290. Ще одним варіантом здійснення даного винаходу є застосування описаних у даному винаході сполук у комбінації з генною терапією для лікування раку. Що стосується огляду генетичних методів підходу до лікування раку, див. Hall et al (Am J Hum Genet (1997) 61:787-789) th і Kufe et al (Cancer Medicine, 5 Ed. Crop. 876-889, ВС Decker, Hamilton 2000). Генна терапія може використовуватися для доставляння будь-якого гену, що придушує пухлину. Приклади таких генів містять, але не обмежуються ними, р53, який може доставлятися за допомогою перенесення гену, опосередковуваного рекомбінантним вірусом (див., наприклад, патент США № 6069134), uPA/uPAR антагоніст («Adenovirus-Mediated Delivery of a uPA/uPAR Antagonist Angiogenesis-Dependent Tumor Growth and Dissemination in Mice,» Gene Therapy, August (1998) 5(8):1105-13), й інтерферон гама (J Immunol (2000) 164:217-222). Сполуки даного винаходу також можуть уводитися в комбінації з інгібітором уродженої або властивої множинної лікарської стійкості (MDR), зокрема MDR, асоційованого з високими рівнями експресії білків переносників. Такі MDR інгібітори містять інгібітори р-глікопротеїну (Pgp), такі як LY335979, XR9576, ОС144-093, R101922, VX853, верапаміл і PSC833 (валсподар). 19 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 Сполука даного винаходу може застосовуватися в комбінації з протиблювотними агентами для лікування нудоти або блювоти, включаючи гостру затриману, у пізній фазі і випереджувальну блювоту, яка може бути результатом застосування сполуки даного винаходу, як такого або з радіаційною терапією. Для запобігання або лікування блювоти сполука даного винаходу може застосовуватися в комбінації з іншими протиблювотними агентами, особливо антагоністами рецептора нейрокініну-1, антагоністами рецептора 5НТ3, такими як онданосетрон, гранісетрон, тропісетрон і затисетрон, GABAB, агоністами рецепторів, такими як баклофен, кортикостероїдами, такими як декадрон (дексаметазон), кеналог, аристокорт, назалід, преферид, бенекортен або інші, такі як розкрито в патентах США №№ 2789118, 2990401, 3048581, 3126375, 3929768, 3996359, 3928326 і 3749712, антидопамінергичним агентом, таким як фенотіазини (наприклад, прохлорперазин, флуфеназин, тіоридазин і мезоридазин), метоклопрамідом або дронабінолом. В одному з варіантів здійснення протиблювотний агент, вибраний з антагоніста рецептора нейрокініну-1, антагоніста рецептора 5НТЗ і кортикостероїду, вводять як ад'ювант для лікування або запобігання блювоти, що може бути результатом уведення розглянутих сполук. Антагоністи рецептора нейрокініну-1 для застосування в комбінації зі сполуками даного винаходу повністю описані, наприклад у патентах США №№ 5162339, 5232929, 5942930, 5373003,5387595, 5459270, 5494926, 5496833, 5637699, 5719147; європейських патентних публікаціях №№ ЕР 0360390, 0394989, 0428434, 0429366, 0430771, 0436334, 0443132, 0482539, 0498069, 0499313, 0512901, 0512902, 0514273, 0514274, 0514275, 0514276, 0515681, 0517589, 0520555, 0522808, 0528495, 0532456, 0533280, 0536817, 0545478, 0558 156, 0577394, 0585913,0590152, 0599538, 0610793, 0634402, 0686629, 0693489, 0694535, 0699655, 0699674, 0707006, 0708101, 0709375, 0709376, 0714891, 0723959, 0733632 і 0776893; міжнародних патентних публікаціях РСТ WO 90/05525, 90/05729, 91/09844, 91/18899, 92/01688, 92/06079, 92/12151, 92/15585, 92/17449, 92/20661, 92/20676, 92/21677, 92/22569, 93/00330, 93/00331, 93/01159, 93/01165, 93/01169, 93/01170, 93/06099, 93/09116, 93/10073, 93/14084, 93/14113, 93/18023, 93/19064, 93/21155, 93/21181, 93/23380, 93/24465, 94/00440, 94/01402, 94/02461, 94/02595, 94/03429, 94/03445, 94/04494, 94/04496, 94/05625, 94/07843, 94/08997, 94/10165, 94/10167, 94/10168, 94/10170, 94/11368, 94/13639, 94/13663, 94/14767, 94/15903, 94/19320, 94/19323, 94/20500, 94/26735, 94/26740, 94/29309, 95/02595, 95/04040, 95/04042, 95/06645, 95/07886, 95/07908, 95/08549, 95/11880, 95/14017, 95/15311, 95/16679, 95/17382, 95/18124, 95/18129, 95/19344, 95/20575, 95/21819, 95/22525, 95/23798, 95/26338, 95/28418, 95/30674, 95/30687, 95/33744, 96/05181, 96/05193, 96/05203, 96/06094, 96/07649, 96/10562, 96/16939, 96/18643, 96/20197, 96/21661, 96/29304, 96/29317, 96/29326, 96/29328, 96/31214, 96/32385, 96/37489, 97/01553, 97/01554, 97/03066, 97/08144, 97/14671, 97/17362, 97/18206, 97/19084, 97/19942 і 97/21702; і в британських патентних публікаціях №№ 2266529, 2268931, 2269170, 2269590, 2271774, 2292144, 2293168, 2293169 і 2302689. Одержання таких сполук повністю описано в приведених вище патентах і публікаціях, що включені в даний опис за допомогою посилання. В одному з варіантів здійснення антагоніст рецептора нейрокініну-1 для застосування в комбінації зі сполуками даного винаходу вибирають з: 2-(R)-(1-(R)-(3,5біс(трифторметил)феніл)етокси)-3-(S)-4-фтофеніл)-4-(3-(5-оксо-1Н,4Н-1,2,4триазоло)метил)морфоліну або його фармацевтично прийнятної солі, який описаний у патенті США № 5719147. Сполука даного винаходу також може уводитися з агентом, застосовуваним при лікуванні анемії. Таким агентом лікування анемії є, наприклад, активатор рецептора безупинного ейтропоезу (такий як епоетин альфа). Сполука даного винаходу також може уводитися з агентом, застосовуваним при лікуванні нейтропенії. Таким агентом лікування нейтропенії є, наприклад, гематопоетичний фактор росту, який регулює продукування і функцію нейтрофілів, такий як фактор, що стимулює гранулоцитну колонію людини, (G-CSF). Приклади G-CSF включають філграстим. Сполука даного винаходу також може уводитися з посилюючим імунологію лікарським засобом, таким як левамізол, ізопринозин і задаксин. Сполука даного винаходу також може бути корисною при лікуванні або запобіганні раку, включаючи рак кісток, у комбінації з бісфосфонатами (варто розуміти, що вони містять бісфосфонати, дифосфонати, бісфосфонові кислоти і дифосфонові кислоти). Приклади бісфосфонатів містять, але не обмежуються ними: етидронат (дидронел), памідронат (аредія), алендронат (фосамакс), ризедронат (актонель), золедронат (зомета), ібандронат (боніва), інкадронат або цимадронат, клодронат, ЕВ-1053, мінодронат, неридронат, піридронат і 20 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 тилудронат, включаючи будь-які і всі їхній фармацевтично прийнятні солі, похідні, гідрати і їх суміші. Таким чином, обсяг даного винаходу охоплює застосування сполук даного винаходу в комбінації з іонізуючими радіацію і/або в комбінації з ще однією сполукою, вибраною з інгібіторів HDAC, модуляторів естрогенового рецептора, модулятора андрогенового рецептора, модулятора ретиноїдного рецептора, циктотоксичного/цитостатичного агента, антипроліферативного агента, інгібітору преніл-протеїн-трансферази, інгібітору HMG-Co редуктази, інгібітору ангіогенезу, агоніста PPAR-γ, агоніста PPAR-γ і противірусного агента, інгібітору властивої стійкості до множинного лікарського засобу, протиблювотного агента, агента, застосовуваного при лікуванні анемії, агента, застосовуваного при лікуванні нейтропенії, що підсилює імунологію лікарського засобу, інгібітору клітинної проліферації і сигналізації виживання, агента, що перешкоджає контрольній точці клітинного циклу, індукуючого апоптоз агента і бісфосфонату. Термін «уведення» і його варіанти (наприклад, «уведення» сполуки) стосовно до сполуки винаходу означає уведення сполуки або проліків даної сполуки в систему тварини, що потребує такого лікування. Коли сполука винаходу або її проліки надається в комбінації з одним або декількома іншими активними агентами (наприклад, цитотоксичним агентом і ін.), варто розуміти, що кожний з термінів «уведення» і його варіанти містить рівнобіжне або послідовне уведення сполуки або її проліків й інших агентів. Мається на увазі, що використовуваний у даному описі термін «композиція» охоплює продукт, що містить конкретно зазначені інгредієнти в обговорених кількостях, а також будьякий продукт, що є результатом, прямо або побічно, комбінації зазначених інгредієнтів у зазначених кількостях. Термін «терапевтично ефективна кількість», використовуваний у даному описі, означає, що кількість активної сполуки або фармацевтичного агента, яка викликає біологічну або медичну відповідну реакцію в тканині, системі, тварині або людині, яка підібрана дослідником, ветеринаром, лікарем або іншим клініцистом. Термін «лікування» стосується лікування ссавця, що страждає від патологічного стану, і стосується дії, яка полегшує даний стан шляхом знищення ракових клітин, а також дія, що приводить в результаті до інгібування прогресування даного стану, і включає зниження швидкості прогресу, зупинку прогресування, поліпіпення стану і лікування від патологічного стану. У винахід також включене лікування як профілактична міра (тобто профілактика). Термін «фармацевтично прийнятний», використовуваний у даному описі, стосується сполук, матеріалів, композицій і/або дозованих форм, які є з урахуванням суджень медиків прийнятними для застосування в контакті з тканинами суб'єкта (наприклад, людини) без надлишкової токсичності, подразнення, алергійної відповідної реакції або інших проблем або ускладнень, співрозмірюваними з розумним співвідношенням користь/ризик. Кожен носій, ексципієнти й ін. також повинні бути «прийнятними» у сенсі сумісності з іншими інгредієнтами рецептурної форми. Термін «додатковий або доповнення» стосується застосування сполук у комбінації з відомими терапевтичними засобами. Такі засоби містять цитотоксичні режими лікарських засобів і/або іонізуючу радіацію, використовувані при лікуванні різних типів раку. Зокрема відомо, що активні сполуки потенціюють дії ряду хіміотерапевтичних засобів для лікування раку, які включають клас отрути топоізомерази (наприклад, топотекан, іринотекан, рубитекан), більшість відомих алкілуючих агентів (наприклад, DTIC, темозоламід) і лікарські засоби на основі платини (наприклад, карбоплатин, цисплатин), використовуваних у лікуванні раку. В обсяг пунктів формули винаходу також включений спосіб лікування раку, що містить уведення терапевтично ефективної кількості сполуки формули І у комбінації з радіаційною терапією і/або в комбінації зі сполукою, вибраною з: інгібіторів HDAC, модулятора естрогенового рецептора, модулятора андрогенового рецептора, модулятора ретиноїдного рецептора, цитотоксичного/цитостатичного агента, антипроліферативного агента, інгібітору преніл-протеїнтрансферази, інгібітору HMG-Co редуктази, інгібітору ангіогенезу, агоніста PPAR-γ, агоніста PPAR-δ, противірусного агента, інгібітору властивої стійкості до множинного лікарського засобу, протиблювотного агента, агента, корисного при лікуванні анемії, агента, корисного при лікуванні нейтропенії, підсилюючого імунологію лікарського засобу, інгібітору клітинної проліферації і сигналізації виживання, агента, який перешкоджає контрольній точці клітинного циклу, індукуючого апоптоз агента і бісфосфонату. Дані й інші аспекти винаходу будуть очевидні з опису, представленого нижче. Скорочення, використовувані в хімічній частині опису й у прикладах, є наступними: 21 UA 97658 C2 5 10 15 АсСІ (ацетилхлорид); (BzO)2 (бензоїлпероксид); Cbz-Cl (бензилхлорформіат); DCM (дихлорметан); DIPEA (діізопропілетиламін; ДМФА (диметилформамід); ДМСО (диметилсульфоксид); екв. (еквівалент); ES (електророзпилювання); EtOAc (етилацетат); ЕtOН (етанол); мол. Сита (молекулярні сита); HATU [гексафторфосфат О-(7-азабензотриазол-1-ил)N,N,N',N'-тетраметилуронію]; MeCN (ацетонітрил); МеОН (метанол); МС (мас спектрометрія); MW (мікрохвильове опромінення); NBS (N-бромсукцинімід); NMMO (N-метилморфолін-N-оксид); ЯМР (ядерний магнітний резонанс); Рсоl (тиск колонки); іРrОН (ізопропанол); КТ або к. т. (кімнатна температура)); нас. вод. (насичений водяний); SiO 2 (силікагель); ТГФ ® (тетрагідрофуран); t-BuOH (трет-бутанол); KОАс (ацетат калію); IST ISOLUTE SPE колонка ® SCX (Міжнародна сорбентна технологія ISOLUTE катіонообмінна смола екстракціонної колонки у твердій фазі); SFC (надкритична рідинна хроматографія); TBTU тетрафторборат O-(1Hбензотриазол-1-ил)-N,N,N',N'-тетраметилуронію; Тсоl (температура стовпчика), CDCl3 (дейтерований хлороформ); ТШХ (тонкошарова хроматографія) і ТФОК (трифтороцтова кислота). Сполуки формули І можуть бути одержані шляхом взаємодії сполуки формули ІА з аміаком: 1 20 25 30 1 35 2 x де R і R мають значення, визначені вище, і R представляє С1-6алкіл, такий як метил. Реакцію звичайно здійснюють з використанням водяного розчину NH 3 у розчиннику, такому як ТГФ, приблизно при 70°С, у герметізованій реакційній судині (з обережністю). Альтернативно, може додаватися основа, така як NaOH або КОН, для гідролізу складного ефіру у відповідну x карбонову кислоту (R представляє водень), з наступним доданням NH3 у присутності конденсованих агентів, таких як HATU або TBTU і DIPEA у розчиннику, такому як ДМФА, причому, реакцію здійснюють приблизно при кімнатній температурі. Альтернативно, карбонова кислота може бути активована з утворенням змішаного ангідриду, наприклад, з використанням Вос2О і наступною взаємодією з бікарбонатом амонію, звичайно в розчиннику, такому як піридин. Альтернативно, складний ефір може бути перетворений у сполуки формули ІА з використанням аміаку в розчиннику, такому як МеОН, приблизно при 120°С, наприклад, при MW. Атом азоту в піперидиновому кільці сполук формули ІА може бути захищений під час описаного вище синтезу, наприклад, групою Вос. Сполуки формули ΙΑ можуть бути одержані шляхом взаємодії сполуки формули IB з азидом: 2 x де R , R і R мають значення, визначені вище. Азид, такий як NaN3, звичайно можна використовувати в розчиннику, такому як ДМФА, приблизно від 90°С до 140°С. Можна використовувати також добавку, таку як 2,6-лутидин. Реакцію можна здійснювати в атмосфері азоту. Сполуки формули IB можуть бути одержані шляхом конденсації сполуки формули IС зі сполукою формули ID: 22 UA 97658 C2 1 5 2 x 1 де R , R і R мають значення, визначені вище, і L представляє відхідну групу, таку як нітро або галоген, наприклад, фтор. Методики включають конденсацію в присутності дегідратуючого агента, такого як MgSO4 або молекулярні сита, або при нагріванні в спиртовому розчиннику, такому як етанол, при кип'ятінні зі зворотним холодильником. Реакцію можна здійснювати в атмосфері азоту. Сполука формули IС може бути одержана окислюванням сполуки формули IE окислювальним агентом, таким як NMMO: 1 x 1 2 15 де R , R i L мають значення, визначені вище, і L представляє відхідну групу, таку як галоген, наприклад бром, звичайно в розчиннику, такому як MeCN, приблизно при кімнатній температурі. Реакцію можна здійснювати в атмосфері азоту. Сполуки формули IE, де L2 представляє бром, можуть бути одержані окислюванням сполуки формули IF бромуючим агентом, таким як NBS, у присутності ініціатора радикалів, такого як бензоїлпероксид: 20 де R , R і L мають значення, визначені вище, звичайно в розчиннику, такому як ССl 4, при кип'ятінні зі зворотним холодильником. Реакцію можна здійснювати в атмосфері азоту. 1 Сполуки формули IF, де L представляє фтор, можуть бути одержані шляхом діазотування сполуки формули IG: 10 1 1 25 x 1 x де R і R мають значення, визначені вище, з наступним розкладанням проміжної діазонієвої солі. Наприклад, діазотування можна здійснювати з використанням тетрафторборату нітрозонію в розчиннику, такому як DCM, приблизно при 0°С. Відповідну тетрафторборатну сіль діазонію можна потім виділити, з наступним розкладанням при підвищених температурах на відповідну похідну фторбензолу (обережно), таким чином, як нагрівання до 160°С в розчиннику, такому як дихлорбензол. 1 Сполука формули IF, де L представляє нітро, може бути одержана нітруванням сполуки формули IH: 23 UA 97658 C2 1 5 10 де R має значення, визначені вище, з наступною складною етерифікацією. Реакцію нітрування можна здійснювати в присутності нітрату, такого як нітрат калію, і кислоти, такої як сірчана кислота, приблизно при кімнатній температурі. Стадію етерифікації можна здійснювати x в стандартних умовах, таких як взаємодія з алкілгалогенідом формули R -X, де X представляє галоген, такий як йод, у присутності основи, такої як карбонат цезію, і в розчиннику, такому як x ДМФА, приблизно при кімнатній температурі. Спирт формули R -OH можна також використовувати разом з кислотним каталізатором, таким як НСl, одержаним на місці з АсСІ/МеОН при нагріванні зі зворотним холодильником. Бажана сполука формули IF може бути потім одержана гідруванням нітроз'єднання у відповідний анілін з використанням водню і каталізатора, такого як паладій на вуглеці, звичайно в спиртовому розчиннику, такому як МеОН. Альтернативно, сполуки формули І можуть бути одержані відновленням сполуки формули IJ: 1 2 1 15 2 де R і R мають значення, визначені вище. Відновлення можна здійснювати за реакцією Fowler з використанням ацилхлориду, такого як CBz-Cl, і відновлювального агента, такого як NaBH4. Гідрування над паладієм на вуглеці завершує реакцію і видаляє CBz-захисну групу. Сполуки формули IJ можуть бути одержані крос-сполученням сполуки формули ІK з 3піридинілбороновою кислотою формули IL: 20 25 2 де R , R і L мають значення, визначені вище. Реакцію звичайно здійснюють в умовах реакції сполучення Сузуки, таких як використання каталізаторів, таких як Pd2(dba) і три(третбутил)фосфіну, разом з основою, такою як карбонат натрію, і розчинників, таких як ДМФА і вода, приблизно при 90°С. Сполуки формули ІK можуть бути одержані шляхом конденсації сполуки формули IМ зі сполукою формули IN: 24 UA 97658 C2 1 1 5 10 15 20 25 30 35 40 45 2 2 3 x де R , R і L мають значення, визначені вище, і L представляє відхідну групу, таку як галоген, наприклад фтор, звичайно в розчиннику, такому як ДМФА, приблизно при 180°С при MW. Також може бути додана основа, таке як K2СО3. Сполуки формули IМ можуть бути одержані шляхом взаємодії сполуки формули IO: де R і R мають значення, визначені вище, з основою, таким як KОН або NaOH, приблизно x при кімнатній температурі з гідролізом складного ефіру у відповідну карбонову кислоту (R представляє водень), з наступним доданням NH 3 у присутності агентів сполучення, таких як HATU, DIPEA і TBTU, у розчиннику, такому як ДМФА, при цьому реакцію здійснюють приблизно при кімнатній температурі. Сполуки формули IO можуть бути одержані зі сполуки формули IG шляхом ацетилування анілінової групи такими реагентами, як ацетилхлорид, у розчиннику, такому як 1,2-DCE, приблизно при 55°С. Потім можна проводити циклізацію в бажаний індазол шляхом оброблювання нітритом натрію в кислоті, наприклад концентрованій хлористоводневій кислоті, звичайно в присутності співрозчинника, такого як толуол і вода, приблизно при 0°С. Коли синтез проміжних сполук і вихідних речовин не описаний, дані сполуки є комерційно доступними або можуть бути одержані з комерційно доступних сполук за допомогою стандартних способів або шляхом використання описаних у даному описі синтезів, схем і прикладів. Сполуки формули І можуть бути перетворені в інші сполуки формули І за допомогою відомих способів або за допомогою способів, описаних вище в даному описі синтезах, схемах і прикладах. Під час будь-яких послідовностей синтезу, описаних у даному описі, може бути необхідно і/або бажано захистити сприйнятливі або реакційно-здатні групи в будь-яких молекулах, про які йдеться. Це можна здійснити за допомогою загальноприйнятих захисних груп, таких як групи, rd описані в Protecting Groups in Organic Synthesis, 3 Edition, Greene, T. W. and Wuts, P. G. M.; Wiley Interscience. 1999 і Kocienski, P. J. Prortecting Groups, Thieme, 1994. Захисні групи можуть бути видалені на зручній наступній стадії з використанням відомих у даній галузі методів. Наприклад, коли присутня Вос (трет-бутоксикарбонільна) або бензилкарбонільна захисна група, вона може бути видалена шляхом додання розчинників, таких як ТФОК, DCM і/або MeCN, приблизно при кімнатній температурі. Сполуку також можна гідрувати з використанням стандартних методів, таких як обробка каталізатором, таким як Pd/C, у розчиннику, такому як метанол, в атмосфері водню. Також можна додавати ЕtOАс у присутності НСl і 1,4-діоксан для видалення Вос або бензилкарбонільної захисної групи приблизно при кімнатній температурі. Сполуки даного винаходу одержували відповідно до наступних схем. Усі перемінні у формулах мають значення, визначені вище. Коли сполуки даного винаходу мають хіральні центри, енантіомери можна виділяти з рацемічних сумішей стандартними методами розділення, такими як використання SFC, хіральної ВЕРХ або розщеплення хіральними кислотами. Розділення можна здійснювати на будь-якій стадії процесу одержання сполук формули І. Так, розділення можна здійснювати на кінцевій стадії або, альтернативно, можна розділити проміжні сполуки і потім окремі конкретні енантіомери можна використовувати на наступних стадіях з одержанням бажаних продуктів. Схема 1 Методика синтезу похідних сполук даного винаходу показана на схемі 1, відповідно до якої заміщені 2H-індазоли одержують з використанням способу синтезу, аналогічно описаному в WO 2005/066136. Наступне далі первісне перетворення похідної 2-нітрол-3-метилбензойної кислоти 25 UA 97658 C2 5 10 у відповідний ефір, радикальне бромування метильної групи з використанням реагентів, таких як N-бромсукцинімід і бензоїлпероксид, дає ключову похідну бензилброміду. Окислювання даного бензилброміду у відповідний бензальдегід можна здійснювати, наприклад, з використанням N-метилморфоліно-N-оксиду і молекулярних сит. Наступна конденсація альдегіду з аміном, замикання кільця можна здійснювати шляхом обробки ключової проміжної сполуки азидом натрію при підвищеній температурі для уведення кінцевого атома азоту і наступного витиснення азоту, з одержанням індазольного кільця. У дану реакцію можна додавати основу, таку як лутидин. Кінцеве перетворення ефіру в первинний амід дає бажані похідні. Це можна здійснити або шляхом нагрівання ефіру в розчині аміаку, або перетворення у відповідну карбонову кислоту, з наступним приєднанням аміду. Схема 1 15 20 25 Схема 2 Нижче на схемі 2 показаний варіант схеми 1, і він дає можливість увести замісники в ядра індазолу. Коли необхідні похідні нітробензойної кислоти не є комерційно доступними, вони можуть бути одержані шляхом нітрування відповідних похідних бензойної кислоти, наприклад, з використанням нітрату в концентрованій сірчаній кислоті. Синтетичні маніпуляції, описані вище, дозволяють здійснити утворення відповідного аніліну, що може бути або циклізований в індазол спочатку шляхом ацетилування індазолу і циклізації нітритом натрію в концентрованій НСI при 0°С. Альтернативно, анілін може бути діазотований тетрафторборатом нітрозію, і відповідну тетрафторборатну сіль діазонію можна розкласти при підвищених температурах на відповідну дифторбензольну похідну за допомогою реакції Schiemann (обережно). Наступна послідовність синтезу, як приведено на схемі 1, дає можливість окислювання метальної групи бензилу у відповідний альдегід і одержання бажаних індазольних похідних шляхом сполучення з (гетеро)аніліном і циклізації азидом натрію. 26 UA 97658 C2 Схема 2 5 10 15 Схема 3 Альтернативна методика включає функціоналізацію індазолу на останній стадії, як показано на схемі 3. У даному випадку, складний ефір індазолу спочатку перетворюють у відповідний карбоксамід і піддають нуклеофільному ароматичному заміщенню відповідного фтор(гетеро)ароматичного броміду. Це дає можливість одержати бромідну похідну, яка може бути поперечно зшита в умовах сполучення Сузуки, наприклад, з використанням три(третбутил)фосфіну і Pd2(dba)3 як каталізаторів в присутності основи, такої як карбонат натрію. Перетворення в бажаний піперидиновий фрагмент потім здійснюють шляхом реакції Fowler з використанням ацилхлориду, такого як CBz-Cl, і відновлювального агента, такого як боргідрид натрію. Кінцева реакція гідрування може давати відповідні піперидинові похідні. Схема 3 27 UA 97658 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приведені як приклади сполуки, описані в даному описі, випробовували в даному аналізі, і було виявлено, що вони мають показник ІС50 менше 5 мкМ, зокрема менше 50 нМ. Використовувані реагенти Буфер для аналізу: 100 мМ Трис рН 8,4 мМ MgCl2, 4 мМ сперміну, 200 мМ KСl, 0,04% нонідетР-40. Ферментна суміш: Буфер для аналізу (12,5 мкл), 100 мМ DTT (0,5 мкл), PARP-1 (5 нМ, Тревіген 4668-500-01), вода (до 35 мкл). 3 Нікотинамід-аденін динуклеотид (NAD)/ДНК суміш: [ H-NAD] (250 мкКю/мл, 0,4 мкл, PerkinElmer NET-443H), NAD (1,5 мМ, 0,05 мкл, SIGMA N-1511), Біотинільований-NAD (250 мкМ, 0,03 мкл, Тревіген 4670-500-01), Активований тимус теляти (1 мг/мл, 0,05 мкл, Amersham Biosciences 27-4575), вода (до 10 мкл). Проявна суміш: стрептавідин SPA гранули (5 мг/мл, Amersham Biosciences RPNQ 0007), розчинені в 500 мм EDTA. Експериментальна методика Реакцію проводять на 96-ямковому мікропланшеті з кінцевим об'ємом 50 мкл/ямка. Додають 5 мкл 5% розчину ДМСО/сполуки, додають ферментну суміш (35 мкл), починають реакцію доданням NAD/ДНК суміші (10 мкл) й інкубують протягом 2 годин при к. т. Зупиняють реакцію доданням проявної суміші, (25 мкл) й інкубують 15 хв при к. т. Вимірювання проводять з використанням приладу Пакард TOP COUNT. Аналіз проліферації на BRCA-1 HeLa клітинах, що приводяться в латентний стан Скорочення: IMDM (Iscove модифіковане середовище Дульбеко); RPMI (Roswell Park Memorial Institute Media); МОL (множинна інфекція); GFP (зелений флуоресцентний білок); PBS (фізіологічний розчин з доданням фосфатного буфера); FCS (сироватка плодового теляти); і DMEM (модифіковане Дульбеко середовище Голка). Сполуки даного винаходу випробовували також в антипроліферативному аналізі на підібраній парі BRCA-1 мас. і BRCA-1-(shPHK) Hela клітинах. Аналіз показує, що інгібітори PARP здатні виявляти селективність відносно інгібування росту BRCA дефіцитних клітин. Сполуки показали величини СС50 менше 5 мкМ на BRCA-1 дефіцитних клітинах і більш ніж 10-кратну селективність відносно BRCA профіцитних клітин. Аналіз ґрунтується на здатності живих клітин перетворювати рідкий барвник (резазурин) у флуоресцентний кінцевий продукт (резофурин). Кількість продукованого резофурину прямо пропорційна кількості клітин. Клітинні лінії: HeLa shBRCA-1-GFP - є Hela клітинами, трансдукованими при МОI 100 лентивірусом, що містить shPHK проти BRCA-1 і експресійну касету для GFP. Латентний BRCA-1 складає більше 80% за даними оцінки аналізу Taqman, і клітини стабільно експресують GFP. HeLa THM-GFP - є HeLa клітинами, трансдукованими при МОI 100 з контрольним вектором, не експресуючим будь-яку shPHK. Протокол Засівають 300 клітин/ямку на 96-ямковий видимий на просвіт чорний планшет у 90 мкл культурального середовища* Додають 10 мкл/ямка 10 × сполуки (5% ДМСО у воді) Інкубують протягом 168 годин при 37°С, 5% СО2 Додають 10 мкл розчину Celltiter Blue (Promega G8081), попередньо розведеного 1:1 у PBS1х Інкубують суміш протягом 45 хв при 37°С, 5% СО2 Інкубують 15 хв при к. т. у темряві Роблять зчитування планшетів з використанням флуориметра екс: 550 нм; ем.: 590 нм *Культуральне середовище: DMEM (GIBCO, 41966-029), 10% FGS (GIBCO, 10106-169), 0,1 мг/мл пеніцилін-стрептоміцин (GIBCO, 15140-114), 2 мМ L-глютамін (GIBCO, 3042190) Аналіз проліферації на природних BRCA дефіцитних клітинних лініях Було продемонстровано також, що сполуки даного винаходу інгібують проліферацію природних BRCA-1 (MDA-MB-436) і BRCA-2 (CAP AN-1) дефіцитних клітинних ліній з показниками СС50 менше 5 мікромолярними. Аналіз проліферації Клітини висівають на 96-ямковий планшет при 700 клітин/ямку в 100 мкл відповідного середовища на ямку*. Наступного дня додають серійно розведену сполуку в кінцевому об'ємі 200 мкл/ямка. Кожне розведення аналізують у трьох повторах. Через шість днів, оцінюють життєздатність клітин з використанням аналізу життєздатності клітин Celltiter Blue відповідно до 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAmide substituted indazoles as poly(adp-ribose)polymerase (parp) inhibitors
Автори англійськоюJones, Philip, Ontoria Ontoria, Jesus, Maria, Skarpelli, Rita, Schultz-Fademrecht, Carsten
Назва патенту російськоюАмидзамещенные индазолы как ингибиторы поли(adp-рибоза)полимеразы (parp)
Автори російськоюДжоунс Филип, Онтория Онтория Хесус Мария, Скарпелли Рита, Шультц-Фадемрехт Карстен
МПК / Мітки
МПК: A61K 31/4439, C07D 401/10, A61P 29/00, A61P 35/00
Мітки: індазоли, амідзаміщені, полі(adp-рибоза)полімерази, інгібітори, parp
Код посилання
<a href="https://ua.patents.su/37-97658-amidzamishheni-indazoli-yak-ingibitori-poliadp-ribozapolimerazi-parp.html" target="_blank" rel="follow" title="База патентів України">Амідзаміщені індазоли як інгібітори полі(adp-рибоза)полімерази (parp)</a>