7-фенілалкілзаміщені 2-хінолінони та 2-хіноксалінони як інгібітори полі(адф-рибоза)полімерази
Номер патенту: 91002
Опубліковано: 25.06.2010
Автори: Жільмон Жером Еміль Жорж, Сомерс Марія Вікторіна Франсіска, Вутерс Вальтер Будевійн Леопольд, Мабір Домінік Жан-П'єр, ван Дун Якобус Альфонсус Йозефус
Формула / Реферат
1. Сполука формули (І)
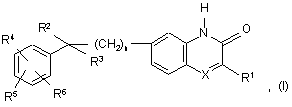
її N-оксидні форми, адитивні солі та стереохімічно ізомерні форми,
де n дорівнює 0, 1 або 2;
X являє собою N або CR7, де R7 являє собою водень;
R1 являє собою С1-6-алкіл або тієніл;
R2 являє собою водень, гідрокси, С1-6-алкіл, С3-6-алкініл або, взятий разом з R3, може утворювати =O;
R3 являє собою радикал, вибраний із групи, що включає:
-(CH2)S-NR8R9, (а-1)
-О-Н, (а-2)
-O-R10, (а-3)
-S-R11 (а-4) або
-C![]() N, (а-5)
N, (а-5)
де s являє собою 0, 1, 2 або 3;
R8 являє собою -СНО, С1-6-алкіл, гідроксіС1-6-алкіл, С1-6-алкілкарбоніл, ді(С1-6-алкіл)аміноС1-6-алкіл, С1-6-алкілоксіС1-6-алкіл, С1-6-алкілкарбоніламіноС1-6-алкіл, піперидинілС1-6-алкіл, піперидинілС1-6-алкіламінокарбоніл, С1-6-алкілокси, тієнілС1-6-алкіл, піролілС1-6-алкіл, арилС1-6-алкілпіперидиніл, арилкарбонілС1-6-алкіл, арилкарбонілпіперидинілС1-6-алкіл, галогеніндозолілпіперидинілС1-6-алкіл або арилС1-6-алкіл(С1-6-алкіл)аміноС1-6-алкіл;
R9 являє собою водень або С1-6-алкіл;
R10 являє собою С1-6-алкіл, С1-6-алкілкарбоніл або ді(С1-6-алкіл)аміноС1-6-алкіл та
R11 являє собою ді(С1-6-алкіл)аміноС1-6-алкіл; або
R3 являє собою групу формули
-(CH2)t-Z-, (b-1)
де
t дорівнює 0, 1, 2 або 3;
Z являє собою гетероциклічну кільцеву систему, вибрану з групи, що включає
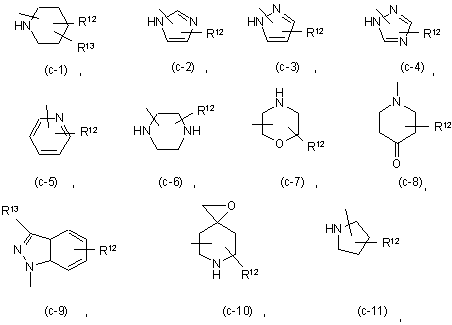
де кожний з R12 незалежно являє собою водень, С1-6-алкіл, амінокарбоніл, гідрокси,
С1-6-алкілоксіС1-6-алкіл, С1-6-алкілоксіС1-6-алкіламіно, ди(фенілС2-6-алкеніл), піперидинілС1-6-алкіл, С3-10-циклоалкіл, С3-10-циклоалкіл С1-6-алкіл, арилокси(гідроксі)С1-6-алкіл, галогеніндазоліл, арил С1-6-алкіл, арилС2-6-алкеніл, морфоліно, С1-6-алкілімідазоліл або піридинілС1-6-алкіламіно; та
кожний з R13 незалежно являє собою водень, піперидиніл або арил;
кожний з R4, R5 та R6 незалежно вибирають із групи, що включає: водень, галоген, тригалогенметил, тригалогенметокси, С1-6-алкіл, С1-6-алкілокси, ді(С1-6-алкіл)аміно, ді(С1-6-алкіл)аміно С1-6-алкілокси або С1-6-алкілоксикарбоніл; або
коли R5 та R знаходяться на сусідніх позиціях, зазначені замісники можуть, взяті разом, утворювати бівалентний радикал формули
-O-СН2-O, (d-1)
-О-(СН2)2-О-, (d-2)
-СН=СН-СН=СН- (d-3) або
-NH-C(O)-NR14=CH-, (d-4)
де R14 являє собою С1-6-алкіл;
арил являє собою феніл або феніл, заміщений галогеном, С1-6-алкілом або С1-6-алкілокси;
за умови, що, коли
n дорівнює 0, X являє собою N, R1 являє собою С1-6-алкіл, R2 являє собою водень, R3 являє собою групу формули (b-1), t дорівнює 0, Z являє собою гетероциклічну кільцеву систему (с-2), де зазначена гетероциклічна кільцева система Z з'єднана з залишком молекули через атом азоту, та R12 являє собою водень; то принаймні один із замісників R4, R5 або R6 відмінний від водню, галогену, С1-6-алкілу або С1-6-алкілокси,
за умови, що виключено 7-бензоїл-3-метил-2(1H)-хіноксалінон.
2. Сполука за п. 1, яка відрізняється тим, що
n дорівнює 0 або 1;
X являє собою N або CR7, де R7 являє собою водень;
R1 являє собою С1-6-алкіл;
R2 являє собою водень;
R3 являє собою радикал, вибраний з (а-1) або (а-2), або являє собою групу формули (b-1); s дорівнює 0, 1 або 2; R8 являє собою С1-6-алкіл або арил С1-6-алкіл(С1-6-алкіл)аміноС1-6-алкіл;
t дорівнює 0, 1 або 2;
Z являє собою гетероциклічну кільцеву систему, вибрану з (с-1), (с-2), (с-3), (с-4), (с-5) або (с-11);
кожен R12 незалежно являє собою водень або С1-6-алкілоксіС1-6-алкіламіно;
кожен R13 незалежно являє собою водень та
кожний з R4, R5 та R6 незалежно вибирають із групи, що включає водень, галоген або С1-6-алкіл.
3. Сполука за пп. 1 або 2, яка відрізняється тим, що
n дорівнює 0 або 1;
X являє собою N;
R1 являє собою С1-6-алкіл;
R2 являє собою водень;
R3 являє собою радикал формули (а-1) або групу формули (b-1);
s дорівнює 0;
R8 являє собою арил С1-6-алкіл(С1-6-алкіл)аміноС1-6-алкіл;
t дорівнює 0;
Z являє собою гетероциклічну кільцеву систему, вибрану з (с-1) або (с-2);
кожен R1 незалежно являє собою водень або С1-6-алкілоксіС1-6-алкіламіно;
кожен R13 незалежно являє собою водень та
кожний з R4, R5 та R6 незалежно вибирають із групи, що включає водень або галоген.
4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що вибрана з групи що включає
Сполука 5
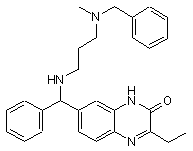
Сполука 9
С2Н2О4 (1:2)
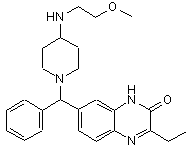
Сполука 2
С2Н2О4 (2:5)
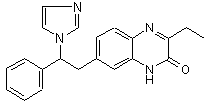
Сполука 1
5. Застосування сполуки за будь-яким з пп. 1-4 як лікарського засобу.
6. Фармацевтична композиція, що містить фармацевтично прийнятні носії та, як активний інгредієнт, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-4.
7. Спосіб одержання фармацевтичної композиції за п. 6, який відрізняється тим, що фармацевтично прийнятні носії та сполуку за будь-яким з пп. 1-4 ретельно змішують.
8. Застосування сполуки для одержання лікарського засобу для хіміосенсибілізації або радіосенсибілізації, де зазначеною сполукою є сполука формули (І)
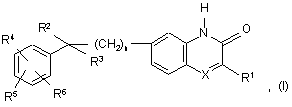
її N-оксидні форми, фармацевтично прийнятні адитивні солі та стереохімічно ізомерні форми, де
n дорівнює 0, 1 або 2;
X являє собою N або CR7,
де R7 являє собою водень;
R1 являє собою С1-6-алкіл або тієніл;
R2 являє собою водень, гідрокси, С1-6-алкіл, С3-6-алкініл або, взятий разом з R3, може утворювати =O;
R3 являє собою радикал, вибраний із групи, що включає:
-(CH2)S-NR8R9, (а-1)
-O-Н, (а-2)
-O-R10, (а-3)
-S-R11 (а-4) або
-C ![]() N, (а-5)
N, (а-5)
де s являє собою 0, 1, 2 або 3;
R8 являє собою -CHO, С1-6-алкіл, гідроксіС1-6-алкіл, С1-6-алкілкарбоніл, ді(С1-6-алкіл)аміноС1-6-алкіл, С1-6-алкілоксіС1-6-алкіл, С1-6-алкілкарбоніламіноС1-6-алкіл, піперидинілС1-6-алкіл, піперидинілС1-6-алкіламінокарбоніл, С1-6-алкілокси, тієнілС1-6-алкіл, піролілС1-6-алкіл, арилС1-6-алкілпіперидиніл, арилкарбонілС1-6-алкіл, арилкарбонілпіперидинілС1-6-алкіл, галогеніндозолілпіперидинілС1-6-алкіл або арилС1-6-алкіл(С1-6-алкіл)аміноС1-6-алкіл;
R9 являє собою водень або С1-6-алкіл;
R10 являє собою С1-6-алкіл, С1-6-алкілкарбоніл або ді(С1-6-алкіл)аміноС1-6-алкіл та
R11 являє собою ді(С1-6-алкіл)аміноС1-6-алкіл;
або R3 являє собою групу формули
-(CH2)t-Z-, (b-1)
де
t дорівнює 0, 1, 2 або 3;
Z являє собою гетероциклічну кільцеву систему, вибрану з групи, що включає
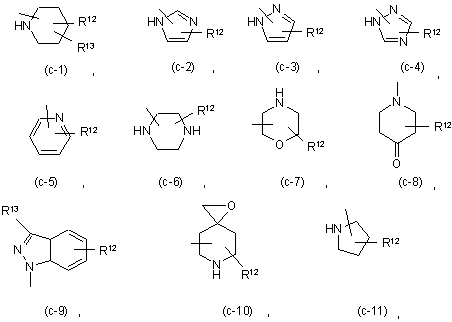
де кожний з R12 незалежно являє собою водень, С1-6-алкіл, амінокарбоніл, гідрокси,
С1-6-алкілоксіС1-6-алкіл, С1-6-алкілоксіС1-6-алкіламіно, ди(фенілС2-6-алкеніл), піперидинілС1-6-алкіл, С3-10-циклоалкіл, С3-10-циклоалкілС1-6-алкіл, арилокси(гідроксі)С1-6-алкіл, галогеніндазоліл, арилС1-6-алкіл, арилС2-6-алкеніл, морфоліно, С1-6-алкілімідазоліл або піридинілС1-6-алкіламіно; та
кожний з R13 незалежно являє собою водень, піперидиніл або арил;
кожний з R4, R5 та R6 незалежно вибирають із групи, що включає: водень, галоген, тригалогенметил, тригалогенметокси, С1-6-алкіл, С1-6-алкілокси, ді(С1-6-алкіл)аміно, ді(С1-6-алкіл)аміноС1-6-алкілокси або С1-6-алкілоксикарбоніл; або
коли R5 та R6 знаходяться на сусідніх позиціях, зазначені замісники можуть, взяті разом, утворювати бівалентний радикал формули
-O-СН2-O, (d-1)
-О-(СН2)2-О-, (d-2)
-СН=СН-СН=СН- (d-3) або
-NH-C(O)-NR14=CH-, (d-4)
де R14 являє собою С1-6-алкіл;
арил являє собою феніл або феніл, заміщений галогеном, С1-6-алкілом або С1-6-алкілокси.
9. Застосування за п. 8, яке відрізняється тим, що лікарський засіб застосовують як хіміосенсибілізатор.
10. Застосування за п. 8, яке відрізняється тим, що лікарський засіб застосовують як радіосенсибілізатор.
11. Комбінація сполуки за будь-яким з пп. 1-4 з хіміотерапевтичним засобом.
12. Спосіб одержання сполуки за п. 1, який відрізняється тим, що здійснюють конденсацію відповідного ортобензолдіаміну формули (XI) зі складним ефіром формули (XII), де Rh являє собою С1-6-алкіл, з одержанням сполук формули (І), де X являє собою N, позначених як сполуки формули (I-і), в присутності карбонової кислоти, наприклад, оцтової кислоти та подібної, мінеральної кислоти, такої як, наприклад, хлористоводнева кислота, сірчана кислота, або сульфокислоти, такої як, наприклад, метансульфокислота, бензолсульфокислота, 4-метилбензолсульфокислота тощо,
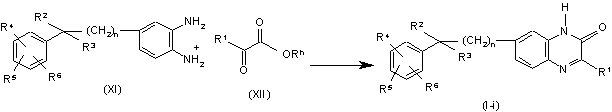 .
.
Текст
1. Сполука формули (І) C2 2 (19) 1 3 91002 R12 HN HN N 4 HN R12 N HN R12 N N R13 (c-2) , , (c-1) HN R12 , , (c-4) H N R12 N (c-5) (c-3) R12 , N R12 NH O (c-6) , R12 O (c-8), (c-7) , O R13 HN N R12 R12 N H N (c-9) , R12 (c-10) , (c-11) , де кожний з R12 незалежно являє собою водень, С1-6-алкіл, амінокарбоніл, гідрокси, C1-6 алкандіїл N NH , С1-6-алкілоксіС1-6-алкіл, С1-6-алкілоксіС1-6алкіламіно, ди(фенілС2-6-алкеніл), піперидинілС1-6алкіл, С3-10-циклоалкіл, С3-10-циклоалкіл С1-6-алкіл, арилокси(гідроксі)С1-6-алкіл, галогеніндазоліл, арил С1-6-алкіл, арилС2-6-алкеніл, морфоліно, С1-6алкілімідазоліл або піридинілС1-6-алкіламіно; та кожний з R13 незалежно являє собою водень, піперидиніл або арил; кожний з R4, R5 та R6 незалежно вибирають із групи, що включає: водень, галоген, тригалогенметил, тригалогенметокси, С1-6-алкіл, С1-6-алкілокси, ді(С16-алкіл)аміно, ді(С1-6-алкіл)аміно С1-6-алкілокси або С1-6-алкілоксикарбоніл; або коли R5 та R знаходяться на сусідніх позиціях, зазначені замісники можуть, взяті разом, утворювати бівалентний радикал формули -O-СН2-O, (d-1) -О-(СН2)2-О-, (d-2) -СН=СН-СН=СН(d-3) або -NH-C(O)-NR14=CH-, (d-4) де R14 являє собою С1-6-алкіл; арил являє собою феніл або феніл, заміщений галогеном, С1-6-алкілом або С1-6-алкілокси; за умови, що, коли n дорівнює 0, X являє собою N, R1 являє собою С12 3 6-алкіл, R являє собою водень, R являє собою групу формули (b-1), t дорівнює 0, Z являє собою гетероциклічну кільцеву систему (с-2), де зазначена гетероциклічна кільцева система Z з'єднана з залишком молекули через атом азоту, та R12 яв C1-6 алкандіїл N O , ляє собою водень; то принаймні один із замісників R4, R5 або R6 відмінний від водню, галогену, С1-6алкілу або С1-6-алкілокси, за умови, що виключено 7-бензоїл-3-метил-2(1H)хіноксалінон. 2. Сполука за п. 1, яка відрізняється тим, що n дорівнює 0 або 1; X являє собою N або CR7, де R7 являє собою водень; R1 являє собою С1-6-алкіл; R2 являє собою водень; R3 являє собою радикал, вибраний з (а-1) або (а2), або являє собою групу формули (b-1); s дорівнює 0, 1 або 2; R8 являє собою С1-6-алкіл або арил С1-6-алкіл(С1-6-алкіл)аміноС1-6-алкіл; t дорівнює 0, 1 або 2; Z являє собою гетероциклічну кільцеву систему, вибрану з (с-1), (с-2), (с-3), (с-4), (с-5) або (с-11); кожен R12 незалежно являє собою водень або С1-6алкілоксіС1-6-алкіламіно; кожен R13 незалежно являє собою водень та кожний з R4, R5 та R6 незалежно вибирають із групи, що включає водень, галоген або С1-6-алкіл. 3. Сполука за пп. 1 або 2, яка відрізняється тим, що n дорівнює 0 або 1; X являє собою N; R1 являє собою С1-6-алкіл; R2 являє собою водень; 5 91002 R3 являє собою радикал формули (а-1) або групу формули (b-1); s дорівнює 0; R8 являє собою арил С1-6-алкіл(С1-6-алкіл)аміноС16-алкіл; t дорівнює 0; Z являє собою гетероциклічну кільцеву систему, вибрану з (с-1) або (с-2); 6 кожен R1 незалежно являє собою водень або С1-6алкілоксіС1-6-алкіламіно; кожен R13 незалежно являє собою водень та кожний з R4, R5 та R6 незалежно вибирають із групи, що включає водень або галоген. 4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що вибрана з групи що включає N Cl HN H N O N O N N Сполука 5 HN H N Сполука 9 С2Н2О4 (1:2) O N N N H N N N H O N O Сполука 1 Сполука 2 С2Н2О4 (2:5) 5. Застосування сполуки за будь-яким з пп. 1-4 як лікарського засобу. 6. Фармацевтична композиція, що містить фармацевтично прийнятні носії та, як активний інгредієнт, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-4. 7. Спосіб одержання фармацевтичної композиції за п. 6, який відрізняється тим, що фармацевтично прийнятні носії та сполуку за будь-яким з пп. 1-4 ретельно змішують. 8. Застосування сполуки для одержання лікарського засобу для хіміосенсибілізації або радіосенсибілізації, де зазначеною сполукою є сполука формули (І) H R4 R2 (CH2)n R3 N O X R1 , (I) R6 R5 її N-оксидні форми, фармацевтично прийнятні адитивні солі та стереохімічно ізомерні форми, де n дорівнює 0, 1 або 2; X являє собою N або CR7, де R7 являє собою водень; R1 являє собою С1-6-алкіл або тієніл; R2 являє собою водень, гідрокси, С1-6-алкіл, С3-6алкініл або, взятий разом з R3, може утворювати =O; R3 являє собою радикал, вибраний із групи, що включає: -(CH2)S-NR8R9, (а-1) -O-Н, (а-2) -O-R10, (а-3) -S-R11 (а-4) або -C N, (а-5) де s являє собою 0, 1, 2 або 3; R8 являє собою -CHO, С1-6-алкіл, гідроксіС1-6-алкіл, С1-6-алкілкарбоніл, ді(С1-6-алкіл)аміноС1-6-алкіл, С1С1-6-алкілкарбоніламіноС1-66-алкілоксіС1-6-алкіл, алкіл, піперидинілС1-6-алкіл, піперидинілС1-6алкіламінокарбоніл, С1-6-алкілокси, тієнілС1-6-алкіл, піролілС1-6-алкіл, арилС1-6-алкілпіперидиніл, арилкарбонілС1-6-алкіл, арилкарбонілпіперидинілС1-6алкіл, галогеніндозолілпіперидинілС1-6-алкіл або арилС1-6-алкіл(С1-6-алкіл)аміноС1-6-алкіл; R9 являє собою водень або С1-6-алкіл; R10 являє собою С1-6-алкіл, С1-6-алкілкарбоніл або ді(С1-6-алкіл)аміноС1-6-алкіл та R11 являє собою ді(С1-6-алкіл)аміноС1-6-алкіл; або R3 являє собою групу формули -(CH2)t-Z-, (b-1) 7 91002 де t дорівнює 0, 1, 2 або 3; 8 Z являє собою гетероциклічну кільцеву систему, вибрану з групи, що включає R12 HN HN N N HN R12 HN R12 N N R13 (c-2) , (c-1) , (c-3) HN R12 (c-5) , , N R12 NH (c-6) (c-4) H N R12 N , R12 O , (c-7) R12 O (c-8) , , O R13 HN N R12 R12 N H N (c-9) , R12 (c-10) , (c-11) , де кожний з R12 незалежно являє собою водень, С1-6-алкіл, амінокарбоніл, гідрокси, C1-6 алкандіїл N NH , С1-6-алкілоксіС1-6-алкіл, С1-6-алкілоксіС1-6алкіламіно, ди(фенілС2-6-алкеніл), піперидинілС1-6алкіл, С3-10-циклоалкіл, С3-10-циклоалкілС1-6-алкіл, арилокси(гідроксі)С1-6-алкіл, галогеніндазоліл, арилС1-6-алкіл, арилС2-6-алкеніл, морфоліно, С1-6алкілімідазоліл або піридинілС1-6-алкіламіно; та кожний з R13 незалежно являє собою водень, піперидиніл або арил; кожний з R4, R5 та R6 незалежно вибирають із групи, що включає: водень, галоген, тригалогенметил, тригалогенметокси, С1-6-алкіл, С1-6-алкілокси, ді(С16-алкіл)аміно, ді(С1-6-алкіл)аміноС1-6-алкілокси або С1-6-алкілоксикарбоніл; або коли R5 та R6 знаходяться на сусідніх позиціях, зазначені замісники можуть, взяті разом, утворювати бівалентний радикал формули -O-СН2-O, (d-1) -О-(СН2)2-О-, (d-2) -СН=СН-СН=СН(d-3) або -NH-C(O)-NR14=CH-, (d-4) де R14 являє собою С1-6-алкіл; C1-6 алкандіїл N O , арил являє собою феніл або феніл, заміщений галогеном, С1-6-алкілом або С1-6-алкілокси. 9. Застосування за п. 8, яке відрізняється тим, що лікарський засіб застосовують як хіміосенсибілізатор. 10. Застосування за п. 8, яке відрізняється тим, що лікарський засіб застосовують як радіосенсибілізатор. 11. Комбінація сполуки за будь-яким з пп. 1-4 з хіміотерапевтичним засобом. 12. Спосіб одержання сполуки за п. 1, який відрізняється тим, що здійснюють конденсацію відповідного ортобензолдіаміну формули (XI) зі складним ефіром формули (XII), де Rh являє собою С1-6алкіл, з одержанням сполук формули (І), де X являє собою N, позначених як сполуки формули (I-і), в присутності карбонової кислоти, наприклад, оцтової кислоти та подібної, мінеральної кислоти, такої як, наприклад, хлористоводнева кислота, сірчана кислота, або сульфокислоти, такої як, наприклад, метансульфокислота, бензолсульфокислота, 4-метилбензолсульфокислота тощо, 9 R4 10 H R2 (CH2)n R3 R5 91002 R6 NH2 + NH2 (XI) O R2 (CH2)n R3 ORh O (XII) Даний винахід відноситься до інгібіторів PARP та представляє сполуки та композиції, що містять розглянуті сполуки. Крім того, даний винахід відноситься до способів застосування описаних інгібіторів PARP, наприклад, як лікарських засобів. Передумови створення винаходу Нуклеарний фермент полі(АДФрибоза)полімераза-1 (PARP-1) є членом сімейства ферментів PARP, що складається з PARP-1 та декількох недавно ідентифікованих нових полі(АДФ-рибозилуючих)ферментів. PARP також носить назву полі(аденозин-5'дифосфорибоза)полімераза або PARS (полі(АДФрибоза)синтетаза). PARP-1 є основним ядерним білком у 116 кДа, що складається з трьох доменів, таких як Nкінцевий ДНК-зв'язуючий домен, що складається з двох цинковмісних пальцеподібних областей, аутомодифікаційний домен та С-кінцевий каталітичний домен. Зазначений PARP-1 присутній майже у всіх еукаріотах. Фермент синтезує полі(АДФрибозу), розгалужений полімер, що містить понад 200 ланок АДФ-рибози. Акцептори білка полі(АДФрибози) безпосередньо або опосередковано залучені в підтримку цілісності ДНК. Такі акцептори включають гістони, топоізомерази, ДНК- та РНКполімерази, ДНК-лігази та Са2+- та Mg2+-залежні ендонуклеази. PARP-білок експресується на високому рівні в багатьох тканинах, що особливо стосується клітин імунної системи, серця, головного мозку та клітин зародкової лінії. В нормальних фізіологічних станах виявляється мінімальна активність PARP. Проте, порушення ДНК викликає негайну активацію PARP до 500-кратного рівня. Серед багатьох функцій, що належать PARP, та, особливо, PARP-1, основна роль полягає в сприянні репарації ДНК шляхом АДФрибозилування та, таким чином, координуванні ряду ДНК-репаративних білків. В результаті активації PARP, NAD+ - рівні істотно знижуються. Екстенсивна активація PARP веде до сильного зменшення NAD+ в клітинах, що страждають масивним порушенням ДНК. Короткий час напівжиття полі(АДФ-рибози) призводить до прискореного обміну речовин. Полі(АДФ-рибоза), як тільки утворюється, швидко розпадається під дією конститутивно активної полі(АДФрибоза)глікогідролази (PARG), разом з фосфодіестеразою та (АДФ-рибоза)протеїнліазою. PARP та PARG утворюють цикл, що перетворює велику кількість NAD+ в АДФ-рибозу. Менше, ніж за годину, надлишкова стимуляція PARP може викликати R5 N O N R4 R1 R1 R6 (I-i) . зниження NAD+ та АТФ до рівня менше 20 % від нормального. Такий варіант розвитку подій особливо руйнівний при ішемії, коли киснева недостатність вже істотно порушує виділення енергії клітинами. Вважають, що наступне продукування вільних радикалів при реперфузії є основною причиною ушкодження тканини. Частина скорочення АТФ, що є типовим для багатьох органів при ішемії та реперфузії, може бути пов'язана з елімінацією NAD , викликаною метаболізмом полі(АДФрибози). Таким чином, можна очікувати, що інгібування PARP або PARG збереже клітинний енергетичний рівень, тим самим потенціюючи виживання ішемічних тканин після інсульту. Синтез полі(АДФ-рибози) також залучений в індуковану експресію ряду генів, необхідних для запальної реакції. Інгібітори PARP придушують продукування індукованого комплексу оксид азотасинтаза (iNOS) в макрофагах, Р-типу селекції та фактора міжклітинної адгезії-1 (ІСАМ-1) в ендотеліальних клітинах. Така активність лежить в основі сильних протизапальних ефектів, що проявляються за допомогою інгібіторів PARP. Інгібування PARP здатне знижувати некроз за допомогою запобігання транслокації та інфільтрації нейтрофілів до ушкоджених тканин. PARP активується порушеними ДНКфрагментами та, будучи активованим, каталізує приєднання до 100 АДФ-рибоза-ланок до різних ядерних білків, включаючи гістони та самі PARP. При більшості клітинних стресів екстенсивна активація PARP може швидко призвести до ушкодження клітин або загибелі через зменшення запасів енергії. Оскільки чотири молекули АТФ витрачається на кожну молекулу регенеруємого NAD+, вміст NAD+ знижується при масивній активації PARP, при спробах повторного синтезу NAD+, вміст АТФ також може знижуватися. Повідомляється, що активація PARP відіграє ключову роль як у NMDA-, так і NО-індукованій нейротоксичності. Це продемонстровано на кортикальних культурах та гіпокампальних зрізах, де попередження токсичності безпосередньо корелюється з ефективністю інгібування PARP. В такий спосіб підтверджується можлива роль інгібіторів PARP у терапії нейродегенеративних захворювань та травми головного мозку, хоча точний механізм дії дотепер не виявлений. Подібним чином було продемонстровано, що разові ін'єкції інгібіторів PARP знижують обсяг інфаркту, викликаного ішемією та реперфузією серцевого або кістякового м'яза у кроликів. В цих дос 11 лідженнях разова ін'єкція 3-амінобензаміду (10 мг/кг), або за одну хвилину до оклюзії, або за одну хвилину до реперфузії, викликає подібні зниження в обсязі інфаркту серця (32-42 %), тоді як 1,5дигідроксіізохінолін (1 мг/кг), інший інгібітор PARP, знижує обсяг інфаркту в порівнянному ступені (3848 %). Ці результати дають підставу припустити, що інгібітори PARP можуть відновлювати серце з вже наявним ішемічним порушенням або реперфузійне порушення тканини кістякового м'яза. Активація PARP також може бути використана як міра порушення, що супроводжує нейротоксичні інсульти, що виникають при впливі яких-небудь наступних індукуючих факторів, таких як глутамат (через стимуляцію рецептора NMDA), реакційноздатні кисневі проміжні сполуки, амілоїдний β-білок, N-метил-4-феніл-1,2,3,6-тетрагідропіридин (МРТР) або відповідний активний метаболіт N-метил-4фенілпіридину (МРР+), що беруть участь у патологічних станах, таких як удар, хвороба Альцгеймера та хвороба Паркінсона. Інші дослідження продовжили з'ясування ролі активації PARP в зернистих клітинах мозочка in vitro та в МРТРнейротоксичності. Надлишковий невральний вплив глутамата, що є переважним нейромедіатором центральної нервової системи та діє на N-метилD-аспартат-(NMDА)рецептори та інші підтипи рецепторів, найбільш часто виникає в результаті удару або інших нейродегенеративних процесів. Позбавлені кисню нейрони вивільняють глутамат у великих кількостях під час ішемічного мозкового інсульту, як наприклад, під час удару або інфаркту міокарда. Таке надлишкове вивільнення глутамата в свою чергу викликає надстимуляцію (ексайтотоксичність) N-метил-D-аспартат-(NMDА-), AMPА-, каінатного та MGR-рецепторів, що відкриває іонні канальці та дозволяє неконтрольований потік іонів (наприклад, Са + та Na+ в клітини та К+ із клітин), що викликає надстимуляцію нейронів. Надстимульовані нейрони виділяють більше глутамата, створюючи контур зворотного зв'язку або ефект "доміно", що у кінцевому рахунку призводить до ушкодження клітини або загибелі через продукування протеаз, ліпаз та вільних радикалів. Надлишкова активація глутаматних рецепторів залучена в різні неврологічні хвороби та стани, такі як епілепсія, удар, хвороба Альцгеймера, хвороба Паркінсона, бічний аміотрофічний склероз (ALS), хвороба Хантингтона, шизофренія, хронічний біль, ішемія та втрата нейронів після гіпоксії, гіпоглікемії, ішемії, травми та нервового інсульту. Вплив глутамата та стимуляція залучені, як вихідні передумови, в компульсивні порушення, зокрема, залежність від ліків. Доказ включає дані, отримані на багатьох видах тварин, а також у церебральнокортикальних культурах, оброблених глутаматом або NMDA, про те, що антагоністи глутаматного рецептора (тобто, сполуки, що блокують глутамат від зв'язування з відповідним рецептором або активації рецептора) блокують нервове порушення, що слідує за васкулярним нападом. Спроби попередити ексайтотоксичність шляхом блокування NMDA-, AMPА-, каїнатного та MGR-рецепторів виявилися важкими, оскільки кожен рецептор має 91002 12 безліч ділянок, з якими може бути зв'язаний глутамат, а отже, виявлення ефективної суміші антагоністів або універсального антагоніста для запобігання зв'язування глутамата з кожним з рецепторів та можливості дослідження цього припущення, ускладнені. Крім того, багато композицій, ефективних в блокуванні рецепторів, також є токсичними для тварин. Власне кажучи, у даний час не існує ефективного лікування глутаматних порушень. Стимуляція NMDA-рецепторів за допомогою глутамата, наприклад, активує фермент нейрональний оксид азота-синтаза (nNOS), що призводить до утворення оксиду азоту (N0), що також опосередковує нейротоксичність. NMDAнейротоксичність можна попередити за допомогою інгібіторів оксид азота-синтази (NOS) або за допомогою спрямованого генетичного руйнування nNOS in vitro. Іншим застосуванням PARP-інгібіторів є лікування ушкоджень периферичного нерва та виникаючого в результаті патологічного болючого синдрому, відомого як невропатичний біль, такого як біль, що викликається хронічним стиском (ССІ) загального сідничного нерва та при якому виникає транссинаптична альтерація спинного рогу спинного мозку, що характеризується гіперхроматозмом цитоплазму та нуклеоплазму (так названі "темні" нейрони). Існує також доказ того, що PARP-інгібітори корисні для лікування запальних захворювань кишечнику, таких як коліт. Зокрема, коліт був викликаний у пацюків шляхом внутрішньопорожнинного введення гаптентринітробензолсульфокислоти в 50 % етанолі. Пацюкам, що піддали лікуванню, давали 3-амінобензамід, специфічний інгібітор PARP-активності. Інгібування PARP-активності знижує запальну реакцію та відновлює морфологію та енергетичний статус дистальної ободочної кишки. Ще один доказ дозволяє припустити, що PARP-інгібітори корисні для лікування артриту. Крім того, доведено, що PARP-інгібітори корисні для лікування діабету. Виявлено також, що PARPінгібітори корисні для лікування ендотоксичного шоку або септичного шоку. PARP-інгібітори також були застосовані для збільшення тривалості життя та проліферативної здатності клітин, включаючи лікування таких захворювань, як старіння шкіри, хвороба Альцгеймера, атеросклероз, остеоартрит, остеопороз, м'язова дистрофія, дегенеративні хвороби кістякового м'яза, що включають реплікативне старіння, стареча м'язова дегенерація, старіння імунної системи, СНІД та інше захворювання, пов'язане зі старінням імунної системи; та зміна експресії генів старіючих клітин. Також відомо , що PARP-інгібітори, такі як 3амінобензамід, впливають в цілому на репарацію ДНК під впливом, наприклад, пероксиду водню або іонізуючого випромінювання. Вирішальна роль PARP у репарації розривів ниток ДНК точно встановлена, особливо, розривів, викликаних безпосереднім впливом іонізуючого випромінювання або виникаючих опосередковано, після ферментативної репарації ушкоджень ДНК, 13 91002 14 викликаних метилуючими засобами, інгібіторами топоізомерази І та іншими хіміотерапевтичними засобами, такими як цисплатин та блеоміцин. Ряд досліджень, з використанням "нокаутованих" мишей, моделей трансдомінантного інгібування (надекспресія ДНК-зв'язуючого домена), антизмістових та низькомолекулярних інгібіторів, демонструє роль PARP у репарації та виживанні клітин після викликання порушення ДНК. Інгібування ферментативної активності PARP приводить до підвищеної чутливості пухлинних клітин у відношенні руйнівної ДНК терапії. Повідомляється, що PARP-інгібітори є ефективними в радіосенсибілізації (гіпоксичних) клітин пухлин та ефективно перешкоджають виходу клітин пухлин з потенційно летального та сублетального порушення ДНК після радіаційної терапії, очевидно, завдяки здатності попереджувати сполучення розривів ниток ДНК та впливати на деякі сигнальні шляхи порушень ДНК. PARP-інгібітори були застосовані для лікування злоякісного новоутворення. Крім того, патент США №5177075 описує деякі ізохіноліни, корисні для посилення летального впливу іонізуючого випромінювання або хіміотерапевтичних засобів на клітини пухлин. Weltin et al., "Effect of 6(5Phenanthridinone, an Inhibitor of Poly(ADP-ribose) Polymerase, on Cultured Tumor Cells", Oncol. Res., 6:9, 399-403 (1994), описує інгібування активності PARP, знижену проліферацію клітин пухлин та помітний синергічний ефект при спільній обробці клітин пухлин алкілуючим лікарським засобом. Недавній повний огляд існуючого рівня техніки опублікований Li and Zhang у IDrags 2001, 4(7): 804-812. Продовжує залишатися потреба в ефективних та сильнодіючих PARP-інгібіторах, та більш переважно, інгібіторах PARP-1, що здійснюють мінімальну побічну дію. Даний винахід відноситься до сполук, композицій та способів, призначених для інгібування активності PARP, з метою лікування злоякісного новоутворення та/або попередження ушкоджень клітин, тканини та/або органів, обумовлених ушкодженнями або загибеллю клітин внаслідок, наприклад, некрозу або апоптозу. Сполуки та композиції за даним винаходом особливо корисні для підвищення ефективності хіміотерапії та променевої терапії, де первинний ефект лікування полягає в тому, що викликають ушкодження ДНК у клітин ах-мішенях. ЕР 371564, опублікована 6 червня 1990 p., описує (1H-азол-1-ілметил)-заміщені похідні хіноліну, хіназоліну або хіноксаліну. Зазначені сполуки придушують елімінацію з плазми ретиноєвих кислот. Більш докладно описані сполука 3-етил-7[(1H-імідазол-1-ілфенілметил]-2(1H)-хіноксалінон (сполука № 19 за даною заявкою) та сполука 7-[(4хлорфеніл)-1H-імідазол-1-ілметил]-3-метил-2(1H)хіноксалінон (сполука № 20 за даною заявкою). Опис винаходу Даний винахід відноситься до сполук формули (І) -O-R10 (а-3), -S-R11 (а-4)або -C N (а-5), Де s означає 0, 1, 2 або 3; R8 являє собою -СНО, С1-6-алкіл, гідроксіС1-6алкіл, С1-6-алкілкарбоніл, ді(С1-6-алкіл)аміноС1-6алкіл, С1-6-алкілоксіС1-6-алкіл, С1-6алкілкарбоніламіно С1-6-алкіл, піперидинілС1-6алкіл, піперидинілС1-6-алкіламінокарбоніл, С1-6алкілокси, тієнілС1-6-алкіл, піролілС1-6-алкіл, арилС1-6-алкілпіперидиніл, арилкарбоніл С1-6алкіл, арилкарбонілпіперидинілС1-6-алкіл, галогеніндозолілпіперидинілС1-6-алкіл або арилС1-6алкіл(С1-6-алкіл)аміно С1-6-алкіл; R9 являє собою водень або С1-6-алкіл; 10 R являє собою С1-6-алкіл, С1-6-алкілкарбоніл або ді(С1-6-алкіл)аміно С1-6-алкіл; та R11 являє собою ді(С1-6-алкіл)аміноС1-6-алкіл; або R3 являє собою групу формули -(CH2)rZ- (b-1), де t дорівнює 0, 1, 2 або 3; їх N-оксидних форм, адитивних солей та стереохімічно ізомерних форм, де n дорівнює 0, 1 або 2; X являє собою N або CR7, де R7 являє собою водень або, взятий разом з R1, може утворювати бівалентний радикал формули -СН=СН-СН=СН-; R1 являє собою С1-6-алкіл або тієніл; R2 являє собою водень, гідрокси, С1-6-алкіл, С33 6-алкініл або, взятий разом з R , може утворювати =0; R3 являє собою радикал, вибраний з групи, що включає -(CH2)s-NR8R9 (а-1), -О-Н (а-2), 15 Ζ являє собою гетероциклічну кільцеву систему, вибрану з групи, що включає де кожний з R12 незалежно являє собою водень, С1-6-алкіл, амінокарбоніл, гідрокси, С1-6-алкілоксі С1-6-алкіл, С1-6-алкілоксі С1-6алкіламіно, ди(фенілС2-6-алкеніл), піперидинілС1-6алкіл, С3-10-циклоалкіл, С3-10-циклоалкілС1-6-алкіл, арилокси(гідроксі) С1-6-алкіл, галогеніндазоліл, арилС1-6-алкіл, арилС2-6-алкеніл, морфоліно, С1-6алкілімідазоліл або піридинілС1-6-алкіламіно; та кожний з R13 незалежно являє собою водень, піперидиніл або арил; кожний з R4, R5 та R6 незалежно вибирають із групи, що включає: водень, галоген, тригалогенметил, тригалогенметокси, С1-6-алкіл, С1-6-алкілокси, ді(С1-6-алкіл)аміно, ді(С1-6-алкіл)аміноС1-6-алкілокси або С1-6-алкілоксикарбоніл; або коли R5 та R6 знаходяться на сусідніх позиціях, вони можуть, взяті разом, утворювати бівалентний радикал формули -O-СН2-O (d-1), -О-(СН2)2-О- (d-2), -СН=СН-СН=СН- (d-3) або -NH-C(O)-NR14=CH- (d-4), де R являє собою С1-6-алкіл; арил являє собою феніл або феніл, заміщений галогеном, С1-6-алкілом або С1-6-алкілокси; за умови, що коли n дорівнює 0, X являє собою N, R1 являє собою С1-6-алкіл, R2 являє собою водень, R3 являє собою групу формули (b-1), t дорівнює 0, Ζ являє собою гетероциклічну кільцеву систему (с-2), де зазначена гетероциклічна кільцева система Ζ з'єднана з залишком молекули через атом азоту, та R12 являє собою водень; то, принаймні, один із замісників R4, R5 або R6 відмінний від водню, галогену, С1-6-алкілу або С1-6-алкілокси. Завжди, коли гетероциклічна кільцева система Ζ містить –СН2-, -СН= або -ΝΗ- групу, замісники 91002 16 R12 та R13 або залишок молекули можуть бути зв'язані з атомом вуглецю або азоту, в цьому випадку заміщаються один або більше атомів водню. Сполуки формули (І) можуть також існувати в таутомерних формах. Мається на увазі, що такі форми, хоча в явному вигляді не зазначені в наведеній вище формулі, входять в межі даного винаходу. Далі пояснюється ряд термінів, використаних у наведених вище визначеннях та нижче. Ці терміни інколи використовуються як такі, або входять в складені терміни. Як використано в наведених вище визначеннях та нижче, галоген в основному являє собою фтор, хлор, бром та йод; С1-6-алкіл являє собою лінійні або розгалужені насичені вуглеводневі радикали з 1 - 6 атомами вуглецю, такі як, наприклад, метил, етил, пропіл, бутил, пентил, гексил, 1метилетил, 2-метилпропіл, 2-метилбутил, 2метилпентил тощо; С1-6-алкандііл являє собою бівалентні лінійні або розгалужені насичені вуглеводневі радикали з 1-6 атомами вуглецю, такі як, наприклад, метилен, 1,2-етандііл, 1,3-пропандііл, 1,4-бутандііл, 1,5-пентандііл, 1,6-гександііл та розгалужені ізомери, такі як 2-метилпентандііл, 3метилпентандііл, 2,2-диметилбутандііл, 2,3диметилбутандііл тощо; тригалоген С1-6-алкіл являє собою С1-6-алкіл, що містить три однакових або різних галогенових замісники, наприклад, трифторметил; С2-6-алкеніл являє собою лінійні або розгалужені вуглеводневі радикали, що містять один подвійний зв'язок та складаються з 2 - 6 атомів вуглецю, такі як, наприклад, етеніл, 2пропеніл, 3-бутеніл, 2-пентеніл, 3-пентеніл, 3метил-2-бутеніл тощо; С3-6-алкініл являє собою лінійні або розгалужені вуглеводневі радикали, що містять один потрійний зв'язок та складаються з 3 - 6 атомів вуглецю, такі як, наприклад, 2-пропініл, 3-бутиніл, 2-бутиніл, 2-пентиніл, 3-пентиніл, 3гексиніл тощо; С3-10-циклоалкіл включає циклічні вуглеводневі групи з 3-10 вуглецями, такі як циклопропіл, циклобутил, циклопентил, циклопентеніл, циклогексил, циклогексеніл, циклогептил, циклооктил тощо. Термін "адитивна сіль" включає солі, що здатні утворювати сполуки формули (І) з органічними або неорганічними основами, такими як аміни, основи лужних металів та основи лужноземельних металів або четвертинні амонієві основи, або з органічними або неорганічними кислотами, такими як мінеральні кислоти, сульфокислоти, карбонові кислоти або фосфорвмісні кислоти. Термін "адитивна сіль" також включає фармацевтично прийнятні солі, комплекси з металами та сольвати, та їх солі, що здатні утворювати сполуки формули (І). Термін "фармацевтично прийнятні солі" являє собою фармацевтично прийнятні кислотно- або основно-адитивні солі. Мається на увазі, що вищезгадані фармацевтично прийнятні кислотно- або основно-адитивні солі включають терапевтично активні нетоксичні кислотно- та нетоксичні основно-адитивні форми солей, що здатні утворювати сполуки формули (І). Сполуки формули (І), які мають основні властивості, можуть бути перетворені 17 у відповідні фармацевтично прийнятні кислотноадитивні солі шляхом обробки зазначеної основної форми підходящою кислотою. Підходящі кислоти включають, наприклад, неорганічні кислоти, такі як галогенводневі, наприклад, хлористоводнева або бромистоводнева кислота; сірчана; азотна; фосфорна та подібні кислоти; або органічні кислоти, такі як, наприклад, оцтова, пропанова, гідроксіоцтова, молочна, піровиноградна, щавлева, малонова, бурштинова (тобто бутандіонова кислота), малеїнова, фумарова, яблучна, винна, лимонна, метансульфонова, етансульфонова, бензолсульфонова, п-толуолсульфонова, цикламова, саліцилова, п-аміносаліцилова, памова та подібні кислоти. Сполуки формули (І), що мають кислотні властивості, можуть бути перетворені у фармацевтично прийнятні основно-адитивні солі шляхом обробки зазначених кислотних форм підходящою органічною або неорганічною основою. Підходящі основні сольові форми включають, наприклад, солі амонію, солі лужних та лужноземельних металів, наприклад солі літію, натрію, калію, магнію, кальцію та подібні, солі з органічними основами, наприклад, солі з бензатином, N-метил-Dглюкаміном, гідрабаміном, та солі з амінокислотами, такими як, наприклад, аргінін, лізин тощо. Терміни "кислотно-" або "основно-адитивна сіль" також включають гідрати та адитивні форми з розчинником, що здатні утворювати сполуки формули (І). Прикладами таких форм служать, наприклад, гідрати, алкоголяти тощо. Термін "комплекси металів" означає комплекс, утворений між сполукою формули (І) та однієї або більше органічною або неорганічною сіллю або солями металу. Приклади зазначених органічних або неорганічних солей включають галогеніди, нітрати, сульфати, фосфати, ацетати, трифторацетати, трихлорацетати, пропіонати, тартрати, сульфонати, наприклад, метилсульфонати, 4метилфенілсульфонати, саліцилати, бензоати тощо, металів другої основної групи періодичної системи, наприклад, солі магнію або кальцію, третьої або четвертої основної групи, наприклад, алюмінію, олова, свинцю, а також першої-восьмої групи перехідних металів періодичної системи, таких як, наприклад, хром, марганець, залізо, кобальт, нікель, мідь, цинк тощо. Термін "стереохімічно ізомерні форми сполуки формули (І)", як використано в даній заявці раніше, означає всі можливі сполуки, які складаються з тих же самих атомів, зв'язаних тією ж послідовністю зв'язків, але які мають відмінні просторові структури, що не є рівноцінними, котрі можуть існувати для сполуки формули (І). Якщо не зазначено або не вказано інше, хімічне позначення сполуки включає суміш всіх можливих стереохімічно ізомерних форм, які може утворювати зазначена сполука. Зазначена суміш може містити всі діастереомери та/або енантіомери основної молекулярної структури зазначеної сполуки. Мається на увазі, що всі стереохімічно ізомерні форми сполуки формули (І), як в чистому вигляді, так і в суміші одна з одною, включені в межі даного винаходу. 91002 18 Мається на увазі, що N-оксидні форми сполуки формули (І) включають ті сполуки формули (І), де один або декілька атомів азоту окиснені до так названого N-оксиду, особливо, ті N-оксиди, де один або більше азотів піперидину, піперазину або піридазинілу є N-окисненими. Мається на увазі, що кожного разу, коли використовується, термін "сполуки формули (І)" включає також N-оксидні форми, фармацевтично прийнятні кислотно- або основно-адитивні солі та всі стереоізомерні форми. Сполуки, описані в ЕР 371564, придушують елімінацію з плазми ретиноєвих кислот. Сполука 3етил-7-[(1H-імідазол-1-ілфенілметил]-2(1H)хіноксалінон (сполука № 19 за даною заявкою) та сполука 7-[(4-хлорфеніл)-1H-імідазол-1-ілметил]-3метил-2(1H)-хіноксалінон (сполука № 20 за даною заявкою) описані в ЕР 371564. Зненацька було виявлено, що сполуки за даним винаходом мають PARP-інгібуючу активність. Перша група сполук, що представляють інтерес, включає ті сполуки формули (І), в яких застосовують одне або більше з наступних обмежень: a) n дорівнює 0 або 1; b) X являє собою N або CR7, де R7 являє собою водень; c) R1 являє собою С1-6-алкіл; d) R2 являє собою водень; e) R являє собою радикал, вибраний з (а-1) або (а-2), або являє собою групу формули (b-1); f) s дорівнює 0, 1 або 2; g) R являє собою С1-6-алкіл або арил С1-6алкіл(С1-6-алкіл)аміно С1-6-алкіл; h) t дорівнює 0, 1 або 2; і) Ζ являє собою гетероциклічну кільцеву систему, вибрану з (с-1), (с-2), (с-3), (с-4), (с-5)або(с11); j) кожен R12 незалежно являє собою водень або С1-6-алкілоксі С1-6-алкіламіно; к) кожен R13 незалежно являє собою водень та 4 5 6 1) кожний з R , R та R незалежно вибирають із групи, що включає водень, галоген або С1-6алкіл. Друга група сполук, що представляють інтерес, включає ті сполуки формули (І), в яких застосовують одне або більше з наступних обмежень: a) n дорівнює 0 або 1; b) X являє собою Ν; c) R1 являє собою С1-6-алкіл; d) R2 являє собою водень; e) R3 являє собою радикал формули (а-1) або групу формули (b-1); f) s дорівнює 0; g) R являє собою арил С1-6-алкіл(С1-6алкіл)аміно С1-6-алкіл; h) t дорівнює 0; і) Ζ являє собою гетероциклічну кільцеву систему, вибрану з (с-1) або (с-2); j) кожен R12 незалежно являє собою водень або С1-6-алкілоксі С1-6-алкіламіно; к) кожен R13 незалежно являє собою водень та 1) кожний з R4, R5 та R6 незалежно вибирають із групи, що включає водень або галоген. Третя група сполук, що представляють інтерес, включає ті сполуки формули (І), що відносять 19 91002 20 ся до першої групи сполук або другої групи сполук, що представляють інтерес, де Ζ являє собою гетероциклічну кільцеву систему, відмінну від гетероциклічної кільцевої системи формули (с-2) або (с-4). Групу переважних сполук складають ті сполуки формули (І), де n дорівнює 0 або 1; X являє собою N або CR7, де R7 являє собою водень; R1 являє собою С1-6-алкіл; R2 являє собою водень; R3 являє собою радикал, вибраний з (а-1) або (а-2), або являє собою групу формули (b-1); s дорівнює 0, 1 або 2; R8 являє собою С1-6 -алкіл або арилС1-6 алкіл(С1-6-алкіл)аміноС1-6-алкіл; t дорівнює 0, 1 або 2; Ζ являє собою гетероциклічну кільцеву систему, вибрану з (с-1), (с-2), (с-3), (с-4), (с-5) або (с-11); кожен R12 незалежно являє собою водень або С1-6 -алкілоксіС1-6-алкіламіно; кожен R13 незалежно являє собою водень та кожний з R4, R5 та R6 незалежно вибирають із групи, що включає водень, галоген або С1-6 -алкіл. Іншу групу переважних сполук складають ті сполуки формули (І), де n дорівнює 0 або 1; X являє собою N; R являє собою С1-6-алкіл; R являє собою водень; R являє собою радикал формули (а-1) або групу формули (b-1); s дорівнює 0; R являє собою арилС1-6-алкіл(С1-6-алкіл)аміноС1-6алкіл; t дорівнює 0; Ζ являє собою гетероциклічну кільцеву систему, вибрану з (с-1) або (с-2); кожен R12 незалежно являє собою водень або С1-6 алкілоксіС1-6-алкіламіно; кожен R13 незалежно являє собою водень та кожний з R4, R5 та R6 незалежно вибирають із групи, що включає водень або галоген. Ще одна група переважних сполук включає ті сполуки формули (І), що відносяться до першої групи сполук або другої групи сполук, що представляють інтерес, де Ζ являє собою гетероциклічну кільцеву систему, відмінну від гетероциклічної кільцевої системи формули (с-2) або (с-4). Найбільш переважними сполуками є сполука № 5, сполука № 9, сполука № 2 та сполука № 1. Сполуки формули (І) можуть бути отримані відповідно до загальних методик, описаних в ЕР 371564. Ряд таких способів одержання описаний нижче більш докладно. Інші способи одержання кінцевих сполук формули (І) описані в прикладах. Сполуки формули (І), де R2 являє собою водень та R3 являє собою -NR9-CHO, де R9 являє собою водень або метил, які в даній заявці називають, як сполуки формули (І-b), можуть бути отримані, виходячи зі сполук формули (І), де R2, взятий разом з R3, утворює =0, названі в даній заявці також сполуками формули (1-а), в присутності формаміду або метилформаміду, позначених як проміжні сполуки формули (II), та мурашиної кислоти. Сполуки формули (І), де R3 являє собою гідрокси, які в даній заявці називають, як сполуки формули (Іс), можуть бути отримані перетворенням кетонної групи сполуки формули (1-а) в гідроксигрупу, із застосуванням відповідного відновника, 21 91002 22 наприклад, боргідриду натрію, в підходящому роз чиннику, наприклад, метанолі та тетрагідрофурані. Сполуки формули (1-а) можуть бути отримані перетворенням сполук формули (1-c), де R2 являє собою водень, названих в даній заявці сполуками формули (І-с-1), в присутності прийнятного окисни ка, такого як триоксид хрому, та кислоти, такої як сірчана кислота, в прийнятному розчиннику, такому як 2-пропанон. Сполуки формули (І), де R2 являє собою водень та R3 являє собою радикал формули (с-1), названі сполуками формули (I-f), можуть бути отримані за допомогою реакції сполук формули (І), де R2 являє собою водень та R3 являє собою ра дикал формули (с-8), названих сполуками формули (I-d), з аміном формули (III), де Ra являє собою відповідний радикал, в присутності прийнятного розчинника, такого як метанол, та прийнятного реагенту, такого як ціаноборгідрид натрію. Проміжні сполуки формули (IV), де W являє собою відповідну групу, що відходить, таку як, наприклад, хлор, бром, метансульфонілокси або бензолсульфонілокси, можуть бути отримані зі сполук формули (І-с-1) шляхом обробки зазначе них сполук прийнятним реагентом, наприклад, мeтансульфонілокси хлоридом або бензолсульфонілокси хлоридом, або галогенуючим реагентом, таким як РОСl3 або SOCI2. Сполуки формули (І), визначені як сполуки формули (І), де Rb приймає значення, зазначені для R8, та Rc приймає значення, зазначені для R9, або Rb та Rc, взяті разом з атомом азоту, до якого приєднані, утворюють відповідну гетероциклічну кільцеву систему, зазначену для Z, названі сполу ками формули (I-h), можуть бути отримані шляхом взаємодії проміжної сполуки формули (IV) із проміжною сполукою формули (V). Взаємодія може бути проведена в реакційно-інертному розчиннику, такому як диметилформамід або ацетонітрил, та, необов'язково, в присутності підходящої основи, 23 91002 24 такої як, наприклад, карбонат натрію, карбонат калію або триетиламін. Сполуки формули (І) також можуть бути перетворені одна в одну за допомогою реакцій або перетворень функціональних груп, відомих з рівня техніки. Ряд таких перетворень вже описаний вище. Іншими прикладами є гідроліз ефірів карбонових кислот до відповідних карбонових кислот або спиртів; гідроліз амідів до відповідних карбонових кислот або амінів; гідроліз нітрилів до відповідних амідів; аміногрупи на імідазолі або фенілі можуть бути замінені на водень за допомогою відомих з рівня техніки реакцій діазотування та наступною заміною діазогрупи на водень; спирти можуть бути перетворені на складні ефіри або прості ефіри; первинні аміни можуть бути перетворені на вторинні або третинні аміни; подвійні зв'язки можуть бути гідровані до відповідних простих зв'язків; радикал йоду на фенільній групі може бути перетворений на складноефірну групу за допомогою введення монооксиду вуглецю в присутності прийнятного паладієвого каталізатора. Таким чином, сполуки формули (І), (1-а), (І-b), (1-е), (І-с-1), (I-d), (1-е), (I-f), (I-h), (1-і), (I-j) та (I-k) можуть бути, необов'язково, піддані одному або більше з наступних перетворень у будь-якому необхідному порядку: (і) перетворення сполуки формули (І) в іншу сполуку формули (І); (іі) перетворення сполуки формули (І) у відповідну прийнятну сіль або відповідний N-оксид; (ііі) перетворення фармацевтично прийнятної солі або N-оксиду сполуки формули (І) у вихідну сполуку формули (І); (iv) одержання стереохімічної ізомерної форми сполуки формули (І) або її фармацевтично прийнятної солі, або N-оксиду. Проміжні сполуки формули (VII), де Rd та Re означають відповідні радикали або, взяті разом з вуглецем, до якого приєднані, утворюють відповідну гетероциклічну кільцеву систему, як зазначено для Z, можуть бути отримані гідролізом проміжних сполук формули (VI), де R3 являє собою групу формули (b-1) або радикал формули (а-1), де s не дорівнює 0, названий в даній заявці R8, за допомогою відомих з рівня техніки способів, таких як перемішування проміжної сполуки (VI) в водному кислотному розчині в присутності реакційноінертного розчинника, наприклад, тетрагідрофурану. Підходящою кислотою є, наприклад, хлористоводнева кислота. Сполуки формули (І), де R2 являє собою водень та R8 приймає вищезазначені значення, названі сполуками формули (I-k), можуть бути отримані, виходячи з проміжних сполук формули (VII), шляхом селективного гідрування зазначеної про міжної сполуки відповідним відновником, як наприклад з каталізатором з благородного металу, таким як платина-на-вугіллі, паладій-на-вугіллі тощо, та відповідним відновником, таким як водень, в прийнятному розчиннику, такому як метанол. 25 91002 26 Сполуки формули (І) можуть бути отримані гідролізом проміжних сполук формули (VIII) відповідно до відомих з рівня техніки способів за допомогою дії на проміжні сполуки формули (VIII) відповідними реагентами, такими як хлорид олова, оцтова кислота та хлористоводнева кислота, в присутності реакційно-інертного розчинника, наприклад, тетрагідрофурану. Сполуки формули (І) можуть бути отримані, виходячи з N-оксидів формули (IX) шляхом перетворення проміжних сполук формули (IX) в присут ності прийнятного реагенту, такого як карбонат натрію або ангідрид оцтової кислоти, коли це доцільно, в розчиннику, такому як дихлорметан. Сполуки формули (І), де X являє собою СН, названі в описі сполуками формули (I-j), можуть також бути отримані циклізацією проміжної сполуки формули (X). Реакція циклізації проміжних сполук формули (X) також може бути проведена відповідно до відомих з рівня техніки методик циклізації. Переважно реакцію проводять в присутності підходящої кислоти Льюїса, наприклад, хлориду алюмінію, або в чистому вигляді, або в підхо дящому розчиннику, такому як, наприклад, ароматичний вуглеводень, наприклад, бензол, хлорбензол, метилбензол тощо; галогеновані вуглеводні, наприклад, трихлорметан, тетрахлорметан тощо; простий ефір, наприклад, тетрагідрофуран, 1,4діоксан тощо; або суміші зазначених розчинників. Злегка підвищені температури, переважно 70-100 °С, та перемішування можуть збільшити швидкість реакції. Сполуки формули (І), де X являє собою N, названі в описі сполуками формули (l-і), можуть бути отримані конденсацією відповідного ортобензолдіаміну формули (XI) зі складним ефіром формули (XII), де R являє собою С1-6 -алкіл. Конденсація заміщеного ортодіаміну формули (XI) та складного ефіру формули (XII) може бути проведена в присутності карбонової кислоти, наприклад, оцтової кислоти та подібної, мінеральної кислоти, такої як, наприклад, хлористоводнева кислота, сірчана кислота або сульфокислоти, такої як, наприклад, ме тансульфокислота, бензолсульфокислота, 4метилбензолсульфокислота тощо. Злегка підвищені температури дозволяють підвищити швидкість реакції, та в деяких випадках реакція може, навіть, бути проведена при нагріванні реакційної суміші до температури кипіння зі зворотним холодильником. Вода, що виділяється під час конденсації, може бути вилучена із суміші шляхом азеотропної перегонки, перегонки та подібними способами. 27 91002 28 Проміжні сполуки формули (XI) можуть бути отримані за допомогою реакції відновлення нітрогрупи до аміно, виходячи з проміжної сполуки формули (ХНІ) в присутності каталізатора на основі металу, такого як нікель Ренея, та відповідного відновника, такого як водень, в прийнятному розчиннику, такому як метанол. Проміжні сполуки формули (XIII) можуть бути отримані за допомогою гідролізу проміжних сполук формули (XIV) відповідно до добре відомих методик, таких як перемішування проміжної сполуки (XIV) у водному кислотному розчині в присутності реакційно-інертного розчинника, наприклад, тетрагідрофурана. Підходящою кислотою є, наприклад, хлористоводнева кислота. Проміжні сполуки формули (X) легко можуть бути одержані за допомогою реакції аніліну формули (XV) з галогенідом формули (XVI) у присут ності основи, такої як піридин, в прийнятному розчиннику, такому як дихлорметан. Проміжні сполуки формули (VIII), де n дорівнює 0, R2 являє собою водень або гідрокси та, коли R являє собою водень, то R являє собою гідрокси, названі в описі проміжними сполуками формули (VHI-a), можуть бути отримані обробкою проміжної сполуки формули (XVII), де W являє собою галоген, літійорганічним реагентом, таким як, наприклад, н-бутиллітій, в реакційно-інертному розчиннику, наприклад, тетрагідрофурані, та наступною реакцією зазначеної проміжної сполуки з проміжною сполукою формули (XVIII), де R1 являє собою водень або радикал, значення якого відповідають R3 . 29 Даний винахід також відноситься до сполук вищезазначеної формули (І) для застосування як лікарського засобу. Сполуки за даним винаходом мають PARPінгібуючі властивості, як видно з наведеної нижче експериментальної частини. Даний винахід відноситься до застосування сполук для одержання лікарського засобу для лікування будь-яких описаних в описі хвороб або розладів у ссавця, де зазначеними сполуками є сполуки формули (І) їх N-оксидні форми, фармацевтично прийнятні адитивні солі та стереохімічно ізомерні форми, де n дорівнює 0,1 або 2; X являє собою N або CR7, де R7 являє собою водень або, взятий разом з R1, може утворювати бівалентний радикал формули -СН=СН-СН=СН-; R1 являє собою С1-6-алкіл або тієніл; R2 являє собою водень, гідрокси, С1-6-алкіл, С3-алкініл або, взятий разом з R3, може утворювати 6 =О; R3 являє собою радикал, вибраний із групи, що включає -(CH2)S-NR8R9 (а-1), -О-Н (а-2), -O-R10 (а-3), -S-R11 (а-4)або -C N (а-5), де s являє собою 0, 1, 2 або 3; R8 являє собою -СНО, С1-6-алкіл, гідрокіС1-6алкіл, С1-6-алкілкарбоніл, ді(С1-6-алкіл)аміноС1-6алкіл, С1-6-алкілоксі С1-6-алкіл, С1-6-алкілкарбоніл аміно С1-6-алкіл, піперидиніл С1-6-алкіл, піперидинілС1-6-алкіламінокарбоніл, С1-6-алкілокси, тієнілС1-алкіл, піролілС1-6-алкіл, арил С1-66 алкілпіперидиніл, арилкарбоніл С1-6-алкіл, арилкарбонілпіперидиніл С1-6-алкіл, галогеніндозолілпіперидинілС1-6-алкіл або арилС1-6-алкіл(С1-6алкіл)аміно С1-6-алкіл; R9 являє собою водень або С1-6 -алкіл; R10 являє собою С1-6-алкіл, С1-6 -алкілкарбоніл або ді(С1-6-алкіл)аміноС1-6-алкіл та R11 являє собою ді(С1-6-алкіл)аміноС1-6-алкіл; або R3 являє собою групу формули -(CH2)rZ(b-1), де t дорівнює 0, 1, 2 або 3; 91002 30 Ζ являє собою гетероциклічну кільцеву систему, вибрану з групи, що включає де кожний з R12 незалежно являє собою водень, С1-6-алкіл, амінокарбоніл, гідрокси, С1-6-алкілоксі С1-6-алкіл, С1-6-алкілоксі С1-6алкіламіно, ди(фенілС2-6-алкеніл), піперидинілС1-6алкіл, С3-10-циклоалкіл, С3-10-ЦиклоалкілС1-6-алкіл, арилокси(гідроксі)С1-6-алкіл, галогеніндазоліл, арилС1-6-алкіл, арил С2-6-алкеніл, морфоліно, С1-6алкілімідазоліл або піридинілС1-6-алкіламіно; та кожний з R13 незалежно являє собою водень, піперидиніл або арил; кожний з R4, R5 та R6 незалежно вибирають із групи, що включає водень, галоген, тригалогенметил, тригалогенметокси, С1-6 -алкіл, С1-6 -алкілокси, ді(С1-6 -алкіл)аміно, ді(С1-6алкіл)аміноС1-6-алкілокси або С1-6алкілоксикарбоніл; або коли R5 та R6 знаходяться на сусідніх позиціях, зазначені замісники можуть, взяті разом, утворювати бівалентний радикал формули -O-СН2-O (d-1), -О-(СН2)2-О- (d-2), -СН=СН-СН=СН- (d-3) або -NH-C(O)-NR14=CH- (d-4), де R14 являє собою С1-6-алкіл; арил являє собою феніл або феніл, заміщений галогеном, С1-6-алкілом або С1-6 -алкілокси. Даний винахід також відноситься до застосування сполук формули (І) для одержання лікарсь 31 кого засобу для лікування одного або більше з описаних в описі захворювань або розладів у ссавця, де сполука являє собою сполуку формули (11) її N-оксидні форми, фармацевтично прийнятні адитивні солі та стереохімічно ізомерні форми, де n дорівнює 0; X являє собою Ν; R1 являє собою метил або етил; R2 являє собою водень; R являє собою групу формули (b-1); t дорівнює 0; -Z являє собою гетероциклічну кільцеву систему (с-2), де зазначена гетероциклічна кільцева система -Z з'єднана з залишком молекули через атом азоту; R12 являє собою водень та R15 являє собою водень, галоген, С1-6 -алкіл або С1-6-алкілокси. Зокрема, сполука формули (1-1) являє собою 3-етил-7-[(1H-імідазол-1-ілфенілметил]-2(1H)хіноксалінон (сполука № 19 за даною заявкою) або сполуку 7-[(4-хлорфеніл)-1H-імідазол-1-ілметил]-3метил-2(1H)-хіноксалінон (сполука № 20 за даною заявкою). Через здатність до зв'язування PARP сполуки за даним винаходом можуть бути використані як стандартні сполуки або мічені сполуки, у цьому випадку один з атомів молекули може бути замінений на, наприклад, радіоактивний ізотоп. Для одержання фармацевтичних композицій за даним винаходом ефективна кількість окремої сполуки, у формі основно - або кислотноадитивної солі, як активний інгредієнт, поєднують з фармацевтично прийнятним носієм в однорідну суміш, зазначений носій може приймати цілий ряд форм в залежності від форми препарату, бажаної для введення. Ці фармацевтичні композиції доцільно випускати в стандартній лікарській формі, придатній, переважно, для введення перорально, ректально, підшкірно, або шляхом парентеральної ін'єкції. Наприклад, для одержання композиції в лікарській формі, призначеній для перорального введення, може бути використане будь-яке загальноприйняте фармацевтичне середовище, таке як, наприклад, вода, гліколі, олії, спирти тощо, у випадку препаратів в рідкій формі для перорального введення, таких як суспензії, сиропи, еліксири та розчини; або тверді носії, такі як крохмалі, цукри, каолін, змазуючі речовини, зв'язуючі речовини, агенти дезинтеграції тощо, у випадку порошків, пігулок, капсул та таблеток. Завдяки легкості застосування, таблетки та капсули являють собою найбільш зручну стандартну лікарську форму для перорального введення, у цьому випадку звичайно використовують тверді фармацевтичні носії. Для парентеральних композицій носій звичайно вклю 91002 32 чає стерильну воду, принаймні, в більшій своїй частині, хоча, наприклад, для додання розчинності, можуть бути включені інші інгредієнти. Наприклад, можуть бути отримані розчини для ін'єкції, в яких носій включає фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину та розчину глюкози. Можуть бути також отримані суспензії для ін'єкції, в цьому випадку можуть бути використані підходящі рідкі носії, суспендуючі агенти тощо. В композиціях, придатних для підшкірного введення, носій, необов'язково, включає речовину, що сприяє проникненню, та/або підходящий зволожуючий засіб, необов'язково, в комбінації з підходящими допоміжними добавками будь-якого характеру в незначних відносних кількостях, при цьому зазначені добавки не повинні здійснювати помітного шкідливого впливу на шкіру. Зазначені добавки можуть полегшувати введення через шкіру та/або сприяти одержанню необхідних композицій. Ці композиції можуть бути введені різними способами, наприклад, за допомогою трансдермального пластиру, крапковим нанесенням, у вигляді мазі. Особливо доцільно виготовляти вищезгадані фармацевтичні композиції в стандартній лікарській формі для зручності введення та рівномірності дозування. Стандартна лікарська форма, як використано в описі та формулі винаходу, являє собою фізично дискретні одиниці, придатні як разові дози, кожна одиниця містить заздалегідь визначену кількість активного інгредієнта, розраховану на одержання заданої терапевтичної дії, в сполученні з необхідним фармацевтичним носієм. Прикладами таких стандартних лікарських форм є таблетки (включаючи розділені таблетки або таблетки, вкриті оболонкою), капсули, пігулки, пакетики з порошком, облатки, розчини або суспензії для ін'єкції, дози в чайних ложках, дози в столових ложках, тощо, та форми розділених багаторазових доз. Сполуки за даним винаходом можуть лікувати або попереджати ушкодження тканини, що виникають у результаті ушкодження клітин або загибелі внаслідок некрозу або апоптозу; можуть зменшувати інтенсивність ушкодження нервової або серцево-судинної тканини, включаючи ушкодження, що супроводжують фокальну ішемію, інфаркт міокарда та реперфузійне порушення; можуть лікувати різні хвороби або стани, викликані або загострені активністю PARP; можуть продовжувати або збільшувати тривалості життя або проліферативну здатність клітин; можуть змінювати експресію генів старіючих клітин; можуть радіосенсибілізувати та/або хіміосенсибілізувати клітини. Звичайно, інгібування PARP-активності охороняє клітини від енергетичних втрат, попереджаючи, у випадку нервових клітин, необоротну деполяризацію нейронів, та тим самим, забезпечує нейропротективну дію. Тому даний винахід також відноситься до способу введення терапевтично ефективних кількостей вищезазначених сполук в кількості, достатній для інгібування PARP-активності, для лікування або попередження ушкодження тканини, що виникає в результаті ушкодження клітин або загибелі внаслідок некрозу або апоптозу, для забезпечення 33 нейронної активності, що не опосередкована NMDA-токсичністю, для забезпечення нейронної активності, що опосередкована NMDAтоксичністю, для лікування ушкодження нервової тканини, що виникає при ішемії та реперфузійному порушенні, неврологічних розладах та нейродегенеративних захворюваннях; для попередження або лікування васкулярного нападу; для лікування або попередження серцево-судинних розладів; для лікування інших станів та/або захворювань, таких як стареча м'язова дегенерація, СНІД та інше захворювання, пов'язане зі старінням імунної системи, запалення, подагра, артрит, атеросклероз, кахексія, злоякісне новоутворення, дегенеративні хвороби кістякового м'яза, що включають реплікативне старіння, діабет, травма головного мозку, запальні захворювання кишечнику (такі як коліт та хвороба Крона), м'язова дистрофія, остеоартрит, остеопороз, хронічний та/або гострий біль (такий як невропатичний біль), ниркова недостатність, ретинальна ішемія, септичний шок (такий як ендотоксичний шок) та старіння шкіри, для збільшення тривалості життя та проліферативного потенціалу клітин; для зміни експресії генів старіючих клітин; для хіміосенсибілізації та/або радіосенсибілізації (гіпоксичних) пухлинних клітин. Даний винахід також відноситься до лікування захворювань та станів у тварини, що включає введення зазначеній тварині терапевтично ефективної кількості вищезазначених сполук. Зокрема, даний винахід відноситься до способу лікування, попередження або придушення неврологічного розладу у тварини, що включає введення зазначеній тварині терапевтично ефективної кількості вищезазначених сполук. Неврологічний розлад вибирають із групи, що включає такі розлади, як периферична невропатія, викликана тілесним ушкодженням або хворобливим станом, травматичне ушкодження головного мозку, травма хребта, удар, пов'язаний з ушкодженням головного мозку, фокальна ішемія, глобальна ішемія, реперфузійне порушення, демієлінізуюче захворювання та неврологічний розлад, пов'язаний з нейродегенерацією. Даний винахід також відноситься до застосування сполук формули (І) для інгібування PARPактивності, для лікування, попередження або стримування ушкодження тканини, що виникає в результаті ушкодження клітин або загибелі через некроз або апоптоз, для лікування, попередження або придушення неврологічного розладу у тварини. Термін "попередження нейродегенерації" включає здатність попереджати нейродегенерацію у пацієнтів із вперше виявленим нейродегенеративним захворюванням або при ризику розвитку нового нейродегенеративного захворювання та для попередження подальшої нейродегенераціїї у пацієнтів, що вже страждають на зазначене захворювання або що мають симптоми нейродегенеративного захворювання. Термін "лікування", як використовується в даній заявці, включає будь-яке лікування хвороби та/або стану у тварини, особливо, людини, та включає: (і) попередження виникнення хвороби 91002 34 та/або стану у пацієнта, що має схильність до захворювання та/або стану, але не має встановленого діагнозу; (іі) стримування захворювання та/або стану, тобто зупинка розвитку; (ііі) послаблення захворювання та/або стану, тобто досягнення регресії захворювання та/або стану. Термін "радіосенсибілізатор", як використовується в даній заявці, означає молекулу, переважно, молекулу з низькою молекулярною масою, яку вводять тваринам в терапевтично ефективних кількостях для збільшення чутливості клітин до іонізуючого випромінювання та/або прискорення лікування захворювань, які піддаються лікуванню за допомогою іонізуючого випромінювання. Захворювання, які піддаються лікуванню за допомогою іонізуючого випромінювання, включають новоутворення, доброякісні та злоякісні пухлини та ракові клітини. Лікування іонізуючим випромінюванням інших, не перерахованих в даній заявці захворювань, також включене в даний винахід. Термін "хіміосенсибілізатор", як використовується в даній заявці, означає молекулу, переважно, молекулу з низькою молекулярною масою, яку вводять тваринам в терапевтично ефективних кількостях для збільшення чутливості клітин до хіміотерапії та/або прискорення лікування захворювань, які піддаються лікуванню за допомогою хіміотерапевтичних засобів. Захворювання, які піддаються лікуванню за допомогою хіміотерапії, включають новоутворення, доброякісні та злоякісні пухлини та ракові клітини. Хіміотерапевтичне лікування інших, не перерахованих в даній заявці захворювань, також включене в даний винахід. Сполуки, композиції та способи за даним винаходом особливо корисні для лікування та профілактики ушкодження тканини, що виникає в результаті загибелі або ушкодження клітин внаслідок некрозу або апоптозу. Сполуки за даним винаходом можуть бути "протираковими засобами", де зазначений термін також включає "засоби проти росту пухлинних клітин" та "антинеопластичні речовини". Наприклад, способи за винаходом корисні для лікування злоякісних новоутворень та хіміосенсибілізування та/або радіосенсибілізування пухлинних клітин в злоякісних новоутвореннях, таких як АСТНпродукуючі пухлини, гострий лімфоцитарний лейкоз, гострий нелімфоцитарний лейкоз, рак кори надниркової залози, рак сечового міхура, рак мозку, рак молочної залози, рак шийки матки, хронічний лімфоцитарний лейкоз, хронічний мієлоцитарний лейкоз, рак ободової та прямої кишки, шкірна Т-клітинна лімфома, ендометріальний рак, рак стравоходу, жовчнопухирна саркома Юїнга (Ewing), лейкоз ворсистих клітин, рак голови та шиї, лімфома Ходжкіна, саркома Капоши, рак нирок, рак печінки, рак легені (дрібноклітинний та/або недрібноклітинний), злоякісна перитонеальна ефузія, злоякісна плевральна ефузія, меланома, мезотеліома, множинна мієлома, нейробластома, неходжкінська лімфома, остеогена саркома, рак яєчника, рак (полової клітини) яєчника, рак передміхурової залози, рак підшлункової залози, рак полового члена, ретинобластома, рак шкіри, саркома м'яких тканин, плоскоклітинна карцинома, рак 35 шлунка, тестикулярний рак, рак щитовидної залози, трофобластична неоплазма, рак матки, рак піхви, рак вульви та пухлина Вільмса. Отже, сполуки за даним винаходом можуть бути використані як "радіосенсибілізатор" та/або "хіміосенсибілізатор". Відомо, що радіосенсибілізатори підвищують чутливість ракових клітин до токсичної дії іонізуючого випромінювання. В літературі обговорені деякі механізми дії радиосенсибілізаторів, що включають наступні: радиосенсибілізатори гіпоксичних клітин (наприклад, сполуки 2-нитроімідазолу та сполуки бензотриазиндіоксиду) імітують кисень або, альтернативно, поводяться як біоредуктивні засоби при гіпоксії; радіосенсибілізатори негіпоксичних клітин (наприклад, галогеновані піримідини) можуть бути аналогами основ ДНК та вибірково включаються в ДНК ракових клітин та, тим самим, сприяють індукованому випромінюванням розщепленню молекул ДНК та/або перешкоджають нормальним механізмам репарації ДНК; а також були запропоновані інші різні механізми дії радіосенсибілізаторів при терапії захворювань. Багато протоколів лікування ракових захворювань використовують в даний час радіосенсибілізатори в сполученні з рентгенівським опроміненням. Приклади активуючих рентгенівське випромінювання радіосенсибілізаторів включають, але не обмежуються, наступні: метронідазол, мізонідазол, дезметилмізонідазол, пімонідазол, етанідазол. німоразол. мітоміцин С, RSU 1069, SR 4233, ЕО9, RB 6145, нікотинамід, 5-бромдеоксіуридин (BUd), 5йоддеоксіуридин (IUd), бромдеоксицитидин, фтордеоксіуридин (FudR), гідроксисечовина, цисплатин та терапевтично ефективні аналоги та похідні зазначених препаратів. Фотодинамічна терапія (PDT) ракових пухлин використовує видиме світло як радіаційний активатор сенсибілізатора. Приклади фотодинамічних радіосенсибілізаторів включають, але не обмежуються, наступні: похідні гематопорфірину, фотофрин, похідні бензопорфірину, етіопорфірин олова, феоборбід-а, бактеріохлорофіл-а, нафталоціаніни, фталоціаніни, цинкфталоціанін та терапевтично ефективні аналоги та похідні зазначених препаратів. Радіосенсибілізатори можуть бути введені разом з терапевтично ефективною кількістю однією або більше інших сполук, що включають, але не обмежуються, наступні: сполуки, що сприяють включенню радіосенсибілізаторів в клітини-мішені; сполуки, що регулюють рух терапевтичних засобів, живильних речовин та/або кисню в клітини-мішені; хіміотерапевтичні засоби, що діють на пухлину за відсутності або в присутності додаткового випромінювання, або інші терапевтично ефективні сполуки для лікування раку та інших захворювань. Приклади допоміжних терапевтичних засобів, що можуть бути використані в сполученні з радіосенсибілізаторами, включають, але не обмежуються, наступні: 5-фторурацил, лейковорин, 5'-аміно-5'деокситимідин, кисень, карбоген, трансфузії ерит 91002 36 роцитів, перфторвуглеці (наприклад, Fluosol 10 DA), 2,3-DPG, BW12C, блокатори кальцієвих каналів, пентоксифілін, сполуки, що перешкоджають ангіогенезу, гідралазин та LBSO. Приклади хіміотерапевтических засобів, що можуть бути використані в сполученні з радіосенсибілізаторами, включають, але не обмежуються, наступні: адріаміцин, камптотецин, карбоплатин, цисплатин, даунорубіцин, доцетаксел, доксорубіцин, інтерферон (альфа, бета, гама), інтерлейкін 2, іринотекан, паклітаксел, топотекан та терапевтично ефективні аналоги та похідні зазначених препаратів. Хіміосенсибілізатори можуть бути введені разом з терапевтично ефективною кількістю однієї або більше інших сполук, що включають, але не обмежуються, наступні: сполуки, що сприяють включенню хіміосенсибілізаторів в клітини-мішені; сполуки, що регулюють рух терапевтичних засобів, живильних речовин та/або кисню в клітини-мішені; хіміотерапевтичні засоби, що діють на пухлину, або інші терапевтично ефективні сполуки для лікування раку та інших захворювань. Приклади допоміжних терапевтичних засобів, що можуть бути використані в сполученні з хіміосенсибілізаторами, включають, але не обмежуються, наступні: метилуючі агенти, інгібітори топоізомерази І та інші хіміотерапевтичні засоби, такі як цисплатин та блеоміцин. Сполуки формули (І) можуть також бути використані для виявлення або ідентифікації PARP, та, точніше, рецептора PARP-1. З цією метою в сполуки формули (І) можуть бути введені радіоактивні мітки. Зазначена мітка може бути вибрана з групи, що включає такі мітки, як радіоізотоп, спінова мітка, антигенна мітка, флуоресцентна група з ферментною міткою або хімілюмінесцентна група. Фахівець в даній галузі техніки легко може визначити ефективну кількість на основі результатів наведених нижче досліджень. Звичайно вважається, що ефективна кількість повинна складати від 0,001 мг/кг до 100 мг/кг маси тіла, та, особливо, від 0,005 мг/кг до 10 мг/кг маси тіла. Може бути доцільним введення необхідної дози у вигляді двох, трьох, чотирьох або більше субдоз, з відповідними інтервалами, протягом дня. Зазначені субдози можуть бути виготовлені у вигляді стандартних лікарських форм, наприклад, що містять від 0,05 до 500 мг, та, переважно, від 0,1 мг до 200 мг активного інгредієнта на стандартну лікарську форму. Наступні приклади ілюструють даний винахід. Експериментальна частина В описі далі, "BuLi" означає бутиллітій, "МеОН" означає метанол, "DIPE" означає діізопропіловий ефір, "ДМФА" означає N,N-диметилформамід, "DME" означає 1,2-диметоксіетан, "DCM" означає дихлорметан, "EtOAc" означає етилацетат, "ТГФ" означає тетрагідрофуран, "МЕК" означає метилетилкетон. А. Одержання проміжних сполук Приклад А1 a) Одержання проміжної сполуки 1 37 Азотну кислоту (димлячу) (26,7 мл) додають по краплях при кімнатній температурі до розчину N-[4-(2-оксо-2-фенілетил)феніл]ацетаміду (0,2128 моль) в ангідриді оцтової кислоти (1100 мл), підтримуючи температуру нижче 30 °С. Суміш перемішують протягом 1 години, виливають у льодяну воду та нейтралізують концентрованим розчином ΝΗ4ΟΗ. Осад відокремлюють фільтруванням, промивають водою та діетиловим ефіром та сушать, одержуючи 40 г (63 %) проміжної сполуки 1. b) Одержання проміжної сполуки2 Гідроборат натрію (0,1056 моль) додають частинами при 10 °С в потоці N2 до розчину проміжної сполуки 1 (0,096 моль) в метанолі (350 мл). Суміш перемішують при 10 °С протягом 30 хв, виливають в льодяну воду та екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та розчинник випарюють насухо, одержуючи 22 г (76 %) проміжної сполуки 2. c) Одержання проміжної сполуки 3 Метилсульфоніл хлорид (0,076 моль) додають по краплях при 0 °С в потоці N2 до суспензії проміжної сполуки 2 (0,038 моль) та триетиламіну (0,076 моль) в DCM (100 мл). Суміш перемішують протягом 12 годин. Розчинник випарюють (без нагрівання). Продукт використовують без додаткового очищення, одержуючи (кільк.) проміжну сполуку 3. d) Одержання проміжної сполуки 4 Суміш проміжної сполуки 3 (0,038 моль), 1Hімідазолу (0,076 моль) та карбонату калію (0,076 моль) в ацетонітрилі (300 мл) перемішують та нагрівають до температури кипіння зі зворотним холодильником протягом 15 годин, потім охолоджу 91002 38 ють до кімнатної температури, виливають у льодяну воду та екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та розчинник випарюють насухо. Залишок очищають за допомогою колоночної хроматографії на силікагелі (елюент: суміш DCM/CH3OH/NH4OH 95/5/0,1). Чисті фракції збирають та розчинник випарюють, одержуючи 4,5 г (34 %) проміжної сполуки 4. e) Одержання проміжної сполуки 5 Суміш проміжної сполуки 4 (0,0128 моль) в гідроксиді натрію (110 мл) та етанолі (30 мл) перемішують при кімнатній температурі протягом 3 годин, виливають на лід та екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та розчинник випарюють насухо, одержуючи 2,75 г (70 %) проміжної сполуки 5. f) Одержання проміжної сполуки 6 Суміш проміжної сполуки 5 (0,0089 моль) в метанолі (150 мл) гідрують при тиску З бар протягом 45 хв з нікелем Ренея (3 г), як каталізатором. Після поглинання Н2 (3 еквів.), каталізатор фільтрують через целіт та фільтрат випарюють насухо, одержуючи 2,59 г (100 %) проміжної сполуки 6. Приклад А2 а) Одержання проміжної сполуки 7 Суміш 3,4-бензофенондіаміну (0,1743 моль) та етил-2-оксобутаноату (0,3486 моль) в етанолі (820 мл) перемішують та нагрівають до температури кипіння зі зворотним холодильником протягом 5 годин та потім охолоджують. Розчинник випарюють. Залишок поміщають в водний насичений розчин NaHСО3. Суміш екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та розчинник випарюють насухо. Залишок (70,3 г) очищають за допомогою колоночної хроматографії на силікагелі (елюент: суміш DCM/2-пропанол 98/2; 20 - 45 мкм). Чисті фракції збирають та розчинник випарюють, одержуючи 15,5 г проміжної сполуки 7. Частину отриманого продукту кристалізують з діетилового ефіру та петролейного ефіру. Осад відокремлюють фільтруванням та сушать, одержуючи 0,85 г проміжної сполуки 7, температура плавлення 197 °С. b) Одержання проміжної сполуки 39 Гідроборат натрію (0,0719 моль) додають при 0 °С в потоці N2 до суспензії проміжної сполуки 7 ((0,0719 моль в метанолі (300 мл) та ТГФ (100 мл)). Суміш перемішують протягом 30 хв та виливають в льодяну воду. Осад відокремлюють фільтруванням, промивають водою та сушать. Частину (0,7 г) цієї фракції (8,33 г) кристалізують із суміші метанолу та води. Осад відокремлюють фільтруванням та сушать, одержуючи 0,59 г проміжної сполуки 8, температура плавлення 202 °С. c) Одержання проміжної сполуки 9 Метансульфоніл хлорид (0,009421 моль) додають при 0 °С в потоці N2 до суспензії проміжної сполуки 8 (0,0043 моль) та триетиламіну (0,0108 моль) в DCM (10 мл) та ТГФ (10 мл). Суміш перемішують при кімнатній температурі протягом 5 годин. Розчинник випарюють охолодженим. Продукт використовують без додаткового очищення, одержуючи (100 %) проміжну сполуку 9. d) Одержання проміжної сполуки 10 Суміш N-(2-метоксіетил)-1-(фенілметил)-4піперидинаміну (0,0402 моль) в етанолі (100 мл) гідрують при 40 °С протягом 2 годин та потім при кімнатній температурі, при тиску З бар, протягом 3 годин за допомогою Pd/C 10 % (1 г), як каталізатора. Після поглинання Н2 (1 еквів.), каталізатор фільтрують через целіт, промивають етанолом та фільтрат випарюють. Продукт використовують без додаткового очищення, одержуючи 6,5 г (99 %) проміжної сполуки 10. Приклад A3 a) Одержання проміжної сполуки 11 Суміш 6-бром-2-хлор-3-метилхіноліну (0,0697 моль) та NaOCH3 30 % (0,3483 моль) в метанолі (90 мл) перемішують та нагрівають до температури кипіння зі зворотним холодильником протягом 15 годин. Суміш охолоджують, виливають в льодяну воду та екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та розчинник випарюють насухо. Продукт використовують без додаткового очищення, одержуючи 12,2 г (69 %) проміжної сполуки 11. b) Одержання проміжної сполуки 12 91002 40 н-BuLi (0,0624 моль) додають по краплях при 60 °С в потоці N2 до розчину проміжної сполуки 11 (0,048 моль) в ТГФ (100 мл), та суміш перемішують при -60 °С протягом 1 години. Додають по краплях розчин 2-бензоїлетилдиметиламіну (0,0576 моль) в ТГФ (100 мл). Суміші дають нагрітися до -20 °С при перемішуванні та потім перемішують протягом 2 годин. Суміш виливають в водний розчин NH4CI та екстрагують EtOAc. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та розчинник випарюють насухо. Продукт використовують без додаткового очищення, одержуючи 17,68 г (кільк.) проміжної сполуки 12. c) Одержання проміжної сполуки 13 Суміш проміжної сполуки 12 (0,0496 моль) в 3 н НСl (261 мл) та ТГФ (133 мл) перемішують та нагрівають до температури кипіння зі зворотним холодильником протягом 8 годин. Суміш охолоджують, виливають на лід, підлужують концентрованим розчином NH4OH та екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та розчинник випарюють майже насухо. Залишок очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: суміш DCM/CH3OH/NH4OH 95/5/1). Чисті фракції збирають та розчинник випарюють, одержуючи 6 г (36 %) проміжної сполуки 13. d) Одержання проміжної сполуки 14 Суміш проміжної сполуки 13 (0,0178 моль) в 3 н НС1 (90 мл) та ТГФ (47 мл) перемішують та нагрівають до температури кипіння зі зворотним холодильником протягом 2 днів. Суміш охолоджують, виливають на лід, підлужують концентрованим розчином NH4OH та екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та розчинник випарюють майже насухо. Залишок кристалізують з діетилового ефіру. Осад відокремлюють фільтруванням та сушать, одержуючи 1,5 г проміжної сполуки 14. Приклад А4 a) Одержання проміжної сполуки 15 41 Суміш (4-аміно-3-нітрофеніл)-(4хлорфеніл)метанону (0,0686 моль) у DCM (200 мл) та ацетил хлориді (20 мл) перемішують протягом 12 годин при кімнатній температурі та потім розчинник випарюють насухо. Залишок поміщають в діетиловий ефір (50 мл), після чого необхідний продукт відокремлюють фільтруванням та сушать, одержуючи 21,6г (99 %) проміжної сполуки 15, температура плавлення 138 °С. b) Одержання проміжної сполуки 16 Суміш проміжної сполуки 15 (0,066 моль) в метанолі (200 мл) перемішують при 0 °С та додають по краплях розчин гідроборату натрію (0,066 моль) у воді, потім реакційну суміш перемішують протягом 1 години при кімнатній температурі та розчинник випарюють. Залишок екстрагують сумішшю DCM/CH3OH/H2O та екстракт сушать (MgSO4). Нарешті, розчинник випарюють та необхідний продукт збирають, одержуючи 20,4 г (97 %) проміжної сполуки 16, температура плавлення 198 °С. c) Одержання проміжної сполуки17 В 3-горлій реакційній колбі (500 мл), постаченій до давальною воронкою та термометром, суміш проміжної сполуки 16 (0,062 моль) та триетиламіну (0,125 моль) в DCM (200 мл) охолоджують до 0 °С та додають по краплях, підтримуючи температуру 0 - 5 °С, метансульфоніл хлорид (0,125 моль), потім реакційну суміш перемішують протягом 4 годин при кімнатній температурі та виливають у воду (1000 мл). Органічний шар відокремлюють, сушать (MgSO4), фільтрують та розчинник випарюють, одержуючи 18г (масло, 85 %) проміжної сполуки 17. d) Одержання проміжної сполуки 18 Суміш проміжної сполуки 17 (0,088 моль), піперидину (0,446 моль) та карбонату калію (0,442 моль) в ацетонітрилі (250 мл) з незначною кількістю КІ перемішують при 40 °С протягом 12 годин та розчинник випарюють (вак.). Залишок поглинають водою та суміш екстрагують DCM. Органічний шар сушать (MgSO4) та розчинник випарюють насухо. Залишок очищають за допомогою рідинної хроматографії на силікагелі (елюент: DCM). Фракції, що 91002 42 містять продукт, збирають та розчинник випарюють, одержуючи 16 г (47 %, масло) проміжної сполуки 18. e) Одержання проміжної сполуки 19 Суміш проміжної сполуки 18 (0,0413 моль) в гідроксиді натрію (1,5 н) (160 мл) та суміші ТГФ/метанол (10 мл) перемішують протягом 48 годин при кімнатній температурі, потім розчин нейтралізують до рН 7, екстрагують EtOAc та промивають водою. Органічний шар сушать (MgSO4) та розчинник випарюють насухо. Маслянистий залишок (12,5 г) очищають за допомогою високоефективної рідинної хроматографії на силікагелі (елюент: суміш DCM/СН3ОН 99/1). Фракції, що містять продукт, збирають та розчинник випарюють, одержуючи 10 г (71 %) проміжної сполуки 19, температура плавлення 124 °С. h) Одержання проміжної сполуки 20 Суміш проміжної сполуки 19 (0,0289 моль) в метанолі (200 мл) гідрують протягом 2 годин в присутності нікелю Ренея (10 г), як каталізатору. Після поглинання Н2 (3 еквів.), розчин фільтрують через шар целіту, одержуючи 9,1 г проміжної сполуки 20 (використовують, як таку на наступній реакційній стадії, без додаткового очищення). В. Одержання кінцевих сполук Приклад В1 Одержання сполуки 1 Суміш проміжної сполуки 6 (0,0089 моль) та етил-2-оксобутаноату (0,0178 моль) в метанолі (50 мл) перемішують та нагрівають до температури кипіння зі зворотним холодильником протягом 15 годин, потім охолоджують до кімнатної температури, виливають в льодяну воду та екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та розчинник випарюють майже насухо. Залишок (3,1 г) очищають за допомогою колоночної хроматографії на силікагелі (1540 мкм) (елюент: суміш толуол/2-пропанол/NH4OH 85/15/0,8). Необхідну фракцію збирають та роз 43 чинник випарюють. Залишок очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: суміш толуол/2-пропанол/NН4ОН 85/15/0,8). Очищені фракції збирають та випарюють розчинник. Залишок (0,3 г) кристалізують з 2пропаноне та діетилового ефіру. Осад відокремлюють фільтруванням та сушать, одержуючи 0,3 г (10%) сполуки 1, температура плавлення 166 °С. Приклад В2 Одержання сполуки 2 Суміш проміжної сполуки 9 (0,0043 моль), проміжної сполуки 10 (0,0052 моль) та карбонату калію (0,0129 моль) в ацетонітрилі (15 мл) перемішують при 80 °С протягом 15 годин, потім охолоджують до кімнатної температури, виливають в льодяну воду та екстрагують EtOAc. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та розчинник випарюють майже насухо. Залишок (2,2 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: суміш DCM/CH3OH/NH4OH 95/5/0,2). Очищені фракції збирають та випарюють розчинник. Залишок (0,27 г) розчиняють в 2-пропаноні та перетворюють в сіль етандіонової кислоти (2:5). Осад відокремлюють фільтруванням та сушать, одержуючи 0,25 г сполуки 2, температура плавлення 98 °С. Приклад В3 Одержання сполуки 3 Проміжну сполуку 14 (0,0107 моль) в метанолі (60 мл) гідрують за допомогою Pd/C 10 % (0,36 г), як каталізатору, протягом 16 годин при тиску 3 бар. Після поглинання Н2 (1 еквів.), каталізатор фільтрують через целіт та фільтрат випарюють майже насухо. Залишок (3,58 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: суміш DCM/CH3OH/NH4OH 93/7/0,5). Чисті фракції збирають та розчинник випарюють. Залишок (1,45 г) кристалізують з метилетилкетону. Осад відокремлюють фільтруван 91002 44 ням, промивають діетиловим ефіром та сушать, одержуючи 0,82 г (30 %) сполуки 3. Приклад В4 Одержання сполуки 4 Гідроборат натрію (0,0719 моль) додають при 0 °С в потоці N2 до суспензії проміжної сполуки 7 (0,0719 моль) в метанолі (300 мл) та ТГФ (100 мл). Суміш перемішують протягом 30 хв та виливають в льодяну воду. Осад відокремлюють фільтруванням, промивають водою та сушать. Частину (0,7 г) цієї фракції (8,33 г) кристалізують з метанолу та води. Осад відокремлюють фільтруванням та сушать, одержуючи 0,59 г сполуки 4, температура плавлення 202 °С. Приклад В5 Одержання сполуки 5 Розчин 2-оксобутанової кислоти (0,0294 моль) в оцтовій кислоті (30 мл) додають до розчину проміжної сполуки 20 (0,0288 моль) в воді (70 мл) при 0 °С та реакційну суміш перемішують протягом 2 годин при 0 °С. Отриманий розчин виливають у суміш лід-вода, нейтралізують гідроксидом натрію (3 н) та екстрагують DCM. Органічний шар сушать (MgSO4), та розчинник випарюють насухо. Залишок очищають за допомогою рідинної хроматографії на силікагелі (елюент: суміш толуол/2пропанол/NН4ОН 90/10/0,1). Два фракції, що містять продукт, збирають та розчинник випарюють. Вищезазначені фракції після очищення кристалізують з суміші діетиловий ефір/DCM/MEK та отриманий продукт збирають, одержуючи 1,15 г сполуки 5. У таблиці F-1 перераховані сполуки, отримані відповідно до одного з наведених вище прикладів. В таблиці використані наступні позначення: Спол. №. означає номер сполуки, приклад [Вn°] означає такий же спосіб, що описано в Вn° прикладах. 45 91002 46 47 Фармакологічний приклад Аналіз PARP-1 -інгібуючої активності методом сцинтиляційного ефекту близькості (SPA) in vitro Сполуки за даним винаходом досліджують в in vitro аналізі, базуючись на SPA технології (запатентована Amersham Pharmacia Biotech). В принципі, аналіз базується на загальноприйнятій SPA технології виявлення полі(АДФрибозил)ування білків-мішенів, тобто гістонів. Таке рибозилування індукують, використовуючи фермент PARP-1, активований ДНК з одноланцюговим розривом, та [3Н]-никотинамідадениндинуклеотид ([3H]-NAD+) як АДФ-рибозил-донором. Як індуктор активності ферменту PARP-1 одержують ДНК з одноланцюговим розривом. З цією метою 25 мг ДНК (постачальник: Sigma) розчиняють в 25 мл ДНКаза-буфері (10 мМ Tris-HCl, pH 7,4; 0,5 мг/мл альбуміну телячої сироватки (BSA); 5 мМ MgCl2 6H2O та 1 мМ КСl), до якого додають 50 мкл ДНКаза-розчину (1 мг/мл в 0,15 Μ NaCl). Після інкубації протягом 90 хв при 37 °С реакцію обривають додаванням 1,45 г NaCl з наступною додатковою інкубацією при 58 °С протягом 15 хв. Реакційну суміш охолоджують на льоді та здійснюють діаліз при 4 °С протягом, відповідно, 1,5 та 2 годин проти 1,5 л 0,2 Μ розчину КСl та двічі проти 1,5 л 0,01 Μ розчину КСl протягом 1,5 та 2 годин, відповідно. Суміш поділяють на аліквоти та зберігають при -20 °С. Гістони (1 мг/мл, тип ІІ-А, постачальник: Sigma) біотинілюють, використовуючи набір для біотинілювання від Amersham, та зберігають у вигляді аліквотних проб при -20 °С. Вихідний розчин 100 мг/мл SРАполі(вінілтолуол)(РVТ)-гранули (постачальник: Amersham) одержують в PBS. Основний розчин [3H]-NAD+ одержують додаванням 120 мкл [3H]NAD+ (0,1 мКюрі/мл, постачальник: NEN) до 6 мл інкубаційного буфера (50 мМ Tris/HCl, pH 8; 0,2 мМ DTT; 4 мМ MgCl2). Розчин 4 мМ NAD+ (постачальник: Roche) одержують в інкубаційному буфері (з 100 мМ основного розчину у воді, що зберігається при -20 °С). Фермент PARP-1 одержують за допомогою відомих технологіях, тобто клонуванням та експресією білка, виходячи з кДНК печінки людини. 91002 48 Інформація, що стосується застосування протеїнової послідовності ферменту PARP-1, включаючи літературні посилання, може бути знайдена в базі даних Swiss-Prot під первинним вхідним номером Р09874. Біотинільовані гістони та PVT-SPAгранули змішують та попередньо інкубують протягом 30 хв при кімнатній температурі. PARP-1фермент (концентрація залежить від партії) змішують із ДНК з одноланцюговим розривом та суміш попередньо Інкубують протягом 30 хв при 4 °С. Рівні порції цього розчину гістони/РVТ-SРАгранули та розчину PARP-1-фермент/ДНК змішують та додають на лунки 96-ямкового мікротитраційного планшета 75 мкл отриманої суміші разом з 1 мкл сполуки в ДМСО та 25 мкл [3H]-NAD+. Кінцеві концентрації в інкубаційній суміші складають 2 мкг/мл для біотинільованих гістонів, 2 мг/мл для PVT-SPA-гранул, 2 мкг/мл для ДНК з одноланцюговим розривом та в межах 5-10 мкг/мл для PARP1-ферменту. Після інкубації суміші протягом 15 хв при кімнатній температурі реакцію обривають додаванням 100 мкл 4 мМ NAD+ в інкубаційному буфері (кінцева концентрація 2 мМ) та вміст планшетів перемішують. Гранулам дають осаджуватися, принаймні, протягом 15 хв, та планшети переносять у TopCountNXTTM(Packard) для підрахунку сцинтиляцій, та значення виражають через число імпульсів на хвилину (імп/хв). Для кожного експерименту паралельно виконують контролі (містять фермент PARP-1 та ДМСО без сполуки), сліпий інкубаційний дослід (містить ДМСО, але без ферменту PARP-1 або сполуки) та проби (містять фермент PARP-1 та сполуку, розчинену в ДМСО). Всі досліджені сполуки розчиняють та остаточно потім розбавляють ДМСО. Спочатку сполуки досліджують при концентрації 10-6М. Якщо сполуки виявляють -6 активність при 10 М, будують криву залежності доза-реакція, де сполуки досліджують при концентраціях в межах від 10-5 Μ до 10-8 М. В кожному дослідженні нульове значення віднімають як зі значень для контролю, так і значень для проби. Контрольна проба відповідає максимальній активності ферменту PARP-1. Для кожної проби кіль 49 кість імп/хв виражають у відсотках від середньої величини імп/хв для контролів. Коли це доцільно, ІС50-значення (концентрація лікарського засобу, необхідна для зниження активності ферменту PARP-1 до 50 % від контролю) розраховують, використовуючи лінійну інтерполяцію між експериментальними точками, трохи вище та нижче 50 % рівня. В даній заявці дії досліджених сполук виражені через pIC50 (негативне значення log від значення ІС50). Як стандартну сполуку вводять 4аміно-1,8-нафталімід для підтвердження правильності SPA аналізу. Досліджені сполуки виявили інгібуючу активність при початковій експериментальній концентрації 10-6М (див. таблицю 2). Фільтраційний аналіз на PARP-1 інгібуючу активність in vitro Сполуки за даним винаходом досліджують на основі фільтраційного аналізу in vitro, оцінюючи PARP-1-активність (ініційовану в присутності ДНК з одноланцюговим розривом) за допомогою активності в полі(АДФ-рибозил)уванні гістонів із застосуванням [32P]-NAD як АДФ-рибозил-донору. Радіоактивні рибозильовані гістони осаджують за допомогою трихлороцтової кислоти (ТСА) в 96ямкових планшетах для фільтрування, та включений [32Р] вимірюють, використовуючи підрахунок сцинтиляцій. Одержують суміш гістонів (вихідний розчин: 5 мг/мл в Н2О), NAD+ (вихідний розчин: 100 мМ в Н2О) та [32P]-NAD+ в інкубаційному буфері (50 мМ Tris/HCl, pH 8; 0,2 мМ DTT; 4 мМ MgCl2). Одержують також суміш ферменту PARP-1 (5-10 мкг/мл) та ДНК з одноланцюговим розривом. ДНК з одноланцюговим розривом одержують, як описано в SPA in vitro для PARP-1-інгібуючої активності. Сімдесят п'ять мкл суміші фермент PARP-1/ДНК разом з 1 мкл сполуки в ДМСО та 25 мкл суміші гістони-NAD+/[32P]-NAD+ додають на лунку 96ямкового планшета для фільтрування (0,45 мкм, постачальник Millipore). Кінцеві концентрації в інкубаційній суміші складають 2 мкг/мл для гістонів, 0,1 мМ для NAD+, 200 мкМ (0,5 мкКю) для [32P]NAD+ та 2 мкг/мл для ДНК з одноланцюговим розривом. Планшети інкубують протягом 15 хв при кімнатній температурі та реакцію обривають дода 91002 50 ванням 10 мкл охолодженої льодом 100 % ТСА з наступним додаванням 10 мкл охолодженого льодом розчину BSA (1 % у Н2О). Білковій фракції дають осаджуватися протягом 10 хв при 4 °С та планшети піддають вакуумному фільтруванню. Планшети послідовно промивають, на кожну лунку, 1 мл 10 % охолодженої льодом ТСА, 1 мл 5 % охолодженої льодом ТСА та 1 мл 5 % ТСА при кімнатній температурі. Нарешті, до кожної лунки додають по 100 мкл сцинтиляційного розчину (Microscint 40, Packard), та планшети переносять в TopCountNXTTM (постачальник: Packard) для підрахунку сцинтиляцій, та значення виражають через число імпульсів на хвилину (імп/хв). Для кожного експерименту паралельно виконують контролі (містять фермент PARP-1 та ДМСО без сполуки), сліпий інкубаційний дослід (містить ДМСО, але без ферменту PARP-1 або сполуку) та проби (містять фермент PARP-1 та сполуку, розчинену в ДМСО). Всі досліджені сполуки розчиняють та остаточно потім розбавляють ДМСО. Спочатку сполуки досліджують при концентрації 10-5 М. Якщо сполуки виявляють активність при 10-5 М, будують криву залежності доза-реакція, де сполуки досліджують при концентраціях в межах від 10-5 Μ до 10-8 М. В кожному аналізі нульове значення віднімають як зі значень для контролю, так і значень для проби. Контрольна проба відповідає максимальній активності ферменту PARP-1. Для кожної проби кількість імп/хв виражають у відсотках від середньої величини імп/хв для контролів. Коли це доцільно, ІС50-значення (концентрація лікарського засобу, необхідна для зниження активності ферменту PARP-1 до 50% від контролю) розраховують, використовуючи лінійну інтерполяцію між експериментальними точками, трохи вище та нижче 50 % рівня. В даній заявці дії досліджених сполук виражені через pIC50 (негативне значення log від значення ІС50). Як стандартну сполуку вводять 4-аміно-1,8-нафталімід для підтвердження правильності фільтраційного аналізу. Досліджені сполуки показали інгібуючу активність при початковій експериментальній концентрації 10-5 Μ (див. таблицю 2). 51 91002 Сполуки можуть бути додатково оцінені в аналізі на хіміо- та/або радіосенсибілізацію, аналізі, що оцінює інгібування ендогенної активності Комп’ютерна верстка І. Скворцова 52 PARP-1 в лініях ракових клітин та, нарешті, в аналізі на радіосенсибілізацію in vivo. Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською7-phenylalkyl substituted 2-quinolinones and 2- quinoxalinones as poly(adp-polymerase inhibitors
Автори англійськоюMabire Dominique Jean-Pierre, Guillemont Jerome Emile Georges, van Dun Jacobus Alphonsus Josephus, Somers Maria Victorina Francisca, Wouters Walter Boudewijn Leopold
Назва патенту російською7-фенилалкилзамещенные 2-хинолиноны и 2-хиноксалиноны как ингибиторы поле(адф-рибоза)полимеразы
Автори російськоюМабир Доминик Жан-Пьер, Жильмон Жером Эмиль Жорж, ван Дун Якобус Альфонсус Йозефус, Сомерс Мария Викторина Франсиска, Вутерс Вальтер Будевийн Леопольд
МПК / Мітки
МПК: A61P 43/00, A61K 31/498, C07D 401/06, C07D 403/06, C07D 241/44
Мітки: 2-хіноксалінони, 2-хінолінони, 7-фенілалкілзаміщені, полі(адф-рибоза)полімерази, інгібітори
Код посилання
<a href="https://ua.patents.su/26-91002-7-fenilalkilzamishheni-2-khinolinoni-ta-2-khinoksalinoni-yak-ingibitori-poliadf-ribozapolimerazi.html" target="_blank" rel="follow" title="База патентів України">7-фенілалкілзаміщені 2-хінолінони та 2-хіноксалінони як інгібітори полі(адф-рибоза)полімерази</a>
Попередній патент: Електричний розподільний щит та підстанція з середніми значеннями напруги, яка містить такий розподільний щит (варіанти)
Наступний патент: Поршнева машина
Випадковий патент: Широкосмуговий балансний нвч-змішувач












