Алкоксизаміщені бензімідазоли, фармацевтичні композиції, що їх містять та спосіб їх застосування
Номер патенту: 73947
Опубліковано: 17.10.2005
Автори: Фонтана Стівен А., Стауелл Грейсон Уокер, Дженкінс Дуглас Джон, Уіттл Роберт Р., Меєр Гленн Ален, Уіттолл Лінда, Санчиліо Фредерік Д.
Формула / Реферат
1. Композиція, що містить сполуки, представлені формулою (Ia):
, (Ia)
де:
Sx - хіральний атом сірки, що обумовлює існування принаймні одного з діастереомерів, представлених Sха і Sxb, де Sxa є (-) діастереомером і Sxb є (+) діастереомером;
R є алкокси;
R1 вибирають з групи, що містить водень, алкіл, галоген, карбоалкокси, алкокси і алканоїл;
R2 є воднем або алкілом; і
R3, R4 і R5 можуть бути однаковими або різними і кожен вибирають з групи, що містить водень, алкіл, алкокси і алкоксіалкокси,
де, коли R4 є алкокси і ні R3 ні R5 не є воднем, алкільний замісник такої алкоксигрупи вибирають з групи, що містить принаймні один з діастереомерів, представлених R4q, і R4z; де R4q є (-) діастереомером і лежить вище площини хіральності; і R4z є (+) діастереомером і лежить нижче площини хіральності;
або одну або більшу кількість їx фармацевтично прийнятних солей, сольватів, гідратів або комбінацій.
2. Композиція згідно з пунктом 1, де згадана композиція є по суті вільною від сполук, представлених формулою (Ib):
, (Ib)
де:
Sx - хіральний атом сірки, що обумовлює існування принаймні одного з діастереомерів, представлених Sxa і Sxb, де Sxa є (-) діастереомером і Sxb є (+) діастереомером;
R є алкокси;
R1 вибирають з групи, що містить водень, алкіл, галоген, карбоалкокси, алкокси і алканоїл;
R2 є воднем або алкілом; і
R3, R4 і R5 можуть бути однаковими або різними і кожен вибирають з групи, що містить водень, алкіл, алкокси і алкоксіалкокси,
де, коли R4 є алкокси і ні R3, ні R5 не є воднем, алкільний замісник такої алкоксигрупи вибирають з групи, що містить принаймні один з діастереомерів, представлених R4q і R4z; де R4q є (-) діастереомером і лежить вище площини хіральності; і R4z є (+) діастереомером і лежить нижче площини хіральності;
або однієї або більшої кількості їx фармацевтично прийнятних солей, сольватів, гідратів або комбінацій згаданих сполук, представлених формулою (Ib).
3. Композиція, що містить:
(а) одну або більшу кількість сполук, представлених формулою (Ia):
, (Ia)
де:
Sx - хіральний атом сірки, що обумовлює існування принаймні одного з діастереомерів, представлених Sxa і Sxb, де Sxa є (-) діастереомером і Sxb є (+) діастереомером;
R є алкокси;
R1 вибирають з групи, що містить водень, алкіл, галоген, карбоалкокси, алкокси і алканоїл;
R2 є воднем або алкілом; і
R3, R4 і R5 можуть бути однаковими або різними і кожен вибирають з групи, що містить водень, алкіл, алкокси і алкоксіалкокси,
де, коли R4 є алкокси і ні R3, ні R4 не є воднем, алкільний замісник такої алкоксигрупи вибирають з групи, що містить принаймні один з діастереомерів, представлених R4q і R4z; де R4q є (-) діастереомером і лежить вище площини хіральності; і R4z є (+) діастереомером і лежить нижче площини хіральності;
або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій, і
(б) одну або більшу кількість сполук, представлених формулою (Ib):
, (Ib)
де:
Sx - хіральний атом сірки, що обумовлює існування, принаймні, одного з діастереомерів, представлених Sxa і Sxb, де Sxa є (-) діастереомером і Sxb є (+) діастереомером;
R є алкокси;
R1 вибирають з групи, що містить водень, алкіл, галоген, карбоалкокси, алкокси і алканоїл;
R2 є воднем або алкілом; і
R3, R4 і R5 можуть бути однаковими або різними і кожен вибирають з групи, що містить водень, алкіл, алкокси і алкоксіалкокси,
де, коли R4 є алкокси і ні R3, ні R5 не є воднем, алкільний замісник такої алкоксигрупи вибирають з групи, що містить принаймні один з діастереомерів, представлених R4q і R4z; де R4q є (-) діастереомером і лежить вище площини хіральності; і R4z є (+) діастереомером і лежить нижче площини хіральності;
або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій згаданої композиції.
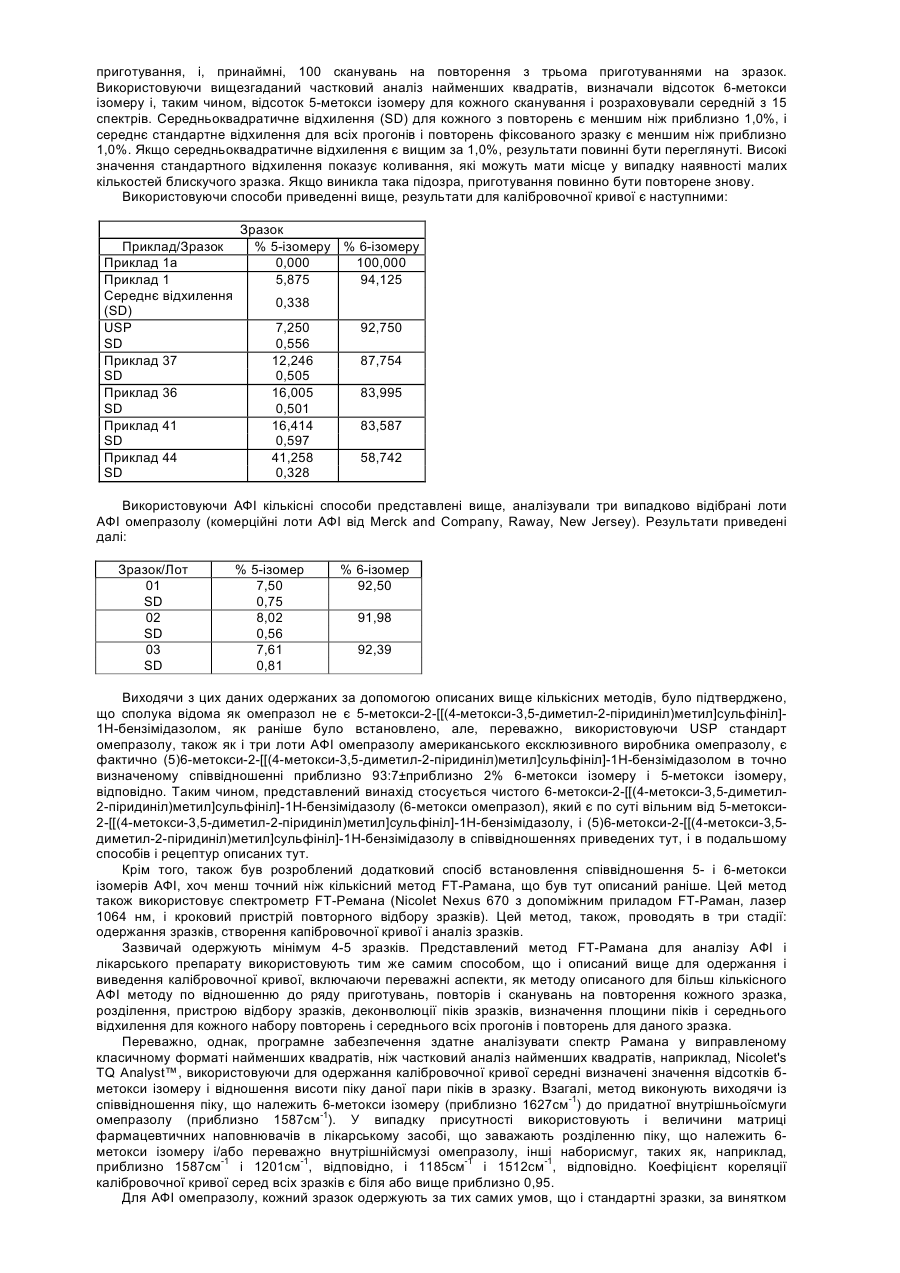
4. Композиція згідно з пунктом 3, де згадана композиція містить сполуки, представлені формулами (Ia) і (Ib), де співвідношення згаданих сполук вибирають з групи, що містить:
(а) згадані сполуки, представлені формулою (Ia), присутні в інтервалі від приблизно 1 відсотка (ваг/ваг) до приблизно 99 відсотків (ваг/ваг) і згадані сполуки, представлені формулою (Ib) присутні в інтервалі від приблизно 1 відсотка (ваг/ваг) до приблизно 99 відсотків (ваг/ваг), так що загальна сума відсотків таких сполук, представлених формулами (Ia) і (Ib), еквівалентна приблизно 100 відсоткам (ваг/ваг);
(б) згадані сполуки, представлені формулою (Ia), присутні в інтервалі від приблизно 96 відсотків (ваг/ваг) до приблизно 99 відсотків (ваг/ваг) і згадані сполуки, представлені формулою (Ib), присутні в інтервалі від приблизно 1 відсотка (ваг/ваг) до приблизно 4 відсотків (ваг/ваг), так що загальна сума відсотків таких сполук, представлених формулами (Ia) і (Ib), еквівалентна приблизно 100 відсоткам (ваг/ваг); і
(в) згадані сполуки, представлені формулою (Ia), присутні в інтервалі від приблизно 1 відсотка (ваг/ваг) до приблизно 85 відсотків (ваг/ваг) і згадані сполуки, представлені формулою (Ib) присутні в інтервалі від приблизно 15 відсотків (ваг/ваг) до приблизно 99 відсотків (ваг/ваг), так що загальна сума відсотків таких сполук, представлених формулами (Ia) і (Ib), еквівалентна приблизно 100 відсоткам (ваг/ваг),
або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій.
5. Композиція згідно з пунктом 4, де згадані сполуки, представлені формулами (Ia) і (Ib), є співкристалізованими частково або повністю.
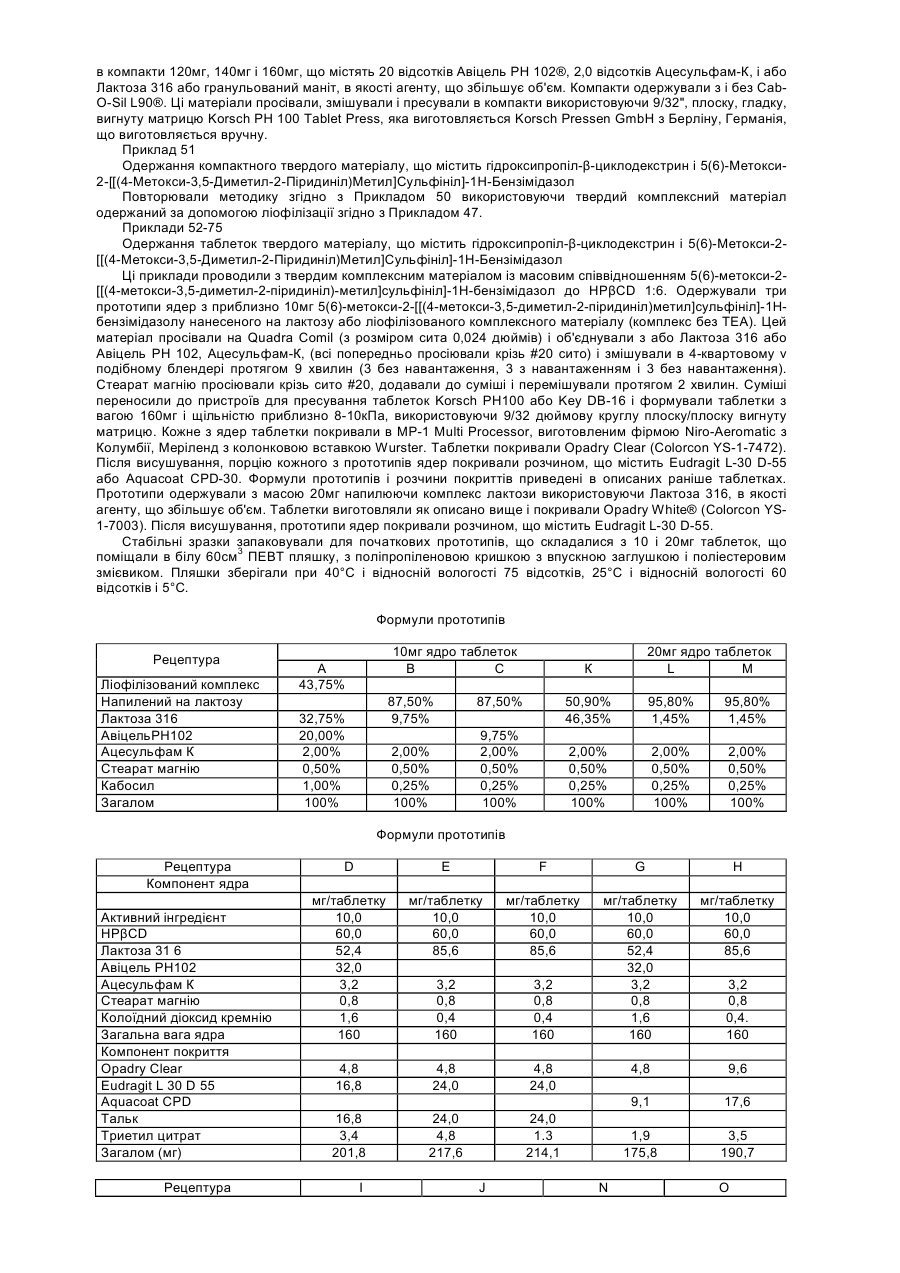
6. Композиція, що містить численні комплекси, де кожний комплекс містить принаймні дві молекули сполук, представлених формулою (Ia) згідно з пунктом 1, де згадані сполуки є однаковими або різними, або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій, і, принаймні, один атом катіону металу для кожної з двох згаданих молекул згаданих сполук і, необов'язково принаймні один залишок розчинника для кожної з двох згаданих молекул згаданих сполук.
7. Композиція згідно з пунктом 6, де згадана композиція є по суті вільною від сполук, представлених формулою (Ib):
, (Ib)
де:
Sx - хіральний атом сірки, що обумовлює існування принаймні одного з діастереомерів представлених Sxa і Sxb, де Sxa є (-) діастереомером і Sxb є (+) діастереомером;
R є алкокси;
R1 вибирають з групи, що містить водень, алкіл, галоген, карбоалкокси, алкокси і алканоїл;
R2 є воднем або алкілом; і
R3, R4 і R5 можуть бути однаковими або різними і кожен вибирають з групи, що містить водень, алкіл, алкокси і алкоксіалкокси,
де, коли R4 є алкокси і ні R3 ні R5 не є воднем, алкільний замісник такої алкоксигрупи вибирають з групи, що містить принаймні один з діастереомерів, представлених R4q і R4z; де R4q є (-) діастереомером і лежить вище площини хіральності; і R4z є (+) діастереомером і лежить нижче площини хіральності;
або однієї або більшої кількості їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій згаданих сполук, представлених формулою (Ib).
8. Композиція, що містить численні комплекси, де кожний комплекс містить принаймні дві однакові або різні молекули, у співвідношенні 1 до 1 молекули сполуки, що представлена формулою (Ia):
, (Ia)
де:
Sx - хіральний атом сірки, що обумовлює існування принаймні одного з діастереомерів, представлених Sxa і Sxb, де Sxa є (-) діастереомером і Sхb є (+) діастереомером;
R є алкокси;
R1 вибирають з групи, що містить водень, алкіл, галоген, карбоалкокси, алкокси і алканоїл;
R2 є воднем або алкілом; і
R3, R4 і R5 можуть бути однаковими або різними і кожен вибирають з групи, що містить водень, алкіл, алкокси і алкоксіалкокси,
де, коли R4 є алкокси і ні R3 ні R5 не є воднем, алкільний замісник такої алкоксигрупи вибирають з групи, що містить принаймні один з діастереомерів, представлених R4q і R4z; де R4q є (-) діастереомером і лежить вище площини хіральності; і R4z є (+) діастереомером і лежить нижче площини хіральності;
або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій, до
молекули сполуки, що представлена формулою (Ib):
, (Ib)
де:
Sx - хіральний атом сірки, що обумовлює існування принаймні одного з діастереомерів, представлених Sxa і Sxb, де Sxa є (-) діастереомером і Sxb є (+) діастереомером;
R є алкокси;
R1 вибирають з групи, що містить водень, алкіл, галоген, карбоалкокси, алкокси і алканоїл;
R2 є воднем або алкілом; і
R3, R4 і R5 можуть бути однаковими або різними і кожен вибирають з групи, що містить водень, алкіл, алкокси і алкоксіалкокси,
де, коли R4 є алкокси і ні R3 ні R5 не є воднем, алкільний замісник такої алкоксигрупи вибирають з групи, що містить принаймні один з діастереомерів представлених R4q і R4z; де R4q є (-) діастереомером і лежить вище площини хіральності; і R4z є (+) діастереомером і лежить нижче площини хіральності;
або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій згаданої композиції,
і принаймні один атом катіону металу для кожної з двох згаданих молекул згаданих сполук, представлених формулами (Ia) і (Ib).
9. Композиція згідно з пунктом 8, де згадані сполуки, представлені формулами (Ia) і (Ib), є співкристалізованими частково або повністю.
10. Фармацевтична рецептура, що містить композицію згідно з будь яким з пунктів 1-9 і принаймні один фармацевтично прийнятний носій, розріджувач або наповнювач.
11. Фармацевтична рецептура згідно з пунктом 10, де згаданою сполукою, що представлена формулою (Ia) є 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол і згаданою сполукою, що представлена формулою (Ib), коли присутня, є 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій згаданих сполук, представлених формулою (Ia) і (Ib).
12. Фармацевтична рецептура згідно з пунктом 11 в одиничній дозованій формі, що містить від приблизно 5 мг до приблизно 60 мг активного інгредієнта на одиничну дозу, яким є згадані сполуки, представлені формулою (Ia) і, коли присутні, формули (Ib), або їх фармацевтично прийнятні солі, сольвати, гідрати або комбінації згаданих сполук, представлених формулами (Ia) і (Ib), де згадана одинична дозована рецептура призначена для орального введення у формі капсули або таблетки.
13. Спосіб підвищення біодоступності композиції згідно з будь яким з пунктів 1-9, що полягає у введенні нетоксичної терапевтично ефективної кількості згаданої композиції у поєднанні з принаймні одним циклодекстрином ссавцю, що потребує лікування захворювань, обумовлених секрецією шлункової кислоти.
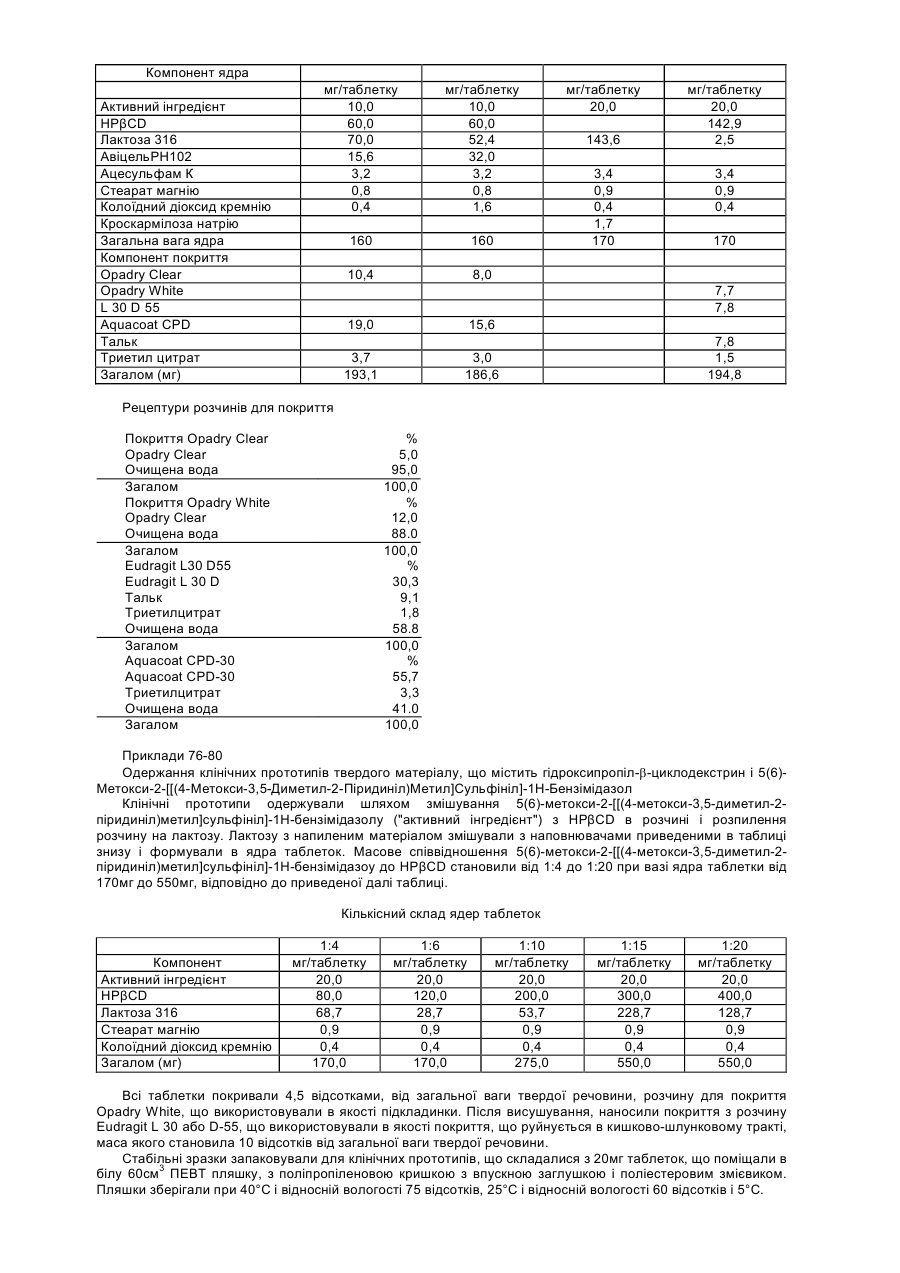
14. Фармацевтична рецептура, що містить композицію згідно з будь яким пунктів 1-9 у поєднанні з принаймні одним циклодекстрином і принаймні одним фармацевтично прийнятним носієм, розріджувачем або наповнювачем.
15. Фармацевтична рецептура згідно з пунктом 14 в одиничній дозованій формі, що містить від приблизно 5 мг до приблизно 60 мг активного інгредієнта на одиничну дозу, яким є згадані композиції з принаймні одним циклодекстрином, де згадана одинична дозована рецептура призначена для орального введення у формі капсули або таблетки.
16. Спосіб інгібування секреції шлункової кислоти у ссавця, що полягає у введенні ссавцю, що потребує лікування, терапевтично ефективної кількості фармацевтичної рецептури згідно з пунктом 10.
17. Спосіб інгібування секреції шлункової кислоти у ссавця, що полягає у введенні ссавцю, що потребує лікування, терапевтично ефективної кількості фармацевтичної рецептури згідно з пунктом 11.
18. Спосіб інгібування секреції шлункової кислоти у ссавця, що полягає у введенні ссавцю, що потребує лікування, терапевтично ефективної кількості фармацевтичної рецептури згідно з пунктом 12.
19. Спосіб інгібування секреції шлункової кислоти у ссавця, що полягає у введенні ссавцю, що потребує лікування, терапевтично ефективної кількості фармацевтичної рецептури згідно з пунктом 14.
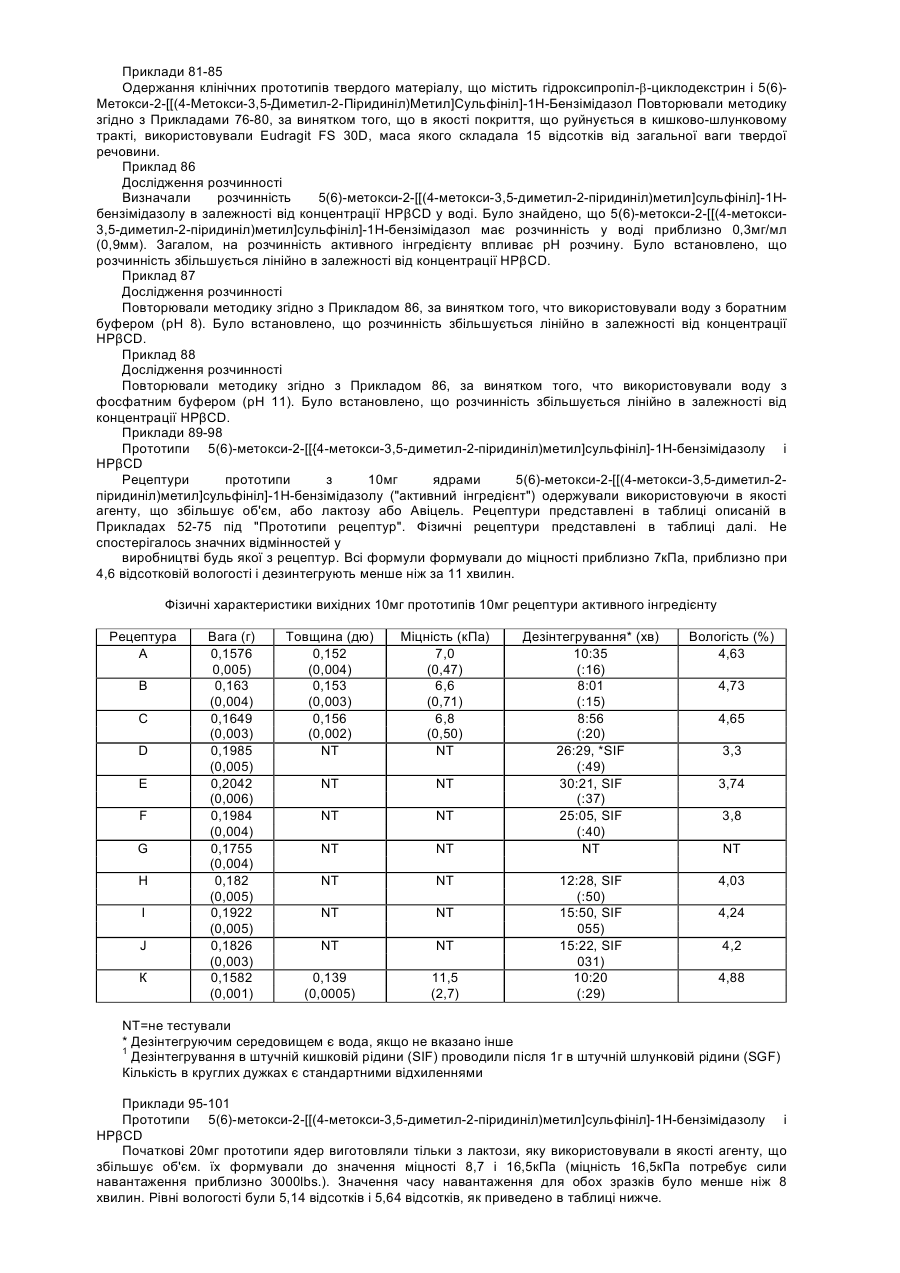
20. Спосіб інгібування секреції шлункової кислоти у ссавця, що полягає у введенні ссавцю, що потребує лікування, терапевтично ефективної кількості фармацевтичної рецептури згідно з пунктом 15.
21. Фармацевтична рецептура, що містить як активний інгредієнт нетоксичну кількість композиції 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу і, необов'язково, 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або їх комбінацій і принаймні один фармацевтично прийнятний носій, розріджувач або наповнювач, де співвідношення згаданого 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу і 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1H-бензімідазолу в згаданій композиції є по суті тим же самим як і співвідношення згаданого 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу і 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу в активному інгредієнті, що використовується в згаданій фармацевтичній рецептурі.
22. Спосіб інгібування секреції шлункової кислоти у ссавця, що полягає у введенні ссавцю, що потребує лікування, терапевтично ефективної кількості фармацевтичної рецептури згідно з пунктом 21.
23. Спосіб підтримання співвідношення активного інгредієнта в композиції, що містить 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол і, необов'язково, 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або їх комбінацій в фармацевтичній рецептурі порівняно із співвідношенням згаданого 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу і 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу в активному фармацевтичному інгредієнті, що використовується у згаданій фармацевтичній рецептурі, що полягає у сухому змішуванні згаданої композиції активного фармацевтичного інгредієнта з принаймні одним фармацевтично прийнятним носієм, розріджувачем, наповнювачем.
24. Суха суміш фармацевтичної рецептури в одиничній дозованій формі, що містить від приблизно 5 мг до приблизно 60 мг активного фармацевтичного інгредієнта на одиничну дозу, яким є 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол або одна або більша кількість його фармацевтично прийнятних солей, сольватів, гідратів або їх комбінацій, в чистій формі, і принаймні один фармацевтично прийнятний носій, розріджувач або наповнювач, де згаданий 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол в згаданій фармацевтичній рецептурі залишається чистим або є по суті вільним від 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу, згаданої фармацевтичної рецептури в одиничній дозованій формі, призначеній для орального введення у формі капсули або таблетки.
25. Фармацевтична рецептура згідно з пунктом 24 у формі, призначеній для введення при лікуванні захворювань, обумовлених секрецією шлункової кислоти у ссавців.
26. Суха суміш фармацевтичної рецептури в одиничній дозованій формі, що містить від приблизно 5 мг до приблизно 60 мг активного фармацевтичного інгредієнта на одиничну дозу, яким є композиція, що містить 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол і, необов'язково, 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або їх комбінацій, і принаймні один фармацевтично прийнятний носій, розріджувач або наповнювач, де співвідношення в згаданій композиції 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу і 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1H-бензімідазолу в згаданій рецептурі є по суті тим же самим як і співвідношення згаданого 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу і 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу в активному фармацевтичному інгредієнті, що використовується у згаданій фармацевтичній рецептурі, і згадана рецептура в одиничній дозованій формі, призначена для орального введення у формі капсули або таблетки.
Текст
Представлена заявка є частковим продовженням заявки Сполучених Штатів з серійним номером 09/519,976, що подана 7 березня 2000, кожного з пріоритетних пунктів попередньої заявки Сполучених Штатів з серійним номером 60/150,878, що подана 26 серпня 1999, описи яких включені сюди в якості посилання у всій своїй повноті. Винахід стосується нових фармацевтично активних сполук, композицій, що їх містять, їх фармацевтичних рецептур, способів їх одержання і способів їх використання. Відомі різноманітні сполуки, що використовуються для інгібування секреції шлункової кислоти і серед яких слід відзначити заміщені бензімідазоли, одним з яких є омепразол. Омепразол входить до складу комерційно доступної рецептури, такої як PRILOSEC®. Зокрема, патент США №4,255,431 стосується таких заміщених бензімідазолів, що описуються формулою (III) в патенті '431, що начеб то включає омепразол. Також в патенті '431 запропоновані різні способи одержання цих сполук. Європейський патент №0124495 В1 стосується різних солей омепразолу, тобто лужних солей формули (І) описаних в '495, якими є солі літію, натрію, калію, магнію і кальцію, а також способів одержання солей. Способи одержання цих солей можуть включати використання гідроксидів, алкоксидів або амінів, або катіоннообмінників металів. Erlandsson, P., et al. J. Chromatography, 532 (1990) pp. 305-319 стосується розділення (-) і (+) енантіомерів омепразолу за допомогою хроматографії. В цій публікації, розділення передбачає використання хіральної фази на основі целюлози, наприклад, трисфеніпкарбамоїлцелюлози нанесеної на 3-амінопропілсилікагель. Зрозуміло, що для цього розділення можуть бути використані інші схеми і процеси. Публікація РСТ №WO 94/27988 стосується солей окремих енантіомерів омепразолу і способів їх одержання. Спосіб включає розділення двох стереоізомерів суміші діастереомерів ацилоксиметилзаміщеного бензімідазолу, що описується формулою (IV), що приведена в цій публікації, з наступним сольволізом кожного окремого діастереомеру у лужному розчині. Солі окремих енантіомерів одержують і виділяють шляхом нейтралізації водних розчинів солей окремих енантіомерів омепразолу використовуючи нейтралізуючий агент. Публікація РСТ №WO 96/02535 стосується способу енантіоселективного синтезу окремих енантіомерів омепразолу або його солей лужних металів. У способі використовується окислюючий агент і хіральний комплекс титану, який може включати сполуку титану (IV). Публікація РСТ №WO 98/54171 стосується магнієвої солі (-) енантіомеру омепразолу. Публікація Ί71 також стосується способу синтезу вищезгаданої магнієвої солі, також як і калієвої солі (-) омепразолу, що може бути використана в якості проміжної сполуки при одержанні магнієвої солі. Калієва сіль також є корисною при лікуванні шлунково-кишкових захворювань. Патент США №5,386,032 Brandstrom стосується удосконаленого способу синтезу омепразолу, який включає реакцію 5-метокси-2-[(4-метокси-3,5-диметил-2-піридиніл)-метилтіо]-1Н-бензімідазолу з мхлорпероксибензойною кислотою в метиленхлориді. Вивчаючи способи одержання омепразолу, як приведено в цих посиланнях, його солей, його енантіомерів і солей енантіомерів, також як і рецептур, в які можуть бути включені ці сполуки, всі виходять з хімічної структури омепразолу, що була точно визначена і приведена для сполуки або сполук послідовно одержуємих використовуючи приведені методики. Більш особливо, метоксигрупа бензімідазольного кільця, якщо виходити з літератури розташована у 5-положенні омепразолу, рацемічної суміші, і оптично чистий ізомер омепразолу позначають як ес-омепразол або s-омепразол. Винахідниками неочікувано було встановлено складність омепразолу і залежність його біоактивності від раніше невідкиритих і неописаних властивостей. Більш особливо, винахідниками було встановлено, що способи відомі з ранішніх публікацій не призводять до одержання окремої сполуки, що має метоксигрупу у 5-положенні бензімідазольного кільця, як раніше було відомо, тобто ні один з способів попереднього рівня техніки не дає однозначних результатів. Фактично, омепразол, як традиційно склалось, для лікарської речовини (у його твердому вигляді) існує у формі суміші двох фармацевтично активних сполук, в яких метоксигрупа бензімідазольного кільця розташована у 6- і 5-положенні. Крім того, винахідниками було встановлено, що присутність другого хірального центру в площині піридинового кільця в кожній з двох сполук, обумовлює для кожної сполуки існування двох позиційних ізомерів і чотирьох діастереомерів. Тому, представлений винахід стосується цих індивідуальних сполук, також як і їх солей, гідратів, сольватів, їх комбінацій і їх поліморфних форм, композицій, і способів їх одержання, що не є відомими або запропонованими в літературі, фармацевтичних рецептур сполук, композицій, і комплексів представленого винаходу, і способів їх застосування. Представлений винахід стосується сполук представлених формулами (Іа) і (Іb), композицій сполук представлених формулами (Іа) і (Іb), які зазвичай співкристапізуються частково або повністю, у вигляді однієї або більшої кількості їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій таких сполук і композицій, і їх комплексів. Винахід також стосується індивідуальних діастереомерів згаданих сполук і комбінацій таких діастереомерів. Винахід також стосується композицій і фармацевтичних рецептур згаданих сполук. Представлений винахід також стосується способу одержання згаданих сполук. Більш особливо, представлене відкриття стосується нових сполук, особливо сполук представленого винаходу, що мають метоксизамісник у 6-положенні бензімідазольного кільця, і композицій, які містять сполуки, що мають метоксигрупи у 5- і 6-положеннях, відповідно. Неочікувано ці індивідуальні сполуки існують у твердому стані і, крім того, у співкристалізованій формі. Співвідношення вищезгаданих ізомерів можна змінювати і тому винахід також стосується нових сполук, що існують у вигляді суміші з різним співвідношенням діастереомерів, таких сполук. Більш детально це описано нижче. Винахід також стосується способів призначення, таких сполук, композицій, і комплексів представленого винаходу ссавцям, що потребують такого лікування, зазвичай, для лікування захворювань викликаних шлунковою кислотою. Якщо використовується тут, терміни множинні форми солей, сольватів, гідратів, і їм подібні, стосуються двох одиничних і чисельних, наприклад, індивідуальних солей, змішаних солей, одиничних сольватів, змішаних сольватів, одиничних гідратів, змішаних гідратів, і їм подібних, і їх комбінацій. Більш детально ці і інші аспекти винаходу описані нижче. Детальний опис переважних втілень Далі винахід описується в більших деталях з посиланням на його переважні втілення. Однак, ці втілення винаходу визначені формулою винаходу, покликані тільки проілюструвати винахід і не повинні розглядатись як такі, що обмежують його. В одному з аспектів, винахід стосується сполуки представленою формулою (Іа), як викладено нижче. Винахідники неочікувано встановили, що ця сполука у твердому стані не була відома або запропонована раніше. Крім того, ними неочікувано було встановлено, що ця відкрита сполука має окремі хіральні центри у твердому стані: (1) хіральний центр сульфоксидної групи і (2) площина хіральності піридинового замісника цієї сполуки. Більш особливо, ними було встановлено, що коли R4 є алкокси, або іншим прийнятним замісником, так група розташована у фіксованій конфігурації, зазвичай, перпендикулярно площині піридину, що обумовлено стеричними утрудненнями, що викликають два замісника розташовані в R3 і R5 положеннях, при умові, що R3 і R5 не є воднем. Блокована орієнтація цього замісника у твердому стані, переважно метокси, викликана існуванням площини хіральності в якій частина або всі такі замісники, переважно метилзамісник такої переважної метоксигрупи, розташований або вище або нижче несиметричної площини хіральності піридину. Однак, в розчині R4 алкокси замісник, сполук представлених формулами Іа і Іb, необов'язково, зберігає таку орієнтацію. Сполука представлена формулою (Іа) приведена далі: де: Sx представляє хіральний атом сірки, що обумовлює існування, принаймні, одного з діастереомерів представлених Sxa і Sxd, де Sxa є (-) енантіомером і Sxd є (+) енантіомером; R є алкокси; R1 вибирають з групи, що містить водень, алкіл, галоген, карбоалкокси, алкокси і алканоїл; R2 є воднем або алкілом; і R3, R4 і R5 можуть бути однаковими або різними і кожен вибирають з групи, що містить водень, алкіл, алкокси і алкоксиапкокси, де коли R4 є алкокси і ні R3 ні R5 не є воднем, алкільний замісник такої алкоксигрупи вибирають з групи, що містить, принаймні, один з енантіомерів представлених R4q і R4z; де R4q є (-) енантіомером і лежить вище площини хіральності; і R4z є (+) енантіомером і лежить нижче площини хіральності; або одна або більша кількість Їх фармацевтично прийнятних солей, сольватів, гідратів, або комбінацій згаданих сполук(и) представлених формулою (Іа). В одному з втілень, всі R3, R4 і R5 не є воднями. В іншому втіленні, коли два з R3, R4 і R5 є воднями, третій не є метилом. Сполука представлена формулою (Іа) переважно існує у твердому стані. Термін "алкокси" переважно стосується алкоксигруп, що мають до 5 атомів вуглецю, більш переважно, до 3 атомів вуглецю, таких як, наприклад, метокси, етокси, н-пропокси або ізопропокси. Термін "карбоалкокси" переважно стосується карбоалкоксигруп, що мають до 5 атомів вуглецю, таких як, наприклад, карбометокси, карбоетокси, карбопропокси і карбобутокси. Термін "алкоксиалкокси" переважно стосується алкоксиалкоксигруп, що мають до 5 атомів вуглецю, таких як, наприклад, метоксиметокси, етоксиетокси і їм, подібні. Метоксиетокси і їм подібні також включені у це визначення. Термін "алкіл" переважно стосується алкільних груп, що мають до 7 атомів вуглецю, більш переважно, до 4 атомів вуглецю, і їх переважно вибирають з метилу, етилу, н-пропілу, ізопропілу, н-бутилу або ізобутилу. Термін "галоген" стосується хлору, брому, фтору або йоду. Термін "алканоїл", переважно, стосується алканоїльних груп, що мають до 4 атомів вуглецю. Прикладами є форміл, ацетил і пропіоніл. В переважному втіленні, R є метокси; R1 є воднем; R2 є воднем; R3 є метилом; R4 є метокси; і R5 є метилом. Заявники звертають увагу, що на всьому протязі попередньої заявки, по якій заявлений пріоритет, R1 замісник знаходився в 4-положенні сполуки представленої формулою (Іа). Для цілей представленої заявки, бензімідазольне кільце нумерується, таким чином, щоб R1 замісник сполуки формули (Іа) знаходився в 6положенні. Ціллю цією зміни нумерації є приведення її до загальноприйнятої хімічної номенклатури і не має ніякого відношення до розташування замісників сполук описаних в попередній заявці або тут. В різних втіленнях представленого винаходу, сполуки представлені формулою (Іа) можуть існувати у формі різних індивідуальних діастереомерів таких як, наприклад: (а) Sxa-R4q; (б) Sxa-R4z,· (в) Sxb-R4q; і (г) Sxb-F4z, або їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій. Ці набори ознак описують можливі відмінності різних стереоізомерів (діастереомерів) на всьому протязі цього документу, і описуються за допомогою стандартної хімічної номенклатури: (а) Sxa-R4q, (S)-(S), або (-)-(-); (б) Sxa-R4z (S)-(R), або (-)-(+); (в) Sxb-R4q, (R)-(S), або (+)-(-); and (г) Sxb-R4z, (R)-(R). або (+)-(+)· Для цілей представленого винаходу, термін "енантіомер" стосується діастереомерних пар, що не є дзеркальними відображеннями один одного. Термін "енантіомерна пара", якщо використовується тут, стосується пар енантіомерів, що утворюють рацемічну суміш. Прикладами енантіомерних пар є (1) S-S і RR і (2) S-R і R-S сполук формули (Іа) і/або (Іb). Термін "(-) енантіомер" може стосуватись будь якого з діастереомерів S-S або S-R і їх пар. Термін "(+) енантіомер" може стосуватись будь якого з діастереомерів R-R і R-S і їх пар. Переважними втіленнями різних видів сполуки, що представлена формулою (Іа), є сполуки формул (Іаі), (Іаіі), (Іаііі), і (laiv): де Sx є Sxa, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів, або комбінацій згаданої сполуки, що представлена формулою (Іаі); де Sx є Sxa, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів, або комбінацій згаданої сполуки, що представлена формулою (Іаіі); де Sx e Sxb, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів, або комбінацій згаданої сполуки, що представлена формулою (Іаііі); і де Sx є Sxb, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів, або комбінацій згаданої сполуки, що представлена формулою (laiv). Приведені вище сполуки можна одержати використовуючи різні способи включаючи ті, що приведені тут в більших деталях. Також можуть бути використані інші способи. В іншому аспекті, винахід стосується композиції, що містить дві або більшу кількість сполук представлених формулою (Іа), що тут приведена. Зокрема, яка розглядається тут в більших деталях, винахідники забезпечили будь яку комбінацію будь якого з чотирьох діастереомерів в різних кількісних співвідношеннях. де: Sx представляє хіральний атом сірки, що обумовлює існування, принаймні, одного з діастереомерів представлених Sxa і Sxb, де Sxa є (-) енантіомером і Sxb є (+) енантіомером; R є алкокси; R1 вибирають з групи, що містить водень, алкіл, галоген, карбоалкокси, алкокси і алканоїл; R2 є воднем або алкілом; і R3, R4 і R5 можуть бути однаковими або різними і кожен вибирають з групи, що містить водень, алкіл, алкокси і алкоксиалкокси, де коли R4 є алкокси і ні R3 ні R5 не є воднем, алкільний замісник такої алкоксигрупи вибирають з групи, що містить, принаймні, один з енантіомерів представлених R4q і R4z, де R4q є (-) енантіомером і лежить вище площини хірапьності; і R4z є (+) енантіомером і лежить нижче площини хіральності; або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів, або комбінацій згаданих сполук(и) представлених формулою (Іа). Композиції двох або більшої кількості сполук, що можуть містити різні кількості енантіомерів Sxa, Sxd, R4q і R4z. Тут описані способи одержання різних енантіомерів і діастереомерів . В одному з втілень, наприклад, кожний з діастереомерів представлених Sxa і Sxb в сполуках представлених формулою (Іа) присутній в інтервалі від приблизно 0 відсотків (ваг/ваг) до приблизно 100 відсотків (ваг/ваг), так що загальна сума відсотків Sxa і Sxd дорівнює приблизно 100 відсоткам (ваг/ваг). В іншому втіленні, кожний з енантіомерів представлених R4q, і R4z присутній в інтервалі від приблизно 0 відсотків (ваг/ваг) до приблизно 100 відсотків (ваг/ваг), так що загальна сума відсотків Sxa і Sxb дорівнює приблизно 100 відсоткам (ваг/ваг). У вищезгаданих композиціях, кожна з, принаймні, двох сполук може бути тією ж самою або іншою. В композиції може бути присутня будь яка кількість комбінацій індивідуальних діастереомерів або їх комбінацій сполуки, що представлена формулою (Іа). Прикладами таких діастереомерів є наступні: Sxa-R4q; Sxa-R4z; Sxb-R4q; і Sxb-R4z, або їх фармацевтично прийнятні солі, сольвати, гідрати або комбінації сполуки, що представлена формулою (Іа). В різних втіленнях, вищезгадані діастереомери або їх комбінацій можуть бути присутні в такому вигляді, що утворюється рацемічна суміш. В інших втіленнях, діастереомери можуть бути присутні в такому вигляді, що рацемічна суміш не утворюється. В одному з втілень, діастереомерами кожної сполуки представленої формулою (Іа) в композиції є SxaR4q і Sxb-R4z або їх фармацевтично прийнятні солі, сольвати, гідрати, або їх комбінацій сполуки, що представлена формулою (Іа). Ці діастереомери можуть бути присутні в таких кількостях, що композиція утворює рацемічну суміш, або альтернативно, ці діастереомери можуть бути присутні в таких кількостях, що композиція не утворює рацемічної суміші. В іншому втіленні, композиція містить Sxa-R4q і Sxb-R4z або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполуки, що представлена формулою (Іа) може бути, по суті, вільною від діастереомерів Sxa-R4z і Sxb-R4q сполук представлених формулою (Іа). Коли використовується при посиланні на індивідуальні діастереомери в цьому документі, термін "по суті вільний" означає, що композиція, містить сполуки представленого винаходу, що мають такі конкретні діастереомери і діастереомерні пари, що складають не більше ніж приблизно 5 відсотків концентрації сполук, що не мають неконкретні діастереомери і/або діастереомерні пари. В одному з втілень, наприклад, сполуки, що мають ці діастереомери (Sxa-R4q, і Sxb-R4z) взагалі утворюють композиції в кристалічній формі, що є вільними або, що більш типово, по суті вільними від сполук, що мають діастереомери Sxa-R4z і Sxb-R4q. В іншому втіленні, діастереомерами кожної з сполук представлених формулою (Іа) в композиції є SxaR4q, і Sxa-R4z, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполуки, що представлена формулою (Іа). В одному з прикладів цього втілення, вищезгадана композиція є, по суті, вільною від сполук представлених формулою (Іа), що має діастереомери представлені Sxb-R4q і/або Sxb-R4z. Зазвичай, ця композиція існує у формі масла, яке при використанні методик описаних тут далі, може утворювати кристали, взагалі мікрокристали, композиції. Таку мікрокристалічну композицію можна одержати зазвичай із значними складностями, використовуючи різні методики, але переважно у формі "солі" такої композиції, яку можна одержати незалежно або, переважно, in situ, як описано далі. Усупереч методиками відомим в цій галузі, способи, що добре відомі для спеціалістів в цій галузі можуть або не можуть давати сіль сполук і композицій представленого винаходу, але можуть, фактично, давати раніше не відомі і не визначені комплекси, які описані тут. Якщо використовується тут, термін "сіль" або "солі", на додаток до його традиційних значень відомих в цій галузі, також стосується таких комплексів, за винятком тих, що інакше тут сформульовані. В іншому втіленні, діастереомерами кожної з сполук представлених формулою (Іа) в композиції є SxbR4z і Sxb-R4q, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполуки, що представлена формулою (Іа). В одному з прикладів цього втілення, вищезгадана композиція є, по суті, вільною від сполук представлених формулою (Іа), що мають діастереомери представлені Sxa-R4z і/або Sxa-R4q. В іншому випадку, сіль такої композиції можна одержати незалежно або, переважно, in situ, як описано тут далі. В іншому втіленні, діастереомерами кожної з сполук представлених формулою (Іа) в композиції є SxaR4q, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполуки, що представлена формулою (Іа). В прикладі цього втілення, композиція є оптично чистою. Термін "оптично чистий" має значення, що є загальноприйнятим в цій галузі і також включає дані або вибрані діастереомери і/або діастереомерні пари, що є, по суті, вільними від інших сполук і/або домішок, що будуть суттєво впливати на оптичне обертання композиції. В іншому прикладі цього втілення, композиція є, по суті, вільною від сполук представлених формулою (Іа), що має діастеомери Sxa-R4z, Sxb-R4q і Sxb-R4z. В іншому втіленні, діастереомерами кожної з сполук представлених формулою (Іа) в композиції є SxaR4z або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполуки, що представлена формулою (Іа). В одному з прикладів цього втілення, композиція є оптично чистою, як тут зазначено. В іншому прикладі цього втілення, композиція є, по суті, вільною від сполук представлених формулою (Іа), що має діастереомери Sxa-R4q, Sxb-R4q і Sxb-R4z. В іншому втіленні, діастереомерами кожної з сполук представлених формулою (Іа) в композиції є SxbR4q, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполуки, що представлена формулою (Іа). В прикладі цього втілення, композиція є оптично чистою як, переважно, тут зазначено. В іншому прикладі цього втілення, композиція є по суті, вільною від сполук представлених формулою (Іа), що має діастереомери Sxa-R4q, Sxa-R4z і Sxb-R4z. В іншому втіленні, діастереомерами кожної з сполук представлених формулою (Іа) в композиції є SxbR4z або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполуки, що представлена формулою (Іа). В прикладі цього втілення, композиція є оптично чистою. В іншому прикладі цього втілення, композиція є по суті, вільною від сполук представлених формулою (Іа), що має діастереомери Sxa-R4q, Sxa-R4z і Sxb-R4q. Сполуки представленого винаходу включають кожний з індивідуальних діастереомерів представлених Sxa-R4q; Sxa-R4z; Sxb-R4q; і Sxb-R4z можуть індивідуально забезпечувати значно більшу біологічну активність при попередженні і/або лікуванні хворобливих станів, що описані тут далі, ніж сполуки представленого винаходу, що мають комбінації таких діастереомерів. Таким чином, способи представленого винаходу забезпечують покращення біологічної активності/ефективності (наприклад, інгібування секрецію шлункової кислоти і, таким чином, лікування розладів продукування шлункової кислоти у ссавців, включаючи людей) фармацевтично активних сполук омепразолу і есомепразолу, як тепер відомо в цій галузі, шляхом призначення такому ссавцю, що потребує лікування, нетоксичної терапевтично ефективної кількості будь якої композиції представленого винаходу, що містить сполуки або композиції представленого винаходу, що мають індивідуальні діастереомери: SxaR4q; Sxa-R4z; Sxb-R4q або Sxb-R4z, або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або їх комбінацій. Також забезпечуються такі способи, де згадані сполуки або комплекси представленого винаходу, мають згадані підібрані індивідуальні діастереомерні пари, по суті, вільні від сполук представленого винаходу, що мають діастереомерні пари інші, ніж ті що згадані підібрані індивідуальні діастереомери. Переважним діастереомером є Sxa-R4q, і особливо переважним діастереомером є Sxa-R4z. Крім того, представлений винахід також забезпечує покращення біологічної активності/ефективності композицій представленого винаходу, що містить сполуки або композиції представленого винаходу, що містять два або більшу кількість діастереомерів: Sxa-R4q; Sxa-R4z; Sxb-R4q або Sxb-R4z, що включає призначення ссавцю, включаючи людей, що потребують інгібування секреції шлункової кислоти і, таким чином, лікування хворобливих станів обумовлених надмірним виділенням шлункової кислоти, будь якої композиції представленого винаходу, що містить сполуки, композиції або комплекси представленого винаходу, що містить індивідуальний діастереомер вибраний з групи, яка містить Sxa-R4q; Sxa-R4z; Sxb-R4q; і Sxb-R4z, або одну або більшу кількість його фармацевтично прийнятних солей, сольватів, гідратів або їх комбінацій. Також забезпечуються такі способи, де згадані сполуки, композиції або комплекси представленого винаходу, містять згаданий підібраний індивідуальний діастереомер по суті вільний від сполук представленого винаходу, що містять діастереомери інші ніж згаданий підібраний індивідуальний діастереомер. В будь якому з вищеприведених втілень, кожна з двох або більшої кількості сполук представлених формулою (Іа), може бути тією ж самою або іншою, при умові, якщо не вказано інше, є, переважно, сполуками формул представлених (Іаі), (Іаіі), (ІаіІі), або (laiv): де Sx є Sxa, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполуки, що представлена формулою (Іаі); де Sx є Sxa, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполуки, що представлена формулою (Іаіі); де Sx є Sxd, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполуки, що представлена формулою (Іаііі); і де Sx є Sxb, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполуки, що представлена формулою (laiv). Інші види сполук представлених формулою (Іа) можуть бути використані для цілей цього винаходу. Будь які втілення здійснюються сполукою(ами) представленою формулою (Іа), у вигляді індивідуальних сполук або композицій і/або комплексів представленого винаходу, або однієї або більшої кількості фармацевтично прийнятних солей, сольватів, гідратів, або їх комбінацій, що зазвичай присутні у кристалічній формі, частково або повністю. В іншому аспекті, винахід також стосується композицій активного фармацевтичного інгредієнту ("АФІ"), що містить будь яку з сполук, композицій або комплексів представленого винаходу, кожна з яких може бути присутня у кристалічній формі, частково або повністю. Переважно, кожна з таких композицій і/або комплексів, що містить сполуки представлені формулою (Іа) може також включати будь яку одну або більшу кількість специфічних сполук представлених формулами (Іаі), (Іаіі), (Іаііі) і (laiv), або їх фармацевтично прийнятних солей, сольватів, гідратів, поліморфів або їх комбінацій, у кристалічній формі, аморфній формі або їх комбінації Кожна може використовуватись в якості основи для будь якої АФІ композиції. Винахід також стосується будь яких композицій описаних тут, що містять дві або більшу кількість сполук формули (Іа), що можуть бути однаковими або різними, і бути, по суті, вільними від сполук представлених формулою (Іb): де: Sx представляє хіральний атом сірки, що обумовлює існування, принаймні, одного з діастереомерів представлених Sxa і Sxb, де Sxa є (-) енантіомером і Sxb є (+) енантіомером; R є алкокси; R1 вибирають з групи, що містить водень, алкіл, галоген, карбоалкокси, алкокси і алканоїл; R2 є воднем або алкілом; і R3, R4 і R5 можуть бути однаковими або різними і кожен вибирають з групи, що містить водень, алкіл, алкокси і алкоксиалкокси, де коли R4 є алкокси і ні R3 ні R5 не є воднем, алкільний замісник такої алкоксигрупи вибирають з групи, що містить, принаймні, один з енантіомерів представлених R4q і R4z; де R4q є (-) енантіомером і лежить вище площини хіральності; і R4z є (+) енантіомером і лежить нижче площини хіральності; або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів, або комбінацій згаданих сполук(и) представлених формулою (Іb). Для цілей винаходу, термін "чистий" стосується сполук формули (Іа), що присутні в таких кількостях, що інші компоненти, включаючи сполуки, що представлені формулою (Іb), присутні в кількостях, що зазвичай менше межі визначення задопомогою загальновідомих технологій, переважно, сполуки формули (Іа) присутні в кількості, принаймні, приблизно 97-98 відсотків (ваг/ваг). Якщо використовується тут, термін "по суті вільна" від сполук формули (Іb), стосується сполук(и) представлених формулою (Іа), переважно, відсоток сполук представлених формулою (Іb) в такій композиції становить менше ніж приблизно 5 відсотків (ваг/ваг), більш переважно приблизно 4 відсотків (ваг/ваг) або менше. В іншому аспекті, який обговорюється тут більш детально, винахідники встановили, що сполуки формул (Іа) і (Іb) зазвичай утворюються таким чином, що опиняються включеними в одну і ту ж кристалічну решітку (тобто, сполуки співкристалізуються, частково або повністю, з розчину). Таким чином, в цьому аспекті, винахід в подальшому стосується композицій, в яких 1:1 співвідношення молекул: (а) сполуки представленої формулою (Іа): де: Sx представляє хіральний атом сірки, що обумовлює існування, принаймні, одного з діастереомерів представлених Sxa і Sxb, де Sxa є (-) енантіомером і Sxb є (+) енантіомером; R є алкокси; R1 вибирають з групи, що містить водень, алкіл, галоген, карбоалкокси, алкокси і алканоїл; R2 є воднем або алкілом; і R3, R4 і R5 можуть бути однаковими або різними і кожен вибирають з групи, що містить водень, алкіл, алкокси і алкоксиалкокси, де коли R4 є алкокси і ні R3 ні R5 не є воднем, алкільний замісник такої алкоксигрупи вибирають з фупи, що містить, принаймні, один з енантіомерів представлених R4q і R4z; де R4q є (-) енантіомером і лежить вище площини хіральності; і R4z є (+) енантіомером і лежить нижче площини хіральності, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів, або їх комбінацій; в комбінації з, і переважно, співкристалізованою з: (b) сполукою представленою формулою (Іb): де: Sx представляє хіральний атом сірки, що обумовлює існування, принаймні, одного з діастереомерів представлених Sxa і Sxb, де Sxa є (-) енантіомером і Sxb є (+) енантіомером; R є апкокси; R1 вибирають з групи, що містить водень, алкіл, галоген, карбоалкокси, апкокси і алканоїл; R2 є воднем або алкілом; і R3, R4 і R5 можуть бути однаковими або різними і кожен вибирають з групи, що містить водень, алкіл, апкокси і алкоксиалкокси, де коли R4 є апкокси і ні R3 ні R5 не є воднем, алкільний замісник такої алкоксигрупи вибирають з групи, що містить, принаймні, один з енантіомерів представлених R4q і R4z; де R4q є (-) енантіомером і лежить вище площини хіральності; і R4z є (+) енантіомером і лежить нижче площини хіральності; де R сполук представлених формулами (Іа) і (Іb) є переважно алкокси замісником; і кожен із замісників Sx, R1, R2, R3, R4 i R5 сполук представлених в кожній з формул (Іа) і (Іb) є переважно однаковими; або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій композицій. Сполуки представлені формулами (Іа) і (Іb) можуть бути однаковими або різними відносно піридинових енантіомерів, але будуть однаковими для сульфоксидних енантіомерів. Будь які вищезгадані композицій можуть містити різні кількості сполук представлених формулами (Іа) і (Іb). В різних втіленнях, наприклад, композиція може містити вищезгадані сполуки, які можуть бути однаковими або різними, в наступних описаних в (а), (б), і (в) співвідношеннях: (а) сполуки представлені формулою (Іа) присутні в інтервалі від приблизно 1 відсотку (ваг/ваг) до приблизно 99 відсотків (ваг/ваг) і сполуки представлені формулою (Іb) присутні в інтервалі від приблизно 1 відсотку (ваг/ваг) до приблизно 99 відсотків (ваг/ваг), так що загальна сума відсотків таких сполук представлених формулами (Іа) і (Іb) еквівалентна приблизно 100 відсоткам (ваг/ваг). Переважно композиція містить сполуки представлені формулою (Іа), що є 6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазолом, яка є, по суті, вільною від сполуки представленою формулою (Іb); (б) сполуки представлені формулою (Іа) присутні в інтервалі від приблизно 96 відсотків (ваг/ваг) до приблизно 99-100 відсотків (ваг/ваг) і сполуки представлені формулою (Іb) присутні в інтервалі від приблизно 0-1 відсотку (ваг/ваг) до приблизно 4 відсотків (ваг/ваг), так що загальна сума відсотків таких сполук представлених формулами (Іа) і (Іb) еквівалентна приблизно 100 відсоткам (ваг/ваг). Переважно (Іа) сполукою для цієї композиції також є 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазол і переважною (Іb) сполукою є 5-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазол; і (в) сполуки представлені формулою (Іа) присутні в інтервалі від приблизно 1 відсотків (ваг/ваг) до приблизно 91 відсотків (ваг/ваг) і сполуки представлені формулою (ІЬ) присутні в інтервалі від приблизно 9 відсотків (ваг/ваг) до приблизно 99 відсотків (ваг/ваг), так що загальна сума відсотків таких сполук представлених формулами (Іа) і (Іb) еквівалентна приблизно 100 відсоткам (ваг/ваг). В одній з переважних композицій, сполуки представлені (Іb) присутні в кількості більше ніж приблизно 15 відсотків. В іншій переважній композиції, сполуки представлені формулою (Іb) присутні в кількості еквівалентній або більшій ніж приблизно 18 відсотків. В кожній такій композиції, переважною (Іа) сполукою є 6-метокси-2-[[(4-метокси3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолом і переважною (Іb) сполукою є 5-метокси-2-[[(4метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол. Кожне з вищезгаданих втілень, що обговорювались в (а), (б) і (в) можуть включати різні комбінації діастереомерів. Такими діастереомерами є наступні: (a) Sxa-R4q, (б) Sxa-R4z (в) Sxb-R4q, або (г) Sxb-R4z, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполук представлених формулами (Іа) і (Іb). Будь які вищезгадані втілення композицій можуть містити, наприклад, наступні пари сполук (lai)-(lbi), (laii)-(lbii), (laiii)-(lbiii) і (laiv)-(lbiv): дє кожен Sx є Sxa; або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій; де кожен Sx є Sxa; або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій; де кожен Sx є Sxb; або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій; і де кожен Sx є Sxb; або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій. В подальшому, сполуки (lai), (laii), (laiii), (laiv), (Ibi), (Ibii), (Ibiii), i (Ibiv) визначені структурами представленими вище. В іншому аспекті, винахід стосується композицій, що містять дві або більшу кількість сполук представлених формулами (Іа) і (Іb), як описано вище, або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполук представлених формулами (Іа) і (Іb). В композиціях і комплексах представленого винаходу, кожна з сполук представлених формулами (Іа) і (Іb) можуть бути однаковими або різними. Вищезгадані композиції можуть містити різні кількості сполук представлених формулами (Іа) і (Іb). В різних втіленнях, наприклад, композиція може містити вищезгадані сполуки, що можуть бути однаковими або різними, у співвідношеннях приведених вище в (а), (б) і (в). Вищезгадані композиції, що містять сполуки представлені формулами (Іа) і (Іb), можуть переважно включати різні відсотки цих сполук. В одному з втілень, наприклад, відсоток сполук представлених формулою (Іb) в композиції є меншим ніж приблизно 40 відсотків (ваг/ваг) і відсоток сполук формули (Іа) є таким, що сума відсотків таких сполук представлених формулами (Іа) і (Іb) дорівнює приблизно 100 відсоткам (ваг/ваг). В іншому втіленні, відсоток сполук представлених формулою (Іb) у згаданій композиції становить від приблизно 9 відсотків (ваг/ваг) до приблизно 50 відсотків (ваг/ваг) і відсоток сполук формули (Іа) є таким, що сума відсотків таких сполук представлених формулами (Іа) і (Іb) дорівнює приблизно 100 відсоткам (ваг/ваг). Переважно, згаданий відсоток сполук представлених формулою (Іb) становить від приблизно 15 відсотків (ваг/ваг) до приблизно 50 відсотків (ваг/ваг), і більш переважно від приблизно 18 відсотків (ваг/ваг) до приблизно 50 відсотків (ваг/ваг). Така композиція двох або більшої кількості сполук може містити різні кількості енантіомерів Sxa, Sxb, R4q, і R4z. Тут описані способи одержання різних енантіомерів і діастереомерів. В одному з втілень, наприклад, кожен з енантіомерів представлених Sxa і Sxb в сполуках представлених формулою (Іа) присутній в кількості від приблизно 0 відсотків (ваг/ваг) до приблизно 100 відсотків (ваг/ваг), так що загальна сума відсотків Sxa, і Sxb дорівнює приблизно 100 відсоткам (ваг/ваг). В іншому втіленні, кожний з енантіомерів представлених R4q і R4z присутній в кількості від приблизно 0 відсотків (ваг/ваг) до приблизно 100 відсотків (ваг/ваг), так що загальна сума відсотків R4q, і R4z дорівнює приблизно 100 відсоткам (ваг/ваг). В таких композиціях, кожна з принаймні двох сполук, можуть однаковими або різними. В композиції може бути присутня будь яка кількість комбінацій індивідуальних діастереомерів або комбінацій сполуки, що представлена формулою (Іа) . Прикладами таких діастереомерів є наступні: Sxa-R4q; Sxa-R4z; Sxb-R4q; і Sxb-R4z, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій сполуки, що представлена формулами (Іа) і (Іb). В різних втіленнях, вищезгадані діастереомери або їх комбінації можуть бути присутні в таких кількостях, що композиція утворює рацемічну суміш. В інших втіленнях, такі діастереомери можуть бути присутні в таких кількостях, що композиція не утворює рацемічну суміш. В іншому втіленні, діастереомери сполук представлених формулами (Іа) і (Іb), що присутні у вищезгаданих композиціях можуть містити, наприклад, наступні: (a) Sxa-R4q, і (б) Sxb-R4z або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або їх комбінацій. В одному з прикладів цього втілення, композиція утворює рацемічну суміш. В іншому прикладі цього втілення, композиція не утворює рацемічну суміш. В іншому прикладі цього втілення, композиція є по суті вільною від сполук, що мають діастереомери представлені Sxa-R4z і Sxb-R4z. В іншому втіленні, діастереомерами кожної з сполук представлених формулами (Іа) і (Іb) в композиції є Sxa-R4q і Sxa-R4z. або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або їх комбінацій. В одному з прикладів цього втілення, вищезгадана композиція є по суті вільною від сполук представлених формулами (la) i (Ib), що мають діастереомери представлені Sxb-R4q і/або Sxb-R4z. Зазвичай, ця композиція існує у формі масла, яке при використанні методик описаних тут далі, може утворювати кристали, взагалі мікрокристали, композиції. Або ж, сіль такої можна одержати незалежно або, переважно, in situ, як описано далі. В іншому втіленні, діастереомерами сполук представлених формулами (Іа) і (Іb), які присутні у вищезгаданих композиціях можуть бути наступні: (a) Sxb-R4q, і (б) Sxa-R4z, або одна або більша кількість Їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій. В одному з прикладів цього втілення, енантіомер представлений Sxa в кожній сполуці в кожній композиції є присутнім в оптично чистій формі, як тут зазначено. В іншому прикладі цього втілення, композиція є по суті, вільною від сполук, що мають діастереомери представлені Sxa-R4q і Sxb-R4z. Вищезгадані композиції, що містять різні діастереомерні компоненти, можуть бути присутні в різних кількостях. В іншому прикладі вищезгаданих втілень, відсоток енантіомерів представлених R4z для однієї або обох сполук представлених формулами (Іа) і (Іb) складає більше ніж приблизно 5 відсотків (ваг/ваг) і менше ніж приблизно 49 відсотків (ваг/ваг) в сполуках представлених формулами (Іа) і (ІЬ), так що загальна сума відсотків таких енантіомерів представлених R4q і R4z становить приблизно 100 відсотків (ваг/ваг). В іншому прикладі вищезгаданих втілень, відсоток енантіомерів представлених R4z для однієї або обох сполук представлених формулами (Іа) і (Іb) складає більше ніж приблизно 51 відсоток (ваг/ваг) в сполуках представлених формулами (Іа) і (Іb), так що загальна сума відсотків таких енантіомерів представлених R4q і R4z становить приблизно 100 відсотків (ваг/ваг). В іншому втіленні, діастереомерами сполук представлених формулами (Іа) і (Іb), що присутні у вищезгаданих композиціях можуть бути наступні: (a) Sxb-R4q і (б) Sxa-R4z, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій. В одному з прикладів цього втілення, енантіомер представлений Sxb, в кожній сполуці в кожній композиції є присутнім в оптично чистій формі, як тут зазначено. В іншому прикладі цього втілення, композиція є по суті, вільною від сполук, що мають діастереомери представлені Sxa-R4q і Sxb-R4z. Вищезгадані композиції, що містять різні діастереомерні компоненти, можуть бути присутні в різних кількостях. В іншому прикладі вищезгаданих втілень, відсоток енантіомерів представлених R4z для однієї або обох сполук представлених формулами (Іа) і (Іb) складає більше ніж приблизно 5 відсотків (ваг/ваг) і менше ніж приблизно 49 відсотків (ваг/ваг) в сполуках представлених формулами (Іа) і (Іb), так що загальна сума відсотків таких енантіомерів представлених R4q і R4z становить приблизно 100 відсотків (ваг/ваг). В іншому прикладі вищезгаданих втілень, відсоток енантіомерів представлених R4z для однієї або обох сполук представлених формулами (Іа) і (Іb) складає більше ніж приблизно 51 відсоток (ваг/ваг) в сполуках представлених формулами (Іа) і (Іb), так що загальна сума відсотків таких енантіомерів представлених R4q і R4z становить приблизно 100 відсотків (ваг/ваг). В іншому втіленні вищезгаданої композиції, діастереомерами кожної з таких сполук представлених формулами (Іа) і (Іb) є Sxa-R4q, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів, або їх комбінацій. В різних втіленнях композицій винаходу, сполуки представлені формулами (Іа) і (Іb) можуть бути присутні в оптично чистій формі, де термін оптично чистий, переважно, є таким як зазначено тут вище. В іншому прикладі цього втілення, композиція містить сполуки представлені формулами (Іа) і (ІЬ), які є, по суті, вільними від сполук, що мають діастереомери представлені: (a) Sxa-R4z; (б) Sxb-R4q і (в) Sxb-R4z. В іншому втіленні вищезгаданої композиції, діастереомерами кожної з таких сполук представлених формулами (Іа) і (Іb) є Sxa-R4z, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або їх комбінацій. В різних втіленнях композицій винаходу, сполуки представлені формулами (Іа) і (Іb) можуть бути присутні в оптично чистій формі, де термін оптично чистий, переважно, є таким як зазначено тут вище. В іншому прикладі цього втілення, композиція містить сполуки представлені формулами (Іа) і (Іb), які є, по суті, вільними від сполук, що мають діастереомери представлені: (a) Sxa-R4q (б) Sxb-R4q і (в) Sxb-R4z. В іншому втіленні вищезгаданої композиції', діастереомерами кожної з таких сполук представлених формулами (Іа) і (Іb) є Sxb-R4q, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або їх комбінацій. В різних втіленнях композицій винаходу, сполуки представлені формулами (Іа) і (Іb) можуть бути присутні в оптично чистій формі, де термін оптично чистий, переважно, є таким як зазначено тут вище. В іншому прикладі цього втілення, композиція містить сполуки представлені формулами (Іа) і (Іb), які є, по суті, вільними від сполук, що мають діастереомери представлені: (a) Sxa-R4q (б) Sxa-R4z і (в) Sxb-R4z. В іншому втіленні вищезгаданої композиції, діастереомерами кожної з таких сполук представлених формулами (Іа) і (Іb) є Sxb-R4z, або одна або більша кількість їх фармацевтично прийнятних солей, сольватів, гідратів або їх комбінацій. В різних втіленнях композицій винаходу, сполуки представлені формулами (Іа) і (Іb) можуть бути присутні в оптично чистій формі, де термін оптично чистий, переважно, є таким як зазначено тут вище. В іншому прикладі цього втілення, композиція містить сполуки представлені формулами (Іа) і (Іb), які є, по суті, вільними від сполук, що мають діастереомери представлені: (a) Sxa-R4q (б) Sxa-R4z і (в) Sxb-R4q. Будь яка композиція втілень може включати, наприклад, сполуки пар (lai)-(lbi), (Іаіі)-(Ibii), (laiii)-(lbiii), і (laiv)-(lbiv) або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або їх комбінацій, як раніше тут було зазначено. Будь яка така композиція втілень містить будь яку з сполук представлених формулами (Іа) і (ІЬ), окремі види сполук (lai)-(lbi), (laii)-(lbii), (laiii)-(lbiii) і (laiv)-(lbiv), їх діастереомери. або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або їх комбінацій, які можуть бути присутні в кристалічній формі, аморфній формі або їх комбінації. Винахід також стосується композицій активного фармацевтичного інгредієнту ("АФІ"), що містить будь яку вищезгадану композицію втілень. Переважно, будь яка з композицій, що містить сполуки представлені формулами (Іа) і (Іb), може бути використана в будь якій такій АФІ композиції, і може також містити будь які особливі композиції представлені формулами (lai)-(lbi); (laii)-(lbii); (laiii)-(lbiii); і (laiv)-(lbiv) або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів, поліморфів, або їх комбінацій, в кристалічній формі, аморфній формі або у вигляді їх комбінацій. Сполуки представлені формулами (Іа) і (Іb) можуть бути одержані як описано в різних втіленнях. Більш особливо, способи описують одержання сполук в розчині. Присутність або сполук формули (Іа) і/або формул (Іа) і (Іb) в розчині приводить до утворення відповідного таутомеру. Таким чином, ці способи, по суті, описують одержання кожного виду сполук. Однак, представлений винахід стосується нових сполук формул (Іа) і (Іb) і їх відповідних твердих форм. Сполуки представленого винаходу одержують використовуючи різні синтетичні способи. Наприклад, шляхом кристалізації 6-метокси-2-[[(4-метокси-3,5-диме.тил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу (сполука представлена формулою (Іа)) і 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]1Н-бензімідазолу (сполука представлена формулою (Іb)) з розчину, в залежності від кількості сполук представлених формулою (Іа) значно змінюється inter alia швидкість кристалізації. Таким чином, незначні зміни в межах одного процесу, як визначено в попередньому рівні техніці, приводять до не контрольованості процесу або описано, що він регулюється раніше невідомою сполукою представленою формулою (Іа), що добре узгоджується з різними співвідношеннями сполук представлених формулою (Іа) до сполук представлених формулою (Іb). Крім того, як описано тут, коли використовують способи запропоновані в попередньому рівні техніці, утворюються незначні або слідові кількості раніше невідомих сполук. Наприклад, при одержанні такої композції, як зазначено в попередньому параграфі, утворюються із варюваннями і нестійкими співвідношенням раніше невідомі діастереомери Sxa-R4q і Sxb-R4z сполук представлених формулами (Іа) і (Іb). Також утворюються в слідових кількостях, і зазвичай в аморфній формі, сполуки представлені формулами (Іа) і (Іb), що мають раніше невідомі діастереомери Sxa-R4z і Sxb-R4q. Крім того, коли для одержання "солей" таких композицій використовуються способи попереднього рівня техніки, що як відомо можуть приводитидо солей, але можуть також приводити до утворення нових комплексів, що тут описані. Таким чином, способи одержання "омепразолу", також як і "есомепразолу" (позначається S-ізомер "омепразолу") описані в попередньому рівні техніки забезпечують кількісне одержання раніше невідомих і неідентифікованих сполук, що мають фармацевтичну активність, або що використовуються в якості проміжних сполук для одержання фармацевтично активних сполук представленого винаходу, або що використовуються в якості проліків, що перетворюються у активні метаболіти in vivo. Крім того, багато таких способів не завжди можна повторити з одержанням того ж самого результату, при чіткому виконанні методики. Далі приведені втілення описаних способів одержання сполук представленого винаходу. В різних втіленнях, ні R3 ні R5 не є воднем, коли R4 є алкокси. В одному з втілень, сполуки можна одержати окисленням сполуки формули (II): де R є алкокси в 5- або 6-положенні, R1, R2, R3, R4 і R5 мають значення приведені вище, з одержанням сполуки формули (Іа) або (Іb). Окислення атому сірки до сульфінілу (S®O) зазвичай проводять в присутності оксилюючого агенту, що вибирають з групи, яка містить азотну кислоту, пероксид водню, надкислоти, перестери, озон, тетраоксид діазоту, йодозобензол, N-галогенсукцинімід, 1-хлорбензотриазол, т-бутилгіпохлорит, бром діазобіцикло[2,2,2]октановий комплекс, метаперйодат натрію, діоксид селену, діоксид марганцю, хромова кислота, церійамоній нітрат, бром, хлор і сульфурилхлорид. Окислення зазвичай проводять в розчиннику, де окислюючий агент присутній з деяким надлишком по відношенню до продукту окислення. В іншому втіленні, сполука формули (III): де R, R1 і R2 є такими як тут зазначено, і Μ є металом, що вибирають з калію, натрію і літію; може реагувати з сполукою формули (IV): де R3, R4 і R5 мають ті ж самі значення, як зазначено вище, і Ζ є естерифікованою гідроксигрупою, що реагує, з утворенням сполук формули (Iа) і (Іb). В іншому втіленні, сполука формули (V): де R і R1 є такими як тут зазначено і Ζ1 є (=S) або естерифікованою гідроксигрупою, що реагує, де коли Z1 є (=S), Z2 є Η, реагує з сполукою формули (VI): де R2, R3, R4 і R5 мають ті ж самі значення, як зазначено вище, і Z2 є естерифікованою гідроксигрупою, що реагує, або SH, з утворенням проміжної сполуки формули (II), яку потім окислюють з одержанням сполук формул (Іа) і (Іb). В іншому втіленні, сполука формули (VII): де R і R1 є таким як зазначено вище, реагує з сполукою формули (VIII): де R1, R3, R4 і R5 є таким як зазначено вище, з утворенням проміжної сполуки формули (II), яку потім окислюють з одержанням сполук формул (Іа) і (Іb). У згаданих вище реакціях, Z, Z1 і Z2 можуть бути естерифікованою гідроксигрупою, що реагує, яка є гідроксигрупою естерифікованою сильною, неорганічною або органічною кислотою, переважно, галогенводневою кислотою, такою як хлорводнева кислота, бромводнева кислота або йодводнева кислота, також як сірчана кислота або сильна органічна сульфонова кислота, така як, наприклад, сильна ароматична кислота, наприклад, бензолсульфонова кислота, 4-бромбензолсульфонова кислота або 4толуолсульфонова кислота. Вихідні матеріали відомі або можуть, якщо будуть новими, бути одержані відповідно до методик відомих per se. В іншому втіленні, сполуки формули (Іа) і (Іb) можуть бути одержані за допомогою реакції сполуки формули (II): де R, R1, R2, R3, R4 і R5 мають значення приведені вище, з м-хлорпероксибензойною кислотою в метиленхлориді. Реакцію проводять, по суті, при постійному рН. Продукт реакції потім екстрагують з основою (наприклад, NaOH) і водну фазу розділяють з органічною фазою. До одержаної водної фази додають алкілформіат для кристалізації сполук формул (Іа) і (Іb). Винахід також стосується способів одержання композицій сполук представлених формулами (Іа) і (Іb). Як описано тут, винахідниками неочікувано було встановлено, що можна одержати сполуки формул (Іа) і (Іb) в комбінації, переважно, співкристалізовані, частково або повністю, композицій в різних кількостях відносно інших, згідно методик описаних нижче. Винахідники підтвердили, що ЯМР розчину показує таутомерізацію сполук формул (Іа) і (Іb). ЯМР розчину підтверджує, що таутомерізація досягає рівноваги приблизно при співвідношенні 2:1 сполук представлених формулами (Іа) до сполук представлених формулами (Іb). Під час кристалізації і виділення, сполуки формули (Іа) проявляють більшу енергетичну придатність ізомеру і кристалізуються першими. Цей процес рівноваги/кристалізації дозволяє переважне виділення твердої речовини (наприклад, кристалічної) ізомеру сполук формули (Іа). Виходячи з ЯМР дослідження розчину, швидкість обміну протону аміну під час таутомерізації може залежати від рН. Наприклад, додаючи незначну кількість основи, як показав ЯМР швидкість обміну уповільнюється, і спостерігаються два окремі піки протонів для кожного з ароматичних протонів бензімідазолу. Способи одержання композицій, що містять сполуки формул (Іа) і (Іb) описані ту з посилання на деякі втілення. Однак, можуть мати місце варіації цих втілень без відхилення від цих окремих способів представленого винаходу. Винахідники встановили, що композиції сполук формул (Іа) і/або (Іb) можуть утворювати такі співвідношення сполук, що не були описані в попередньому рівні техніці. В одному з втілень, спосіб забезпечує таку сполуку представлену формулою (Іа), що є по суті вільною від її відповідного ізомеру (сполуки формули (Іb)). Переважно, сполуки представлені формулою (Іа) присутні в кількості від приблизно 96 до приблизно 99 відсотків (ваг/ваг). Спосіб зазвичай передбачає спочатку одержання розчину, що містить таутомери формул (Іа) і (Іb) і розчинник. Прикладами розчинників є, але не обмежується, водні розчинники, переважно підлуговані розчинники, такі як , наприклад, вода і аміак, або органічні розчинники. Прикладами органічних розчинників є, але не обмежується, кетони (наприклад, ацетон), нітрильні розчинники (наприклад, ацетонітрил, ацетонітрил/вода), аміни (наприклад, диметилформамід (ДМФА) або піридин), арили (наприклад, толуол), галогенвмісні розчинники (наприклад, метиленхлорид, хлороформ), спирти (наприклад, метанол, етанол), гідроксид амонію, і сірковмісні розчинники (наприклад, диметилсульфоксид (ДМСО)). Також можуть використовуватися суміші вищезгаданих розчинників. Переважно, розчин є насиченим. Розчин повільно випарюють (переважно від приблизно 3 днів до приблизно 7 днів) доки не відбудеться утворення кристалів решітка яких складається з сполук представлених формулами (Іа) і/або (Іb), що зазвичай співкристалізуються. Переважно, відносні кількості сполук формул (Іа) і (Іb), що можуть бути одержані у співкристалізованій формі, можна змінювати шляхом доцільного підбору декількох змінних, але нема необхідності обмежуватись, вибором розчинника, вологості, температури і котролювання швидкості дифузії пара. Вибір розчинника для використання в способі може залежати від різних обставин. Наприклад, хоча не означає зв'язок з теорією, що використання розчинників, що повільно випаровуються (наприклад, ДМФА) і розчинника або розчинників з контролюємим випаровуванням зменшує температуру утворення кристалів з вищим відсотком сполук представлених формулами (Іа) в кристалічній решітці, переважно сполук формули (Іа) чистих або по суті, вільних від сполук представлених формулою (Іb), як тут зазначено. В інших втіленнях, органічні розчинники, такі як, наприклад, метиленхлорид, етанол і хлороформ здатні утворювати кристали з вищим відсотком сполук представлених формулою (Іb) в такій кристалічній решітці, зазвичай від приблизно 20 відсотків (ваг/ваг) до приблизно 50 відсотків (ваг/ваг) сполук представлених формулою (Іb). З усіма іншими факторами, що не протирічать один одному, припускають, що відсоток вологи, що присутня в кристалізаційні камері, безпосередньо пропорційний відсотку сполук представлених формулою (Іb). Підвищення рівня вологості в камері збільшує відсоток сполук представлених формулою (Іb), які включені в кристалічну решітку. З усіма іншими факторами, що не протирічать один одному, температура не має значного впливу на утворення сполук представленого винаходу (наприклад, сполук представлених формулами(Іа) і (Іb)), але може впливати на розмір і чистоту таких кристалів. Зазвичай, температура нижча за кімнатну забезпечує кристали, що мають більший розмір і кращу чистоту. На швидкість кристалізації (наприклад, перекристалізації) також може впливати швидкість випаровування розчинника і цей вплив на способи, що використовуються, добре відомий в цій галузі. В одному з втілень, шляхом витримування зразків сполук представлених формулами (Іа) і (Іb) у оточуючому середовищі, швидкість випаровування повинна збільшуватись і повинно збільшуватись вміст сполук представлених формулою (Іb) в кристалічній решітці. І навпаки, в іншому втіленні, шляхом контролювання (тобто, уповільнення) швидкості випаровування, перекристалізаційні процеси повинні уповільнюватись, і таким чином збільшується вихід сполук представлених формулою (Іа). Таким чином, шляхом різних маніпуляцій описаних тут можна одержати бажаний відсотковий вміст сполук(и) представлених формулами (Іа) і/або (Іb). Наприклад, в одному з переважних втілень, використання ДМФА, зменшення випаровування, зменшення вологості і зниження температури приводить до підвищення відсотків сполуки, що представлена формулою (Іа), переважно від приблизно 96 до приблизно 100 відсотків (ваг/ваг). Кристали, що містять більші відсотки сполуки, що представлена формулою (Іb) можна одержати використовуючи розчинник, що містить хлороформ або метиленхлорид, підвищуючи випаровування і використовуючи кімнатну температуру. Структуру однієї з сполук формули (Іа), і зокрема, 6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазолу, підтверджували за допомогою рентгенівською спектроскопії окремого кристалу одержаного у відповідності з приведеними вище методами. Використовуючи приведені вище спосіб(и) одержання сполуки, що представлена формулою (Іа) в твердому стані, одержували (-) і (+) енантіомери, у вигляді рацемічної суміші, що містить різні кількості діастереомерів, що тут описані. В одному з втілень, винахідниками було встановлено, що (-) і (+) енантіомери можуть переважно містити Sxa-R4q і Sxb-R4z діастереомери. Хоча не означає зв'язок з теорією, в цьому втіленні, дві молекули (тобто, сполуки формул (Іа) і (Іb)) співкристалізуються в основну просторову групу в якій молекули пов'язані одна з одною через центр інверсії і зв'язані за допомогою водневого зв'язку воднів аміногрупи і сульфоксидиних киснів. Метильна група R4 метокси безпосередньо направлена в центр місткового комплексу. Аналіз контактних відстаней в місці, де повинна знаходитись інша метильна групи метокси показав, що нема відповідного місця в межах кристалічної решітки для співіснування інших діастереомерів (Sxa-R4z і Sxb-R4q). В цьому втіленні, сполука, що представлена формулою (Іа) може містити приблизно 99 відсотків (ваг/ваг) Sxb-R4z і Sxa-R4q, діастереомерів і відсоток, що залишився, належить іншим компонентам, якими можуть бути, наприклад, діастереомери Sxa-R4z і Sxb-R4q, зазвичай в аморфній формі. У приведеному вище втіленні, кристалізацію сполук представлених формулами (Іа) і (Іb) контролюють термодинамічно шляхом рівноваги бипіримідальної інверсії сульфоксидного хірального центру, яка обумовлює перетворення Sxb-R4q діастереомеру в Sxa-R4q і Sxa-R4z діастереомеру в Sxb-R4z діастереомери. Така поведінка можу бути підтверджена ренгеноструктурним дослідженням структури кристалу, і більш особливо, упаковкою кристалу. Нема пропозицій пов'язаних з теорією, хоча припускають, що молекулярне упакування не забезпечує адекватної площини для інших діастереомерів представлених в межах даної кристалічної решітки. Після одержання композиції, що містить сполуку формули (Іа), як описано вище, можна використати придатну методику розділення індивідуальних (-) і (+) енантіомерів. В подальшому можна використати придатну методику (включаючи, наприклад, ті що описані далі) розділення діастереомерних компонентів (-) і (+) енантіомерів. По відношенню до (-) енантіомерів такої сполуки, що представлена формулою (Іа), в ряді втілень, приведені вище методики придатні для одержання приблизно 95 відсотків (ваг/ваг) Sxa-R4q діастереомеру і приблизно 5 відсотків (ваг/ваг) Sxa-R4z діастереомеру сполуки формули (Іа), зокрема, в специфічному втіленні, в якому описується сполука (Іа) за допомогою сполук формул (Іаі) і (Іаіі). Хоча не означає зв'язок з теорією, припускають, що рівновага бипіримідальної інверсії сульфоксидного хірального центра приводить до перетворення Sxb-R4q діастереомеру в Sxa-R4q діастереомер такої сполуки, що представлена формулою (Іа). Однак, за допомогою методик приведених далі для композиції відокремленого (+) енантіомеру можна одержати переважно Sxb-R4z діастереомер (наприклад, приблизно 95 відсотків (ваг/ваг)). Подібно до одержання Sxa-R4q, діастереомеру, рівновага бипіримідальної інверсії дозволяє перетворити S xa-R4z діастереомер у Sxb-R4z діастереомер. Апьтерантивно, в іншому втіленні, спосіб розділення за допомогою біорозділення дозволяє відокремити (-) енантіомер від (+) енантіомеру, де композиція (-) енантіомеру містить приблизно 50 відсотків (ваг/ваг) Sxa-R4q, діастереомеру і приблизно 50 відсотків (ваг/ваг) Sxa-R4z діастереомеру. Крім того, виділений за допомогою цього способу біосинтезу (+) діастереомер містить приблизно 50 відсотків (ваг/ваг) Sxb-R4q діастереомеру і приблизно 50 відсотків (ваг/ваг) Sxb-R4z діастереомеру. Приведені вище методики можуть також бути використані для співкристалізування металвмісного аналога сполук представлених формулами (Іа) і (Іb) в кількостях, що приведені вище. Повторне розділення таких сполук(и), як припускають, ініціюється бипіримідальною інверсією, яка призводить до утворення діастереомерних компонентів Sxa-R4q, Sxa-R4z, Sxb-R4q, і Sxb-R4z в кількостях, які як припускають, залежать, але потенційно не обмежуються, швидкістю рівноваги бипіримідильної інверсії, часом, який потрібен для утворення металвмісного аналога, і часом, який потрібен для кристалізації аналога. Повинно бути зрозуміло, що цими змінними можна маніпулювати будь який спеціаліст в цій галузі. Переважно, вміст кожного з чотирьох діастереомерів може коливатись від приблизно 60:40 до приблизно 100:0 енантіомерних Sxa-R4z і Sxb-R4z аналогів до Sxa-R4q і Sxb-R4z аналогів. Представлений винахід також стосується способу одержання сполук формули (Іb) в твердому стані. В переважному специфічному втіленні, спосіб включає підвищення рівня сполуки, що представлена формулою (Іb) в композиції, що містить сполуки представлені формулами (Іа) і (Іb). Спосіб включає розмелюванню такої сполуки формули (Іа) і/або формул (Іа) і (Іb) за умов достатніх для твердофазного перетворення таких сполук(и) у сполуку формули (Іb), або, принаймні, композиції, що містить більший відсоток такої сполуки, що представлена формулою (Іb), порівняно з вихідним матеріалом. Переважно, сполука представлена формулою (Іа) присутня в композиції і приведений вище спосіб підвищує відсоток сполуки, що представлена формулою (Іb), що присутня в композиції В цьому втіленні, композиція може містити сполуку представлену формулою (Іа), що по суті є вільною від сполуки, що представлена формулою (Іb), хоча повинно бути зрозуміло, що розглядаються і інші приклади, в яких композиція містить сполуки формул (Іа) і (Іb) в кількостях, що описані далі. Впродовж стадії, що обговорюється, можуть змінюватись різні умови для керування кількістю сполуки, що представлена формулою (Іb), наприклад, обертів на хвилину (ОНХ) і довжиною стадії, що обговорюється. Стадію, що обговорюється, переважно, проводять від приблизно 350онх до приблизно 500онх, більш переважно від приблизно 350онх до приблизно 450онх, і найбільш переважно приблизно 450онх. Переважним часом проведення стадії, що обговорюється, є від приблизно 5 до приблизно 30 хвилин, більш переважно від приблизно 10хв до приблизно 30хв, і найбільш переважно приблизно 15 хвилин. Переважно, сполуки не деградують протягом цієї операції. Стадію, що обговорюється можна провести за допомогою будь якого пристрою, що використовується для подрібнення твердого матеріалу. Переважно, пристроєм є механічниймлин. Один з прикладів придатногомлина описаний в патент США №5,773,173, що належіть Whittle et al., опис якого включений сюди в якості посилання у всій своїй повноті. Повинно бути зрозуміло, що можна використовувати інші втілення ніж ті що описані вище і все же знаходяться в межах способу одержання таких сполук формули (Іb) в твердому стані. Хоча не означає зв'язок з теорією, такі сполуки формули (Іа), як припускають, кристалізуються з незначною кількість аморфної речовини. Однак, коли для розмелювання використовують твердий зразок, що містить сполуку формули (Іа), і в переважному втіленні сполуки формул (Іа) і (Іb), підвищується аморфність зразка, як припускають, в наслідок підвищення кількості сполуки формули (Іb). Знову не означає зв'язок з теорією, припускають, що зразок, який піддається твердофазному перетворенню і "перекристалізації" або трансформації протягом відносного коротку проміжку часу з більш аморфного стану у більш кристалічний стан з наступним розмелюванням. Проте, припускають, що проводячи стадії з багатократним розмелюванням, (тобто, розмелювання чергується з релаксацією) можна одержати твердий зразок, що став більш аморфними і відповідно включає більшу кількість сполуки формули (Іb), на противагу зразку, який зазнав меншу кількість розмелювань. Приведений вище спосіб забезпечує різні кількості сполуки формули (Іb). Структуру сполуки формули (Іb) можна підтвердити використовуючи різноманітні твердофазні методи досліджень, такі як, наприклад, дифракція рентгенівського випромінювання на порошку, метод Рамана, FTIR, твердофазна ЯМР, і термальний аналіз, розмеленого матеріалу і нерозмеленого матеріалу. Наприклад, порівняння двох порошкоподібних зразків показало чітке зменшення інтенсивності уширених піків і підвищення аморфності розмеленого матеріалу. Розмелений матеріал, який є порошкоподібним зразком, показав, що він є більш аморфною сполукою формули (Іb), наприклад, 5-метокси-2-[[(4-метокси3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолом. Представлений винахід також стосується сполук формул (Іа)і (Іb) у формі їх фармацевтично прийнятних солей, як описано далі. Аналогічно до одержання сполук формули (Іа) і/або (Іb), що описані вище, одержання солі кожної з сполук формул (Іа) і/або (Іb) в розчині призводить до утворення солей обох сполук внаслідок таутомерізації, що відбувається в розчині. Таким чином, ці способи описують одержання солей обох родин сполук. В залежності від умов проведення способу і вихідних матеріалів кінцевий продукт способу одержання сполук представлених формулами (Іа) і/або (Іb) зазвичай одержується у вигляді вільної основи. Можна одержати основну, нейтральну або змішану сіль, також як і сольват і гемі-, моно-, сескві-, тетра або полігідрат. Прикладами придатних основ для одержання солей є, але не обмежується, сполуки, що містять лужні метали або лужноземельні метали, хоча для спеціаліста в цій галузі повинно бути зрозуміло, що можуть використовуватись основи, що містять інші метали. Прикладами органічних основ є, але не обмежується, гідроксид натрію, карбонат натрію, бікарбонат натрію, гідроксид калію, гідроксид кальцію, гідроксид магнію, і їм подібні. Також можуть використовуватись основи у формі, наприклад, азотвмісних компонентів. Прикладами азотвмісних сполук є, але не обмежується, аміак, органічні аміни і їм подібні. Вільні основи, що одержуються, можуть утворювати солі з органічними або неорганічними кислотами. Як обговорюється тут в більших деталях, для одержання солей сполук представленого винаходу, переважно, використовують гідриди металів, зокрема, гідрид натрію. Винахідниками були розроблені інші способи, що зазвичай корисні для одержання солей таких сполук, але в цьому випадку приводять до комплексоутворення. Таким чином, спосіб одержання таких солей, в якому використовуються гідриди металів таких сполук не був описаний в попередньому рівні техніці. Кислотноадитивні солі складно одержати внаслідок кислотонестабільної природи сполук винаходу, але можуть бути одержані при рН більше 6,0, при якому підвищується стабільність сполук. Кислотами придатним для одержання таких солей є, але не обмежується, хлорводнева кислота, сульфонова, фосфорна, азотна, і перхлорна кислоти; аліфатичні, аліциклічні, ароматичні, гетероциклічні карбокси або сульфонові кислоти, такі як мурашина, оцтова, пропіонова, бурштинова, щавлева, молочна, малонова, винна, лимонна, аскорбінова, малеїнова, гідроксималеїнова, пірувінова, фенілоцтова, бензойна, памінобензойна, антранілова, п-гідроксибензойна, саліцилова або п-аміносаліцилова кислота, ембонова, метансульфонова, етансульфонова, гідроксиетансульфонова, етиленсульфонова, галогенбензолсульфонова, толуолсульфонова, нафтилсульфонова або сульфанільна кислоти; метіонін, триптофан, лізин або аргінін. Ці і інші солі нових сполук, як наприклад, пікрати, можуть використовуватись в якості очисних агентів при одержанні вільних основ. Солі основ можна одержати внаслідок виділення з розчину і потім можна виділити вільну основу з розчину нової солі в очищеному стані. Оскільки існує зв'язок між новими сполуками у формі вільної основи і їх солями зрозуміло, що відповідні солі включені в межі винаходу. Солі можна одержати за допомогою різних способів. Наприклад, такі солі можна одержати з органічних сполук, коли така сполука має "кислотний" протон. Протон можна видалити, наприклад, за допомогою основи, що дозволяє одержати аніон сполуки якому протистоїть катіон. Припускають, що перетворення у сіль може контролюватись за допомогою різних рКа у втіленнях, з полярним протонним оточенням, таким як луги або гідроксиди лужних металів, або алкоксиди лужних металів присутні в спирті або суміші органічних розчинників, таких як 2-бутанон/толуол. В різних втіленнях, такі способи здатні забезпечити солі представленого винаходу, що мають діастереомери представлені Sxa-R4z і Sxb-R4q в інтервалі від приблизно 60 до приблизно 70 відсотків (ваг/ваг). Інший приклад способу одержання солей сполук представлених формулами (Іа) і/або (Іb) полягає у піддані таких сполук дії полярного апротонного середовища для одержання таких солей. Прикладами полярного апротонного середовища є, наприклад, луги або гідриди лужних металів в органічному розчиннику (наприклад, тетрагідрофуран (ТГФ) або диметилформамід (ДМФА)). Хоча не означає зв'язок з теорією, в полярних апротонних середовищах перетворення солі може контролюватись такими факторами як розчинність як органічної сполуки так і основи, що використовується і стеричні перешкоди взаємодії. Хоча обидва типи реакцій (наприклад, полярні протонні середовища і полярні апротонні середовища) можуть бути використані для одержання солей, реакції переважно проводять в полярному апротонному середовищі. Наприклад, використовуючи полярне апротонне середовище можна, переважно, забезпечити вихід солей сполук і/або композицій представленого винаходу від приблизно 90 до приблизно 95 відсотків (ваг/ваг). Хоча у приведених вище способах можуть використовуватись різні луги і солі лужних металів, переважно, одержують натрієві і магнієві солі сполук представленого винаходу. Зазвичай, до розчину однієї або більшої кількості відібраних сполук і/або композицій представленого винаходу в прийнятному розчиннику додають розчин фільтрованого лугу або гідриду лужного металу, переважно, має концентрацію в мінеральному маслі від приблизно 50% до приблизно 70%, переважно гідрид натрію або магнію, переважно, in situ, і перемішують протягом від приблизно 5 до приблизно 30 хвилин. Одержаний розчин фільтрують, якщо необхідно, і одержану тверду речовину сушать в вакуумі, зазвичай при кімнатній температурі. Одержаний порошок можна перекристалізувати як тут зазначено або як відомо середньому спеціалісту в цій галузі. Альтернативно, попередньо виділені сполуки і/або композиції представленого винаходу додають до розчину відфільтрованого лугу або гідриду лужного металу, що переважно має концентрацію в мінеральному маслі від приблизно 50% до приблизно 70%, переважно гідрид натрію або магнію, перемішують, зазвичай протягом від приблизно 5 до приблизно 15 хвилин, і залишають при кімнатній температурі. Одержують кристалічні солі представленого винаходу. Кожний з способів, в якому використовуються гідриди для одержання солей сполук і композицій представленого винаходу може приводити до значного підвищення/покращення виходу порівняно з способами, що зазвичай використовуються і/або відомі середньому спеціалісту в цій галузі. Крім того, за допомогою інших реакцій можна одержати інші солі. Наприклад, в одному з втілень, використовуючи придатну методику комплекс можна одержати шляхом реакції сполук представлених формулами (Іа) і/або (Іb) з катіоном Az+, наприклад, екстракцією іонної пари. У приведеному вище втіленні, А є літієм, натрієм, калієм, магнієм, кальцієм, титаном (4+), N+(R1)4, або: де R1 є алкільною групою, що містить від 1 до 4 атомів вуглецю, і z є 1, 2 або 4. Наприклад, тетрабутиламонієві солі винаходу можна одержати розчиняючи Αz+ сіль у воді, що містить одну або більшу кількість тетрабутиламонієвих сполук, таких як, наприклад, хлорид або гідроксид, з наступною екстракцією тетрабутиламонієвої солі в метиленхлоридну фазу, і подальшим виділенням тетрабутиламонієвої солі. Таким способом, можна одержати інші тетраалкіламонієві солі. В одному з втілень, сіль сполуки формули (I') можна одержати за допомогою реакції сполуки формули (Іа) і/або (Іb) з основою здатною вивільнювати катіон Αz+, де z є 1, 2 або 4; і А є літієм, натрієм, калієм, магнієм, кальцієм, титаном(4+), N+(R1)4, або: де R1 є алкільною групою, що містить від 1 до 4 атомів вуглецю, з одержанням солі формули (I'): де R є алкокси в 5- або 6-положенні: R1 вибирають з групи, що містить водень, алкіл, галоген, карбоалкокси, алкокси і алканоїл; R2 є воднем або алкілом; і R3, R4 і R5 можуть бути однаковими або різними і кожен вибирають з групи, що містить водень, алкіл, алкокси і алкоксиалкокси, і де z і А2+ є такими як зазначено вище. В одному з прикладів, літієва, калієва або натрієва солі формули (І') можна одержати обробляючи сполуки формули (Іа) і/або (Ib) LiOH, NaOH або КОН у водному або неводному середовищі або LiOR1, UNH2, LiNR12, NaOR1, NaNH2, NaNR12, KOR1, KNH2, KNR12, де R1 є таким як зазначено вище, у водному або неводному середовищі. Магнієві, кальцієві або титанові солі можна одержати обробляючи сполуку формули (Іа) або (Іb) Mg(OR1)2 , Ca(OR1)2, CaH2, Ti(OR1)4 або ТіН4, де R1 є таким як зазначено вище, у неводному розчиннику, такому як спирт (для алкоголятів), або в ефірі, такому як тетрагідрофуран. В іншому прикладі, сіль сполуки формули (I'), де А є: можна одержати обробляючи сполуки представленого винаходу сильною основою формули: що розчинена в розчиннику, такому як, наприклад, спирт. Сіль представлену формулою (I') можна перетворити у іншу сіль з тією ж самою формулою шляхом заміни катіону. Коли і вихідний матеріал і сіль одержана як кінцевий продукт є достатньо розчинними, такий обмін можна провести використовуючи катіообміннісмоли насичені катіоном, що бажаний у продукті. Обмін також можна провести використовуючи нижчу розчинність бажаної солі. Реакцію між сполукою формули (Іа) і/або (Іb) і Az+ також можна провести за допомогою екстракції іонної пари. Наприклад, тетрабутиламонієві солі винаходу можна одержати шляхом розчинення Na+ солі у воді, що містить одну або більшу кількість тетрабутиламонієвих сполук з наступною екстракцією тетрабутиламонієвої солі в метиленхлорид, і подальшим виділенням тетрабутиламонієвої солі. У такий спосіб можна одержати інші тетраалкіламонієві солі. Прикладами радикалу R1 є метил, етил, н-пропіл, н-бутил, ізобутил, втор-бутил і трет-бутил. Переважний спосіб одержання магнієвих солей сполук представленого винаходу характеризується наступними послідовними стадіями: а) обробка розчину, принаймні, однієї сполуки формули (Іа) і/або (Іb) або їх солей апкоголятом магнію; б) виділення неорганічних солей з реакційної суміші; в) кристалізація магнієвих солей сполук формул (Іа) і/або (Іb); г) виділення одержаних кристалічних магнієвих солей і, необов'язково, д) очищення і висушування кристалічних магнієвих солей використовуючи загальновідомі способи. Далі приведений спосіб виробництва магнієвих солей: нижчий спирт, такий як метанол, етанол, нпропанол або ізо-пропанол, переважно метанол, обробляють розчином полярного розчинника із суспендованим магнієм при температурі від приблизно 0°С до температури кипіння. Температура повинна бути переважно від приблизно 10°С до приблизно 40°С. Після додавання магнію до розчину температура може, на другій стадії, підніматися від приблизно 0°С до температури кипіння, переважно від приблизно 20°С до приблизно 50°С. Після завершення реакції, температуру зніжують від приблизно 0°С до приблизно 40°С, переважно від приблизно 10°С до приблизно 25°С. Потім до розчину додають сполуку формули (Іа) і/або (Іb) або їх сіль і після завершення реакції суміш охолоджують від приблизно -10°С до приблизно +20°С, переважно від приблизно -5°С до приблизно +5°С. Потім від приблизно 40 до приблизно 60 відсотків початкового об'єму розчинника випарюють, що приводити до випадіння неорганічної солі. Осад відокремлюють від реакційного розчину, наприклад, за допомогою центрифугування або фільтрування і розчин нагрівають від приблизно 5°С до приблизно 30°С, після чого з розчину випадають магнієві кристали сполуки формули (Іа) і/або (Іb). Для ініціювання кристалізації додають воду, кількість якої приблизно еквівалентна об'єму розчину. Розчин охолоджують від приблизно -10°С до приблизно +20°С, переважно від приблизно 0°С до приблизно 10°С, до повної кристалізації. Кристалі, що утворились відокремлюють від маточного розчину, наприклад, за допомогою центрифугування або фільтрування, і промивають полярними розчинниками, переважно, водним розчином нижчого спирту, таким як водний метанол. В кінці кінців, одержані кристали сушать, переважно, при пониженому тиску і нагріванні. Магнієві солі можуть включати різні кількості сполук формул (Іа) і/або (Іb). Наприклад, в одному з втілень, композиція магнієвої солі може, переважно, містити до приблизно 30 відсотків (ваг/ваг) сполуки формули (Іb), і більш переважно до приблизно 27 відсотків (ваг/ваг) сполуки формули (Іb). В іншому аспекті, винахід також стосується комплексів сполуки, що представлена формулами (Іа) і/або (Іb). Зокрема, винахід стосується композиції, що містить комплекс: (а) двох або більшої кількості сполук, що містяться в композиції описаній вище, що містить сполуки представлені формулами (Іа) і/або (Іb); і, принаймні, один атом катіону металу, переважно, катіон лужного або лужноземельного металу. Приклади катіонів металів вибирають з груп ІА, IIА і ІІІА періодичної таблиці хоча можуть бути використані інші катіони. Переважно, композиція присутня в кристалічні формі. Натрій і магній для кожного з прикладів є переважними катіонами. Такі композиції представленого винаходу можуть використовувати розчинник(и), що зазвичай використовуються при одержанні комплексів. В переважному втіленні, такі композиції в подальшому містять два розчинника. Розчинниками, що здатні віддавати пару електронів є, наприклад, спирти, ТГФ, ДМФА, ДМСО і їх суміші. Комплекси винаходу можна одержати використовуючи матеріали, які зазвичай використовуються для одержання комплексів, наприклад, алкоксиди і гідроксиди металів, таких як, без обмежень, ті що описані вище. Дві або більша кількість сполук представлених формулами (Іа) і/або (Іb) можуть бути однаковими або різними і можуть бути присутні в якості сполук в будь якій з чотирьох діастереомерних конфігурацій (наприклад, Sxa-R4q, Sxa-R4z, Sxb-R4q, і Sxb-R4z)· В основному, комплекси сполук формул (Іа) і/або (Іb) зазвичай включають дві сполуки, що, принаймні, один катіонметалу вказаний тут. Катіон металу зв'язаний з різними прийнятними окремими парами або місцями, що віддають електрон двох сполук, а саме атоми кисню і азоту з посиланням на такі сполуки. В різних переважних втіленнях, такі комплекси також зазвичай включають, принаймні, один "залишок розчинника", які одержують з одного або більшої кількості розчинників описаних тут. В таких комплексах, залишок розчинника зв'язаний з катіоном металу і азоту, що присутній в бензімідазольній частині сполук. Прикладами придатних залишків розчинників є, без обмежень, алкоксиди (наприклад, нижчі (С1С4)алкоксиди), де етоксид є переважним. Відношення катіону металу до сполуки в комплексі винаходу зазвичай залежіть від особливостей структури сполуки і валентності катіону металу. У втіленнях, в яких використовуються залишок розчинника, кількість такого залишку, що використовується, зазвичай залежить від вище згаданих факторів, також як і від типу залишку, що використовується. В преважних втіленнях, співвідношення: (1) сполук формул (Іа) і/або (Іb), як зазначено за допомогою будь якої з сполук (lai), (laii), (laiii), (laiv), (Ibi), (Ibii), (Ibiii) і (Ibiv), відповідно, або їх комбінацій; до (2) однієї або більшої кількості катіонів металів; до (3) залишку розчинника, зазвичай становить 2:1:4 або 2:2:2 для магнію або натрію, відповідно, і може в іншому випадку сильно залежати від катіону металу і сполуки, що використовується, і крім того, відповідно, від сил упакування кристалу. Інші бажані співвідношення можуть залежати від заряду катіону і типу комплексу. В різних втіленнях, композиції, що містять комплекси можуть бути по суті, вільними від сполук представлених формулою (Іb), як тут зазначено. В цих втіленнях, термін "по суті вільний", переважно стосується таких комплексів, що містять в якості катіона металу натрій і містять, принаймні, приблизно 95 відсотків (ваг/ваг) сполуки, що представлена формулою (Іа). Композиції, що містять комплекси описані вище, переважно, існують в кристалічній формі. В деяких втіленнях, композиції, що містять комплекси можуть використовувати діастереомери сполук представлених формулою (Іа) і, якщо можливо, сполуки представлені формулою (Іb), відповідно з будь яким з втілень описаних тут вище. В одному з втілень, що не є обмежуючим, наприклад, концентрація сполук, що мають комбінацію діастереомерів Sxa-R4z і Sxb-R4q становить від приблизно 50 відсотків (ваг/ваг) до приблизно 100 відсотків (ваг/ваг) композиції, і концентрація сполук, що мають комбінацію діастереомерів Sxa-R4q і Sxb-R4z становить від приблизно 0 відсотків (ваг/ваг) до приблизно 50 відсотків (ваг/ваг) композиції, так що загальна сума концентрацій всіх таких сполук дорівнює приблизно 100 відсоткам (ваг/ваг). Переважно, концентрація таких сполук, що мають комбінацію діастереомерних пар Sxa-R4z і Sxa-R4q є більшою ніж приблизно 70 відсотків. Гідрати і сольвати сполук формул (Іа) і (Іb) поряд з їх поліморфними формами також забезпечуються винаходом і можуть бути одержані згідно з способами відомими середньому спеціалісту в фармацевтиці. Як приклад, сольвати будь якого з втілень сполук представлених формулою (Іа) можуть бути одержані згідно з відомими методиками. Придатними розчинниками для використання при одержанні сольватів є відомими в цій галузі і можуть змінюватись в залежності від конкретного втілення. Прикладами розчинників є спирти, такі як, без обмеження, метанол, етанол і їм подібні. Винахід також стосується способу одержання кожного з діастереомерів Sxa-R4q, Sxa-R4z, Sxb-R4q, і Sxa-R4q сполук формул (la) і/або (Ib), або їх пар, в індивідуальній формі. Переважно, в різних втіленнях, кожна діастереомерна пара сполук (Іа) і/або (Іb) є по суті, вільною від трьох інших діастереомерів, або їх комбінацій, наприклад, принаймні, 95 відсотків (ваг/ваг). Як тут зазначено, для сполук (Іа) і (Іb) було встановлена наявність двох різних хіральних центрів: (1) атомний хіральний центр розташований на кожній сульфоксидній групі (яка позначається першою літерою в позначенні діастереомерної пари) і (2) структурний хіральний центр (тобто, площина хіральності) розташована по кожному піримідиновому заміснику сполуки (яка позначається першою літерою в позначенні діастереомерної пари). Переважний спосіб виділення кожної із згаданих вище діастереомерних пар включає спочатку розділення матеріалів з різними структурними хіральними центрами в процесі створення сполук (Іа) і/або (Іb), включаючи ті, що тут приведені. Наприклад, вихідний піридин можна розділити по R4 позиції згаданій тут, або один з піридильних замісників, що містять проміжні сполуки можна розділити по R4 позиції так як, наприклад, тіольну сполуку представлену формулами (II) або (VIII). В цьому випадку, розділення тіольної сполуки здійснюють перед окисленням, яке в кінці кінців дає сполуки формул (Іа) і/або (Іb). Представлені методики розділення структурних хіральних центрів можна проводити за допомогою різних придатних способів. Використовуючи наступне окислення матеріалів в процесі створення сполук (Іа) і/або (Іb) їх розділяють по атомному хіральному центру, в кінці кінців одержуючи кожну з розділених діастереомерних пар сполук (Іа) і/або (Іb). Будь яка з методик може бути використана для розділення за атомними хіральними центрами цих сполук, наприклад, перекристалізацією з оптичноактивним розчинником, використовуючи мікроорганізми, реакції з оптичноактивними кислотами, що утворюють солі, які можуть бути розділені використовуючи різну розчинність діастереомерів. Придатними оптичноактивними кислотами є, наприклад, L- і D-форми винної кислоти, ди-о-толілвинної кислоти, яблучної кислоти, манделової кислоти, камфорсульфонової кислоти або хінної кислоти. В одному з втілень, розділення за атомним хіральним центром сполук формул (Іа) і (Іb) можна провести за допомогою хроматографії. Матеріалами, що можуть бути використані в цьому способі є целюлоза (наприклад, трифенілкарбамоїлцелюлоза) нанесена на кремнійвмісний матеріал, яким заповнена колонка (наприклад, силікагель або 3-амінопропілсилікагель). Колонку можна одержати за допомогою суспендування в органічному розчиннику (наприклад, метанолі або 2-пропанолі) використовуючи прийнятні методики, такі як, наприклад, методику завантаження суспензії. Рухому фазу для використання в цій методиці можна одержати за допомогою різних методик, таких як, наприклад, використання н-гексану і діетиламіну у різних співвідношеннях. Однак, можуть бути використані інші матеріали, таю як, без обмеження, спирти (наприклад, метанол, етанол). Сполуки формули (Іа) і/або (Іb) можна об'єднати з рухомою фазою разом з іншими компонентами відомими в цій галузі, такими як, наприклад, придатний буфер (наприклад, фосфат). Рухому фазу потім пропускають крізь колонку за умов проведення процесу (наприклад, температура, швидкість і тиск), що можуть контролюватись оператором. Діастереомер, що першим елююється з колонки може бути виділений за допомогою випарювання розчинників. Діастереомер може бути виділений за допомогою відомих аналітичних методик. В іншому втіленні, одержання сполук формул (Іа) і/або (Іb), що мають різні атомні хіральні центри можна провести за допомогою асиметричного окислення в органічному розчиннику прохіральних сульфідів формули (X): де R, R1 R2, R3, R4 і R5 є таким як зазначено вище, з R, що знаходиться в 6- або 5-положенні, за допомогою окислюючого агенту і хірального комплексу титану, необов'язково, в присутності основи. Може бути використаний ряд окислюючих агентів, таких як, наприклад, гідропероксид, більш переважно, трет-бутилгідропероксид або гідроксипероксид кумену. Придатний комплекс титану для використання а реакції можна одержати використовуючи різні методи. В одному з втілень, комплекс титану одержують з хірального ліганду і сполуки титану (IV), такої як, наприклад, переважно алкоксид титану (IV), і необов'язково, в присутності води. Особливо переважним апкоксидом титану (IV) є ізопероксид або ізопропоксид титану (IV). Можуть бути використані різні кількості хірального комплекси титану. Зазвичай, переважною є кількість, менша ніж приблизно 0,5 еквівалентів і особливо переважною кількістю є від приблизно 0,05 до приблизно 0,30 еквівалентів. Комплекси титану можна одержати за допомогою реакції тетрахлориду титану з хіральним лігандом в присутності основи. Хірапьним лігандом, що використовується при одержанні комплексу титану, зазвичай, є розгалужений або нерозгапужений алкілдіол або ароматичний діол. Переважним хіральним діолом є, наприклад, естери винної кислоти, особливо, (+)-діетил L-тартрат або (-)-діетил D-тартрат. Слід відзначити, що титановий комплекс можна одержати в присутності сполуки формули (X) або перед додаванням сполуки формули (X) до реакційної колби. Окислення переважно проводять в присутності основи. Наприклад, основа може бути неорганічною або органічною, такою як, але без обмеження, гідрокарбонат, амід або амін, такий як гуанідин або амідин. Прикладами інших основ є триетиламін або Ν,Ν-діізопропілетиламін. Зазвичай, окислення проводять в присутності органічного розчинника. Розчинник можна вибрати в залежності від потрібних умов. Придатними органічними розчинниками є, але не обмежується, толуол, етилацетат, метилетиловий кетон, метилізобутиловий кетон, діетилкарбонат, третбутилметиловий етер, тетрагідрофуран, метиленхлорид і їм подібні, і їх сполучення і суміші. Переважно, окислення проводять в органічному розчиннику при кімнатній температурі або при температурі трохи вищу за кімнатну, наприклад, від приблизно 20°С до приблизно 40°С. Припускають, що час реакції може бути довшим, якщо реакцію проводять при температурі нижче 20°С. Температуру реакції можна змінювати в залежності від намірів спеціаліста в цій галузі. Продукти, що утворюються під час окислення можна екстрагувати водним розчином аміаку або іншою N-вмісною основою для уникнення висадження і/або утворення нерозчинних солей титану. Водну фазу відокремлюють від органічної фази одержаної суміші і відокремлену водну фазу нейтралізують додаючи нейтралізуючий агент, що призводить до протонування діастереомерів. Діастереомери можна екстрагувати органічним розчинником. Вони також можуть кристалізуватись у водному або органічному розчиннику одержуючи бажані розділені діастереомери сполук (Іа) і/або.(Іb). Крім того використовуючи приведені вище методики одержують індивідуальні діастереомери Sxa-R4q, Sxa-R4z, Sxb-R4q, і Sxb-R4z. Ці методики можуть бути використані для одержання різних комбінацій діастереомерів приведених тут, включаючи, без обмеження, тих, що по суті, вільними від інших діастереомерів. Винахід також стосується способів одержання солей діастереомерів J їх пар. Переважний спосіб одержання солей індивідуальних діастереомерів і/або їх пар, спочатку включає одержання цих діастереомерів або їх пар згідно з методиками попереднього розділу, в якій спочатку розділяють за площиною хіральності і потім розділяють по сульфоксидному атомному хіральному центру. Потім можуть бути одержані згідно з різними методиками солі цих розділених діастереомерів або їх пар. Прикладами солей діастереомерів або їх пар, що можуть бути одержані, включають, але не обмежується, солі лужних і лужноземельних металів. Як приклад, для одержання оптичночистих лужних солей сполук формул (Іа) і/або (Іb), діастереомер, одержаний за способом описаним тут, можна обробити: (1) основою, такою як, наприклад, М1+ОН, де М1+ є натрієм, амонієм, калієм або літієм, у водному або неводному середовищі; (2) М1+OR2, де М1+ є таким як зазначено вище, і R2 є алкільною групою, що містить від 1 до 4 атомів вуглецю; або (3) М1+ΝΗ2, де М1+ є таким як зазначено вище. Переважно, для одержання кристалічної форми лужної солі, додають основу М1+ОН в неводному середовищі, такому як суміш 2 бутанону і толуолу. Для одержання оптичночистою солі лужноземельного металу діастереомеру або їх пар сполук формул (Іа) і/або (Іb), оптичночисту сіль лужного металу обробляють водним розчином неорганічної солі лужного металу, такою як, наприклад, М22+СІ2, де М22+ є лужноземельним металом, таким як кальцій, магній, стронцій, барій і їм подібні, внаслідок чого випадає сіль лужноземельного металу окремого енантіомеру. Оптичночисті солі лужноземельного металу також можна одержати обробляючи окремий енантіомер сполук формул (Іа) і/або (Іb) основою, такою як, наприклад, M22+(OR3)2, де R3 є алкільною групою, що містить від 1 до 4 атомів вуглецю, в неводному розчиннику, такому як спирт (для алкаголятів), або в етері, такому як тетрагідрофуран. Переважне втілення одержання магнієвих солей Sxa-R4q, або Sxa-R4z діастереомеру або їх пар полігадратів сполук формул (Іа) і/або (ІЬ) включає: а) обробку магнієвої солі вищезгаданого окремого діастереомеру або їх пар, таких сполук, водою при придатній температурі протягом придатного проміжку часу. Фраза "придатна температура" означає температуру, при якій індукується трансформація вихідного матеріалу у продукт без розкладення будь якої з цих сполук. Прикладами таких придатних температур є, але не обмежується, кімнатна температура. Придатним часом є час за який відбувається найбільше перетворення вихідного матеріалу в продукт і за який не відбувається ніяке розкладення будь якої сполуки, тобто, результатом якого є добрий вихід. Цей придатний час сильно залежить від температури, що використовується, і що добре відомо спеціалісту в цій галузі. Підвищуючи температуру зменшується час необхідний для забезпечення бажаного перетворення. Кількість води, зазвичай, не є критичним параметром і залежить від умов проведення процесу. Магнієві солі вищезгаданих діастереомерів або їх пар полігідратів сполук формул (Іа) і/або (Іb) виділяють з водної суспензії, наприклад, фільтруванням або центрифугуванням і наступного висушування до постійної ваги. Необов'язково, процес може включати: б) окислення сполук формули (II) зазначених тут, за допомогою окислюючого агенту і хірального комплексу титану, необов'язково, в присутності основи. Окислення проводять в органічному розчиннику, наприклад, толуолі або дихлорметані. Неочищений продукт потім перетворюють у відповідну калієву сіль (або, наприклад, натрієву сіль, як заміна калієвих солей) за допомогою обробки джерелом калію, таким як метанольний розчин гідроксиду калію або метанольний розчин метилату калію, з наступним виділенням одержаної солі. Одержану калієву сіль Sxa-R4q або Sxa-R4z діастереомерів, або їх комбінацій, сполук формул (Іа) і/або (Іb) в подальшому перетворюють у відповідні магнієві солі обробляючи джерелом магнію, таким як, наприклад, сульфат магнію в нижчому алкіловому спирті, такому як метанол. Розчин, необов'язково, фільтрують і висаджують осад додаючи розчинник, що не розчиняє, такий як ацетон. Продукт відфільтровують і, необов'язково, промивають водою і продовжують методику, як описано в а) вище. Альтернативно, калієві солі можна обробити джерелом магнію, таким як, наприклад, сульфат магнію у воді і виділити магнієві солі полігідартів діастереомерів Sxa-R4q або Sxa-R4z або їх пар сполук формул (іа) і/або (Іb), або можна використати будь які інші загальновідомі методики перетворення калієвої солі у відповідну магнієву сіль. Калієві солі діастереомерів Sxa-R4q або Sxa-R4z або їх пар сполук формул (Іа) і/або (Іb) є придатними проміжними сполуками одержання магнієвих солей діастереомерів або їх пар. Калієві солі цих діастереомерів також можна використати в якості активних компонентів в фармацевтичних рецептурах, що використовуються при лікуванні різних захворювань описаних тут, зокрема, захворювань викликаних шлунковою кислотою. Використовуючи спектрометр FT-Рамана (Nicolet Nexus 670 з допоміжним приладом FT-Раман, лазер 1064нм, і кроковий пристрій повторного відбору зразків; Nicolet Instruments Соф., Madison, Wisconsin) і спектрографічний метод Рамана встановили кількісне співвідношення 5- і 6-метокси ізомерів омепразолу АФІ, включаючи нові співвідношення таких ізомерів представленого винаходу ("модифіковані сполуки омепразолу"). Представлений спосіб проводять в три стадії: одержання зразків, створення калібровочної кривої і аналіз зразків. Зазвичай, одержують мінімум 4-5 зразків. В представленому способі, було одержано сім зразків використовуючи способи описані в Прикладах 1, 1а, 36, 37, 41 і 44, плюс зразки омепразолу одержані з комерційних джерел і придбані в Фармакопії Сполучених Штатів (USP). На додаток до USP зразків, необхідне використання зразків, які містять менше 5-метокси ізомеру, переважно чистої форми, одна з яких має вище концентрацію 5-метокси ізомеру, таку як від приблизно 40%, і ряд, принаймні, двох інших зразків з розподілом від приблизно 5% до приблизно 25%. Для створення калібровочної кривої кожний зразок проганяють, принаймні, тричі використовуючи кроковий пристрій повторного відбору зразків проводячи безперервно 15 повторень для кожного приготування зразка і 500 сканувань на повтор, використовуючи розділення 2см-1, і силу лазера приблизно 0,7 ват, при інструментальному наборі параметрів приладу для одержання придатних S/N. Для кожного з вибраних зразків, інший ніж "чистий" 6-метокси ізомер, для деконволюції площини піків приблизно при 1365см'1 (5-метокси ізомер) і 1354см"1 (6-метокси ізомер) використовують алгоритм деконволюції (програмне забезпечення само-Фур'є деконволюції; таке як, наприклад, TQ Analyst™ від Nicolet Instruments Corporation). Чистий 6-метокси ізомер (Приклад 1а) показує тільки простий пік при 1354см-1, оскільки концентрація 6-метокси ізомеру становить 100%. Використовуючи такий алгоритм визначали відсоток площини 6-метокси ізомеру в кожному зразку, що містить і 5- і 6-метокси ізомери. Середньоквадратичне відхилення для кожного набору повторень становило менше ніж приблизно 0,7% і середнє середньоквадратичне відхилення для середнього числа всіх прогонів і повторень фіксованого зразку становило менше ніж приблизно 0,7% або одержані дані повинні перевірятись. Для створення калібровочної кривої використовували програмне забезпечення для аналізу спектру Рамана в частині формату найменших квадратів, таке як, наприклад, Nicolet's TQ Analyst™, і використовуючи середні значення визначених відсотків 6-метокси ізомеру і спектр фіксованого зразку. Коефіцієнти кореляції повинні бути такими або вище приблизно 0,98 серед всіх зразків. Кожний АФІ зразок аналізували використовуючи спосіб подібний до описаного для встановлених зразків, за винятком, принаймні, трьох приготувань з, принаймні, п'ятю повтореннями на зразок приготування, і, принаймні, 100 сканувань на повторення з трьома приготуваннями на зразок. Використовуючи вищезгаданий частковий аналіз найменших квадратів, визначали відсоток 6-метокси ізомеру і, таким чином, відсоток 5-метокси ізомеру для кожного сканування і розраховували середній з 15 спектрів. Середньоквадратичне відхилення (SD) для кожного з повторень є меншим ніж приблизно 1,0%, і середнє стандартне відхилення для всіх прогонів і повторень фіксованого зразку є меншим ніж приблизно 1,0%. Якщо середньоквадратичне відхилення є вищим за 1,0%, результати повинні бути переглянуті. Високі значення стандартного відхилення показує коливання, які можуть мати місце у випадку наявності малих кількостей блискучого зразка. Якщо виникла така підозра, приготування повинно бути повторене знову. Використовуючи способи приведенні вище, результати для калібровочної кривої є наступними: Приклад/Зразок Приклад 1а Приклад 1 Середнє відхилення (SD) USP SD Приклад 37 SD Приклад 36 SD Приклад 41 SD Приклад 44 SD Зразок % 5-ізомеру % 6-ізомеру 0,000 100,000 5,875 94,125 0,338 7,250 0,556 12,246 0,505 16,005 0,501 16,414 0,597 41,258 0,328 92,750 87,754 83,995 83,587 58,742 Використовуючи АФІ кількісні способи представлені вище, аналізували три випадково відібрані лоти АФІ омепразолу (комерційні лоти АФІ від Merck and Company, Raway, New Jersey). Результати приведені далі: Зразок/Лот 01 SD 02 SD 03 SD % 5-ізомер 7,50 0,75 8,02 0,56 7,61 0,81 % 6-ізомер 92,50 91,98 92,39 Виходячи з цих даних одержаних за допомогою описаних вище кількісних методів, було підтверджено, що сполука відома як омепразол не є 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]1Н-бензімідазолом, як раніше було встановлено, але, переважно, використовуючи USP стандарт омепразолу, також як і три лоти АФІ омепразолу американського ексклюзивного виробника омепразолу, є фактично (5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолом в точно визначеному співвідношенні приблизно 93:7±приблизно 2% 6-метокси ізомеру і 5-метокси ізомеру, відповідно. Таким чином, представлений винахід стосується чистого 6-метокси-2-[[(4-метокси-3,5-диметил2-піридиніл)метил]сульфініл]-1Н-бензімідазолу (6-метокси омепразол), який є по суті вільним від 5-метокси2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1H-бензімідазолу, і (5)6-метокси-2-[[(4-метокси-3,5диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу в співвідношеннях приведених тут, і в подальшому способів і рецептур описаних тут. Крім того, також був розроблений додатковий спосіб встановлення співвідношення 5- і 6-метокси ізомерів АФІ, хоч менш точний ніж кількісний метод FT-Рамана, що був тут описаний раніше. Цей метод також використовує спектрометр FT-Ремана (Nicolet Nexus 670 з допоміжним приладом FT-Раман, лазер 1064 нм, і кроковий пристрій повторного відбору зразків). Цей метод, також, проводять в три стадії: одержання зразків, створення капібровочної кривої і аналіз зразків. Зазвичай одержують мінімум 4-5 зразків. Представлений метод FT-Рамана для аналізу АФІ і лікарського препарату використовують тим же самим способом, що і описаний вище для одержання і виведення калібровочної кривої, включаючи переважні аспекти, як методу описаного для більш кількісного АФІ методу по відношенню до ряду приготувань, повторів і сканувань на повторення кожного зразка, розділення, пристрою відбору зразків, деконволюції піків зразків, визначення площини піків і середнього відхилення для кожного набору повторень і середнього всіх прогонів і повторень для даного зразка. Переважно, однак, програмне забезпечення здатне аналізувати спектр Рамана у виправленому класичному форматі найменших квадратів, ніж частковий аналіз найменших квадратів, наприклад, Nicolet's TQ Analyst™, використовуючи для одержання калібровочної кривої середні визначені значення відсотків бметокси ізомеру і відношення висоти піку даної пари піків в зразку. Взагалі, метод виконують виходячи із співвідношення піку, що належить 6-метокси ізомеру (приблизно 1627см-1) до придатної внутрішньоїсмуги омепразолу (приблизно 1587см-1). У випадку присутності використовують і величини матриці фармацевтичних наповнювачів в лікарському засобі, що заважають розділенню піку, що належить 6метокси ізомеру і/або переважно внутрішнійсмузі омепразолу, інші наборисмуг, таких як, наприклад, приблизно 1587см-1 і 1201см-1, відповідно, і 1185см-1 і 1512см-1, відповідно. Коефіцієнт кореляції калібровочної кривої серед всіх зразків є біля або вище приблизно 0,95. Для АФІ омепразолу, кожний зразок одержують за тих самих умов, що і стандартні зразки, за винятком того, що переважно використовують, принаймні, три приготування з, принаймні, п'ятю повтореннями на зразок приготування і, принаймні, 100 сканувань на повторення. Використовуючи вищезгаданий виправлений класичний аналіз найменших квадратів, визначали відсоток 6-метокси ізомеру і, таким чином, відсоток 5-метокси ізомеру для кожного сканування і розраховували середнє з 15 спектрів. Середньоквадратичне відхилення для кожного повторення є меншим ніж приблизно 2,0%, і середнє стандартне відхилення всіх прогонів і повторень для даного зразка є меншим ніж приблизно 2,0%. Омепразол зазвичай одержують з капсули і таблеток. Для капсул, достатньою кількістю капсул є переважно приблизно 5-10 капсул, які відкривають і часточки омепразолу висипають в прийнятний контейнер. Контейнер є м'яко розкатаною сумішшю зерняток або порошком, в залежності від обставин, з різних капсул, що забезпечують гомогенну суміш. Для таблетки, достатньою кількістю таблеток є переважно приблизно 5-10 таблеток, що обережно розмелюють (енергійне розмелювання може приводити до виникнення в омепразолі 5- і 6-метокси ізомерів), і змішують забезпечуючи гомогенну суміш розмеленого матеріалу. Кожний прийнятний композитний зразок аналізують за тих же самих умов, що і стандартні зразки, корегуючи відповідну потужність лазеру компенсуючи присутність наповнювачів. Для аналізу FT-Рамана, кожний зразок приготування (композити з капсул або таблеток) проганяли використовуючи, принаймні, три приготування з, принаймні, трьома повтореннями і, принаймні, 500 сканувань на повторення. Використовуючи вищезгаданий виправлений класичний аналіз найменших квадратів, визначали відсоток 6метокси ізомеру і, таким чином, відсоток 5-метокси ізомеру для кожного сканування і розраховували середнє з 9 спектрів. Середньоквадратичне відхилення для кожного повторення є меншим ніж приблизно 3,0%, і середнє стандартне відхилення всіх прогонів і повторень для даного зразка є меншим ніж приблизно 3,0%. Хоча частковий метод найменших квадратів описаний вище для АФІ є більш точним, ніж класичний метод найменших квадратів, деконволюція піків, що належать залишкам 5- і 6-метокси ізомерів є тим ж самими для обох методів і, таким чином, використовують ті ж самі калібровочні криві для кожного з залишків. Результати класичного методу аналізу найменших квадратів АФІ зразку показують трохи меншу системну похибку, ніж результати від використання неповного методу наименьших квадратів, але дані неповного аналізу найменших квадратів зразків АФІ омепразолу підтверджують надійність цього методу для загального кількісного методу визначення співвідношення 5- і 6-метокси ізомерів в омепразолі (Prilosec®), який одержували з комерційних джерел через рецепт. Лікарський засіб, що використовується в представленому класичному методі найменших квадратів, одержували від Merck and Company, Raway, New Jersey. Результати АФІ аналізу трьох випадково відібраних лотів використовуючи попередньоописаний неповний метод найменших квадратів використовуючи класичні методи найменших квадратів є наступними: Зразок/лот 01 SD 02 SD 03 SD % 5-ізомер 6,14 0,97 6,56 1,10 6,40 1.21 % 6-ізомер 93,86 93,44 93,60 При використанні цього класичного аналітичного методу найменших квадратів до лікарського засобу, неочікувано було встановлено, що на співвідношення 5- і 6-метокси ізомерів омепразолу, і таким чином, як припускають інших сполук представлених формулами (Іа) і/або (ІЬ), в якості активного фармацевтичного інгредієнту(ів), під час одержання лікарського засобу може значно впливати велика кількість факторів (кінцева фармацевтична рецептура для призначення, переважно, в одиничній дозованій формі). Для омепразолу зареєстрованого U.S. Food and Drug Administration і, що продається в Сполучених Штатах (Prilosec®), співвідношення 6- і 5-метокси ізомерів в АФІ зазвичай коливається від співвідношення приблизно 93:7 (+/-приблизно 2%), відповідно, до співвідношення лікарського продукту приблизно 86:14 (+/приблизно 3%), відповідно. Фактори, такі як механічні маніпуляції (наприклад, розмелювання або, потенційно, активне просіювання) і, особливо використання зазвичай використовуємого процесу вологого гранулювання під час одержання продукту імовірно впливають на ці суттєві і неочікувані зміни. Таким чином, перетворення більш термодинамічностабільних сполук представленого винаходу, що мають вищий відсоток 6-метокси ізомеру (з переважним вмістом чистого 6-метокси ізомеру) у менш стабільні сполуки представленого винаходу, що мають підвищений вміст 5-метокси ізомеру втій же самій композиції може впливати на стабільність і розчинення лікарського засобу. Сполуки і фармацевтичні рецептури представленого винаходу мають вищий відсоток 6-метокси ізомеру, що забезпечує більшу стабільність, приймаючи до уваги те, що підвищення відсотку 5-метокси ізомеру обумовлює більшу швидкість розчинення. Використовуючи класичний аналітичний метод найменших квадратів описаний вище одержували результати для лікарського засобу Prilosec®, що приведені далі: Доза Prilosec 20мг SD 20мг SD 20мг SD 40мг % 5-ізомер 14,7 2,3 14,5 2,0 14,7 3,0 13,2 % 6-ізомер 85,3 85,5 85,3 86,8 SD 40мг SD 10мг SD 10мг SD 1,6 12,9 0,9 13,6 2,8 13,3 2,4 87,1 86,4 86,7 На додаток, гомогенну суху суміш фармацевтичної рецептури вищезгаданого АФІ омепразолу від Merck and Company і маніт одержували з еквівалентної дози 20мг на дозовону форму, переважно у формі капсули з покриттям, що розчиняється в кишковому тракті, як тут описано. Описаний вище аналітичний метод FTРамана використовують для визначення співвідношення в композиції 6-метокси-2-[[(4-метокси-3,5-диметил2-піридиніл)метил]сульфініл]-1Н-бензімідазолу до 5-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазолу в такій фармацевтичній рецептурі порівнюючи співвідношення таких сполук у відповідному активному фармацевтичному інгредієнті використовуючи класичний аналітичний метод найменших квадратів FT-Рамана для АФІ описаного вище. Неочікувано було встановлено, що співвідношення двох сполук в АФІ (приблизно 93-94%:6-7% 6-метокси ізомеру до 5метокси ізомеру, відповідно) було тим же самим, що і співвідношення композції 6-метокси ізомеру до 5метокси ізомеру в сухій суміші фармацевтичної рецептури. Ці дані були неочікуваними оскільки, як показано вище, відсоток 6-метокси ізомеру омепразолу значно зменшується і відсоток 5-метокси ізомеру значно збільшується, коли таку композицію АФІ Merck and Company формують у лікарський продукт Prilosec®. Таким чином, для того щоб використати переваги вищих вмістів 6- і 5-метокси ізомерів омепразолу описаних тут і щоб підтримати бажане співвідношення 6- і 5-метокси ізомерів композицій і комплексів представленого винаходу в прийнятних лікарських продуктах, включаючи одиничні дозовані форми представлені тут, представлений винахід в подальшому стосується фармацевтичних рецептур, що містять нетоксичну кількість композиції', принаймні, однієї сполуки, що представлена формулою (Іа) і, необов'язково, принаймні, однієї сполуки формули (ІЬ) або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій таких сполук представлених формулами (Іа) і (Іb), і, принаймні, один неводний фармацевтично прийнятний носій, розріджувач або наповнювач, де співвідношення згаданої сполуки, що представлена формулою (Іа) і згаданої сполуки, що представлена формулою (Іb) в згаданій композиції є по суті тим же самим, що і співвідношення згаданої сполуки, що представлена формулою (Іа) і згаданої сполуки, що представлена формулою (Іb) в активному фармацевтичному інгредієнті, що використовується в згаданій фармацевтичній рецептурі. Якщо використовується в цьому контексті, термін "по суті ту ж саму" означає, що співвідношення 6- до 5-метокси ізомерів сполук представлених формулами (Іа) і (Іb) АФІ активного інгредієнту в лікарському продукті, відповідно, не змінюється більше ніж на +/-п'ять відсотків (ваг/ваг). Наприклад, для АФІ, що містить співвідношення 6- до 5-метокси ізомеру приблизно 95:5 (ваг/ваг), співвідношення активного інгредієнту у відповідному лікарському продукті становить від приблизно 100:0 до приблизно 90:10 (ваг/ваг), відповідно. Зазвичай неводними носіями, розріджувачами і наповнювачами є, наприклад, маніт, лактоза і їм подібні. На додаток, будь які сухі змішані рецептури можуть, необов'язково, включати один або більшу кількість стабілізуючих агентів, які добре відомі в цій галузі. Переважним стабілізуючим агентом є гранульований гідроксид натрію, який є гомогенно змішаним з гомогенною сухою змішаною рецептурою представленого винаходу перед одержанням кінцевої дозованої форми. Переважними кінцевими дозованими формами (лікарський продукт) цих сухих змішаних фармацевтичних рецептур є ті, що тільки що тут описані, включаючи переважні одиничні дозовані форми і концентрацій доз. Переважною сполукою представленою формулою (Іа) є 6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазол, в чистій формі, по суті вільний від 5-метокси-2-[[(4-тетокси-3,5диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу, і у вигляді композиції з 5-метокси-2-[[(4-метокси3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу, як тут описано. Переважною сполукою формули (Іb) є 5-метокси-2-[[(4-метокси-3,5-сіітетил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол. Представлений винахід в подальшому стосується фармацевтичних рецептур, в яких присутній згаданий переважний 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол в концентрації менше ніж приблизно 83% (ваг/ваг) і, в іншому переважному втіленні, в концентрації більше ніж приблизно 89% (ваг/ваг), відносно відповідного 5-метокси ізомеру, так що сума 6-метокси ізомеру і 5метокси ізомеру еквівалента 100%. В подальшому винахід стосується способу по суті підтримання бажаного співвідношення активного інгредієнта композиції, що містить сполуку представлену формулою (Іа), переважно, 6-метокси-2-[[(4метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол, і, необов'язково, сполуку представлену формулою (Іb), переважно, 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазол, або одну або більшу кількість їх фармацевтично прийнятних солей, сольватів, гідратів або комбінацій таких сполук, що представлені формулами (Іа) і (Іb), у фармацевтичній рецептурі порівняно із співвідношенням згаданих сполук представлених формулами (Іа) і (Іb) в активному фармацевтичному інгредієнті, що використовується у згаданій фармацевтичній рецептурі, що містить суху суміш згаданої композиції активного фармацевтичного інгредієнту з, принаймні, одним нетоксичним фармацевтично прийнятним носієм розріджувачем або наповнювачем. Переважні композиції і співвідношення згаданих сполук є такими як зазначено вище для лікарського продукту і тут. Такі сухі суміші фармацевтичних рецептур представленого винаходу, зокрема, в одиничній дозованій формі, використовують для лікування захворювань описаних тут. Як такий, представлений винахід в подальшому стосується способів лікування суб'єкту (наприклад, ссавців, зокрема людей), що полягають у призначенні суб'єкту, що потребує лікування (включаючи профілактику) захворювань обумовлених шлунковою кислотою/хворобливих станів шляхом інгібування секреції шлункової кислоти, як в подальшому тут обговорюється, терапевтично ефективної нетоксичної кількості згаданих вище фармацевтичних рецептур. Переважними сполуками і композиціями, в якості активних інгредієнтів одиничних дозованих форм, і дозованих концентратів є ті що тут описані. Представлений винахід також стосується інших фармацевтичних рецептур, що містять, принаймні, один фармацевтично прийнятний інгредієнт представленого винаходу і, принаймні, один фармацевтично прийнятний носій, розріджувач або наповнювач, або їх комбінацію, вибір яких відомий для спеціаліста в цій галузі. Для цілей винаходу, термін "активний інгредієнт" стосується будь якого втілення описаного тут з посиланням на сполуку(и) формул (Іа) і/або (Іb), їх діастереомерів, будь якої комбінації їх діастереомерів, їх фармацевтично прийнятних солей, разом з комплексами, гідратами, сольватами і поліморфними формами будь якої з вище писаних сполук, також як і будь якими їх комбінаціями, також як їх композиціями. Пролікарські форми будь якого з цих активних фармацевтичних інгредієнтів також можуть використовуватись для цілей цього винаходу, більш переважно, як частина фармацевтичної рецептури, де згадана пролікарська форма метаболізує , in vivo, у фармацевтично активну сполуку, хоча їх використання в інших втіленнях може мати місце. Термін "активний інгредієнт" також стосується, в одному з втілень, твердої фармацевтичної композиції представленого винаходу, яка є змішаною з, принаймні, одним фармацевтично прийнятним наповнювачем, розведений наповнювачем або включений в такий наповнювач, що може бути у формі капсули, саше, таблетки, букальної форми, коржика, паперового пакету або інших контейнерів. Коли інертний наповнювач, використовують в якості розріджувача, він може бути твердим, напів-твердим або рідким матеріалом, який виступає в якості розчинника, носія або середовища для активного інгредієнту. Таким чином, рецептури можуть бути у формі таблеток, пілюль, порошків, еліксирів, суспензій, емульсій, розчинів, сиропів, капсул (таких як, наприклад, м'які і тверді желатинові капсули), супозиторіїв, стерильних розчинів для ін'єкцій і стерильно упакованих порошків. Прикладами придатних наповнювачів є, але не обмежується, крохмалі, гуміарабік, силікат кальцію, мікрокристалічна целюлоза, полівінілпіролідон, целюлоза, вода, сироп і метилцелюлоза. Рецептури можуть додатково містити змащуючи агенти, такі як, наприклад, тальк, стеарат магнію і мінеральні маса; змочувальні агенти; емульсифікуючи і суспендуючи агенти; консерванти, такі як метил- і пропілгідроксибензоати; підсолоджувачи; абосмакові агенти. Також можуть ути використані роліоли, буфери і інертні наповнювачі. Прикладами поліолів є, але не обмежується: маніт, сорбіт, ксиліт, цукор, мальтоза, глюкоза, лактоза, декстроза і їм подібні. Придатними буферами є, але не обмежується, фосфат, цитрат, тартрат, сукцинат і їм подібні. Інші інертні наповнювачі, що можуть бути використані включають ті, що відомі в цій галузі і є корисними у виробництві різних дозованих форм. При бажанні, тверда фармацевтична композиція може включати інші компоненти, такі як агенти, що збільшують об'єм і/або гранулюючи агенти і їм подібні. Композиції винаходу можна сформувати так, щоб забезпечити швидке, довготривале або затримане вивільнення активного інгредієнту після призначення пацієнту використовуючи методики, що добре відомі спеціалістам в цій галузі. Коли вищезгадані рецептури використовуються для парентерального введення, такі рецептури, зазвичай, містять стерильні водні і неводні розчини для ін'єкцій, що містять активний інгредієнт, для одержання яких вони є переважно ізотонічними з кров'ю реципієнта, якому вони призначаються. Ці розчини можуть містити антиоксиданти, буфери, анатибактеріальні препарати і розчини, які роблять рецептуру ізотонічною з кров'ю реципієнта, якому вони призначаються. Водні і неводні суспензії можуть включати суспендуючи агенти і агенти, що попереджають зсідання. Рецептури можуть існувати у вигляді одноразових і багаторазових контейнерів, наприклад, герметичні ампули і пробірки. Приготовлені для негайного використання розчини для ін'єкцій і суспензії можуть бути одержані з стерильних порошків, гранул і таблеток, що раніше були тут описані. В деяких втіленнях винаходу, активний інгредієнт можна виготовляти у формі дозованої одиниці для орального призначення. Активний інгредієнт може бути змішаний з твердим тонкорозмеленим носієм, таким як, наприклад, лактоза, цукор, сорбіт, маніт, крохмаль, амілопектин, похідні целюлози або желатин, також як і з антифрикційним агентом, таким як, наприклад, стеарат магнію, стеарат кальцію і поліетіленгліколеві воски. Суміш поті пресують у таблетки. Якщо потрібні покриті таблетки, одержане вище ядро можна покрити концентрованим розчином цукру, який може містити гуміарабік, желатин, такльк, діоксид титану або лаком, розчиненим у леткому органічному розчиннику або суміші розчинників. До цих покриттів можуть додаватись різні барвники для того що можна було розрізнити таблетки з різними активним сполуками або з різними кількостями присутньої активної сполуки. Можна одержати м'які желатинові капсули, які містять суміш активного інгредієнту і рослинну олію або неводні матеріали, що змішуються з водою, такі як, наприклад, поліетіленгліколь і їм подібні. Тверді желатинові капсули можуть містити гранули активного інгредієнту в комбінації з твердим порошкоподібним носієм, таким як, наприклад, лактоза, цукор, сорбіт, маніт, картопляний крохмаль, кукурудзяний крохмаль, амілопектин, похідні целюлози або желатин. Дозовані одиниці для ректального призначення можна одержати у формі супозиторіїв, що містять активний інгредієнт в суміші з нейтральною жировою основою, або їх можна одержати у формі желатинових ректальних капсул, які містять активну речовину в суміші з рослинною олією або парафіновим маслом. Рідкі форми для орального призначення можна одержати у формі сиропів або суспензій, наприклад, розчинів, що містять активний інгредієнт, цукор і суміш етанолу, води, гліцирину і пропіленгліколю. При бажанні, такі рідкі форми можуть містити барвники,смакові агенти і сахарін. Також можуть використовуватись агенти, що збільшують густину, такі як карбоксиметилцелюлоза. Розчини для парентерального введення за допомогою ін'єкції можна одержати у вигляді водного розчину водорозчинної фармацевтично прийнятної солі активного інгредієнту. Ці розчини також можуть містити стабілізатори і/або буфери і можуть бути виготовлені у вигляді ампул з різним дозуванням. Таблетки для орального використання зазвичай одержують наступним чином, хоча можуть бути використані інші методики. Тверді речовини обережно змелюють і просівають до бажаного розміру частинок, і зв'язуючи агент гомогенізують і суспендують у придатному розчині. Активний інгредієнт і допоміжні речовини змішують з розчином зв'язуючого агенту. Одержану суміш зволожують до утворення однорідної суспензії. Зволоження зазвичай сприяє незначній агломерації часточок і одержану масу обережно продавлюють крізь сито з нержавіючої сталі, що має бажані розміри отворів. Шари суміші потім висушують в сушарках з контролюємими умовами протягом визначеного проміжку часу до одержання бажаного розміру часточок і консистенції. Гранули висушеної суміші обережно просівають для видалення порошку, До цієї суміші додають дезінтегратори, антифрикційні і антиадгезивні агенти. В кінці кінців, з суміші пресують таблетки використовуючи машину з придатними формоблоками і матрицями, одержуючи таблетку бажаного розміру. Робочі параметри машини можуть бути вибрані середнім спеціалістом в цій галузі. Зазвичай, одержання коржиків і букальних дозованих форм проводять за методами, що добре відомі спеціалістам в цій галузі. В особливому втіленні, активний інгредієнт можуть бути присутній в ядрі, що оточене одним або більшою кількістю шарів, включаючи шар, що руйнується в кишковому тракті. Відносно утворення ядра, активний інгредієнт змішують з інертним, переважно, водорозчинними звичайними фармацевтично прийнятним компонентами з одержанням переважної концентрації активного інгредієнту в кінцевій суміші з лужною реакцією, в іншому випадку, інертну фармацевтично прийнятну речовину (або речовини), яка дає "мікро-рН" навколо кожної часточки активної сполуки не менше ніж рН 7, переважно, не менше ніж рН 8, коли вода адсорбується часточками суміші або коли незначну кількість води додають до суміші. Такі речовини можна вибрати серед, але не обмежується, натрієвих, калієвих, кальцієвих, магнієвих І алюмінієвих солей фосфорної кислоти, карбонової кислоти, лимонної кислоти або інших придатних неорганічних або органічних кислот; речовин, що зазвичай використовують для нейралізації кислот, таких як гідроксиди алюмінію, кальцію і магнію; оксид магнію або складні речовини, такі як, наприклад, АІ2О3*6МgО СО2*12Н2О, (Мg6АІ2*ОН16СО34Н2О), МgОАІ2О3, 2SiO2*nH2O, де n, необов'язково є цілим числом і може бути менше ніж 2, або подібні сполуки; органічні рН-буферючі реочивини, такі як тригідроксиетиламінометан або інші подібні фармацевитчно прийнятні рН-буферуючі речовини. Для стабілізування високого значення рН порошкоподібній суміші також може використовуватися лужна сіль активної сполуки, така як, але не обмежується, натрієві, калієві, магнієві і кальцієві солі активного інгредієнту, окремо або в комбінації із звичайними буферуючими речовинами, що були описані раніше. Порошкова суміш можна потім сформувати у маленькі кульки, тобто, пілюлі або таблетки, використовуючи загальновідомі фармацевтичні методики. Пілюлі, таблетки або желатинові капсули можуть потім використовуватись в якості ядер в наступних процесах. Реагуючі ядра, що містять активний інгредієнт можуть бути відокремлені від полімеру(ів) покриття, що руйнується в кишковому тракті, і що містять вільні карбоксильні групи, що інакше здатні спричиняти деградацію/знебарвлення активної сполуки під час процесу нанесення покриття або протягом зберігання. Шар, що знаходиться під покриттям (тобто, роздільний/бар'єрний шар), також виступає в якості рНбуферуючої зони, що містить достатню буферну ємність, так що іони водню, що дифузують із зовні до ядра можуть реагувати з гідроксил іонами, що дифузують з ядра до поверхні покритою часточки. рН-буферуючі властивості роздільного шару можуть бути в подальшому підсилені шляхом введення в шар речовин, що вибирають з групи сполук, що зазвичай використовуються в нейтралізуючих кислоти рецептурах описаних вище. Роздільний шар зазвичай складається з однієї або більшої кількості водорозчинних інертних шарів, що необов'язково містять рН-буферуючі речовини. Роздільний шар(и) може наноситись на ядра, зазвичай, у формі пілюль або таблеток, за допомогою загальновідомих методик нанесення покриття в придатних апаратах для нанесення покриття або апаратах з киплячим шаром, використовуючи воду і/або загальновідомі органічні розчинники в якості розчинника для речовини покриття. Матеріал для роздільного шару можна вибрати серед фармацевтично прийнятних водорозчинних інертних сполук або полімерів, що використовуються для цілей плівкового покриття, таких як, наприклад, цукор, поліетилеегліколь, полівінілпіролідон, полівініловий спирт, гідроксипропілцелюлоза, гідроксиметилцелюлоза, гідроксипропілметилцелюлоза або їм подібні. Товщину роздільного шару може визначити середній спеціаліст в цій галузі. У випадку таблеток, може бути використаний інший спосіб нанесення покриття, такий як суха методика. Спочатку одержують таблетку, що містить активний інгредієнт, як тут описано. На таблетку наносять шар використовуючи придатні машини. Зовнішній роздільний шар таблетки містить фармацевтино прийнятні водорозчинні або швидко вододезінтегруючі наповнювачі. В роздільний шар можуть бути включені, звичайні пластифікатори, барвники, діоксид титану, тальк і інші наповнювачі. У випадку желатинових капсул сама желатинова капсула є роздільним шаром. Шар покриття, що руйнується в кишковому тракті, зазвичай наноситься на ядро з покриттям використовуючи загальновідомі методики нанесення покриття, такі як, наприклад, придатні апарати для нанесення покриття або апарати з киплячим шаром, використовуючи розчин полімеру у воді і/або придатному органічному розчиннику або використовуючи латексні суспензії полімерів. Полімерами покриттів, що руйнується в кишковому тракті, що можуть бути використані є, наприклад, фталатацетатцелюлоза, фталатгідроксипропілметилцелюлоза, полівінілацетатфталат, карбоксиметилетилцелюлоза, співполімеризовані метакрилова кислота/метиловий естер метакрилової кислоти, такі як, наприклад, сполуки відомі під торговими назвами EudragitâL 12,5 або Eudragit®L 100 (Rohm Pharma of Darmstadt, Germany), або інші подібні сполуки. Покриття, що руйнується в кишковому тракті, також можна наносити використовуючи дисперсії полімерів у воді, наприклад Aquateric® (FMC Corporation of Chicago, Illinois), Eudragit®L100-55 (Rohm Pharma of Darmstadt, Germany), Coating CE 5142 (BASF of Mount Olive, New Jersey). Шар покриття, що руйнується в кишковому тракті, може, необов'язково, містити фармацевтично прийнятний пластифікатор, такий як, наприклад, цетанол, триацетин, естери лимонної кислоти, такі як, наприклад, ті що відомі під торговими назвами Citroflex® (Pfizer of New York, New York), естери фталевої кислоти, дибутилсукцинат або подібні пластифікатори. Кількість пластифікатору зазвичай оптимізують в залежності від полімеру(ів) покриття, що руйнується в кишковому тракті. В шар покриття, що руйнується в кишковому тракті, також можу бути включені дисперсанти, такі як тальк, барвники і пігменти. Таким чином, рецептури описані за допомогою описаних вище втілень містять ядра, що містять, принаймні, один активний інгредієнт описаний тут, необов'язково, змішаний з лужною сполукою, або ядра містять сіль, принаймні, одного активного інгредієнту або одну або більшу кількість їх енантіомерів, як тут описано, або одну або більшу кількість фармацевтично прийнятних солей, гідратів, сольватів, поліморфів або їх комбінацій, необов'язково, в поєднанні з лужною сполукою. Лужний матеріал ядра і/або лужна сіль активного інгредієнту, як припускають, підвищує стабільність активного інгредієнту. Ядра суспендують у воді у формі розчину або суспензії, які мають рН вищий ніж розчин, в якому розчинений тільки полімеру, що використовується для нанесення покриття, що руйнується в кишковому тракті. На ядра можна нанести інертне водорозчинне або швидко вододезінтегруюче покриття, що необов'язково містить рН-буферуючі речовини, які відокремлюють ядра від шару покриття, що руйнується в кишковому тракті. Без цього відокремлюючого шару, стійкість до дії шлункового соку може бути незначною і/або стійкість дозованої форми при зберіганні буде неприйнятно короткою. На дозовану форму з роздільним покриттям в кінці кінців наносять шар покриття, що руйнується в кишковому тракті, що сприяє зменшенню розчинності дозованої форми в кислому середовищі, але прискорює дезінтеграцію/розчинення в нейтральному або лужному середовищі, такому як, наприклад, рідини, що присутні в проксимальній частині тонкої кишки. Кінцева дозована форма згаданих вище втілень може бути або таблеткою з покриттям, що руйнується в кишковому тракті, або капсулою, або у випадку гранул з покриттям, що руйнується в кишковому тракті, тверді желатинові капсули наповнені гранулами, або саше або гранули сформовані у таблетки. Бажано для збільшення терміну зберігання, щоб вміст води в кінцевій дозованій формі, що містить активний інгредієнт (таблетки з покриттям, що руйнується в кишковому тракті, капсули або гранули) був як можливо меншим. Як наслідок, кінцева упаковка, що містить тверді желатинові капсули наповнені гранулами з покриттям, що руйнується в кишковому тракті, переважно, також містить десикант, який зменшує вміст води в желатиновій оболонці до рівня, при.якому вміст води в гранулах з покриттям, що руйнується в кишковому тракті, що наповнюють капсули не перевищує деякого рівня. Таким чином, сполуки і композиції представленого винаходу, переважно, є сформованими у одиничні дозовані форми, і кожна доза містить від приблизно 5мг до приблизно 60мг, і більш переважно, кількість описану тут. Термін "одинична дозована форма" стосується фізичнодискретних одиниць, таких як капсули або таблетки, що придатні для одиничного призначення людям і іншим ссавцям, кожна одиниця містить попередньо задану кількість однієї або більшої кількості активних інгредієнт(ів), що розрахована для одержання бажаного терапевтичного ефекту, у поєднанні з, принаймні, одним фармацевтично прийнятним носієм, розріджувачем, наповнювачем або їх комбінацією. Зазвичай, переважна доза активного інгредієнту(ів) в такій одиничній дозованій формі складає від приблизно 8мг до приблизно 10мг, приблизно від 16мг до приблизно 20мг, і приблизно від 32мг до приблизно 40мг, особливо 10мг, 20мг і 40мг на одиничну дозу. В іншому аспекті, винахід стосується комплексу, що містить будь які активні інгредієнти, як тут зазначено вище, і, принаймні, один циклодекстрин. Більш переважно, комплекс представляє собою комплекс включення. Якщо використовується тут, термін "активний інгредієнт" стосується будь якого з втілень описаних тут з посиланням на сполуку(и) формул (Іа) і/або (Іb), їх діастереомери, будь які комбінації їх діастереомерів, їх фармацевтично прийнятних солей, разом з комплексами, гідратами, сольватами і поліморфними формами будь яких описаних вище сполук, також як і будь яких їх композицій, і будь яких комбінацій описаних вище. Для цілей винаходу, термін "циклодекстрин" повинен розглядатись широко і включає, без обмеження, апьфа-циклодекстрини, бета-циклодекстрини і гама-циклодекстрини. Прикладом опису циклодекстринів є стаття в The Merck Index, 12th Ed., (p.458) 1996. Як відомо з літератури, циклодекстрини є циклічними олігосахаридами, що зазвичай містять 6, 7 або 8 глюкозних залишків. Глюкозні залишки зв'язані по альфа-1,4-глікозидним зв'язкам. Як наслідок кріслоподібної форми цукрових залишків, всі вторинні гідроксильні групи (наприклад, С2 і С3) розташовані по один бік кільця, в той час як первинна гідроксильна група при С6 розташована по інший бік. Як результат, зовнішні поверхні є гідрофільними, що робить циклодекстрини водорозчинним. На противагу, каверні циклодекстрини є гідрофобними, оскільки вони є лінійчатими, що обумовлено воднями С3, С5 атомів і етероподібними киснями. Також під визначення циклодекстрин попадають похідні циклодекстринів. В різних втіленнях, від 18 до 24 гідроксильних груп відповідних молекул циклодекстрину є вихідними точками для синтезу таких похідних. Використовуючи відомі методики можна одержати метил-, етил-, гідроксиетил-, гідроксиметил, і гідроксипропіл заміщені циклодекстрини. Прикладами циклодекстринів, що можуть бути використані є, без обмеження, гідроксипропіл-бетациклодекстрин, гідроксиетил-бета-циклодекстрин, G2-альфа-циклодекстрин, G2-бета-циклодекстрин, гамациклодекстрин і метил-бета-циклодекстрин. Особливо переважним циклодекстрином є гідроксипропіл-бетациклодекстрин (ΗΡβCD). Також для цілей винаходу можуть використовуватись суміші циклодекстринів. Хоча не спостерігається ніякого зв'язку з теорією, припускають, що водневий зв'язок і/або сили Ван-дерВаальса відповідають за зв'язування в межах комплексу за допомогою водневих зв'язків, що присутні для частини молекули відкритої зовнішньої сторони циклодекстринового кільця. Теорія зв'язків і їх сила описана в літературі і добре відома середньому спеціалісту в цій галузі. Хоча використання циклодекстринів, в якості агентів що сприяють розчиненню відоме в фармацевтиці, досить рідко, використовуються один або більша кількість циклодекстринів для впливу на біодоступність або інші біологічні характеристики активного інгредієнту(ів). Неочикувано було встановлено, що додавання циклодекстрину до АФІ омепразолу значно збільшує і Сmах і, більш важливо, AUC порівняно з рецептурою омепразолу, до якої не включали циклодекстрин. Розчинність сполук представленого винаходу буде змінюватись, але припускають, що для таких сполук покращуються біологічні характеристики, коли вони змішані з циклодекстринами, як тут описано. Таким чином, винахід в подальшому стосується композицій, що містять будь який активний інгредієнт, як тут зазначено, і, принаймні, один циклодекстрин. В одному з втілень, циклодекстрин і активний інгредієнт можуть бути присутні у формі комплексу. В іншому втіленні, циклодекстрин може бути у вільній формі. В іншому аспекті, винахід стосується фармацевтичних рецептур, переважно в одиничній дозованій формі, що містять, принаймні, один активний інгредієнт, як тут зазначено вище, принаймні, один циклодекстрин, і принаймні, один фармацевтично прийнятний носій, розріджувач або наповнювач, що є такими як тут зазначено, вбір яких зможе зробити середній спеціаліст в цій галузі. Ці фармацевтичні рецептури можуть бути присутні в будь якій формі описаній тут або як відому в цій галузі. Особливо переважними є оральні дозовані форми з покриття, що руйнується в кишковому тракті, що включають, принаймні, один активний інгредієнт і, принаймні, один циклодекстрин, переважно, гідроксипропіл-bциклодекстрин. Згадані вище рецептури можуть бути одержані використовуючи методики відомі в цій галузі включаючи, без обмеження, ліофілізаію, сушіння розпиленням і гранулювання розпиленням. Переважно, що в рецептурах активний інгредієнт і циклодекстрин присутні у формі комплексів включення. В одному з втілень, тверді і м'які капсули, що містять, принаймні, один циклодекстрин і активний інгредієнт(и) є особливо переважними для цілей винаходу. Ці рецептури можна одержати згідно з методиками відомими середньому спеціалісту в цій галузі використовуючи загальноприйняті інгредієнти (наприклад, наповнювачи, носи і/або розріджувачи), такі як, без обмеження, що описані тут вище. Наприклад, може бути використаний, принаймні, один фармацевтично прийнятний нетоксичний солюбілізуючий агент. Такими доступними солібілізуючими агентами добре відомі в цій галузі і, зазвичай, представлені родиною сполук відомих як поліетиленгліколі (ПЕГ), що мають молекулярну вагу від приблизно 200 до приблизно 8000. Коли бажані рідкі кінцеві рецептури або використовуються рідини для наповнення м'яких капсул, переважно м'які желатинові капсули, переважна молекулярна вага ПЕГ знаходиться в інтервалі від приблизно 200 до приблизно 600, де ПЕГ 400 є особливо переважними. Коли переважними є напівтверді, особливо для наповнення твердих капсул, переважно тверді желатинові капсули, переважна молекулярна вага ПЕГ становить приблизно 3350, в той час як особливо переважна комбінація включає ПЕГ з молекулярною вагою 3350 плюс ПЕГ з молекулярною вагою 400 для надання капсулі кращих характеристик. Для виготовлення желатинових капсул, що руйнуються в кишковому тракті, використовують високомолекулярний ПЕГ (наприклад, 3350). Рецептури можуть включати різні кількості циклодекстрину і активного інгредієнту. Переважно, комплекс містить ці компоненти у молярному співвідношенні активного інгредієнту до циклодекстрину в інтервалі від приблизно 1:4 до приблизно 1:28, більш переважно від приблизно 1:4 до приблизно 1:10. Винахід також стосується способів лікування суб'єктів (наприклад, ссавців, особливо людей), що полягають у призначенні суб'єкту, що потребує такого лікування терапевтично ефективної кількості, принаймні, одного активного інгредієнту, його рецептури, або його одиничної дозованої форми, які тут описані. Активний інгредієнт(и) може використовуватись для лікування ряду захворювань. Взагалі, такі активні інгредієнти корисні для інгібування секреції шлункової кислоти і для попередження і лікування захворювань викликаних шлунковою кислотою у ссавців, особливо людей. Цими захворюваннями є, але не можуть обмежуватись, виразка дванадцятипалої кишки, інфекція Н. pylon, виразка шлунку, захворювання шлунково-стравоходного відтоку і викликаних нім симптомів (наприклад, печія), ерозія стравоходу, стани патологічної гіперсекреції (наприклад, синдром Золінгера-Елісона, аденома ендокринної системи і систематичний мастоцитоз), гастрит, дуоденіт. Активний інгредіент(и) може також використоуватись для лікування інших гастроінтестинальних захворювань, при яких бажане інгібування секреції шлункової кислоти (наприклад, при лікуванні за допомогою НПЗС (нестероїдний протизапальний засіб), при лікуванні не виразкової диспепсії). Активний інгредієнт(и) може також використовуватись до пацієнтів, що знаходяться у відділенні інтенсивної терапії, до пацієнтів з гострою кровотечею в верхньому гастроінтестинальному тракті, перед і після хірургічного втручання для попередження аспірації кислоти і для попередження і лікування виразки внаслідок стресу. Однак, активний інгредієнт(и) може бути корисний при лікуванні псоріазу, також як і інфекцій Heliocobacter і захворювань обумовлених цим. Активний інгредієнт(и) також може бути корисний при лікуванні запальних станів у ссавця і, особливо, людей, особливо тих, що обумовлені лізозимальними ферментами. Якщо використовується тут, термін "лікування", або його похідні, стосується часткового або повного інгібування стану хвороби, такої як, наприклад, виразка дванадцятипалої кишки, коли активний інгредієнт представленого винаходу вводиться профілактично або після нападу хвороби для якого такий активний інгредієнт представленого винаходу призначається. Для цілей представленого винаходу, "профілактика" стосується введення активного інгредієнту(ів) ссавцю для захисту ссавця від будь яких описаних вище захворювань, також як і інших. Інші прикладами таких станів, що можуть лікуватись, є ревматоїдний артрит і подагра. Іншими розладами, що можуть бути попереджені або вилікувані у відповідності з винаходом є шизофренія, симптоми брадифремп хвороби Паркінсона, підвищення внутрішьоочного тиску і мікробні інфекції, що викликані грам-негативними бактеріями (особливо мікроаерофільними бактеріями), бактеріями роду Campylbacter, що представлені С. pylori. За допомогою діючого засобу винаходу можна лікувати інфекційні захворювання, що викликані такими бактеріями у ссавців, включає без обмеження, людей, велику рогату худобу, коней, собак, мишей, щурів, контролювати і інгібувати забруднення оточуючого середовища і проводити дезінфекційну обробку. Активний інгредієнт(и), що тут розкритий, має терапевтичні властивості, що заслуговують на увагу, такі як інгібування секреції шлункової кислоти, що демонструють на ступні дослідження. Експерименти по визначення активності у інгібуванні секреції шлункової кислоти провоили на на собаках, що знадяться у свідомості, забезпечуючи шлункові фістули звичайного і дуоденальні фістули, останні використовували для безпосереднього інтрадуоденального введення активного інгредієнту(ів). Після 18 годин голодування і позбавлення води собакам підшкірно інфузували пентагастрин (1-4нмоль/кг/г) протягом 6-7 годин. Відбирали зразки шлункового соку через кожні 30 хвилин. Аліквоти кожного зразку титрували використовуючи 0,1 N NaOH до рН 7 для визначення концентрації визначаємої кислоти використовуючи автоматичний титратор і рН-метр. Розраховували продукування кислоти, якммоль Н760 хвилин. Активний інгредієнт(и), суспендований в 0,5 відсотковому розчині метилцелюлози, вводили інтрадуоденально в дозах від 4 до 20нмоль/кг, коли секреторна відповідь на пентагастрин досягала стійкого рівню. Це втілення також можна використати для профілактичного введення активного інгредієнт перед введенням пентагастріну. Звичайна активна добова доза активного інгредієнту(ів) буде залежати від різних факторів, таких як, наприклад, індивідуальна відповідь кожного пацієнту, шлях введення і захворювання. Лікар, що лікує, може корегувати норму дози виходячи з цих і інших критеріїв, якщо він або вона цього бажає. Наприклад, придатна оральна дозована форма може містити від приблизно 5 до приблизно 360мг загальної добової дози, яку зазвичай вводять в одиничній або розподілених дозах. Більш переважно використовують інтервал від приблизно 8мг до приблизно 60мг загальної добової дози, і більш переважно використовують інтервал від приблизно 10мг до приблизно 40мг загальної добової дози. На додаток, активний інгредієнт(и) може вводитись у вигляді розчину, і, як приклад, може бути використана описана вище добова доза. В одному з втілень, активний інгредієнт(и) можна додати до прийнятної кількості розчину, такою як розчин, що містить, наприклад, від приблизно 0,1мг/мл до приблизно 10мг/мл активного інгредієнту(ів). Повинно бути зрозуміло лікуючому лікарю, що суб'єкту можуть бути введені інші добові дози, ніж ті що тут описані. Переважними активними інгредієнтами є ті що тут описані, в той час як особливо переважними інгредієнтами є, наприклад, 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол, у чистій формі, 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол, по суті, вільний від 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу, композиція, щo містить 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол і 5-метокси-2[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол, де згаданий 6-метокси-2-[[(4метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол, містить від приблизно 96% до приблизно 100% (ваг/ваг) згаданої композиції і композиції, містить 6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазол і 5-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазол присутній в кількості більше ніж приблизно 9%, переважно 15%, і більш переважно 18% (ваг/ваг) згаданої композиції. Для способу підвищення біодоступності одного або більшої кількості активних інгредієнтів, що описані тут нижче, також переважною є композиція, що містить 6метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол і 5-метокси-2-[[(4метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол. Також переважними є одиничні дозовані форми, як тут описано, особливо, що містять від приблизно 8мг до приблизно 10мг, приблизно від 16мг до приблизно 20мг, і приблизно від 32мг до приблизно 40мг активного інгредієнту на дозовану одиницю. В іншому аспекті, представлений винахід стосується способу підвищення біодоступності одного або більшої кількості активних інгредієнтів представленого винаходу суб'єктом (наприклад, ссавцем, особливо людьми), що полягає у введенні суб'єкту, що потребує такого лікування, терапевтично ефективної кількості, принаймні, одного активного інгредієнту, його композиції або його рецептури, як тут описано вище, і, принаймні, одного циклодекстрину. Цей спосіб може бути використаний у відповідності з будь якою методикою описаною тут, включаючи використання, без обмеження, будь якої згаданої дозованої форми, особливо у формі одиничних доз, що тут описані. Для цілей винаходу, термін "біодоступність" стосується загальної кількості активного інгредієнту, що усвоюється через деякий час. Біодоступність можна визначити шляхом вимірювання загальної систематичної концентрації активного інгредієнту через деякий час після введення такого активного інгредієнту(ів) представленого винаходу або індивідуально або у порівнянні з біодоступністю після введення загальновідомої рецептури омепразолу (наприклад, Prilosec®). Наприклад, покращення біодоступності можна визначити як площина під кривою (AUC). AUC є інтегрованою мірою системної концентрації активного інгредієнту через деякий час в одиницях маса-час/об'єм. Вимірюють дію на суб'єкт активного інгредієнту AUC або, в деяких випадках, активної молекули, яка є метаболітом активного інгредієнту після ведення дози активного інгредієнту, від часу введення дози до часу, коли в тілі не залишається активного інгредієнту. В переважному втіленні, цей спосіб зазвичай приводить до підвищення AUC приблизно на 20 відсотків або більше порівняно з загальновідомою рецептурою омепразолу. В іншому втіленні, спосіб призводить до підвищення Сmах суб'єкту приблизно на 25 відсотків або більше порівняно з загальновідомою рецептурою омепразолу. Наступні приклади призначені для ілюстрації винаходу і не повинні розглядатись як такі, що обмежують рамки винаходу. Для цілей прикладів, фраза "(5)6-метокси 2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазол" стосується комбінації, переважно, співкристалізованої суміші, (з або без аморфних сполук), 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу і 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу, кожна з яких визначена і описана тут. Приклад 1 Одержання відносно чистого 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу Приблизно 850мл метанолу поміщали в 1 літровий скляний стакан з кришкою. Розчин насичували розчиняючи приблизно 10,5г (5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу, і одержаний розчин перемішували. До насиченого розчину додавали 17г (5)6-метокси-2-[[(4метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу одержуючи суспензію. Кришку закривали і насичену суспензію перемішували і стабілізували протягом чотирьох днів. Через чотири дні, суспензію фільтрували крізь паперовий фільтр і потім промивали незначною кількістю метанолу. Надосадкову рідину переносили до 1 літрового скляного стакану і до насиченого розчину додавали 10г (5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу. Процедуру повторювали для одержання додаткових зразків. Всі зразки, як було встановлено за допомогою спектроскопи Рамана, були відносно чистим 6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазолом. Цю методику також успішно проводили використовуючи етанол. Приклад 1а Одержання чистого 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу До 1000мл скляного стакану з кришкою, що містить приблизно 500мл метанолу, додавали 1,93г твердого гідроксиду натрію. Розчин перемішували до повного розчинення гідроксиду натрію, і до одержаної суспензії додавали омепразол АФІ. Розчин закривали і залишали при кімнатній температурі на чотири дні, потім фільтрували використовуючи вакуумне фільтрування і паперовий фільтр. Одержану тверду речовину тричі промивали 50мл порціями метанолу, потім поміщали в вакуум для висушування при кімнатній температурі. Вказану в заголовку сполуку видаляли після висушування протягом 24 годин, і чистоту перевіряли за допомогою спектроскопії FT-Рамана. Приклад 2 Одержання відносно чистого 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу До 50мл стакану з 30мл диметилформаміду (ДМФА) додавали приблизно 1г (5)6-метокси-2-[[(4метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу. До одержаного розчину додавали (5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол до утворення суспензії. Розчин перемішували протягом приблизно 10 хвилин, і потім фільтрували крізь 0,45мкм полі(тетрафтроетиленовий) (ПТФЕ) або нейлоновий фільтр. Одержаний насичений розчин поміщали в мілку чашку петрі, накривали і зберігали при охолодженні (приблизно 5°С) з інтервалом вологості від приблизно 0 до 50 відсотків до утворення кристалів (4-6 дні). Ідентичність вказаної в заголовку сполуки підтверджували за допомогою рентгенівської спектроскопії окремого кристалу і спектроскопії Рамана, і яка показала присутність приблизно 96-98 відсотків (ваг/ваг) 6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазолу і приблизно 2-4 відсотків (ваг/ваг) 5-метокси-2-[[(4-метокси-3,5диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу. Приклад 3 Одержання (5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу Методику представлену в Прикладі 2 повторювали, за винятком того, що в якості розчинника замість ДМФА використовували етанол і одержана структура показала використовуючи дифракцію ренгенівського випромінювання і/або спектроскопії Рамана присутність приблизно 82-85 відсотків (ваг/ваг) 6-метокси-2-[[(4метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу і приблизно 15-18 відсотків (ваг/ваг) 5метокси 2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу. Приклад 4 Одержання ізомерів 5(6)-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу До 50мл стакану з 30мл диметилформаміду (ДМФА) додавали приблизно 1г (5)6-метокси-2-[[(4метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу. До одержаного розчину додавали (5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол до утворення суспензії. Розчин перемішували протягом приблизно 10 хвилин, і потім фільтрували крізь 0,45мкм полі(тетрафтроетиленовий) (ПТФЕ) або нейлоновий фільтр. Одержаний насичений розчин поміщали в мілку чашку петрі, накривали і зберігали при кімнатній температурі з інтервалом вологості від приблизно 0 до 50 відсотків до утворення кристалів (1-2 дні). Ідентичність вказаної в заголовку сполуки підтверджували за допомогою рентгенівської спектроскопії окремого кристалу і спектроскопії Рамана. Одержана структура містила приблизно 93 відсотків (ваг/ваг) 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]1Н-бензімідазолу і приблизно 7 відсотків (ваг/ваг) 5-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазолу. Приклад 5 Одержання ізомерів 5(6)-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу До 50мл стакану з 30мл метиленхлориду додавали приблизно 1г (5)6-метокси-2-[[(4-метокси-3,5диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу. До одержаного розчину додавали (5)6-метокси-2[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол до утворення суспензії. Розчин перемішували протягом приблизно 10 хвилин, і потім фільтрували крізь 0,45мкм полі(тетрафтроетиленовий) (ПТФЕ) або нейлоновий фільтр. Одержаний насичений розчин поміщали в стакан, накривали, і зберігали при охолодженні (приблизно 5°С) до утворення кристалів (1-2 дні). Ідентичність вказаної в заголовку сполуки підтверджували за допомогою рентгенівської спектроскопії окремого кристалу і/або спектроскопії Рамана. Одержаний матеріал містив від приблизно 84 до 88 відсотків (ваг/ваг) 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)-метил]сульфініл]-1H-бензімідазолу і від приблизно 12 до 16 відсотків (ваг/ваг) 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)-метил]сульфініл]1H-бензімідазолу. Приклад 6 Одержання ізомерів 5(6)-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу До 50мл стакану з 25мл ацетону додавали приблизно 1г (5)6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1H-бензімідазолу. До одержаного розчину додавали (5)6-метокси-2-[[(4-метокси3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол до утворення суспензії. Розчин перемішували протягом приблизно 5 хвилин, і потім фільтрували крізь 0,45мкм полі(тетрафтроетиленовий) (ПТФЕ) або нейлоновий фільтр. Одержаний насичений розчин поміщали в 50мл стакан, накривали, і зберігали при кімнатній температурі і відносній вологості від приблизно 0 до 50 відсотків до утворення кристалів (1-2 дні). Ідентичність вказаної в заголовку сполуки підтверджували за допомогою рентгенівської спектроскопії окремого кристалу і/або спектроскопії Рамана. Одержаний матеріал містив приблизно 86 відсотків (ваг/ваг) 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу і приблизно 14 відсотків (ваг/ваг) 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу. Приклад 7 Одержання ізомерів 5(6)-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу Повторювали методику приведену в Прикладі 6, за винятком того, що замість ацетону, в якості розчинника використовували суміш АЦН/вода. Одержували подібну композицію 6-метокси-2-[[(4-метокси3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу і 5-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1H-бензімідазолу. Приклад 8 Одержання ізомерів 5(6)-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу Повторювали методику приведену в Прикладі 6, за винятком того, що замість ацетону, в якості розчинника використовували суміш АЦН/вода. Одержували подібну композицію 6-метокси-2-[[(4-метокси3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу і 5-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1H-бензімідазолу. Приклад 9 Одержання ізомерів (5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу До 400мл стакану з 200мл етанолу додавали приблизно 5г (5)6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1H-бензімідазолу. До розчину додавали 10мл гідроксиду амонію і до одержаного розчину додавали ще 5(6)-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Hбензімідазол до утворення суспензії. Розчин перемішували протягом приблизно 10 хвилин, потім фільтрували крізь паперовий фільтр. Одержаний насичений розчин поміщали у дві окремі висушені посудини, і зберігали в паровому ковпаку при кімнатній температурі до утворення кристалів (1-12 годин). Ідентичність вказаної в заголовку сполуки підтверджували за допомогою рентгенівської дифракції на окремому кристалі. Одержана структура містила приблизно 82 відсотків (ваг/ваг) 6-метокси-2-[[(4-метокси3,5-диметил-2-піридиніл)метил]сульфініл]-1H-бензімідазолу і приблизно 18 відсотків (ваг/ваг) 5-метокси-2[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1H-бензімідазолу. Приклад 10 Одержання (5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1H-бензімідазолу (5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазол (16,2г; 0,0492 моль)) піддавали реакції з м-хлорбензойною кислотою (13,6г; 0,0537 моль) в СН2СІ2 і рН=8,6. рН підтримували за допомогою КНСО3 (5,6г; 0,056 моль), що використовували в якості буферу. Температуру під час додавання підтримували в межах приблизно 0°С. Додавали розведений NaOH до рН вище 12 і СН2СІ2 фазу відокремлювали. Водну фазу заміняли диметилформамідом (4,7г) і рН підтримували вище 9, після чого утворювались кристали суміші (5)6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1H-бензімідазолу. Кристали відфільтрували і промивали водою і метанолом при температурі приблизно 0°С. Промиті кристали сушили під вакуумом і встановлювали переважний вміст 6метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу. Приклад 11 Одержання натрієвої солі 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу До перемішуємої суспензії 10г (29ммоль) (5)6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1H-бензімідазолу в 200мл метилетилового кетону (МЕК) в 1л колбі додавали при кімнатній температурі 6мл 5Μ водного розчину гідроксиду натрію. До цієї суміші додавали 200мл толуолу. Через приблизно 7 хвилин, суміш ставала прозорою. Приблизно через 2 хвилини, суміш знову ставала мутною. Цю суміш залишали перемішуватись при кімнатній температурі протягом ночі. Наступним ранком, для затравки додавали декілька кристалів натрієвої солі 6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1H-бензімідазолу. Протягом декількох хвилин починав утворюватись продукт. Через приблизно 1 годину, продукт виділяли за допомогою вакуумного фільтрування крізь паперовий фільтр на керамічній воронці Бюхнера і промивали 25мл діетилового етеру. Одержану тверду речовину залишали сушитись на повітрі на 24 години. Приклад 12 Одержання натрієвої солі 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Hбензімідазолу До колби, що містить 20мл метанолу повільно додавали при перемішуванні 580мг (14,48ммоль) 60% дисперсію гідриду натрію в мінеральному маслі. Одержану мутну суміш фільтрували під вакуумом крізь скляний фільтр з папером одержуючи прозорий розчин. До цього прозорого розчину додавали при перемішуванні 5г (14,48ммоль) 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Hбензімідазолу. Після перемішування приблизно 5 хвилин розчин ставав прозорим. Перемішування завершували колбу накривали і залишали. Через приблизно 5 хвилин починали утворюватися кристали. Суміш поміщали на ніч в холодильник з температурою 5°С. На наступний день тверду речовину відокремлювали за допомогою фільтрування під вакуумом одержуючи приблизно 5г бажаного продушу у вигляді білого кристалічного порошку. Приклад 13 Одержання натрієвої солі 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу До перемішуємого розчину 5г (14,48ммоль) (5)6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазолу в 50мл диметилформаміду (ДМФА) в 100мл стакані повільно додавали при кімнатній температурі 580мг (14,48ммоль) 60% дисперсії гідриду натрію в мінеральному маслі. Після додавання всього гідриду натрію, суміш залишали перемішуватись протягом 10 хвилин. Розчин фільтрували під вакуумом крізь паперовий фільтр на керамічній воронці Бюхнера. 20мл порцію одержаного розчину поміщали в 250мл круглодонну колбу, розводили 50мл толуолу і концентрували при пониженому тиску при 20°С (2 рази), і потім 50мл тетрагідрофурану (1 раз). Одержані тверді речовини сушили 18 годин при кімнатній температурі в вакуумі одержуючи бажаний продукт у вигляді майже-білого кристалічного порошку. Порошок перекристапізували з метанолу залишаючи профільтрований насичений розчин при 5°С в холодильнику на декілька днів до утворення кристалів. Приклад 14 Одержання натрієвої солі 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу До перемішуємої суспензії 5г (14,48ммоль) (5)6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1H-бензімідазолу в 50мл тетрагідрофурані (ТГФ) в 100мл стакані повільно додавали при кімнатній температурі 580мг (14,48ммоль) 60% дисперсії гідриду натрію в мінеральному маслі. Після додавання всього гідриду натрію, суміш залишали перемішуватись протягом 10 хвилин. Розчин фільтрували під вакуумом крізь паперовий фільтр на керамічній воронці Бюхнера і промивали незначною кількістю ТГФ. Тверді речовини сушили 18 годин при кімнатній температурі в вакуумі одержуючи 4,8г (90%) бажаного продукту у вигляді майже-білого кристалічного порошку. Порошок перекристалізували з 1:1 суміші метанол:етилацетат залишаючи профільтрований насичений розчин при 5°С в холодильнику на декілька днів до утворення кристалів. Приклад 15 Одержання натрієвої солі (-)(5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу До перемішуємого розчину 1,5г (4,33ммоль) (-)-(5)6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазолу в 15мл тетрагідрофурану (ТГФ) в 50мл стакані повільно додавали при кімнатній температурі 173мг 60% дисперсії гідриду натрію в мінеральному маслі. Після додавання всього гідриду натрію, суміш залишали перемішуватись протягом 45 хвилин при кімнатній температурі. До суміші додавали 15мл ТГФ і залишали перемішуватись ще на 20 хвилин. Тверду речовину, що утворилась, виділяли за допомогою фільтрування під вакуумом крізь паперовий фільтр на керамічній воронці Бюхнера, промивали 40мл ТГФ і сушили 18 годин при кімнатній температурі в вакуумі одержуючи 1,3г (81 відсотків) бажаного продукту у вигляді майже-білого порошку. Приклад 16 Одержання натрієвої солі (+)-(5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Нбензімідазолу До перемішуємо! суспензії 650мг (1,89ммоль) (+)-(5)6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазолу в 6,5мл метилетилового кетону (МЕК) в 50мл колбі додавали при кімнатній температурі 0,39мл 5М водного розчину гідроксиду натрію. До цієї суміші додавали 13мл толуолу. Одержана суміш мутніла тому додавали ще 6,5мл МЕК і суміш ставала прозорим жовтим розчином. Суміш залишали перемішуватись при кімнатній температурі протягом ночі. Наступним ранком, для затравки додавали декілька кристалів натрієвої солі 6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазолу, але кристалічний продукт не утворювався. Крізь суміш барботували сухий азот до початку виділення розчинника. Через приблизно 10 хвилин, утворювався продукт. Тверду речовину виділяли за допомогою фільтрування під вакуумом і промивали незначною кількістю діетилового етеру. Тверду речовину поміщали в вакуумний десікатор для видалення слідів етеру одержуючи приблизно 500мг бажаного продукту у вигляді майже-білого порошку. Приклад 17 Одержання тетрагідрату магнієвої солі (5)6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазолу 1,65г натрієвої солі 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Hбензімідазолу розчиняли в 30мл води. До перемішує мого розчину додавали 0,47г хлориду магнію розчиненого в 20мл води. Зразу після додавання розчину хлориду магнію починав утворюватись білий осад. Суспензію залишали перемішуватись ще на 5 хвилин, і потім продукт виділяли за допомогою фільтрування під вакуумом. Тверді речовини поміщали на ніч у вакуумний десікатор одержуючи бажаний продукт у вигляді білого порошку. Маленьку порцію порошку розчиняли в метанолі приблизно 75мг/мл, фільтрували і розводили еквівалентним об'ємом води. Цей розчин не щільно накривали і залишали для повільного випаровування. Через приблизно 5 днів, кристали виділяли, аналізували за допомогою дифракції рентгенівського випромінювання окремого кристалу, що підтверджували одержання бажаного продукту. Приклад 18 Одержання суміші (-) енантіомерів (5)6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1H-бензімідазолу (5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]тіо]-1Н-бензімідазол(4,0г, 12,1ммоль) суспендували в толуолі (12мл). При перемішуванні при 50°С додавали (-) діетил D-тартрат (0,17мл, 1,0ммоль) і ізопропоксид титану(І\/) (0,15мл, 0,50ммоль). Суміш перемішували при 50°С протягом 50 хвилин і потім при 30°С додавали Ν,Ν-діізопропілетиламін (0,085мл, 0,50ммоль). Потім додавали гідропероксид кумолу (83%, 2,1мл, 11,9ммоль) і суміш перемішували протягом 15 хвилин при 30°С. Одержана суміш містила (-) енантіомери (5)6 метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Hбензімідазолу. Приклад 19 Одержання суміші (+) енантіомерів (5)6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1H-бензімідазолу (+) Діетил L-тартрат (1,71мл, 10ммоль) і ізопропоксид титану (IV) (1,5мл, 5ммоль) розчиняли в метиленхлориді (50мл). При перемішуванні додавали воду (90мкл, 5ммоль) і одержану суміш нагрівали із зворотнім холодильником протягом години. Суміш охолоджували до кімнатної температури. Після чого при кімнатній температурі додавали (5)б-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]тіо]-1Нбензімідазол (1,65г, 5ммоль) і гідроксипероксид кумолу (80%, 1,5г, 5,5ммоль). Розчин перемішують при кімнатній температурі протягом 90 хвилин. Кінцевий продукт містить (5)6-метокси-2-[[(4гметокси-3,5диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазоли. Приклад 20 Одержання магнієвої солі (-)-(5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Hбензімідазолу До промитої азотом колби, що містить 50мл метанолу додавали при перемішуванні 0,11г (4,5ммоль) магнію, після чого додавали каталітичну кількість (~0,5мл) метиленхлориду. Цю суміш нагрівали при 40°С протягом 5 годин, потім завершення нагрівання залишали охолоджуватись до кімнатної температури. До мутного, перемішує мого розчину додавали приблизно 2г (-)-5(6)-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1H-бензімідазолу. Колбу добре промивали азотом, закривали і залишали перемішуватись при кімнатній температурі протягом ночі. Потім до реакційної суміші додавали приблизно 0,1мл води і залишали перемішуватись на 30 хвилин до випадіння неорганічних магнієвих солей. Суміш фільтрували у вакуумі і об'єм фільтрату зменшували при пониженому тиску до приблизно 20% від початково. До одержаного розчину додавали при перемішуванні 100мл ацетону. Після приблизно 5 хвилин перемішування починав утворюватись осад. Суміш залишали перемішуватись ще на 30 хвилин. Тверду речовину відокремлювали за допомогою фільтрування під вакуумом і промивали свіжим ацетоном. Тверді речовини залишали сушитися на повітрі одержуючи 640мг бажаного продукту. Приклад 21-29 Одержання 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу з сумішей 5- і 6-метоксибензімідазолів Композиції одержані в Прикладах 3-10 піддавали обробці приведеній в Прикладі 1. Слідуючи цій методиці одержували чисті 6-метокси сполуки. Приклад 30-33 Одержання 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу з сумішей 5- і 6-метоксибензімідазолів Композиції одержані в Прикладах 15-17 і 20 піддавали обробці приведеній в Прикладі 1. Слідуючи цій методиці одержували чисті солі 6-метокси сполук. Приклад 34 Визначення відсотків співкристалізованих ізомерів 5- і б-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1Н-бензімідазолу Зазвичай, для визначення процентного вмісту ізомерів 5- і 6метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1H-бензімідазол АФІ використовували дифракцію рентгенівського випромінювання на окремому кристалі. Без зв'язка з теорією, припускають, що дифракція рентгенівського випромінювання кристалічного матеріалу відповідає конструктивній і деструктивній інтерференції розсіяного рентгенівського випромінювання на атомах молекули в межах кристалічної решітки. Інтенсивність і положення дифракційних плям одержували з кристалу здатного генерувати структурну інформацію про приблизне розташування в кристалі атомів молекули. У цьому випадку, досліджуємий окремий кристал матеріалу розташовували в кінці скляної нитки. Кристал встановлювали в дифрактометрі в спеціальному положенні. Знімали дифракційні плями, поті кристал повертали в іншу позицію. Описану вище процедуру повторювали до вимірюючи і знімаючи до тисяч окремих дифракційних плям. Потім дифракційні плями аналізували і дані фазували одержуючи карту електронної густини, з якої визначали молекулярну структуру молекули. Дані дифракції рентгенівського випромінювання знімали використовуючи або дифрактометр Nonius CAD4 або дифрактометр Nonius Kappa CCD, що виготовляються Nonius Corporation, Делфт, Голландія. Дані дифракції зняті з різних партій АФІ омепразолу підтвердили присутність і молекулярну структуру лікарського засобу. Виходячи з даних було встановлено, що кристалічна решітка характеризується різними ступенями невпорядкованості 6- і 5-метокси ізомерів в межах АФІ. Було встановлено, що в межах однієї кристалічної решітки співкристалізуються два ізомери. Ця співкристалізація в межах окремої решітки, як припускають, обумовлює спотворення шести незалежних параметрів комірки решітки у відношенні до кількості кожного ізомеру. Точно визначали вміст 5метокси ізомеру використовуючи дані методу найменших квадратів. Аналіз лінійної регресії констант комірки до вмісту 5-метокси ізомеру підтверджує добру кореляцію коефіцієнтів. В цьому прикладі, було встановлено, що сполуки переважно містять два діастереомери, що позначені як Sxa-R4q і Sxb-R4z похідні. Така поведінка не була очикуваною, оскільки спосіб в який були синтезовані сполуки, як припускають не повинні приводити до відбору R4q або R4z площинэ хіральності з відповідним Sxa або R4z хіральним центром. Хоча не спостерігається зв'язку з теорією, аналізу структури показує, що 5- і 6метокси ізомери кристалізуються завдяки центру інверсії і зв'язані за допомогою водневого зв'язку воднів аміну з киснями сульфоксиду. Метоксигрупи метилів, як припускають, спрямовані безпосередньо до центру місткового комплексу. Знову без зв'язку з теорією, визначення контактних відстаней в регіоні, де знаходяться інші метоксигрупи метильних залишків, що можуть не відповідати місцям в межах кристалічної решітки для іншого діастереомеру (Sxa-FUz і Sxb-R4q). що знаходиться поруч. Атом кисню метоксигрупи розташований на відстані приблизно 3,6Å від 4 інших атомів окрім водню і на відстані 3,2Å від 2 водневих атомів сусідньої молекули омепразолу. Нормальна відстань взаємодії сил Ван-дер-Ваальса становить приблизно 3,7Å для інших атомів крім водню Приклад 35 Одержання (5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу До 50мл стакану з 30мл диметилформаміду (ДМФА) додавали приблизно 1г (5)6-метокси-2-[[(4метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу. До одержаного розчину додавали (5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1H-бензімідазол до утворення суспензії. Розчин перемішували протягом приблизно 10 хвилин, і потім фільтрували крізь 0,45мкм полі(тетрафтроетиленовий) (ПТФЕ) або нейлоновий фільтр. Одержаний насичений розчин поміщали в мілку чашку петрі, накривали і зберігали при охолодженні (приблизно 5°С) і відносній вологості від приблизно 50 до 90 відсотків до утворення кристалів (4-7 дні). Ідентичність вказаної в заголовку сполуки підтверджували за допомогою рентгенівської спектроскопії окремого кристалу і/або спектроскопії Рамана. Одержаний матеріал показав присутність від приблизно 85 до 89 відсотків (ваг/ваг) 6-метокси-2-[[(4мет.окси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу і від приблизно 11 до 15 відсотків (ваг/ваг) 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1Н-бензімідазолу. Приклад 36 Одержання (5)6-метокси-2-[[(4-метокси-3,5-диметил-2-піридинїл)метил]сульфініл]-1Н-бензімідазолу До 50мл стакану з 30мл ацетону додавали приблизно 1г (5)6-метокси-2-[[(4-метокси-3,5-диметил-2піридиніл)метил]сульфініл]-1H-бензімідазолу. До одержаного розчину додавали (5)6-метокси-2-[[(4-метокси3,5-диметил-2-піридиніл)метил]сульфініл]-1H-бензімідазол до утворення суспензії. Розчин перемішували протягом приблизно 10 хвилин, і потім фільтрували крізь 0,45мкм полі(тетрафтроетиленовий) (ПТФЕ) або нейлоновий фільтр. Одержаний насичений розчин поміщали в мілку чашку петрі, накривали і зберігали при охолодженні (приблизно 5°С) і відносній вологості від приблизно 50 до 90 відсотків до утворення кристалів (1-2 дні). Ідентичність вказаної в заголовку сполуки підтверджували за допомогою рентгенівської спектроскопії окремого кристалу і/або спектроскопії Рамана. Одержаний матеріал показав присутність від приблизно 79 до 82 відсотків (ваг/ваг) 6-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]
ДивитисяДодаткова інформація
Назва патенту англійськоюAlkoxysubstituted benzimidazoles, pharmaceutical compositions containing them, and a method for application thereof
Назва патенту російськоюАлкоксизамещенные бензимидазолы, фармацевтические композиции, которые их содержат и способ их применения
Автори російськоюJenkins, Douglas, John
МПК / Мітки
МПК: A61K 31/4439, A61K 47/40, C07D 401/12
Мітки: застосування, містять, спосіб, алкоксизаміщені, композиції, бензимідазоли, фармацевтичні
Код посилання
<a href="https://ua.patents.su/39-73947-alkoksizamishheni-benzimidazoli-farmacevtichni-kompozici-shho-kh-mistyat-ta-sposib-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Алкоксизаміщені бензімідазоли, фармацевтичні композиції, що їх містять та спосіб їх застосування</a>
Попередній патент: Імідазоімідазоли і триазоли як протизапальні агенти
Наступний патент: Ферментатор біогазової установки
Випадковий патент: Модульний перетворювач магнітної енергії