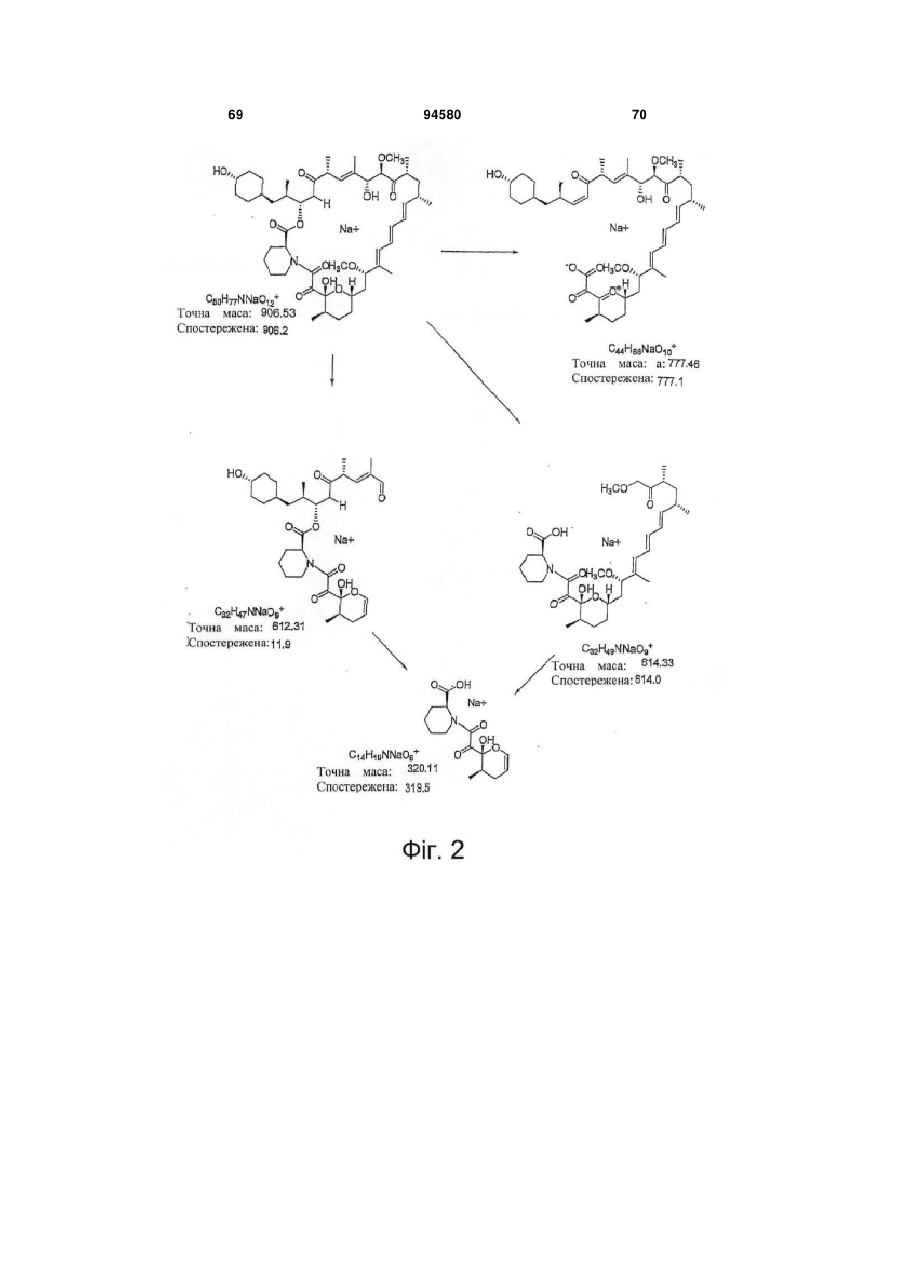
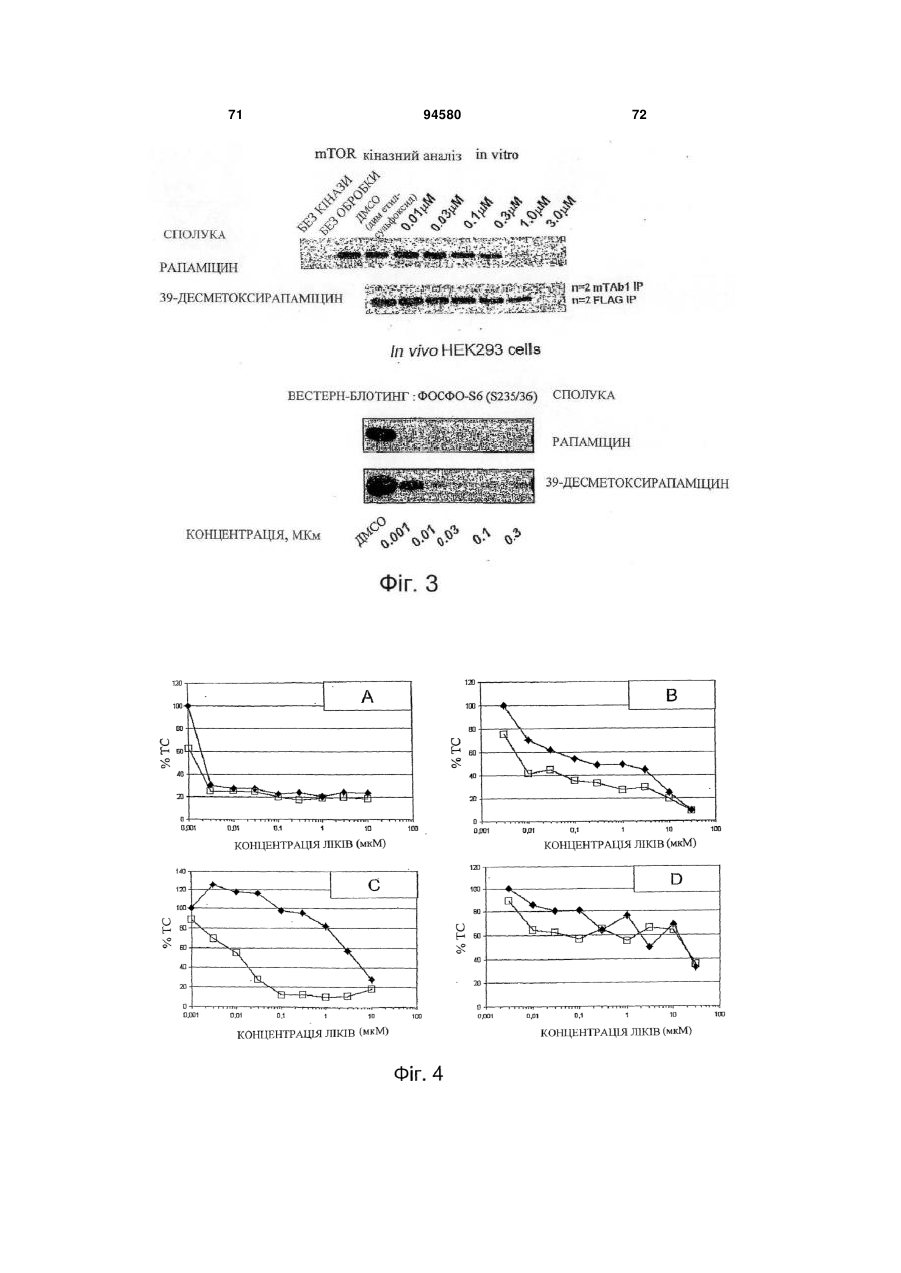
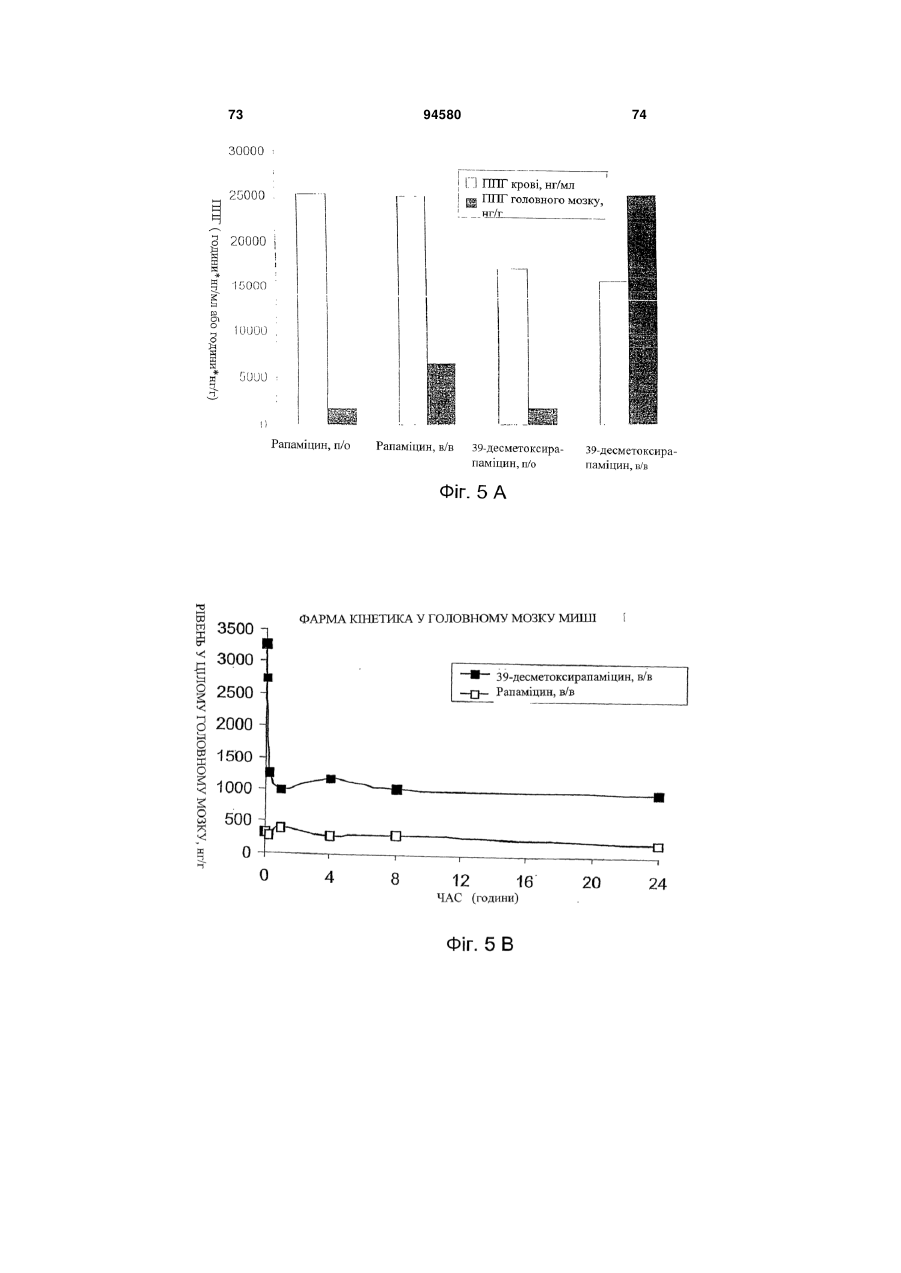
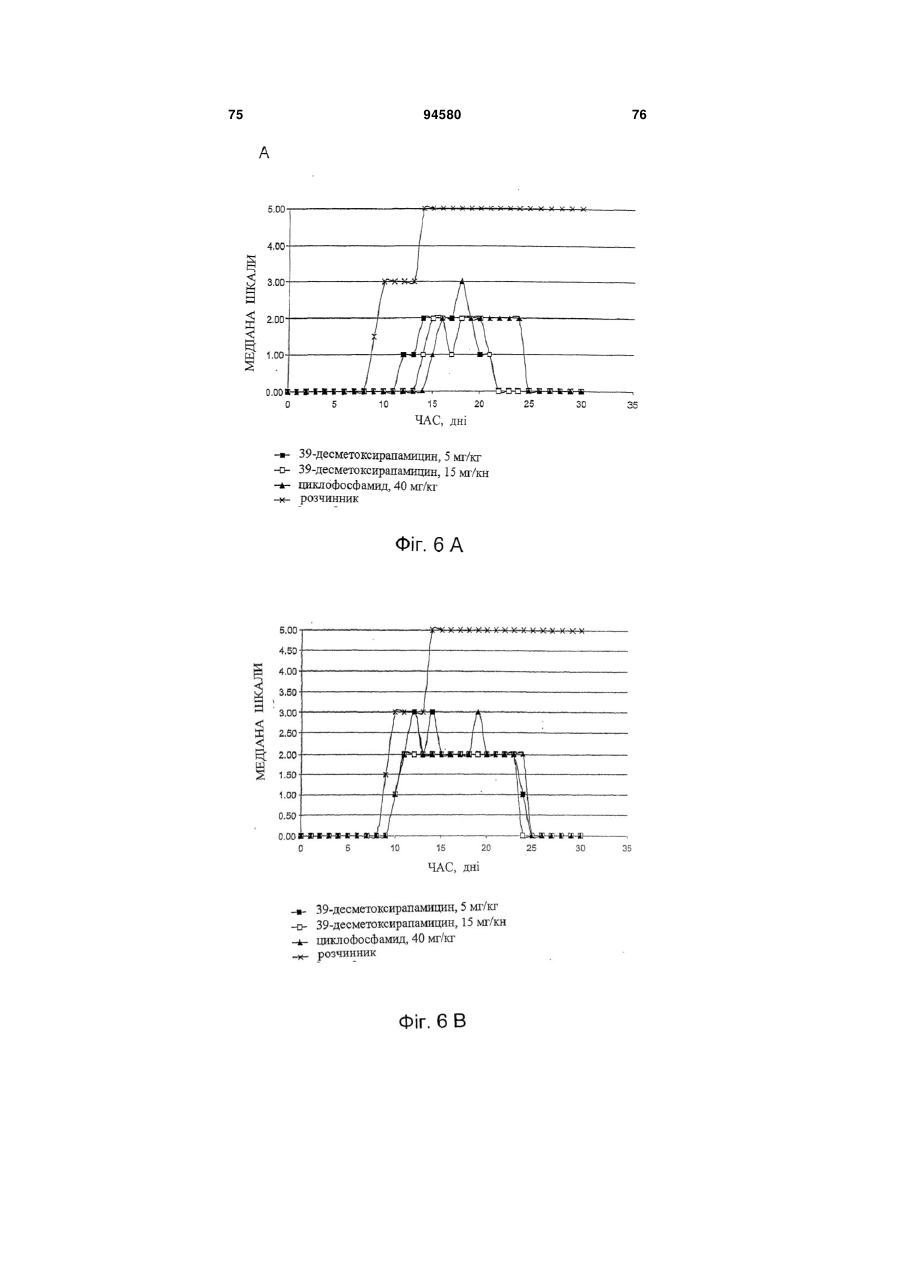
Аналог 39-дезметоксирапаміцину, здатний долати гематоенцефалічний бар’єр, для лікування патологічного стану, викликаного нейрогенним пошкодженням або захворюванням
Номер патенту: 94580
Опубліковано: 25.05.2011
Автори: Шерідан Роза Мері, Жанг Мінгкьянг, Грегорі Метью Алан
Формула / Реферат
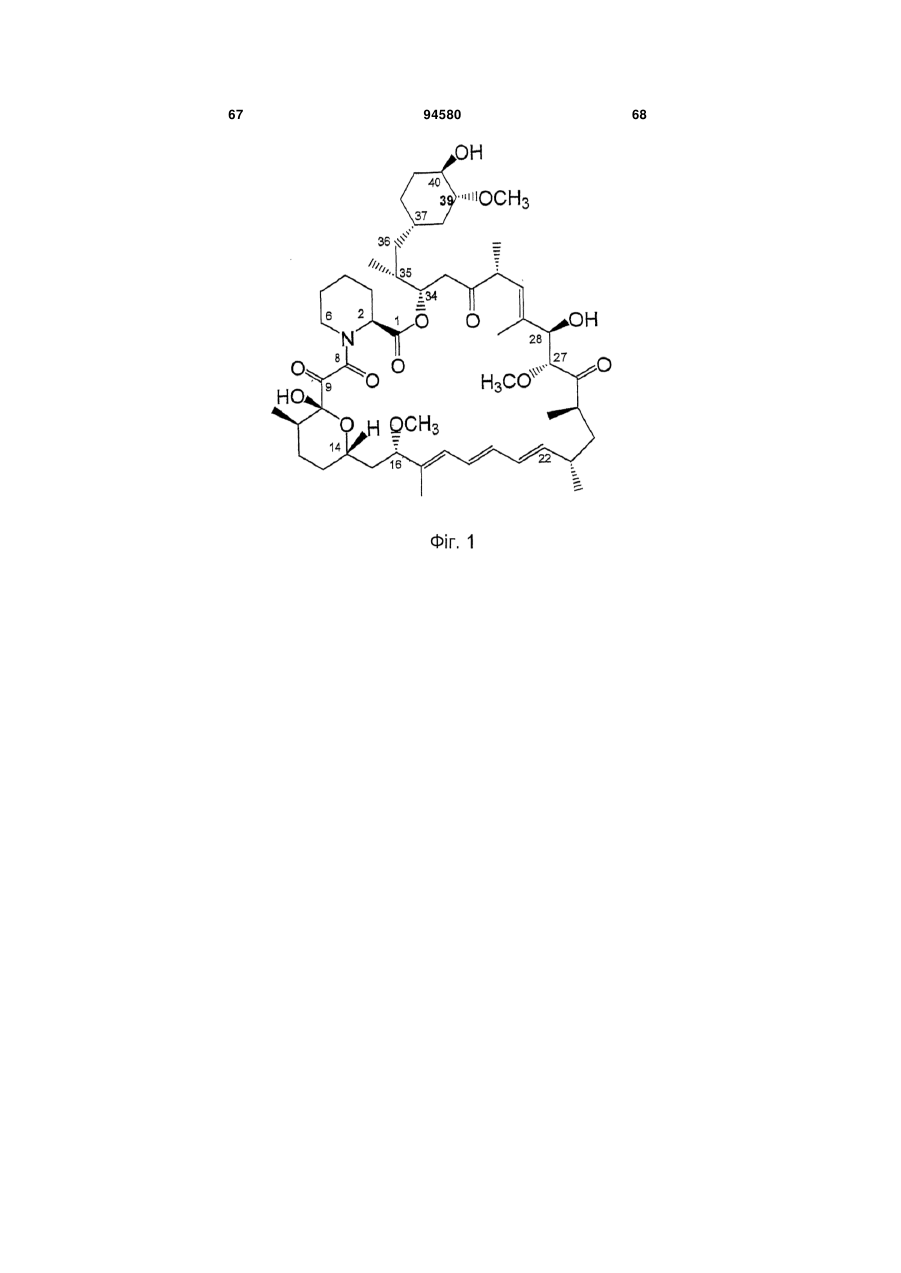
1. Агент, який є сполукою-аналогом 39-дезметоксирапаміцину формули (І), 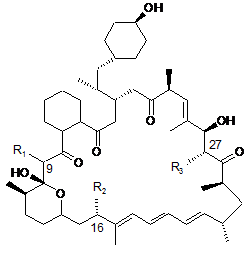 , (І)
, (І)
де R1 представлений (Н, Н) або = O, a R2 та R3 кожний незалежно представлені Н, ОН або ОСН3, або його фармацевтично прийнятна сіль, здатні долати гематоенцефалічний бар'єр, для лікування патологічного стану, який є наслідком нейрогенного пошкодження або захворювання, і/або лікування пухлин або В-клітинних новоутворень, де пухлина або В-клітинне новоутворення є резистентним до одного або більше існуючих протипухлинних агентів.
2. Застосування агента, який є аналогом 39-дезметоксирапаміцину формули (І),  , (I)
, (I)
де R1 представлений (Н, Н) або = О, a R2 та R3 кожний незалежно представлені Н, ОН або ОСН3, або його фармацевтично прийнятної солі для лікування патологічного стану, який є результатом нейрогенного ушкодження або захворювання.
3. Застосування агента, який є аналогом 39-дезметоксирапаміцину формули (І),  , (I)
, (I)
де R1 представлений (Н, Н) або = О, a R2 та R3 кожний незалежно представлені Н, ОН або ОСН3, для приготування медикаменту для лікування патологічного стану, який зачіпає центральну нервову систему, коли патологічний стан вимагає медикаменту, який проникає крізь гематоенцефалічний бар'єр.
4. Агент за п. 1 або 2, або 3, який відрізняється тим, що патологічний стан вибраний із групи, яка складається з пухлини(ин) головного мозку та нейродегенеративних станів.
5. Агент за п. 4, який відрізняється тим, що медикамент призначений для лікування пухлин головного мозку.
6. Агент за п. 5, який відрізняється тим, що пухлиною головного мозку є мультиформна гліобластома.
7. Агент за п. 4, який відрізняється тим, що медикамент призначений для лікування нейродегенеративних станів.
8. Агент за п. 7, який відрізняється тим, що нейродегенеративним станом є хвороба Альцгеймера,
9. Агент за п. 7, який відрізняється тим, що нейродегенеративним станом е розсіяний склероз.
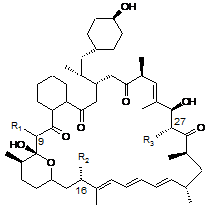
9. Застосування агента за п. 1, який є сполукою-аналогом 39-дезметоксирапаміцину формули (І),
 , (I)
, (I)
де R1 представлений (Н, Н) або = O, a R2 та R3 кожний незалежно представлені Н, ОН або ОСН3, або його фармацевтично прийнятної солі у приготуванні медикаменту для лікування пухлин або В-клітинних новоутворень, де пухлина або В-клітинне новоутворення є резистентним до одного або більше існуючих протипухлинних агентів.
11. Застосування за п. 10, яке відрізняється тим, що пухлина або В-клітинне новоутворення експресують Р-глікопротеїн.
12. Застосування за п. 11, яке відрізняється тим, що пухлина або В-клітинне новоутворення мають високий рівень експресії Р-глікопротеїну.
13. Агент за будь-яким з пп. 1-12, який відрізняється тим, що медикамент призначений для введення аналога 39-дезметоксирапаміцину або його фармацевтично прийнятної солі внутрішньовенно.
14. Агент за будь-яким з пп. 1-12, який відрізняється тим, що медикамент додатково включає один або більше інших терапевтичних агентів.
15. Агент за будь-яким з п. 1 або пп. 2-6, або 10-14, який відрізняється тим, що медикамент призначений для лікування пухлин або В-клітинних новоутворень і де медикамент додатково включає один або більше агентів, вибраних із групи, яка складається з метотрексату, лейковорину, адріаміцину, пренізону, блеоміцину, циклофосфаміду, 5-фторурацилу, паклітакселю, доцетакселю, вінкристину, вінбластину, вінорельбіну, доксорубіцину, тамоксифену, тореміфену, мегестрол-ацетату, анастрозолу, госереліну, анти-НЕК2 моноклональних антитіл (Герцептину™), капецитабіну, ралоксифен-гідрохлориду, інгібіторів рецептора епідермального фактора росту, інгібіторів фактора росту васкулярного ендотелію, інгібіторів протеасом та інгібіторів hsp90.
16. Агент за будь-яким з пп. 1-15, який відрізняється тим, що аналогом 39-дезметоксирапаміцину є 39-дезметоксирапаміцин.
17. Агент за будь-яким з пп. 1-15, який відрізняється тим, що аналог 39-дезметоксирапаміцину додатково відрізняється від рапаміцину за одним або більше положеннями 9, 16 або 27.
18. Агент за п. 17, який відрізняється тим, що аналог 39-дезметоксирапаміцину додатково відрізняється від рапаміцину за одним або більше положеннями 16 або 27.
19. Агент за п. 16, який відрізняється тим, що аналог 39-дезметоксирапаміцину додатково відрізняється від рапаміцину за положеннями 16 та 27.
20. Агент за будь-яким з пп. 17-19, який відрізняється тим, що аналог 39-дезметоксирапаміцину має гідроксильну групу в положенні 27, тобто R3 представлений ОН.
21. Агент за будь-яким з пп. 17-19, який відрізняється тим, що аналог 39-дезметоксирапаміцину має водень у положенні 27, тобто R3 представлений ОН.
22. Агент за будь-яким з пп. 16-20, який відрізняється тим, що аналог 39-дезметоксирапаміцину має гідроксильну групу в положенні 16, тобто R2 представлений ОН.
23. Фармацевтична композиція, яка включає аналог 39-дезметоксирапаміцину формули (І),
 ,
,
де R1 представлений (Н, Н) або = O, a R2 та R3 кожний незалежно представлені Н, ОН або ОСН3, або його фармацевтично прийнятну сіль разом з фармацевтично прийнятним носієм.
24. Фармацевтична композиція за п. 23, яка відрізняється тим, що спеціально розроблена для внутрішньовенного застосування.
Текст
1. Агент, який є сполукою-аналогом 39дезметоксирапаміцину формули (І), OH (19) (21) a200711241 (22) 10.03.2006 (24) 25.05.2011 (86) PCT/GB2006/000834, 10.03.2006 (31) 0504995.2 (32) 11.03.2005 (33) GB (31) 11/097,605 (32) 01.04.2005 (33) US (31) 0522829.1 (32) 09.11.2005 (33) GB (46) 25.05.2011, Бюл.№ 10, 2011 р. (72) ШЕРІДАН РОЗА МЕРІ, GB, ЖАНГ МІНГКЬЯНГ, NL/GB, ГРЕГОРІ МЕТЬЮ АЛАН, GB (73) БІОТИКА ТЕКНОЛОДЖІ ЛІМІТЕД, GB (56) WO 2004/007709 A, 22.01.2004 WO 2006/016167 A2, 16.02.2006 LOWDEN PHILIP A S ET AL: "New rapamycin derivatives by precursor-directed biosynthesis." CHEMBIOCHEM : A EUROPEAN JOURNAL OF CHEMICAL BIOLOGY. 2 APR 2004, vol. 5, no. 4, 2 April 2004 (2004-04-02), pages 535-538 GREGORY M A ET AL: "566 Novel mTOR inhibitors with improved pharmacological properties over rapamycin" EUROPEAN JOURNAL OF CANCER. SUPPLEMENT, PERGAMON, OXFORD, GB, vol. 2, no. 8, September 2004 (2004-09), page 172 HAMILTON G S ET AL: "NEUROIMMUNOPHILIN LIGANDS AS NOVEL THERAPEUTICS FOR THE TREATMENT OF DEGENERATIVE DISORDERS OF THE NERVOUS SYSTEM" CURRENT PHARMACEUTICAL DESIGN, BENTHAM SCIENCE PUBLISHERS, SCHIPHOL, NL, vol. 3, no. 4, 1997, pages 405-428 GREGORY MATTHEW A ET AL: "Mutasynthesis of rapamycin analogues through the manipulation of a 2 3 94580 4 8. Агент за п. 7, який відрізняється тим, що нейродегенеративним станом є хвороба Альцгеймера, 9. Агент за п. 7, який відрізняється тим, що нейродегенеративним станом е розсіяний склероз. 10. Застосування агента за п. 1, який є сполукоюаналогом 39-дезметоксирапаміцину формули (І), OH OH OH O R1 HO O 9 27 O O R3 R2 O R1 16 , (I) де R1 представлений (Н, Н) або = О, a R2 та R3 кожний незалежно представлені Н, ОН або ОСН3, або його фармацевтично прийнятної солі для лікування патологічного стану, який є результатом нейрогенного ушкодження або захворювання. 3. Застосування агента, який є аналогом 39дезметоксирапаміцину формули (І), OH OH O R1 HO O 9 O OH O 27 O O R3 R2 16 , (I) де R1 представлений (Н, Н) або = О, a R2 та R3 кожний незалежно представлені Н, ОН або ОСН3, для приготування медикаменту для лікування патологічного стану, який зачіпає центральну нервову систему, коли патологічний стан вимагає медикаменту, який проникає крізь гематоенцефалічний бар'єр. 4. Агент за п. 1 або 2, або 3, який відрізняється тим, що патологічний стан вибраний із групи, яка складається з пухлини(ин) головного мозку та нейродегенеративних станів. 5. Агент за п. 4, який відрізняється тим, що медикамент призначений для лікування пухлин головного мозку. 6. Агент за п. 5, який відрізняється тим, що пухлиною головного мозку є мультиформна гліобластома. 7. Агент за п. 4, який відрізняється тим, що медикамент призначений для лікування нейродегенеративних станів. HO O 9 O 27 O O R3 R2 16 , (I) де R1 представлений (Н, Н) або = O, a R2 та R3 кожний незалежно представлені Н, ОН або ОСН3, або його фармацевтично прийнятної солі у приготуванні медикаменту для лікування пухлин або Вклітинних новоутворень, де пухлина або Вклітинне новоутворення є резистентним до одного або більше існуючих протипухлинних агентів. 11. Застосування за п. 10, яке відрізняється тим, що пухлина або В-клітинне новоутворення експресують Р-глікопротеїн. 12. Застосування за п. 11, яке відрізняється тим, що пухлина або В-клітинне новоутворення мають високий рівень експресії Р-глікопротеїну. 13. Агент за будь-яким з пп. 1-12, який відрізняється тим, що медикамент призначений для введення аналога 39-дезметоксирапаміцину або його фармацевтично прийнятної солі внутрішньовенно. 14. Агент за будь-яким з пп. 1-12, який відрізняється тим, що медикамент додатково включає один або більше інших терапевтичних агентів. 15. Агент за будь-яким з п. 1 або пп. 2-6, або 10-14, який відрізняється тим, що медикамент призначений для лікування пухлин або В-клітинних новоутворень і де медикамент додатково включає один або більше агентів, вибраних із групи, яка складається з метотрексату, лейковорину, адріаміцину, пренізону, блеоміцину, циклофосфаміду, 5фторурацилу, паклітакселю, доцетакселю, вінкристину, вінбластину, вінорельбіну, доксорубіцину, тамоксифену, тореміфену, мегестрол-ацетату, анастрозолу, госереліну, анти-НЕК2 моноклональних антитіл (Герцептину™), капецитабіну, ралоксифен-гідрохлориду, інгібіторів рецептора епідермального фактора росту, інгібіторів фактора росту васкулярного ендотелію, інгібіторів протеасом та інгібіторів hsp90. 16. Агент за будь-яким з пп. 1-15, який відрізняється тим, що аналогом 39-дезметоксирапаміцину є 39-дезметоксирапаміцин. 17. Агент за будь-яким з пп. 1-15, який відрізняється тим, що аналог 39-дезметоксирапаміцину 5 додатково відрізняється від рапаміцину за одним або більше положеннями 9, 16 або 27. 18. Агент за п. 17, який відрізняється тим, що аналог 39-дезметоксирапаміцину додатково відрізняється від рапаміцину за одним або більше положеннями 16 або 27. 19. Агент за п. 16, який відрізняється тим, що аналог 39-дезметоксирапаміцину додатково відрізняється від рапаміцину за положеннями 16 та 27. 20. Агент за будь-яким з пп. 17-19, який відрізняється тим, що аналог 39-дезметоксирапаміцину має гідроксильну групу в положенні 27, тобто R3 представлений ОН. 21. Агент за будь-яким з пп. 17-19, який відрізняється тим, що аналог 39-дезметоксирапаміцину має водень у положенні 27, тобто R3 представлений ОН. 22. Агент за будь-яким з пп. 16-20, який відрізняється тим, що аналог 39-дезметоксирапаміцину має гідроксильну групу в положенні 16, тобто R2 представлений ОН. 23. Фармацевтична композиція, яка включає аналог 39-дезметоксирапаміцину формули (І), Даний винахід стосується медичного застосування аналогів З 9-дезметоксирапаміцину. Рапаміцин (сиролімус) (Фіг.1) є ліпофільним макролідом, який продукується Streptomyces hygroscopicus NRRL 54 91 (Sehgal et al.,1975; US 3 929 992; US 3 993 749) з 1,2,3-трикарбонільною частиною компонента, зв'язаною з лактоном піпеколієвої кислоти (Piva et al., 1991). З огляду на мету даного винаходу нумерація атомів виконана у рапаміцині за McAlpin et al. (1991), на противагу нумерації за Findlay et al. (1980) або Chemical Abstracts (11-й Кумулятивний індекс, 1982-1986 p60719CS). Рапаміцин має значну терапевтичну цінність завдяки широкому спектру біологічної активності (Huang et al., 2003). Сполуки за винаходом є потужними інгібіторами мішені рапаміцину у ссавців (mTOR) - серин-треонін кіназного шляху фосфатидил-інозитол-3-кіназного (Р13К)/Akt (протеїн-кіназа В) сигнального каскаду, який визначає виживання та проліферацію клітин. Інгібуюча активність досягається після того, як рапаміцин зв'язується з імунофілін-FK 506-зв'язуючим протеїном 12 (FKBP12) (Dumont, F.J. and Q.X. Su, 1995). У Т-клітинах рапаміцин інгібує передачу сигналів від ІЛ-2 рецептора і наступну аутопроліферацію Т-клітин, приводячи до імуносупресії. Рапаміцин продається як імуносупресант для лікування пацієнтів після трансплантації органів для запобігання відторгнення трансплантата (Huang et al., 2003). Крім імуносупресії, рапаміцин має терапевтичний потенціал при лікуванні ряду захворювань, наприклад онкологічних захворювань; серцево-судинних захворювань, таких як рестеноз; аутоімунних захворювань, таких 94580 6 OH OH O R1 HO O 9 O 27 O O R3 R2 16 , де R1 представлений (Н, Н) або = O, a R2 та R3 кожний незалежно представлені Н, ОН або ОСН3, або його фармацевтично прийнятну сіль разом з фармацевтично прийнятним носієм. 24. Фармацевтична композиція за п. 23, яка відрізняється тим, що спеціально розроблена для внутрішньовенного застосування. як розсіяний склероз, ревматоїдний артрит; грибкових інфекцій та нейродегенеративних захворювань, таких як хвороба Альцгеймера, хвороба Паркінсона та хвороба Гентінгтона. Незважаючи на свою корисність при ряді патологічних станів, рапаміцин має ряд недоліків. По-перше, він є субстратом викачуючої помпи на клітинній мембрані - Р-глікопротеіну (P-gp, LaPante et al., 2002, Crowe et al., 1999) , яка виводить сполуки із клітини, погіршуючи проникнення рапаміцину крізь клітинну мембрану. Це спричиняє погану абсорбцію сполуки після прийому ліків. Крім того, оскільки головним механізмом множинної фармацевтичної резистентності пухлинних клітин є ця помпа клітинної мембрани, рапаміцин менш ефективний проти пухлинних клітин, які проявляють мульти-фармацевтичну резистентність (МФР). Подруге, рапаміцин значноюй мірою метаболізується ферментами родини цитохрома Р450 (Lampen et al., 1998). Його втрата при первинному проходженні через печінку висока, що також вносить вклад у його низьку оральну бioдоступність. Роль CYP3A4 та Р-gр у низькій бioдоступності рапаміцину була підтверджена в дослідженнях, які продемонстрували, що застосування інгібіторів CYP3A4 та/або P-gp знижує виведення рапаміцину з СYР3А4-трансформованих клітин лінії Сасо-2 (Cummins et al., 2004), і що застосування інгібіторів CYP3A4 знижує метаболізм рапаміцину в тонкому кишківнику (Lampen et al., 1998). Низька оральна бioдоступність рапаміцину викликає значну міжіндивідуальну варіабельність, яка призводить до неспроможності терапевтичного результату і важ 7 кості клінічного менеджменту (Kuhn et al., 2001, Crowe et al., 1999). Таким чином, існує необхідність розробки нових рапаміцин-подібних сполук, які не є субстратом P-gp, та які можуть бути метаболічно більш стабільними і таким чином, можуть мати покращену біодоступність. При використанні як протипухлинних агентів ці сполуки можуть мати більшу ефективність проти МФР-пухлинних клітин, зокрема, проти Р-gр-експресуючих пухлинних клітин. Повідомлялося про ряд синтезованих аналогів рапаміцину, які використовують хімічно доступні ділянки молекули. Опис таких сполук був пристосований до системи нумерації молекул рапаміцину, описаної на Фіг. 1. Хімічно доступні ділянки молекули для дериватизації або заміщення включають С40 та С28 гідроксильні групи (наприклад, US 5 665 772; US 5 362 718), С39 і С16 метоксигрупи (наприклад, WO96/41807; US 5 728 7100, С32, С26 та С9 кето-групи (наприклад, US 5 378 836; US 5 138 051; US 5 665 7720). Гідрогенування в ділянках С17, С19 та/або С21, спрямоване на триєн, призводить до збереження протигрибкової активності, але відносного зниження імуносупресії (наприклад, US 5391730; US 5023262). Значного підвищення стабільності молекули (наприклад, утворення оксимів у ділянках С32, С40 та/або С28, US 5536145, US 5446048), стійкості до метаболічної атаки (наприклад, US 5912253), біодоступності (наприклад, US 5221670; US 5955457; WO 98/04279) і продукції проліків (наприклад, US 6015815; US 5432183) було досягнуто шляхом дериватизації. Двома найбільш успішними похідними рапаміцину в клінічній розробці є 40-О-(2-гідрокси)етилрапаміцин (RAD001, Цертикан, еверолімус) - напівсинтетичний аналог рапаміцину, який демонструє імуносупресивний фармакологічний ефект (Sedrani, R. et al., 1998; Kircher et al., 2000; US 5665772) та 40-O-[2,2біс(гідроксиметил)пропіонілокси]рапаміцин, ССІ779 (Wyeth-Ayerst) - ефір рапаміцину, який пригнічує клітинний ріст in vitro та інгібує ріст пухлини in vivo (Yu et al., 2001). CCI-779 на даний час проходить різні клінічні випробування як потенційний протипухлинний засіб. Недавні публікації про II фазу клінічних випробувань ССІ-779 у пацієнтів з рекурентною мультиформною гліобластомою (Chang, et al., 2005) дозволили припустити, що низька ефективність цих ліків у пацієнтів може бути обумовлена їх поганим проникненням крізь гематоенцефалічний бар'єр. Дослідження фармакокінетики RAD001 показали, що як і рапаміцин, він є субстратом для P-gp (Crowe et al., 1999; Laplante et al., 2002). Незважаючи на тісну структурну подібність до рапаміцину, сполуки даного винаходу проявляють цілком відмінний фармакологічний профіль. Зокрема, вони демонструють значно збільшену проникність крізь клітинну мембрану та зниження виходу в порівнянні з рапаміцином, і вони не є субстратом Р-gр. Крім того, 39дезметоксирапаміцин демонструє потужнішу активність проти множинної фармакологічної резистентності та P-gp-експресуючих пухлинних клітинних 94580 8 ліній, ніж рапаміцин. При порівнянні з рапаміцином 39-дезметоксирапаміцин показує інгібіторний профіль, який значно відрізняється від панелей NCI 60 клітинних ліній. Крім того, аналоги 39-дезметоксирапаміцину показують фармакокінетичний профіль, який значно відрізняється у порівнянні з рапаміцином та його провідними похідними в клінічних випробуваннях. Аналоги 39-дезметоксирапаміцину показують несподівано збільшену здатність перетинати гематоенцефалічний бар'єр і таким чином, демонструють поліпшену доступність для мозку. Таким чином, даний винахід стосується медичного застосування аналогів 39дезметоксирапаміцину, ці аналоги рапаміцину мають значно змінену фармакокінетику, поліпшену здатність до проникнення крізь гематоенцефалічний бар'єр, поліпшену метаболічну стабільність, поліпшену проникність крізь клітинні мембрани, знижену швидкість виходу та профіль інгібування пухлинних клітин, який відрізняється від такого у рапаміцину. Ці сполуки можуть бути застосовані в медицині, зокрема для лікування пухлин та/або Вклітинних новоутворень, для індукції або підтримки імуносупреси, стимуляції нейронної регенерації або лікування грибкових інфекцій, відторгнення трансплантата, реакції «трансплантат проти хазяїна», аутоімунних захворювань, запальних захворювань судин та фіброзних захворювань. Даний винахід зокрема стосується застосування 39дезметоксирапаміцину для лікування пухлин та/або В-клітинних новоутворень. Було показано, що рапаміцин стимулює аутофагію (Raught et al., 2001). Порушення аутофагії або розлад регуляції аутофагії утягується в ряд захворювань, включаючи хворобу Альцгеймера, хворобу Паркінсона, хворобу Гентінгтона та пріонні захворювання (включаючи хворобу Крейтцфельда-Якоба), дозволяючи припустити, що маніпуляція цим шляхом може принести користь при лікуванні даних захворювань. Недавні дослідження in vitro продемонстрували, що застосування рапаміцину здатне знизити появу агрегатів і клітинну загибель, пов'язані з полі(Q) і полі(А) експансією в трансформованих COS-7 клітинах. (Ravikumar et al., 2002). Таким чином, якщо рапаміцин був здатний перетинати гематоенцефалічний бар'єр, ці результати показують, що він може бути придатним кандидатом для лікування хвороби Гентінгтона та інших подібних хвороб. Це дозволяє припустити, що існує необхідність розробки аналогів рапаміцину, які здатні перетинати гематоенцефалічний бар'єр. Гіперфорсфорилювання пов'язаного з мікротубулами тау-протеїну та його наступна агрегація в нерозчинні спарені гелікальні філаменти, які формують внутрішньоклітинні «клубки», є однією з характерних ознак хвороби Альцгеймера, і нагромадження цієї нейрофібрілярної патології та пов'язана з цим загибель нейронних клітин тісно пов'язані з когнітивним погіршенням. Недавні дослідження An et al.(2003) показали, що активована р70 S6 кіназа спільно розподіляється з нейрофібрілярною патологією в мозку при хворобі Альцгеймера, і зокрема, активована р70 S6 кіназа 9 явно підвищена в нейронах перед розвитком клубків (An et al., 2003). При аналізі in vitro, де застосування сульфату цинку призводило до активації р70 S6 кінази та підвищувало рівень загального, нормального і гіперфосфорильованого тау, було показано, що попередня обробка клітин рапаміцином знижувала активацію р70 S6 кінази в три рази і значно зменшувала рівень загального, нормального та гіперфосфорильованого тау. Таким чином, дані результати показують, що застосування аналогів рапаміцину може бути корисним для зниження нейрофібрілярної патології при хворобі Альцгеймера, пропонуючи сполуки, здатні досягати місця дії. Крім того, повідомлялося, що раламіцин підвищує. розростання нейритів та нейронне виживання в деяких in vitro і in vivo моделях (Avramut and Achim, 2002), що свідчить про те, що рапаміцин і аналоги, таким чином, можуть бути використані для лікування захворювань, при яких нейронна регенерація може приносити значну терапевтичну користь. Однак ця користь залежить від здатності досягати місця дії, і в такий спосіб аналоги рапаміцину з поліпшеною здатністю до перетинання гематоенцефалічного бар'єра можуть бути особливо бажаними. Даний винахід стосується нового та незвичайного застосування аналогів 39дезметоксирапаміцину в медицині, зокрема до використання 39-дезметоксирапаміцину, зокрема при лікуванні пухлин або В-клітинних новоутворень, для індукції або підтримки імуносупресії, стимуляції нейронної регенерації або лікування грибкових інфекцій, відторгнення трансплантата, хвороби «трансплантат проти хазяїна», аутоімунних захворювань, нейродегенеративних станів, запальних захворювань судин і фіброзних захворювань. Зокрема даний винахід стосується застосування аналогів 39-дезметоксирапаміцину для лікування пухлин та В-клітинних новоутворень. У кращому втіленні даний винахід стосується застосування аналогів 39-дезметоксирапаміцину для лікування неврологічних і нейродегенеративних станів. Зокрема в кращому втіленні даний винахід стосується застосування аналогів 39дезметоксирапаміцину для лікування пухлин головного мозку, зокрема мультиформної гліобластоми. У конкретному аспекті даного винаходу аналогом 39-дезметоксирапаміцину є 39дезметоксирапаміцин. Даний винахід стосується медичного застосування аналогів 39-дезметоксирапаміцину, зокрема 39-дезметоксирапаміцину, зокрема для лікування пухлин та/або 3-клітинних новоутворень, індукції або підтримки імуносупреси, лікування відторгнення трансплантата, хвороби «трансплантат проти хазяїна», аутоімунних захворювань, нейродегенеративних станів, запальних захворювань судин та фіброзних захворювань, стимуляції нейронної регенерації або лікування грибкових інфекцій. Зокрема даний винахід стосується застосування аналогів 39-дезметоксирапаміцину для лікування пухлин та В-клітинних новоутворень. У конкретному втіленні даний винахід стосується застосування 39-дезметоксирапаміцину для лікування пухлин та 94580 10 В-клітинних новоутворень. Даний винахід також особливо стосується застосування аналогів 39дезметоксирапаміцину для лікування пухлин мозку або нейродегенеративних станів. У конкретному втіленні даний винахід стосується застосування 39-дезметоксирапаміцину для лікування пухлин мозку або нейродегенеративних станів. Даний винахід також конкретно стосується застосування аналогів 39-дезметоксирапаміцину для лікування нейродегенеративних станів. Зокрема даний винахід стосується застосування 39дезметоксирапаміцину для лікування нейродегенеративних станів. Визначення Термін «аутоімунне(і) Захворювання(ня)» включає без обмеження: системний червоний вовчак (СЧВ), ревматоїдний артрит, міастенію гравіс і розсіяний склероз. Термін «запальні захворювання» включає без обмеження: псоріаз, дерматит, екзему, себорею, запальні захворювання кишковика (включаючи, але не обмежуючись виразковим колітом і хворобою Крона), запальні захворювання легенів (включаючи астму, хронічне обструктивне захворювання легенів, емфізему, гострий респіраторний дистрессиндром та бронхіт), ревматоїдний артрит і увеіт. Термін «пухлина» відноситься до пухлин або доброякісного росту клітин у шкірі або органах тіла, наприклад але без обмеження, у молочній залозі, простаті, легенях, нирках, підшлунковій залозі, головному мозку, шлунку або кишківнику. Злоякісна пухлина має тенденцію інфільтрувати суміжні тканини та поширюватися (метастазувати) у віддалені органи, наприклад, кістки, печінку, легені або головний мозок. Термін «пухлина» включає всі метастатичні типи пухлинних клітин, такі як, але без обмежень, меланома, лімфома, лейкемія, фібросаркома, рабдоміосаркома, та мастоцитома і типи тканинної карциноми, такої як, але без обмеження, колоректальний рак, рак простати, дрібноклітинний рак легенів і не-дрібноклітинний рак легенів, рак молочної залози, рак підшлункової залози, рак сечового міхура, рак нирки, рак шлунка, гліобластома, первинний рак печінки та рак яєчника. Цей термін також особливо включає пухлину(и) головного мозку, як це більш докладно описано нижче. Термін «пухлина(и) головного мозку» відноситься до злоякісних або доброякісних клітин головного мозку; він включає первинні та вторинні (метастатичні) пухлини. Первинні пухлини головного мозку включають, без обмеження, гліому (наприклад, мультиформну гліобластому, астроцитому, гліому стовбура мозку, епендимому та олігодендрогліому), медулобластому, менінгіому, шванному (або акустичну неврому), краніофарингіому, пухлину із зародкових клітин мозку (наприклад, герміному), або пухлину пінеальної області. Термін «пухлина головного мозку» також використовується для опису вищезгаданого переліку захворювань, і ці терміни тут використовуються почергово. Термін «В-клітинні новоутворення» включає групу захворювань, яка включає хронічну лімфоцитарну лейкемію (ХЛЛ), множинну мієлому, і не 11 Ходжскінську лімфому (НХЛ). Це неопластичні захворювання крові та кровотворних органів. Вони викликають порушення функції кісткового мозку та імунної системи, що веде до високої сприйнятливості до інфекцій і знекровлювання організму. Термін «захворювання судин» включає без обмеження: гіперпроліферативні захворювання судин (наприклад, рестеноз і оклюзію судини), атеросклероз судин трансплантата, серцевосудинні захворювання, церебральні судинні захворювання та хвороби периферійних судин (наприклад, захворювання коронарної артерії, артеріосклероз, атеросклероз, не-атероматозний артеріосклероз або ушкодження судинної стінки). Він також використовується для позначення захворювань, які включають неогенез або проліферацію кров'яного русла ока, зокрема хороідальну неоваскуляризацію. Термін «нейронна регенерація» відноситься до стимуляції росту нейронних клітин і включає розростання нейриту та функціональне відновлення нейронних клітин. Захворювання та розлади, при яких нейронна регенерація може приносити значну терапевтичну користь, включають, але не обмежуються, хворобу Альцгеймера, хворобу Паркінсона, хорею (хвороба) Гентінгтона, аміотрофічний латеральний склероз, невралгію трійчастого нерва, невралгію язикоглоткового нерва, параліч Белла, м'язову дистрофію, інсульт, прогресуючу м'язову атрофію, прогресуючу бульбарну спадкову м'язову атрофію, цервікальний спондильоз, синдром Гійєна-Барре, деменцію, периферійні нейропатії та ушкодження периферійних нервів, викликані фізичним ушкодженням (наприклад, ушкодження або травма спинного мозку, ушкодження або травма сідничного або лицьового нерва) або патологічним станом (наприклад, діабетом). Термін «патологічний стан, який є наслідком нейронного ушкодження або захворювання», включає без обмеження нейродегенеративне(і) захворювання(я), пухлину(и) головного мозку, інфекцію або запалення головного мозку та інші стани, які можуть призвести до загибелі або порушення функції нервових або гліальних клітин або тканин. Термін «нейродегенеративний стан(и)» включає без обмеження хворобу Альцгеймера, хворобу Паркінсона, хворобу Гентінгтона, аміотрофічний латеральний склероз (АЛС), (окулофарингеальну) м'язову дистрофію, розсіяний склероз, пріонні хвороби (наприклад, хворобу Крейтцфельда-Якоба (ХКЯ)), хворобу Піка, деменцію з тільцями Леві (або хворобу з тільцями Леві) та/або хворобу моторних нейронів. Термін «патологічні стани, які вражають центральну нервову систему, і потребують медикаментів, які перетинають гематоенцефалічний бар'єр» включають без обмеження патологічні стани, які є результатом ушкоджень або захворювань нервової системи, та будь-яких інших чинників, для ефективної терапії яких необхідний доступ медикаментів до нервових клітин. Термін «фіброзні захворювання» відноситься до захворювань, пов'язаних з надлишковою про 94580 12 дукцією екстрацелюлярного матрикса і включає (без обмеження) саркоідоз, келоїди, гломерулонефрит, захворювання нирок у термінальній стадії, фіброз печінки (включаючи, але не обмежуючись названими, цироз, алкогольне ураження печінки та стеатогепатит), хронічну нефропатію трансплантата, хірургічні спайки, васкулопатію, фіброз серця, легеневий фіброз (включаючи, але не обмежуючись названими, ідиопатичний легеневий фіброз та криптогенний фіброзуючий альвеоліт), макулярну дегенерацію, ретинопатію та вітреоретинопатію та фіброз, індукований хіміотерапією або радіацією. Термін «хвороба «трансплантат проти хазяїна»» відноситься до ускладнень, які спостерігаються після трансплантації алогенних стовбурових клітин/кісткового мозку. Дана хвороба розвивається, коли клітини донора, які покликані протидіяти інфекції, ідентифікують організм пацієнта як такий, що є відмінним або чужорідним. Ці клітини, які покликані протидіяти інфекції, потім атакують тканини в організмі пацієнта так, як вони атакують інфекцію. ХТПХ вважається гострою, якщо вона розвивається протягом перших 100 днів після трансплантації і хронічною, якщо вона розвивається більше ніж через 100 днів після трансплантації. Зазвичай тканинами, які втягуються у цей процес, є печінка, шлунково-кишковий тракт та шкіра. Хронічна хвороба «трансплантат проти хазяїна»» зустрічається приблизно у 10-40% пацієнтів після трансплантації стовбурових клітин/кісткового мозку. Термін «біодоступність» відноситься до ступеня або швидкості, за якої ліки або інша речовина абсорбується або стає доступною у місці біологічної активності після застосування. Ця властивість залежить від ряду факторів, включаючи розчинність сполуки, швидкість абсорбції в кишківнику, ступінь зв'язування з білками та метаболізмом тощо. Різні тести на біодоступність, відомі особам, компетентнимим у даній галузі, описані тут (див. також Trepanier et al., 1998, Gallant-Hainder et al., 2000). Термін «пухлина або В-клітинні новоутворення, стійкі до одного або більше існуючого протиопухолевого агента(ів)» відноситься до видів пухлин або В-клітинних новоутворень, для яких, принаймні, один вид терапії, який зазвичай застосовується є неефективним. Ці види пухлин характеризуються здатністю до виживання після застосування, принаймні, одного неопластичного агента, при якому аналоги - нормальні клітини (наприклад ті, що регулюють ріст клітини такого ж самого походження) проявляють ознаки клітинної токсичності, клітинної загибелі або клітинної нерухомості (наприклад, не можуть ділитися). Зокрема, вони включають МФР-види пухлин або В-клітинних новоутворень, які експресують високий рівень Рgр. Ідентифікація таких стійких видів пухлин або Вклітинних новоутворень у межах можливостей і звичайної практики лікарів або інших компетентних осіб. Термін «аналоги 39-дезметоксирапаміцину» відноситься до сполук формули (І) наведеної нижче, або їх фармацевтично прийнятних солей. 13 де R1 є (Н,Н; або =O, а R2 та R3 незалежно є Н, ОН або ОСН3. Ці сполуки також відносяться до «сполук даного винаходу», і ці терміни використовуються почергово в даній заявці. У даній заявці термін «аналог 39дезметоксирапаміцину» включає 39дезметоксирапаміцин як такий. Термін «39-дезметоксирапаміцин» відноситься до сполуки формули (І) наведеної вище, або її фармацевтично прийнятної солі, при цьому R1 представлений =O, a R2 та R3 кожний представлені ОСН3. Фармацевтично прийнятні солі аналогів 39дезметоксирапаміцину включають звичайні солі, утворені фармацевтично прийнятними неорганічними або органічними кислотами або основами, також як і додатковими солями четвертинних амонійних кислот. Більш конкретні приклади придатних кислот включають соляну, бромоводневу, сірчану, фосфорну, азотну, перхлорну, фумарову, оцтову, пропіонову, бурштинову, гліколеву, мурашину, молочну, малеїнову, винну, лимонну, пальмову, малонову, гідроксималеінову, фенілоцтову, глутамінову, бензойну, саліцилову, толуолсульфонову, метансульфонову, нафталін-2-сульфонову, бензинсульфонову, нафтойну, йодоводневу, яблучну, стероїдную, дубильну та їм подібні кислоти. Інші кислоти, такі як щавлева, хоча та не є фармакологічно прийнятними, можуть бути корисними для приготування солей, які використовуються як інтермедіати при одержанні сполук даного винаходу та їх фармацевтично прийнятних солей. Більш конкретні приклади прийнятних основ солей включають солі натрію, літію, калію, магнію, алюмінію, кальцію, цинку, N,N-дибензилетилендіаміну, хлоропрокаїну, холіну, діетаноламіну, етилендіаміну, N-метилглюкаміну та прокаіну. Надалі посилання на сполуки відповідно до даного винаходу включають як 39-дезметоксирапаміцин, так і його фармацевтично прийнятні солі. Даний винахід стосується застосування аналогів 39-дезметоксирапаміцину в медицині, зокрема для лікування пухлин та В-клітинних новоутворень, індукції або підтримки імуносупресії, лікування відторгнення трансплантата, хвороби «трансплантат проти хазяїна», аутоімунних захворювань, нейродегенеративних станів, запальних захворювань, захворювань судин та фіброзних захворювань, стимуляції нейронної регенерації, лікування 94580 14 неврологічних захворювань або нейродегенеративних станів або лікування грибкових інфекцій. Таким чином, даний винахід стосується використання аналогів 39-дезметоксирапаміцину, або їх фармацевтично прийнятних солей, для лікування патологічних станів, які є результатом ушкоджень або захворювань нервової системи. В іншому конкретному втіленні даний винахід стосується застосування 39-дезметоксирапаміцину, або його фармацевтично прийнятних солей, для лікування патологічних станів, які є результатом ушкоджень або захворювань нервової системи. В іншому конкретному втіленні даний винахід стосується застосування аналогів 39-дезметоксирапаміцину, які додатково відрізняються від рапаміцину за одним або більше положенням 9, 16 або 27, для лікування патологічних станів, які є результатом ушкоджень або захворювань нервової системи. Даний винахід також стосується застосування аналога 39-дезметоксирапаміцину, тобто аналога рапаміцину з підвищеною здатністю проникати крізь гематоенцефалічний бар'єр, або його фармацевтично прийнятної солі, для лікування патологічних станів, які впливають на центральну нервову систему, і які потребують медикаменту, який проникає крізь гематоенцефалічний бар'єр, тобто патологічних станів, при яких гематоенцефалічний бар'єр перешкоджає надходженню сполуки. В іншому конкретному втіленні, даний винахід стосується застосування 39-дезметоксирапаміцину, або його фармакологічно прийнятної солі, для лікування патологічних станів, які впливають на центральну нервову систему, де гематоенцефалічний бар'єр перешкоджає надходженню сполуки. В іншому конкретному втіленні, даний винахід стосується використання аналога 39дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27, для лікування патологічних станів, які впливають на центральну нервову систему, при яких гематоенцефалічний бар'єр перешкоджає надходженню сполуки. В іншому окремому втіленні даний винахід стосується застосування аналогів 39дезметоксирапаміцину для лікування пухлин і Вклітинних новоутворень. В іншому конкретному втіленні даний винахід стосується застосування 39-дезметоксирапаміцину для лікування пухлин і В-клітинних новоутворень. В іншому (додатковому) окремому втіленні даний винахід стосується застосування аналога 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27, для лікування пухлин і В-клітинних новоутворень. Даний винахід також зокрема стосується застосування аналогів 39-дезметоксирапаміцину для лікування пухлини(н) головного мозку. В іншому конкретному втіленні даний винахід стосується застосування аналога 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27, для лікування пухлини(н) головного мозку. Зокрема, даний винахід стосується застосування аналога 39-дезметоксирапаміцину для лікування мультиформної гліобластоми. У конкретному втіленні 15 даний винахід стосується застосування 39дезметоксирапаміцину для лікування мультиформної гліобластоми. В іншому конкретному втіленні, даний винахід стосується застосування аналога 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27, для лікування мультиформної гліобластоми. Даний винахід також стосується застосування аналогів 39-дезметоксирапаміцину для лікування нейродегенеративних станів. В іншому конкретному втіленні даний винахід стосується застосування аналога 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27, для лікування нейродегенеративних станів. Зокрема, нейродегенеративние стани можуть бути обрані із групи, яка складається із хвороби Альцгеймера, розсіяного склерозу та хвороби Гентінгтона. Таким чином, в одному втіленні даний винахід стосується застосування аналогів 39-дезметоксирапаміцину для лікування хвороби Альцгеймера. В іншому окремому втіленні даний винахід стосується застосування 39дезметоксирапаміцину для лікування хвороби Альцгеймера. В іншому конкретному втіленні даний винахід стосується застосування аналога 39дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27, для лікування хвороби Альцгеймера. У ще одному конкретному втіленні даний винахід стосується застосування аналогів 39дезметоксирапаміцину для лікування розсіяного склерозу. В іншому конкретному втіленні даний винахід стосується застосування 39дезметоксирапаміцину для лікування розсіяного склерозу. В іншому конкретному втіленні даний винахід стосується застосування аналога 39дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27, для лікування розсіяного склерозу. В альтернативному втіленні даний винахід стосується застосування аналогів 39дезметоксирапаміцину для лікування хвороби Гентінгтона. В іншому конкретному втіленні даний винахід стосується застосування 39дезметоксирапаміцину для лікування хвороби Гентінгтона. У ще одному конкретному втіленні даний винахід стосується застосування аналога 39дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27, для лікування хвороби Гентінгтона. В альтернативному втіленні, даний винахід стосується способу лікування пухлин або Вклітинних новоутворень, способу індукції або підтримки імуносупресії, стимуляції нейронної регенерації, способу лікування грибкових інфекцій, відторгнення трансплантата, хвороби трансплантат проти хазяїна, аутоімунних захворювань, нейродегенеративних станів, запальних захворювань судин або фіброзних захворювань, що включає застосування в пацієнтів в ефективній кількості аналога 39-дезметоксирапаміцину, зокрема 39дезметоксирапаміцину або аналога 39дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше поло 94580 16 женням 9, 16 або 27. Зокрема, даний винахід стосується способу лікування патологічних станів, які є результатом ушкоджень або захворювань нервової системи, який передбачає застосування аналога 39-дезметоксирапаміцину, або його фармацевтично прийнятної солі. В іншому конкретному втіленні даний винахід стосується способу лікування патологічних станів, які є результатом ушкоджень або захворювань нервової системи, який передбачає застосування 39дезметоксирапаміцину. В іншому конкретному втіленні, даний винахід стосується способу лікування патологічних станів, які є результатом ушкоджень або захворювань нервової системи, який передбачає застосування аналога 39дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. Даний винахід також стосується способу лікування патологічних станів, які впливають на центральну нервову систему, при яких гематоенцефалічний бар'єр перешкоджає надходженню сполуки, шляхом застосування ефективної кількості аналога 39дезметоксирапаміцину, тобто аналога рапаміцину з підвищеною здатністю проникати крізь гематоенцефалічний бар'єр, або його фармацевтично прийнятної солі. У конкретному аспекті аналогом 39дезметоксирапаміцину є 39-дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39дезметоксирапаміцину є аналог 39дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. У кращому випадку, даний винахід стосується способу лікування пухлин або В-клітинних новоутворень, який передбачає введення пацієнтові ефективної кількості аналога 39дезметоксирапаміцину. В іншому конкретному кращому втіленні даний винахід стосується способу лікування пухлини(н) головного мозку, який передбачає введення пацієнтові ефективної кількості аналога 39-дезметоксирапаміцину. У конкретному аспекті аналогом 39-дезметоксирапаміцину є 39дезметоксирапаміцин. У ще одному конкретному аспекті аналогом 39-дезметоксирапаміцину є аналог 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. В іншому конкретному втіленні даний винахід стосується способу лікування мультиформної гліобластоми, який передбачає введення пацієнтові ефективної кількості аналога 39-дезметоксирапаміцину. У конкретному аспекті аналогом 39-дезметоксирапаміцину є 39дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39-дезметоксирапаміцину є аналог 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. В іншому кращому втіленні даний винахід стосується способу лікування нейродегенеративних станів, який передбачає введення пацієнтові ефективної кількості аналога 39дезметоксирапаміцину. У конкретному аспекті аналогом 39-дезметоксирапаміцину є 39дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39-дезметоксирапаміцину є аналог 17 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. Зокрема, перелік нейродегенеративних станів включає хворобу Альцгеймера, розсіяний склероз та хворобу Гентінгтона. Таким чином, в одному втіленні даний винахід стосується способу лікування хвороби Альцгеймера, який передбачає введення пацієнтові ефективної кількості аналога 39дезметоксирапаміцину. У конкретному аспекті аналогом 39-дезметоксирапаміцину є 39дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39-дезметоксирапаміцину є аналог 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. В іншому конкретному втіленні даний винахід стосується способу лікування розсіяного склерозу, який передбачає введення пацієнтові ефективної кількості аналога 39дезметоксирапаміцину. У конкретному аспекті аналогом 39-дезметоксирапаміцину є 39дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39-дезметоксирапаміцину є аналог 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. В альтернативному втіленні даний винахід стосується способу лікування хвороби Гентінгтона, який передбачає введення пацієнтові ефективної кількості аналога 39дезметоксирапаміцину. У конкретному аспекті аналогом 39-дезметоксирапаміцину є 39дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39-дезметоксирапаміцину є аналог 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. Даний винахід також стосується застосування аналога 39-дезметоксирапаміцину у виробництві медикаменту для лікування пухлин або Вклітинних новоутворень, індукції або підтримки імуносупресії, стимуляції нейронноі регенерації, лікування грибкових інфекцій, лікування відторгнення трансплантата, хвороби «трансплантат проти хазяїна», аутоімунних захворювань, нейродегенеративних станів, запальних захворювань, захворювань судин і фіброзних захворювань. Зокрема, даний винахід стосується застосування аналога 39-дезметоксирапаміцину, або його фармацевтично прийнятної солі, для приготування медикаменту для лікування патологічних станів, які є результатом ушкоджень або захворювань нервової системи. У конкретному аспекті аналогом 39-дезметоксирапаміцину є 39дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39-дезметоксирапаміцину є аналог 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. Даний винахід також стосується застосування аналога 39-дезметоксирапаміцину, тобто аналога рапаміцину з підвищеною здатністю проникати крізь гематоенцефалічний бар'єр, або його фармацевтично прийнятної солі, для приготування медикаменту для лікування патологічних станів, які впливають на центральну нервову систему, при 94580 18 яких гематоенцефалічний бар'єр перешкоджає надходженню сполуки. У конкретному аспекті аналогом 39-дезметоксирапаміцину є 39дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39-дезметоксирапаміцину є аналог 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. Даний винахід також конкретно стосується застосування аналога 39-дезметоксирапаміцину у виробництві медикаменту для лікування пухлини(лин) головного мозку. У конкретному аспекті аналогом 39-дезметоксирапаміцину є 39дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39-дезметоксирапаміцину є аналог 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. В іншому конкретному втіленні даний винахід конкретно стосується застосування аналога 39-дезметоксирапаміцину у виробництві медикаменту для лікування мультиформної гліобластоми. У конкретному аспекті аналогом 39-дезметоксирапаміцину є 39дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39-дезметоксирапаміцину є аналог 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. Даний винахід також стосується застосування аналога 39-дезметоксирапаміцину у виробництві медикаменту для лікування нейродегенеративних станів. У конкретному аспекті аналогом 39дезметоксирапаміцину є 39-дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39дезметоксирапаміцину є аналог 39дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. Зокрема, перелік нейродегенеративних станів може включати хворобу Альцгеймера, розсіяний склероз та хворобу Гентінгтона. Таким чином, в одному втіленні даний винахід стосується застосування аналога 39дезметоксирапаміцину у виробництві медикаменту для лікування хвороби Альцгеймера. У конкретному аспекті аналогом 39-дезметоксирапаміцину є 39-дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39-дезметоксирапаміцину є аналог 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. В іншому конкретному втіленні даний винахід стосується застосування аналога 39-дезметоксирапаміцину у виробництві медикаменту для лікування розсіяного склерозу. У конкретному аспекті аналогом 39дезметоксирапаміцину є 39-дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39дезметоксирапаміцину є аналог 39дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. В альтернативному втіленні даний винахід стосується застосування аналога 39-дезметоксирапаміцину у виробництві медикаменту для лікування хвороби Гентінгтона. У конкретному аспекті аналогом 39дезметоксирапаміцину є 39-дезметоксирапаміцин. 19 94580 В іншому конкретному аспекті аналогом 39дезметоксирапаміцину є аналог 39дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. Аналоги 39-дезметоксирапаміцину є близькими структурними аналогами рапаміцину, які виго 20 товлені з використанням способів, описаних в WО 04/007709. Однак вони демонструють різний спектр активності рапаміцину, наприклад, як показано COMPARE-аналізом панелі клітинної лінії NCI 60 для 39-дезметоксирапаміцину та споріднених аналогів (див. таблицю 1 нижче). Таблиця 1 Сполуки 16-О-десмети-27-О-дезметил-39-дезметоксирапаміцин 27-О-дезметил-39-дезметоксирапаміцин 39-дезметоксирапаміцин 27-десметокси-39-дезметоксирапаміцин ССІ-779 COMPARE-аналіз використовує аналіз Пірсона для того, щоб порівняти активність двох сполук на панелі клітинної лінії NCI 60, і дає коефіцієнт кореляції, який показує, наскільки схожі спектри активності двох сполук, і це може показати, як пов'язані механізми їхньої дії. Як конкретний приклад, коефіцієнт Пірсона для рапаміцину та 39дезметоксирапаміцину становить 0,614, це можна порівняти з коефіцієнтом Пірсона між рапаміцином та ССІ-779 (40-гідрокси-ефірним похідним рапаміцину), який становить 0,86 (Dancey, 2000). Таким чином, виявляється, що аналоги 39дезметоксирапаміцину мають спектр активності відмінний від такого рапаміцину. Мульти-фармакологічна резистентність (МФР) є значною проблемою при лікуванні пухлин та Вклітинних новоутворень. Це основна причина розвитку фармакологічної резистентності при багатьох видах пухлин (Persidis А., 1999). Ліки, які спочатку діють, через деякий час стають повністю неефективними. МФР пов'язана зі зрослим рівнем аденозин-трифосфат-зв'язуючих касетних переносчиків (АЗК-переносників), зокрема з підвищенням експресії гена MDR1, який кодує Р-глікопротеїн (Рgр) або гена MRP1, який кодує MRP1. Рівень експресії гена MDR1 коливається в широких межах серед клітинних ліній, виділених з пухлин, у деяких клітинних ліній він не виявляється, у той час як інші можуть демонструвати аж до 10 або 100разового збільшення експресії в порівнянні зі стандартним контролем. Деякі з позначених розходжень спектра активності між рапаміцином та 39дезметоксирапаміцином можуть бути пояснені тим, що аналоги 39-дезметоксирапаміцину не є субстратом для Р-gр. Аналоги 39дезметоксирапаміцину мають знижений вихід із клітин Сасо-2 у порівнянні з рапаміцином, і 39дезметоксирапаміцин, як було показано, не є субстратом для Р-gр в in vitro аналізі на субстрат для Р-gр (див. приклади). Таким чином, конкретний аспект даного винаходу стосується застосування аналогів 39дезметоксирапаміцину для лікування пухлин або В-клітинних новоутворень, стійких до одного або більше існуючих протипухлинних агентів, тобто МФР видів пухлин або В-клітинних новоутворень. У конкретному аспекті даний винахід стосується Коефіцієнт Пірсона у порівнянні з рапаміцином 0,435 0,261 0,614 0,313 0,86 застосування 39-дезметоксирапаміцину для лікування P-gp-експресуючих видів пухлин або Вклітинних новоутворень. У ще кращому втіленні даний винахід стосується застосування 39дезметоксирапаміцину для лікування видів пухлин або В-клітинних новоутворень з високим рівнем Pgp-експресіі. Зокрема, види пухлин або Вклітинних новоутворень з високим рівнем P-gpекспресіі можуть мати 2-разове, 5-разове, 10разове, 20-разове, 25-разове, 50-разове або 100разове підвищення експресії в порівнянні з контрольним рівнем. У конкретному аспекті вище вказаним аналогом 39-дезметоксирапаміцину є 39дезметоксирапаміцин. В іншому конкретному аспекті використання аналогом 39дезметоксирапаміцину є аналог 39дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. Придатним контролем є клітини, які не експресують Р-gр, які мають низький рівень експресії Р-gр, або які мають низьку МФР; фахівці у даній галузі, можуть ідентифікувати такі клітинні лінії; як приклад, але не як обмеження, такі клітинні лінії включають: MDA435/LCC6, SBC3/CDDP, MCF7, NCI-H23, А549/АТСС, EKVX, NCIH226, NCI-H322M, NCI-H460, НОР-18, НОР-92, LXFL 529, DMS 114, НТ29, НСС-2998, НСТ-116, COLO 205, КМ12, KM20L2, MDA-MB-231/ATCC, MDA-MB-435, MDA-N, ВТ-549, T-47D, OVCAR-3, OVCAR-4, OVCAR-5, OVCAR-8, IGROV1, SK-OV-3, K-562, MOLT-4, HL-60(TB), RPMI-8226, SR, SN12C, RXF-631, 786-0, ТК-10, LOX IMVI, MALME-3M, SKMEL-2, SK-MEL-5, SK-MEL-28, M14, UACC-62, UACC-257, РС-3, DU-145, SNB-19, SNB-75, SNB78, U251, SF-268, SF-539, XF 498. В альтернативному аспекті даний винахід стосується застосування аналога 39дезметоксирапаміцину для приготування медикаменту для використання його при лікуванні МФР видів пухлин або В-клітинних новоутворень. У конкретному аспекті даний винахід стосується застосування аналога 39-дезметоксирапаміцину для приготування медикаменту для використання його при лікуванні P-gp-експресуючих видів пухлин або В-клітинних новоутворень. У ще кращому втіленні даний винахід стосується застосування 39дезметоксирапаміцину для приготування медикаменту для лікування таких видів пухлин або В 21 клітинних новоутворень для яких характерним є високий рівень P-gp-експресіі. Зокрема, види пухлин або В-клітинних новоутворень з високим рівнем P-gp-експресіі можуть мати 2-разове, 5разовег 10-разове, 20-разове, 25-разове, 50разове або 100-разове підвищення експресії в порівнянні з контрольним рівнем. У конкретному аспекті застосування аналогом 39дезметоксирапаміцину є 39-дезметоксирапаміцин. В іншому конкретному аспекті аналогом 39дезметоксирапаміцину, який використовується є аналог 39-дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. Придатним є контроль описаний вище. Методи визначення рівня експресії Р-gр у зразку обговорюються тут далі. Таким чином, в іншому конкретному аспекті даний винахід стосується способу лікування P-gpекспресуючих видів пухлин або В-клітинних новоутворень, який передбачає введення терапевтично ефективних кількостей аналога 39дезметоксирапаміцину. У конкретному аспекті аналогом 39-дезметоксирапаміцину є 39дезметоксирапаміцин. В іншому конкретному аспекті використовуваним аналогом 39дезметоксирапаміцину є аналог 39дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. Рівень експресії Рглікопротеїну (Р-gр) для окремих типів пухлин може бути визначений фахівцем у даній галузі, за допомогою методів перелік яких включає, але не обмежений, метод ОТ-ПЦР у реальному часі (Szakacs et al., 2004; Stein et al., 2002; Langmann et al., 2003), метод імуногістохімії (Stein et al., 2002), або метод мікрочипів (Lee et al, 2003), ці методи приводяться тільки як приклад, інші придатні методи можуть використовуватися особами, компетентними у даній галузі. 39-дезметоксирапаміцин демонструє підвищену метаболічну стабільність у порівнянні з рапаміцином, як показано тут у прикладах. У ряді статей 39-метокси-група рапаміцину попередньо була ідентифікована як головна ділянка метаболічної атаки для перетворення рапаміцину в 39-Oдезметоксирапаміцин (Trepanier et al., 1998). Головні метаболіти рапаміцину мають значно знижену активність у порівнянні з вихідною сполукою (Gallant-Hainder et al., 2000; Trepanier et al., 1998). Навпаки, 39-дезметоксирапаміцин уже не має найбільш значимих ділянок для метаболічної атаки, що призводить до підвищення стабільності сполук (див. приклади). Разом з більш високою або еквівалентною ефективністю це забезпечує довший час напів-життя сполуки даного винаходу. Це додаткова несподівана перевага 39дезметоксирапаміцину над рапаміцином. Властивості 39-дезметоксирапаміцину, описані вище (те, що він не є субстратом для Р-gр, має підвищену метаболічну стабільність і зменшений вихід із клітини через Р-gр) показують, що 39дезметоксирапаміцин має поліпшену біодоступність у порівнянні з вихідною сполукою рапаміцином. Таким чином, даний винахід присв'ячений 94580 22 застосуванню у медицині 39дезметоксирапаміцину, аналога рапаміцину з поліпшеною метаболічною стабільністю, поліпшеною проникаючою здатністю крізь клітинні мембрани, який відрізняється інгібуючим профілем відносно пухлинних клітин, зокрема для лікування пухлин або В-клітинних новоутворень. Даний винахід також стосується фармацевтичної композиції, яка містить аналог 39дезметоксирапаміцину, або його фармацевтично прийнятної солі, разом з фармацевтично прийнятним носієм. У конкретному аспекті даний винахід стосується фармацевтичної композиції, яка містить 39-дезметоксирапаміцин. В іншому конкретному аспекті даний винахід стосується фармацевтичної композиції, яка містить аналог 39дезметоксирапаміцину, який додатково відрізняється від рапаміцину за одним або більше положенням 9, 16 або 27. У конкретному втіленні даний винахід стосується фармацевтичної композиції, як описано вище, яка специфічно складена для внутрішньовенного використання. Рапаміцин і подібні сполуки, які перебувають на стадії або пройшли клінічні випробування, такі як ССІ-77 9 і RAD001, мають поганий фармакологічний профіль, який включає погану метаболічну стабільність, погану проникаючу здатність, високий рівень виходу через Р-gр і погану бioдоступність. Даний винахід стосується застосування аналога 39-дезметоксирапаміцину або його фармацевтично прийнятної солі, які мають поліпшені фармацевтичні властивості в порівнянні з рапаміцином. Окремим несподіваним аспектом даного винаходу - є те, що аналоги 39-дезметоксирапаміцину проявляють фармакокінетичний профіль, який разюче відрізняється у порівнянні з існуючими аналогами рапаміцину. Зокрема, аналоги 39дезметоксирапаміцину демонструють підвищену проникаючу здатність крізь гематоенцефалічний бар'єр, і тому в головному мозку спостерігається підвищений вплив даних з'єднань у порівнянні з подібними аналогами при певному рівні в крові. Ця відмінність фармакокінетики є зовсім несподіваною та не була відомою в існуючому рівні техніки. Відомий недолік терапії, яка використовується на даний час, захворювань включаючи нейродегенеративні стани та пухлини мозку - проблема доставки ліків до місця дії (див. Pardridge, 2005). Також повідомлялося, що це є проблемою при використанні в терапії існуючих аналогів рапаміцину; зокрема, дослідження ефективності ССІ779 у лікуванні мультиформної глioбластоми дозволило зробити висновок, що хоча системна концентрація була достатньою, гематоенцефалічний бар'єр був на перешкоді для доставки ліків до пухлини (Chang, 2005). Даний винахід, таким чином, уперше відкриває аналог рапаміцину з поліпшеною проникаючою здатністю для гематоенцефалічного бар'єра, і таким чином, значною користю при лікуванні пухлин головного мозку та нейродегенеративних станів. Кращими аналогами 39-дезметоксирапаміцину для використання в будь-яких з аспектів даного винаходу, описаних вище, є ті, які додатково відрі 23 зняються від рапаміцину за кожним з положень 9, 16 або 27, тобто бажано, щоб аналог 39дезметоксирапаміцину не був властне 39дезметоксирапаміцином. Інші кращі аналоги 39дезметоксирапаміцину включають: - аналог 39-дезметоксирапаміцину, який має гідроксильну групу в положенні 27, тобто R3 представлений ОН; - аналог 39-дезметоксирапаміцину, який має водень у положенні 27, тобто R3 представлений ОН; або - аналог 39-дезметоксирапаміцину, який має гідроксильну групу в положенні 16, тобто R2 представлений ОН. Особи, компетентні в даній галузі, здатні визначити фармакокінетику та біодоступність сполуки даного винаходу з використанням in vitro і in vivo методів, відомих компетентним особам, включаючи, але не обмежуючись, ті, які описані вище та в Gallant-Hainder et al., 2000 і Trepanier et al., 1998, і включені тут у вигляді посилань. Біодоступність сполуки визначається рядом чинників (наприклад, розчинністю у воді, проникненням крізь клітинні мембрани, ступенем зв'язування з білками, метаболізмом та стабільністю), кожний з яких може бути визначений аналізами in vitro, як описано в прикладах вище; особами, компетентними в даній галузі, відзначається, що поліпшення одного або більше факторів веде до поліпшення біодоступності сполуки. Крім того, біодоступність 39дезметоксирапаміцину або його фармацевтично прийнятної солі може бути визначена методами in vivo, як це описано нижче більш детально, або в прикладах. Методи аналізу in vivo. Методи аналізу in vivo також можуть бути використані для визначення біодоступності такої сполуки, як 39-дезметоксирапаміцин. Загалом, вищевказані сполуки застосовувались на експериментальних тваринах (наприклад, на мишах або пацюках) як інтраперитонеально (і/п) або внутрішньовенно (в/в), так і перорально (п/ο), і відбирали зразки крові з регулярними інтервалами, щоб оцінити, як концентрація ліків у плазмі змінюється протягом часу. Зміна з часом концентрації в плазмі може бути використана для того, щоб підрахувати абсолютну бioдоступність сполуки як відсотка при використанні стандартних моделей. Приклад типового протоколу наведений нижче. Мишам уводили дозу 3 мг/кг 39дезметоксирапаміцину в/в або 10 мг/кг 39дезметоксирапамшину п/о. Зразки крові відбирали через 5 хв, 15 хв, 1 годину, 4 години та 24 години, і визначали концентрацію 39-дезметоксирапаміцину в зразку методом ВЕРХ. Зміна з часом концентрації в плазмі або в цільній крові потім могли бути використані, щоб одержати ключові параметри, такі як площа під графіком "концентрація в крові або плазмі - час" (ППГ - яка прямо пропорційна загальній кількості незмінених ліків, які надійшли до системної циркуляції), максимум (пік) концентрації в крові або плазмі; момент часу, в який спостерігається максимум концентрації ліків у крові або плазмі (час піка); додаткові фактори, які використовуються для точного визначення 94580 24 бioдоступності, включаючи: час напів-життя сполуки, загальний кліренс організмом, статичний об'єм розподілу та F%. Ці параметри потім аналізують не-розділяючими або розділяючими методами, щоб одержати підраховану процентну бioдоступність, наприклад за типом методу див. Gallant-Haidner et al., 2000 i Trepanier et al., 1998, і посилання. Ефективність 39-дезметоксирапаміцину може бути проаналізована в моделях in vivo для нейродегенеративних захворювань, які описані тут і які відомі особам, компетентним у даній галузі. Такі моделі включають, але не обмежуються переліченими, для хвороби Альцгеймера - тварин, які експресують людський п-амілоідний попередник (АРР) родинної спадкової хвороби Альцгеймера (FAD); тварин, які надлишково експресують людський АРР дикого типу; тварин, які надлишково експресують р-амілоїд 1-42 (рА); тварин, які експресують FAD пресенілін-1 (PS-1) (наприклад, German and Tisch, 2004). Для розсіяного склерозу модель експериментального аутоімунного енцефаломієліту (ЕАЕ) (див. Bradl, 2003 і Приклад 7). Для хвороби Паркінсона - 1-метил-4-феніл-1,2, 3,β-тетрагідропіридинову (МРТР) модель або 6гідроксидофамінову (6-OHDA) модель (див., наприклад, Emborg, 2004; Schober Α., 2004). Для хвороби Гентінгтона є кілька моделей, включаючи модель на R6 лініях, утворених шляхом введення екзона 1 з гена хвороби Гентінгтона (ГБ) людини, який несе сильно розширені CAG повтори в мишачу зародкову лінію (Sathasivam et al., 1999) та інші (див. Hersch and Ferrante, 2004). Вищезгадана сполука запропонована винаходом або її композиція можуть уводитися за допомогою будь-якого додаткового способу, наприклад, але без обмежуючись перерахованими, вони можуть бути застосовані парентерально, перорально, місцево (у тому числі буккально, сублінгвально або трансдермально), через медичні прилади (наприклад, стент), шляхом інгаляції або за допомогою ін'єкції (підшкірної або внутріш1 ньом язової). Лікування може складатися з одиничної дози або багатьох доз протягом певного періоду часу. Якщо можливо застосувати аналог 39дезметоксирапаміцину окремо, бажано представити його як фармацевтичну композицію, разом з одним або більше прийнятними носіями. Носій (ї) повинен бути "прийнятним" у тому сенсі, що він повинен бути сумісним із сполуками винаходу, і не заподіяти шкоди пацієнтові внаслідок його застосування. Приклади придатних носіїв більш детально описані нижче. Аналог 39-дезметоксирапаміцину може застосовуватися окремо або в комбінації з іншими терапевтичними агентами; спільне застосування двох (або більше) агентів дозволяє значно знизити дозу кожного з використовуваних речовин, таким чином, знижуючи можливі побічні ефекти. Підвищена метаболічна стабільність 39дезметоксирапаміцину дає ту додаткову перевагу у порівнянні з рапаміцином, що він з меншою ймовірністю може спричинити взаємодію між ліками, якщо він використовується в комбінації з ліками, 25 які є субстратами для ферментів родини Р450, як це відбувається з рапаміцином (Lampen et al., 1998). Отже, в одному втіленні аналог 39дезметоксирапаміцину застосовується разом з іншим терапевтичним агентом для індукції або підтримки імуносупреси, для лікування відторгнення трансплантата, хвороби "трансплантат проти хазяїна", аутоімунних порушень або запальних захворювань, включаючи такі кращі агенти, але не обмежуючись переліченими, імунорегуляторні агенти, наприклад азатioприн, кортикостероїди, циклофосфамід, циклоспорин A, FK506, мікофенолят мофетил, ОКТ-3 і ATG. В альтернативному втіленні аналог 39дезметоксирапаміцину вводиться разом з іншим терапевтичним агентом для лікування пухлин і Вклітинних новоутворень, перелік кращих агентів включає, але не обмежується перерахованими, метотрексат, лейковорин, адріаміцин, пренізон, блеоміцин, циклофосфамід, 5-фторурацил, паклітаксель, доцетаксель, вінкристін, вінбластін, вінорельбін, доксорубіцин, тамоксифен, тореміфен, мегестрол ацетат, анастрозол, госерелін, антиНЕR2 моноклональні антитіла (наприклад, Герцептин™) , капецитабін, ралоксифен гідрохлорид, інгібітори рецептора епідермального ростового фактора (наприклад, Iressa®, Tarceva™, Erbitux™) , інгібітори фактора росту васкулярного ендотелію (наприклад, Avastin™) , інгібітори протеасом (наприклад, Velcade™), Glivec® або інгібітори hsp90 (наприклад, 17 AAG). Крім того, 39дезметоксирапаміцин може застосовуватися у поєднанні з іншими видами лікування, включаючи, але не обмежуючись перерахованими, радіотерапію або хірургію. В одному втіленні аналог 39дезметоксирапаміцину застосовується разом з іншим терапевтичним агентом для лікування захворювань судин, перелік кращих агентів включає, але не обмежується перерахованими, АСЕ інгібітори, антагоністи рецептора ангіотензину II похідні фібрової кислоти, інгібітори HMG-CoA-редуктази; агенти, які блокують бета-адренергічні рецептори, блокатори кальцієвих каналів, антиоксиданти, антикоагулянти та інгібітори тромбоцитів (наприклад, Plavix™). В іншому втіленні аналог 39дезметоксирапаміцину вводиться разом з іншим терапевтичним агентом для стимуляції нейронної регенерації, перелік кращих агентів включає, але не обмежується перерахованими, нейротрофні фактори, наприклад, фактор росту нервових клітин; фактор росту, виділений із гліальних клітин; фактор росту, виділений з головного мозку; циліарний нейротрофний фактор і нейротрофін-3. В одному втіленні аналог 39дезметоксирапаміцину вводиться разом з іншим терапевтичним агентом для лікування грибкових інфекцій; перелік кращих агентів включає, але не обмежується перерахованими, амфотеріцин В, флюцитозін, ехінокандіни (наприклад, каспофунгін, анідулафунгін або мікафунгін), грізеофульвін, імідазольні або триазольні протигрибкові агенти (наприклад, клортимазол, міконазол, кетоконазол, 94580 26 еконазол, бутоконазол, оксиконазол, терконазол, ітраконазол, флюконазол або вориконазол). В одному втіленні аналог 39дезметоксирапаміцину застосовується разом з іншим терапевтичним агентом для лікування хвороби Альцгеймера; перелік кращих агентів включає, але не обмежується перерахованими, інгібітори холінестерази, наприклад, донепезил, ривастигмін, і галантаміл; антагоністи рецептора Nтил-О-аспартату, наприклад, мемантин. В одному втіленні аналог 39дезметоксирапаміцину вводиться разом з іншим терапевтичним агентом для лікування розсіяного склерозу; перелік кращих агентів включає, але не обмежується перерахованими, інтерферон бета-lb, інтерферон бета-1a, глатирамер, мітоксантрон, циклофосфамід, кортикостероїди (наприклад, метилпреднізолон, преднізон, дексаметазон). При спільному введенні використовують засоби доставки двох або більше терапевтичних агентів пацієнтові як частин одного і того ж самого режиму лікування, відомі фахівцям у даній галузі. Чи застосовуються два або більше агентів одночасно в одній композиції, не є істотним. Ці агенти можуть застосовуватися в різних композиціях у різний час. Композиція може для зручності бути представлена в одиничному дозуванні та може бути виготовлена за допомогою будь-якого зі способів, добре відомих у фармацевтиці. Такі способи включають стадію впровадження в асоціацію активного інгредієнта (сполуки винаходу) з носієм, який складається з одного або більше додаткових агентів. Загалом, композиція готується шляхом однорідного та міцного зв'язування активного інгредієнта з рідкими носіями, або тонко розділеними твердими носіями, або тим і іншим, і потім, якщо необхідно, формування продукту. Аналог 39-дезметоксирапаміцину зазвичай вводиться внутрішньовенно, перорально або кожним з парентеральних способів, у формі фармацевтичної композиції, яка містить активний інгредієнт, додатково у формі нетоксичної органічної, неорганічної, кислої, основної, додаткової солі, у фармацевтично прийнятній формі дозування. Залежно від захворювання та пацієнта, якому він призначений, а також способу застосування, композиція може застосовуватися в різній дозі. Фармацевтичні композиції даного винаходу, прийнятні для ін'єкційного застосування, включають стерильні водяні розчини або суспензії. Більше того, композиції можуть бути можуть бути у формі стерильних порошків для безпосереднього приготування перед введенням таких стерильних ін'єкційних розчинів або суспензій. У всіх випадках, остаточна ін'єкційна форма повинна бути стерильною та повинна бути досить рідкою для легкого введення шприцем. Фармацевтичні композиції повинні бути стабільні в умовах виробництва та зберігання; так, вони повинні бути убезпечені від забруднюючої дії мікроорганізмів, таких як бактерії та гриби. Носій може бути розчинником або дисперсійним середовищем, який містить, наприклад, воду, етанол, полioл (наприклад, гліцерин, пропіленгліколь і рід 27 кий поліетиленгліколь), рослинні олії, та їхні прийнятні суміші. Наприклад, аналог 39-дезметоксирапаміцину може застосовуватися перорально, буккально або сублінгвально у формі таблеток, капсул, овул, еліксирів, розчинів або суспензій, які можуть містити смакові або забарвлюючі агенти, добавки для негайного, уповільненого, або контрольованого вивільнення. Розчини або суспензії аналога 39дезметоксирапаміцину, прийнятні для перорального застосування, можуть також містити наповнювачі, наприклад N,N-диметилацетамід, диспергуючі речовини, наприклад, полісорбат 80, сурфактанти та солюбілізатори, наприклад, поліетиленгліколь, Phosal 50PG (який складається з фосфатиділ-холіну, жирних кислот сої, етанолу, моно/дигліцеридів, пропіленгліколю та аскорбілпальмітату). Такі таблетки можуть містити наповнювачі, такі як мікрокристалічна целюлоза, лактоза (наприклад, моногідрат лактози або ангідрид лактози), цитрат натрію, карбонат кальцію, двозаміщенний фосфат кальцію та гліцин, бутильованний гідрокситолуол (Е321), кросповідон, гіпромелоза; дезінтегранти, такі як крохмаль (переважно кукурудзяний, картопляний або крохмаль із тапioки) , натрію крохмаль гліколят, кроскармелоза натрію, і певні комплексні силікати, і з'єднуючі речовини для грануляції, такі як полівінілпіролідон, гідроксипропіл метилцелюлоза (ГПМЦ), гідроксипропілцелюлоза (ГПЦ) , макрогол 8000, сахароза, желатин і акація. Крім того, можуть бути додані любриканти, такі як стеарат магнію, стеаринова кислота, гліцерилбегенат і тальк. Тверді композиції подібного типу можуть також застосовуватися як наповнювачі в желатинових капсулах. Кращі щодо цього наповнювачі включають лактозу, крохмаль, целюлозу, молочний цукор і поліетиленгліколі з високою молекулярною масою. Для водних суспензій і/або еліксирів, сполуки винаходу можуть бути комбіновані з різними підсолоджувачами або ароматизаторами, барвниками або фарбами, з емульгаторами та/або суспендуючими агентами та з розріджувачами, такими як вода, етанол, пропіленгліколь і гліцерин, або їхніми комбінаціями. Таблетки можуть бути виготовлені шляхом пресування або формування, з одним або більше додатковим інгредієнтом. Пресовані таблетки можуть бути виготовлені шляхом пресування на придатній машині активних інгредієнтів у вільнотекучій формі, такій як порошок або гранули, змішуються додатково з з'єднуючою речовиною (наприклад, повідоном, желатином, гідроксипропілметилцелюлозою), любрикантом, інертним розріджувачем, консервантом, дезінтегрантом (наприклад, натрію крохмаль-гліколятом, переxрестно-зв’язаним повідоном, переxрестнозв'язаною натрію карбоксиметил-целюлозою), поверхнево-активним або диспергуючим агентом. Наповнені таблетки можуть бути виготовлені шляхом наповнення на придатній машині суміші порошкових сполук із інертним рідким розріджувачем. Ці таблетки можуть додатково бути покриті оболо 94580 28 нкою або на них нанесено зарубку, або вони можуть бути виготовлені таким чином, щоб забезпечити повільне або контрольоване вивільнення активного інгредієнта, шляхом використання, наприклад, гідроксипропілметилцелюлози в різних пропорціях, щоб забезпечити бажаний профіль вивільнення. Форми складу відповідно до даного винаходу, прийнятні для перорального застосування, можуть бути представлені дискретними одиницями, такими як капсули, облатки або таблетки, кожна з них містить задану кількість активного інгредієнта; такими як порошок або гранули; як розчин або суспензія у водному або не-водному середовищі; або як водно-олійна або олійно-водна рідка емульсія. Активний інгредієнт може також бути представлений як болюс, електуарій або паста. Форма складу, прийнятна для місцевого застосування в роті, включає льодяники, які містять активний інгредієнт у смаковій основі, звичайно сахарозі та акації або трагаканті; пастилки, які містять активний інгредієнт в інертній основі, такій як желатин або гліцерин, або сахароза або акація; і спреї, які містять активний інгредієнт у прийнятному рідкому носії. Можна зрозуміти, що на додаток до інгредієнтів, спеціально згаданих вище, фармакологічна форма даного винаходу може включати інші агенти, прийнятні в даній галузі, яка відноситься до типу такої форми, наприклад, ті, які є прийнятними для перорального застосування, можуть включати ароматизатори. Фармацевтичні композиції, пристосовані для місцевого застосування, можуть бути виконані у вигляді мазей, кремів, суспензій, лосьонів, порошків, розчинів, паст, гелів, імпрегньованних пов'язок, спреїв, аерозолів або олій, трансдермальних пристроїв, присипок, та тому подібного. Ці композиції, які містять активні агенти, можуть бути виготовлені за допомогою стандартних способів. Так, вони можуть також містити сумісні стандартні носії та добавки, такі як консерванти, розчинники для того, щоб полегшити проникнення ліків, емульгатор у кремах або мазях, і етанол або олеіловий спирт для лосьонов. Такі носії можуть становити від близько 1% до близько 98% композиції. Найчастіше вони становлять до приблизно 80% композиції. Тільки як ілюстрація, крем або мазь готують змішуванням достатніх кількостей гідрофільного матеріалу та води, яка містить близько 5-10% сполуки за масою, у достатніх кількостях для виробництва крему або мазі, які мають бажану консистенцію. Фармацевтичні композиції, пристосовані для трансдермального застосування, можуть бути представлені у вигляді дискретних пов'язок, призначених для того, щоб залишатися в тісному контакті з епідермісом реципієнта протягом тривалого періоду часу. Наприклад, активний інгредієнт може вивільнятися з пов'язки шляхом іонтофорезу. Для застосування на зовнішніх тканинах, наприклад у роті і на шкірі, композицію переважно застосовують у вигляді місцевої мазі або крему. При використанні у вигляді мазі, активний інгреді 29 єнт може застосовуватися або на парафіновій, або на мазевій основі, яка може змішуватись з водою. Крім того, активний агент може застосовуватися в складі крему з олійно-водною або водноолійною кремовою основою. Для парентерального застосування, рідка окрема форма дозування готується з використанням активного інгредієнта та стерильного розчинника, наприклад, але без обмеження, води, спиртів, поліолів, гліцерину та рослинних олій, кращою є вода. Активний інгредієнт, залежно від розчинника та застосованої концентрації, може бути або суспендований, або розчинений у розчиннику. У приготовлених розчинах активний інгредієнт може бути розчинений у воді для ін'єкцій і підданий стерилізуючій фільтрації, перед розливом у придатні флакони або ампули та запаюванням. Бажано, щоб такі агенти як анестетики, консерванти та буферні агенти, були розчинені в розчиннику. Для того щоб підвищити стабільність, композиція може бути заморожена після розливу у флакони, і вода вилучена під вакуумом. Ліофільно висушений порошок потім закорковується у флакони, а також може додаватися супутній флакон води для ін'єкцій для розчинення перед використанням. Парентеральні суспензії готуються в основному у такий же саме спосіб, як і розчини, за винятком того, що активний інгредієнт суспендується в розчиннику замість розчинення, і стерилізація не може здійснюватися шляхом фільтрації. Активний інгредієнт може бути стерилізований шляхом впливу оксиду етилену перед суспендуванням у стерильному розчиннику. Бажано, щоб у композицію включався сурфактант або зволожуючий агент для того, щоб полегшити однорідний розподіл активного інгредієнта. Аналог 39-дезметоксирапаміцину може також застосовуватися з використанням відомих медичних приладів. Наприклад, в одному втіленні, фармацевтична композиція даного винаходу може застосовуватися за допомогою гіподермального безтолкового інжектора, такого як інжектор, описаний в US 5 339 163; US 5 383 851; US 5 312 335; US 5 064 413; US 4 941 880; US 4 790 824, або US 4 596 556. Приклади добре відомих імплантатів і модулів, придатних для даного винаходу, включають: US 4487603, який описує імплантований мікро-інфузійний насос для введення ліків з контрольованою швидкістю; US 4 486 194, який описує терапевтичний пристрій для введення медикаментів крізь шкіру; US 4 447 233, який описує інфузійний насос для ліків для подачі їх з точною інфузійною швидкістю; US 4 447 22 4, який описує імплантовані інфузійні апарати змінного потоку для тривалої подачі ліків; US 4 439 196, який описує осмотичну систему доставки ліків, яка має багатокамерні компартменти; і US 4475196, який описує осмотичну систему доставки ліків. В іншому конкретному втіленні аналог 39дезметоксирапаміцину може застосовуватися з використанням елююючогого ліки стента, наприклад, такого, як описаний в WO 01/87263 і подібних публікаціях, або такого, як описаний Perm 94580 30 (Perm, Ε.С, 2005). Багато інших подібних імплантатів, систем доставки та модулів відомі особам компетентним в даній галузі. Призначена для введення доза сполуки даного винаходу може змінюватися відповідно до виду конкретної сполуки, супутнього захворювання, пацієнта, природи захворювання та ступенем її тяжкості та фізичним станом пацієнта, і обраним способом застосування. Придатна доза може бути швидко визначена особою, компетентною у даній галузі. Композиція може містити сполуки винаходу від 0,1% за вагою, бажано від 5 до 60%, найкраще від 10 до 30% за вагою, залежно від способу застосування. Фахівцями в даній галузі визнається, що оптимальна кількість і інтервали індивідуальних дозувань сполуки винаходу визначаються природою та ступенем стану, при якому його застосовують; формою, шляхом і місцем застосування, а також віком і станом конкретного пацієнта, який потребує лікування, і те, що лікар остаточно визначає достатнє для використання дозування. Це дозування може повторюватися так часто, як це буде необхідно. Якщо розвиваються побічні ефекти, кількість і/або частота дозування можуть бути змінені або зменшені, відповідно до звичайної клінічної практики. Фіг.1. показує структуру рапаміцину. Фіг.2. показує шлях фрагментації 39дезметоксирапаміцину. Фіг.3. показує результати вестерн-блотингу, які підсумовують mTOR-інгібіторну активність 39дезметоксирапаміцину та рапаміцину. Фіг.4. %Т/С величин для всіх аналізованих концентрацій паклітакселю (А та С) і 39дезметоксирапаміцину (У та D) для нормальних (А та В) або високо-Р-gр-експресуючих (С та D) клітинних ліній. Фіг.5. А - показує загальну площу під графіком (ППГ) протягом 0-24 годин для зразків тканини головного мозку або крові після одиничного в/в або п/о застосування рапаміцину або 39дезметоксирапаміцину. В - показує рівень 39-дезметоксирапаміцину та рапаміцину, що виявляється в тканині головного мозку протягом часу після одиничного в/в застосування. Фіг.6. А - показує прогресування захворювання на ЕАЕ моделі при профілактичному режимі. Наведені величини є медіаною від розчинника або групи, що лікується. В - показує прогресування захворювання на ЕАЕ моделі при терапевтичному режимі. Наведені величини є медіаною від розчинника або групи, що лікується. Фіг.7. Графік, який показує відносний % виживання мишей після індукції гліоми шляхом стереотаксичного введення клітин U87-MG. Зафарбовані ромби представляють групу, яка не лікується, зафарбовані квадрати - групу, яка лікується, незафарбовані кола представляють групу, яка лікується 39-дезметоксирапаміцином. 31 94580 Приклади Матеріали та методи Матеріали Всі реагенти, використані в прикладах, наведених нижче, отримані з комерційних джерел, якщо немає інших вказівок. Культура S.hygroscopicus MG2-10 [IJMNOQLhis] (WO 04/007709, Gregory et al., 2004) культивували на агарових пластинах у середовищі 1 (див. нижче) при 28°С. Запас спор готовили після вирощування на середовищі 1, підготували в 20% в/о гліцерині: 10% в/о лактозі в дистильованій воді, і зберігали при -80°С. Вегетативні культури готували шляхом Компонент Вимочений кукурудзяний порошок Дріжджовий екстракт Карбонат кальцію Сульфат заліза Бакто-агар Пшеничний крохмаль Вода до № за каталогом C-8160 0127-17 C5929 F8633 Sigma S2760 На літр 5г 35 г 4г 10 г 2г 1, 6 мл 7г Середовище потім стерилізували автоклавуванням при 121°С, 20 хв. Після стерилізації 0,16 мл 40% розчину глюкози додавали до кожних 7 мл середовища. Середовище 3: Середовище MD6 (середовище ферментації). Компонент Підсмажена нутрисоя (ADM Ingredients Ltd) Кукурудзяний крохмаль (Sigma) Avedex W80 декстрин (Deymer Ingredients Ltd) Дріжджі (Allinson) Екстракт із зерен кукурудзи (Sigma) KН2РО4 K2НРО4 (NH4)2SO4 NaCl інокуляції 0,1 мл замороженого запасу в 50 мл середовища 2 (див. нижче) в 250-мл флаконі. Культури інкубували від 36 до 48 годин при 28°С, 300 об./хв. Метод одержання Рослинні культури інокулювали 2,5-5% о/о в середовище 3. Культивування проводили протягом 6-7 днів, 2б°С, 300 об./хв. Процедура живлення Процедуру додавання циклогексанкарбоксильноі кислоти виконували через 24-48 години пiсля інокуляції та доводили до 1-2 мМ концентрації, якщо не було вказано інакше. Середовище 1. Джерело Sigma Difco Sigma Sigma Середовище потім стерилізували автоклавуванням при 121°С, 20 хвилин. Середовище 2: RapV7 середовище для посіву. Компонент Підсмажена нутрісоя (ADM Ingredients Ltd) Avedex W80 декстрин (Deymer Ingredients Ltd) Екстракт із зерен кукурудзи (Sigma) Глюкоза (NH4)2SO4 Молочна кислота (80%) СаСО3 (Caltec) Доводять рН до 7,5 1М NaOH 32 На літр 30 г 30 г 19 г 3г 1г 2,5 г 2,5 г 10 г 5г На літр 2,5 г 3г 3г 0,3 г 20 г 10 г 1л СаСО3 (Caltec) МnСl2*4Н2О MnSO4*7H2O FeSO4*7H2O ZnSO4*7H2O MES (2-морфолінетан-сірчаної кислоти моногідрат) pH скорегований до 6,0 1М NaOH 10 г 10 мг 2, 5 мг 120 мг 50 мг 21,2 г Перед стерилізацією до 1 л середовища додавали 0,4 мл D-амілази Sigma (BAN 250). Середовище стерилізували 20 хв при 121°С. Після стерилізації 0,35 мл стерильної 40% фруктози та 0,10 мл L-лізину (140 мг/мл води, простерилізований шляхом фільтрації) додавали до кожних 7 мл. Середовище 4: RapV7a середовище для посіву. Компонент Підсмажена нутрисоя (ADM Ingredients Ltd) Avedex W80 декстрин (Deymer Ingredients Ltd) Екстракт із зерен кукурудзи (Sigma) (NH4)2SO4 Молочна кислота (80%) СаСО3 (Caltec) Доводять рН до 7,5 1М NaOH На літр 5г 35 г 4г 2г 1,6 мл 7г Середовище потім стерилізували автоклавуванням при 121°С, 20 хв. Середовище 5: MD6/5-1 (середовище ферментації). 33 Компонент Підсмажена нутрисоя (ADM Ingredients Ltd) Avedex W80 декстрин (Deymer Ingredients Ltd) Дріжджі (Allinson) Екстракт із зерен кукурудзи (Sigma) KН2РО4 K2HPO4 (NH4)2SO4 NaCl СаСО3 (Caltec) МnСl2*4Н2О MnSO4*7H2O FeSO4*7H2O ZnSO4*7H2O SAG 471 94580 На літр 15 г 50 г 3г 1г 2,5 г 2,5 г 10 г 13 г 10 г 3,5 мг 15 мг 150 мг 60 мг 0,1 мл Середовище стерилізували 30 хв при 121°С. Після стерилізації додавали 15 г фруктози на літр. Через 48 годин додавали 0,5 г/л L-лізину. Аналітичні методи Метод А Об'єм, що вводиться: 0,005-0,1 мл (залежно від чутливості). ВЕРХ виконували на картриджах Agilent "Spherisorb" "Rapid Resolution" SB C8, 3 мікрон, 30 мм × 2,1 мм, з використанням рухомої фази: Рухома фаза А: 0,01% розчин мурашиної кислоти в очищеній воді. Рухома фаза В: 0,01% розчин мурашиної кислоти в ацетонітрилі. Швидкість потоку: 1 мл/хв. Використовували лінійний градієнт, від 5%В в 0 хв до 95%В до 2,5 хв, утримуючи 95%В протягом 4 хв, повертаючись до 5%В до наступного циклу. Детекцію здійснювали за рахунок поглинання в УФ-області при 254 нм та/або шляхом масспектрометрії з іонізацією електророзпиленням (позитивною або негативною), з використанням мікромас-спектрометра Microraass Quattro-Micro Instrument. Метод В Об'єм, що вводиться, 0,02 мл. ВЕРХ виконували на колонці 3 мікрони BDS C18 Hypersil (Thermo-Hypersil-Keystone Ltd), 150 × 4,6 мм, що зберігається при температурі 50°С, з використанням рухомої фази: Рухома фаза А: Ацетонітрил (100 мл) , трифтороцтова кислота (1 мл), 1М ацетат амонію (10 мл), доводили об'єм до 1 л деіонізованою водою. Рухома фаза В: Деіонізована вода (100 мл), трифтороцтова кислота (1 мл), 1М ацетат амонію, доводили об'єм до 1 л ацетонітрилом. Швидкість потоку: 1 мл/хв. Використовували лінійний градієнт від 55%В95%В протягом 10 хвилин, потім протягом 2 хвилин при 95%В; 0,5 хвилин до 55%В та наступні 2,5 хв при 55%В. Детекцію сполук здійснювали за рахунок поглинання в Уф-області при 280 нм. 34 Метод С Система ВЕРХ складалася з Agilent HP1100, хроматографію проводили на колонці 3 мікрони BDS C18 Hypersil (Thermo-Hypersil-Keystone Ltd), 150 × 4,6 мм, що зберігається при температурі 40°С, з використанням рухомої фази: Рухома фаза А: деіонізована вода. Рухома фаза В: Ацетонітрил. Швидкість потоку: 1 мл/хв. Дану систему приєднували до електрораспилюючого мас-спектрометра Bruker Daltonics Esquire 3000. Позитивно-негативне перемикання використовували в діапазоні сканування від 500 до 1000 дальтон. Використовували лінійний градієнт від 55%В до 95%В протягом 10 хвилин, потім протягом 2 хвилин при 95%В; 0,5 хвилин до 55%В та наступні 2,5 хв при 55%В. Біоаналіз протипухлинної активності in vitro Оцінку протипухлинної активності сполук in vitro на панелі 12 людських пухлинних клітинних ліній у моношаровому проліфераційному тесті проводили на Oncotest Testing Facility, Інститут експериментальної онкології, Oncotest GmbH, Фрейбург. Характеристики 12 відібраних клітинних ліній узагальнені у таблиці 2. Таблиця 2 Аналізовані клітинні лінії # Клітинні лінії 1 MCF-7 2 MDA-MB231 3 MDA-MB-4 68 4 NCI-H460 5 SF-268 6 OVCAR-3 7 8 9 10 11 12 Характеристики Молочна залоза, стандарт NCI Молочна залоза, PTENпозитивні, стійкі до 17-AAG Молочна залоза, PTENнегативні, стійкі до 17-AAG Легені, стандарт NCI ЦНС, стандарт NCI Яєчники, р85-мутантні. Ампліфікований АКТ А498 Нирки, висока експресія MDR GXF 251L Шлунок MEXF 394NL Меланома UXF 1138L Матка LNCAP Простата, PTEN-негативні DU145 Простата, PTEN-позитивні Клітинні лінії Oncotest були виділені із ксенографтів пухлин людини, як описано Roth et al., 1999. Походження донорських ксенографтів описане Fiebig et al., 1992. Інші клітинні лінії були отримані від NCI (H460, SF-268, OVCAR-3, DU145, MDA-MB-231, MDA-MB-468) або придбані в DSMZ, Брауншвейг, Німеччина (LNCAP). Всі клітинні лінії, якщо це не вказується особливо, вирощували при 37°С у зволоженій атмосфері (95% повітря, 5% СО2) у готовому середовищі, яке містить середовище RPMI 1640, 10% ембріональну телячу сироватку, та 0,1 мг/мл гентаміцину (РАА, Кельбе, Німеччина). Моношаровий аналіз - Протокол 1. 35 Щоб оцінити ефекти аналізованої сполуки(к) на ріст 12 людських пухлинних клітинних ліній, використовували модифікований пропідіуміодідний тест (Dengler et al., 1995). Коротко кажучи, клітини збирали з культур в експонентній фазі за допомогою трипсинізації, підраховували та розміщували в 96-коміркові плоскодонні мікротитрувальні планшети при щільності клітин, яка залежить від клітинної лінії (5-10.000 життєздатних клітин/на комірку). Через 24 години відновлення, для того, щоб дозволити клітинам відновити експонентний ріст, у комірки додавали 0,01 мл культурального середовища (6 контрольних комірок на планшет) або культурального середовища, яке містить 39-дезметоксирапаміцин. Кожну концентрацію додавали в трьох повторностях. 39-дезметоксирапаміцин вносили у двох концентраціях (0,001 мМ та 0,01 мМ). Через 4 дні інкубації, клітинне культуральне середовище з- або без 39дезметоксирапаміцину заміняли на 0,2 мл водного розчину пропідіум-іодиду (ПІ) (7 мг/л). Щоб визначити пропорцію життєздатних клітин, змінювали проникність мембран клітин шляхом заморожування планшетів. Після розтавання планшетів, вимірювали флюоресценцію з використанням ридера для мікропланшетів Cytofluor 4 000 (збудження 530 нм, емісія 620 нм), задаючи прямий зв'язок стосовно загальної кількості життєздатних клітин. Пригнічення росту виражали як відношення обробки до контролю × 100 (%Т/С). Для активних сполук величини ІС50 та ІС70 визначали, наносячи на графік концентрацію сполуки проти життєздатності клітин. Моношаровий тест - Протокол 2: Людські пухлинні клітинні лінії від онкоскринінгових панелей Національного Інституту Онкології (NCI) вирощували на середовищі RPMI 1640, яке містить 5% ембріональну телячу сироватку та 2 мМ L-глутаміну (Boyd and Paull, 1995). Клітини інокулювали в комірки 9б-коміркового планшета для мікротитрування в 0,1 мл і щільності клітин від 5000 до 40000 клітин/на комірку, залежно від часу подвоєння індивідуальних клітинних ліній. Після інокуляції клітин, планшети для мікротитрування інкубували при 37°С, 5% СО2, 95% повітря та 100% відносної вологості протягом 24 годин перед внесенням експериментальних ліків. Через 24 години, два планшети з кожної клітинної лінії фіксували in situ трихлороцтовою кислотою (ТХО) для подання вимірювання клітинної популяції для кожної клітинної лінії під час додавання ліків (Tz). Експериментальні ліки солюбілізували в диметилсульфоксиді до 400-разовоі бажаної кінцевої максимальної тестової концентрації, і зберігали в замороженому вигляді до використання. До часу додавання ліків, аліквоти замороженого концентрату відтавали та розбавляли до подвійної відповідно до бажаної кінцевої максимальної тестової концентрації за допомогою повного середовища, яке містить 0,05 мг/мл гентаміцину. Додатково готували чотири серійних розведення, десятикратних або 1/2 log-, щоб одержати в цілому п'ять концентрацій ліків плюс контроль. Аліквоти 0,1 мл цих різних розведень ліків додавали у відповідні комірки мікропланшета, які 94580 36 вже містять 0,1 мл середовища, одержуючи необхідну кінцеву концентрацію ліків. Після додавання ліків, планшети інкубували додатково протягом 48 годин при 37°С, 5% СО2, 95% повітря, і 100% відносній вологості. Для клітин, які прилипали, аналіз закінчували додаванням холодної ТХО. Клітини фіксували m situ обережним додаванням 0,05 мл холодної 50% (в/о) ТХО (до кінцевої концентрації 10% ТХО) і інкубували 60 хвилин при 4°С. Надосадову рідину зливали, планшети відмивали п'ятиразово водою з водогону та висушували на повітрі. 0,1 мл 0,4% розчину (в/о) сульфородаміну Б (СРБ) в 1% оцтовій кислоті додавали в кожну комірку, і інкубували планшети 10 хв за кімнатної температури. Після фарбування незв'язаний барвник видаляли п'ятиразовим промиванням 1% оцтовою кислотою, і висушували планшети на повітрі. Зв'язаний барвник послідовно солюбілізували в 10 мМ трис(оксиметил)амілометані, поглинання визначали на автоматичному ридері мікропланшетів при довжині хвилі 515 нм. Для суспензій клітин методологія була тією ж самою, за винятком того, що тест закінчували фіксуванням осілих клітин на дні комірки обережним додаванням 0,05 мл 80% ТХО (до кінцевої концентрації 16% ТХО). Використовуючи сім вимірювань поглинання [час нуля (Т0) , контрольний ріст (С), і аналізований ріст у присутності ліків на п'яти рівнях концентрації (Ті)], підраховували відсоток росту за кожного рівня концентрації ліків. Відсоток пригнічення росту розраховували як: [(Ті-Т0)/(С-Т0)] 100 для концентрацій, де Ті Т0 [(Ті-То)/То] 100 для концентрацій, де Ti T0 Розраховували три параметри відповіді на дозу для кожного експериментального агента. Пригнічення росту на 50% (GI50) розраховували з [ (ТіТ0)/(С-Т0) ] 100 = 50, де концентрація ліків призводила до 50% зниження зростання загального протеїну (визначеного шляхом фарбування СРБ) у контрольних клітинах під час інкубації з ліками. Концентрацію ліків, яка призводить до повного пригнічення росту (TGI) розраховували з Ті=Т0. Концентрацію LC50 (концентрацію ліків, яка приводить до 50% зменшення визначеного білка наприкінці обробки ліками в порівнянні з початком), що вказує загальну втрату клітин після лікування, розраховували з [(Ті-Т0)/То] 100 = -50. Клітинні лінії із множинною фармакологічною резистентністю серед 60 панелей клітинних ліній були ідентифіковані NCI як клітинні лінії з високим вмістом Р-gр, як було визначено за виходом родаміну В (Lee et al., 1994) і ПЦР-визначенням мРНК для mdr-1 (Alvarez et al., 1995). Фармакокінетичний аналіз - Протокол 1. Аналізовані речовини готовили в розчині, який складається з 4% етанолу, 5% Tween 20, 5% поліетиленгліколю 400 в 0,15 Μ NaCl. Окремі дози 10 мг/кг п/о або 3 мг/кг в/в уводили в групах мишейсамок CD1 (3 миші на кожну сполуку на одиницю часу). В 0 хв, 4 хв, 15 хв, 1 годину, 4 години та 24 години мишей з цих груп забивали, і кров і головний мозок брали в кожної миші для подальших аналізів. 37 Зразки головного мозку миттєво заморожували в рідкому азоті та зберігали при -20°С. Мінімум 0,2 мл цільної крові від кожної тварини збирали в пробірку, яка містить етилен-діамін-тетраоцтову кислоту (ЕДТА) як антикоагулянт, ретельно перемішували, і зберігали при -20°С. Фармакокінетичний аналіз - Протокол 2. Для того щоб приготувати дозований розчин, 5 мг аналізованої сполуки розчиняли в 100 мкл етанолу, створюючи розчин сполуки з концентрацією 50 мг/мл. Потім розчин розбавляли до 2 мг/мл, додаючи приблизно 2,4 мл 0,15М NaCl (0,9% в/о розчин), 5% о/о Tween 20 і 5% о/о ПЕГ 400 (кінцева концентрація етанола 4% о/о). Окремі дози аналізованої сполуки по 10 мг/кг п/о або по 2 мг/кг в/в уводили в групах з 3 мишейсамок лінії Balb C. На 5 хвилині, 15 хв, 60 хв, 4 години, 8 годин і 24 години мишей з цих груп забивали, і зразки цільної крові приблизно по 0,2 мл вносили в ЕДТА для одержання кінцевої концентрації 0, 5 мМ, додатково відбирали головний мозок. Як цільну кров, так і головний мозок миттєво заморожували в рідкому азоті та зберігали при 20°С до відправлення на твердому діоксиді вуглецю на аналіз. Аналіз зразків фармакокінетичного дослідження: Аналіз виконували в ASI Limited (Медична школа госпіталю Сент-Джордж, Лондон). Концентрацію аналізованої речовини в отриманих зразках крові та головного мозку визначали методом ВЕРХ із МС-детекцією. Контрольні, вільні від аналізованої речовини зразки крові були отримані від Harian Sera-Lab Limited (Лонгборо, Англія). Зразки головного мозку нульового часу були використані як контрольні, вільні від аналізованої сполуки. Приготування зразків головного мозку: По одній півкулі з кожного головного мозку гомогенізували в 5 мл води. Екстракція зразків Контрольні або аналізовані зразки головного мозку або крові мишей (0,05 мкл), внутрішній стандартний розчин (0,1 мл), 5% розчин сульфату цинку (0,5 мл) і ацетон (0,5 мл) додавали за допомогою піпетки в 2 мл поліпропіленові пробірки (Sarstedt Limited, Beaumont Leys, Лейчестер, Великобританія), і вміст змішували протягом як мінімум 5 хвилин (на міксері IKA-Vibrax-VXR, Merk (BDH) Limited, Пул Дорсет, Великобританія). Потім пробірки центрифугували на мікроцентрифузі як мінімум 2 хвилини. Шар розчинника зливали декантацією в 4,5 мл поліпропіленові пробірки, які містять гідроксид натрію (0,1 М, 0,1 мл) і метил-третбутиловий ефір (МТБЕ, 2 мл). Потім пробірки перемішували як мінімум 5 хвилин (на міксері IKAVibrax-VXR) і центрифугували при 3500 об./хв. протягом 5 хвилин. Шар розчинника потім переносили в 4,5 мл конічні поліпропіленові пробірки, поміщали в SpeedVac® і випарювали до сухого стану. Висушені екстракти розчиняли 0,15 мл 80% метанолу та перемішували протягом як мінімум 5 хвилин (на міксері IKA-Vibrax-VXR), і центрифугували при 3500 об./хв. протягом 5 хвилин. Екстракт переносили в пробірки для автоматичного відбору 94580 38 проби (NLG Analytical, Adelphi Mill, Bollington, Чешир, Великобританія) і поміщали в штатив для автоматичного відбору проби, який зберігали за кімнатної температури. Пристрій для автовідбору проби програмували для введення по 0,03 мл аліквот кожного з екстрактів на аналітичний стовпчик. Приклад 1. Ферментація та виділення аналізованих з'єднань. 1.1. Ферментація та виділення 39дезметоксирапаміцину 39-дезметоксирапаміцин одержували від зростаючих культур S.hygroscopicus MG2-10 [IJMNOQLhis] і постачали циклогексанкарбоксильною кислотою (ЦГКК), як це описано нижче. S.hygroscopicus MG2-10 [IJMNOQLhis] одержували введенням до MG2-10 штаму, описаного в WO 2004/007709 плазміди, яка містить гени гарI, rapJ, rapM, rapN, rapO, rapQ і rapL. Касету генів конструювали з геном rapL, який містить 5' внутрішньорамкову гістидінову мітку. Як описано в WO 2004/007709, плазміда також містила джерело переносу та маркер стійкості апраміцину для трансформації MG2-10 шляхом кон'югації та селекції екскон'югантів, і ділянка для прикріплення phiBT1 для сайт-специфічної інтеграції в хромосому. Виділення кожного із цих генів, і метод, який використовується для конструкції касет генів, що містять комбінації пост-PKS генів, виконували, як описано в WO 2004/007709. Ρідкі куль тури. Вегетативні культури S.hygroscopicus MG2-10 культивували, як описано в Матеріалах і Методах. Продукуючі культури інокулювали з вегетативними культурами по 0,5 мл в 7 мл середовища 3 в 50 мл пробірки. Культивування проводили протягом 7 днів, при 26°С, 300 об./хв. Зразки по 1 мл екстрагували 1:1 ацетонітрилом при струшуванні протягом 30 хв., центрифугували 10 хв., 13000 об./хв., і аналізували та розраховували відповідно до Методу В аналізу (див. Матеріали та Методи). Підтвердження продукту проводили масспектрометрією з використанням Методу С аналізу (див. Матеріали та Методи). Аналог рапаміцину, який спостерігався, як передбачалося, виявився бажаним 39дезметоксирапаміцином, на основі аналітичних даних, описаних при характеристиці нижче. Ферментація Первинну вегетативну культуру S.hygroscopicus MG2-10 [IJMNOQLhis] на середовищі 4 культивували в основному так, як описано в Матеріалах і Методах. Вторинну вегетативну культуру в середовищі 4 інокулювали при 10% о/о, 28°С, 250 об./хв., протягом 24 годин. Вегетативні культури інокулювали при 5% о/о на середовище 5 (див. Матеріали та Методи) в 20 л ферментер. Культивування проводили протягом β днів при 26°С, 0,5 vvm. 30% розчиненого кисню підтримували шляхом зміни дугової швидкості імпелера, мінімальна дугова швидкість 1,18 м/с, максимальна дугова швидкість 2,75 м/с. Додавання циклогексан-карбоксильної кислоти виконували на 24 і 48 годину після інокуляції, щоб одержати кінцеву концентрацію 2 мм. 39 Екстракція та очищення Ферментаційний бульйон (30 л) перемішували з рівним об'ємом метанолу протягом 2 годин, а потім центрифугували, щоб осадити клітини (10 хв, 3500 об./хв.). Надосадову рідину перемішували зі ® смолою Dianon HP20 (43 г/л) протягом 1 години, потім фільтрували. Смолу відмивали батчметодом за допомогою ацетону, щоб відокремити аналог рапаміцину, і видаляли розчинник вакуумом. Водний концентрат потім розбавляли водою до 2 л і екстрагували етилацетатом (3 2 л). Розчинник видаляли вакуумом до одержання коричневої олії (20,5 г). Екстракт розчиняли в ацетоні, висушували кварцом, наносили на кварцеву колонку (6 × 6,5 см діаметр) і елюювали східчастим градієнтом ацетон/гексану (20%-40%). Збирали фракції, які містять аналог рапаміцину, і видаляли розчинник вакуумом. Осад (2,6 г) далі хроматографували (в 3 партіях) на Sephadex LH20, елююючи сумішшю хлороформ/гептан/етанол 10:10:1. Частково очищений аналог рапаміцину (1,7 г) очищали обернено-фазовою (С18) препаративною ВЕРХ із використанням Gilson HPLC, елююючи колонкові Phenoraenex 21,2 250 мм Luna 5 MKM C18 BDS зі швидкістю 21 мл/хв. сумішшю 65% ацетонітрил/вода. Поєднували найбільш очищені фракції (визначені аналітичною ВЕРХ, Метод В), і видаляли розчинник у вакуумі для одержання 39дезметоксирапаміцину (563 мг). Характеристика 1 Н ЯМР-спектр 39-дезметоксирапаміцину був еквівалентний до стандартного (P.Lowden, Ph.D., Dissertation, University of Cambridge, 1997). n PX-MC і РХ-МС - аналіз екстрактів культур показав, що відношення m/z аналога рапаміцину на 30 а.е.м. менше, ніж для рапаміцину, що відповідає відсутності метокси-групи. Іони, які спостеріга+ + лись: [М-Н] 882.3, [M+NH4] 901.4, [M+Na] 906.2, + [М+K] 922.2. Фрагментація натрієвого похідного дала прогнозовані іони для 39дезметоксирапаміцину після раніше визначеного шляху фрагментації (Фіг. 2) (J.A. Reather, Ph.D. Dissertation, University of Cambridge, 2000). Ці дані мас-спектрометрії з фрагментації звузили область аналогів рапаміцину, де мала місце втрата метокси-групи, до фрагмента С28-С42, який містить циклогексильну послідовність. Дані мас-спектрометрії з фрагментації повністю відповідають структурі 39дезметоксирапаміцину. 1.2. Ферментація та виділення 27-О-дезметил39-дезметоксирапаміцину 27-O-дезметил-39-дезметоксирапаміцин одержували від зростаючих культур S.hygroscopicus MG2-10 [JMNOLhis] і постачали циклогексанкарбоксильною кислотою (ЦГКК), як це описано нижче. S.hygroscopicus MG2-10 [JMNOLhis] одержували введенням в MG2-10 штам, описанийв WO 2004/007709 плазміди, яка містить гени rapJ, rapM, rapN, rapO і rapL. Касету генів конструювали з геном rapL, який містить 5' внутрішньорамкову гістидінову мітку. Як описано в WO 2004/007709, плазміда також містила джерело переносу та маркер 94580 40 стійкості апраміцину для трансформації MG2-10 шляхом кон'югації та селекції екскон'югантів, і ділянку для прикріплення phiBT1 для сайтспецифічної інтеграції в хромосому. Виділення кожного із цих генів, і метод, який використовується для конструкції касет генів, які містять комбінації пост-PKS генів, виконували, як описано в WO 2004/007709. Рідкі культури. Вегетативні культури S.hygroscopicus MG2-10 [JMNOLhis] культивували, як описано в Матеріалах і Методах. Продукуючі культури інокулювали з вегетативними культурами по 0,5 мл в 7 мл середовища 3 в 50 мл пробірки. Культивування проводили протягом 7 днів, при 2б°С, 300 об./хв. Зразки по 1 мл екстрагували 1:1 ацетонітрилом при струшуванні протягом 30 хв., центрифугували 10 хв., 13000 об./хв., і аналізували та розраховували відповідно до Методу В аналізу (див. Матеріали та Методи). Підтвердження продукту проводили масспектрометрією з використанням Методу С аналізу (див. Матеріали та Методи). Аналог рапаміцину, який спостерігався, як передбачалося, виявився бажаним 39дезметоксирапаміцином, на основі аналітичних даних, описаних при характеристиці нижче. Ферментація Первинну вегетативну культуру S.hygroscopicus MG2-10 [JMNOLhis] на середовищі 2 культивували в основному так, як описано в Матеріалах і Методах. Вторинну вегетативну культуру в середовищі 2 інокулювали при 10% о/о, 28°С, 250 об./хв., протягом 24 годин. Вегетативні культури інокулювали при 10% о/о на середовищі 5 (див. Матеріали та Методи) в 20 л ферментер. Культивування проводили протягом 6 днів при 26°С, 0,75 vvm. 30% розчиненого кисню підтримували шляхом зміни дугової швидкості імпелера, мінімальна дугова швидкість 1,18 м/с, максимальна дугова швидкість 2,75 м/с. Додавання циклогексанкарбоксильної кислоти виконували на 24 і 48 годину після інокуляції, щоб одержати кінцеву концентрацію 2 мм. Екстракція та очищення Ферментаційний бульйон (15 л) перемішували з рівним за об'ємом метанолом протягом 2 годин, а потім центрифугували, щоб осадити клітини (10 хв., 3500 об./хв.). Надосадову рідину перемішува® ли зі смолою Dianon HP20 (43 г/л) протягом 1 години, потім фільтрували. Смолу відмивали батчметодом за допомогою ацетону, щоб відокремити аналог рапаміцину, і видаляли розчинник вакуумом. Водний концентрат потім розбавляли водою до 2 л і екстрагували етилацетатом (3 × 2 л). Розчинник видаляли вакуумом до одержання коричневої олії (12 г). Екстракт розчиняли в ацетоні, висушували кварцом, наносили на кварцеву колонку (4 × 6,5 см діаметр) і елюювали східчастим градієнтом ацетон/гексана (20%-40%). Збирали фракції, які містять аналог рапаміцину, і видаляли розчинник вакуумом. Осад (0,203 г) збагачували оберненофазовою (С18) препаративною ВЕРХ із використанням Gilson HPLC, елююючи колонкові Phenomenex 21,2 250 мм Luna 5 мкм С18 BDS зі 41 швидкістю 21 мл/хв. сумішшю 65% ацетонітрил/вода. Поєднували найбільш очищені фракції (визначеніені аналітичною ВЕРХ, Метод В), і видаляли розчинник у вакуумі для одержання осаду (25,8 мг). Осад очищали обернено-фазовою (С18) препаративною ВЕРХ із використанням Gilson HPLC, елююючи колонкові Hypersil 4,6 × 150 мм 3 мкм С18 BDS зі швидкістю 1 мл/хв. сумішшю 60% 94580 42 ацетонітрил/вода. Поєднували найбільш очищені фракції (визначені аналітичною ВЕРХ, Метод В), і видаляли розчинник у вакуумі для одержання 27O-дезметил-39-дезметоксирапаміцину (19,9 мг). Характеристика 1 Н та 13С ЯМР-спектри узгоджуються зі структурою 27-O-дезметил-39-дезметоксирапаміцину, розподіл показаний у таблиці 3. 43 94580 44 45 94580 46 47 94580 48 13 - * Величини зазначені як подвійна інтеграція при порівнянні з іншими С-Величинами в 13 С-ЯМР спектрі. - Стереохімія не була визначена, тому що нам було потрібно більше ЯМР -експериментів 1 (таких як 1D і 2D NOESY), тому метиленовий аксіальний і екваторіальний Н не були визначені. n РХ-МС і РХ-МС - аналіз екстрактів культур показав, що відношення m/z аналога рапаміцину на 44 а.е.м. менше, ніж для рапаміцину, що відповідає відсутності метил- і метокси-групи. Іони, які + спостерігались: [М-Н] 868.7, [M+NH4] 887.8, + [M+Na] 892.8. Фрагментація натрієвого похідного дала прогнозовані іони для 27-O-дезметил-39дезметоксирапаміцину після раніше визначеного шляху фрагментації (Фіг. 2) (J.A. Reather, Ph.D. Dissertation, University of Cambridge, 2000). Ці дані мас-спектрометрії з фрагментації звузили область аналогів рапаміцину, де мала місце втрата метокси-групи, до фрагмента С28-С42, який містить циклогексильну послідовність, і звузили область аналогів рапаміцину, де мала місце втрата 0метил-групи, до фрагмента С15-С27. Дані мас-спектрометрії з фрагментації повністю відповідають структурі 27-O-дезметил-39дезметоксирапаміцину. 1.3. Ферментація та виділення 16-О-дезметил27-О-дезметил-39-дезметоксираламіцину 16-O-дезметил-27-O-дезметил-39дезметоксирапаміцин одержували від зростаючих культур S.hygroscopicus MG2-10 [IJNOLhis] і постачали циклогексан-карбоксильною кислотою (ЦГКК), як описано нижче. S.hygroscopicus MG2-10 [IJNOLhis] одержували введенням в MG2-10 штам, описаний в WO 2004/007709 плазміди, яка містить гени гарі, rapJ, rapN, rapO і rapL. Касету генів конструювали з геі ном rapL, який містить 5 внутрішньорамкову гістидінову мітку. Як описано в WO 2004/007709, плазміда також містила джерело переносу та маркер стійкості апраміцину для трансформації MG2-10 шляхом кон'югації та селекції екскон'югантів, і ді лянку для прикріплення phiBTl для сайтспецифічної інтеграції в хромосому. Виділення кожного із цих генів, і метод, який використовується для конструкції касет генів, які містять комбінації пост-PKS генів, виконували, як описано в WO 2004/007709. Рідкі куль тури. Вегетативні культури S.hygroscopicus MG2-10 [IJNOLhis] культивували, як описано в Матеріалах і Методах. Продукуючі культури інокулювали з вегетативними культурами по 0,5 мл в 7 мл середовища 3 в 50 мл пробірки. Культивування проводили протягом 7 днів, при 26°С, 300 об./хв. Зразки по 1 мл екстрагували 1:1 ацетонітрилом при струшуванні протягом 30 хв, центрифугували 10 хв, 13000 об./хв., і аналізували та розраховували відповідно до Методу В аналізу (див. Матеріали та Методи). Підтвердження продукту проводили масспектрометрією з використанням Методу С аналізу (див. Матеріали та Методи). Аналог рапаміцину, який спостерігався, як передбачалося, виявився бажаним 16-O-дезметил27-O-дезметил-39-дезметоксирапаміцином, на підставі аналітичних даних, описаних при характеристиці нижче. Ферментація Первинну вегетативну культуру S.hygroscopicus MG2-10 [IJNOLhis] на середовищі 2 культивували в основному так, як описано в Матеріалах і Методах. Вторинну вегетативну культуру в середовищі 2 інокулювали при 10% о/о, 28°С, 250 об./хв., протягом 48 годин, і третинну культуру інокулювали при 10% о/о, 28°С, 250 об./хв., протягом 24 годин. Вегетативні культури інокулювали при 10% о/о на середовищі 5 (див. Матеріали та 49 94580 Методи) в 3 × 7 л ферментери. Культивування проводили протягом б днів при 26°С, 0,75 vvm. 30% розчиненого кисню підтримували шляхом зміни дугової швидкості імпелера, мінімальна дугова швидкість 0,94 м/с, максимальна дугова швидкість 1,88 м/с. Додавання циклогексанкарбоксильної кислоти виконували на 24 годину після інокуляції, щоб одержати кінцеву концентрацію 1 мМ. L-лізин додавали при t=0. Екстракція та очищення Ферментаційний бульйон (12 л) перемішували з рівним за об'ємом метанолом протягом 2 годин, а потім центрифугували, щоб осадити клітини (10 хв, 3500 об./хв.). Надосадову рідину перемішували зі смолою DianonHP20 (43 г/л) протягом 1 години, потім фільтрували. Смолу відмивали батчметодом за допомогою ацетону, щоб відокремити аналог рапаміцину, і видаляли розчинник вакуумом. Водний концентрат потім розбавляли водою до 2 л і екстрагували етилацетатом (3 × 2 л). Розчинник видаляли вакуумом до одержання коричневої олії (8,75 г). Екстракт розчиняли в ацетоні, висушували кварцом, наносили на кварцеву колонку (4 × 6,5 см діаметр) і елюювали східчастим градієнтом ацетон/гексану (20%-40%). Збирали фракції, які містять аналог рапаміцину, і видаляли розчинник вакуумом. Осад (0,488 г) далі хроматографували (у трьох батчах) на Sephadex LH20, елююючи сумішшю хлороформ/гептан/етанол 10:10:1. Поєднували фракції, які містять аналог рапаміцину, і видаляли розчинник вакуумом. Частково очищений аналог рапаміцину (162 мг) очищали оберненофазовою (С18) препаративною ВЕРХ із використанням Gilson HPLC, елююючи колонкові Phenomenex 21,2 × 250 мм Luna 5 мкм С18 BDS зі швидкістю 21 мл/хв. сумішшю 65% ацетонітрил/вода. Поєднували найбільш очищені фракції (визначені аналітичною ВЕРХ, Метод В), і видаляли розчинник у вакуумі для одержання 16-О 50 дезметил-27-О-дезметил-39дезметоксирапаміцину (44,7 мг). Характеристика n РХ-МС і РХ-МС - аналіз екстрактів культур показав присутність нового аналога рапаміцину, який елююється набагато раніше всіх інших аналогів 39-дезметоксирапаміцину. Відношення m/z для різних іонів аналога рапаміцину на 58 а.е.м. є меншим, ніж для рапаміцину, що відповідає відсутності двох О-метильних і метокси-групи. Іони, які + спостерігаються: [М-Н] 854.7, [M+NH4] 877.8, + + [M+Na] 892.7, [М+К] 908.8. Фрагментація натрієвого похідного дала прогнозовані іони для 16-Одесметил-27-О-десметил-39дезметоксирапаміцину після раніше визначеного шляху фрагментації (Фіг. 2) (J.A. Reather, Ph.D. Dissertation, University of Cambridge, 2000). Ці дані мас-спектрометрії з фрагментації звузили область аналогів рапаміцину, де мала місце втрата метокси-групи, до фрагмента С28-С42, який містить циклогексильну послідовність, і звузили область аналогів рапаміцину, де мала місце втрата Ометильних груп, до фрагмента С15-С27. Дані ЯМР та мас-спектрометрії з фрагментації повністю відповідають структурі 16-О-десметил-27-Одесметил-39-дезметоксирапаміцину. Приклад 2. Біоаналіз in vitro протипухлинної активності Визначення in vitro протипухлинної активності 39-дезметоксирапаміцину Визначення in vitro протипухлинної активності 39-дезметоксирапаміцину на панелі з 12 людських пухлинних клітинних ліній у моношаровому проліфераційному тесті проводили, як описано в Протоколі 1 у наведених вище методах, з використанням модифікованого пропідіум-йодидного тесту. Результати відображені в таблиці 4 нижче, кожний результат є середнімім від подвійних експериментів. Таблиця 5 показує ІС50 та ІС70 для сполук і рапаміцину серед аналізованих клітинних ліній. Таблиця 4 Клітинна лінія SF268 251L Н460 MCF-7 MDA231 MDA4 68 394NL QVCAR3 DU145 LNCAP А498 1138L 1 мкМ 53.5 75.5 67 68.5 67 56.5 45 69 50.5 61 58.5 42 Тест/контроль (%) та концентрація речовини Рапаміцин 39-дезметоксирапаміцин 10 мкМ 1 мкМ 10 мкМ 46 57.5 23 40 86 32.5 66 71 55. 5 26.5 92.5 18.5 63.5 68 37.5 32 65 13.5 44 48 40.5 69.5 77.5 62 54 65.5 44.5 34 74.5 28.5 48.5 62.5 43.5 21.5 52 9.5 51 94580 52 Таблиця 5 Рапаміцин 3.5 9.1 Середнє ІС50 (мікроМ) Середнє ІС70 (мікроМ) Визначення in vitro протипухлинної активності 39-дезметоксирапаміцину, селективної у відношенні мульти-фармакологічноі резистентності Визначення in vitro селективної МФР протипухлинної активності 39-дезметоксирапаміцину на панелі клітинної лінії NCI 60 з людських пухлинних 39-дезметоксирапаміцин 3.25 6. 95 клітинних ліній у моношаровому проліфераційному тесті проводили, як описано в Протоколі 2, Матеріали та методи, з використанням тесту, заснованого на SRB тесті. Результати аналізу відображені в таблиці 6 нижче: Таблиця 6 Активність in vitro проти високо-МФР-експресуючих клітинних ліній Сполука 39-дезметоксирапаміцин Рапаміцин NSCLC НОР-62 -8.3 -6.63 Log GI5o Кишковик SW-620 ЦНС SF295 -8.3 -5.85 -4.60 -7.0 Можна бачити, що за винятком однієї клітинної лінії, 39-дезметоксирапаміцин демонструє однакову або кращу активність проти високо-МФРекспресуючих клітинних ліній, у порівнянні з рапаміцином. Приклад 3. In vitro АРМЕ аналіз Аналіз проникності Сасо-2 Сасо-2 клітини, які зливаються (Li, A.P., 1992, Volpe, D.A., et al., 2001) в 24-комірковому форматі Corning Costar Transwell одержували від In Vitro Technologies Inc. (IVT Inc., Балтімор, Меріленд, США). Апікальна камера містила 0,15 мл FАDлансованого буферного розчину Хенкса (HBBS) рН 7,4, 1% ДМСО, 0,1 мМ люцифера жовтого. Базальна камера містила 0,6 мл HBBS, рН 7,4, 1% ДМСО. Контрольні та аналізовані зразки інкубували при 37°С у зволоженому інкубаторі, струшуючи з швидкістю 130 об./хв. протягом 1 години. Люцифер жовтий проникає тільки парацелюлярним шляхом (між тісними зв'язками), висока ефективна проникність (Рарр) для люцифера жовтого свідчить про клітинне ушкодження під час тесту, і всі такі комірки відкидали. Як референсну сполуку використовували пропанолол (гарна пасивна проникність із невідомими ефектами транспортерів) та ацебуталол (погана пасивна проникність, ослаблена активним виведенням через Рглікопротеін). Сполуки аналізували в одно- та двокоордичатному форматі, вносячи сполуки в апікальну і базальну камери (по 0,01 мМ). Сполуки в апікальній та базальній камері аналізували методом ВЕРХ-МС (Метод А, див. Матеріали та Методи). Результати виражали у вигляді ефективної Нирки А498 Нирки UO-31 -7.07 -8.3 -6.60 -7.0 проникності, Рарр, (нм/с) та у вигляді коефіцієнта потоку (А до В проти В до А). Об' єм акцептора [акцептора ] Papp (нм / с ) Площа [ донора] час Об'єм акцептора: 0,6 мл (А>В) та 0,15 мл (В>А) 2 Площа моношару: 0,33 см Дчас: 60 хв Позитивне значення коефіцієнта потоку вказує на активний вихід з апікальної поверхні клітин. Аналіз стабільності мікросом печінки людини (ЛПМ) Гомогенати печінки дозволяють оцінювати властиву сполукам схильність дії ферментів І фази (окисної), включаючи цитохроми CYP450 (наприклад, CYP2c8, CYP2D6, CYP1A, CYP3A4, CYP2E1), естерази, амідази та флавінмонооксигенази (ФМО). Визначали час напів-життя (Т1/2) аналізованих сполук, при впливі мікросом печінки людини, контролюючи їхнє зникнення протягом часу за допомогою РХ-МС. Сполуки при 0,01 мМ інкубували протягом 40 хв при 37°С, 0,1М Трис-НСІ, рН 7,4 із субклітинною фракцією мікросом печінки людини при концентрації білка 0,25 мг/мл і рівнем, який насичує, НАДРН як кофактор. Після закінчення проміжків часу, до аналізованих зразків додавали ацетонітрил, щоб осадити білок і зупинити метаболізм. Зразки центрифугували та аналізували на вміст вихідної сполуки з використанням аналітичного Методу А (див. Матеріали та Методи). 53 94580 54 Таблиця 7 Результати In vitro ADME-аналізу Тест Сасо-2: Рарр (нм/с) Коефіцієнт джерела Стабільність ЛПМ: TS, хв Рапаміцин 39-дезметоксирапаміцин 2 458 40 29 15 59 Приклад 4. Аналізи зв'язування m vitro FKBP12 FKBP12 обернено розгортається в хімічному денатуранті гуанідин-гідрохлориді (ГдНСІ), і розгортання може бути відстежено за зміною власної флуоресценції білка (Main et al., 1998). Ліганди, які специфічно зв'язують і стабілізують нативний стан FKBP12, змінюють криву денатурації таким чином, що білок розгортається при більш високих концентраціях хімічного денатуранта (Main et al., 1999). За розходженням стабільності може бути визначена константа зв'язування ліганда з використанням рівняння 1. [L] HO Gapp G 2 RTIn1 (1) D N Kd де AGapp - ефективне розходження вільної енергії розгортання між вільною та лігандH2O зв'язаною формою, GD - вільна енергія розгортання вільного білка у воді, [L]-концентрація ліганда, Kd - константа дисоціації комплексу білокліганд (Meiering et al., 1992). Вільна енергія розгортання може бути зв'язана із середньою точкою переходу розгортання з використанням наступного рівняння: HO (2) G 2 mD N[D]50% D N де mD-N - є константою для даного денатуранта та пропорційна зміні ступеня впливу залишків на розгортання (Tanford 1968 and Tanford 1970), a [D]50% є концентрацією денатуранта, яка відповідає середній точці розгортання. Ми визначаємо GDL N , розходження стабільності FKBP12 з рапаміцином та невідомим лігандом (за тієї ж самої концентрації ліганда), як: (3) GL mD N [D]50% D N де є середньою m-величиною переходу розгортання, а [D]50% - розходженням середніх точок для переходу розгортання рапаміцинFKВР12 та переходу розгортання комплексу невідомий ліганд-FKВР12. За умов, коли [L] > Kd, тоді GD-N може бути пов'язане з відносними Kd двох сполук через рівняння 4: Kx (4) GL RTIn d D N Krap d rap де Kd є константою дисоціації рапаміцину, a x Kd - константою дисоціації невідомого ліганда X. Таким чином, Сполука 16-O-десметил-27-O27-O-десметил-39десметил-39-дезметоксидезметоксирапаміцин рапаміцин 13 4 37 91 47 27 mD N [D]50% K x Krap exp d d RT (5) Для визначення Kd для 39дезметоксирапаміцину криву денатурації пристосували для одержання величин mD-N та [D]50%, які були використані для розрахунку середньої mx величини, , та [D]50%, і звідси Kd . Викорисx товували значення Kd 0,2 нМ, наявне в літературі. Таблиця 8 Результати аналізу зв'язування FKBP12 і in vitro Рапаміцин 39-дезметоксирапаміцин 27-O-десметил-39дезметоксирапаміцин 16-O-десметил-27-O-десметил-39дезметоксирапаміцин 39-дезметоксирапаміцин FKBP12 Kd (нМ) 0,2 0,7 0, 8 101 160 mTOR Інгібування mTOR може бути встановлене опосередковано шляхом визначення рівня фосфорилювання сурогатних маркерів mTOR-шляху та p70S 6-кінази і S6 (Brunn et al., 1997; MotheSatney et al., 2000; Tee and Proud, 2002; Huang and Houghton, 2002). Клітини НЕК2 93 ко-трансфектували FLAGмічених mTOR та myc-міченим Raptor, культивували 24 години, потім обробляли сироваткою протягом ночі. Клітини стимулювали 100 нМ інсуліну, потім збирали та лізували за допомогою 3 циклів заморожування/відтавання. Лізати поєднували, і рівні кількості піддавали імунопреципітаціі FLAGантитілами до mTOR/Raptor-комплексу. Потім переробляли імунопреципітати: зразки, оброблені сполукою (від 0,00001 до 0,003 мМ) попередньо інкубували протягом 30 хвилин при 30°С з FKВР12/рапаміцином, FKBP12/39дезметоксирапаміцином або з розчином (ДМСО), не-оброблені зразки інкубували в кіназному буфері. Імунопреципітати потім піддавали кіназному аналізу in vitro у присутності 3 мМ АТФ, 10 мМ Мn2+ та GST-4E-BP1 як субстрат. Реакції зупиняли з 4х-зразковим буферним розчином, потім піддавали 15% SDS-ΠΑΓΕ, переносили вологим способом на PVDF-мембрану, потім досліджували на фосфо-4Е-ВР1 (Т37/46). 55 Додатково, НЕК293 клітини поміщали в бкоміркові планшети і попередньо інкубували протягом 24 годин, і потім обробляли сироваткою протягом ночі. Потім клітини попередньо обробляли розчином або сполукою протягом 30 хв при 30°С, потім стимулювали 100 нМ інсуліном протягом 30 хвилин при 30°С та лізували трьома циклами заморожування/відтавання, і визначали в них концентрацію білка. Рівні кількості білка були внесені і розділені на SDS-ПАЕФ-гелях. Потім білок переносили вологим способом на PVDF-мембрану і досліджували на фосфо-S6 (S3235/36) або фосфо-р70 S6K(T389). Результати цих експериментів узагальнені на Фіг. 3. Приклад 5: P-gp-субстратний аналіз in vitro Клітинні лінії Обидві клітинні лінії, використані у даному дослідженні (MACL MCF7 та MACL MCF7 ADR) були отримані в National Cancer Institute, США. Клітини рутинно пасирували один-два рази на тиждень. У культурі їх підтримували не більше 20 пасажів. Всі клітини вирощували при 37°С у зволоженій атмосфері (95% повітря, 5% СО2) у середовищі RPMI 1640 (РАА, Кельбе, Німеччина) з додаванням 5% ембріональної телячої сироватки (РАА, Кельбе, Німеччина) та 0,1% гентаміцину (РАА, Кельбе, Німеччина). Протокол аналізу Для того щоб оцінити ефекти 39дезметоксирапаміцину, використовували модифікований пропідіум-йодидний аналіз, заснований на протоколі 1, описаному вище (Dengler et al., 1995). Коротко кажучи, клітини збирали з експоненціально-фазових культур за допомогою трипсинізації, підраховували і розміщували в 96-коміркові плоскодонні планшети з щільністю клітин 5 000 клітин на комірку. Після витримування протягом 24 годин для відновлення експонентного росту клітин, до клітин додавали 0,01 мл верапамілу в концентрації 0,18 мг/мл, або 0,01 мл культурального середовища, для одержання кінцевої концентрації верапамілу в комірках 0,01 мг/мл. У попередніх експериментах було встановлено, що ця концентрація є нетоксичною для клітин. Культуральне середовище, яке містить 39-дезметоксирапаміцин, таксол, або чисте культуральне середовище, додавали в кількості 0,01 мл на комірку. Сполуки вносили в трьох повторностях для 8 концентрацій з напівлогарифмічним кроком від 0,03 мм до 10 нМ. Через 3 дні тривалого впливу ліків, середовище або середовище з речовиною заміняли 0,2 мл водні розчини пропідіум-йодиду (ПЙ) (7 мг/мл). Через те, що ПЙ проникає тільки крізь ушкоджені або лізовані мембрани, забарвлюється та вимірюється ДНК загиблих клітин, тоді як живі клітини не забарвлюються. Щоб визначити частку живих клітин, клітини пермеабілізували заморожуванням пластин, що приводить до загибелі всіх клітин. Після відтавання планшетів вимірювали флюоресценцію з використанням ридера мікропланшетів Cytofluor 4000 (збудження 530 нм, емісія 620 нм), показуючи пряме співвідношення до загального числа клітин. 94580 56 Інгібування росту виражали як Тест/Контроль × 100 (%Т/З). Результати аналізу враховувалися тільки в тому випадку, якщо позитивний контроль (таксол) індукував зміну інгібування росту пухлини в присутності та за відсутності верапамілу, і якщо контрольні клітини, оброблені розчином, мали інтенсивність флюоресценції >500. Приготування аналізованих розчинів 39дезметоксирапаміцину Базовий розчин 3,3 мМ 39дезметоксирапаміцину готували в ДМСО та зберігали при -20°С. Базовий розчин потім разморожували в день використання та зберігали за кімнатної температури до та під час дозування. Процедури розведення виконували з використанням середовища RPMI 1640, щоб одержати розчини кінцевою концентрацією, зменшеної в 18 разів. Результати На Фіг. 4 показані 4 графіка, які демонструють значення %Т/С за всіх аналізованих концентрацій для паклітакселю (А та С) і 39дезметоксирапаміцину (Y та D) у клітинних лініях з нормальним (А та В) і високим (С та D) рівнем експресії Р-gр. Зафарбовані ромби представляють значення після застосування тільки паклітакселю або 39-дезметоксирапаміцину, не зафарбовані квадрати представляють значення після застосування паклітакселю або 39-дезметоксирапаміцину в присутності 0,01 мг/мл верапамілу (інгібітора Рgр). Паклітаксель, відомий субстрат Р-gр, демонструє зниження потужності при інгібуванни P-gpексперсуючоі пухлинної клітинної лінії МС7 ADR, і ця знижена потужність відновлюється при спільному застосуванні верапамілу, інгібітору Р-gр (Фіг. 4А та 4С). 39-дезметоксирапаміцин не викликав значної зміни кривої проліферації P-gp-експерсуючої клітинної лінії МС7 ADR як з верапамілом, так і без нього (Фіг. 4В та 4D), що свідчило, про те що 39дезметоксирапаміцин не є субстратом Р-gр. Приклад 6 - фармакокінетичний аналіз 6.1. РК-аналіз рапаміцину та 39дезметоксирапаміцину Фармакокінетичний аналіз із використанням стандартних методів, описаних вище, виконували для рапаміцину та 39-дезметоксирапаміцину, (протокол для кожної сполуки показаний у таблиці 9). ППГ для кожної сполуки в крові та тканині головного мозку розраховували з використанням Kinetica 4/4 (InnaPhase Corporation), використовуючи не-компартментальну модель і трапезоідальний метод для розрахунку ППГ. Коефіцієнт розподілу (Ri) для кожної сполуки після п/о та в/в введення розраховували, як зазначено нижче: ППГ мозку Ri ППГ крові Результати аналізу узагальнені в таблиці 9 поданій нижче та на Фіг. 5. 57 94580 58 Таблиця 9 Узагальнення фармакокінетичних даних Сполуки Рапаміцин 39-дезметоксирапаміцин Протокол Рк 2 1 ППГмозку п/о в/в 1658,37 6338,11 1697,69 24911,4 6.2 РК аналіз рапаміцину, дезметоксирапаміцину та 27-O-десметил-39-дезметоксирапаміцину Фармакокінетичний аналіз із використанням стандартних методів, описаних вище, виконували для рапаміцину, 39-дезметоксирапаміцину, і 27-Oдесметил-39-дезметоксирапаміцину (використовуючи Протокол 1, описаний вище). ППГ для кожної сполуки в крові та тканині головного мозку розраховували з використанням ППГкрові п/о в/в 25212,2 24876,5 16856,5 15444,3 Ri п/о 0,066 0,100 в/в 0,255 1,613 Kinetica 4/4 (InnaPhase Corporation), використовуючи не-компартментальну модель і трапезоідальний метод для розрахунку ППГ. Коефіцієнт розподілу (Ri) для кожної сполуки після в/в введення розраховували як зазначено нижче: ППГ мозку Ri ППГ крові Таблиця 10 Фармакокінетичні дані Сполуки Рапаміцин 39-дезметоксирапаміцин 27-О-десметил-39-дезметоксирапаміцин Приклад 7 - Активність на моделі експериментального алергійного енцефаломіеліту (ЕАЕ) для розсіяного склерозу Експериментальний алергійний енцефаломієліт (ЕАЕ) є аутоімунним запальним демієлінізуючим захворюванням центральної нервової системи (ЦНС), і вважається найкращим доступним аналогом розсіяного склерозу у тварин. Захворювання може бути викликане в генетично сприйнятливих тварин введенням цільного спинного мозку, або мієлінового основного протеїну (МОП) з повним ад'ювантом Фрейнда (ПАФ). Антиген-специфічні ефекторні клітини, які утягуються в ушкодження ЦНС, є CD4+ Т-лімфоцитами, рестриктованими з II класом головного комплексу пстосумістності (МНС). Нещодавно зростаюча увага була привернута до ролі цитокінів, таких як інтерлейкін-1 (ІЛ-1), фактори некрозу пухлин (ФНЛ) та інтерферони (ІФН), у запальних процесах. При активації антигеном, Т-клітини продукують деякі лімфокіни, які у випадку ЕАЕ можуть бути прямо або опосередковано відповідальні за ушкодження ЦНС. Лімфокінами, які, можливо, утягуються в патогенез ЕАЕ, є ІЛ-2, ΙΦΗγ ι ΦΗΟβ. ІЛ-2 відіграє важливу роль в активації та проліферації Т-клітин, тоді як ΙΦΗγ є потужним медіатором активації макрофагів. Крім того, ΙΦΗγ індукує продукцію запальних цитокінів, таких як ІЛ-1, ФНО, а також експресію молекул II класу МНС, серед іншого, на ендотеліальних клітинах кров'яного русла в ЦНС, і на астроцитах, які, як вважається, відіграють важливу роль у презентації антигену енцефалітогенним Т-клітинам. 7.1 - Тварини та процедура імунізації Пацюків-самців лінії Lewis у віці 8-10 тижнів утримували в стандартних лабораторних умовах (не вільних від специфічних патогенів) з вільним ППГмозку, в/в 12156,6 15543,9 844005 ППГкрові, в/в 10756,2 8017,88 1851,12 Ri, в/в 1,13 1, 94 4,56 доступом до їжі та води. ЕАЕ індукували одиничною ін'єкцією в основу хвоста 50 мл неповного ад'юванта Фрейнда (Difco, Детройт, Мічиган) плюс 50 мл сольового розчину, який містить 25 мг спинного мозку морських свинок та 1 мг Mycobacterium Tuberculosis, штам Η 37 RA (Difco). 7.2 - Клінічна та гістологічна оцінка Пацюків обстежували щодня шляхом аналізу маси тіла та клінічних ознак ЕАЕ до 30 днів після імунізації. Клінічну класифікацію проводив спостерігач, який не знав про імунізацію: 0= немає захворювання, 1= млявий хвіст, 2= помірний парапарез, 3= важкий парапарез, 4 = атональний стан, 5= загибель. Лікування захворювання визначали як повну відсутність клінічних симптомів і повернення до рухливості передімунізаційного періоду, у пацюків, у яких була визначена 0 ступінь протягом 5 наступних днів. 7.3 - Експериментальне лікування Дослідні сполуки давали в різних дозах (5 або 15 мг/кг маси тіла) як у профілактичному, так і в лікувальному режимі. Для профілактичної частини дослідження лікування починали за 1 день до імунізації, а для лікувальної частини лікування починали на 7 день після імунізації (п/і). Як контрольну групу використовували пацюків, яким уводили розчинник за тих же самих експериментальних умов, профілактично або лікувально. Лікування проводили п/о щодня, шість разів на тиждень до 30 дня п/і. Як позитивний контроль використовували циклофосфамід. Результати експерименту відображені на Фіг. 6 і в таблиці 11, поданій нижче. Фіг. 6А відображає ефект профілактичного режиму 39дезметоксирапаміцину при 5 та 15 мг/кг, Фіг. 6В відображає ефект лікувального режиму 39 59 94580 дезметоксирапаміцину при 5 та 15 мг/кг. Для кожного режиму показаний ефект 40 мг/кг циклофосфаміду як позитивного контролю. На обох графіках показане середнє значення для кожної групи. Можна бачити, що 39-дезметоксирапаміцин має однакову із циклофосфамідом ефективність на цій моделі, і що він не тільки знижує ступінь тяжкості 60 симптомів, але також зменшує тривалість епізоду. Потрібно відзначити, що через загибель 5 з 7 пацюків, які одержували розчинник, під час дослідження, середнє значення для цієї групи зупинилося на 5, однак, два пацюки, які вижили поступово повернулися до базових значень до 28 дня. Таблиця 11 Сполуки Розчинник 39-дезметоксирапаміцин 39-дезметоксирапаміцин Циклофосфамід 39-дезметоксирапаміцин 39-дезметоксирапаміцин Циклофосфамід н/і 5 Початок хвороби Тривалість (дні) (се(середнє значення ± реднє значення ± Режим середньо-екв. відсередньо-екв. відхил) хил) н/і 9+0,8 21+1,3 Профілактичний 12±2,1* 10±1,8* 15 Профілактичний 12+2,4* 10±3,4* 22+22* 40 5 Профілактичний Лікувальний 13±2,6* 10+1,0* 13+3,4* 15±1,3* 33+14,1* 30±3,1* 15 Лікувальний 9±1,4 16±3,3* 32±5,7* 40 Лікувальний 11+1,1* 15±3,2* 37+26,6* Доза, мг/кг Сукупний бальний показник (середнє значення ± середньо-екв. відхил) 84+28,6 17+4,б* * вірогідно відрізняється від пролікованого розчинником контролю, р.
ДивитисяДодаткова інформація
Назва патенту англійською39-desmethoxyrapamycin analogue with increased blood-brain barrier permeability for the treatment of a medical condition resulting from neural injury or disease
Автори англійськоюSheridan Rose Mary, Zhang Mingqiang, Gregory Matthew Alan
Назва патенту російськоюАналог 39-дезметоксирапамицина, способный преодолевать гематоэнцефалический барьер, для лечения патологического состояния, вызванного нейрогенным повреждением или заболеванием
Автори російськоюШеридан Роза Мери, Жанг Мингкьянг, Грегори Метью Алан
МПК / Мітки
МПК: A61P 25/00, A61P 25/28, A61K 31/436, A61P 35/00
Мітки: захворюванням, 39-дезметоксирапаміцину, аналог, патологічного, здатний, бар'єр, нейрогенним, стану, гематоенцефалічний, лікування, долати, викликаного, пошкодженням
Код посилання
<a href="https://ua.patents.su/39-94580-analog-39-dezmetoksirapamicinu-zdatnijj-dolati-gematoencefalichnijj-barehr-dlya-likuvannya-patologichnogo-stanu-viklikanogo-nejjrogennim-poshkodzhennyam-abo-zakhvoryuvannyam.html" target="_blank" rel="follow" title="База патентів України">Аналог 39-дезметоксирапаміцину, здатний долати гематоенцефалічний бар’єр, для лікування патологічного стану, викликаного нейрогенним пошкодженням або захворюванням</a>
Попередній патент: Анетолдитіолтіон та інші дитіолтіони для лікування станів, пов’язаних з дисфункцією нейротрансмісії моноаміну
Наступний патент: Пристрій для демонстрації інформації з растровою структурою освітлювальних елементів
Випадковий патент: Спосіб визначення моменту процесу запалювання дуги та зміни режиму руху при холостому ході електрода-інструмента верстата розмірної обробки дугою