Спосіб індукції пероксидазної активності базидіоміцетів pleurotus ostreatus (jacq.: fr.) kumm. та lentinula edodes (berk.) sing. аскорбіновою кислотою
Номер патенту: 38623
Опубліковано: 12.01.2009
Формула / Реферат
Спосіб індукції пероксидазної активності базидіоміцетів Pleurotus ostreatus (Jacq.: Fr.) Kumm. та Lentinula edodes (Berk.) Sing. аскорбіновою кислотою, що включає культивування та визначення пероксидазної активності їстівних базидіоміцетів, який відрізняється тим, що визначення рівня активності пероксидази Pleurotus ostreatus (Jacq.: Fr.) Kumm. та Lentinula edodes (Berk.) Sing. проводять при додаванні в культуральну рідину аскорбінової кислоти в концентраціях 0,5; 1,0; 5,0; 10,0 мкМоль/л за 24 години до визначення пероксидазної активності.
Текст
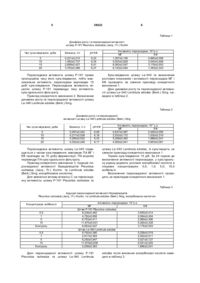
Спосіб індукції пероксидазної активності базидіоміцетів Pleurotus ostreatus (Jacq.: Fr.) Kumm. та 3 38623 ливих факторів довкілля, таких як спека, водний дефіцит [15], засолення, холод, надлишкове світло [12], поранення [13], озон [17], ультрафіолетове випромінення та інфекції патогенів [11, 16] є посилене утворення та накопичення активних форм кисню [15], що відіграє подвійну роль - з одного боку, вони є високотоксичними інтермедіантами, з іншого - регуляторами метаболічних процесів і захисних реакцій. У відповідь на дію стресорів, що проявляються у вигляді збільшення загальної кількості активних форм кисню, спостерігається значне підвищення пероксидазної активності. Відомо, що солі кадмію інгібують синтез пероксидази під час експозиції лабораторної культури ракоподібних Amphipoda у розчині хлористого кадмію, що ймовірно пов’язано з безпосереднім інгібуванням іонами кадмію молекули ферменту або із загальним пригніченням процесів метаболізму в організмі. Також спостерігається залежність рівню активності пероксидази від терміну експозиції [1]. Дані щодо зміни пероксидазної активності макроміцетів за дії біотичних чи абіотичних чинників не наводяться. Вплив хімічних речовин на пероксидазну активність (ПА), що виступають субстратом для пероксидази, майже не вивчений. Найбільш близький за технічною суттю і досяжністю результату є спосіб визначення стресового стану базидіоміцетів та екологічного стану місця їх зростання за активністю пероксидази, в якому визначають пероксидазну активність дикорослих плодових тіл їстівни х базидіоміцетів Flammulina velutipes (Curt.: Fr.) Sing, і Pleurotus ostreatus (Jacq.: Fr.) Kumm. з різних, за екологічними умовами, місць зростання та міцеліальних культур цих грибів при штучному культивуванні в оптимальних умовах і за дії температурних стресів. Вивчені динаміка активності пероксидази плодових тіл та культури в залежності від дії несприятливих факторів довкілля чи умов культивування, не надаються дані про індукцію пероксидазної активності хімічними речовинами [7]. В основу корисної моделі покладено завдання розробки способу індукції пероксидазної активності базидіоміцетів Pleurotus ostreatus (Jacq.: Fr.) Kumm. та Lentinula edodes (Berk.) Sing., в якому визначається рівень активності пероксидази цих макроміцетів при додаванні в культуральну рідину аскорбінової кислоти, за рахунок чого підвищується синтез ферменту пероксидази, яка може бути використана у мікробіологічному виробництві, медицині, фармацевтичній, хімічній, харчовій та інших галузях промисловості. Поставлене завдання вирішується тим, що в способі індукції пероксидазної активності базидіоміцетів Pleurotus ostreatus (Jacq.: Fr.) Kumm. та Lentinula edodes (Berk.) Sing., що включає культивування та визначення пероксидазної активності їстівних базидіоміцетів, який відрізняється тим, що визначення рівня активності пероксидази Pleurotus ostreatus (Jacq.: Fr.) Kumm. та Lentinula edodes (Berk.) Sing, проводять при додаванні в культура 4 льну рідину аскорбінової кислоти в концентраціях 0,5; 1,0; 5,0; 10,0мкМоль/л за 24 години до визначення пероксидазної активності. Концентрації аскорбінової кислоти в культуральній рідині та час визначення ПА обрані згідно попередніх досліджень, які показали відсутність вірогідного впливу на ПА цих штамів концентрацій нижче 0,5мкМоль/л, та її пригнічення при концентраціях вище 10,0мкМоль/л на 24 годину після внесення вітаміну. Пропонований спосіб є новим тому, що він не відомий з рівня техніки та об’єктів дослідження. Приклад конкретного виконання 1. Визначення динаміки росту та пероксидазної активності штаму Р-191 Pleurotus ostreatus (Jacq.: Fr.) Kumm. З метою визначення динаміки накопичення біомаси і зміни активності пероксидази штам Р-191 культивують в колбах Ерленмейера поверхнево на стерильному глюкозо-пептонному середовищі (рН0=6,25) наступного складу, г/л: глюкоза 10,0 пептон 3,0 КН2РО4 0,6 К2НРО4 0,4 MgSO4 x7H2 O 0,5 СаСl2 0,05 ZnSO4 x7H2O 0,001 дистильована вода до 1л [8] Культивування проводять при температурі 27,5°С протягом 20 діб. Інокулюмом є штам Р-191 гливи звичайної, який вирощують протягом 7-10 діб в пробірках на стерильному сусло-агарі 4° за Баллінгом чи КГА при температурі 25°С. Визначення показників росту: рН культурального фільтрату (КФ), накопичення біомаси та активності пероксидази в міцелії і КФ проводять через кожні 5 діб ферментації. Визначають пероксидазну активність за методом, який базується на фотоелектроколориметричному вимірі інтенсивності забарвлення продукту окислення о-діанізидину перекисом водню, який утворився при дії пероксидази. Одиниця пероксидази відповідає кількості ферменту, що каталізує перетворення 1 мкМоля Н2О2 за одну хвилину в оптимальних умовах. Розрахунки проводять за формулою [4]: X= E × V1 ×p , E1 × K × V2 × t де, X - активність ферменту пероксидази; Е екстинкція; V1 - об’єм забарвленої проби; V2 об’єм гомогенату міцелію (МГ) або культурального фільтрату (КФ); Е1 - коефіцієнт мікромолярної екстинкції (0,0128); К - коефіцієнт для перерахунку з міліметрів у лі три (1000); t - час інкубації (5хв); р розведення. Дані динаміки росту та пероксидазної активності штаму Р-191 Pleurotus ostreatus (Jacq.: Fr.) Kumm. наведені в таблиці 1. 5 38623 6 Таблиця 1 Динаміка росту та пероксидазної актив ності штаму Р-191 Pleurotus ostreatus (Jacq.: Fr.) Kumm Час культивув ання, доба Біомаса, г/л рН КФ 5 10 15 20 0,221±0,210 1,482±0,737 2,699±0,427 3,763±0,488 6,22 6,34 6,41 6,37 Пероксидазна активність штаму Р-191 прямо пропорційна часу його культивування, тобто максимальна активність пероксидази відповідає 15 добі культивування. Пероксидазна активність міцелію штаму Р-191 перевищує таку активність культурального фільтрату. Приклад конкретного виконання 2. Визначення динаміки росту та пероксидазної активності штаму Le-340 Lentinula edodes (Berk.) Sing. Активність пероксидази, 10-2у.о. МГ КФ 1,267±0,146 0,860±0,098 5,003±0,826 3,540±0,468 6,563±0,047 3,176±0,553 6,143±0,054 1,393±0,343 Культивування штаму Le-340 та визначення ростових показників і активності пероксидази МГ і КФ проводять за схемою прикладу конкретного виконання 1. Дані динаміки росту та пероксидазної активності штаму Le-340 Lentinula edodes (Berk.) Sing, наведені в таблиці 2. Таблиця 2 Динаміка росту та пероксидазної актив ності штаму Le-340 Lentinula edodes (Berk.) Sing Час культивув ання, доба Біомаса, ті л рН КФ 5 10 15 20 0,097±0,042 0,217±0,038 0,285±0,032 0,352±0,248 6,06 6,18 6,33 6,17 Пероксидазна активність штаму Le-340 підвищується з часом культивування: максимум ПА МГ і КФ припадає на 15 добу ферментації. ПА міцелію перевищує П А культурального фільтрату. Приклад конкретного виконання 3. Індукція пероксидазної активності базидіоміцетів Pleurotus ostreatus (Jacq.: Fr.) Kumm. та Lentinula edodes (Berk.) Sing, аскорбіновою кислотою. Для вивчення впливу вітаміну С на пероксидазну активність штаму Р-191 Pleurotus ostreatus та Активність пероксидази, 10-2 у.о. МГ КФ 0,637±0,087 0,490±0,095 2,533±0,172 1,530±0,310 5,208±0,363 1,886±0,241 4,500±0,041 0,853±0,081 штаму Le-340 Lentinula edodes, їх культивують за схемою прикладу конкретного виконання 1. Термін культивування 15 діб. За 24 години до визначення активності пероксидази, у культуральну рідину додають розчини аскорбінової кислоти в кінцевих концентраціях: 0,5; 1,0; 5,0; 10,0 мкМоль/л. Визначення пероксидазної активності проводять за прикладом конкретного виконання 1. Таблиця 3 Індукція пероксидазної актив ності базидіоміцетів Pleurotus ostreatus (Jacq.: Fr.) Kumm. та Lentinula edodes (Berk.) Sing, аскорбінов ою кислотою Концентрація, мкМоль/л 0,5 1 5 10 Контроль 0,5 1 5 10 Контроль Активність пероксидази, 10-2у.о. МГ Штам Р-191 Pleurotus ostreatus 8,228±0,482 4,792±0,656 8,753±0,411 11,875±0,631 6,563±0,047 Штам Le-340 Lentinula edodes 9,792±0,380 2,917±0,363 6,250±0,947 11,979±0,638 5,208±0,363 Дані пероксидазної активності штаму Р-191 Pleurotus ostreatus та штаму Le-340 Lentinula КФ 3,855±0,414 2,084±0,454 2,969±0,396 5,260±0,328 3,176±0,553 5,208±0,519 2,552±0,511 3,021±0,127 6,041±0,205 1,886±0,241 edodes після внесення аскорбінової кислоти наведені в таблиці 3. 7 38623 Аналіз даних таблиці 3, свідчить про те, що активність пероксидази в міцелії та культуральному фільтраті штаму Р-191 Pleurotus ostreatus і штаму Le-340 Lentinula edodes змінюється під впливом вітаміну С. Додавання аскорбінової кислоти до культуральної рідини через 24 години спричиняє збільшення пероксидазної активності в порівнянні з контролем. Спостерігаються піки максимальної активності ферменту, що відповідають концентраціям вітаміну С 0,5; 5,0 і 10,0мкМоль/л для штаму Р-191 та 0,5 і 10,0мкМоль/л для штаму Le-340. Таким чином, отримані результати показали, що спосіб індукції пероксидазної активності базидіоміцетів Pleurotus ostreatus (Jacq.: Fr.) Kumm. та Lentinula edodes (Berk.) Sing, аскорбіновою кислотою є новим та придатним для застосування в лабораторних дослідженнях та промисловому виробництві. Джерела інформації, які використані при укладанні заявки: 1. Бедулина Д.С., Шатилина Ж.М. Ингибирование пероксидазы при интоксикации солями кадмия.// Вестник РГМУ. - 2005. №3 (42). - С.156. 2. Бухало А.С, Соломко Е.Ф., Митропольская Н.Ю. Базидіальні макроміцети з лікарськими властивостями// Укр. ботан. журн. - 1996. - 53, №3. С.192-201. 3. Граскова И.А., Владимирова СВ., Колесниченко А.В. и др. Изменение активности пероксидазы клеток картофеля при патогенезе кольцевой гнили// Вісник Харківського національного аграрного університету. Серія "Біологія" - 2002. №9 (1), С.37-44. 4. Дудка И.А., Вассер СП., Элланская И.А. Методы экспериментальной микологии. Справочник. -К.: Наук, думка, 1982. - 550с. 5. Капустян А.В., Кучеренко В.П., Панюта О.О., Мусієнко М.М. Активність пероксидази та зміна її ізоферментних форм за умов низькотемпературного стресу// Физиология и биохимия культ, растений. - 2004. Т.36. №1. - С.55-63. 6. Кучеренко В.П., Капустян А.В., Шередеко Л.М., Мусієнко М.М. Спосіб прогнозування зимостійкості озимих зернових// Деклараційний патент на винахід №32911 А. Опубл. 15.02.2001. - Бюл. №1. Комп’ютерна в ерстка Н. Лисенко 8 7. Патент 6372 України. Спосіб визначення стресового стану базидіоміцетів та екологічного стану місця їх зростання// Федотов О.В. Заявка №20040605160, від 29.06.2004, кл. 7 A01G7/00, А01Н3/00, Бюл. №5, від 16.05.05. (прототип) 8. Савич И.М. Пероксидазы - стрессовые белки растений// Успехи современной биологии. 1989. - Т.107, вып. 3. - С.406-417. 9. Соломко Э.Ф., Дудка И.А. Перспективы использования высших базидиомицетов в микробиологической промышленности// ВНИСЭТИ: Обзорная информация, сер.3. -М.: 1985. - 48с. 10. Таран Н.Ю., Оканенко О.А., Бацманова Л.М., Мусієнко М.М. Вторинний оксидний стрес як елемент загальної адаптивної відповіді рослин на дію несприятливих факторів довкілля.// Физиология и биохимия культ. растений. - 2004. Т.36. №1. С.3-14. 11. Тарчевский И.А. Элиситор-индуцируемые сигнальные системы и их взаимодействие// Физиология растений. - 2000. - 47, №2. - С.321-331. 12. Behera R.K., Choudhuri N.K. High irradiance induced pigment degradation and loss of photochemical activity of wheat chloroplasts// Biol. plant. - 2002. - P.45-49. 13. Chamnongpol S., Willekens H., Moeder W. et al. Defence activation and enhanced pathogen tolerance induced by H2O2 in transgenic tobacco// PNAS. - 1998. - 95, №5. - P.5818-5823. 14. Eriksson K.-E., Blanchette R.A., Ander P. Microbial and enzymatic degradation of wood and wood components. Berlin, Heidelberg: SpringierVerlag, 1990. 15. Foyer C.H., Descourvieres P., Kunert K.J. Protection against oxygen radicals: an important defence mechanism studied in transgenic plants// Plant Cell Environ. - 1994. - 17, №2. - P. 507-523. 16. Lamb C, Dixon R.A. The oxidative burst in plant disease resistance// Annu. Rev. Plant Physiol. And Plant Мої. Biol. - 1997. - 48. - P.251-275. 17. Sakaki T. Photochemical oxidants: toxicity// Responses of plant metabolism to air pollution and global change / Eds. L. J. De Kok, J. stolen. - Leiden, The Netherlands: Backhuys Publ., 1998. - P.117-129. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for inducing peroxidase activity of basidiomycetes pleurotus ostreatus (jacq.: fr.) kumm. and lentinula edodes (berk.) sing. with ascorbic acid
Автори англійськоюFedotov Oleh Valeriiovych, Voloshko Tetiana Yevhenivna
Назва патенту російськоюСпособ индукции пероксидазной активности базидиомицетов pleurotus ostreatus (jacq.: fr.) kumm. и lentinula edodes (berk.) sing. аскорбиновой кислотой
Автори російськоюФедотов Олег Валериевич, Волошко Татьяна Евгеньевна
МПК / Мітки
МПК: C12N 1/14, A01H 15/00
Мітки: sing, berk, edodes, спосіб, ostreatus, пероксидазної, активності, kumm, jacq, аскорбіновою, кислотою, pleurotus, lentinula, індукції, базидіоміцетів
Код посилання
<a href="https://ua.patents.su/4-38623-sposib-indukci-peroksidazno-aktivnosti-bazidiomicetiv-pleurotus-ostreatus-jacq-fr-kumm-ta-lentinula-edodes-berk-sing-askorbinovoyu-kislotoyu.html" target="_blank" rel="follow" title="База патентів України">Спосіб індукції пероксидазної активності базидіоміцетів pleurotus ostreatus (jacq.: fr.) kumm. та lentinula edodes (berk.) sing. аскорбіновою кислотою</a>
Попередній патент: Спосіб діагностики та оцінки ефективності комплексного лікування епілептичних синдромів та епілепсій у дітей
Наступний патент: Спосіб комплексного хірургічного лікування жовчнокам’яної хвороби, ускладненої холангітом і холангіогенними абсцесами печінки
Випадковий патент: Захисний ковпачок