Спосіб одержання 8-окса-12-тіа-10,15-діазотетрацикло-[7.6.1.02,7.011,15]гексадека-2,4,6,10-тетраєнів
Номер патенту: 52003
Опубліковано: 10.08.2010
Автори: Вакула Володимир Миколайович, Яременко Федір Георгійович, Свидло Ірина Миколаївна, Мусатов Володимир Іванович
Формула / Реферат
1. Спосіб одержання 8-окса-12-тіа-10,15-діазотетрацикло-[7.6.1.02,7.011,15]гексадека-2,4,6,10-тетраєнів загальної формули:
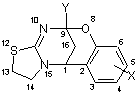 ,
,
де Х - гідроген, алкіл, алкокси або галоген,
Y - алкіл, циклоалкіл, феніл, заміщений феніл,
який відрізняється тим, що використовують реакцію циклоконденсації 2-амінотіазоліну з похідними 2'-гідроксибензиліденкетонів.
2. Спосіб за п. 1, який відрізняється тим, що реакцію здійснюють в органічних розчинниках, зокрема в ацетоні, нижчих спиртах та ароматичних вуглеводнях.
Текст
1. Спосіб одержання 8-окса-12-тіа-10,15діазотетрацикло-[7.6.1.02,7.011,15]гексадека-2,4,6,10тетраєнів загальної формули: 10 видається під відповідальність власника патенту 3 52003 4 ОТДЄ, приведе як до змін кількісних показників відомих фармакологічних ефектів, так і до появи нових видів біологічної активності. Віртуальний скринінг біологічної дії ОТДЄ, здійснений за програмою PASS (Prediction of Activity Spectra for Substance) [10], передбачає високу ймовірність виявлення антирадикальних властивостей, вазодилятаторної, кардіопротекторної та антигіпоксичної дії, прояву спазмолітичних властивостей при урологічній патології. Позитивний є також прогноз щодо пошуку засобів для лікування захворювань центральної нервової системи (когнітивні розлади, склероз). Отже, за результатами прогнозу для сполук з ряду ОТДЄ слід очікувати комплексну фармакологічну дію, переважно спрямовану на імунну, серцево-судинну та нервову системи. На сьогодні з ряду ОТДЄ відома лише одна речовина, це гідробромід основи 2а (схема). Вона одержана шляхом двохстадійного синтезу [11], який включає попереднє одержання циклічної тіосечовини А (вихід 14 %) [11] за відомою реакцією Біджінеллі [12] з використанням метилового естеру ацетооцтової кислоти (Б). Подальше циклоалкілювання диброметаном при кип'ятінні в ДМФА супроводжується відщепленням метоксикарбонільної групи, при цьому одержують гідробромід основи 2а з виходом 43 % [11] (загальний вихід гідроброміду 2а за двома стадіями становить 6 %). Виділити відповідну основу 2 авторам [11] не вдалося в силу нестабільності гідроброміду в лужному середовищі. Отже, недоліками цього методу є низький вихід продукту, ускладнення з виділенням основ з нестійких солей та малодоступність відповідних метилових естерів кетокислот типу Б при замісниках Y, відмінних від метилу. Задачею корисної моделі є розробка нового технологічного та економічного способу синтезу похідних 8-окса-12-тіа-10,15-діазотетрацикло[7.6.1.02,7.011,15]гексадека-2,4,6,10-тетраєнів. Поставлена задача вирішується тим, що для синтезу ОТДЄ використовують реакцію циклоконденсації між доступними саліциліден-кетонами 1 та 2-амінотіазоліном (2АТ), а сам процес здійснюють в органічних розчинниках, зокрема у нижчих спиртах, ацетоні, ароматичних вуглеводнях та ін. Технічний результат - підвищення виходу цільових продуктів, усунення необхідності використання дорогих і токсичних реагентів та розчинників. Спосіб одержання похідних 8-окса-12-тіа10,15-діазотетрацикло-[7.6.1.02,7.011,15]гексадека2,4,6,10-тетраєнів ілюструється схемою: Необхідні для реалізації цієї схеми саліциліденкетони одержано відомою реакцією альдольної конденсації [13] відповідних саліцилових альдегідів та кетонів. Характеристики синтезованих нами саліциліденкетонів 1, як вихідних сполук для 2, у більшості випадків відповідають літературним даним, а неоптимізовані виходи становлять, як міні мум, 71 - 89 % (таблиця). Використаний 2АТ є комерційне доступним. Хімічна будова всіх одержаних сполук доведена спектральними методами (ЯМР 1Н, 13С; ІЧ), молекулярні маси визначені за даними масспектрометрії електронного удару. 5 52003 6 Таблиця Характеристики орто-гідроксистирилкетонів 1 та похідних ОТДЄ 2 Сполука 1а 1б 1в 1г 1д 1е 1є 2а 2б 2в 2г 2д 2е 2є Замісники Х гідроген гідроген гідроген 5-метил 3,4диметокси 5-бром 5-бром гідроген гідроген гідроген 4-метил 5,6диметокси 4-бром 4-бром Вихід, % (літ. вихід) Т. пл, С(літ. т. пл.) метил феніл 4-флуорофеніл метил метил 72 (76 [14]) 83 (99 [13], 80 [15]) 71 (98 [15]) 89 (89 [14]) 137-139 (136-138 [14]) 155-157 (153-154 [13], 124 [15]) 170-171 (150 [15]) 130-132 (130-133 [14]) 80 (82 [14]) 142-144 (142-144 [14]) метил циклопропіл метил феніл 4-флуорофеніл метил метил 75 (83 [16]) 72 70 /50/ 46 /38/ 44 /31/ 67 /60/ 145-150 (152-154 [16]) 96-99 235-237 208-210 192-194 236-238 64 /51/ 228-230 43 /32/ 47 /34/ 245-246 203-205 Y метил циклопропіл Приклад 1. Одержання 9-метил-8-окса-12-тіа10,15-діазотетрацикло-[7.6.1.02,7.011,15]гeкcaдeкa2,4,6,10-тeтpaєнy (2a). До розчину 5,0 г (30,8 ммоль) 2гідроксибензальацетону в 70 мл ацетону додають ацетоновий розчин 3,2 г (30,8 ммоль) 2амінотіазоліну. Реакційну суміш витримують при кімнатній температурі до випадіння осаду, який фільтрують, промивають ацетоном, висушують і кристалізують зі спирту. Одержують 5,31 г (21,5 ммоль) сполуки 2а з т. пл. 235 - 237 °С. Вихід 70 %. ІЧ спектр (в КВr): 1604 та 1580 см-1 ( Ar+C=N), 1237 та 1104 см-1 ( C-O-C). ПМР спектр у ДМСО ( , м.ч.): 7,15 (т., 1Н, 5-СН); 7,10 (д., 1Н, 3-СН); 6,77 (д., 1Н, 6-СН); 6,80 (т., 1Н, 4-СН); 4,39 (м., 1Н, 1СН); 3,68т. і 3,31 м. (2Н, 14-СН2); 3,19 м. і 3,03 м. (2Н, 13-CH2); 2,15 дд. і 2,09 дд. (2Н, J = 12,9 і 2,2 16-СН2); 1,58 (с., 3Н, 9-СН3). Мас-спектр (m/z, інтенсивність, віднесення): 246 (46 % [М]), 245 (17% [М-Н]), 153 (100 %, М-С6Н3О-2Н), 145 (20 %, МС3Н5N2S). Приклад 2. Одержання 4-бром-9-метил-8-окса12-тіа-10,15-діазотетрациклo[7.6.1.02,7.011,15]гeкcaдeкa-2,4,6,10-тeтpaєнy (2e). Розчиняють 1,0 г (4,15 ммоль) 5-бром-2гідроксибензальацетону та 0,42 г (4,15 ммоль) 2амінотіазоліну у мінімальній кількості етанолу (6-8 мл) і кип'ятять впродовж двох годин (контроль методом ТШХ). Осад, що випадав після завершення реакції, фільтрують, промивають спиртом, висушують і кристалізують із суміші хлороформ - етанол. Одержують 0,58 г (1,78 ммоль) сполуки 2е з т. пл. 245 - 246 С, вихід 43 %. ІЧ спектр (в КВr): 1600 та 1584 см-1 ( Ar+C=N), 1252 та 1120 см-1 ( C-O-C). ЯМР спектр 1Н у ДМСО ( , м.ч.): 7,45 (д., J = 2,4 1Н, 3-СН); 7,34 (дд., J = 9,0 і 2,4 1Н, 5-СН); 6,77 (д., J = 9,0 1Н, 6-CH); 4,52 (м., 1Н, 1-СН); 3,76 м. і 3,253,1 м. (4Н, 14-СН2 і 13-СН2); 2,14 дд. і 2,07 дд. (2Н, J = 13,4 і 3,2 16-СН2); 1,55 (с., 3Н, 9-СН3). ЯМР спектр 13С у ДМСО ( , м.ч.): 26,7; 29,0; 49,6; 51,9; 84,1; 111,1; 119,4; 124,0; 132,2; 132,6; 152,9; 165,1. Мас-спектр (m/z, інтенсивність, віднесення): 326 (10 %) і 324 (10 %) [М]); 153 (100 %, М-ВrС6Н2О2Н); 60 (14 %). Характеристики деяких інших похідних ОТДЄ, одержаних цим методом, наведено в таблиці. З даних таблиці випливає, що запропонований спосіб дозволяє одержувати цільові ОТДЄ з виходами 43 - 70 %. Порівнюючи запропонований метод з відомим на прикладі описаної сполуки 2а, можна констатувати, що загальний вихід за двома стадіями становить, як мінімум, 50 % проти 6 % за даними [11], тобто майже у 8 разів більший. Таким чином, запропоновано зручний спосіб одержання похідних 8-окса-12-тіа-10,15діазотетрацикло[7.6.1.02,7.011,15]гeкcaдeкa-2,4,6,10тетраєну з використанням простих, комерційно доступних реагентів та розчинників, з високим виходом кінцевих сполук. Джерела інформації: 1. Граник В. Г. Оксид азота (NO). Новый путь к поиску лекарств [Текст] / В. Г. Граник, Н. Б. Григорьев. - М.: Вузовская книга, 2004. - 360 с. 2. Simkeviciene, V. N-Acetil-1-cysteine and 2amino-2-thiazoline N-acetil-1-cysteinate as a possible cancer chemopreventive agents in murine models [Text] / V. Simkeviciene, J. Straukas, S. Vleckiene / Acta Biol. Hung. - 2002. - Vol. 53, №3.-P. 293-298. 3. Macquet, V. Action of aminothiazoline camphorate in respiratory pathology [Text] / V. Macquet, F. Guerrin, C. Wallaert. // Lille Med. - 1967. - Vol. 12, №9.-P. 1122-1125. 4. Synthesis and cholera toxin binding properties of a lactose-2-aminothiazoline conjugate [Text] / L. Vrasidas, J. Kemmink, R. М. Liskamp, R. J. Pieters // Org. Lett-2002.- Vol.4, N20.- P. 1807-1808. 5. Pat 2033145 DE, IPC1-7: C07D99/06. Thiazolo and thiazino pyrimidines [Electronic 7 52003 resourse] / М. Seperic (DE). - N 33646-69; заявл. 03.07.69; опубл. 14.01.71 - Режим доступа: http://ep.espacenet.com. 6. Hit-to-lead studies: the discovery of potent, orally bioavailable thiazolopyrimidine CXXR2 receptor antagonists [Text] / A. Baxter, A. Cooper, E. Kinchin, K. Moakes, J. Unitt, A. Wallace // Bioorg. Med.Chem. Lett - 2006. -Vol. 16, №4.-P. 960-963. 7. One pot synthesis of thiazolodihydropyrimidinones and evalution of their anti-cancer activity [Text] / B. S. Holla, B. S. Rao, B. K. Sazojini, P. М. Akberali // Eur. J. Med. Chem. 2004. - Vol. 39, N 9. - P. 777-783. 8. Солдатенков А. Т. Основы органической химии лекарственных веществ [Текст] / А. Т. Солдатенков, Н. М. Колядина, И. В. Шендрик. - М.: Химия, 2001.- 188с. 9. Пат. W09506468 US, МПК7 А61K31/00. Method for treating migraine headaches [Electronic resourse] / P. G. Lysko, R. N. Willette, N. Miwatashi (US); заявитель SMITHKLINE BEECHAM CORP [US]. - № W01994US09814; заявл. 01.09.1994; опубл. 09.03.1995. Режим доступа : http://ep.espacenet.com. 10. http://www.ibmc.msk.ru/PASS. Комп’ютерна верстка Л.Литвиненко 8 11. Svetlik, J. Extended oxygen-bridged pyridines and pyrimidines [Text] / J. Svetlik, V. Hanus, J. Bella // J. Chem. Res. (M). -1991.-P.101-114. 12. Kappe C. O. The Biginelli dihydropyrimidine synthesis [Text] / С. О. Карре, A. Stadler// Org. React. - 2004. - Vol. 63. - P. 1-115. 13. Nielsen A. T. The aldol condensation [Text] / A. T. Nielsen, W. Houlihan // Org. React. - 1968. Vol. 16. - 439 p. 14. Tricyclic cyanoguanidines: synthesis, site of action and insecticidal activity of a novel class of reversible acetylcholinesterase inhibitors [Text] / B. L. Finkel-stein, E. A. Benner, M. C. Hendrixson, K. T. Kranis, J. J. Rauh, M. R. Sethuraman, S. F. McCann // Bioorg. Med. Chem. - 2002. - Vol. 10. - 599-613. 15. Synthesis of some novel 2,3,4,8,9pentahydro-7-(4-haloaryl)-pyrazolo-[5,1e]benzo[1,5]oxazocines and 2,3(erythro), 7,8tetrahydro-2-aryl-3-(4-fluoro-3-methylbenzoyl)-6-(4haloaryl)pyrazolo[5,1-d]benzo[1,4]oxazepines via solid-liquid PTC [Text] / V. N. Pathak, R. Gupta, R. Tiwari, R. Gupta, V. Sareen, B. Varshney // Synth. Commun. - 2007. - Vol. 37. - P. 977-984. 16. Макин С. M. Полиметиновые красители на основе ионов пирилия [Текст] / С. M. Макин, Т. А. Маркина, И. И. Бойко // Журнал орган, химии. 1988. - Т. 24, № 11. - С. 2419-2424. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 8-oxa-12-thia-10,15-diazotetracyclo-[7.6.1.011,15]hexadeca-2,4,6,10-tetraenes
Автори англійськоюYaremenko Fedir Heorhiiovych, Svydlo Iryna Mykolaivna, Vakula Volodymyr Mykolaiovych, Musatov Volodymyr Ivanovych
Назва патенту російськоюСпособ получения 8-окса-12-тиа-10,15-диазотетрацикло-[7.6.1.02,7.011,15]гексадека-2,4,6,10-тетраенов
Автори російськоюЯременко Федор Георгиевич, Свидло Ирина Николаевна, Вакула Владимир Николаевич, Мусатов Владимир Иванович
МПК / Мітки
МПК: C07D 519/00
Мітки: спосіб, одержання, 8-окса-12-тіа-10,15-діазотетрацикло-[7.6.1.02,7.011,15]гексадека-2,4,6,10-тетраєнів
Код посилання
<a href="https://ua.patents.su/4-52003-sposib-oderzhannya-8-oksa-12-tia-1015-diazotetraciklo-76102701115geksadeka-24610-tetraehniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 8-окса-12-тіа-10,15-діазотетрацикло-[7.6.1.02,7.011,15]гексадека-2,4,6,10-тетраєнів</a>
Попередній патент: Поліестерна композиція для антикорозійного покриття сталевих труб
Наступний патент: Пристрій для сушіння сільськогосподарських кормів
Випадковий патент: Спосіб прогнозування розвитку гострого порушення мозкового кровотоку








