Гідроксипохідні тилозину та способи їх одержання
Номер патенту: 66355
Опубліковано: 17.05.2004
Автори: НАРАНДЬЯ Амалія, ЛОПОТАР Невенка, Мандіч Зоран
Формула / Реферат
1. 12,13-дигідроксипохідні тилозину формули І
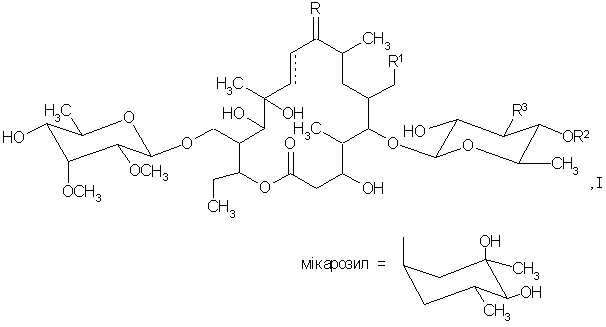
де
R являє собою О, R1 являє собою СНО, CH=NOH або СН(ОСН3)2, R2 являє собою Н або мікарозил, R3 являє собою N(CH3)2 або NO(СН3)2 і лінія ![]() означає одинарний чи подвійний зв'язок, за умови, що R3 являє собою N(CH3)2, якщо лінія
означає одинарний чи подвійний зв'язок, за умови, що R3 являє собою N(CH3)2, якщо лінія ![]() означає одинарний зв'язок; або
означає одинарний зв'язок; або
де
R являє собою NOH, R1 являє собою СНО або СH(ОСН3)2, R2 являє собою Н або мікарозил, R3 являє собою N(СН3)2 або NO(CH3)2 і лінія ![]() означає одинарний чи подвійний зв'язок, за умови, що R3 являє собою N(CH3)2, якщо лінія
означає одинарний чи подвійний зв'язок, за умови, що R3 являє собою N(CH3)2, якщо лінія ![]() означає одинарний зв'язок.
означає одинарний зв'язок.
2. Сполука за п. 1, яка відрізняється тим, що R являє собою О, R1 являє собою СН(ОСН3)2, R2 являє собою Н, R3 являє собою NO(СН3)2 і лінія ![]() означає подвійний зв'язок.
означає подвійний зв'язок.
3. Сполука за п. 1, яка відрізняється тим, що R являє собою О, R1 являє собою СН(ОСН3)2, R2 являє собою мікарозил, R3 являє собою NO(СН3)2 і лінія ![]() означає подвійний зв'язок.
означає подвійний зв'язок.
4. Сполука за п. 1, яка відрізняється тим, що R являє собою NOH, R1 являє собою СН(ОСН3)2, R2 являє собою Н, R3 являє собою NO(СН3)2 і лінія ![]() означає подвійний зв'язок.
означає подвійний зв'язок.
5. Сполука за п. 1, яка відрізняється тим, що R являє собою О, R1 являє собою СН(ОСН3)2, R2 являє собою Н, R3 являє собою N(СН3)2 і лінія ![]() означає подвійний зв'язок.
означає подвійний зв'язок.
6. Сполука за п. 1, яка відрізняється тим, що R являє собою О, R1 являє собою СН(ОСН3)2, R2 являє собою Н, R3 являє собою N(СН3)2 і лінія ![]() означає одинарний зв'язок.
означає одинарний зв'язок.
7. Сполука за п. 1, яка відрізняється тим, що R являє собою NOH, R1 являє собою СН(ОСН3)2, R2 являє собою Н, R3 являє собою N(СН3)2 і лінія ![]() означає одинарний зв'язок.
означає одинарний зв'язок.
8. Сполука за п. 1, яка відрізняється тим, що R являє собою NOH, R1 являє собою СН(ОСН3)2, R2 являє собою Н, R3 являє собою N(СН3)2 і лінія ![]() означає подвійний зв'язок.
означає подвійний зв'язок.
9. Сполука за п. 1, яка відрізняється тим, що R являє собою NOH, R1 являє собою CНО, R2 являє собою Н, R3 являє собою N(СН3)2 і лінія ![]() означає подвійний зв'язок.
означає подвійний зв'язок.
10. Сполука за п. 1, яка відрізняється тим, що R являє собою О, R1 являє собою СНО, R2 являє собою Н, R3 являє собою N(СН3)2 і лінія ![]() означає подвійний зв'язок.
означає подвійний зв'язок.
11. Сполука за п. 1, яка відрізняється тим, що R являє собою О, R1 являє собою CH=NOH, R2 являє собою Н, R3 являє собою N(СН3)2 і лінія ![]() означає подвійний зв'язок.
означає подвійний зв'язок.
12. Спосіб одержання похідних 12,13-дигідрокситилозину формули І:

де
R являє собою О або NOH, R1 являє собою СНО або СН(ОСН3)2, R2 являє собою Н або мікарозил, R3 являє собою N(СН3)2 або NO(СН3)2 і лінія ![]() означає подвійний зв'язок,
означає подвійний зв'язок,
який відрізняється тим, що сполуку формули II:
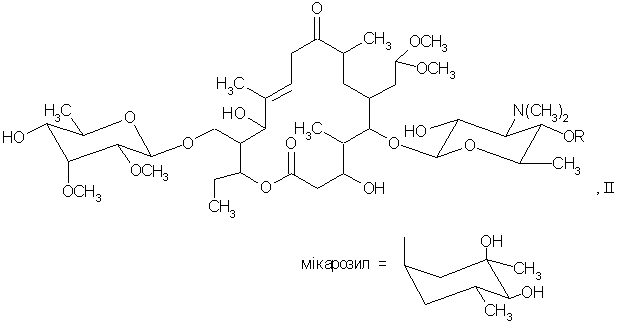
де R являє собою Н або мікарозил, піддають реакції окислення, після чого одержану сполуку формули І, де
R являє собою О, R1 являє собою СН(ОСН3)2, R2 являє собою Н або мікарозил, R3 являє собою NO(СН3)2 і лінія ![]() означає подвійний зв'язок, піддають
означає подвійний зв'язок, піддають
відновленню N-оксиду з утворенням сполуки формули І,
де R являє собою О, R1 являє собою СН(ОСН3)2, R2 являє собою Н або мікарозил, R3 являє собою N(СН3)2 і лінія ![]() означає подвійний зв'язок;
означає подвійний зв'язок;
яку потім піддають реакції оксимування з утворенням сполуки формули І,
де R являє собою NОH, R1 являє собою СН(ОСН3)2, R2 являє собою Н або мікарозил, R3 являє собою N(СН3)2 і лінія ![]() означає подвійний зв'язок;
означає подвійний зв'язок;
яку потім піддають реакції деацеталізації з утворенням сполуки формули І,
де R являє собою NОH, R1 являє собою СНО, R2 являє собою Н або мікарозил, R3 являє собою N(СН3)2 і лінія ![]() означає подвійний зв'язок.
означає подвійний зв'язок.
13. Спосіб за п. 12, який відрізняється тим, що окислення проводять з 3-8 еквівалентами м-хлорпербензойної кислоти у галогенізованому вуглеводні, більш прийнятно у метиленхлориді, протягом 6-20 годин при кімнатній температурі.
14. Спосіб за п. 12, який відрізняється тим, що відновлення N-оксиду здійснюють Zn-порошком у суміші нижчого С1-С3 аліфатичного спирту та води (1:2) при доданні 3-5% в/о нашатирю, при значенні рН від 2 до 7, більш прийнятно в діапазоні від 5,0 до 5,5, при кімнатній температурі впродовж 3-6 годин.
15. Спосіб за п. 12, який відрізняється тим, що оксимування здійснюють з 1-8 еквівалентами солянокислого гідроксиламіну у піридині чи нижчому С1-С3 аліфатичному спирті при доданні основи (піридину або Na2CO3) у струмені азоту при кімнатній температурі або температурі флегми протягом 1-10 годин.
16. Спосіб за п. 12, який відрізняється тим, що деацеталізацію здійснюють у суміші ацетонітрилу та 0,2 N НСl (2:1) або ацетонітрилу і 1% водного розчину трифтороцтової кислоти (1:2) при кімнатній температурі протягом 2 годин.
17. Спосіб одержання похідних 12,13-дигідрокситилозину формули І:

де
R являє собою О або NOH, R1 являє собою СНО або СН(ОСН3)2, R2 являє собою Н або мікарозил, R3 являє собою N(СН3)2 або NO(СН3)2 і лінія ![]() означає одинарний чи подвійний зв’язок, за умови, що R3 являє собою N(CH3)2, якщо лінія
означає одинарний чи подвійний зв’язок, за умови, що R3 являє собою N(CH3)2, якщо лінія ![]() означає одинарний зв'язок,
означає одинарний зв'язок,
який відрізняється тим, що сполуку формули II:

де R являє собою Н або мікарозил, піддають реакції окислення, після чого одержану сполуку формули І, де
R являє собою О, R1 являє собою СН(ОСН3)2, R2 являє собою Н або мікарозил, R3 являє собою NO(СН3)2 і лінія ![]() означає подвійний зв'язок, піддають
означає подвійний зв'язок, піддають
відновленню N-оксиду та С10-С11 подвійного зв’язку з утворенням сполуки формули І,
де R являє собою О, R1 являє собою СН(ОСН3)2, R2 являє собою Н або мікарозил, R3 являє собою N(СН3)2 і лінія ![]() означає одинарний зв'язок;
означає одинарний зв'язок;
яку потім піддають реакції оксимування з утворенням сполуки формули І,
де R являє собою NОH, R1 являє собою СН(ОСН3)2, R2 являє собою Н або мікарозил, R3 являє собою N(СН3)2 і лінія ![]() означає одинарний зв'язок;
означає одинарний зв'язок;
яку потім піддають реакції деацеталізації з утворенням сполуки формули І,
де R являє собою NОH, R1 являє собою СНО, R2 являє собою Н або мікарозил, R3 являє собою N(СН3)2, і лінія ![]() означає одинарний зв'язок.
означає одинарний зв'язок.
18. Спосіб за п. 17, який відрізняється тим, що окислення проводять з 3-8 еквівалентами м-хлорпербензойної кислоти у галогенізованому вуглеводні, більш прийнятно у метиленхлориді, протягом 6-20 годин при кімнатній температурі.
19. Спосіб за п. 17, який відрізняється тим, що відновлення N-оксиду та подвійного зв'язку С10-С11 здійснюють шляхом каталітичної гідрогенізації в органічному розчиннику, більш прийнятно у нижчому С1-С3-аліфатичному спирті, у присутності 2-5% в/в паладію-на-деревному вугіллі під тиском водню 0,2-0,5МПа при кімнатній температурі протягом 5-8 годин.
20. Спосіб за п. 17, який відрізняється тим, що відновлення N-оксиду та подвійного зв'язку С10-С11 здійснюють шляхом електролітичного відновлення у гальванічному елементі з окремими анодним та катодним відділеннями, в якому використовують ртутний резервуар як робочий електрод (катод), графіт – як протиелектрод і електрод з насиченого каломелю - як електрод порівняння, у фосфатному буфері (рН=5,4) при постійному потенціалі - 1,4В відносно електрода з насиченого каломелю, при кімнатній температурі впродовж 40 хвилин та при втраті заряду 80Кл.
21. Спосіб за п. 17, який відрізняється тим, що оксимування здійснюють з 1-8 еквівалентами солянокислого гідроксиламіну у піридині чи нижчому С1-С3 аліфатичному спирті при доданні основи (піридину або Na2CO3) у струмені азоту при кімнатній температурі або температурі флегми протягом 1-10 годин.
22. Спосіб за п. 17, який відрізняється тим, що деацеталізацію здійснюють у суміші ацетонітрилу та 0,2 N НСl (2:1) або ацетонітрилу і 1% водного розчину трифтороцтової кислоти (1:2) при кімнатній температурі протягом 2 годин.
23. Спосіб одержання похідних 12,13-дигідрокситилозину формули І:

де
R являє собою О, R1 являє собою СНО, CH=NOH або СН(ОСН3)2, R2 являє собою Н або мікарозил, R3 являє собою N(СН3)2 або NO(СН3)2 і лінія ![]() означає подвійний зв'язок,
означає подвійний зв'язок,
який відрізняється тим, що сполуку формули II:

де R являє собою Н або мікарозил, піддають реакції окислення, після чого одержану сполуку формули І, де
R являє собою О, R1 являє собою СН(ОСН3)2, R2 являє собою Н або мікарозил, R3 являє собою NO(СН3)2 і лінія ![]() означає подвійний зв'язок, піддають
означає подвійний зв'язок, піддають
відновленню N-оксиду з утворенням сполуки формули І,
де R являє собою О, R1 являє собою СН(ОСН3)2, R2 являє собою Н або мікарозил, R3 являє собою N(СН3)2 і лінія ![]() означає подвійний зв'язок;
означає подвійний зв'язок;
яку потім піддають реакції деацеталізації з утворенням сполуки формули І,
де R являє собою О, R1 являє собою СНО, R2 являє собою Н або мікарозил, R3 являє собою N(СН3)2 і лінія ![]() означає подвійний зв'язок,
означає подвійний зв'язок,
яку потім піддають реакції оксимування з утворенням сполуки формули І,
де R являє собою О, R1 являє собою CH=NOH, R2 являє собою Н або мікарозил, R3 являє собою N(СН3)2 і лінія ![]() означає подвійний зв'язок.
означає подвійний зв'язок.
24. Спосіб за п. 23, який відрізняється тим, що окислення проводять з 3-8 еквівалентами м-хлорпербензойної кислоти у галогенізованому вуглеводні, більш прийнятно у метиленхлориді, протягом 6-20 годин при кімнатній температурі.
25. Спосіб за п. 23, який відрізняється тим, що відновлення N-оксиду здійснюють Zn-порошком у суміші нижчого С1-С3 аліфатичного спирту та води (1:2) при доданні 3-5% в/о нашатирю, при значенні рН від 2 до 7, більш прийнятно в діапазоні від 5,0 до 5,5, при кімнатній температурі впродовж 3-6 годин.
26. Спосіб за п. 23, який відрізняється тим, що оксимування здійснюють з 1-8 еквівалентами солянокислого гідроксиламіну у піридині чи нижчому С1-С3 аліфатичному спирті при доданні основи (піридину або Na2CO3) у струмені азоту при кімнатній температурі або температурі флегми протягом 1-10 годин.
27. Спосіб за п. 23, який відрізняється тим, що деацеталізацію здійснюють у суміші ацетонітрилу та 0,2 N НСl (2:1) або ацетонітрилу і 1% водного розчину трифтороцтової кислоти (1:2) при кімнатній температурі протягом 2 годин.
Текст
Даний винахід стосується похідних тилозину, нових синтетичних продуктів класу макролідів, які виявляють антимікробну активність. Він, зокрема, стосується похідних 12,13-дигідрокситилозину формули (І) де: R являв собою О, R1 являє собою СНО, CH=NOH або СН(ОСН3)2, R2 являє собою Η або мікарозил, R3 являє собою N(CH3)2 або NO(CH3)2, і лінія - - - позначає одинарний чи подвійний зв'язок за умови, що R 3 являє собою N(CH 3)2) якщо лінія - - - позначає одинарний зв'язок; де: R являє собою NOH, R1 являє собою СНО або СН(ОСН3)2, R2 являє собою Η або мікарозил, R3 являє собою N(CH 3)2 або NO(CH 3)2, і лінія - - - позначає одинарний чи подвійний зв'язок за умови, що R3 являє собою N(CH3)2, якщо лінія - - - позначає одинарний зв'язок; та способу їх приготування. Попередній рівень техніки Відомим є приготування 13-гідрокси похідних тилозину відновлювальним розриванням оксиранового кільця 12,13-епокситилозинової похідної з подальшим проведенням каталітичної гідрогенізації, реакцій оксимування або гідролізу (A. Narandja, SI 9700281). У попередньому рівні техніки ще не описувалось введення другої гідроксильної групи та утворення суміжного діолу, отже, 12,13-дигідрокси похідні тилозину являють собою нові, досі не описані сполуки, що також вірно для способу їх одержання. Технічне рішення Було виявлено, що по хідні 12,13-дигідрокситшюзину формули де: R являє собою О, R1 являє собою СНО, CH=NOH або СН(ОСН3)2, R2 являє собою Η або мікарозил, R3 являє собою N(CH3)2 або NO(CH3)2, і лінія - - - позначає одинарний чи подвійний зв'язок за умови, що R 3 являє собою N(CH 3)2, якщо лінія - - - позначає одинарний зв'язок; де: R являє собою NOH, R1 являє собою СНО або СН(ОСН3)2, R2 являє собою Η або мікарозил, R3 являє собою N(CH 3)2 або NO(CH 3)2, і лінія - - - позначає одинарний чи подвійний зв'язок за умови, що R3 являє собою N(CH3)2, якщо лінія - - - позначає одинарний зв'язок; може бути приготовано, піддаючи сполуку формули (II) де R являє собою Η або мікарозил, розчинену у галогенізованому вуглеводні, більш прийнятно у метиленхлориді, реакції окислення з 3-8 еквівалентами м-хлорпербензойної кислоти протягом 6-20 годин при кімнатній температурі, після чого, необов'язково, сполуку формули І, де: R являє собою О, R1 являє собою СН(ОСН 3)2, R2 являє собою Η або мікарозил, R3 являє собою NO(CH3)2, і лінія - - - позначає подвійний зв'язок, піддають: A) відновленню N-оксиду Zn-порошком у суміші нижчого С 1-С3-аліфатичного спирту та води при доданні 35% в/о нашатирю при значенні рН від 2 до 7, більш прийнятно в діапазоні від 5,0 до 5,5, при кімнатній температурі впродовж 3-6 годин, або, необов'язково, B) відновленню N-оксиду та подвійного зв'язку С 10-С11 B1) шляхом каталітичної гідрогенізації в органічному розчиннику, більш прийнятно у нижчому С 1-С3 аліфатичному спирті, у присутності 2-5% в/в паладію-на-деревному вугіллі під тиском водню 0,2-0,5МПа при кімнатній температурі протягом 5-8 годин; або, необов'язково, В2) шляхом електролітичного відновлення у гальванічному елементі з окремими анодним та катодним відділеннями, в якому використовується ртутний резервуар в якості робочого електрода (катода), графіт - в якості протиелектрода і електрод з насиченої каломелі - як електрод порівняння, у фосфатному буфері (рН=5,4) при постійному потенціалі -1,4В відносно електроду з насиченої каломелі при кімнатній температурі впродовж 40 хвилин та при втраті заряду 80Кл; або, необов'язково, С) реакції оксимування з 1-8 еквівалентами солянокислого гідроксиламіну у піридині чи нижчому С 1С3аліфатичному спирті при доданні основи (піридину або Na2CO3) у стр умені азоту при кімнатній температурі або температурі флегми протягом 1-10 годин, або, необов'язково, сполуку формули (І), де R являє собою NOH, R1 являє собою СН(ОСН 3)2, R2 являє собою Η або мікарозил, 3 R являє собою NO(CH3)2, і лінія - - - позначає подвійний зв'язок, піддають відновленню N-оксиду у Спосіб А, або, необов'язково, відновленню N-оксиду та подвійного зв'язку шляхом каталітичної гідрогенізації, як описано в В1, або, необов'язково, сполуку формули (І), де R являє собою О, R1 являє собою СН(ОСН3)2, R являє собою Η або мікарозил, В3 являє собою N(CH 3)2, і лінія - - - позначає одинарний чи подвійний зв'язок, піддають реакції оксимування, як описано в С, або, необов'язково, сполуку формули (І), де R являє собою NOH, R1 являє собою СН(ОСН 3)2, R2 являє собою Η або мікарозил, R3 являє собою N(CH 3)2, і лінія - - - позначає одинарний чи подвійний зв'язок, піддають гідролізу у суміші ацетонітрилу та 0,2 N НСl (2:1) або ацетонітрилу і 1% водного розчину трифтороцтової кислоти (1:2) при кімнатній температурі протягом 2 годин, або, необов'язково, сполуку формули (І), де R являє собою О, R1 являє собою СНО, R2 являє собою Η або мікарозил, R3 являє собою N(CH3)2, і лінія - - - позначає одинарний чи подвійний зв'язок, піддають реакції оксимування, як описано в С. Відповідно до цього винаходу нові сполуки виділяють у звичайні способи виділення з водних лужних розчинів з використанням галогенізованих вуглеводнів, таких як метиленхлорид, хлороформ або тетрахлорметан, та випарюванням до сухого залишку. Після реакцій проводять хроматографію на тонкому шарі силікагелю (Merck 60 F254) у системі розчинників: метиленхлорид - метанол - їдкий аміак 25% (90:9:1,5, система Е), (90:9:0,5, система Е1) або хлороформ метанол - їдкий аміак 25% (95:15:1,5, система AJ), Якщо потрібно, поділ продуктів реакції та очищення продуктів для спектрального аналізу проводять на силікагельній колонці (Merck 60, 230-400 сито (Американське товариство випробування матеріалів (АТВМ)) або 60-230 сито (АТВМ) у системі розчинників Ε, Ε1 або AJ). Ідентифікацію нових сполук здійснювали УФ та ЯМР спектроскопією та масовим аналізом. Нові сполуки виявляють антибактеріальну активність, але також можуть застосовуватись як проміжні сполуки у приготуванні нових похідних. Цей винахід ілюструється, але ніяким чином не обмежується, наведеними далі Прикладами. Приклад 1 12,13-дигідро-12,13-дигідрокси-десмікозин (3'N-оксид) 20-диметилацеталь (1) 10,13-дигідро-13-гідрокси-десмікозин 20-диметилацеталь (10г, 12ммоль) розчинили у метиленхлориді (150мл), додали м-хлорпербензойну кислоту 71% (11,6г, 48ммоль) та перемішували при кімнатній температурі впродовж 8 годин. Реакційний розчин вилили у 400мл води, підлугували до величини рН 8,5, додавши 20% NaOH, перемішували 30 хвилин і, далі, після вилучення органічного шару, ще раз екстрагували сумішшю метиленхлориду та і-пропанолу (5:1). Об'єднані екстракти промивали насиченим розчином NaHCO3, висушували та випарювали до сухого залишку. Неочищений продукт (6,92г) очищали хроматографією на колонці (система Е). Одержали: 4,5г (43,3%) Rf(Е) 0,35, МН+ 868; УФ (EtOH) l max 230 нм, log e 3,88 1 H-ЯМР (CDCl3) d ppm 6,84 (1Η, d, H-11), 6,41 (1H, d, H-10), 4,52 (1H, d, 1’’’), 4,50 (1H, m, H-20), 4,34 (1H, d, 1’), 3,60 (3H, s, 3’’’OMe), 3,44 (6H, s, N-Me, 2’’’OMe), 3,34 (3H, s, 20-OMe), 3,29 (3H, s, 20-OMe), 3,25 (3H, s, N-Me); 13 С-ЯМР (CDCla) 5 ppm 204,4 (s, C-9), 172,2 (s, C-1), 148,7 (d, C-11), 127,9 (d, C-10), 104,6 (d, C-1’, C-20), 99,7 (d, C-1’’’), 76,2 (s, C-12), 75,4 (d, C-13), 61,3 (q, 3’’’OMe, N-Me), 57,4 (q, 2’’’OMe), 54,0 (q, 20-OMe, NMe), 51,8 (q, 20 OMe). Приклад 2 12,13-дигідро-12,13-дигідрокси-десмікозин(3’N-оксид)-9(E+Z)оксим 20-диметилацеталь (2) Сполуку 1 (3г, 3,45ммоль) розчинили у сухому піридині (25мл), додали солянокислий гідроксиламін (1,92г, 27,6ммоль) і перемішували у струмені азоту протягом 5 годин при кімнатній температурі. Реакційну суміш виливали у 150мл води, алкалізували до рН 9, після чого піридин вилучали азеотропним дистилюванням. Здійснювали виділення сумішшю СНСl3 та i-PrOH (5:1), і об'єднані екстракти висушували і випарювали до сухого залишку. Неочищений продукт (2,45г) піддали хроматографії на силікагельній колонці (система AJ). Одержали: 1,58г (51,7%) Rf(El) 0,28, МН+ 883; УФ (EtOH) l max 230 нм, log ε 3,71 1 H-ЯМР (D MSO-d6) d ppm . 10,79, 10,37 (1H, s, 9-NOH), зникає при перемішуванні з D 2O; 1 H-ЯМР (CDCl3) d ppm 6,25 (1H, d, H-11), 6,11 (1H, d, H-10), 4,52 (1H, d, 1’’’), 4,50 (1H, m, H-20), 4,33 (1H, d, 1’), 3,61 (ЗН, s, 3’’’ОМе), 3,45 (6Н, s, N-Me, 2’’’ОМе), 3,36 (3Н, s, 20-ОМе), 3,32 (3Н, s, 20-ОМе), 3,26 (3Н, s, NМе); 13 С-ЯМР(СВСl3) d ррm 171,8, 170,9 (s, C-1), 163,8, 159,0 (s, C-9), 143,2, 142,2 (d, C-11), 123,3,115,3 (d, C10), 104,7 (d, C-1’, С-20), 99,6 (d, С-1’’’), 76,6 (s, C-12), 75,7 (d, C-13), 61,3 (q, 3’’’ОМе, N-Me), 57,4 (q, 2’’’OMe), 54,0 (q, 20-ОМе, N Me), 51,8 (q, 20-ОМе). Приклад 3 12,13-дигідро-12,13-дигідрокси-тилозин (3’N-оксид) 20-диметилацеталъ (3) 10,13-дигідро-13-гідрокси-тилозин 20-диметилацеталь (2,0г, 2ммоль) розчинили в метиленхлориді (30мл), додали м-хлорпербензойну кислоту 71% (2,18г, 9ммоль) та перемішували при кімнатній температурі протягом 8 годин, після чого здійснили виділення, як описано в Прикладі 1. Одержали: 0,67г (33%) Rf(El) 0,55, МН+ 1012; УФ (ЕЮН) lmax 230 нм, log є 3,58 1 H-ЯМР (CDCl3) d ppm 6,82 (1H, d, H-11), 6,39 (1H, d, H-10), 5,08 (1Н, d, 1’’), 4,55 (1H, d, 1’’’, 4,50 (1H, m, H20), 4,34 (1H, d, 1’), 3,60 (3H, s, 3’’’OMe), 3,44 (6H, s, NMe, 2’’’OMe), 3,34 (3H, s, 20-OMe), 3,29 (3H, s, 20-OMe), 3,25 (3H, s, N-Me): 13 С-ЯМР (CDCl3) d ppm 203,6 (s, C-9), 172,2 (s, C-1) 148,7 (d, C-11), 127,9 (d, C-10), 104,6 (d, C-1’, C-20), 99,7 (d, C-1’’’), 97,1 (d, C-1’’), 61,3 (q, 3’’’OMe, N-Me), 57,4 (q, 2’’’OMe), 54,0 (q, 20-OMe, N Me), 51,8 (q, 20-OMe). Приклад 4 12,13-дигідро-12,13-дигідрокси-десмікозин 20-диметилацеталъ (4) Сполуку 1 (1г, 1,15ммоль) розчинили у 35% етанолі (60мл), додали 3,1г NH 4Cl і, поступово, 1г Zn при підтриманні значення рН на рівні 5,0-5,5. Перемішували при кімнатній температурі протягом 5 годин, після чого Zn виділили фільтруванням, та EtOH вилучили випарюванням за пониженого тиску. Водний розчин алкалізували до величини рН 8,5, після чого здійснили екстрагування хлороформом. Екстракти висушували й випарювали до сухого залишку. Одержали: 0,83г (84,6%) Rf(Е) 0,48, Rf(Е1) 0,43, MH + 852; УФ (EtOH) l max 230 нм, log ε 3,91 1 H-ЯМР (CDCl3) d ppm 6,83 (1H, d, H-11), 6,39 (1H, d, H-10), 4,51 (1H, d, 1’’’), 4,49 (1H, m, H-20), 4,35 (1H, d, 1’), 3,60 (3H, s, 3’’’OMe), 3,44 (3H, s, 2’’’OMe), 3,34 (3H, s, 20-OMe), 3,29 (3H, s, 20-OMe), 2,50 (6H, s, NMe 2)3; 13 С-ЯМР (CBCl3) d ppm 204,5 (в, C-9), 172,3 (s, C-1) 148,9 (d, C-11, 127,9 (d, C-10), 104,6 (d, C-1’, C-20), 99,8 (d, C-1’’’), 76,4 (s, C-12), 75,4 (d, C-13), 61,3 (q, 3’’’OMe), 57,4 (q, 2’’’OMe, 54,0 (q, 20-OMe), 51,8 (q, 20-OMe), 40,1 (q, NMe 2). Приклад 5 12,13-дигідрокси-10,11,12,13-тетрагідро-десмікозин20-диметилацеталь (5) Спосіб А Сполуку 1 (1г, 1,15ммоль) розчинили в етанолі (50мл), додали 0,5г 10% Pd/C і гідрогенізували протягом 8 годин під тиском водню 0,5МПа при кімнатній температурі, після чого каталізатор вилучали фільтруванням, а етанол випарювали до сухого залишку. Одержали: 0,88г (90%) Rf(Е) 0,45, МН+ 854; не поглинає в УФ 1 H-ЯМР (CDCl3) d ρρπι 4,55 (1H, d, 1’’’), 4,52 (1Н, m, H-20), 4,35 (1H, d, 1’), 3,60 (3H, s, 3’’’OMe), 3,44 (3H, s, 2’’’OMe), 3,34 (3H, s, 20-OMe), 3,29 (3H, s, 20-OMe), 2,50 (6H, s, NMe 2); 13 С-ЯМР (CDCl3) d ppm 212,4 (s, C-9), 173,0 (s, C-1) 104,6 (d, C-1’, C-20), 99,7 (d, С1’’’), 61,3 (q, 3’’’OMe), 57,4 (q, 2’’’OMe), 54,0 (q, 20-OMe), 51,8 (q, 20-OMe), 40,1 (q, NMe2). Спосіб В Сполуку 1 (0,2г, 0,23ммоль) розчинили у 50мл фосфатного буфера (рН=5,4) і потім перенесли в гальванічний елемент з окремими анодним та катодним відділеннями. Ртутний резервуар використовувався в якості робочого електрода (катода), а графіт - в якості протиелектрода, і електрод з насиченої каломелі - як електрод порівняння. Реакцію проводили при постійному потенціалі -1,4 В відносно електроду з насиченої каломелі при кімнатній температурі впродовж 40 хвилин при втраті заряду 80Кл. Реакційний розчин алкалізували до рН 8,5 і екстрагували хлороформом. Екстракт промивали насиченим розчином NaHCO3 і випарювали до сухого залишку. Одержали: 0,16г (81,6%) Rf(Е) 0,45, Rf (E1) 0,43, МН+ 854, спектральні характеристики такі самі, як у сполуки, що її одержали у спосіб 5А. Приклад 6 12,13-дигідрокси-10,11,12,13-тетрагідро-десмікозин-9(E+Z) оксим20-диметилацеталь (6) Сполуку 2 (1г, 1,13ммоль) розчинили в етанолі (50мл), додали 0,5г 10% Pd/C і гідрогенізували протягом 9 годин під тиском водню 0,5МПа при кімнатній температурі, після чого каталізатор вилучали фільтруванням, а етанол випарювали до сухого залишку. Одержали: 0,85г (88%) Rf(El) 0,43, МН+ 869; не поглинає в УФ 1 H-ЯМР (D MSO-d6) d ppm 10,69, 10,49 (1H, s, 9-NOH), зникає при перемішуванні з D2O; 1 H-ЯМР (CDCl3) d ppm 4,51 (1H, d, 1’’’), 4,50 (1H, m, H-20), 4,32 (1H, d, 1’), 3,61 (3H, s, 3’’’OMe), 3,45 (3H, s, 2’’’OMe), 3,36 (3Н, s, 20-OMe), 3,32 (3Н, s, 20-ОМе), 2-51 (6Н, s, NMe2); 13 С-ЯМР (CDCl3) d ppm 172,5 (s, С1), 165,6,162,3 (s, C-9), 104,7 (d, С-1’), 104,5 (d, C-20), 99,6 (d, C-1’’’), 61,3 (q, 3’’’OMe), 57,4 (q, 2’’’OMe), 54,0 (q, 20-OMe), 51,8 (q, 20-OMe). Приклад 7 12,13-дигідро-12,13-дигідрокси-десмікозин-9(E+Z) оксим20-диметилацеталь (7) Сполуку 4 (2г, 2,34ммоль) розчинили у сухому піридині (25мл), додали солянокислий гідроксиламін (1,9г, 27,6ммоль) і перемішували у стр умені азоту протягом 6 годин при кімнатній температурі. Виділення здійснювали як описано в Прикладі 2. Одержали: 1,14г (55,9%) Rf(E1) 0,39, МН+867; УФ (EtOH) l max 231 нм, log ε 3,97 1 H-ЯMP (D MSO-d6) d ppm 10,77, 10,49 (1H, s, 9-NOH), зникає при перемішуванні з D2O; 1 H-ЯMP (CDCl3) d ppm 6,23 (1H, d, H-11), 6,09 (1H, d, H-10), 4,52 (1H, d, 1’’’), 4,50 (1H, m, H-20), 4,33 (1H, d, 1’), 3,61 (3H, s, 3’’’OМе), 3,45 (3Н, в, 2’’’OМе), 3,36 (3Н, s, 20-ОМе), 3,32 (3Н, s, 20-ОМе), 2,50 (6Н, s, NMe2); 13 С-ЯМР (CDCl3) d ppm 171,9 (s, C-1), 163,6,159,2 (s, C-9), 148,7,143,8 (d, C-11), 123,6, 116,0 (d, C-10), 104,7 (d, C-1’, C-20), 99,6 (d, C-1’’’), 76,6 (s, C-12), 75,5 (d, C-13), 61,3 (q, 3’’’-OMe), 57,4 (q, 2’’’OMe), 54,0 (q, 20-OMe), 51,8 (q, 20-OMe), 40,3 (q, N Me 2). Приклад 8 12,13-дигiдро-12,13-дигідрокси-десмікозин-9(Е+Z)оксим (8) Сполуку 7 (0,5г, 0,58ммоль) розчинили в ацетонітрилі (5мл) та у 1% водному розчині трифтороцтової кислоти (10мл) і перемішували при кімнатній температурі протягом 2 годин. До реакційної суміші додали хлороформ (8мл), і її алкалізували до рН 8,5. Здійснили ще одне екстрагування хлороформом. Об'єднані екстракти промили 1% розчином NaHCO3, висушили й випарили до сухого залишку. Одержали: 0,4г (85%) Rf(E1) 0,30, МН+821; УФ (EtOH) l max 232 нм, log ε 3,47 1 H-ЯMP (D MSO-d6) d ppm 10,75, 10,48 (1H, s, 9-NOH), зникає при перемішуванні з D2O; 1 H-ЯMP (CDCl3) d ppm 9,67 (1H, s, H-20), 6,24 (1H, d, H-11), 6,10 (1H, d, H-10), 4,52 (1H, d, 1’’’), 4,33 (1H, d, 1’), 3,61 (3H, s, 3’’’OMe), 3,45 (3H, s, 2’’’OMe), 2,50 (6H, s, NMe 2); 13 С-ЯМР (CDCl3) d ppm 203,1 (d, C-20), 172,9 (s, C-1), 163,2,159,6 (s, C-9), 148,7 (d, C-11), 123,8, 115,9 (d, C10), 104,7 (d, C-1’), 99,6 (d, C-1’’’), 61,3 (q, 3’’’OMe), 57,4 (q, 2’’’OMe), 40,3 (q, N Me 2). Приклад 9 12,13-дигідро-12,13-дигідрокси-десмікозин (9) Сполуку 4 (1г, 1,17ммоль) розчинили в ацетонітрилі (10мл) та у 1% водному розчині трифтороцтової кислоти (18мл), після чого здійснили гідроліз та виділення, як це описане в Прикладі 8. Одержали: 0,75г (80%) Rf (Ε) 0,42, MH + 806; УФ (EtOH) l max 230 нм, log ε 3,79 1 H-ЯMP (CDCl3) d ppm 9,68 (1Η, s, H-20), 6,81 (1H, d, H-11), 6,39 (1H, d, H-10), 4,52 (1H, d, 1’’’), 4,33 (1H, d, 1’), 3,61 (3H, s, 3’’’OMe), 3,45 (3H, s, 2’’’OMe), 2,50 (6H, s, NMe 2); 13 С-ЯМР (CDCl3) d ppm 203,2 (s, C-9), 203,1 (d, C-20), 172,9 (s, C-1), 148,7 (d, C-11), 124,0 (d, C-10), 104,7 (d, C-1’), 99,6 (d, C1’’’), 61,3 (q, 3’’’OMe), 57,4 (q, 2’’’OMe), 40,3 (q, N Me 2). Приклад 10 12,13-дигідро-12,13-дигідрокси-десмікозин-20-оксим (10) Сполуку 9 (0,5г, 0,62ммоль) розчинили в етанолі (10мл), додали піридин (0,3мл) і солянокислий гідроксиламін (0,043г, 0,62ммоль) та перемішували у стр умені азоту протягом 1 години при кімнатній температурі. До реакційної суміші додали воду (10мл) та її алкалізували до рН 9 й випарили до 1/3 об'єму. Здійснили екстрагування хлороформом при рН 5,5 (5мл) та рН 9,0 (2x5мл). Об'єднані екстракти (рН 9) випарили до сухого залишку. Одержали: 0,28г (55%) Rf(E1) 0,35, МH+ 821; УФ (EtOH) l max 230 нм, log ε 3,67 1 H-ЯMP (D MSO-d6) d ppm 10,37 (1H, s, 20-NOH), зникає при перемішуванні з D2O; 1 H-ЯMP (CDCl3) d ppm 6,81 (1Η, d, H-11), 6,39 (1H, d, H-10), 4,52 (1H, d, 1’’’), 4,33 (1H, d, 1’), 3,61 (3H, s, 3’’’OMe), 3,45 (3H, s, 2’’’OMe), 2,50 (6H, s, NMe 2); 13 С-ЯМР (CDCl3) d ppm 203,2 (s, C-9), 172,9 (s, C-1), 151,5 (d, C-20), 148,8 (d, C-11), 123,8 (d, C-10), 104,7 (d, C1’), 99,6 (d, С1’’’), 61,3 (q, 3’’’OМе), 57,4 (q, 2’’’OMe), 40,3 (q, N Me 2).
ДивитисяДодаткова інформація
Назва патенту англійськоюHydroxy derivatives of tylosin and methods for the preparation thereof
Автори англійськоюLopotar Nevenka
Назва патенту російськоюГидроксипроизводные тилозина и способы их получения
Автори російськоюЛопотар Невенка
МПК / Мітки
МПК: C07H 17/08
Мітки: одержання, способи, гідроксипохідні, тилозину
Код посилання
<a href="https://ua.patents.su/4-66355-gidroksipokhidni-tilozinu-ta-sposobi-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Гідроксипохідні тилозину та способи їх одержання</a>
Попередній патент: Спосіб зниження захворюваності на некротичний ентероколіт у дітей (варіанти)
Наступний патент: Оптичний пірометр
Випадковий патент: Гідропрес для штампування черепиці








