Спосіб саузерн-блот-гібридизації днк клітин для визначення та контролю генотоксичності речовин з властивостями інгібіторів днк-топоізомерази іі
Номер патенту: 67042
Опубліковано: 15.06.2004
Автори: Завелевич Михайло Петрович, Кішинська Олена Григорівна, Смирнова Ірина Адріанівна
Формула / Реферат
Застосування способу Саузерн-блот-гібридизації ДНК клітин для визначення та контролю генотоксичності речовин з властивостями інгібіторів ДНК-топоізомерази II.
Текст
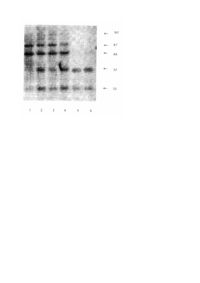
Винахід, що заявляється, стосується медицини та фармакології, а саме способів визначення та контролю генотоксичності препаратів, які проходять випробування як фармакологічні агенти, зокрема генотоксичності протипухлинних хіміопрепаратів, а також тестування можливої генотоксичності речовин, у яких передбачають наявність інгібувальної активності по відношенню до ДНК-топоізомерази II. Визначення генотоксичності є невід'ємною складовою доклінічного вивчення нових лікарських засобів і є важливим етапом в розробці та створенні ефективних медичних препаратів. Відсутність генотоксичності є одним з показників нешкідливості і безпечності препарату, який пропонується як лікарський засіб. Разом з тим, деякі лікарські засоби, зокрема протипухлинні препарати безпосередньої дії на ДНК клітин, є саме генотоксичними агентами і наразі виникає необхідність у контролюванні їхнього побічного впливу на нормальні тканини організму з метою попередження небажаних побічних наслідків протипухлинної терапії, зокрема розвитку вторинних лейкемій внаслідок лікування хворих на рак протипухлинними препаратами. Існує кілька визнаних способів та тест-систем для визначення генотоксичності, які офіційно застосовуються для оцінки генотоксичного потенціалу у речовин, які випробовуються в якості нових лікарських засобів. В основу кожного з таких способів покладено той чи інший спосіб обліку генетичних змін в різних клітинних системах, які виникають під дією генотоксичних агентів. Причому всі існуючі способи розрізняються принципово один від одного, оскільки в них враховуються ті чи інші аспекти дії досліджуваних препаратів, зважаючи на особливості системи, в якій вони досліджуються. Таким чином і інформація, яку можна отримувати за допомогою кожного з цих способів є неповною і в усякому випадку повинна бути доповнена даними, отриманими при застосуванні інших способів з арсеналу тих, що їх застосовують для визначення генотоксичного потенціалу. Згідно існуючих рекомендацій В 003 та відповідних національних відомств для оцінки генотоксичного потенціалу використовується низка способів, оскільки саме комбінація способів дозволяє забезпечити достатню інформативність для вирішення цих важливих для практики медицини та фармакології завдань (1). Головними зі способів, які наразі застосовують з цією метою, є тест Еймса (2) та способи, в яких оцінюються аберації хромосом та сестринських хроматидних обмінів (3). В тесті Еймса облік генних мутацій проводиться на спеціальних залежних штамах мікроорганізмів, які містять певні мутації в ДНК. При цьому враховуються зворотні мутації, викликані мутагенними агентами, що спричинюють втрату залежності від певних поживних факторів. Відомо кілька способів, за якими генотоксичність визначається за тими чи іншими структурними пошкодженнями хромосом або за утворенням мікроядерець, зокрема в клітинах кісткового мозку мишей, яким вводять речовини, що підлягають аналізу. Кожен із застосованих способів визначення генотоксичності виявляє лише певні типи генетичних ушкоджень, за якими проводять екстраполяцію на генотоксичність досліджуваної речовини в цілому. Оскільки жоден з них не є універсальним, виникає потреба у розширенні арсеналу можливих способів оцінки генотоксичного потенціалу з метою якомога ширшого охоплення всіх можливих генетичних змін, які індукуються досліджуваними речовинами, особливо з погляду не тільки на загальну генотоксичність, а й на геноспецифічну дію тих чи інших агентів на генетичний апарат клітини. Хіміопрепарати з властивостями інгібіторів ДНК-топоізомерази II являють собою найчисленнішу гр уп у відомих протипухлинних засобів. Відомо, що інгібітори ДНК-топоізомерази II справляють саме сайт-специфічну дію на генетичний апарат клітини. Зокрема, відома така дія цих препаратів по відношенню до гена MLL, перебудови якого мають відношення до генезу вторинних лейкемій після проведення курсу хіміотерапії онкологічних захворювань. Відомі й інші гени, специфічні перебудови яких виникають в результаті негомологічних рекомбінацій, індукованих під впливом інгібіторів ДНК-топоізомерази II. Аналіз літератури з цього питання свідчить про те, що деякі з цих генів можуть також бути придатні для тестування генотоксичності зазначених інгібіторів, причому перебудови таких генів, як скажімо, C-MYC, повинні мати більш узагальнене значення, не обмежуючись певними формами патологій або типами клітин, оскільки C-MYC є геном, задіяним в регуляції клітинного циклу і, відповідно, в реалізації апоптичної відповіді клітин будь-якого генезу. Більше того, характер специфічних перебудов C-MYC є неоднаковим в клітинах різного генезу, але сталим для одних і тих же клітин, що дозволяє аналізувати специфічність генотоксичної дії зазначених вище сполук з використанням широкого спектру клітин, які можуть бути мішенями дії інгібіторів. Слід врахувати також той факт, що, згідно даних літератури, зміни в генах, що є сайт-специфічними мішенями дії інгібіторів ДНК-топоізомерази II, можуть бути принаймні на порядок більш індикативними щодо впливу цих речовин на геном, аніж зміни, що їх виявляють за допомогою інших способів. Крім того, останнім часом було показано, що деякі речовини природного походження, які входять до складу харчового раціону, зокрема флавоноїди, також можуть бути інгібіторами ДНК-топоізомерази II, хоча стр уктурно вони цілком відмінні від відомих інгібіторів, які застосовуються з терапевтичною метою. Доведено, що специфічні перебудови гена MLL внаслідок інгібування ДНК-топоізомерази II флавоноїдами пов'язані з лейкозами новонароджених в разі вживання вагітними надмірних кількостей біологічно активних домішок, що містять природні речовини з властивостями інгібіторів ДНК-топоізомерази II. Причому в останньому випадку перебудови гену MLL були аналогічними таким, що індуковані хіміопрепаратами, які належать до інгібіторів ДНКтопоізомерази II. Все вищевказане свідчить про те, що існує нагальна потреба в розробці способів визначення генотоксичності як протипухлинних хіміопрепаратів, так і інших речовин з властивостями інгібіторів ДНК-топоізомерази II. Такі способи обов'язково повинні включати в себе дію препарату на живі клітини, оскільки в процесі метаболізму неактивних препаратів, наприклад при розщепленні глікозидів деяких флавоноїдів можливе утворення похідних, які можуть на відміну від глікозильованих попередників бути активними інгібіторами ДНК-топоізомерази II. Оцінку впливу подібних інгібіторів на клітини бажано проводити за їхнім сайт-специфічним рекомбіногенним ефектом, враховуючи найбільш характерні генетичні зміни, які були б загальними для клітин різного походження. Визначення генотоксичності за допомогою подібних способів важливо як для скринінгу нових протипухлинних хіміопрепаратів, що належать до інгібіторів ДНК-топоізомерази II, так і для виявлення можливої генотоксичності аналогічних синтетичних речовин та речовин природного походження з метою обмеження їхнього надходження до організму людини. Найбільш прийнятним для обліку сайт-специфічних змін генів під впливом зазначених речовин може бути відомий спосіб Саузерн-блот-гібридизації, який застосовується дотепер як спосіб для ідентифікації структури генів за їхніми сайтами рестрикції (4). Зазначений спосіб використовується для ідентифікації протяжних делецій та вставок в генах. Для цього згідно опису способу ДНК екстрагують з тканин чи клітин та розщеплюють на фрагменти ДНК відповідними рестриктазами. Фрагменти, отримані після розщеплення ДНК, розділяють електрофорезом в агарозному гелі, переносять на мембранний фільтр та іммобілізують. ДНК, зв'язану з фільтром, гібридизують з ДНК-зондом, міченим радіоактивним фосфором. Гібридизація між комплементарними послідовностями міченого зонду та ДНК, що аналізується, виявляється за положенням відповідних смуг на радіоавтографі. Спосіб Саузерн-блот-гібридизації є уніфікованим набором процедур і розрізняється в кожному конкретному випадку застосованими генною пробою та рестриктазою. Попередня галузь застосування способу -молекулярна біологія та генетика, ідентифікація та картування генів, аналіз структури генів, діагностика спадкових хвороб. Оскільки дія речовин з активністю інгібіторів ДНК-топоізомерази II призводить до специфічних та відтворюваних змін структури генів, що є мішенями цих інгібіторів, можна припустити, що порівняльний аналіз структури одного з цих генів-мішеней в контрольних клітинах та клітинах, які зазнали впливу речовини, що досліджується на предмет генотоксичності, може свідчити з високою специфічністю про наявність або відсутність такої властивості у досліджуваної речовини. В основу винаходу, що заявляється, поставлено задачу застосувати спосіб Саузерн-блот-гібридизації за новим призначенням, а саме, як спосіб для високоспеціфічного визначення генотоксичності у речовин, які інгібують активність ДНК топоізомерази II, і таким чином, запропонувати новий додатковий спосіб визначення генотоксичності речовин, який міг би використовуватись як один із способів у комплексному тестуванні генотоксичності. Метою такого застосування є удосконалення тестування генотоксичності протипухлинних хіміопрепаратів, а також інших сполук з властивостями інгібіторів ДНК-топоізомерази II для більш ефективного визначення специфічної дії зазначених речовин на геном клітин різного генезу та скринінгу речовин, які можуть мати зазначену властивість. Поставлена задача вирішується тим, що для тестування генотоксичності застосовують спосіб Саузерн-блотгібридизації, що складається з усталеного набору процедур, починаючи з екстрагування ДНК з клітин і закінчуючи проведенням гібридизації. За зонд при використанні цього способу нами обрано послідовність, що відповідає фрагментові одного з генів, структура якого зазнає специфічних змін в разі дії на клітини інгібіторів ДНКтопоізомерази II, а саме ген C-MYC. Опис способу стосовно застосування, що заявляється: За тест-клітини правили перещеплювані клітини злоякісної лімфоми людини Namalwa або гострого ліфмобластного лейкозу МТ-4. Клітини підтримували у вигляді суспензії за загальноприйнятими методиками в середовищі RPMI-1640 з додаванням 10% сироватки ембріонів корів. Клітини інкубували на протязі обумовленого часу з різними концентраціями відомого інгібітору ДНКтопоізомерази II, а саме вепезиду. Контрольні клітини інкубують в звичайному середовищі. Використовували загальноприйнятий метод виділення препаратів ДНК, прийнятний для способу Саузерн-блот-гібридизації, а саме: Відмиті від залишків культурального середовища клітини суспендують в буфері для виділення ДНК (50ммоль/л трис-НСl, рН 8,0; 100ммоль/л NaCl; 10ммоль/л ЕДТА) та додають протеїназу К (до 50мкг/мл) та додецилсульфат натрію (до 0,5%). Суміш інкубують на протязі ночі при 42°С. До суміші додають рівний об'єм водонасиченого фенолу, з 0,1% 8-оксихіноліну і 0,2% меркаптоетанолу. Суміш струшують на протязі 30 хвилин і центрифугують при 12тис.об/хв. Водну фазу 2-3 рази обробляють сумішшю фенол-хлороформ 1:1 по 15-30 хвилин з наступним центрифугуванням до зникнення проміжного шару. Для видалення залишків фенолу водну фаз у двічі обробляють хлороформом по 10 хвилин з наступним центрифугуванням. ДНК осаджують етанолом в присутності хлористого амонію і перерозчиняють в буфері, що містить 50ммоль/л трис-НСl, рН 8 і 10ммоль/л ЕДТА на протязі ночі при струшуванні. Концентрацію ДНК визначають спектрофотометричне при 260нм. Нативність отриманих препаратів ДНК перевіряють електрофорезом в 0,8% агарозному гелі. Далі з виділеними ДНК нативних клітин та клітин, проінкубованих з різними концентраціями досліджуваних препаратів, виконують безпосередньо Саузерн-блот-гібридизацію з метою виявлення специфічної дії інгібіторів ДНК-топоізомерази II на ген C-MYC. Гібридизацію проводять згідно наведеного опису: Спочатку за допомогою ендонуклеази MspI проводять рестрикцію отриманих препаратів ДНК за стандартною методикою на протязі 5 годин при 42°С. Продукти рестрикції наносять на 1% агарозний гель і проводять електрофорез на протязі ночі при кімнатній температурі і напрузі 30В в буфері, що містить 0,04моль/л трисацетат та 0,02моль/л ЕДТА. Після закінчення електрофорезу гель 30 хвилин фарбують в розчині бромистого етидію та візуаілізують в ультрафіолеті. Потім гель денатурують в розчині, що містить 1,5моль/л хлориду натрію та 0,5моль/л гідроксиду натрію, промивають 2-3 рази по 5 хвилин в дистильованій воді та нейтралізують на протязі 1год. в буфері, що містить 1,5моль/л хлориду натрію, 0,5моль/л трис-НСl рН 7,2 та 0,001моль/л ЕДТА. Після нейтралізації проводять стандартний перенос фрагментів ДНК з гелю на нітроцелюлозний фільтр для блотів на протязі ночі. Після переносу нітроцелюлозний фільтр промивають в розчині 2хSSC, висушують на повітрі під електричною лампою і запікають між двома листами паперу "Ватман ЗММ" 2год. при 80°С. Мічений зонд одержують за допомогою набору "Ready-to-Go" та Readivue a -32Р-дЦТФ за інструкцією фірмивиробника. За пробу для гібридизації править фрагмент C-MYC довжиною 1,3 т.п.н., клонований в pUC18. Перед проведенням гібридизації зонд денатур ують прогріванням на протязі 5хв. при 95-100°С, а потім охолоджують в льодяній бані. Блоти перед проведенням гібридизації предгібридизують 12год. при 42°С в герметично запаяних поліетиленових пакетах в суміші, що містить 50% формаміду, 5 х розчин Денхардта, 0,8моль/л хлориду натрію, 100мкг/мл денатурованої ДНК із сперми лосося. Після вилучення предгібридизаційної рідини заливають гібридизаційну суміш з додаванням міченої за 32P проби C-MYC. Гібридизацію проводять протягом ночі при 42°С з постійним струшуванням. Після закінчення терміну гібридизації блоти відмивають в розчині 2хSSC з 0,5% додецилсульфату натрію 5 хвилин і 2хSSC з 0,1% додецилсульфату натрію 15 хвилин при кімнатній температурі, а потім в 0,1хSSC з 0,5% додецилсульфату натрію 30 хвилин при 68°С. Для отримання радіоавтографів блоти експонують з рентгенівською плівкою на протязі 2 тижнів при -70°С. Аналіз результатів проводиться, базуючись на характерному розподілі фрагментів рестрикційного поліморфізму C-MYC для лінії клітин Namalwa або МТ-4 в нормі та в разі дії на клітини інгібіторів ДНКтопоізомерази II. Наявність зміни величини та характеру розподілу цих фрагментів свідчить про сайт-специфічний вплив речовини, що досліджується, на стан гена С-MYC, отже й про генотоксичний ефект досліджуваної речовини, зокрема, з властивостями інгібіторів ДНК-топоізомерази II. Заявлений спосіб має певні переваги перед іншими охарактеризованими вище способами визначення генотоксичності, які є аналогами заявленого способу. Зокрема, використання сайт-специфічного гену дозволяє принаймні на порядок підвищити чутли вість щодо визначення генотоксичності. Спосіб не потребує спеціальної системи для активації ксенобіотика, як цього потребує тест Еймса. Спосіб дозволяє аналізувати речовини не лише в токсичних, айв субтоксичних концентраціях, причому на протязі досить тривалої експозиції, що теж дозволяє підвищити чутливість детектування генотоксичності. Таким чином, запропонований спосіб можна використовува ти як специфічний та високочутливий способ визначення генотоксичності інгібіторів ДНКтопоізомерази II. Можливості способу розкриваються на такому прикладі: Проведено випробування генотоксичності на клітинах МТ-4 препарату "Протефлазид", до складу якого входить глікозид кверцетину. За препарат порівняння правив етопозид, що є відомим хіміопрепаратом, дія якого пов'язана саме з інгібуванням активності ДНК-топоізомерази II. Клітини МТ-4 культивували в присутності протефлазиду або субтоксичних доз етопозиду, які було попередньо підібрано. Концентрації препаратів були підібрані таким чином, щоб не викликати гострої токсичності досліджуваних клітин. Після закінчення інкубування на протязі принаймні трьох пасажів з клітин виділяли препарати ДНК та аналізували генотоксичність із застосуванням Саузерн-блот-гібридизації, як це було зазначено вище. Результати Саузерн-блот-гібридизації з пробою C-MYC після культивування досліджуваних клітин на протязі різного часу з протефлазидом в нетоксичній концентрації (1,7мкг/мл) і препаратом порівняння етопозидом в субтоксичній концентрації (0,4мкг/мл) наведено на рисунку. Інкубація з протефлазидом клітин МТ-4 супроводжувалась на початкових пасажах (особливо на першому) суттєвим зменшенням інтенсивності низькомолекулярних рестрикційних фрагментів гена C-MYC (2,2 та 3,5 т.п.н.) без повного їх зникнення, що може ймовірно бути пов'язаним з певними змінами стану цього гена в частині клітин. Однак подальше культивування клітин в середовищі без протефлазиду показало, що такі зміни в подальшому в геномі не закріплюються і кінцева картина розташування та інтенсивності смуг, що відповідають фрагментам рестрикційного поліморфізму гена CMYC при використанні мілкоподрібнюючої рестриктази MspI, не відрізнялась від контрольних клітин. Водночас, тривала інкубація клітин МТ-4 на протязі 18 діб з субтоксичними дозами етопозиду (0,4 мкг/мл), яка теж не супроводжувалась токсичними проявами і призводила лише до незначної затримки проліферації клітин, призводила до суттєви х змін картини фрагментів рестрикційного поліморфізму гена с-myc при використанні тієї ж рестриктази, а саме - до повного зникнення високомолекулярних фрагментів довжиною 16,7, 8,7 та 6,0 т.п.н. при збереженні двох менших фрагментів, що свідчить про суттєві перебудови гена C-MYC в досліджуваних умовах в разі дії інгібітору ДНК-топоізомерази II. На малюнку зображено: Саузерн-блот-гібридизація розщепленої рестриктазою Mspl геномної ДНК клітин МТ4, культивованих з протефлазидом, контрольних клітин МТ-4, та ци х же клітин, інкубованих з препаратом порівняння етопозидом, з міченою пробою с-myc: 1 - клітини, інкубовані з протефлазидом на протязі одного пасажу (3 доби); 2 - ті ж клітини, інкубовані з протефлазидом на протязі 9 діб (три пасажі) з наступним інкубуванням на протязі 9 діб в середовищі без препарату; 3 - ті ж клітини, інкубовані з протефлазидом на протязі 9 діб (три пасажі); 4 - інтактні клітини МТ-4; 5,6- клітини, інкубовані з етопозидом в концентрації 0,4 мкг/мл на протязі трьох пасажів (загальна тривалість культивування 18 діб). Розмір фрагментів ДНК в т.п.н. обраховували шляхом порівняння з фрагментами ДНК фагу l , розщепленої ендонуклеазою HindIII. Наведений приклад практичного використання запропонованого способу свідчить про те, що з його допомогою генотоксичність препарату етопозид вдалось показати навіть у субтоксичній дозі препарату сумісній з довгостроковим збереженням життєздатності клітин. Разом з тим, при тих же умовах не було виявлено генотоксичності препарату "Протефлазид", головним компонентом якого є глікозид кверцетину, принаймні в використаних нетоксичних для клітин концентраціях. Таким чином, спосіб Саузерн-блот-гібридизації може застосовуватись для визначення генотоксичності речовин з властивостями інгібіторів ДНК-топоізомерази II та для скринінгу речовин, у яких передбачають наявність такої активності. Спосіб відрізняється більшою специфічністю та чутливістю, оскільки він спрямований безпосередньо на зазначену гр упу речовин. Окрім цього, спосіб має також й інші переваги перед відомими способами визначення генотоксичності, а саме - можливість випробування речовин у субтоксичних концентраціях на протязі кількох генерацій. Спосіб може знайти застосування у фармакології для комплексного визначення генотоксичності, а також в онкології з метою скринінгу речовин, які можуть знайти своє застосування як потенційні протипухлинні препарати. Джерела інформації. 1. Ме тодические рекомендации по проверке мутагенных свойств у новы х лекарственных препаратов / (Изд. официальное. Фармакологический комитет МЗ СССР). М, 1981. - 55с. 2. Ames B.N., Durston W.E., Yamasaki E., Lee F.D. Carcinogens are mutagens: a simple test system combining liver homogenates for activation and bacteria for detection // Proc. Nat. Acad. Sci. USA. - 1973. - V.70. - P.2281-2285. 3. Evans H.J. Cytological methods for detecting chemical mutagens / Chemical mutagens: Principles and methods for their detection (Hollanger A., ed.). - NY, London: Plenum Press, 1976. - V.4. - P.1-29. 4. Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование. Пер. с англ. - М.: Мир, 1984г. - 480с. (прототип).
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of southern hybridization of dna-containing cells for detecting and monitoring gene toxicity of substances with the properties of dna topoisomerase ii
Автори англійськоюZevelevych Mykhailo Petrovych, Zavelevych Mykhailo Petrovych
Назва патенту російськоюСпособ саузерн-блот гибридизации клеток, содержащих молекулу днк, для обнаружения и контроля генной токсичости веществ со свойствами ингибиторов днк-топоизомеразы ii
Автори російськоюЗавелевич Михаил Петрович
МПК / Мітки
МПК: G01N 33/15, C12N 15/12, G01N 33/50
Мітки: спосіб, саузерн-блот-гібридизації, інгібіторів, речовин, контролю, властивостями, генотоксичності, визначення, днк, днк-топоізомерази, клітин
Код посилання
<a href="https://ua.patents.su/4-67042-sposib-sauzern-blot-gibridizaci-dnk-klitin-dlya-viznachennya-ta-kontrolyu-genotoksichnosti-rechovin-z-vlastivostyami-ingibitoriv-dnk-topoizomerazi-ii.html" target="_blank" rel="follow" title="База патентів України">Спосіб саузерн-блот-гібридизації днк клітин для визначення та контролю генотоксичності речовин з властивостями інгібіторів днк-топоізомерази іі</a>