N-арилалкінілкарбамати та їх циклічні ізомери, які виявляють протисудомну активність
Номер патенту: 82566
Опубліковано: 25.04.2008
Автори: Ємельянова Оксана Іванівна, Лозинський Мирон Онуфрійович, Євтушенко Ольга Олександрівна, Біденко Галина Віталіївна, Громов Леонід Олександрович, Сироватська Лідія Павлівна, Овінова Галина Василівна, Гудима Андрій Олегович
Формула / Реферат
N-арилалкінілкарбамати та їх циклічні ізомери загальної формули:
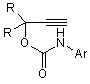 ,
,
де: R = H, 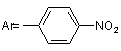 , (І)
, (І)
R = H, 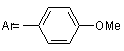 , (II)
, (II)
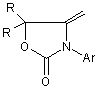 ,
,
R = -CH3, 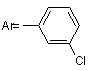 ,(III)
,(III)
які виявляють протисудомну активність.
Текст
N-арилалкінілкарбамати та їх циклічні ізомери загальної формули: 2 Винахід відноситься до органічної хімії, а саме до похідних карбамінової кислоти, які виявляють протисудомну активність і можуть застосовуватись в якості нових потенційних протиепілептичних засобів, загальної формули: R R H N O O Ar 3 Ar= NO2 82566 (І) , де: R = H, Ar= OMe (II) , R = H, R R O N Ar O , Ar= (III) Cl , R = -CH3, За даними ВООЗ близько 1% населення земної кулі страждають на епілепсію, причому майже кожен четвертий пацієнт, страждає від епілептичних нападів, резистентних до сучасної протиепілептичної терапії [1]. Незважаючи на наявність достатньої кількості протиепілептичних засобів, за допомогою яких можна купіювати майже кожний епілептичний напад, проблема лікування епілепсії залишається далеко не вирішеною. Відомо, що за допомогою «традиційних» протиепілептичних засобів першого покоління, які застосовуються при монотерапії, де найбільш поширеними і широковживаними є фенобарбітал, фенітоїн, пірімідон, етосуксимід, карбамазепін, вальпроат, можна забезпечити контроль епілептичних нападів лише у 75%-80% випадків. Однак у цієї групи пацієнтів часто виникають проблеми, пов'язані з досить серйозними побічними ефектами з боку центральної нервової системи, алергічними реакціями та тератогенною дією препаратів. Для 20%-25% людей, які страждають від дуже тяжких резистентних форм епілепсії, користь від застосування традиційної мототерапії взагалі мала, оскільки у цієї групи пацієнтів у відповідь на лікування високими дозами препаратів виникають дуже тяжкі непереносимі побічні ефекти [2]. Ці пацієнти, резистентні до традиційної монотерапії, потребують комплексного лікування (політерапії), що в свою чергу ще більш ускладнюється небажаними побічними реакціями, які виникають внаслідок фармакодинамічних та: фармакокінетичних взаємодій різних (вігабатрин, Препарати другого покоління лікарських фелбамат, габапентин, ламотриджин, топірамат, засобів. тіагабін, леветірацетам, оксарбазепін, зонізамід, прегабалін), які ліцензовані протягом останніх 15 років, призначені, в основному, як додаткові засоби для лікування резистентних форм парціальної епілепсії [2-7]. Тільки деякі з них 4 (ламотриджин, окскарбазепін та топірамат) рекомендовані в якості монотерапії при вперше діагностованій епілепсії та у разі резистентних форм парціальної епілепсії. Проведені клінічні дослідження показали, що препарати нового покоління є більш безпечними порівняно з традиційними базовими протиепілептичними засобами, однак сфера їх застосування на сьогодні обмежена. На сьогодні відсутні достатні дані, на підставі яких можна було б зробити раціональний вибір серед цих препаратів. Немає остаточного заключения щодо різниці їх ефективності чи толерантності. Стосовно вігабатрина та ламотриджина, останні випробування не дають змоги прогнозувати ефективність цих препаратів у випадках стійкої резистентної епілепсії. Застосування ж фелбамату дуже обмежується. Отже, з огляду на це, існує необхідність подальшого пошуку нових протиепілептичних засобів, які б забезпечували ефективний та безпечний контроль епілептичних нападів. Лікарських засобів, аналогів за структурою запропонованих синтезованих нами сполук, що застосовуються у клінічній практиці як протисудомні, немає. Найближчим аналогом за фармокологічною дією та віддаленим аналогом за структурою є препарат фелбамат (2-феніл-1,3-пропандіол дікарбамат). Фелбамат вперше був рекомендований як для додаткової, так і для монотерапії парціальної епілепсії та синдрому Ленокса-Гасто. Препарат ефективний і при інших видах епілепсій. Але як з’ясувалося при проведенні постмаркетингових клінічних випробувань, він викликає дуже серйозні побічні ефекти з летальними наслідками (апластична анемія та гепатотоксичність) і тому зараз застосування цього препарату дуже обмежене. Препарат рекомендується для застосування у крайніх випадках для лікування тих пацієнтів, які резистентні до всіх існуючих протепілептичних засобів і методів терапії [3, 4]. Задачею винаходу є пошук нових хімічних сполук, що мають протисудомну активність та створення на їх основі більш ефективних та безпечних лікарських засобів. Поставлена задача досягається синтезом Nарил-алкінілкарбаматів (1, 11) та їх циклічних ізомерів (III). Зазначені сполуки одержують наступним шляхом: R R + O ArN=C=O NEt3 R R B H N O O R R Ar O N Ar O де: В=CH3ONa Внаслідок взаємодії алкінілкарбінолів з відповідним ізоціанатом в присутності триетиламіну в якості каталізатора, одержують алкінілкарбамат (I, II). Цільовий продукт III отримують циклізацією відповідного алкінілкарбамату (Аr=м-хлорфеніл) в сильнолужному середовищі. Винахід ілюструється наступними прикладами. Приклад 1. 5 82566 Синтез Н-(п-нітрофеніл)-О-пропаргілкарбамату (І). До розчину 1.46 г (8.89 ммоль) паранітрофенілізоціанату та 0.5 г (8.89 ммоль) пропаргілового спирту в 15 мл бензолу додають по краплях при перемішуванні 2 мл триетиламіну. Відразу ж утворюється жовтий осад. Суміш перемішують ще 2 години. Осад фільтрують, промивають гексаном, сушать у вакуумі. Вихід паранітрофеніл пропаргіл карбамату (І) 1.7 г (86%). Ттопл=117°С. ПМР-спектр (DMSO-d6, δ, м. ч): δ=3.61 (t, 1Н, 4JНН=2.4 Hz, =C-H); 4.82 (d, 2H, 4 JНН=2.4 Hz, CH2); 7.69 (d, 2H, 3JНН=9.4 Hz, CHarom.); 8.21 (d, 2Н, 3JНН=9.4 Hz, CHarom.); 10.59 (s, 1H, NH). Знайдено%: С - 54,70; Н - 3,52; N- 12,81. C10H8N2О4. Обчислено%: С - 54,55; Н - 3,66; N 12,72. М-(п-метоксифеніл)-0-пропаргіл-карбамат (II) отримують за такою ж методикою. Вихід параметоксифеніл карбамату (II) 1.78 г (85%). Tтопл=84-85°С. ПМР-спектр (DMSO-d6, δ, м. ч): δ=3.61 (t, 1H, 4JНН=2.4 Hz, =C-H); 4.82 (d, 2H, 4 JНН=2.4 Hz, CH2); 7.69 (d, 2H, 3JНН=9.4 Hz, CHarom.); 8.21 (d, 2H, 3JНН=9.4 Hz, CHarom.); 10.59 (s, 1H, NH). Знайдено%: С - 64,58; Н - 5,26; N - 6,89. С11Н11NО3. Обчислено%: С - 64,38; Н - 5,40; N 6,83. У випадку застосування метахлорфенілізоціанату за аналогічною методикою, утворюється суміш М-(м-хлорфеніл)О-(3-метилбут-1-ін-3-іл)-карбамату та 5,5-диметил4-метилен-3-м-хлорфеніл-1,3-оксазолідінону у мольному співвідношенні 5:1. Приклад 2. Синтез 5,5-диметил-4-метилен-3-м-хлорфеніл1,3-оксазолідінону (III). До розчину 0.89 г суміші з прикладу 1 в 15 мл метанолу додають при перемішуванні розчин метилату натрію, отриманого розчиненням натрію 6 (0.02 г) в 5мл метанолу. Реакційну суміш перемішують при нагріванні 2 години. Розчинник упарюють, залишок перекристалізовують з суміші гексан-бензол. Вихід чистого метахлорфенілоксазолідінону 0.7 г (79%). Ттопл=102°С. ПМР-спектр (DMSO-d6, δ, м. ч): δ=1.6 (s, 6Н, (СН3)2); 3.98 (d, 1Н, 2JНН=2.8 Hz, =CH2); 4.28 (d, 1Н, 2JНН=2.8 Hz, =CH2); 7.39 (m, 1H, C-Harom); 7.5-7.6 (m, 3Н, C-Harom). Знайдено%: С - 60,38; H 4,99; N - 5,92. C12H12ClNО2. Обчислено%: С - 60,64; H - 5,09; N - 5,89. Приклад 3. Визначення медико-біологічної активності та гострої токсичності сполук І, II, III. Мінімальну нейротоксичну дозу (ТД50) - дозу, яка викликає мінімальний нейротоксичний ефект у 50% дослідних тварин, - визначали за допомогою методу обертаючого стрижня ("ротород-тесту") [8]. Специфічну протисудомну активність сполук досліджували на двох моделях судомних станів: коразолові судоми та МЕШ (максимальний електрошок) [9, 10, 11]. Досліди проведені на статевозрілих білих мишах вагою 18-22 г при внутрішньочеревинному введенні емульсії сполук з розрахунку 0,1 мл на 10 г маси. Сполуки диспергували у водній суспензії з 0.02% Твіном-80 у кількості, необхідній для досягнення бажаної концентрації діючої речовини. Нейротоксичність та протисудомну активність вивчали через 1 годину після введення сполук. Визначення ЕД50 (середня ефективна доза) та ТД50 здійснювали за методом Літчфілда та Уілкоксона [8]. Широту терапевтичної дії оцінювали за величиною ЗІ (захисний індекс), який дорівнює TTW ЕД50. Специфічна протисудомна активність та нейротоксичність досліджуваних сполук співставлена з токсичністю відомих протиепілептичних засобів (табл. 1). Табл. 1 Мінімальна нейротоксичність та протисудомна активність при внутрішньочеревинному введенні сполук І, II, III порівняно з базовими протиепілептичними засобами Сполука І II III ТД50 мг/кг 350 (250÷490) 73 (40.5÷94.9) ~ 300 42,8 (36,4-47,5) 47,8 Карбамазепін* (39,2-59,2) 483 Вальпроат* (412-571) 323 Етосуксимід* (279-379) 0,27 Клоназепам* (0,14-0,43) 1545,0* Фелбамат* (1229,1-1986,8) - * - використані дані з монографії [12]. - ** - пероральний спосіб введення Фенітоїн* Коразол ЕД50 ЗІ (ТД50/ЕД50) 330 1,06 (253÷429) 38 1.92 (28.14÷-51.3) 150 2 (117,18÷192) >50 0,9 МЕШ ЕД50 90 (50÷162) 15.4 (9.6÷24.6) 55 (47,8÷63,25) 6,48 (5,65-7,24) 9,85 ЗІ (ТД50/ЕД50) 3,88 1,7 2,5 287 (237-359) >350 16 23,76 0,01 2,8* 81,1** (72,0-92,7) 19* >50
ДивитисяДодаткова інформація
Назва патенту англійськоюN-arylalkynylcarbamates and closed-chain isomers thereof having anticonvulsant activity
Автори англійськоюBidenko Halyna Vitaliivna, Hudyma Andrii Olehovych, Lozynskyi Myron Onufriiovych, Lozynskyi Myron Onufriovych, Hromov Leonid Oleksandrovych, Syrovatska Lidia Pavlivna, Emrlyanova Oksana Ivanivna, Ovinova Halyna Vasylivna, Yevtushenko Olha Oleksandrivna
Назва патенту російськоюN-арилалкинилкарбаматы и их циклические изомеры, которые проявляют противосудорожную активность
Автори російськоюБиденко Галина Виталиевна, Гудима Андрей Олегович, Лозинский Мирон Онуфриевич, Громов Леонид Александрович, Сироватская Лидия Павловна, Емельянова Оксана Ивановна, Овинова Галина Васильевна, Евтушенко Ольга Александровна
МПК / Мітки
МПК: C07C 271/26, A61K 31/27, C07C 271/28
Мітки: протисудомну, активність, циклічні, ізомери, n-арилалкінілкарбамати, виявляють
Код посилання
<a href="https://ua.patents.su/4-82566-n-arilalkinilkarbamati-ta-kh-ciklichni-izomeri-yaki-viyavlyayut-protisudomnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">N-арилалкінілкарбамати та їх циклічні ізомери, які виявляють протисудомну активність</a>
Попередній патент: Торцеве ущільнення
Наступний патент: Будівля або споруда та спосіб її зведення
Випадковий патент: Спосіб та пристрій для безперервної подачі кондитерських мас








