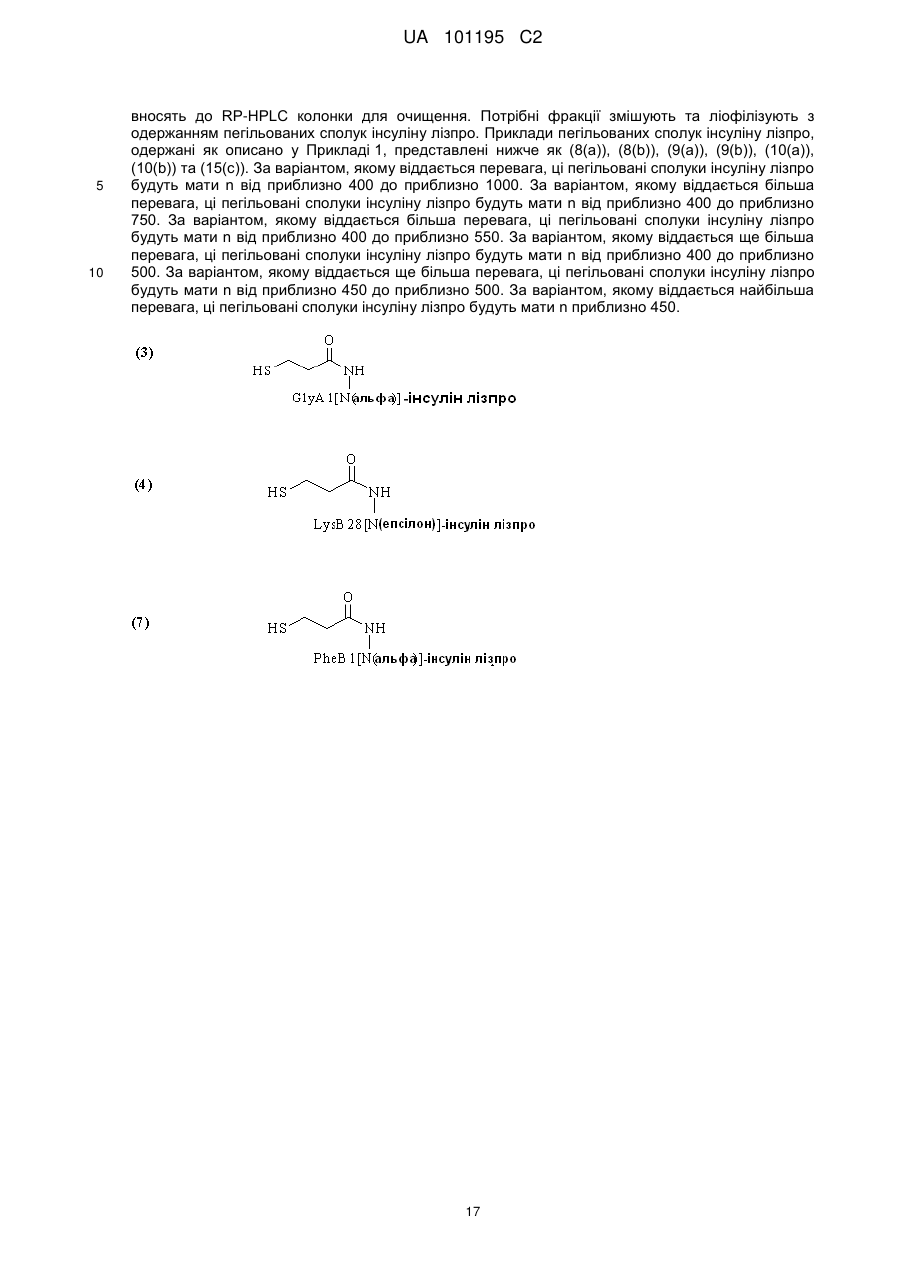
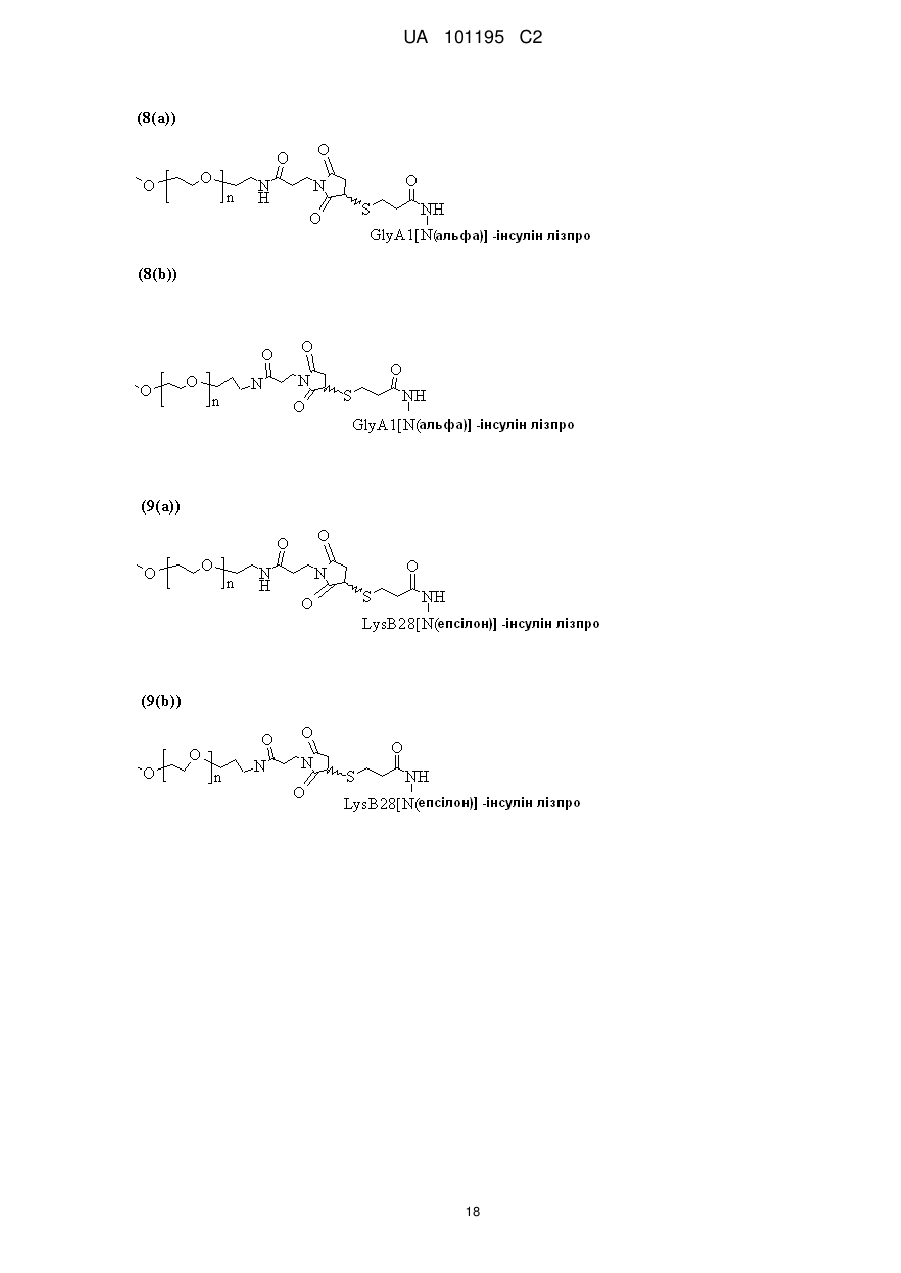
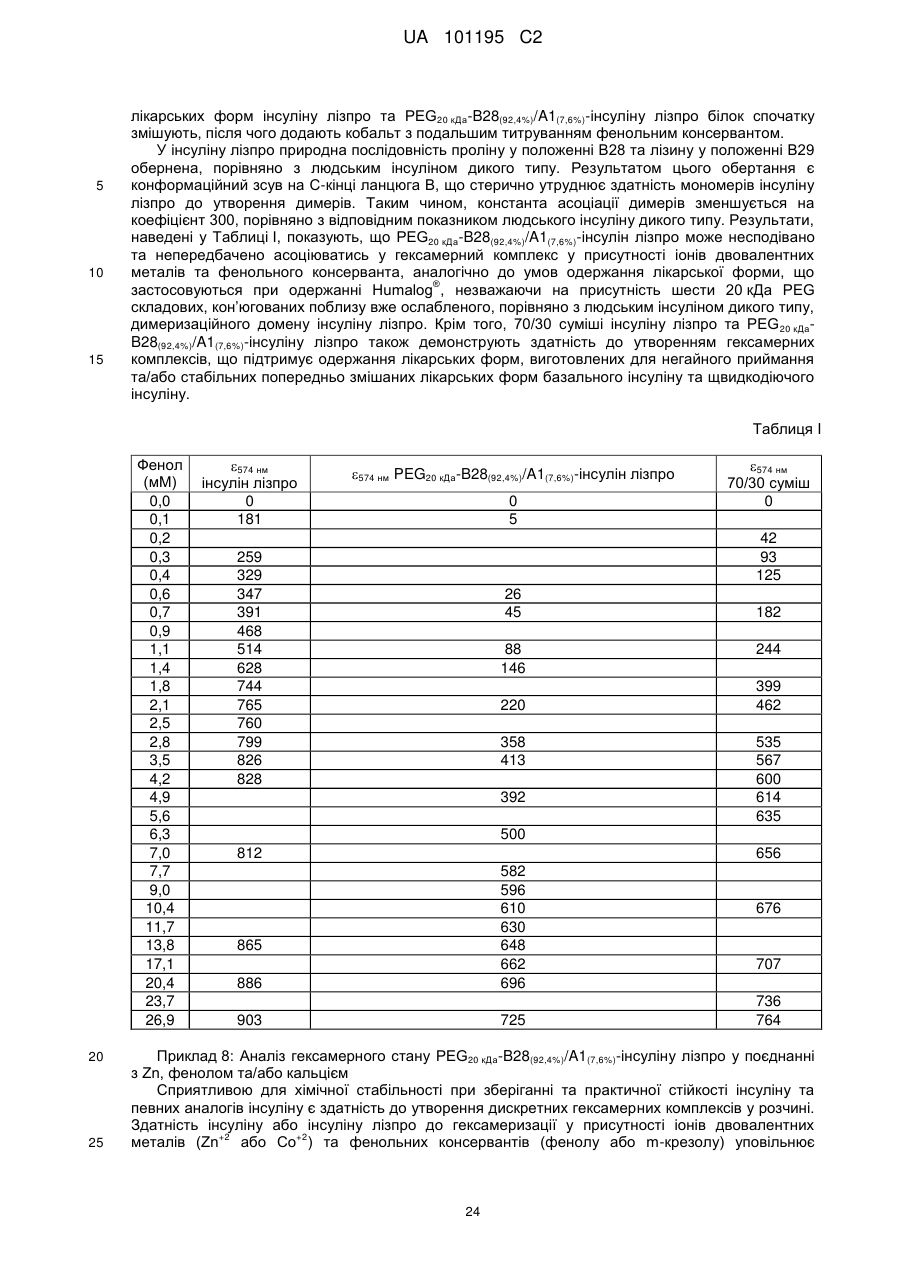
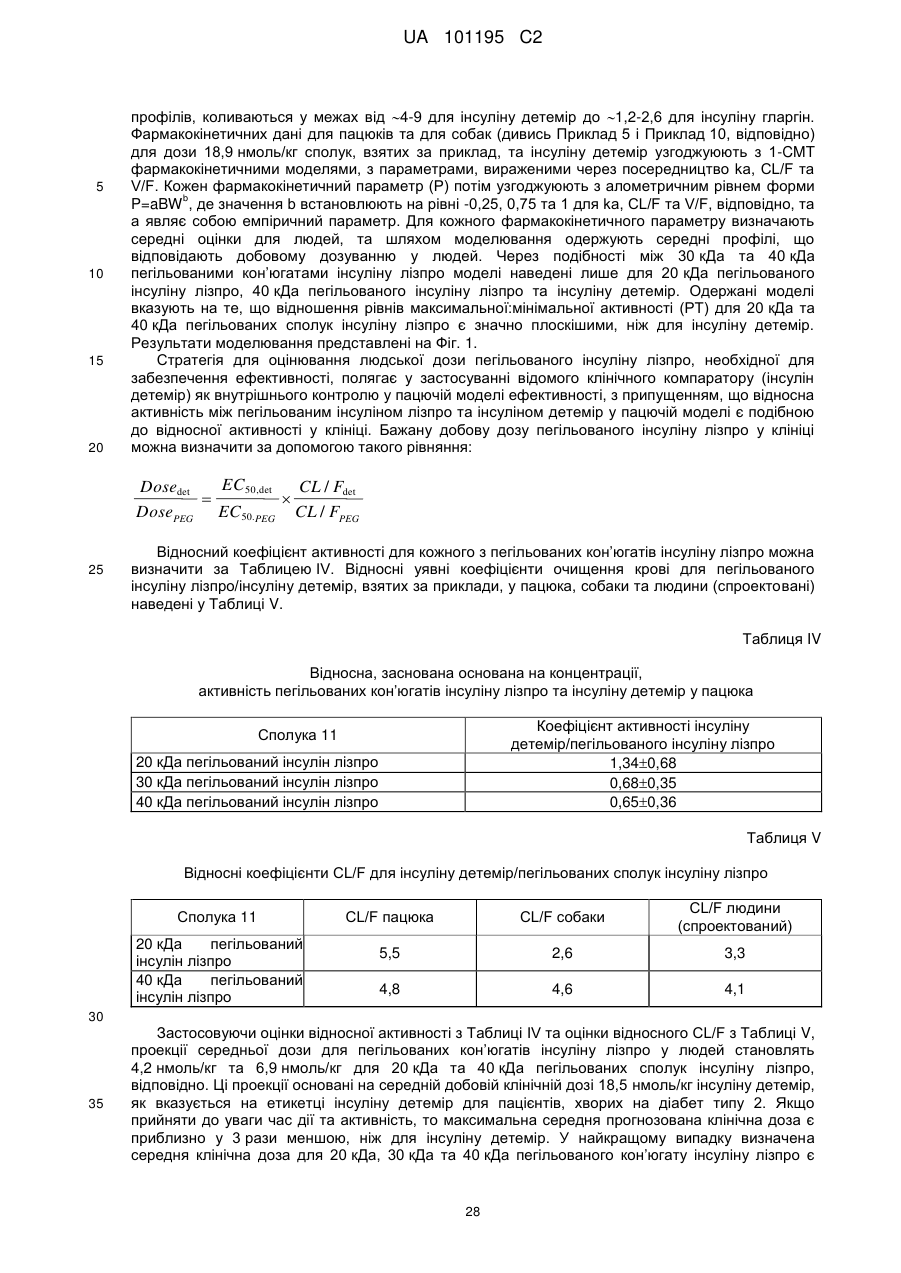
Пегильована сполука інсуліну лізпро, фармацевтична композиція на її основі та спосіб її одержання
Номер патенту: 101195
Опубліковано: 11.03.2013
Автори: Ширані Шахріар, Білз Джон Майкл, Дойл Брендон, Хансен Райан Джон, Катлер Гордон Батлер, Чжан Ляншен, Лі Шан
Формула / Реферат
1. Пегильована сполука інсуліну лізпро формули:
Р-[(А)-(В)] або її фармацевтично прийнятна сіль, де:
А - ланцюг А інсуліну лізпро (послідовність SEQ ID NO: 1);
В - ланцюг В інсуліну лізпро (послідовність SEQ ID NO: 3); та
Р - PEG, що має молекулярну масу від приблизно 17,5 кДа до приблизно 40 кДа, і де А та В є відповідним чином перехреснозв'язаними, та Р є приєднаним за допомогою ковалентного уретанового зв'язку до епсилон-аміногрупи лізину у положенні 28 ланцюга В.
2. Сполука за п. 1, де PEG має молекулярну масу від приблизно 17,5 кДа до приблизно 25 кДа.
3. Сполука за будь-яким з пп. 1, 2, де PEG має молекулярну масу від приблизно 20 кДа до приблизно 25 кДа.
4. Сполука за будь-яким з пп. 1-3, де PEG має молекулярну масу приблизно 20 кДа.
5. Сполука за будь-яким з пп. 1-4, особливістю якої є відношення рівнів максимальної:мінімальної активності, яке є меншим ніж 2 при парентеральному введенні пацієнту терапевтично ефективної кількості сполуки.
6. Сполука за будь-яким з пп. 1-5 для застосування у терапії.
7. Сполука за будь-яким з пп. 1-6 для застосування при лікуванні гіперглікемії або діабету.
8. Застосування сполуки за будь-яким з пп. 1-7 для виготовлення лікарського засобу для лікування гіперглікемії або діабету.
9. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-7 та один або декілька фармацевтично прийнятних наповнювачів, розріджувачів або носіїв.
10. Фармацевтична композиція за п. 9, яка також містить трис-буфер з концентрацією від приблизно 10 мМ до приблизно 25 мМ трис, причому рН згаданої фармацевтичної композиції становить від приблизно рН 7,0 до приблизно рН 8,0, і згадана фармацевтична композиція містить щонайменше один засіб для регулювання ізотонічності, при цьому згадана композиція має ізотонічність від приблизно 270 мОсм до приблизно 330 мОсм.
11. Фармацевтична композиція за п. 9, яка також містить фосфатний буфер з концентрацією від приблизно 5 мМ до приблизно 10 мМ, причому рН згаданої фармацевтичної композиції становить від приблизно рН 7,0 до приблизно рН 7,5, і згадана фармацевтична композиція містить щонайменше один засіб для регулювання ізотонічності, при цьому згадана композиція має ізотонічність від приблизно 270 мОсм до приблизно 330 мОсм.
12. Фармацевтична композиція за будь-яким з пп. 9-11, яка містить пегильовану сполуку інсуліну лізпро з концентрацією від приблизно 15 мг/мл до приблизно 40 мг/мл, цинк з відношенням цинку до пегильованої сполуки інсуліну лізпро від приблизно 0,33 до приблизно 0,83 та m-крезол з концентрацією від приблизно 10 мМ до приблизно 40 мМ при рН від приблизно рН 7,0 до приблизно рН 8,0.
13. Фармацевтична композиція за будь-яким з пп. 9-12, яка також містить терапевтично ефективну кількість інсуліну лізпро.
14. Спосіб одержання пегильованої сполуки інсуліну лізпро формули:
Р-[(А)-(В)] або її фармацевтично прийнятної солі, де:
А - ланцюг А інсуліну лізпро (послідовність SEQ ID NO: 1);
В - ланцюг В інсуліну лізпро (послідовність SEQ ID NO: 3); та
Р - PEG, що має молекулярну масу від приблизно 20 кДа до приблизно 40 кДа, і де А та В є відповідним чином перехреснозв'язаними, та Р є приєднаним за допомогою ковалентного уретанового зв'язку до епсилон-аміногрупи лізину у положенні 28 ланцюга В,
який включає реагування епсилон-аміногрупи лізину у положенні 28 ланцюга В з монометоксиполіетиленгліколь-р-нітрофенілкарбонатом (mPEG-NPC), що має зважене середнє значення молекулярної маси від приблизно 20 кДа до приблизно 40 кДа, у водному розчині при рН від приблизно рН 8,5 до приблизно рН 11,5 та при температурі від 25 °C до приблизно 30 °C впродовж періоду часу тривалістю від приблизно 3 год. до приблизно 6 год.
15. Спосіб за п. 14, який відрізняється тим, що має мольне співвідношення РЕО:інсулін лізпро від приблизно 2,5 до приблизно 5,0.
16. Спосіб за п. 14 або п. 15, який відрізняється тим, що зважене середнє значення молекулярної маси mPEG-NPC становить приблизно 20 кДа.
17. Спосіб за будь-яким з пп. 14-16, який відрізняється тим, що рН реакції підтримується у межах від приблизно рН 10,5 до приблизно рН 11,5.
18. Спосіб за будь-яким з пп. 14-17, який відрізняється тим, що реакцію здійснюють при температурі від приблизно 25 °C до приблизно 30 °C впродовж приблизно 3 год.
Текст
Реферат: Цей винахід стосується пегильованих сполук інсуліну лізпро. Цей винахід також стосується способів одержання таких молекул, фармацевтичних композицій, які їх містять, та їх терапевтичного застосування. UA 101195 C2 (12) UA 101195 C2 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПЕГІЛЬОВАНІ СПОЛУКИ ІНСУЛІНУ ЛІЗПРО Цей винахід стосується галузі лікування діабету. Конкретніше, цей винахід має відношення до пегільованих сполук інсуліну лізпро, які є високорозчинними та мають пролонгований профіль дії, до способів одержання таких молекул, до фармацевтичних композицій, які містять згадані сполуки, та до терапевтичного застосування таких сполук. Для досягнення нормального рівня вмісту глюкози у крові розроблена програма інсулінозамісної терапії, призначена для максимально подібного відтворення секреції ендогенного інсуліну, як вона відбувається у здорових суб’єктів. Добова фізіологічна потреба у інсуліні коливається і може бути поділена на дві фази: (а) абсорбтивна фаза, яка потребує швидкого виділення інсуліну для подолання викиду глюкози у кров після приймання їжі, та (b) постабсорбтивна фаза, яка потребує тривалого підтримування рівня інсуліну для регулювання виділення глюкози печінкою для підтримання оптимального рівня глюкози у крові натщесерце. Таким чином, ефективна інсулінотерапія у пацієнтів, хворих на цукровий діабет, охоплює, як правило, комбіноване застосування лікарських форм екзогенного інсуліну двох типів: швидкодіючого прандіального інсуліну, який постачається ін’єкціями ударних доз, та інсуліну пролонгованої дії, який вводять шляхом ін’єкції один раз або двічі на добу для регулування рівнів глюкози у крові між прийманнями їжі. Доступним на цей час програмам інсулінозамісної терапії бракує одного або декількох клінічно важливих аспектів. Наприклад, традиційні лікарські форми інсуліну проміжної та пролонгованої дії, такі як аналог базального інсуліну, інсулін детемір, мають тривалість дії, яка є недостатньою для забезпечення контролювання базального рівня глюкози впродовж цілої доби при щоденному введенні. Як наслідок, при введенні однієї ін’єкції на день тривалість дії базального інсуліну часто є недостатньою для достатнього контролювання гіперглікемії і, конкретніше, для задовільнення потреб постабсорбтивної фази. Крім того, пропускання однієї ін’єкції існуючих на цей час лікарських засобів може привести до значного підвищення відношення рівнів “максимальної активності:мінімальної активності” лікарського засобу, наслідком чого є порушення контролю рівня вмісту глюкози. Крім того, застосування стратегій нерозчинності для подовження виділення інсуліну у традиційних лікарських формах інсуліну проміжної та тривалої дії, наприклад, кристалічних нейтрального протаміну Хагедорна (NPH)® інсуліну та ULTRALENTE , або стратегії in vivo осадження інсуліну гларгін, підвищує змінність між ін’єкціями, результатом чого є підвищена змінність профілю “доза-вплив”. Конкретніше, ® суспензії NPH та ULTRALENTE потребують механічного перемішування для забезпечення однорідності продукту, мають підвищену міжсуб’єктну змінність та схильність до досягнення максимального рівня, замість забезпечення ідеального “плоского” фармакодинамічного профілю, необхідного для підтримання оптимального рівня глюкози у крові натщесерце продовж тривалого періоду часу між прийманнями їжі. Таким чином, лікарські форми інсуліну, які покладаються на стан нерозчинності для подовження дії інсуліну, є по суті менш прогнозованими, ніж розчинні лікарські форми, і як результат, забезпечують менш ніж достатній контроль рівня глюкози у крові та більшу схильність до виникнення випадків гіпоглікемії, які є небезпечними для життя. Крім того, сучасні аналоги базального інсуліну не є легко змішуваними з лікарськими формами інсуліну швидкої та проміжної дії. Таким чином, сучасні програми інсулінозамісної терапії все ще залишають пацієнтів, хворих на цукровий діабет, під загрозою виникнення гіпоглікемічних епізодів, які є небезпечними для життя, серйозних довготривалих медичних діабетичних ускладнень та/або завдають пацієнту значних турбот та створюють йому незручності, які погіршують якість життя. Патент США № 4,179,337, який має назву “Non-Immunogenic Polypeptides”, розкриває інсулін, кон’югований з лінійними молекулами поліетиленгліколю (PEG), молекулярна маса якого знаходиться у межах від приблизно 500 Да до приблизно 20000 Да. Hinds та Kim описали інсулін, кон’югований з низькомолекулярним (600 Да, 750 Да та 2000 Да) монометоксиполіетиленгліколем (Hinds, K.D., and Kim, et al., Advanced Drug Delivery Reviews, 54:505-530 (2002)). У цій статті автори стверджують, що вони обмежили своє дослідження кон’югатами низькомолекулярного монометоксиполіетиленгліколю (mPEG) з інсуліном, “оскільки [заздалегідь] було встановлено, що приєднання високомолекулярного mPEG (5000 Да) значно пригнічує біологічну активність кон’югату”. Публікація міжнародної заявки WO 2006/079641 розкриває кон’югування похідних інсуліну, у тому числі інсуліну лізпро, з дрібномолекулярними розгалуженими полімерами. Публікація міжнародної заявки WO 2004/091494 розкриває, між іншим, молекули інсуліну, кон’юговані з лінійними та розгалуженими молекулами PEG, у яких загальна молекулярна маса PEG досягає приблизно 10 кДа та приблизно 20 кДа, відповідно. Публікації міжнародних заявок WO 2008/015099 (опублікована 7 лютого 2008 року) та WO 2008/084051 (опублікована 17 липня 2008 року) розкривають, між іншим, різні аналоги 1 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 інсуліну, кон’юговані з молекулами PEG, які мають номінальну молекулярну масу від приблизно 200 Да до приблизно 40000 Да. Очевидно, все ще існує критична потреба у інсулінах пролонгованої дії, які є більш пристосованими для програм базальної інсулінозамісної терапії. Зокрема, необхідними є розчинні базальні інсуліни, які є змішуваними з лікарськими формами прандіального інсуліну, мають подовжені профілі “час-дія” (тобто є здатними достатньо контролювати рівні глюкози у крові при введенні ін’єкції один раз на день або рідше), більш плоскі фармакокінетичні профілі активності (тобто менші відношення рівнів максимальної/мінімальної активності), зменшену міжсуб’єктну змінність (тобто більш прогнозованій профіль “час-дія”, який перетворюється на зменшену кількість випадків гіпоглікемії та/або приросту маси тіла) та/або менше подразнення місця ін’єкції або біль під час введення ін’єкції. У цьому описі винахідники повідомляють про відкриття, суть якого полягає у тому, що інсулін лізпро може бути пегільованим високомолекулярними похідними поліетиленгліколю з одержанням пегільованих сполук інсуліну лізпро, які мають терапевтично ефективну активність базального інсуліну, подовжені профілі “час-дія”, є високорозчинними при фізіологічному значенні рН та/або є змішуваними з іншими широко застосовуваними лікарськими формами прандіального інсуліну. Цей винахід пропонує сполуку Формули I: P-[(A)-(B)] або її фармацевтично прийнятну сіль, де: A – ланцюг A інсуліну лізпро (послідовність SEQ ID NO: 1); B – ланцюг B інсуліну лізпро (послідовність SEQ ID NO: 3); та P – PEG, який має молекулярну масу від приблизно 20 кДа до приблизно 40 кДа, і де A та B є відповідним чином перехреснозв’язаними, та P є прямо або опосередковано приєднаним за допомогою ковалентного зв’язку до альфа-аміногрупи гліцину у положенні 1 ланцюга A, альфааміногрупи фенілаланіну у положенні 1 ланцюга B або епсилон-аміногрупи лізину у положенні 28 ланцюга B. Цей винахід також пропонує композиції, які містять певну кількість моно- та дипегільованих сполук інсуліну лізпро, де більше ніж приблизно 75% пегільованих сполук інсуліну лізпро у композиції становлять монопегільовані сполуки Формули I. Цей винахід також пропонує композиції, які містять монопегільовані сполуки інсуліну Формули I, де більше ніж приблизно 50% монопегільованих сполук у композиції мають PEG, ковалентно (прямо або опосередковано) приєднаний до епсилон-аміногрупи лізину у положенні 28 ланцюга B. Цей винахід також пропонує фармацевтичні композиції, які містять пегільований інсулін лізпро Формули I та один або декілька фармацевтично прийнятних консервантів, засобів для регулювання ізотонічності, іонів металу або буферів. У певних варіантах здійснення цього винаходу фармацевтичні композиції, які містять пегільований інсулін лізпро Формули I та один або декілька фармацевтично прийнятних консервантів, засобів для регулювання ізотонічності, іонів металу або буферів, також містять терапевтично ефективну кількість аналогу інсуліну. Цей винахід також пропонує способи лікування гіперглікемії, цукрового діабету або діабету вагітних, причому згадані способи включають введення пацієнту терапевтично ефективної кількості фармацевтичної композиції, яка містить пегільовану сполуку інсуліну лізпро за цим винаходом. Цей винахід також охоплює застосування пегільованої сполуки інсуліну лізпро за цим винаходом для терапії. Цей винахід також охоплює застосування пегільованої сполуки інсуліну лізпро за цим винаходом для виготовлення лікарського засобу для лікування гіперглікемії, цукрового діабету або діабету вагітних. Короткий опис фігур На Фіг. 1 у графічній формі показані модельовані людські PK (фармакокінетичні) профілі для 20 кДа-PEG-B28-інсуліну лізпро, 40 кДа-PEG-B28-інсуліну лізпро та інсуліну детемір, основу яких становить алометричне масштабування PK параметрів пацюків та собак. Профілі показують один інтервал між прийманням лікарського засобу після тижневого введення лікарського засобу. Цифри являють собою середні відношення рівнів максимальної/мінімальної активності. Фіг. 2 – графік швидкості введення глюкози (GIR) у людей після підшкірного введення дози PEG20 кДа-B28(95%)/A1(5%)-інсуліну лізпро (LY; 0,225 мг/кг) або інсуліну гларгін (0,5 Од/кг). Основу профілів GIR становлять експериментальні дані, а для округлення експериментальних даних застосовували “менш гладеньку” функцію (Splus 2000, Professional Edition, MathSoft, Inc), розроблену в Lilly Research Laboratories. 2 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 Докладний опис винаходу У цьому описі застосовують наведені нижче скорочення: ACN: ацетонітрил. Boc: третбутоксикарбоніл. BSA: бичачий сироватковий альбумін. DCM: дихлорметан, метиленхлорид. DMF: N,N-диметилформамід. DMSO: диметилсульфоксид. DTT: дитіотреітол. EDTA: етилендіамінтетраоцтова кислота. Et: етил. EtOH: етанол. Fmoc: 9-фторенілметилоксикарбоніл. HCl: хлористоводнева кислота. Da: Дальтон. kDa: кілодальтон. Lilly: Eli Lilly and Company (Indianapolis, штат Індіана). mAb: моноклональне антитіло. Me: метил. MeOH: метанол. PBS: фосфатно-сольовий буферний розчин. RP-HPLC: зворотнофазова високоефективна рідинна хроматографія. SEC: гель-хроматографія за розміром молекул. SEM: середня квадратична помилка середнього. SPA: сцинтиляційний аналіз із застосуванням молекулярно-імпринтованих полімерів. TFA: трифтороцтова кислота. Усі скорочені позначення амінокислот, вжиті у цьому описі, є позначеннями, прийнятими Відомством з патентів та товарних знаків США, як сформульовано у 37 C.F.R. (Звід федеральних правил) § 1.822(B)(2). Термін “інсулін” означає інсулін дикого типу від будь-якого виду, у тому числі (але без обмеження ними) свинячий інсулін, бичачий інсулін та людський інсулін. Нативний інсулін, або інсулін дикого типу, означає інсулін, який має амінокислотну послідовність, яка відповідає амінокислотній послідовності природного інсуліну. Полінуклеотидні та амінокислотні послідовності, що кодують інсулін ряду різних видів, є добре відомими пересічним фахівцям у цій галузі. Наприклад, людський інсулін має ланцюг А, що складається з двадцяти однієї амінокислоти, та ланцюг В, що складається з тридцяти амінокислот (послідовності SEQ ID NO: 1 та SEQ ID NO: 2, відповідно). Інсулін може бути природним (тобто виділеним з природного джерела) або одержаним біосинтетичним чи синтетичним шляхом. Термін “інсулін” означає також будь-яку похідну та/або аналог інсуліну. “Аналог інсуліну” або “похідна інсуліну” визначається у цьому описі як білок, який має активність інсуліну і по суті таку ж саму амінокислотну послідовність, як і людський інсулін, але відрізняється від людського інсуліну модифікацією, порівняно з людським інсуліном, й який включає одну або декілька амінокислотних замін, делецій, інверсій або додань. Такі сполуки є добре відомими у цій галузі. Дивись, наприклад, публікації міжнародних заявок WO 96/15804 та WO 03/053339; патенти США № 3,528,960, № 5,514,646, № 5,618,913, № 5,750,497, № 6,011,007, № 6,251,856; та патенти EP 254,516 та EP 280,534. Взятий за приклад, але не вичерпний перелік аналогів інсуліну, відомих фахівцю у цій галузі, включає інсулін аспарт, інсулін лізпро, інсулін гларгін, інсулін детемір та інсулін глулізин. Крім того, термін “інсулін”, вжитий у цьому описі, також означає сполуки, які можуть одночасно вважатись як похідною інсуліну так і аналогом інсуліну. Приклади таких сполук описані у патентах США № 5,750,497 та № 6,011,007. Конкретним прикладом такої сполуки, відомої фахівцю у цій галузі, є інсулін детемір. Різні аналоги та/або похідні інсуліну є відомими як швидкодіючі (“fast-acting” або “rapidacting”) аналоги інсуліну. Терміни “fast-acting” або “rapid-acting” вжиті у цьому описі взаємозамінно. “Швидкодіючий аналог інсуліну” справляє вплив прандіальної дії глюкози, що (a) розпочинається після підшкірного введення скоріше ніж вплив людського інсуліну, та/або (b) демонструє коротшу тривалість дії, порівняно з людським інсуліном, після підшкірного введення. Приклади швидкодіючих аналогів інсуліну включають “мономерні аналоги інсуліну”, які є швидкодіючими внаслідок того, що вони, як правило, є менш схильними до димеризації або самоскладання при фізіологічних умовах. Мономерні аналоги інсуліну є відомими у цій галузі. Дивись, наприклад, патент США № 5,700,662 та EP 214 826. Інсулін лізпро є швидкодіючим мономерним аналогом інсуліну, у якому пролін у положенні 28 ланцюга В інсуліну дикого типу (послідовність SEQ ID NO: 2) та лізин у положенні 29 ланцюга В інсуліну дикого типу (послідовність SEQ ID NO: 2) були переключені. Відповідним чином, інсулін лізпро є B28 B29 відомим у цій галузі під різними позначеннями, у тому числі (але без обмеження) Lys Pro людський інсулін, LysB28ProB29-людський інсулін та B28Lys, B29Pro людський інсулін. Термін “перехресно зв’язаний” означає дисульфідні зв’язки, які існують між цистеїновими залишками. Наприклад, відповідним чином перехресно зв’язаний людський інсулін містить дисульфідний зв’язок між цистеїном у положенні 7 послідовності SEQ ID NO: 1 та цистеїном у положенні 7 послідовності SEQ ID NO: 2, між цистеїном у положенні 20 послідовності SEQ ID NO: 1 та цистеїном у положенні 19 послідовності SEQ ID NO: 2 та між цистеїном у положенні 6 послідовності SEQ ID NO: 1 і цистеїном у положенні 11 послідовності SEQ ID NO: 1. Подібним же чином, відповідним чином перехреснозв’язана сполука інсуліну лізпро містить дисульфідний зв’язок між цистеїном у положенні 7 послідовності SEQ ID NO: 1 та цистеїном у положенні 7 послідовності SEQ ID NO: 3, між цистеїном у положенні 20 послідовності SEQ ID NO: 1 та цистеїном у положенні 19 послідовності SEQ ID NO: 3 і між цистеїном у 3 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 положенні 6 послідовності SEQ ID NO: 1 та цистеїном у положенні 11 послідовності SEQ ID NO: 3. Словосполучення “PEG-кон’югований інсулін лізпро” або “пегільований інсулін лізпро”, вжите у цьому описі, означає людський інсулін лізпро або його похідну, який(яка) є ковалентно зв’язаним(-ою) із щонайменше одним PEG і має інсулінову активність in vivo. Біологічні активності інсуліну та інсуліну лізпро є добре визначеними. Словосполучення “інсулінова активність” стосовно пегільованої сполуки інсуліну лізпро за цим винаходом означає здатність до значного зниження рівнів глюкози у крові у щонайменше однієї загальноприйнятої in vivo тваринної моделі, у тому числі (але без обмеження) тваринних моделей діабету типу 1 і типу 2, опис яких наведений нижче у Прикладі 5 та Прикладі 6, відповідно. Таким чином, інсулінова активність означає здатність пегільованої сполуки інсуліну лізпро до зниження рівня глюкози у крові до рівня 100 мг/дл або нижче у пацюка, обробленого із застосуванням STZ (стрептозокотин), впродовж періоду часу від приблизно 4 год до щонайменше приблизно 36 год після одноразової підшкірної ін’єкції STZ у дозі 568 нмоль/кг. Термін “поліетиленгліколь” або “PEG” означає сполуку або похідну поліалкіленгліколю, зі сполучними речовинами або без них, або дериватизацію із сполучними або активуючими складовими. PEG, у своїй типовій формі, являє собою лінійний полімер з кінцевими гідроксильними групами і має формулу HO-CH2CH2-(CH2CH2O)n-CH2CH2-OH. Кількість повторюваних субодиниць “n” у PEG є наближеною до молекулярної маси, позначеної у дальтонах. Як правило, реагенти PEG, які застосовуються для одержання пегільованих сполук, містять гетерогенну суміш поліетиленгліколей, які мають різну кількість (n) етиленгліколевих субодиниць у полімері PEG. Одна етиленгліколева субодиниця (-(CH2CH2O)) PEG має молекулярну масу приблизно 44 Да. Таким чином, молекулярна маса полімеру PEG залежить від числа (n). Поліетиленгліколі, приєднані до пегільованих сполук інсуліну лізпро за цим винаходом, будуть мати (n) від приблизно 400 субодиниць до приблизно 1000 субодиниць. За варіантом, якому віддається перевага, поліетиленгліколі, приєднані до пегільованих сполук інсуліну лізпро за цим винаходом, будуть мати (n) від приблизно 400 субодиниць до приблизно 750 субодиниць. За варіантом, якому віддається більша перевага, поліетиленгліколі, приєднані до пегільованих сполук інсуліну лізпро за цим винаходом, будуть мати (n) від приблизно 400 субодиниць до приблизно 550 субодиниць. За варіантом, якому віддається найбільша перевага, поліетиленгліколі, приєднані до пегільованих сполук інсуліну лізпро за цим винаходом, будуть мати (n) від приблизно 400 субодиниць до приблизно 500 субодиниць. Численні похідні PEG та способи їх одержання і кон’югування з білком, таким як інсулін або інсулін лізпро, є відомими у цій галузі і прийнятними для застосування за цим винаходом. Дивись, наприклад, публікації міжнародних заявок WO 01/62827, WO 2006/028745, WO 2006/096535, WO 2006/036825; Zalipsky, S. Bioconjugate Chem. 6:150-165, 1995; Veronese, et al., Applied Biochem. and Biotech. 11:141-152, 1985; та Roberts, M. et al. Advanced Drug Delivery Reviews, 54:459-476, 2002. Одним з PEG, якому віддається особлива перевага для застосування за цим винаходом, є PEG, у якому один кінець полімеру закінчується відносно інертною групою, такою як нижча C1-6 алкоксильна група. За варіантом, якому віддається перевага, PEG являє собою монометоксиполіетиленгліколь (який традиційно позначається як mPEG), що є лінійною формою PEG, у якому один кінець полімеру є метоксильною (-OCH3) групою. За варіантом, якому віддається ще більша перевага, PEG, застосований у цьому винаході, являє собою “активований mPEG”, у якому один кінець лінійного PEG закінчується метоксильною групою, та другий кінець закінчується реакційноздатною групою, прийнятною для сполучення з бажаною ділянкою на інсуліні лізпро або на похідній інсуліну лізпро, дериватизованій для полегшення пегілування з бажаним активованим mPEG на конкретній ділянці молекули інсуліну лізпро. Оскільки поліетиленгліколі, як правило, одержують та застосовують у вигляді сумішей сполук поліетиленгліколю, які певною мірою різняться за своєю молекулярною масою, то фахівець у цій галузі, як правило, описує молекулярну масу PEG, приєднаного до сполуки, шляхом опису середнього розміру реактиву PEG, застосованого у реакції пегілування, у якій була створена конкретна пегільована сполука. Серед багатьох можливих способів повідомлення середніх значень традиційно застосовують три: середньочислові молекулярні маси, зважені середні значення молекулярних мас та z-середні молекулярні маси. Словосполучення “середня молекулярна маса”, вжите у цьому описі, означає середньозважене значення молекулярної маси, яке може бути визначене за допомогою добре відомих у цій галузі методів, у тому числі (але без обмеження) (мас-спектрометрії з іонізацією методом лазерної десорбції у матричному розчині з часопролітним аналізатором (MALDI-TOF), гель-проникної хроматографії або інших методів рідинної хроматографії, методів розсіювання світла, 4 UA 101195 C2 5 10 15 20 25 30 35 40 45 ультрацентрифугування та віскозиметрії. Формула для обчислення зваженого середнього 2 значення молекулярної маси може бути представлена як (Mi Ni)/(MiNi), де Ni – молярна частка (або числова частка) молекул з молекулярною масою M i у суміші. Згадана формула для обчислення середньочислової молекулярної маси може бути представлена як (MiNi)/(Ni), де Ni – молярна частка (або числова частка) молекул з молекулярною масою Mi у суміші. Відношення зваженого середнього значення молекулярної маси та середньочислової молекулярної маси є відомим як індекс полідисперсності (PDI), що надає приблизне вказання ширини розподілу. Реактиви PEG, прийнятні для одержання пегільованих сполук інсуліну лізпро за цим винаходом, є, як правило, полідисперсними (тобто середньочислова молекулярна маса та зважене середнє значення молекулярної маси полімерів не є однаковими). За варіантом, якому віддається перевага, PDI для реактивів PEG, які застосовують для одержання сполук або композицій за цим винаходом, є меншим ніж приблизно 1,1. За варіантом, якому віддається більша перевага, PDI для реактивів PEG, які застосовують для одержання сполук або композицій за цим винаходом, є меншим ніж приблизно 1,05. Стосовно пегільованих сполук інсуліну лізпро за цим винаходом PEG, ковалентно приєднаний до молекули інсуліну лізпро, має молекулярну масу від приблизно 17,5 кДа до приблизно 40 кДа (n від приблизно 400 до приблизно 1000), або PEG має середню молекулярну масу від приблизно 17,5 кДа до приблизно 40 кДа. За варіантом, якому віддається перевага, PEG, ковалентно приєднаний до молекули інсуліну лізпро, має молекулярну масу від приблизно 20 кДа до приблизно 30 кДа (n від приблизно 450 до приблизно 750), або PEG має середню молекулярну масу від приблизно 20 кДа до приблизно 30 кДа. За варіантом, якому віддається більша перевага, PEG, ковалентно приєднаний до молекули інсуліну лізпро, має молекулярну масу від приблизно 17,5 кДа до приблизно 25 кДа (n від приблизно 400 до приблизно 550), або PEG має середню молекулярну масу від приблизно 17,5 кДа до приблизно 25 кДа. За варіантом, якому віддається найбільша перевага, PEG, ковалентно приєднаний до молекули інсуліну лізпро, має молекулярну масу від приблизно 17,5 кДа до приблизно 20 кДа (n від приблизно 400 до приблизно 500), або PEG має середню молекулярну масу від приблизно 17,5 кДа до приблизно 20 кДа. У певних варіантах здійснення пегільовані сполуки інсуліну лізпро за цим винаходом одержують шляхом ковалентного приєднання активованого mPEG бажаної середньої молекулярної маси до інсуліну лізпро. Умови проведення реакції пегілування інсуліну лізпро будуть змінюватись у залежності від конкретного застосованого PEG, ділянки приєднання на інсуліні лізпро, конкретного типу реакційноздатної групи на інсуліні лізпро, що є мішенню для приєднання, бажаного ступеню пегілування тощо, і можуть бути легко визначені фахівцем у цій галузі. Оптимізовані експериментальні умови для конкретної стратегії пегілування можуть бути легко визначені, як правило, шляхом проведення стандартних досліджень фахівцем у цій галузі. У варіантах здійснення, яким віддається перевага, пегільовані сполуки інсуліну лізпро за цим винаходом одержують шляхом опосередкованого кон’югування активованого mPEG, який є відносно тіол-вибірковим, таким як mPEG-малеімід (mPEG-MAL) або mPEG-тіол (mPEG-SH), з інсуліном лізпро, шляхом кон’югування тіол-вибіркового активованого mPEG з тіоловою функціональною групою, яка була введена до інсуліну лізпро за допомогою модифікаторів “амін-тіол”, таких як N-сукцинімідил-S-ацетилтіопропіонат (SATP) та N-сукцинімідил-Sацетилтіоацетат (SATA). За варіантом, якому віддається більша перевага, активованим mPEG, застосованим для ковалентного приєднання PEG до тіолової (сульфгідрильної) групи на інсуліні лізпро, є mPEG-малеімід, такий як представлений нижче (a), (b) або (c). 5 UA 101195 C2 (a) (b) O O O O N N H n O O O N H n O O N O (c) O O O 5 10 15 20 25 30 O n N O H O H N O O n O H N O O N N H O Переважний спосіб одержання пегільованих сполук інсуліну лізпро за цим винаходом застосовує реакцію Міхаеля для одержання стабільного тіоефірного зв’язку. Згадана реакція є високоспецифічною і проходить при м’яких умовах у присутності інших функціональних груп. Наприклад, mPEG-малеімід є прийнятним як активований mPEG, для одержання кон’югатів пегільованого інсуліну лізпро за цим винаходом. За варіантом, якому віддається перевага, у процедурі пегілування застосовують мольний надлишок тіол-дериватизованого інсуліну лізпро, відносно mPEG-малеіміду, для доведення згаданої реакції до завершення. За варіантом, якому віддається перевага, згадані реакції здійснюють також при значенні рН 4,0-9,0 при кімнатній температурі впродовж 1-40 год. Надлишок непегільованого тіолвмісного пептиду легко відокремлюють від пегільованого продукту за допомогою традиційних методів відокремлення. Умови, взяті за приклад, які є необхідними для пегілування інсуліну лізпро із застосуванням активованого mPEG-малеіміду, описані у Прикладі 1. У певних варіантах здійснення пегільовані сполуки інсуліну лізпро за цим винаходом одержують шляхом кон’югування активованого mPEG, який є відносно специфічним до амінів. Активовані mPEG, придатні, головним чином, для аміноспецифічного пегілування інсуліну лізпро, включають mPEG-сукцинімідилпропіонат (mPEG-SPA), mPEG-сукцинімідилбутаноат (mPEG-SBA), mPEG-сукцинімідил--метилбутаноат (mPEG-SMB), mPEG-сукцинімідилкарбонат (mPEG-SC), mPEG-бензотриазолкарбонат та mPEG-p-нітрофенілкарбонат (mPEG-NPC). У варіантах здійснення цього винаходу, яким віддається перевага, результатом застосування активованих mPEG для пегілування інсуліну лізпро є одержання інсуліну лізпро, ковалентно зв’язаного з mPEG за допомогою гідролітично стабільного ковалентного зв’язку, такого як амідний, уретановий (відомий також як карбаматний), амінний, тіоефірний (відомий також як сульфідний) або сечовинний (відомого також як карбамідний) зв’язок. За варіантом, якому віддається більша перевага, активованим mPEG, що застосовується для пегілування інсуліну лізпро, є mPEG-SC або mPEG-NPC, наслідком застосування обох з яких є одержання інсуліну лізпро, ковалентно приєднаного до ПЕГ через уретановий (або карбаматний) зв’язок. Умови, взяті за приклад, які є прийнятними при пегілуванні інсуліну лізпро із застосуванням mPEG-NPC різної молекулярної маси, наведені у Прикладі 2. mPEG-SC: mPEG-NPC: O O O n O O O O N O O n O 35 O O O NO2 Пегільовані сполуки інсуліну лізпро за цим винаходом очищають, як правило, за допомогою одного або декількох способів очищення, таких як іонообмінна хроматографія, гель 6 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 хроматографія за розміром молекул, афінна хроматографія, гідрофобна хроматографія та/або зворотнофазова хроматографія. Загальна гетерогенність пегільованих сполук інсуліну лізпро (кількість і пропорція пегільованих сполук інсуліну лізпро, одержаних в результаті реакції пегілування) у зразку може бути оцінена за допомогою одного або декількох з наведених нижче методів: хроматографія, електрофорез, мас-спектрометрія, зокрема, MALDI-MS, та ЯМРспектроскопія. Інсулін лізпро, який застосовують для одержання пегільованих сполук інсуліну лізпро за цим винаходом, може бути одержаний за будь-яким з цілого ряду визнаних методів синтезу пептидів, у тому числі методів синтезу з рідкої фази, методів синтезу з твердої фази, напівсинтетичних методів та методів рекомбінантних ДНК. Наприклад, патент США № 5,700,662 (Chance, et al.) та європейський патент № 214 826 (Brange, et al.) розкривають одержання різних аналогів інсуліну. Ланцюги A та B інсуліну лізпро можуть також бути одержані з проінсуліноподібної молекули-попередника за допомогою методу рекомбінантних ДНК. У варіантах здійснення, яким віддається перевага, проінсуліноподібний попередник застосовують для одержання інсуліну лізпро, який застосовують для одержання пегільованого інсуліну лізпро за цим винаходом. Цей винахід пропонує сполуку Формули I: P-[(A)-(B)] або її фармацевтично прийнятну сіль, де: A – ланцюг A інсуліну лізпро (послідовність SEQ ID NO: 1); B – ланцюг B інсуліну лізпро (послідовність SEQ ID NO: 3); та P – PEG, який має молекулярну масу від приблизно 17,5 кДа до приблизно 40 кДа, і де A та B є відповідним чином перехреснозв’язаними, причому P є прямо або опосередковано приєднаним за допомогою ковалентного зв’язку до альфа-аміногрупи гліцину у положенні 1 ланцюга A, альфа-аміногрупи фенілаланіну у положенні 1 ланцюга B або епсилон-аміногрупи лізину у положенні 28 ланцюга B. До числа сполук за цим винаходом, яким віддається перевага, належать ті сполуки, у яких: (a) P є ковалентно приєднаним до інсуліну лізпро уретановим або тіоефірним зв’язком; та (b) особливістю згаданої сполуки є те, що вона має Ki до людського інсулінового рецептора на рівні приблизно 30 нМ, приблизно 20 нМ, приблизно 10 нМ або приблизно 5 нМ або менше, період напіввиведення з плазми більше ніж приблизно 6 год, приблизно 8 год, приблизно 10 год, приблизно 12 год або приблизно 14 год у пацюка, обробленого STZ, при введенні STZ у дозі приблизно 568 нмоль/кг, або активність зниження рівня глюкози у крові до рівня приблизно 100 мг/дл або нижче у пацюка, обробленого STZ, впродовж періоду часу, тривалість якого становить від приблизно 4 год до щонайменше приблизно 36 год, приблизно 48 год, приблизно 60 год, приблизно 72 год, приблизно 84 год, приблизно 96 год, приблизно 108 год або приблизно 120 год після одноразової підшкірної ін’єкції згаданої сполуки у дозі приблизно 568 нмоль/кг. До числа сполук, яким віддається ще більша перевага, належать ті сполуки, у яких: (a) P є ковалентно приєднаним до інсуліну лізпро уретановим зв’язком; (b) особливістю згаданої сполуки є те, що вона має Ki до людського інсулінового рецептора на рівні приблизно 10 нМ або менше; (с) особливістю згаданої сполуки є те, що вона має період напіввиведення з плазми більше ніж 6 год у пацюка, обробленого STZ, при введенні STZ у дозі приблизно 568 нмоль/кг; та (d) особливістю згаданої сполуки є те, що вона має активність зниження рівня глюкози у крові до рівня приблизно 100 мг/дл або нижче у пацюка, обробленого STZ, впродовж періоду часу, тривалість якого становить від приблизно 4 год до щонайменше приблизно 48 год, приблизно 60 год, приблизно 72 год, приблизно 84 год, приблизно 96 год, приблизно 108 год або приблизно 120 год після одноразової підшкірної ін’єкції згаданої сполуки у дозі приблизно 568 нмоль/кг. До числа сполук, яким віддається найбільша перевага, належать ті сполуки, у яких: (a) P є ковалентно приєднаним до інсуліну лізпро уретановим зв’язком; (b) особливістю згаданої сполуки є те, що вона має Ki до людського інсулінового рецептора на рівні приблизно 10 нМ або менше; (с) особливістю згаданої сполуки є те, що вона має період напіввиведення з плазми більше ніж 6 год у пацюка, обробленого STZ, при введенні STZ у дозі приблизно 568 нмоль/кг; (d) особливістю згаданої сполуки є те, що вона має активність зниження рівня глюкози у крові до рівня приблизно 100 мг/дл або нижче у пацюка, обробленого STZ, впродовж періоду часу, тривалість якого становить від приблизно 4 год до щонайменше приблизно 48 год, приблизно 60 год, приблизно 72 год, приблизно 84 год, приблизно 96 год, приблизно 108 год або приблизно 120 год після одноразової підшкірної ін’єкції згаданої сполуки у дозі приблизно 568 нмоль/кг, та (е) особливістю згаданої сполуки є те, що вона має період напіввиведення з плазми більше ніж приблизно 24 год, приблизно 30 год, приблизно 32 год, приблизно 34 год, приблизно 36 год, 38 год, приблизно 40 год або приблизно 42 год при введенні людині згаданої сполуки парентеральним шляхом однією дозою, яка дорівнює 0,225 мг/кг. 7 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до особливостей та принципів цього винаходу, варіант здійснення цього винаходу пропонує монопегільовану сполуку інсуліну лізпро, яка містить PEG, який має середню молекулярну масу приблизно 17,5 кДа, приблизно 20 кДа, приблизно 25 кДа, приблизно 30 кДа або приблизно 40 кДа, прямо або опосередковано ковалентно зв’язаний з альфа-аміногрупою гліцину у положенні 1 ланцюга A інсуліну лізпро (PEG-GlyA1 інсулін лізпро), альфа-аміногрупою фенілаланіну у положенні 1 ланцюга B інсуліну лізпро (PEG-PheB1 інсулін лізпро) або епсилон-аміногрупою лізину у положенні 28 ланцюга B інсуліну лізпро (PEG-LysB28 інсулін лізпро). За варіантом, якому віддається перевага, монопегільована сполука інсуліну лізпро містить PEG, який має середню молекулярну масу приблизно 17,5 кДа, приблизно 20 кДа, приблизно 25 кДа, приблизно 30 кДа або приблизно 40 кДа, прямо або опосередковано зв’язаний з альфа-аміногрупою фенілаланіну у положенні 1 ланцюга B інсуліну лізпро або епсилон-аміногрупою лізину у положенні 28 ланцюга B інсуліну лізпро. За варіантом, якому віддається більша перевага, монопегільований інсулін лізпро містить PEG, який має середню молекулярну масу приблизно 17,5 кДа, приблизно 20 кДа, приблизно 25 кДа, приблизно 30 кДа або приблизно 40 кДа, зв’язаний з епсилон-аміногрупою лізину у положенні 28 ланцюга B інсуліну лізпро. За варіантом, якому віддається ще більша перевага, монопегільований інсулін лізпро містить PEG, який має середню молекулярну масу приблизно 17,5 кДа або приблизно 20 кДа, зв’язаний з епсилон-аміногрупою лізину у положенні 28 ланцюга B інсуліну лізпро (20 кДа-PEG-LysB28 інсулін лізпро). За варіантом, якому віддається найбільша перевага, монопегільований інсулін лізпро містить PEG, який має середню молекулярну масу приблизно 20 кДа, зв’язаний з епсилон-аміногрупою лізину у положенні 28 ланцюга B інсуліну лізпро (тобто PEG20 кДа-LysB28 інсулін лізпро). Інші приклади здійснення цього винаходу пропонують монопегільовану сполуку інсуліну лізпро, яка містить PEG, який має молекулярну масу приблизно 17,5 кДа, приблизно 20 кДа, приблизно 25 кДа, приблизно 30 кДа або приблизно 40 кДа, прямо або опосередковано ковалентно зв’язаний з альфа-аміногрупою гліцину у положенні 1 ланцюга A інсуліну лізпро, альфа-аміногрупою фенілаланіну у положенні 1 ланцюга B інсуліну лізпро або епсилонаміногрупою лізину у положенні 28 ланцюга B інсуліну лізпро. За варіантом, якому віддається перевага, монопегільована сполука інсуліну лізпро містить PEG, який має молекулярну масу приблизно 17,5 кДа, приблизно 20 кДа, приблизно 25 кДа, приблизно 30 кДа або приблизно 40 кДа, прямо або опосередковано зв’язаний з альфа-аміногрупою фенілаланіну у положенні 1 ланцюга B інсуліну лізпро або епсилон-аміногрупою лізину у положенні 28 ланцюга B інсуліну лізпро. За варіантом, якому віддається більша перевага, монопегільований інсулін лізпро містить PEG, який має молекулярну масу приблизно 17,5 кДа, приблизно 20 кДа, приблизно 30 кДа або приблизно 40 кДа, зв’язаний з епсилон-аміногрупою лізину у положенні 28 ланцюга B інсуліну лізпро. За варіантом, якому віддається найбільша перевага, монопегільований інсулін лізпро містить PEG, який має молекулярну масу приблизно 20 кДа, зв’язаний з епсилонаміногрупою лізину у положенні 28 ланцюга B інсуліну лізпро, і особливістю згаданого PEGLysB28-інсуліну лізпро є те, що він має період напіввиведення з плазми більше ніж приблизно 24 год, приблизно 30 год, приблизно 32 год, приблизно 34 год, приблизно 36 год, приблизно 38 год, приблизно 40 год або приблизно 42 год при введенні людині композиції підшкірним шляхом однією дозою, яка становить 0,225 мг/кг. У іншому варіанті здійснення цей винахід пропонує композиції, які містять суміш пегільованих сполук інсуліну лізпро, де приєднання PEG відбувається у різних місцях, та/або суміш монопегільованих, дипегільованих та трипегільованих сполук інсуліну лізпро. Прикладами композицій за цим винаходом є композиції, які містять більше однієї пегільованої сполуки інсуліну лізпро, вибраної з групи, до складу якої входить: i) PEG-GlyA1 інсулін лізпро, ii) PEGPheB1 інсулін лізпро, iii) PEG-LysB28 інсулін лізпро, iv) ди-PEG-GlyA1PheB1-інсулін лізпро, v) диPEG-GlyA1LysB28-інсулін лізпро, vi) ди-PEG-PheB1LysB28-інсулін лізпро та vii) ди-PEGGlyA1PheB1-інсулін лізпро. За варіантом, якому віддається більша перевага, композиції за цим винаходом містять суміш пегільованих сполук інсуліну лізпро, де більше ніж приблизно 80%, приблизно 85%, приблизно 90%, приблизно 95% або приблизно 97% згаданих пегільованих сполук інсуліну лізпро складають монопегільовані сполуки інсуліну лізпро Формули I. За варіантом, якому віддається ще більша перевага, композиції за цим винаходом містять суміш пегільованих сполук інсуліну лізпро, де більше ніж приблизно 80%, приблизно 85%, приблизно 90%, приблизно 95% або приблизно 97% згаданих пегільованих сполук інсуліну лізпро складають монопегільовані сполуки інсуліну лізпро, і менше ніж приблизно 20%, приблизно 15%, приблизно 10%, приблизно 5% або приблизно 3% від загального об’єму пегільованих сполук інсуліну лізпро складають дипегільовані сполуки інсуліну лізпро. За варіантом, якому віддається ще більша перевага, композиції за цим винаходом містять суміш пегільованих 8 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполук інсуліну лізпро, де більше ніж приблизно 80%, приблизно 85%, приблизно 90%, приблизно 95% або приблизно 97% згаданих пегільованих сполук інсуліну лізпро складає PEGLysB28-інсулін лізпро. За варіантом, якому віддається ще більша перевага, композиції за цим винаходом містять суміш пегільованих сполук інсуліну лізпро, де більше ніж приблизно 80%, приблизно 85%, приблизно 90%, приблизно 95% або приблизно 97% згаданих пегільованих сполук інсуліну лізпро складають PEG-LysB28-інсулін лізпро, і менше ніж приблизно 20%, приблизно 15%, приблизно 10%, приблизно 5% або приблизно 3% від загального об’єму пегільованих сполук інсуліну лізпро складають PEG-GlyA1-інсулін лізпро. За варіантом, якому віддається ще більша перевага, композиції за цим винаходом містять суміш пегільованих сполук інсуліну лізпро, де більше ніж приблизно 80%, приблизно 85%, приблизно 90%, приблизно 95% або приблизно 97% згаданих пегільованих сполук інсуліну лізпро складають PEG-LysB28-інсулін лізпро, менше ніж приблизно 20%, приблизно 15%, приблизно 10%, приблизно 5% або приблизно 3% від загального об’єму пегільованих сполук інсуліну лізпро складає PEG-GlyA1-інсулін лізпро, і менше ніж приблизно 10%, приблизно 5% або приблизно 3% від загального об’єму пегільованих сполук інсуліну лізпро складають дипегільовані сполуки інсуліну лізпро. За варіантом, якому віддається ще більша перевага, композиції за цим винаходом містять суміш пегільованих сполук інсуліну лізпро, де приблизно 80% від загального об’єму згаданих пегільованих сполук інсуліну лізпро складає PEG-LysB28-інсулін лізпро, приблизно 10% складає PEG-GlyA1-інсулін лізпро, і приблизно 10% складає ди-PEGGlyA1LysB28-інсулін лізпро. За варіантом, якому віддається ще більша перевага, композиції за цим винаходом містять суміш пегільованих сполук інсуліну лізпро, де приблизно 90% або більше від загального об’єму згаданих пегільованих сполук інсуліну лізпро складає PEG-LysB28інсулін лізпро, приблизно 5% або менше складає PEG-GlyA1-інсулін лізпро, і приблизно 5% або менше складає ди-PEG-GlyA1LysB28-інсулін лізпро. За варіантом, якому віддається ще більша перевага, композиції за цим винаходом містять суміш пегільованих сполук інсуліну лізпро, де приблизно 90% або більше від загального об’єму згаданих пегільованих сполук інсуліну лізпро складає PEG-LysB28-інсулін лізпро, приблизно 5% або менше складає PEG-GlyA1-інсулін лізпро, приблизно 5% або менше складає ди-PEG-GlyA1LysB28-інсулін лізпро, і де особливістю згаданого PEG-LysB28-інсуліну лізпро є те, що він має період напіввиведення плазми більше ніж приблизно 24 год, приблизно 30 год, приблизно 32 год, приблизно 34 год, приблизно 36 год, приблизно 38 год, приблизно 40 год або приблизно 42 год при введенні людині композиції підшкірним шляхом однією дозою, яка дорівнює 0,225 мг/кг. За варіантом, якому віддається найбільша перевага, композиції за цим винаходом містять суміш пегільованих сполук інсуліну лізпро, де приблизно 95% або більше від загального об’єму згаданих пегільованих сполук інсуліну лізпро складає PEG-LysB28-інсулін лізпро, приблизно 5% або менше складає PEGGlyA1-інсулін лізпро, і де особливістю згаданого PEG-LysB28-інсуліну лізпро є те, що він має період напіввиведення з плазми більше ніж приблизно 24 год, приблизно 30 год, приблизно 32 год, приблизно 34 год, приблизно 36 год, приблизно 38 год, приблизно 40 год або приблизно 42 год при введенні людині композиції підшкірним шляхом однією дозою, яка дорівнює 0,225 мг/кг. Термін “основні умови”, вжитий у цьому описі, означає основність реакції пегілування. Для забезпечення більш вибіркового пегілування інсуліну лізпро на лізині у положенні 28 ланцюга В інсуліну лізпро згадана реакція повинна проходити з по суті депротонованими альфааміногрупами інсуліну лізпро. У водному розчиннику або співрозчиннику основні умови означають, що реакція проходить при значенні рН, яке перевищує 7,0. За варіантом, якому віддається перевага, реакція пегілування проходить при значенні рН від приблизно рН 8,5 до приблизно рН 11,5. У органічному розчиннику згадана реакція проходить у присутності основи з основністю, яка відповідає значенню pKa, яке перевищує або дорівнює 10,75 у воді. Цей винахід також охоплює спосіб одержання пегільованої сполуки інсуліну лізпро формули: P-[(A)-(B)] або її фармацевтично прийнятної солі, де: A – ланцюг A інсуліну лізпро (послідовність SEQ ID NO: 1); B – ланцюг B інсуліну лізпро (послідовність SEQ ID NO: 3); та P – PEG, який має молекулярну масу від приблизно 20 кДа до приблизно 40 кДа, і де A та B є відповідним чином перехреснозв’язаними, та P є приєднаним за допомогою уретанового ковалентного зв’язку до епсилон-аміногрупи лізину у положенні 28 ланцюга B, що включає реакцію епсилон-аміногрупи лізину у положенні 28 ланцюга B з монометоксиполіетиленглікольp-нітрофенілкарбонатом (mPEG-NPC), який має зважене середнє значення молекулярної маси від приблизно 20 кДа до приблизно 40 кДа у водному розчиннику при значенні рН від приблизно рН 8,5 до приблизно рН 11,5 та при температурі реакції від приблизно 25C до приблизно 30C. За варіантом, якому віддається перевага, значення рН реакції підтримують від приблизно 9 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 рН 10,5 до приблизно рН 11,1, реакцію пегілування проводять при температурі від приблизно 25C до приблизно 30C впродовж періоду часу від приблизно 2 год до приблизно 12 год, і співвідношення mPEG-NPC та інсуліну лізпро знаходиться у межах від приблизно 1,0 до приблизно 5,0. За варіантом, якому віддається більша перевага, зважене середнє значення молекулярної маси mPEG-NPC становить приблизно 20 кДа, значення рН реакції підтримують у межах від приблизно рН 10,5 до приблизно рН 11,1, реакцію пегілування проводять при температурі від приблизно 25C до приблизно 30C впродовж періоду часу від приблизно 2 год до приблизно 12 год, і співвідношення mPEG-NPC та інсуліну лізпро знаходиться у межах від приблизно рН 1,0 до приблизно рН 5,0. За варіантом, якому віддається ще більша перевага, молярне відношення PEG:інсуліну лізпро знаходиться у межах від приблизно 2,5 до приблизно 4,5, зважене середнє значення молекулярної маси mPEG-NPC становить приблизно 20 кДа, значення рН реакції пегілування підтримують у межах від приблизно рН 10,5 до приблизно рН 11,1, температуру реакції пегілування підтримують у межах від приблизно 25C до приблизно 30C впродовж періоду часу від приблизно 3 год до приблизно 6 год. За варіантом, якому віддається найбільша перевага, молярне відношення PEG:інсуліну лізпро знаходиться у межах від приблизно 2,6 до приблизно 4,5, зважене середнє значення молекулярної маси mPEG-NPC становить приблизно 20 кДа, значення рН реакції пегілування підтримують у межах від приблизно рН 10,5 до приблизно рН 11,0, і температуру реакції підтримують у межах від приблизно 25C до приблизно 30C впродовж приблизно 3 год. При необхідності пегільовані сполуки інсуліну лізпро за цим винаходом, які мають різні молекулярні маси, можуть виділятись за допомогою різних методів, відомих фахівцю у цій галузі, у тому числі (але без обмеження) гель-фільтраційної хроматографії та/або іонообмінної хроматографії. Тобто гель-фільтраційна хроматографія може застосовуватись для фракціонування монопегільованих, дипегільованих та трипегільованих сполук інсуліну лізпро на основі їх різної молекулярної маси (де різниця відповідає по суті середній молекулярній масі PEG, який застосовують при проведенні реакції пегілування). Наприклад, у реакції, взятій за приклад, де інсулін лізпро кон’югується з активованим mPEG, який має середню молекулярну масу приблизно 20 кДа, кінцева реакційна суміш може містити немодифікований інсулін лізпро, який має молекулярну масу приблизно 5808 Да, монопегільований інсулін лізпро, який має середню молекулярну масу приблизно 25808 Да, дипегільований інсулін лізпро, який має середню молекулярну масу приблизно 45808 Да, та трипегільований інсулін лізпро, який має середню молекулярну масу приблизно 65808 Да. Однак оскільки методом гель-фільтрації відокремлюють сполуки на основі гідродинамічного розміру, то монопегільований інсулін лізпро, кон’югований з mPEG, який має середню молекулярну масу приблизно 20 кДа, буде мігрувати під час гель-фільтрації як білок масою приблизно 82 кДа, незважаючи на те, що він має середню молекулярну масу приблизно 25808 Да. Фахівець у цій галузі може сподіватись на те, що ди- та трипегільовані різновиди, пегільовані з mPEG, який має середню молекулярну масу приблизно 20 кДа, будуть мати дуже різний час міграції або утримування, що надає можливість їх очищення та/або кількісного визначення. Словосполучення “plasma half-life” означає час, необхідний для половинного зниження рівня концентрації лікарського засобу у плазмі. Альтернативно застосовуваним є словосполучення “період напіввиведення”, яке відповідає кінцевій логарифмічно-лінійній швидкості виведення. Фахівцям у цій галузі зрозуміло, що період напіввиведення є похідним параметром, який змінюється як функція кліренсу та об’єму розподілу. Терміни “подовжений”, “довший” або “підвищений”, які застосовуються у контексті періоду напіввиведення з плазми або періоду напіввиведення, вжиті у цьому описі взаємозамінно і означають існування статистично значущого підвищення періоду напіввиведення експериментальної сполуки (наприклад, пегільованого інсуліну лізпро), порівняно з періодом напіввиведення еталонної молекули (наприклад, інсуліну лізпро), як визначено при порівнянних умовах. Кліренс є критерієм здатності організму до видалення лікарського засобу. При зниженні кліренсу внаслідок, наприклад, модифікацій лікарського засобу, слід очікувати підвищення періоду напіввиведення. Однак цей взаємозв’язок точно витримується лише при відсутності зміни об’єму розподілу. Прийнятний приблизний взаємозв’язок між кінцевим логарифмічнолінійним періодом напіввиведення (t1/2), кліренсом (CL) та об’ємом розподілу (V) надається рівнянням: t1/2 0,693 (V/CL). Кліренс не вказує на те, яка кількість лікарського засобу видаляється, а скоріше вказує на те, який об’єм біологічної рідини, такої як кров або плазма, повинен бути повністю звільненим від лікарського засобу для забезпечення виведення. Кліренс виражається у об’ємі за одиницю часу. Термін “лікування”, вжитий у цьому описі, означає медичне лікування та догляд за пацієнтом, який має діабет або гіперглікемію чи інший стан, при якому введення інсуліну є 10 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 показаним для подолання або полегшення тяжкості симптомів та ускладнень згаданих станів. Лікування включає введення сполук або композицій за цим винаходом для запобігання появі симптомів або ускладнень, полегшення тяжкості симптомів або ускладнень або ліквідації захворювання, стану або розладу. Пацієнт, який підлягає лікуванню, є ссавцем, за варіантом, якому віддається перевага, людиною. Пегільовані сполуки інсуліну лізпро Формули I є ефективними при лікуванні гіперглікемії при введенні пацієнту, який потребує цього, терапевтично ефективної кількості однієї або декількох сполук Формули I. Словосполучення “терапевтично ефективна кількість”, вжите у цьому описі, означає кількість пегільованої сполуки інсуліну лізпро Формули I або композицій на її основі, достатню для регулювання рівня глюкози у крові пацієнта. За варіантом, якому віддається перевага, терапевтично ефективна кількість пегільованого інсуліну лізпро Формули I становить від приблизно 0,01 нмоль/кг до приблизно 100 нмоль/кг. За варіантом, якому віддається більша перевага, терапевтично ефективна кількість становить від приблизно 0,01 нмоль/кг до приблизно 50 нмоль/кг. За варіантом, якому віддається ще більша перевага, терапевтично ефективна кількість становить від приблизно 0,01 нмоль/кг до приблизно 20 нмоль/кг. За варіантом, якому віддається ще більша перевага, терапевтично ефективна кількість становить від приблизно 0,01 нмоль/кг до приблизно 10 нмоль/кг. За варіантом, якому віддається ще більша перевага, терапевтично ефективна кількість становить від приблизно 0,1 нмоль/кг до приблизно 7,5 нмоль/кг. За варіантом, якому віддається ще більша перевага, терапевтично ефективна кількість становить від приблизно 0,1 нмоль/кг до приблизно 5 нмоль/кг. За варіантом, якому віддається найбільша перевага, терапевтично ефективна кількість становить від приблизно 0,5 нмоль/кг до приблизно 5 нмоль/кг. Однак слід розуміти, що фактично введена кількість пегільованої сполуки інсуліну лізпро або композиції, яка містить одну або декілька пегільованих сполук інсуліну лізпро, буде визначена лікарем, виходячи з відповідних обставин, у тому числі стану, який піддають лікуванню (тобто причина гіперглікемії), конкретного різновиду пегільованого інсуліну лізпро або конкретної суміші пегільованих сполук інсуліну лізпро, призначених для введення, інших лікарських засобів, інсулінів тощо, призначених для одночасного введення, вибраного парентерального шляху введення, віку, маси та реакції окремого пацієнта та тяжкості симптомів пацієнта. Таким чином, вищенаведені діапазони доз не призначені для жодного обмеження обсягу цього винаходу. Словосполучення “достатня для регулювання рівня глюкози у крові” означає, що результатом введення сполуки або композиції пацієнту є нормальний рівень глюкози у плазмі натщесерце. Клінічно нормальний рівень глюкози у плазмі крові натщесерце дорівнює 70110 мг/дл. Клінічно нормальний постпрандіальний рівень глюкози у плазмі крові є меншим ніж 140 мг/дл. Відомо, що у структурі інсуліну при зберіганні відбуваються ковалентні хімічні зміни. Це може привести до утворення молекул, які є менш активними і потенційно імуногенними, такі як продукти деамідування та високомолекулярних продуктів перетворення (наприклад, димерів, олігомерів, полімерів). Результати всебічного дослідження хімічної стабільності інсуліну наведені у роботі Jens Brange "Stability of Insulin", Kluwer Academic Publishers, 1994. Строк придатності інсулінових продуктів скорочується головним чином внаслідок утворення через певний час розчинних агрегатів (димерів, олігомерів та полімерів), незважаючи на те, що інсулінові композиції, як правило, зберігаються при низькій температурі, яка не перевищує приблизно 2-8C, що значно поліпшує строк придатності, порівняно із зберіганням, наприклад, при кімнатній температурі. Крім того, інсулінові продукти зазнають утворення нерозчинних агрегатів (фібрил), які є наслідком струшування, наприклад, при перенесенні їх у кишені пацієнта або під час транспортування. Невід’ємною умовою забезпечення якості інсулінового продукту є зменшення до абсолютного мінімуму схильності до утворення таких розчинних та нерозчинних агрегатів, що є результатом хімічних або фізичних впливів. Таким чином, інсулінові композиції для того, щоб знайти терапевтичне застосування, повинні демонструвати прийнятні властивості хімічної та фізичної стабільності. Термін “стабільність”, вжитий у цьому описі, означає фізичну та/або хімічну стабільність лікарських форм пегільованих сполук інсуліну лізпро. Фізична нестабільність пегільованої лікарської форми інсуліну лізпро може бути спричинена агрегуванням білкових молекул з утворенням полімерів вищого порядку або навіть осадів. “Стабільною” лікарською формою є лікарська форма, де ступінь агрегування білків є прийнятно контрольованим і не підвищує ступеню неприйнятності з перебігом часу. У певних варіантах здійснення цього винаходу пегільована лікарська форма інсуліну лізпро вважається стабільною впродовж певного періоду часу, якщо ступінь агрегування знаходиться у межах приблизно 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20%, 25% або 30% від ступеню агрегування, який спостерігався у вихідного матеріалу. У певних 11 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантах здійснення цього винаходу пегільована лікарська форма інсуліну лізпро вважається стабільною впродовж певного періоду часу, якщо біологічна активність поліпептиду становить щонайменше приблизно 99%, 95%, 90%, 85%, 80%, 75%, 70%, 65%, 60%, 55% або 50% від активності, яка спостерігалась у вихідного матеріалу. Термін “хімічна стабільність”, вжитий у цьому описі, означає схильність пегільованої композиції інсуліну лізпро до утворення розчинних білкових агрегатів під час зберігання при статичних умовах, у тому числі під час зберігання при низьких температурах на рівні приблизно 2-8C або підвищених температурах на рівні 20-40C. Хімічна стабільність пегільованої сполуки інсуліну лізпро за цим винаходом може бути встановлена шляхом визначення аналітичних властивостей лікарської форми при специфічних умовах, наприклад, при конкретній температурі та умовах вологості впродовж певного періоду часу. Аналітичні властивості, які можуть бути визначені, включають утворення високомолекулярних різновидів, за допомогою, наприклад, високоефективної гель-хроматографії за розміром молекул. Потім результати можуть контролюватись і порівнюватись з заздалегідь визначеними параметрами. Термін “фізична стабільність”, вжитий у цьому описі, означає схильність пегільованої композиції інсуліну лізпро до утворення нерозчинних білкових агрегатів унаслідок фізичної дії, такої як струшування пегільованої композиції інсуліну лізпро. Фізична стабільність пегільованих сполук інсуліну лізпро за цим винаходом під час зберігання впродовж визначеного періоду часу при різних температурах у різних фармацевтичних лікарських формах може бути визначена за допомогою методів, добре відомих у цій галузі, у тому числі шляхом визначення уявного ослаблення світла зразком (спектральної поглинальної здатності, або оптичної густини). Таке визначення ослаблення світла пов’язується з каламутністю лікарської форми. Каламутність обумовлюється агрегуванням або осадженням білків або комплексів у лікарській формі. У цій галузі є добре відомими інші методи визначення фізичної стабільності, у тому числі візуальне визначення наявності або відсутності частинок або виявлення утворення фібрил/гелю засобами флуоресцентної мікроскопії у присутності тіофлавіну Т. Інші варіанти здійснення цього винаходу пропонують фармацевтичні композиції, прийнятні для введення пацієнту, зокрема, людині, які містять терапевтично ефективну кількість щонайменше однієї пегільованої сполуки інсуліну лізпро Формули I та один або декілька фармацевтично прийнятних наповнювачів, розріджувачів, буферів, іонів металу або носіїв. Такі фармацевтичні композиції є, як правило, хоча і не обов’язково, парентеральними за своєю природою, і їх можна одержати за будь-яким з цілого ряду різних методів із застосуванням традиційних наповнювачів, буферів, розріджувачів, іонів металу або носіїв для парентеральних продуктів, які є добре відомими у цій галузі. Оскільки пегільовані сполуки інсуліну лізпро за цим винаходом є дуже водорозчинними, то фармацевтична композиція за цим винаходом являє собою композицію, яка містить воду як основний розчинник, пегільовані сполуки інсуліну лізпро із загальною концентрацією щонайменше 1 мг/мл, щонайменше 2 мг/мл, щонайменше 5 мг/мл, щонайменше 10 мг/мл, щонайменше 15 мг/мл, щонайменше 20 мг/мл, щонайменше 25 мг/мл, щонайменше 30 мг/мл, щонайменше 35 мг/мл, щонайменше 40 мг/мл, щонайменше 45 мг/мл, щонайменше 50 мг/мл або більше та фармацевтично прийнятний буфер, причому згадана фармацевтична композиція має рН від приблизно рН 4,0 до приблизно рН 8,5. За варіантом, якому віддається перевага, фармацевтична композиція за цим винаходом має рН від приблизно рН 6,0 до приблизно рН 8,5. За варіантом, якому віддається більша перевага, фармацевтична композиція за цим винаходом містить пегільовані сполуки інсуліну лізпро із загальною концентрацією від приблизно 2,5 мг/мл до приблизно 60 мг/мл та буфер, причому згадана композиція має рН від приблизно рН 6,0 до приблизно рН 8,5. За варіантом, якому віддається більша перевага, фармацевтична композиція за цим винаходом містить пегільовані сполуки інсуліну лізпро з концентрацією від приблизно 5 мг/мл до приблизно 50 мг/мл та буфер, де згадана фармацевтична композиція має рН від приблизно рН 6,5 до приблизно рН 7,5. За варіантом, якому віддається ще більша перевага, фармацевтична композиція за цим винаходом містить пегільовані сполуки інсуліну лізпро з концентрацією від приблизно 10 мг/мл до приблизно 40 мг/мл та буфер, де згадана фармацевтична композиція має рН від приблизно рН 6,5 до приблизно рН 7,5. За варіантом, якому віддається ще більша перевага, фармацевтична композиція за цим винаходом містить пегільовані сполуки інсуліну лізпро з концентрацією від приблизно 15 мг/мл до приблизно 40 мг/мл та буфер, причому згадана фармацевтична композиція має рН від приблизно рН 7,0 до приблизно рН 7,5 або від приблизно рН 7,0 до приблизно рН 8,0. За варіантом, якому віддається ще більша перевага, фармацевтична композиція за цим винаходом також містить терапевтично ефективну кількість інсуліну. За варіантом, якому віддається ще більша перевага, згаданим інсуліном є аналог інсуліну. За 12 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантом, якому віддається ще більша перевага, згаданим аналогом інсуліну є швидкодіючий аналог інсуліну. За варіантом, якому віддається найбільша перевага, згаданим швидкодіючим аналогом інсуліну є інсулін лізпро. Термін “буфер” означає розчин, який опирається змінам значення рН внаслідок дії своїх кислотно-основних кон’югатних компонентів. За варіантом, якому віддається перевага, застосовуваними буферами є фармацевтично прийнятні буфери. Словосполучення “фармацевтично прийнятний буфер” означає розчин, який є безпечним для застосування у лікарських формах інсуліну і який може контролювати значення рН фармацевтичної композиції на бажаному рівні. У варіантах здійснення, яким віддається перевага, згаданий буфер має значення рН від приблизно рН 6,0 до приблизно рН 8,5. За варіантом, якому віддається більша перевага, згаданий буфер має значення рН від приблизно рН 7,0 до приблизно рН 8,0. Фармацевтично прийнятні буфери для контролювання значення рН композицій за цим винаходом у цьому діапазоні включають, але ними не обмежуються, такі засоби, як фосфатний, ацетатний, цитратний, аргініновий, трис- та гістидиновий буфери, а також їх комбінації. “Трисбуфер” означає 2-аміно-2-гідроксиметил-1,3-пропандіол та будь-яку його фармацевтично прийнятну сіль. Двома поширеними формами трис-буферу є буфер у формі вільної основи та буфер у поєднанні з розчином хлористоводневої кислоти (тобто трис-HCl). Трис-буфер також є відомим у цій галузі як триметилоламінометан, трометамін та трис(гідроксиметил)амінометан. За варіантом, якому віддається перевага, фармацевтична композиція за цим винаходом містить від приблизно 2,5 мМ до приблизно 50 мМ фосфатного буферу або трис-буферу. За варіантом, якому віддається більша перевага, фармацевтична композиція за цим винаходом містить від приблизно 5 мМ до приблизно 20 мМ фосфатного буферу або трис-буферу. За варіантом, якому віддається ще більша перевага, фармацевтична композиція за цим винаходом містить від приблизно 5 мМ до приблизно 10 мМ фосфатного буферу. За варіантом, якому віддається ще більша перевага, фармацевтична композиція за цим винаходом містить приблизно 5 мМ фосфатного буферу. За варіантом, якому віддається ще більша перевага, фармацевтична композиція за цим винаходом містить від приблизно 7,5 мМ до приблизно 50 мМ трис-буферу. За варіантом, якому віддається ще більша перевага, фармацевтична композиція за цим винаходом містить від приблизно 10 мМ до приблизно 25 мМ трис-буферу. За варіантом, якому віддається ще більша перевага, фармацевтична композиція за цим винаходом містить від приблизно 15 мМ до приблизно 20 мМ трис-буферу. За варіантом, якому віддається найбільша перевага, фармацевтична композиція за цим винаходом містить приблизно 16 мМ трис-буферу. Пегільовані сполуки та композиції інсуліну лізпро за цим винаходом можуть бути виготовлені аналогічно відомим лікарським формам інсулінів, що вводяться пацієнтам парентеральним шляхом. Такі лікарські форми відомі фахівцю у цій галузі. За варіантом, якому віддається перевага, пегільовані сполуки інсуліну лізпро Формули I виготовляють аналогічно лікарській ® ® формі інсуліну лізпро HUMALOG або Humulin . Таким чином, фармацевтична композиція за цим винаходом, якій віддається перевага, може містити воду, пегільовану сполуку інсуліну лізпро Формули I, засіб для регулювання ізотонічності та фармацевтично прийнятний буфер. За варіантом, якому віддається перевага, фармацевтична композиція за цим винаходом також містить фармацевтично прийнятний консервант. За варіантом, якому віддається більша перевага, фармацевтична композиція за цим винаходом також містить двовалентний катіон, такий як цинк та/або кобальт, який може полегшити гексамеризацію інсуліну. За варіантом, якому віддається ще більша перевага, фармацевтична композиція за цим винаходом також містить щонайменше один гексамер-стабілізувальний засіб. Крім того, хлористоводнева кислота та/або гідроксид натрію можуть додаватись для регулювання значення рН. “Засіб для регулювання ізотонічності” являє собою сполуку, яка є фізіологічно переносною та наділяє лікарську форму прийнятним рівнем ізотонічності для запобігання результуючому потокові води через клітинні мембрани, які контактують з введеною фармацевтичною композицією. У ролі засобу для регулювання ізотонічності традиційно застосовують гліцерол, відомий також як гліцерин. Інші засоби для регулювання ізотонічності включають i) інші цукрові спирти, такі як (але без обмеження) маніт та сорбіт, ii) солі, такі як (але без обмеження) NaCl, iii) моносахариди, у тому числі (але без обмеження) декстроза, та iv) дисахариди, у тому числі (але без обмеження) лактоза, цукроза та трегалоза. Фармацевтичні композиції за цим винаходом можуть включати один або декілька засобів для регулювання ізотонічності. За варіантом, якому віддається перевага, фармацевтичні лікарські форми за цим винаходом містять один або декілька засобів для регулювання ізотонічності, які забезпечують одержання лікарської форми з рівнем ізотонічності, який знаходиться у межах від приблизно 270 мОсм до приблизно 330 мОсм. За варіантом, якому віддається більша перевага, засобом(-ами) для регулювання ізотонічності є гліцерин, сорбіт, цукроза, NaCl, трегалоза та/або маніт. За 13 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантом, якому віддається ще більша перевага, засобом для регулювання ізотонічності є гліцерин, сорбіт, цукроза, NaCl та/або трегалоза. За варіантом, якому віддається ще більша перевага, фармацевтичні композиції за цим винаходом містять гліцерин, сорбіт, цукрозу, NaCl або трегалозу у концентрації від приблизно 100 мМ до приблизно 200 мМ. За варіантом, якому віддається ще більша перевага, фармацевтичні композиції за цим винаходом містять гліцерин у концентрації від приблизно 100 мМ до приблизно 200 мМ. За варіантом, якому віддається ще більша перевага, фармацевтичні композиції за цим винаходом містять гліцерин у концентрації від приблизно 150 мМ до приблизно 180 мМ. За варіантом, якому віддається ще більша перевага, фармацевтичні композиції за цим винаходом містять гліцерин у концентрації від приблизно 130 мМ до приблизно 175 мМ. За варіантом, якому віддається ще більша перевага, фармацевтичні композиції за цим винаходом містять NaCl у концентрації від приблизно 50 мМ до приблизно 300 мМ. За варіантом, якому віддається ще більша перевага, фармацевтичні композиції за цим винаходом містять NaCl у концентрації від приблизно 100 мМ до приблизно 200 мМ. За варіантом, якому віддається найбільша перевага, фармацевтичні композиції за цим винаходом містять NaCl у концентрації приблизно 150 мМ. Фармацевтичні композиції за цим винаходом можуть також містити гексамер-стабілізувальну сполуку. Словосполучення “гексамер-стабілізувальна сполука” означає небілкову дрібномолекулярну сполуку, яка стабілізує пегільовані сполуки інсуліну лізпро за цим винаходом у гексамерному асоційованому стані. Іони кальцію, цинк, кобальт, мідь, нікель, залізо, магній, марганець, аніони, зокрема, хлорид, бромід, йодид, тіоціанат, та фенольні сполуки, зокрема, фенол, фенольні консерванти, резорцин, 4’-гідроксиацетанілід, 4гідроксибензамід та 2,7-дигідроксинафталін є відомими гексамер-стабілізувальними сполуками для молекул інсуліну. За варіантом, якому віддається перевага, гексамер-стабілізувальною сполукою є фенол, m-крезол, o-крезол, p-крезол, хлоркрезол, метилпарабен, кальцій, хлорид або комбінація двох або декількох з цих сполук. За варіантом, якому віддається більша перевага, гексамер-стабілізувальною сполукою є фенол, m-крезол, кальцій, хлорид або їх комбінація. За варіантом, якому віддається перевага, фармацевтична композиція за цим винаходом містить від приблизно 1 мМ до 75 мМ кальцію, від приблизно 1 мМ до приблизно 50 мМ кальцію, від приблизно 1 мМ до приблизно 25 мМ кальцію, від приблизно 5 мМ до приблизно 50 мМ кальцію, від приблизно 2,5 мМ до приблизно 30 мМ кальцію, від приблизно 2,5 мМ до приблизно 15 мМ кальцію, від приблизно 2,5 мМ до приблизно 10 мМ кальцію, від приблизно 5 мМ до приблизно 30 мМ кальцію, від приблизно 5 мМ до приблизно 15 мМ кальцію. За варіантом, якому віддається більша перевага, фармацевтична композиція за цим винаходом містить від приблизно 2,5 мМ до 10 мМ кальцію. Лікарські форми фармацевтичних композицій багаторазового застосування за цим винаходом можуть також містити консервант. Термін “консервант” означає сполуку, яка додається до фармацевтичної лікарської форми для справляння дії протимікробного засобу. До числа консервантів, відомих у цій галузі як ефективні та прийнятні у парентеральних лікарських формах, належать бензалконію хлорид, бензетоній, хлоргексидин, фенол, m-крезол, бензиловий спирт, метилпарабен, пропілпарабен, хлорбутанол, o-крезол, p-крезол, хлоркрезол, фенілмеркурію нітрат, тимеросал, бензойна кислота та різні їх суміші. Відомо, що певні фенольні консерванти, такі як метилпарабен, фенол та m-крезол, зв’язуються з інсуліном та інсуліноподібними молекулами і тим самим спричинюють конформаційні зміни, які підвищують фізичну або хімічну стабільність чи те і друге (дивись, наприклад, Birnbaum, D. T., et al., Pharmaceutical. Res. 14:25-36 (1997); Rahuel-Clermont, S., et al., Biochemistry 36:5837-5845 (1997)). “Фенольний консервант” включає сполуки: фенол, m-крезол, o-крезол, p-крезол, хлоркрезол, метилпарабен та їх суміші. Консервантом, який застосовується у лікарських формах пегільованих сполук інсуліну лізпро за цим винаходом, може бути фенольний консервант, така ж сама сполука, що і гексамер-стабілізувальна сполука, або сполука, що відрізняється від неї. За варіантом, якому віддається перевага, згаданим фенольним консервантом є m-крезол або фенол. За варіантом, якому віддається більша перевага, фармацевтична композиція за цим винаходом містить фенол та/або m-крезол з концентрацією від приблизно 0,1 мМ до приблизно 75 мМ як консервант із значенням pH від приблизно pH 7,0 до приблизно pH 8,0. За варіантом, якому віддається ще більша перевага, фармацевтична композиція за цим винаходом містить фенол та/або m-крезол з концентрацією від приблизно 1 мМ до приблизно 60 мМ як консервант із значенням pH від приблизно pH 7,0 до приблизно pH 8,0. За варіантом, якому віддається ще більша перевага, фармацевтична композиція за цим винаходом містить фенол та/або m-крезол з концентрацією від приблизно 10 мМ до приблизно 40 мМ як консервант із значенням pH від приблизно pH 7,0 до приблизно pH 8,0. За варіантом, якому віддається ще більша перевага, фармацевтична композиція за цим винаходом містить 14 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 фенол та/або m-крезол з концентрацією приблизно 30 мМ із значенням pH від приблизно pH 7,0 до приблизно pH 8,0. За варіантом, якому віддається найбільша перевага, фармацевтична композиція за цим винаходом містить фенол та/або m-крезол з концентрацією приблизно 30 мМ із значенням pH від приблизно pH 7,3 до приблизно pH 7,5. Як згадувалось вище, фармацевтичні композиції за цим винаходом можуть містити катіони двовалентних металів, такі як цинк або кобальт, які стимулюють гексамеризацію інсуліну або іншим чином стабілізують інсулінові сполуки. Словосполучення “катіон двовалентного металу” означає іон або іони, які приймають участь у створенні комплексу з численними білковими молекулами. Перехідні метали, лужні метали та лужноземельні метали є прикладами металів, які, як відомо, утворюють комплекси з інсуліновими сполуками. Перевага віддається перехідним металам. За варіантом, якому віддається перевага, катіон двовалентного металу є одним або декількома катіонами, вибраними з групи, до складу якої входить цинк, мідь, кобальт, нікель, марганець, магній, кадмій та залізо. За варіантом, якому віддається більша перевага, катіоном двовалентного металу є цинк. Відомо, що цинк полегшує утворення гексамерів інсуліну та різних аналогів інсуліну та/або похідних, у тому числі інсуліну лізпро. Основна роль двовалентних катіонів, таких як цинк або кобальт, у фармацевтичних композиціях за цим винаходом полягає у полегшенні утворення гексамерів пегільованих сполук інсуліну лізпро за цим винаходом та/або будь-яких інших інсулінів або аналогів інсуліну у фармацевтичній композиції, яка містить пегільовану сполуку інсуліну лізпро за цим винаходом. У присутності фенольного консерванта утворення гексамерів може полегшуватись доведенням значення рН розчину, який містить фармацевтичні композиції за цим винаходом, до нейтрального рівня у присутності іонів Zn(II) або шляхом додання Zn(II) після доведення значення pH до нейтрального рівня. За варіантом, якому віддається перевага, нижня межа відношення цинк:сполука інсуліну, аналог інсуліну та/або пегільована сполука інсуліну лізпро становить приблизно 0,33, тобто два атоми цинку на гексамер інсуліну, гексамер аналогу інсуліну та/або гексамер пегільованого інсуліну лізпро. За варіантом, якому віддається більша перевага, відношення цинк:сполука інсуліну, аналог інсуліну та/або пегільована сполука інсуліну лізпро становить від приблизно 0,33 до приблизно 0,67. Під час процесу може застосовуватись ще більше цинку, якщо є присутньою сполука, яка конкурує з білком за зв’язування цинку, така як цитрат або фосфат. Надлишок цинку, порівняно з кількістю, необхідною для гексамеризації, може бути бажаним для сильнішого стимулювання гексамеризації, наприклад, відношення цинк:сполука інсуліну, аналог інсуліну та/або пегільована сполука інсуліну лізпро від приблизно 0,33 до приблизно 0,83. Надлишок цинку, порівняно з кількістю, необхідною для гексамеризації, також може бути присутнім у фармацевтичній композиції за цим винаходом і може бути бажаним для поліпшення хімічної та фізичної стабільності, для поліпшення “суспендувальності” і, можливо, для додаткового збільшення часу дії. З іншого боку, наслідком надлишкових кількостей цинку у цитратному або фосфатному буферах може бути осадження цитрату цинку або фосфату цинку, відповідно, а також інсуліну. Відповідно до цього винаходу цинк може бути присутнім у лікарській формі у кількості від приблизно 0,3 моль до приблизно 3 моль на моль інсуліну, аналогу інсуліну або гексамеру пегільованого інсуліну лізпро. За варіантом, якому віддається більша перевага, цинк є присутнім у фармацевтичних композиціях за цим винаходом у кількості від приблизно 0,3 моль до приблизно 1 моль на моль загальної кількості інсуліну, аналогу інсуліну або гексамеру пегільованого інсуліну лізпро. За варіантом, якому віддається ще більша перевага, цинк є присутнім у фармацевтичних композиціях за цим винаходом у кількості від приблизно 0,3 моль до приблизно 0,7 моль на моль загальної кількості інсуліну, аналогу інсуліну або гексамеру пегільованого інсуліну лізпро. За варіантом, якому віддається найбільша перевага, цинк є присутнім у фармацевтичних композиціях за цим винаходом у кількості від приблизно 0,3 моль до приблизно 0,55 моль на моль інсуліну, аналогу інсуліну або гексамеру пегільованого інсуліну лізпро. Сполукою цинку, що надає цинк для цього винаходу, може бути будь-яка фармацевтично прийнятна сполука цинку. Як додання цинку до препаратів інсуліну, так і фармацевтично прийнятні джерела цинку є відомими у цій галузі. За варіантом, якому віддається перевага, цинк надається у формі солі, такої як сульфат цинку, хлорид цинку, ацетат цинку, цитрат цинку, оксид цинку або нітрат цинку. У іншому варіанті здійснення цього винаходу фармацевтична композиція за цим винаходом також містить одну або декілька поверхнево-активних речовин. Термін “поверхнево-активна речовина”, вжитий у цьому описі, охоплює засоби, які зменшують поверхневий натяг рідини внаслідок адсорбування на поверхні розділу повітря-рідина. Приклади поверхнево-активних речовин включають (без обмеження ними) неіоногенні поверхнево-активні речовини, такі як полісорбати (наприклад, полісорбат 80 або полісорбат 20); полоксамери (наприклад, 15 UA 101195 C2 TM 5 10 15 20 25 30 35 40 45 50 55 60 TM полоксамер 188); Triton (наприклад, Triton X-100); поліетиленгліколь; поліпропіленгліколь; та співполімери етиленгліколю та пропіленгліколю (наприклад, плуроніки, PF68). Наприклад, фармацевтична композиція за цим винаходом може містити поверхнево-активну речовину у кількості приблизно 0,001-0,5%, наприклад, приблизно 0,05-0,3%. За варіантом, якому віддається перевага, поверхнево-активною речовиною, застосованою у фармацевтичній композиції за цим винаходом, є полоксамер 188. За варіантом, якому віддається більша перевага, поверхнево-активною речовиною є полоксамер 188 з концентрацією від приблизно 0,5 мг/мл до приблизно 10 мг/мл, від приблизно 1 мг/мл до приблизно 10 мг/мл, від приблизно 2 мг/мл до приблизно 10 мг/мл, від приблизно 3 мг/мл до приблизно 10 мг/мл, від приблизно 4 мг/мл до приблизно 10 мг/мл, від приблизно 1 мг/мл до приблизно 5 мг/мл, від приблизно 2 мг/мл до приблизно 5 мг/мл, від приблизно 3 мг/мл до приблизно 5 мг/мл та від приблизно 4 мг/мл до приблизно 5 мг/мл. Цей винахід також пропонує пегільовану сполуку інсуліну лізпро Формули I або її фармацевтично прийнятну сіль для застосування при лікуванні гіперглікемії та/або діабету, за варіантом, якому віддається перевага, у людей. Цей винахід також пропонує пегільовану сполуку інсуліну лізпро Формули I або її фармацевтично прийнятну сіль для застосування при виготовленні лікарського засобу для лікування гіперглікемії та/або діабету, за варіантом, якому віддається перевага, у людей. Фармацевтичні композиції, які містять пегільований інсулін лізпро за цим винаходом, можуть вводитись парентеральним шляхом пацієнтам, які потребують такого лікування. Парентеральне введення може здійснюватись шляхом здійснення підшкірної, внутрішньом’язової або внутрішньовенної ін’єкції за допомогою шприцу, за факультативним варіантом, шприц-ручки або ін’єктору з механічним приводом. За альтернативним варіантом парентеральне введення може здійснюватись за допомогою інфузійного насосу. Препарат 1 GlyA1-HSCH2CH2CO-інсулін лізпро (3) та LysB28-HSCH2CH2CO-інсулін лізпро (4) Trt-SCH2CH2CO-OH, N-гідроксисукцинімід (NHS) та діізопропілкарбодиімід (DIC) (обидва у кількості 1 моль) змішують у 2 мл DMF впродовж 30 хв з одержанням складного ефіру TrtSCH2CH2CO-NHS. Одну десяту ммоль інсуліну лізпро розчиняють у 10 мл 5% розчину триетиламіну (TEA) у DMSO. До розчину додають 0,2 ммоль активованого Trt-SCH2CH2CO-NHS. Через 2 год при кімнатній температурі додають 0,2 мл етаноламіну для закінчення реакції. Після цього реакційну суміш розбавляють 90 мл H2O, і вносять у колонку RP-C18 для очищення. Потрібні фракції LysB28-Trt-SCH2CH2CO-інсуліну лізпро (2) змішують та ліофілізують. Окремо змішують та ліофілізують потрібні фракції GlyA1-Trt-SCH2CH2CO-інсуліну лізпро (1). Одну десяту ммоль (1) або (2) розчиняють у 5 мл TFA, що містить 0,2 мл тіоанізолу та 0,4 мл тріізопропілсилану. Через 30 хв TFA видаляють шляхом випарювання, та залишковий пептид розчиняють у 50 мл 10% розчину ACN у H2O. Одержаний розчин вносять у колонку RP-C18 для очищення. Потрібні фракції (3) або (4) змішують і, за факультативним варіантом, ліофілізують. Препарат 2 PheB1-HSCH2CH2CO-інсулін лізпро (7) Одну десяту ммоль інсуліну лізпро розчиняють у 10 мл 5% розчину TEA у DMSO. До розчину додають 0,2 ммоль розчину ди-трет-бутилкарбонату у DMSO. Через 1 год при кімнатній температурі додають 0,2 мл етаноламіну для закінчення реакції. Після цього реакційну суміш розбавляють 90 мл H2O, і вносять у колонку RP-C18 для очищення. Потрібні фракції Boc-GlyA1, Boc-LysB28-інсуліну лізпро змішують та ліофілізують з одержанням (5). Одну десяту ммоль (5) розчиняють у 10 мл 5% розчину TEA у DMSO. У розчин додають 0,2 ммоль активованого TrtSCH2CH2CO-NHS. Через 2 год при кімнатній температурі додають 0,2 мл етаноламіну для закінчення реакції. Після цього реакційну суміш розбавляють 90 мл H2O, і вносять у колонку RPC18 для очищення. Потрібні фракції змішують та ліофілізують з одержанням Trt-SCH2CH2COPheB1, Boc-GlyA1, Boc-LysB28-інсуліну лізпро (6). Одну десяту ммоль (6) розчиняють у 5 мл TFA, що містить 0,2 мл тіоанізолу та 0,4 мл тріізопропілсилану. Через 30 хв TFA видаляють шляхом випарювання, та залишковий пептид розчиняють у 50 мл 10% розчину ACN у H2O. Одержаний розчин вносять у колонку RP-C18 для очищення. Потрібні фракції змішують і ліофілізують з одержанням (7). Приклад 1: Пегілування тіол-дериватизованих проміжних продуктів інсуліну лізпро Монометокси-PEG-MAL, що має середню молекулярну масу приблизно 20 кДа (b), 30 кДа (a), 40 кДа (a) або 60 кДа (c), розчиняють у суміші (1:1) 100 мМ буферу NH4Ac (pH 4,69) та ACN. У розчин додають ліофілізований порошок тіол-дериватизованого інсуліну лізпро, наприклад, сполуку (3), (4) або (7). Перебіг реакції може відслідковуватись за допомогою аналітичної RPHPLC. Після завершення реакції (як правило, приблизно через 4 год), суміш розбавляють H2O, і 16 UA 101195 C2 5 10 вносять до RP-HPLC колонки для очищення. Потрібні фракції змішують та ліофілізують з одержанням пегільованих сполук інсуліну лізпро. Приклади пегільованих сполук інсуліну лізпро, одержані як описано у Прикладі 1, представлені нижче як (8(a)), (8(b)), (9(a)), (9(b)), (10(a)), (10(b)) та (15(c)). За варіантом, якому віддається перевага, ці пегільовані сполуки інсуліну лізпро будуть мати n від приблизно 400 до приблизно 1000. За варіантом, якому віддається більша перевага, ці пегільовані сполуки інсуліну лізпро будуть мати n від приблизно 400 до приблизно 750. За варіантом, якому віддається більша перевага, ці пегільовані сполуки інсуліну лізпро будуть мати n від приблизно 400 до приблизно 550. За варіантом, якому віддається ще більша перевага, ці пегільовані сполуки інсуліну лізпро будуть мати n від приблизно 400 до приблизно 500. За варіантом, якому віддається ще більша перевага, ці пегільовані сполуки інсуліну лізпро будуть мати n від приблизно 450 до приблизно 500. За варіантом, якому віддається найбільша перевага, ці пегільовані сполуки інсуліну лізпро будуть мати n приблизно 450. 17 UA 101195 C2 18 UA 101195 C2 5 10 15 20 25 Приклад 2: Пегілування інсуліну лізпро за допомогою монометоксиполіетиленгліколь-pнітрофенілкарбонату (mPEG-NPC) Одну десяту ммоль інсуліну лізпро розчиняють у 20 мл 0,2 М боратного буферу, рН 10,5, і до одержаного розчину з енергійним перемішуванням додають 1,98 г розчину mPEG-NPC, що має середню молекулярну масу приблизно 20 кДа, у 20 мл ACN. Перебіг реакції відслідковується за допомогою RP-HPLC та SEC. Приблизно через 4 год реакційну суміш за допомогою оцтової кислоти підкисляють до pH 5-7, і вносять до RP-HPLC колонки для очищення. Бажані фракції змішують та ліофілізують з одержанням монопегільованого PEG20Kінсуліну лізпро з виходом 20-45%. Ідентичність та ступінь чистоти підтверджують засобами RPHPLC, SEC та MALDI-MS. Пропорцію mPEG, приєднаного до ланцюга A або до ланцюга B, визначають за об’єднанням ділянок вільного ланцюга A та ланцюга B, виділених після обробки епсілон одержаного кон’югату із застосуванням трис(2-карбоксиетил)фосфіну гідрохлориду (TCEP). Відношення mPEG-NPC до інсуліну лізпро визначає розподіл монопегільованих та дипегільованих різновидів. Значення рН реакційної суміші визначає сайтспецифічність пегілування. При підвищенні значення рН з приблизно 8 до приблизно 12 головним продуктом стає сполука (11). Якщо реакція проходить при рН 10,5 з mPEG-NPC, що має середню молекулярну масу приблизно 20 кДа (n дорівнює приблизно 450), то відношення (11) до (12) дорівнює приблизно 85:15. Реакція пегілування, опис якої наведений вище, може також бути проведена у незабуференому водному розчині шляхом підтримання значення рН реакційної суміші шляхом безперервного додання 0,2 М розчину NaOH. При проведенні згаданої реакції у незабуференому водному розчині із застосуванням mPEG-NPC, який має середню молекулярну масу приблизно 20 кДа, у той час як рН підтримується на рівні приблизно рН 11,5, продукти реакції пегілування включають (11) та (12) у співвідношенні приблизно 92:8. За варіантом, якому віддається перевага, сполука (11) буде мати n від приблизно 400 до приблизно 1000. За 19 UA 101195 C2 5 10 15 20 25 варіантом, якому віддається більша перевага, сполука (11) буде мати n від приблизно 400 до приблизно 750. За варіантом, якому віддається ще більша перевага, сполука (11) буде мати n від приблизно 400 до приблизно 550. За варіантом, якому віддається ще більша перевага, сполука (11) буде мати n від приблизно 400 до приблизно 500. За варіантом, якому віддається ще більша перевага, сполука (11) буде мати мати n від приблизно 450 до приблизно 500. За варіантом, якому віддається найбільша перевага, сполука (11) буде мати n приблизно 450. Приклад 3: In vitro спорідненість рецепторів Аналізи зв’язування рецепторів здійснюють на P1 мембранах, які були одержані із стабільно трансфектованих 293 EBNA HEK клітин, які надекспресують людський інсуліновий рецептор (hIR) або людський IGF-1 рецептор (hIGF-1R). Cпорідненість до зв’язування визначають за результатами аналізу конкурентного зв’язування радіолігандів із застосуванням людського 125 14 рекомбінантного (3-[ I]йодотирозил A )-інсуліну(2000 Кі/ммоль) або людського 125 рекомбінантного [ I] інсуліноподібного фактора росту 1 (2000 Кі/ммоль). Аналіз проводили методом SPA із застосуванням оброблених PVT PEI SPA гранул типу A, сполучених з аглютиніном з паростків пшениці. SPA аналітичний буфер (50 мМ розчин трис-HCl, pH 7,5, 150 мМ розчин NaCl, 0,1% BSA) застосовували для приготування усіх реактивів. Потрійні серійні розведення сполук (від 100 нМ до 2 пМ) готують у аналітичному буфері за допомогою роботизованої розкраплювальної станції Freedom/Evo (Tecan) і вносять до 96-лункових мікропланшетів білого кольору з прозорим дном (Corning/Costar) з розчином Multimek (Beckman Coulter). Радіоліганд, мембрани та SPA гранули додають за допомогою приладу для одночасного піпетування декількох зразків (Titertek). Після 10 год інкубування при кімнатній температурі рівень радіоактивності визначають за допомогою сцинтиляційного лічильника Microbeta Trilux. Немічений інсулін лізпро та немічений IGF-1 інкубують у кожному експерименті як позитивні та негативні контролі, відповідно. Значення IC 50 визначають шляхом 4параметричного логістичного нелінійного регресійного аналізу. Константу спорідненості (Ki) 20 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 обчислюють за значенням IC50 на основі рівняння Ki=IC50/(1+D/Kd), де D дорівнює концентрації радіоліганду, який застосовується у експерименті, Kd дорівнює константі зв’язувальної спорідненості радіоліганду у стані рівноваги, що визначається шляхом насичувального аналізу зв’язування (Kd для hIR та hIGF-1R дорівнює 0,124 нМ та 0,130 нМ, відповідно). Геометричне середнє значення Ki, наведене нижче, дорівнює 10^(середнє логарифмічне Ki), де середнє логарифмічне Ki=середнє (Ki1+Ki2+Ki3 ...Kin), і кількість незалежних експериментів (n) є більшою ніж два. Однак там, де нижче вказано стосовно людського IGF-1, n дорівнює двом. Наведені нижче пегільовані сполуки інсуліну лізпро, які одержали, як описано у Прикладі 1, мають геометричне середнє Ki менше ніж 30 нМ у аналізі зв'язування hIR, опис якого наведений вище: сполука 10(a), одержана із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу приблизно 40 кДа, сполука 8(a), яку одержана із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу приблизно 40 кДа, сполука 15(c), одержана із застосуванням розгалуженого mPEG-MAL, що має середню молекулярну масу приблизно 60 кДа, сполука 9(a), одержана із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу приблизно 30 кДа, сполука 9(a), одержана із застосуванням лінійного mPEGMAL, що має середню молекулярну масу приблизно 40 кДа, та сполука 9(b), одержана із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу 20 кДа. У аналізах зв’язування hIR та hIGFR сполука 9(a), одержана із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу приблизно 40 кДа, має геометричне середнє Ki, що дорівнює 3,070,32 нМ (S.E.M; n=6) та більше ніж 84,3 нМ (SEM=не визначалась; n=6), відповідно. Крім того, гетерогенні пегільовані сполуки інсуліну лізпро, які були одержані, як описано у Прикладі 2 із застосуванням лінійного mPEG-NPC масою 40 кДа, 30 кДа або 20 кДа, також мають геометричне середнє Ki менше ніж 30 нМ у аналізі зв’язування hIR, опис якого наведений вище. У аналізі зв’язування hIR, опис якого наведений вище, інсулін лізпро має геометричне середнє Ki, яке дорівнює 0,220,072 нМ (SEM; n=4). У аналізі зв’язування hIGFR, опис якого наведений вище, усі вищезгадані сполуки мають геометричне середнє Ki, що перевищує 75 нМ, а людський IGF-1 має геометричне середнє Ki, яке дорівнює 1,510,23 нМ (SEM; n=2). Ці дані показують, що результатом пегілування положення B28 є зменшення спорідненості hIR приблизно у 10 разів, внаслідок чого ці пегільовані різновиди інсуліну лізпро стають слабкими агоністами hIR. Ці пегільовані різновиди інсуліну лізпро також не мають вимірних властивостей зв’язування IGFR-1 у цьому аналізі за цих умов. Приклад 4: Визначення активності пегільованого інсуліну лізпро за допомогою цільноклітинного аналізу фосфорилування інсулінових рецепторів Функціональна активність пегільованих сполук інсуліну лізпро за цим винаходом може ® оцінюватись за допомогою DELFIA , комерційно доступного (Perkin-Elmer) гетерогенного флуорометричного аналітичного методу з часовим розділенням. Коротко кажучи, клітини лінії 293HEK, які надекспресують людський інсуліновий рецептор, трипсинізують і висівають (60000 клітин/лунку) на сенсибілізовані полі-D-лізином 96-лункові планшети з половинним ребром для культури тканин (Costar) у безсироватковому середовищі (SFM) (DMEM з 0,1% BSA без жирних кислот). Планшети для культури тканин інкубують впродовж ночі при температурі 37C у CO2-інкубаторі. За ніч до застосування 96-лункових титраційних мікропланшетів чорного кольору з половинним ребром (Costar) готують також планшети з іммобілізованим антитілом (mAb 8314) проти ланцюга A інсулінового рецептора, які обробляють впродовж ночі при температурі 4C 30 мкл моноклонального антитіла (mAb 8314) проти ланцюга A інсулінового рецептора (Soos, M.A., et al. Biochem J 235:199-208 (1986); комерційно доступне, у тому числі від Abcam, Inc., Cambridge, штат Массачусетс), розбавленого до 1 мкг/мл у 10 мМ розчині карбонату натрію. Планшети з іммобілізованим антитілом mAb 8314 чотири рази промивають 50 мМ розчином трис-буферу, pH 7,5, 150 мМ розчином NaCl та 0,1% розчином твін (TBST) для видалення будь-якого незв’язаного mAb 8314. Після цього планшет з іммобілізованим mAb 8314 блокують впродовж більше ніж 1 год при температурі 4C з 1% розчином BSA у TBST. Після завершення блокування планшет з іммобілізованим антитілом двічі промивають TBST для видалення надлишку розчину BSA. При знаходженні планшету з іммобілізованим антитілом у блокувальному буфері планшети для культури тканин видаляють з інкубатора і зрівноважують при кімнатній температурі. Експериментальні сполуки серійно розводять у SFM. Для стимулювання аутофосфорилування інсулінового рецептора 50 мкл розбавленого експериментального засобу додають до клітинного моношару. Через 30 хв при кімнатній температурі реакцію припиняють шляхом відсмоктування експериментальних сполук та додання 50 мкл 2 лізисного буферу (2% NP40, 100 мМ розчин трис-буферу, pH 7,4, 300 мМ TM розчин NaCl, протеазні інгібітори Roche Complete з EDTA та 4 мМ розчин ванадату). Після 21 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 30 хв у лізисному буфері при кімнатній температурі 30 мкл лізату переносять на блокований планшет з іммобілізованим антитілом, який містить 30 мкл антитіла PY20 проти фосфотирозину з протоном N1 європію, Eu-N1-PY20 (Perkin Elmer), розбавленого до 50 нг/мл у 10 мМ розчині гепес-буферу, 140 мМ розчині NaCl та 0,1% розчині твін. Цю суміш інкубують впродовж 1 год при кімнатній температурі з подальшим 6 промиваннями TBST для видалення незв’язаного EuN1-PY20 і клітинного лізату та з подальшим інкубуванням з 50 мкл посилювального розчину (Perkin Elmer) впродовж 10 хв з періодичним струшуванням у процесі розвитку сигналу. Кількісне визначення фосфорилованого інсулінового рецептора визначають за допомогою Wallac Victor із застосуванням уставок з часовим розділенням флуоресценції європію. Рівень фосфорилування обчислюють як відсоток реакції на максимальну стимулювальну дозу інсуліну (100 нМ). Активність аналогів інсуліну обчислюють як EC50 дозу шляхом чотирипараметричної підгонки кривої залежності між дозою та реакцією. Пегільовані сполуки інсуліну лізпро за цим винаходом, одержані як описано у Прикладі 1, які мають EC50 меншу ніж 15 нМ у аналізі, опис якого наведений у Прикладі 4, включають сполуку 10(a), одержану із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу приблизно 40 кДа, сполуку 9(a), одержану із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу приблизно 40 кДа, сполуку 9(a), одержану із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу приблизно 30 кДа, та сполуку 9(b), одержану із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу приблизно 20 кДа. У аналізі, опис якого наведений у Прикладі 4, сполука 9(a), одержана із застосуванням лінійного mPEG-MAL, має EC50, що становить 10,88 нМ. Гетерогенні пегільовані продукти інсуліну лізпро, одержані як описано у Прикладі 2, із застосуванням лінійного mPEG-NPC, який має середню молекулярну масу приблизно 40 кДа, приблизно 30 кДа або приблизно 20 кДа, також мають EC50 меншу ніж 15 нМ у аналізі, опис якого наведений у Прикладі 4. Суміш 50:50 та 70:30 сполуки 8(a), одержаної із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу приблизно 40 кДа, та сполуки 9(a), яку одержали із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу приблизно 40 кДа, також має EC50 меншу за 15 нМ у аналізі, опис якого наведений у Прикладі 4. За результатами такого ж самого аналізу людський інсулін та інсулін лізпро має EC50 2,3 нМ та 0,7 нМ, відповідно. Ці дані показують, що результатом пегілування положення B28 є зменшення in vitro активності hIR приблизно у 10-20 разів, внаслідок чого ці пегільовані різновиди інсуліну лізпро стають слабкими агоністами hIR. Ці пегільовані різновиди інсуліну лізпро також не мають вимірних властивостей зв’язування IGFR-1. Приклад 5: Визначення in vivo активності та фармакокінетичних профілів пегільованого інсуліну лізпро на пацючій моделі діабету типу 1 Пацюкам-самцям лінії Harlan Sprague-Dawley (Harlan, Indianapolis) віком десять тижнів, масою 250-280 г, внутрішньовенним шляхом (хвостова вена) у дозі 45 мг/кг вводять стрептозокотин (STZ) у 0,5 М розчині лимонної кислоти, рН 4,5, за три дні до початку дослідження. На початку дослідження тварин розподіляють на групи за масою тіла та рівнем глюкози у крові. У дослідженні застосовували лише тварин з рівнем глюкози у крові 400550 мг/дл. Вранці на початку дослідження тварини одержують одну підшкірну ін’єкцію експериментальної сполуки у одній з декількох заздалегідь визначених доз. Періодично з хвостової вени відбирають подвійні проби крові, які збирають до пробірок з динатрій EDTA. Рівні глюкози у крові визначають за допомогою глюкозометру. При збиранні проб венозної крови збирають також плазму. Для визначення рівнів введеного лікарського засобу у плазмі використовують комерційно доступного радіоімуноаналізу пацючого інсуліну. Для кожної окремої тварини обчислюють площу під кривою для рівнів глюкози у крові з часом (мггод/дл), і дані застосовують для проведення чотирипараметричного логістичного регресійного аналізу для визначення ED50. У цьому аналізі сполука 9(a), одержана із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу приблизно 40 кДа, сполука 9(a), одержана із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу приблизно 30 кДа, та сполука 9(b), одержана із застосуванням лінійного mPEG-MAL, що має середню молекулярну масу приблизно 20 кДа, має активність (ED50) 241 нмоль/кг, 138 нмоль/кг та 69 нмоль/кг, відповідно, за типовою кривою залежності між дозою та реакцією. Крім того, ці сполуки були здатними до зниження на щонайменше 36 год рівня глюкози у крові пацюків, оброблених STZ, однією підшкірною ін’єкцією STZ у дозі 568 нмоль/кг до рівня, що є нормальним у пацюків цієї лінії (100 мг/дл або нижче). Інсулін детемір, з іншого боку, нормалізує глюкозу на 5-6 год у вищенаведеному аналізі однією дозою у 568 нмоль/кг. Крім визначення фармакодинамічних параметрів середні значення фармакокінетичних параметрів експериментальних сполук у пацюків визначають за допомогою подвійних проб 22 UA 101195 C2 5 10 15 20 25 30 35 40 45 50 55 60 крові. Фармакокінетичні параметри обчислюють за допомогою незалежних від моделей методів (WinNonlin Pro). Визначені значення фармакокінетичних параметрів демонструють нелінійність як функцію дози. Діапазон наведених значень відповідає значенням фармакокінетичних параметрів, одержаних між найвищою випробуваною (568 нмоль/кг) та найнижчою (5,6 нмоль/кг) дозами. Фармакокінетичні результати для сполуки 9(b), одержаної із застосуванням лінійного mPEGMAL, що має середню молекулярну масу приблизно 20 кДа, показали час до досягнення максимальної концентрації (Tmax) у межах 6-12 год, уявну швидкість кліренсу (CL/F) у межах 0,05-0,14 л/год/кг, уявний об’єм розподілу (V/F) у межах 0,6-7,2 л/кг та період напіввиведення з плазми (t1/2) у межах 8,5-34,5 год. Фармакокінетичні результати для сполуки 9(a), одержаної із застосуванням лінійного mPEGMAL, що має середню молекулярну масу приблизно 30 кДа, показали Tmax 12 год, CL/F у межах 0,05-0,13 л/год/кг, V/F у межах 0,6-2,0 л/кг та t1/2 у межах 8,3-11,0 год. Фармакокінетичні результати для сполуки 9(a), одержаної із застосуванням лінійного mPEGMAL, що має середню молекулярну масу приблизно 40 кДа, показали Tmax у межах 12-24 год, CL/F у межах 0,06-0,2 л/год/кг, V/F у межах 1,0-7,5 л/кг та t1/2 у межах 11,1-48,5 год. При подібному введенні інсуліну лізпро у дозі 568 нмоль/кг пацюкам-самцям, обробленим STZ, визначають t1/2 приблизно 1 год та CL/F приблизно 1,2 л/год/кг. При подібному введенні інсуліну детемір у дозах у межах 18,9-568 нмоль/кг пацюкамсамцям, обробленим STZ, визначають t1/2 у межах приблизно 1,9-3,1 год та CL/F приблизно 0,81,7 л/год/кг. Внаслідок складнощів з фармакокінетичними даними уявні відношення CL між інсуліном детемір та прикладами пегільованих сполук інсуліну лізпро є різними у залежності від дози, застосованої при цьому визначенні. Однак результати досліджень, опис яких наведений у Прикладі 5, вказують на те, що приклади пегільованих сполук інсуліну лізпро, кон’юговані з 20 кДа або 40 кДа ПЕГ, мають приблизно у 5-30 разів повільніший уявний кліренс, порівняно з інсуліном детемір, у пацюків з діабетом, спричиненим застосуванням STZ. Приклад 6: Визначення in vivo тривалості дії та фармакокінетичних властивостей пегільованого інсуліну лізпро на пацючій моделі діабету типу 2 Глікодинамічну активність сполуки 9(a) з лінійним PEG масою 40 кДа оцінювали на пацюкахсамцях лінії ZDF fa/fa (n=4 пацюки/групу) після однієї підшкірної ін’єкції контрольного носія (PBS) або 517 нмоль/кг сполуки 9(a), одержаної із застосування лінійного mPEG-MAL, що має середню молекулярну масу приблизно 40 кДа. Серійні зразки збирають для визначення як фармакокінетичних, так і фармакодинамічних параметрів. Одноразове підшкірне введення 517 нмоль/кг сполуки 9(a), одержаної із застосування лінійного mPEG-MAL, що має середню молекулярну масу приблизно 40 кДа, пацюкам-самцям лінії ZDF fa/fa, пов’язується із статистично значущим зниженням рівня глюкози, що підтримується впродовж щонайменше семи днів (порівняно з плацебо; p
ДивитисяДодаткова інформація
Назва патенту англійськоюPegylated insulin lispro compounds, pharmaceutical composition based thereon and method for producing thereof
Автори англійськоюBeals, John, Michael, Cutler, Gordon, Butler, Doyle, Brandon, Hansen, Ryan, John, Li, Shun, Shirani, Shahriar, Zhang, Lianshan
Назва патенту російськоюПегилированное соединение инсулина лизпро, фармацевтическая композиция на его основе и способ его получения
Автори російськоюБилз Джон Майкл, Катлер Гордон Батлер, Дойл Брендон, Хансен Райан Джон, Ли Шан, Ширани Шахриар, Чжан Ляншен
МПК / Мітки
МПК: A61K 47/48, A61K 38/28, A61P 3/10
Мітки: сполука, композиція, основі, інсуліну, фармацевтична, пегільована, спосіб, лізпро, одержання
Код посилання
<a href="https://ua.patents.su/40-101195-pegilovana-spoluka-insulinu-lizpro-farmacevtichna-kompoziciya-na-osnovi-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Пегильована сполука інсуліну лізпро, фармацевтична композиція на її основі та спосіб її одержання</a>
Попередній патент: Вертикальний комбінований сировинний/продуктовий теплообмінник зі змінюваним кутом відбивача
Наступний патент: Адаптивний вібраційний млин
Випадковий патент: Прилад для вертикального гель-електрофорезу