Похідні хіназоліну, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі, проміжна сполука
Номер патенту: 83252
Опубліковано: 25.06.2008
Автори: Аннекен Лоран Франсуа Андре, Бредбері Роберт Хью, Барлаам Бернар Крістоф
Формула / Реферат
1. Похідне хіназоліну формули І:
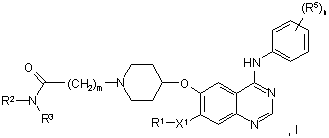
у якій n являє собою 0, 1, 2 або 3,
кожен R5 незалежно вибирають із галогену, ціано, нітро, гідрокси, аміно, карбокси, сульфамоїлу, трифторметилу, С1-С6-алкілу, С2-С8-алкенілу, С2-С8-алкінілу, С1-С6-алкокси, С2-С6-алкенілокси, С2-С6-алкінілокси, С1-С6-алкілтіо, С1-С6-алкілсульфінілу, С1-С6-алкілсульфонілу, С1-С6-алкіламіно, ді-[С1-С6-алкіл]аміно, С1-С6-алкоксикарбонілу, N-С1-С6-алкілсульфамоїлу, і N,N-ді-[С1-С6-алкіл]сульфамоїлу, C(O)NR6R7, де R6 й R7 незалежно вибирають із водню, необов'язково заміщеного С1-С6-алкілу, необов'язково заміщеного С3-С8-циклоалкілу або необов'язково заміщеного арилу, або R6 й R7 разом з атомом азоту, до якого вони приєднані, утворюють необов'язково заміщене гетероциклічне кільце, яке може містити додаткові гетероатоми;
X1 являє собою простий зв'язок або О;
R1 вибирають із водню й С1-С6-алкілу, де С1-С6-алкільна група необов'язково заміщена одним або декількома замісниками, які можуть бути однаковими або різними, вибраними з гідрокси й галогену, і/або замісник, вибраний з аміно, нітро, карбокси, ціано, галогену, С1-С6-алкокси, гідроксі-С1-С6-алкокси, С2-С8-алкенілу, С2-С8-алкінілу, С1-С6-алкілтіо, С1-С6-алкілсульфінілу, С1-С6-алкілсульфонілу, С1-С6-алкіламіно, ді-[С1-С6-алкіл]аміно, карбамоїлу, N-С1-С6-алкілкарбамоїлу, N,N ді-[С1-С6-алкіл]карбамоїлу, С2-С6-алканоїлу, С2-С6-алканоїлокси, С2-С6-алканоїламіно, N-С1-С6-алкіл-С2-С6-алканоїламіно, С1-С6-алкоксикарбонілу, сульфамоїлу, N-С1-С6-алкілсульфамоїлу, N,N-ді-[С1-С6-алкіл]сульфамоїлу, С1-С6-алкансульфоніламіно й N-С1-С6-алкіл-С1-С6-алкансульфоніламіно;
m являє собою 0, 1, 2 або 3;
R2 являє собою водень або С1-С6-алкіл; і
R3 являє собою С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл або С1-С6-алкокси, кожний з яких необов'язково може бути заміщений біля атома вуглецю С1-С6-алкокси, аміно, С1-С6-алкіламіно, ді-С1-С6-алкіламіно, або групу S(О)sС1-С6-алкіл, де s являє собою 0, 1 або 2, або насичене 5- або 6-членне гетероциклічне кільце, яке необов'язково містить додаткові гетероатоми, вибрані з кисню, сірки або NR8, де R8 являє собою водень, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, С1-С6-алкілсульфоніл або С1-С6-алкілкарбоніл;
або R2 й R3 разом з атомом азоту, до якого вони приєднані, утворюють насичене 5- або 6-членне гетероциклічне кільце, яке необов'язково містить додаткові гетероатоми, вибрані з кисню, S, SO або S(O)2, або NR8, де R8 має значення, вказані вище; за умови, що похідне хіназоліну не являє собою:
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(диметиламіно)карбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4-іл)карбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4-іл)карбоніл]-піперидин-4-ілокси}-хіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(диметиламіно)карбоніл]-піперидин-4-ілокси}-хіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(діетиламіно)карбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(піперидин-1-іл)карбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(піролідин-1-іл)карбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(4-метилпіперазин-1-іл)карбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4-іл)карбоніл]-піперидин-4-ілокси}-7-етоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4-іл)карбоніл]-піперидин-4-ілокси}-7-(2-метоксіетокси)-хіназолін;
4-[(3-етинілфеніл)аміно]-6-{1-[(морфолін-4-іл)карбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(етиламіно)карбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(ізопропіламіно)карбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(диметиламіно)карбонілметил]-піперидин-4-ілокси}-хіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4-іл)карбонілметил]-піперидин-4-ілокси}-хіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(диметиламіно)карбонілметил]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4-іл)карбонілметил]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(метиламіно)карбонілметил]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(піролідин-1-іл)карбонілметил]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(метиламіно)карбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(2-метоксіетил)амінокарбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(N-метил-N-2-метоксіетил)амінокарбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(3-метоксипропіл)амінокарбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(N-метил-N-3-метоксипропіл)амінокарбоніл]-піперидин-4-ілокси}-7-метоксихіназолін;
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4-іл)карбонілетил]-піперидин-4-ілокси}-7-метоксихіназолін або
4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4-іл)карбонілпропіл]-піперидин-4-ілокси}-7-метоксихіназолін;
або його фармацевтично прийнятна сіль.
2. Похідне хіназоліну відповідно до пункту 1, у якому n являє собою 1, 2 або 3.
3. Похідне хіназоліну відповідно до пункту 1 або 2, у якому n являє собою 2 або 3.
4. Похідне хіназоліну відповідно до будь-якого з пунктів 1-3, у якому n являє собою 2.
5. Похідне хіназоліну відповідно до будь-якого з пунктів 1-3, у якому n являє собою 3.
6. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому кожна група R5 являє собою галогенову групу.
7. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому кожна група R5 вибрана із хлору й фтору.
8. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, що містить групу R5, розташовану в орто-(2-)положенні на бензольному кільці, до якого вона приєднана.
9. Похідне хіназоліну відповідно до пункту 8, у якому група R5 розташована в орто-(2-)положенні, являє собою фтор.
10. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, в якому у формулі І група підформули (і):
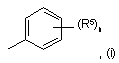
являє собою групу підформули (іі):
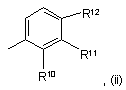
у якій (а) один з R10 або R12 являє собою водень, а інший являє собою галоген, і R11 являє собою галоген, або (б) R10 являє собою галоген, R11 являє собою галоген й R12 вибирають із водню або галогену, або (в) R10 являє собою фтор, R11 являє собою хлор, a R12 вибраний з водню або фтору.
11. Похідне хіназоліну відповідно до пункту 10, у якому один з R10 або R12 являє собою водень, а інший являє собою фтор, і R11 являє собою хлор.
12. Похідне хіназоліну відповідно до пункту 10, у якому R10 являє собою фтор, R11 являє собою хлор, і R12 являє собою водень.
13. Похідне хіназоліну відповідно до пункту 10, у якому R10 являє собою фтор, R11 являє собою хлор, і R12 являє собою фтор.
14. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому X1 являє собою кисень.
15. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R1 вибирають із водню, С1-С6-алкілу й С1-С6-алкоксі-С1-С6-алкілу, де будь-яка С1-С6-алкільна група в R1 необов'язково має один або декілька гідрокси або галогенових замісників.
16. Похідне хіназоліну відповідно до пункту 15, у якому R1 вибирають із С1-С6-алкілу, який необов'язково має один або декілька гідрокси або галогенових замісників.
17. Похідне хіназоліну відповідно до будь-якого з пунктів 1-13, у якому R1-X1-вибирають із водню, метокси, етокси й 2-метоксіетокси.
18. Похідне хіназоліну відповідно до пункту 17, у якому R1-X1- являє собою метокси.
19. Похідне хіназоліну відповідно до пункту 1 формули ІА:
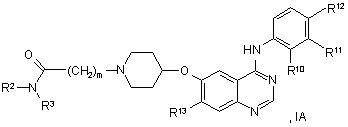
у якій R2, R3 й m мають значення, вказані в пункті 1, R10, R11 й R12 мають значення, вказані в будь-якому з пунктів 10-13, і R13 вибирають із водню, метокси, етокси й 2-метоксіетокси.
20. Похідне хіназоліну відповідно до пункту 1 формули IB:
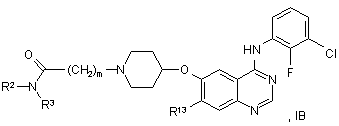
у якій R2, R3 й m мають значення, вказані в пункті 1, і R13 вибирають із водню, метокси, етокси й 2-метоксіетокси.
21. Похідне хіназоліну відповідно до пункту 1 формули IС:
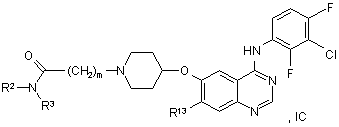
у якій R2, R3 й m мають значення, вказані в пункті 1, і R13 вибирають із водню, метокси, етокси й 2-метоксіетокси.
22. Похідне хіназоліну відповідно до будь-якого з пунктів 19-21, у якому R13 являє собою метокси.
23. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому m являє собою 0 або 1.
24. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому m являє собою 1.
25. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R2 являє собою водень або С1-С3-алкіл.
26. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R2 являє собою водень або метил.
27. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R2 являє собою водень.
28. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R3 являє собою С1-С6-алкіл.
29. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R3 являє собою С1-С3-алкіл.
30. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R3 являє собою метил.
31. Похідне хіназоліну відповідно до пункту 1, яке вибране з однієї або декількох наступних сполук:
4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-метилкарбамоїлметил)піперидин-4-іл]-окси}хіназоліну;
4-(3-хлор-2-фтораніліно)-6-{[1-(N,N-диметилкарбамоїлметил)піперидин-4-іл]окси}-7-метоксихіназоліну;
4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(морфолін-4-ілкарбонілметил)піперидин-4-іл]окси}-хіназоліну;
4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(піролідин-1-ілкарбоніл)піперидин-4-іл]окси}хіназоліну;
4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-метилкарбамоїл)піперидин-4-іл]окси}хіназоліну;
4-(3-хлор-2-фтораніліно)-6-{[1-(N-(2-диметиламіноетил)карбамоїл)піперидин-4-іл]окси}-7-метоксихіназоліну;
4-(3-хлор-2-фтораніліно)-6-{[1-(N,N-диметилкарбамоїл)піперидин-4-іл]окси}7-метоксихіназоліну;
4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(морфолін-4-ілкарбоніл)піперидин-4-іл]окси}хіназоліну;
4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-[2-піролідин-1-ілетил]карбамоїл)піперидин-4-іл]окси}хіназоліну;
4-(3-хлор-2,4-дифтораніліно)-7-метокси-6-{[1-(N-метилкарбамоїлметил)піперидин-4-іл]окси}хіназоліну;
4-(3-хлор-2-фтораніліно)-6-{[1-(N-етилкарбамоїлметил)піперидин-4-іл]окси}-7-метоксихіназоліну;
4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-[2-(піролідин-1-іл)етил]карбамоїлметил)піперидин-4-іл]окси}хіназоліну;
4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-(2-метоксіетил)карбамоїлметил)піперидин-4-іл]окси}хіназоліну;
4-(3-хлор-2-фтораніліно)-6-{[1-(N-(2-диметиламіноетил)карбамоїлметил)піперидин-4-іл]окси}-7-метоксихіназоліну;
4-(3-хлор-2-фтораніліно)-7-метокси-6-({1-[2-(4-метилпіперазин-1-іл)-2-оксоетил]піперидин-4-іл}окси)хіназоліну;
4-(3-хлор-2-фтораніліно)-7-метокси-6-({1-[2-(піперазин-1-іл)-2-оксоетил]піперидин-4-іл}окси)хіназоліну і
4-(3-хлор-2,4-дифтораніліно)-7-метокси-6-({1-[2-(4-метилпіперазин-1-іл)-2-оксоетил]піперидин-4-іл}окси)хіназоліну;
або їх фармацевтично прийнятної солі.
32. Похідне хіназоліну відповідно до пункту 1, яке являє собою 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-метилкарбамоїлметил)піперидин-4-іл]окси}хіназолін або його фармацевтично прийнятну сіль.
33. Похідне хіназоліну відповідно до пункту 1, яке являє собою 4-(3-хлор-2,4-дифтораніліно)-7-метокси-6-{[1-(N-метилкарбамоїлметил)піперидин-4-іл]окси}хіназолін або його фармацевтично прийнятну сіль.
34. Похідне хіназоліну відповідно до пункту 1, яке являє собою 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-[2-(піролідин-1-іл)етил]карбамоїлметил)піперидин-4-іл]окси}хіназолін або його фармацевтично прийнятну сіль.
35. Похідне хіназоліну відповідно до пункту 1, яке являє собою 4-(3-хлор-2-фтораніліно)-7-метокси-6-({1-[2-(4-(метилпіперазин-1-іл)-2-оксоетил]піперидин-4-іл}окси)хіназолін або його фармацевтично прийнятну сіль.
36. Похідне хіназоліну відповідно до пункту 1, яке являє собою 4-(3-хлор-2-фтораніліно)-7-метокси-6-({1-[2-(піперазин-1-іл)-2-оксоетил]піперидин-4-іл}окси)хіназолін або його фармацевтично прийнятну сіль.
37. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому сполуку формули II:
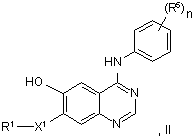
у якій R1, X1, R5 й n мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена,
піддають взаємодії зі сполукою формули III:
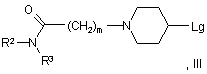
у якій R2, R3 й m мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена й Lg являє собою групу, яка витісняється, де взаємодію сприятливо здійснюють у присутності підходящої основи.
38. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому замісник модифікують в або замісник вводять в інше похідне хіназоліну формули І або його фармацевтично прийнятну сіль, як визначено вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена.
39. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому сполуки формули IV:
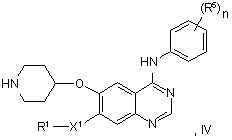
у якій R1, X1, R5 й n мають значення, вказані для формули І, за винятком того, що будь-яка функціональна група, при необхідності, захищена, зі сполукою формули V або V':
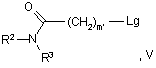
![]()
де R2 й R3 мають значення, вказані у пункті 1, і m' являє собою 0, 1, 2 або 3, за умови, що він не дорівнює 0, якщо R2 являє собою водень, і Lg являє собою групу, яка витісняється.
40. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому з похідного хіназоліну формули І або його фармацевтично прийнятної солі видаляють захисну групу.
41. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому сполуку формули II, як визначено в пункті 37, піддають взаємодії зі сполукою формули III, як визначено в пункті 37, за винятком того, що Lg являє собою ОН, в умовах Міцунобу.
42. Спосіб одержання похідного хіназоліну відповідно до пункту 1 формули І, у якій R1-X1 являє собою гідроксигрупу, у якому похідне хіназоліну формули І, у якій R1-X1 являє собою С1-С6-алкоксигрупу; розщеплюють.
43. Спосіб одержання похідного хіназоліну відповідно до пункту 1 формули І, у якій X1 являє собою О й R1 не являє собою водень, у якому сполуку формули VI:
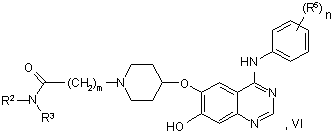
у якій R2, R3, R5, m й n мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена,
піддають взаємодії зі сполукою формули R1-Lg, де R1 має будь-яке зі значень, вказаних у пункті 1, крім водню, і за винятком того, що будь-яка функціональна група, при необхідності, захищена й Lg являє собою групу, яку витісняють.
44. Спосіб одержання похідного хіназоліну відповідно до пункту 1 формули І, у якій R1 містить С1-С6-алкокси або заміщену С1-С6-алкоксигрупу або С1-С6-алкіламіно або заміщену С1-С6-алкіламіногрупу, у якому похідне хіназоліну формули І, у якій R1 містить гідроксигрупу або первинну або вторинну аміногрупу, якщо це є прийнятним, алкілують.
45. Спосіб одержання похідного хіназоліну відповідно до пункту 1 формули І, у якій R1 заміщений групою Т, де Т вибрана із С1-С6-алкіламіно, ді-[С1-С6-алкіл]аміно, С2-С6-алканоїламіно, С1-С6-алкілтіо, С1-С6-алкілсульфінілу й С1-С6-алкілсульфонілу,
у якому сполуку формули VII:
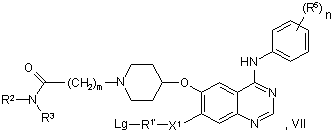
у якій R2, R3, R5, X1, n й m мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, R1’ являє собою групу R1, як визначено в пункті 1, за винятком того, що будь-яка група Т замінена Lg, і Lg являє собою групу, яка витісняється (наприклад, хлор або бром),
піддають взаємодії зі сполукою формули ТН, де Т має значення, вказані вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена.
46. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому сполуку формули VIII:
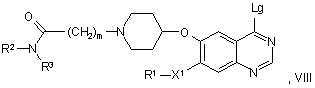
у якій R1, R2, R3, X1 і m мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена й Lg являє собою групу, яка витісняється, як визначено вище,
піддають взаємодії з аніліном формули IX:
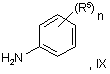
у якій R5 й n мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, і де взаємодію сприятливо здійснюють у присутності підходящої кислоти.
47. Спосіб одержання похідного хіназоліну відповідно до пункту 1 формули І, у якій m являє собою 1, 2 або 3, у якому сполуку формули X:
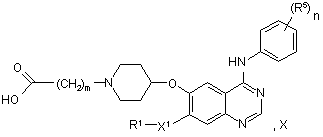
у якій m являє собою 1, 2 або 3 й R1, X1, R5 і n мають значення, вказані вище в пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена,
піддають сполученню з первинним або вторинним аміном формули R2NHR3, де R2 й R3 мають значення, вказані в пункті 1.
48. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому сполуку формули IV, як визначено вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена,
піддають взаємодії зі сполукою формули V":
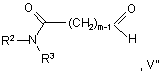
використовуючи методику відновного амінування.
49. Спосіб одержання похідного хіназоліну відповідно до пункту 1 формули І, у якій R3 являє собою С2-С6-алкіл, заміщений біля атома вуглецю аміно, С1-С6-алкіламіно, ді-С1-С6-алкіламіно, або насичене 5- або 6-членне гетероциклічне кільце, яке містить NR8, де R8 має значення, вказані в пункті 1,
у якому сполуку формули XX:
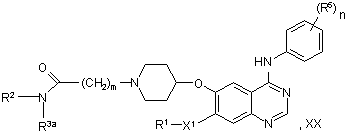
у якій R3a являє собою Lg-С2-С6-алкіл, де Lg являє собою групу, яка витісняється, і де R1, R2, X1, R5, m й n мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена,
піддають взаємодії з аміаком або з підходящим первинним або вторинним аміном.
50. Фармацевтична композиція, яка містить похідне хіназоліну формули І або його фармацевтично прийнятну сіль, як визначено в будь-якому з пунктів 1-36, у сполученні з фармацевтично прийнятним розріджувачем або носієм.
51. Похідне хіназоліну формули І, як визначено в будь-якому з пунктів 1-36, або його фармацевтично прийнятна сіль для застосування як лікарський засіб.
52. Застосування похідного хіназоліну формули І або його фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-36, для приготування лікарського засобу для застосування для одержання антипроліферативної дії в теплокровної тварини.
53. Спосіб забезпечення антипроліферативної дії в теплокровної тварини, яка потребує такого лікування, який включає введення вказаній тварині похідного хіназоліну формули І або його фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-36.
54. Сполука формули VI:
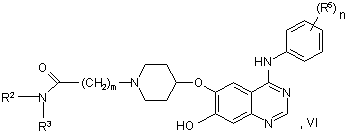
у якій R2, R3, R5, m й n мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, або її сіль.
55. Сполука формули VII:
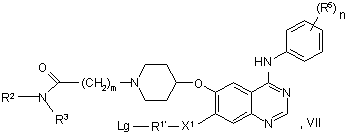
у якій R2, R3, R5, X1, n й m мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, R1’ являє собою групу R1, як визначено у пункті 1, за винятком того, що будь-яка група Т замінена Lg, і Lg являє собою групу, яка витісняється (наприклад, хлор або бром), або її сіль.
56. Сполука формули VIII:
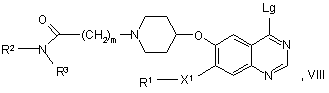
у якій R1, R2, R3, X1, і m мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена й Lg являє собою групу, яка витісняється, як визначено вище, або її сіль.
57. Сполука формули X:
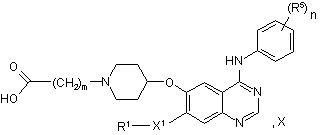
у якій m являє собою 1, 2 або 3 й R1, X1, R5 i n мають значення, вказані вище в пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, або її сіль.
58. Сполука формули XX:

у якій R3a являє собою Lg-C2-C6-алкіл, де Lg являє собою групу, яка витісняється, і де R1, R2, X1, R5, m й n мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, або її сіль.
59. Застосування похідного хіназолину формули І або його фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-36, для приготування лікарського засобу для застосування при лікуванні злоякісного новоутворення.
60. Застосування похідного хіназоліну формули І або його фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-36, для приготування лікарського засобу для застосування при лікуванні пухлини.
Текст
1. Похідне хіназоліну формули І: C2 2 (19) 1 3 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(диметиламіно)карбоніл]-піперидин-4-ілокси}хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(діетиламіно)карбоніл]-піперидин-4-ілокси}-7метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(піперидин-1іл)карбоніл]-піперидин-4-ілокси}-7метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(піролідин-1іл)карбоніл]-піперидин-4-ілокси}-7метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(4метилпіперазин-1-іл)карбоніл]-піперидин-4-ілокси}7-метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4іл)карбоніл]-піперидин-4-ілокси}-7-етоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4іл)карбоніл]-піперидин-4-ілокси}-7-(2метоксіетокси)-хіназолін; 4-[(3-етинілфеніл)аміно]-6-{1-[(морфолін-4іл)карбоніл]-піперидин-4-ілокси}-7метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(етиламіно)карбоніл]-піперидин-4-ілокси}-7метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(ізопропіламіно)карбоніл]-піперидин-4-ілокси}-7метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(диметиламіно)карбонілметил]-піперидин-4ілокси}-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4іл)карбонілметил]-піперидин-4-ілокси}-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(диметиламіно)карбонілметил]-піперидин-4ілокси}-7-метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4іл)карбонілметил]-піперидин-4-ілокси}-7метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(метиламіно)карбонілметил]-піперидин-4-ілокси}7-метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(піролідин-1іл)карбонілметил]-піперидин-4-ілокси}-7метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(метиламіно)карбоніл]-піперидин-4-ілокси}-7метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(2метоксіетил)амінокарбоніл]-піперидин-4-ілокси}-7метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(N-метил-N-2метоксіетил)амінокарбоніл]-піперидин-4-ілокси}-7метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(3метоксипропіл)амінокарбоніл]-піперидин-4-ілокси}7-метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(N-метил-N-3метоксипропіл)амінокарбоніл]-піперидин-4-ілокси}7-метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4іл)карбонілетил]-піперидин-4-ілокси}-7метоксихіназолін або 83252 4 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4іл)карбонілпропіл]-піперидин-4-ілокси}-7метоксихіназолін; або його фармацевтично прийнятна сіль. 2. Похідне хіназоліну відповідно до пункту 1, у якому n являє собою 1, 2 або 3. 3. Похідне хіназоліну відповідно до пункту 1 або 2, у якому n являє собою 2 або 3. 4. Похідне хіназоліну відповідно до будь-якого з пунктів 1-3, у якому n являє собою 2. 5. Похідне хіназоліну відповідно до будь-якого з пунктів 1-3, у якому n являє собою 3. 6. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому кожна група R5 являє собою галогенову групу. 7. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому кожна група R5 вибрана із хлору й фтору. 8. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, що містить групу R5, розташовану в орто-(2-)положенні на бензольному кільці, до якого вона приєднана. 9. Похідне хіназоліну відповідно до пункту 8, у якому група R5 розташована в орто-(2-)положенні, являє собою фтор. 10. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, в якому у формулі І група підформули (і): (R5)n , (i) являє собою групу підформули (іі): R12 R11 R10 , (ii) у якій (а) один з R10 або R12 являє собою водень, а інший являє собою галоген, і R11 являє собою галоген, або (б) R10 являє собою галоген, R11 являє собою галоген й R12 вибирають із водню або галогену, або (в) R10 являє собою фтор, R11 являє собою хлор, a R12 вибраний з водню або фтору. 11. Похідне хіназоліну відповідно до пункту 10, у якому один з R10 або R12 являє собою водень, а інший являє собою фтор, і R11 являє собою хлор. 12. Похідне хіназоліну відповідно до пункту 10, у якому R10 являє собою фтор, R11 являє собою хлор, і R12 являє собою водень. 13. Похідне хіназоліну відповідно до пункту 10, у якому R10 являє собою фтор, R11 являє собою хлор, і R12 являє собою фтор. 14. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому X1 являє собою кисень. 15. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R1 вибирають із водню, С1-С6-алкілу й С1-С6-алкоксі-С1-С6-алкілу, де будьяка С1-С6-алкільна група в R1 необов'язково має один або декілька гідрокси або галогенових замісників. 16. Похідне хіназоліну відповідно до пункту 15, у якому R1 вибирають із С1-С6-алкілу, який необов'я 5 83252 зково має один або декілька гідрокси або галогенових замісників. 17. Похідне хіназоліну відповідно до будь-якого з пунктів 1-13, у якому R1-X1-вибирають із водню,метокси, етокси й 2-метоксіетокси. 18. Похідне хіназоліну відповідно до пункту 17, у якому R1-X1- являє собою метокси. 19. Похідне хіназоліну відповідно до пункту 1 формули ІА: R12 HN O (CH2)m R2 N O N N R3 R13 R11 N R10 , IA у якій R2, R3 й m мають значення, вказані в пункті 1, R10, R11 й R12 мають значення, вказані в будьякому з пунктів 10-13, і R13 вибирають із водню, метокси, етокси й 2-метоксіетокси. 20. Похідне хіназоліну відповідно до пункту 1 формули IB: HN O (CH2)m R2 N O N N R3 R13 Cl N F , IB у якій R2, R3 й m мають значення, вказані в пункті 1, і R13 вибирають із водню, метокси, етокси й 2метоксіетокси. 21. Похідне хіназоліну відповідно до пункту 1 формули IС: F HN O (CH2)m R2 N O N N R3 R13 Cl N F , IC у якій R2, R3 й m мають значення, вказані в пункті 1, і R13 вибирають із водню, метокси, етокси й 2метоксіетокси. 22. Похідне хіназоліну відповідно до будь-якого з пунктів 19-21, у якому R13 являє собою метокси. 23. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому m являє собою 0 або 1. 24. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому m являє собою 1. 25. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R2 являє собою водень або С1-С3-алкіл. 26. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R2 являє собою водень або метил. 27. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R2 являє собою водень. 6 28. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R3 являє собою С1-С6алкіл. 29. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R3 являє собою С1-С3алкіл. 30. Похідне хіназоліну відповідно до будь-якого з попередніх пунктів, у якому R3 являє собою метил. 31. Похідне хіназоліну відповідно до пункту 1, яке вибране з однієї або декількох наступних сполук: 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїлметил)піперидин-4-іл]окси}хіназоліну; 4-(3-хлор-2-фтораніліно)-6-{[1-(N,Nдиметилкарбамоїлметил)піперидин-4-іл]окси}-7метоксихіназоліну; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(морфолін-4-ілкарбонілметил)піперидин-4-іл]окси}хіназоліну; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(піролідин-1-ілкарбоніл)піперидин-4іл]окси}хіназоліну; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїл)піперидин-4-іл]окси}хіназоліну; 4-(3-хлор-2-фтораніліно)-6-{[1-(N-(2диметиламіноетил)карбамоїл)піперидин-4-іл]окси}7-метоксихіназоліну; 4-(3-хлор-2-фтораніліно)-6-{[1-(N,Nдиметилкарбамоїл)піперидин-4-іл]окси}7метоксихіназоліну; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(морфолін-4-ілкарбоніл)піперидин-4іл]окси}хіназоліну; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-[2піролідин-1-ілетил]карбамоїл)піперидин-4іл]окси}хіназоліну; 4-(3-хлор-2,4-дифтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїлметил)піперидин-4іл]окси}хіназоліну; 4-(3-хлор-2-фтораніліно)-6-{[1-(Nетилкарбамоїлметил)піперидин-4-іл]окси}-7метоксихіназоліну; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-[2(піролідин-1-іл)етил]карбамоїлметил)піперидин-4іл]окси}хіназоліну; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-(2метоксіетил)карбамоїлметил)піперидин-4іл]окси}хіназоліну; 4-(3-хлор-2-фтораніліно)-6-{[1-(N-(2диметиламіноетил)карбамоїлметил)піперидин-4іл]окси}-7-метоксихіназоліну; 4-(3-хлор-2-фтораніліно)-7-метокси-6-({1-[2-(4метилпіперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназоліну; 4-(3-хлор-2-фтораніліно)-7-метокси-6-({1-[2(піперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназоліну і 4-(3-хлор-2,4-дифтораніліно)-7-метокси-6-({1-[2-(4метилпіперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназоліну; або їх фармацевтично прийнятної солі. 32. Похідне хіназоліну відповідно до пункту 1, яке являє собою 4-(3-хлор-2-фтораніліно)-7-метокси-6{[1-(N-метилкарбамоїлметил)піперидин-4 7 83252 іл]окси}хіназолін або його фармацевтично прийнятну сіль. 33. Похідне хіназоліну відповідно до пункту 1, яке являє собою 4-(3-хлор-2,4-дифтораніліно)-7метокси-6-{[1-(N-метилкарбамоїлметил)піперидин4-іл]окси}хіназолін або його фармацевтично прийнятну сіль. 34. Похідне хіназоліну відповідно до пункту 1, яке являє собою 4-(3-хлор-2-фтораніліно)-7-метокси-6{[1-(N-[2-(піролідин-1іл)етил]карбамоїлметил)піперидин-4іл]окси}хіназолін або його фармацевтично прийнятну сіль. 35. Похідне хіназоліну відповідно до пункту 1, яке являє собою 4-(3-хлор-2-фтораніліно)-7-метокси-6({1-[2-(4-(метилпіперазин-1-іл)-2оксоетил]піперидин-4-іл}окси)хіназолін або його фармацевтично прийнятну сіль. 36. Похідне хіназоліну відповідно до пункту 1, яке являє собою 4-(3-хлор-2-фтораніліно)-7-метокси-6({1-[2-(піперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназолін або його фармацевтично прийнятну сіль. 37. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому сполуку формули II: (R5) n n HN HO R1 N N X1 , II у якій R , X , R й n мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, піддають взаємодії зі сполукою формули III: O (CH2) m N Lg 2 N R 1 1 5 8 (R5 ) n n HN HN O R1 N N X1 , IV у якій R , X , R й n мають значення, вказані для формули І, за винятком того, що будь-яка функціональна група, при необхідності, захищена, зі сполукою формули V або V': O Lg (CH2)m' O N R3 R2 N , V' ,V R3 де R2 й R3 мають значення, вказані у пункті 1, і m' являє собою 0, 1, 2 або 3, за умови, що він не дорівнює 0, якщо R2 являє собою водень, і Lg являє собою групу, яка витісняється. 40. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому з похідного хіназоліну формули І або його фармацевтично прийнятної солі видаляють захисну групу. 41. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому сполуку формули II, як визначено в пункті 37, піддають взаємодії зі сполукою формули III, як визначено в пункті 37, за винятком того, що Lg являє собою ОН, в умовах Міцунобу. 42. Спосіб одержання похідного хіназоліну відповідно до пункту 1 формули І, у якій R1-X1 являє собою гідроксигрупу, у якому похідне хіназоліну формули І, у якій R1-X1 являє собою С1-С6алкоксигрупу; розщеплюють. 43. Спосіб одержання похідного хіназоліну відповідно до пункту 1 формули І, у якій X1 являє собою О й R1 не являє собою водень, у якому сполуку формули VI: 1 1 5 (R5 ) R3 , III у якій R2, R3 й m мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена й Lg являє собою групу, яка витісняється, де взаємодію сприятливо здійснюють у присутності підходящої основи. 38. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому замісник модифікують в або замісник вводять в інше похідне хіназоліну формули І або його фармацевтично прийнятну сіль, як визначено вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена. 39. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому сполуки формули IV: HN O (CH2 )m R2 n N O N N R3 HO N , VI у якій R2, R3, R5, m й n мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, піддають взаємодії зі сполукою формули R1-Lg, де R1 має будь-яке зі значень, вказаних у пункті 1, крім водню, і за винятком того, що будь-яка функціональна група, при необхідності, захищена й Lg являє собою групу, яку витісняють. 44. Спосіб одержання похідного хіназоліну відповідно до пункту 1 формули І, у якій R1 містить С1-С6алкокси або заміщену С1-С6-алкоксигрупу або С1С6-алкіламіно або заміщену С1-С6-алкіламіногрупу, у якому похідне хіназоліну формули І, у якій R1 9 83252 містить гідроксигрупу або первинну або вторинну аміногрупу, якщо це є прийнятним, алкілують. 45. Спосіб одержання похідного хіназоліну відповідно до пункту 1 формули І, у якій R1 заміщений групою Т, де Т вибрана із С1-С6-алкіламіно, ді-[С1С6-алкіл]аміно, С2-С6-алканоїламіно, С1-С6алкілтіо, С1-С6-алкілсульфінілу й С 1-С6алкілсульфонілу, у якому сполуку формули VII: (R5 ) n HN O (CH2 )m R2 n N O N N R3 Lg R1' N X1 , VII у якій R2, R3, R5, X1, n й m мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, R 1’ являє собою групу R1, як визначено в пункті 1, за винятком того, що будь-яка група Т замінена Lg, і Lg являє собою групу, яка витісняється (наприклад, хлор або бром), піддають взаємодії зі сполукою формули ТН, де Т має значення, вказані вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена. 46. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому сполуку формули VIII: Lg O (CH 2)m R2 N O N N R3 1 R1 2 3 X1 N (R 5) n HN O (CH2)m N O N HO R1 N X1 ,X у якій m являє собою 1, 2 або 3 й R1, X1, R5 і n мають значення, вказані вище в пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, піддають сполученню з первинним або вторинним аміном формули R2NHR3, де R2 й R3 мають значення, вказані в пункті 1. 48. Спосіб одержання похідного хіназоліну відповідно до пункту 1, у якому сполуку формули IV, як визначено вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена, піддають взаємодії зі сполукою формули V": O O (CH2) m-1 H R2 N R3 , V'' використовуючи методику відновного амінування. 49. Спосіб одержання похідного хіназоліну відповідно до пункту 1 формули І, у якій R3 являє собою С2-С6-алкіл, заміщений біля атома вуглецю аміно, С1-С6-алкіламіно, ді-С1-С6-алкіламіно, або насичене 5- або 6-членне гетероциклічне кільце, яке містить NR8, де R8 має значення, вказані в пункті 1, у якому сполуку формули XX: (R 5) , VIII n 1 у якій R , R , R , X і m мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена й Lg являє собою групу, яка витісняється, як визначено вище, піддають взаємодії з аніліном формули IX: (R5) n n H2N 10 , IX у якій R5 й n мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, і де взаємодію сприятливо здійснюють у присутності підходящої кислоти. 47. Спосіб одержання похідного хіназоліну відповідно до пункту 1 формули І, у якій m являє собою 1, 2 або 3, у якому сполуку формули X: HN O R2 N R 3a (CH2)m N O R1 X1 N N , XX у якій R3a являє собою Lg-С2-С6-алкіл, де Lg являє собою групу, яка витісняється, і де R1, R2, X1, R5, m й n мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, піддають взаємодії з аміаком або з підходящим первинним або вторинним аміном. 50. Фармацевтична композиція, яка містить похідне хіназоліну формули І або його фармацевтично прийнятну сіль, як визначено в будь-якому з пунктів 1-36, у сполученні з фармацевтично прийнятним розріджувачем або носієм. 51. Похідне хіназоліну формули І, як визначено в будь-якому з пунктів 1-36, або його фармацевтично прийнятна сіль для застосування як лікарський засіб. 52. Застосування похідного хіназоліну формули І або його фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-36, для приготування лікарського засобу для застосування для 11 83252 одержання антипроліферативної дії в теплокровної тварини. 53. Спосіб забезпечення антипроліферативної дії в теплокровної тварини, яка потребує такого лікування, який включає введення вказаній тварині похідного хіназоліну формули І або його фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-36. 54. Сполука формули VI: (R 5) n 12 у якій R1, R2, R3, X1, і m мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена й Lg являє собою групу, яка витісняється, як визначено вище, або її сіль. 57. Сполука формули X: (R5 ) HN O (CH2 )m O R2 (CH2)m N N O R3 N R1 N , VI N HO O N HO HN у якій R2, R3, R5, m й n мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, або її сіль. 55. Сполука формули VII: (R 5) у якій m являє собою 1, 2 або 3 й R1, X1, R5 i n мають значення, вказані вище в пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, або її сіль. 58. Сполука формули XX: (R 5) R2 N R3 N R1' Lg R2 O N у якій R2, R3, R5, X1, n й m мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, R 1’ являє собою групу R1, як визначено у пункті 1, за винятком того, що будь-яка група Т замінена Lg, і Lg являє собою групу, яка витісняється (наприклад, хлор або бром), або її сіль. 56. Сполука формули VIII: Lg O R2 (CH2) m N R3 N O R1 X1 N N N R 3a , VII N X1 n n HN (CH2)m ,X N X1 HN O O n , VIII Винахід стосується певних нових похідних хіназоліну або їх фармацевтично прийнятних солей, які мають протипухлинну дію, і, отже, є корисними в способах лікування людини або тварини. Винахід також стосується способів одержання вказаних похідних хіназоліну, фармацевтичних композицій, які їх містять, і їх застосування в способах лікування, наприклад, для приготування лікарських засобів для застосування для профілактики або лікування солідних пухлин у теплокровної тварини, такої як людина. У багатьох сучасних підходах до лікування захворювань, які виникають внаслідок атипової регуляції клітинної проліферації, таких як псоріаз і злоякісне новоутворення, придатними є сполуки, які інгібують синтез ДНК і клітинну проліферацію. У (CH2)m N O R1 X1 N N , XX у якій R3a являє собою Lg-C2-C6-алкіл, де Lg являє собою групу, яка витісняється, і де R1, R2, X1, R5, m й n мають будь-яке зі значень, вказаних у пункті 1, за винятком того, що будь-яка функціональна група, при необхідності, захищена, або її сіль. 59. Застосування похідного хіназолину формули І або його фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-36, для приготування лікарського засобу для застосування при лікуванні злоякісного новоутворення. 60. Застосування похідного хіназоліну формули І або його фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-36, для приготування лікарського засобу для застосування при лікуванні пухлини. цей час сполуки, які застосовуються для такого лікування, звичайно є токсичними для клітин, однак їх посилена дія на клітини, які швидко діляться, такі як пухлинні клітини, може бути корисною. Також зараз розвиваються альтернативні підходи до таких цитотоксичних протипухлинних засобів, наприклад, селективні інгібітори метаболічних шляхів передачі сигналів у клітинах. Ці типи інгібіторів, імовірно, мають підвищену вибірковість по відношенню до пухлинних клітин, і тому меншу ймовірність виникнення небажаних побічних дій при лікуванні. Еукаріотичні клітини постійно реагують на різноманітні позаклітинні сигнали, завдяки чому здійснюється обмін інформацією між клітинами в організмі. Ці сигнали регулюють різноманітні 13 фізіологічні реакції-відповіді клітин, включаючи проліферацію, диференціацію, апоптоз і рухливість. Позаклітинні сигнали являють собою різноманітні розчинні фактори, включаючи фактори росту, а також паракринні й ендокринні фактори. Шляхом зв'язування зі специфічними трансмембранними рецепторами ці ліганди інтегрують позаклітинний сигнал у метаболічні шляхи внутрішньоклітинної передачі сигналу, у такий спосіб сигнал передається через плазматичну мембрану й забезпечується можливість окремій клітині реагувати на такі позаклітинні сигнали. У багатьох таких способах передачі сигналів використовується оборотний процес фосфорилування білків, які залучені в активування цих різних реакцій-відповідей клітин. Фосфорилований стан білків-мішеней регулюється специфічними кіназами й фосфатазами, які відповідають за регулювання активності біля третини всіх білків, які кодуються геномом ссавців. Оскільки фосфорилування являє собою важливий регуляторний механізм у передачі сигналів, отже, не буде несподіваним той факт, що порушення цих метаболічних внутрішньоклітинних шляхів передачі сигналів приводить до атипового росту клітин і диференціації, і в такий спосіб сприяють трансформації клітин [див. огляд Cohen й ін., Curr Opin Chem Віоі, 1999,3,459-465]. Добре відомо, що багато тирозинкіназ піддані мутаціям, при цьому утворюються конститутивно активні форми та/або їх експресія приводить до трансформації різних клітин людини. Ці мутовані й понадекспресовані форми кіназ у великій кількості виявлені в пухлинах людини [див. огляд Kolibaba й ін., Biochimica et Biophysica Acta, 1997, 133, F217F248]. Оскільки тирозинкінази відіграють вирішальну роль у проліферації й диференціації різних тканин, основна увага при розробці нових підходів до лікування злоякісних новоутворень звертається на ці ферменти. Сімейство цих ферментів поділяється на дві групи - рецепторні й нерецепторні тирозинкінази, наприклад, сімейство EGF рецепторних тирозинкіназ і сімейство SRC тирозинкіназ відповідно. У результаті численних досліджень, включаючи розшифровку геному людини, у геномі людини було ідентифіковано близько 90 тирозинкіназ, 58 з яких рецепторного типу й 32 - нерецепторного типу. їх можна підрозділити на 20 підсімейств тирозинкіназ рецепторного типу й 10 підсімейств тирозинкіназ нерецепторного типу [Robinson й ін., Опсодепе, 2000,19, 5548-5557]. Тирозинкінази рецепторного типу відіграють надзвичайно важливу роль у передачі сигналів, які викликають мітоз, що ініціює поділ клітин. Вони являють собою більші глікопротеїнові молекули, які розташовані в плазматичній мембрані клітин і мають позаклітинний зв'язувальний домен для специфічних лігандів (таких як, епідермальний фактор росту (EGF) для рецептора EGF). Зв'язування ліганду приводить до активування ферментативної активності рецепторної кінази, яка є внутрішньоклітинною частиною рецептора. Цей активний фермент фосфорилює ключові залишки тирозину в білках-мішенях, що проводить до передачі проліферативних сигналів через клітинну плазматичну мембрану. 83252 14 Відомо, що erbB сімейство рецепторних тирозинкіназ, що включає EGFR, erbB2, еrbВ3 й еrbВ4, найчастіше приймає участь в стимулюванні проліферації й виживання пухлинних клітин [див. огляд Оlауіоуе й ін., ЕМВО J., 2000, 19, 3159]. Одним з можливих механізмів є понадекспресія рецептора на рівні білка, звичайно в результаті ампліфікації гена. Це спостерігається при багатьох поширених видах злоякісних новоутворень у людини [див. огляд Кіарреr й ін., Adv. Cancer Res., 2000, 77, 25], таких як рак молочної залози [Sainsbury й ін., Brit. J. Cancer, 1988, 58, 458; Guerin й ін., Oncogene Res.. 1988, 3, 21; Slamon й ін., Science, 1989, 244, 707; Klijn й ін.. Breast Cancer Res. Treat.. 1994, 29, 73 й огляд Salomon й ін., Crit. Rev. Oncol. Hematol.. 1995, Г9, 183], недрібноклітинному раку легені (NSCLC), включаючи аденокарциноми [Cerny й ін., Brit. J. Cancer. 1986, 54, 265; Reubi й ін., Int. J. Cancer. 1990, 45, 269; Rusch й ін., Cancer Research. 1993, 53, 2379; Brabender hul, Clin. Cancer Res.. 2001, 7,1850], a також при інших типах раку легені [Hendler й ін., Cancer Cells. 1989, 7, 347; Ohsaki й ін., Oncol. Rep.. 2000, 7, 603], раку сечового міхура [Neal й ін., Lancet. 1985, 366; Chow й ін., Clin. Cancer Res., 2001, 7,1957, Zhau й ін., Моl Carcinog., 3, 254], раку стравоходу [Mukaida й ін., Cancer, 1991, 68, 142], раку шлунково-кишкового тракту, такому як рак товстої кишки, прямої кишки або рак шлунка [Bolen й ін., Oncogene Res., 1987,1, 149; Kapitanovic й ін., Gastroenterology. 2000, 112, 1103; Ross й ін., Cancer Invest., 2001,19, 554], раку передміхурової залози [Visakorpi й ін., Histochem. J., 1992, 24, 481; Kumar й ін,., 2000, 32, 73; Scher й ін., J. Natl. Cancer Inst., 2000, 92, 1866], лейкозі [Konaka й ін., Cell, 1984, 37, 1035, Martin-Subero й ін., Cancer Genet Cvtogenet. 2001, 127, 174], раку яєчників [Hellstrom й ін., Cancer Res., 2001, 61, 2420], раку голови й шиї [Shiga й ін., Head Neck, 2000,22, 599] або раку підшлункової залози [Ovotny й ін., Neoplasma, 2001, 48, 188]. Оскільки велика кількість тканин пухлини людини досліджуються щодо експресії в них сімейства erbB рецепторних тирозинкіназ, очікують, що в майбутньому знання про їх широке поширення й значимість будуть більш докладними. У результаті порушення регуляції одного або більше цих рецепторів, як вважають, більшість пухлин стають клінічно більш агресивними, що корелює з погіршенням прогнозу для пацієнта [Brabender й ін., Clin. Cancer Res., 2001, 7, 1850; Ross й ін., Cancer Investigation. 2001, 19, 554, Yu й ін., Bioessays. 2000, 22,7, 673]. Додатково до цих клінічних відомостей, дані доклінічних досліджень свідчать про те, що сімейство erbB рецепторних тирозинкіназ приймає участь в трансформації клітин. Про це свідчать дані про те, що багато ліній пухлинних клітин понадекспресують один або декілька рецепторів erbB і що EGFR або erbB2 при трансфектуванні ними непухлинних клітин мають здатність трансформувати ці клітини. Надалі ця здатність до злоякісної трансформації була підтверджена на трансгенних мишах, у яких понадекспресія erbB2 приводить до мимовільного розвитку пухлини молочних залоз. Крім того, численні до 15 клінічні дослідження свідчать про те, що антипроліферативна дія може індукуватися шляхом блокування активності одного або більше erbB за допомогою невеликих молекул інгібіторів, домінантних негативних або інгібітор них антитіл [див. огляд Mendelsohn й ін., Oncogene, 2000,19, 6550]. Таким чином, відомо, що інгібітори цих рецепторних тирозинкіназ є ефективними як вибірні інгібітори проліферації ракових клітин ссавців [Yaish й ін. Science, 1988, 242, 933, Kolibaba й ін., Biochimica et Biophysica Acta, 1997,133, F217-F248; Al-Obeidi й ін., 2000, Oncogene, 19, 5690-5701; Mendelsohn й ін., 2000, Oncogene, 19, 6550-6565]. Додатково до цих даних доклінічних досліджень, при використанні інгібіторних антитіл до EGFR й erbB2 (с-225 і трастузумаб відповідно) було виявлено, що вони є придатними в клініці для лікування вибраних солідних пухлин [див. огляд Mendelsohn й ін., 2000, Oncogene, 19, 6550-6565]. Також досліджувалася ампліфікація та/або активність представників рецепторних тирозинкіназ ErbB-типу й було виявлено, що вони беруть участь у різних незлоякісних порушеннях проліферації, таких як псоріаз [Ben-Bassat, Curr. Pharm. Des., 2000, 6, 933; Elder й ін., Science, 1989, 243, 811], доброякісна гіперплазія передміхурової залози (ВРН) [Kumar й ін., bit. Urol. Nephrol., 2000, 32, 73], атеросклероз і рестеноз [Bokemeyer й ін., Kidney Int., 2000, 58, 549]. Таким чином, вважають, що інгібітори рецепторних тирозинкіназ erbB-типу будуть придатними для лікування цих та інших незлоякісних порушень надмірної клітинної проліферації. У заявці на європейський патент ЕР 566 226 описані певні 4-анілінохіназоліни, які є інгібіторами рецепторної тирозинкінази. У міжнародних заявках на патент WO 96/33977, WO 96/33978, WO 96/33979, WO 96/33980, WO 96/33981, WO 97/30034 й WO 97/38994 описані певні похідні хіназоліну, які мають аніліновий замісник в 4-му положенні й замісник в 6-му та/або 7-му положенні, які мають інгібуючу дію по відношенню до рецепторної тирозинкінази. У заявці на європейський патент ЕР 837 063 описані арил-заміщені похідні 4-амінохіназоліну, які мають частину, яка містить арильну або гетероарильну групу в 6-му або 7-му положенні хіназолінового кільця. Вказані сполуки придатні для лікування гіперпроліферативних захворювань. У міжнародних заявках на патент WO 97/30035 й WO 98/13354 описані певні 4-анілінохіназоліни, заміщені в 7-му положенні, які є інгібіторами рецепторної тирозинкінази фактора росту ендотелію судин. У заявці WO 00/55141 описані сполуки 6,7заміщеного 4-анілінохіназолшу, у яких замісники в 6-му та/або 7-му положенні несуть складноефірну зв'язувальну частину (RO-CO). У заявці WO 00/56720 описані сполуки 6,7діалкокси-4-анілінохіназоліну для лікування злоякісного новоутворення або алергічних реакцій. У заявці WO 02/41882 описані сполуки 4анілінохіназоліну, заміщені в 6-му та/або 7-му по 83252 16 ложенні заміщеної піролідиніл-алкокси або піперидиніл-алкокси групою. У заявці WO 03/082290 описано, що певні сполуки 6,7-заміщеного 4-анілінохіназоліну мають інгібуючу дію по відношенню до рецепторної тирозинкінази. Конкретним прикладом такої сполуки є 6-{[1-(N-метилкарбамоїлметил)піперидин-4іл]окси}-4-(3-хлор-4-фтораніліно)-7-метоксихіназолін. Ніде в попередньому рівні техніки не було описано сполук 4-(2,3-дигалогенанілшо)хіназоліну або 4-(2,3,4-тригалогенаніліно)хіназоліну. У міжнародній заявці PCT/GB 03/01306, яка знаходиться в процесі одночасного розгляду, описано, що певні похідні 4-(2,3дигалогенаніліно)хіназоліну мають ефективну протипухлинну дію, і зокрема, є селективними по відношенню до EGFR. Конкретним прикладом такої сполуки є 6-{[1-(карбамоїлметил)піперидин-4іл]метокси}-4-(3-хлор-2-фтораніліно)-7-метоксихіназолін. Однак зараз заявниками несподівано було виявлено, що введення замісника в карбамоїльну групу, і, необов'язково, введення додаткового замісника в анілінову групу, забезпечує селективну групу сполук з підвищеною активністю, які мають подвійну дію, являючись переважно активними як інгібітори erbB2 кінази, у той же час зберігаючи інгібуючу дію по відношенню до EGF, що робить їх надзвичайно придатними в клініці для лікування пухлин, у які залучені обидві ці кінази. Не обмежуючись теорією, що сполуки, розкриті в даному винаході, мають фармакологічну дію тільки за допомогою впливу на окремий біологічний процес, вважають, що сполуки забезпечують протипухлинну дію шляхом інгібування двох рецепторних тирозинкіназ erbB-сімейства, які залучені в поетапну передачу сигналів, які приводять до проліферації пухлинних клітин. Особливо, вважають, що сполуки згідно із даним винаходом забезпечують протипухлинну дію шляхом інгібування EGFR та/або erbB2 рецепторних тирозинкіназ. Відповідно до першого варіанта здійснення винаходу, забезпечується похідне хіназоліну формули І: у якій n являє собою 0, 1,2 або 3, кожен R5 незалежно вибирають із галогену, ціано, нітро, гідрокси, аміно, карбокси, сульфамоїлу, трифторметилу, С1-С6-алкілу, С2-С8-алкенілу, С2С8-алкінілу, С1-С6-алкокси, С2-С6-алкенілокси, С2С6-алкінілокси, С1-С6-алкілтіо, С1-С6алкілсульфінілу, С1-С6-алкілсульфонілу, С1-С6алкіламіно, ди-[С1-С6-алкіл]аміно, С1-С6алкоксикарбонілу, N-C1-С6-алкілсульфамоїлу, і N,N-ди-[С1-С6-алкіл]сульфамоїлу, C(O)NR6R7, де R6 й R7 незалежно вибирають із водню, необов'яз 17 ково заміщеного C1-С6-алкілу, необов'язково заміщеного С3-С8-циклоалкілу або необов'язково заміщеного арилу, або R6 й R7 разом з атомом азоту, до якого вони приєднані, утворюють необов'язково заміщене гетероциклічне кільце, яке може містити додаткові гетероатоми; X1 являє собою простий зв'язок або О; R1 вибирають із водню й С1-С6-алкілу, де С1С6-алкільна група необов'язково заміщена одним або декількома замісниками, які можуть бути однаковими або різними, вибраними з гідрокси й галогену, і/або замісник, вибраний з аміно, нітро, карбокси, ціано, галогену, С1-С6-алкокси, гідрокси-С1С6-алкокси, С2-С8-алкенілу, С2-С8-алкінілу, С1-С6алкілтіо, С1-С6-алкілсульфінілу, С1-С6алкілсульфонілу, С1-С6-алкіламіно, ди-[С1-С6алкіл]аміно, карбамоїлу, N-C1-С6-алкілкарбамоїлу, Ν,Ν ди-[С1-С6-алкіл]карбамоїлу, С2-С6-алканоїлу, С2-С6-алканоїлокси, С2-С6-алканоїламіно, N-C1-С6алкіл-С2-С6-алканоїламіно, С1-С6алкоксикарбонілу, сульфамоїлу, N-C1-С6алкілсульфамоїлу, N,N-ди-[С1-С6алкіл]сульфамоїлу, С1-С6-алкансульфоніламіно й N-С1-С6-алкіл-С1-С6-алкансульфоніл аміно; m являє собою 0,1,2 або 3; R2 являє собою водень або С1-С6-алкіл; і R3 являє собою С1-С6-алкіл, С2-С6-алкеніл, С2С6-алкініл або С1-С6-алкокси, кожний з яких необов'язково може бути заміщений біля атома вуглецю С1-С6-алкокси, аміно, С1-С6-алкіламіно, ди-С1-С6алкіламіно, або групу S(О)sС1-С6-алкіл, де s являє собою 0, 1 або 2, або насичене 5-ти або 6-ти членне гетероциклічне кільце, яке необов'язково містить додаткові гетероатоми, вибрані з кисню, сірки або NR8, де R8 являє собою водень, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, С1-С6-алкілсульфоніл або С1-С6-алкілкарбоніл; або R2 й R3 разом з атомом азоту, до якого вони приєднані, утворюють насичене 5-ти або 6-ти членне гетероциклічне кільце, яке необов'язково містить додаткові гетероатоми, вибрані з кисню, S, SO або S(O)2 або NR8, де R8 має значення, вказані вище; за умови, що похідне хіназоліну не представляє собою: 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(диметиламіно)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбоніл]-піперидин-4-іл-окси}хіназолін; 4-[(3-хлор-4-фторфенїл)аміно]-6-{1[(диметиламіно)карбоніл]-піперидин-4-іл-окси}хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(діетиламіно)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(піперидин-1-іл)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 83252 18 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(піролідин1-іл)карбоніл]-піперидин-4-іл-окси}-7-метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(4-метилпіперазин-1-іл)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбоніл]-піперидин-4-іл-окси}-7етокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбоніл]-піперидин-4-іл-окси}-7(2-метокси-етокси)-хіназолін; 4-[(3-етиніл-феніл)аміно]-6-{1-[(морфолін-4іл)карбоніл]-піперидин-4-іл-окси}-7-метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(етиламіно)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(ізопропіламіно)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(диметиламіно)карбонілметил]-піперидин-4-ілокси}-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбонілметил]-піперидин-4-ілокси}-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(диметиламіно)карбонілметил]-піперидин-4-ілокси}-7-мехокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбонілметил]-піперидин-4-ілокси}-7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(метиламіно)карбонілметил]-піперидин-4-іл-окси}7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(диметиламіно)карбонілметил]-піперидин-4-ілокси}-7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(піролідин1-іл)карбонілметил]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбонілметил]-піперидин-4-ілокси}-7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(метиламіно)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(2метоксіетил)аміно)карбоніл]-піперидин-4-іл-окси}7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(N-мелилN-2-метоксіетил)аміно)карбоніл]-піперидин-4-ілокси}-7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(3метоксипропіл)аміно)карбоніл]-піперидин-4-ілокси}-7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(N-метилN-3-метоксипропіл)аміно)карбоніл]-піперидин-4-ілокси}-7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбонілетил]-піперидин-4-ілокси}-7-метокси-хіназолін; або 19 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбонілпропіл]-піперидин-4-ілокси}-7-метокси-хіназолін; або його фармацевтично прийнятна сіль. У даному винаході загальний термін "алкіл" включає як прямоланцюгові алкільні групи, так й алкільні групи з розгалуженим ланцюгом, такі як пропіл, ізопропіл і трет-бутут, і С3-С7-циклоалкільні групи, такі як циклопропіл, циклобутил, циклопентил, циклогексил і циклогептил. Однак, щодо конкретних алкільних груп, таких як "пропіл", маються на увазі тільки групи із прямим ланцюгом, і щодо конкретних алкільних груп з розгалуженим ланцюгом, таких "ізопропіл", маються на увазі тільки групи з розгалуженим ланцюгом, і щодо конкретних циклоалкільних груп, таких як "циклопентил", маються на увазі тільки 5-членні кільцеві структури. Аналогічна умова застосовується й до інших загальних термінів, наприклад, С1-С6-алкокси включає метокси, етокси, циклопропілокси й циклопентилокси, С1-С6-алкіламіно включає метиламіно, етиламіно, циклобутиламіно й циклогексиламіно, і ди[(С1-С6алкіл]аміно включає диметиламіно, діетиламіно, N-циклобутил-N-метиламіно й Nциклогексил-N-етиламіно. Термін "арил" стосується ароматичних вуглеводневих кілець, таких як феніл або нафтил. Терміни "гетероциклічний" або "гетероцикліл" включають кільцеві структури, які можуть бути моноабо біциклічними й містять від 3 до 15 атомів, принаймні один із яких, і підходяще від 1 до 4 з яких, являє собою гетероатом, такий як кисень, сірка або азот. Кільця можуть бути ароматичними, неароматичними або частково ароматичними в тому розумінні, що одне кільце конденсованої кільцевої системи може бути ароматичним, а інше - неароматичним. Переважними прикладами таких кільцевих систем є фурил, бензофураніл, тетрагідрофурил, хроманіл, тієніл, бензтієніл, піридил, піперидиніл, хіноліл, 1,2,3,4-тетрагідрохінолініл, ізохіноліл, 1,2,3,4-тетрагідроізохінолініл, піразиніл, піперазиніл, піримідиніл, піридазиніл, хіноксалініл, хіназолініл, циннолініл, піроліл, піролідиніл, індоліл, індолініл, імідазоліл, бензимідазоліл, піразоліл, індазоліл, оксазоліл, бензоксазоліл, ізоксазоліл, тіазоліл, бензотіазоліл, ізотіазоліл, морфолініл, 4Н-1,4-бензоксазиніл, 4Н-1,4бензотіазиніл, 1,2,3-триазоліл, 1,2,4-триазоліл, оксадіазоліл, фуразаніл, тіадіазоліл, тетразоліл, дибензофураніл, дибензтієніл оксираніл, оксетаніл, азетидиніл, тетрагідропіраніл, оксепаніл, оксазепаніл, тетрагідро-1,4-тіазиніл, 1,1діоксотетрагідро-1,4-тіазиніл, гомопіперидиніл, гомопіперазиніл, дигідропіридиніл, тетрагідропіридиніл, дигідропіримідиніл, тетрагідропіримідиніл, тетрагідротієніл, тетрагідротіопіраніл або тіоморфолініл. 83252 20 Переважними прикладами гетероциклічних груп є тетрагідропіраніл, тетрагідрофураніл або NC1-С6-алкілпіролідин або N-C1-С6-піперидин. Якщо кільця містять атоми азоту, то вони можуть нести атом водню, або замісник, такий як С1С6-алкільна група, якщо це необхідно для задоволення вимог до утворення хімічних зв'язків атомом азоту, або вони можуть бути зв'язані з іншою структурою за допомогою атома азоту. Атом азоту в гетероциклічній групі може бути окислений, утворюючи відповідний N-оксид. Як правило, сполуки мають сприятливі фізичні властивості, такими як висока розчинність, зберігаючи при цьому високу антипроліферативну активність. Крім того, багато сполук згідно із даним винаходом є неактивними або виявляють тільки незначну активність в hERG дослідженні. Також мається на увазі, що оскільки певні сполуки формули І, визначені вище, можуть існувати в оптично активні або рацемічних формах внаслідок наявності одного або декількох асиметрично заміщених атомів вуглецю та/або атомів сірки, і, отже, можуть існувати в таких формах, і можуть бути виділені в енантіомерно чистому виді, у вигляді суміші діастереоізомерів або у вигляді рацемату. Даний винахід охоплює будь-яку рацемічну, оптично-активну, енантіомерно чисту форму, суміш діастереоізомерів, стереоізомерну форму сполуки формули І або їх суміші, які мають вищевказану активність. Оптично активні форми можна синтезувати за допомогою стандартних методик органічної хімії, які добре відомі в даній галузі, наприклад, шляхом здійснення синтезу з оптично активних вихідних речовин, або шляхом розділення рацемічної форми. Подібним чином, визначення вищевказаної активності може здійснюватися за допомогою стандартних лабораторних методик, які будуть наведені надалі. Винахід стосується всіх таутомерних форм сполук формули І, які мають антипроліферативну активність. Також мається на увазі, що певні сполуки формули І можуть існувати у вигляді сольватів, а також у вигляді несольватованих форм, таких як, наприклад, гідратовані форми. Мається на увазі, що винахід охоплює всі такі сольватовані форми, які мають антипроліферативну активністю. Також мається на увазі, що певні сполуки формули І можуть мати поліморфізм і що винахід охоплює всі такі форми, які мають антипроліферативну активністю. Підходящими значеннями для загальних радикалів, вказаних вище, є значення, наведені нижче. Підходящими значеннями для будь-яких груп R1, R2, R3 або R5, як визначено вище або надалі в даному винаході, є: 21 83252 22 23 Також мається на увазі, що якщо R1 являє собою С1-С6-алкільну групу, заміщену, наприклад аміногрупою, з утворенням, наприклад, 2аміноетильної групи, то в цьому випадку С1-С6алкільна група приєднана до групи X1 (або до хіназолінового кільця, якщо X1 являє собою простий зв'язок). Якщо в даному винаході наведене посилання на С1-С4-алкільну групу, то маються на увазі такі групи, які належать до алкільних груп, які містять аж до 4-х атомів вуглецю. Для фахівця в даній галузі техніки є очевидним, що типовими прикладами таких груп є перераховані вище групи для С1-С6-алкілу, які містять аж до 4-х атомів вуглецю, такі як метил, етил, пропіл, ізопропіл, бутил і третбутил. Подібним чином, при згадуванні С1-С3алкільної групи мають на увазі алкільні групи, які містять аж до 3-х атомів вуглецю, такі як метил, етил, пропіл й ізопропіл. Аналогічна умова застосовується й до інших груп, перерахованих вище, таких як C1-С4-алкокси, С2-С4-алкеніл, С2-С4алкініл і С2-С4-алканоїл. У сполуці формули І атоми водню знаходяться в 2-му, 5-му й 8-му положеннях хіназолінового кільця Підходяща фармацевтично прийнятна сіль сполуки формули І являє собою, наприклад, кислото-адитивну сіль сполуки формули І, наприклад, кислото-адитивну сіль із неорганічною або органічною кислотою, такою як соляна, бромистоводнева, сірчана, трифтороцтова, лимонна або малеїнова кислота; або, наприклад, сіль сполуки формули І, яка є достатньо кислотною, наприклад, сіль лужного металу або лужноземельного металу, таку як кальцієва або магнієва сіль, або сіль амонію, або сіль із органічною основою, такою як метиламін, диметиламін, триметиламін, піперидин, морфолін або трис-(2-гідроксіетил)амін. Переважним значенням для n є 1,2 або 3, підходяще 2 або 3. Підходяще кожну групу R5 незалежно вибирають із галогену, трифторметилу, С1-С6-алкілу, С2С8-алкенілу, С2-С8-алкінілу або групи C(O)NR6R7, де R6 й R7 мають значення, вказані вище. Зокрема, кожну групу R5 незалежно вибирають із галогену, такого як хлор або фтор. Переважними замісниками для груп R6 й R7, якщо вони не являють собою атом водню, є галоген, нітро, ціано, гідрокси, аміно, карбокси, карбамоїльна, сульфамоїльна, трифторметильна, С2-С8алкенільна, С2-С8-алкінільна, С1-С6-алкокси, С2-С6алкенілокси, С2-С6-алкінілокси, С1-С6-алкілтіо, С1С6-алкілсульфінільна, С1-С6-алкілсульфонільна, С1-С6-алкіламіно, ди-[С1-С6-алкіл]аміно, С1-С6алкоксикарбонільна, N-C1-С6-алкіл карбамоїльна, 83252 24 N,N-ди-[С1-С6-алкіл] карбамоїльна, N-C1-С6-алкіл сульфамоїльна, N,N-ди-[С1-С6алкіл]сульфамоїльна, С3-C8-циклоалкільна, арильна або гетероциклічна групи. Переважними прикладами арильних замісників для R6 або R7 є феніл або нафтил, особливо феніл. Переважними прикладами гетероциклічних замісників для R6 або R7 є 5-ти або 6-ти членні гетероциклічні кільця, такі як фурил, тетрагідрофурил, тієніл, піридил, піперидиніл, піразиніл, піперазиніл, піримідиніл, піридазиніл, піроліл, піролідиніл, імідазоліл, піразоліл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, морфолініл, 1,2,3триазоліл, 1,2,4-триазоліл, оксадіазоліл, фуразаніл, тіадіазоліл або тетразоліл. Якщо R6 й R7 разом з атомом азоту, до якого вони приєднані, утворюють необов'язково заміщене гетероциклічне кільце, то воно являє собою, наприклад, 5-ти або 6-ти членне кільце, яке може бути насиченим або ненасиченим. Переважними прикладами є піперидиніл, піролідиніл, морфолініл або тіоморфоліно. Альтернативно, R6 й R7 разом утворюють С3-С6-алкенільну групу. Гетероциклічні кільця, утворені R6 й R7 разом з атомом азоту, до якого вони приєднані, можуть бути заміщені будь-якою групою, вказаною вище для R6 й R7. Крім того, ці кільця можуть бути заміщені однією або декількома С1-С6-алкільними групами, які самі необов'язково можуть бути заміщені однією або декількома групами, вибраними з галогену, нітро, ціано, гідрокси, аміно, карбокси, карбамоїлу, сульфамоїлу, трифторметилу, С2-С8алкенілу, С2-С8-алкінілу, С1-С6-алкокси, С2-С6алкенілокси, С2-С6-алкінілокси, С1-С6-алкілтіо, С1С6-алкілсульфінілу, С1-С6-алкілсульфонілу, С1-С6алкіламіно, ди-[С1-С6-алкіл]аміно, С1-С6алкоксикарбонілу, N-С1-С6-алкілкарбамоїлу, N,Nди-[С1-С6-алкіл]карбамоїлу, N-C1-С6алкілсульфамоїлу або N,N-ди-[С1-С6алкіл]сульфамоїлу. Характерною групою замісників для R6 або R7, коли вони відрізняються від атома водню, є ціано, гідрокси, С2-С8-алкенільна, С2-С8-алкінільна, С1-С6алкокси, С1-С6-алкілтіо, С1-С6-алкіламіно, арильна, така як фенільна, або гетероциклічна групи, така як фурил, і додатково, якщо R6 й R7 разом з атомом азоту, до якого вони приєднані, утворюють кільце, то С1-С6-алкільні групи, такі як метил. Якщо η являє собою 1, 2 або 3, то одна група R5 підходяще розташована в орто-(2-) положенні на бензольному кільці. Якщо η являє собою 1, 2 або 3, то одна група R5 підходяще розташована в мета-(3-) положенні на бензольному кільці. 25 Таким чином, якщо n являє собою 1, то група R5 підходяще розташована в орто- (2-) або мета(3-) положенні на бензольному кільці. В одному варіанті здійснення винаходу, якщо η являє собою 2, то перша група R5 підходяще розташована в мета-положенні, а друга група R5 підходяще розташована в орто- або пара- положенні на бензольному кільці, і, отже, кільце має замісника в 2-му й 3-му або 3-му й 4-му положеннях на бензольному кільці. В іншому варіанті здійснення винаходу, якщо n являє собою 2 або 3, то перша група R5 підходяще розташована в орто-положенні, а друга група R5 підходяще розташована в мета-положенні й, необов'язково (якщо n являє собою 3), третя група R5 підходяще розташована в пара-положенні на бензольному кільці. Отже, якщо n являє собою 2, то кільце підходяще мають замісники в 2-му й 3-му положенням на бензольному кільці, а якщо n являє собою 3, то кільце підходяще має замісники в 2-му, 3-му й 4-му положеннях на бензольному кільці. Заявниками несподівано було виявлено, що похідні хіназоліну, які мають замісники (наприклад, галогенові замісники) в 2-му й 3-му положенням або в 2-му, 3-му й 4-му положеннях на бензольному кільці, у порівнянні з похідними хіназоліну, які мають замісники в 3-му й 4-му положеннях на бензольному кільці, утворюють сполуки з підвищеною активністю, як і сполуки, що мають посилену активність по відношенню до erbB2 та/або EGFR (переважно erbB2) рецепторних тирозинкіназ у дослідженнях на клітинах. Вважають, що похідні хіназоліну, які мають замісники (наприклад, галогенові замісники) в 2-му й 3-му положеннях або в 2-му, 3-му й 4-му положеннях на бензольному кільці, також будуть мати підвищену активність по відношенню до erbB2 та/або EGFR (переважно erbB2) рецепторних тирозикіназ в умовах in vivo. Підходяще, якщо η являє собою 2 або 3, то кожна група R5 являє собою однаковий або різний атом галогену, такий як хлор або фтор. Підходяще, принаймні одна група R5 являє собою фтор, при цьому принаймні один атом фтору переважно розташований в орто- (2-) положенні на бензольному кільці. Підходяще, якщо n являє собою 2, то кожна група R5 являє собою однаковий або різний атом галогену. Зокрема, одна група R5 являє собою хлор і він переважно розташований у мета- (3)положенні на бензольному кільці, до якого він приєднаний, а інша група R5 являє собою фтор, який переважно розташований в орто- (2-) або пара-(4-) (переважно в орто- (2-)) положенні на бензольному кільці. Підходяще, якщо η являє собою 3, то кожна група R5 являє собою однаковий або різний атом галогену. Зокрема, одна група R5 являє собою хлор і він переважно розташований у мета- (3)положенні на бензольному кільці, до якого він приєднаний, а дві інші групи R5 кожна являє собою атом фтору, які переважно розташовані відповідно в орто- (2-) і пара- (4)- положенні на бензольному кільці. 83252 26 Отже, переважними прикладами групи підформули (і): у формулі І є групи підформули (іі): у якій (а) один з R1 або R12 являє собою водень, а інший являє собою галоген, такий як хлор або фтор, і переважно фтор, a R11 являє собою галоген, такий як хлор або фтор, і переважно хлор, або (б) R10 являє собою галоген, такий як хлор або фтор, і переважно фтор, R11 являє собою галоген, такий як хлор або фтор, і переважно хлор, а R12 являє собою водень або галоген, такий як хлор або фтор, і переважно фтор, або (в) R10 являє собою фтор, R11 являє собою хлор, a R12 являє собою водень або фтор. Зокрема, R10, R11 й R12 мають значення, вказані в (б) і/або (в). В одному варіанті здійснення винаходу, якщо n являє собою 2, то кожна група R5 являє собою однаковий або різний атом галогену (такий, як фтор та/або хлор) і перша група R5 знаходиться в орто-положенні й другій групі R5 знаходиться в мета-положенні на бензольному кільці, то в цьому випадку (і) якщо m являє собою 0, 1, 2 або 3, то R не представляє собою С1-С6-алкіл й (іі) якщо m являє собою 0, то R2 й R3, разом з атомом азоту, до якого вони приєднані, не утворюють насичене 5-ти або 6-ти членне гетероциклічне кільце, яке необов'язково містить додаткові гетероатоми, вибрані з кисню, S, SO або S(O)2 або NR8, де R8 являє собою водень, С1-С4-алкіл або С1-С4алкілсульфоніл. Підходяще X1 являє собою кисень. Зокрема, R1 вибирають із водню, С1-С6-алкілу й С1-С6-алкокси-С1-С6-алкілу, де будь-яка С1-С6алкільна група в R1 необов'язково має один або декілька (підходяще 1 або 2) гідрокси або галогенових замісників. Більш переважно, R1 вибирають із С1-С6-алкілу, переважно із С1-С4-алкілу й ще більш переважно із С1-С2-алкілу. Наприклад, R1 може являти собою метил. Наприклад, R1-X1- вибирають із метокси, етокси, ізопропілокси, циклопропілметокси, 2гідроксіетокси, 2-фторетокси, 2-метоксіетокси, 2,2дифторетокси, 2,2,2-трифторетокси або 3гідрокси-3-метилбутокси. Зокрема R1-X- вибирають із водню, С1-С4алкокси й С1-С4-алкокси-С1-С4-алкокси. Наприклад, R1-X- вибирають із водню, метокси, етокси й 2-метоксіетокси. Переважним прикладом групи R1X1- є метокси. Підходяще m являє собою 1, 2 або 3. Переважно m являє собою 0 або 1 (більш переважно 1). 27 Якщо R2 й R3 разом з атомом азоту, до якого вони приєднані, утворюють насичене гетероциклічне кільце, яке необов'язково містить додаткові гетероатоми, то гетероциклічне кільце переважно є 6-ти членним. Якщо R2 й R3 разом з атомом азоту, до якого вони приєднані, утворюють насичене 5-ти або 6-ти (переважно 6-ти) членне гетероциклічне кільце, яке необов'язково містить додаткові гетероатоми, то воно підходяще містить додаткові гетероатоми, вибрані з О й NR8, де R8 має значення, вказані для формули І. Якщо R2 й R3 разом з атомом азоту, до якого вони приєднані, утворюють насичене 5-ти або 6-ти членне гетероциклічне кільце, яке необов'язково містить додаткові гетероатоми, то воно підходяще містить піролідинове кільце, морфолінове кільце, піперидинове кільце або піперазинове кільце, яке необов'язково заміщене на доступному атомі азоту групою R8, як визначено вище. Зокрема, гетероциклічне кільце містить морфолінове кільце або піперазинове кільце, яке необов'язково заміщене на доступному атомі азоту групою R8, як визначено для формули І. Переважними прикладами групи R8 є С1-С3алкіл, такий як метил; С1-С3-алкілсульфоніл, такий як метилсульфоніл; С1-С3-алкілкарбоніл, такий як ацетил; С2-С4-алкеніл, такий як аліл; або С2-С4алкініл, такий як пропаргіл. Особливо, R8 являє собою С1-С3-алкільну групу, таку як метил. Таким чином, якщо R2 разом з R3 разом з атомом азоту, до якого вони приєднані, утворюють насичене 5-ти або 6-ти членне гетероциклічне кільце, яке необов'язково містить додаткові гетероатоми, то воно підходяще містить морфолінове кільце. Іншими прикладами є піролідин, піперидин, піперазин або N-метилпіперазин, переважно піперазин або N-метилпіперазин. Переважно R2 являє собою водень або С1-С3алкіл. Особливо, R2 являє собою водень або метил (переважно водень). Підходящими замісниками для R3 є С1-С6алкокси, С1-С6-алкіламіно, ди-С1-С6-алкіламіно або насичене 5-ти або 6-ти членне гетероциклічне кільце, яке необов'язково містить додаткові гетероатоми, вибрані з кисню, сірки або NR8, де R8 має значення, вказані вище. Особливо підходящими замісниками для R3 є С1-С3-алкокси, такий як метокси, аміно, С1-С3алкіламіно, ди-С1-С3-алкіламіно, такий як диметиламіно, С1-С3-алкілсульфоніл, піролідинове кільце або піперазинове кільце, яке може містити на доступному атомі азоту С1-С3-алкільну групу, таку як метил, С2-С4-алкенільну групу, таку як вініл, С2-С4алкінільну групу, таку як пропаргіл, С1-С5алкілсульфонільну групу, таку як метилсульфоніл, або С1-С6-алкілкарбонільну групу, таку як ацетил. Підходяще R3 являє собою С1-С6-алкіл, особливо С1-С3-алкіл, такий як метил або етил. Підходяще R2 являє собою водень й R3 являє собою С1С6-алкіл, особливо С1-С3-алкіл, такий як метил або етил. Переважними прикладами сполук формули І є сполуки формули ІА: 83252 28 у якій R2, R3 й m мають значення, вказані вище, R10, R11 й R12 мають значення, вказані для підформули (іі) вище, і R13 вибирають із водню, метокси, етокси й 2-метоксіетокси, і особливо метокси. Для запобігання будь-якої невизначеності, якщо сполуки формули І визначаються як сполуки формули ІА, то вони не являють собою такі похідні хіназоліну: 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(диметиламіно)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбоніл]-піперидин-4-іл-окси}хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(диметиламіно)карбоніл]-піперидин-4-іл-окси}хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(діетиламіно)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(піперидин-1-іл)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(піролідин1-іл)карбоніл]-піперидин-4-іл-окси}-7-метоксихіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(4-метилпіперазин-1-іл)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбоніл]-піперидин-4-іл-окси}-7етокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбоніл]-піперидин-4-іл-окси}-7(2-метокси-етокси)-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(етиламіно)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(ізопротламіно)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(диметиламіно)карбонілметил]-піперидин-4-ілокси}-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбонілметил]-піперидин-4-ілокси}-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(диметиламіно)карбонілметил]-піперидин-4-ілокси}-7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбонілметил]-піперидин-4-ілокси}-7-метокси-хіназолін; 29 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(метиламіно)карбонілметил]-піперидин-4-іл-окси} 7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(диметиламіно)карбонілметил]-піперидин-4-ілокси}-7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(піролідин1-іл)карбонілметил]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбонілметил]-піперидин-4-ілокси}-7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(метиламіно)карбоніл]-піперидин-4-іл-окси}-7метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(2метоксіетил)аміно)карбоніл]-піперидин-4-іл-окси}7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(N-метилN-2-метоксіетил)аміно)карбоніл]-піперидин-4-ілокси}-7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(3метоксипропіл)аміно)карбоніл]-піперидин-4-ілокси} -7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1-[(N-метилN-3-метоксипропіл)аміно)карбоніл]-піперидин-4-ілокси}-7-метокси-хіназолін; 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбонілетил]-піперидин-4-ілокси}-7-метокси-хіназолін; або 4-[(3-хлор-4-фторфеніл)аміно]-6-{1[(морфолін-4-іл)карбонілпропіл]-піперидин-4-ілокси}-7-метокси-хіназолін; або їх фармацевтично прийнятну сіль. Іншими переважними прикладами сполук формули І є сполуки формул IB й lС: у які R2, R3 й m мають значення, вказані вище, і R вибирають із водню, метокси, етокси й 2метоксіетокси, і особливо метокси. Іншими переважними прикладами сполук формули І є сполуки формули ID: 13 83252 30 у якій: R5a й R5b незалежно вибирають із галогену (наприклад, фтору та/або хлору); X1 являє собою простий зв'язок або О; R1 вибирають із водню й С1-С6-алкілу, де С1С6-алкільна група необов'язково заміщена одним або декількома замісниками, які можуть бути однаковими або різними, вибраними з гідрокси й галогену, і/або замісник, вибраний з аміно, нітро, карбокси, ціано, галогену, С1-С6-алкокси, гідрокси-С1С6-алкокси, С2-С8-алкенілу, С2-С8-алкінілу, С1-С6алкілтіо, С1-С6-алкілсульфінілу, С1-С6алкілсульфонілу, С1-С6-алкіламіно, ди-[С1-С6алкіл]аміно, карбамоїлу, N-C1-С6-алкілкарбамоїлу, Ν,Ν ди-[С1-С6-алкіл]карбамоїлу, С2-С6-алканоїлу, С2-С6-алканоїлокси, С2-С6-алканоїламіно, N-C1-С6алкіл-С2-С6-алканоїламіно, С1-С6алкоксикарбонілу, сульфамоїлу, N-C1-С6алкілсульфамоїлу, N,N-ди-[С1-С6алкіл]сульфамоїлу, С1-С6-алкансульфоніламіно й N-С1-С6-алкіл-С1-С6-алкансульфоніламіно; m являє собою 0, 1, 2 або 3; R2 являє собою водень або С1-С6-алкіл; і R3 являє собою С1-С6-алкіл, де С1-С6-алкільна група необов'язково заміщена біля атома вуглецю С1-С6-алкокси, аміно, С1-С6-алкіламіно, ди-С1-С6алкіламіно, або групу S(О)sС1-С6-алкіл, де s являє собою 0, 1 або 2, або насичене 5-ти або 6-ти членне гетероциклічне кільце, яке необов'язково містить додаткові гетероатоми, вибрані з кисню, сірки або NR8, де R8 являє собою водень, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, С1-С6-алкілсульфоніл або С1-С6-алкілкарбоніл; або якщо m являє собою 0, то R2 й R3 разом з атомом азоту, до якого вони приєднані, утворюють насичене 5-ти або 6-ти членне гетероциклічне кільце, яке необов'язково містить додаткові гетероатоми, вибрані з кисню, S, SO або S(O)2 або NR8, де R8 являє собою водень, С1-С4-алкіл або С1-С4алкілсульфоніл; або його фармацевтично прийнятна сіль. В одному варіанті здійснення сполук формули ID, група R3 являє собою C1-С6-алкіл, переважно незаміщений С1-С6-алкіл. Наприклад, група R3 може являти собою метил або етил, переважно метил. В іншому варіанті здійснення сполук формули ID, m являє собою 0 й R2 й R3 разом з атомом азоту, до якого вони приєднані, утворюють насичене 5-ти або 6-ти членне гетероциклічне кільце, яке необов'язково містить додаткові гетероатоми, вибрані з кисню, S, SO або S(O)2 або NR8, де R8 являє собою водень, С1-С4-алкіл або С1-С4алкілсульфоніл. Наприклад, R2 разом з R3 разом з атомом азоту, до якого вони приєднані, можуть утворювати морфолінове кільце. Іншими прикладами є піролідин, піперидин, піперазин або N 31 метилпіперазин, переважно піперазин або Νметилпіперазин. Для фахівця в даній галузі техніки очевидно, що переважними новими сполуками за винаходом є ті сполуки формули І (включаючи І A, IB, lС й ID), у яких, якщо спеціально не вказано інакше, кожний з R1, R2, R3, R5, X1, m й n має будь-яке зі значень, вказаних вище. Прикладами похідних хіназоліну формули І є одна або декілька наступних сполук: 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїлметил)піперидин-4-іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(N,Nдиметилкарбамоїлметил)піперидин-4-іл]окси}-7метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(морфолін-4-ілкарбонілметил)піперидин-4-іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(піролідин-1-ілкарбоніл)піперидин-4іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїл)піперидин-4-іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(N-(2диметиламіноетил)карбамоїл)піперидин-4-іл]окси}7-метоксихіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(N,Nдиметилкарбамоїл)піперидин-4-іл]окси}-7-метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(морфолін-4-ілкарбоніл)піперидин-4-іл]окси} хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-[2пiролідин-1-ілетил]карбамоїл)піперидин-4іл]окси}хіназолін; 4-(3-хлор-2,4-дифтораніліно)-7-метокси-6-{[1(N-метилкарбамоїлметил)піперидин-4іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(Nетилкарбамоїлметил)піперидин-4-іл]окси}-7метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-[2(піролідин-1-іл)етил]карбамоїлметил)піперидин-4іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-(2метоксіетил)карбамоїлметил)піперидин-4іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(N-(2диметиламіноетил)карбамоїлметил)піперидин-4іл]окси}-7-метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-({1-[2-(4метилпіперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-({1-[2(піперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназолін; і 4-(3-хлор-2,4-дифтораніліно)-7-метокси-6-({1[2-(4-метилпіперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназолін; або їх фармацевтично прийнятну сіль. Переважними прикладами похідних хіназоліну формули І є одна або декілька наступних сполук: 83252 32 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїлметил)піперидин-4-іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїл)піперидин-4-іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(морфолін-4-ілкарбоніл)піперидин-4-іл]окси} хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-[2піролідин-1-ілетил]карбамоїл)піперидин-4-іл]окси} хіназолін; 4-(3-хлор-2,4-дифтораніліно)-7-метокси-6-{[1(N-метилкарбамоїлметил)піперидин-4-іл]окси} хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(Nетилкарбамоїлметил)піперидин-4-іл]окси}-7метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-[2(піролідин-1-іл)етил]карбамоїлметил)піперидин-4іл]окси} хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-(2метоксіетил)карбамоїлметил)піперидин-4іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(N-(2диметиламіноетил)карбамоїлметил)піперидин-4іл]окси}-7-метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-({1-[2-(4метилпіперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-({1-[2(піперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназолін; і 4-(3-хлор-2,4-дифтораніліно)-7-метокси-6-({1[2-(4-метилпіперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназолін; або їх фармацевтично прийнятну сіль. Переважна група прикладів похідних хіназоліну формули І включає одну або декілька наступних сполук: 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїлметил)піперидин-4іл]окси}хіназолін; і 4-(3-хлор-2,4-дифтораніліно)-7-метокси-6-{[1(N-метилкарбамоїлметил)піперидин-4іл]окси}хіназолін; або їх фармацевтично прийнятну сіль. Переважна група прикладів похідних хіназоліну формули IB включає одну або декілька наступних сполук: 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїлметил)піперидин-4-іл]-окси} хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(N,Nдиметилкарбамоїлметил)піперидин-4-іл]окси}-7метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(морфолін-4-ілкарбонілметил)піперидин-4-іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(піролідин-1-ілкарбоніл)піперидин-4-іл]окси} хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїл)піперидин-4-іл] окси}хіназолін; 33 4-(3-хлор-2-фтораніліно)-6-{[1-(N-(2диметиламіноетил)карбамоїл)піперидин-4-іл] окси}-7-метоксихіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(N,Nдиметилкарбамоїл)піперидин-4-іл]окси}-7-метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(морфолін-4-ілкарбоніл)піперидин-4-іл]окси} хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-[2піролідин-1-ілетил]карбамоїл)піперидин-4іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(Nетилкарбамоїлметил)піперидин-4-іл]окси}-7метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-[2(піролідин-1-іл)етил]карбамоїлметил)піперидин-4іл]окси} хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-(2метоксіетил)карбамоїлметил)піперидин-4іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(N-(2диметиламіноетил)карбамоїлметил)піперидин-4іл]окси}-7-метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-({1-[2-(4метилтперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназолін; і 4-(3-хлор-2-фтораніліно)-7-метокси-6-({1-[2(піперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хїназолін; або їх фармацевтично прийнятну сіль. Переважна група прикладів похідних хіназоліну формули lС включає одну або декілька наступних сполук: 4-(3-хлор-2,4-дифтораніліно)-7-метокси-6-{[1(N-метилкарбамоїлметил)піперидин-4іл]окси}хіназолін; і 4-(3-хлор-2,4-дифтораніліно)-7-метокси-6-({1[2-(4-метилпіперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназолін; або їх фармацевтично прийнятну сіль. Переважна група прикладів похідних хіназоліну формули ID включає одну або декілька наступних сполук: 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїлметил)піперидин-4-іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(N,Nдиметилкарбамоїлметил)піперидин-4-іл]окси}-7метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(піролідин-1-ілкарбоніл)піперидин-4іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїл)піперидин-4-іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(N-(2диметиламіноетил)карбамоїл)піперидин-4-іл]окси}7-метоксихіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(N,Nдиметилкарбамоїл)піперидин-4-іл]окси}-7-метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(морфолін-4-ілкарбоніл)піперидин-4-іл]окси} хіназолін; 83252 34 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Ν-[2піролідин-1-ілетил]карбамоїл)піперидин-4іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(Nетилкарбамоїлметил)піперидин-4-іл]окси}-7метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-[2(піролідин-1-іл)етил]карбамоїлметил)піперидин-4іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-(2метоксіетил)карбамоїлметил)піперидин-4іл]окси}хіназолін; і 4-(3-хлор-2-фтораніліно)-6-{[1-(N-(2диметиламіноетил)карбамоїлметил)піперидин-4іл]окси}-7-метоксихіназолін; або їх фармацевтично прийнятну сіль. Інша переважна група прикладів похідних хіназоліну формули ID включає одну або декілька наступних сполук: 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїлметил)піперидин-4-іл]-окси} хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(N,Nдиметилкарбамоїлметил)піперидин-4-іл]окси}-7метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(піролідин-1-ілкарбоніл)піперидин-4-іл]окси} хіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїл)піперидин-4-іл]окси}хіназолін; 4-(3-хлор-2-фтораніліно)-6-{[1-(N,Nдиметилкарбамоїл)піперидин-4-іл]окси}-7-метоксихіназолін; 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1(морфолін-4-ілкарбоніл)піперидин-4-іл]окси} хіназолін; і 4-(3-хлор-2-фтораніліно)-6-{[1-(Nетилкарбамоїлметил)піперидин-4-іл]окси}-7метоксихіназолін; або їх фармацевтично прийнятну сіль. Переважним прикладом сполуки формули І є 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(Nметилкарбамоїлметил)піперидин-4іл]окси}хіназолін або його фармацевтично прийнятна сіль. Іншим переважним прикладом сполуки формули І є 4-(3-хлор-2,4-дифтораніліно)-7-метокси-6-{[1(N-метилкарбамоїлметил)піперидин-4іл]окси}хіназолін або його фармацевтично прийнятна сіль. Іншим переважним прикладом сполуки формули І є 4-(3-хлор-2-фтораніліно)-7-метокси-6-{[1-(N-[2(піролідин-1-іл)етил]карбамоїлметил) піперидин-4іл]окси}хіназолін або його фармацевтично прийнятна сіль. Іншим переважним прикладом сполуки формули І є 4-(3-хлор-2-фтораніліно)-7-метокси-6-({1[2-(4-метилпіперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназолін або його фармацевтично прийнятна сіль. Іншим переважним прикладом сполуки формули І є 35 4-(3-хлор-2-фтораніліно)-7-метокси-6-({1-[2(піперазин-1-іл)-2-оксоетил]піперидин-4іл}окси)хіназолін або його фармацевтично прийнятна сіль. Синтез похідних хіназоліну формули І Відповідно до подальшого варіанта здійснення, даний винахід забезпечує спосіб одержання похідного хіназоліну формули І або його фармацевтично прийнятної солі. Також слід врахувати, що при здійсненні деяких наступних способів певні замісники можуть мати потребу в захисті для запобігання небажаних реакцій. Фахівцеві в даній галузі хімії є очевидним, коли такий захист необхідний, а також відомі способи введення таких захисних груп й їх наступного видалення. Приклади захисних груп наведені в багатьох посібниках з даної тематики, наприклад, 'Захисні групи в органічному синтезі' [Protective Groups in Organic Synthesis] Theodora Green (опубл.: John Wiley & Sons). Захисні групи можуть бути вилучені за допомогою будь-якого підходящого способу, описаного в літературі або відомого фахівцеві в даній галузі хімії, якщо він є підходящим для видалення даної захисної групи, ці способи вибирають таким чином, щоб видалення захисної групи супроводжувалося мінімальним пошкодження груп, які знаходяться в іншій частині молекули. Таким чином, якщо реагуючі речовини містять, наприклад, такі групи, як аміногрупа, карбоксильна група або гідроксильна група, може бути бажаним захищати таку групу в деяких реакціях, описаних у даному винаході. Підходящою захисною групою для аміногрупи або алкіламіногрупи є, наприклад, ацильна група, наприклад, алканоїльна група, така як ацетил, алкоксикарбонільна група, наприклад, метоксикарбонільна, етоксикарбонільна або mpemбутоксикарбонільна група, арилметоксикарбонільна група, наприклад, бензилоксикарбоніл, або ароїльна група, наприклад, бензоїл. Умови зняття захисту для вищезгаданих захисних груп головним чином залежать від вибору захисної групи. Так, наприклад, ацильна група, така як алканоїльна або алкоксикарбонільна група або ароїльна група можуть бути відщеплені, наприклад, шляхом гідролізу з підходящою основою, такою як гідроксид лужного металу, наприклад, гідроксид літію або натрію. Альтернативно, ацильна група, така як mpem-бутоксикарбонільна група, може бути відщеплена, наприклад, шляхом обробки підходящою кислотою, такою як соляна, сірчана або фосфорна кислота або трифтороцтова кислота, і арилметоксикарбонільна група, така як бензилоксикарбонільна група, може бути відщеплена, наприклад, шляхом гідрування в присутності каталізатора, такого як паладій на вугіллі, або шляхом обробки кислотою Л'юіса, наприклад, трис(трифторацетатом) бору. Підходящою альтернативною захисною групою для первинної аміногрупи є, наприклад, фталоїльна група, яка може бути відщеплена шляхом обробки алкіламіном, наприклад, диметиламінопропіламіном, або гідразином. 83252 36 Підходящою захисною групою для гідроксильної групи є, наприклад, ацильна група, наприклад, алканоїльна група, така як ацетил, ароїльна група, наприклад, бензоїл, або арилметильна група, наприклад, бензил. Умови зняття захисту для вищезгаданих захисних груп головним чином будуть залежати від вибору захисної групи. Так, наприклад, ацильна група, така як алканоїльна або ароїльна група, може бути відщеплена, наприклад, за допомогою гідролізу з підходящою основою, такою як гідроксид лужного металу, наприклад гідроксид літію, натрію або аміак. Альтернативно, арилметильна група, така як бензильна група, може бути відщеплена, наприклад, шляхом гідрування в присутності каталізатора, такого як паладій на вугіллі. Підходящою захисною групою для карбоксильної групи є, наприклад, естерифікована група, наприклад, метильна або етильна група, яка може бути відщеплена, наприклад, шляхом гідролізу з основою, такою як гідроксид натрію, або, наприклад, трет-бутпльпа, група, яка може бути відщеплена, наприклад, шляхом обробки кислотою, наприклад, органічною кислотою, такою як трифтороцтова кислота, або, наприклад, бензильна група, яка може бути відщеплена, наприклад, шляхом гідрування в присутності каталізатора, такого як паладій на вугіллі. Також як захисна група можуть застосовуватися полімери. Захисні групи можуть бути відщеплені на будьякій підходящій стадії синтезу за допомогою звичайних методик, добре відомих в галузі хімії. Похідне хіназоліну формули І або його фармацевтично прийнятна сіль можуть бути отримані за допомогою будь-якого відомого способу, який є придатним для одержання споріднених хімічних сполук. Такі способи, коли застосовуються для одержання похідного хіназоліну формули І, або його фармацевтично прийнятної солі, являють собою додатковий варіант здійснення винаходу й ілюструються наступними характерними прикладами. Необхідні вихідні речовини можуть бути отримані за допомогою стандартних методик органічної хімії (див., наприклад, Advanced Organic Chemistry (Wiley-Interscience), Jerry March). Одержання такі вихідних матеріалів описано в супровідних прикладах, які не обмежують винахід. Альтернативно, необхідні вихідні речовини одержують за допомогою методик, аналогічних до наведених, які є звичайними для середнього фахівця в даній галузі органічної хімії. Відомості про одержання необхідних вихідних матеріалів або родинних сполук (які можуть бути адаптовані для одержання необхідних вихідних матеріалів) також можна знайти в наступних патентах й опублікованих патентних заявках, зміст подібних процесів яких включено в дану заявку шляхом посилання: WO 94/27965, WO 95/03283, WO 96/33977, WO 96/33978, WO 96/33979, WO 96/33980, WO 96/33981, WO 97/30034, WO 97/38994, WO 01/66099, US 5,252,586, EP 520 722, EP 566 226, EP 602 851 й ЕР 635 507. Даний винахід також забезпечує, що похідні хіназоліну формули І або їх фармацевтичні солі можуть бути отримані за допомогою способу (а) 37 (н), описаного нижче (де змінювані групи мають вищевказані значення, якщо спеціально не вказано інакше): Спосіб (а) Шляхом взаємодії сполуки формули II: у якій R1, X1, R5 й n має будь-яке зі значень, вказаних у даному описі вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена, зі сполукою формули III: у якій R2, R3 й m має будь-яке зі значень, вказаних у даному описі вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена й Lg являє собою групу, яка витісняється, де взаємодію сприятливо здійснюють у присутності підходящої основи, і потім будь-яку наявну захисну групу видаляють за допомогою звичайних способів. Підходяща група Lg, яка витісняється, являє собою, наприклад, галоген, алкансульфонілокси або арилсульфонілокси групу, наприклад хлор, бром, метансульфонілокси, 4нітробензолсульфонілокси або толуол-4сульфонілокси групу (підходяще метансульфонілокси, 4-нітробензолсульфонілокси або толуол-4сульфонілокси групу). Реакцію сприятливо здійснюють у присутності основи. Підходящою основою є, наприклад, органічна амінова основа, така так, наприклад, диiзопропілетиламін, піридин, 2,6-лутидин, колідин, 4-диметиламінопіридин, триетиламін, Nметилморфолін або діазабіцикло[5.4.0]ундец-7-ен, або, наприклад, карбонат або гідроксид лужного або лужноземельного металу, наприклад, карбонат натрію, карбонат калію, карбонат цезію, карбонат кальцію, гідроксид натрію або гідроксид калію. Альтернативно, такою основою є, наприклад, гідрид лужного металу, наприклад гідрид натрію, амід лужного металу або лужноземельного металу, наприклад, амід натрію або біс(триметилсиліл)амід натрію, або достатньо лужний галогенід лужного металу, наприклад фторид цезію або йодид натрію. Реакцію підходяще здійснюють у присутності інертного розчинника або 83252 38 розріджувача, наприклад, спирту або складного ефіру, такого як метанол, етанол, 2-пропанол або етилацетат, галогенованого розчинника, такого як метиленхлорид, трихлорметан або тетрахлорид вуглецю, простого ефіру, такого як тетрагідрофуран або 1,4-діоксан, ароматичного вуглеводневого розчинника, такого як толуол, або (підходяще) полярного апротонного розчинника, такого як Ν,Νдиметилформамід, Ν,Ν-диметилацетамід, №метилпіролідин-2-он або диметилсульфоксид. Реакцію підходяще здійснюють при температурі в інтервалі, наприклад, 10 - 150°С (або точці кипіння розчинника), підходяще в інтервалі 20 - 90°С. Переважна підходяща основа являє собою фторид цезію. Цю реакцію підходяще здійснюють в інертному полярному апротонному розчиннику, такому як Ν,Ν-диметилацетамід або Ν,Νдиметилформамід. Реакцію підходяще здійснюють при температурі від 25 до 85°С. Спосіб (б) Шляхом модифікації замісника в або введення замісника в інше похідне хіназоліну формули І або його фармацевтично прийнятну сіль, як визначено вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена, і потім будь-яку наявну захисну групу видаляють за допомогою звичайних способів. Способи перетворення замісників в інші замісники відомі з рівня техніки. Наприклад, алкілтіогрупа може бути окислена до алкілсульфінільної або алкілсульфонільної групи, ціаногрупа відновлена до аміногрупи, нітрогрупа відновлена до аміногрупи, гідрокси група алкілована до метокси групи, бромвмісна група перетворена в алкілтіогрупу, аміногрупа може бути ацетильована, утворюючи алканоїламіногрупу (наприклад, шляхом взаємодії з підходящим хлорангідридом кислоти або ангідридом кислоти) або алканоїлокси група може бути гідролізована до гідрокси групи (наприклад ацетилоксіацетильна група може бути перетворена в гідроксіацетильну групу) Підходяще, одна група R1 може бути перетворена в іншу групу R1 як заключна стадія при одержанні сполуки формули І. Спосіб (в) Шляхом взаємодії сполуки формули IV: у якій R1, X1, R5 й n мають значення, вказані для формули І, за винятком того, що будь-яка функціональна група, при необхідності, захищена, зі сполукою формули V або V¢: 39 де R2 й R3 мають значення, вказані вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена й m' являє собою 0, 1, 2 або 3, за умови, що він не дорівнює 0, якщо R2 являє собою водень, і Lg являє собою групу, яка витісняється (наприклад, галоген, такий як хлор або бром). Реакції, описані вище, сприятливо здійснюють у присутності підходящої основи (такої як основа, описана вище для способу (а), наприклад карбонат калію, триетиламін, 4-диметиламінопіридин або ди-ізопропілетиламін) і підходяще у присутності інертного розчинника або розріджувача (наприклад, інертних розчинників і розріджувачів, описаних у способі (а), таких як N-метилпіролідин-2-он, ацетонітрил, Ν,Ν-диметилацетамід, метанол, етанол або метиленхлорид). Якщо m' являє собою 1, 2 або 3, то взаємодію підходяще здійснюють у присутності джерела йодиду, такого як йодид натрію або йодид калію, і при температурі в інтервалі, наприклад, від 10 до 150°С (або при температурі кипіння розчинника), підходяще в інтервалі від 20 до 90°С. Наприклад, якщо m являє собою 1, то взаємодію можна здійснювати, використовуючи триетиламін як підходящу основу, йодид калію як підходяще джерело йодиду й Ν,Ν-диметилацетамід як підходящий розчинник або розріджувача при температурі близько 80°С. Якщо m являє собою 0, то джерела йодиду не потрібно й звичайно температура взаємодії становить від 0°С до кімнатної температури. Взаємодія сполуки формули IV зі сполукою формули V придатна для одержання сполук, у яких R2 являє собою водень й m являє собою 0. Спосіб (г) Шляхом видалення захисної групи з похідного хіназоліну формули І або його фармацевтично прийнятної солі. Підходящі способи видалення захисних груп добре відомі й розглядалися в даному винаході. Наприклад, для одержання тих сполук формули І, у якій R1 містить первинну або вторинну аміногрупу, розщеплення відповідної сполуки формули І, у якій R1 містить первинну або вторинну аміногрупу. Підходящими захисними групами для аміногруп є, наприклад, будь-які захисні групи, описані вище для аміногруп. Підходящі способи відщеплення таких амінозахисних груп також описані вище. Зокрема, підходящою захисною групою є нижча алкоксикарбонільна група, така як третбутоксикарбонільна група, яка може бути відщеплена у звичайних умовах реакції, таких як каталізований кислотою гідроліз, наприклад у присутності трифтороцтової кислоти. Спосіб (д) Шляхом взаємодії сполуки формули II, як визначено, вище зі сполукою формули III, як визначено вище, за винятком того, що Lg являє собою ОН, в умовах Міцунобу, і потім будь-яку 83252 40 наявну захисну групу видаляють за допомогою звичайних способів. Підходящими умовами Міцунобу є, наприклад, реакція в присутності підходящого третинного фосфіну й ди-алкілазодикарбоксилату в органічному розчиннику, такому як ТГФ, або підходяще дихлорметану й при температурі в інтервалі 0°С - 60°С, але підходяще при температурі навколишнього середовища. Підходящим третинним фосфіном є, наприклад три-н-бутилфосфін або підходяще трифенілфосфін. Підходящим диалкілазодикарбоксилатом є, наприклад, діетилазодикарбоксилат (DEAD) або підходяще ди-третбутил азодикарбоксилат. Більш докладно реакція Міцунобу описана в Tet. Letts., 31, 699, (1990); [The Mitsunobu Reaction, D.L.Hughes, Organic Reactions, 1992, том 42, 335-656 й Progress in the Mitsunobu Reaction, D.L.Hughes, Organic Preparations and Procedures International, 1996, том 28, 127-164]. Спосіб (e) Для одержання тих сполук формули І, у якій R1-X1 являє собою гідрокси групу, шляхом розщеплення похідного хіназоліну формули І, у якій R1-X1 являє собою С1-С6-алкокси групу. Реакцію розщеплення підходяще можна здійснювати за допомогою будь-якої з методик, відомих для такого перетворення. Реакцію розщеплення сполуки формули І, у якій R1 являє собою С1-С6алкокси групу, можна здійснювати, наприклад, шляхом взаємодії похідного хіназоліну із С1-С6алкіл сульфідом лужного металу, таким як етантіолат натрію, або, наприклад, шляхом взаємодії з діарилфосфидом лужного металу, таким як дифенілфосфид літію. Альтернативно, реакцію розщеплення підходяще можна здійснювати, наприклад, шляхом взаємодії похідного хіназоліну із тригалогенідом бору або алюмінію, таким як трибромід бору, або шляхом взаємодії з органічною або неорганічною кислотою, наприклад, трифтороцтовою кислотою. Такі реакції підходяще здійснювати в присутності підходящого інертного розчинника або розріджувача, як визначено вище. Переважною реакцією розщеплення є взаємодія похідного хіназоліну формули І з гідрохлоридом піридину. Реакцію розщеплення підходяще здійснюють при температурі в інтервалі, наприклад, від 10 до 150°С, наприклад від 25 до 80°С. Спосіб (ж) Для одержання тих сполук формули І, у якій X1 являє собою О й R1 не представляє собою водень, шляхом взаємодії сполуки формули VI: у якій R2, R3, R5, m й n мають будь-яке зі значень, вказаних у даному описі вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена, зі сполукою формули R1-Lg, де R1 має будь-яке зі значень, вказаних вище, крім 41 водню, і за винятком того, що будь-яка функціональна група, при необхідності, захищена й Lg являє собою групу, яка витісняється, де взаємодію сприятливо здійснюють у присутності підходящої основи; і потім будь-яку наявну захисну групу видаляють за допомогою звичайних способів. Підходящі групи Lg, які витісняються, мають значення, вказані вище для способу (а), наприклад хлор або бром. Взаємодію підходяще здійснюють у присутності підходящої основи. Підходящими розчинниками, розріджувачами й основами є, наприклад, ті, які описані вище для способу (а). Альтернативно, якщо Lg являє собою гідрокси групу, то взаємодію можна здійснювати в умовах Міцунобу, як описано вище для способу (д). Спосіб (з) Для одержання тих сполук формули І, у якій R1 містить С1-С6-алкокси або заміщену С1С6-алкокси групу або С1-С6-алкіламіно або заміщену C1-С6-алкіламіно групу, алкілування, підходяще у присутності прийнятної основи, як визначено вище для способу (а), похідного хіназоліну формули І, у якій R1 містить гідрокси групу або первинну або вторинну аміногрупу, якщо це є прийнятним. Підходящий алкілувальний засіб являє собою, наприклад, будь-який засіб, відоме в даній галузі, для алкілування гідроксильної групи в алкоксигрупу або заміщену алкоксигрупу, або для алкілування аміногрупи в алкіламіногрупу або заміщену алкіламіногрупу, наприклад, алкіл- або заміщений алкілгалогенід, наприклад С1-С6-алкіл хлорид, бромід або йодид або заміщений С1-С6-алкіл хлорид, бромід або йодид, підходяще у присутності підходящої основи, як вказано вище, у підходящому інертному розчиннику або розріджувачі, як вказано вище, і при температурі в інтервалі, наприклад, 10 - 140°С, підходяще при температурі навколишнього середовища або приблизно при температурі навколишнього середовища. Аналогічна методика може застосовуватися для введення необов'язково заміщених С2-С6-алканоїлокси, С2С6-алканоїламіно й С1-С6-алкансульфоніламіно груп в R1. Підходяще для одержання тих сполук формули І, у якій R1 містить С1-С6-алкіламіно або заміщену С1-С6-алкіламіно групу, реакція відновного амінування може здійснюватися за допомогою формальдегіду або С2-С6-алканолальдегіду (наприклад, ацетальдегіду або пропіональдегіду). Наприклад, для одержання тих сполук формули І, у якій R1 містить N-метильну групу, відповідну сполуку, яка містить N-H групу, можна піддавати взаємодії з формальдегідом у присутності підходящого відновника. Підходящої відновником є, наприклад, гідридний відновник, наприклад, мурашина кислота, алюмінійгідрид лужного металу, такий як літійалюмінійгідрид, або, підходяще, борогідрид лужного металу, такий як борогідрид натрію, ціаноборогідрид натрію, триетилборогідрид натрію, триметоксиборогідрид натрію й триацетоксиборогідрид натрію. Реакцію, як правило, здійснюють у підходящому інертному розчиннику або розріджувачі, наприклад тетрагідрофурані й діетиловому ефірі для більш сильних відновників, таких 83252 42 як літійалюмінійгідрид, і, наприклад, метиленхлорид, або в протонному розчиннику, такому як метанол й етанол для менш сильних відновників, таких як триацетоксиборогідрид натрію й ціаноборогідрид натрію. Якщо відновником є мурашина кислота, то реакцію підходяще здійснюють за допомогою водного розчину мурашиної кислоти. Реакцію здійснюють при температурі в інтервалі, наприклад, 10 - 100°С, такій як 70 - 90°С або, підходяще, при температурі навколишнього середовища або приблизно при температурі навколишнього середовища. Підходяще, якщо відновником є мурашина кислота, то захисні групи, такі як трет-бутоксикарбоніл на групі NH для алкілування (наприклад, яка знаходиться внаслідок синтезу вихідної речовини) можуть бути відщеплені in-situ при реакції. Спосіб (і) Для одержання тих сполук формули І, у якій R1 заміщений групою Т, де Τ вибрана із С1С6-алкіламіно, ди-[С1-С6-алкіл]аміно, С2-С6алканоїламіно, С1-С6-алкілтіо, С1-С6алкілсульфінілу й С1-С6-алкілсульфонілу, взаємодію сполуки формули VII: у якій R2, R3, R5, X1, n й m має будь-яке зі значень, вказаних у даному описі вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена, R1 являє собою групу R1, як визначено у винаході, за винятком того, що будьяка група Τ замінена Lg, і Lg являє собою групу, яка витісняється (наприклад, хлор або бром, або мезилат) зі сполукою формули ТН, де Τ має значення, вказані вище, за винятком того, що будьяка функціональна група, при необхідності, захищена; і потім будь-яку наявну захисну групу видаляють за допомогою звичайних способів. Взаємодію сприятливо здійснюють у присутності підходящої основи. Реакцію сприятливо можна здійснювати в підходящому інертному розчиннику або розріджувачі. Підходящими основами, розчинниками й розріджувачами є, наприклад, ті, які описані для способу (а). Взаємодію підходяще проводити при температурі, наприклад, від 10 до 150°С, наприклад, від 30 до 60°С. Спосіб (к) Шляхом взаємодії сполуки формули VIII: у якій R1, R2, R3, X1, і m має будь-яке зі значень, вказаних у даному описі вище, за винятком 43 того, що будь-яка функціональна група, при необхідності, захищена й Lg являє собою групу, яка витісняється, як визначено вище, з аніліном формули IX: у якій R5 й n має будь-яке зі значень, вказаних у даному описі вище, за винятком того, що будьяка функціональна група, при необхідності, захищена, і де взаємодію сприятливо здійснюють у присутності підходящої кислоти, і потім будь-яку наявну захисну групу видаляють за допомогою звичайних способів. Підходящі групи, які витісняють, представлені Lg, мають значення, вказані вище, зокрема галоген, такий як хлор. Реакцію підходяще здійснюють у присутності підходящого інертного розчинника або розріджувача, наприклад, спирту або складного ефіру, такого як метанол, етанол, ізопропанол або етилацетат, галогенованого розчинника, такого як метиленхлорид, хлороформ або чотирихлористий вуглець, простого ефіру, такого як тетрагідрофуран або 1,4-діоксан, ароматичного розчинника, такого як толуол, або полярного апротонного розчинника, такого як Ν,Ν-диметилформамід, Ν,Νдиметилацетамід, N-метилпіролідин-2-он ацетонітрил або диметилсульфоксид. Взаємодію підходяще здійснюють при температурі в інтервалі, наприклад, від 10 до 250°С, сприятливо в інтервалі від 40 до 120°С або де розчинник або розріджувач використовують при температурі флегми. Підходяще, сполуку формули VIII піддають реакції зі сполукою формули IX у присутності протонного розчинника, такого як ізопропанол, сприятливо в присутності кислоти, наприклад, каталітичної кількості кислоти, в умовах, описаних вище. Підходящими кислотами є хлористоводневий газ у діетиловому ефірі або діоксані, і соляна кислота, наприклад 4М розчин хлористого водню діоксані. Альтернативно, цю реакцію підходяще можна здійснювати в апротонному розчиннику, такому як діоксан, або полярному апротонному розчиннику, такому як Ν,Ν-диметилацетамід або ацетонітрил, у присутності кислоти, наприклад хлористоводневого газу в діетиловому ефірі або діоксані, або соляної кислоти. Сполуку формули VIII, у якій Lg являє собою галоген, можна піддавати реакції зі сполукою формули IX при відсутності кислоти. У цій реакції витиснення галогенової групи Lg, яка вилучається, утворюється кислота HLg in-situ і реакція автокаталізується. Підходяще взаємодію здійснюють у прийнятному інертному органічному розчиннику, наприклад ізопропанолі, діоксані або Ν,Νдиметилацетаміді. Підходящі умови для цієї реакції є такими, як описано вище. 83252 44 Альтернативно, сполуку формули VIII можна піддавати взаємодії зі сполукою формули IX у присутності підходящої основи. Підходящими основами для цієї реакції є такі, як вказано вище для способу (а). Наприклад, підходящими основами є аміди лужноземельних металом, такі як біс(триметилсиліл)амід натрію. Цю реакцію сприятливо здійснювати в інертному розчиннику або розріджувачі, наприклад, тих, які вказані вище для цього способу (к); Спосіб (л) Для одержання тих сполук формули І, у якій m являє собою 1, 2 або 3, сполучення сполуки формули X: у якій m являє собою 1, 2 або 3 й R1, X1, R5 й n мають значення, вказані вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена, з первинним або вторинним аміном формули R2NHR3, де R2 й R3 мають значення, вказані вище; і потім будь-яку наявну захисну групу видаляють за допомогою звичайних способів. Реакцію сполучення підходяще здійснюють у присутності підходящої зв'язувальної речовини, такої як карбодіімід (наприклад 1-[3(диметиламіно)пропіл]-3-етилкарбодіімід), або підходящої пептидної зв'язувальної речовини, наприклад, гексафторфосфату О-(7азабензотриазол-1-іл)-N,N,N',N'-тетраметилуронію (HATU). Взаємодія також можна здійснювати в присутності 1-гідроксибензотриазолу в комбінації з підходящою зв'язувальною речовиною, такою як карбодіімід. Реакцію сполучення підходяще здійснюють в інертному розчиннику, такому як, наприклад, галогенований розчинник, такий як метиленхлорид, або полярному апротонному розчиннику, такому як Ν,Ν-диметилформамід, Ν,Νдиметилацетамід, 1-метил-2-піролідинон. Підходяще реакцію сполучення здійснюють у присутності підходящої основи, такої як органічний амін, наприклад ди-ізопропілетиламін або 4диметиламінопіридин. Реакцію сполучення підходяще здійснюють при температурі від -25°С до 150°С, підходяще при температурі навколишнього середовища. Спосіб (м) Шляхом взаємодії сполуки формули IV, як визначено вище, за винятком того, що будьяка функціональна група, при необхідності, захищена, зі сполукою формули V": 45 використовуючи методику відновного амінування. Підходящі умови реакції очевидні для фахівця в даній галузі та/або відомі з літератури. Спосіб (н) Для сполук формули І, у якій R3 являє собою С2-С6-алкіл, заміщений біля атома вуглецю аміно, С1-С6-алкіламіно, ди-С1-С6-алкіламіно, або насичене 5-ти або 6-ти членне гетероциклічне кільце, яке містить NR8, де R8 має значення, вказані для формули І, шляхом взаємодії сполуки формули XX: у якій R3a являє собою Lg-С2-С6-алкіл, де Lg являє собою групу, яка витісняється, як визначено вище, і де R1, R2, X1, R5, m й n мають будь-яке зі значень, вказаних у даному описі вище, за винятком того, що будь-яка функціональна група, при необхідності, захищена, з аміаком або з підходящим первинним або вторинним аміном, таким як піролідин, і потім будь-яку наявну захисну групу видаляють за допомогою звичайних способів. Реакцію способу (н) сприятливо здійснюють у присутності інертного розчинника або розріджувача (наприклад, інертних розчинників і розріджувачів, описаних у способах (а) і (в), таких як ацетонітрил, Ν,Ν-диметилацетамід, метанол, етанол або метиленхлорид). Взаємодію підходяще здійснюють у присутності джерела йодиду, такого як йодид натрію або йодид калію й при температурі в інтервалі, наприклад, від 10 до 150°С (або при температурі кипіння розчинника), підходяще в інтервалі від 20 до 90°С. Також слід врахувати, що певні різні кільцеві замісники в сполуках згідно із даним винаходом можуть бути введені за допомогою стандартних реакцій ароматичного заміщення або отримані шляхом модифікації звичайних функціональних груп як перед, так і безпосередньо після способів, описаних вище, і по суті включені в спосіб згідно із даним винаходом. Такі реакції й модифікації включають, наприклад, введення замісника за допомогою реакції ароматичного заміщення, відновлення замісників, алкілування замісників й окислення замісників. Реагенти й умови реакції для таких методик добре відомі в галузі хімії. Конкретними прикладами реакцій ароматичного заміщення є введення нітрогрупи за допомогою концентрованої азотної кислоти, введення ацильної групи за допомогою, наприклад, ацилгалогеніду й кислоти Л'юіса (такої як трихлорид алюмінію) в умовах Фріделя Крафта; введення алкільної групи за допомогою алкілгалогеніду й кислоти Л'юіса (такої як трихлорид алюмінію) в умовах Фріделя Крафта; і введення галогенової групи. Фахівець у даній галузі техніки може врахувати, що для одержання сполук за винаходом за 83252 46 допомогою альтернативних, і в деяких випадках, більш підходящих способів, конкретні стадії способів, описаних вище, можна здійснювати порізному, і/або окремі реакції можна здійснювати на різній стадії загального шляху синтезу (тобто хімічні перетворення можуть здійснюватися на основі різних проміжних продуктів, які відрізняються від описаних раніше в конкретній реакції). Якщо потрібна фармацевтично прийнятна сіль похідного хіназоліну формули І, наприклад, кислото-адитивна сіль, то вона може бути отримана, наприклад, шляхом взаємодії вказаного похідного хіназоліну з підходящою кислотою за допомогою звичайної методики. Для полегшення виділення сполуки при одержанні сполука може бути отримана у вигляді солі, яка не є фармацевтично прийнятною сіллю. Отримана сіль потім може бути модифікована за допомогою звичайних методик, з одержанням фармацевтично прийнятної солі сполуки. Такими методиками є, наприклад, іонообмінні методики або повторне осадження сполуки в присутності фармацевтично прийнятного протиіону. Наприклад, при повторному осадженні в присутності підходящої кислоти, такої як НСl, одержують гідрохлоридну кислото-адитивну сіль. У вищенаведеному розділі вираз "інертний розчинник" стосується розчинника, який не реагує із вихідними речовинами, реагентами, проміжними продуктами або продуктами таким чином, що він несприятливо не впливає на вихід необхідного продукту. Одержання вихідних речовин Сполуки формули II є комерційно доступними або можуть бути отримані за допомогою звичайних методик або способів, які аналогічні до описаних у рівні техніки. Зокрема, у тих патентах і заявках, які перераховані вище, такі як WO 96/15118, WO 01/66099 й ЕР 566 226. Наприклад, сполуки формули II можуть бути отримані відповідно до схеми реакцій 1: де R1, X1, R5, Lg й n мають значення, вказані вище й Pg являє собою гідрокси захисну групу. (і) Реакцію підходяще здійснюють в інертному протонному розчиннику (такому як спирт, наприклад ізо-пропанол), апротонному розчиннику (такому як діоксан) або полярному апротонному розчиннику (такому як Ν,Ν-диметилацетамід) у присутності кислоти, наприклад хлористоводнево 47 го газу в діетиловому ефірі або діоксані, або соляної кислоти, в умовах, аналогічних до описаних вище в способі (к). Альтернативно, реакцію можна здійснювати в одному з перерахованих вище інертних розчинників підходяще у присутності основи, наприклад карбонату калію. Вищенаведені реакції підходяще здійснюють при температурі в інтервалі, наприклад, від 0 до 150°С, підходяще при температурі флегми розчинника реакції або приблизно при температурі флегми розчинника реакції. (іі) Відщеплення Pg можна здійснювати в стандартних умовах для таких реакцій. Наприклад, якщо Pg являє собою алканоїльну групу, таку як ацетил, то він може бути відщеплений при нагріванні в присутності метального розчину аміаку. Сполуки формули XI відомі або можуть бути отримані за допомогою відомих способів, які використовуються для одержання аналогічних сполук. Якщо вони не є комерційно доступними, то сполуки формули XI можуть бути отримані за допомогою методик, які вибрані зі стандартних хімічних методик, методик, які аналогічні синтезу відомих, структурно-подібних сполук, або методик, які аналогічні до способів, описаних у прикладах. Наприклад, стандартними хімічними методиками є ті, які описані в Houben Weyl. Наприклад, сполука формули XI, у якій R1-X1-являє собою метокси, Lg являє собою хлор й Pg являє собою ацетил, може бути отримана за допомогою способу, наведеного на схемі реакцій 2: Схема реакцій 2 може бути узагальнена фахівцем у даній галузі для використання сполук у межах даного винаходу, які конкретно не описані (наприклад, для введення замісника, який не представляє собою метокси, в 7-е положенні в хіназоліновому кільці). Сполуки формули III є комерційно доступними або можуть бути отримані за допомогою стандартних методик, наприклад, як описано в US 5,252,586 й WO 94/27965. Сполуки формули IV можуть бути отримані шляхом взаємодії сполуки формули II зі сполукою XVa або XVb: де Lg являє собою групу, яка витісняється, як визначено вище, і Pg являє собою підходящу захисну групу. Наприклад, Lg може являти собою алкансульфонілокси групу, таку як метансульфо 83252 48 нілокси, і Pg може являти собою третбутилкарбоксилат. Взаємодію сполуки формули II зі сполукою формули XVa можна здійснювати в умовах, аналогічних до описаних вище в способі (а), з наступним видаленням захисної групи в стандартних умовах. Наприклад, взаємодію можна здійснювати, використовуючи карбонат калію як підходящу основу, N-метилпіролідин-2-он як підходящий розріджувач і при температурі близько 105°С. Взаємодію сполуки формули II зі сполукою формули XVb можна здійснювати в умовах Міцунобу, як описано вище в способі (д), з наступним видаленням захисної групи в стандартних умовах. Сполуки формули IV також можуть бути отримані шляхом взаємодії сполуки формули IX зі сполукою формули XVc: у якій Lg, X1 й R1 мають значення, вказані вище, і Pg являє собою підходящу захисну групу. Взаємодію сполуки формули IX зі сполукою формули XVc можна здійснювати в умовах, аналогічних до описаних вище в способі (к), з наступним видаленням захисної групи в стандартних умовах. Сполуки формули VI також можуть бути отримані за допомогою вищеописаного способу (а) або способу (д), використовуючи як вихідну речовину сполука, отримана, наприклад, за допомогою схеми реакцій 1. Сполуки формули VII можуть бути отримані, наприклад, за допомогою способу (а) або способу (г) або способу (д), у яких групу, представлену R1, що підходяще образом функціоналізують з підходящою групою Lg, яку витісняють, такою як хлор або бром. Сполуки формули VIII також можуть бути отримані за допомогою звичайних способів, відомих у даній галузі техніки. Наприклад, гідрокси захисну групу, Pg, у сполуці формули XI, як описано вище на схемі реакцій 1, видаляють, одержуючи сполуку формули XIII · Захисна група Pg може бути вилучена зі сполуки формули XI за допомогою звичайних методик. Потім сполуку формули XIII можна піддавати реакції сполучення зі сполукою формули III, як визначено вище, використовуючи умови, аналогічні до описаних у способі (а) або способі (д). 49 Сполуки формули XX можуть бути отримані, наприклад, за допомогою вищеописаного способу (а), способу (в) або способу (л). Сполуки формули V, V й IX є комерційно доступними або також можуть бути отримані за допомогою стандартних методик. Сполуки формули V" також можуть бути отримані за допомогою стандартних методик, наприклад, як описано в Synthesis, 1993,12,1233 й Tetrahedron, 1992, 48, 5557, Сполуки формули X, у якій m являє собою 1, 2 або 3, можуть бути отримані, наприклад, зі сполуки формули IV шляхом алкілування з R1O2C(CH2)mLg, де Lg й R1 мають значення, вказані вище, у присутності основи й використовуючи умови, аналогічні до описаних вище в способі (в), з наступним перетворенням складного ефіру в карбонову кислоту (наприклад, шляхом омилення або зняття захисту з кислотної групи). Альтернативно, сполуки формули X, у якій m являє собою 1, 2 або 3, можуть бути отримані зі сполуки формули IV шляхом реакції Міцунобу з R1O2C(CH2)m-OH, використовуючи умови, аналогічні до описаних вище в способі (д), з наступним перетворенням складного ефіру в карбонову кислоту (наприклад, шляхом омилення або зняття захисту з кислотної групи). Певні нові проміжні продукти, які використовуються у вищеописаних способах, забезпечують подальший варіант здійснення даного винаходу спільно зі способом їх одержання. Відповідно до подальшого варіанта здійснення даного винаходу, забезпечується сполуки формул VI, VII, VIII, X й XX або їх солі, (включаючи їх фармацевтично прийнятні солі), як визначено вище. Прикладами таких сполук є 6-{[1-(N-(2хлоретил)карбамоїл)піперидин-4-іл]окси}-4-(3хлор-2-фтораніліно)-7-метоксихіназолін, [4-({4-(3хлор-2-фтораніліно)-7-метоксихіназолін-6іл}окси)піперидин-1-іл] оцтова кислота й [4-({4-(3хлор-2,4-дифтораніліно)-7-метоксихіназолін-6іл}окси)піперидин-1-іл]оцтова кислота. Біологічні дослідження Інгібуючу дію сполук оцінювали за допомогою неклітинних досліджень, проведених на білкових тирозинкіназах, а також досліджень клітинної проліферації, потім їх активність оцінювали в умовах in vivo на моделях ксенотрансплантатів. а) Дослідження фосфорилування білків тирозинкіназами У цьому дослідженні визначали здатність тестованої сполуки інгібувати фосфорилування тирозину в поліпептидному субстраті за допомогою ферменту EGFR або erbB2 тирозинкінази. Рекомбінантні внутрішньоклітинні фрагменти EGFR, erbB2 й егbВ4 (реєстраційні номери Х00588, Х03363 й L07868 відповідно) клонували й експресували в системі бакуловірус/Sf21. Із цих клітин одержували лізати за допомогою обробки льодяним лізуючим буфером (20мМ N-2гідроксіетилпіперизин-N¢-2-етансульфонової кислоти (HEPES) рН 7,5, 150мМ NaCl, 10% гліцерин, 1% тритон Х-100, 1,5мМ MgCl2, 1мМ етиленгліколь-біс(b-аміноетиловий ефір) Ν',Ν',Ν',Ν'тетраоцтової кислоти (EGTA), а також інгібіторами 83252 50 протеази, і потім відокремлювали шляхом центрифугування. Конститутивну кіназну активність рекомбінантного білка оцінювали за його здатністю фосфорилувати синтетичний пептид (який являє собою довільний співполімер глутамінової кислоти, аланіну й тирозину в співвідношенні 6:3:1). Зокрема, Maxisorb™ 96-лункові імунопланшети покривали синтетичним пептидом (0,2мкг пептиду в 100мкл фосфатно-сольового буферного розчину (PBS) і інкубували при 4°С всю ніч). Планшети промивали в PBS-T (фосфатно-сольовий буферний розчин з 0,5% Твін 20), потім в 50мМ HEPES рН 7,4 при кімнатній температурі для видалення надлишку незв'язаного синтетичного пептиду. Активність EGFR, ERBB2 або ERB4 тирозинкінази вимірювали при інкубації планшет, покритих пептидом, протягом 20 хвилин при 22°С в 100мМ HEPES рН 7,4, з аденозинтрифосфатом (АТФ) при Km концентрації для відповідного ферменту, 10мМ МnСl2, 0,1мМ Na3VO4, 0,2мМ DL-дитіотретоїлом (DTT), 0,1% тритоном Х-100 з тестованою сполукою в ДМСО (кінцева концентрація 2,5%). Реакції зупиняли видаленням рідких досліджуваних компонентів з наступним промиванням планшет PBS-T. Іммобілізований фосфо-пептидний продукт реакції визначали імунологічними методами. Спочатку планшети інкубували протягом 90 хвилин при кімнатній температурі з первинними антифосфотирозиновими антитілами, які вироблялися в організмі мишей (4G10 від Upstate Biotechnology). Потім ретельно промиті планшети обробляли пероксидазою хрону (HRP), кон'югованою із вторинними антимишиними антитілами овець (NXA931 від Amersham) протягом 60 хвилин при кімнатній температурі. Після додаткового промивання колориметрично визначали HRP активність у кожній лунці планшета, використовуючи кристалічну діамонієву сіль 22¢-азино-ди-[3етибензтіазолін сульфонату (6)] (ABTS™ від Roche) як субстрат. Визначення кількості забарвлення й у такий спосіб активності ферменту здійснювали шляхом визначення оптичної густини при 405 нм на спектрофотометрі для аналізу мікропланшету Molecular Devices ThermoMax. Інгібування кінази даною сполукою виражали у вигляді значення ІС50. Його визначали шляхом розрахунку концентрації сполуки, необхідної для 50% інгібування фосфорилування в цьому дослідженні. Рівень фосфорилування розраховували на основі позитивних (розчинник плюс АТФ) і негативних (розчинник мінус АТФ) контрольних значень. б) Дослідження проліферації KB клітин, яка опосередковується EGFR За допомогою цього дослідження визначали здатність тестованої сполуки інгібувати проліферацію KB клітин (назо-фарингеальної карциноми людини, отриманих з Американської колекції типових культур (АТСС)). KB клітини (назо-фарингеальної карциноми людини, отриманих з АТСС) культивували в живильному середовищі Ігла, модифікованому Дульбекко (DMEM), що містить 10% фетальну телячу сироватку, 2мМ глутаміну й замінні амінокислоти при 51 83252 37°С в 7,5% атмосфері СО2 у термостаті при доступі повітря. Клітини збирали з колб, що містять маточну культуру, за допомогою трипсину/етилендіамінтетраоцтової кислоти (ЕДТА). Щільність клітин визначали за допомогою гемоцитометра й життєздатність підраховували за допомогою розчину трипанового синього, перед висіванням при щільності 1,25 x 103 клітин на лунку в 96-лунковий планшет в DMEM, що містить 2,5% сироватки, пропущеної через деревне вугілля, 1мМ глутаміну й замінні амінокислоти при 37°С в атмосфері 7,5% СО2 і залишали відстоюватися протягом 4 годин. Після адгезії до планшету клітини обробляли EGF (кінцева концентрація 1нг/мл) або не обробляли EGF і сполукою в діапазоні концентрації в диметилсульфоксиді (ДМСО) (0,1% кінцева концентрація) або без сполуки, потім інкубували протягом 4 днів. Після періоду інкубування визначали кількість клітин шляхом додавання 50мкл броміду 3-(4,5-диметилтіазол-2-іл)-2,5-дифенілтетразолію (МТТ) (маточний розчин 5мг/мл) протягом 2 годин. Потім розчин МТТ видаляли, із планшету обережно відводили рідину для висушування й клітини розчиняли при додаванні 100мкл ДМСО. Оптичну густину солюбілізованих клітин вимірювали при 540нм, використовуючи зчитувальний пристрій для мікропланшет Molecular Devices ThermoMax. Інгібування проліферації виражали у вигляді значення ІС50. Його визначали шляхом розрахунку концентрації сполуки, необхідної для 50% інгібування проліферації. Рівень проліферації розраховували на основі позитивних (розчинник плюс EGF) і негативних (розчинник мінус EGF) контрольних значень. в) Дослідження ксенотрансплантантів в умовах in vivo (і) LOVO У цьому дослідженні оцінювали здатність тестованої сполуки інгібувати ріст пухлини LoVo (колоректальна аденокарцинома, отримана з АТСС) у самок безтимусних мишей Swiss (Alderley Park, генотип пи/пи). Самок безтимусних мишей Swiss (генотип пи/пи) розводили й утримували в Alderley Park у камерах з негативним тиском (PFI Systems Ltd.). Мишей утримували в клітинах з 12 годинними періодами день/ніч і забезпечували водою й стерильною їжею ad libitum. Всі процедури здійснювали на мишах старше 8 тижнів. Ксенотрансплантовані пухлинні клітини LoVo (колоректальна аденокарцинома, отримана з АТСС) вводили в задню бокову частину тулуба миші-донора шляхом підшкірної ін'єкції 1 x 107 свіжих культивованих клітин в 100мкл живильного середовища без сироватки кожній тварині. На 5-й день після імплантації мишей розділяли на групи по 7 тварин, і потім їм 1 раз на день вводили сполуку за винаходом або контрольний розчинник у дозі 0,1мл/10г ваги тіла. Об'єм пухлини вимірювали двічі на тиждень за допомогою двостороннього вимірювального циркуля Vernier, використовуючи формулу (довжина x ширина) x x (p/6), (довжина x ширина) 52 де довжина являє собою найбільший діаметр пухлини, і відповідно, ширина - це перпендикулярний до нього діаметр. Інгібування росту від початку дослідження визначали шляхом порівняння зміни об'єму пухлини в контрольній групі й у групах, підданих лікуванню, і статистичну обробку отриманих результатів у двох групах проводили за допомогою t-критерію Ст'юдента. (іі) Дослідження ксенотрансплантантів ВТ-474 в умовах in vivo У цьому дослідженні оцінювали здатність тестованої сполуки інгібувати ріст кленотрансплантованих пухлинних клітин ВТ-474 [рак молочної залози людини, отримана від д-ра Baselga, Laboratorio Recerca Oncologica, Paseo Vail D'Hebron 119-129, Барселона 08035, Іспанія) у самок безтимусних мишей Swiss (Alderley Park, генотип пи/пи) (Baselga, J. і in. (1998) Cancer Research, 58, 2825-2831]. Самок безтимусних мишей Swiss (генотип пи/пи) розводили й утримували в Alderley Park у камерах з негативним тиском (PFI Systems Ltd.). Мишей утримували в клітинах з 12 годинними періодами день/ніч і забезпечували водою й стерильною їжею ad libitum. Всі процедури здійснювали на мишах старше 8 тижнів. Ксенотрансплантовані пухлинні клітини ВТ-474 вводили в задню бокову частину тулуба миші-донора шляхом підшкірної ін'єкції 1 x 107 свіжих культивованих клітин в 100мкл живильного середовища без сироватки з 50% Matrigel кожній тварині. На 14-й день після імплантації мишей розділяли на групи по 10 тварин, і потім їм 1 раз на день вводили сполуку за винаходом або контрольний розчинник у дозі 0,1мл/кг ваги тіла. Об'єм пухлини вимірювали двічі на тиждень за допомогою двостороннього вимірювального циркуля Vernier, використовуючи формулу (довжина x ширина) x (довжина x ширина) x p/6), де довжина являє собою найбільший діаметр пухлини, і відповідно, ширина - це перпендикулярний до нього діаметр. Інгібування росту від початку лікування визначали шляхом порівняння зміни об'єму пухлини в контрольній групі й у групах, підданих лікуванню, і статистичну обробку отриманих результатів у двох групах проводили за допомогою t-критерію Ст'юдента. г) Дослідження інгібування калієвого каналу, який кодується hERG У цьому дослідженні визначали здатність тестованої сполуки інгібувати залишковий струм, який проходить через калієвий канал, що кодується «ether-a-go-go»-3B'fl3amiM геном людини (hERG). Клітини нирки ембріона людини (НЕК), які експресують hERG-кодований канал, вирощували в мінімально необхідному живильному середовищі Ігла (ЕМЕМ; номер каталогу Sigma-Aldric M2279), доповненому 10% фетальною телячою сироваткою (Labtech International; номер продукту 4-101500), з 10% МІ доповненням без сироватки (Egg Technologies; номер продукту 70916) і 0,4 мг/мл Geneticin G418 (Sigma-Aldrich; номер каталогу G7034). За один або два дні перед кожним експе 53 риментом клітини ізолювали з колб із культивованою тканиною за допомогою аккутази (Accutase) (TCS Biologicals), використовуючи стандартні способи культивування тканини. Потім їх поміщали на скляні покривні стекла й залишали в лунках 12лункового планшету й покривали 2 мл ростовим живильним середовищем. Для кожної реєстрованої клітини, скляне покривне скло, що містить клітини, поміщали на дно камери Perspex, яка містить розчин для інкубації (див. нижче) при кімнатній температурі (-20°С). Цю камеру фіксували на предметному столику інвертованого фазово-контрастного мікроскопа. Безпосередньо після приміщення покривного скла в камеру, розчин для інкубації перфузували в камері з резервуара, що подає самопливом, протягом 2 хвилин при швидкості ~ 2мл/хв. Після цього перфузію зупиняли. Невелику піпетку, зроблену з борсилікатної скляної трубки, (GC120F, Harvard Apparatus), використовуючи Р-97 мікропіпеточний виштовхувач (Sutter Instrument Co.), наповнювали розчином для піпетки (див. далі). Піпетку приєднували до головного блоку «patch-clamp» підсилювача (Axopatch 200B, Axon Instruments) за допомогою проведення зі срібла/хлориду срібла. Заземлювач головного блоку з'єднували із заземлюючим електродом. Він складався дроти зі срібла/хлориду срібла, зануреного в 3% агар, приготовлений з 0,85% хлориду натрію. 83252 54 Клітини записували в конфігурації «ціла клітина» «patch clamp» методу. Після "пробою", який здійснювали при вихідному потенціалі -80 мВ (установлюється підсилювачем), і відповідному коректуванню додаткового опору і ємнісного опору контролів, електрофізіологічне забезпечення (Clampex, Axon Instruments) застосовували для встановлення вихідного потенціалу (-80 мВ) і подачі протоколу напруги. Цей протокол застосовували кожні 15 секунд і він складався з 1 с стадії до +40 мВ із наступною 1 с стадією до -50 мВ. Для відповідного струму на кожний протокол напруги, який накладається, відфільтровували низькі частоти за допомогою підсилювача при 1кГц. Потім оперативно одержували відфільтрований сигнал шляхом перетворення цього аналогового сигналу від підсилювача в цифровий у цифровому перетворювачі. Потім сигнал, перетворений у цифрову форму, записували за допомогою комп'ютерного програмного забезпечення Clampex (Axon Instruments). Протягом вихідного потенціалу й на стадії до + 40 мВ робили вибірку струму при 1кГц. Потім частоту вибірки встановлювали до 5кГц для залишку протоколу напруги. Склад, рН й осмомолярність розчину для інкубації й розчину для піпетки зведені в таблицю, представлену нижче. 55 Амплітуду залишкового струму калієвого каналу, кодованого hERG, після стадії від +40мВ до 50мВ, оперативно реєстрували за допомогою програмного забезпечення Clampex (Axon Instruments). Після стабілізації амплітуди залишкового струму, розчин для інкубації, який містить розчинник для тестованої сполуки, застосовували до клітини. За умови, що застосування розчинника істотного не впливало на амплітуду залишкового струму, після цього будували загальну криву дії для сполуки залежно від концентрації. Дію кожної концентрації тестованої сполуки кількісно визначали шляхом вираження амплітуди залишкового струму в присутності даної концентрації тестованої сполуки в процентному вираженні в порівнянні із присутністю розчинника. Ефективність тестованої сполуки (ІС50) визначали шляхом обробки процентних значень інгібування, отриманих для залежності концентраціяефект для чотирьох параметрів рівняння Хіла, використовуючи стандартний пакет для обробки даних. Якщо отриманий рівень інгібування для найбільшої досліджуваної концентрації не перевищував 50%, не одержували значень ефективності й значення інгібування у відсотках для цієї концентрації приводили в дужках. д) Дослідження клітин клону 24 фосфо-erbB2 У цьому імунофлуоресцентному дослідженні кінцевої точки визначали здатність тестованої сполуки інгібувати фосфорилування erbB2 у клітинній лінії, що має походження з MCF7 (рак молочної залози), яку одержували шляхом трансфекції MCF7 клітин повнорозмірним геном erbB2 за допомогою відомих способів, одержуючи клітинну лінію, яка понадекспресує повнорозмірний білок erbB2 дикі типи (надалі клітини 'клону 24'). Клітини клону 24 культивували в живильному середовищі (середовище Ігла, модифіковане Дульбекко без фенолового червоного (DMEM), що містить 10% фетальну телячу сироватку, 2мМ глутаміну й 1,2мг/мл G418) в 7,5% атмосфері СО2 у термостаті з доступом повітря при 37°С. Клітини збирали з Т75 колб, що містять маточну культуру, шляхом однократного промивання в PBS (фосфатно-сольовий буферний розчин, рН 7,4, Gibco №10010-015) і збирання за допомогою 2 mls трипсину (1,25мг/мл) / розчину етиламіндіамінтетраоцтової кислоти (EDTA) (0,8мг/мл). Клітини ресуспендували в живильному середовищі. Щільність клітин вимірювали за допомогою гемоцитометра й визначали життєздатність за допомогою розчину трипанового синього, після цього знову розводили в живильному середовищі й з висівали при щільності lxl04 клітин на лунку (в 100мкл) у планшети на 96 лунок із прозорим дном (Packard, №6005182). Через три дні з лунок видали живильне середовище, заміняючи його на 100мкл середовища для дослідження (DMEM без фенолового червоного, 2мМ глутамін, 1,2мг/мл G418) зі сполукою, яка інгібує erbB, або без неї. Планшети знову поміщали в термостат на 4 години й потім у кожну лунку додавали 20мкл 20% розчину формальдегіду в PBS і планшет залишали при кімнатній температурі протягом 30 хвилин. Цей фіксуючий розчин ви 83252 56 даляли за допомогою багатоканальної піпетки, у кожну лунку додавали 100мкл PBS, після цього видаляли за допомогою багатоканальної піпетки й потім у кожну лунку додавали 50мкл PBS. Після цього планшети запечатували й зберігали до 2 тижнів при 4°С. Здійснювали фарбування з використанням імунної мітки при кімнатній температурі. Лунки один раз промивали 200мкл PBS / Твін 20 (отриманий шляхом додавання 1 пакетика PBS / безводного порошку Твін (Sigma, № Р3563) до 1л бідистильованої Н2О), використовуючи планшетний промивач, потім додавали 200 мкл блокуючого розчину (5% сухого знежиреного молока марвел (Nestle) в PBS /Твін 20) і iнкубували протягом 10 хвилин. Блокуючий розчин видаляли за допомогою планшетного промивача й для проникності клітин додавали 200мкл 0,5% Тритон-100 / PBS. Через 10 хвилин планшет промивали 200мкл PBS / Твін 20 і після цього знову додавали 200мкл блокуючого розчину, і інкубували протягом 15 хвилин. Після видалення блокуючого розчину, за допомогою планшетного промивача в кожну лунку додавали 30мкл кролячого поліклонального антифосфо ErbB2 IgG антитіла (епітоп фосфо-Туr 1248, SantaCruz, № SC-12352-R), розведеного 1: 250 у блокуючому розчині і інкубували протягом 2 годин. Потім з лунок видаляли цей розчин первинного антитіла за допомогою планшетного промивача, після цього два рази промивали 200мкл PBS / Твін 20, використовуючи планшетний промивач. Потім у кожну лунку додавали 30мкл Alexa-Fluor 488 цапиного антикролячого IgG вторинного антитіла (Molecular Probes, № А-11008), розведеного 1:750 у блокуючому розчині. Надалі, при будь-яких можливостях, планшети захищали від дії світла, на цій стадії запечатуючи чорною підтримуючою стрічкою. Планшети інкубували протягом 45 хвилин і потім з лунок видаляли розчин вторинного антитіла, після цього двічі промивали 200мкл PBS / Твін 20, використовуючи планшетний промивач. Потім у кожен планшет додавали 100мкл PBS, інкубували протягом 10 хвилин і після цього видаляли, використовуючи планшетний промивач. Потім до кожного планшету додатково додавали 100мкл PBS, і після цього, без тривалого інкубування, видаляли за допомогою планшетного промивача. Після цього в кожну лунку додавали 50мкл PBS і планшети знову запечатували чорною підтримуючою стрічкою й зберігали до двох днів при 4°С перед дослідженням. У кожній лунці вимірювали флуоресцентний сигнал за допомогою Acumen Explorer Instrument (Acumen Bioscience Ltd.), планшет-рідер, який може застосовуватися для швидкої кількісної характеристики зображень, генерованих при лазерному скануванні. Прилад налаштовували для вимірювання кількості флуоресціюючих об'єктів вище заздалегідь установленого граничного значення, і це забезпечує вимірювання фосфорилованого стану erbB2 білка. Отримані дані флуоресценції для залежності доза-ефект для кожної сполуки обробляли за допомогою підходящого програмного забезпечення (такого, як Origin) для проведення аналізу апроксимації кривих. Інгібування erbB2 57 83252 58 фосфорилування виражали у вигляді ІС50 значень. їх визначали шляхом обчислення концентрації сполуки, яка необхідна для забезпечення 50% інгібування erbB2 фосфорилувального сигналу. Незважаючи на те, що фармакологічні властивості сполук формули І відрізняються у зв'язку зі структурними відмінностями, як очікувалося, у цілому сполуки формули І можуть проявляти активність у нижченаведених концентраціях або дозах в одному або більше вищевказаних дослідженнях: Дослід (а): ІС50 в інтервалі, наприклад, 0,00110мкМ Дослід (б): ІС50 в інтервалі, наприклад, 0,00110мкМ Дослід (д): ІС50 в інтервалі, наприклад, 0,00110мкМ Дослід (в): активність в інтервалі, наприклад, 1-200мг/кг/день; Як приклад у таблиці А наведена активність репрезентативних сполук відповідно до винаходу. У колонці 2 таблиці А наведені дані ІС50 з досліду (а) інгібування фосфорилування білків EGFR тирозинкіназою; у колонці 3 наведені дані ІС50 з досліду (а) інгібування фосфорилування білків erbB2 тирозинкіназою; у колонці 4 наведені дані ІС50 для інгібування проліферації KB у досліді (б), описаному вище; і в колонці 5 наведені дані ІС50 інгібування фосфорилування erbB2 у клітинах, які мають походження від MCF7, у досліді (д), описаному вище: Відповідно до подальшого варіанта здійснення винаходу, забезпечується фармацевтична композиція, яка містить похідне хіназоліну формули І або його фармацевтично прийнятну сіль, як визначено вище, у сполученні з фармацевтично прийнятним розріджувачем або носієм. Композиції за винаходом можуть знаходитися у формах, які підходять для перорального застосування (наприклад, у вигляді таблеток, коржів, твердих або м'яких капсул, водних або масляних суспензій, емульсій, диспергованих порошків або гранул, сиропів або еліксирів), для місцевого введення (наприклад, у вигляді паст, мазей, гелів, водних або масляних розчинів або суспензій), для введення шляхом інгаляції (наприклад, у вигляді тонкоподрібненого порошку або рідкого аерозолю), для введення шляхом вдування (наприклад, у вигляді тонкоподрібненого порошку), або для парентерального введення (наприклад, у вигляді стерильного водного або масляного розчину для внутрішньовенного, підшкірного, внутрішньом'язового введення, або у вигляді супозиторію для ректального введення). Композиції за винаходом можуть бути отримані звичайними способами при використанні звичайних фармацевтичних наповнювачів, добре відомих у даній галузі. Таким чином, композиції, призначені для перорального введення, можуть містити, наприклад, один або декілька барвників, підсолоджувачів, ароматизаторів та/або консервантів. Кількість активного компонента, яка необхідна для одержання одиничної лікарської форми в сполученні з одним або декількома наповнювачами, головним чином залежить від організму, який піддається лікуванню, і конкретного шляху введення. Наприклад, лікарська форма, призначена для перорального введення людині, як правило, містить, наприклад, від 0,5мг до 0,5г активної речовини (більш переважно від 0,5 до 100мг, наприклад, від 1 до 30мг) у сполученні з підходящою й прийнятною кількістю наповнювачів, що може змінюватися від приблизно 5 до приблизно 98% від загальної маси композиції. Доза похідної сполуки формули І для лікування або профілактики звичайно змінюється залежно від природи й тяжкості станів, віку й статі тварини або людини, і шляху введення, і визначається відповідно до добре відомих підходів у медицині. Сполука формули І, яка застосовується для лікування або профілактики, звичайно вводиться в добовій дозі в інтервалі, наприклад, від 0,1мг/кг до 75мг/кг ваги тіла пацієнта, і, при необхідності, може бути розділена на декілька прийомів. У цілому, при парентеральному введенні застосовуються більш низькі дози. Так, наприклад, для внутрішньовенного введення звичайно застосовують дозу в інтервалі, наприклад, від 0,1мг/кг до 30мг/кг ваги тіла. Подібним чином, для введення шляхом інгаляції застосовується доза в інтервалі, наприклад, від 0,05мг/кг до 25мг/кг ваги. Переважним, однак, є пероральне введення, як правило, у формі табле 59 тки. Звичайно, стандартна лікарська доза містить приблизно від 0,5мг до 0,5г сполуки згідно із даним винаходом. Нами було виявлено, що сполуки згідно із даним винаходом мають антипроліферативну дію, таку як протиракова дія, яка, як вважають, є наслідком їх інгібуючої дії по відношенню до рецепторних тирозинкіназ сімейства erbB, і, особливо, змішаним erbB2/ EGF профілем. Таким чином, сполуки згідно із даним винаходом, як очікується, є придатними для лікування захворювань або хворобливих станів, опосередковуваних тільки erbB рецепторними тирозинкіназами або частково опосередкованих цими тирозинкіназами, тобто сполуки можуть застосовуватися для одержання інгібуючої дії по відношенню до erbB рецепторної тирозинкінази в теплокровної тварини, яка має потребу в такому лікуванні. Таким чином, сполуки згідно із даним винаходом забезпечують спосіб лікування злоякісних клітин, який характеризується інгібуванням однієї або декількох рецепторних тирозинкіназ сімейства erbB. Переважно сполуки за винаходом можуть застосовуватися для одержання антипроліферативної та/або проапоптотичної та/або антиінвазивної дії, опосередкованої тільки інгібуванням erbB рецепторної тирозинкінази, або частково опосередкованої інгібуванням цього ферменту. Більш переважно, сполуки згідно із даним винаходом, як очікується, є придатними для профілактики або лікування тих пухлин, які чутливі до інгібування однієї або декількох erbB рецепторних тирозинкіназ, що залучені в стадії передачі сигналів, які регулюють проліферацію й виживання цих пухлинних клітин. Таким чином, сполуки згідно із даним винаходом, як очікується, є придатними для лікування псоріазу, доброякісної гіперплазії передміхурової залози (ВРН), атеросклерозу й рестенозу, і/або злоякісного новоутворення шляхом забезпечення антипроліферативної дії, особливо для лікування злоякісних новоутворень, чутливих до erbB рецепторної тирозинкінази. Такі доброякісні або злоякісні пухлини можуть виникати в будьяких тканинах і включають несолідні пухлини, такі як лейкоз, множинну мієлому або лімфому, а також солідні пухлини, наприклад, рак жовчних протоків, кісток, сечового міхура, головного мозку/ЦНС, молочної залози, прямої кишки, ендометрію, шлунка, голови й шиї, печінки, легень, нервових клітин, стравоходу, яєчників, підшлункової залози, передміхурової залози, нирок, шкіри, яєчок, щитовидної залози, матки й зовнішніх жіночих статевих органів. Відповідно до цього варіанта здійснення винаходу, забезпечується сполука формули І або її фармацевтично прийнятна сіль, для застосування як лікарський засіб. Відповідно до подальшого варіанта здійснення винаходу, забезпечується сполука формули І або її фармацевтично прийнятна сіль для застосування для одержання антипроліферативної дії в теплокровної тварини, такої як людина. Таким чином, відповідно до цього варіанта здійснення винаходу, забезпечується застосування похідного хіназоліну формули І або його фар 83252 60 мацевтично прийнятної солі, як визначено вище, для приготування лікарського засобу для застосування для одержання антипроліферативної дії в теплокровної тварини, такої як людина. Відповідно до подальшого аспекту цього варіанта здійснення винаходу, забезпечується спосіб забезпечення антипроліферативної дії в теплокровної тварини, такої як людина, яка потребує такого лікування, який передбачає введення вказаній тварині ефективної кількості похідного хіназоліну формули І або його фармацевтично прийнятної солі, як визначено вище. Відповідно до подальшого варіанта здійснення винаходу, забезпечується застосування похідного хіназоліну формули І або його фармацевтично прийнятної солі, як визначено вище, для приготування лікарського засобу для застосування для запобігання або лікування тих пухлин, які чутливі до інгібування erbB рецепторних тирозинкіназ, таких як комбінація EGFR й erbB2, залучених у поетапну передачу сигналів, які приводять до проліферації пухлинних клітин. Відповідно до подальшого аспекту цього варіанта здійснення винаходу, забезпечується спосіб запобігання або лікування тих пухлин, які чутливі до інгібування однієї або декількох рецепторних тирозинкіназ erbB сімейства, таких як комбінація EGFR й erbB2, залучених у поетапну передачу сигналів, які приводять до проліферації та/або виживання пухлинних клітин, який передбачає введення вказаній тварині ефективної кількості похідного хіназоліну формули І або його фармацевтично прийнятної солі, як визначено вище. Відповідно до подальшого аспекту цього варіанта здійснення винаходу, забезпечується сполука формули І або її фармацевтично прийнятна сіль для застосування для запобігання або лікування тих пухлин, які чутливі до інгібування erbB рецепторних тирозинкіназ, таких як комбінація EGFR й erbB2, залучених у поетапну передачу сигналів, які приводять до проліферації пухлинних клітин. Відповідно до подальшого варіанта здійснення винаходу, забезпечується застосування похідного хіназоліну формули І або його фармацевтично прийнятної солі, як визначено вище, для приготування лікарського засобу для застосування для забезпечення комбінованої інгібуючої дії по відношенню до EGFR й erbB2 тирозинкіназам. Відповідно до подальшого аспекту цього варіанта здійснення винаходу, забезпечується спосіб забезпечення комбінованої інгібуючої дії по відношенню до EGFR й erbB2 тирозинкіназам, який передбачає введення вказаній тварині ефективної кількості похідного хіназоліну формули І або його фармацевтично прийнятної солі, як визначено вище. Відповідно до подальшого аспекту цього варіанта здійснення винаходу, забезпечується сполука формули І або її фармацевтично прийнятна сіль для застосування для забезпечення комбінованої інгібуючої дії по відношенню до EGFR й erbB2 тирозинкіназам. Відповідно до подальшого варіанта здійснення даного винаходу, забезпечується застосування похідного хіназоліну формули І або його фармаце
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinazoline derivative, process for the preparation thereof, pharmaceutical composition based thereon, intermediate
Автори англійськоюBradbury Robert Hugh, Barlaam Bernard Christophe
Назва патенту російськоюПроизводные хиназолина, способ их получения (варианты), фармацевтическая композиция на их основе, промежуточное соединение
Автори російськоюБредбери Роберт Хью, Барлаам Бернар Кристоф
МПК / Мітки
МПК: A61K 31/517, C07D 401/12, A61P 35/00
Мітки: проміжна, композиція, фармацевтична, одержання, сполука, спосіб, основі, похідні, хіназоліну, варіанти
Код посилання
<a href="https://ua.patents.su/36-83252-pokhidni-khinazolinu-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-na-kh-osnovi-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Похідні хіназоліну, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі, проміжна сполука</a>
Попередній патент: Застосування комбінації фунгіцидів та спосіб захисту насіннєвого матеріалу
Наступний патент: Спосіб виготовлення теплової ударної трубки і теплова ударна трубка, виготовлена цим способом
Випадковий патент: Комбінований спосіб одночасного очищення димових газів від оксидів азоту та сірки












