Похідні варіоліну b, фармацевтична композиція на їх основі, спосіб їх одержання, проміжна сполука
Номер патенту: 77400
Опубліковано: 15.12.2006
Автори: Бледа Давід Фернандес, Пуентес Хосе Луіс Фернандес, Альварес Мерседес
Формула / Реферат
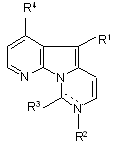
1. Сполука формули (І)
 ,
,
де
R1 являє собою ароматичний замісник, вибраний з ароматичного циклу із 4-10 циклічними атомами, який може бути конденсованим і може містити один або декілька гетероатомів, і
R2 являє собою водень або замісник, коли пунктирна лінія відсутня, або R2 відсутній, коли пунктирна лінія представляє зв’язок, і утворюється подвійний зв’язок між азотом, до якого приєднаний R2, і вуглецем, до якого приєднаний R3;
R3 являє собою оксогрупу =O, коли пунктирна лінія відсутня, або являє собою замісник, коли пунктирна лінія представляє зв’язок, і утворюється подвійний зв’язок між азотом, до якого приєднаний R2, і вуглецем, до якого приєднаний R3;
R4 являє собою водень; і фармацевтично прийнятна сіль,
замісник являє собою ОН, OR’, SH, SR’, SOR’, SO2R’, NH2, NHR’, N(R’)2, NHCOR’, N(COR’)2, NHSO2R’, C(=O)R’, CO2H, CO2R’, С1-С12алкіл і С1-С12галогеналкіл, причому кожну групу R’ вибирають незалежно з групи, що складається з ОН, С1-С12алкілу, С1-С12галогеналкілу, арилу (який може бути необов’язково заміщеним групою, вибраною з С1-С6алкілу, С1-С6алкокси, С1-С6алкілтіо, NH2, С1-С6алкіламіно, ді(С1-С6)алкіламіно, NO2, CN та галогену), аралкілу, або арилалкенілу (арильна група якого може бути необов’язково заміщена групою, вибраною з С1-С6алкілу, С1-С6алкокси, С1-С6алкілтіо, NH2, С1-С6алкіламіно, ді(С1-С6)алкіламіно, NO2, CN та галогену), і де група R1 є групою формули N(R’)2 або N(COR’)2, групи R’ можуть бути однаковими або різними, або дві групи R’ разом з атомом азоту, до якого вони приєднані, утворюють 5-12-членний гетероцикл.
2. Сполука за п. 1, де R1 являє собою 4-піримідильну групу.
3. Сполука за п. 2, де 4-піримідильна група є заміщеною.
4. Сполука за будь-яким з попередніх пунктів, де R2, коли присутній, являє собою водень.
5. Сполука за будь-яким з попередніх пунктів, де R3 являє собою оксогрупу.
6. Сполука за будь-яким з пп. 1, 2 або 3, де пунктирна лінія являє собою зв’язок.
7. Сполука за п. 6, де
R1 являє собою 4-піримідильну групу, заміщену в положенні 2 аміногрупою, N-ациламіногрупою, метилтіогрупою або метансульфінільною або метансульфонільною групою;
R2 відсутній;
R3 являє собою необов’язково захищену аміногрупу або N-ациламіногрупу; і
R4 являє собою водень.
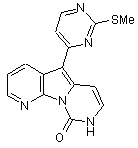
8. Сполука за п. 1, яка являє собою 8,9-дигідро-5-(2-метансульфанілпіримідин-4-іл)піридо[3’,2’:4,5]піроло[1,2-с]піримідин-9-он формули
 .
.
9. Сполука за п. 1, яка являє собою 9-аміно-5-(2-метансульфанілпіримідин-4-іл)піридо[3’,2’:4,5]піроло[1,2-с]піримідин формули
 .
.
10. Сполука за п. 1, яка являє собою 9-ацетиламіно-5-(2-метансульфанілпіримідин-4-іл)піридо[3’,2’:4,5]піроло[1,2-с]піримідин формули
 .
.
11. Сполука за п. 1, яка являє собою 9-аміно-5-(2-метансульфінілпіримідин-4-іл)піридо[3’,2’:4,5]піроло[1,2-с]піримідин формули
 .
.
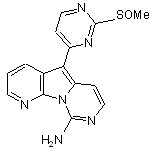
12. Сполука за п. 1, яка являє собою 9-аміно-5-(2-метансульфінілпіримідин-4-іл)піридо[3’,2’:4,5]піроло[1,2-с]піримідин формули
 .
.
13. Сполука за п. 1, яка являє собою 9-аміно-5-(2-метансульфонілпіримідин-4-іл)піридо[3’,2’:4,5]піроло[1,2-с]піримідин формули
 .
.
14. Сполука за будь-яким з пунктів 1-13 як активний інгредієнт медикаменту для лікування раку.
15. Фармацевтична композиція, яка володіє протираковою активністю і яка містить сполуку за будь-яким з попередніх пунктів разом з фармацевтично прийнятним носієм.
16. Спосіб одержання сполуки за будь-яким з пунктів 1-13, що включає взаємодію необов’язково заміщеного 5-галогенпіридо[3’,2’:4,5]піроло[1,2-с]піримідину або 8,9-дигідро-5-галогенпіридо[3’,2’:4,5]піроло[1,2-с]піримід-9-ону з дериватизованою ароматичною сполукою, і необов’язкову дериватизацію продукту.
17. Спосіб за п. 16, де дериватизована ароматична сполука являє собою станіларильну сполуку.
18. Проміжна сполука, яка являє собою необов’язково заміщений 5-галогенпіридо[3’,2’:4,5]піроло[1,2-с]піримідин або 8,9-дигідро-5-галогенпіридо-[З’,2’:4,5]піроло[1,2-с]піримід-9-он формули
 або
або 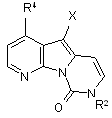 ,
,
де Х являє собою галоген, і R2, R3 і R4 мають значення, вказані в п. 1.
19. Проміжна сполука за п. 18, де Х являє собою йод, R2 являє собою захисну групу, R3 являє собою захищену аміногрупу.
Текст
1. Сполука формули (І) 2 3 77400 4 N 2. Сполука за п. 1, де R1 являє собою 4SOMe піримідильну групу. N 3. Сполука за п. 1, де 4-піримідильна група є заміщеною. 4. Сполука за будь-яким з попередніх пунктів, де N N 2 N R , коли присутній, являє собою водень. H2N 5. Сполука за будь-яким з попередніх пунктів, де . R3 являє собою оксогрупу. 12. Сполука за п. 1, яка являє собою 9-аміно-5-(26. Сполука за будь-яким з попередніх пунктів, де метансульфінілпіримідин-4R4 являє собою водень, метокси або гідрокси. іл)піридо[3’,2’:4,5]піроло[1,2-с]піримідин формули N 7. Сполука за п. 6, де SOMe R1 являє собою 4-піримідильну групу, заміщену в N положенні 2 аміногрупою, N-ациламіногрупою, метилтіогрупою або метансульфінільною або меN N тансульфонільною групою; N R2 відсутній; HN . 3 R являє собою необов’язково захищену аміногру13. Сполука за п. 1, яка являє собою 9-аміно-5-(2пу або N-ациламіногрупу; і метансульфонілпіримідин-4R4 являє собою водень. іл)піридо[3’,2’:4,5]піроло[1,2-с]піримідин формули 8. Сполука за п. 1, яка являє собою 8,9-дигідро-5N SO2 Me (2-метансульфанілпіримідин-4N іл)піридо[3’,2’:4,5]піроло[1,2-с]піримідин-9-он формули 2 N SMe N N N N H2 N N N N H O . 9. Сполука за п. 1, яка являє собою 9-аміно-5-(2метансульфанілпіримідин-4іл)піридо[3’,2’:4,5]піроло[1,2-с]піримідин формули 1' N SMe N 4' 5 3 1 N N H2 N 7 9 N . 10. Сполука за п. 1, яка являє собою 9ацетиламіно-5-(2-метансульфанілпіримідин-4іл)піридо[3’,2’:4,5]піроло[1,2-с]піримідин формули N SMe N N N N . 14. Сполука за будь-яким з пунктів 1-13 як активний інгредієнт медикаменту для лікування раку. 15. Фармацевтична композиція, яка володіє протираковою активністю і яка містить сполуку за будьяким з попередніх пунктів разом з фармацевтично прийнятним носієм. 16. Спосіб одержання сполуки за будь-яким з пунктів 1-13, що включає взаємодію необов’язково заміщеного 5-галогенпіридо[3’,2’:4,5]піроло[1,2с]піримідину або 8,9-дигідро-5галогенпіридо[3’,2’:4,5]піроло[1,2-с]піримід-9-ону з дериватизованою ароматичною сполукою, і необов’язкову дериватизацію продукту. 17. Спосіб за п. 16, де дериватизована ароматична сполука являє собою станіларильну сполуку. 18. Проміжна сполука, яка являє собою необов’язково заміщений 5галогенпіридо[3’,2’:4,5]піроло[1,2-с]піримідин або 8,9-дигідро-5-галогенпіридо-[З’,2’:4,5]піроло[1,2с]піримід-9-он формули R4 N O AcHN . 11. Сполука за п. 1, яка являє собою 9-аміно-5-(2метансульфінілпіримідин-4іл)піридо[3’,2’:4,5]піроло[1,2-с]піримідин формули Даний винахід відноситься до похідних варіоліну В. Варіолін А (1), варіолін В (2), варіолін D (3) і R4 X N R2 N X N N R2 O або , де Х являє собою галоген, і R2, R3 і R4 мають значення, вказані в п. 1. 19. Проміжна сполука за п. 18, де Х являє собою йод, R являє собою захисну групу, R3 являє собою захищену аміногрупу. R3 N(3')-метилтетрагідроваріолін В (4) являють собою невелику групу гетероциклічних речовин морського походження, виділених з арктичної губки 5 77400 6 Kirkpatrickia varialosa в 1994 [див. Tetrahedron, подвійний зв'язок між азотом, до якого приєднаний 1994, 50, 3987-3992, і Tetrahedron, 1994, 50, 3993R2, і вуглецем, до якого приєднаний R3; 4000]. Вони мають звичайну трициклічну структуру R4 являє собою водень або замісник; піридо[3',2':4,5]піроло[1,2-с]піримідину. Така струкі їх фармацевтично прийнятних солей. тура не має прецеденту в природних продуктах ні Група R1, як правило, являє собою ароматичназемного, ні морського походження. Раніше опуний цикл з 4-10 циклічними атомами, переважніше бліковані дві роботи, що описують синтетичні спо- 5, 6 або циклічними атомами, і найбільш переваріднені структури [див. Chem. Ber., 1974, 107, 929жно - 6 циклічними атомами. Даний винахід допус936, і Tetrahedron Lett., 2000, 41, 4777-4780]. кає конденсовані циклічні системи. Цикл може містити один або декілька гетероатомів, і відповідний варіант включає 1-3 циклічних гетероатоми, вибраних серед атомів азоту, кисню або сірки, особливо - 2 гетероатоми. Особливо переважні гетероатоми азоту, і прикладом R1 є піримідиновий цикл, особливо, замісник 4-піримідил, тобто, група формули Важливою особливістю таких сполук є їх біологічна активність: варіолін В є найбільш активним, володіючим цитотоксичною активністю проти клітинної лінії Р388 і також є ефективним проти Herpes simplex; він неактивний відносно ряду інших мікроорганізмів [див. Tetrahedron, 1994, 50, 3987-3992]. Варіолін А також показує істотну цитотоксичну активність проти клітинної лінії Р388. N(3')-Метилтетрагідроваріолін В інгібує зростання Sacharomyces cerevisae і показує in vitro активність проти клітинної лінії НСТ 116. Варіолін D неактивний при всіх аналізах. Вважають, що різна активність вказаних алкалоїдів показує біологічне значення амінопіримідинового циклу в (2), окисленої форми в (1) і відновленого піримідину в (4), в протилежність метоксикарбонільному заміснику у варіоліні D. Даний винахід відноситься до дезоксиваріолінів, що володіють цитотоксичною активністю і, як очікується, корисних як протипухлинні засоби. У одному аспекті винахід відноситься до сполук формули (І) де R1 являє собою ароматичний замісник; R2 являє собою водень або замісник, коли пунктирна лінія відсутня, або R2 відсутній, коли пунктирна лінія представляє зв'язок, і утворюється подвійний зв'язок між азотом, до якого приєднаний R2, і вуглецем, до якого приєднаний R3;. R3 являє собою оксогрупу =O, коли пунктирна лінія відсутня, або являє собою замісник, коли пунктирна лінія представляє зв'язок, і утворюється Ароматичний цикл може бути заміщеним, наприклад, однією або декількома групами, вибраними з алкілу, алкокси, тіоалкілу, галогену, аміно, заміщеного аміно, галогеналкілу, алкоксіалкілу, арилу, гідрокси, карбокси, алкоксикарбонілу або інших звичайних груп, включаючи мезильні групи. Далі в тексті вказані інші групи, які можна використати як замісники. R2, коли присутній, являє собою, переважно, водень, захисну групу для азоту або якийсь інший замісник. Приклади захисних груп для азоту, такі як метоксиметил або тозил, добре відомі, і немає необхідності приводити подробиці. Прикладами інших замісників є будь-які групи, які можна заміняти в даному положенні шляхом взаємодії сполуки, де R1 являє собою водень. Більш широко посилання на інші групи дається в даному описі далі. R3 являє собою оксогрупу або може являти собою замісник, який можна ввести шляхом реакції оксоз'єднання, включаючи аміно, заміщений аміно, в тому числі, захищений аміно, і тіоалкіл. Більш широко посилання на інші групи дається в даному описі далі. R4 являє собою водень або замісник, такий як алкокси, особливо - метокси, гідрокси, галоген, особливо - хлор, або іншу групу, яку можна ввести нуклеофільним заміщенням або іншим методом дериватизації, включаючи тіоалкіл або мезил. Коли R4 являє собою водень, сполуки являють собою похідні дезоксиваріоліну В. Коли R4 являє собою гідрокси, сполуки являють собою похідні варіоліну В. Більш широко посилання на інші групи дається в даному описі далі. R1 являє собою, переважно, 4-піримідильну групу, заміщену в положенні 2. Відповідними замісниками є аміногрупа і її похідні, такі як N-ацил, особливо, N-ацетил. Передбачаються й інші замісники, такі як алкокси або алкілтіо, особливо, метилтіогрупа. R2, переважно, відсутній. R3 являє собою, переважно, аміногрупу і її похідні, такі як N-ацил, особливо, N-ацетил. R4, переважно, являє собою водень. Пунктирна лінія, переважно, представляє зв'язок. Особливо переважним класом сполук є такі 7 77400 8 сполуки формули (І), в яких мів вуглецю, ще переважніше - від 2 до приблизно R1 являє собою, переважно, 4-піримідильну 6 атомів вуглецю, і навіть ще переважніше - 2, 3 групу, заміщену в положенні 2 аміно, N-ацилом, або 4 атоми вуглецю. Терміни "алкеніл" і "алкініл", особливо, N-ацетилом, алкілтіо, особливо, метилщо використовуються в даному описі, відносяться тіогрупою, алкіл- або арилсульфінілом, особливо, як до циклічних, так і до ациклічних груп, хоча, як метансульфінілом, або алкіл- або арилсульфоніправило, більш переважні лінійні і розгалужені лом, особливо, метансульфонілом; ациклічні групи. R2 відсутній; Переважні алкоксильні групи в сполуках даноR3 являє собою необов'язково захищену аміго винаходу включають групи, що містять один або ногрупу або N-ацил, особливо, N-ацетил;і декілька (але переважно, тільки один) кисневих R4 являє собою водень, гідрокси або метокси. зв'язків і від 1 до приблизно 12 атомів вуглецю, Винахід також відноситься до фармацевтично переважніше - від 1 до приблизно 8 атомів вуглеприйнятних солей. цю, ще переважніше - від 1 до приблизно 6 атомів Прикладами замісників, які можна використати вуглецю, і найбільш переважно - 1, 2, 3 або 4 атов даному винаході, є ОН, OR', SH, SR', SOR', ми вуглецю. SO2R', NH2, NHR', N(R')2, NHCOR', NH(COR')2, Переважні алкілтіогрупи в сполуках даного виNHSO2R', C(=O)R', CO2H, CO2R', (С1-С12)-алкіл і находу містять один або декілька (але переважно, (С1-С12)-галогеналкіл, причому кожну групу R' витільки один) простих тіоефірних зв'язків і від 1 до бирають, незалежно, з групи, що складається з приблизно 12 атомів вуглецю, переважніше - від 1 ОН, (С1-С12)-алкілу, (С1-С12)-галогеналкілу, арилу до приблизно 8 атомів вуглецю, і ще переважніше (який можливо, необов'язково, заміщений групою, - від 1 до приблизно 6 атомів вуглецю. Алкілтіогрувибраною з числа (С1-С6)-алкілу, (С1-С6)-алкокси, пи з 1, 2, 3 або 4 атомами вуглецю особливо пере(С1-С6)-алкілтіо, NH2, (С1-С6)-алкіламіно, ді-(С1-С6)важні. алкіламіно, NO2, CN і галогену), аралкілу або ариПереважні алкілсульфінільні групи в сполуках лалкенілу (арильна група якого може бути, неободаного винаходу включають групи, що містять одв'язково, заміщена групою, вибраною з числа (С1ну або декілька сульфоксидних (SO) груп і від 1 до С6)-алкілу, (С1-С6)-алкокси, (С1-С6)-алкілтіо, NH2, приблизно 12 атомів вуглецю, переважніше - від 1 (С1-С6)-алкіламіно, ді-(С1-С6)-алкіламіно, NO2, CN і до приблизно 8 атомів вуглецю, і ще переважніше галогену), і де група R1 являє собою групу форму- від 1 до приблизно 6 атомів вуглецю. Особливо ли N(R')2 або NH(COR')2, групи R' можуть бути одпереважними є алкілсульфінільні групи з 1, 2, 3 наковими або різними, або дві групи R', разом з або 4 атомами вуглецю. атомом азоту, до якого вони приєднані, утворюють Переважні алкілсульфонільні групи в сполуках 5-12-членний гетероцикл. даного винаходу включають групи, що містять одУ визначеннях, що використовуються в даному ну або декілька сульфонільних (SO2) груп і від 1 до винаході, алкільні групи можуть являти собою груприблизно 12 атомів вуглецю, переважніше - від 1 пи з лінійними або розгалуженими ланцюгами і, до приблизно 8 атомів вуглецю, і ще переважніше переважно, містять від 1 до приблизно 12 атомів - від 1 до приблизно 6 атомів вуглецю. Особливо вуглецю, переважніше - від 1 до приблизно 8 атопереважними є алкілсульфонільні групи з 1, 2, 3 мів вуглецю, ще переважніше - від 1 до приблизно або 4 атомами вуглецю. 6 атомів вуглецю, і найбільш переважно - 2, 3 або Переважні алканоїльні групи в сполуках дано4 атоми вуглецю. Особливо переважними алкільго винаходу включають групи, що містять одну або ними групами в сполуках даного винаходу є метил, декілька карбонільних (CO) груп і від 1 до приблиетил і пропіл, включаючи ізопропіл. Термін "алкіл", зно 12 атомів вуглецю, переважніше - від 1 до що використовується в даному описі, якщо немає приблизно 8 атомів вуглецю, і ще переважніше інших вказівок, відноситься як до циклічних, так і від 1 до приблизно 6 атомів вуглецю (включаючи до ациклічних груп, хоча циклічні групи містять вуглець карбонілу). Особливо переважними є алщонайменше три циклічних атоми вуглецю. каноїльні групи з 1, 2, 3 або 4 атомами вуглецю, Галогеналкільні групи являють собою алкільні особливо, формільна, ацетильна, пропіонільна, групи (в тому числі, циклоалкільні групи), що мабутирильна і ізобутирильна групи. ють вказані вище значення, заміщені одним або Переважні алкіламіногрупи в сполуках даного декількома атомами галогену (переважно, фтору, винаходу містять один або декілька (але переважхлору, брому або йоду) і що містять, переважно, но, тільки один) NH-зв'язків і від 1 до приблизно 12 від 1 до приблизно 12 атомів вуглецю, переважніатомів вуглецю, переважніше - від 1 до приблизно ше від 1 до приблизно 8 атомів вуглецю, ще пере8 атомів вуглецю, і ще переважніше - від 1 до приважніше - від 1 до приблизно 6 атомів вуглецю, і близно 6 атомів вуглецю. Особливо переважними найбільш переважно - 1, 2, 3 або 4 атоми вуглецю. є алкіламіногрупи з 1, 2, 3 або 4 атомами вуглецю, Особливо переважними галогеналкільними групаособливо, групи метиламіно, етиламіно, пропілами в сполуках даного винаходу є метильні, етильні міно і бутиламіно. і пропільні, включаючи ізопропільні, групи, заміщеПереважні діалкіламіногрупи в сполуках даноні 1, 2 або 3 атомами галогену, які можуть бути го винаходу містять один або декілька (але переоднаковими або різними, особливо, фторметил, важно, тільки один) атомів азоту, пов'язаних з фторхлорметил, трифторметил і трихлорметил. двома алкільними групами, кожна з яких може місПереважні алкенільні і алкінільні групи в спотити від 1 до приблизно 12 атомів вуглецю, перелуках даного винаходу містять один або декілька важніше - від 1 до приблизно 8 атомів вуглецю, і ненасичених зв'язків і від 2 до приблизно 12 атомів ще переважніше - від 1 до приблизно 6 атомів вугвуглецю, переважніше - від 2 до приблизно 8 атолецю. Алкільні групи можуть бути однаковими або 9 77400 10 різними. Особливо переважними є діалкіламіногсуспензії або емульсії) відповідного складу для рупи, де кожна алкільна група містить 1, 2, З або 4 перорального, місцевого або парентерального атоми вуглецю, особливо, групи диметиламіно, введення, і вони можуть містити чисту сполуку або діетиламіно, N-метилетиламіно, Nїї поєднання з будь-яким носієм або іншими фаретилпропіламіно, дипропіламіно, дибутиламіно і Nмакологічно активними сполуками. Може бути потметилбутиламіно. рібна стерильність таких композицій, коли їх ввоПереважні алканоїламіногрупи в сполуках дадять парентерально. ного винаходу містять один зв'язок NH-CO-, приєВведення таких сполук або композицій можна днаний до алкільної групи, що містить від 1 до здійснити будь-яким відповідним способом, таким приблизно 12 атомів вуглецю, переважніше - від 1 як внутрішньовенна інфузія, у вигляді препаратів до приблизно 8 атомів вуглецю, і ще переважніше для перорального введення, інтраперітонеальним - від 1 до приблизно 6 атомів вуглецю. Особливо і внутрішньовенним способом. Переважно застопереважними є алканоїламіногрупи з 1, 2, 3 або 4 совувати інфузію тривалістю до 24 годин, переваатомами вуглецю, особливо, групи форміламіно, жніше - протягом 2-12 годин, найбільш переважно ацетиламіно, пропіоніламіно і бутириламіно. Група - протягом 2-6 годин. Особливо бажані короткочаацетиламіно є особливо переважною. сні інфузії, що дозволяють здійснювати лікування Переважні діалканоїламіногрупи в сполуках без того, щоб залишати в госпіталі на ніч. Однак, даного винаходу містять один атом азоту, пов'язаінфузія може продовжуватися 12-24 години або ний з двома алканоїльними групами, що мають навіть довше, якщо це необхідне. Інфузію можна вказане вище значення, які можуть бути однакоздійснювати з відповідними інтервалами, напривими або різними, і кожна з яких містить від 1 до клад, в 2-4 тижні. Фармацевтичні композиції, що приблизно 12 атомів вуглецю, переважніше від 1 містять сполуки винаходу, можна доставляти за до приблизно 8 атомів вуглецю, і ще переважніше допомогою інкапсулювання в ліпосомах або нано- від 1 до приблизно 6 атомів вуглецю. Особливо сферах, за допомогою композицій з відстроченим переважними є діалканоїламіногрупи, де кожна вивільненням або будь-яким іншим способом досалканоїльна група містить 1, 2, 3 або 4 атоми вугтавки. лецю, особливо, групи диформіламіно, формілаТочне дозування сполук буде змінюватися в цетиламіно, діацетиламіно, дипропіоніламіно і дизалежності від конкретної композиції, способу забутириламіно. Група діацетиламіно є особливо стосування і конкретних ситуацій, хазяїна і пухлипереважною. ни, від якої лікують. Потрібно брати до уваги і інші Переважні алкілсульфоніламіногрупи в сполуфактори, такі як вік, маса тіла, стать, харчування, ках даного винаходу містять один зв'язок NH-SO2-, час введення, швидкість екскреції, стан пацієнта, приєднаний до алкільної групи, що містить від 1 до комбінації лікарських засобів, чутливість до впливу приблизно 12 атомів вуглецю, переважніше - від 1 і серйозність захворювання. Введення можна здійдо приблизно 8 атомів вуглецю, і ще переважніше снювати безперервно або періодично в межах - від 1 до приблизно 6 атомів вуглецю. Особливо переносимої дози. переважними є алкілсульфоніламіногрупи з 1, 2, 3 Даний винахід також відноситься до фармацеабо 4 атомами вуглецю, особливо, групи метансувтичних композицій для комбінованої терапії, що льфоніламіно, етансульфоніламіно, пропансульвключають сполуку за даним винаходом і щонайфоніламіно і бутансульфоніламіно. менше одну іншу терапевтично активну сполуку. Приклади конкретних сполук за даним винахоІнша сполука може володіти протипухлинною акдом включають сполуки (1), (2), (5), (16), (18) і (21) тивністю або може володіти деякою іншою активна подальших сторінках, а також сполука, познаністю для застосування в поєднанні з протипухчена (20а), яка на схемі 4 є проміжною сполукою линною активністю сполук за даним винаходом. між сполуками (20) і (21), де R2 відсутній, R3 являє Інші лікарські засоби можуть становити частисобою ацетамідо, R4 являє собою водень, і R1 явну тієї ж композиції або можуть представлятися у ляє собою 2-метилтіопіримідин-4-іл, що є сполувигляді окремої композиції для введення в той же кою формули або інший час. Особливості іншого лікарського засобу спеціально не обмежуються, і відповідними кандидатами є а) лікарські засоби з антимітотичною дією, особливо, направлені на елементи цитоскелету, включаючи модулятори мікротрубочок, такі як таксанові лікарські засоби (такі як таксол, паклітаксел, таксотер, доцетаксел), подофілотоксини або алкалоїди барвінку (вінкристин, вінбластин); b) антиметаболічні лікарські засоби, такі як 5Даний винахід також відноситься до фармацефлуорурацил, цитарабін, гемцитабін, аналоги пувтичних композицій, що містять сполуки за даним рину, такі як пентостатин, метотрексат; винаходом і фармацевтично прийнятного носія, і c) алкілуючі засоби, такі як азотвмісні похідні до застосування сполук за даним винаходом при іприту (такі як циклофосфамід або іфосфамід); одержанні лікарського засобу. Він також відноd) лікарські засоби, направлені на ДНК, такі як ситься до способів лікування. антрациклінові лікарські засоби адріаміцин, доксоПриклади фармацевтичних композицій вклюрубіцин, фарморубіцин або епірубіцин; чають будь-які тверді форми (таблетки, пілюлі, e) лікарські засоби, направлені на топоізомекапсули, гранули і т.п.) або рідкі форми (розчини, рази, такі як етопозид; 11 77400 12 f) гормони і агоністи або антагоністи гормонів, такі як естроген, антиестрогени (тамоксифен і споде X являє собою галоген, і R2, R3 і R4 мають ріднені сполуки) і андрогени флутамід, лейпроревказані вище значення, зокрема, коли X являє солін, гозерлін, ципротрон або октреотид; бою йод, R2 являє собою захисну групу, R3 являє g) лікарські засоби, направлені на сигнальну собою захищену аміногрупу, і R4 являє собою вотрансдукцію в пухлинних клітинах, включаючи подень, гідрокси або метокси. хідні антитіл, такі як герцептин; Підхід до синтезу варіоліну В розроблений з h) алкілуючі лікарські засоби, такі, як такі, що використанням як мішень дезоксиваріоліну В (5). містять платину, лікарські засоби (цисплатин, карРаніше синтез засновувався на одержанні звичайбонплатин, оксаплатин, параплатин), або нітрозоної трициклічної системи піридопіролопіримідину з сечовини; 7-азаіндолу. Ключовою стадією є гетероарильне і) лікарські засоби, що потенційно впливають поєднання з метою введення піримідинового заміна метастаз пухлин, такі як інгібітори матрикссника, каталізоване Pd(0). металопротеїназ; j) засоби генної терапії і антисмислові засоби; k) терапевтичні препарати на основі антитіл; і) інші біологічно активні сполуки морського походження, особливо, дидемніни, такі як аплідин, або ектеїнасцидини, такі як Et 743; m) протиблювотні лікарські засоби, зокрема, дексаметазон. Цитотоксичність сполук за даним винаходом, Введення ланцюга, що містить функціональні одержаних за схемою 4, ілюструється наведеними групи, з двома вуглецями у 2-е положення 7далі даними за ІС50 в мкМ. азаіндолу [див. J. Org. Chem., 1965, 30, 2531-2533], Сполука Р-388 А-549 НТ-29 досягають шляхом взаємодії 2-літійпохідного з 25 0,36 0,04 0,04 фталімідоацетальдегідом (6), який сам одержують 21 >3 0,16 0,16 з виходом 75% з диметилацеталю 220а >3 0,29 0,29 аміноацетальдегіду, захищаючи аміногрупу шляваріолін В 0,85 0,17 0,09 хом взаємодії з фталевим ангідридом в СН2Сl2 при Винахід також відноситься до синтезу сполук, 140°С протягом 15 хвилин, з подальшим гідролівиходячи з 7-азаіндолу, або на більш пізній стадії. зом ацетальної групи за допомогою 10% НСl при Одержання трициклічних піридопіролопіримідонів кип'ятінні із зворотнім холодильником. Літіювання (11), виходячи з 7-азаіндолу, досягають шляхом 7-азаіндолу раніше описане тільки для його Nлітіювання за вуглецем 2, введення бічного ланфенілсульфонільного похідного [див. Tetrahedron, цюга 3 2 і подальшої циклізації. Реакцію гетероа1997, 53, 3637-3648]. Використовують спосіб, опирильного поєднання використовують для введення саний [Katritzky, див. J. Am. Chem. Soc, 1986, 108, четвертого ароматичного циклу. 6808-6809], що включає 2-літіювання літієвої солі Таким чином, даний винахід відноситься до 1-карбонової кислоти, одержаної in situ, оскільки способу одержання сполук за даним винаходом, чудовий вихід знайдений з використанням 1що включає взаємодію необов'язково заміщеного фенілсульфоніл-7-азаіндолу, і, крім того, виклю5-галогентридо[3',2':4,5]піроло[1,2-с]піримідину або чаються дві окремі стадії введення і видалення N8,9-дигідро-5-галогенпіридо-[3',2':4,5]піроло[1,2захисної групи. Таким чином, взаємодія біслітійс]піримід-9-ону з дериватизованою ароматичною похідного (7) з альдегідом (6) дає спирт (8) з вихосполукою, такою як станіларильна сполука, особдом 44%. Захист спирту у вигляді простого тетраливо, триметилстаніларильна сполука, особливо, гідропіранільного ефіру дає суміш діастереомерів, похідне триметилстанілпіримідину. Потім одержаяка не розділяється, оскільки обидва центри симений продукт можна ввести у взаємодію для заміни трії пізніше при синтезі втрачаються. Гідразиноліз замісників. Аміно або інші реакційноздатні заміснифталімідного залишку дає амін (9) з кількісним ки у вихідній сполуці можна захистити, а потім вивиходом, який перетворюють в тетрагідропіримідалити захисні групи. дон (10) з виходом 76% при обробці трифосгеном Таким чином, переважними проміжними спов СН2Сl2 з діізопропілетиламіном (DIEPA) як оснолуками за даним винаходом є сполуки формул ва. Дигідропіримідон (11) одержують після видалення захищаючої гідрокси групи за допомогою кислотного гідролізу з подальшою дегідратацією спирту через мезилат (схема 1). Схема 1. Синтез піридо[3',2':4,5]піроло[1,2-с]піримідин1-ону (11)9 13 77400 14 і: МОМСl, NaH, ДМФА, 0°С (87%); іі: NBS, СН2Сl2, 0°С (80%); іі: І2, КОН, ДМФА, 0°С (62%). Змінюють стратегію реакції поєднання і на цей раз використовують триметилстанілпіримідин (15) і йод-7-азаіндол (13b). Одержання піримідину (15) [див. Tetrahedron, 1989, 45, 993-1006], покращується з використанням Pd(OAc)2 і PPh3 в ТГФ і скорочуються кількість TBAF і час реакції в порівнянні з тим, що описано в більш ранній роботі. і: н-BuLi, ТГФ, від -78°С до кімнатної температури (кт); іі: СО2, -78°С; ііі: трет-BuLi, ТГФ, -78°С; iv: 5 ТГФ, від -78°С до кт, 44%; v: DHP, НСІ-бензол, СНСl3 (87%); vi: NH2NH2.H2O, EtOH (100%); vii: (Cl3O)2CO, DIPEA, CH2Cl2, кт (76%); viii: 4H HCl, CH2Cl2 (100%); ix: MsCl, TEA, CH2Cl2, 0°C (95%). На основі раніше здійснених експериментів з гетероарильного поєднання з 7-азаіндолом [див. Synthesis, 1999, 615-620], і літіювання дигідропіроло[1,2-с]піримідин-1-онів, [див. J. Soc. Chem. Perkin Trans., I, 1999, 249-255], розробляється одержання похідного (14) з галогенпохідного із захисною групою (13). Захисту трициклічного піримідону (11) досягають за допомогою метилхлорметилового ефіру в ДМФА з використанням гідриду натрію як основи з одержанням (12). Галогенування (12) з використанням Nбромсукциніміду (NBS) або йоду з гідроксидом калію дає (13а) (80%) і (13b) (62%), відповідно. Те, що галоген введений по С-5, підтверджують, порівнюючи спектри 1Н-ЯМР: синглет Н-5 при 66,41 м.д. присутній в (12), але не присутній в спектрах (13а) і (13b). На жаль, не вдається виділити похідне олова (14), наприклад, обробка (13а) бутиллітієм з подальшим гасінням хлоридом триметилолова [див. Synthesis, 1999, 615-620], дає складну суміш, яку неможливо розділити. Спроби здійснити взаємообмін йоду і олова шляхом обробки (13b) гексаметилдіоловом в діоксані з каталізатором Pd(PPh3)4 приводять до суміші (14) і (12) в співвідношенні 7:3, але виділити 14 методом колонкової хроматографії не вдається. Схема 2 Розчин йодовмісного похідного (1ммоль), (15) (3ммоль), каталізатора А або В і LiCl (3ммоль) в діоксані (20мл) кип'ятять із зворотнім холодильником протягом 5 годин. Розчинник випаровують і залишок очищають колонковою флешхроматографією. Реакція поєднання між (13b) і (15) в усіх умовах експерименту дає суміш (12) і (16), які неможливо розділити (табл. 1). Таблиця 1 Реакція поєднання між (13b) і (15) в діоксані (15)/(13b)а Катал./ліг.ь 1,1 А 1,2 В 2 В LiCl/CuIc 3/-3/-3X0,1 16/12d 2:1 2:1 3:1 %е 56 52 53 а: молярне співвідношення; b: A = Pd(PPh3)4, 0,1 еквівалента; В=Рd2(dbа)3, 0,1 еквівалента, і PPh3, 0,2 еквівалента; с: відносно 1 еквівалента 13b; d: відношення вимірюють методом 1Н-ЯМР; e: вихід (16) обчислюють методом 1Н-ЯМР на сиру реакційну суміш. Через труднощі очищення (16) робиться введення нової захисної групи. Йодовмісну сполуку (17), які відрізняється від (13b) захисною групою, синтезують за допомогою взаємодії (11) з тозилхлоридом і гідридом натрію в ДМФА з подальшим йодуванням за допомогою NIS. Реакція поєднання між (17) і триметилстанілпіримідином (15) дає тетрациклічну сполуку (18), але з виходом тільки 10% навіть при використанні умов реакції, вказаних в табл. 1 для поєднання (13b) і (15). Схема 4 Синтез дезоксиваріоліну В 15 і: TsCl, NaOH, ДМФА (40%); ii: NIS, CHCl3, кт (80%); ііi: 15, Pd2(dba)3, PPh3, LiCl, Cul (10%); iv: TMSCІ, HMDSA, 2,6-лутидин; ν: NH3, 150°C, 60ф/д2 (30% в двох стадіях); vi: Ас2О, ТГФ (75%); vii: NIS, CHCl3 (95%); viii: iii, потім НСІ-МеОН (45%); іх: м-СРВА, СН2СІ2, 0°С (90%); х: ΝΗ4ΟΗ, діоксан, 80°С (90%). Наступним наближенням є зміна функціональності С-циклу шляхом перетворення пиримідону (11) в йодамідопіримідин (20). Амінопохідне 19 одержують О-силілуванням (11) TMSCІ і гексанетилдисилазаном (HMDSA) як силілуючим агентом з подальшим нуклеофільним заміщенням аміаком [див. Lebgs Ann. Chem., 1975, 988-1002]. Ацилювання аміну (19) і галогенування за вільним поло 77400 16 женням -збагаченого циклу проходять з чудовим виходом. Гетероарильне поєднання (20) і (15) в одних і тих же умовах реакції і з тим же каталізатором, що і раніше, дає суміш ацильованих і позбавлених захисних груп амінів, які при метанолізі з сухим НСI в метанолі дають амін (21) з виходом 45%. Дезоксиваріолін В (5) одержують шляхом заміни метилтіогрупи нового піримідинового циклу на аміногрупу. Окислення (21) з використанням мхлорпербензойної кислоти з подальшою заміною одержаного сульфону на аміногрупу з використанням гідроксиду амонію дає (5) з високим виходом [див. Tetrahedron, 1989, 45, 993-1006, і Katrizky A.R., Rees C.W., Comprehensive Heterocyclic Chemistry, Pergamon Press, Oxford, 1984, vol.3, page 111]. Більш загальна схема синтезу має наступний вигляд. 17 Реагенти і: н-BuLi, ТГФ, від -78°С до кт; іі: СО2, -78°С; ііі: трет-BuLi, ТГФ, -78°С; iv: 6, ТГФ, від -78°С до кт; v: DHP, HCI, бензол, СНСI3, А; vi: NH2NH2.H2O, EtOH, A; vii: (CI3CO)2CO, DIPEA, СН2СI2, кт; viii: 4H HCl, CH2Cl2; іх: MsCl, TEA, CH2CI2, 0°C; x: МОМСl або TsCl, NaH, ДМФА, 0°С; xi: NBS/NIS, CH2Cl2, 0°C, або I2, KOH, 0°C; xii: 15, Pd2(dba)3,PPh3, LiCl, Cul, діоксан, А; xiii: TMSCl, HDMSA, лутидин, D; xiv:NH3, 150°C, 60ф/д2; xv: Ac2O, ТГФ, кт; xvi: NIS, CHCI3, 0°C; xvii: TsN=CCl2, DIPEA, CH2Cl2, кт; хvііі: 4н НСl, СНСl3, кт; xix: MsCl, TEA, CH2Cl2, кт; xx: NIS, CHCl3, -30°C; xxi: сухий МеОН-НСІ або 48% HBr, A. Біциклічну спол. 11b (X = OMe) одержують з 4метокси-7-азаіндолу [див. J. Heterocyclic Chem., 1989, 26, 317], з тими ж подальшими взяємодіями, що і у випадку 11а. Перетворення 11b в 19b здійснюють з виходом тільки 22% за допомогою Осилілування триметилсилілхлоридом (TMSCl) і гексаметилдисилазаном (HMDSA) з подальшим нуклеофільним заміщенням аміаком. Ацилювання 19b і йодування одержаного ацетилпохідного да1 ють йодацетамід 20b. Н-ЯМР 20b показує дві незалежні АВ-ароматичні системи через пари протонів Н3-Н4 і Н7-Н8. Каталізоване паладієм поєднання 20b і 2-ацетиламіно-4триметилстанілпіримідину (27) з подальшою обробкою кислотою дає О-метилваріолін В (5b). Станілпіримідин (27) одержують з виходом 40% з 4хлор-2-метансульфонілпіримідину [див. Heterocycles, 1977, 8, 229], шляхом нуклеофільного заміщення метансульфонільної групи аміаком в ізо-РrOН з подальшим ацилюванням Ас2О і взаємообміном галогену і металу в діоксані з використанням гексаметилдіолова і Pd(PPh3)4 як каталізатора. Утворення піримідонового циклу не включає поліпшення одержання трициклічних систем 19. Трициклічні сполуки 22а-с одержують з 9а-с за допомогою взаємодії з N-дихлорметилен-4метилбензолсульфонамідом [див. Chem. Ver., 1966, 99, 1252], і DIPEA в СН2СI2 з подальшими видаленням О-захисної групи і дегідратацією. NТозилпохідні 23 одержують подібним чином із 22 за допомогою каталізованого кислотою видалення О-захисної групи з подальшою дегідратацією, як описується для перетворення 10 41. Видалення N-тозилзахисної групи із 23 здійснюють з використанням Na в аміаку або Na в нафталіні, причому одержують 19 з помірним виходом. Реакція гетероарильного поєднання 23 і станілпохідного 27 в умовах, подібних описаним раніше, дає 25 з дуже хорошим виходом. Видалення захисної групи для N-ацетилу можна здійснити метанолізом МеОН в НСI, що каталізується кислотою. Перехід 25а 26 можна здійсни 77400 18 ти шляхом обробки НВr. Сполука 26 є новим похідним варіоліну В, захищеним тільки за одним азотом. Одержано декілька похідних варіоліну В, три з яких тільки з однією зміною: 5а являє собою дегідроксиваріолін В, 5b являє собою метилваріолін В, і 26 являє собою тозилваріолін В. Видалення тозилу з 26 можна здійснити в тих же умовах, що і у випадку 23, і буде виходити варіолін В. За допомогою подібної експериментальної процедури з 23с можна одержати сполуку 25с, а з неї - похідні, утворені за піримідиновим циклом. Попередній експеримент показує хороші результати, що передбачаються при поєднанні гетероароматичних олововмісних похідних і 13b, 17 і 24, причому в загальній формулі одержують різні R1. Розроблена універсальна процедура синтезу, яку можна використати не тільки для синтезу похідних вказаної групи алкалоїдів морського походження, але також для одержання похідних інших природних продуктів. За даною заявкою запитується пріоритет за більш ранньою подачею. Те, що при подачі не включено в текст даного опису, включене в нього як посилання. Приклади винаходу Приклад 1 2-(1-Гідрокси-2-фталімідоетил)-7-азаіндол (8а) До охолодженого (-78°С) розчину 7-азаіндолу (7,6г, 64ммоль) в сухому ТГФ (150мл), додають HBuLi (44мл 1,6Μ розчину в гексані), і суміш перемішують протягом 10хв. Через суміш протягом 40хв. барботують сухий СО2. Розчинник випаровують, і залишок розчиняють в свіжій порції сухого ТГФ (400мл). Розчин охолоджують до -78°С, і додають трет-BuLi (42мл 1,7Μ розчину в гексані). Суміш перемішують протягом 20хв. Додають поступово розчин фталімідоацетальдегіду (14г, 71ммоль) в ТГФ (400мл). Через 1,5 години реакцію гасять насиченим водн. розчином NH4Cl (100мл), і органічний розчинник випаровують. Суміш розчиняють в СН2Сl2 і промивають водою. Органічний розчин сушать і упарюють. Суміш очищають колонковою флеш-хроматографією. Елюювання сумішшю СН2Сl2 і ацетону (95/5) дає 7-азаіндол (3,8г, 50%) і сумішшю СН2Сl2 і МеОН (98/2) дає 8а (8,7г, 44%) у вигляді білої твердої речовини. Т.пл. 231-232°С (СН2Сl2/МеOН). ІЧ (KBr) 3200 (m, NH), 1760 (s, С=О), 1704 (s, NCO), 1427 (m, C-N), 1395 (m, С-О). 1 Н-ЯМР (ДМСО-d6, 200МГц) 3,88 (дд, J 13,6 і 6,0, 1Н, Н2'), 4,00 (дд, J 13,6 і 7,8, 1Н, Н2'), 5,06 (ддд, J 7,8, 6,0 і 5,2, 1Н, Н1'), 5,83 (д, J 5,2, 1Н, ОН), 6,34 (д, J 1,8, 1Н, Н3), 6,99 (дд, J 8,0 і 4,8, 1Н, Н5), 7,81-7,88 (м, 4Н, Ph), 7,89 (дд, J 8,0 і 1,4, 1Н, 19 77400 20 Н4), 8,14 (дд, J 4,8 і 1,4,1 Н, Н6), 11,75 (ушир.с, 1Н, Слідуючи вище описаному способу, з 4-хлорNH). 7-азаіндолу (5г, 33ммоль) в ТГФ (100мл), H-BuLi 13 (20мл 1,6Μ розчину в гексані), трет-BuLi (20мл C-NMR (ДМСО-d6, 75МГц) 43,6 (т, С2'), 64,4 1,7Μ розчину в гексані) і розчину фталімідоацета(д, С1'), 96,8 (д, С3), 115,4 (д, С5), 119,8 (с, С3а), льдегіду (7,5г, 39ммоль) в ТГФ (140мл) одержують 123,0 (д, Ph- ), 127,6 (д, С4), 131,6 (с, сам Ph), сиру суміш, яку очищають колонковою флеш134,3 (д, Ph-a), 140,8 (с, С2), 142,1 (д, С6), 148,6 (с, хроматографією. Елюювання сумішшю СН2СI2 і С7а), 167,7 (с, Ph-CO). ацетону (95/5) дає 4-хлоразаіндол (4г, 80%), і суМС (El) m/z 308 (М+1, 6), 307 (М+, 25), 244 (8), мішшю СН2СI2 і МеОН (98/2) дає 8с (1,5г, 12%) у 160 (43), 147 (фталімід, 100), 119 (азаіндол, 52). вигляді білої твердої речовини. Елемент, аналіз: для C17H13N3O3 обчислено: С 1 Н-ЯМР (ДМСО-d6, 200МГц) 3,86 (м, 1Н, Н2'), (66,44), Η (4,26), Ν (13,67); знайдено: С (65,11), Η 3,95 (м, 1Н, Н2'), 5,01 (м, 1Н, Н1'), 5,92 (д, J 5,2, (4,26), Ν (13,37). 1Н, ОН), 6,41 (с, 1Н, Н3), 7,14 (д, J 5,6, 1Н, Н5), Приклад 2 7,84 (м, 4Н, Ph), 8,11 (д, J5,6, 1Н, Н6), 11,75 2-(1-Гідрокси-2-фталімідоетил)-4-метокси-7(ушир., 1Η, ΝΗ). азаіндол (8b) 13 С-ЯМР (ДМСО-d6, 75МГц) 43,6 (т, С2'), 64,3 (д, С1'), 94,9 (д, С3), 115,3 (д, С5), 118,7 (с, С3а), 123,0 (д, Ph- ), 131,6 (с, сам Ph), 133,3 (с, С2), 134,3 (д, Ph- ), 142,2 (с, С4), 142,8 (д, С6), 49,2 (с, С7а), 167,7 (с, Ph-CO). МС (El) m/z 342 (М+1, 4), 341 (М+, 20)'323 (МН2O, 44), 177 (100). Приклад 4 2-[2-Фталімідо-1-(2,3,5,6-тетрагідропіран-2іл)оксіетил]-7-азаіндол Слідуючи вище описаному способу, з 4метокси-7-азаіндолу (3,55г, 24ммоль) в ТГФ (75мл), H-BuLi (16,5мл 1,6Μ розчину в гексані), трет-BuLi (16мл 1,7Μ розчину в гексані) і розчину фталімідоацетальдегіду (5г, 26ммоль) в ТГФ (100мл) одержують сиру суміш, яку очищають колонковою флеш-хроматографією. Елюювання сумішшю СН2Сl2 і ацетону (95/5) дає 4метоксіазаіндол (2,06г, 58%), і сумішшю СН2Сl2 і МеОН (98/2) дає 8b (3,68г, 43%) у вигляді білої твердої речовини. Т.пл. 225-226°С (СН2Сl2/Ме0Н). ІЧ (KBr) 3500 (s, NH/OH), 1702 (s, С=O), 1594 (m), 1395 (m). 1 Н-NMR (ДМСО-d6, 200МГц) 3,88 (с, 3Н, Me), 3,86 (дд, J 13,8 і 6,0, 1Н, Н2'), 3,95 (дд, J 13,8 і 7,8, 1Η, Н2'), 5,00 (ддд, J 7,8, 6,0 і 5,1, 1Н, Н1'), 5,73 (д, J 5,1, 1Н, ОН), 6,30 (д, J 1,8, 1Н, Н3), 6,58 (д, J5,4, 1Н, Н5), 7,83 (м, 4Н, Ph), 8,02 (д, J 5,4, 1Н, Н6), 11,65 (ушир., 1Η,ΝΗ). 13 C-NMR (ДМСО-d6, 75МГц) 43,6 (т, С2'), 55,3 (кв., Me), 64,2 (д, С1'), 94,0 (д, С5), 97,8 (д, С3), 109,5 (с, С3а), 123,0 (д, Ph- ), 131,6 (с, сам Ph), 134,1 (д, Ph- ), 138,1 (с, С2), 144,2 (д, С6), 150,3 (с, С7а*), 158,5 (с, С4*), 167,7 (с, Ph-CO). МС (El) m/z 338 (М+1, 4), 337 (М+, 20), 319 (МН2О, 44), 177 (100). Елемент, аналіз: для C18H15N3O4.1/4H2O обчислено: С (63,25), Η (4,57), Ν (12,29); знайдено: С (63,32), Η (4,54), Ν (12,07). Приклад 3 4-Хлор-2-(1-гідрокси-2-фталімідоетилУ7азаіндол (8с) До розчину 8а (10,2г, 33ммоль) в СНСI3 (1л) додають 6н розчин НСI в сухому бензолі (180мл). До суміші додають 2,3-дигідропіран (46мл, 330ммоль). Реакційну суміш кип'ятять із зворотнім холодильником протягом 7 годин. Після охолоджування суміш промивають насиченим водн. розчином NаНСО3, сушать і упарюють. Суміш очищають колонковою флеш-хроматографією. Елюювання сумішшю СН2СI2 і МеОН (97/3) дає 2[2-фталімідо-1-(2,3,5,6-тетрагідропіран-2іл)оксіетил]-7-азаіндол (10,8г, 87%) як суміш діастереомерів (1:1) у вигляді білої твердої речовини. ІЧ (плівка) 1717 (s, С=О), 1390 (m, CO), 1026 (m, CO). 1 Н-ЯМР (ДМСО-d6, 200МГц) 1,30-1,80 (м, 6Н, Н3", Н4" і Н5"), 3,25-3,45 (м, 2Н, Н2'), 3,80, 3,98, 4,22 і 4,38 (м, дд, J 14,0 і 4,4, дд, J 14,8 і 2,0 і дд, J 14,0 і 9,4, 2Н, Н6"), 4,58 і 4,72 (дд, J 3,2 і 2,8 і дд, J 3,4 і 3,0, 1Н, Н2"), 5,30 і 5,39 (дд, У 8,4 і 5,2 і дд, J 9,2 і 4,0,1 Н, Н1'), 6,47 і 6,51(д, J 1,8 і д, J 1,8, 1Н, Н3), 7,08 і 7,15 (дд, J 8,2 і 4,8 і дд, J 8,2 і 5,2, 1Н, Н5), 7,69 (м, 2Н, Ph- ), 7,86 (м, 2Н, Ph- ), 7,86 (м, 1Н, Н4), 8,43 і 8,63 (дд, J 4,8 і 1,6 і дд, J 5,0 і 1,7,1 Н, Н7), 10,8 і 12,5 (ушир., 1Н, NH). 13 С-ЯМР (CDCI3, 50МГц) 8 18,8 і 19,9 (т, С3"*), 25,0 і 25,2 (т, С4"*), 30,2 і 30,8 (т, С5"*), 41,6 і 42,8 (т, С6"), 61,8 і 63,6 (т, С2'), 69,3 і 71,7 (д, С1'), 95,5 і 97,9 (д, С2"), 100,3 і 100,8 (д, С3), 115,9 (д, С5), 120,6 і 120,7 (с, С3а), 123,2 і 123,4 (д, Ph- ), 128,7 і 128,8 (д, С4), 131,8 і 132,0 (с, сам Ph), 133,9 і 134,0 21 77400 22 7-азаіндолу, з 8с (1/3г, 3,8ммоль) в СНСl3 (50мл), (д, Ph- ), 136,5 і 137,8 (с, С2), 143,1 (д, С6), 148,7 і 6н розчину НСl в бензолі (5мл) і 2,3-дигідропірану 149,2 (с, С7а), 168,1 (с, Ph-CO). (1,7мл, 19ммоль) одержують 4-хлор-2-[2МС (El) m/z 391 (М+, 1), 307 (М-ТНР, 9), 147 фталімідо-1-(2,3,5,6-тетрагідропіран-2-іл)оксіетил](38), 85 (100). 7-азаіндол (1,0г, 63%) у вигляді суміші діастереоЕлемент, аналіз: для C22H21N3O4.1/2H2O обчимерів (1:1). слено: С (65,99), Η (5,54), Ν (10,49); знайдено: С 1 Н-ЯМР (CDCl3, 300МГц) 1,30-1,80 (м, 6Н, (66,02), Η (5,80), Ν (10,28). Приклад 5 Н3", Н4" і Н5"), 3,25-3,45 (м, 2Н, Н2'), 3,96-4,39 (м, 4-Метоксі-2-[2-фталімідо-1-(2,3,5,62Н, Н6"), 4,58 і 4,72 (м, 1Н, Н2"), 5,30 і 5,40 (дд, J тетрагідропіран-2-іл)-оксіетил]-7-азаіндол 8,4 і 4,4 і дд, J 9,2 і 4,0, 1Н, Н1'), 6,58 і 6,63 (д, J 2,2 і д, J 2,2, 1Н, Н3), 7,13 і 7,20 (д, J 5,2 і д, J 5,2, 1Н, Н5), 7,70 (м, 2Н, Ph- ), 7,86 (м, 2Н, Ph- ), 8,35 і 8,55 (д, J 5,2 і д, J 5,2, 1Н, Н7), 11,7 (ушир., 1Η,ΝΗ). 13 С-ЯМР (CDCl3, 300МГц) 18,9 і 19,5 (т, С3"*), 25,0 і 25,3 (т, С4"*), 30,2 і 30,8 (т, С511*), 41,8 і 42,9 (т, С6"), 61,9 і 63,5 (т, С2'), 69,2 і 71,6 (д, С1'), 95,5 і 96,4 (д, С2"), 98,8 і 100,7 (д, С3), 116,1 (д, С5), 116,3 (с, С3а), 123,1 і 123,3 (д, Ph- ), 131,7 і 132,0 (с, сам Ph), 133,8 і 133,9 (д, Ph- ), 134,0 (с, С2), 143,2 і 143,3 (д, С6). Слідуючи тому ж способу, як для 2-[2МС (El) m/z 426 (М+1, 2), 425 (М+, 5), 341 (Мфталімідо-1-(2,3,5,6-тетрагідропіран-2-іл)оксіетил]ТНР, 14), 177 (100). 7-азаіндолу, з 8b (3,8г, 11ммоль) в СНСl3 (350мл), Приклад 7 6н розчини НСl в бензолі (35мл) і 2,3-дигідропірану 2-[2-Аміно-1-(2,3,5,6-тетрагідропіран-2(10мл, 110ммоль) одержують 4-метоксі-2-[2іл)оксіетил]-7-азаіндол (9а) фталімідо-1-(2,3,5,6-тетрагідропіран-2-іл)оксіетил]7-азаіндол (3,07г, 65%) у вигляді суміші діастереомерів (1:1). ІЧ (плівка) 1714 (s, ОО), 1392 (m, CO), 1026 (m, CO). 1 Н-ЯМР (CDCI3, 300МГц) 1,30-1,80 (м, 6Н, Н3", Н4" і Н5"), 3,25-3,45 (м, 2Н, Н2'), 3,99 і 4,01 (с, 3Н, ОМе), 3,96, 4,08, 4,28 і 4,39 (дд, J 13,5 і 3,9, дд, J 13,8 і 4,6, дд, J 13,8 і 8,5 і дд, J 13,5 і 9,6, 2Н, Н6"), 4,57 і 4,73 (ушир.т, J 3,2 і ушир.т, J 3,4, 1Н, Н2"), 5,25 і 5,33 (дд, J 6,9 і 2,4 і дд, J 9,9 і 4,1, 1Н, Н1'), 6,54 і 6,58 (ушир.с і ушир.с, 1Н, Н3), 6,56 і 6,62 (д, J 5,7 і д, J 5,7, 1Н, Н5), 7,68 (м, 2Н, Ph- ), 7,83 (м, 2Н, Ph- ), 8,38 і 8,57 (д, J 5,7 і д, J 5,7, 1Н, Н7), 11,7 (ушир., 1Н, NH). 13 С-ЯМР (CDCl3, 50МГц) 18,9 і 19,5 (т, С3"*), 25,0 і 25,3 (т, С4"*), 30,2 і 30,7 (т, С5"*), 42,0 і 43,0 (т, С6"), 55,4 (кв., МеО), 61,7 і 62,9 (т, С2'), 69,4 і 71,5 (д, С1'), 94,4 і 95,3 (д, С2"), 97,7 (д, С5), 97,8 і 100,1 (д, С3), 110,5 (с, С3а), 123,1 і 123,2 (д, Ph- ), 132,1 і 132,1 (с, сам Ph), 133,8 і 133,9 (д, Ph- ), 134,0 і 135,2 (с, С2), 144,9 і 145,1 (д, С6), 150,6 і 151,1 (с, С7а*), 159,8 (с, С4*), 168,1 (с, Ph-CO). МС (El) m/z 422 (М+1, 2), 421 (М+, 4), 337 (МТНР, 15), 177 (100). МС вис.розр., m/z, для C23H23N3O5 обчислене 421,1637; знайдене 421,1625. Приклад 6 4-Хлор-2-[2-фталімідо-1-(2,3,5,6тетрагідропіран-2-іл)-оксіетил]-7-азаіндол Слідуючи тому ж способу, як для 2-[2фталімідо-1-(2,3,5,6-тетрагідропіран-2-іл)оксіетил] До розчину 2-[2-фталімідо-1-(2,3,5,6тетрагідропіран-2-іл)оксіетил]-7-азаіндолу (10,2г, 26ммоль) в ЕtOН (630мл) додають NH2NH2.H2O (1,53мл, 31ммоль). Суміш кип'ятять із зворотнім холодильником протягом 3 годин. Розчинник випаровують, залишок розчиняють в СН2СI2 і промивають насиченим водн. розчином NaHCO3. Водний шар екстрагують три рази СН2СI2. Органічні розчини об'єднують і упарюють, і одержують суміш діастереомерів (1:1) 9а (6,12г, 100%) у 24 вигляді світло-оранжевої твердої речовини. ІЧ (плівка) ν 3200 (m, NH), 1421 (m, C-N), 1022 (m, CO). 1 Н-ЯМР (CDCI3, 200МГц) 1,40-1,90 (м, 6Н, Н3", Н4" і Н5"), 3,20 (м, 2Н, Н2'), 3,48 і 3,90 (м, 1Н, Н6"), 4,60 і 4,85 (ушир.т, J 3,5 і м, 1Н, Н2") 4,85 і 4,97 (м і ушир.т, J 5,7, 1Н, Н1'), 6,32 і 6,43 (с, 1Н, Н3), 7,03 і 7,07 (дд, J 6,6 і 4,8 і дд, J 6,6 і 5,0, 1Н, Н5), 7,85 і 7,90 (дд, J 6,6 і 1,4,1 Н, Н4), 8,29 і 8,36 (дд, J 4,8 і 1,4 і дд, J 5,0 і 1,4,1 Н, Н7), 10,9 і 12,5 (ушир., NH). 13 С-ЯМР (CDCI3, 75МГц) 19,7 і 20,0 (т, С3"*), 25,1 і 25,3 (т, С4"*), 30,6 і 30,9 (т, С5"*), 45,3 і 47,3 (т, С6"), 62,9 і 63,5 (т, С21), 73,4 і 75,5 (д, С1'), 96,1 і 97,3 (д, С2"), 99,8 і 99,9 (д, С3), 115,6 (д, С5), 120,7 (с, С3а), 128,4 і 128,5 (д, С4), 138,3 і 139,0 (с, С2), 142,2 і 142,3 (д, С6), 148,5 і 149,0 (с, С7а). МС (СІ, СН4) m/z 263 (М+1,15), 262 (М+, 100). МС вис.розр., m/z, для C14H19N3O2.H обчислене 262,1555; знайдене 262,1557. Приклад 8 23 2-[2-Аміно-1-(2,3,5,6-тетрагідропіран-2іл)оксіетил]-4-метоксі-7-азаіндол (9b) Слідуючи тому ж способу, як для 9а, з 4метоксі-2-[2-фталімідо-1-(2,3,5,6-тетрагідропіран2-іл)оксіетил]-7-азаіндолу (2,9г, 10ммоль) в ЕtOН (100мл) і NH2NH2.H2O (420мкл, 15ммоль) після взаємодії протягом 3год. одержують суміш діастереомерів (1:1) 9b (1,9г, 95%). ІЧ (плівка) 3150 (m, NH), 1590 (m, С=С), 1329 (m, C-N), 1114 (m, СО). 1 Н-ЯМР (CDCl3, 200МГц) 1,40-1,90 (м, 6Н, Н3"-Н5"), 3,19 (м, 2Н, Н21), 3,48 і 3,90 (м, 1Н, Н6"), 3,99 і 4,00 (с, 3Н, МеО), 4,60 і 4,85 (м, 1Н, Н2"), 4,85 і 4,97 (м і ушир.т J 5,7, 1Н, Н1'), 6,42 і 6,51 (с, 1Н, Н3), 6,51 і 6,55 (д, J 5,4, 1Н, Н5), 8,23 і 8,30 (Д, J 5,4, 1Н, Н7). 13 С-ЯМР (CDCl3, 75МГц) 20,0 (т, С311*), 25,2 і 25,4 (т, С4"*), 30,7 і 30,9 (т, С51'*), 45,4 і 47,4 (т, С6"), 55,4 і 55,5 (кв., МеО), 62,9 і 63,4 (т, С2'), 73,5 і 75,5 (д, С1'), 94,7 і 96,1 (д, С2"*), 97,1 і 99,6 (д, С3), 97,6 (д, С5), 110,5 (с, С3а), 135,8 і 136,5 (с, С2), 144,3 і 144,4 (д, С6), 150,3 і 151,3 (с, С4*), 159,4 і 159,5 (с, С7а*). МС (СІ, СН4) m/z 291 (М+, 2), 262 (M-CH2NH3, 12), 190 (М-ТНРО, 8), 177 (100). Приклад 9 2-[2-Аміно-1-(2,3,5,6-тетрагідропіран-2іл)оксіетил]-4-хлор-7-азаіндол (9с) Слідуючи тому ж способу, як для 9а, з 4-хлор2-[2-фталімідо-1-(2,3,5,6-тетрагідропіран-2іл)оксіетил]-7-азаіндолу (950мг, 2,2ммоль) в ЕtOН (50мл) і NH2NH2.H2O (250мкл, 4,4ммоль) після взаємодії протягом 3год. одержують суміш діастереомерів (1:1) 9с (640мг, 97%). 1 Н-ЯМР (CDCl3, 200МГц) 1,40-1,90 (м, 6Н, Н3"-Н5"), 3,19 (м, 2Н, Н2'), 3,50 і 3,95 (м, 1Н, Н6"), 4,60 і 4,85 (м, 1Н, Н2") 4,85 і 4,97 (ушир.т, 1Н, Н''), 6,46 і 6,54 (с, 1Н, Н3), 7,07 і 7,10 (д, J5,4, 1Н, Н5), 8,19 і 8,25 (д, J5,4, 1Н, Н7). 13 С-ЯМР (CDCl3, 75МГц) 19,8 і 20,1 (т, С3"*), 25,1 і 25,3 (т, С4"*), 30,6 і 30,9 (т, С5"*), 45,2 і 47,1 (т, С6"), 63,1 і 63,7 (т, С2'), 73,1 і 75,1 (д, С1'), 96,0 і 96,4 (д, С2"*), 98,3 і 100,2 (д, С3), 115,8 (д, С5), 120,1 і 120,4 (с, С4), 135,6 і 135,8 (с, С4), 139,1 і 139,8 (с, С3а), 142,4 і 142,5 (д, С6), 148, 9 і 149,5 (с, С7а). МС (СІ, СН4) m/z 295 (М+, 2), 266 (M-CH2NH3, 12), 194 (М-НРО, 8), 177 (100). Приклад 10 6,7,8,9-Тетрагідро-6-[2,3,5,6-тетрагідропіран-2 77400 24 іл)оксипіридо[3',2':4,5]-піроло[1,2-c]-піримідин-9-он (10а) Розчин 9а (7,4г, 28ммоль) і DIPEA (5мл, 28ммоль) в СН2Сl2 (300мл) поступово додають до розчину трифосгену (2,82г, 10ммоль) в СН2Сl2 (740мл), і суміш перемішують при кімнатній температурі протягом 30хв. Органічну суміш промивають насиченим води, розчином NH4Cl і водою. Органічний розчин сушать і упарюють, і одержують суміш діастереомерів (1:1) 10а (6,06г, 76%). ІЧ (КВr) ν 3252 (m, NH), 1716 (s, С=О), 1407 (m, C-N), 1302 (m, CO). 1 Н-ЯМР (CDCl3, 200МГц) 1,40-1,80 (м, 6Н, Н3"-Н5"), 3,45-4,00 (м, 2Н, Н7 і Н6') і 4,94 (м, 1Н, Н2"), 5,04 і 5,10 (дд, J 3,2 і 3,0 і J 4,4 1Н, H6), 6,56 і 6,59 (с, 1Н, H5), 6,79 і 7,00 (ушир., 1Н, NH), 7,20 і 7,22 (дд, J 7,6 і 4,8 і дд, J 8,0 і 4,8, 1Н, Н3), 7,89 і 7,93 (дд, J 7,6 і 1,8 і дд, J8,0 і 1,8,1 Η, Η4), 8,54 і 8,57 (дд, J4,8 і 1,8 і дд, J4,8 і 1,4, 1Н,Н2). 13 С-ЯМР (CDCl3, 50МГц) 18,9 і 19,3 (т, С4'), 25,3 і 25,4 (т, С5'), 30,1 і 30,4 (т, С3'), 43,5 і 45,3 (т, С6'), 62,2 і 62,6 (т, С7), 63,2 і 64,3 (д, С6), 95,7 і 96,7 (д, С2'), 102,3 і 103,7 (д, С5), 118,6 (д, С3), 121,3 і 121,7 (с, С4а), 129,1 і 129,2 (д, С4), 133,5 і 136,1 (с, С5а), 145,2 і 145,6 (д, С2), 148,0 і 148,1 (с, С10а), 149,8 і 150,2 (с, С9). МС (СІ, СН4) m/z 289 (М+1, 6), 288 (М+, 25), 204 (М-ТНР, 23), 85 (ТНР, 100). МС вис.розр., m/z, для С15Н17N3О3.Н обчислене 288,1348; знайдене 288,1352. Приклад 11 6,1,8,9-Тетрагідро-6-(2,3,5,6-тетрагідропіран-2іл)окси-4-метоксипіридо[3',2':4,5]піроло[1,2с]піримідин-9-он (10b) Слідуючи тому ж способу, як для 10а, з трифосгену (20мг, 0,7ммоль) в СН2СI2 (3мл), 9b (58мг, 0,20ммоль) і DIPEA (34мкл, 0,20ммоль) в СН2Сl2 (3мл) протягом 30хв. при кімнатній температурі одержують сиру суміш, яку очищають колонковою флеш-хроматографією. Елюювання сумішшю СН2Сl2 і МеОН дає суміш діастереомерів (1:1) 10b (40мг, 63%). ІЧ (KВr) 3258 (m, NH), 1714 (s, С10), 1566 (m, C=N), 1290 (m, CO). 1 Н-ЯМР (CDCl3, 200МГц) 1,40-1,80 (м, 6Н, Н3', Н4' і Н5'), 3,45 і 3,95 (м, 2Н, Н6'), 3,65 і 3,75 (м, 25 77400 26 2Н, Н7), 4,00 (с, 3Н, МеО), 4,67 і 4,94 (м, 1Н, Н2'), 124,2 (д, С4), 135,4 (с, С5а), 139,3 (д, С2), 142,9 (с, 4,99 і 5,07 (м, 1Н, Н6), 6,20 і 6,30 (ушир, 1Н, ΝΗ), С10а*), 143,8 (с, С9*). 6,65 і 6,66 (с, 1Н, Н5), 6,69 (д, J 5,9, 1Н, Н3), 8,44 і Приклад 13 8,46 (д, J 5,9, 1Н, Н2). 6,7,8,9-Тетрагідро-6-гідрокси-413 метоксипіридо[3',2':4,51піроло[1,2-сіпіримідин-9-он С-ЯМР (CDCl3, 50МГц) 18,7 і 19,4 (т, С4'), 25,3 і 25,4 (т, С5'), 30,1 і 30,3 (т, С3'), 43,5 і 45,3 (т, С6'), 61,9 і 62,6 (т, С7), 62,9 і 63,9 (д, С6), 95,5 і 96,2 (д, С2'), 99,6, 100,6 і 101,1 (д, С3 і С5), 130,9 (с, С5а), 147,3 і 147,7 (д, С2), 149,9 і 150,3 (с, С10а або С4), 159,7 (с,С9). MC (ΕΙ) m/z 318 (M+1, 2), 317 (M+, 28), 233 (22), 217 (66), 216 (65), 177 (100), 85 (ΤΗΡ, 100). МС вис.розр., m/z, для C16H19N3O4 обчислене 317,1376; знайдене 317,1383. До розчину 10b (25мг, 0,08ммоль) в СН2Сl2 Приклад 12 (5мл) додають 4н соляну кислоту (5мл), і суміш 6,7,8,9-Тетрагідро-6перемішують при кімнатній температурі протягом гідроксипіридо[3',2':4,5]піроло[1,2-с]піримідин-9-он 45хв. Органічний розчин відділяють і екстрагують 4н соляною кислотою. Водний розчин фільтрують і упарюють, і одержують 6,7,8,9-тетрагідро-6гідрокси-4-метоксипіридо[3',2':4,5]піроло[1,2с]піримідин-9-он (20мг, 95%) у формі гідрохлориду у вигляді світло-оранжевої твердої речовини. ІЧ (плівка) 3244 (m, NH), 1718 (s, O=O), 1627 (s, NCO), 1505 (m, ON), 1298 (m, CO). 1 До розчину 10а (6г, 21ммоль) в СН2Сl2 (400мл) Н-ЯМР (CD3OD, 200МГц) 3,56 (дд, J 13,6 і додають 4н соляну кислоту (450мл). Після пере4,8, 1Н, Н7), 3,71 (дд, J 13,6 і 3,6, 1Н, Н7), 4,29 (с, мішування протягом 45хв. при кімнатній темпера3Н, МеО), 5,11 (дд, J 4,8 і 3,6, 1Н, Н6), 6,91 (с, 1Н, турі два шари розділяють. Органічний розчин ексН5), 7,40 (д, J 6,9, 1Н, Н3), 8,42 (д, J 6,9, 1Н, Н2). 13 трагують 4н соляною кислотою. Водний розчин С-ЯМР (ДМСО-d6, 75МГц) 48,9 (т, С7), 60,5 фільтрують і упарюють, і одержують 6,7,8,9(кв., Me), 62,3 (д, С6), 101,7 (д, C5), 105,5 (д, С3), тетрагідро-6-гідроксипіридо-[3',2':4,5]піроло[1,2117,4 (с, С4а), 137,0 (с, С5а), 140,6 (д, С2), 141,4 с]піримідин-9-он (5г, 100%) у формі гідрохлориду у (с, С10а), 151,9 (с, С9), 169,0 (с, С4). вигляді світло-оранжевої твердої речовини. МС (El) m/z 234 (М+1, 12), 233 (М+, 77), 215 (МГідрохлорид 6,7,8,9-тетрагідро-6Н2О, 17), 55 (100). гідроксипіридо[3',2':4,5]піроло[1,2-с]піримідин-9-ону МС вис.розр., m/z, для С11Н11N3О3 обчислене ІЧ (KВr) 3500 (s, ВІН), 1721 (s, С=О), 1638 (m, 233,0800; знайдене 233,0813. С-С), 1503 (m, C=N). Приклад 14 1 Н-ЯМР (CD3OD, 300МГц) 3,61 (дд, J 13,0 і 8,9-Дигідропіридо[3',2':4,5]піроло[1,25,0, 1Н, Н7), 3,77 (дд, J 13,0 і 4,0, 1Н, Н7), 5,23 (дд, с]піримідин-9-он (11a) J 5,0 і 4,0, 1Н, Н6), 7,05 (с, 1Н, Н5), 7,86 (дд, J 8,0 і 6,0, 1Н, Н3), 8,56 (дд, J 6,0 і 1,2, 1Н, Н2), 8,86 (дд, J 8,0 і 1,2, 1Н, Н4). 13 С-ЯМР (CD3OD, 75МГц) 45,8 (т, С7), 59,6 (д, С6), 101,9 (д, С5), 119,0 (д, С3), 127,1 (с, С4а), 124,3 (д, С4), 137,4 (с, С5а), 139,4 (д, С2), 141,9 (с, С10а), 149,0 (с, С9). МС (CI, NH3) m/z 205 (M+1, 3), 204 (М+, 4), 180 (100), 163 (50), 130 (90). До охолодженого (0°С) розчину 6,7,8,9МС вис.розр., m/z, для C10H10N3O3 обчислене тетрагідро-6-гідроксипіридо[3',2':4,5]-піроло[1,2204,0773; знайдене 204,0772. с]піримідин-9-ону (1г, 4,2ммоль) і TEA (1,74мл, Розчин гiдрохлориду 6,7,8,9-тетрагідро-613ммоль) в СН2СI2 (20мл) додають краплями MsCl гідроксипіридо[3',2':4,5]піроло[1,2-с]піримідин-9-ону (320мкл, 4,2ммоль). Реакційну суміш перемішують в насиченому водн. розчині Na2CO3 тривало екстпротягом 30хв. при тій же температурі і органічний рагують СН2Сl2 і одержують зв'язану основу. розчин промивають насиченим водн. розчином 6,7,8,9-Тетрагідро-6NH4CI і водою. Органічний розчин сушать і упарюгідроксипіридо[3',2':4,5]піроло[1,2-с]піримідин-9-он ють, і одержують без додаткового очищення 11а ІЧ (KВr) 3400 (m, NH/OH), 1707 (s, С=О), (730мг, 95%) у вигляді білої твердої речовини. 1468 (m, C-N), 1408 (m, C-N), 1297 (m, CO). Т.пл. 265-266°С (МеОН). 1 Н-ЯМР (ДМСО-d6, 300МГц) 3,27 (м, 1Н, Н7), ІЧ (KBr) 3424 (m, NH), 1721 (s, C=О), 1691 (m, 3,42 (м, 1Н, Н7), 4,90 (дд, J 9,3 і 5,1,1 Η, Н6), 5,88 NCO), 1633 (m, C=С), 1408 (m, C=N), 1380 (m), (д, J 5,1, 1Н, ОН), 6,54 (с, 1Н, Н5), 7,21 (дд, J 7,4 і 1303 (m). 1 4,2, 1Н, Н3), 7,88 (ушир., 1Н, ΝΗ), 7,99 (ушир.д, J Н-ЯМР (ДМСО-d6, 300МГц) 6,50 (д, J 7,4, 7,4, 1Н, Н2), 8,30 (ушир.д, J 4,2, 1Н, Н4). 1Н, Н6), 6,60 (с, 1Н, Н5), 6,97 (дд, J 7,4 і 5,3, 1Н, 13 С-ЯМР (ДМСО-d6, 75МГц) 41,0 (т, С7), 55,7 Н7), 7,37 (дд, J 8,0 і 4,7, 1Н, Н3), 8,08 (дд, J 8,0 і (д, С6), 95,4 (д, С5), 113,8 (д, С3), 116,7 (с, С4а), 1,7, 1Н, Н4), 8,39 (дд, J 4,7 і 1,7, 1Н, Н2), 10,81 27 77400 28 (ушир.д, J 5,3, 1Н, NH). залишок очищають колонковою флеш13 хроматографією. Елюювання сумішшю СН2СI2 і С-ЯМР (ДМСО-d6, 75МГц) 94,9 (д, С5), 98,0 МеОН (95/5) дає 12 (267мг, 87%) у вигляді білої (д, С6), 119,8 (д, С3), 123,1 (с, С4а), 127,5 (д, С4), твердої речовини. 128,0 (д, С7), 137,0 (с, С5а), 142,5 (д, С2), 145,6 (с, ІЧ (плівка) 1711 (s, С=О), 1642 (m, NCO), С10а*), 146,7 (с, С9*). + МС (El) m/z 186 (М+1, 18), 185 (М , 15), 157 (М1393 (m, CO), 1175 (m, CO). 1 СО, 10) Н-ЯМР (CDCl3, 300МГц) 3,41 (с, 3Н, Me), (СІ, NHs) m/z 204 (М+18, 12), 187 (М+2,14), 186 5,29 (с, 2Н, СН2), 6,37 (д, J 7,5, 1Н, Н6), 6,41 (с, 1Н, (М+1, 100), 109 (48). Н5), 7,81 (д, J 7,5, 1Н, Н7), 7,26 (дд, J 7,8 і 4,8, 1Н, МС вис.розр., m/z, для С10Н7N3О обчислене Н3), 7,90 (дд, J 7,8 і 1,2, 1Н, H4), 8,52 (дд, J 4,8 і 185,0589; знайдене 185,0593. 1,2, 1Н, Н2). 13 Приклад 15 С-ЯМР (CDCl3, 50МГц) 56,9 (кв., Me), 78,0 8,9-Дигідро-4(т, CH2), 95,9 (д, С5), 99,6 (д, С6), 119,5 (д, С3), метоксипіридо[3',2':4,5]піроло[1,2-с]піримідин-9-он 123,3 (с, С4а), 127,9 (д, С4), 128,1 (д, С7), 135,1 (с, (11b) С5а), 143,7 (д, С2), 146,2 (с, С9), 147,1 (с, С10а). МС (El) m/z 230 (М+1, 30), 229 (М+, 100). МС вис.розр., m/z, для С12Н11N3О2 обчислено 229,0851; знайдене 229,0850. Приклад 17 8,9-Дигідро-8-(4метилфетлсульфоніл)піридо[3',2':4,5]піроло[1,2с]піримідин-9-он Слідуючи тому ж способу, як і для 11а, з 6,7,8,9-тетрагідро-6-гідрокси-4метоксипіридо[3',2':4,5]піроло[1,2-с]піримідин-9-ону (113мг, 0,42ммоль), TEA (195мкл, 1,25ммоль) і MsCl (32мкл, 0,42ммоль) в СН2СI2 (20мл) протягом 30хв. одержують без додаткового очищення 11b (74мг, 85%) у вигляді білої твердої речовини. ІЧ (KВr) 3380 (m, NH), 1721 (s, C=O), 1693 (m, NCO), 1633 (m, C=C), 1500 (m, C=N), 1294 (m, CO). 1 Н-ЯМР (ДМСО-d6, 200МГц) 3,98 (с, 3Н, Me), 6,44 (д, J 7,5, 1Н, Н6), 6,54 (с, 1Н, Н5), 6,89 (дд, J 7,5 і 2,0,1 Η, Н7), 6,96 (д, J 5,5, 1Н, Н3), 8,26 (д, J 5,5, 1Н, Н2). 13 С-ЯМР (ДМСО-d6, 75МГц) 55,5 (кв., Me), 92,6 (д, С5), 98,9 (д, С6), 101,0 (д, С3), 124,7 (д, С7), 114,0 (с, С4а), 134,1 (с, С5а), 144,9 (д, С2), 146,5 (с, С9), 147,7 (с, С10а), 159,1 (с, С4). МС (El) m/z 216 (М+1, 17), 215 (М+, 100), 214 (М-1, 11), 200 (М-Ме, 59), 172 (48). МС вис.розр., m/z, для C11H9N3O2 обчислене 215,0694; знайдене 215,0690. Приклад 16 8,9-Дигідро-8метоксиметилпіридо["3',2':4,5]піроло[1,2с]піримідин-9-он (12) До охолодженого (0°С) розчину 11а (250мг, 1,4ммоль) в ДМФА (10мл) додають NaH (65мг, 1,6ммоль). Суміш перемішують протягом 10хв. і додають краплями МОМСI (103мкл, 1,4ммоль). Суміш перемішують при 0°С протягом 1год. і гасять водою (1мл). Розчинник випаровують і залишок розчиняють в СН2СI2. Органічний розчин промивають води, розчином Na2CO3, упарюють, і До охолодженого (0°С) розчину 11а (500мг, 2,7ммоль) в ДМФА (30мл) додають NaH (130мг, 3,2ммоль). Суміш перемішують протягом 10хв. і додають розчин п-толуолсульфонілхлориду (570мг, 3,0ммоль) в ДМФА (10мл). Суміш перемішують при кімнатній температурі протягом 1 години і гасять водою (1мл). Розчинник випаровують, і залишок розчиняють в AcOEt. Органічний розчин промивають водн. розчином Na2CO3, упарюють, і залишок очищають колонковою флешхроматографією. Елюювання сумішшю гексану і СН2СI2 (1/1) дає 8,9-дигідро-8-(4метилфенілсульфоніл)-піридо[3',2':4,5]піроло[1,2с]піримідин-9-он (360мг, 40%) у вигляді білої твердої речовини. ІЧ (KВr) 1737 (s, 00), 1642 (m, NCO), 1393 (s, 502), 1175 (m). 1 H-HMP (CDCl3, 200МГц) 2,42 (с, 3Н, Me), 6,45 (д, J 8,0, 1Н, Н6), 6,48 (с, 1Н, Н5), 7,27 (дд, J 8,2 і 4,7, 1Н, Н3), 7,34 (д, J 8,4, 2Н, Н3' і Н5'), 7,65 (д, J 8,0, 1Н, Н7), 7,90 (дд, J 8,2 і 1,4,1 Η, Н4), 8,09 (д, J 8,4, 2Н, Н2' і Н6'), 8,53 (дд, J 4,7 і 1,4, 1Н, Н2). 13 С-ЯМР (CDCl3, 50МГц) 21,8 (кв., Me), 98,3 (д, С5), 100,2 (д, С6), 118,5 (с, С4'), 120,1 (д, С3), 123,6 (с, С4а), 123,7 (д, С4), 128,6 (д, С7), 129,6 (д, С3' і С5'), 129,8 (д, С2' і С6'), 133,8 (с, С5а), 141,8 (с, С1'), 144,6 (д, С2), 146,0 (с, С9). МС (El) m/z 340 (М+1, 7), 339 (М+, 32), 184 (MTs, 100). МС вис.розр., m/z, для C17H13N3O3S обчислене 339,0677; знайдене 339,0682. Приклад 18 8,9-Дигідро-5-бром-8метоксиметилпіридо[3',2':4,5]піроло[1,2с]піримідин-9-он (13а) 29 До розчину 12а (100мг, 0,44ммоль) в СН2СI2 (30мл) при 0°С додають NBS (78мг, 0,44ммоль), і суміш перемішують протягом 10хв. Суміш розбавляють СН2СI2 (50мл) і три рази промивають насиченим водн. розчином NaHCO3. Органічний шар сушать і упарюють, і одержують без додаткового очищення 13а (107мг, 80%) у вигляді світло-жовтої твердої речовини. ІЧ (KВr) 1715 (s, С=О), 1640 (m, ОС), 1092 (m, CO). 1 Н-ЯМР (CDCl3, 300МГц) 3,39 (с, 3Η, Me), 5,29 (с, 2Н, СН2), 6,43 (д, J 7,8, 1Н, Н6), 6,90 (д, J 7,8, 1Н, Н7), 7,33 (дд, J 8,1 і 4,8, 1Н, Н3), 7,86 (дд, J 8,1 і 1,5, 1Н, Н4), 8,54 (дд, J 4,8 і 1,5, 1Н, Н2). 13 С-ЯМР (CDCI3, 50МГц) 57,0 (кв., Me), 77,1 (с, С5), 78,3 (т, СН2), 97,7 (д, С6), 120,1 (д, С3), 122,7 (с, С4а), 126,7 (д, С4), 129,2 (д, С7), 132,8 (с, С5а), 144,8 (д, С2), 146,2 (с, С9), 146,5 (с, С10а). МС (El) m/z 310 (81ВrМ+1, 5), 309 (81ВrМ+, 50), 308 (79ВrМ+1, 5), 307 (79ВrМ+, 50), 45 (MOM, 100). МС вис.розр., m/z, для C12H1079BrN3O2 обчислене 306,9957; знайдене 306,9956. Приклад 19 8,9-Дигідро-5-йод-8метоксиметилпіридо[3',2':4,5]піроло[1,2с]піримідин-9-он (13b) До охолодженого (0°С) розчину 11а (100мг, 0,44ммоль) в ДМФА (4мл) одночасно додають йод (220мг, 0,8ммоль) і КОН (94мг, 1,66ммоль). Суміш перемішують протягом 30хв. при 0°С. Суміш гасять водним розчином (25мл) 0,5% NH3 і 0,1% Na2S2O5. Розчин екстрагують AcOEt і органічний розчин двічі промивають насиченим водн. розчином NaHCO3. Органічний шар сушать і упарюють, і одержують 13b (96мг, 62%) без якого-небудь додаткового очищення у вигляді світло-жовтої твердої речовини. ІЧ (плівка) 3200 1714 (s, С=О), 1637 (m, С=С), 1089 (m, С-О). 1 Н-ЯМР (CDCl3, 300МГц) 3,45 (с, 3Н, Me), 5,36 (с, 2Н, СН2), 6,46 (д, J 8,1, 1Н, Н6), 6,99 (д, J 8,1, 1Н, Н7), 7,40 (дд, J 8,1 і 4,8, 1Н, Н3), 7,81 (дд, J 8,1 і 1,8, 1Н, H4), 8,59 (дд, 49 J 4,8 і 1,8, 1Н, H2). 13 С-ЯМР (CDCl3, 50МГц) 54,5 (с, С5), 57,1 (кв., Me), 78,3 (т, СН2), 99,6 (д, С6), 120,3 (д, С3), 125,5 (с, С4а), 128,6 (д, С4), 129,8 (д, С7), 136,5 (с, С5а), 144,9 (д, С2), 146,0 (с, С9), 146,3 (с, С10а). МС (CI, NH3) m/z 357 (М+2, 5), 356 (М+1, 30), 230 (100), 77400 30 МС вис.розр., m/z, для С12H10IN3O2 обчислене 354,9820; знайдене 354,9823. Приклад 20 2-Метансульфаніл-4-триметилстанілпіримідин (15) До розчину 4-йод-2-метансульфенілпіримідину (800мг, 3,2ммоль), гескаметилдіолова (1мл, 4,8ммоль), Pd(OAc)2 (45мг, 0,31ммоль) і PPh3 (90мг, 0,62ммоль) в ТГФ (10мл) додають краплями TBAF (5мл 1Μ розчину в ТГФ). Суміш перемішують при кімнатній температурі протягом 1,5 годин. Розчинник видаляють у вакуумі і залишок очищають колонковою хроматографією на нейтральному оксиді алюмінію. Елюювання сумішшю гексану і AcOEt (99/1) дає 15 (585мг, 65%) у вигляді безбарвного масла. ІЧ (плівка) 1539 (m, ON), 1402 (m), 1306 (m), 1196 (m). 1 Н-ЯМР (CDCl3, 200МГц) 0,34 (с, 9Н, 3Ме), 2,54 (с, 3Н, Me), 7,08 (д, J 4,5, 1Н,Н5), 8,26 (д, 14,5, 1Н, Н6). 13 С-ЯМР (CDCl3, 75МГц) -9,5 (кв., Me), 14,0 (кв., Me), 124,5 (д, С5), 153,6 (д,С6), 171,4 (с, С2). МС (El) m/z 291 (120SnM+, 50), 276 (120SnM-Me, 100). МС вис.розр., m/z, для C8H14N2S120Sn обчислене 290,9977; знайдене 290,9973. Приклад 21 8,9-Дигідро-5-йод-8-(4метилфенілсульфоніл)піридо[3',2':4,5]піроло[1,2-с]піримідин-9-он (17) До охолодженого (0°С) розчину 11а (200мг, 0,59ммоль) в СН2Сl2 (20мл) додають порціями NIS (133мг, 0,59ммоль), і суміш перемішують протягом 30хв. при вказаній температурі. Суміш розбавляють СН2СI2 (50мл) і двічі промивають водою. Органічний шар сушать і упарюють, і одержують 17 (218мг, 80%) без якого-небудь додаткового очищення у вигляді світло-жовтої твердої речовини. ІЧ (плівка) 1735 (s, С=О), 1636 (s, NCO), 1395 (m, C-N), 1368 (s, SO2), 1175 (m), 1075 (m). 1 Н-ЯМР (CDCl3, 300МГц) 2,38 (с, 3H, Me), 6,43 (д, J 8,3, 1Н, Н6), 7,30 (м, 3Н, Н3, Н31 і Н5'), 7,68 (дд, J 8,1 і 1,5, 1Н, Н4), 7,72 (д, J 8,3, 1Н, Н7), 8,04 (д, J 8,4, 2Н, Н2' і Н6'), 8,49 (дд, J 4,8 і 1,5, 1Η, Η2). 13 С-ЯМР (CDCl3, 75МГц) 21,7 (кв., Me), 56,9 (с, С5), 100,0 (д, С6), 120,7 (д, С3), 123,8 (с, С4'), 125,3 (д, С4), 125,7 (с, С4а), 129,0 (д, С7), 129,5 (с, 31 77400 32 С1'), 129,6 (д, С3' і С5', 129,7 (д, С2' і С6'), 133,3 (с, но 464,9646; знайдене 464,9649. С5а), 135,0 (с, С10а), 145,5 (д, С2), 146,1 (с, С9).) Приклад 22 МС (El) m/z 466 (М+1, 8), 465 (М+, 36), 310 (M8,9-Дигідро-5-(2-метансульфанілтримідин-4Ts, 100), іл)піридо[3',2':4,5]піроло[1,2-с]піримідин-9-он (18) МС вис.розр., m/z, для C17H12IN3O3S обчислесушать і упарюють, і одержують 19а (4мг, 38%) у вигляді жовтої твердої речовини Т.пл. 214-215°С (різн.), (СН2Сl2/гексан). ІЧ (KВr) 3452 (m, NH), 3304 (m, NH), 1654 (m, C=C), 1618 (m, C=C), 1570 (m, C=M), 1403 (m, C-N). 1 Н-ЯМР (ДМСО-d6, 300МГц) 6,49 (с, 1Н, Н5), 6,72 (д, J 6,6, 1P, H6), 6,80 (ушир., 1Н, NH), 7,30 (д, J 6,6, 1H, H7), 7,42 (дд, J 7,8 і 4,6, 1H, H3), 8,14 (дд, J 7,8 і 1,5, 1H, H4), 8,33 (дд, J 4,6 і 1,5, 1H, H2), 8,60 (ушир., 1Н, NH). 13 С-ЯМР (ДМСО-d6, 75МГц) 88,8 (д, С5), Розчин 17 (50мг, 0,11ммоль), 2101,0 (д, С6), 119,6 (д, С3), 122,9 (с, С4а), 127,5 (д, метансульфаніл-4-триметилстанілпіримідину С4), 136,8 (с, С5а), 138,9 (д, С2), 139,4 (д, С7), (93мг, 0,32ммоль), Pd2(dba)3 (11мг, 0,011ммоль), 141,8 (с, С10а), 148,8 (с, С9). PPh3 (6мг, 0,022ммоль), LiCl (14мг, 0,32ммоль) і МС (El) m/z 185(М+1,15), 184 (М+, 100), 183 (МCul (4мг, 0,011ммоль) в діоксані (2мл) кип'ятять із 1, 7). зворотнім холодильником протягом 5 годин. РозМС вис.розр., m/z, для C10H8N4 обчислене чинник випаровують і сирий залишок очищають 184,0749; знайдене 184,0747. колонковою флеш-хроматографією. Елюювання Приклад 24 сумішшю СН2Сl2, МеОН і водн. розчину NH3 (4/4/2) 9-Аміно-4-метокситридо[3',2':4,5]піроло[1,2дає 18 (4мг, 12%). 1 с]піримідин (19b) Н-ЯМР (ДМСО-d6, 300МГц) 2,60 (3Н, s, MeS), 7,20 (1Н, d, J 6,3, H7), 7,42 (1H, дд, J 7,5 і 4,2, Н3), 7,45 (1H, d, J 5,7, H5'), 7,70 (1H, d, J 6,3, H6), 8,22 (1H, d, J 4,2, H2), 8,39 (1Н, d, J 5,7, H6'), 8,73 (1H, d, J 7,5, H4). MC (APCI) AP- m/z 309 (M+, 20), 308 (M-1, 90), 307 (M-2, 100); AP+ m/z 331(M+Na, 10), 310 (M+1, 20), 309 (M+, 25). Приклад 23 9-Амінопіридо[3',2':4,5]піроло[1,2-с]піримідин (19a) З 11а До розчину 11а (500мг, 2,70ммоль) в 2,6лутидині (40мл) і HMDSA (60мл) додають TMSCl (400мкл, 2,70ммоль), і суміш кип'ятять із зворотнім холодильником протягом 15год. Додають TMSTf (100мкл, 0,27ммоль) і через суміш барботують NH3 протягом 15хв. при 0°С. Суміш закривають в стальному автоклаві і гріють при 150°С протягом 8 годин (60ф/д2). Розчинник випаровують і сирий залишок очищають колонковою флешхроматографією. Елюювання сумішшю СН2СI2 і МеОН (98/2) дає 19а (150мг, 30%) у вигляді світложовтої твердої речовини. З 23а До розчину 23а (20мг, 0,06ммоль) в рідкому NH3 (8мл) при -78°С невеликими порціями додають Na доти, поки синій колір не буде зберігатися протягом 10хв. Додають порціями NH4C1 доти, поки синій колір не зникне, і реакційну суміш перемішують при кімнатній температурі доти, поки не випариться розчинник. Твердий залишок розчиняють у воді і екстрагують СН2Сl2. Органічний розчин З 11b Слідуючи тому ж способу, що і для 19а, змішують 11b (60мг, 0,27ммоль), HMDS А (30мл), 2,6лутидин (15мл) і TMSCl (36мкл, 0,27ммоль). Час реакції 15 годин. Додають TMSTf (12мкл, 0,06ммоль) і через суміш барботують NH3 протягом 15хв. при 0°С. Час реакції в стальному автоклаві 8 годин, нагрівання при 150°С (60ф/д2). Розчинник випаровують і сирий залишок очищають колонковою флешхроматографією. Елюювання сумішшю СН2Сl2 і МеОН (99/1) дає 19b (13мг, 22%), і елюювання сумішшю СН2СI2 і МеОН (95/5) дає 11b (9мг, 15%). З 23b До розчину 23b (200мг, 0,54ммоль) в ТГФ (25мл) при 0°С краплями додають заздалегідь одержаний зелений розчин Na в нафталіні в ТГФ (1,43мл, 0,54ммоль). Розчин перемішують протягом 20хв. при кімнатній температурі, додають краплями Na в нафталіні в ТГФ (7,2мл, 2,70ммоль) і суміш перемішують протягом 15хв. Розчинник видаляють і сирий залишок розчиняють в AcOEt. Органічний розчин три рази екстрагують 4н НСl. Водні шари об'єднують, підлуговують NaHCO3 і екстрагують СН2СI2. Органічний розчин сушать і упарюють, і залишок очищають колонковою флешхроматографією. Елюювання сумішшю СН2СI2 і МеОН (95/5) дає 19b (27мг, 23%) у вигляді світложовтої твердої речовини. 1 Н-ЯМР (CDCl3+CD3OD, 300МГц) 4,01 (с, 3Н, Me), 6,45 (с, 1Н, Н5), 6,61 (д, J 6,6, 1Н, Н6), 6,75 (д, 33 77400 34 J 5,6, 1Н, Н3), 7,14 (д, J 6,6, 1Н, Н7), 8,18 (д, J 5,6, розчиняють в СН2СI2. Розчин промивають насиче1Н, Н2). ним водн. розчином NaHCO3. Органічний шар су13 шать і упарюють. 9-Ацетиламіно-4С-ЯМР (CDCl3+CD3OD, 75МГц) 55,6 (кв., метоксипіридо[3',2':4,5]піроло[1,2-с]піримідин Me), 87,5 (д, С5), 100,6 (д, С6), 102,2 (д, С3), 114,3 (17мг, 95%) одержують без якого-небудь додатко(с, С4а), 134,4 (с, С5а), 136,0 (д, С2), 141,7 (д, С7), вого очищення. 142,8 (с, С 10а), 149,0 (с, С9), 158,8 (с, С4). 1 Н-ЯМР (CDCl3, 300МГц) 2,60 (с, 3Н, Me), МС (El) m/z 215 (М+1, 7), 214 (М+, 36), 213 (М1, 6), 199 (М-Ме, 36), 57 (100). 4,07 (с, 3Н, Me), 6,60 (с, 1Н, Н5), 6,82 (д, J 5,7, 1Н, (ES+) m/z 216 (М+2, 20), 215 (М+1, 100). Н3), 6,96 (д, J 6,6, 1Н, Н6), 7,47 (д, J 6,6,1Н, Н7), Приклад 25 8,29 (д, J 5,7,1Н, Н2). 13 9-Ацетиламінопіридо[3',2':4,5]піроло[1,2С-ЯМР (ДМСО-d6, 75МГц) 26,3 (кв., Me), 55,8 с]піримідин (кв., Me), 88,1 (д, С5), 100,7 (д, С6), 107,7 (д, С3), 114,1 (с, С4а), 134,5 (с, С5а), 135,9 (д, С2), 142,1 (д, С7), 159,5 (с, С4), 170,1 (с, СО). МС (ES) m/z 258 (М+2, 30), 257 (М+1, 100). Приклад 27 9-Ацетиламіно-5-йодпіридо[3,2':4,5]піроло[1,2с]піримідин (20а) До розчину 19а (250мг, 1,36ммоль) в ТГФ (20мл) додають оцтовий ангідрид (200мкл, 2,04ммоль) і суміш перемішують при кімнатній температурі протягом 20 годин. Розчинник видаляють і залишок розчиняють в СН2СI2. Розчин промивають насиченим водн. розчином NaHCO3. Органічний шар сушать і упарюють. Сирий залишок очищають колонковою флеш-хроматографією. Елюювання сумішшю СН2СІ2 і МеОН (99/1) дає 9ацетиламшогаридо[3',2':4,5]піроло[1,2-с]піримідин (225мг, 75%) у вигляді коричнювато-жовтої твердої речовини. Т.пл. 160-161°С (СН2Сl2/гексан). ІЧ (KВr) 3150 (m, NH), 1708 (s, С=О), 1626 (m, NCO), 1574 (m, C=N), 1372 (m, ON), 1269 (m). 1 Н-ЯМР (CDCl3, 300МГц) 2,63 (с, 3Н, Me), 6,53 (с, 1Н, Н5), 6,97 (д, J 6,6, 1Н, Н6), 7,41 (дд, J 8,0 і 4,8, 1Н, Н3), 7,51 (д, J 6,6, 1Н, Н7), 8,10 (дд, J 8,0 і 1,5, 1Н, Н4), 8,41 (дд, J 4,8 i 1,5, 1Н, Н2). 13 С-ЯМР (CDCI3, 75МГц) 26,2 (кв., Me), 90,5 (д, С5), 107,2 (д, С6), 119,6 (д, С3), 122,8 (с, С4а), 128,4 (д, С4), 136,0 (с, С5а), 136,5 (д, С2), 139,6 (д, С7), 141,3 (с, С10а), 142,3 (с, С9), 170,0 (с, СО). МС (El) m/z 227 (М+1, 3), 226 (М+, 18), 184 (МАс, 100). МС вис.розр., m/z, для C12H10N4O обчислено 226,0855; знайдене 226,0852. Елементи, аналіз: для C12H10N4O обчислено: С (63,71), Η (4,46), Ν (24,77); знайдено: С (63,65), Η (4,59), Ν (24,80). Приклад 26 9-Ацетиламіно-4метоксипіридо[3',2':4,5]піроло[1,2-с]піримідин До розчину 19b (16мг, 0,08ммоль) в ТГФ (2мл) додають оцтовий ангідрид (10мкл, 0,05ммоль) і суміш перемішують при кімнатній температурі протягом 20 годин. Розчинник видаляють і залишок До охолодженого (0°С) розчину 9ацетиламінопіридо[3',2':4,5]піроло[1,2-с]піримідину (100мг, 0,44ммоль) в СН2СI2 (20мл) додають порціями NIS (100мг, 0,44ммоль). Суміш перемішують протягом 15хв. Розчин розбавляють СН2СI2 (50мл) і двічі промивають водою. Органічний шар сушать і упарюють, і одержують 20а (142мг, 93%) у вигляді коричнювато-жовтої речовини. Т.пл. 163-164°С (різн.), (СН2СI2/гексан). ІЧ (KBr) 3050 (m, NH), 1694 (m, С=О), 1573 (m, C=N), 1372 (m, C-N), 1307 (m). 1 Н-ЯМР (CDCI3, 200МГц) 2,63 (с, 3Н, Me), 6,94 (д, J 6,4, 1Н, Н6), 7,47 (дд, J 8,2 і 4,8, 1Н, Н3), 7,61 (д, J 6,4, 1Н, Н7), 7,93 (дд, J 8,2 і 1,6, 1Н, Н4), 8,40 (дд, J 4,8 і 1,6, 1Н, Н2). 13 С-ЯМР (CDCl3, 75МГц) 26,4 (кв., Me), 46,7 (с, С5), 107,0 (д, С6), 120,6 (д, С3), 125,2 (с, С4а), 128,8 (д, С4), 136,9 (с, С5а), 138,6 (д, С7), 140,9 (д, С2), 141,5 (с, С 10а), 142,7 (с, С9), 170,2 (с, СО). МС (El) m/z 353 (М+1, 3), 352 (М+, 22), 310 (МАс, 100). МС вис.розр., m/z, для C12H9IN4O обчислено 351,9821; знайдене 351,9821. Елементи, аналіз: для C12H9IN4O обчислено: С (40,93), Η (2,58), Ν (15,91); знайдено: С (40,91), Η (2,64), Ν (15,79). Приклад 28 9-Ацетиламіно-5-йод-4метоксипіридо[3',2':4,5]піроло[1,2-с]піримідин (20b) До охолодженого (0°С) розчину 9 35 77400 36 ацетиламіно-4-метоксипіридо[3',2':4,5]-піроло[1,2Т.пл. 223-224°С (СН2СI2/гексан). с]піримідину (20мг, 0,078ммоль) в СН2СI2 (15мл) ІЧ (KBr) 3390 (m, NH), 1632 (m, ОС), 1557 (m, додають порціями NIS (18мг, 0,078ммоль). Суміш ON), 1517 (m), 1464 (m, С-N), 1265 (m). 1 перемішують протягом 15хв. Розчин розбавляють Н-ЯМР (CDCl3, 300МГц) 2,68 (с, 3Н, Me), СН2СI2 (50мл) і двічі промивають водою. Органіч7,33 (д, J 5,4, 1Н, Н5'), 7,49 (дд, J 8,4 і 4,8, 1Н, Н3), ний шар сушать і упарюють, і одержують 20b 7,58 (д, J 6,6, 1Н, Н7), 7,68 (д, J 6,6, 1Н, Н6), 8,40 (27мг, 93%). (дд, J 4,8 і 1,6, 1Н, Н2), 8,48 (д, J 5,4, 1Н, Н6'), 8,73 1 Н-ЯМР (CDCl3, 200МГц) 2,61 (с, 3Н, Me), (дд, J 8,4 і 1,6, 1Н, Н4). 13 4,08 (с, 3Н, Me), 6,84 (д, J 5,7, 1Н, Н3), 6,97 (д, J С-ЯМР (CDCl3, 50МГц) 14,4 (кв., MeS), 6,6, 1Н, Н6), 7,57 (д, J 6,6, 1Н, Н7), 8,31 (д, J 5,7, 100,3 (с, С5), 102,1 (д, С6), 112,6 (д, С5'), 120,7 (д, 1Н, Н2). С3), 122,0 (с, С4а), 128,6 (д, С4), 138,7 (с, С5а), 13 С-ЯМР (CDCl3, 75МГц) 26,3 (кв., Me), 55,8 140,3 (д, С2), 142,1 (с, С10а), 143,4 (д, С7), 149,8 (кв., Me), 101,2 (д, С6), 107,7 (д, С3), 114,1 (с, С4а), (с, С9), 156,5 (д, С6'), 161,2 (с, С4'), 172,3 (с, С2'). 133,5 (с, С5а), 137,7 (д, С2), 142,5 (д, С7), 142,6 (с, МС (EI) т/2 309 (М+1, 7), 308 (М+, 33). С10а), 151,8 (с, С9), 170,4 (с, С4), 176,8 (с, СО). МС вис.розр., m/z, для C15H12N6S обчислене МС (ES+) m/z 384 (М+2,15), 383 (М+1, 100), 308,0844; знайдене 308,0839. 192 (М+22+, 50), 191 (М+12+, 22). УФ (МеОН) 217 (16,324), 252 (21,415), 400 Приклад 29 (11,692). 9-Аміно-5-(2-метансульфанілпіримідин-49-Ацетиламіно-5-(2-метансульфенілпіримідиніл)піридо[3',2':4,5]піроло[1,2-с]піримідин (21) і 94-іл)піридо[3',2':4,5]-піроло[1,2-с|піримідин. ацетиламіно-5-(2-метансульфанілпіримідин-4Т.пл. 160-162°С (СН2СI2/гексан). іл)піридо[3',2':4,5]піроло[1,2-с]піримідин ІЧ (KВr) 1704 (s, С=О), 1620 (m, С=С), 1556 (m), 1536 (m, C=N), 1517 (m), 1502 (m), 1476 (m, CN), 1265 (m). 1 Н-ЯМР (CDCl3, 200МГц) 2,67 (с, 3Н, Me), 2,69 (с, 3Н, MeS), 7,36 (д, J 5,2, 1Н, Н5·), 7,58 (дд, J 8,2 і 4,8, 1Н, Н3), 7,83 (д, J 6,6, 1Н, Н7), 7,93 (д, J 6,6, 1Н, Н6), 8,52 (дд, J 4,8 і 1,4, 1Н, Н2), 8,54 (д, J 5,2, 1Н, Н6'), 8,77 (дд, J 8,2 і 1,4,1 Η, Η4). 13 С-ЯМР (CDCl3, 75МГц) 14,4 (кв., MeS), 26,4 (кв., Me), 104,5 (с, С5), 107,4 (д, C6), 113,0 (д, C5'), 121,1 (д, С3), 121,6 (с, С4а), 129,5 (д, С4), 137,7 (с, С5а), 141,0 (д, С2), 141,1 (д, С7), 142,5 (с, С10а), Розчин 20а (130мг, 0,37ммоль), 2143,3 (с, С9), 156,8 (д, С6'), 160,7 (с, С4'), 170,2 (с, метансульфеніл-4-триметилстанілпіримідину С2), 172,7 (с, СО). (93мг, 1,10ммоль), Pd2(dba)3 (76мг, 0,07ммоль), МС (EI) m/z 351 (М+1, 3), 350 (М+, 33), 308 (МPPh3 (39мг, 0,15ммоль), LiCl (47мг, 1,10ммоль) і Ас, 100). Cul (14мг, 0,07ммоль) в діоксані (10мл) кип'ятять із МС вис.розр., m/z, для C17H14N6OS обчислене зворотнім холодильником протягом 1,5 годин. Ор350,0949; знайдене 350,0940. ганічний розчинник видаляють і одержане масло УФ (МеОН) 255 (25,480), 400 (17,710). розчиняють в СН2Сl2. Органічний розчин екстрагуПриклад 30 ють чотири рази 4н НСl і водний розчин підлуго9-Аміно-5-(2-метансульфінілпіримідин-4вують твердим Na2CO3. Водний розчин екстрагуіл)піридо[3',2':4,5]піроло[1,2-с]піримідин ють СН2Сl2. Органічний шар упарюють і залишок очищають колонковою флеш-хроматографією. Елюювання сумішшю СН2Сl2 і МеОН (99/1) дає 9ацетиламіно-5-(2-метансульфенілпіримідин-4іл)піридо[3',2':4,5]піроло[1,2-с]піримідин (21мг, 16%) у вигляді жовтої твердої речовини і сумішшю СН2Сl2 і МеОН (95/5) дає 21 (30мг, 26%) у вигляді жовтої твердої речовини. Розчин 9-ацетиламіно-5-(2метансульфенілпіримідин-4-іл)піридо[3',2':4,5]піроло[1,2-с]піримідину (15мг, 0,043ммоль) в 5н НСІ/МеОН (5мл) кип'ятять із зворотнім холодильником протягом 1 години. Розчинник видаляють і залишок розчиняють в насиченому водн. розчині Na2CO3. Розчин екстрагують СН2Сl2. Органічний розчинник випаровують і одержують 21 (12мг, 90%). Коли взаємодію повторюють і проводять обробку НСl/МеОН безпосередньо перед очищенням колонковою флеш-хроматографією, одержують 21 (45%) як єдиний продукт реакції. 9-Аміно-5-('2-метансульфенілпіримідин-4іл)піридо[3',2':4,5]піроло[1,2-с]піримідин (21) До охолодженого (0°С) розчину 21 (20мг, 0,07ммоль) в СН2Сl2 (5мл) додають м-СРВА (32мг, 0,13ммоль). Суміш перемішують протягом 30хв. Додають насичений водн. розчин Na2S2O3 (1мл) і суміш підлуговують насиченим водн. розчином Na2CO3. Органічний шар відділяють і водний шар екстрагують СН2Сl2. Органічні розчини об'єднують, сушать і упарюють, і одержують 9-аміно-5-(2метансульфінілпіримідин-4іл)піридо[3',2':4,5]піроло[1,2-с]піримідин (20мг, 90%). ІЧ (KВr) 3388 (m, NH), 1635 (m, С=С), 1569 37 77400 38 (m), 1519 (m, C=N), 1467 (m), 1267 (s, S=O). 340 (М+, 100), 309 (М-О2, 5), 263 (M-SO2Me, 25). 1 МС вис.розр., m/z, для C15H12N3O2S обчислене Н-ЯМР (CDCl3, 300МГц) 3,03 (с, 3Н, Me), 340,0742; знайдене 340,0740. 7,53 (дд, J 8,2 і 4,8, 1Н, Н3), 7,63-7,78 (м, 3Н, Н7, Приклад 32 Н6 і Н5'), 8,42 (дд, J 4,8 і 1,4, 1Η, Н2), 8,73 (д, J 5,4, 9-Аміно-5-(2-амінопіримідин-41Н, Н6'), 8,84 (дд, J 8,2 і 1,4, 1Н, Н4). 13 іл)піридо[3',2':4,5]піроло[1,2-с]піримідин (5а) С-ЯМР (CDCl3, 300МГц) 40,3 (кв., Me), 99,5 (с, С5), 102,2 (д, С6), 116,5 (д, С5'), 121,3 (д, С3), 121,9 (с, С4а), 129,1 (д, С4), 140,0 (с, С5а), 140,8 (д, С2), 143,8 (с, С10а), 144,6 (д, С7), 150,0 (с, С9), 157,3 (д, С6'), 162,6 (с, С4'), 163,5 (с, С2'). МС (El) m/z 324 (М+, 47), 261 (M-SOMe, 100); (ES+) m/z 326 (М+2,20), 325 (М+1, 100). Приклад 31 9-Аміно-5-(2-метансульфонілпіримідин-4іл)піридо[3',2':4,5]піроло[1,2-с]піримідин Спосіб А До розчину 9-аміно-5-(2метансульфінілпіримідин-4-іл)піридо[3',2':4,5]піроло[1,2-с]піримідину (50мг, 0,16ммоль) в СН2СI2 (15мл) при кімнатній температурі додають м-СРВА (88мг, 0,36ммоль). Суміш перемішують протягом 2 година. Додають насичений водн. розчин Na2S2O3 (1мл) і суміш підлуговують насиченим водн. розчином Na2CO3. Органічний шар відділяють і водний шар екстрагують СН2СI2. Органічні розчини об'єднують і упарюють, і одержують 9-аміно-5-(2-метансульфонілпіримідин-4іл)піридо[3',2':4,5]піроло[1,2-с]піримідин (50мг, 91%) у вигляді світло-оранжевої твердої речовини. Спосіб В До розчину 21 (200мг, 0,65ммоль) в СН2СL2 (50мл) додають м-СРВА (320мг, 1,30ммоль). Суміш перемішують протягом 2 годин при кімнатній температурі. Додають насичений водн. розчин Na2S2O3 (5мл) і суміш підлуговують насиченим водн. розчином Na2CO3. Органічний шар відділяють і водний шар екстрагують СН2СI2. Органічні розчини об'єднують, сушать і упарюють, і одержують 9-аміно-5-(2-метансульфонілпіримідин-4іл)піридо[3',2':4,5]піроло[1,2-с]тримідин (201мг, 91%). Т.пл. 118-189°С(СН2СI2/гексан). ІЧ (плівка) 3340 (m, NH), 1569 (m, С=С), 1517 (m), 1462 (m), 1262 (s, S=O2). 1 Н-ЯМР (CDCl3, 300МГц) 3,41 (с, 3Η, Me), 7,56 (дд, J 8,1 і 4,8, 1Н, Н3), 7,69 (д, J 6,6, 1Н, Н7), 7,78 (д, J 5,7, 1Н, Н5'), 7,80 (д, J.6,6, 1Н, Н6), 8,44 (дд, J 4,8 і 1,5, 1Н, Н2), 8,75 (д, J 5,7, 1Н, Н6'), 8,84 (дд, J 8,1 і 1,5, 1Н, Н4). 13 С-ЯМР (ДМСО-d6, 50МГц) 39,8 (кв., Me), 97,4 (с, C5), 101,0 (д, С6), 118,4 (д, C51), 121,0 (с, С4а), 121,2 (д, С3), 128,6 (д, С4), 130,3 (с, С5а), 140,5 (д, С2), 143,3 (с, С10а), 146,8 (д, С7), 149,9 (с, С9), 157,5 (д, С61), 161,5 (с, С4'), 165,2 (с, С2'). МС (CI, NH3) m/z 342 (М+2, 6), 341 (М+1, 20), Спосіб А Розчин 9-аміно-5-(2-метансульфонілпіримідин4-іл)піридо[3',2':4,5]піроло[1,2-с]піримідину (25мг, 0,04ммоль) в діоксані (3мл) і 23% водн. розчин NH3 (5мл) нагрівають в запаяній пробірці при 80°С протягом 6 годин. Суміш охолоджують і розчинник видаляють. Залишок розчиняють в насиченим водн. розчині Na2CO3 і розчин декілька разів екстрагують СН2СI2. Органічні шари сушать і упарюють. Сиру речовину очищають колонковою флешхроматографією. Елюювання сумішшю СН2СI2 і МеОН (97/3) дає 5а (18мг, 90%) у вигляді жовтої твердої речовини. Спосіб В Розчин 20а (120мг, 0,36ммоль), 27 (200мг, 0,72ммоль), Pd2(dba)3 (75мг 0,06ммоль), PPh3 (35мг, 0,14ммоль), LiCl (42мг, 1,10ммоль) і Cul (12мг, 0,06ммоль) в діоксані (4мл) кип'ятять із зворотнім холодильником протягом 1,5 годин. Органічний розчинник видаляють і одержане масло розчиняють і кип'ятять із зворотнім холодильником в НСІ/МеОН протягом 1 години. Розчинник випаровують і залишок розчиняють в СН2СI2. Органічний розчин екстрагують чотири рази 4н НСI і водний розчин підлуговують твердим Na2CO3. Водний розчин екстрагують СН2СI2. Після випаровування розчинника суміш очищають колонковою флешхроматографією. Елюювання сумішшю СН2СI2 і МеОН (95/5) дає 5а (50мг, 54%) у вигляді жовтої твердої речовини. Т.пл. 160-162°С (СН2СI2/гексан). ІЧ (плівка) 3332 (m, NH), 1632 (m, С=С), 1574 (m, C=N), 1454 (m, C-N), 1262 (m). 1 H-NMR (ДМСО-d6, 500МГц) 6,63 (ушир., 2Н, 2'ΝΗ2), 7,12 (д, J 5,5, 1Н, Н5'), 7,64 (д, J 8,0 і 4,4, 1Н, Н3), 7,70 (д, J 6,6, 1Н, Н7), 7,76 (д, J 6,6, 1Н, Н6), 8,29 (д, J 5,5, 1Н, Н6'), 8,51 (дд, J 4А і 1,4, 1Н, Н2), 8,52 (ушир., 1Н, 9NH), 8,99 (дд, J 8,0 і 1,4, 1Н, Н4), 9,35 (ушир, 1Н, 9NH). 13 C-NMR (ДМСО-d6, 50МГц) 99,5 (с, С5), 101,7 (д, С6), 106,8 (д, С5'), 120,7 (д, С3), 121,6 (с, С4а), 129,1 (д, С4), 138,2 (с, С5а), 140,1 (д, С2), 142,8 (с, С10а), 143,8 (д, С7), 149,7 (с, С9), 158,0 (д, С6'), 161,4 (с, С4'), 163,5 (с, С2'). МС (ES+) m/z 279 (М+2, 20), 278 (М+1, 100), 277 (М+, 10). МС вис.розр, m/z, для C15H11N7 обчислене 277,1075; знайдене 277,1071. 39 77400 40 УФ (МеОН) 225 (36,010), 250 (34,126), 350 (д, С3), 121,5 (с, С4а), 126,4 (д, Ts), 129,2 (д, Ts), (20,942), 400 (26,481). 129,2 (д, С4), 131,9 і 134,7 (с, С5а), 140,0 і 142,5 (с, Приклад 33 С10а), 145,6 і 145,9 (д, С2), 148,1 (с,С9). 9-Аміно-5-(2-амінопіримідин-4МС (El) m/z 440 (М+, 1), 376 (M-SO2, 19). іл)піридо[3'.2':4.5]піроло[1,2-с]піримідин (5b) Приклад 35 4-Метокси-9-тозиламіно-6тетрагідропіраноксипіридо[3',2':4,5]піроло[1,2с]піримідин (22b) Слідують тому ж способу, що для 5а (спосіб В). Суміш 20b (26мг, 0,07ммоль), 27 (32мг, 0,11ммоль), Pd2(dba)3 (15мг, 0,014ммоль), PPh3 (7мг, 0,028ммоль), LiCl (9мг, 0,21ммоль) і Cul (3мг, 0,014ммоль) в діоксані (3мл) кип'ятять із зворотнім холодильником протягом 1 години. Після очищення колонковою флеш-хроматографією одержують 5b (8мг, 38%). 1 Н-ЯМР (CDCl3, 200МГц) 4,03 (с, 3Н, Me), 6,90 (д, J 5,4, 1Н, Н3), 7,08 (д, J 5,4, 1Н, Н6), 7,50 (д, J 5,4, 1Н, Н7), 7,54 (д, J 5,0, 1Н, Н5% 8,28 (д, J 5,4, 1Н, Н2), 8,47 (д, J 5,0, 1Н, Н6'). МС (ES+) m/z 308 (М+1, 100), 307 (М+, 20). Приклад 34 9-Тозиламіно-6тетрагідропіраноксипіридо[3',2':4,5]піроло[1,2с]піримідин (22а) Розчин 9а (235мг, 0,88ммоль) і DIPEA (505мкл, 1,98ммоль) в СН2СI2 (20мл) поступово додають до розчину TsNCCl2 (250мг, 0,99ммоль) в СН2СI2 (20мл). Розчин перемішують протягом 30хв. і промивають водою. Органічний розчин сушать, фільтрують і упарюють, і одержують сирий продукт реакції, який очищають колонковою флешхроматографією. Елюювання сумішшю DCM і МеОН (99/1) дає 22а (235мг, 60%) у вигляді світлооранжевої твердої речовини. ІЧ (плівка) 3312 (m, NH), 1639 (s, N=C), 1472 (m, C-N), 1277 (m, CO). 1 Н-ЯМР (CDCl3, 200МГц) 1,40-1,80 (м, 6Н, Н3', Н4' і Н5'), 2,38 (с, 3Н, Me), 3,45-4,00 (м, 4Н, Н7 і Н6'), 4,65 і 4,95 (ушир.т, 1Н, Н2'), 5,02 і 5,05 (ушир.т, 1Н, Н6), 6,59 і 6,61 (с, 1Н, Н5), 7,20 і 7,21 (дд, J 7,8 і 4,8, 1Н, Н3), 7,27 (д, J 8,4, 2Н, Ts), 7,84 і 7,85 (дд, J 7,8 і 1,5, 1Н, Н4), 8,12 (д, J8/4, 2Н, Ts), 8,40 (ушир., 1Н, NH), 8,50 і 8,52 (дд, J 4,8 i 1,5, 1Н, Н2). 13 С-ЯМР (CDCl3, 50МГц) 18,7 і 19,1 (т, С4'), 21,5 (кв, Ts), 25,2 і 25,3 (т, С5'), 29,9 і 30,3 (т, С3'), 43,1 і 44,7 (т, С6'), 62,2 і 62,5' (т, С7), 62,6 і 63,8 (д, С6), 95,7 і 96,8 (д, С2'), 104,1 і 105,5 (д, С5), 119,2 Слідуючи методології для 22а, з 9b (1г, 3,44ммоль), DIPEA (1,9мл, 7,58ммоль) і TsNCCl2 (952мг, 3,78ммоль) одержують сполуку 22b (1,05г, 65%) у вигляді світло-оранжевої твердої речовини. 1 Н-ЯМР (CDCl3, 200МГц) 1,40-1,80 (м, 6Н, Н3', Н4' і Н5'), 2,38 (с, 3Н, Me), 3,45-3,95 (м, 4Н, Н7 і Н6'), 3,97 (с, 3Н, Me), 4,62 і 4,95 (ушир.т, 1Н, Н2'), 5,01 (м, 1Н, Н6), 6,69 (м, 1Н, Н3 і Н5), 7,26 (д, J 8,4, 2Н, Ts), 8,10 (д, J 8,4, 2Н, Ts), 8,41 і 8,42 (д, J 5,8, 1Н, Н2). 13 С-ЯМР (CDCl3, 50МГц) 18,5 і 19,3 (т, С4'), 21,6 (кв., Ts), 25,2 і 25,3 (т, С5'), 30,0 і 30,2 (т, С3'), 43,3 і 44,9 (т, C6'), 55,6 (кв., Me), 61,9 і 62,3 (т, С7), 62,7 і 63,5 (д, С6), 95,5 і 96,4 (д, С2'), 101,3 (д, С3), 101,5 і 102,9 (д, С5), 126,2 (с, С4а), 126,5 (д, Ts), 129,2 (д, Ts), 129,3 і 129,5 (с, С5а), 132,2 (с, Ts), 142,5 (с, С10а), 147,6 і 147,9 (д, С2), 159,7 (с, С9). Приклад 36 4-Хлор-9-тозиламіно-6тетрагідропіраноксипіридо[3',2':4,5]піроло[1,2с]піримідин (22b) Слідуючи методології для 22а, з 9с (175мг, 0,59ммоль), DIPEA (225мкл, 1,30ммоль) і TsNCCl2 (164мг, 0,65ммоль) одержують сполуку 22с (165мг, 60%). ІЧ (плівка) 3309 (m, NH), 1634 (s, N=C), 1471 (m, C-N), 1358 (m, SO2), 1280 (m, CO). 1 Н-ЯМР (CDCl3, 200МГц) 1,40-1,80 (м, 6Н, Н3', Н4' і Н5'), 2,38 (с, 3Н, Me), 3,45-3,95 (м, 4Н, Н7 і Н6'), 4,65 і 4,95 (м, 1Н, Н2'), 5,01 (М, 1Н, Н6), 6,71 і 6,72 (с, 1Н, Н5), 7,24 і 7,25 (д, J 5,4, 1Н, Н3), 7,27 (д, J 8,0, 2Н, Ts), 8,10 (д, J 8,4, 2Н, Ts), 8,39 і 8,41 (д, J 4,8, 1Н, Н2) 8,48 (ушир., 1Н, NH). 13 С-ЯМР (CDCl3, 50МГц) 18,8 і 19,1 (т, С4'), 21,6 (кв, Ts), 25,2 і 25,3 (т, С5'), 30,0 і 30,3 (т, С3'), 43,1 і 44,7 (т, С6'), 62,5 і 62,6 (т, С7), 63,3 і 63,6 (д, С6), 95,8 і 96,8 (д, С2'), 101,9 і 103,2 (д, С5), 119,3 (д, С3), 127,3 (с, С4а), 126,4 (д, Ts), 129,2 (д, Ts), 132,2 (с, Ts), 135,5 і 136,4 (с, С5а), 139,8 (с, Ts), 142,6 (с, С10а), 145,8 і 146,2 (д,С2), 147,9 і 148,1 41 (с, С9). МС (El) m/z 475 (М+, 1), 410 (M-SO2, 20). Приклад 37 9-Тозиламіно-6гідрокситридо[3',2':4,5]піроло[1,2-с]піримідин Розчиняють 22а (210мг, 0,48ммоль) в СН2Сl2 (25мл), додають 4н соляну кислоту (25мл), і суміш енергійно перемішують протягом 20хв. Розчин підлуговують і відділяють органічний розчин. Водний шар двічі екстрагують СН2Сl2. Органічні розчини об'єднують і упарюють, і залишок очищають колонковою флеш-хроматографією. Елюювання сумішшю і МеОН (95/5) дає 9-тозиламіно-6гідроксипіридо[3',2':4,5]піроло[1,2-с]піримідин (160мг, 95%) у вигляді блідо-жовтої твердої речовини. ІЧ (плівка) 3315 (m, NH), 1624 (s, C=N), 1473 (s, N-C), 1276 (m, SO2), 1135 (m, CO). 1 Н-ЯМР (CDCl3, 300МГц) 2,35 (с, 3Н, Me), 3,50 (м, 1Н, Н7), 3,75 (м, 1Н, Н7), 5,04 (ушир., 1Н, Н6), 6,55 (с, 1Н, Н5), 7,00 (дд, J 7,8 і 4,8, 1Н, Н3), 7,24 (д, J 8,4, 2Н, Ts), 7,71, (дд, J 7,8 і 1,5, 1Н, Н4), 8,03 (д, J 8,4, 2Н, Ts), 8,27 (дд, J 4,8 і 1,5, 1Н, Н2), 8,42 (ушир., 1Н, NH). 13 С-ЯМР (CDCl3, 75МГц) 21,5 (кв., Me), 45,8 (т, C7), 60,4 (д, С6), 101,7 (д, С5), 103,7 (д, С3), 119,1 (д, С4), 122,2 (с, С4а), 126,5 (д, Ts), 129,2 (д, Ts), 129,4 (д, С4), 136,7 (с, С5а), 139,6 (с, Ts), 142,7 (с, С 10а), 144,9 (д, С2), 147,5 (с, Ts), 148,5 (с, С9). МС (El) m/z 357 (М+1, 1), 356 (М+, 3), 338 (МН2О, 2), 292 (M-SO2, 18). Приклад 38 4-Метокси-9-тозиламіно-6гідроксипіридо[3',2':4,5]піроло[1,2-с]піримідин Слідуючи методології одержання попередньої сполуки, з 22b (1,05г, 2,23ммоль) одержують сполуку 4-метокси-9-тозиламіно-6-гідроксипіридо[3',2':4,5]піроло[1,2-с]піримідин (819мг, 95%) у вигляді світло-жовтої твердої речовини. ІЧ (плівка) 3317 (m, NH), 1627 (s, C=N), 1475 (s, N-C), 1293 (m, SO2), 1139 (m, CO). 1 Н-ЯМР (CDCl3, 200МГц) 2,35 (с, 3H, Me), 3,50 (м, 1Н, Н7), 3,75 (м, 1Н, Н7), 3,85 (с, 3Н, Me), 5,02 (ушир., 1Н, Н6), 6,43 (д, J 5,4, 1Н, Н3), 6,52 (с, 1Н, Н5), 7,24 (д, J 8,0, 2Н, Ts), 8,04 (д, J 8,0, 2Н, Ts), 8,09 (д, J 5,4, 1Н, Н2), 8,41 (ушир., 1Н, NH). 13 С-ЯМР (CDCl3, 50МГц) 21,5 (кв., Me), 45,9 77400 42 (т, С7), 55,6 (кв., Me), 60,1 (д, С6), 100,8 (д, С3), 101,4 (д, С5), 112,1 (с, С4а), 126,5 (д, Ts), 129,3 (д, Ts), 134,3 (с, С5а), 139,6 (с, Ts), 142,7 (с, С10а), 146,7 (д, С2), 148,6 (с, С9), 159,6 (с, С4). Приклад 39 4-Хлор-9-тозиламіно-6гідроксипіридо[3',2':4,5]піроло[1,2-с]піримідин Слідуючи способу одержання попередньої сполуки, з 22с (50мг, 0,11ммоль) одержують сполуки 4-хлор-9-тозиламіно-6гідроксипіридо[3',2':4,5]піроло[1,2-с]піримідин (37мг, 90%). ІЧ (плівка) 3316 (m, NH), 1632 (s, C=N), 1472 (s, N-C), 1277 (m, SO2), 1082 (m, CO). 1 Н-ЯМР (CDCl3, 200МГц) 2,35 (с, 3H, Me), 3,56 (ушир.д, J 13,6, 1Н, Н7), 3,80 (дт, J 13,6 і 2,6, 1Н, Н7), 4,80 (ушир., 1Н, ОН), 5,10 (ушир., 1Н, Н6), 6,61 (с, 1Н, Н5), 7,04 (д, J 5,0, 1Н, Н3), 7,24 (д, J 8,2, 2Н, Ts), 8,03 (д, J 8,2, 2Н, Ts), 8,16 (д, J 5,0, 1Н, Н2), 8,46 (ушир., 1Н, NH). 13 С-ЯМР (CDCl3, 50МГц) 21,6 (кв., Me), 45,7 (т, С7), 60,4 (д, С6), 101,5 (д, С5), 119,2 (д, С3), 121,4 (с, С4а), 126,5 (д, Ts), 129,3 (д, Ts), 131,0 (с, Ts), 136,5 (с, С5а), 137,4 (с, Ts), 142,8 (с, С 10а), 145,2 (д, С2), 148,3 (с, С9). МС (El) m/z 392 (37С1М+, 2), 390 (35С1М+, 6), 328 (35C1M-SO2,10), 326 (35С1М-SO2,31). МС вис.розр., m/z, для C17H15ClN4O5S обчислене 390,0553; знайдене 390,0548. Приклад 40 9-Тозиламінопіридо[3',2':4,5]піроло[1,2с]піримідин (23а) 9-Тозиламіно-6гідроксипіридо[3',2':4,5]піроло[1,2-с]піримідин (170мг, 0,48ммоль) і TEA (133мкл, 0,96ммоль) розчиняють в СН2Сl2 (25мл), додають краплями метансульфонілхлорид (37мкл, 0,48ммоль) і суміш перемішують протягом 20хв. Розчин промивають водою і органічні розчини сушать і упарюють. Сиру суміш очищають колонковою флешхроматографією. Елюювання сумішшю СН2Сl2 і МеОН (98/2) дає 23а (124мг, 78%) у вигляді жовтої твердої речовини. ІЧ (KBr) 3266 (m, NH), 1604 (s, C=N), 1399, 1281 (m, SO2). 1 Н-ЯМР (CD3OD, 300МГц) 2,35 (с, 3Η, Me), 6,69 (с, 1Н, Н5), 6,73 (д, J 7,8, 1Н, Н6), 7,04 (д, J 7,8, 1Н, Н7), 7,31 (д, J 8,4, 2Н, Ts), 7,44 (дд, J 8,1 і 5,1, 1Н, Н3), 7,99 (д, J 8,4, 2Н, Ts), 8,15 (д, J 8,1, 43 77400 44 1Н, Н4), 8,46 (д, J 5,1, 1Н, Н2). МС (El) m/z 374 (37С1М+, 5), 372 (35С1М+, 12), МС (ΕΙ) m/z 339 (M+1, 4), 338 (М+, 19), 273 (M309 (37C1M-SO2, 24), 307 (35C1M-SO2, 63). SO2, 100). MC вис.розр., m/z, для C17H13ClN4O2S обчисМС вис.розр., m/z, для C17H14N4O2S обчислене лене 372,0448; знайдене 372,0444. 338,0837; знайдене 338,0841. Приклад 43 Приклад 41 5-Йод-9-тозиламінопіридо[3',2':4,5]піроло[1,24-Метокси-9с]піримідин (24а) тозиламінопіридо[3',2':4,5]піроло[1,2-с]піримідин (23b) Слідуючи способу для 23а, з 4-метокси-9тозиламіно-6-гідроксипіридо-[3',2':4,5]піроло[1,2с]піримідину (170мг, 0,48ммоль) одержують сполуку 23b (124мг, 78%) у вигляді світло-жовтої твердої речовини. ІЧ (KBr) 3266 (m, NH), 1604 (s, C=N), 1399,1293 (m, SO2), 1141. 1 Н-ЯМР (CD3OD, 300МГц) 2,35 (с, 3Η, Me), 4,01 (с, 3Н, Me), 6,57 (с, 1Н, Н5), 6,64 (д, J 7,5, 1Н, Н6), 6,93 (д, J 6,0, 1Н, Н3), 6,98 (д, J 7,5, 1Н, Н7), 7,30 (д, J 8,1, 2Н, Ts), 8,00 (д, J 8,1, 2Н, Ts), 8,30 (д, J 6,0, 1Н, Н2). 13 С-ЯМР (DMSO-d6, 50МГц) 21,0 (кв., Me), 55,9 (кв., Me), 93,0 (д, С5), 101,5 (д, С6), 102,1 (д, С3), 113,9 (с, С4а), 125,9 (д, Ts), 129,3 (д, С2 і Ts), 132,6 (с, С5а), 142,3 (с, С10а), 143,9 (с, С9), 145,1 (д, С7), 158,4 (с, С4). МС вис.розр., m/z, для C18H16N4O5S обчислене 368,0943; знайдене 368,0941. Приклад 42 4-Хлор-9-тозиламінопіридо[3',2':4,5]піроло[1,2с]піримідин (23с) Слідуючи способу для 23а, з 4-хлор-9тозиламіно-6-гідроксипіридо-[3',2':4,5]піроло[1,2с]піримiдину (165мг, 0,42ммоль) одержують сполуку 23с (104мг, 66%) у вигляді світло-жовтої твердої речовини. ІЧ (KBr) 3265 (m, NH), 1602 (s, C=N), 1396, 1281 (m, SO2), 1141. 1 Н-ЯМР (ДМСО-d6, 50МГц) 2,34 (с, 3Н, Me), 6,80 (с, 1Н, Н5), 6,84 (д, J 7,8, 1Н, Н6), 7,17 (д, J 7,8, 1Н, Н7), 7,37 (д, J 7,8,2H, Ts), 7,58 (д, J 4,8,1Н, Н3), 8,03 (д, J 7,8, 2Н, Ts), 7 8,45 (д, J 4,8, 1Н, Н2), 11,20 (ушир., 1Н, NH). 13 С-ЯМР (ДМСО-d6, 50МГц) 21,0 (кв., Me), 93,7 (д, С5), 101,3 (д, С6), 119,9 (д, С3), 122,5 (с, С4а), 125,9 (д, Ts), 126,3 (д, С2), 129,4 (д, Ts), 133,5 (с, С5а), 135,6 (с, Ts), 142,5 (с, С10а), 143,5 (д, С7), 143,8 (с, С9), 145,3 (с, С4). До розчину 23а (10мг, 0,03ммоль) в СН2Сl2 (5мл) при -30°С додають порціями Nйодсукцинімід (7мг, 0,03ммоль) і суміш перемішують протягом 15хв. Розчин промивають водою, і органічні розчини сушать, фільтрують і упарюють, і одержують 24а (14мг, 95%) у вигляді жовтої твердої речовини. ІЧ (KВr) 3264 (m, NH), 1599 (m, N=C), 1393 (m, C-N), 1140. 1 Н-ЯМР (CD3OD, 300МГц) 2,37 (с, 3H, Me), 6,61 (д, J 7,5, 1Н, H6), 7,15 (д, J 7,5, 1Н, H7), 7,34 (д, J 8,4, 2Н, Ts), 7,46 (дд, J 7,5 і4,8, 1Н, Н3), 7,81 (дд, J 7,5 і 1,5, 1Н, Н4), 8,07 (д, J 8,4, 2Н, Ts), 8,46 (дд, J 4,8 і 1,5, 1Н, Н2). MC (El) m/z 464 (М+, 13), 399 (M-SO2, 32), 338 (М-1,1), 309 (M-Ts, 5), 273 (М-SO2-I, 33), 182(M-Ts-I, 58). MC вис.розр., m/z, для C17H13IN4O2S обчислене 463,9804; знайдене 463,9799. Приклад 44 5 -Йод-4-метокси-9-тозиламінопіридо [3,2' ;4,5]піроло[1,2-с]піримідин (24b) Слідуючи способу для 24а, з 23b (250мг, 0,68ммоль) одержують сполуку 24b (295мг, 95%) у вигляді світло-жовтої твердої речовини. ІЧ (KВr) 3259 (m, NH), 1592 (s, C=N), 1293 (m, 802), 1142. 1 Н-ЯМР (ДМСО-d6, 200МГц) 2,33 (с, 3Н, Me), 3,97 (с, 3Н, Me), 6,62 (д, J 7,7, 1Н, Н6), 7,06 (д, J 5,6, 1Н, Н3), 7,18 (д, J 7,7, 1Н, Н7), 7,35 (д, J 8,2, 2Н, Ts), 8,02 (д, J 8,2, 2Н, Ts), 8,40 (д, J 5,6, 1Н, Н2), 11,15 (ушир., 1Н, NH). 13 С-ЯМР (ДМСО-d6, 50МГц) 21,0 (кв., Me), 56,2 (кв., Me), 102,1 (д, С3), 113,9 (с, С4а), 126,1 (д, Ts), 129,4 (д, С2 і Ts), 133,9 (с, С5а), 142,6 (с, С10а), 143,4 (с,С9), 145,1 (д,С7), 159,0 (с, С4). МС (El) m/z 494 (М+, 31), 429 (M-SO2, 65), 368 (M-I, 12), 339 (M-Ts, 15), 303 (M-SO2-I, 58), 212 (MTs-I, 100). МС вис.розр., m/z, для C18H15IN4O5S обчислене 493,9909; знайдене 493,9891. 45 Приклад 45 4-Метокси-9-тозиламіно-5-(2ацетиламінопіримідин-4-іл)піридо[3',2':4,5]піроло[1,2-с]піримідин (25) Розчин 24b (295мг, 0,60ммоль), 27 (258мг, 0,9ммоль), Pd2(dba)3.CHCl3 (120мг, 0,12ммоль), PPh3 (60мг, 0,24ммоль), LiCl (74мг, 1,8ммоль) і Cul (23мг, 0,12ммоль) в діоксані (25мл) кип'ятять із зворотнім холодильником протягом однієї години. Розчинник випаровують і залишок розчиняють в СН2Сl2. Органічний розчин екстрагують чотири рази 4н соляною кислотою. Водні розчини об'єднують, підлуговують твердим NaHCO3 і екстрагують СН2Сl2. Органічний розчин упарюють і залишок очищають колонковою флеш-хроматографією. Елюювання сумішшю СН2Сl2 і МеОН (99/1) дає 23b (66мг, 28%) і сумішшю СН2Сl2 і МеОН (9/1) дає 25 (209мг, 71%) у вигляді жовтої твердої речовини. ІЧ (KВr) 3379 (m, NH), 1592 (s, C=N), 1474, 1449, 1422, 1293 (SO2), 1143. 1 Н-ЯМР (CDCl3, 200МГц) 2,41 (с, 3Η, Me), 2,47 (с, 3Н, Me), 4,05 (с, 3Н, Me), 6,92 (ушир., 1Н, Н3), 7,31 (д, J 8,4, 2Н, Ts), 7,46 (ушир.д, 1Н, Н6), 7,60 (д, J 6,6, 1Н, Н7), 7,98 (ушир., 1Н, Н5'), 8,12 (д, J 8,4, 2Н, Ts), 8,38 (ушир., 1Н, Н2), 8,50 (ушир., 1Н, Η6). МС (ES+) m/z 505 (М+2, 30), 504 (M+1, 100). Приклад 46 4-Гідрокси-9-тозиламіно-5-(2-амінопіримідин-4іл)піридо[3',2':4.5]піроло[1,2-с]піримідин (26) Розчин 25 (10мг, 0,02ммоль) в НВr (48%) кип'ятять із зворотнім холодильником протягом 10хв. Розчин підлуговують NaHCO3 і екстрагують СН2Сl2. Органічний розчин сушать, фільтрують і упарюють, і одержують 26 (7мг, 78%) у вигляді жовтої твердої речовини. 1 Н-ЯМР (CDCl3+CD3OD, 300МГц) 2,34 (с, 3Н, Me), 6,76 (д, J 6,6, 1Н, H6), 7,03 (д, J 6,6, 1Н, Η5·, 7,06 (д, J 6,6, 1Н, H5'), 7,23 (д, J 8,1, 2H, Ts), 7,65 (д, J 6,6, 1Н, H7), 8,00 (д, J 8,1,2Н, Ts), 8,01 (д, J 6,6, 1Н, Н6'), 8,23 (ушир.д, 1Н, Н2). МС (ES+) m/z 449 (М+1, 10), 448 (М+, 100). Приклад 47 4-Хлор-2-метансульфонілпіримідин 77400 46 [Див. Heterocycles, 1977, 8, 299]. До розчину 4хлор-2-метан-сульфенілпіримідину (5г, 31ммоль) в СН2Сl2 (100мл) додають м-СРВА (16,12г, 94ммоль) і суміш перемішують протягом 2год. при кімнатній температурі. Суміш промивають насиченим водн. розчином Na2S2O3 і водний розчин підлуговують Na2CO3. Органічний шар відділяють і водний розчин екстрагують СН2Сl2. Органічні шари об'єднують і упарюють, і одержують 4-хлор-2метансульфонілпіримідин (5,5г, 92%) у вигляді білої твердої речовини. 1 Н-ЯМР (CDCl3, 200МГц) 3,39 (с, 3Н, Me), 7,61 (д, J 5,4, 1Н, Н5), 8,83 (д, J 5,4,1Н,Н6). МС (CI, СН4) m/z 192 (М35Сl+, 1), 157 (М-С1,1), 97 (100). Приклад 48 2-Аміно-4-хлорпіримідин До розчину 4-хлор-2метансульфонілпіримідину (5г, 26ммоль) в ізоРrОН (20мл) додають 20% водн. розчин NH3 (20мл) і суміш перемішують протягом 20хв. при кімнатній температурі. Суміш чотири рази екстрагують СН2Сl2 і видаляють органічний розчинник у вакуумі. Одержують 2-аміно-4-хлорпіримідин (3,3г, 100%) у вигляді білої твердої речовини. 1 Н-ЯМР (CDCl3, 200МГц) 5,26 (ушир., 2Н, ΝΗ2), 6,67 (д, J 5,2, 1Н, Н5), 8,17 (д, J 5,2, 1Н, Н6). МС (СІ, СН4) m/z 132 (37С1М+1,33), 131 37 ( С1М+, 2), 130 (35С1М+1, 87), 129 (35С1М, 8), 97 (100), 94 (М-С1, 53). Приклад 49 2-Ацетиламіно-4-хлорпіримідин і 4-хлор-2діацетиламінопіримідин Розчин 2-аміно-4-хлорпіримідину (500мг, 3,9ммоль) в оцтовому ангідриді (20мл) кип'ятять із зворотнім холодильником протягом 30хв. Розчинник видаляють у вакуумі і масло, що залишилося, розчиняють в насиченому водн. розчині Na2CO3. Водний розчин екстрагують СН2Сl2. Органічний розчин сушать і упарюють, і одержують масло, яке очищають колонковою флеш-хроматографією. Елюювання сумішшю СН2Сl2 і гексану (2/1) дає 4хлор-2-діацетиламінопіримідин (122мг, 16%) у вигляді білої твердої речовини і СН2Сl2 дає 2ацетиламіно-4-хлорпіримідин (270мг, 45%) у ви 47 77400 48 гляді білої твердої речовини. 2-Ацетиламіно-4-хлорпіримідин 1 Н-ЯМР (CDCl3, 200МГц) 2,51 (с, 3Н, Me), 7,04 (д, J 5,3, 1Н, Н5), 8,17 (д, J 5,3, 1Н, Н6). 13 С-ЯМР (CDCl3, 50МГц) 25,3 (кв., Me), 116,0 (д, С5), 157,5 (с, С4), 159,2 (д, С6), 161,8 (с, С2). МС (El) m/z 173 (37С1М, 5), 171 (35С1М, 16), Розчин 2-ацетиламіно-4-хлорпіримідину 131 (37С1М-Ас, 32), 129 (35С1М-Ас, 100). (170мг, 1,0ммоль), гексаметилдіолова (400мкл, 4-Хлор-2-діацетиламінопіримідин 1 1,8ммоль) і Pd(PPh3)4 (40мг, 0,03ммоль) в діоксані Н-ЯМР (CDCl3, 200МГц) 3,32 (с, 6Н, 2Ме), (6мл) кип'ятять із зворотнім холодильником протя7,45 (д, J 5,2, 1Н, Н5), 8,76 (д, J5,2, 1Н, Н6). гом 1 години. Розчинник видаляють у вакуумі і 13 С-ЯМР (CDCl3, 50МГц) 26,3 (кв., Me), 121,2 залишок очищають колонковою хроматографією (д, C5), 160,0 (д, С6), 163,1 (с, C4), 171,6(0, C2). на нейтральному оксиді алюмінію. Елюювання 37 37 -1 MC (CI, CH4) m/z 215 ( C1M, 1), 214 ( С1М , сумішшю гексану і AcOEt (7/3) дає 27 (240мг, 80%) 35 35 -1 37 3), 213 ( C1M, 1), 212 ( С1М , 5), 174 ( C1M-Ac, у вигляді білої твердої речовини. 35 32), 172 ( C1M-Ac, 100). 1 Н-ЯМР (CDCl3, 300МГц) 0,36 (с, 9Н, 3Ме), Приклад 50 2,53 (с, 3Н, Me), 7,13 (д, J 4,8, 1Н, Н5), 7,98 (ушир., 2-Ацетиламіно-4-триметилстанілпіримідин (27) 1Н, NH), 8,35 (д, J 4, 8, 1Н, Н6). 13 С-ЯМР (CDCl3, 75МГц) -9,5 (кв., 3Ме), 25,3 (кв., Me), 124,4 (д, С5), 154,7 (д, С6). MC (El) m/z 300 (120SnM+, 1), 285 (120SnM-Me, 34) 270 (120SnM-2Me, 1), 255 (120SnM-3Me, 6), 244 (120SnM-3Me-Ac, 30), 136 (M-SnMe3, 100). Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюVariolin b derivatives, pharmaceutical composition, method for production, intermadiates
Назва патенту російськоюПроизводные вариолина в, фармацевтическая композиция на их основе, способ получения, промежуточное соединение
МПК / Мітки
МПК: A61K 45/00, A61K 31/519, A61P 35/00, C07D 471/14
Мітки: проміжна, похідні, спосіб, одержання, варіоліну, основі, композиція, фармацевтична, сполука
Код посилання
<a href="https://ua.patents.su/24-77400-pokhidni-variolinu-b-farmacevtichna-kompoziciya-na-kh-osnovi-sposib-kh-oderzhannya-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Похідні варіоліну b, фармацевтична композиція на їх основі, спосіб їх одержання, проміжна сполука</a>
Попередній патент: Композиція солі фентанілу для інтраназального введення
Наступний патент: Пристрій для сприйняття радіального навантаження від передньої частини вала приводу вентилятора турбореактивного двигуна з подовжньою віссю
Випадковий патент: Спосіб механотерапії у дітей