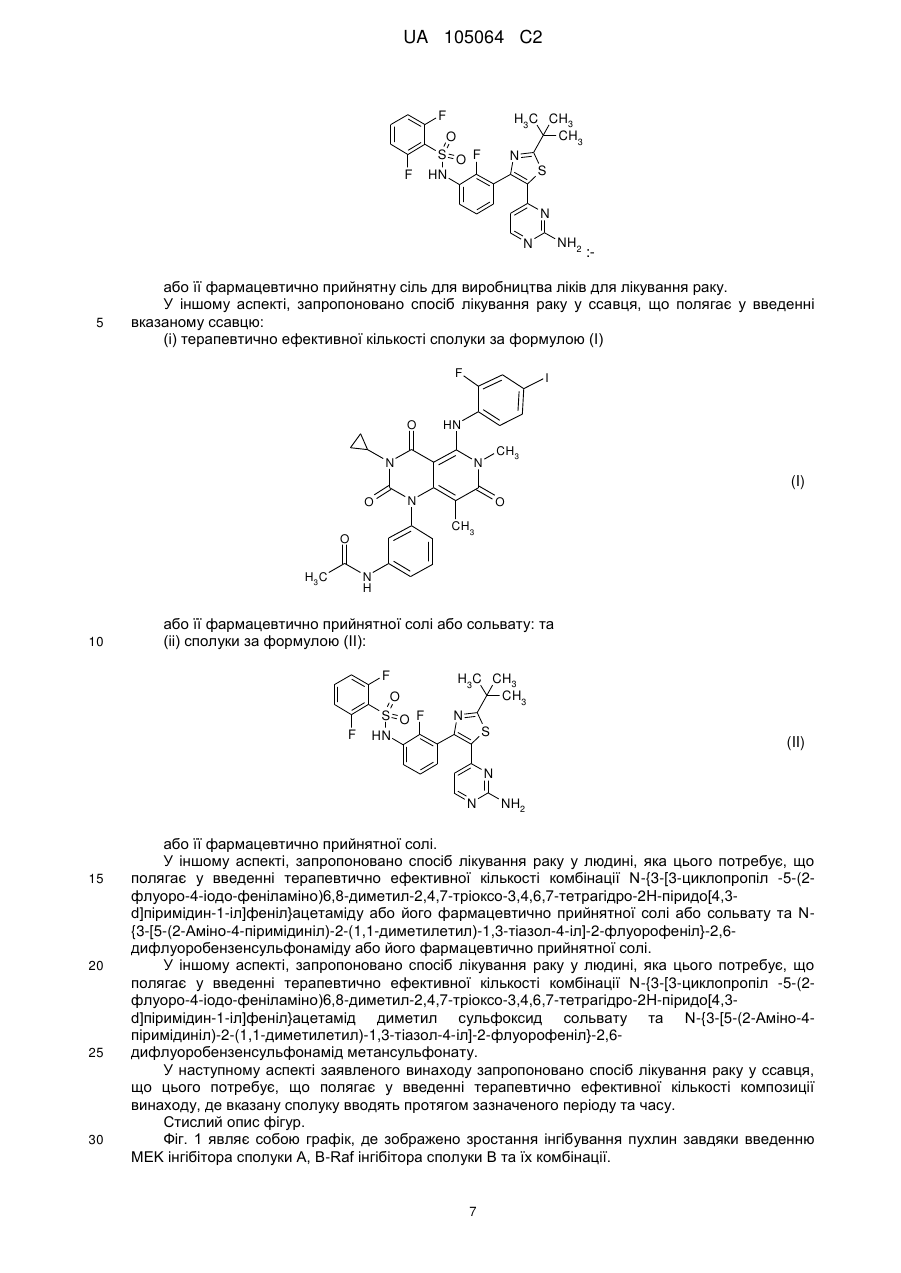
Комбінація, що містить інгібітор мек та інгібітор в-raf
Номер патенту: 105064
Опубліковано: 10.04.2014
Автори: Кумар Ракеш, Дамбл Мелісса, Лебовіц Пітер, Лакерр Сільві
Формула / Реферат
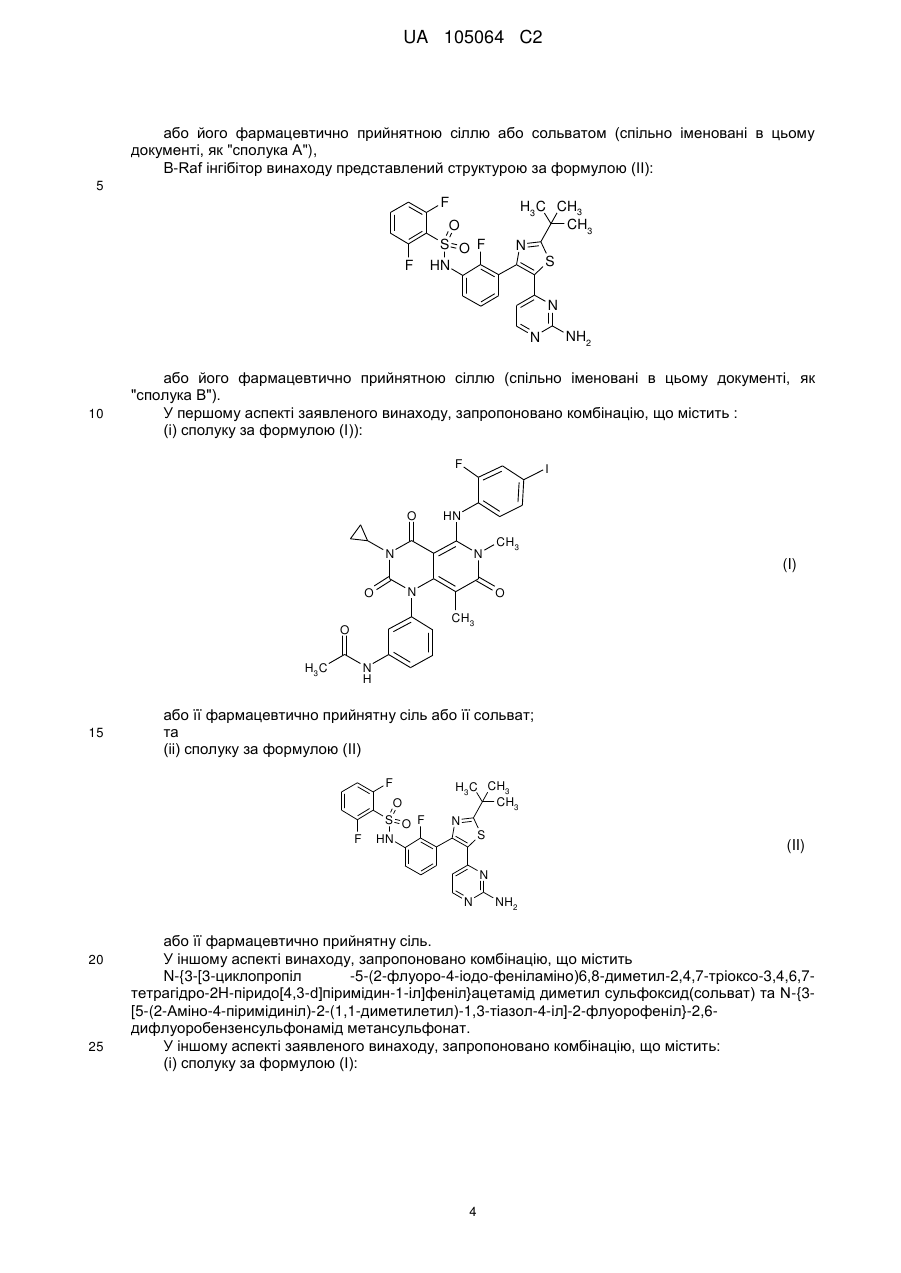
1. Комбінація, що містить:
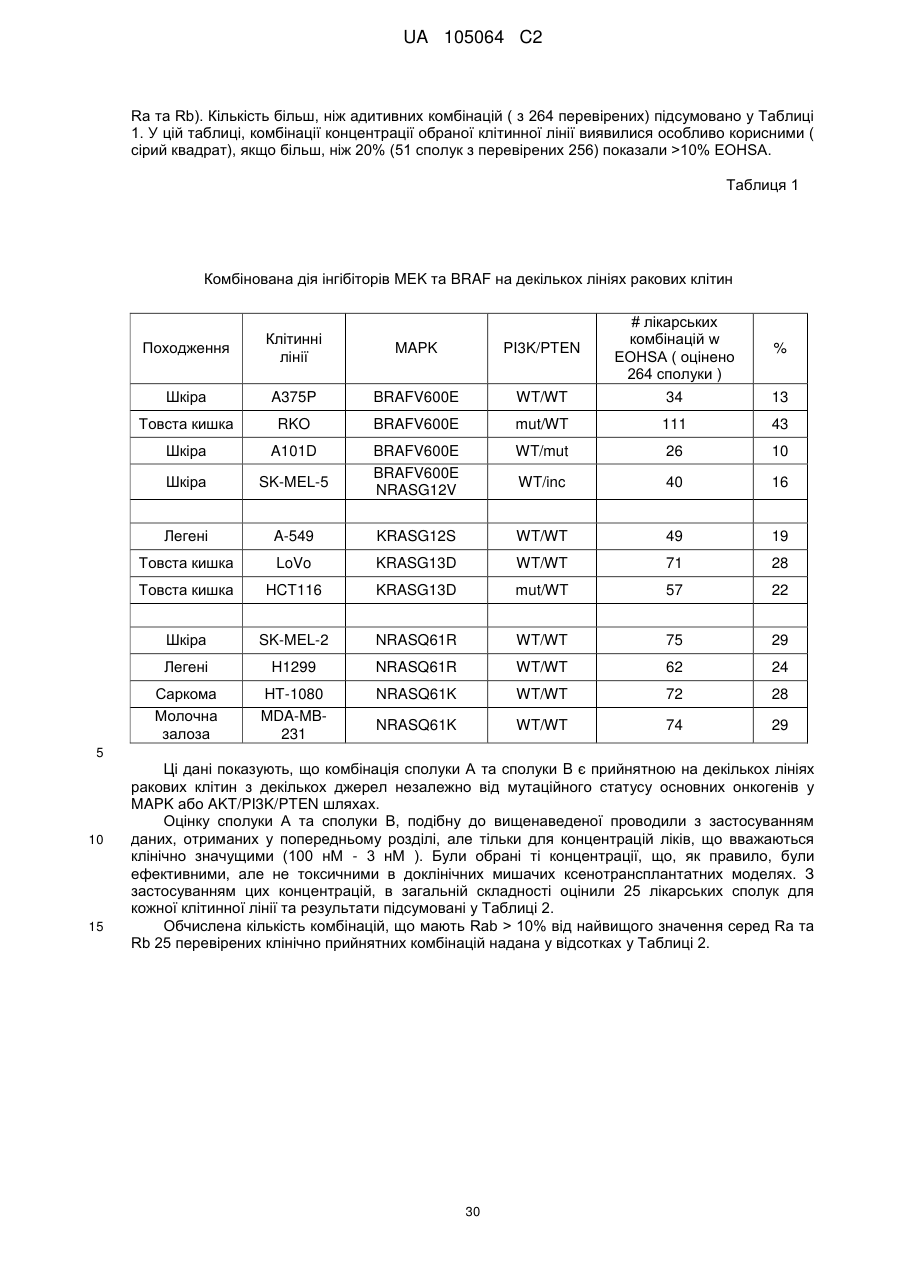
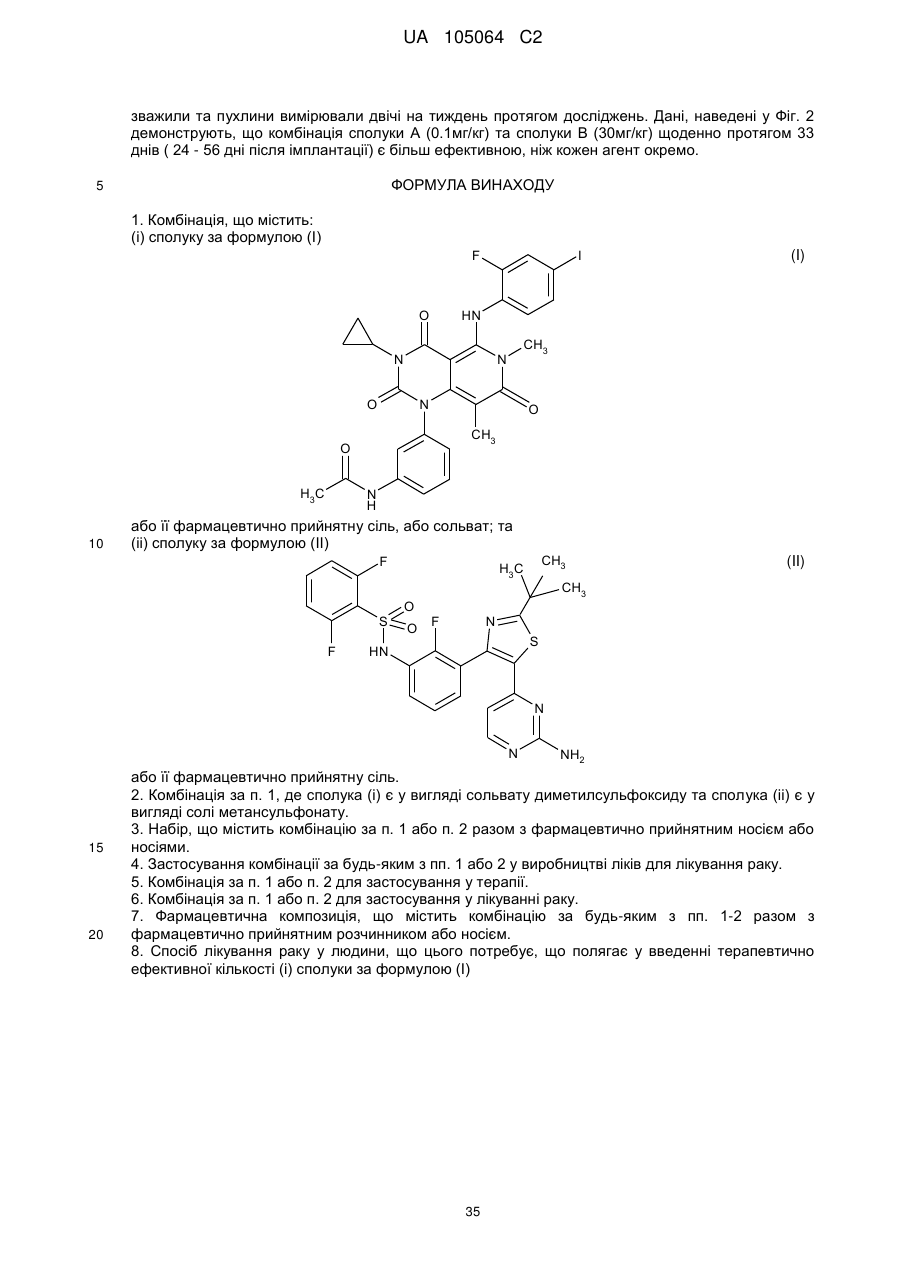
(і) сполуку за формулою (І)
 (I)
(I)
або її фармацевтично прийнятну сіль, або сольват; та
(іі) сполуку за формулою (II)
 (II)
(II)
або її фармацевтично прийнятну сіль.
2. Комбінація за п. 1, де сполука (і) є у вигляді сольвату диметилсульфоксиду та сполука (іі) є у вигляді солі метансульфонату.
3. Набір, що містить комбінацію за п. 1 або п. 2 разом з фармацевтично прийнятним носієм або носіями.
4. Застосування комбінації за будь-яким з пп. 1 або 2 у виробництві ліків для лікування раку.
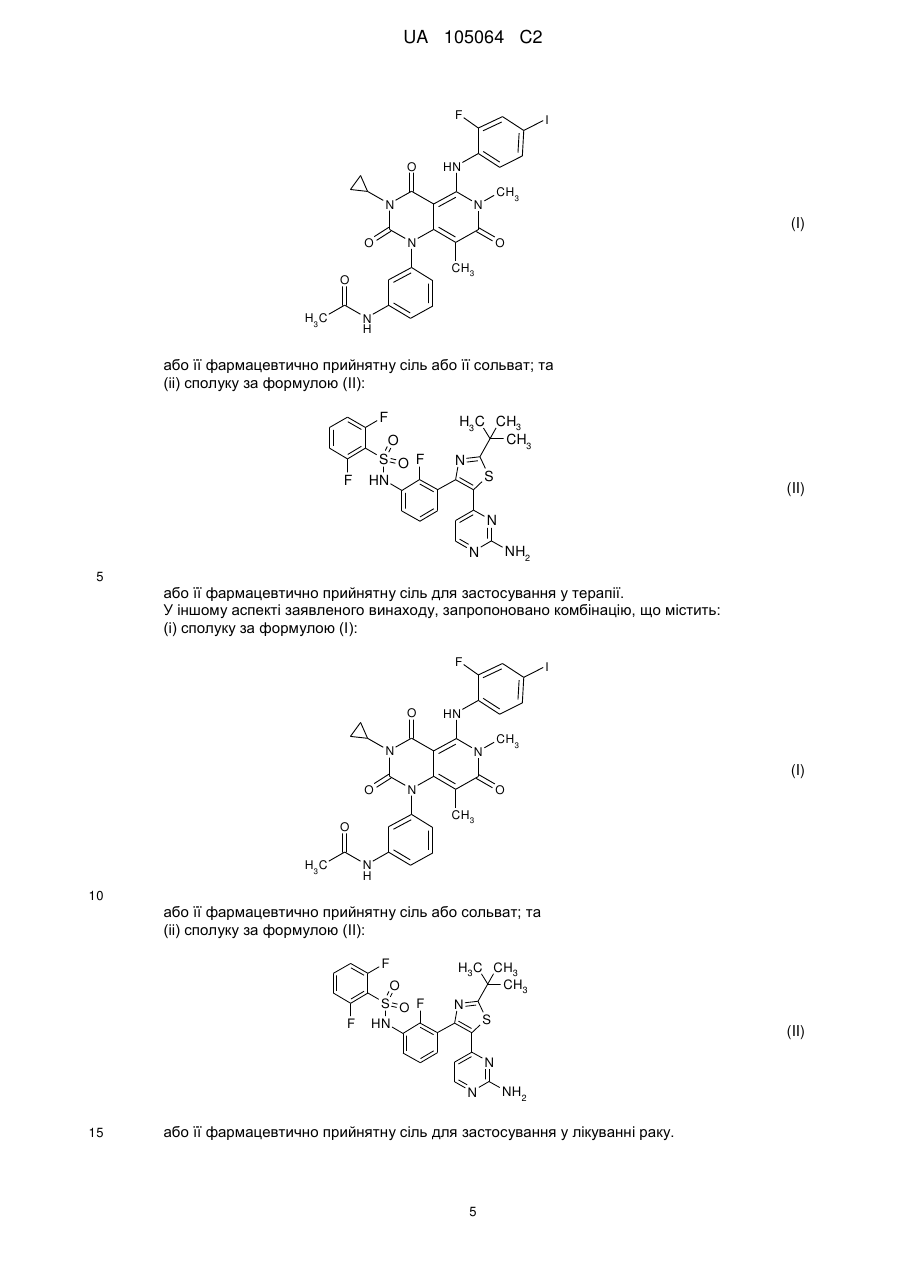
5. Комбінація за п. 1 або п. 2 для застосування у терапії.
6. Комбінація за п. 1 або п. 2 для застосування у лікування раку.
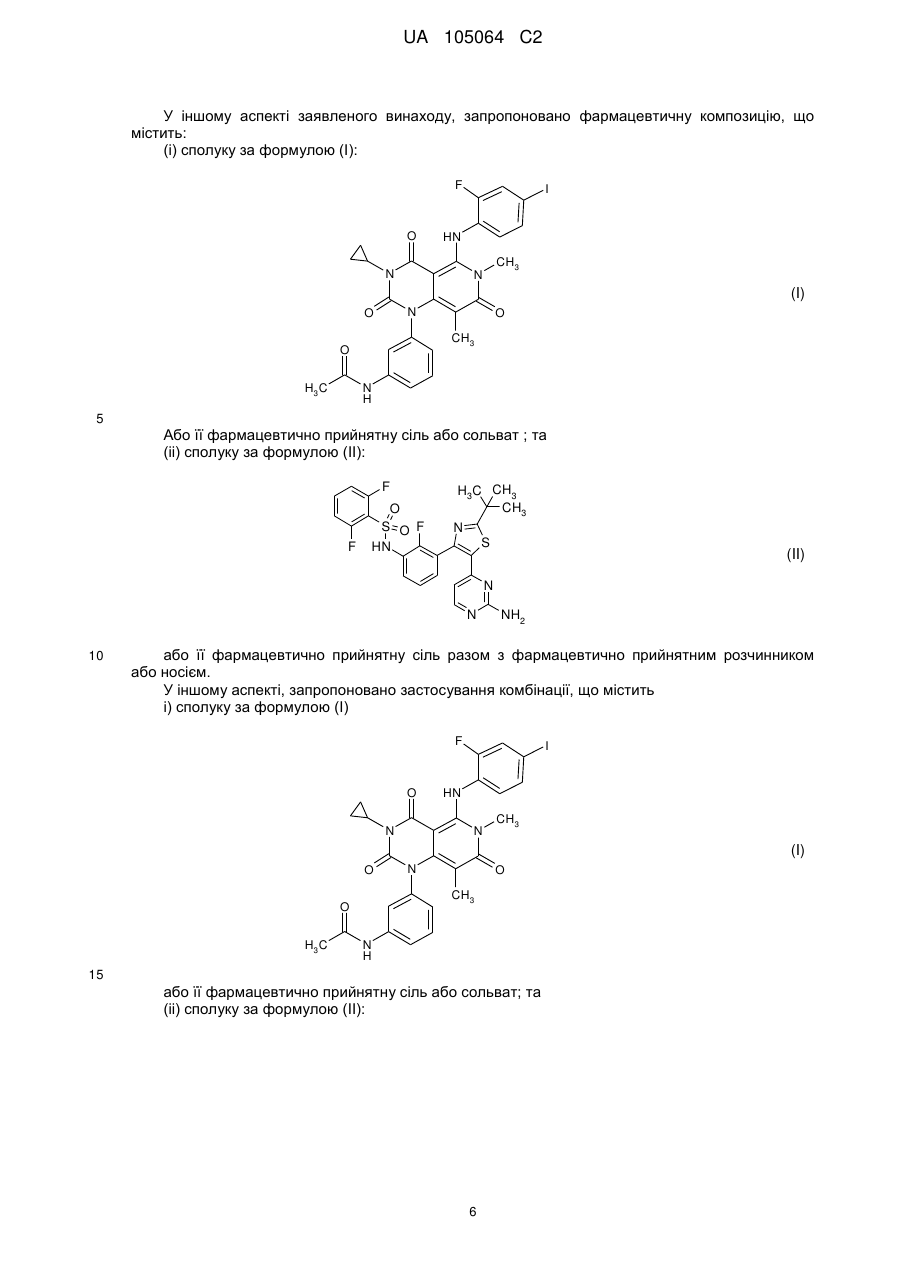
7. Фармацевтична композиція, що містить комбінацію за будь-яким з пп. 1-2 разом з фармацевтично прийнятним розчинником або носієм.
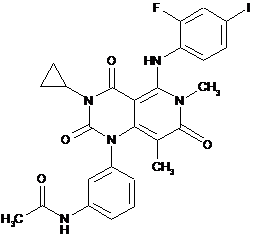
8. Спосіб лікування раку у людини, що цього потребує, що полягає у введенні терапевтично ефективної кількості (і) сполуки за формулою (І)
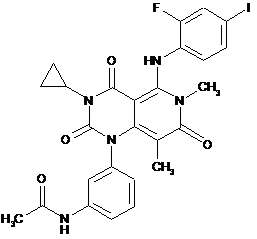 (I)
(I)
або її фармацевтично прийнятної солі, або сольвату;
та (іі) сполуки за формулою (II)

або її фармацевтично прийнятної солі.
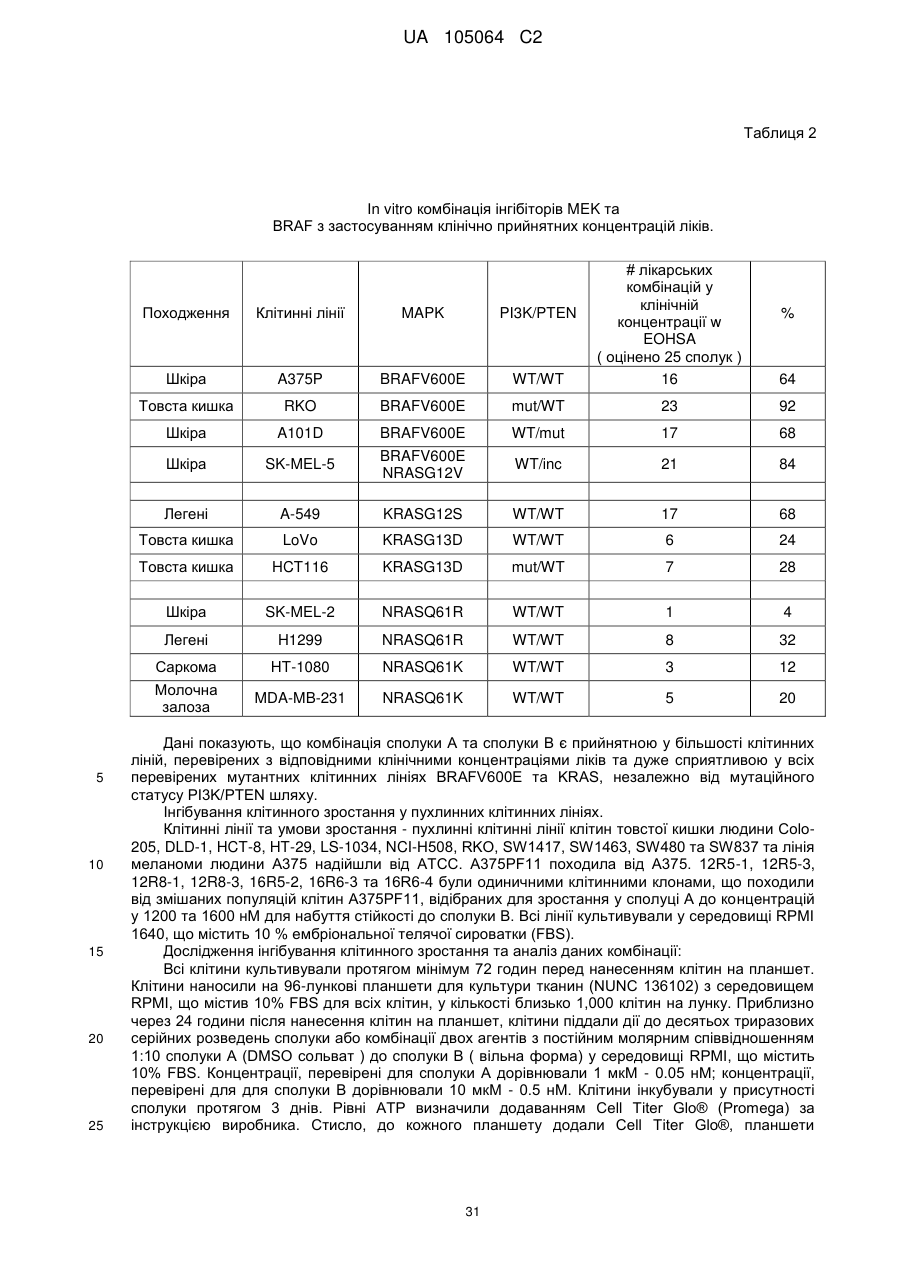
9. Спосіб за п. 8, де захворювання на рак є вибраним з раку голови та шиї, раку молочної залози, раку легенів, раку товстої кишки, раку яєчників, раку передміхурової залози, гліом, гліобластоми, астроцитоми, мультиформної гліобластоми, синдрому Банаян-Зонана, захворювання Ковдена, захворювання Лерміта-Дюкло, запального раку молочної залози, пухлини Вільма, Саркоми Юінга, рабдоміосаркоми, епендимоми, медулобластоми, раку нирки, раку печінки, меланоми, раку підшлункової залози, саркоми, остеосаркоми, гігантської пухлини кістки, раку щитовидної залози, лімфобластного Т-клітинного лейкозу, хронічного мієлолейкозу, хронічного лімфолейкозу, волосатоклітинного лейкозу, гострого лімфобластного лейкозу, гострого мієлобластного лейкозу, гострого мієлоїдного лейкозу, хронічного нейтрофільного лейкозу, гострого лімфобластного Т-клітинного лейкозу, плазмоцитоми, імунобластного крупноклітинного лейкозу, лейкозу мантійних клітин, множинного мієломного мегакаріобластного лейкозу, множинної мієломи, гострого мегакаріотичного лейкозу, промієлоцитарної лейкемії, еритролейкемії, злоякісної лімфоми, ходжкінської та неходжкінської лімфом, лімфобластної Т-клітинної лімфоми, лімфоми Беркіта, фолікулярної лімфоми, нейробластоми, раку сечового міхура, раку уротелія, раку вульви, раку шийки матки, раку ендометрія, раку нирки, мезотеліоми, раку стравоходу, раку слинної залози, гепатоцелюлярного раку, раку шлунка, рак носоглотки, раку слизової оболонки рота, раку рота, GIST (шлунково-кишкової стромальної пухлини) та раку яєчок.
10. Спосіб за п. 8 або п. 9, де рак є меланомою.
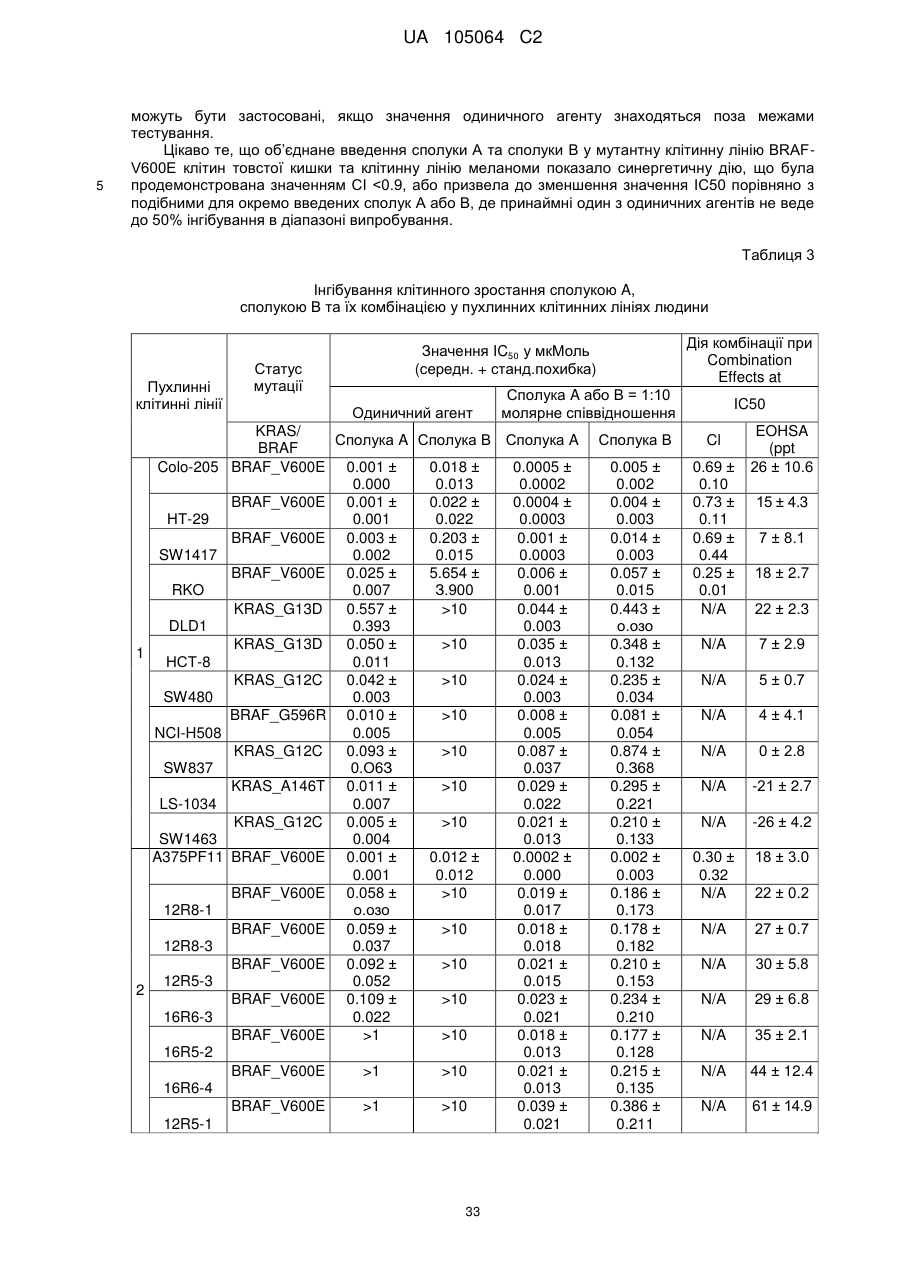
11. Спосіб за будь-яким з пп. 8-10, де сполука (і) знаходиться у вигляді сольвату диметилсульфоксиду та сполука (іі) знаходиться у вигляді солі метансульфонату.
Текст
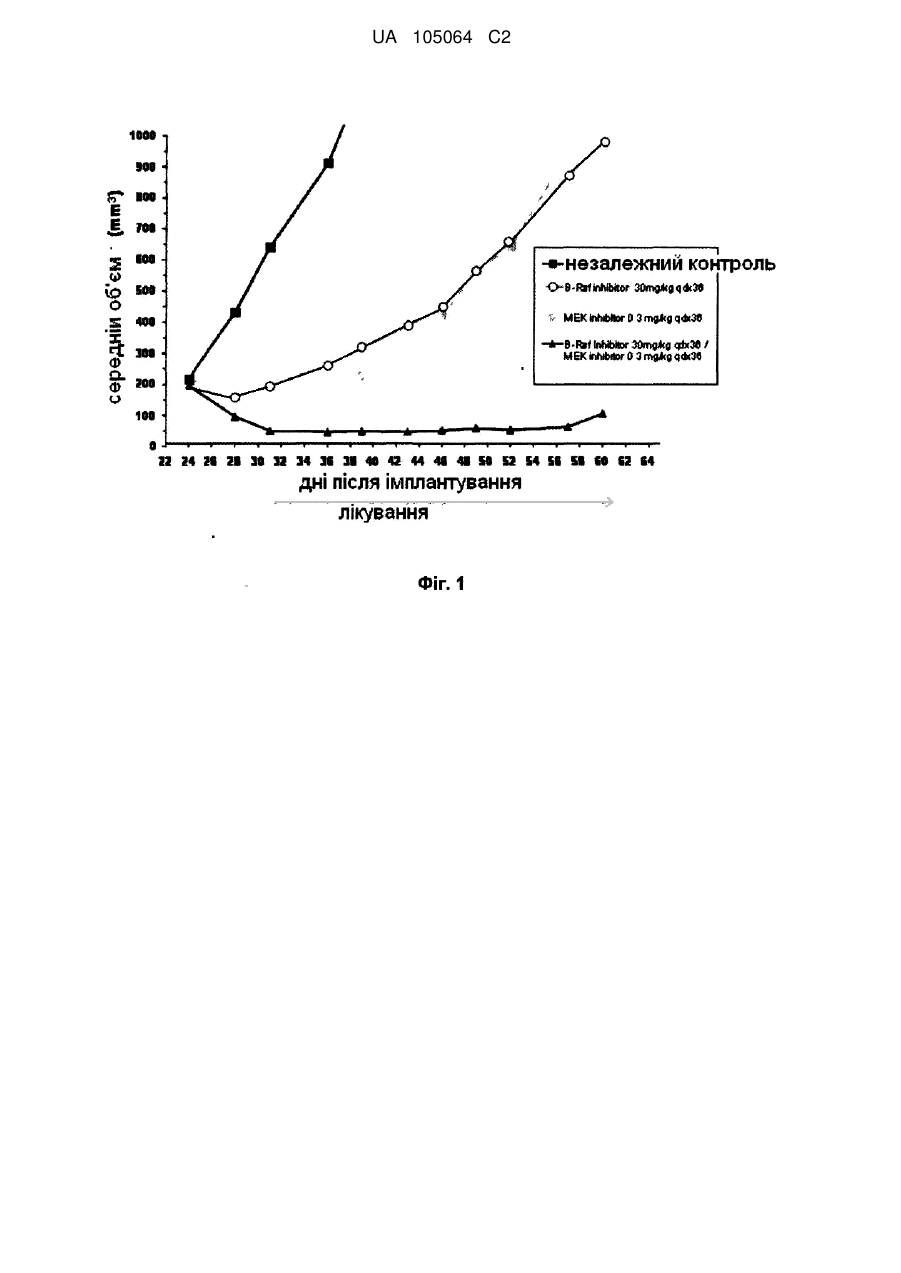
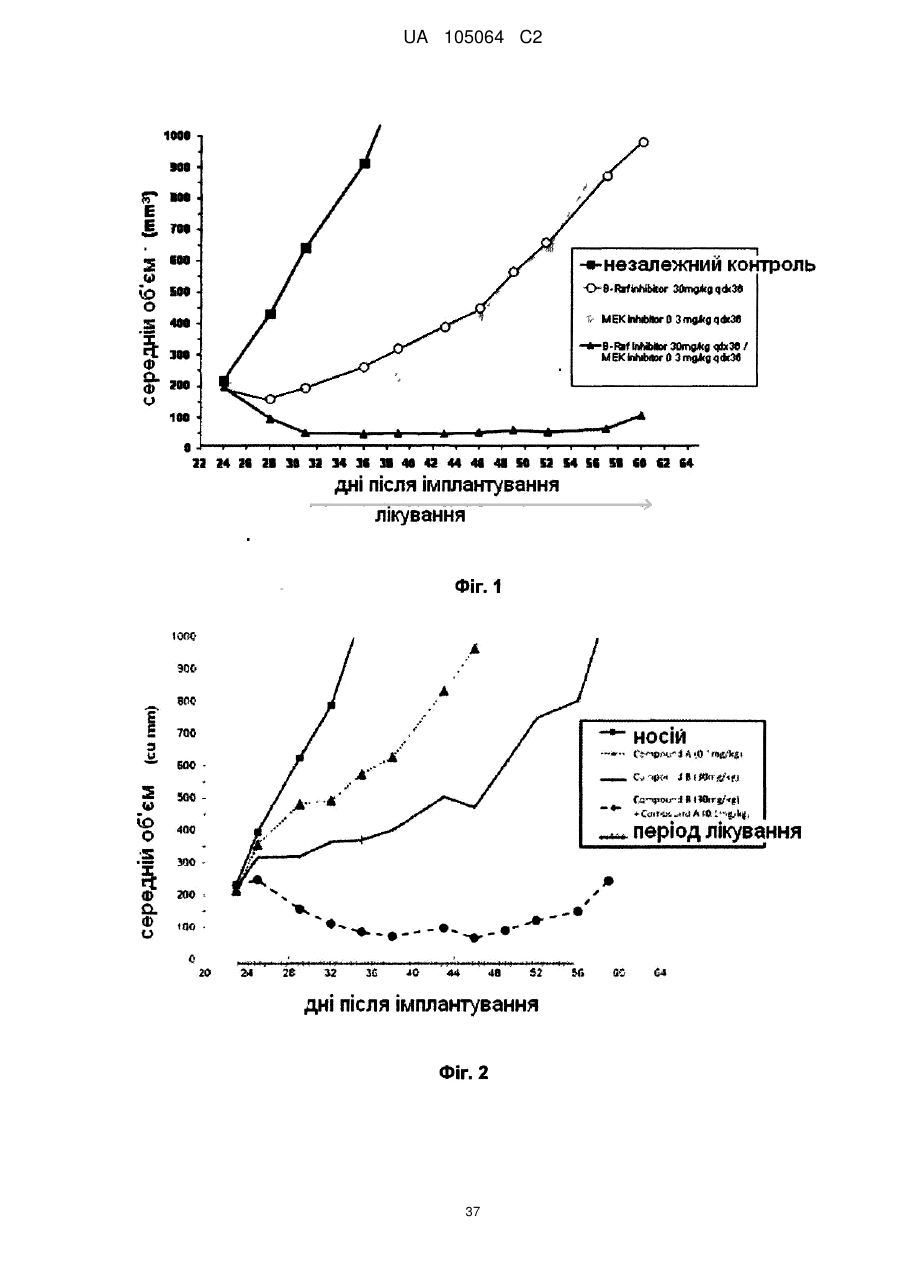
Реферат: Винахід стосується комбінації, що містить інгібітор МЕК N-{3-[3-циклопропіл-5-(2-флуоро-4-іодофеніламіно)6,8-диметил; -2,4,7-тріоксо-3,4,6,7-тетрагідро-2Н-піридо[4,3-d]піримідин-1іл]феніл}ацетамід або її фармацевтично прийнятну сіль або сольват з інгібітором B-Raf, зокрема з N-{3-[5-(2-аміно-4-піримідиніл)-2-(1,1-диметилетил)-1,3-тіазол-4-іл]-2-флуорофеніл}2,6-дифлуоробензенсульфонамідом або з його фармацевтично прийнятною сіллю; фармацевтичної композиції, що її містить, та способу застосування такої комбінації та композиції у лікуванні станів, де інгібування МЕК та/або B-Raf є корисним, наприклад раку. UA 105064 C2 (12) UA 105064 C2 UA 105064 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується способу лікування раку у ссавця та комбінацій, прийнятних у такому лікуванні. Зокрема, спосіб стосується нової комбінації, що містить інгібітор MEK N-{3-[3циклопропіл-5-(2-флуоро-4-іодо-феніламіно)6,8-диметил;-2,4,7-тріоксо-3,4,6,7-тетрагідро-2Hпіридо[4,3-d]піримідин-1-іл]феніл}ацетамід або її фармацевтично прийнятну сіль або сольват, з інгібітором B-Raf, зокрема з N-{3-[5-(2-аміно-4-піримідиніл)-2-(1,1-диметилетил)-1,3-тіазол-4-іл]2-флуорофеніл}-2,6-дифлуоробензенсульфонамідом або з його фармацевтично прийнятною сіллю, фармацевтичних композицій, що її містять та способів застосування таких сполук та композицій у лікуванні станів, де інгібування MEK та/або B-Raf є корисним, наприклад, раку. Ефективне лікування гіперпроліферативних розладів, в тому числі раку, є постійною метою у онкології. Звичайно, рак веде до порушення регулювання нормальних процесів, що контролюють клітинне поділ, диференціювання та апоптоз клітин та характеризуються проліферацією злоякісних клітин, що мають потенціал до необмеженого зросту, локального поширення та системного метастазу. Порушення регулювання нормальних процесів полягає у виникненні аномалій у шляхах передачі сигналів та у відповіді на фактори, що відрізняються від подібних у нормальних клітинах. Важливою великою родиною ензимів є родина ферментів протеїнкіназ. Зараз відомо про приблизно 500 різних протеїнкіназ. Протеїнкінази каталізують фосфорилювання амінокислотного бічного ланцюга у різних білках шляхом переносу - фосфату комплексу ATP2+ Mg до вказаного амінокислотного бічного ланцюга. Ці ферменти контролюють більшість сигнальних процесів у клітинах, тим самим керуючи зростання, диференціювання та руйнацію (апоптоз) клітин за допомогою реверсивного фосфорилювання гідроксильних груп серинових, треонінових та тирозинових залишків у білків. Дослідження показали, що протеїнкінази є ключовими регуляторами багатьох клітинних функцій, в тому числі передачі сигналу, регуляції транскрипції, рухливості та поділу клітин. Було показано, що декілька онкогенів кодують протеїнкінази, що наводить на думку про те, що ці кінази відіграють роль у онкогенезі. Ці процеси суворо регулюються, часто за допомогою складних шляхів, що перекриваються, де кожна кіназа сама регулюється однією або декількома кіназами. Отже, аберантна або неприйнятна активність протеїнкіназ може сприяти зростанню хворобливих станів, пов’язаних з такою аберантною кіназною активністю, в тому числі з доброякісними та злоякісними проліферативними розладами, а також з захворюваннями, що виникли від неприйнятної активації імунної та нервової систем. Завдяки їх фізіологічному значенню, різноманітності та розповсюдженості, протеїнкінази стали одними з найбільш важливих та широко досліджуваних родин ферментів у біохімічних та медичних дослідженнях. Родину протеїнкіназ по типу амінокислотного залишку, що вони фосфорилюють, звичайно поділяють на дві основні підродини: тирозинові протеїнкінази та серин/треонінові тирозинкінази. Серин/треонінові тирозинкінази (PSTK), охоплюють цАМФ- та цГМФ - залежні протеїнкінази, кальцій та фосфоліпід- залежні протеїнкінази, кальцій - та кальмодулін - залежні протеїнкінази, казеїнкінази, протеїнові кінази циклу клітинного поділу тощо. Ці кінази звичайно є цитоплазматичними або пов’язаними з частинками фракцій клітин, можливо за допомогою якірних білків. Аберантна білкова активність серин/треонінової кінази є причиною або підозрюється у спричиненні ряду різних патологій, як-то ревматоїдного артриту, псоріазу, септичного шоку, втрати кісткової маси, багатьох захворювань на рак та інших проліферативних захворювань. Відповідно, серин/треонінові кінази та сигнальні шляхи, частиною яких вони є, є важливою метою для розробки ліків. Тирозинкінази фосфорилюють тирозинові залишки та грають в рівній мірі важливу роль у клітинній регуляції. Ці кінази містять різні рецептори молекул, як-то гормонів та факторів зростання, в тому числі рецептор епідермального фактора зростання, інсуліновий рецептор, тромбоцитарний рецептор фактора зростання тощо. Дослідження показали, що багато тирозинкіназ є трансмембранними білками зі своїми рецепторними доменами, розташованими на зовнішній стороні клітин та їх кіназними доменами всередині. Зараз також проводиться велика робота по визначенню модуляторів тирозинкіназ. Рецепторні тирозинкінази (RTK) каталізують фосфорилювання деяких тирозилових амінокислотних залишків у різних білків, в тому числі у тих, що регулюють зростання, проліферацію та диференціацію клітин. Нижче деяких RTK знаходяться кілька сигнальних шляхів, серед яких є Ras-Raf-MEK-ERK кіназний шлях. Зараз зрозуміло, що активація білків Ras ГТФази у відповідь до факторів зростання, гормонів, цитокінів тощо, стимулює фосфорилювання та активацію Raf кінази. Потім ці кінази фосфорилюють та активують внутрішньоклітинні протеїнкінази MEK1 та MEK2, що у свою чергу фосфорилюють та активують інші протеїнкінази ERK1 та 2. Цей сигнальний шлях, також відомий, як мітоген-активований протеїнкіназний (MAPK) шлях або цитоплазматичний каскад, опосередковує клітинні відповіді до сигналів зростання. Кінцевою функцією цього є 1 UA 105064 C2 5 10 15 20 25 30 35 40 45 50 55 60 зв’язування рецепторної активності на клітинній мембрані з модифікацією цитоплазматичних або ядерних мішеней, що регулюють клітинну проліферацію, диференціацію та виживання. Конститутивної активації цього шляху достатньо для викликання клітинної трансформації. Нерегульовану активацію MAP - кіназного шляху завдяки аберантній активації рецептора тирозинкінази, Ras або Raf мутацій часто знаходять у людських ракових пухлинах та вона являє собою головний фактор, що визначає ненормальний контроль зростання. У людських злоякісних пухлинах, Ras мутації зустрічаються постійно та вони були визначені у близько 30% випадків раку. Ras родина ГТФазних білків (білки, що перетворюють гуанозинтрифосфат на гуанозиндифосфат) передають сигнали від активованих рецепторів фактора зростання до нижчестоячих внутрішньоклітинних партнерів. Чільне місце серед мішеней, захоплених активною, пов’язаною з мембраною Ras займає родина Raf серин/треонінових протеїнових кіназ. Родина Raf складається з трьох споріднених кіназ (A-, B- та C-Raf), що діють, як нижчестоячі ефектори Ras. Ras-опосередкована Raf активація, в свою чергу, викликає активацію MEK1 та MEK2 (MAP / ERK кінази 1 та 2) що, в свою чергу, фосфорилюють ERK1 та ERK2 ( позаклітинні сигнал - керовані кінази 1 та 2) у тирозині -185 та треоніні -183. Активовані ERK1 та ERK2 переміщуються та накопичуються у нуклеусі, де вони можуть фосфорилювати різні субстрати, в тому числі фактори транскрипції, що контролюють клітинне зростання та виживання. Враховуючи важливість Ras /Raf / MEK / ERK шляху у розвитку людських ракових пухлин, кіназні компоненти сигнального каскаду вважаються потенційно важливими мішенями для модулювання прогресування раку та інших проліферативних захворювань. MEK1 та MEK2 є членами великої родини кіназ з подвійною специфічністю (MEK1-7), що фосфорилюють треонінові та тирозинові залишки різних MAP кіназ. Хоча MEK1 та MEK2 кодуються різними генами, вони обидві мають високу тотожність (80%) у C-термінальних каталітичних кіназних доменах та у більшій частині N- термінальної регуляторної ділянки. У людських ракових пухлинах не було знайдено онкогенних форм MEK1 та MEK2, але було показано, що конститутивна активація MEK веде до клітинної трансформації. На додачу до Raf, MEK також може бути активований іншим онкогенезом. На цей час, єдиними відомими субстратами MEK1 та MEK2 є ERK1 та ERK2. Ця незвичайна субстратна специфічність на додачу до унікальної здатності фосфорилювати разом тирозинові та треонінові залишки робить MEK1 та MEK2 ключовим пунктом у каскаді передачі сигналу, що дозволяє інтегрувати багато позаклітинних сигналів у MAPK шлях. Відповідно, було визнано, що інгібітор білка MAPK кіназного шляху ( наприклад, MEK) повинен бути корисним у якості анти - проліферативного, про-апоптичного та анти-інвазивного агента для застосування у стримуванні та/або лікуванні проліферативного або інвазивного захворювання. Більш того, також відомо, що сполука, що має MEK інгібіторну активність ефективно спричинює інгібування ERK1/2 активності та пригнічення клітинної проліферації ( Journal of Biological Chemistry, vol. 276, No. 4 pp. 2686-2692, 2001) та очікується, що сполука буде впливати на захворювання, спричинені небажаною клітинною проліферацією, як-то розвитком пухлин та/або захворюванням на рак. Було виявлено, що мутації у різних Ras ГТФазах та B-Raf кіназі можуть приводити до тривалої та визначальної активації MAPK шляху, що зрештою веде до збільшення клітинного поділу та виживання. Внаслідок цього, ці мутації тісно пов’язані зі створенням, розвитком та поширенням широкого спектра захворювань людини на рак. Біологічна роль Raf кінази, особливо B-Raf, у передачі сигналу описана у Davies, H., et al., Nature (2002) 9:1-6; Garnett, M.J. & Marais, R., Рак Клітин (2004) 6:313-319; Zebisch, A. & Troppmair, J., Cell. Mol. Life Sci. (2006) 63:1314-1330; Midgley, R.S. & Kerr, D.J., Crit. Rev. Onc/Hematol. (2002) 44:109-120; Smith, R.A., et al., Curr. Top. Med. Chem. (2006) 6:1071-1089; and Downward, J., Nat. Rev. Cancer (2003) 3:11-22. Природні мутації B-Raf кінази, що активують MAPK сигнальний шлях були знайдені у великому відсотку людських меланом (Davies (2002) supra) та ракових пухлин щитовидної залози (Cohen et al J. Nat. рак Inst. (2003) 95(8) 625-627 та Kimura et al Cancer Res. (2003) 63(7) 1454-1457), а також з більш низькою, але все ж значною, частотою у наступних захворюваннях: аденосаркома Барета (Garnett et al., Cancer Cell (2004) 6 313-319 та Sommerer et al Oncogene (2004) 23(2) 554-558), карциноми жовчовивідних шляхів (Zebisch et al., Cell. Mol. Life Sci. (2006) 63 1314-1330), рак молочної залози (Davies (2002) supra), рак шиї (Moreno-Bueno et al Clin. Cancer Res. (2006) 12(12) 3865-3866), холангіокарцинома (Tannapfel et al Gut (2003) 52(5) 706712), пухлини центральної нервової системи, в тому числі первинні пухлини центральної нервової системи, як-то гліобластоми, астроцитоми та епендимоми (Knobbe et al Acta Neuropathol. (Berl.) (2004) 108(6) 467-470, Davies (2002) supra, та Garnett et al., Cancer Cell (2004) supra) та вторинні пухлини центральної нервової системи (тобто, метастази у центральній 2 UA 105064 C2 5 10 15 20 25 30 35 40 45 нервовій системи від пухлин, що виникли поза центральною нервовою системою ), колоректальний рак, в тому числі карцинома товстої кишки (Yuen et al Cancer Res. (2002) 62(22) 6451-6455, Davies (2002) supra та Zebisch et al., Cell. Mol. Life Sci. (2006), рак шлунку (Lee et al Oncogene (2003) 22(44) 6942-6945), карцинома голови та шиї, в тому числі сквамозна клітинна карцинома голови та шиї (Cohen et al J. Nat. Cancer Inst. (2003) 95(8) 625-627 та Weber et al Oncogene (2003) 22(30) 4757-4759), гематологічні захворювання на рак, в тому числі лейкемії (Garnett et al., Cancer Cell (2004) supra, особливо гостра лімфобластична лейкемія (Garnett et al., Cancer Cell (2004) supra and Gustafsson et al Leukemia (2005) 19(2) 310-312), гострий мієлоїдний лейкоз (AML) (Lee et al Leukemia (2004) 18(1) 170-172, and Christiansen et al Leukemia (2005) 19(12) 2232-2240), мієлодиспластичні синдроми(Christiansen et al Leukemia (2005) supra) та хронічна міелогенічна лейкемія (Mizuchi et al Biochem. Biophys. Res. Commun. (2005) 326(3) 645651); лімфома Ходжкіна (Figl et al Arch. Dermatol. (2007) 143(4) 495-499), неходжкінська лімфома (Lee et al Br. J. Cancer (2003) 89(10) 1958-1960), мегакаріобластична лейкемія (Eychene et al Oncogene (1995) 10(6) 1159-1165), хвороба Калера (Ng et al Br. J. Haematol. (2003) 123(4) 637645), карцинома клітин печінки (Garnett et al., Cancer Cell (2004), рак легенів (Brose et al Cancer Res. (2002) 62(23) 6997-7000, Cohen et al J. Nat. рак Inst. (2003) supra and Davies (2002) supra), в тому числі дрібноклітинний рак легенів (Pardo et al EMBO J. (2006) 25(13) 3078-3088) та недрібноклітинний рак легенів (Davies (2002) supra), рак яєчників (Russell & McCluggage J. Pathol. (2004) 203(2) 617-619 and Davies (2002) supr), ендометріальний рак (Garnett et al., Cancer Cell (2004) supra, and Moreno-Bueno et al Clin. Cancer Res. (2006) supra), панкреатичний рак (Ishimura et al Cancer Lett. (2003) 199(2) 169-173), аденома гіпофіза (De Martino et al J. Endocrinol. Invest. (2007) 30(1) RC1-3), рак передміхурової залози (Cho et al Int. J. Cancer (2006) 119(8) 1858-1862), рак нирок (Nagy et al Int. J. Cancer (2003) 106(6) 980-981), саркома (Davies (2002) supra), та шкірні захворювання на рак (Rodriguez-Viciana et al Science (2006) 311(5765) 1287-1290 and Davies (2002) supra). Надлишкова експресія c-Raf є пов’язаною з AML (Zebisch et al., Cancer Res. (2006) 66(7) 3401-3408, та Zebisch (Cell. Mol. Life Sci. (2006)) та з еритроміелозом (Zebisch et la., Cell. Mol. Life Sci. (2006). В силу ролі, що відіграють кінази Raf родин у цих захворюваннях на рак та пошукових досліджень з рядом доклінічних і терапевтичних агентів, в тому числі тих, що вибірково спрямовані на інгібування активності B-Raf кіназ (King A.J., et al., (2006) Cancer Res. 66:1110011105), загально визнано, що інгібітори однієї або декількох кіназ родини Raf будуть корисними для лікування таких захворювань на рак або інших станів, пов’язаних з Raf кіназами. Мутація B-Raf також причетна до інших станів, в тому числі до кардіо-фаціо-шкірного синдрому (Rodriguez-Viciana et al Science (2006) 311(5765) 1287-1290) та до полікістозу нирок (Nagao et al Kidney Int. (2003) 63(2) 427-437). Хоча зараз є багато досягнень у галузі лікування раку сполуками, як-то MEK та інгібітор BRaf, залишається необхідність у більш ефективному та/або посиленому лікуванні осіб, що страждають від наслідків раку. Винахідники виявили комбінацію хіміотерапевтичних агентів, що забезпечує підвищену активність, ніж при монотерапії. Зокрема, лікарську комбінацію, що містить MEK інгібітор N-{3-[3циклопропіл -5-(2-флуоро-4-іодо-феніламіно)6,8-диметил-2,4,7-тріоксо-3,4,6,7-тетрагідро-2Hпіридо[4,3-d]піримідин-1-іл]феніл}ацетамід або її фармацевтично прийнятну сіль або сольват у поєднанні з B-Raf інгібітором N-{3-[5-(2-аміно-4-піримідиніл)-2-(1,1-диметилетил)-1,3-тіазол-4-іл]2-флуорофеніл}-2,6-дифлуоробензенсульфонамідом або його фармацевтично прийнятною сіллю. MEK інгібітор винаходу представлений структурою за формулою (I): F O N O HN N N N H 3 CH3 O CH3 O H3 C I UA 105064 C2 або його фармацевтично прийнятною сіллю або сольватом (спільно іменовані в цьому документі, як "сполука A"), B-Raf інгібітор винаходу представлений структурою за формулою (II): 5 F F H3 C CH3 CH3 N S O S O F HN N NH2 N 10 або його фармацевтично прийнятною сіллю (спільно іменовані в цьому документі, як "сполука B"). У першому аспекті заявленого винаходу, запропоновано комбінацію, що містить : (i) сполуку за формулою (I)): F O I HN N N N O (I) O CH3 O H3 C 15 CH3 N H або її фармацевтично прийнятну сіль або її сольват; та (ii) сполуку за формулою (II) F F O S O F HN H3 C CH3 CH3 N S (II) N N 20 25 NH2 або її фармацевтично прийнятну сіль. У іншому аспекті винаходу, запропоновано комбінацію, що містить N-{3-[3-циклопропіл -5-(2-флуоро-4-іодо-феніламіно)6,8-диметил-2,4,7-тріоксо-3,4,6,7тетрагідро-2H-піридо[4,3-d]піримідин-1-іл]феніл}ацетамід диметил сульфоксид(сольват) та N-{3[5-(2-Аміно-4-піримідиніл)-2-(1,1-диметилетил)-1,3-тіазол-4-іл]-2-флуорофеніл}-2,6дифлуоробензенсульфонамід метансульфонат. У іншому аспекті заявленого винаходу, запропоновано комбінацію, що містить: (i) сполуку за формулою (I): 4 UA 105064 C2 F O I HN N CH3 N (I) N O CH3 O H3 C O N H або її фармацевтично прийнятну сіль або її сольват; та (ii) сполуку за формулою (II): F F O S O F HN H3 C CH3 CH3 N S (II) N NH2 N 5 або її фармацевтично прийнятну сіль для застосування у терапії. У іншому аспекті заявленого винаходу, запропоновано комбінацію, що містить: (i) сполуку за формулою (I): F O N I HN CH3 N (I) N O CH3 O H3 C O N H 10 або її фармацевтично прийнятну сіль або сольват; та (ii) сполуку за формулою (II): F F O S O F HN H3 C CH3 CH3 N S N N 15 NH2 або її фармацевтично прийнятну сіль для застосування у лікуванні раку. 5 (II) UA 105064 C2 У іншому аспекті заявленого винаходу, запропоновано фармацевтичну композицію, що містить: (i) сполуку за формулою (I): F O I HN N CH3 N (I) N O CH3 O H3 C O N H 5 Або її фармацевтично прийнятну сіль або сольват ; та (ii) сполуку за формулою (II): F F O S O F HN H3 C CH3 CH3 N S (II) N N 10 NH2 або її фармацевтично прийнятну сіль разом з фармацевтично прийнятним розчинником або носієм. У іншому аспекті, запропоновано застосування комбінації, що містить i) сполуку за формулою (I) F O N I HN N CH3 (I) O O CH3 O H3 C N N H 15 або її фармацевтично прийнятну сіль або сольват; та (ii) сполуку за формулою (II): 6 UA 105064 C2 F F H3 C CH3 CH3 N S O S O F HN N NH2 N 5 : або її фармацевтично прийнятну сіль для виробництва ліків для лікування раку. У іншому аспекті, запропоновано спосіб лікування раку у ссавця, що полягає у введенні вказаному ссавцю: (i) терапевтично ефективної кількості сполуки за формулою (I) F O N I HN CH3 N (I) N O CH3 O H3 C 10 O N H або її фармацевтично прийнятної солі або сольвату: та (ii) сполуки за формулою (II): F F O S O F HN H3 C CH3 CH3 N S (II) N N 15 20 25 30 NH2 або її фармацевтично прийнятної солі. У іншому аспекті, запропоновано спосіб лікування раку у людині, яка цього потребує, що полягає у введенні терапевтично ефективної кількості комбінації N-{3-[3-циклопропіл -5-(2флуоро-4-іодо-феніламіно)6,8-диметил-2,4,7-тріоксо-3,4,6,7-тетрагідро-2H-піридо[4,3d]піримідин-1-іл]феніл}ацетаміду або його фармацевтично прийнятної солі або сольвату та N{3-[5-(2-Аміно-4-піримідиніл)-2-(1,1-диметилетил)-1,3-тіазол-4-іл]-2-флуорофеніл}-2,6дифлуоробензенсульфонаміду або його фармацевтично прийнятної солі. У іншому аспекті, запропоновано спосіб лікування раку у людині, яка цього потребує, що полягає у введенні терапевтично ефективної кількості комбінації N-{3-[3-циклопропіл -5-(2флуоро-4-іодо-феніламіно)6,8-диметил-2,4,7-тріоксо-3,4,6,7-тетрагідро-2H-піридо[4,3d]піримідин-1-іл]феніл}ацетамід диметил сульфоксид сольвату та N-{3-[5-(2-Аміно-4піримідиніл)-2-(1,1-диметилетил)-1,3-тіазол-4-іл]-2-флуорофеніл}-2,6дифлуоробензенсульфонамід метансульфонату. У наступному аспекті заявленого винаходу запропоновано спосіб лікування раку у ссавця, що цього потребує, що полягає у введенні терапевтично ефективної кількості композиції винаходу, де вказану сполуку вводять протягом зазначеного періоду та часу. Стислий опис фігур. Фіг. 1 являє собою графік, де зображено зростання інгібування пухлин завдяки введенню MEK інгібітора сполуки A, B-Raf інгібітора сполуки В та їх комбінації. 7 UA 105064 C2 5 Фіг. 2 являє собою графік, де зображено зростання інгібування пухлин завдяки введенню MEK інгібітора сполуки A, B-Raf інгібітора сполуки В та їх комбінації. Як тут застосовано, MEK інгібітор N-{3-[3-циклопропіл-5-(2-флуоро-4-іодо-феніламіно)6,8диметил-2,4,7-тріоксо-3,4,6,7-тетрагідро-2H-піридо[4,3-d]піримідин-1-іл]феніл}ацетамід або його фармацевтично прийнятна сіль або сольват, представлений сполукою за формулою (I): F O N I HN CH3 N (I) N O CH3 O H3 C 10 15 O N H або його фармацевтично прийнятною сіллю або сольватом. Для зручності, група можливих сполук та солей або сольватів разом позначена тут як сполука A, що означає, що посилання на сполуку А буде мати відношення до будь-якої її сполуки або, альтернативно, її фармацевтично прийнятної солі або сольвату. В залежності від іменування, сполука за формулою (I) може також тут бути відповідно названа N-{3-[3-циклопропіл -5-[(2-флуоро -4-йодофеніл )аміно ]-6,8-диметил-2,4,7-тріоксо 3,4,6,7-тетрагідропіридо[4,3-d]піримідин-1(2H)-іл]феніл}ацетамідом. Як тут застосовано, BRaf інгібітор N-{3-[5-(2-Аміно-4-піримідиніл)-2-(1,1-диметилетил)-1,3тіазол-4-іл]-2-флуорофеніл}-2,6-дифлуоробензенсульфонамід або його фармацевтично прийнятна сіль, представлений сполукою за формулою (II): F F O S O F HN H3 C CH3 CH3 N S (II) N N 20 25 30 35 NH2 або її фармацевтично прийнятною сіллю. Для зручності, група можливої сполуки та солей разом позначена тут як сполука B, що означає, що посилання на сполуку В буде мати відношення до будь-якої цієї сполуки або, альтернативно, до її фармацевтично прийнятної солі. Як тут застосовано, термін "комбінація винаходу" має відношення до сполуки, що містить сполуку А та сполуку B. Як тут застосовано, термін "новоутворення" має відношення до аномального зростання клітин або тканин та, як зрозуміло, охоплює доброякісні, тобто, неонкогенні новоутворення та злоякісні, тобто, онкогенні новоутворення. Термін "пухлинний" означає або має відношення до новоутворення. Як тут застосовано, під терміном "агент" розуміють речовину, що дозволяє отримати бажану дію у тканині, системі, тварині, ссавці, людині або у іншому суб’єкті. Відповідно, під терміном "протипухлинний агент" розуміють речовину, за допомогою якої отримують протипухлинну дію у тканині, системі, тварині, ссавці, людині або у іншому суб’єкті. Також зрозуміло, що "агентом" може бути одинична сполука або комбінація або композиція з двох або декількох сполук. Під терміном "лікування" та застосованими тут його похідними, мається на увазі терапевтичне лікування. У зв’язку з певним станом лікування означає: (1) поліпшення стану або одного або декількох біологічних проявів стану, (2) втручання до (a) одного або до декількох пунктів у біологічному каскаді, що веде до або відповідає стану або (b) одному або декільком 8 UA 105064 C2 5 10 15 20 25 30 35 40 45 50 55 біологічним проявам стану (3) полегшує один або декілька симптомів, дій або побічних проявів, пов’язаних зі станом або з одним або декількома симптомами, діями або бічними проявами, пов’язаними зі станом або з його лікуванням; або (4) уповільнення поширення стану або одного або декількох біологічних проявів стану. Як тут застосовано, під "запобіганням" розуміють профілактичне введення ліків для суттєвого зменшення ймовірності або тяжкості стану або його біологічного прояву або для затримання початку такого стану або його біологічного прояву. Досвідчений фахівець розуміє, що "запобігання" не є абсолютним терміном. Профілактична терапія є необхідною, наприклад, коли суб’єкт, як вважають, має великий ризик розвитку захворювання на рак, як-то, коли він має чітку родину історію захворювань на рак або коли він був під дією канцерогену. Як тут застосовано, термін "ефективна кількість" означає кількість ліків або фармацевтичного агента, що буде викликати біологічну або медичну відповідь тканини, системи, тварини або людини, яка потрібна, наприклад, досліднику або лікарю. Крім того, термін "терапевтично ефективна кількість" означає будь-яку кількість, що, в порівнянні з відповідним суб’єктом, що не отримував її, веде до покращення лікування, зцілення, запобігання або до послаблення захворювання, розладу або побічної дії або веде до зниження швидкості просування захворювання або розладу. Термін також охоплює кількості, ефективні для посилення нормальної фізіологічної функції. Сполуки А та/або B можуть містити один або декілька хіральних атомів або, в іншому випадку, здатні існувати у вигляді енантіомерів. Відповідно, сполуки заявленого винаходу охоплюють суміші енантіомерів у вигляді або очищених енатніомерів або енантіомерно збагачених сумішей. Також, зрозуміло, що сполука А та сполука B охоплюють всі таутомери та суміші таутомерів. Також зрозуміло, що сполуки А та B можуть бути представлені або окремо або разом у вигляді сольватів. Як тут застосовано, термін "сольват" має відношення до комплексу змінної стехіометрії, утвореного розчиненою речовиною ( у цьому винаході, сполукою за формулою (I) або (II) або її сіллю та розчинником. Такі розчинники для цілей винаходу можуть не впливати на біологічну активність розчиненої речовини. Приклади прийнятних розчинників охоплюють, але без обмеження, воду, метанол, диметилсульфорид, етанол та оцтову кислоту. У одному втіленні, застосований розчинник є фармацевтично прийнятним розчинником. Приклади прийнятних фармацевтично прийнятних розчинників охоплюють, але без обмеження, воду, етанол та оцтову кислоту. У іншому втіленні, застосований розчинник є водою. Сполуки А та B можуть мати здатність до кристалізації у більш, ніж одну форму, характерну своїм притаманним поліморфізмом та зрозуміло, що такі поліморфні форми ("поліморфи") охоплюються сполуками А та B. Поліморфізм, звичайно, може відбуватися в якості відповіді на змінення тиску або температури або обох факторів та також може бути результатом змін у процесі кристалізації. Поліморфи можуть відзначатися різними відомими фахівцям фізичними характеристиками, як-то рентгенівською дифракцією, розчинністю та точкою плавлення. Сполука А, разом з її фармацевтично прийнятними солями та сольватами, що може бути корисною в якості інгібітора MEK активності, зокрема, для лікування раку, була винайдена та заявлена у WO 2005/121142. Сполука А є сполукою Прикладів 4-1 та може бути отримана, як описано у WO 2005/121142. Відповідно, сполука А є у вигляді диметилсульфоксидсольвату. Відповідно, сполука А є також у вигляді солі натрію. Відповідно, сполука А є у вигляді сольвату, вибраного від: гідрату, оцтової кислоти, етанолу, нітрометану, хлорбензолу, 1- пентаколу, ізопропілового спирту, етиленгліколю та 3- метил -1- бутанолу. Ці сольватні та сольові форми можуть бути отримані фахівцями за допомогою опису у WO 2005/121142. Сполука В, разом з її фармацевтично прийнятними солями, що може бути корисною в якості інгібітора BRaf активності, зокрема, для лікування раку, була винайдена та заявлена у патентній заявці PCT patent application PCT/US09/42682. Сполука B також описана у Прикладах заявки №№ 58a - 58e. Заявка PCT надрукована 12.11. 2009 у вигляді публікації WO2009/137391 та включена тут у якості посилання. Зокрема, сполука B може бути отримана за допомогою нижченаведених способів: Спосіб 1: сполука B (перша кристалічна форма) - N-{3-[5-(2-Аміно-4-піримідиніл)-2-(1,1диметилетил)-1,3-тіазол-4-іл]-2-флуорофеніл}-2,6-дифуоробензенсульфонамід 9 UA 105064 C2 F F H3 C CH3 CH3 N S O S O F HN N N 5 10 15 20 25 NH2 Суспензію N-{3-[5-(2-хлоро-4-піримідиніл)-2-(1,1-диметилетил)-1,3-тіазол-4-іл]-2-флуоро феніл}-2,6-дифлуоробензенсульфонамід (196 мг, 0.364 ммоль) та аміаку у 7M метанолі (8 мл, 56.0 ммоль) нагрівали у герметичному посуді протягом 24 год. при 90 °C. Реакційну суміш розбавили DCM, додали силікагель та концентрували. Неочищений продукт піддано хроматографії з елююванням у силікагелі з 100% DCM до 1:1 [DCM:(9:1 EtOAc:MeOH)]. Очищені фракції концентрували до виходу технічного продукту. Технічний продукт ще раз очистили за допомогою ВЕРХ (HPLC)-хроматографії зі зворотною фазою (градієнт ацетонітрилу: вода з 0.1%TFA у обох). Комбіновані концентровані чисті фракції були розподілені між DCM та насиченим NaHCO3. Шар DCM відокремили та підсушили над Na2SO4. В результаті отримали Сполуку В, N-{3-[5-(2-аміно-4-піримідиніл)-2-(1,1-диметилетил)-1,3-тіазол-4-іл]-2-флуорофеніл}2,6-дифлуоробензенсульфонамід. (94 мг, 47% виходу). 1H NMR (400 MHz, DMSO-d6) δ ppm 10.83 (s, 1 H), 7.93 (d, J=5.2 Hz, 1 H), 7.55 - 7.70 (m, 1 H), 7.35 - 7.43 (m, 1 H), 7.31 (t, J=6.3 Hz, 1 H), 7.14 - 7.27 (m, 3 H), 6.70 (s, 2 H), 5.79 (d, J=5.13 Hz, 1 H), 1.35 (s, 9 H). MS (ESI): 519.9 [M+H]+. Спосіб 2: сполуку B (альтернативна кристалічна форма) - N-{3-[5-(2-Аміно-4-піримідиніл)-2(1,1-диметилетил)-1,3-тіазол-4-іл]-2-флуорофеніл}-2,6-дифлуоробензенсульфонамід 19.6 мг of N-{3-[5-(2-Аміно-4-піримідиніл)-2-(1,1-диметилетил)-1,3-тіазол-4-іл]-2-флуорофеніл}-2,6дифлуоробензенсульфонамід (може бути отримана у відповідності з прикладом 58a) об’єднали з 500 мкл етилацетату у 2-мл колбі при при кімнатній температурі. Суспензію піддано термоциклюванню при температурах між 0 - 40oC протягом 48 год. Отриманій суспензії дали охолонути до кімнатній температурі та тверді частки зібрали вакуумною фільтрацією. Ці частки аналізували з застосуванням Raman ( спектроскопії комбінаційного розсіювання), PXRD (порошкової рентгенівської дифракції), DSC/TGA (диференційної скануючої калориметрії та термогравіметричного аналізу), що виявило кристалічні форми, що відрізнялися від кристалічних форм з Прикладу 58a, див. вище. Спосіб 3: сполука B (альтернативна кристалічна форма, велика партія) - N-{3-[5-(2-аміно-4піримідиніл)-2-(1,1-диметилетил)-1,3-тіазол-4-іл]-2-флуорофеніл}-2,6дифлуоробензенсульфонамід 30 F O S HN O F F N S N N NH2 Етап A: метил 3-{[(2,6-дифлуорофеніл)сульфоніл]аміно }-2-флуоробензоат F O HN S O F F O O 35 10 UA 105064 C2 5 10 15 20 Mетил 3-аміно -2-флуоробензоат (50 г, 1 екв.) завантажили до реактора, після чого додали дихлорометан (250 мл, 5 обс.). Зміст перемішали та охолодили до ~15°C та додали піридин (26.2 мл, 1.1 екв.). Після додавання піридину, зміст реактора скоригували до ~15°C та почали додавати через воронку 2,6-дифлуороробензену сульфонілхлорид (39.7 мл, 1.0 екв.). Протягом додавання зберігали температуру
ДивитисяДодаткова інформація
Назва патенту англійськоюМмм мс
Автори англійськоюDumble, Melissa, Kumar, Rakesh, Laquerre, Sylvie, Lebowitz, Peter
Автори російськоюДамбл Мелисса, Кумар Ракеш, Лакерр Сильви, Лебовиц Питер
МПК / Мітки
МПК: A01N 43/90, A61K 31/519, A61P 35/00
Мітки: в-raf, інгібітор, містить, комбінація, мек
Код посилання
<a href="https://ua.patents.su/40-105064-kombinaciya-shho-mistit-ingibitor-mek-ta-ingibitor-v-raf.html" target="_blank" rel="follow" title="База патентів України">Комбінація, що містить інгібітор мек та інгібітор в-raf</a>
Попередній патент: Спосіб поетапної зміни подачі палива при експлуатації реактора з камерою згоряння із захопленим вихором
Наступний патент: Ящик
Випадковий патент: Змінний вузол універсальної ділильно-закочувальної машини для бараночних виробів