1,4-заміщені 3-ціанопіридонпохідні та їх застосування як позитивних модуляторів mglur2-рецептора
Номер патенту: 99125
Опубліковано: 25.07.2012
Автори: Сід-Нюнез Хосе Марія, МакДональд Грегор Джеймс, Дюве Ґійом Альбер Як'юес, Лют'єнс Роберт Йоганнес, Трабанко-Суарез Андрес Авеліно
Формула / Реферат
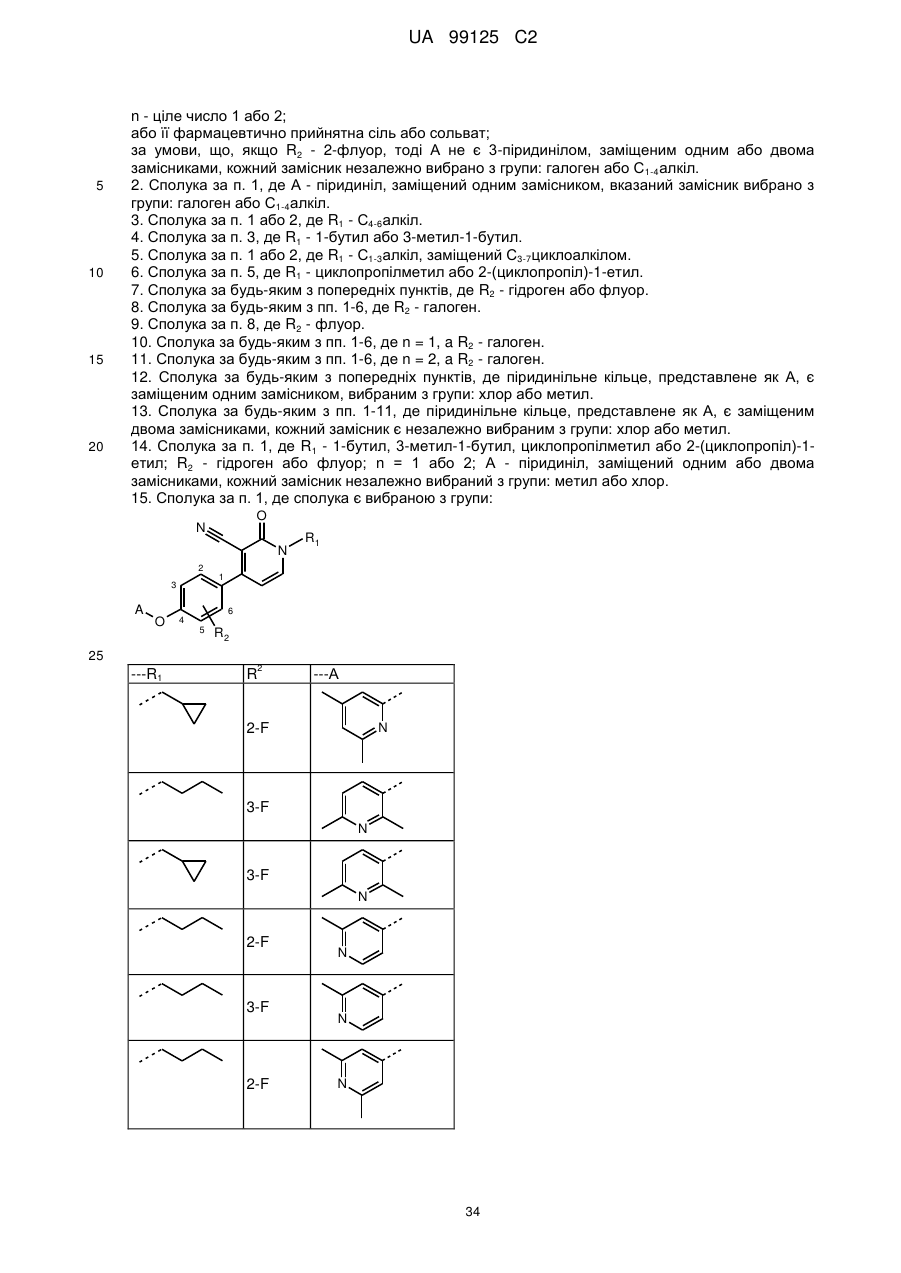
1. Сполука формули
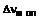 , (I)
, (I)
у тому числі будь-яка її стереохімічно ізомерна форма, де
R1 - С4-6алкіл або С1-3алкіл, заміщений С3-7циклоалкілом;
R2 - гідроген або галоген;
А - піридиніл, заміщений одним або двома замісниками, кожний замісник незалежно вибрано з групи: галоген або С1-4алкіл;
n - ціле число 1 або 2;
або її фармацевтично прийнятна сіль або сольват;
за умови, що, якщо R2 - 2-флуор, тоді А не є 3-піридинілом, заміщеним одним або двома замісниками, кожний замісник незалежно вибрано з групи: галоген або С1-4алкіл.
2. Сполука за п. 1, де А - піридиніл, заміщений одним замісником, вказаний замісник вибрано з групи: галоген або С1-4алкіл.
3. Сполука за п. 1 або 2, де R1 - С4-6алкіл.
4. Сполука за п. 3, де R1 - 1-бутил або 3-метил-1-бутил.
5. Сполука за п. 1 або 2, де R1 - С1-3алкіл, заміщений С3-7циклоалкілом.
6. Сполука за п. 5, де R1 - циклопропілметил або 2-(циклопропіл)-1-етил.
7. Сполука за будь-яким з попередніх пунктів, де R2 - гідроген або флуор.
8. Сполука за будь-яким з пп. 1-6, де R2 - галоген.
9. Сполука за п. 8, де R2 - флуор.
10. Сполука за будь-яким з пп. 1-6, де n = 1, a R2 - галоген.
11. Сполука за будь-яким з пп. 1-6, де n = 2, a R2 - галоген.
12. Сполука за будь-яким з попередніх пунктів, де піридинільне кільце, представлене як А, є заміщеним одним замісником, вибраним з групи: хлор або метил.
13. Сполука за будь-яким з пп. 1-11, де піридинільне кільце, представлене як А, є заміщеним двома замісниками, кожний замісник є незалежно вибраним з групи: хлор або метил.
14. Сполука за п. 1, де R1 - 1-бутил, 3-метил-1-бутил, циклопропілметил або 2-(циклопропіл)-1-етил; R2 - гідроген або флуор; n = 1 або 2; А - піридиніл, заміщений одним або двома замісниками, кожний замісник незалежно вибраний з групи: метил або хлор.
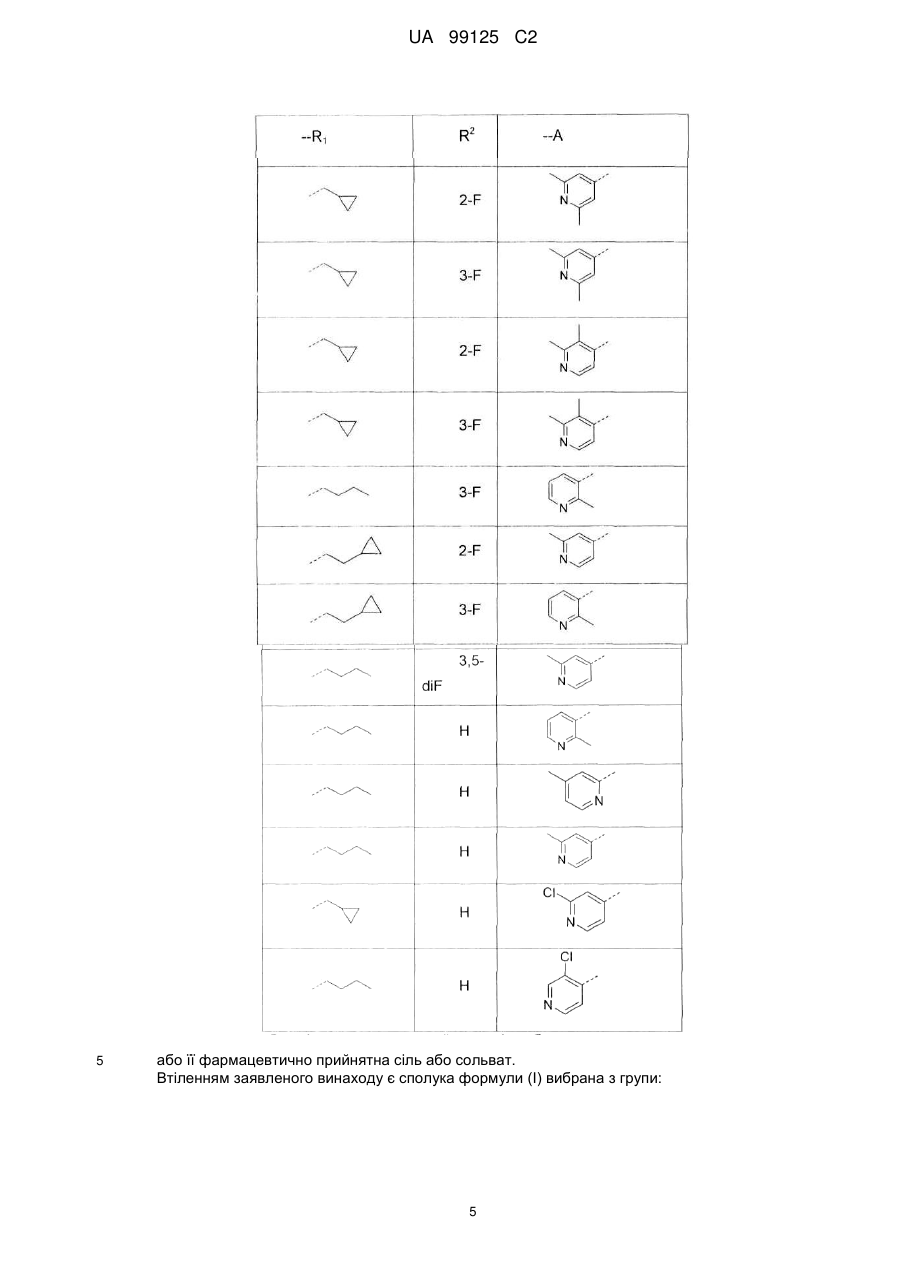
15. Сполука за п. 1, де сполука є вибраною з групи:
---R1
R2
---А
![]()
2-F
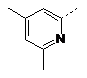
![]()
3-F

![]()
3-F

![]()
2-F
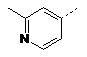
![]()
3-F
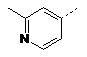
![]()
2-F
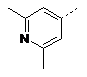
![]()
3-F
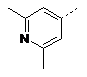
![]()
2-F
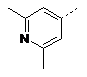
![]()
3-F
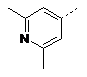
![]()
2-F
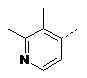
![]()
3-F
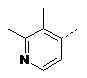
![]()
3-F
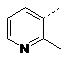
![]()
2-F
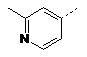
![]()
3-F
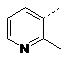
![]()
3,5-диF
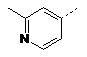
![]()
H
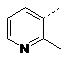
![]()
H
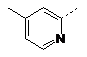
![]()
H
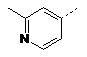
![]()
H
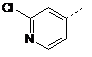
![]()
H
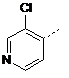
або її фармацевтично прийнятна сіль або сольват.
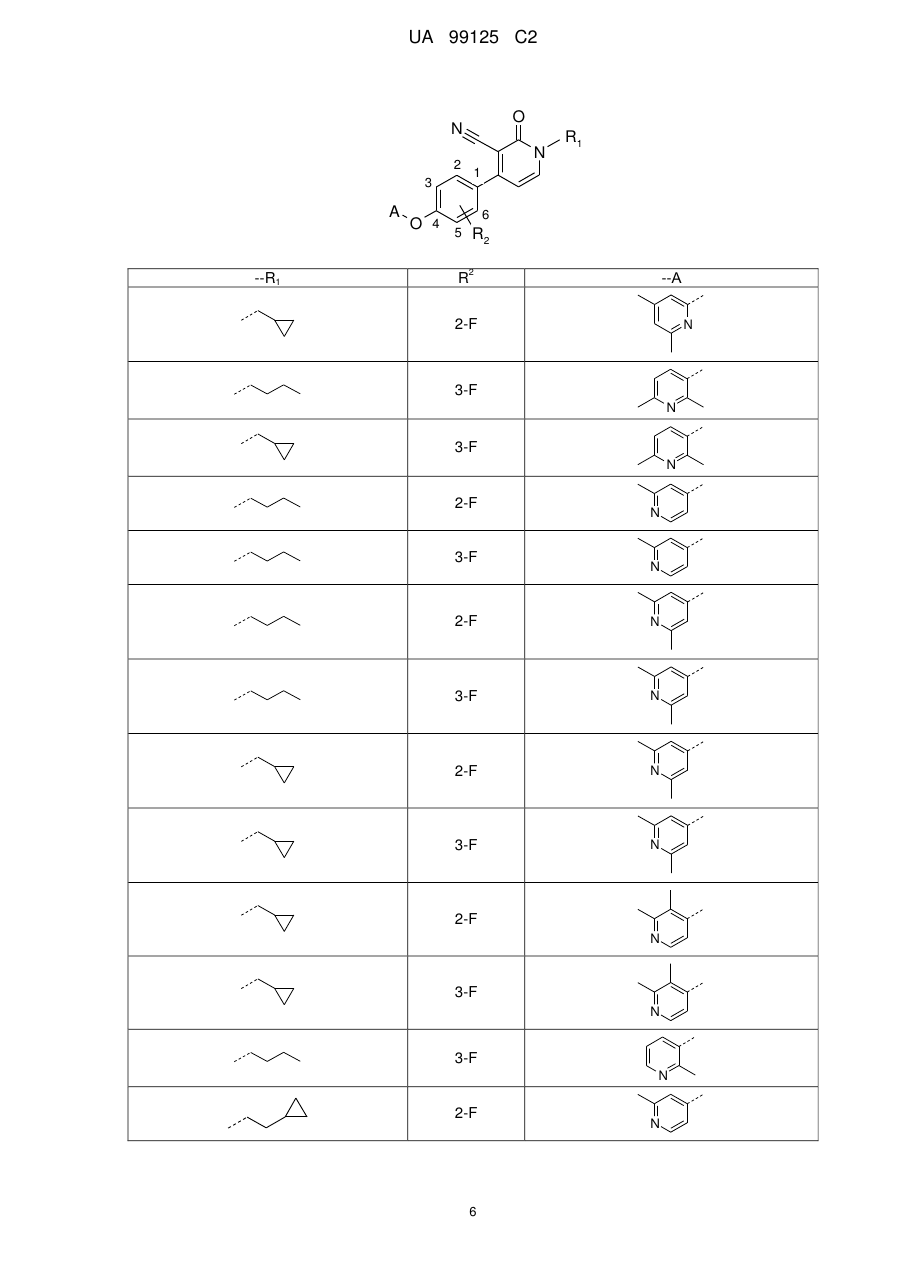
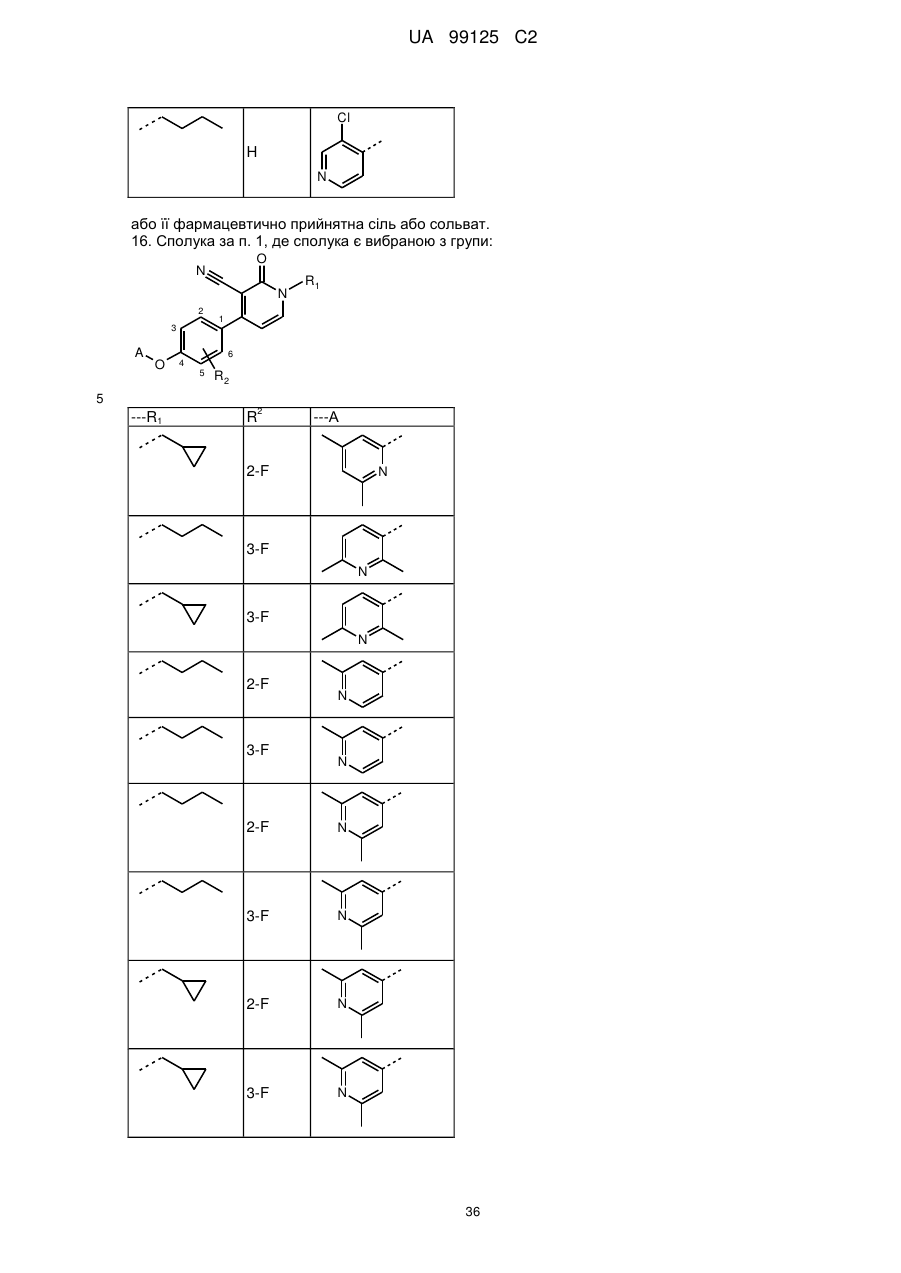
16. Сполука за п. 1, де сполука є вибраною з групи:
---R1
R2
---А
![]()
2-F
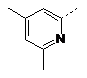
![]()
3-F

![]()
3-F

![]()
2-F
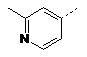
![]()
3-F
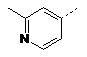
![]()
2-F
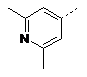
![]()
3-F
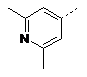
![]()
2-F
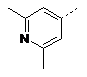
![]()
3-F
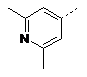
![]()
2-F
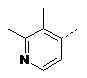
![]()
3-F
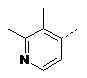
![]()
3-F
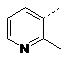
![]()
2-F
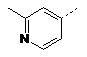
![]()
3-F
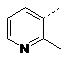
![]()
3,5-диF
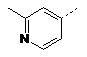
![]()
H
або її фармацевтично прийнятна сіль або сольват.
17. Сполука за будь-яким з пп. 1-16 для застосування як медикаменту.
18. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-16 та фармацевтично прийнятний носій або розріджувач.
19. Застосування сполуки за будь-яким з пп. 1-16 для виробництва медикаменту для лікування або попередження стану у ссавця, у тому числі людини, лікування або попередження котрого здійснюється або полегшується нейромодуляторною дією позитивного алостеричного модулятора mGluR2.
20. Застосування сполуки за будь-яким з пп. 1-16 для виробництва медикаменту для лікування або попередження розладу центральної нервової системи, вибраного з групи: розлад з компонентом тривоги, психотичні розлади, розлади особистості, пов'язані з речовинами розлади, розлади харчування, розлади настрою, мігрень, епілепсія або конвульсивні розлади, дитячі розлади, когнітивні розлади, нейродегенерація, нейротоксичність та ішемія.
21. Застосування за п. 20, де розладом центральної нервової системи є розлад з компонентом тривоги, вибраний з групи: агорафобія, генералізований розлад з компонентом тривоги (GAD), обсесивно-компульсивний розлад (OCD), розлад панічного типу, посттравматичний стресовий розлад (PTSD), соціальна фобія та інші фобії.
22. Застосування за п. 20, де розладом центральної нервової системи є психотичний розлад, вибраний з групи: шизофренія, галюцинаційний розлад, шизоафективний розлад, шизофреноподібний розлад та індукований речовинами психотичний розлад.
23. Застосування за п. 20, де розладом центральної нервової системи є розлад особистості, вибраний з групи: обсесивно-компульсивний розлад особистості та шизоїдний, шизоподібний розлад.
24. Застосування за п. 20, де розладом центральної нервової системи є пов'язаний з речовинами розлад, вибраний з групи: зловживання алкоголем, залежність від алкоголю, алкогольна абстиненція, маячний стан при алкогольній абстиненції, індукований алкоголем психотичний розлад, залежність від амфетамінів, амфетамінова абстиненція, залежність від кокаїну, кокаїнова абстиненція, залежність від нікотину, нікотинова абстиненція, залежність від опіоїдів та опіоїдна абстиненція.
25. Застосування за п. 20, де розладом центральної нервової системи є розлад харчування, вибраний з групи: нервово-психічна анорексія та нейрогенна булімія.
26. Застосування за п. 20, де розладом центральної нервової системи є розлад настрою, вибраний з групи: біполярні розлади (І та II), циклотимічний розлад, депресія, психічна депресія, глибокий депресивний розлад та індукований речовиною розлад настрою.
27. Застосування за п. 20, де розладом центральної нервової системи є мігрень.
28. Застосування за п. 20, де розладом центральної нервової системи є епілепсія або конвульсивний розлад, вибрані з групи: генералізована неконвульсивна епілепсія, генералізована конвульсивна епілепсія, мала епілепсія, велика епілепсія, часткова епілепсія з втратою або без втрати притомності, дитячі спазми, епілепсія часткової продовжуваності та інші форми епілепсії.
29. Застосування за п. 20, де розладом центральної нервової системи є дитячий розлад.
30. Застосування за п. 29, де дитячим розладом є розлад з дефіцитом уваги/гіперактивністю.
31. Застосування за п. 20, де розладом центральної нервової системи є когнітивний розлад, вибраний з групи: маячний стан, індукований речовинами стійкий маячний стан, деменція, деменція внаслідок ВІЛ-хвороби, деменція внаслідок хвороби Хантінгтона, деменція внаслідок хвороби Паркінсона, деменція типу Альцгеймера, індукована речовинами стійка деменція та помірне когнітивне порушення.
32. Застосування за п. 20, де розладом центральної нервової системи є вибраний з групи: неспокій, шизофренія, мігрень, депресія та епілепсія.
33. Застосування сполуки за будь-яким з пп. 1-16 у комбінації з ортостеричним агоністом mGluR2 для виробництва медикаменту для лікування або попередження стану за будь-яким з пп. 19-32 у ссавця, у тому числі людини.
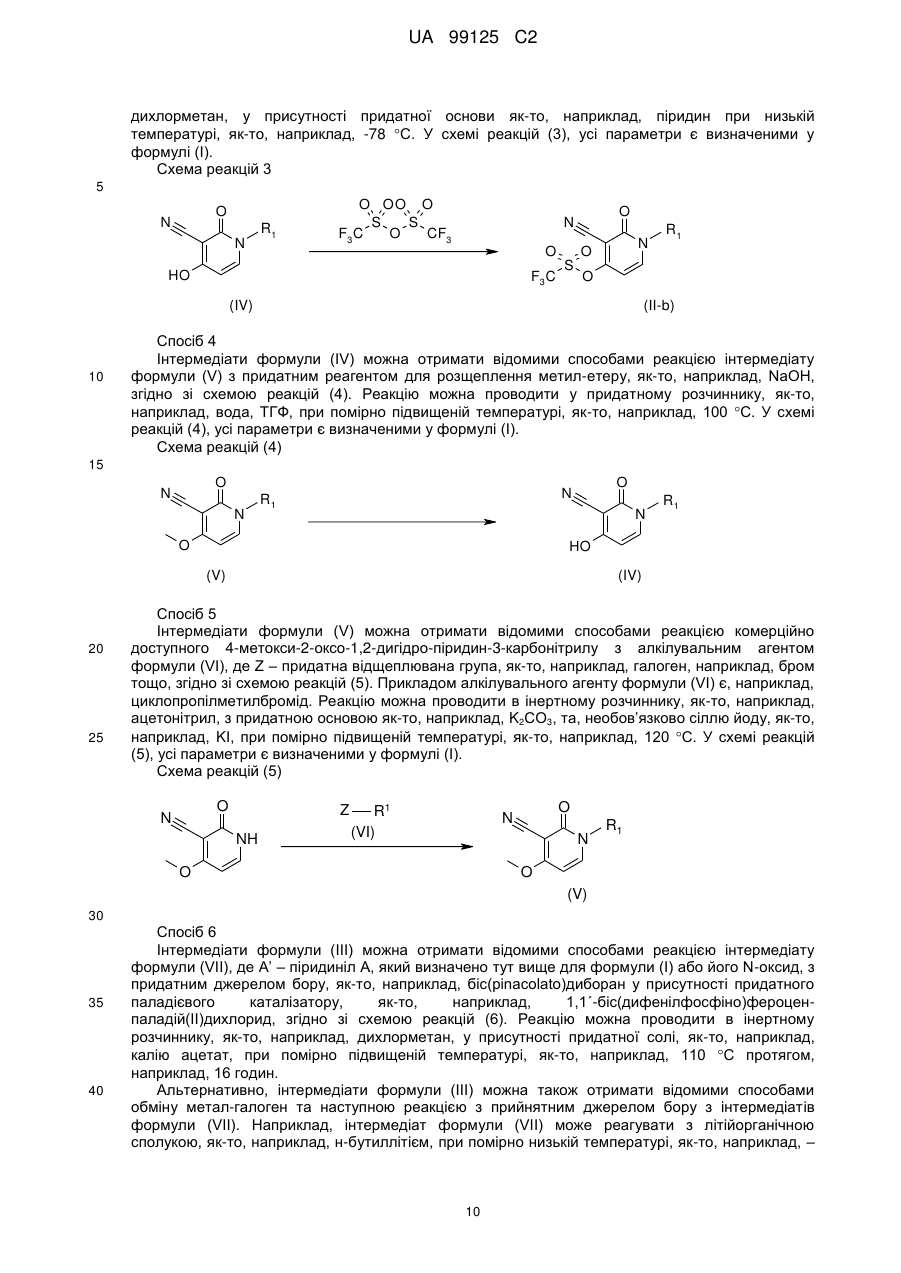
34. Спосіб отримання сполуки за п. 1, який відрізняється тим, що здійснюють реакцію інтермедіату формули (II), де Y - група, придатна для опосередкованого Pd сполучення з бороновими кислотами або бороновими естерами, з інтермедіатом формули (III), де R3 та R4 - гідроген або С1-4алкіл, або де R3 та R4 можуть разом утворювати двовалентний радикал формули -СН2СН2-, -СН2СН2СН2- або -С(СН3)2С(СН3)2-, у придатному реакційно інертному розчиннику, у присутності придатної основи та придатного каталізатора при нагріванні
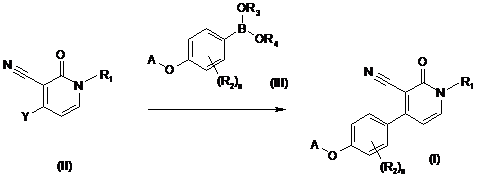 ,
,
де R1, R2, А та n визначено у п. 1;
або, якщо бажано, подальше перетворення сполуки формули (І) однієї в одну відомими з рівня техніки перетвореннями; або, крім того, якщо бажано, перетворення сполуки формули (І), у терапевтично активну нетоксичну кислотно-адитивну сіль обробкою кислотою, або навпаки, перетворення кислотно-адитивної солі у вільну основу обробкою лугом; або, якщо бажано, отримання її стереохімічно ізомерних форм.
Текст
Реферат: ТА ЇХ ЗАСТОСУВАННЯ ЯК ПОЗИТИВНИХ UA 99125 C2 ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ UA 99125 C2 Заявлений винахід стосується сполук, зокрема похідних O N N A O (R2)n R1 , у тому числі будь-яких їх стереохімічно ізомерних форм або їх фармацевтично прийнятних солей або сольватів, де усі радикали є визначеними у заявці та формулі винаходу. Сполуки згідно з винаходом є позитивними алостеричними модуляторами метаботропних рецепторів глутамату підтипу 2 ("mGluR2"), котрі є корисними для лікування або попередження неврологічних та психіатричних розладів, асоційованих з глутаматною дисфункцією, та хвороб, у котрих підтип mGluR2 метаботропних рецепторів є задіяним. Зокрема, такі хвороби є розладами центральної нервової системи, вибраними з групи: неспокій, шизофренія, мігрень, депресія та епілепсія. Винахід також стосується фармацевтичних композицій та способів отримання таких сполук та таких композицій, а також застосування таких сполук для попередження та лікування таких хвороб, у котрих mGluR2 є задіяним. UA 99125 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується нових похідних піридин-2-ону, котрі є позитивними алостеричними модуляторами метаботропного рецептору глутамату підтип 2 (“mGluR2”) та котрі є корисними для лікування або попередження неврологічних та психіатричних розладів, асоційованих з глутаматною дисфункцією, та хворобами, у котрих є задіяним підтип mGluR2 метаботропних рецепторів. Винахід також стосується фармацевтичних композицій, що містять такі сполуки, способів отримання таких сполук та таких композицій, та застосування таких сполук для попередження або лікування неврологічних та психіатричних розладів та хвороби, у котрих mGluR2 є задіяним. Глутамат є головним амінокислотним нейротрансмітером у центральній нервовій системі ссавців. Глутамат грає головну роль у ряді фізіологічних функцій, як-то навчання та пам’ять, але також почуттєве сприйняття, розвиток синаптичої пластичності, моторний контроль, дихання, та регулювання серцево-судинної функції. Більш того, глутамат є у центрі кількох відмінних неврологічних та психіатричних хвороб, де є дисбаланс у глутаматергічній нейротрансмісії. Глутамат опосередковує синаптичну нейротрансмісію активацією каналів іонотропних рецепторів глутамату (іGluRs), та NМDА, АМРА та каїнатних рецепторів, котрі є відповідними за швидку передачу збудження. На додаток, глутамат активує метаботропні рецептори глутамату (mGluR), котрі мають більшу модуляторну роль, що сприяє точному регулюванню синаптичної ефективності. Глутамат активує mGluR зв’язуванням з великим зовнішньоклітинним амінокінцевим доменом рецептору, названим тут ортостеричним зв’язувальним сайтом. Це зв’язування індукує конформаційну зміну рецептору, що призводить до активації G-білку та шляхів внутрішньоклітинної передачі сигналів. Підтип mGluR2 є негативно сполученим з аденілат-циклазою через активацію Gγі-білку, та його активація призводить до інгібування вивільнення глутамату у синапсі. У центральній нервовій системі (ЦНС), рецептори mGluR2 є головним чином поширеними у корі головного мозку, таламічних регіонах, додатковій зачиняльній луковиці, гіпокампі, мигдалевидній залозі та хвостатій шкаралупі. Активування mGluR2 було показано у клінічних дослідженнях як ефективне для лікування розладів з компонентом тривоги. На додаток, активування mGluR2 у різних тваринних моделях було показано як ефективне, а тому представляє потенційно новий терапевтичний підхід для лікування шизофренії, епілепсії, наркоманії/залежності від ліків, хвороби Паркінсона, болю, розладів сну та хвороби Хантингтона. Зараз більшість наявних фармакологічних засобів, що націлюють mGluR, є ортостеричними лігандами, котрі активують кілька членів родини, оскільки вони є структурними аналогами глутамату. Новим шляхом розробки селективних сполук, що діють на mGluR, є ідентифікування сполук, що діють за алостеричними механізмами, модулюючи рецептор зв’язуванням з сайтом відмінним від високозбереженого ортостеричного зв’язувального сайту. Позитивні алостеричні модулятори mGluR з’явилися нещодавно як нові фармакологічні об’єкти, що дають цю привабливу альтернативу. Різні сполуки описані як позитивні алостеричні модулятори mGluR2. WО2004/092135 (NРS & Аstrа Zеnеса), WО2004/018386, WО2006/014918 та WО2006/015158 (Меrсk), WО2001/56990 (Еlі Lіllу) та WО2006/030032 (Аddех & Jаnssеn Рhаrmасеutіса) описують відповідно похідні феніл-сульфонаміду, ацетофенону, інданону, піридилметилу сульфонаміду та піридинону як позитивні алостеричні модулятори mGluR2. Жодна з конкретних розкритих сполук не є структурно спорідненою зі сполуками винаходу. WО2007/104783 описує похідні 1,4-дизаміщеного 3-ціано-піридону, що є позитивними алостеричними модуляторами метаботропних рецепторів підтипу 2 (“mGluR2”). Продемонстровано, що такі сполуки не активують рецептор самі. Точніше, вони розблоковують рецептор для створення максимальної реакції на концентрацію глутамату, котрий сам індукує мінімальну реакцію. Мутаційний аналіз продемонстрував недвозначно, що зв’язування позитивних алостеричних модуляторів mGluR2 не відбувається на ортостеричному сайті, але замість на алостеричному сайті, розташованому у семі-трансмембранному регіоні рецептору. Дані від тварин підказують, що позитивні алостеричні модулятори mGluR2 мають дію у моделях неспокою та психозу, подібну отриманій з ортостеричними агоністами. Алостеричні модулятори mGluR2 були показаними як активні у потенцированому страхом переляку, та в індукованих стресом моделях гіпертермії неспокою. Більш того, такі сполуки були показаними як активні у скасуванні індукованої кетаміном або амфетаміном гіперлокомоції, та у скасуванні індукованого амфетаміном порушення інгібування виникнення імпульсу у моделі шизофренії від 1 UA 99125 C2 5 10 15 20 дії акустичного переляку (J. Рhаrmасоl. Ехр. Тhеr. 2006, 318, 173-185; Рsусhорhаrmасоlоgу 2005, 179, 271-283). Нещодавні дослідження тварин крім того виявили, що селективний позитивний алостеричний модулятор метаботропного рецептору глутамату підтипу 2 біфеніл-інданон (ВІNА) блокує модель психозу від галюциногенних ліків, підтримуючи стратегію націлювання рецепторів mGluR2 для лікування глутаматергічної дисфункції у шизофренії (Моl. Рhаrmасоl. 2007, 72, 477-484). Позитивні алостеричні модулятори полегшують потенціювання реакції глутамату, але вони, як також показано, потенціюють реакцію на ортостеричні агоністи mGluR2 як-то LY379268 або DСG-ІV. Ці дані дають свідчення про ще один новий терапевтичний підхід для лікування вищезгаданих неврологічних та психіатричних хвороб із задіяним mGluR2 із застосуванням комбінації позитивного алостеричного модулятору mGluR2 разом з ортостеричним агоністом mGluR2. Представлені сполуки характеризуються центральною групою піридин-2-ону, заміщеного у позиції 3 ціано, а у позиції 4 необов’язково заміщеним фенілом, котрий є у свою чергу заміщеним у позиції 4 заміщеним піридинілоксилом. Представлені сполуки є потужними позитивними алостеричними модуляторами mGluR2 та виявляють поліпшений профіль серцево-судинної безпечності. Винахід стосується сполук, що мають модуляторну активність стосовно метаботропного рецептору глутамату 2. Заявлений винахід стосується сполуки формули (І), O N R1 N 2 3 A 25 30 35 O 4 (R2)n У тому числі будь-якої її стереохімічно ізомерної форми, де R1 – С4-6алкіл, або С1-3алкіл, заміщений С3-7циклоалкілом; R2 – гідроген або галоген; А – піридиніл, заміщений одним або двома замісниками, кожний замісник незалежно вибрано з групи: галоген або С1-4алкіл; n – ціле число 1 або 2; або її фармацевтично прийнятної солі або сольвату; за умови, що якщо R2 – 2-флуор, тоді А не є 3-піридинілом, заміщеним одним або двома замісниками, кожний замісник незалежно вибрано з групи: галоген або С1-4алкіл. Заявлений винахід також стосується застосування сполуки формули (І) або будь-якої її підгрупи для виробництва медикаменту для лікування або попередження, зокрема для лікування, стану у ссавця, у тому числі людини, лікування або попередження котрого здійснюється або полегшується нейромодуляторною дією алостеричного модулятору mGluR2, зокрема позитивного алостеричного модулятору. Втіленням заявленого винаходу є такі сполуки формули (І) O N R1 N 2 A 45 (І), 6 5 3 40 1 O 4 1 (І), 6 5 (R2)n у тому числі будь-якої її стереохімічно ізомерної форми, де R1 – С4-6алкіл, або С1-3алкіл, заміщений С3-7циклоалкілом; R2 – гідроген або галоген; А – піридиніл, заміщений одним або двома замісниками, кожний замісник незалежно вибрано з групи: галоген або С1-4алкіл; n – ціле число 1 або 2; або її фармацевтично прийнятної солі або сольвату; за умови, що якщо R2 – 2-флуор, тоді А не є 3-піридинілом, заміщеним одним або двома замісниками, кожний замісник незалежно вибрано з групи: галоген або С 1-4алкіл; та за умови, що сполукою не є така 2 UA 99125 C2 O N 2 3 A --R1 O R1 1 6 4 R N 5 R2 2 --А Н N Н N Cl Н N Cl Н N 5 10 15 20 25 30 35 Втіленням заявленого винаходу є такі сполуки формули (І), де R 1 – С4-6алкіл, зокрема С4як-то, наприклад, 1-бутил, 2-метил-1-пропіл, 3-метил-1-бутил; зокрема 1-бутил або 3метил-1-бутил; більш конкретно 1-бутил. Втіленням заявленого винаходу є такі сполуки формули (І), де R 1 – С1-3алкіл, заміщений С3циклоалкілом, зокрема циклопропілметил або 2-(циклопропіл)-1-етил, більш конкретно 7 циклопропілметил. Втіленням заявленого винаходу є такі сполуки формули (І) або будь-яка їх підгрупа, яку вищезгадано у втіленні, де R2 – гідроген або флуор, зокрема флуор. Втіленням заявленого винаходу є такі сполуки формули (І) або будь-яка їх підгрупа, яку вищезгадано у втіленні, де R2 – галоген, зокрема флуор. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де n = 1 та R2 – гідроген. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де n = 1 та R 2 – галоген, зокрема флуор. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де n = 2 та R 2 – галоген, зокрема флуор. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де n = 1 та R2 – галоген, зокрема флуор, що розташований в орто-позиції відносно піридинонової групи, тобто у позиції 2. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де n = 1 та R2 – галоген, зокрема флуор, що розташований у мета-позиції відносно піридинонової групи, тобто у позиції 3. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де n = 2 та R2 – галоген, зокрема флуор, та R2замісники є розташованими у мета позиції відносно піридинонової групи, тобто у позиціях 3 та 5. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де n = 2 та R 2 – галоген, зокрема флуор, та R2замісники є розташованими в орто-позиції відносно піридинонової групи, тобто у позиціях 2 та 6. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де А – заміщений 2-піридиніл. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де А – заміщений 3-піридиніл. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де А – заміщений 4-піридиніл. 5алкіл, 3 UA 99125 C2 5 10 15 Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де піридинільне кільце, представлене як А, є заміщеним одним замісником, вибраним з групи: галоген, зокрема флуор, або С 1-4алкіл, зокрема метил. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де піридинільне кільце, представлене як А, є заміщеним двома замісниками, кожний замісник незалежно вибраний з групи: галоген, зокрема хлор, або С1-4алкіл, зокрема метил. Втіленням заявленого винаходу є такі сполуки формули (І), де R 1 – С4-6алкіл, зокрема 1бутил або 3-метил-1-бутил; або С1-3алкіл, заміщений С3-7циклоалкілом, зокрема циклопропілметил або 2-(циклопропіл)-1-етил; R2 – гідроген або флуор; n = 1 або 2; А – піридиніл, заміщений одним або двома замісниками, кожний замісник незалежно вибраний з групи: метил або хлор. Втіленням заявленого винаходу є сполука формули (І) вибрана з групи: O N 2 3 A O 4 N 1 6 5 R2 20 4 R1 UA 99125 C2 5 або її фармацевтично прийнятна сіль або сольват. Втіленням заявленого винаходу є сполука формули (І) вибрана з групи: 5 UA 99125 C2 O N 2 3 A --R1 O 4 N R1 1 6 5 R R2 2 --А 2-F N 3-F N 3-F N 2-F 3-F N N 2-F N 3-F N 2-F N 3-F N 2-F N 3-F N 3-F N 2-F 6 N UA 99125 C2 --R1 R 2 --А 3-F N 3,5-dіF N Н N 5 10 15 20 25 30 35 40 45 50 або її фармацевтично прийнятна сіль або сольват. Позначення С1-3алкілу як групи або частини групи визначає насичений, нерозгалужений або розгалужений вуглеводневий радикал, що має від 1 до 3 атомів карбону, як-то метил, етил, 1пропіл та 1-метил-1-етил. Переважно С1-3алкіл – метил. Позначення С1-4алкілу як групи або частини групи визначає насичений, нерозгалужений або розгалужений вуглеводневий радикал, що має від 1 до 4 атомів карбону як-то метил, етил, пропіл, 1-метил-1-етил, 1-бутил, 2-метил-1-пропіл. Переважно, С1-4алкіл – метил. Позначення С4-6алкілу як групи або частини групи визначає насичений, нерозгалужений або розгалужений вуглеводневий радикал, що має від 4 до 6 атомів карбону як-то 1-бутил, 2-метил1-пропіл, 1-пентил, 2-метил-1-бутил, 3-метил-1-бутил, 1-гексил тощо. Переважно С4-6алкіл – 1бутил. Позначення С4-5алкілу як групи або частини групи визначає насичений, нерозгалужений або розгалужений вуглеводневий радикал, що має 4 або 5 атомів карбону як-то 1-бутил, 2-метил-1пропіл, 1-пентил, 2-метил-1-бутил, 3-метил-1-бутил тощо. Позначення С3-7циклоалкіл визначає насичений, циклічний вуглеводневий радикал, що має від 3 до 7 атомів карбону, як-то циклопропіл, циклобутил, циклопентил, циклогексил та циклогептил. Переважно С3-7циклоалкіл – циклопропіл. Позначення галоген означає флуор, хлор, бром та йод. Для терапевтичного застосування, солі сполук формули (І) є тими, де протиіон є фармацевтично прийнятним. Однак, солі кислот та основ, котрі є фармацевтично неприйнятними, можуть також знайти застосування, наприклад, в отриманні або очистці фармацевтично прийнятної сполуки. Усі солі, фармацевтично прийнятні або ні, є у межах заявленого винаходу. Фармацевтично прийнятні солі охоплюють терапевтично активні нетоксичні форми кислотно-адитивних солей, що сполуки формули (І) здатні утворювати. Вказані солі можна отримати обробкою основної форми сполуки формули (І) прийнятними кислотами, наприклад, неорганічними кислотами, як-то галогенідна кислота, зокрема хлоридна кислота, бромідна кислота, сульфатна кислота, нітратна кислота та фосфатна кислота; органічними кислотами, якто оцтова кислота, гідроксіоцтова кислота, пропанова кислота, молочна кислота, піровиноградна кислота, щавлева кислота, малонова кислота, бурштинова кислота, малеїнова кислота, фумарова кислота, яблучна кислота, винна кислота, лимонна кислота, метансульфонова кислота, етансульфонова кислота, бензенсульфонова кислота, птолуєнсульфонова кислота, цикламова кислота, саліцилова кислота, п-аміносаліцилова кислота та памова кислота. Навпаки, вказані форми солей кислот можна перетворити у форму вільної основи обробкою прийнятною основою. Сполуки формули (І), що містять кислотні протони, можна також перетворити у їх терапевтично активні нетоксичні форми солей основ обробкою прийнятними органічними та неорганічними основами. Прийнятні форми солей основ містять, наприклад, солі амонію, солі лужних та лужноземельних металів, зокрема, солі літію, натрію, калію, магнію та кальцію, солі з органічними основами, наприклад, бензатином, N-метил-D-глюкамін, гібрамін солі, та солі з амінокислотами, наприклад, аргініом та лізином. Навпаки, вказані форми солей основ можна перетворити у форми вільних кислот обробкою прийнятною кислотою. Фармацевтично прийнятні форми кислотно-адитивних солей сполук формули (І) є кращими фармацевтично прийнятними формами солей сполук формули (І). Термін сольват охоплює форми з доданим розчинником, а також їх фармацевтично прийнятні солі, котрі сполуки формули (І) здатні утворювати. Прикладами таких форм з доданим розчинником є, наприклад, гідрати, алкоголяти тощо. 7 UA 99125 C2 5 10 15 20 25 30 35 40 45 50 55 60 Треба розуміти, що деякі сполук формули (І) та їх солі та сольвати можуть містити один або більше центрів хіральності та існувати як стереохімічно ізомерні форми. Термін ”стереохімічно ізомерні форми”, як застосовувано далі, визначає усі можливі ізомерні форми, що можуть мати сполуки формули (І). Якщо не вказане інше, хімічна назва сполуки позначає суміш усіх можливих стереохімічно ізомерних форм, вказані суміші містять усі діастереомери та енантіомери базової молекулярної структури. Але винахід також стосується кожної з індивідуальних ізомерних форм формули (І) та їх солей або сольватів, по суті вільних, тобто асоційованих з менше, ніж 10%, переважно менше, ніж 5%, зокрема менше, ніж 2% та найкраще менше, ніж 1% інших ізомерів. Тому, коли сполуку формули (І), наприклад, позначено як (R), це означає, що сполука є по суті вільною від (S) ізомеру. Зокрема, стереогенні центри можуть мати R- або S-конфігурацію; замісники на двовалентних циклічних (частково) насичених радикалах можуть мати цис- або трансконфігурацію. За номенклатурною домовленістю САS, коли два стереогенні центри відомої абсолютної конфігурації є представленими у сполуці, R або S ідентифікатор встановлюють (на основі правил Кана-Інгольда-Прелога) відносно найнижче нумерованого хірального центру, опорного центру. Конфігурацію другого стереогенного центру позначають, застосовуючи відповідні ідентифікатори [R*,R*] або [R*,S*], де R* завжди позначено як опорний центр, а [R*,R*] показує центри з однаковою хіральністю та [R*,S*] показує центри небажаної хіральності. Наприклад, якщо найнижче нумерований хіральний центр у сполуці має S конфігурацію, а другий центр є R, стереоідентифікатор слід позначати як S-[R*,S*]. Якщо застосовують “α” та “β”: позиція заміснику найвищої першочерговості на асиметричному атомі карбону у кільцевій системі, що має найнижчий номер у кільці, є довільно завжди в “α” позиції середньої площини, визначеної кільцевою системою. Позиція заміснику найвищої першочерговості на іншому асиметричному атомі карбону у кільцевій системі (атом гідрогену у сполуках формули (І)) відносно позиції заміснику найвищої першочерговості на опорному атомі є позначеним “α”, якщо він є на тій же ділянці середньої площини, визначеної кільцевою системою, або “β”, якщо він є на іншій ділянці середньої площини, визначеної кільцевою системою. Кожного разу, при застосовуванні далі, термін "сполуки формули (І)" або будь-яка їх підгрупа, також охоплює їх стереохімічно ізомерні форми, їх фармацевтично прийнятні солі та їх сольвати. Особливе значення мають сполуки формули (І), котрі є стереохімічно чистими. У рамках цієї заявки елемент, зокрема при згадувані відносно сполук формули (І), охоплює усі ізотопи та суміші ізотопів цього елементу, природно існуючого або синтетично створеного, з природним надлишком або в ізотопно збагаченій формі. Зокрема, коли гідроген є згаданим, він 1 2 3 11 12 13 14 стосується Н, Н, Н або їх суміші; коли карбон є згаданим, він стосується С, С, С, С або 13 14 15 їх суміші; коли нітроген є згаданим, він стосується N, N, N або їх суміші; коли оксиген є 14 15 16 17 18 згаданим, він стосується О, О, О, О, О або їх суміші; та коли флуор є згаданим, він 18 19 стосується F, F або їх суміші. Сполуки згідно з винаходом тому також охоплюють сполуки з одним або більше ізотопами одного або більше елементів, та їх суміші, охоплюючи радіоактивні сполуки, також названі радіоміченими сполуками, де один або більше нерадіоактивних атомів заміщено одним з його радіоактивних ізотопів. Зокрема, радіоактивний атом є вибраним з групи: гідроген, карбон, нітроген, сульфур, оксиген та галоген. Переважно, радіоактивний атом є вибраним з групи: гідроген, карбон та галоген. Зокрема, радіоактивний ізотоп є вибраним з 3 11 18 122 123 125 131 75 76 77 82 групи: Н, С, F, І, І, І, І, Вr, Вr, Вr та Вr. Переважно, радіоактивний ізотоп є 3 11 18 вибраним з групи: Н, С та F. Кожного разу, при застосовуванні раніше або далі, ці замісники можуть бути вибраними, кожний незалежно, з вищенаведеного переліку, призначеними є усі можливі комбінації, котрі є хімічно можливими. Лінії від замісників у кільцевих системах показують, що зв’язок може бути приєднаним до будь-якого з придатних кільцевих атомів. Загалом, сполуки формули (І) можна отримати нижченаведеними способами 1. Спосіб 1 Сполуки формули (І) можна отримати реакцією інтермедіату формули (ІІ), де Y – група, придатна для опосередкованого Рd сполучення з бороновими кислотами або бороновими естерами, як-то, наприклад, галоген або трифлат, з інтермедіатом формули (ІІІ), де R 3 та R4 – гідроген або С1-4алкіл, або, де R3 та R4 можуть разом утворювати, наприклад, двовалентний радикал формули –СН2СН2-, -СН2СН2СН2-, або -С(СН3)2С(СН3)2-, згідно зі схемою реакцій (1). Реакцію можна проводити у придатному реакційно-інертному розчиннику, як-то, наприклад, 1,4діоксан або суміші інертних розчинників як-то, наприклад, 1,4-діоксан/ДМФ, у присутності придатної основи, як-то, наприклад, водного NаНСО3 або Nа2СО3, придатного каталізатору, як 8 UA 99125 C2 то, наприклад, Рd-комплексного каталізатору як-то, наприклад, Рd(РРh3)4, при нагріванні реакційної суміші при 150 С мікрохвильовим опроміненням, протягом, наприклад, 10 хвилин. У схемі реакцій (1), усі параметри є визначеними у формулі (І) або визначеними тут вище. Схема реакцій (1) 5 OR3 B OR4 A O N N R1 O (R2)n (III) O N N R1 Y A (II) 10 15 20 25 30 35 40 O (R2)n (I) Сполуки формули (І) та деякі з інтермедіатів у заявленому винаході можуть містити асиметричний атом карбону. Чисті стереохімічно ізомерні форми вказаних сполук та вказаних інтермедіатів можна отримати відомими способами. Наприклад, діастереоізомери можна відокремлювати фізичними способами, як-то селективна кристалізація або хроматографія, наприклад, зустрічно-струменеве розподілення, хіральна рідинна хроматографія тощо. Енантіомери можна отримати з рацемічної суміші спершу перетворенням вказаної рацемічної суміші придатним відокремлювальним агентом як-то, наприклад, хіральною кислотою, у суміш діастереомерних солей або сполук; тоді фізичним відокремленням вказаної суміші діастереомерних солей або сполук, наприклад, селективною кристалізацією або хроматографією, наприклад, рідинною хроматографією тощо; та зрештою перетворенням вказаних відокремлених діастереомерних солей або сполук у відповідні енантіомери. Чисті стереохімічно ізомерні форми можна також отримати з чистих стереохімічно ізомерних форм прийнятних інтермедіатів та вихідних матеріалів, за умови, що проміжні реакції відбуваються стереоспецифічно. Альтернативний спосіб відокремлення енантіомерних форм сполук формули (І) та інтермедіатів охоплює рідинну хроматографію або СКР (Суперкритичну рідинну) хроматографію, зокрема з хіральною стаціонарною фазою. Деякі з інтермедіатів та вихідних матеріалів є відомими сполуками та можуть бути комерційно доступними або їх можна отримати відомими способами. Інтермедіати можна також отримати нижченаведеними способами 2 – 10. Спосіб 2 Інтермедіати формули (ІІ), де Y – галоген, де вказані інтермедіати представлені формулою (ІІ-а), можна отримати реакцією інтермедіату формули (ІV) з придатним галогенувальним агентом як-то, наприклад, Р(=О)Вr3 згідно зі схемою реакцій (2). Реакцію можна проводити у придатному реакційно-інертному розчиннику як-то, наприклад, ДМФ, при помірно підвищеній температурі, як-то, наприклад, 110 С. У схемі реакцій (2), усі параметри є визначеними у формулі (І). Схема реакцій (2) Спосіб 3 Інтермедіати формули (ІІ), де Y – F3С-S(=О)2-О-, де вказані інтермедіати представлені формулою (ІІ-b), можна отримати реакцією інтермедіату формули (ІV) з трифлатним ангідридом (також названий трифлуорметансульфоновий ангідрид) згідно зі схемою реакцій (3). Реакцію можна проводити у придатному реакційно-інертному розчиннику як-то, наприклад, 9 UA 99125 C2 дихлорметан, у присутності придатної основи як-то, наприклад, піридин при низькій температурі, як-то, наприклад, -78 С. У схемі реакцій (3), усі параметри є визначеними у формулі (І). Схема реакцій 3 5 O N N R1 O OO O S S CF3 F3 C O O N O HO F3 C N O S O (IV) 10 R1 (II-b) Спосіб 4 Інтермедіати формули (ІV) можна отримати відомими способами реакцією інтермедіату формули (V) з придатним реагентом для розщеплення метил-етеру, як-то, наприклад, NаОН, згідно зі схемою реакцій (4). Реакцію можна проводити у придатному розчиннику, як-то, наприклад, вода, ТГФ, при помірно підвищеній температурі, як-то, наприклад, 100 С. У схемі реакцій (4), усі параметри є визначеними у формулі (І). Схема реакцій (4) 15 O N N O N R1 N O HO (V) 20 25 R1 (IV) Спосіб 5 Інтермедіати формули (V) можна отримати відомими способами реакцією комерційно доступного 4-метокси-2-оксо-1,2-дигідро-піридин-3-карбонітрилу з алкілувальним агентом формули (VІ), де Z – придатна відщеплювана група, як-то, наприклад, галоген, наприклад, бром тощо, згідно зі схемою реакцій (5). Прикладом алкілувального агенту формули (VІ) є, наприклад, циклопропілметилбромід. Реакцію можна проводити в інертному розчиннику, як-то, наприклад, ацетонітрил, з придатною основою як-то, наприклад, K2СО3, та, необов’язково сіллю йоду, як-то, наприклад, KІ, при помірно підвищеній температурі, як-то, наприклад, 120 С. У схемі реакцій (5), усі параметри є визначеними у формулі (І). Схема реакцій (5) O N Z NH R1 (VI) O N N O R1 O (V) 30 35 40 Спосіб 6 Інтермедіати формули (ІІІ) можна отримати відомими способами реакцією інтермедіату формули (VІІ), де А’ – піридиніл А, який визначено тут вище для формули (І) або його N-оксид, з придатним джерелом бору, як-то, наприклад, біс(ріnасоlаtо)диборан у присутності придатного паладієвого каталізатору, як-то, наприклад, 1,1´-біс(дифенілфосфіно)фероценпаладій(ІІ)дихлорид, згідно зі схемою реакцій (6). Реакцію можна проводити в інертному розчиннику, як-то, наприклад, дихлорметан, у присутності придатної солі, як-то, наприклад, калію ацетат, при помірно підвищеній температурі, як-то, наприклад, 110 С протягом, наприклад, 16 годин. Альтернативно, інтермедіати формули (ІІІ) можна також отримати відомими способами обміну метал-галоген та наступною реакцією з прийнятним джерелом бору з інтермедіатів формули (VІІ). Наприклад, інтермедіат формули (VІІ) може реагувати з літійорганічною сполукою, як-то, наприклад, н-бутиллітієм, при помірно низькій температурі, як-то, наприклад, – 10 UA 99125 C2 40 С, в інертному розчиннику, як-то, наприклад, ТГФ, а потім з прийнятним джерелом бору, якто, наприклад, триметоксиборан. У схемі реакцій (6), усі параметри є визначеними у формулі (І) або визначеними тут вище. Схема реакцій (6) 5 OR3 B OR4 halo A' O A (R2)n (VII) 10 15 O (R2)n (III) Спосіб 7 Інтермедіати формули (VІІ) можна отримати відомими способами реакцією гідроксифенолу формули (VІІІ) з придатним інтермедіатом формули (ІХ), де Х – придатна відщеплювана група, як-то, наприклад, галоген або нітро, згідно зі схемою реакцій (7). Приклади інтермедіатів формули (ІХ) є 2,3-диметил-4-нітро-піридин 1-оксид та 2-бром-4,6-диметилпіридин. Реакцію можна проводити в інертному розчиннику, як-то, наприклад, диметилформамід або ксилен, у присутності придатної основи, як-то, наприклад, натрію гідрид або калію карбонат, при помірно підвищеній температурі, як-то, наприклад, 180 С протягом, наприклад, 60 хвилин класичним або мікрохвильовим нагріванням. У схемі реакцій (7), усі параметри є визначеними у формулі (І). Схема реакцій (7) 20 25 Спосіб 8 Інтермедіати формули (VІІ), де А’ – А, де вказані інтермедіати представлені формулою (VІІа), можна отримати відомими способами з інтермедіату типу аніліну формули (Х) реакцією типу Сандмейера згідно зі схемою реакцій (8). У схемі реакцій (8), усі параметри є визначеними у формулі (І). Схема реакцій (8) 30 35 Спосіб 9 Інтермедіати формули (Х) можна отримати відомими способами з відповідного нітроінтермедіату формули (ХІ) vіа rеduсtіоn оf нітро груп до аміно функці відомими способами як-то каталітичн гідрогенаtіоn bу usіng придатного каталізатору, як-то, наприклад, паладій 10% на активован карбон або застосування оf tіn(ІІ) хлорид дигідрат як rеduсtіng агент, згідно зі схемою реакцій (9). У схемі реакцій (9), усі параметри є визначеними у формулі (І). Схема реакцій (9) 11 UA 99125 C2 5 10 15 20 25 30 35 40 45 Спосіб 10 Інтермедіати формули (ХІ) можна отримати відомими способами реакцією інтермедіату формули (ХІІ) з придатним гідроксипіридилом формули (ХІІІ), як-то, наприклад, 2-метил-3гідроксипіридин, згідно зі схемою реакцій (10). Реакцію можна проводити в інертному розчиннику, як-то, наприклад, тетрагідрофуран, у присутності придатної основи, як-то, наприклад, цезію карбонат, при помірно підвищеній температурі, як-то, наприклад, 140 С, протягом, наприклад, 16 годин. У схемі реакцій (10), усі параметри є визначеними у формулі (І). Схема реакцій (10) Фармакологія Сполуки згідно з цим винаходом є позитивними алостеричними модуляторами метаботропних рецепторів глутамату, зокрема вони є позитивними алостеричними модуляторами mGluR2. Сполуки заявленого винаходу не виявляють зв’язування з сайтом розпізнавання глутамату, сайтом ортостеричного ліганду, але замість цього з алостеричним сайтом у семи-трансмембранному регіоні рецептору. У присутності глутамату або агоністу mGluR2, сполуки згідно з цим винаходом збільшення реакції mGluR2. Сполуки згідно з винаходом, як очікують, діють на mGluR2 на основі їх здатності збільшувати реакцію таких рецепторів на глутамат або агоністи mGluR2, посилюючи реакцію рецептору. Звідси, заявлений винахід стосується сполуки згідно з заявленим винаходом для застосування як медикаменту, а також до застосування сполуки згідно з винаходом або фармацевтичної композиції згідно з винаходом для виробництва медикаменту для лікування або попередження, зокрема лікування, стану у ссавця, у тому числі людини, лікування або попередження котрого здійснюється або полегшується нейромодуляторною дією алостеричних модуляторів mGluR2, зокрема його позитивних алостеричних модуляторів. Заявлений винахід також стосується сполуки згідно з заявленим винаходом або фармацевтичної композиції згідно з винаходом для застосування у виробництві медикаменту для лікування або попередження, зокрема лікування, стану у ссавця, у тому числі людини, лікування або попередження котрого здійснюється або полегшується нейромодуляторною дією алостеричних модуляторів mGluR2, зокрема його позитивних алостеричних модуляторів. Заявлений винахід також стосується сполуки згідно з заявленим винаходом або фармацевтичної композиції згідно з винаходом для лікування або попередження, зокрема лікування, стану у ссавця, у тому числі людини, лікування або попередження котрого здійснюється або полегшується нейромодуляторною дією алостеричних модуляторів mGluR2, зокрема його позитивних алостеричних модуляторів. Також, заявлений винахід стосується застосування сполуки згідно з винаходом або фармацевтичної композиції згідно з винаходом для виробництва медикаменту для лікування, попередження, поліпшення, контролювання або зменшення ризику різних неврологічних та психіатричних розладів, асоційованих з глутаматною дисфункцією у ссавця, у тому числі людини, лікування або попередження котрих здійснюється або полегшується нейромодуляторною дією позитивних алостеричних модуляторів mGluR2. Якщо винахід стосується застосування сполуки або композиції згідно з винаходом для виробництва медикаменту, наприклад, для лікування ссавця, зрозуміло, що таке застосування слід інтерпретувати у деяких сферах як спосіб, наприклад, лікування ссавця, що полягає у 12 UA 99125 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосовуванні до ссавця при потребі такого лікування, ефективної кількості сполуки або композиції згідно з винаходом. Зокрема, неврологічні та психіатричні розлади, асоційовані з глутаматною дисфункцією, охоплюють одне або більше з нижченаведених станів або хвороб: гострі неврологічні та психіатричні розлади, як-то, наприклад, недостатність головного мозку після серцевого шунтування та трансплантування, інсульт, ішемія головного мозку, травма спинного хребта, травма голови, перинатальна гіпоксія, зупинка серця, гіпоглікемічне нейронне пошкодження, деменція (у тому числі індукована СНІД деменція), хвороба Альцгеймера, хорея Хантингтона, бічний аміотрофічний склероз, пошкодження очей, ретинопатія, когнітивні розлади, ідіопатична та індукована ліками хвороба Паркінсона, спазми м’язів та розлади, асоційовані зі спастичністю м’язів, у тому числі тремор, епілепсія, конвульсії, мігрень (у тому числі головний біль при мігрені), нетримання сечі, чутливість до речовин, синдром відвикання від речовини (у тому числі опіатів, нікотину, тютюнових продуктів, алкоголю, бензодіазепінів, кокаїну, заспокійливих, снодійних засобів тощо.), психоз, шизофренія, неспокій (у тому числі генералізований розлад з компонентом тривоги, розлад панічного типу, та обсесивно-компульсивний розлад), розлади настрою (у тому числі депресія, манія, біполярні розлади), тригемінальна невралгія, втрата слуху, дзвін у вухах, дегенерація жовтої плями, блювота, набряк головного мозку, біль (у тому числі гострий та хронічний, суворий біль, важковиліковний біль, невропатичний біль, та посттравматичний біль), пізня дискінезія, розлади сну (у тому числі нарколепсія), розлад з дефіцитом уваги/гіперактивністю та розлад поведінки. Зокрема, заявлений винахід стосується застосування сполуки формули (І) для виробництва медикаменту для лікування або попередження, зокрема для лікування, розладу центральної нервової системи, вибраного з групи: розлад з компонентом тривоги, психотичні розлади, розлади особистості, пов’язані з речовинами розлади, розлади харчування, розлади настрою, мігрень, епілепсія або конвульсивні розлади, дитячі розлади, когнітивні розлади, нейродегенерація, нейротоксичність та ішемія. Переважно, розладом центральної нервової системи є розлад з компонентом тривоги, вибраний з групи: агорафобія, генералізований розлад з компонентом тривоги (GАD), обсесивно-компульсивний розлад (ОСD), розлад панічного типу, посттравматичний стресовий розлад (РТSD), соціальна фобія та інші фобії. Переважно, розладом центральної нервової системи є психотичний розлад, вибраний з групи: шизофренія, галюцинаційний розлад, шизоафективний розлад, шизофреноподібний розлад та індукований речовинами психотичний розлад Переважно, розладом центральної нервової системи є розлад особистості, вибраний з групи: обсесивно-компульсивний розлад особистості та шизоїдний, шизоподібний розлад. Переважно, розладом центральної нервової системи є пов’язаний з речовинами розлад, вибраний з групи: зловживання алкоголем, залежність від алкоголю, алкогольна абстиненція, маячний стан при алкогольній абстиненції, індукований алкоголем психотичний розлад, залежність від амфетамінів, амфетамінова абстиненція, залежність від кокаїну, кокаїнова абстиненція, залежність від нікотину, нікотинова абстиненція, залежність від опіоїдів та опіоїдна абстиненція. Переважно, розладом центральної нервової системи є розлад харчування, вибраний з групи: нервово-психічна анорексія та нейрогенна булімія. Переважно, розладом центральної нервової системи є розлад настрою, вибраний з групи: біполярні розлади (І ТА ІІ), циклотимічний розлад, депресія, психічна депресія, глибокий депресивний розлад та індукований речовиною розлад настрою. Переважно, розладом центральної нервової системи є мігрень. Переважно, розладом центральної нервової системи є епілепсія або конвульсивний розлад, вибраний з групи: генералізована неконвульсивна епілепсія, генералізована конвульсивна епілепсія, мала епілепсія, велика епілепсія, часткова епілепсія з порушенням або без порушення притомності, дитячі спазми, епілепсія часткової продовжуваності та інші форми епілепсії. Переважно, розладом центральної нервової системи є розлад з дефіцитом уваги/гіперактивністю. Переважно, розладом центральної нервової системи є когнітивний розлад, вибраний з групи: маячний стан, індукований речовинами стійкий маячний стан, деменція, деменція внаслідок ВІЛ-хвороби, деменція внаслідок хвороби Хантингтона, деменція внаслідок хвороби Паркінсона, деменція типу Альцгеймера, індукована речовинами стійка деменція та помірне когнітивне порушення. З вищезгаданих розладів лікування неспокою, шизофренії, мігрені, депресії, та епілепсії 13 UA 99125 C2 5 10 15 20 25 30 35 40 45 50 55 60 особливо важливим. Зараз, четверте видання Dіаgnоstіс & Stаtіstісаl Маnuаl оf Меntаl Dіsоrdеrs (DSМ-ІV) від Аmеrісаn Рsусhіаtrіс Аssосіаtіоn пропонує діагностичний засіб для ідентифікації розладів, описаних тут. Спеціалісту ясно, що альтернативні номенклатури та системи класифікації для неврологічних та психіатричних розладів, описаних тут, існують та розвиваються з прогресом медицини та науки. Оскільки такі позитивні алостеричні модулятори mGluR2, у тому числі сполуки формули (І), посилюють реакцію mGluR2 на глутамат, це є перевагою, що представляє способи використання ендогенного глутамату. Оскільки позитивні алостеричні модулятори mGluR2, у тому числі сполуки формули (І), посилюють реакцію mGluR2 на агоністи, зрозуміло, що заявлений винахід стосується лікування неврологічних та психіатричних розладів, асоційованих з глутаматною дисфункцією застосуванням ефективної кількості позитивного алостеричного модулятору mGluR2, у тому числі сполуки формули (І), у комбінації з агоністом mGluR2. Сполуки заявленого винаходу можна застосовувати у комбінації з одними або більше іншими ліками у лікуванні, попередженні, контролі, поліпшенні або зменшенні ризику хвороб або станів, для котрих сполуки формули (І) або інші ліки можуть мати корисність, де комбінація ліків разом є безпечною або більш ефективною, ніж ці ліки поодинці. Фармацевтичні композиції Винахід також стосується фармацевтичної композиції, що містить фармацевтично прийнятний носій або розріджувач та, як активний інгредієнт, терапевтично ефективну кількість сполуки згідно з винаходом, зокрема сполуки формули (І), у тому числі її стереохімічно ізомерної форми, або її фармацевтично прийнятної солі або сольвату. Сполуку згідно з винаходом, зокрема сполуку формули (І), у тому числі її стереохімічно ізомерні форми, або її фармацевтично прийнятні солі або сольвати, або будь-яку її підгрупу або комбінацію можна формувати у різні фармацевтичні форми для застосування. Прийнятними є усі композиції, звичайно застосовувані для систематично застосовуваних ліків. Для отримання фармацевтичних композицій згідно з цим винаходом, ефективну кількість певної сполуки, необов’язково у формі солі, як активного інгредієнту, комбінують у суміш з фармацевтично прийнятним носієм або розріджувачем, котрі можуть мати багато форм залежно від форми препарату для застосування. Ці фармацевтичні композиції є бажаними в окремій дозованій формі, придатній, зокрема, для застосування перорально, ректально, підшкірно, парентеральними ін’єкціями або інгаляцією. Наприклад, при виготовленні композиції у пероральній дозованій формі, можна застосовувати будь-яке зі звичайних фармацевтичних середовищ, як-то, наприклад, вода, гліколі, олії, спирти тощо у випадку пероральних рідких препаратів, як-то, наприклад, суспензії, сиропи, еліксири, емульсії та розчини; або тверді носії, як-то, наприклад, крохмалі, цукри, каолін, розріджувачі, лубриканти, зв’язуючі, дезинтегратори тощо у випадку порошків, пілюль, капсул та таблеток. Внаслідок легкості застосування пероральне застосування є кращим, а таблетки та капсули є найпереважними пероральними формами одиничних доз, у котрих тверді фармацевтичні носії є звичайно застосовуваними. Для парентеральних композицій носій звичайно містить стерильну воду, принаймні у великій частині, хоча інші інгредієнти, наприклад, для розчинності, можна уводити. Наприклад, можна отримати придатні для ін’єкцій розчини, у котрих носій охоплює фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину та розчину глюкози. Придатні для ін’єкцій суспензії можна отримати також, у котрих можна застосовувати прийнятні рідкі носії, суспендувальні агенти тощо. Також охоплені препарати твердих форм, що є призначеними для перетворення безпосередньо перед застосуванням у препарати рідких форм. У композиціях, придатних для підшкірного застосування, носій необов’язково містить агент посилення проникності та/або придатний змочувальний агент, необов’язково комбінований з придатними добавками будь-якої природи у незначній пропорції, ці добавки не дають значного шкідливого впливу на шкіру. Вказані добавки можуть полегшувати застосування до шкіри та/або можуть бути корисними для отримання бажаних композицій. Ці композиції можна застосовувати різними шляхами, наприклад, як трансдермальний пластир та мазь. Є особливо переважним формувати вищезгадані фармацевтичні композиції в одиничні дозовані форми для легкості застосування та однаковості дозування. Одинична дозована форма, як застосовано тут, стосується фізично дискретних одиниць, придатних як окремі дози, кожна одиниця містить попередньо визначену кількість активного інгредієнту, розраховану для створення бажаної терапевтичної дії в асоціації з потрібним фармацевтичним носієм. Прикладами таких форм одиничних доз є таблетки (у тому числі надрізані чи покриті таблетки), капсули, пілюлі, пакетики порошку, облатки, супозиторії, придатні для ін’єкцій розчини або 14 UA 99125 C2 5 10 15 20 25 30 суспензії тощо, та їх розділені кратні кількості. Точне дозування та частота застосування залежить від конкретної застосовуваної сполуки формули (І), конкретного лікованого стану, суворості лікованого стану, віку, маси, статі, ступеню розладу та загального фізичного стану конкретного пацієнта, а також інших застосовуваних ліків, як добре відомо спеціалістам. Більш того, є свідоцтво, що вказана ефективна добова кількість може бути зменшеною або збільшеною залежно від реакції лікованої особи та/або залежно від оцінки лікарем сполуки згідно з цим винаходом. Залежно від режиму застосування, фармацевтична композиція містить від 0,05 до 99 мас.%, переважно від 0,1 до 70 мас.%, більше переважно від 0,1 до 50 мас.% активного інгредієнту, та, від 1 до 99,95 мас.%, переважно від 30 до 99,9 мас.%, більше переважно від 50 до 99,9 мас.% фармацевтично прийнятного носія, усі відсотки є на основі загальної маси композиції. Як вже згадано, винахід також стосується фармацевтичної композиції, що містить сполуку згідно з винаходом та одні або більше інших ліків у лікуванні, попередженні, контролі, поліпшенні або зменшенні ризику хвороб або станів, для котрих сполуки формули (І) або інші ліки можуть мати корисність, а також застосування такої композиції для виробництва медикаменту. Заявлений винахід також стосується комбінації сполуки згідно з заявленим винаходом та ортостеричного агоністу mGluR2. Заявлений винахід також стосується такої комбінації для застосування як медикаменту. Заявлений винахід також стосується продукту, що містить (а) сполуку згідно з заявленим винаходом, її фармацевтично прийнятну сіль або сольват, та (b) ортостеричний агоніст mGluR2, як комбінований препарат для одночасного, роздільного або послідовного застосування у лікуванні або попередженні стану у ссавця, у тому числі людини, лікування або попередження котрого здійснюється або полегшується нейромодуляторною дією алостеричних модуляторів mGluR2, зокрема позитивних алостеричних модуляторів mGluR2. Відмінн ліки такої комбінації або продукту можуть бути комбінованими в окремий препарат разом з фармацевтично прийнятними носіями або розріджувачами, або вони можуть бути в окремих препаратах разом з фармацевтично прийнятними носіями або розріджувачами. Наступні приклади є призначеними для ілюстрації, але не для обмеження рамок заявленого винаходу. Експериментальна частина Кілька способів отримання сполук згідно з цим винаходом є ілюстрованими у нижченаведених прикладах. Якщо не вказане інше, усі вихідні матеріали були отриманими від комерційних постачальників та застосовуваними без очистки. Конкретно, наступні скорочення можна застосовувати у прикладах та в описі: 35 ЕtОАс (етилацетат) ВЕРХ (високоефективна рідинна хроматографія) ДХМ (дихлорметан) мл (мілілітри) Р(=О)Вr3 (Фосфор трибромід) г (грами) МеОН (метанол) ТГФ (тетрагідрофуран) ДМФ (диметилформамід) РХ-МС (рідинна хроматографія-масспектроскопія) Еt2О (діетилетер) 40 45 ДМСО (диметилсульфоксид) Усі посилання на розсіл стосуються насиченого водного розчину NаСl. Якщо не вказане інше, усі температури є вираженими у °С. Усі реакції проводять у неінертній атмосфері при кімнатній температурі, якщо не вказане інше. Реакції з мікрохвильовим нагріванням проводили в одно-режимному мікрохвильовому реакторі ЕmrуsТМ Орtіmіzеr (Реrsоnаl Сhеmіstrу А.В., зараз Віоtаgе) або у багато-режимному мікрохвильовому реакторі МісrоSYNТН Lаbstаtіоn (Міlеstоnе, Іnс.). А. Отримання інтермедіатів Приклад А,1 1-Циклопропілметил-4-метокси-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 1) O N N O До розчину 4-метокси-2-оксо-1,2-дигідро-піридин-3-карбонітрилу (12,2 г, 81,48 ммоль) в ацетонітрилі (250 мл) додавали (бромметил)циклопропан (11 г, 81,48 ммоль) та калію карбонат 15 UA 99125 C2 5 10 15 20 25 30 35 40 (22,48 г, 162,9 ммоль) та суміш гріли при 110 С протягом 24 годин. Суміш охолоджували до кімнатної температури та твердий матеріал відфільтровували. Фільтрат випарювали до сухого стану та утворений сирий залишок тоді розтирали у порошок з діетил-етером, отримуючи чистий інтермедіат 1 (15,72 г, 94%) як білий твердий матеріал. Приклад А,2 1-Бутил-4-метокси-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 2) O N N O До розчину 4-метокси-2-оксо-1,2-дигідро-піридин-3-карбонітрилу (20 г, 133 ммоль) в ацетонітрилі (800 мл) додавали 1-бромбутан (15,8 мл, 146 ммоль) та калію карбонат (36,7 г, 266 ммоль) та суміш гріли при 110 С протягом 24 годин. Суміш охолоджували до кімнатної температури та твердий матеріал відфільтровували. Фільтрат випарювали до сухого стану та утворений сирий залишок тоді розтирали у порошок з діетил-етером, отримуючи чистий інтермедіат 2 (27,39 г, >99%) як білий твердий матеріал. Приклад А,3 1-Циклопропілметил-4-гідрокси-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 3) O N N HO Інтермедіат 1 (15,7 г, 76,8 ммоль) додавали при кімнатній температурі до 1 Н водного розчину натрію гідроксиду (300 мл) та ТГФ (50 мл). Реакційну суміш гріли при 140 С (температура оливної бані) протягом 16 годин. Суміш охолоджували до кімнатної температури та ТГФ головним чином випарювали у вакуумі. Водний шар охолоджували до 0 ºС та підкислювали додаванням водної 2 Н НСl, доводили рН приблизно до 3, при цьому осаджувався білий твердий матеріал. Твердий матеріал відфільтровували, промивали Еt2О та сушили у вакуумі, отримуючи інтермедіат 3 як білий твердий матеріал (10,44 г, 71%), що було застосовано без очистки. Приклад А,4 1-Бутил-4-гідрокси-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 4) O N N HO Інтермедіат 2 (27,39 г, 133 ммоль) додавали при кімнатній температурі до 1 Н водного розчину натрію гідроксиду (500 мл) та ТГФ (100 мл). Реакційну суміш гріли при 110 С (температура оливної бані) протягом 24 годин. Суміш охолоджували до кімнатної температури та розчинник випарювали у вакуумі до зменшення об’єму приблизно до 250 мл. Водний шар тоді охолоджували до 0 С та підкислювали додаванням водної 2 Н НСl, доводили рН приблизно до 3, при цьому осаджувався білий твердий матеріал. Твердий матеріал відфільтровували, промивали Еt2О та сушили у вакуумі, отримуючи інтермедіат 4 як білий твердий матеріал (25 г, 98%), що було застосовано без очистки. Приклад А,5 4-Бром-1-циклопропілметил-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 5) O N N Br До розчину інтермедіату 3 (10,4 г, 54,67 ммоль) у ДМФ (250 мл) додавали фосфор трибромід (31,3 г, 109,3 ммоль) та суміш гріли при 110 С протягом 1,5 годин. Після охолодження у льодяній бані розчин розподіляли між водою та ЕtОАс. Після трьох екстракцій ЕtОАс комбіновані органічні фракції промивали розсолом, сушили над МgSО 4 та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 5 (8,83 г, 16 UA 99125 C2 64 %). Приклад А,6 4-Бром-1-бутил-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 6) O N N 5 10 Br До розчину інтермедіату 4 (39 г, 203 ммоль) у ДМФ (600 мл) додавали фосфор трибромід (116 г, 406 ммоль) та суміш гріли при 110 С протягом 1,5 годин. Після охолодження у льодяній бані розчин розподіляли між водою та ЕtОАс. Після трьох екстракцій ЕtОАс комбіновані органічні фракції промивали розсолом, сушили над Nа 2SО4 та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 6 (36,7 г, 72 %). Приклад А,7 2-(4-Бром-3-флуор-фенокси)-4,6-диметил-піридин (інтермедіат 7) F Br O N 15 20 Суміш 2-бром-4,6-диметилпіридину (1 г, 5,4 ммоль), 4-бром-3-флуор-фенолу (1,03 г, 5,4 ммоль), та калію карбонату (0,89 г, 6,4 ммоль) гріли при 150 С (температура оливної бані) у герметичній тубі протягом 7 діб. Після охолодження до кімнатної температури суміш розбавляли ДХМ та фільтрували через шар діатомової землі. Фільтрат випарювали до сухого стану та так отриманий сирий продукт очищали колонковою хроматографією (силікагель; ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 7 (1,1 г, 53 %). Приклад А,8 2-[3-Флуор-4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-фенокси]-4,6-диметил-піридин (інтермедіат 8) F O B O O N 25 30 До розчину інтермедіату 7 (0,5 г, 1,69 ммоль) в 1,4-діоксані (9 мл) та ДМФ (1 мл) додавали біс(пінаколято)диборан (0,643 г, 2,53 ммоль) та калію ацетат (0,497 г, 5,06 ммоль). Суміш дегазували та тоді додавали [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,0413 г, 0,05 ммоль; САS [95464-05-4]). Реакційну суміш гріли при 150 С протягом40 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури додавали воду та суміш екстрагували ЕtОАс. Органічну фракцію сушили (Nа 2SО4) та розчинник випарювали у вакуумі, отримуючи бажаний інтермедіат 8 (0,6 г, 100%) як сирий продукт, що було застосовано без очистки. Приклад А,9 3-(2-Флуор-4-нітро-фенокси)-2,6-диметил-піридин (інтермедіат 9) 17 UA 99125 C2 O + N F O O N 5 10 При кімнатній температурі до розчину 2,6-диметил-3-піридинолу (3 г, 24,35 ммоль) у ТГФ (30 мл) додавали цезію карбонат (15,87 г, 48,71 ммоль) та 3,4-дифлуор-1-нітро-бензен (3,87 г, 24,35 ммоль). Реакційну суміш гріли при кипінні під зворотним холодильником протягом 2 годин. Після охолодження до кімнатної температури тверді матеріали відфільтровували та фільтрат випарювали до сухого стану. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН(NН3) до 2% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 9 (5,88 г, 92 %). Приклад А,10 4-(2,6-Диметил-піридин-3-ілокси)-3-флуор-феніламін (інтермедіат 10) NH2 F O N 15 Розчин інтермедіату 9 (5,88 г, 22,44 ммоль) в етанолі (200 мл) гідрували при кімнатній температурі у присутності 10% паладію на активованому вугіллі (0,58 г) протягом 3 годин. Тверді матеріали відфільтровували та фільтрат випарювали до сухого стану, отримуючи інтермедіат 10 (5,20 г, >99 %), що було застосовано без очистки. Приклад А,11 3-(4-Бром-2-флуор-фенокси)-2,6-диметил-піридин (інтермедіат 11) Br F O N 20 25 30 До розчину інтермедіату 10 (7,7 г, 33,2 ммоль) у НВr (75 мл, 48% водн), охолодженого до 0 С додавали краплями протягом 45 хвилин розчин натрію нітриту (4,57 г, 66,3 ммоль) у вод (75 мл). Реакційну суміш гріли до кімнатної температури та далі перемішували протягом 15 хвилин. Суміш охолоджували до 0 С та купрум (І) бромід (4,0 г, 28,4 ммоль) додавали порціями. Перемішування продовжували протягом 15 хвилин при 0 С та тоді суміш гріли до кімнатної температури та далі перемішували протягом 15 хвилин. Реакційну суміш тоді гріли при 140 С протягом 1,5 годин. Суміш охолоджували до кімнатної температури та обережно нейтралізували водним насиченим розчином калію карбонату. ЕtОАс було тоді добавлено та шари відокремлювали. Органічн фаз сушили (Nа2SО4) та випарювали до сухого стану. Сирий продукт очищали колонковою хроматографією (силікагель; гептан до гептан/ЕtОАс до 10% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 11 (8,75 г, 89 %). Приклад А,12 3-[2-Флуор-4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-фенокси]-2,6-диметил-піридин (інтермедіат 12) 18 UA 99125 C2 O B F O O N 5 10 До розчину інтермедіату 11 (1,5 г, 5,07 ммоль) в 1,4-діоксані (9 мл) та ДМФ (3 мл) додавали біс(пінаколято)диборан (3,86 г, 15,2 ммоль) та калію ацетат (1,48 г, 15,2 ммоль). Суміш дегазували та тоді [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,16 г, 0,20 ммоль; САS [95464-05-4]) додавали. Реакційну суміш гріли при 150 С протягом 10 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури додавали воду та суміш екстрагували ЕtОАс. Органічну фракцію сушили (Nа 2SО4) та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 12 (1,74 г, 100%) як сирий продукт, що було застосовано без очистки. Приклад А,13 4-(4-Бром-3-флуор-фенокси)-2-метил-піридин 1-оксид (інтермедіат 13) F Br O + 15 20 N O При кімнатній температурі до розчину 4-бром-3-флуорфенолу (6 г, 31,41 ммоль) у Nметилпіролідон (20 мл) додавали натрію гідрид (1,34 г, 56 ммоль, 60% у мінеральній оливі) порціями. Після перемішування протягом 10 хвилин додавали 4-нітро-2-піколін N-оксид (5,6 г, 36,12 ммоль). Реакційну суміш гріли при 180 С протягом 60 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури суміш розбавляли ЕtОАс (250 мл) та промивали водою (250 мл). Розчин тоді екстрагували додатково ЕtОАс (2 150 мл).Комбіновані органічні екстракти сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН(NН 3) до 2% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 13 (3,61 г, 39 %). Приклад А,14 2-Флуор-4-(2-метил-4-піридилокси)феніл боронова кислота (інтермедіат 14) OH F B OH O 25 30 N До розчину інтермедіату 13 (1,05 г, 3,52 ммоль) в 1,4-діоксані (9 мл) та ДМФ (4 мл) додавали біс(пінаколято)диборан (2,68 г, 10,56 ммоль) та калію ацетат (1,035 г, 10,56 ммоль). Суміш дегазували та тоді [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,115 г, 0,141 ммоль; САS [95464-05-4]) додавали. Реакційну суміш гріли при 150 С протягом 15 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури додавали воду та суміш екстрагували ЕtОАс (20 мл). Органічну фракцію сушили (Nа 2SО4) та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 14 (0,87 г, 100%) як сирий продукт, що було застосовано без очистки. 19 UA 99125 C2 Приклад А,15 4-(4-Бром-2-флуор-фенокси)-2-метил-піридин 1-оксид (інтермедіат 15) Br F O + 5 10 15 N O При кімнатній температурі до розчину 4-бром-2-флуорфенол (3,44 мл, 31,41 ммоль) у Nметилпіролідон (20 мл) додавали натрію гідрид (1,34 г, 56 ммоль, 60% у мінеральній оливі ) порціями. Після перемішування протягом 20 хвилин 4-нітро-2-піколін N-оксид (5,6 г, 36,12 ммоль) додавали Реакційну суміш гріли при 180 С протягом 60 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури суміш розбавляли ЕtОАс (250 мл) та промивали водою (250 мл). Розчин тоді екстрагували додатково ЕtОАс (2 150 мл). Комбіновані органічні екстракти сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН(NН 3) до 2% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 15 (4,36 г, 47 %). Приклад А,16 3-Флуор-4-(2-метил-4-піридилокси)феніл боронова кислота (інтермедіат 16) OH B F OH O 20 25 N До розчину інтермедіату 15 (1,05 г, 3,52 ммоль) в 1,4-діоксані (9 мл) та ДМФ (4 мл) додавали біс(пінаколято)диборан (2,68 г, 10,56 ммоль) та калію ацетат (1,035 г, 10,56 ммоль). Суміш дегазували та тоді [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,115 г, 0,141 ммоль; САS [95464-05-4]) додавали. Реакційну суміш гріли при 150 С протягом 15 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури додавали воду та суміш екстрагували ЕtОАс (20 мл). Органічну фракцію сушили (Nа 2SО4) та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 16 (0,87 г, 100%) як сирий продукт, що було застосовано без очистки. Приклад А,17 4-(4-Бром-3-флуор-фенокси)-2,6-диметил-піридин (інтермедіат 17) F Br O 30 35 N Суміш 4-бром-2,6-диметил-піридин (1 г, 5,4 ммоль), 4-бром-3-флуор-фенол (0,59 г, 5,4 ммоль), та калію карбонат (0,89 г, 6,4 ммоль) у ксилені (2 мл) гріли при 150 С (температура оливної бані) у герметичній тубі протягом 48 годин. Після охолодження до кімнатної температури суміш розбавляли ЕtОАс та фільтрували через шар діатомової землі. Фільтрат випарювали до сухого стану та так отриманий сирий продукт очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ЕtОАс до 10% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 17 (1,18 г, 72 %). Приклад А,18 4-[3-Флуор-4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-фенокси]-2,6-диметил-піридин (інтермедіат 18) 20 UA 99125 C2 F O B O O 5 10 N До розчину інтермедіату 17 (1 г, 3,37 ммоль) в 1,4-діоксані (10,8 мл) та ДМФ (1,2 мл) додавали біс(пінаколято)диборан (1,286 г, 5,06 ммоль) та калію ацетат (0,994 г, 10,13 ммоль). Суміш дегазували та тоді [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,0827 г, 0,101 ммоль; САS [95464-05-4]) додавали. Реакційну суміш гріли при 150 С протягом 10 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури додавали воду та суміш екстрагували ЕtОАс. Органічну фракцію сушили (Nа 2SО4) та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 18 (1,14 г, 100%) як сирий продукт, що було застосовано без очистки. Приклад А,19 4-(4-Бром-2-флуор-фенокси)-2,6-диметил-піридин (інтермедіат 19) Br F O 15 20 N Суміш 4-бром-2,6-диметил-піридин (1 г, 5,4 ммоль), 4-бром-2-флуор-фенол (0,59 г, 5,4 ммоль), та калію карбонат (0,89 г, 6,4 ммоль) у ксилені (2 мл) гріли при 150 С (температура оливної бані) у герметичній тубі протягом 48 годин. Після охолодження до кімнатної температури суміш розбавляли ЕtОАс та фільтрували через шар діатомової землі. Фільтрат випарювали до сухого стану та так отриманий сирий продукточищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ЕtОАс до 10% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 19 (1,28 г, 80 %). Приклад А,20 4-[2-Флуор-4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-фенокси]-2,6-диметил-піридин (інтермедіат 20) F O B O O 25 30 N До розчину інтермедіату 19 (1 г, 3,37 ммоль) в 1,4-діоксані (10,8 мл) та ДМФ (1,2 мл) додавали біс(пінаколято)диборан (1,286 г, 5,06 ммоль) та калію ацетат (0,994 г, 10,13 ммоль). Суміш дегазували та тоді [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,0827 г, 0,101 ммоль; САS [95464-05-4]) додавали. Реакційну суміш гріли при 150 С протягом 10 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури додавали воду та суміш екстрагували ЕtОАс. Органічну фракцію сушили (Nа 2SО4) та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 20 (1,15 г, 100%) як сирий продукт, що було застосовано без очистки. Приклад А,21 4-(4-Бром-3-флуор-фенокси)-2,3-диметил-піридин 1-оксид (інтермедіат 21) 21 UA 99125 C2 F Br O + 5 10 N O При кімнатній температурі до розчину 4-бром-3-флуорфенол (15 г, 78,53 ммоль) у ДМФ (50 мл) додавали натрію гідрид (3,32 г, 85,67 ммоль, 60% у мінеральній оливі) порціями. Після перемішування протягом 10 хвилин 2,3-диметил-4-нітро-піридин 1-оксид (1,05 г, 6,28 ммоль) додавали. Реакційну суміш гріли при 180 С протягом 60 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури суміш фільтрували через шар діатомової землі та фільтрат тоді розбавляли ЕtОАс та промивали водою. Розчин тоді екстрагували додатково ЕtОАс (2 150 мл). Органічн шар сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН до 5% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 21 (3,44 г, 19 %). Приклад А,22 2-Флуор-4-(2,3-диметил-4-піридилокси) фенілборонова кислота (інтермедіат 22) OH F B OH O 15 20 N До розчину інтермедіату 21 (0,40 г, 1,28 ммоль) в 1,4-діоксані (2,6 мл) та ДМФ (0,8 мл) додавали біс(пінаколято)диборан (0,97 г, 3,84 ммоль) та калію ацетат (0,37 г, 3,84 ммоль). Суміш дегазували та тоді [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,042 г, 0,051 ммоль; САS [95464-05-4]) додавали. Реакційну суміш гріли при 150 С протягом 15 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури додавали воду та суміш екстрагували ЕtОАс. Органічну фракцію сушили (Nа 2SО4) та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 22 (0,334 г, 100%) як сирий продукт, що було застосовано без очистки. Приклад А,23 4-(4-Бром-2-флуор-фенокси)-2,3-диметил-піридин 1-оксид (інтермедіат 23) Br F O + 25 30 35 N O При кімнатній температурі до розчину 4-бром-2-флуорфенол (1 г, 5,23 ммоль) у Nметилпіролідон (10 мл) додавали натрію гідрид (0,27 г, 6,79 ммоль, 60% у мінеральній оливі) порціями. Після перемішування протягом 10 хвилин 2,3-диметил-4-нітро-піридин 1-оксид (1,05 г, 6,28 ммоль) додавали. Реакційну суміш гріли при 180 С протягом 60 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури суміш фільтрували через шар діатомової землі та фільтрат тоді розбавляли ЕtОАс та промивали водою. Розчин тоді екстрагували додатково ЕtОАс (2 150 мл). Органічн шар сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН до 3% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 23 (0,75 г, 46 %). Приклад А,24 22 UA 99125 C2 4-[2-Флуор-4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-фенокси]-2,3-диметил-піридин (інтермедіат 24) F O B O O 5 10 N До розчину інтермедіату 23 (0,420 г, 1,36 ммоль) в 1,4-діоксані (6 мл) та ДМФ (2 мл) додавали біс(пінаколято)диборан (1,025 г, 4,03 ммоль) та калію ацетат (0,385 г, 4,03 ммоль). Суміш дегазували та тоді [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,044 г, 0,054 ммоль; САS [95464-05-4]) додавали. Реакційну суміш гріли при 150 С протягом 10 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури додавали воду та суміш екстрагували ЕtОАс. Органічну фракцію сушили (Nа 2SО4) та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 24 (1,41 г, 100%) як сирий продукт, що було застосовано без очистки. Приклад А,25 4-(4-Бром-фенокси)-2-метил-піридин (інтермедіат 25) Br N O 15 20 До розчину NаН (60 % у мінеральній оливі) (0,13 г, 3,25 ммоль) у ДМФ (5 мл) додавали комерційно доступний 4-бромфенол (0,50 г, 2,89 ммоль) та реакційну суміш перемішували при кімнатній температурі протягом 10 хвилин. Тоді, 4-хлор-2-піколін (0,30 г, 2,40 ммоль) додавали та утворену реакційну суміш тоді гріли у мікрохвильовій шафі при 150 С протягом 10 хвилин. Після охолодження, суміш розбавляли водою та екстрагували Еt 2О. Комбіновані органічні шари сушили над Nа2SО4 та концентрували у вакуумі. Так отриманий залишок очищали флешхроматографією (ДХМ), отримуючи інтермедіат 25 (0,52 г, 81%). Приклад А,26 4-[4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-фенокси]-2-метил-піридин (інтермедіат 26) O N 25 30 35 B O O До розчину інтермедіату 25 (0,50 г, 1,89 ммоль) у ДМСО (5 мл) додавали біс(пінаколято)дибор (0,72 г, 2,84 ммоль) та КОАс (0,56 г, 5,68 ммоль), розчин тоді дегазували азотом та до реакційної суміші додавали 1,1'-біс(дифенілфосфіно)фероценпаладій (ІІ) дихлорид, ДХМ (0,05 г, 0,06 ммоль). Реакційну суміш тоді гріли при 110 С в атмосфері азоту протягом 16 годин. Реакційну суміш тоді охолоджували до кімнатної температури та розбавляли водою та утворений розчин екстрагували АсОЕt. Органічну фракцію тоді сушили над Nа2SО4 та концентрували у вакуумі, отримуючи інтермедіат 26 (0,58 г, 100 %), що застосовували у наступному етапі без очистки. В. Отримання кінцевих сполук Приклад В,1 1-Циклопропілметил-4-[4-(4,6-диметил-піридин-2-ілокси)-2-флуор-феніл]-2-оксо-1,2-дигідропіридин-3-карбонітрил (сполука 1) 23 UA 99125 C2 O N N O F N 5 10 До розчину інтермедіату 8 (1,42 ммоль) в 1,4-діоксані (6 мл) та насиченого розчину NаНСО 3 (5 мл) додавали інтермедіат 5 (0,329 г, 1,3 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,15 мг, 0,13 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 140 С протягом 5 хвилин. Утворену охолоджену реакційну суміш тоді розбавляли ЕtОАс та фільтрували через шар діатомової землі. Фільтрат промивали водою, сушили (Nа2SО4) та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ЕtОАс до 10% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 1, що промивали діетил-етером та сушили у вакуумі (0,207 г, 41%). Точка плавлення: 137,0 С. Приклад В,2 1-Бутил-4-[4-(2,6-диметил-піридин-3-ілокси)-3-флуор-феніл]-2-оксо-1,2-дигідро-піридин-3карбонітрил (сполука 2) O N N F O N 15 20 25 До розчину інтермедіату 12 (2 ммоль) в 1,4-діоксані (6 мл) та насиченого розчину NаНСО 3 (6 мл) додавали інтермедіат 6 (0,51 г, 2 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,231 мг, 0,2 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 С протягом 10 хвилин. Утворену охолоджену реакційну суміш фільтрували через шар діатомової землі та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН до 3% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 2 (0,405 г, 52%). Точка плавлення: 156,4 С. Сполуки 12, 14 та 16 (дивись таблицю 1) можна отримати згідно з протоколом, описаним для сполуки 2. Приклад В,3 1-Циклопропілметил-4-[4-(2,6-диметил-піридин-3-ілокси)-3-флуор-феніл]-2-оксо-1,2-дигідропіридин-3-карбонітрил (сполука 3) O N N F O N 24 UA 99125 C2 5 10 До розчину інтермедіату 12 (2 ммоль) в 1,4-діоксані (6 мл) та насиченого розчину NаНСО3 (6 мл) додавали інтермедіат 5 (0,51 г, 2 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,231 мг, 0,2 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 С протягом 10 хвилин. Утворену охолоджену реакційну суміш фільтрували через шар діатомової землі та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН до 3% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 3 (0,445 г, 58%). Точка плавлення: 152,7 С. Приклад В,4 1-Бутил-4-[2-флуор-4-(2-метил-піридин-4-ілокси)-феніл]-2-оксо-1,2-дигідро-піридин-3карбонітрил (сполука 4) O N N O 15 20 25 F N До розчину інтермедіату 14 (1,77 ммоль) в 1,4-діоксані (6 мл) та насиченого розчину NаНСО 3 (6 мл) додавали інтермедіат 6 (0,451 г, 1,77 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,204 мг, 0,177 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 С протягом 10 хвилин. Утворену охолоджену реакційну суміш фільтрували через шар діатомової землі та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН до 3% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 4 (0,45 г, 68%). Точка плавлення: 127,1 С. Сполуки 13, 17, 19 та 20 (дивись таблицю 1) можна отримати згідно з протоколом, описаним для сполуки 4. Приклад В,5 1-Бутил-4-[3-флуор-4-(2-метил-піридин-4-ілокси)-феніл]-2-оксо-1,2-дигідро-піридин-3карбонітрил (сполука 5) O N N F O 30 35 N До розчину інтермедіату 16 (1,77 ммоль) в 1,4-діоксані (6 мл) та насиченого розчину NаНСО 3 (6 мл) додавали інтермедіат 6 (0,451 г, 1,77 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,204 мг, 0,177 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 С протягом 10 хвилин. Утворену охолоджену реакційну суміш фільтрували через шар діатомової землі та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН до 3% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 5 (0,45 г, 68%). Точка плавлення: 125,4 С. Сполуку 15 (дивись таблицю 1) можна отримати згідно з протоколом, описаним для сполуки 5. Приклад В,6 1-Бутил-4-[4-(2,6-диметил-піридин-4-ілокси)-2-флуор-феніл]-2-оксо-1,2-дигідро-піридин-3карбонітрил (сполука 6) 25 UA 99125 C2 O N N O 5 10 F N До розчину інтермедіату 18 (1,078 ммоль) в 1,4-діоксані (6 мл) та насиченого розчину NаНСО3 (5 мл) додавали інтермедіат 6 (0,25 г, 0,979 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,113 мг, 0,098 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 С протягом 10 хвилин. Утворену охолоджену реакційну суміш фільтрували через шар діатомової землі та шар діатомової землі промивали ЕtОАс. Комбіновані фільтрати промивали водою та органічний шар відокремлювали, сушили (Nа2SО4) та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН до 2% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 6, що осаджували з діетил-етеру (0,220 г, 57%). Точка плавлення: 169,9 С. Приклад В,7 1-Бутил-4-[4-(2,6-диметил-піридин-4-ілокси)-3-флуор-феніл]-2-оксо-1,2-дигідро-піридин-3карбонітрил (сполука 7) O N N F O 15 20 25 N До розчину інтермедіату 20 (1,078 ммоль) в 1,4-діоксані (6 мл) та насиченого розчину NаНСО3 (5 мл) додавали інтермедіат 6 (0,25 г, 0,979 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,113 мг, 0,098 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 С протягом 10 хвилин. Утворену охолоджену реакційну суміш фільтрували через шар діатомової землі та шар діатомової землі промивали ЕtОАс. Комбіновані фільтрати промивали водою та органічний шар відокремлювали, сушили (Nа2SО4) та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН до 2% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 7, що осаджували з діетил-етеру (0,225 г, 59%). Точка плавлення: 205,4 С. Приклад В,8 1-Циклопропілметил-4-[4-(2,6-диметил-піридин-4-ілокси)-2-флуор-феніл]-2-оксо-1,2-дигідропіридин-3-карбонітрил (сполука 8) O N N O 30 F N До розчину інтермедіату 18 (1,05 ммоль) в 1,4-діоксані (4,5 мл) та насиченого розчину NаНСО3 (4,5 мл) додавали інтермедіат 5 (0,22 г, 0,892 ммоль). Утворений розчин дегазували 26 UA 99125 C2 5 10 азотом та до цього додавали Рd(РРh3)4 (0,13 мг, 0,114 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 С протягом 10 хвилин. Утворену охолоджену реакційну суміш фільтрували через шар діатомової землі. Фільтрат розбавляли ЕtОАс, та тоді промивали водою, сушили над Nа2SО4 та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН до 5% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи залишок, що тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ЕtОАс до 10% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 8, що осаджували з діізопропілетеру (0,176 г, 51%). Точка плавлення: з розкладанням Приклад В,9 1-Циклопропілметил-4-[4-(2,6-диметил-піридин-4-ілокси)-3-флуор-феніл]-2-оксо-1,2-дигідропіридин-3-карбонітрил (сполука 9) O N N F O 15 20 25 N До розчину інтермедіату 20 (1,066 ммоль) в 1,4-діоксані (4,5 мл) та насиченого розчину NаНСО3 (4,5 мл) додавали інтермедіат 5 (0,23 г, 0,906 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,12 мг, 0,106 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 С протягом 10 хвилин. Утворену охолоджену реакційну суміш фільтрували через шар діатомової землі. Фільтрат розбавляли ЕtОАс, та тоді промивали водою, сушили (Nа2SО4) та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ЕtОАс до 50% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 9, що осаджували з діетил-етеру (0,144 г, 42%). Точка плавлення: 201,2 С Приклад В,10 1-Циклопропілметил-4-[4-(2,3-диметил-піридин-4-ілокси)-2-флуор-феніл]-2-оксо-1,2-дигідропіридин-3-карбонітрил (сполука 10) O N N O 30 35 40 F N До розчину інтермедіату 22 (0,34 g1,321 ммоль) в 1,4-діоксані (5,5 мл) та насиченого розчину NаНСО3 (5,5 мл) додавали інтермедіат 5 (0,28 г, 1,123 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,15 мг, 0,132 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 С протягом 10 хвилин. Утворену охолоджену реакційну суміш фільтрували через шар діатомової землі. Фільтрат розбавляли ЕtОАс, та тоді промивали водою, сушили (Nа2SО4) та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/АсОЕt 1:1 як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи залишок, що розтирали у порошок з діетил-етером, отримуючи сполуку 10 (0,068 г, 16%) Приклад В,11 1-Циклопропілметил-4-[4-(2,3-диметил-піридин-4-ілокси)-3-флуор-феніл]-2-оксо-1,2-дигідропіридин-3-карбонітрил (сполука 11) 27 UA 99125 C2 O N N F O 5 10 N До розчину інтермедіату 24 (1,769 ммоль) в 1,4-діоксані (7 мл) та насиченого розчину NаНСО3 (7 мл) додавали інтермедіат 5 (0,38 г, 1,504 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,2 мг, 0,176 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 С протягом 10 хвилин. Утворену охолоджену реакційну суміш фільтрували через шар діатомової землі. Фільтрат розбавляли ЕtОАс, та тоді промивали водою, сушили (Nа2SО4) та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН до 5% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 11, осаджену з діізопропіл-етеру (0,190 г, 32%). Точка плавлення: з розкладанням Приклад В12 3-ціано-1-бутил-4-[4-(2-метил-піридин-4-ілокси)-феніл]-піридин-2(1Н)-он (сполука 18) N O N N O 15 20 Інтермедіат 6 (0,48 г, 1,89 ммоль) та інтермедіат 26 (0,59 г, 1,89 ммоль) змішували в 1,4діоксані (4 мл) та насиченому розчині NаНСО 3 (4 мл). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,22 г, 0,19 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 С протягом 10 хвилин. Утворену реакційну суміш тоді фільтрували через шар діатомової землі та промивали АсОЕt. Фільтрат промивали розсолом. Комбіновані органічні шари сушили над МgSО 4 та концентрували у вакуумі. так отриманий залишок очищали флеш-хроматографією (ДХМ / МеОН суміші), отримуючи сполуку 18 (0,16 г, 25 %). Таблиця 1 наводить сполуки формули (І), що отримували згідно з прикладами. Таблиця 1 O N 2 3 A O 4 R1 N 1 6 5 R2 25 Сп. № Пр. № 1 В1 --R1 R 2 2-F 28 --А N
ДивитисяДодаткова інформація
Назва патенту англійською1,4-disubstituted 3-cyano-pyridone derivatives and their use as positive mglur2 -receptor modulators
Автори англійськоюCid-Nunez, Jose, Maria, Trabanco-Suarez, Andres, Avelino, Macdonald, Gregor, James, Duvey, Guillaume, Albert, Jacques, Lutjens, Robert, Johannes
Назва патенту російською1,4-замещенные 3-цианопиридонпроизводные и их применение в качестве положительных модуляторов mglur2-рецептора
Автори російськоюСид-Нюнез Хосе Мария, Трабанко-Суарез Андрес Авелино, Макдональд Грегор Джеймс, Дюве Гийом Альбер Якьюэс, Лютьенс Роберт Йоганнес
МПК / Мітки
МПК: C07D 405/06, A61P 25/22, C07D 401/10, C07D 409/04, C07D 401/12, A61K 31/4412, A61K 31/4418, A61K 31/443, A61K 31/444, C07D 401/14, C07D 401/06, A61K 31/4436, C07D 213/85, C07D 401/04, A61K 31/4439
Мітки: 3-ціанопіридонпохідні, позитивних, модуляторів, mglur2-рецептора, застосування, 1,4-заміщені
Код посилання
<a href="https://ua.patents.su/40-99125-14-zamishheni-3-cianopiridonpokhidni-ta-kh-zastosuvannya-yak-pozitivnikh-modulyatoriv-mglur2-receptora.html" target="_blank" rel="follow" title="База патентів України">1,4-заміщені 3-ціанопіридонпохідні та їх застосування як позитивних модуляторів mglur2-рецептора</a>
Попередній патент: Похідні 3-ціано-4-(4-тетрагідропіранфеніл)піридин-2-ону
Наступний патент: Спосіб виготовлення негативної решітки для батареї
Випадковий патент: Пристрій для електрообігріву підлог тваринницьких приміщень