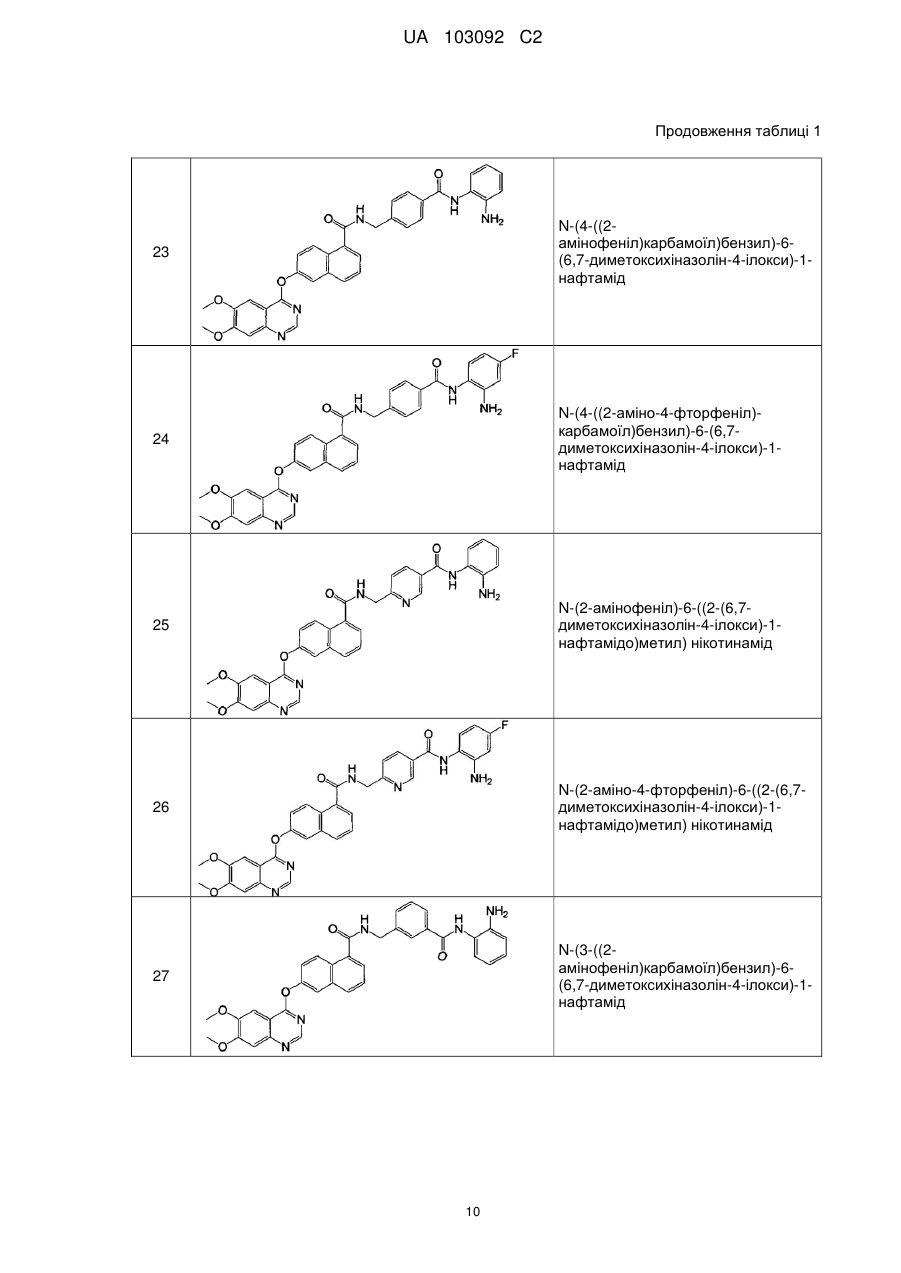
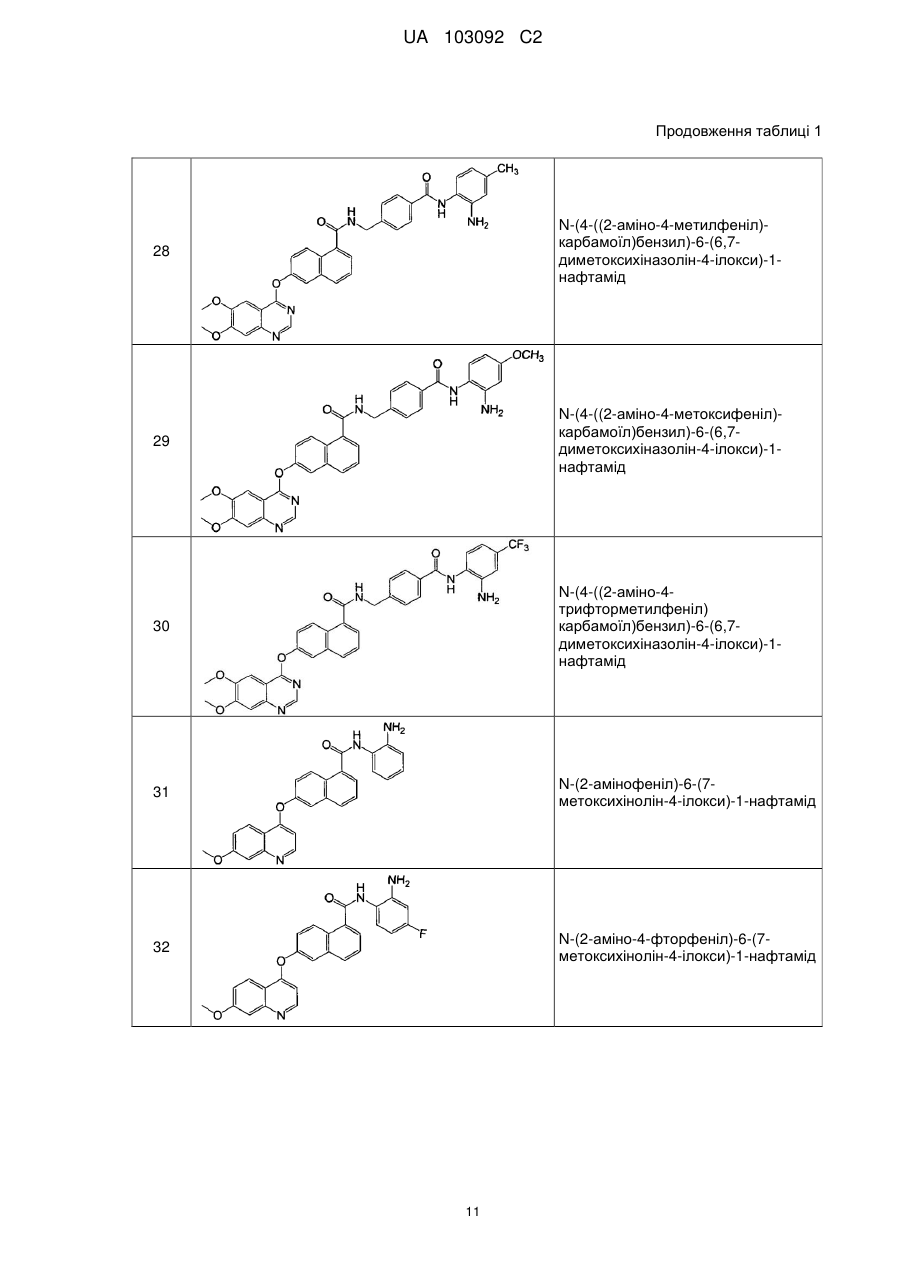
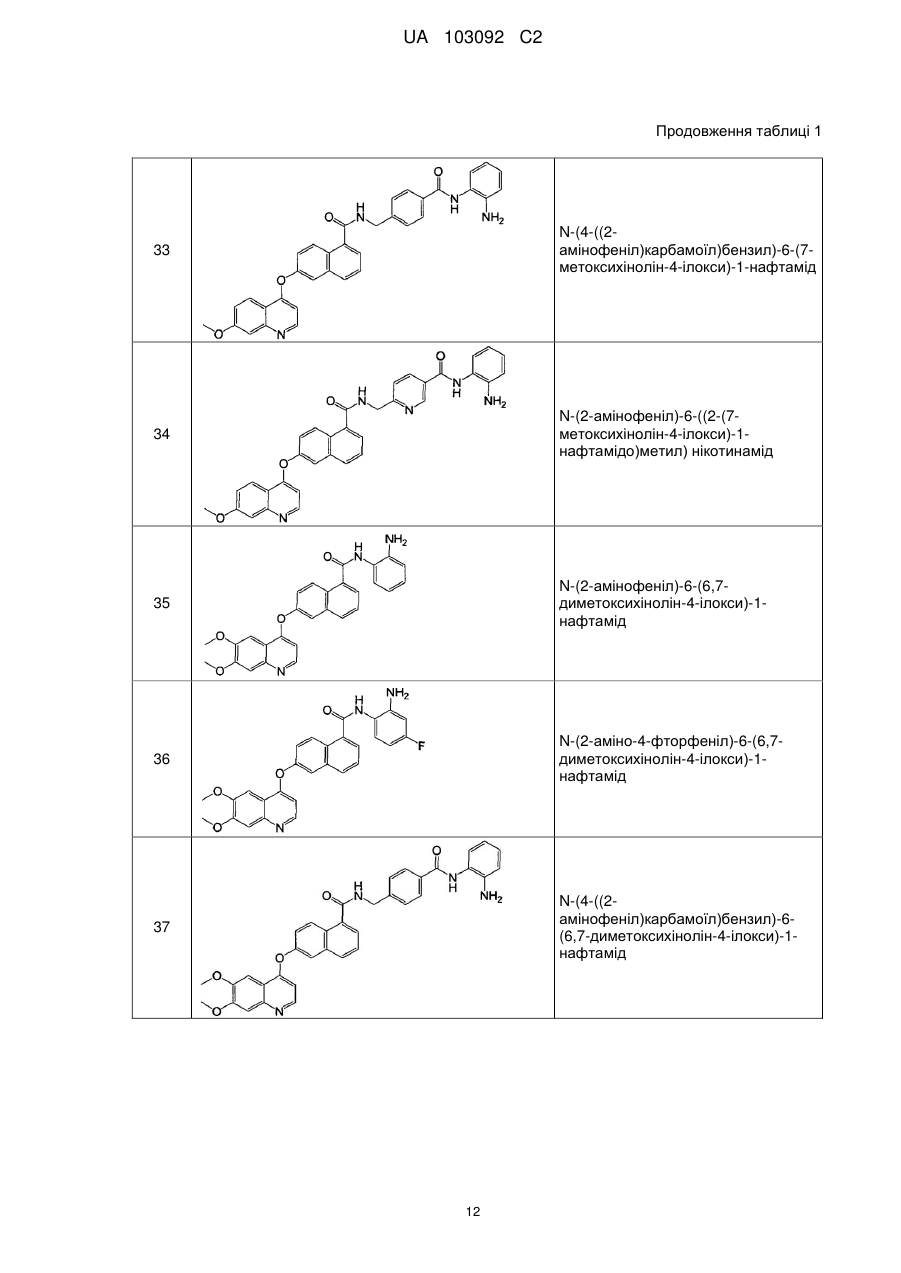
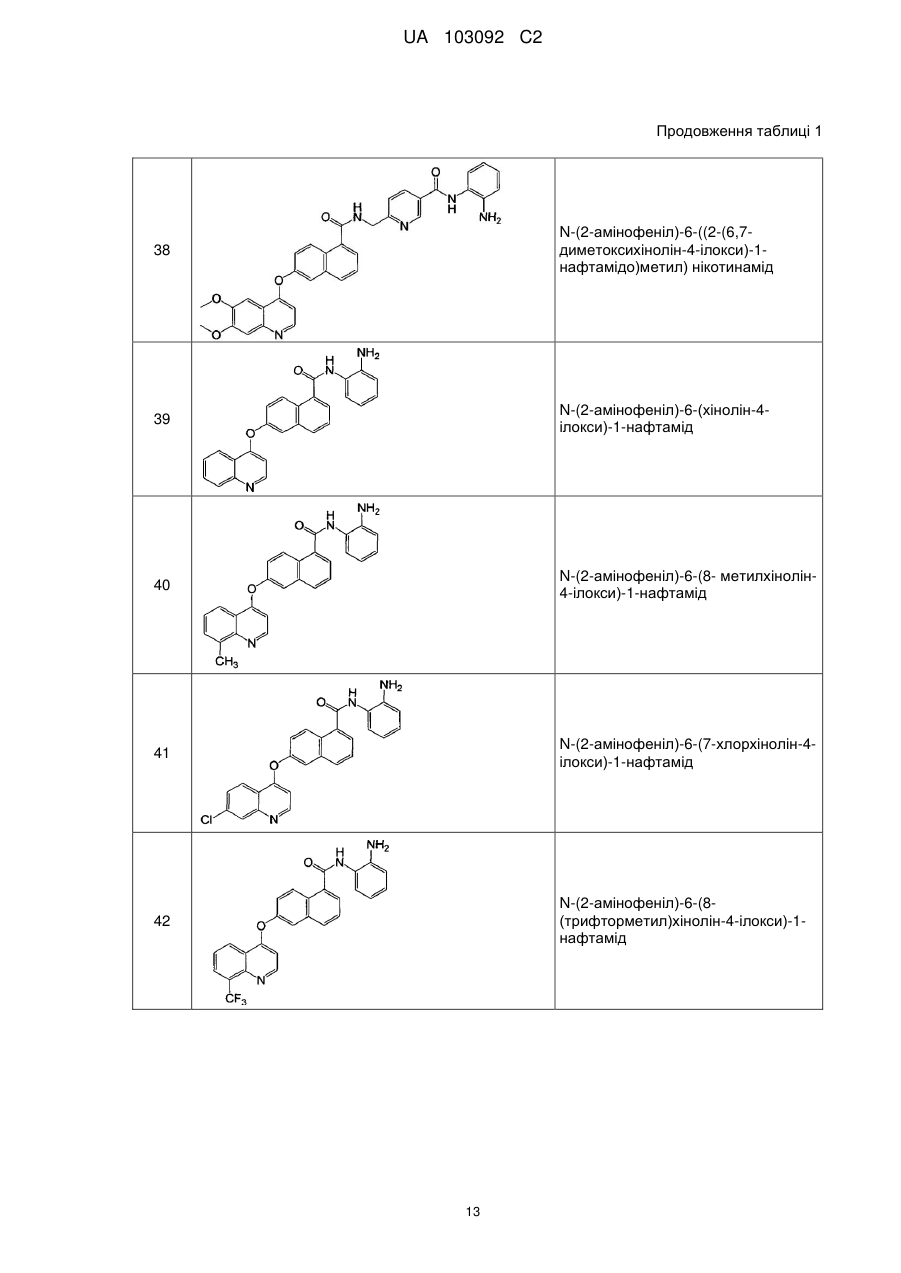
Похідні нафталінкарбоксаміду як інгібітори протеїнкінази і гістондеацетилази, спосіб їх отримання і застосування
Номер патенту: 103092
Опубліковано: 10.09.2013
Автори: Лу Сяньпін, Юй Цзиньді, Шань Сун, Лі Чжибінь, Нін Чжицян
Формула / Реферат
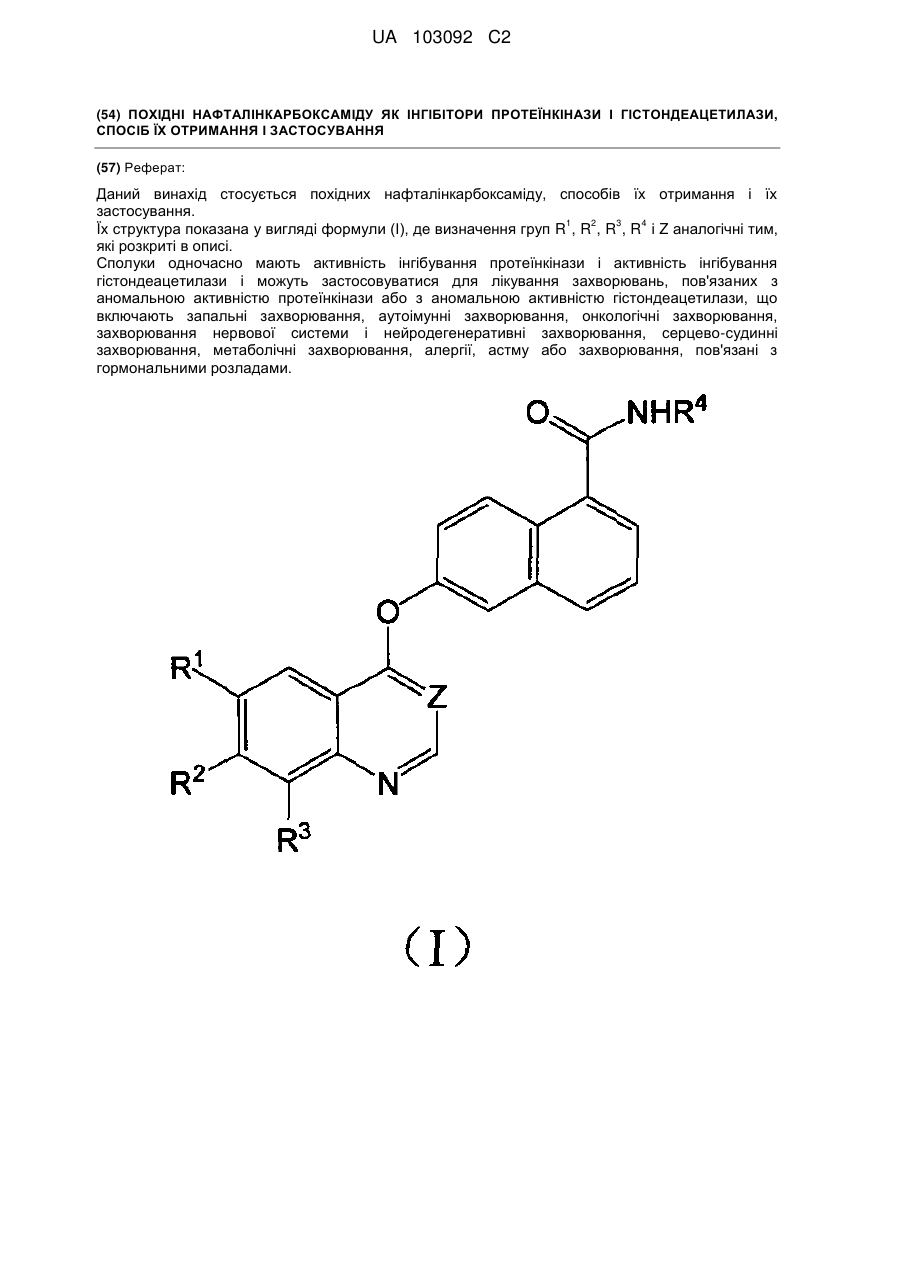
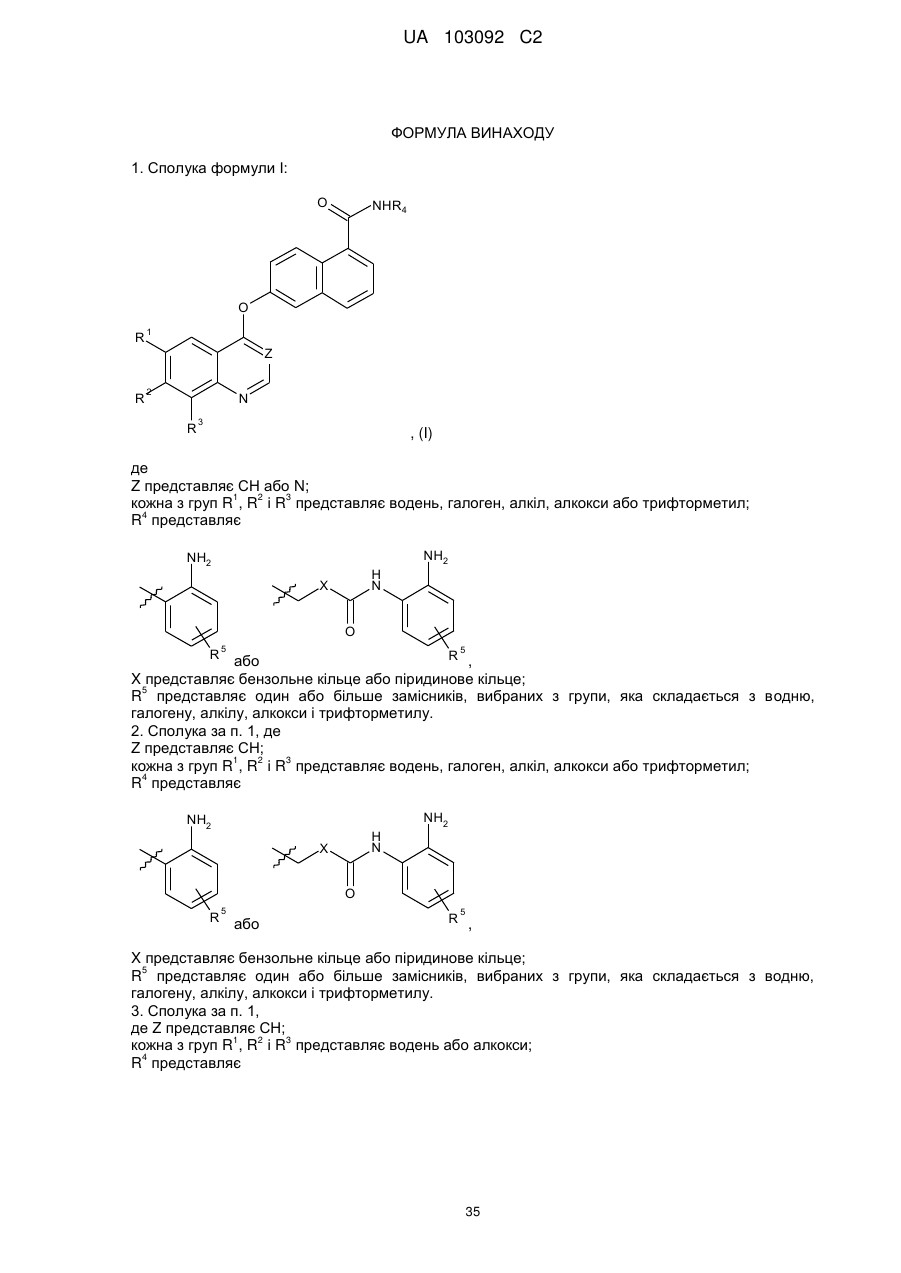
1. Сполука формули І:
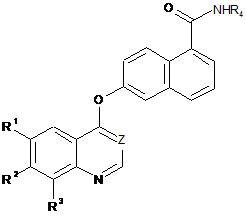 , (I)
, (I)
де
Z представляє СН або N;
кожна з груп R1, R2 і R3 представляє водень, галоген, алкіл, алкокси або трифторметил;
R4 представляє
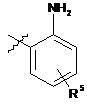 або
або 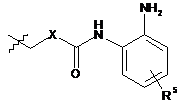 ,
,
X представляє бензольне кільце або піридинове кільце;
R5 представляє один або більше замісників, вибраних з групи, яка складається з водню, галогену, алкілу, алкокси і трифторметилу.
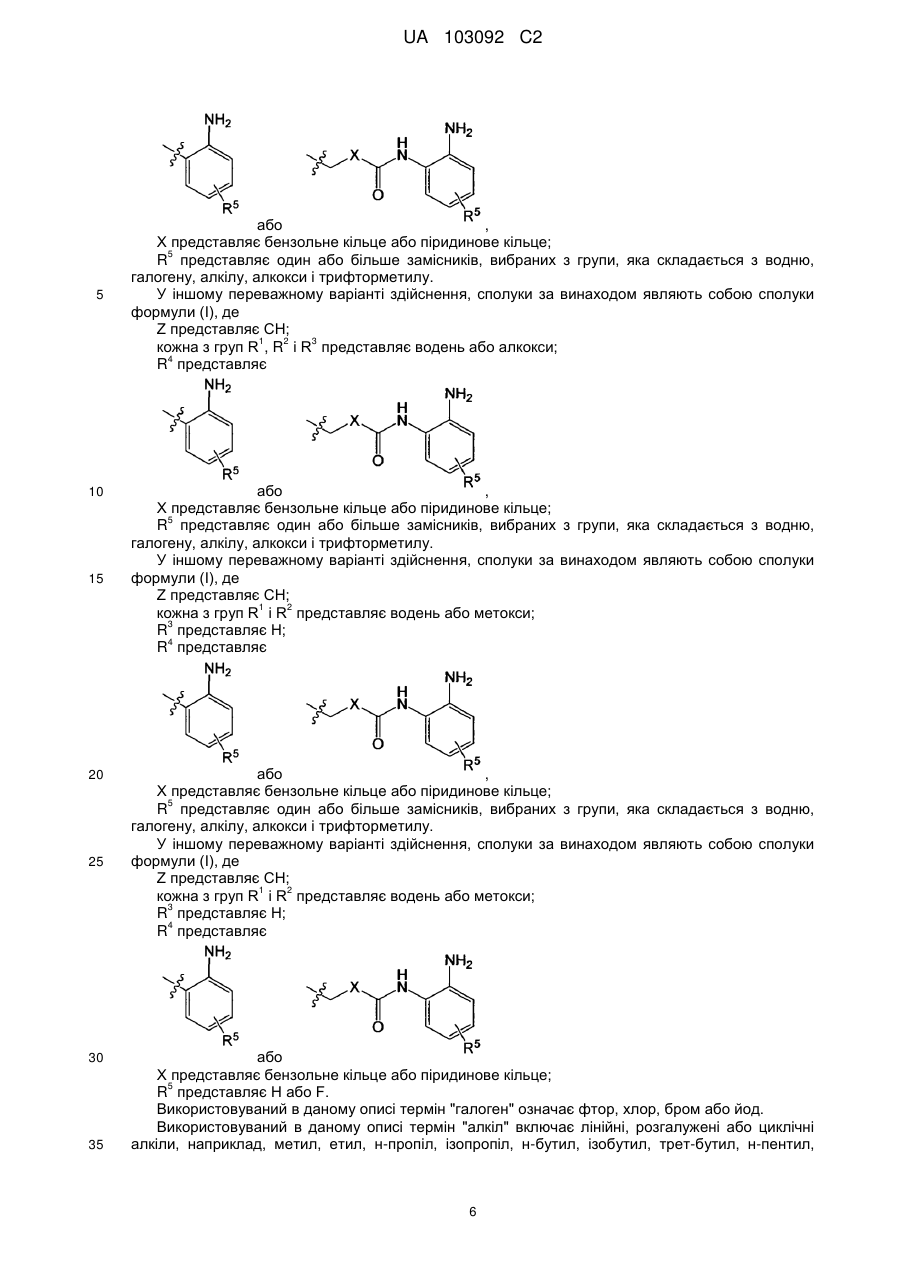
2. Сполука за п. 1, де
Z представляє СН;
кожна з груп R1, R2 і R3 представляє водень, галоген, алкіл, алкокси або трифторметил;
R4 представляє
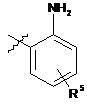 або
або  ,
,
X представляє бензольне кільце або піридинове кільце;
R5 представляє один або більше замісників, вибраних з групи, яка складається з водню, галогену, алкілу, алкокси і трифторметилу.
3. Сполука за п. 1,
де Z представляє СН;
кожна з груп R1, R2 і R3 представляє водень або алкокси;
R4 представляє
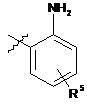 або
або  ,
,
X представляє бензольне кільце або піридинове кільце;
R5 представляє один або більше замісників, вибраних з групи, яка складається з водню, галогену, алкілу, алкокси і трифторметилу.
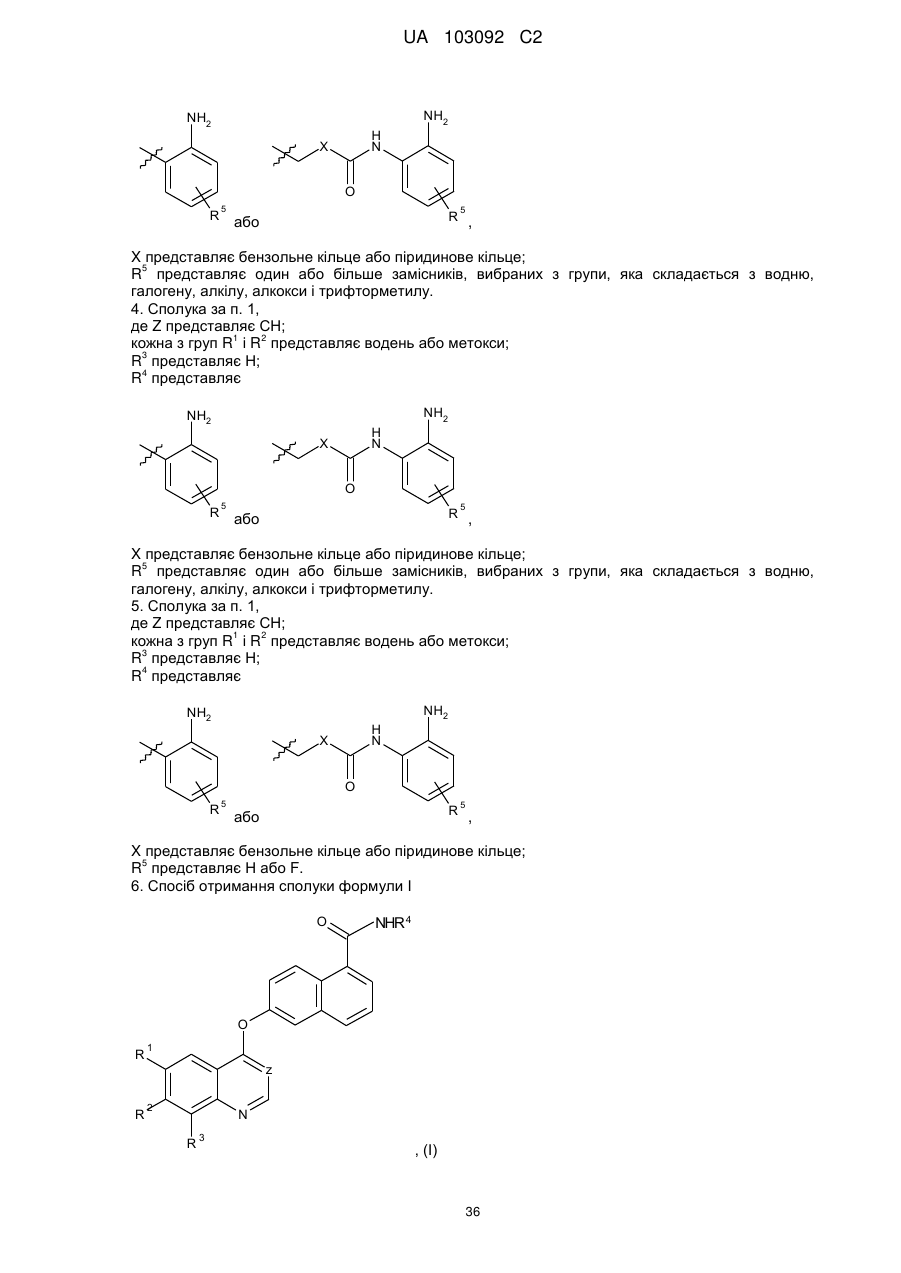
4. Сполука за п. 1,
де Z представляє СН;
кожна з груп R1 і R2 представляє водень або метокси;
R3 представляє Н;
R4 представляє
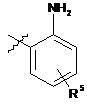 або
або  ,
,
X представляє бензольне кільце або піридинове кільце;
R5 представляє один або більше замісників, вибраних з групи, яка складається з водню, галогену, алкілу, алкокси і трифторметилу.
5. Сполука за п. 1,
де Z представляє СН;
кожна з груп R1 і R2 представляє водень або метокси;
R3 представляє Н;
R4 представляє
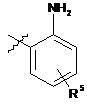 або
або  ,
,
X представляє бензольне кільце або піридинове кільце;
R5 представляє Н або F.
6. Спосіб отримання сполуки формули І
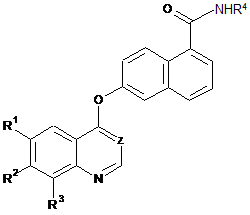 , (І)
, (І)
де
Z представляє СН або N;
кожна з груп R1, R2 і R3 представляє водень, галоген, алкіл, алкокси або трифторметил;
R4 представляє
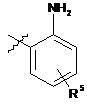 або
або  ,
,
X представляє бензольне кільце або піридинове кільце;
R5 представляє один або більше замісників, вибраних з групи, яка складається з водню, галогену, алкілу, алкокси і трифторметилу;
в якому здійснюють взаємодію
сполуки формули (II)
 (II)
(II)
із сполукою формули (III)
![]() (ІІI)
(ІІI)
в присутності органічного розчинника і пептидного конденсуючого агента з утворенням сполуки формули (І).
7. Спосіб за п. 6, де вказаний пептидний конденсуючий агент вибирають з групи, яка складається з 1-етил-3-(3-диметиламінопропіл)карбодііміду (EDC), N,N'-дициклогексилкарбодііміду (DCC) і N,N'-карбонілдіімідазолу (CDI).
8. Спосіб за п. 6, де вказаний органічний розчинник вибирають з групи, яка складається з бензолу, толуолу, тетрагідрофурану, 1,4-діоксану, дихлорметану, хлороформу і N,N-диметилформаміду.
9. Фармацевтичний препарат для лікування захворювань, пов'язаних з аномальною активністю протеїнкінази або аномальною активністю гістондеацетилази, що містить сполуку формули (І) за п. 1 і фармацевтично прийнятний носій, ексципієнт або розріджувач.
10. Фармацевтичний препарат за п. 9 у формі таблетки, капсули, порошку, сиропу, розчину, суспензії, ін'єкції або мазі.
11. Застосування сполуки за п. 1 для отримання лікарського засобу для лікування запальних захворювань, аутоімунних захворювань, онкологічних захворювань, захворювань нервової системи і нейродегенеративних захворювань, алергій, астми, серцево-судинних захворювань і метаболічних захворювань або захворювань, пов'язаних з гормональними розладами.
12. Застосування фармацевтичного препарату за п. 9 для отримання лікарського засобу для лікування запальних захворювань, аутоімунних захворювань, онкологічних захворювань, захворювань нервової системи і нейродегенеративних захворювань, алергій, астми, серцево-судинних захворювань і метаболічних захворювань або захворювань, пов'язаних з гормональними розладами.
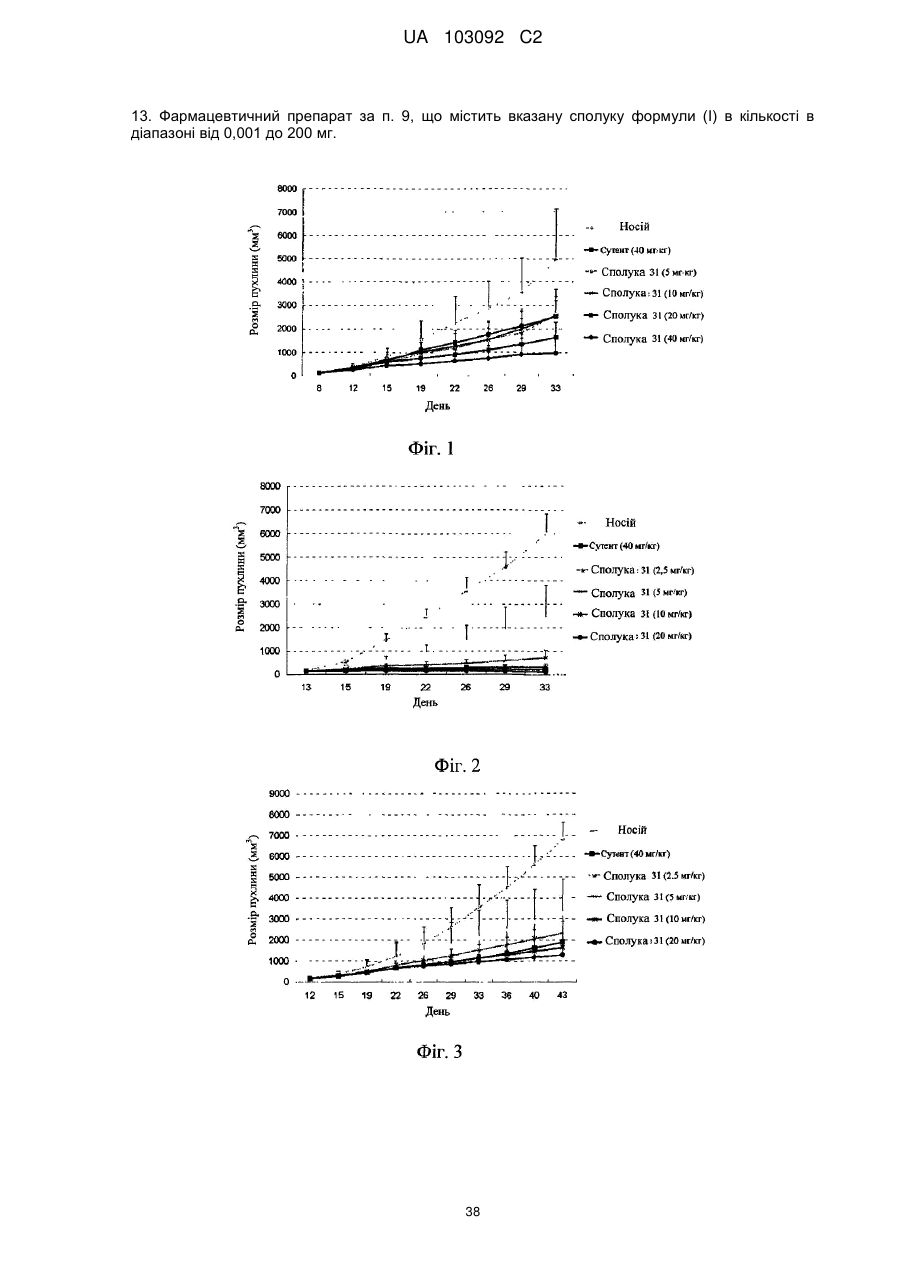
13. Фармацевтичний препарат за п. 9, що містить вказану сполуку формули (І) в кількості в діапазоні від 0,001 до 200 мг.
Текст
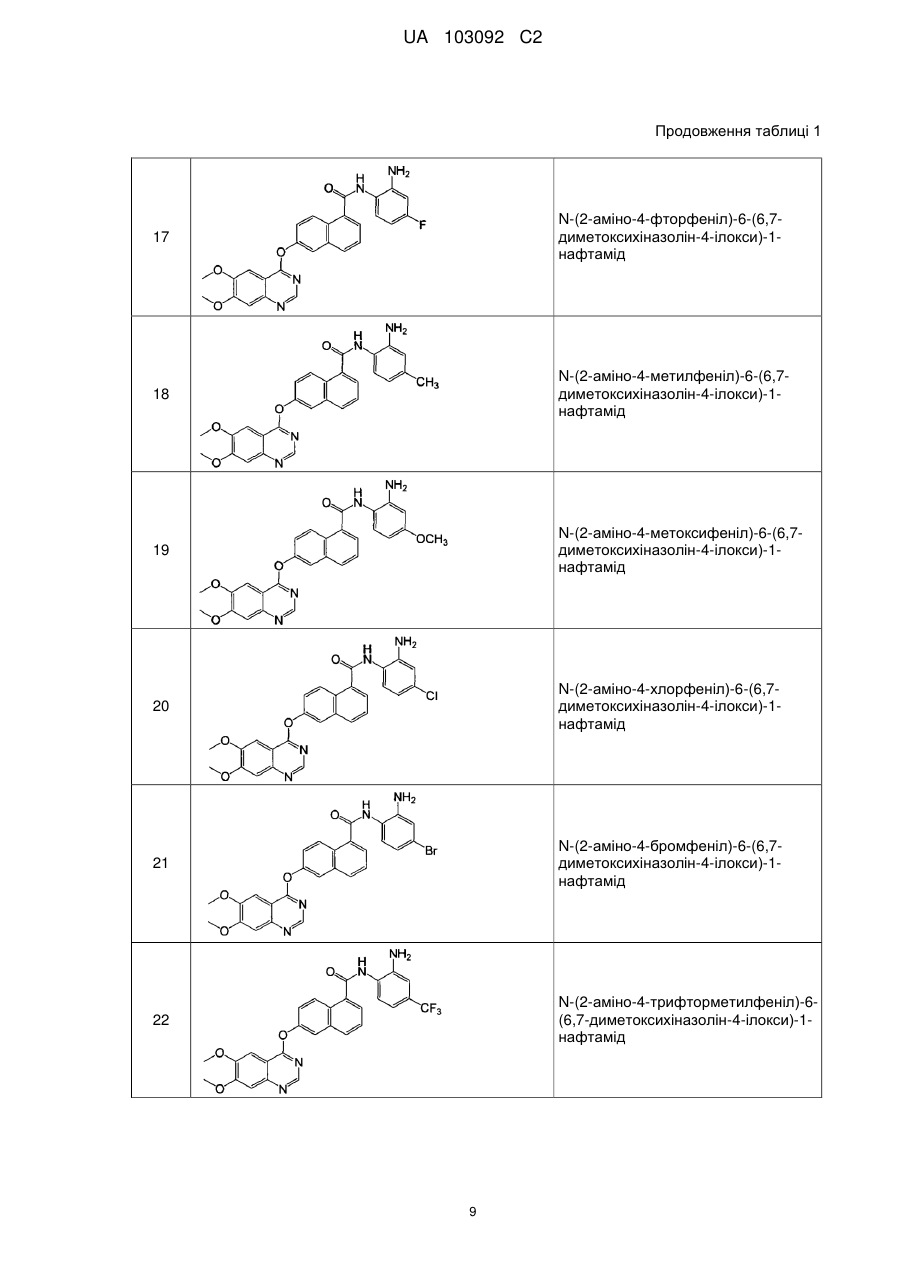
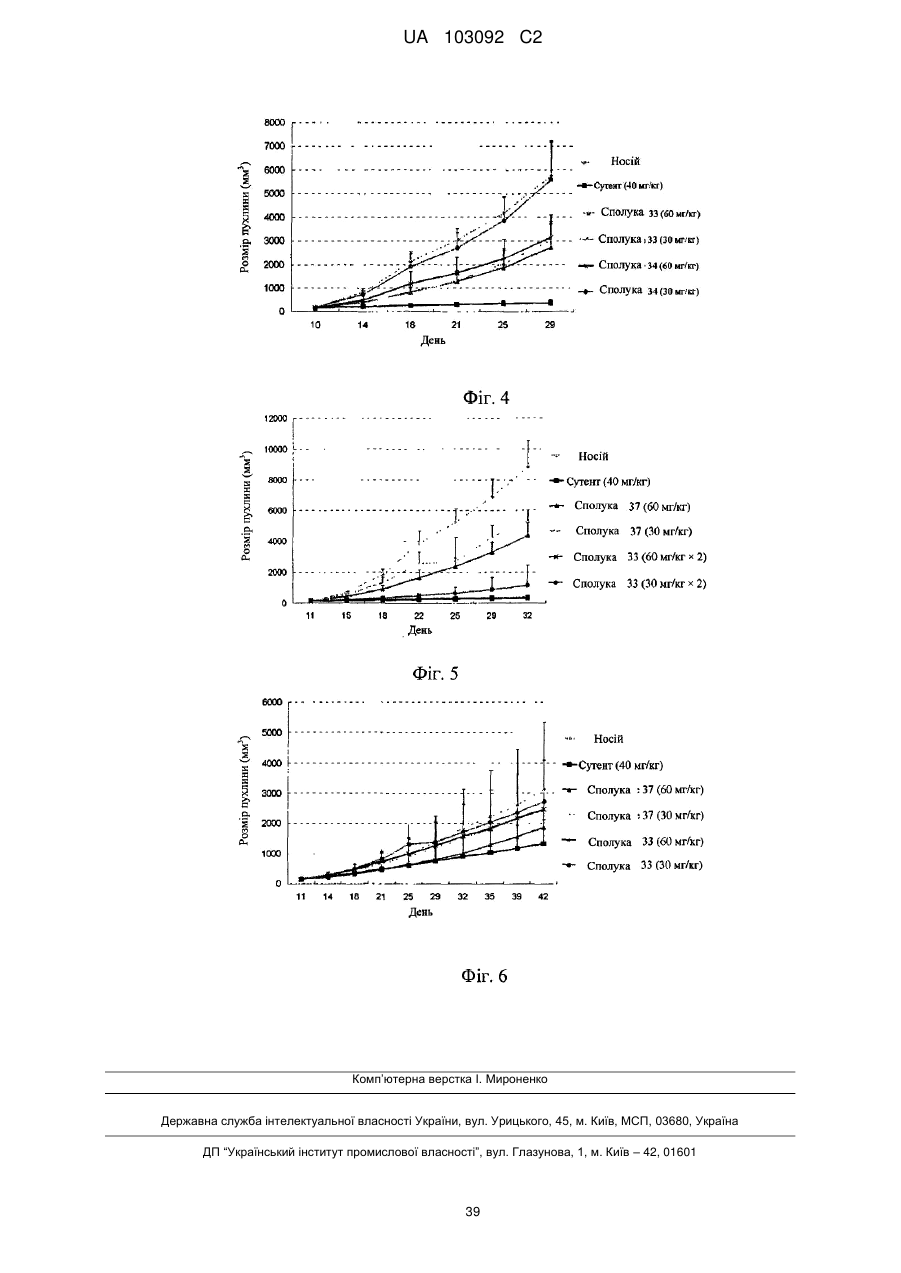
Реферат: Даний винахід стосується похідних нафталінкарбоксаміду, способів їх отримання і їх застосування. 1 2 3 4 Їх структура показана у вигляді формули (І), де визначення груп R , R , R , R і Z аналогічні тим, які розкриті в описі. Сполуки одночасно мають активність інгібування протеїнкінази і активність інгібування гістондеацетилази і можуть застосовуватися для лікування захворювань, пов'язаних з аномальною активністю протеїнкінази або з аномальною активністю гістондеацетилази, що включають запальні захворювання, аутоімунні захворювання, онкологічні захворювання, захворювання нервової системи і нейродегенеративні захворювання, серцево-судинні захворювання, метаболічні захворювання, алергії, астму або захворювання, пов'язані з гормональними розладами. UA 103092 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь, якої стосується винахід Даний винахід стосується похідних нафталінкарбоксаміду (нафтаміду), які мають активність інгібування протеїнкіназ і інгібування гістондеацетилаз, способів їх отримання і їх клінічного застосування при лікуванні захворювань, пов'язаних з порушенням активності протеїнкінази і порушенням активності гістондеацетилази. Попередній рівень техніки Протеїнкінази являють собою сімейство ферментів, які каталізують фосфорилування білків, зокрема, гідроксигрупи певних залишків тирозину, серину і треоніну в білках. Протеїнкінази відівідіграють ключову роль в регуляції широкої різноманітності клітинних процесів, включаючи метаболізм, клітинну проліферацію, клітинну диференціацію, виживання клітин, реакцію організму хазяя на фактори навколишнього середовища, імунну відповідь і ангіогенез. Багато які захворювання пов'язані з патологічними клітинними реакціями, що запускаються регуляцією протеїнкінази. Ці захворювання включають запальні захворювання, аутоімунні захворювання, онкологічні захворювання, захворювання нервової системи і нейродегенеративні захворювання, серцево-судинні захворювання, метаболічні захворювання, алергії, астма і захворювання, пов'язані з гормональними порушеннями (Tan, S-L., 2006, J. Immunol., 176: 2872-2879; Healy, А. et al., 2006, J. Immunol., 177: 1886-1893; Salek-Ardakani, S. et al., 2005, J. Immunol., 175: 76357641; Kim, J. et al., 2004, J. Clin. Invest., 114: 823-827). Тому робилися значні зусилля для ідентифікації інгібіторів протеїнкінази, які ефективні як терапевтичні засоби проти вказаних захворювань. Протеїнкінази можуть звичайно розподілятися на два класи, протеїнтирозинкінази (PTK) і серин-треонінкінази (STK). Протеїнтирозинкінази (PTK) можуть розподілятися на два класи: нетрансмембранні тирозинкінази і трансмембранні рецептори факторів росту, які мають тирозинкіназну активність (RTK). У цей час були ідентифіковані щонайменше 19 виразних підродин RTK, такі як рецептор епідермального фактора росту (EGFR), рецептор судинного ендотеліального фактора росту (VEGFR), рецептор тромбоцитарного фактора росту (PDGFR) і рецептор фактора росту фібробластів (FGFR). Сімейство рецептора епідермального фактора росту (EGFR) включає чотири трансмембранних рецепторів факторів росту, які мають тирозинкіназну активність: HER1, HER2, HER3 і HER4. Зв'язування специфічного набору лігандів рецептора сприяє димеризації EGFR і приводить до аутофосфорилування рецепторів на залишках тирозину (Arteaga, C-L., 2001, Curr. Opin. Oncol., 6: 491-498). Після аутофосфосфорилування рецептора, стають активованими декілька шляхів передачі сигналів EGFR, що знаходяться нижче по ходу транскрипції. Шляхи передачі сигналів EGFR зв'язували з неопластичними процесами, включаючи розвиток клітинного циклу, інгібування апоптозу, рухливість, інвазію і метастазування пухлинних клітин. Активація EGFR також стимулює судинний ендотеліальний фактор росту (VEGF), який являє собою первинний індуктор ангіогенезу (Petit, A-M. et al., 1997, Am. J. Pathol., 151: 1523-1530). В експериментальних моделях, разрегуляція опосередкованих EGFR шляхів передачі сигналів пов'язана з онкогенезом (Wikstrand, C-J. et al., 1998, J Natl Cancer Inst., 90: 799-800). Мутації, які ведуть до безперервної активації ампліфікації і надмірної експресії протеїнів EGFR, спостерігаються при багатьох пухлинах людини, включаючи пухлини молочних залоз, легень, яєчників і нирок. Дані мутації є такими, що визначають агресивність пухлин (Wikstrand, C-J. et al., 1998, J Natl Cancer Inst., 90: 799-800). Надмірна експресія EGFR часто спостерігається при недрібноклітинному раку легень (NSCLC). Активність EGFR може інгібуватися або блокуванням позаклітинного домену зв'язування ліганду з використанням анти-EGFR антитіл, або шляхом використання дрібних молекул, які інгібують тирозинкіназу EGFR, таким чином приводячи до інгібування компонентів шляху EGFR, які знаходяться нижче по ходу транскрипції (Mendelsohn, J., 1997, Clin. Can. Res., 3: 2707-2707). Судинний ендотеліальний фактор росту (VEGF) секретується майже всіма солідними пухлинами і пов'язаної з пухлиною стромою у відповідь на гіпоксію. Він високо специфічний для судинного ендотелію і регулює і проліферацію, і проникність судин. Надмірна експресія рівнів VEGF корелюється із збільшеною мікросудинною щільністю, рецидивом онкологічних захворювань і зменшеним виживанням (Parikh, A-A., 2004; Hematol. Oncol. Clin. N. Am., 18:951971). Існують 6 різних лігандів рецептора VEGF, з VEGF-A по -E і плацентарний фактор росту. Ліганди зв'язуються зі специфічними рецепторами на ендотеліальних клітинах, головним чином, VEGFR-2. Зв'язування VEGF-A з VEGFR-1 викликає міграцію ендотеліальних клітин. Зв'язування з VEGFR-2 викликає проліферацію, проникність і виживання ендотеліальних клітин. Вважається, що VEGFR-3 опосередковує лімфангіогенез. Зв'язування VEGF з рецепторами VEGFR-2 приводить до активації і аутофосфорилування внутрішньоклітинних доменів 1 UA 103092 C2 5 10 15 20 25 30 35 40 45 50 55 тирозинкінази, які далі запускають інші внутрішньоклітинні каскади процесів передачі сигналів (Parikh, A-A., 2004, Hematol. Oncol. Clin. N. Am., 18:951-971). Серин-треонінкінази (STK) є переважно внутрішньоклітинними, хоч існує декілька рецепторних кіназ типу STK. STK являють собою найпоширеніші форми цитозольних кіназ, які виконують свою функцію в частині цитоплазми, відмінній від цитоплазматичних органел і цитоскелету. Глікоген синтаза-кіназа-3 (GSK-3) являє собою серин-треонінпротеїнкіназу, яка складається з α- і β-ізоформ, кожна з яких кодується певними генами. Було виявлено, що GSK-3 фосфорилує і модулює активність ряду регуляторних білків. GSK-3 зв'язували з розвитком різних захворювань, включаючи цукровий діабет, хворобу Альцгеймера, розлади ЦНС, такий як маніакально-депресивний розлад і нейродегенеративні захворювання, і гіпертрофію кардіоміоцитів (Haq, et al., 2000, J. Cell Biol., 151: 117). Aurora-2 являє собою серин-треонінпротеїнкіназу, яку зв'язували з онкологічними захворюваннями у людей, такими як рак ободової кишки, рак молочної залози і інші солідні пухлини. Вважають, що дана кіназа бере участь в фосфорилуванні білків, які регулюють клітинний цикл. Зокрема, Aurora-2 може відігравати роль в регуляції точної сегрегації хромосом під час мітозу. Порушення регуляції клітинного циклу може привести до клітинної проліферації і інших патологічних процесів. Було виявлено, що в тканини раку ободової кишки людини, білок Aurora2 надмірно експресований (Schumacher, et al., 1998, J. Cell Biol., 143: 1635-1646; Kimura et al., 1997, J. Biol. Chem., 272: 13766-13771). Циклінзалежні кінази (CDK) являють собою серин-треонінпротеїнкіназу, яка регулює розподіл клітин ссавців. До даного часу були ідентифіковані 9 субодиниць кіназ (CDK 1-9). Кожна кіназа асоціюється з певним регуляторним партнером і разом становить активну каталітичну частину. Неконтрольована проліферація являє собою відмітну ознаку злоякісних клітин, і порушення регуляції функції CDK відбувається з високою частотою при багатьох важливих солідних пухлинах. CDK2 і CDK4 представляють особливий інтерес, тому що їх активність часто порушується при широкій різноманітності онкологічних захворювань людей. Raf-кіназа, що знаходиться нижче по ходу транскрипції ефектор онкопротеїну ras, являє собою ключовий медіатор шляхів трансдукції сигналів від клітинної поверхні до ядра клітини. Інгібування raf-кінази корелювалось in vitro і in vivo з інгібуванням зростання різноманітних типів пухлин людини (Monia et al., 1996, Nat. Med., 2: 668-675). Інші серин-треонінкінази включають протеїнкінази А, В і C. Указані кінази, відомі як PKA, PKB і PKC, відіграють ключові ролі в шляхах трансдукції сигналів. Робилася велика кількість спроб ідентифікації невеликих молекул, які діють як інгібітори протеїнкіназ, які можна застосовувати при лікуванні захворювань, пов'язаних з аномальною активністю протеїнкіназ. Наприклад, циклічні сполуки (патент США № 7151096), біциклічні сполуки (патент США № 7189721), трициклічні сполуки (патент США № 7132533), (2-оксиндол-3метиліден), похідні оцтової кислоти (патент США № 7214700), похідні 3-(4-амідопірол-2ілметиліден)-2-індолінону (патент США № 7179910), конденсовані похідні піразолу (патент США № 7166597), сполуки амінофуразану (патент США № 7157476), пірол-заміщені 2-індолінонові сполуки (патент США № 7125905), триазольні сполуки (патент США № 7115739), піразоліламінзаміщені хіназолінові сполуки (патент США № 7098330) і індазольні сполуки (патент США № 7041687) - всі були описані як інгібітори протеїнкінази. Декілька інгібіторів протеїнкінази, таких як глівек, сутен і сорафеніб, були успішно затверджені FDA (Адміністрацією харчових продуктів і лікарських засобів США) для протиракової терапії. Їх клінічне застосування продемонструвало явні переваги перед існуючими видами хіміотерапевтичного лікування, стимулюючи інтереси до інновації, які зберігаються, основаних на механізмах способів лікування і удосконалення хімічних каркасів для виявлення нових сполук з чудовою пероральною біодоступністю, кращою протипухлинною активністю і більш низькою токсичністю. Короткий виклад суті винаходу Однією метою даного винаходу є отримання певних похідних нафтаміду, які здатні селективно інгібувати протеїнкінази і гістондеацетилази. Іншою метою даного винаходу є розробка способів отримання вказаних сполук. Іншою метою даного винаходу є забезпечення клінічного застосування вказаних сполук при лікуванні захворювань, пов'язаних з аномальною активністю протеїнкіназ і аномальною активністю гістондеацетилаз. 2 UA 103092 C2 5 10 15 20 25 30 35 40 45 50 55 60 Короткий опис креслень Фіг. 1 графічно ілюструє протипухлинну активність сполуки 31 у голої миші з трансплантованою пухлиною раку легень людини A549, де Vehicle представляє носій, Sutent представляє існуючий лікарський засіб сунитиніб і comp 31 представляє сполуку 31. Фіг. 2 графічно ілюструє протипухлинну активність сполуки 31 у голої миші з трансплантованою пухлиною раку ободової кишки людини HCT-8, де Vehicle представляє носій, Sutent представляє існуючий лікарський засіб сунітиніб і comp 31 представляє сполуку 31. Фіг. 3 графічно ілюструє протипухлинну активність сполуки 31 у голої миші з трансплантованою пухлиною раку печінки людини SSMC7721, де Vehicle представляє носій, Sutent представляє існуючий лікарський засіб сунітиніб і comp 31 представляє сполуку 31. Фіг. 4 графічно ілюструє протипухлинну активність сполуки 33 і сполуки 34 у голої миші з трансплантованою пухлиною раку ободової кишки людини HCT-8, де Vehicle представляє носій, Sutent представляє існуючий лікарський засіб сунітиніб, comp 33 представляє сполуку 33, і com 34 представляє сполуку 34. Фіг. 5 графічно ілюструє протипухлинну активність сполуки 33 і сполуки 37 у голої миші з трансплантованою пухлиною раку ободової кишки людини HCT-8, де Vehicle представляє носій, Sutent представляє існуючий лікарський засіб сунітиніб, comp 33 представляє сполуку 33, і com 37 представляє сполуку 37. Фіг. 6 графічно ілюструє протипухлинну активність сполуки 33 і сполуки 37 у голої миші з трансплантованою пухлиною раку печінки людини SSMC7721, де Vehicle представляє носій, Sutent представляє існуючий лікарський засіб сунітиніб, comp 33 представляє сполуку 33, і com 37 представляє сполуку 37. Детальний опис винаходу Білки гістондеацетилази (HDAC) відіграють ключову роль в регуляції генної експресії in vivo шляхом зміни доступності транскрипційних факторів для геномної ДНК. Зокрема, білки HDAC видаляють ацетильну групу залишків ацетиллізину на гістонах, що може привести до нуклеосомального ремоделювання (Grunstein, M., 1997, Nature, 389: 349-352). Білки HDAC, в зв'язку з їх керівною роллю в генній експресії, пов'язані з різноманітними клітинними явищами, включаючи регуляцію клітинного циклу, клітинну проліферацію, диференціацію, перепрограмування генної експресії і розвиток онкологічних захворювань (Ruijter, A-J-M., 2003, Biochem. J., 370: 737-749; Grignani, F., 1998, Nature, 391: 815-818; Lin, R-J., 1998, 391: 811-814; Marks, P-A., 2001, Nature Reviews Cancer, 1: 194). Патологічне деацетилування, викликане порушенням регуляції деацетилування гістонів, зв'язували з різними захворюваннями, такими як синдром Рубінштейна-Тейбі, синдром крихкої X-хромосоми, нейродегенеративні захворювання, серцево-судинні і метаболічні захворювання, ревматоїдне захворювання, лейкоз і інші види онкологічних захворювань (Langley В et al., 2005, Current Drug Targets-CNS & Neurological Disorders, 4: 41-50). В експериментах було продемонстровано, що у людей і тварин інгібітори HDAC зменшують зростання пухлин, включаючи рак легень, рак шлунка, рак молочної залози, рак передміхурової залози, лімфому і подібне (Dokmanovic, M., 2005, J. Cell Biochenm., 96: 293-304). HDAC ссавців можна розділити на три класи відповідно до гомології послідовності. Клас I складається з білків, подібних до дріжджової Rpd3 (HDAC 1, 2, 3, 8 і 11). Клас II складається з білків, подібних до дріжджової HDA1 (HDAC 4, 5, 6, 7, 9 і 10). Клас III складається з білків, подібних до дріжджової SIR2 (SIRT 1, 2, 3, 4, 5, 6 і 7). Активність HDAC1 пов'язана з клітинною проліферацією, характерною ознакою онкологічного захворювання. Зокрема, клітини ссавців з нокдауном експресії HDAC1 з використанням siРНК (малої інтерферуючої РНК) мали антипроліферативну дію (Glaser, K-B., 2003, Biochem. Biophys. Res. Comm., 310: 529-536). Хоч у миші з нокдауном HDAC1 була ембріональна летальна мутація, отримані стовбурові клітини виявляли змінене клітинне зростання (Lagger, G., 2002, EMBO J., 21: 2672-2681). Мишачі клітини, які надмірно експресують HDAC1, продемонстрували подовження фаз G2 і M і знижену швидкість зростання (Bartl. S., 1997, Mol. Cell Biol., 17: 5033-5043). Тому опубліковані дані мають на увазі участь HDAC1 в регуляції клітинного циклу і проліферації клітин. HDAC2 регулює експресію багатьох плідних міокардіальних білкових ізоформ. Недостатність HDAC2 або хімічне інгібування гістондеацетилази можуть запобігти повторній експресії фетальних генів і послаблюють серцеву гіпертрофію. Стійкість до гіпертрофії пов'язана зі збільшеною експресією гена, що кодує інозитол поліфосфат-5-фосфатазу f (Inpp5f), приводячи до активації глікоген синтази кінази 3β (Gsk3β) за допомогою інактивації прото-онкогену тимоми (Akt) і 3-фосфоінозитидзалежної протеїнкінази-1 (Pdk1). Навпаки, у HDAC2 трансгенних мишей була посилена гіпертрофія, пов'язана з інактивованою Gsk3β. Хімічне інгібування активованої 3 UA 103092 C2 5 10 15 20 25 30 35 40 45 50 55 60 Gsk3β дозволило дорослим з недостатністю HDAC2 стати чутливою до гіпертрофічної стимуляції. Дані результати свідчать про те, що HDAC2 являє собою важливу молекулярну мішень інгібіторів HDAC в серце і що і HDAC2, і Gsk3β являють собою компоненти регуляторного шляху, забезпечуючи привабливу терапевтичну мішень для лікування серцевої гіпертрофії і серцевої недостатності (Trivedi, C-M., 2007, Nat. Med, . 13: 324-331). HDAC3 максимально експресовані в проліферуючих клітинах крипт в здоровому кишечнику. Сайленсинг експресії HDAC3 в лініях клітин раку ободової кишки приводив до інгібування зростання клітин, зменшення виживання клітин і збільшеного апоптозу. Подібні результати спостерігалися для HDAC2 і, в меншій мірі, для HDAC1. Сайленсинг гена HDAC3 також селективно викликав експресію лужної фосфатази, маркера дозрівання клітин ободової кишки. Надекспресія HDAC3 інгібувала базальну і викликану бутиратом транскрипцію p21, тоді як сайленсинг HDAC3 стимулював промоторну активність і експресію p21. Вказані дані ідентифікують HDAC3 як ген, регуляція якого порушується при раку ободової кишки людини і як новий регулятор дозрівання клітин ободової кишки і експресії p21 (Wilson, A-J., 2006, J. Biol. Chem., 281: 13548-13558). HDAC6 являє собою підтип сімейства HDAC, який деацетилує альфа-тубулін і збільшує рухливість клітин. З використанням кількісної полімеразної ланцюгової реакції із зворотною транскрипцією і вестерном-блотингу на дев'яти лініях клітин, отриманих з плоскоклітинної карциноми ротової порожнини (OSCC) і нормальних кератиноцитів ротової порожнини (NOK), мРНК HDAC6 і експресія білків звичайно стимулювалися у всіх клітинних лініях, в порівнянні з NOK. Аналіз імунофлюоресценції виявив білок HDAC6 в цитоплазмі ліній клітин OSCC. Подібно до ліній клітин OSCC, стимуляція HDAC6 була очевидна по рівню і мРНК (74 %), і білка (51 %) первинних пухлин OSCC людини. Серед аналізованих клінічних змінних величин було виявлено, що клінічна стадія пухлини пов'язана зі станами експресії HDAC6. Аналіз указав на значну відмінність рівня експресії HDAC6 між пухлинами на ранній стадії (стадії I і II) і на пізніх стадіях (стадії III і IV) (Р=0,014). Дані результати свідчать про те, що експресія HDAC6 може корелювати з агресивністю пухлини і надають ключі для планування нових видів лікування (Sakuma, Т., 2006, Int. J. Oncol., 29: 117-124). Епігенетичний сайленсинг функціональних хромосом HDAC являє собою один з основних механізмів, що відбуваються при багатьох патологічних процесах, при яких пов'язані з функцією гени репресуються або перепрограмовуються активністю HDAC, що веде до втрати фенотипів при регуляції кінцевої диференціації, дозрівання і зростання і до втрати функціональної активності тканин. Наприклад, гени-супресори пухлин часто піддаються сайленсингу під час розвитку онкологічних захворювань, і інгібітор HDAC може придушувати експресію цих генівсупресорів пухлин, приводячи до інгібування зростання і диференціації клітин (Glaros S et al., 2007, Oncogene June 4, друкується; Mai, А, et al., 2007, Int J. Biochem Cell Bio., April 4, друкується; Vincent A. et al., 2007, Oncogene, April 30, друкується; неопубліковані дані заявників). Репресія структурних генів, таких як FXN при атаксії Фрідріха і SMN при спинномозковій м'язовій атрофії, може усуватися інгібіторами HDAC, що приводить до реекспресії генів FXN і SMN і поновленню їх функцій в тканинах (Herman D et al., 2006, Nature Chemical Biology, 2(10): 551-8; Avila AM et al., 2007, J Clinic Investigation, 117(3): 659-71; de Bore J, 2006, Tissue Eng. 12(10): 2927-37). Індукція експресії всього сімейства генів MHC II за допомогою перепрограмування "гарячої плями" HDAC в хромосомі 6p21-22 інгібітором HDAC додатково розширює епігенетичну модуляцію імунного розпізнавання і імунної відповіді (Gialitakis M et al., 2007, Nucleic Acids Res., 34(1);765-72). Були ідентифіковані декілька класів інгібіторів HDAC, включаючи (1) коротколанцюжкові жирні кислоти, наприклад, бутират і фенілбутират; (2) органічні гідроксамові кислоти, наприклад, субероїланілідгідроксамову кислоту (SAHA) і трихостатин А (TSA); (3) циклічні тетрапептиди, що містять частину у вигляді 2-аміно-8-оксо-9,10-експоксидеканоїлу (AOE), наприклад, трапоксин і НС-токсин; (4) циклічні тетрапептиди без частини у вигляді AOE, наприклад, апіцидин і FK228; і (5) бензаміди, наприклад, MS-275 (EP0847992A1, US2002/0103192A1, WO02/26696A1, WO01/70675A2, WO01/18171A2). Хоч HDAC успадкував дуже перспективні біологічні ролі як лікарська мішень, успіх препарату SAHA, що випускається компанією Merck, в цей час обмежується лише лікуванням шкірної Т-клітинної лімфоми, в той час як не було повідомлень про високу ефективність даного лікування при основних солідних пухлинах. Тому ще є потреба у виявленні нових сполук з більш високою інгібуючою активністю відносно HDAC і активністю проти онкологічних захворювань, з більш селективним інгібуванням різних підтипів HDAC і більш низькою токсичністю. Улюбленою метафорою розробників лікарських засобів проти онкологічних захворювань протягом тривалого часу була прицільна терапія. Була надія на створення лікарського засобу, 4 UA 103092 C2 5 10 15 20 25 30 35 який може вражати пухлинні клітини як одну специфічну мішень, знищувати пухлинні клітини, в той же час нормальні клітини залишаючи непошкодженими. Однак злоякісні клітини можуть використовувати множинні біологічні пускові механізми і шляхи для зростання і поширення по всьому організму. Ураження їх у вигляді однієї мішені також викличе їх перегрупування і перерозподіл по нових шляхах зростання. Усвідомлення цього привело до розробки способів комбінованої прицільної терапії, які стають новою парадигмою для лікування онкологічних захворювань. У цей час розробляються декілька інгібіторів кінази, що мають множину мішеней, і два з них сорафеніб і сутен, вже затверджені в США. Наприклад, сорафеніб, розроблений компанією Bayer Pharmaceuticals, являє собою перший лікарський препарат, націлений і на шлях RAF/MEK/ERK (що бере участь в клітинній проліферації) і каскаді передачі сигналів VEGFR2/PDGFRβ (що бере участь в ангіогенезі). Цей лікарський препарат був уперше затверджений в грудні 2005 р. з приводу запущеного раку нирок. Однак дані прицільні терапії, хоч і є ефективними проти деяких солідних пухлин, але далекі від задоволення з точки зору досягнення кращої ефективності при збереженні прийнятних побічних ефектів, пов'язаних зі способами лікування проти інших солідних пухлин. Даний винахід стосується нових хімічних сполук, які комбінують антиангіогенну і антипроліфератину активність інгібіторів RTK разом з індукуючою диференціацію, імуномодулюючою, зупиняючою клітинний цикл і індукуючою апоптоз активністю інгібіторів HDAC, для досягнення кращої ефективності проти солідних пухлин, одночасно долаючи побічні ефекти, такі як гіпертензія, подовження інтервалу QT на ЕКГ, регресія щитовидної залози, висип і зміна кольору шкіри і болі, пов'язані з інгібіторами RTK, які є в цей час на ринку. Зокрема, даний винахід стосується сполуки, яка має структуру, представлену формулою (I): , включаючи її вільну форму, сольову форму, енантіомер, діастереомер або гідрат, де Z представляє CH або N; 1 2 3 кожна з груп R , R і R представляє водень, галоген, алкіл, алкокси або трифторметил; 4 R представляє або , X представляє бензольне кільце або піридинове кільце; 5 R представляє один або більше замісників, вибраних з групи, яка складається з водню, галогену, алкілу, алкокси і трифторметилу. У переважному варіанті здійснення, сполуки за даним винаходом являють собою сполуки формули (I), де Z представляє CH; 1 2 3 кожна з груп R , R і R представляє водень, галоген, алкіл, алкокси або трифторметил; 4 R представляє 5 UA 103092 C2 5 10 15 20 25 30 35 або , X представляє бензольне кільце або піридинове кільце; 5 R представляє один або більше замісників, вибраних з групи, яка складається з водню, галогену, алкілу, алкокси і трифторметилу. У іншому переважному варіанті здійснення, сполуки за винаходом являють собою сполуки формули (I), де Z представляє CH; 1 2 3 кожна з груп R , R і R представляє водень або алкокси; 4 R представляє або , X представляє бензольне кільце або піридинове кільце; 5 R представляє один або більше замісників, вибраних з групи, яка складається з водню, галогену, алкілу, алкокси і трифторметилу. У іншому переважному варіанті здійснення, сполуки за винаходом являють собою сполуки формули (I), де Z представляє CH; 1 2 кожна з груп R і R представляє водень або метокси; 3 R представляє Н; 4 R представляє або , X представляє бензольне кільце або піридинове кільце; 5 R представляє один або більше замісників, вибраних з групи, яка складається з водню, галогену, алкілу, алкокси і трифторметилу. У іншому переважному варіанті здійснення, сполуки за винаходом являють собою сполуки формули (I), де Z представляє CH; 1 2 кожна з груп R і R представляє водень або метокси; 3 R представляє Н; 4 R представляє або X представляє бензольне кільце або піридинове кільце; 5 R представляє Н або F. Використовуваний в даному описі термін "галоген" означає фтор, хлор, бром або йод. Використовуваний в даному описі термін "алкіл" включає лінійні, розгалужені або циклічні алкіли, наприклад, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, н-пентил, 6 UA 103092 C2 5 10 15 20 ізопентил, н-гексил, ізогексил, циклопропіл, циклобутил, циклопентил, циклогексил і тому подібні. Використовуваний в даному описі термін "алкокси" означає групу, утворену приєднанням алкільного радикала до атома кисню, де атом кисню має здатність вільного зв'язування. Його приклади включають метокси, етокси, пропокси, бутокси, пентокси, ізопропокси, трет-бутокси, циклопропокси, циклогексилокси і тому подібні. Сполуки за даним винаходом можуть бути отримані таким чином: Сполуки формули (II) конденсується сполукою формули (III) для отримання сполуки (I). Реакція конденсації проводиться шляхом використання пептидного конденсуючого агента як каталізатора, такого як 1-етил-3-(3-диметиламінопропіл)карбодіімід (EDC), N, N'дициклогексилкарбодіімід (DCC), N, N'-карбонілдіімідазол (CDI) і т. д. Реакція може проводитися при температурі від 0 до 80ºC протягом від 4 до 72 годин. Розчинники, які можуть використовуватися, являють собою нормальні розчинники, такі як бензол, толуол, тетрагідрофуран, діоксан, дихлорметан, хлороформ, N, N-диметилформамід і т. д. При необхідності, основа, така як гідроксид натрію, триетиламін або піридин, може додаватися до реакційної системи. Сполуки формули (II) можуть бути отримані таким чином: Комерційно доступна 6-гідроксинафтоєва кислота нагрівається в присутності карбонату цезію і відповідним чином заміщеного 4-хлорхіноліну (IV) в ДМСО (диметелсульфоксиду) для отримання нафтоєвих кислот (II). Реакція може проводитися при температурі від 130 до 140ºC протягом 3-24 годин. Сполуки формули (III) комерційно доступні або виходять таким чином: 25 Комерційно доступна сполука (V) конденсується з комерційно доступною сполукою (VI) для отримання сполуки (VII). Реакція конденсації проводиться з використанням пептидного 7 UA 103092 C2 5 10 15 20 25 30 35 конденсуючого агента як каталізатора, такого як 1-етил-3-(3-диметиламінопропіл)карбодіімід (EDC), N, N'-дициклогексилкарбодіімід (DCC), N, N'-карбонілдіімідазол (CDI) і т. д. Реакція може проводитися при температурі від 0 до 60ºC протягом 2-72 годин. Розчинники, які можуть використовуватися, являють собою нормальні розчинники, такі як бензол, толуол, тетрагідрофуран, діоксан, дихлорметан, хлороформ, N, N-диметилформамід і т. д. При необхідності, основа, така як гідроксид натрію, триетиламін або піридин, може додаватися до реакційної системи. Сполука (VII) розчиняється в метанолі і гідрується з використанням 5 % паладію на активованому вугіллі як каталізатора для виходу сполуки (IIIa). Реакція може проводитися при кімнатній температурі. При необхідності, до реакційної системи може додаватися кислота, така як сірчана кислота. Сполуки, представлені формулою (I), можуть очищатися звичайними способами виділення, такими як екстракція, перекристалізація, колонкова хроматографія і тому подібні. Сполуки, представлені формулою (I), здатні одночасно інгібувати протеїнкінази і гістондеацетилази, і тому можуть застосовуватися при лікуванні захворювань, пов'язаних з аномальними видами активності протеїнкінази і аномальними видами активності гістондеацетилази. Зокрема, вони високоефективні проти гематологічних злоякісних захворювань і солідних пухлин. Сполуки, представлені формулою (I), можуть складатися в звичайні фармацевтичні препарати, такі як таблетки, капсули, порошки, сиропи, розчини, суспензії, ін'єкційні препарати, мазі і тому подібні. Препарати можуть містити сполуку формули (I) як активний інгредієнт разом з фармацевтично прийнятними носіями, ексципієнтами і розріджувачами. Такий препарат звичайно містить від 0,5 до 70 %, переважно, від 1 до 20 % мас. активного інгредієнта. У даному винаході фармацевтично прийнятні носії, ексципієнти і розріджувачі включають без обмеження ті, які перераховані в керівництві "Handbook of Pharmaceutical Excipients" (American Pharmaceutical Association, October, 1986). Сполуки, представлені в даному описі формулою (I), можуть клінічно вводитися ссавцям, включаючи людей, перорально або шляхом ін'єкцій. Переважно введення пероральним шляхом. Дозування, що вводиться, знаходиться в діапазоні від 0,0001 до 200 мг/кг маси тіла на день, переважно, в діапазоні від 0,01 до 100 мг/кг маси тіла на день і, найбільш переважно, в діапазоні від 0,1 до 50 мг/кг маси тіла на день. Однак оптимальне дозування варіюється у різних отримуючих лікування індивідів, загалом, спочатку вводиться менша доза, і потім проводиться її ступінчасте збільшення. Репрезентативні сполуки за даним винаходом показані нижче в таблиці 1. Номери сполук відповідають "номерам прикладів" в розділі "Приклади". Тобто синтез сполуки 1, як показано в таблиці 1, описаний в "Прикладі 1", а синтез сполуки 44, як показано в таблиці 1, описаний в "Прикладі 44". Таблиця 1 Репрезентативні сполуки за даним винаходом Приклад Структура Назва N-(2-амінофеніл)-6-(6,7диметоксихіназолін-4-ілокси)-1нафтамід 16 40 8 UA 103092 C2 Продовження таблиці 1 17 N-(2-аміно-4-фторфеніл)-6-(6,7диметоксихіназолін-4-ілокси)-1нафтамід 18 N-(2-аміно-4-метилфеніл)-6-(6,7диметоксихіназолін-4-ілокси)-1нафтамід 19 N-(2-аміно-4-метоксифеніл)-6-(6,7диметоксихіназолін-4-ілокси)-1нафтамід 20 N-(2-аміно-4-хлорфеніл)-6-(6,7диметоксихіназолін-4-ілокси)-1нафтамід 21 N-(2-аміно-4-бромфеніл)-6-(6,7диметоксихіназолін-4-ілокси)-1нафтамід 22 N-(2-аміно-4-трифторметилфеніл)-6(6,7-диметоксихіназолін-4-ілокси)-1нафтамід 9 UA 103092 C2 Продовження таблиці 1 23 N-(4-((2амінофеніл)карбамоїл)бензил)-6(6,7-диметоксихіназолін-4-ілокси)-1нафтамід 24 N-(4-((2-аміно-4-фторфеніл)карбамоїл)бензил)-6-(6,7диметоксихіназолін-4-ілокси)-1нафтамід 25 N-(2-амінофеніл)-6-((2-(6,7диметоксихіназолін-4-ілокси)-1нафтамідо)метил) нікотинамід 26 N-(2-аміно-4-фторфеніл)-6-((2-(6,7диметоксихіназолін-4-ілокси)-1нафтамідо)метил) нікотинамід 27 N-(3-((2амінофеніл)карбамоїл)бензил)-6(6,7-диметоксихіназолін-4-ілокси)-1нафтамід 10 UA 103092 C2 Продовження таблиці 1 28 N-(4-((2-аміно-4-метилфеніл)карбамоїл)бензил)-6-(6,7диметоксихіназолін-4-ілокси)-1нафтамід 29 N-(4-((2-аміно-4-метоксифеніл)карбамоїл)бензил)-6-(6,7диметоксихіназолін-4-ілокси)-1нафтамід 30 N-(4-((2-аміно-4трифторметилфеніл) карбамоїл)бензил)-6-(6,7диметоксихіназолін-4-ілокси)-1нафтамід 31 N-(2-амінофеніл)-6-(7метоксихінолін-4-ілокси)-1-нафтамід 32 N-(2-аміно-4-фторфеніл)-6-(7метоксихінолін-4-ілокси)-1-нафтамід 11 UA 103092 C2 Продовження таблиці 1 33 N-(4-((2амінофеніл)карбамоїл)бензил)-6-(7метоксихінолін-4-ілокси)-1-нафтамід 34 N-(2-амінофеніл)-6-((2-(7метоксихінолін-4-ілокси)-1нафтамідо)метил) нікотинамід 35 N-(2-амінофеніл)-6-(6,7диметоксихінолін-4-ілокси)-1нафтамід 36 N-(2-аміно-4-фторфеніл)-6-(6,7диметоксихінолін-4-ілокси)-1нафтамід 37 N-(4-((2амінофеніл)карбамоїл)бензил)-6(6,7-диметоксихінолін-4-ілокси)-1нафтамід 12 UA 103092 C2 Продовження таблиці 1 38 N-(2-амінофеніл)-6-((2-(6,7диметоксихінолін-4-ілокси)-1нафтамідо)метил) нікотинамід 39 N-(2-амінофеніл)-6-(хінолін-4ілокси)-1-нафтамід 40 N-(2-амінофеніл)-6-(8- метилхінолін4-ілокси)-1-нафтамід 41 N-(2-амінофеніл)-6-(7-хлорхінолін-4ілокси)-1-нафтамід 42 N-(2-амінофеніл)-6-(8(трифторметил)хінолін-4-ілокси)-1нафтамід 13 UA 103092 C2 Продовження таблиці 1 43 44 5 10 15 20 N-(4-((2амінофеніл)карбамоїл)бензил)-6-(7хлорхінолін-4-ілокси)-1-нафтамід N-(4-((2амінофеніл)карбамоїл)бензил)-6-(8(трифторметил)хінолін-4-ілокси)-1нафтамід Далі даний винахід буде проілюстрований в комбінації з приведеними нижче прикладами, однак, об'єм захисту даного винаходу не обмежується приведеними прикладами. Далі, поки немає інших визначень, приведені в даному описі процентні частки дані на масу. Будь-який діапазон приведених в описі чисел, таких як одиниці вимірювання, умови реакцій, фізичні стани сполуки або процентні частки, призначені для надання буквальним і певним посиланням. Фахівці в даній галузі при здійсненні даного винаходу, використовуючи температури, концентрації, кількості, числа атомів вуглецю і тому подібні, які випадають з діапазону або відрізняються від однієї величини, досягнуть бажаного результату. Приклад 1 Отримання 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти 6-Гідрокси-1-нафтоєву кислоту (1,43 г, 7,6 ммоль) розчиняли в 38 мл ДМСО, потім додавали карбонат цезію (7,5 г, 22,9 ммоль) і 4-хлор-6,7-диметоксихіназоліну (2,05 г, 9,14 ммоль). Суміш нагрівали при 140ºC протягом 3 годин. Коли реакція завершувалася, суміш охолоджували до кімнатної температури і розбавляли 40 мл H2O. Суміш нейтралізували 2 н. HCl до pH=6,5. Осаджені тверді речовини фільтрували, промивали H 2O, сушили і перекристалізовували з метанолу для отримання вказаної в заголовку сполуки (1,68 г, вихід 59 %) у вигляді твердої речовини коричневого кольору. LC-MS (рідинна хроматографія-мас-спектроскопія)(m/z) 377 (M+1). Приклад 2 Отримання 6-(7-метоксихінолін-4-ілокси)-1-нафтоєвої кислоти 14 UA 103092 C2 5 10 15 20 25 Вказану в заголовку сполуку (1,73 г, вихід 66 %) отримували у вигляді твердої речовини коричневого кольору з 6-гідрокси-1-нафтоєвої кислоти (1,43 г, 7,6 ммоль) і 4-хлор-7метоксихіноліну (1,77 г, 9,14 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 1. LC-MS (m/z) 346 (M+1). Приклад 3 Отримання 6-(6,7-диметоксихінолін-4-ілокси)-1-нафтоєвої кислоти Вказану в заголовку сполуку (1,95 г, вихід 68 %) отримували у вигляді твердої речовини коричневого кольору з 6-гідрокси-1-нафтоєвої кислоти (1,43 г, 7,6 ммоль) і 4-хлор-6,7диметоксихіноліну (2,04 г, 9,14 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 1. LC-MS (m/z) 376 (M+1). Приклад 4 Отримання 6-(хінолін-4-ілокси)-1-нафтоєвої кислоти Вказану в заголовку сполуку (1,24 г, вихід 52 %) отримували у вигляді твердої речовини коричневого кольору з 6-гідрокси-1-нафтоєвої кислоти (1,43 г, 7,6 ммоль) і 4-хлорхіноліну (1,49 г, 9,14 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 1. LC-MS (m/z) 316 (M+1). Приклад 5 Отримання 6-(8-метилхінолін-4-ілокси)-1-нафтоєвої кислоти Вказану в заголовку сполуку (1,25 г, вихід 55 %) отримували у вигляді твердої речовини коричневого кольору з 6-гідрокси-1-нафтоєвої кислоти (1,43 г, 7,6 ммоль) і 4-хлор-8метилхіноліну (1,62 г, 9,14 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 1. LC-MS (m/z) 330 (M+1). Приклад 6 Отримання 6-(7-хлорхінолін-4-ілокси)-1-нафтоєвої кислоти 15 UA 103092 C2 5 10 15 20 25 30 35 Вказану в заголовку сполуку (1,57 г, вихід 59 %) отримували у вигляді твердої речовини коричневого кольору з 6-гідрокси-1-нафтоєвої кислоти (1,43 г, 7,6 ммоль) і 4,7-дихлорхіноліну (1,81 г, 9,14 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 1. LC-MS (m/z) 350 (M+1). Приклад 7 Отримання 6-(8-(трифторметил)хінолін-4-ілокси)-1-нафтоєвої кислоти Вказану в заголовку сполуку (1,43 г, вихід 49 %) отримували у вигляді твердої речовини коричневого кольору з 6-гідрокси-1-нафтоєвої кислоти (1,43 г, 7,6 ммоль) і 4-хлор-8(трифторметил)хіноліну (2,12 г, 9,14 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 1. LC-MS (m/z) 384 (M+1). Приклад 8 Отримання 4-(амінометил)-N-(2-амінофеніл)бензаміду 4-Ціанобензойну кислоту (294 мг, 2 ммоль) розчиняли в 8 мл ДМФА, потім додавали 1-етил3-(3-диметиламінопропіл)карбодіімід гідрохлорид (768 мг, 4 ммоль), 1-гідроксибензотриазол (324 мг, 2,4 ммоль), триетиламін (808 мг, 8 ммоль) і о-фенілендіамін (432 мг, 4 ммоль). Суміш перемішували протягом 20 годин при кімнатній температурі. Суміш розбавляли 400 мл концентрованого розчину солі. Тверді речовини збирали вакуумною фільтрацією, промивали водою і сушили у вакуумі для отримання N-(2-амінофеніл)-4-ціанобензаміду (364 мг, 77 %) у вигляді твердої речовини сірого кольору. LC-MS (m/z) 238 (M+1). N-(2-амінофеніл)-4-ціанобензамід (237 мг, 1 ммоль) розчиняли в метанолі (40 мл), потім додавали сірчану кислоту (196 мг, 1 ммоль) і 5 % паладій на активованому вугіллі (0,20 г). Суміш перемішували в атмосфері водню до завершення реакції. Суміш фільтрували через целіт і фільтрат нейтралізували 1 н. розчином NaOH (2 мл). Отриману суміш фільтрували, і фільтрат концентрували у вакуумі для отримання вказаної в заголовку сполуки (232 мг, вихід 96 %) у вигляді твердої речовини сірого кольору. LC-MS (m/z) 242 (M+1). Приклад 9 Отримання 4-(амінометил)-N-(2-аміно-4-фторфеніл)бензаміду Вказану в заголовку сполуку (186 мг, вихід 72 %) отримували у вигляді твердої речовини коричневого кольору з 4-ціанобензойної кислоти (294 мг, 2 ммоль) і 4-фтор-о-фенілендіаміну (302 мг, 2,4 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 8. LC-MS (m/z) 260 (M+1). Приклад 10 Отримання 4-(амінометил)-N-(2-аміно-4-метилфеніл)бензаміду 16 UA 103092 C2 5 10 15 20 25 30 35 Вказану в заголовку сполуку (173 мг, вихід 68 %) отримували у вигляді твердої речовини сірого кольору з 4-ціанобензойної кислоти (294 мг, 2 ммоль) і 4-метил-о-фенілендіаміну (293 мг, 2,4 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 8. LC-MS (m/z) 256 (M+1). Приклад 11 Отримання 4-(амінометил)-N-(2-аміно-4-метоксифеніл)бензаміду Вказану в заголовку сполуку (192 мг, вихід 71 %) отримували у вигляді твердої речовини сірого кольору з 4-ціанобензойної кислоти (294 мг, 2 ммоль) і 4-метокси-о-фенілендіаміну (331 мг, 2,4 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 8. LC-MS (m/z) 272 (M+1). Приклад 12 Отримання 4-(амінометил)-N-(2-аміно-4-трифторметилфеніл)бензаміду Вказану в заголовку сполуку (195 мг, вихід 63 %) отримували у вигляді твердої речовини сірого кольору з 4-ціанобензойної кислоти (294 мг, 2 ммоль) і 4-трифторметил-о-фенілендіаміну (422 мг, 2,4 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 8. LC-MS (m/z) 310 (M+1). Приклад 13 Отримання 3-(амінометил)-N-(2-амінофеніл)бензаміду Вказану в заголовку сполуку (140 мг, вихід 58 %) отримували у вигляді твердої речовини сірого кольору з 3-ціанобензойної кислоти (294 мг, 2 ммоль) і о-фенілендіаміну (432 мг, 4 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 8. LC-MS (m/z) 242 (M+1). Приклад 14 Отримання 6-(амінометил)-N-(2-амінофеніл)нікотинаміду Вказану в заголовку сполуку (157 мг, вихід 65 %) отримували у вигляді твердої речовини сірого кольору з 6-ціанонікотинової кислоти (296 мг, 2 ммоль) і о-фенілендіаміну (864 мг, 8 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 8. LC-MS (m/z) 243 (M+1). Приклад 15 Отримання 6-(амінометил)-N-(2-аміно-4-фторфеніл)нікотинаміду Вказану в заголовку сполуку (135 мг, вихід 52 %) отримували у вигляді твердої речовини сірого кольору з 6-ціанонікотинової кислоти (296 мг, 2 ммоль) і 4-фтор-о-фенілендіаміну (302 мг, 2,4 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 8. LC-MS (m/z) 261 (M+1). Приклад 16 17 UA 103092 C2 Отримання N-(2-амінофеніл)-6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтаміду 5 10 15 20 25 30 35 6-(6,7-Диметоксихіназолін-4-ілокси)-1-нафтоєву кислоту (37,6 мг, 0,1 ммоль) розчиняли в 4 мл ДМФА, потім додавали 1-етил-3-(3-диметиламінопропіл)карбодіімід гідрохлорид (38,4 мг, 0,2 ммоль), 1-гідроксибензотриазол (16,2 мг, 0,12 ммоль), триетиламін (40,4 мг, 0,4 ммоль) і офенілендіамін (43,2 мг, 0,4 ммоль). Суміш перемішували протягом 20 годин при кімнатній температурі. Суміш розбавляли 200 мл концентрованого розчину солі. Тверді речовини збирали вакуумною фільтрацією, промивали водою і сушили у вакуумі для отримання вказаної в 1 заголовку сполуки (39,1 мг, 84 %) у вигляді твердої речовини коричневого кольору. H-ЯМР (ДМСО-d6) δ 4,01 (с, 6H, 2×OCH3), 4,97 (с, 2H, бензол-NH2), 6,65 (т, J=7,2 Гц, 1H, Ar-H), 6,82 (д, J=7,0 Гц, 1H, Ar-H), 7,00 (т, J=7,1 Гц, 1H, Ar-H), 7,38 (д, J=7,1 Гц, 1H, Ar-H), 7,42 (с, 1H, Ar-H), 7,60 (дд, J=2,4 і 9,2 Гц, 1H, Ar-H), 7,64-7,68 (м, 2H, Ar-H), 7,87 (д, J=6,7 Гц, 1H, Ar-H), 7,97 (д, J=2,3 Гц, 1H, Ar-H), 8,09 (д, J=8,2 Гц, 1H, Ar-H), 8,38 (д, J=9,2 Гц, 1H, Ar-H), 8,54 (с, 1H, Ar-H), 9,85 (с, 1H, бензол-NH). LC-MS (m/z) 467 (M+1). Приклад 17 Отримання N-(2-аміно-4-фторфеніл)-6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (43,1 мг, вихід 89 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 4-фтор-о-фенілендіаміну (15,1 мг, 0,12 ммоль) процедурою, аналогічною процедурі, 1 описаній в прикладі 16. H-ЯМР (ДМСО-d6) δ 4,01 (с, 6H, 2×ОСН3), 5,28 (с, 2Н, бензол-NH2), 6,41 (тд, J=2,6 і 8,5 Гц, 1H, Ar-H), 6,59 (дд, J=2,6 і 11,2 Гц, 1H, Ar-H), 7,35 (тд, J=1,8 і 7,5 Гц, 1H, Ar-H), 7,41 (с, 1H, Ar-H), 7,59 (дд, J=2,2 і 8,4 Гц, 1H, Ar-H), 7,63-7,67 (м, 2H, Ar-H), 7,89 (д, J=6,9 Гц, 1H, Ar-H), 7,96 (д, J=1,9 Гц, 1H, Ar-H), 8,08 (д, J=8,2 Гц, 1H, Ar-H), 8,38 (д, J=9,2 Гц, 1H, Ar-H), 8,54 (с, 1H, Ar-H), 9,77 (с, 1H, бензол-NH). LC-MS (m/z) 485 (M+1). Приклад 18 Отримання N-(2-аміно-4-метилфеніл)-6(6,7-диметоксихіназолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (39,4 мг, вихід 82 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 4-метил-о-фенілендіаміну (14,6 мг, 0,12 ммоль) процедурою, аналогічною процедурі, 1 описаній в прикладі 16. H-ЯМР (ДМСО-d6) (відношення ізомерів 0,77/0,23) δ 2,21 (с, 1H, Ar-CH3), 4,01 (с, 6H, 2×ОСН3), 4,77 (с, 0,23×2H, бензол-NH2), 4,89 (с, 0,77×2H, бензол-NH2), 6,46 (д, J=7,6 Гц, 0,77×1H, Ar-H), 6,64 (с, 0,77×1H, Ar-H), 6,73 (д, J=7,9 Гц, 0,23×1H, Ar-H), 6,81 (с, 0,23×1H, ArH), 7,24 (д, J=8,1 Гц, 1H, Ar-H), 7,41 (с, 1H, Ar-H), 7,58-7,66 (м, 3H, Ar-H), 7,85 (д, J=6,7 Гц, 1H, Ar 18 UA 103092 C2 5 10 15 20 25 30 35 H), 7,97 (с, 1H, Ar-H), 8,08 (д, J=7,9 Гц, 1H, Ar-H), 8,38 (д, J=9,0 Гц, 1H, Ar-H), 8,54 (с, 1H, Ar-H), 9,77 (с, 1H, бензол-NH). LC-MS (m/z) 481 (M+1). Приклад 19 Отримання N-(2-аміно-4-метоксифеніл)-6(6,7-диметоксихіназолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (43,2 мг, вихід 87 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 4-метокси-о-фенілендіаміну (16,5 мг, 0,12 ммоль) процедурою, аналогічною процедурі, 1 описаній в прикладі 16. H-ЯМР (ДМСО-d6) δ 3,70 (с, 3H, -ОСН3), 4,01 (с, 6H, 2×ОСН3), 5,00 (с, 2H, бензол-NH2), 6,23 (дд, J=2,6 і 8,6 Гц, 1H, Ar-H), 6,40 (д, J=2,6 Гц, 1H, Ar-H), 7,22 (д, J=8,6 Гц, 1H, Ar-H), 7,41 (с, 1H, Ar-H), 7,59 (дд, J=2,2 і 9,1 Гц, 1H, Ar-H), 7,62-7,66 (м, 2H, Ar-H), 7,86 (д, J=6,9 Гц, 1H, Ar-H), 7,96 (д, J=2,0 Гц, 1H, Ar-H), 8,07 (д, J=8,2 Гц, 1H, Ar-H), 8,38 (д, J=9,2 Гц, 1H, Ar-H), 8,54 (с, 1H, Ar-H), 9,70 (с, 1H, бензол-NH). LC-MS (m/z) 497 (M+1). Приклад 20 Отримання N-(2-аміно-4-хлорфеніл)-6(6,7-диметоксихіназолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (42,9 мг, вихід 83 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 4-хлор-о-фенілендіаміну (17,1 мг, 0,12 ммоль) процедурою, аналогічною процедурі, 1 описаній в прикладі 16. H-ЯМР (ДМСО-d6) δ 4,01 (с, 6H, 2×ОСН3), 5,31 (с, 2H, бензол-NH2), 6,65 (д, J=8,3 Гц, 1H, Ar-H), 6,86 (д, J=1,9 Гц, 1H, Ar-H), 7,41 (с, 1H, Ar-H), 7,58-7,67 (м, 4H, Ar-H), 7,89 (д, J=6,8 Гц, 1H, Ar-H), 8,01 (с, 1H, Ar-H), 8,09 (д, J=8,1 Гц, 1H, Ar-H), 8,37 (д, J=9,2 Гц, 1H, Ar-H), 8,55 (с, 1H, Ar-H), 9,84 (с, 1H, бензол-NH). LC-MS (m/z) 501 (M+1). Приклад 21 Отримання N-(2-аміно-4-бромфеніл)-6(6,7-диметоксихіназолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (42,0 мг, вихід 77 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 4-бром-о-фенілендіаміну (22,4 мг, 0,12 ммоль) процедурою, аналогічною процедурі, 1 описаній в прикладі 16. H-ЯМР (ДМСО-d6) δ 4,01 (с, 6H, 2×ОСН3), 5,31 (с, 2H, бензол-NH2), 6,77 (д, J=8,3 Гц, 1H, Ar-H), 7,01 (с, 1H, Ar-H), 7,41 (с, 1H, Ar-H), 7,58-7,65 (м, 5H, Ar-H), 7,89 (д, J=7,0 Гц, 1H, Ar-H), 8,00 (с, 1H, Ar-H), 8,14 (д, J=10,2 Гц, 1H, Ar-H), 8,37 (д, J=9,1 Гц, 1H, Ar-H), 8,54 (с, 1H, Ar-H), 9,84 (с, 1H, бензол-NH). LC-MS (m/z) 545 (M+1). 19 UA 103092 C2 Приклад 22 Отримання N-(2-аміно-4-трифторметилфеніл)-6(6,7-диметоксихіназолін-4-ілокси)-1-нафтаміду 5 10 15 20 25 30 Вказану в заголовку сполуку (42,3 мг, вихід 79 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 4-трифторметил-о-фенілендіаміну (21,1 мг, 0,12 ммоль) процедурою, аналогічною 1 процедурі, описаній в прикладі 16. H-ЯМР (ДМСО-d6) δ 4,01 (с, 6H, 2×ОСН3), 5,72 (с, 2Н, бензол-NH2), 6,92 (д, J=8,5 Гц, 1H, Ar-H), 7,42 (с, 1H, Ar-H), 7,59-7,65 (м, 3H, Ar-H), 7,90-7,96 (м, 2H, Ar-H), 7,98 (с, 1H, Ar-H), 8,10 (д, J=8,3 Гц, 1H, Ar-H), 8,17 (д, J=7,3 Гц, 1H, Ar-H), 8,39 (д, J=9,2 Гц, 1H, Ar-H), 8,54 (с, 1H, Ar-H), 9,90 (с, 1H, бензол-NH). LC-MS (m/z) 535 (M+1). Приклад 23 Отримання N-(4-((2-амінофеніл)карбамоїл)бензил)-6(6,7-диметоксихіназолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (43,1 мг, вихід 72 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 4-(амінометил)-N-(2-амінофеніл)бензаміду (28,9 мг, 0,12 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 16. LC-MS (m/z) 600 (M+1). Приклад 24 Отримання N-(4-((2-аміно-4-фторфеніл)карбамоїл)бензил)-6-(6,7-диметоксихіназолін-4ілокси)-1-нафтаміду Вказану в заголовку сполуку (46,3 мг, вихід 75 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 4-(амінометил)-N-(2-аміно-4-фторфеніл)бензаміду (31,1 мг, 0,12 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 16. LC-MS (m/z) 618 (M+1). Приклад 25 Отримання N-(2-амінофеніл)-6-((2-(6,7-диметоксихіназолін-4-ілокси)-1нафтамідо)метил)нікотинаміду 20 UA 103092 C2 5 10 15 20 Вказану в заголовку сполуку (41,4 мг, вихід 69 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 6-(амінометил)-N-(2-амінофеніл)нікотинаміду (29,0 мг, 0,12 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 16. LC-MS (m/z) 601 (M+1). Приклад 26 Отримання N-(2-аміно-4-фторфеніл)-6-((2-(6,7-диметоксихіназолін-4-ілокси)-1нафтамідо)метил)нікотинаміду Вказану в заголовку сполуку (43,3 мг, вихід 77 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 6-(амінометил)-N-(2-аміно-4-фторфеніл)нікотинаміду (31,2 мг, 0,12 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 16. LC-MS (m/z) 619 (M+1). Приклад 27 Отримання N-(3-((2-амінофеніл)карбамоїл)бензил)-6(6,7-диметоксихіназолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (48,5 мг, вихід 81 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 3-(амінометил)-N-(2-амінофеніл)бензаміду (28,9 мг, 0,12 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 16. LC-MS (m/z) 600 (M+1). Приклад 28 Отримання N-(4-((2-аміно-4-метилфеніл)карбамоїл)бензил)-6-(6,7-диметоксихіназолін-4ілокси)-1-нафтаміду 25 21 UA 103092 C2 5 10 15 20 25 30 Вказану в заголовку сполуку (52,7 мг, вихід 86 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 4-(амінометил)-N-(2-аміно-4-метилфеніл)бензаміду (30,6 мг, 0,12 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 16. LC-MS (m/z) 614 (M+1). Приклад 29 Отримання N-(4-((2-аміно-4-метоксифеніл)карбамоїл)бензил)-6-(6,7-диметоксихіназолін-4ілокси)-1-нафтаміду Вказану в заголовку сполуку (51,6 мг, вихід 82 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 4-(амінометил)-N-(2-аміно-4-метоксифеніл)бензаміду (32,5 мг, 0,12 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 16. LC-MS (m/z) 630 (M+1). Приклад 30 Отримання N-(4-((2-аміно-4-трифторметилфеніл)карбамоїл)бензил)-6-(6,7диметоксихіназолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (46,7 мг, вихід 70 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихіназолін-4-ілокси)-1-нафтоєвої кислоти (37,6 мг, 0,1 ммоль) і 4-(амінометил)-N-(2-аміно-4-трифторметилфеніл)бензаміду (37,1 мг, 0,12 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 16. LC-MS (m/z) 668 (M+1). Приклад 31 Отримання N-(2-амінофеніл)-6-(7-метоксихінолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (39,6 мг, вихід 91 %) отримували у вигляді твердої речовини коричневого кольору з 6-(7-метоксихінолін-4-ілокси)-1-нафтоєвої кислоти (34,5 мг, 0,1 ммоль) і о-фенілендіаміну (43,2 мг, 0,4 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 1 16. H-ЯМР (ДМСО-d6) δ 3,95 (с, 3H, -OCH3), 4,97 (с, 2H, бензол-NH2), 6,60 (д, J=5,2 Гц, 1H, Ar-H), 6,64 (т, J=7,6 Гц, 1H, Ar-H), 6,82 (д, J=7,8 Гц, 1H, Ar-H), 6,99 (т, J=7,4 Гц, 1H, Ar-H), 7,31 (дд, J=2,5 і 9,1 Гц, 1H, Ar-H), 7,38 (д, J=7,6 Гц, 1H, Ar-H), 7,45 (д, J=2,4 Гц, 1H, Ar-H), 7,57 (дд, J=2,4 і 9,2 Гц, 1H, Ar-H), 7,65 (т, J=7,8 Гц, 1H, Ar-H), 7,87-7,88 (м, 2H, Ar-H), 8,07 (д, J=8,2 Гц, 1H, Ar-H), 8,25 (д, J=9,2 Гц, 1H, Ar-H), 8,43 (д, J=9,2 Гц, 1H, Ar-H), 8,65 (д, J=5,2 Гц, 1H, Ar-H), 9,84 (с, 1H, бензолNH). LC-MS (m/z) 436 (М+1). 22 UA 103092 C2 Приклад 32 Отримання N-(2-аміно-4-фторфеніл)-6-(7-метоксихінолін-4-ілокси)-1-нафтаміду 5 10 15 20 25 30 Вказану в заголовку сполуку (33,1 мг, вихід 73 %) отримували у вигляді твердої речовини коричневого кольору з 6-(7-метоксихінолін-4-ілокси)-1-нафтоєвої кислоти (34,5 мг, 0,1 ммоль) і 4-фтор-о-фенілендіаміну (15,1 мг, 0,12 ммоль) процедурою, аналогічною процедурі, описаній в 1 прикладі 16. H-ЯМР (ДМСО-d6) δ 3,95 (с, 3Н, -ОСН3), 5,27 (с, 2Н, бензол-NH2), 6,41 (тд, J=2,5 і 8,4 Гц, 1H, Ar-H), 6,57-6,61 (м, 2H, Ar-H), 7,30-7,36 (м, 2H, Ar-H), 7,45 (д, J=2,2 Гц, 1H, Ar-H), 7,56 (дд, J=2,2 і 9,2 Гц, 1H, Ar-H), 7,65 (т, J=7,6 Гц, 1H, Ar-H), 7,87-7,91 (м, 2H, Ar-H), 8,07 (д, J=8,3 Гц, 1H, Ar-H), 8,24 (д, J=9,1 Гц, 1H, Ar-H), 8,43 (д, J=9,2 Гц, 1H, Ar-H), 8,65 (д, J=5,1 Гц, 1H, Ar-H), 9,75 (с, 1H, бензол-NH). LC-MS (m/z) 454 (М+1). Приклад 33 Отримання N-(4-((2-амінофеніл)карбамоїл)бензил)-6(7-метоксихінолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (48,3 мг, вихід 85 %) отримували у вигляді твердої речовини коричневого кольору з 6-(7-метоксихінолін-4-ілокси)-1-нафтоєвої кислоти (34,5 мг, 0,1 ммоль) і 4-(амінометил)-N-(2-амінофеніл)бензаміду (28,9 мг, 0,12 ммоль) процедурою, аналогічною 1 процедурі, описаній в прикладі 16. H-ЯМР (ДМСО-d6) δ 3,95 (с, 3Н, -ОСН3), 4,64 (д, J=5,6 Гц, 2Н, -СН2), 4,87 (с, 2H, бензол-NH2), 6,58-6,62 (т, 2Н, Ar-Н), 6,78 (дд, J=1,2 і 7,8 Гц, 1H, Ar-H), 6,97 (тд, J=1,4 і 8,1 Гц, 1H, Ar-H), 7,18 (д, J=7,0 Гц, 1H, Ar-H), 7,31 (дд, J=2,5 і 9,2 Гц, 1H, Ar-H), 7,44 (д, J=2,4 Гц, 1H, Ar-H), 7,53-7,56 (м, 3H, Ar-H), 7,62 (т, J=8,0 Гц, 1H, Ar-H), 7,72 (д, J=6,1 Гц, 1H, ArH), 7,86 (д, J=2,5 Гц, 1H, Ar-H), 7,98-8,06 (м, 3H, Ar-H), 8,24 (д, J=9,1 Гц, 1H, Ar-H), 8,39 (д, J=9,2 Гц, 1H, Ar-H), 8,64 (д, J=5,2 Гц, 1H, Ar-H), 9,21 (т, J=6,0 Гц, 1H, -CONH), 9,61 (с, 1H, бензол-NH). LC-MS (m/z) 569 (М+1). Приклад 34 Отримання N-(2-амінофеніл)-6-((2-(7-метоксихінолін-4-ілокси)-1нафтамідо)метил)нікотинаміду Вказану в заголовку сполуку (46,6 мг, вихід 82 %) отримували у вигляді твердої речовини коричневого кольору з 6-(7-метоксихінолін-4-ілокси)-1-нафтоєвої кислоти (34,5 мг, 0,1 ммоль) і 6-(амінометил)-N-(2-амінофеніл)нікотинаміду (29,0 мг, 0,12 ммоль) процедурою, аналогічною 1 процедурі, описаній в прикладі 16. H-ЯМР (ДМСО-d6) δ 3,95 (с, 3H, -OCH3), 4,74 (с, 2H, -CH2), 4,95 (с, 2H, бензол-NH2), 6,60 (м, 2H, Ar-H), 6,79 (с, 1H, Ar-H), 6,98 (с, 1H, Ar-H), 7,17 (с, 1H, Ar 23 UA 103092 C2 5 10 15 H), 7,31 (д, J=8,6 Гц, 1H, Ar-H), 7,44 (с, 1H, Ar-H), 7,58-7,63 (м, 3H, Ar-H), 7,77 (с, 1H, Ar-H), 7,87 (с, 1H, Ar-H), 8,05 (д, J=5,6 Гц, 1H, Ar-H), 8,24 (д, J=8,3 Гц, 1H, Ar-H), 8,33 (с, 1H, Ar-H), 8,47 (д, J=7,5 Гц, 1H, Ar-H), 9,13 (с, 1H, Ar-H), 9,25 (с, 1H, -CONH), 9,77 (с, 1H, бензол-NH). LC-MS (m/z) 570 (M+1). Приклад 35 Отримання N-(2-амінофеніл)-6-(6,7-диметоксихінолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (40,0 мг, вихід 86 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихінолін-4-ілокси)-1-нафтоєвої кислоти (37,5 мг, 0,1 ммоль) і о-фенілендіаміну (43,2 мг, 0,4 ммоль) процедурою, аналогічною процедурі, описаній в 1 прикладі 16. H-ЯМР (ДМСО-d6) δ 3,93 (с, 3Н, -ОСН3), 3,95 (с, 3Н, -ОСН3), 4,99 (с, 2H, бензолNH2), 6,56 (д, J=5,2 Гц, 1H, Ar-Н), 6,63 (т, J=7,6 Гц, 1H, Ar-H), 6,81 (д, J=7,6 Гц, 1H, Ar-H), 6,98 (т, J=7,2 Гц, 1H, Ar-H), 7,36 (д, J=7,6 Гц, 1H, Ar-H), 7,43 (с, 1H, Ar-H), 7,56-7,58 (м, 2H, Ar-H), 7,65 (т, J=7,6 Гц, 1H, Ar-H), 7,87-7,90 (м, 2H, Ar-H), 8,08 (д, J=8,0 Гц, 1H, Ar-H), 8,43 (д, J=9,2 Гц, 1H, ArH), 8,49 (д, J=5,2 Гц, 1H, Ar-H), 9,87 (с, 1H, бензол-NH). LC-MS (m/z) 466 (M+1). Приклад 36 Отримання N-(2-аміно-4-фторфеніл)-6(6,7-диметоксихінолін-4-ілокси)-1-нафтаміду 30 Вказану в заголовку сполуку (39,1 мг, вихід 81 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихінолін-4-ілокси)-1-нафтоєвої кислоти (37,5 мг, 0,1 ммоль) і 4-фтор-о-фенілендіаміну (15,1 мг, 0,12 ммоль) процедурою, аналогічною процедурі, 1 описаній в прикладі 16. H-ЯМР (ДМСО-d6) δ 3,93 (с, 3Н, -ОСН3), 3,95 (с, 3Н, -ОСН3), 5,31 (с, 2H, бензол-NH2), 6,40 (с, 1H, Ar-H), 6,55-6,59 (т, 2Н, Ar-Н), 7,30 (д, J=7,6 Гц, 1Н, Ar-H), 7,42 (с, 1H, ArH), 7,54-7,57 (м, 2H, Ar-H), 7,64 (т, J=8,0 Гц, 1H, Ar-H), 7,89-7,91 (м, 2H, Ar-H), 8,07 (д, J=8,0 Гц, 1H, Ar-H), 8,42 (д, J=9,2 Гц, 1H, Ar-H), 8,49 (д, J=5,2 Гц, 1H, Ar-H), 9,79 (с, 1H, бензол-NH). LC-MS (m/z) 484 (M+1). Приклад 37 Отримання N-(4-((2-амінофеніл)карбамоїл)бензил)-6(6,7-диметоксихінолін-4-ілокси)-1-нафтаміду 35 Вказану в заголовку сполуку (49,0 мг, вихід 82 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихінолін-4-ілокси)-1-нафтоєвої кислоти (37,5 мг, 0,1 ммоль) і 4-(амінометил)-N-(2-амінофеніл)бензаміду (28,9 мг, 0,12 ммоль) процедурою, 1 аналогічною процедурі, описаній в прикладі 16. H-ЯМР (ДМСО-d6) δ 3,93 (с, 3H, -OCH3), 3,95 (с, 20 25 24 UA 103092 C2 5 10 15 20 25 30 3H, -OCH3), 4,63 (д, J=5,6 Гц, 2H, -CH2), 4,90 (с, 2H, бензол-NH2), 6,56-6,59 (м, 2H, Ar-H), 6,78 (д, J=7,6 Гц, 1H, Ar-H), 6,96 (т, J=8,1 Гц, 1H, Ar-H), 7,17 (д, J=7,6 Гц, 1H, Ar-H), 7,42 (с, 1H, Ar-H), 7,53-7,55 (м, 4H, Ar-H), 7,62 (т, J=8,0 Гц, 1H, Ar-H), 7,71 (д, J=6,8 Гц, 1H, Ar-H), 7,87 (с, 1H, Ar-H), 7,98-8,06 (м, 3H, Ar-H), 8,39 (д, J=9,2 Гц, 1H, Ar-H), 8,49 (д, J=5,2 Гц, 1H, Ar-H), 9,26 (т, J=6,0 Гц, 1H, -CONH), 9,66 (с, 1H, бензол-NH). LC-MS (m/z) 599 (M+1). Приклад 38 Отримання N-(2-амінофеніл)-6-((2-(6,7-диметоксихінолін4-ілокси)-1-нафтамідо)метил)нікотинаміду Вказану в заголовку сполуку (47,9 мг, вихід 80 %) отримували у вигляді твердої речовини коричневого кольору з 6-(6,7-диметоксихінолін-4-ілокси)-1-нафтоєвої кислоти (37,5 мг, 0,1 ммоль) і 6-(амінометил)-N-(2-амінофеніл)нікотинаміду (29,0 мг, 0,12 ммоль) процедурою, 1 аналогічною процедурі, описаній в прикладі 16. H-ЯМР (ДМСО-d6) δ 3,93 (с, 3H, -OCH3), 3,95 (с, 3H, -OCH3), 4,73 (д, J=5,6 Гц, 2H, -CH2), 4,97 (с, 2H, бензол-NH2), 6,57 (м, 2H, Ar-H), 6,77 (д, J=6,4 Гц, 1H, Ar-H), 6,98 (т, J=8,1 Гц, 1H, Ar-H), 7,16 (д, J=5,6 Гц, 1H, Ar-H), 7,42 (с, 1H, Ar-H), 7,55-7,63 (м, 4H, Ar-H), 7,62 (т, J=8,0 Гц, 1H, Ar-H), 7,76 (д, J=6,8 Гц, 1H, Ar-H), 7,88 (с, 1H, Ar-H), 8,06 (с, 1H, Ar-H), 8,33 (с, 1H, Ar-H), 8,45-8,48 (м, 2H, Ar-H), 9,12 (с, 1H, Ar-H), 9,30 (т, J=6,0 Гц, 1H, CONH), 9,80 (с, 1H, бензол-NH). LC-MS (m/z) 600 (M+1). Приклад 39 Отримання N-(2-амінофеніл)-6-(хінолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (35,6 мг, вихід 88 %) отримували у вигляді твердої речовини коричневого кольору з 6-(хінолін-4-ілокси)-1-нафтоєвої кислоти (31,5 мг, 0,1 ммоль) і офенілендіаміну (43,2 мг, 0,4 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 1 16. H-ЯМР (ДМСО-d6) δ 4,97 (с, 2Н, бензол-NH2), 6,65 (т, J=7,3 Гц, 1H, Ar-H), 6,75 (д, J=5,1 Гц, 1H, Ar-H), 6,82 (д, J=7,8 Гц, 1H, Ar-H), 7,00 (т, J=7,1 Гц, 1H, Ar-H), 7,38 (д, J=7,5 Гц, 1H, Ar-H), 7,59 (дд, J=2,3 і 9,2 Гц, 1H, Ar-H), 7,64-7,71 (м, 2H, Ar-H), 7,83-7,92 (м, 3H, Ar-H), 8,08 (д, J=8,4 Гц, 2H, Ar-H), 8,37 (д, J=7,9 Гц, 1H, Ar-H), 8,45 (д, J=9,2 Гц, 1H, Ar-H), 8,73 (д, J=5,1 Гц, 1H, Ar-H), 9,85 (с, 1H, бензол-NH). LC-MS (m/z) 406 (M+1). Приклад 40 Отримання N-(2-амінофеніл)-6-(8-метилхінолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (37,7 мг, вихід 90 %) отримували у вигляді твердої речовини коричневого кольору з 6-(8-метилхінолін-4-ілокси)-1-нафтоєвої кислоти (32,9 мг, 0,1 ммоль) і о 25 UA 103092 C2 5 10 15 20 25 30 фенілендіаміну (43,2 мг, 0,4 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 1 16. H-ЯМР (ДМСО-d6) δ 2,76 (с, 3Н, Ar-СН3), 4,97 (с, 2H, бензол-NH2), 6,64 (т, J=7,1 Гц, 1H, ArH), 6,78 (д, J=5,0 Гц, 1H, Ar-H), 6,82 (д, J=7,8 Гц, 1H, Ar-H), 6,99 (т, J=7,3 Гц, 1H, Ar-H), 7,38 (д, J=7,5 Гц, 1H, Ar-H), 7,55-7,58 (м, 2H, Ar-H), 7,65 (т, J=7,6 Гц, 1H, Ar-H), 7,71 (д, J=7,0 Гц, 1H, ArH), 7,87-7,89 (м, 2H, Ar-H), 8,07 (д, J=8,2 Гц, 1H, Ar-H), 8,20 (д, J=7,9 Гц, 1H, Ar-H), 8,44 (д, J=9,2 Гц, 1H, Ar-H), 8,76 (д, J=5,0 Гц, 1H, Ar-H), 9,84 (с, 1H, бензол-NH). LC-MS (m/z) 420 (M+1). Приклад 41 Отримання N-(2-амінофеніл)-6-(7-хлорхінолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (33,2 мг, вихід 83 %) отримували у вигляді твердої речовини коричневого кольору з 6-(7-хлорхінолін-4-ілокси)-1-нафтоєвої кислоти (35,0 мг, 0,1 ммоль) і офенілендіаміну (43,2 мг, 0,4 ммоль) процедурою, аналогічною процедурі, описаній в прикладі 1 16. H-ЯМР (ДМСО-d6) δ 4,97 (с, 2H, бензол-NH2), 6,65 (т, J=7,4 Гц, Ar-H), 6,77 (д, J=5,5 Гц, 1H, Ar-H), 6,82 (д, J=7,2 Гц, 1H, Ar-H), 7,00 (т, J=7,0 Гц, 1H, Ar-H), 7,38 (д, J=7,2 Гц, 1H, Ar-H), 7,60 (дд, J=2,6 і 9,2 Гц, 1H, Ar-H), 7,67-7,74 (м, 2H, Ar-H), 7,89 (д, J=7,4 Гц, 1H, Ar-H), 7,94 (д, J=2,4 Гц, 1H, Ar-H), 8,09 (д, J=8,2 Гц, 1H, Ar-H), 8,13 (д, J=2,1 Гц, 1H, Ar-H), 8,41 (д, J=9,0 Гц, 1H, Ar-H), 8,46 (д, J=9,6 Гц, 1H, Ar-H), 8,76 (д, J=5,2 Гц, 1H, Ar-H), 9,85 (с, 1H, бензол-NH). LC-MS (m/z) 440 (M+1). Приклад 42 Отримання N-(2-амінофеніл)-6-(8-трифторметилхінолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (38,3 мг, вихід 81 %) отримували у вигляді твердої речовини коричневого кольору з 6-(8-трифторметилхінолін-4-ілокси)-1-нафтоєвої кислоти (39,8 мг, 0,1 ммоль) і о-фенілендіаміну (43,2 мг, 0,4 ммоль) процедурою, аналогічною процедурі, описаній в 1 прикладі 16. H-ЯМР (ДМСО-d6) δ 4,98 (с, 2H, бензол-NH2), 6,65 (т, J=7,3 Гц, 1H, Ar-H), 6,83 (д, J=7,6 Гц, 1H, Ar-H), 6,89 (д, J=5,2 Гц, 1H, Ar-H), 7,00 (т, J=7,2 Гц, 1H, Ar-H), 7,38 (д, J=7,5 Гц, 1H, Ar-H), 7,62 (дд, J=2,4 і 9,2 Гц, 1H, Ar-H), 7,68 (т, J=7,7 Гц, 1H, Ar-H), 7,83 (т, J=7,9 Гц, 1H, Ar-H), 7,90 (д, J=7,0 Гц, 1H, Ar-H), 7,97 (д, J=2,3 Гц, 1H, Ar-H), 8,10 (д, J=8,3 Гц, 1H, Ar-H), 8,29 (д, J=7,1 Гц, 1H, Ar-H), 8,47 (д, J=9,2 Гц, 1H, Ar-H), 8,70 (д, J=7,8 Гц, 1H, Ar-H), 8,87 (д, J=5,2 Гц, 1H, Ar-H), 9,86 (с, 1H, бензол-NH). LC-MS (m/z) 474 (M+1). Приклад 43 Отримання N-(4-((2-амінофеніл)карбамоїл)бензил)-6(7-хлорхінолін-4-ілокси)-1-нафтаміду 26 UA 103092 C2 5 10 15 20 25 30 35 Вказану в заголовку сполуку (42,4 мг, вихід 74 %) отримували у вигляді твердої речовини коричневого кольору з 6-(7-хлорхінолін-4-ілокси)-1-нафтоєвої кислоти (35,0 мг, 0,1 ммоль) і 4(амінометил)-N-(2-амінофеніл)бензаміду (28,9 мг, 0,12 ммоль) процедурою, аналогічною 1 процедурі, описаній в прикладі 16. H-ЯМР (ДМСО-d6) δ 4,64 (д, J=5,8 Гц, 2H, -CH2), 4,87 (с, 2H, бензол-NH2), 6,60 (т, J=7,0 Гц, 1H, Ar-H), 6,75-6,79 (м, 2H, Ar-H), 6,97 (т, J=7,5 Гц, 1H, Ar-H), 7,18 (д, J=7,7 Гц, 1H, Ar-H), 7,53-7,59 (м, 3H, Ar-H), 7,66 (т, J=8,0 Гц, 1H, Ar-H), 7,70-7,74 (м, 2H, Ar-H), 7,92 (д, J=2,0 Гц, 1H, Ar-H), 7,99 (д, J=7,9 Гц, 2H, Ar-H), 8,06 (д, J=8,2 Гц, 1H, Ar-H), 8,13 (с, 1H, Ar-H), 8,39-8,42 (м, 2H, Ar-H), 8,75 (д, J=5,1 Гц, 1H, Ar-H), 9,22 (т, J=5,6 Гц, 1H, -CONH), 9,62 (с, 1H, бензол-NH). LC-MS (m/z) 573 (M+1). Приклад 44 Отримання N-(4-((2-амінофенілкарбамоїл)бензил)-6(8-трифторметилхінолін-4-ілокси)-1-нафтаміду Вказану в заголовку сполуку (47,3 мг, вихід 78 %) отримували у вигляді твердої речовини коричневого кольору з 6-(8-трифторметилхінолін-4-ілокси)-1-нафтоєвої кислоти (38,3 мг, 0,1 ммоль) і 6-(амінометил)-N-(2-амінофеніл)нікотинаміду (29,0 мг, 0,12 ммоль) процедурою, 1 аналогічною процедурі, описаній в прикладі 16. H-ЯМР (ДМСО-d6) δ 4,64 (д, J=5,6 Гц, 2H, -CH2), 4,87 (с, 2H, бензол-NH2), 6,60 (т, J=7,2 Гц, 1H, Ar-H), 6,78 (д, J=7,8 Гц, 1H, Ar-H), 6,89 (д, J=5,1 Гц, 1H, Ar-H), 6,97 (т, J=7,2 Гц, 1H, Ar-H), 7,18 (д, J=7,9 Гц, 1H, Ar-H), 7,53-7,66 (м, 4H, Ar-H), 7,74 (д, J=6,9 Гц, 1H, Ar-H), 7,83 (т, J=7,9 Гц, 1H, Ar-H), 7,95-8,08 (м, 4H, Ar-H), 8,29 (д, J=7,0 Гц, 1H, Ar-H), 8,42 (д, J=9,1 Гц, 1H, Ar-H), 8,69 (д, J=8,3 Гц, 1H, Ar-H), 8,86 (д, J=5,0 Гц, 1H, Ar-H), 9,22 (т, J=5,5 Гц, 1H, -CONH), 9,61 (с, 1H, бензол-NH). LC-MS (m/z) 607 (M+1). Приклад 45 Отримання таблеток Склад (1000 таблеток): Сполука 31 5г Мікрокристалічна целюлоза 90 г Карбоксиметилкрохмаль 5г натрію 4 % розчин полівідону (K30) в 50 г абсолютному етанолі Порошок тальку 0,5 г Сполуки 31 просівали через сито 100 меш. Мікрокристалічну целюлозу, карбоксиметилкрохмаль натрію і порошок тальку відповідно просівали через сито 80 меш. Мікрокристалічну целюлозу і карбоксиметилкрохмаль натрію відважували у кількості, що включається в склад, і однорідно змішували зі сполукою 31 способом ступінчастого додавання. Для отримання вологих гранул додавали прийнятну кількість 4 % розчину полівідону (K30) в абсолютному етанолі. Гранули сушили і додавали порошок тальку у кількості, що включається в склад. Потім проводили пресування для отримання таблеток. Приклад 46 Отримання капсул Склад (1000 капсул): Сполука 31 5г Мікрокристалічна целюлоза 55 г Лактоза 35 г Карбоксиметилкрохмаль 5г натрію Стеарат магнію 0,5 г Сполуку 31 просівали через сито 100 меш. Мікрокристалічну целюлозу, лактозу, карбоксиметилкрохмаль натрію і стеарат магнію відповідно просівали через сито 80 меш. 27 UA 103092 C2 5 10 15 20 25 30 Мікрокристалічну целюлозу, лактозу і карбоксиметилкрохмаль натрію відважували у кількості, що включається в склад, і однорідно змішували зі сполукою 31 способом ступінчастого додавання. Потім стеарат магнію додавали у кількості, що включається в склад, і однорідно змішували. Потім проводили заповнення капсул для отримання готових до вживання капсул. Приклад 47 Отримання ін'єкційного препарату Склад: Сполука 31 1,00 мг ДМСО 0,10 мл Етанол 1,00 мл Сполуку 31 розчиняли в ДМСО і потім додавали етанол для отримання ін'єкційного препарату. Приклад 48 Аналіз залежної від лігандів PDGF і VEGF клітинної проліферації під дією сполук формули (I) Вимірювання інгібування in vivo залежної від рецепторних лігандів клітинної проліферації: 1. PDGF-залежна клітинна проліферація: Методами інженерії конструювали лінію клітин мишачих фібробластів NIH-3T3 для стабільної експресії людського PDGFRβ і використовували для оцінки PDGF-залежної клітинної проліферації. Експресуючі людський PDGFRΒ клітини NIH-3T3 висівали в 96-ямкові планшети в кількості 5000 на ямку і інкубували протягом ночі в безсироватковому середовищі через 24 години. Додавали підлягаючі тестуванню сполуки і PDGF BB (50 нг/мл) і клітини інкубували протягом 72 годин в безсироватковому середовищі. Впливи на проліферацію визначали способом MTS (Promega), відповідно до інструкції. Інкубацію виконували протягом 2 годин при 37ºC в інкубаторі в атмосфері CO2, і спектральну поглинальну здатність при 490 нм вимірювали з використанням зчитувального пристрою планшет ELISA (імуноферментного аналізу). 2. VEGF-залежна клітинна проліферація: Клітини HUVEC висівали в 96-ямкові планшети в кількості 6000 на ямку і через 24 години інкубували в безсироватковому середовищі протягом 2 годин. Додавали підлягаючі тестуванню сполуки і VEGF 165 (50 нг/мл) і інкубували протягом 72 годин в безсироватковому середовищі. Впливи на проліферацію визначали способом MTS (Promega), відповідно до інструкції. Інкубацію виконували протягом 2 годин при 37ºC в інкубаторі в атмосфері CO 2, і спектральну поглинальну здатність при 490 нм вимірювали з використанням зчитувального пристрою планшет ELISA. Експериментальні результати показані в таблиці 2. Таблиця 2 Приклад (сполуки) 16 17 18 19 20 21 22 23 25 31 32 33 34 35 36 37 38 39 GI50, нМ GI50, нМ (залежна від ліганду PDGF клітинна (залежна від ліганду VEGF клітинна проліферація) проліферація) 48 3 40 3 15 7 11 23 23 6 19 5 372 3 148 18 69 13 46 5 20 2 300 8 248 90 5 1 3 2 159 4 74 25 32 107 35 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNaphthalene carboxamide derivatives as inhibitors of protein kinase and histone deacetylase, preparation methods and uses thereof
Автори англійськоюLu, Xianping, Li, Zhibin, Shan, Song, Yu, Jindi, Ning, Zhiqiang
Автори російськоюЛу Сяньпин, Ли Чжибинь, Шань Сун, Юй Цзиньди, Нин Чжицян
МПК / Мітки
МПК: A61P 9/00, A61P 29/00, C07D 215/22, A61K 31/444, A61P 11/00, A61P 25/00, A61P 3/00, C07D 239/88, A61P 35/00, A61K 31/517, A61P 37/08, A61K 31/438, C07D 401/12, C07D 215/233
Мітки: отримання, похідні, гістондеацетилази, інгібітори, протеїнкінази, нафталінкарбоксаміду, застосування, спосіб
Код посилання
<a href="https://ua.patents.su/41-103092-pokhidni-naftalinkarboksamidu-yak-ingibitori-protenkinazi-i-gistondeacetilazi-sposib-kh-otrimannya-i-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні нафталінкарбоксаміду як інгібітори протеїнкінази і гістондеацетилази, спосіб їх отримання і застосування</a>
Попередній патент: Спосіб визначення якісного складу фенолкарбонових кислот у біомасі вищих водяних рослин за допомогою хромато-мас-спектрофотометра
Наступний патент: Очисник вороху коренебульбоплодів від домішок
Випадковий патент: Личкована панель