Кристалічна форма вільної основи бендамустину (варіанти) та фармацевтична композиція для лікування раку (варіанти)
Номер патенту: 109109
Опубліковано: 27.07.2015
Автори: Курвуазьє Лоран Д., Маккін Роберт Е., Еддлстоун Марк, Холтіванджер Кертіс Р.
Формула / Реферат
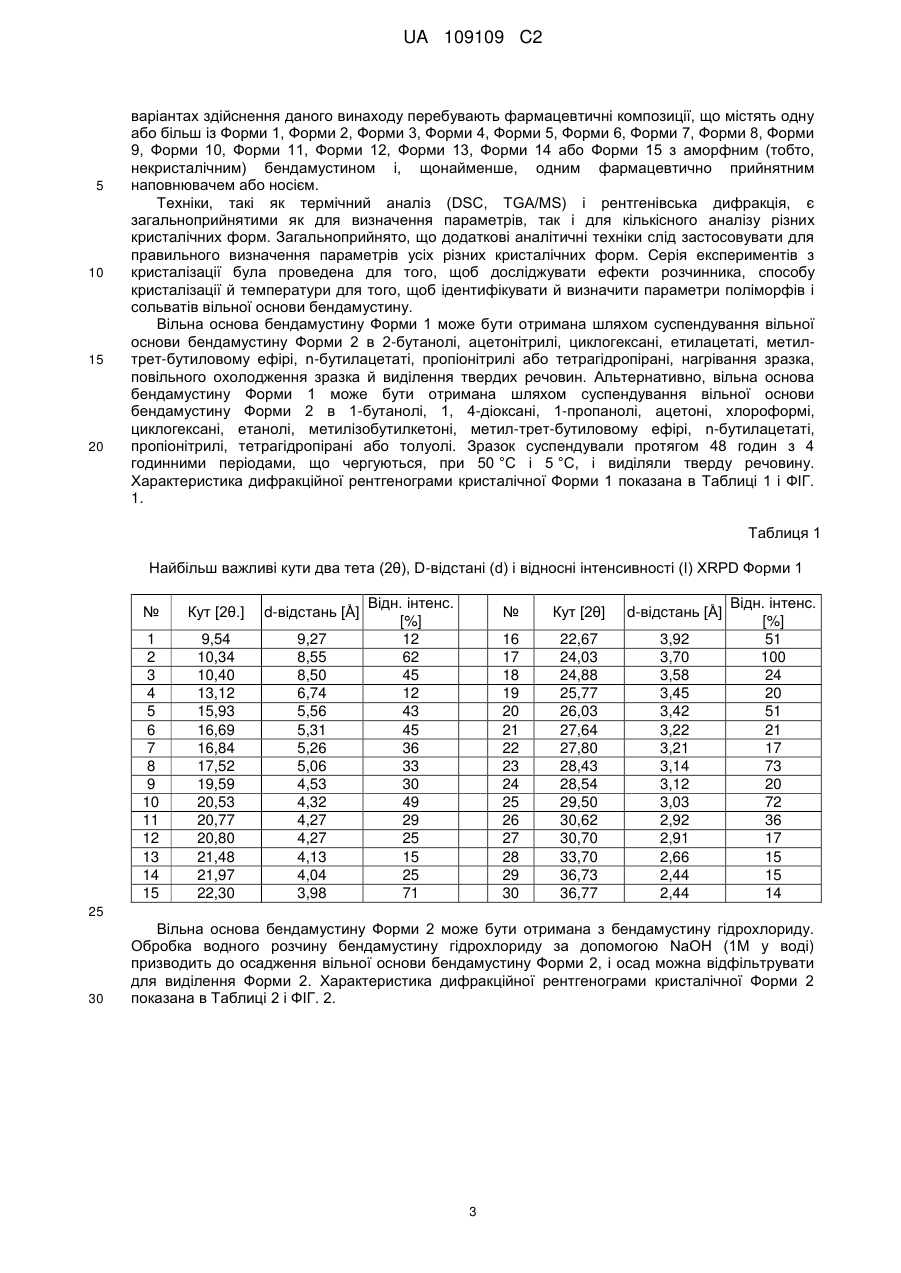
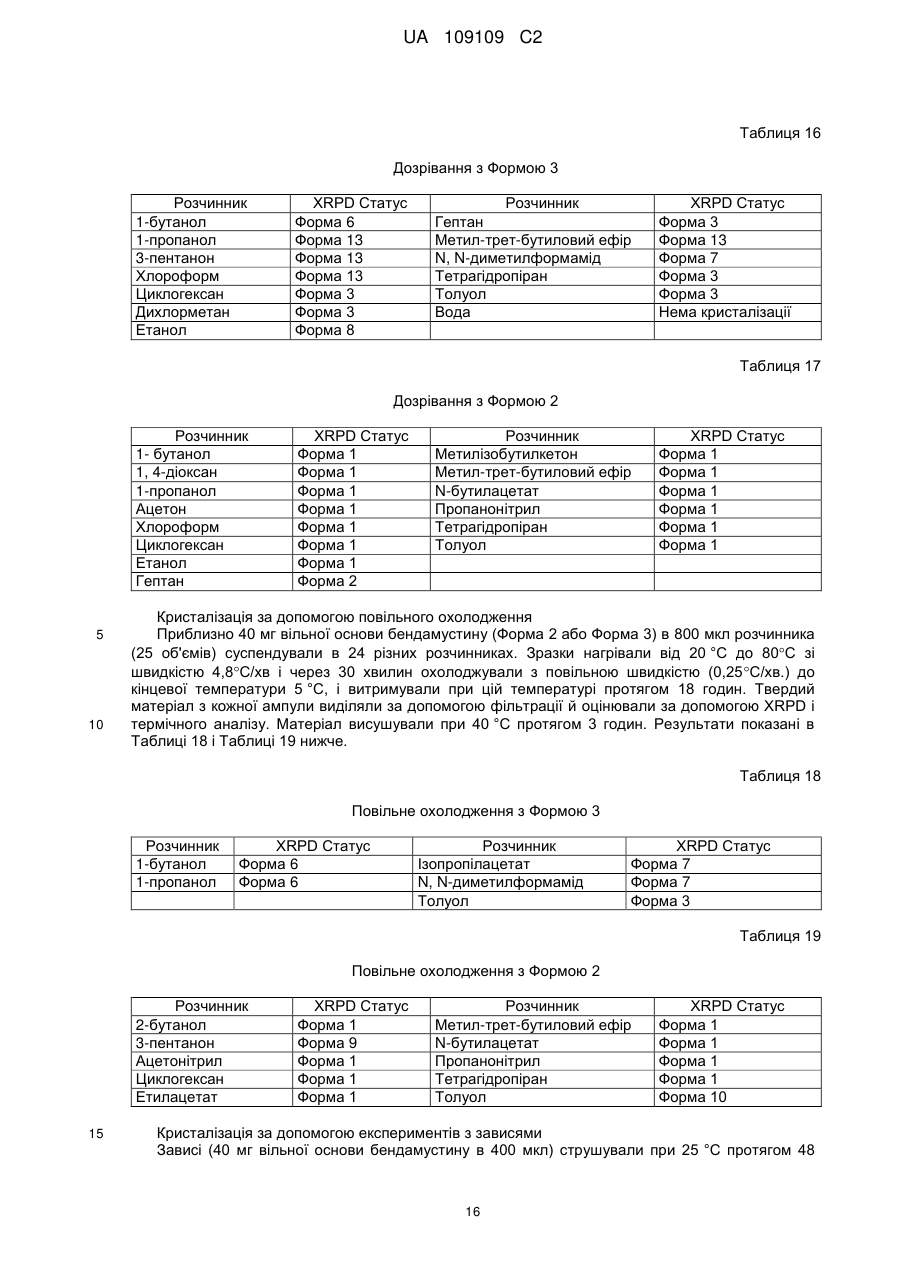
1. Кристалічна форма 1 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 10,34, 22,30, 24,03, 28,43 і 29,50±0,2 градуса 2q.
2. Кристалічна форма вільної основи бендамустину за п. 1, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 16,69, 20,53 і 22,67±0,2 градуса 2q.
3. Кристалічна форма вільної основи бендамустину за п. 1, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 1.
4. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 1-3.
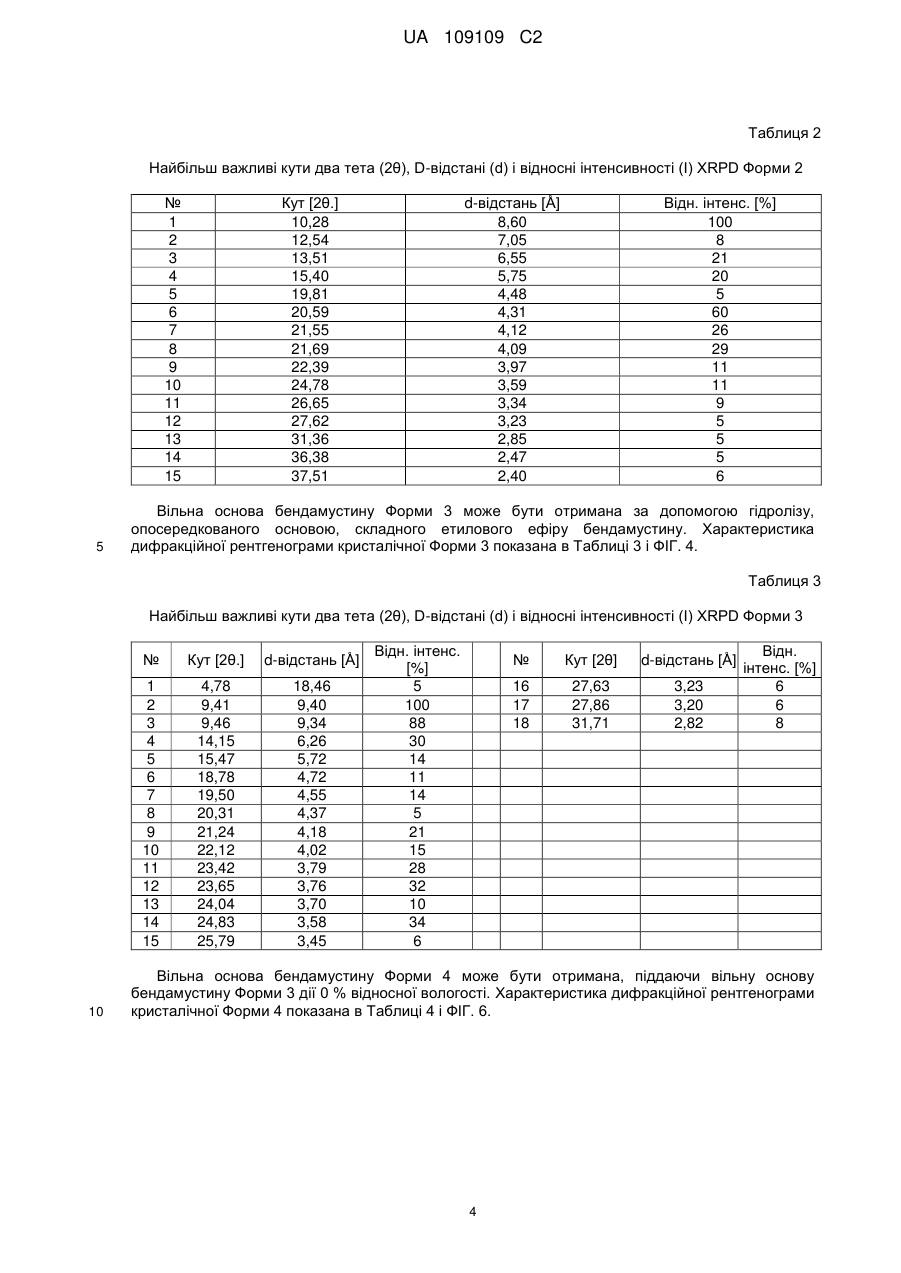
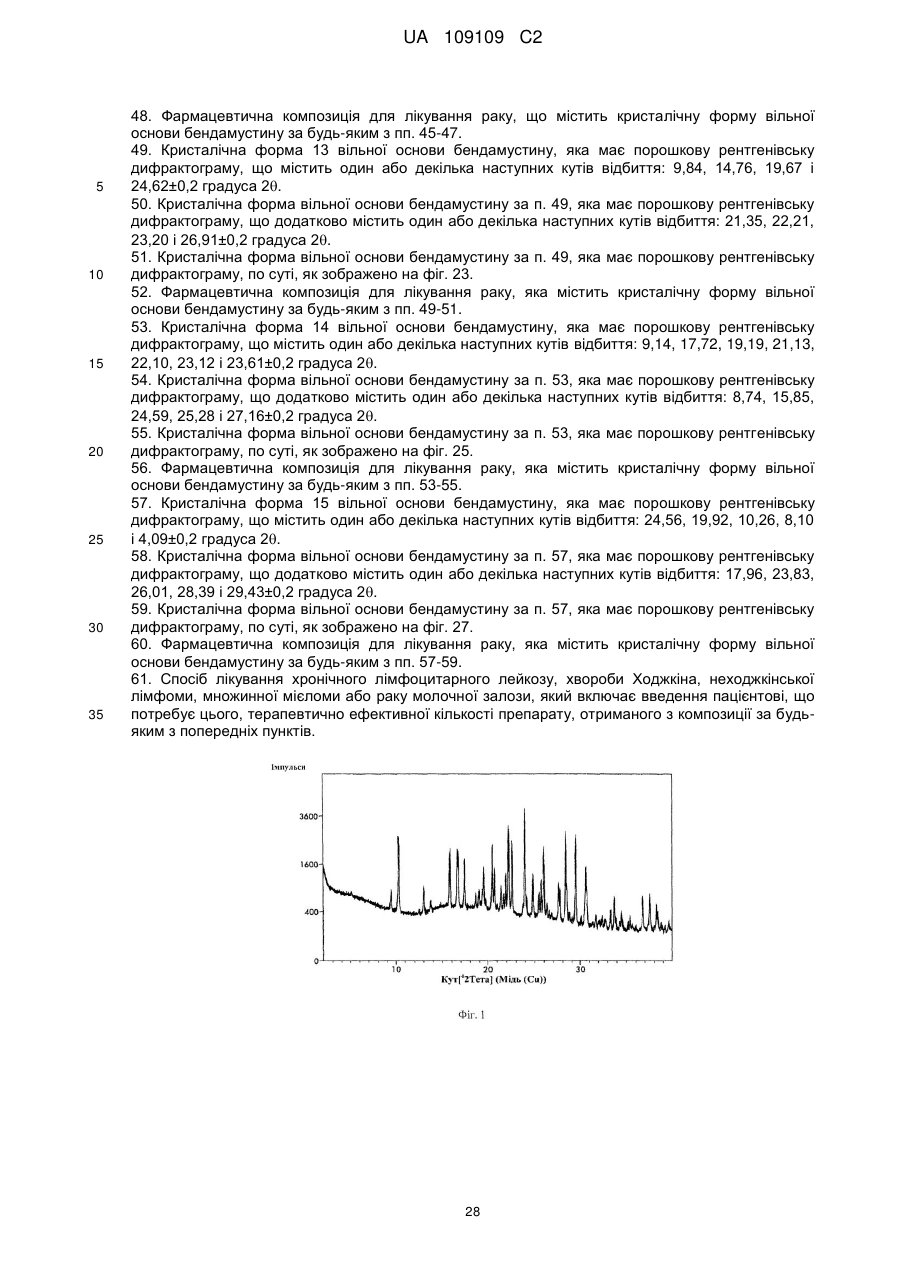
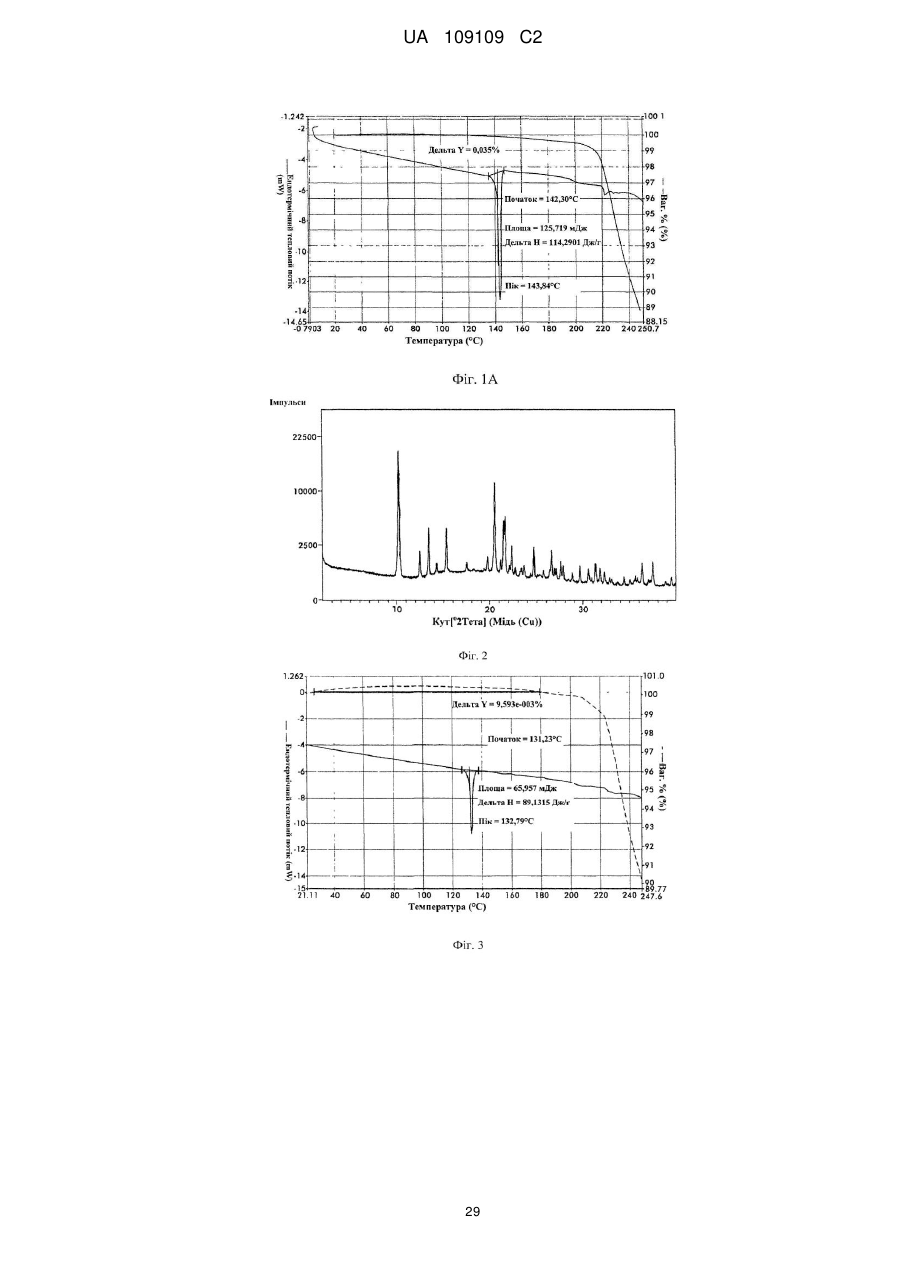
5. Кристалічна форма 2 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 10,28, 20,59, 21,55, 21,69 і 24,78±0,2 градуса 2q.
6. Кристалічна форма вільної основи бендамустину за п. 5, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 12,54, 13,51, 15,40 і 22,39±0,2 градуса 2q.
7. Кристалічна форма вільної основи бендамустину за п. 5, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 2.
8. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 5-7.
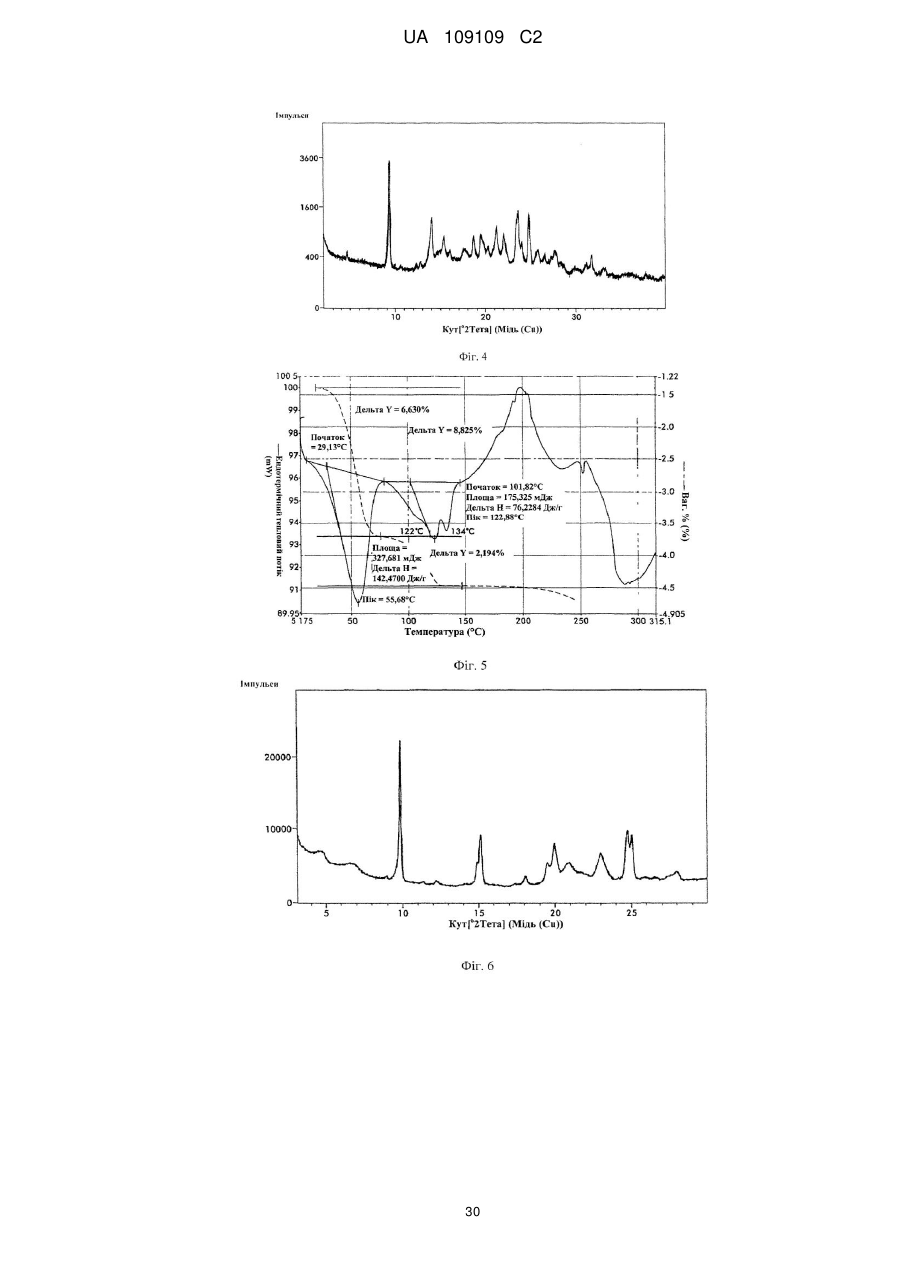
9. Кристалічна форма 3 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 9,41, 9,46, 14,15, 23,42 і 23,65±0,2 градуса 2q.
10. Кристалічна форма вільної основи бендамустину за п. 9, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 14,15, 18,78 і 24,83±0,2 градуса 2q.
11. Кристалічна форма вільної основи бендамустину за п. 9, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 4.
12. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 9-11.
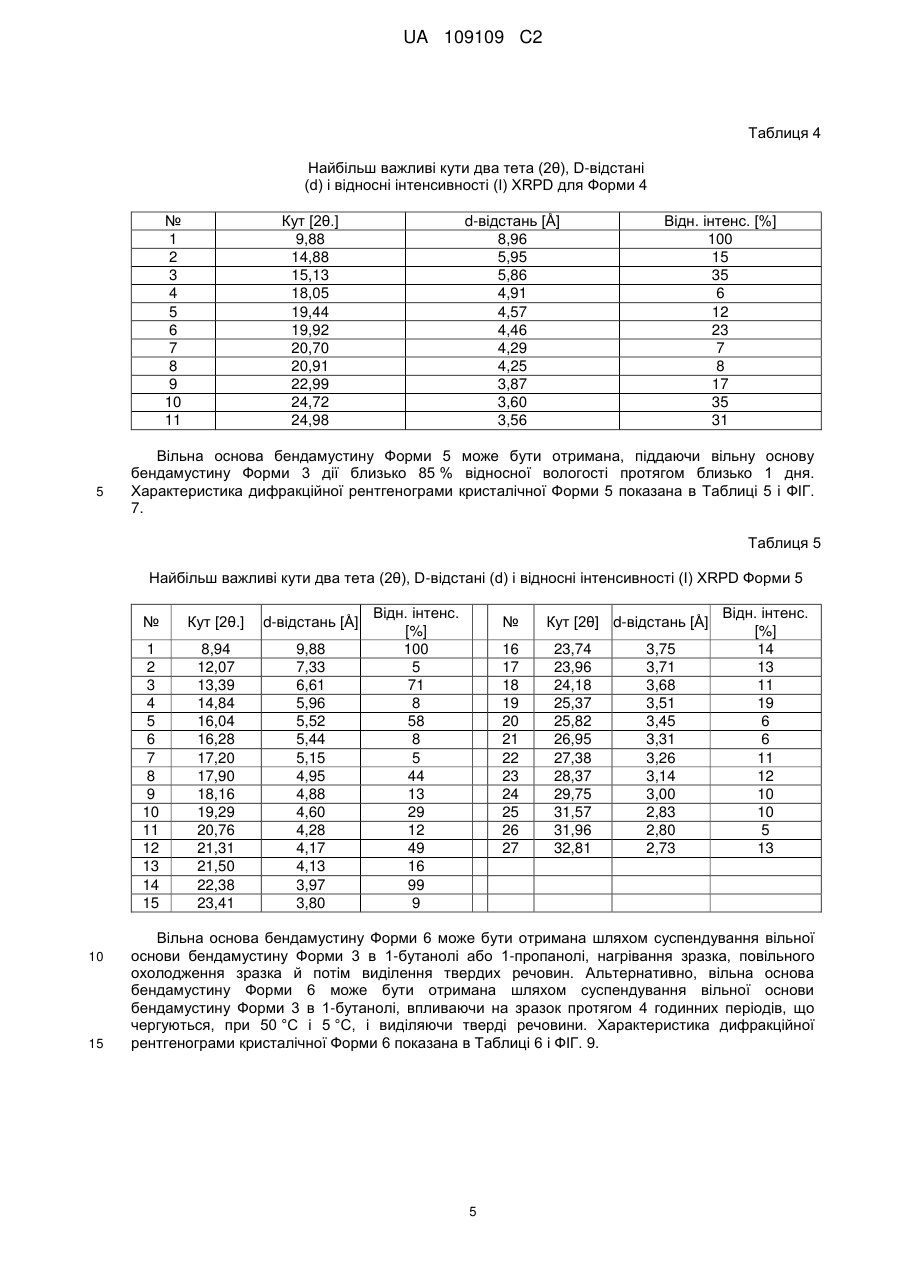
13. Кристалічна форма 4 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 9,88, 15,13, 19,92, 22,99, 24,72 і 24,98±0,2 градуса 2q.
14. Кристалічна форма вільної основи бендамустину за п. 13, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 19,44 і 20,70±0,2 градуса 2q.
15. Кристалічна форма вільної основи бендамустину за п. 13, що має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 6.
16. Фармацевтична композиція для лікування раку, що містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 13-15.
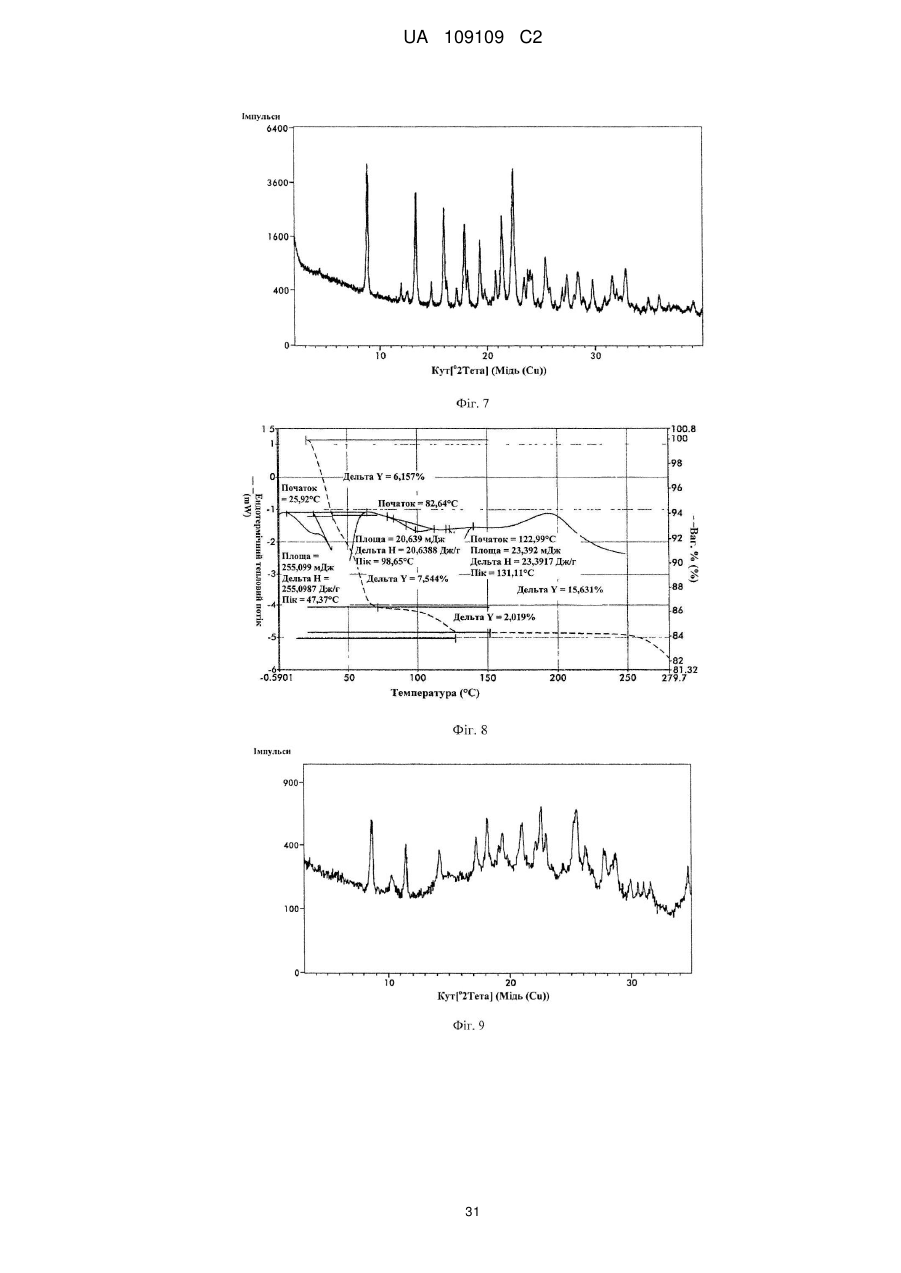
17. Кристалічна форма 5 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 8,94, 13,39, 16,04, 21,31 і 22,38±0,2 градуса 2q.
18. Кристалічна форма вільної основи бендамустину за п. 17, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 17,90, 19,29 і 25,37±0,2 градуса 2q.
19. Кристалічна форма вільної основи бендамустину за п. 17, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 7.
20. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 17-19.
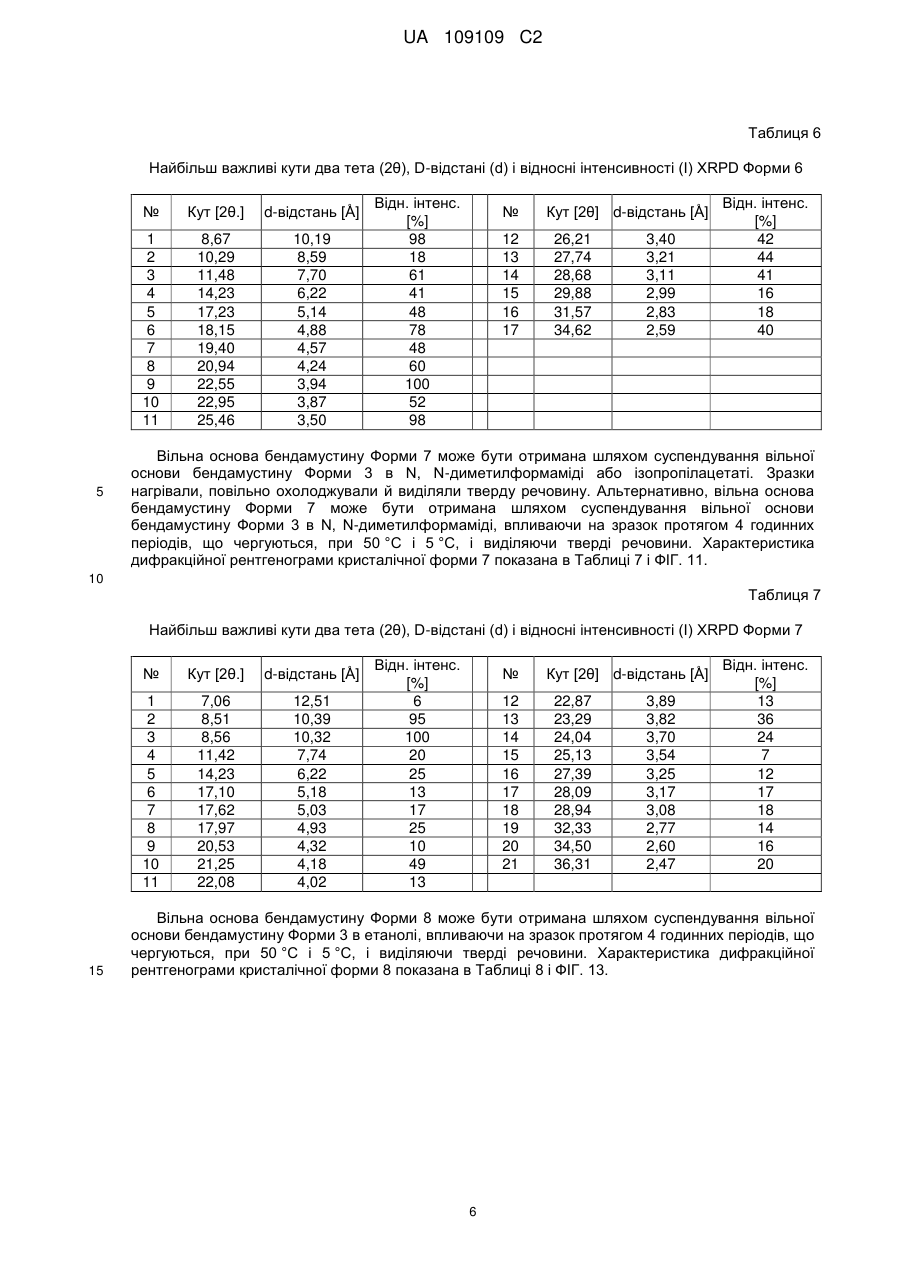
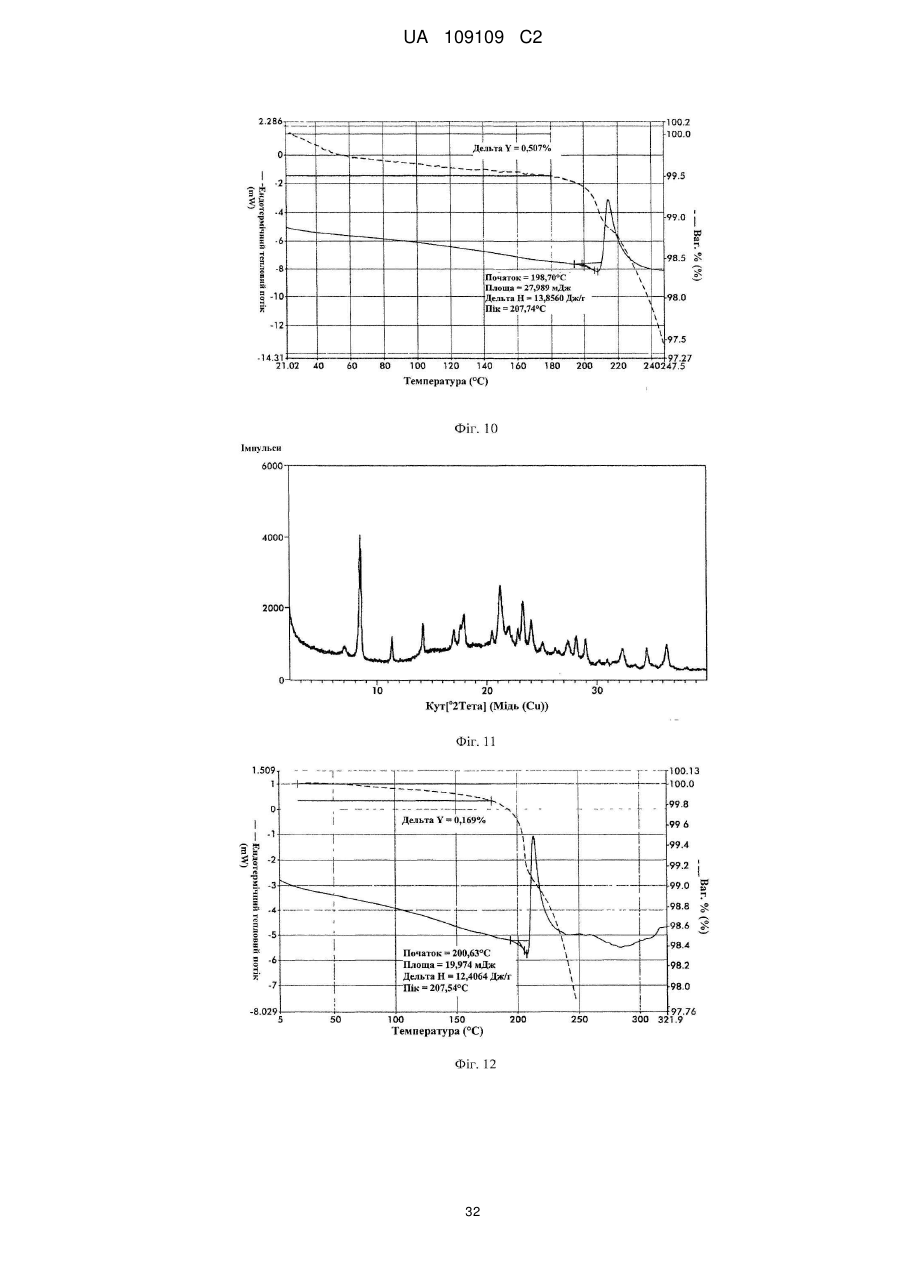
21. Кристалічна форма 6 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 8,67, 18,15, 20,94, 22,55 і 25,46±0,2 градуса 2q.
22. Кристалічна форма вільної основи бендамустину за п. 21, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 19,40, 22,95, 26,21, 27,74 і 34,62±0,2 градуса 2q.
23. Кристалічна форма вільної основи бендамустину за п. 21, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 9.
24. Фармацевтична композиція для лікування раку, що містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 21-23.
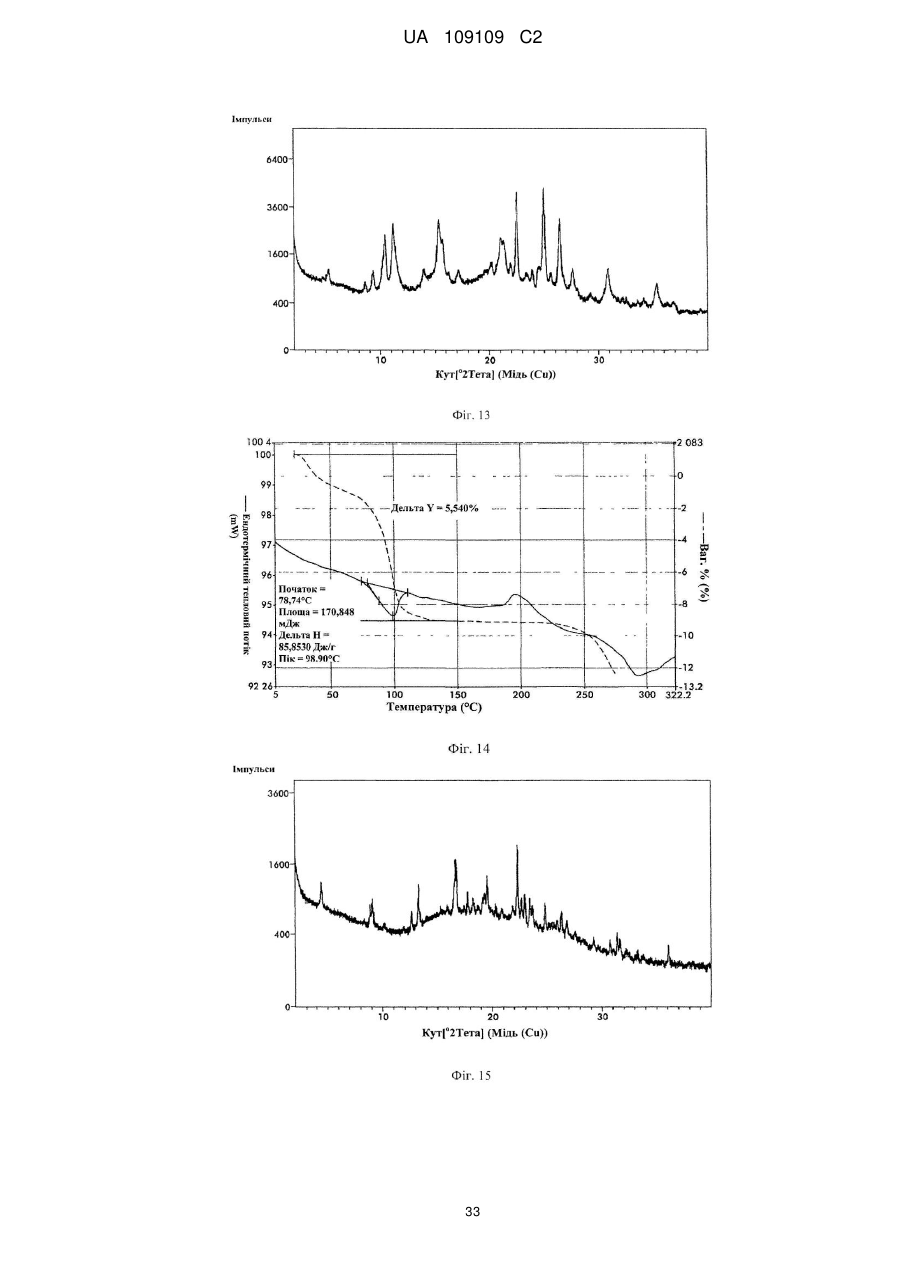
25. Кристалічна форма 7 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 8,51, 17,97, 21,25, 28,09 і 36,31±0,2 градуса 2q.
26. Кристалічна форма вільної основи бендамустину за п. 25, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 11,42, 14,23, 23,29, 24,04 і 28,09±0,2 градуса 2q.
27. Кристалічна форма вільної основи бендамустину за п. 25, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 11.
28. Фармацевтична композиція для лікування раку, що містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 25-27.
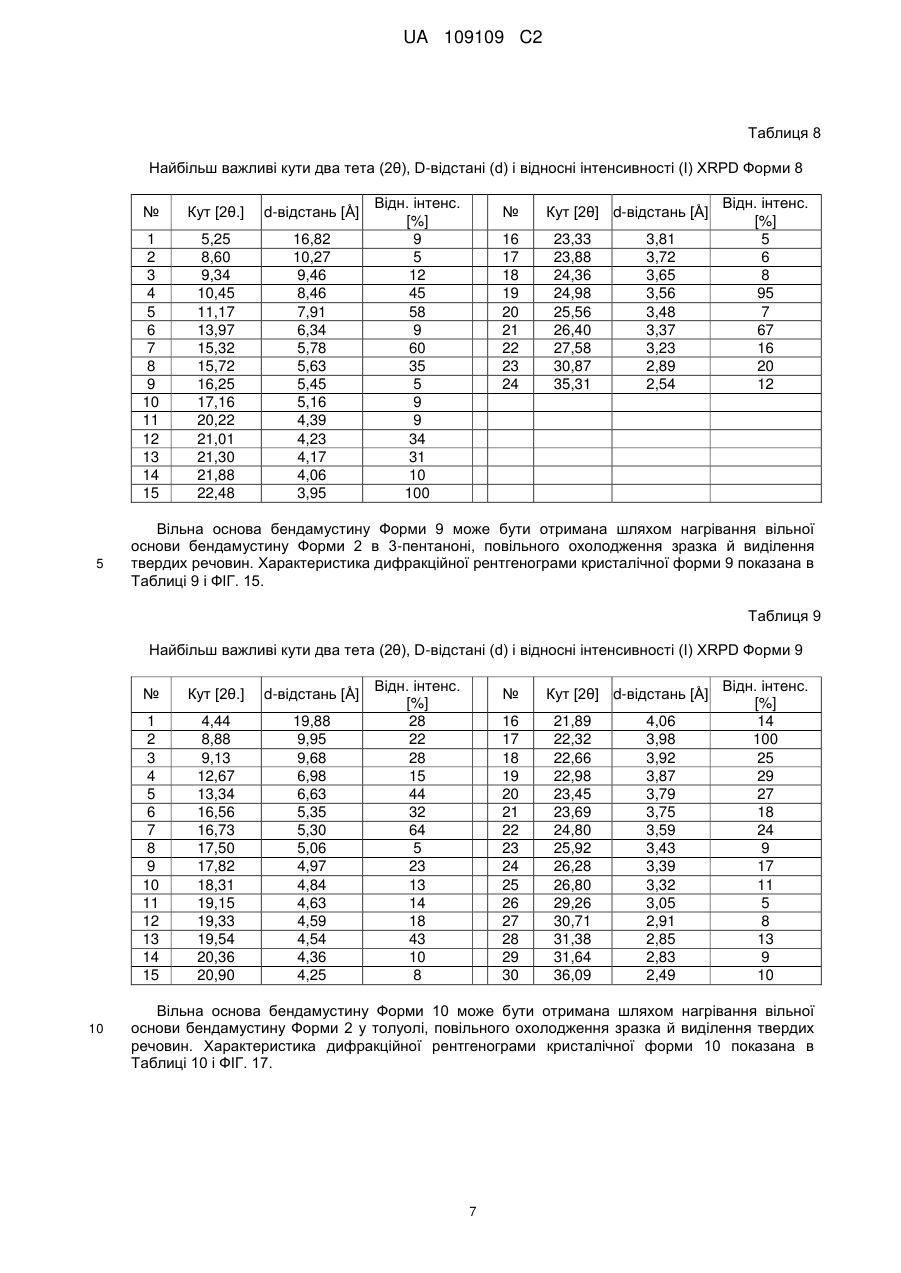
29. Кристалічна форма 8 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 9,34, 10,45, 11,17, 15,32, 22,48, 24,98 і 26,40±0,2 градуса 2q.
30. Кристалічна форма вільної основи бендамустину за п. 29, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 15,72, 21,01, 21,30 і 30,87±0,2 градуса 2q.
31. Кристалічна форма вільної основи бендамустину за п. 29, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 13.
32. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 29-31.
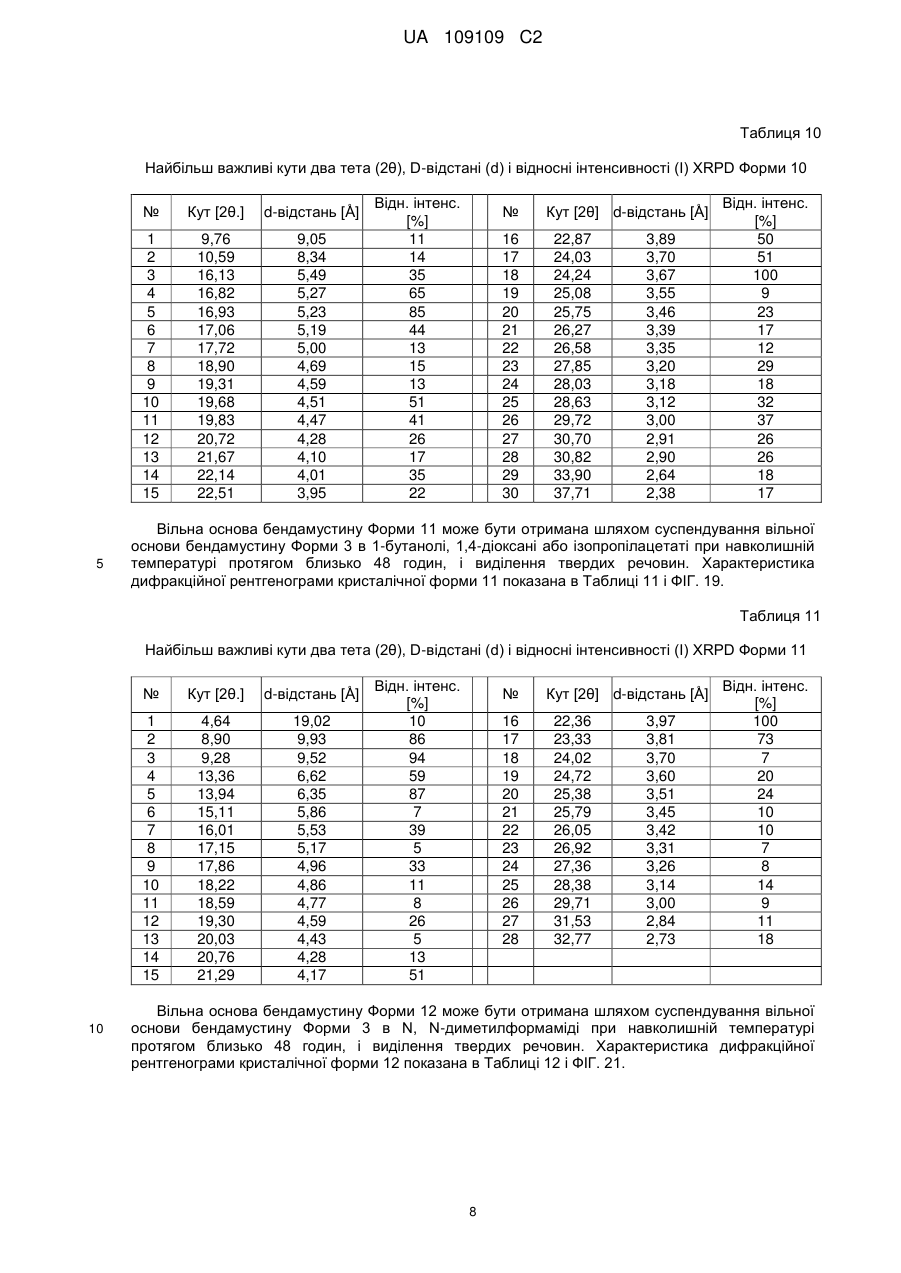
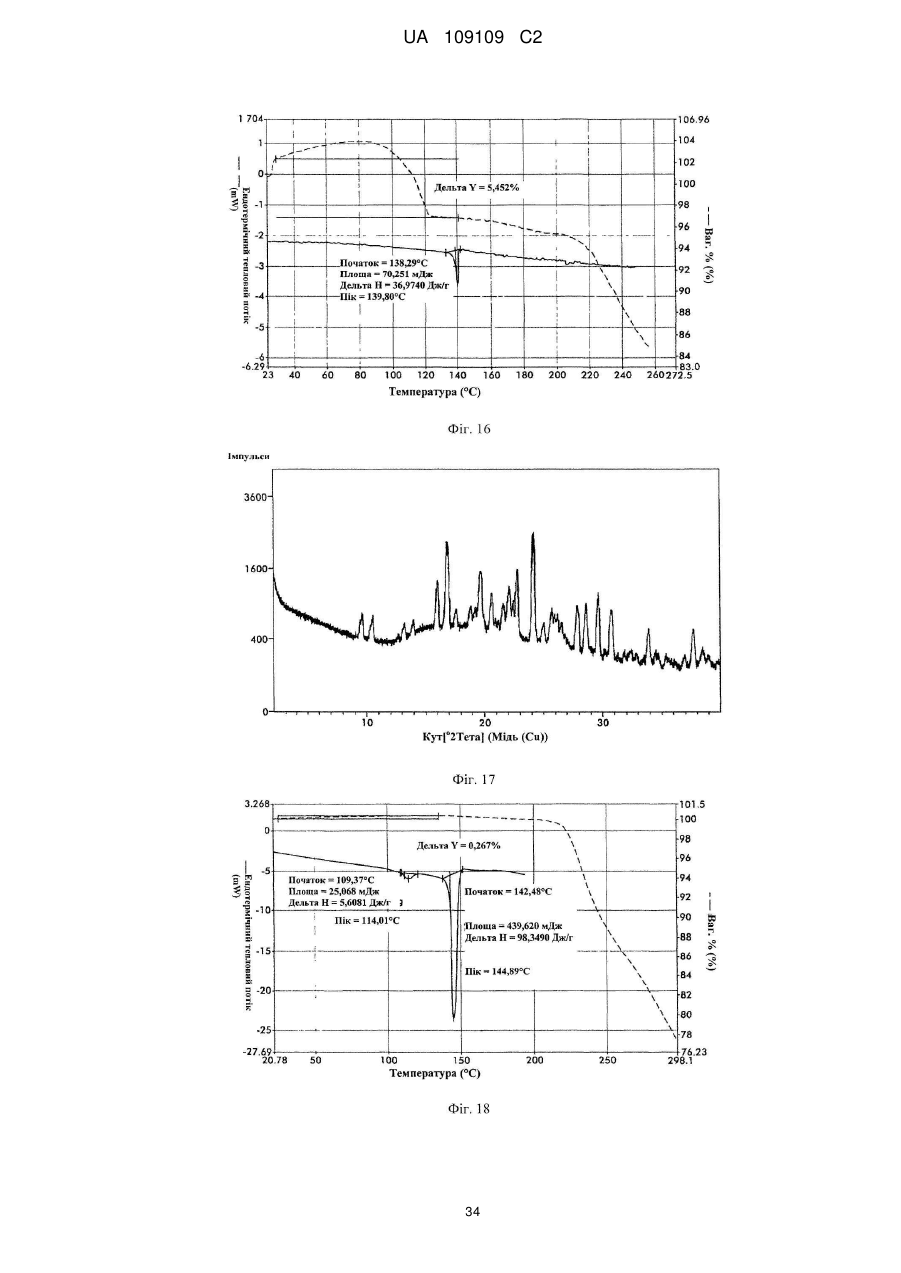
33. Кристалічна форма 9 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 4,44, 13,34, 16,73, 19,54 і 22,32±0,2 градуса 2q.
34. Кристалічна форма вільної основи бендамустину за п. 33, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 22,98, 23,45 і 24,80±0,2 градуса 2q.
35. Кристалічна форма вільної основи бендамустину за п. 33, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 15.
36. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 33-35.
37. Кристалічна форма 10 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 16,82, 16,93, 17,06, 19,68, 19,83, 22,87, 24,24, 28,63 і 29,72±0,2 градуса 2q.
38. Кристалічна форма вільної основи бендамустину за п. 37, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 16,13, 25,75 і 37,71±0,2 градуса 2q.
39. Кристалічна форма вільної основи бендамустину за п. 37, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 17.
40. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 37-39.
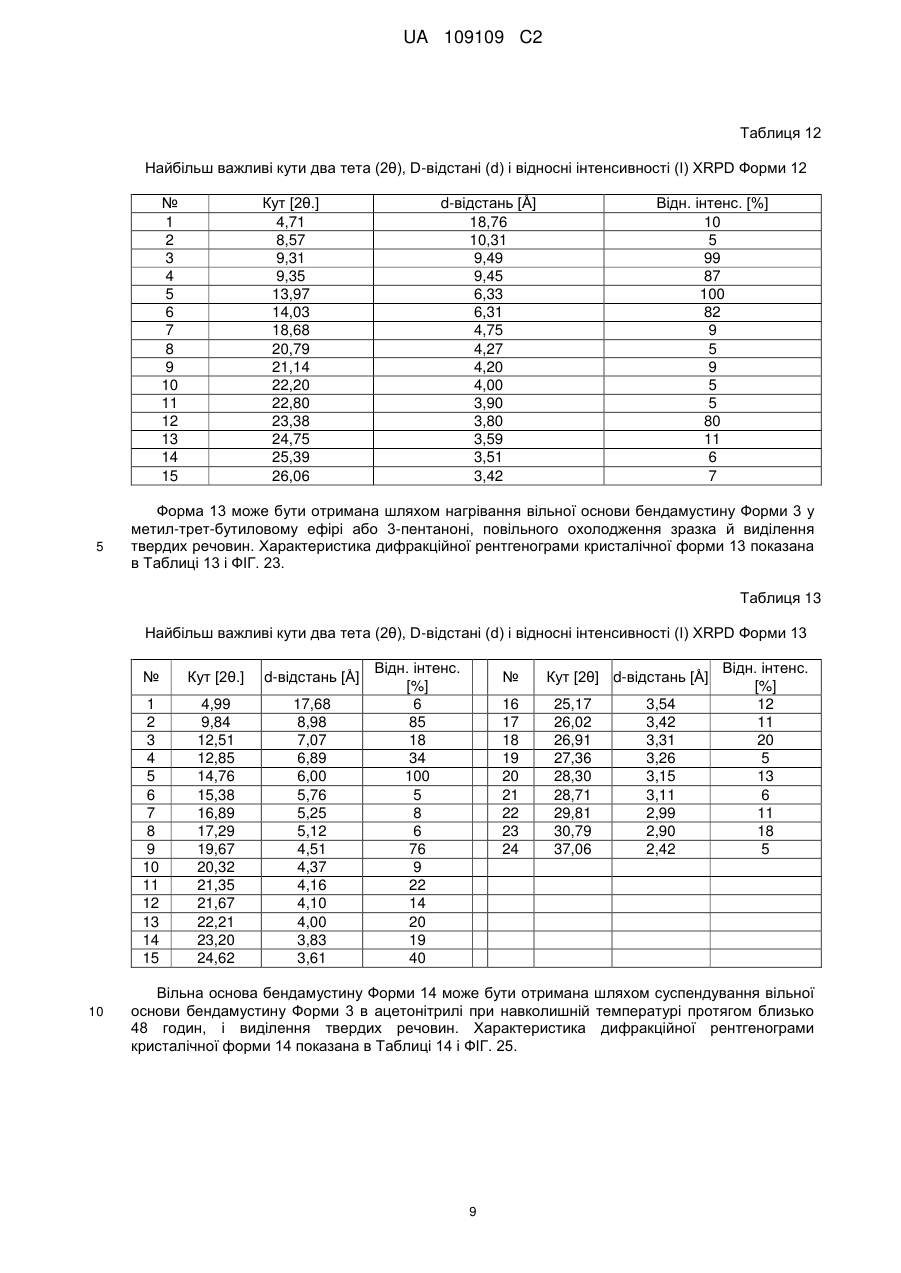
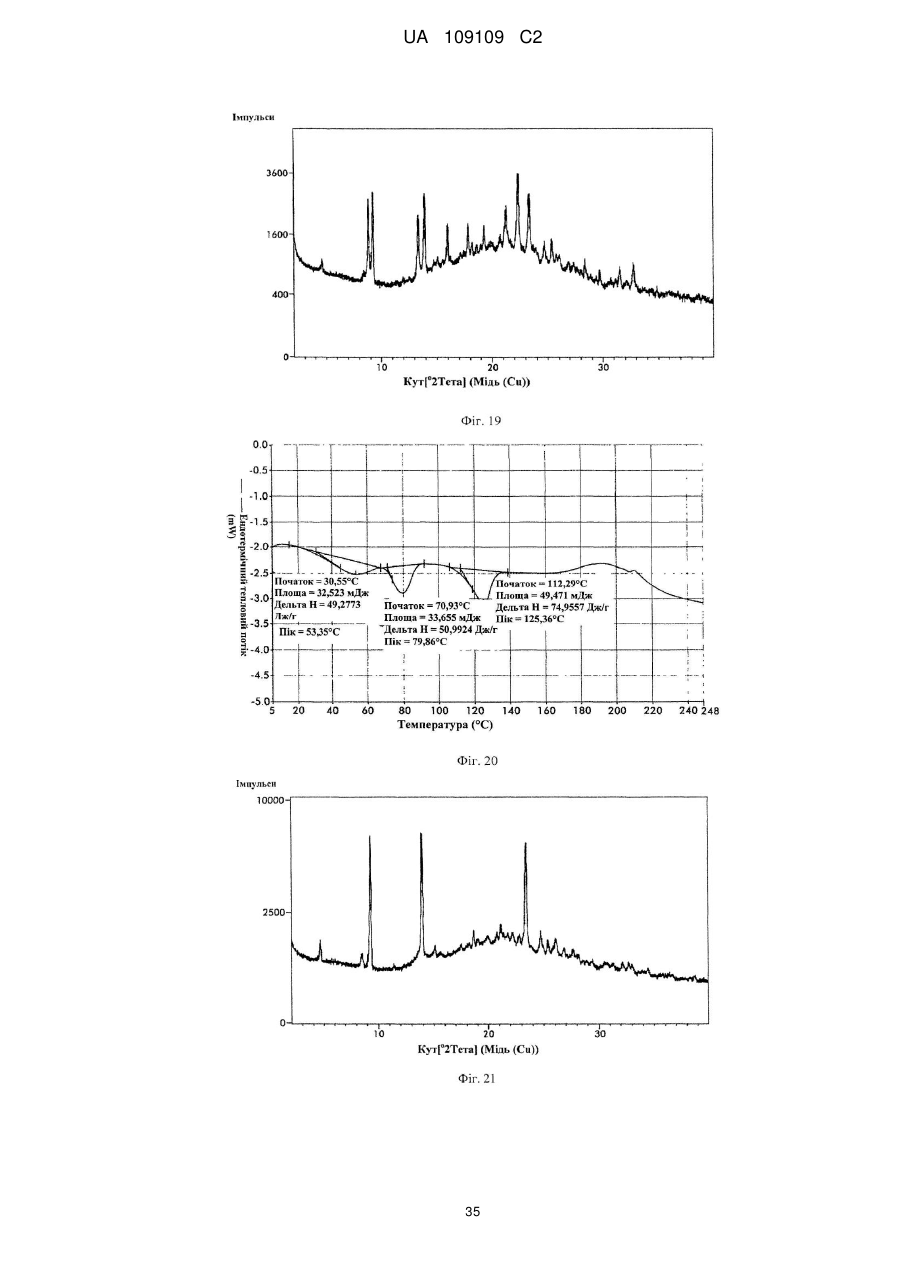
41. Кристалічна форма 11 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 8,90, 9,28, 13,94, 22,36 і 23,33±0,2 градуса 2q.
42. Кристалічна форма вільної основи бендамустину за п. 41, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 16,01, 19,30, 21,29 і 25,38±0,2 градуса 2q.
43. Кристалічна форма вільної основи бендамустину за п. 41, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 19.
44. Фармацевтична композиція для лікування раку, що містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 41-43.
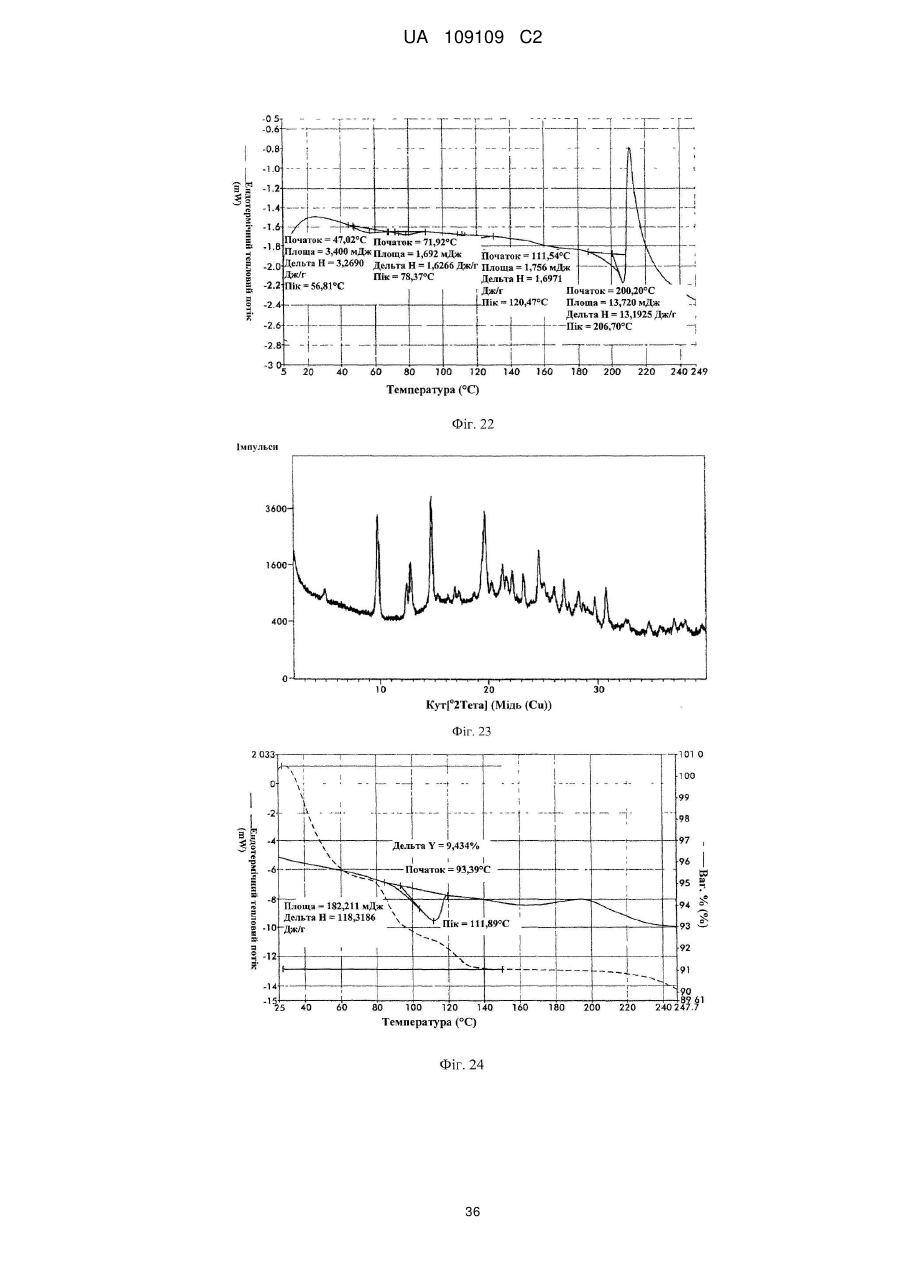
45. Кристалічна форма 12 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 9,31, 9,35, 13,97, 14,03 і 23,38±0,2 градуса 2q.
46. Кристалічна форма вільної основи бендамустину за п. 45, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 4,71, 24,75 і 26,06±0,2 градуса 2q.
47. Кристалічна форма вільної основи бендамустину за п. 45, що має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 21.
48. Фармацевтична композиція для лікування раку, що містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 45-47.
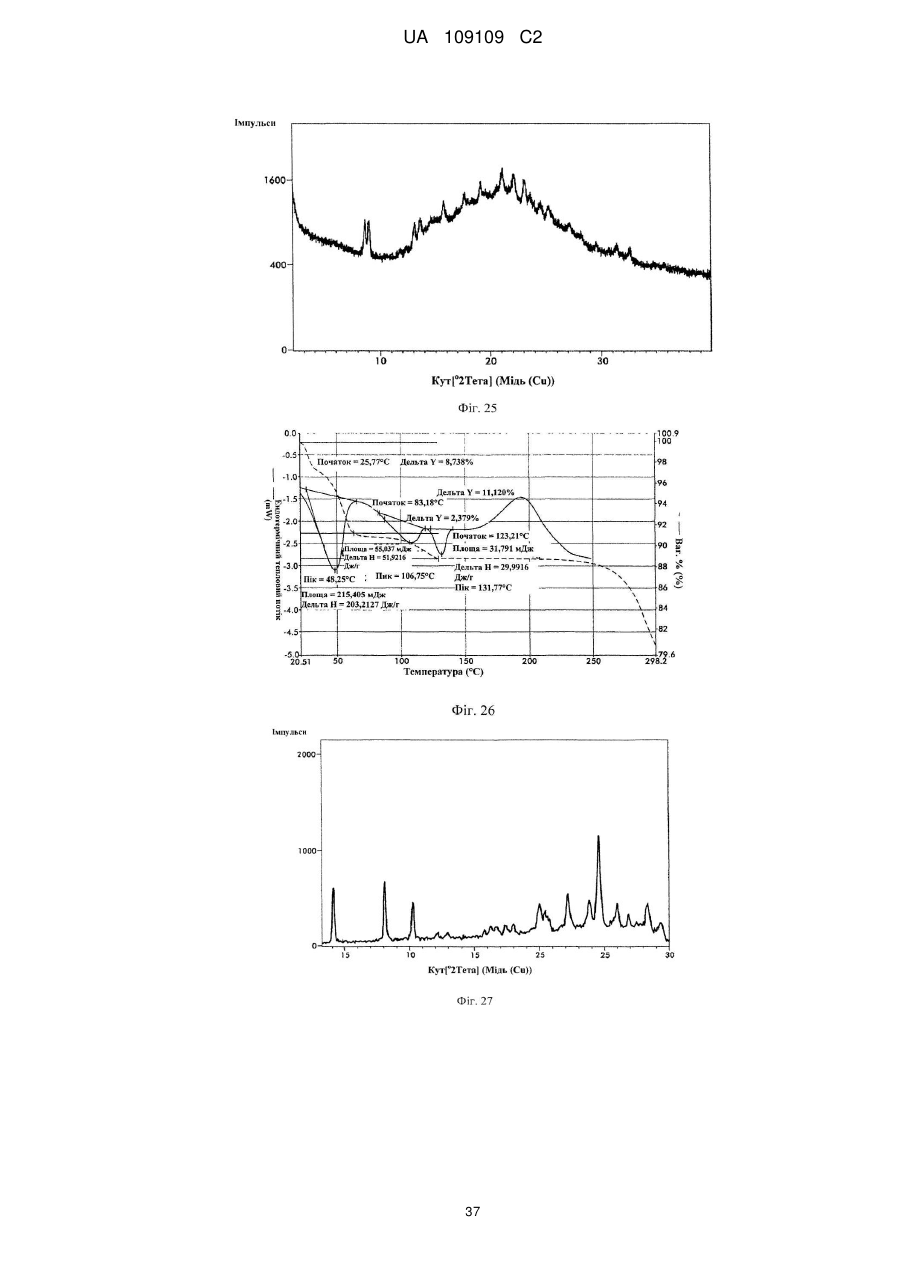
49. Кристалічна форма 13 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 9,84, 14,76, 19,67 і 24,62±0,2 градуса 2q.
50. Кристалічна форма вільної основи бендамустину за п. 49, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 21,35, 22,21, 23,20 і 26,91±0,2 градуса 2q.
51. Кристалічна форма вільної основи бендамустину за п. 49, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 23.
52. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 49-51.
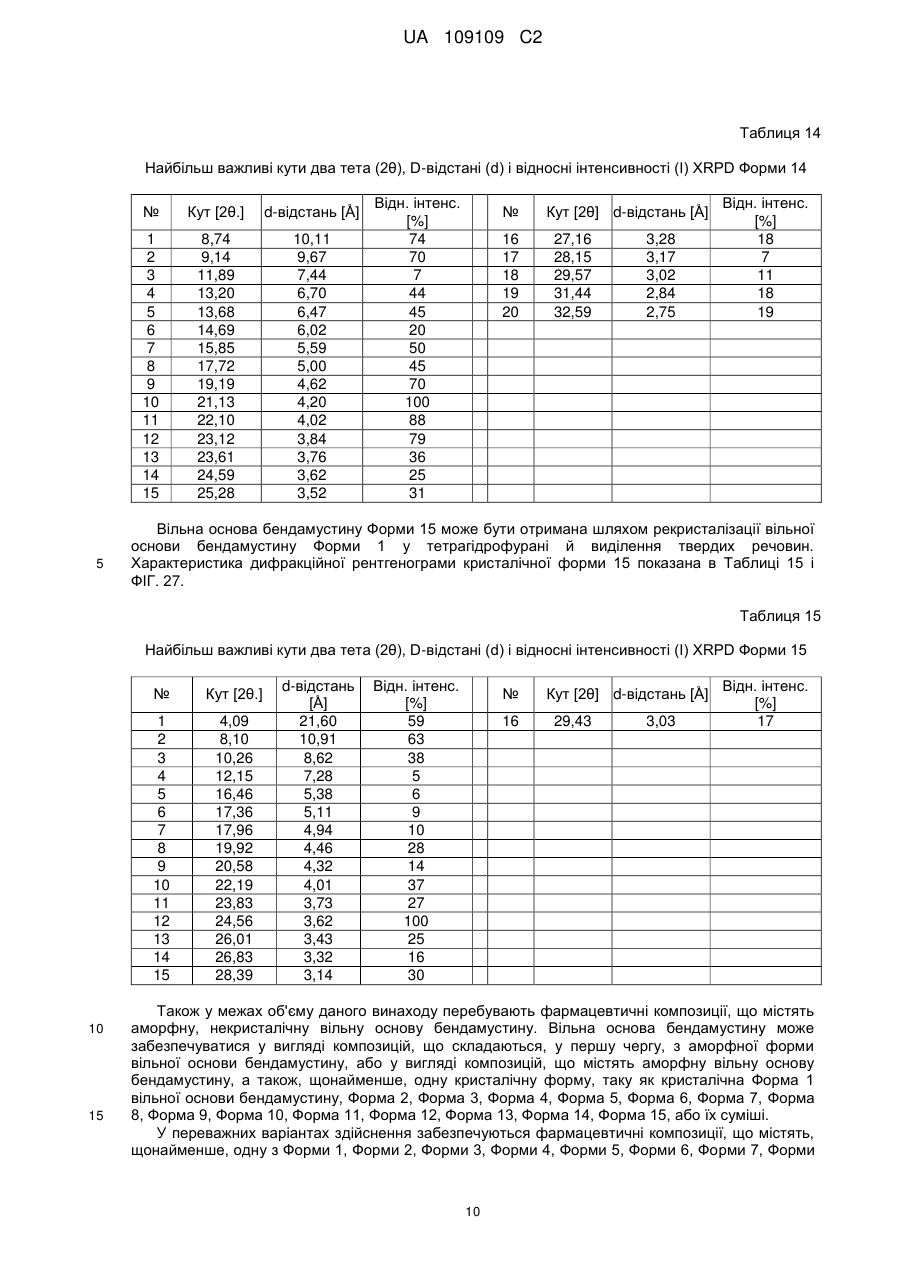
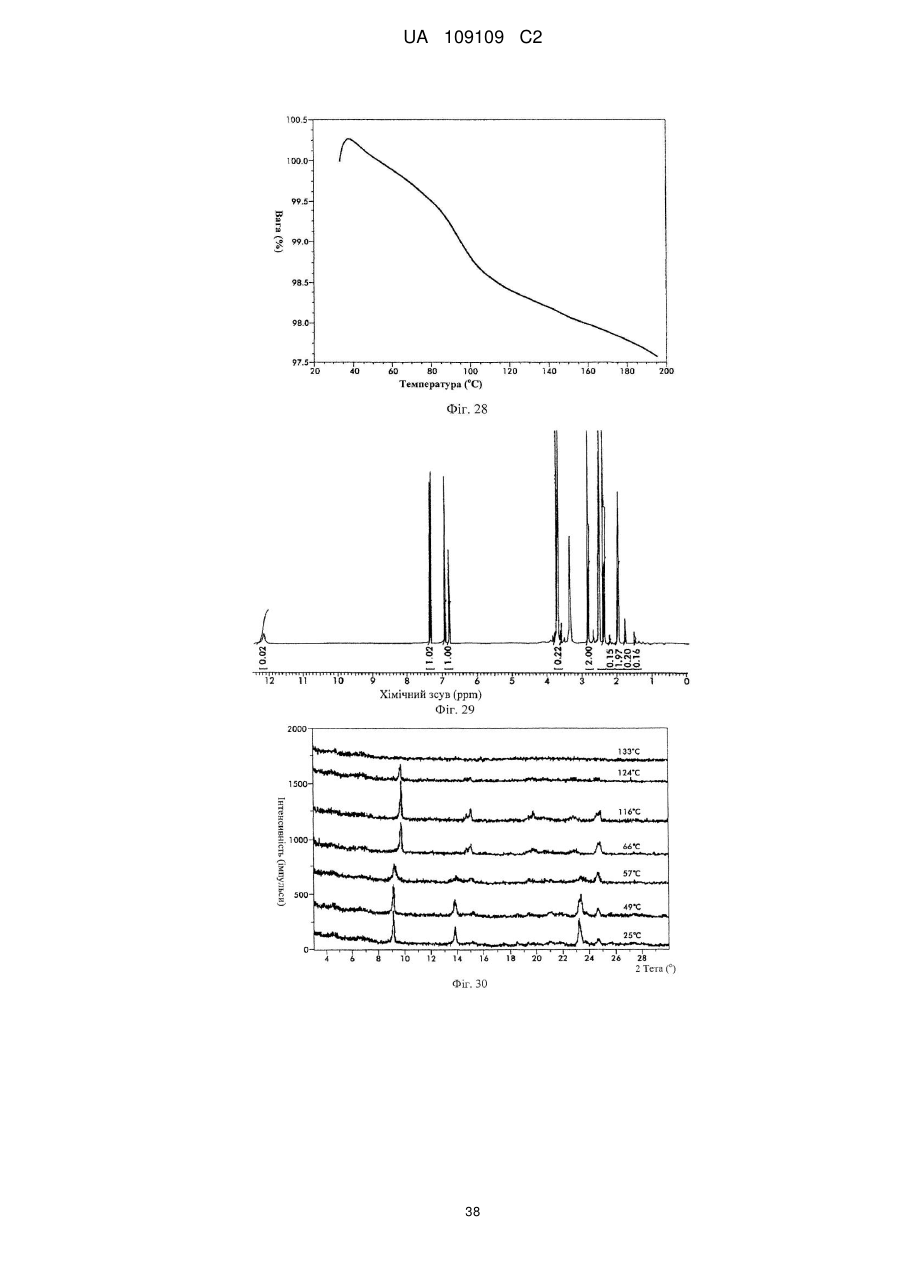
53. Кристалічна форма 14 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 9,14, 17,72, 19,19, 21,13, 22,10, 23,12 і 23,61±0,2 градуса 2q.
54. Кристалічна форма вільної основи бендамустину за п. 53, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 8,74, 15,85, 24,59, 25,28 і 27,16±0,2 градуса 2q.
55. Кристалічна форма вільної основи бендамустину за п. 53, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 25.
56. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 53-55.
57. Кристалічна форма 15 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 24,56, 19,92, 10,26, 8,10 і 4,09±0,2 градуса 2q.
58. Кристалічна форма вільної основи бендамустину за п. 57, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 17,96, 23,83, 26,01, 28,39 і 29,43±0,2 градуса 2q.
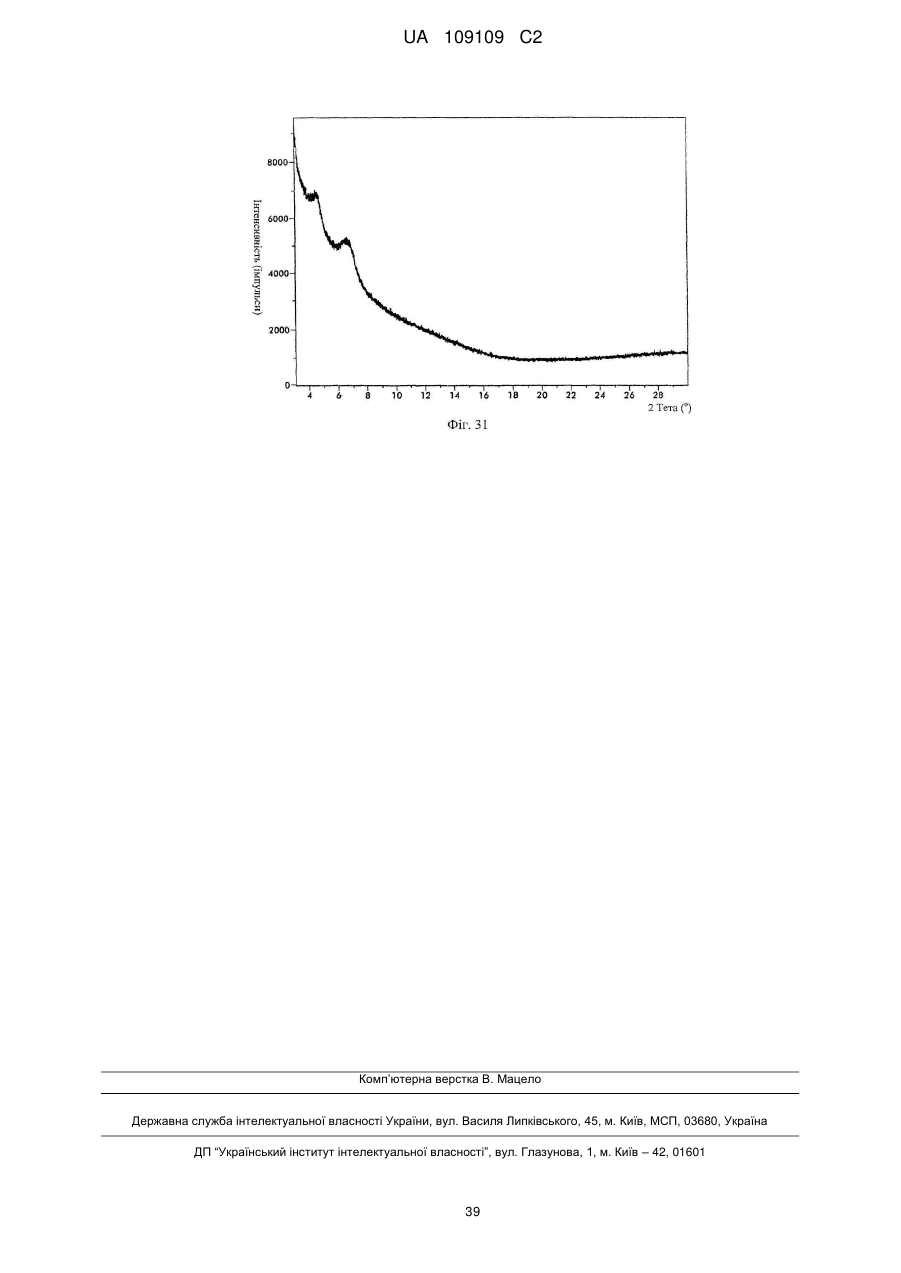
59. Кристалічна форма вільної основи бендамустину за п. 57, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 27.
60. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 57-59.
61. Спосіб лікування хронічного лімфоцитарного лейкозу, хвороби Ходжкіна, неходжкінської лімфоми, множинної мієломи або раку молочної залози, який включає введення пацієнтові, що потребує цього, терапевтично ефективної кількості препарату, отриманого з композиції за будь-яким з попередніх пунктів.
Текст
Реферат: Описані нові поліморфні форми вільної основи бендамустину, включаючи аморфну вільну основу бендамустину, шість безводних кристалічних форм, чотири гідратні форми й п'ять сольватних форм, а також описані способи їх одержання й застосування. UA 109109 C2 (12) UA 109109 C2 UA 109109 C2 5 10 15 ОБЛАСТЬ ВИНАХОДУ Даний винахід стосується композицій, що містять вільну основу бендамустину, фармацевтичних композицій, що містять вільну основу бендамустину, способів їх відтворюваного одержання й способів лікування пацієнтів, використовуючи їх. ПЕРЕДУМОВИ ВИНАХОДУ Активні фармацевтичні інгредієнти (API) можуть бути отримані в безлічі різних форм, наприклад, хімічних похідних, сольватів, гідратів, сокристалів або солей. API можуть також бути аморфними, можуть мати різні кристалічні поліморфи або можуть існувати в різних станах сольватації або гідратації. Шляхом зміни форми API можливо змінювати його фізичні властивості. Наприклад, кристалічні поліморфи типово мають різні розчинності так, що більш термодинамічно стабільний поліморф є менш розчинним ніж менш термодинамічно стабільний поліморф. Поліморфи можуть також відрізнятися за властивостями, такими як строк зберігання, біодоступність, морфологія, тиск пари, щільність, колір і стисливість. Відповідно, зміна кристалічного стану API є одним зі шляхів, якими модулюють його фізичні й фармакологічні властивості. Бендамустин, 4-{5-[біс(2-хлоретил)аміно]-1-метил-2-бензімідазоліл} бутанова кислота: O OH N Cl N N Cl 20 25 30 35 40 45 50 Бендамустин спочатку був синтезований в 1963 у Німецькій Демократичній Республіці (НДР) і був доступний з 1971 до 1992 там у якості гідрохлоридної солі під торговельною назвою Cytostasan®. Відтоді він продавався в Німеччині під торговельною назвою Ribomustin. Ribomustin являє собою аморфний, некристалічний порошок. Бендамустин гідрохлорид для ін'єкції доступний у Сполучених Штатах Америки під торговельною назвою Treanda®. Бендамустин являє собою алкілуючий засіб, який, як було показано, має терапевтичне застосування в лікуванні хвороб, таких як хронічний лімфоцитарний лейкоз, хвороба Ходжкіна, неходжкінська лімфома, множинна мієлома і рак молочної залози. Він поставляється у вигляді ліофілізованого коржу гідрохлоридної солі бендамустину. Безпосередньо перед лікуванням ліофілізований корж розчиняють у фармацевтично прийнятному розріджувачі, переважно хлориді натрію для ін'єкції. В цілому бажано, щоб композиції для ін'єкцій поставлялися у вигляді форми вільної основи, а не формі солі, для мінімізації будь-яких побічних ефектів, які може робити протиіон. Раніше описані форми вільної основи бендамустину, однак, були нестабільними й не підходили для комерційного одержання, доставки й введення. У результаті необхідні стабільні форми вільної основи бендамустину. КОРОТКИЙ ОПИС ДАНОГО ВИНАХОДУ У даному документі описано п'ятнадцять нових, кристалічних поліморфних форм вільної основи бендамустину. Також описані фармацевтичні композиції, що містять одну або більше з описаних поліморфних форм вільної основи бендамустину, а також фармацевтичні композиції, що додатково містять аморфну вільну основу бендамустину. Також описані, наприклад, способи застосування бажаних форм і композицій для лікування лейкозу, лімфоми, мієломи й раку молочної залози. КОРОТКИЙ ОПИС ГРАФІЧНИХ МАТЕРІАЛІВ ФІГ. 1 являє собою спектр порошкової рентгенівської дифрактограми (XRPD) Форми 1 вільної основи бендамустину. ФІГ. 1A Накладення даних диференціальної скануючої калориметрії/термогравіметричного аналізу (DSC/TGA) для Форми 1. ФІГ. 2 являє собою XRPD спектр Форми 2 вільної основи бендамустину. ФІГ. 3 являє собою накладення DSC/TGA даних для Форми 2 вільної основи бендамустину. ФІГ. 4 являє собою XRPD спектр Форми 3 вільної основи бендамустину. ФІГ. 5 являє собою накладення DSC/TGA даних для Форми 3 вільної основи бендамустину. ФІГ. 6 являє собою XRPD спектр Форми 4 вільної основи бендамустину. ФІГ. 7 являє собою XRPD спектр Форми 5 вільної основи бендамустину. 1 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 55 60 ФІГ. 8 являє собою накладення DSC/TGA даних для Форми 5 вільної основи бендамустину. ФІГ. 9 являє собою XRPD спектр Форми 6 вільної основи бендамустину. ФІГ. 10 являє собою накладення DSC/TGA даних для Форми 6 вільної основи бендамустину. ФІГ. 11 являє собою XRPD спектр Форми 7 вільної основи бендамустину. ФІГ. 12 являє собою накладення DSC/TGA даних для Форми 7 вільної основи бендамустину. ФІГ. 13 являє собою XRPD спектр Форми 8 вільної основи бендамустину. ФІГ. 14 являє собою накладення DSC/TGA даних для Форми 8 вільної основи бендамустину. ФІГ. 15 являє собою XRPD спектр Форми 9 вільної основи бендамустину. ФІГ. 16 являє собою накладення DSC/TGA даних для Форми 9 вільної основи бендамустину. ФІГ. 17 являє собою XRPD спектр Форми 10 вільної основи бендамустину. ФІГ. 18 являє собою накладення DSC/TGA даних для Форми 10 вільної основи бендамустину. ФІГ. 19 являє собою XRPD спектр Форми 11 вільної основи бендамустину. ФІГ. 20 являє собою накладення DSC/TGA даних для Форми 11 вільної основи бендамустину. ФІГ. 21 являє собою XRPD спектр Форми 12 вільної основи бендамустину. ФІГ. 22 являє собою накладення DSC/TGA даних для Форми 12 вільної основи бендамустину. ФІГ. 23 являє собою XRPD спектр Форми 13 вільної основи бендамустину. ФІГ. 24 являє собою накладення DSC/TGA даних для Форми 13 вільної основи бендамустину. ФІГ. 25 являє собою XRPD спектр Форми 14 вільної основи бендамустину. ФІГ. 26 являє собою накладення DSC/TGA даних для Форми 14 вільної основи бендамустину. ФІГ. 27 являє собою XRPD спектр Форми 15 вільної основи бендамустину. ФІГ. 28 являє собою TGA дані для Форми 15 вільної основи бендамустину з розміром зразка 1,4590 мг, який аналізують від навколишньої температури до 200 °C при 10 °C у хвилину. 1 ФІГ. 29 являє собою H ЯМР Форми 15 вільної основи бендамустину. ФІГ. 30 являє собою XRPD при змінній температурі для Форми 3. ФІГ. 31 являє собою XRPD спектр аморфної вільної основи бендамустину. ДОКЛАДНИЙ ОПИС ІЛЮСТРАТИВНИХ ВАРІАНТІВ ЗДІЙСНЕННЯ У наш час виявлені стабільні форми вільної основи бендамустину. У даному документі описані шість поліморфних форм безводної вільної основи бендамустину (Форма 1, Форма 2, Форма 4, Форма 6, Форма 7, Форма 10), а також чотири гідратні форми (Форма 3, Форма 5, Форма 13, Форма 14) і п'ять сольватних форм вільної основи бендамустину (Форма 8, Форма 9, Форма 11, Форма 12, Форма 15). Аморфна вільна основа бендамустину також перебуває в об'ємі даного винаходу. У переважних варіантах здійснення перебувають кристалічні форми вільної основи бендамустину, які являють собою Форму 1, Форму 2, Форму 3, Форму 4, Форму 5, Форму 6, Форму 7, Форму 8, Форму 9, Форму 10, Форму 11, Форму 12, Форму 13, Форму 14, Форму 15 або їх суміші. Ці поліморфи можуть бути визначені за допомогою порошкової рентгенівської дифракції і характеризуватися одним, двома, трьома, чотирма, п'ятьма або більш піками відбиття, які є характеристикою кожної поліморфної форми. 15 кристалічних поліморфів (Форма 1, Форма 2, Форма 3, Форма 4, Форма 5, Форма 6, Форма 7, Форма 8, Форма 9, Форма 10, Форма 11, Форма 12, Форма 13, Форма 14, Форма 15) можна також визначити на основі їх порошкових рентгенівських дифрактограм (XRPD), термограм диференціальної скануючої калориметрії (DSC), термограм термогравіметричного аналізу (TGA) і/або слідів гравіметричної сорбції пари (GVS), які представлені на ФІГ. 1-29. Способи створення кожного поліморфу або суміші поліморфів можуть бути проведені з використанням технік, описаних у даному документі. В іншому варіанті здійснення даного винаходу перебувають фармацевтичні композиції, що містять Форму 1, Форму 2, Форму 3, Форму 4, Форму 5, Форму 6, Форму 7, Форму 8, Форму 9, Форму 10, Форму 11, Форму 12, Форму 13, Форму 14, Форму 15, або їх суміші, вільної основи бендамустину. В інших варіантах здійснення даного винаходу перебувають фармацевтичні композиції, що містять одну або більш із Форми 1, Форми 2, Форми 3, Форми 4, Форми 5, Форми 6, Форми 7, Форми 8, Форми 9, Форми 10, Форми 11, Форми 12, Форми 13, Форми 14 або Форми 15 з аморфним (тобто, некристалічним) бендамустином. У ще одному варіанті здійснення даного винаходу перебувають фармацевтичні композиції, що містять Форму 1, Форму 2, Форму 3, Форму 4, Форму 5, Форму 6, Форму 7, Форму 8, Форму 9, Форму 10, Форму 11, Форму 12, Форму 13, Форму 14, Форму 15, або їх суміші, вільної основи бендамустину й, щонайменше, один фармацевтично прийнятний наповнювач або носій. В інших 2 UA 109109 C2 5 10 15 20 варіантах здійснення даного винаходу перебувають фармацевтичні композиції, що містять одну або більш із Форми 1, Форми 2, Форми 3, Форми 4, Форми 5, Форми 6, Форми 7, Форми 8, Форми 9, Форми 10, Форми 11, Форми 12, Форми 13, Форми 14 або Форми 15 з аморфним (тобто, некристалічним) бендамустином і, щонайменше, одним фармацевтично прийнятним наповнювачем або носієм. Техніки, такі як термічний аналіз (DSC, TGA/MS) і рентгенівська дифракція, є загальноприйнятими як для визначення параметрів, так і для кількісного аналізу різних кристалічних форм. Загальноприйнято, що додаткові аналітичні техніки слід застосовувати для правильного визначення параметрів усіх різних кристалічних форм. Серія експериментів з кристалізації була проведена для того, щоб досліджувати ефекти розчинника, способу кристалізації й температури для того, щоб ідентифікувати й визначити параметри поліморфів і сольватів вільної основи бендамустину. Вільна основа бендамустину Форми 1 може бути отримана шляхом суспендування вільної основи бендамустину Форми 2 в 2-бутанолі, ацетонітрилі, циклогексані, етилацетаті, метилтрет-бутиловому ефірі, n-бутилацетаті, пропіонітрилі або тетрагідропірані, нагрівання зразка, повільного охолодження зразка й виділення твердих речовин. Альтернативно, вільна основа бендамустину Форми 1 може бути отримана шляхом суспендування вільної основи бендамустину Форми 2 в 1-бутанолі, 1, 4-діоксані, 1-пропанолі, ацетоні, хлороформі, циклогексані, етанолі, метилізобутилкетоні, метил-трет-бутиловому ефірі, n-бутилацетаті, пропіонітрилі, тетрагідропірані або толуолі. Зразок суспендували протягом 48 годин з 4 годинними періодами, що чергуються, при 50 °C і 5 °C, і виділяли тверду речовину. Характеристика дифракційної рентгенограми кристалічної Форми 1 показана в Таблиці 1 і ФІГ. 1. Таблиця 1 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 1 № Кут [2θ.] d-відстань [Å] 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 9,54 10,34 10,40 13,12 15,93 16,69 16,84 17,52 19,59 20,53 20,77 20,80 21,48 21,97 22,30 9,27 8,55 8,50 6,74 5,56 5,31 5,26 5,06 4,53 4,32 4,27 4,27 4,13 4,04 3,98 Відн. інтенс. [%] 12 62 45 12 43 45 36 33 30 49 29 25 15 25 71 № Кут [2θ] d-відстань [Å] 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 22,67 24,03 24,88 25,77 26,03 27,64 27,80 28,43 28,54 29,50 30,62 30,70 33,70 36,73 36,77 3,92 3,70 3,58 3,45 3,42 3,22 3,21 3,14 3,12 3,03 2,92 2,91 2,66 2,44 2,44 Відн. інтенс. [%] 51 100 24 20 51 21 17 73 20 72 36 17 15 15 14 25 30 Вільна основа бендамустину Форми 2 може бути отримана з бендамустину гідрохлориду. Обробка водного розчину бендамустину гідрохлориду за допомогою NaOH (1M у воді) призводить до осадження вільної основи бендамустину Форми 2, і осад можна відфільтрувати для виділення Форми 2. Характеристика дифракційної рентгенограми кристалічної Форми 2 показана в Таблиці 2 і ФІГ. 2. 3 UA 109109 C2 Таблиця 2 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 2 № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 5 Кут [2θ.] 10,28 12,54 13,51 15,40 19,81 20,59 21,55 21,69 22,39 24,78 26,65 27,62 31,36 36,38 37,51 d-відстань [Å] 8,60 7,05 6,55 5,75 4,48 4,31 4,12 4,09 3,97 3,59 3,34 3,23 2,85 2,47 2,40 Відн. інтенс. [%] 100 8 21 20 5 60 26 29 11 11 9 5 5 5 6 Вільна основа бендамустину Форми 3 може бути отримана за допомогою гідролізу, опосередкованого основою, складного етилового ефіру бендамустину. Характеристика дифракційної рентгенограми кристалічної Форми 3 показана в Таблиці 3 і ФІГ. 4. Таблиця 3 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 3 № d-відстань [Å] 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 10 Кут [2θ.] 4,78 9,41 9,46 14,15 15,47 18,78 19,50 20,31 21,24 22,12 23,42 23,65 24,04 24,83 25,79 18,46 9,40 9,34 6,26 5,72 4,72 4,55 4,37 4,18 4,02 3,79 3,76 3,70 3,58 3,45 Відн. інтенс. [%] 5 100 88 30 14 11 14 5 21 15 28 32 10 34 6 № Кут [2θ] d-відстань [Å] 16 17 18 27,63 27,86 31,71 3,23 3,20 2,82 Відн. інтенс. [%] 6 6 8 Вільна основа бендамустину Форми 4 може бути отримана, піддаючи вільну основу бендамустину Форми 3 дії 0 % відносної вологості. Характеристика дифракційної рентгенограми кристалічної Форми 4 показана в Таблиці 4 і ФІГ. 6. 4 UA 109109 C2 Таблиця 4 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD для Форми 4 № 1 2 3 4 5 6 7 8 9 10 11 5 Кут [2θ.] 9,88 14,88 15,13 18,05 19,44 19,92 20,70 20,91 22,99 24,72 24,98 d-відстань [Å] 8,96 5,95 5,86 4,91 4,57 4,46 4,29 4,25 3,87 3,60 3,56 Відн. інтенс. [%] 100 15 35 6 12 23 7 8 17 35 31 Вільна основа бендамустину Форми 5 може бути отримана, піддаючи вільну основу бендамустину Форми 3 дії близько 85 % відносної вологості протягом близько 1 дня. Характеристика дифракційної рентгенограми кристалічної Форми 5 показана в Таблиці 5 і ФІГ. 7. Таблиця 5 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 5 № 15 d-відстань [Å] 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 10 Кут [2θ.] 8,94 12,07 13,39 14,84 16,04 16,28 17,20 17,90 18,16 19,29 20,76 21,31 21,50 22,38 23,41 9,88 7,33 6,61 5,96 5,52 5,44 5,15 4,95 4,88 4,60 4,28 4,17 4,13 3,97 3,80 Відн. інтенс. [%] 100 5 71 8 58 8 5 44 13 29 12 49 16 99 9 № 16 17 18 19 20 21 22 23 24 25 26 27 Кут [2θ] d-відстань [Å] 23,74 23,96 24,18 25,37 25,82 26,95 27,38 28,37 29,75 31,57 31,96 32,81 3,75 3,71 3,68 3,51 3,45 3,31 3,26 3,14 3,00 2,83 2,80 2,73 Відн. інтенс. [%] 14 13 11 19 6 6 11 12 10 10 5 13 Вільна основа бендамустину Форми 6 може бути отримана шляхом суспендування вільної основи бендамустину Форми 3 в 1-бутанолі або 1-пропанолі, нагрівання зразка, повільного охолодження зразка й потім виділення твердих речовин. Альтернативно, вільна основа бендамустину Форми 6 може бути отримана шляхом суспендування вільної основи бендамустину Форми 3 в 1-бутанолі, впливаючи на зразок протягом 4 годинних періодів, що чергуються, при 50 °C і 5 °C, і виділяючи тверді речовини. Характеристика дифракційної рентгенограми кристалічної Форми 6 показана в Таблиці 6 і ФІГ. 9. 5 UA 109109 C2 Таблиця 6 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 6 № d-відстань [Å] 1 2 3 4 5 6 7 8 9 10 11 5 Кут [2θ.] 8,67 10,29 11,48 14,23 17,23 18,15 19,40 20,94 22,55 22,95 25,46 10,19 8,59 7,70 6,22 5,14 4,88 4,57 4,24 3,94 3,87 3,50 Відн. інтенс. [%] 98 18 61 41 48 78 48 60 100 52 98 № 12 13 14 15 16 17 Кут [2θ] d-відстань [Å] 26,21 27,74 28,68 29,88 31,57 34,62 3,40 3,21 3,11 2,99 2,83 2,59 Відн. інтенс. [%] 42 44 41 16 18 40 Вільна основа бендамустину Форми 7 може бути отримана шляхом суспендування вільної основи бендамустину Форми 3 в N, N-диметилформаміді або ізопропілацетаті. Зразки нагрівали, повільно охолоджували й виділяли тверду речовину. Альтернативно, вільна основа бендамустину Форми 7 може бути отримана шляхом суспендування вільної основи бендамустину Форми 3 в N, N-диметилформаміді, впливаючи на зразок протягом 4 годинних періодів, що чергуються, при 50 °C і 5 °C, і виділяючи тверді речовини. Характеристика дифракційної рентгенограми кристалічної форми 7 показана в Таблиці 7 і ФІГ. 11. 10 Таблиця 7 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 7 № d-відстань [Å] 1 2 3 4 5 6 7 8 9 10 11 15 Кут [2θ.] 7,06 8,51 8,56 11,42 14,23 17,10 17,62 17,97 20,53 21,25 22,08 12,51 10,39 10,32 7,74 6,22 5,18 5,03 4,93 4,32 4,18 4,02 Відн. інтенс. [%] 6 95 100 20 25 13 17 25 10 49 13 № 12 13 14 15 16 17 18 19 20 21 Кут [2θ] d-відстань [Å] 22,87 23,29 24,04 25,13 27,39 28,09 28,94 32,33 34,50 36,31 3,89 3,82 3,70 3,54 3,25 3,17 3,08 2,77 2,60 2,47 Відн. інтенс. [%] 13 36 24 7 12 17 18 14 16 20 Вільна основа бендамустину Форми 8 може бути отримана шляхом суспендування вільної основи бендамустину Форми 3 в етанолі, впливаючи на зразок протягом 4 годинних періодів, що чергуються, при 50 °C і 5 °C, і виділяючи тверді речовини. Характеристика дифракційної рентгенограми кристалічної форми 8 показана в Таблиці 8 і ФІГ. 13. 6 UA 109109 C2 Таблиця 8 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 8 № d-відстань [Å] 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 5 Кут [2θ.] 5,25 8,60 9,34 10,45 11,17 13,97 15,32 15,72 16,25 17,16 20,22 21,01 21,30 21,88 22,48 16,82 10,27 9,46 8,46 7,91 6,34 5,78 5,63 5,45 5,16 4,39 4,23 4,17 4,06 3,95 Відн. інтенс. [%] 9 5 12 45 58 9 60 35 5 9 9 34 31 10 100 № 16 17 18 19 20 21 22 23 24 Кут [2θ] d-відстань [Å] 23,33 23,88 24,36 24,98 25,56 26,40 27,58 30,87 35,31 3,81 3,72 3,65 3,56 3,48 3,37 3,23 2,89 2,54 Відн. інтенс. [%] 5 6 8 95 7 67 16 20 12 Вільна основа бендамустину Форми 9 може бути отримана шляхом нагрівання вільної основи бендамустину Форми 2 в 3-пентаноні, повільного охолодження зразка й виділення твердих речовин. Характеристика дифракційної рентгенограми кристалічної форми 9 показана в Таблиці 9 і ФІГ. 15. Таблиця 9 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 9 № d-відстань [Å] 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 10 Кут [2θ.] 4,44 8,88 9,13 12,67 13,34 16,56 16,73 17,50 17,82 18,31 19,15 19,33 19,54 20,36 20,90 19,88 9,95 9,68 6,98 6,63 5,35 5,30 5,06 4,97 4,84 4,63 4,59 4,54 4,36 4,25 Відн. інтенс. [%] 28 22 28 15 44 32 64 5 23 13 14 18 43 10 8 № 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Кут [2θ] d-відстань [Å] 21,89 22,32 22,66 22,98 23,45 23,69 24,80 25,92 26,28 26,80 29,26 30,71 31,38 31,64 36,09 4,06 3,98 3,92 3,87 3,79 3,75 3,59 3,43 3,39 3,32 3,05 2,91 2,85 2,83 2,49 Відн. інтенс. [%] 14 100 25 29 27 18 24 9 17 11 5 8 13 9 10 Вільна основа бендамустину Форми 10 може бути отримана шляхом нагрівання вільної основи бендамустину Форми 2 у толуолі, повільного охолодження зразка й виділення твердих речовин. Характеристика дифракційної рентгенограми кристалічної форми 10 показана в Таблиці 10 і ФІГ. 17. 7 UA 109109 C2 Таблиця 10 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 10 № d-відстань [Å] 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 5 Кут [2θ.] 9,76 10,59 16,13 16,82 16,93 17,06 17,72 18,90 19,31 19,68 19,83 20,72 21,67 22,14 22,51 9,05 8,34 5,49 5,27 5,23 5,19 5,00 4,69 4,59 4,51 4,47 4,28 4,10 4,01 3,95 Відн. інтенс. [%] 11 14 35 65 85 44 13 15 13 51 41 26 17 35 22 № 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Кут [2θ] d-відстань [Å] 22,87 24,03 24,24 25,08 25,75 26,27 26,58 27,85 28,03 28,63 29,72 30,70 30,82 33,90 37,71 3,89 3,70 3,67 3,55 3,46 3,39 3,35 3,20 3,18 3,12 3,00 2,91 2,90 2,64 2,38 Відн. інтенс. [%] 50 51 100 9 23 17 12 29 18 32 37 26 26 18 17 Вільна основа бендамустину Форми 11 може бути отримана шляхом суспендування вільної основи бендамустину Форми 3 в 1-бутанолі, 1,4-діоксані або ізопропілацетаті при навколишній температурі протягом близько 48 годин, і виділення твердих речовин. Характеристика дифракційної рентгенограми кристалічної форми 11 показана в Таблиці 11 і ФІГ. 19. Таблиця 11 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 11 № d-відстань [Å] 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 10 Кут [2θ.] 4,64 8,90 9,28 13,36 13,94 15,11 16,01 17,15 17,86 18,22 18,59 19,30 20,03 20,76 21,29 19,02 9,93 9,52 6,62 6,35 5,86 5,53 5,17 4,96 4,86 4,77 4,59 4,43 4,28 4,17 Відн. інтенс. [%] 10 86 94 59 87 7 39 5 33 11 8 26 5 13 51 № 16 17 18 19 20 21 22 23 24 25 26 27 28 Кут [2θ] d-відстань [Å] 22,36 23,33 24,02 24,72 25,38 25,79 26,05 26,92 27,36 28,38 29,71 31,53 32,77 3,97 3,81 3,70 3,60 3,51 3,45 3,42 3,31 3,26 3,14 3,00 2,84 2,73 Відн. інтенс. [%] 100 73 7 20 24 10 10 7 8 14 9 11 18 Вільна основа бендамустину Форми 12 може бути отримана шляхом суспендування вільної основи бендамустину Форми 3 в N, N-диметилформаміді при навколишній температурі протягом близько 48 годин, і виділення твердих речовин. Характеристика дифракційної рентгенограми кристалічної форми 12 показана в Таблиці 12 і ФІГ. 21. 8 UA 109109 C2 Таблиця 12 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 12 № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 5 Кут [2θ.] 4,71 8,57 9,31 9,35 13,97 14,03 18,68 20,79 21,14 22,20 22,80 23,38 24,75 25,39 26,06 d-відстань [Å] 18,76 10,31 9,49 9,45 6,33 6,31 4,75 4,27 4,20 4,00 3,90 3,80 3,59 3,51 3,42 Відн. інтенс. [%] 10 5 99 87 100 82 9 5 9 5 5 80 11 6 7 Форма 13 може бути отримана шляхом нагрівання вільної основи бендамустину Форми 3 у метил-трет-бутиловому ефірі або 3-пентаноні, повільного охолодження зразка й виділення твердих речовин. Характеристика дифракційної рентгенограми кристалічної форми 13 показана в Таблиці 13 і ФІГ. 23. Таблиця 13 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 13 № d-відстань [Å] 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 10 Кут [2θ.] 4,99 9,84 12,51 12,85 14,76 15,38 16,89 17,29 19,67 20,32 21,35 21,67 22,21 23,20 24,62 17,68 8,98 7,07 6,89 6,00 5,76 5,25 5,12 4,51 4,37 4,16 4,10 4,00 3,83 3,61 Відн. інтенс. [%] 6 85 18 34 100 5 8 6 76 9 22 14 20 19 40 № 16 17 18 19 20 21 22 23 24 Кут [2θ] d-відстань [Å] 25,17 26,02 26,91 27,36 28,30 28,71 29,81 30,79 37,06 3,54 3,42 3,31 3,26 3,15 3,11 2,99 2,90 2,42 Відн. інтенс. [%] 12 11 20 5 13 6 11 18 5 Вільна основа бендамустину Форми 14 може бути отримана шляхом суспендування вільної основи бендамустину Форми 3 в ацетонітрилі при навколишній температурі протягом близько 48 годин, і виділення твердих речовин. Характеристика дифракційної рентгенограми кристалічної форми 14 показана в Таблиці 14 і ФІГ. 25. 9 UA 109109 C2 Таблиця 14 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 14 № d-відстань [Å] 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 5 Кут [2θ.] 8,74 9,14 11,89 13,20 13,68 14,69 15,85 17,72 19,19 21,13 22,10 23,12 23,61 24,59 25,28 10,11 9,67 7,44 6,70 6,47 6,02 5,59 5,00 4,62 4,20 4,02 3,84 3,76 3,62 3,52 Відн. інтенс. [%] 74 70 7 44 45 20 50 45 70 100 88 79 36 25 31 № 16 17 18 19 20 Кут [2θ] d-відстань [Å] 27,16 28,15 29,57 31,44 32,59 3,28 3,17 3,02 2,84 2,75 Відн. інтенс. [%] 18 7 11 18 19 Вільна основа бендамустину Форми 15 може бути отримана шляхом рекристалізації вільної основи бендамустину Форми 1 у тетрагідрофурані й виділення твердих речовин. Характеристика дифракційної рентгенограми кристалічної форми 15 показана в Таблиці 15 і ФІГ. 27. Таблиця 15 Найбільш важливі кути два тета (2θ), D-відстані (d) і відносні інтенсивності (I) XRPD Форми 15 № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 10 15 Кут [2θ.] 4,09 8,10 10,26 12,15 16,46 17,36 17,96 19,92 20,58 22,19 23,83 24,56 26,01 26,83 28,39 d-відстань [Å] 21,60 10,91 8,62 7,28 5,38 5,11 4,94 4,46 4,32 4,01 3,73 3,62 3,43 3,32 3,14 Відн. інтенс. [%] 59 63 38 5 6 9 10 28 14 37 27 100 25 16 30 № 16 Кут [2θ] d-відстань [Å] 29,43 3,03 Відн. інтенс. [%] 17 Також у межах об'єму даного винаходу перебувають фармацевтичні композиції, що містять аморфну, некристалічну вільну основу бендамустину. Вільна основа бендамустину може забезпечуватися у вигляді композицій, що складаються, у першу чергу, з аморфної форми вільної основи бендамустину, або у вигляді композицій, що містять аморфну вільну основу бендамустину, а також, щонайменше, одну кристалічну форму, таку як кристалічна Форма 1 вільної основи бендамустину, Форма 2, Форма 3, Форма 4, Форма 5, Форма 6, Форма 7, Форма 8, Форма 9, Форма 10, Форма 11, Форма 12, Форма 13, Форма 14, Форма 15, або їх суміші. У переважних варіантах здійснення забезпечуються фармацевтичні композиції, що містять, щонайменше, одну з Форми 1, Форми 2, Форми 3, Форми 4, Форми 5, Форми 6, Форми 7, Форми 10 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 55 60 8, Форми 9, Форми 10, Форми 11, Форми 12, Форми 13, Форми 14 або Форми 15 і, факультативно, аморфну вільну основу бендамустину, а також, щонайменше, один фармацевтично прийнятний наповнювач. Фармацевтично прийнятні наповнювачі відомі в даному рівні техніки й включають ті, які описані в, наприклад, Заявці на патент США № 11/267010. Ці фармацевтичні композиції можуть бути отримані як ін'єкційні препарати, або як рідкі розчини, або суспензії, а також тверді форми, наприклад, капсули, таблетки, ромбовидні коржі, пастилки, порошки, суспензії й подібне. У переважних варіантах здійснення фармацевтичні композиції є сублімованими, переважно висушеними заморожуванням або ліофілізованими, композиціями. В інших варіантах здійснення забезпечуються способи одержання таких сублімованих, переважно висушених заморожуванням або ліофілізованих, препаратів вільної основи бендамустину, які містять Форму 1, Форму 2, Форму 3, Форму 4, Форму 5, Форму 6, Форму 7, Форму 8, Форму 9, Форму 10, Форму 11, Форму 12, Форму 13, Форму 14, Форму 15 або їх суміш. Ліофілізація включає додавання води до сполуки з наступним заморожуванням отриманої суспензії або розчину, і сублімації води зі сполуки. У переважних варіантах здійснення, щонайменше, один органічний розчинник додають до суспензії/розчину. В інших переважних варіантах здійснення суспензія/розчин додатково містить наповнювач для ліофілізації. Ліофілізовані препарати вільної основи бендамустину даного винаходу можуть додатково містити аморфна вільна основа бендамустину. У типовій процедурі ліофілізації воду, фармацевтично прийнятний наповнювач для ліофілізації, органічний розчинник і вільну основу бендамустину комбінують, переважно у стерильних умовах, для утворення розчину. Переважно, розчин готують і стерилізують за допомогою фільтрації. Цей розчин потім ліофілізують, використовуючи стандартне, стерильне обладнання для ліофілізації. Незважаючи на те, що переважні варіанти здійснення даного винаходу включають ліофілізацію вільної основи бендамустину, припускають, що інші техніки сублімації можуть також бути використані. Наприклад, одну або більше з описаних форм вільної основи бендамустину можуть розчиняти, диспергувати або суспендувати у розчиннику, отриману суміш (яка є розчином, дисперсією або суспензією) заморожувати, і розчинник видаляти сублімацією. Наповнювач для ліофілізації може бути будь-яким фармацевтично прийнятним наповнювачем, який, при використанні в ході процесу ліофілізації, дає в результаті ліофілізований продукт, який має покращені властивості, наприклад, покращені технологічні властивості, властивості розчинності й подібне. Наповнювач для ліофілізації може бути, наприклад, об'ємоутворюючим засобом; підходящі об'ємоутворюючі засоби відомі в даному рівні техніки. Приклади підходящих наповнювачів для ліофілізації включають, наприклад, фосфат натрію, фосфат калію, лимонну кислоту, винну кислоту, желатин, гліцин, маніт, лактозу, сахарозу, мальтозу, гліцерин, декстрозу, декстран, трегалозу, гідроксиетилкрохмаль або їх суміші. Наповнювач для ліофілізації може також містити фармацевтично прийнятний антиоксидант, такий як, наприклад, аскорбінова кислота, ацетилцистеїн, цистеїн, гідросульфіт натрію, бутил-гідроксиланізол, бутил-гідрокситолуол або альфа-токоферол ацетат. Переважний наповнювач для ліофілізації являє собою маніт. Розчинники для застосування в даному винаході включають воду й органічні розчинники, які утворюють стабільні розчини з вільною основою бендамустину без значного розкладання бендамустину і які здатні бути вилученими за допомогою ліофілізації. Приклади підходящих органічних розчинників включають, наприклад, метанол, етанол, n-пропанол, ізопропанол, nбутанол, трет-бутанол або їх суміші. Переважний органічний розчинник являє собою третбутанол. Також у межах об'єму даного винаходу перебувають способи лікування захворювань, таких як, наприклад, хронічний лімфоцитарний лейкоз, хвороба Ходжкіна, неходжкінська лімфома, множинна мієлома або рак молочної залози, з фармацевтичною композицією даного винаходу. У певних варіантах здійснення спосіб містить введення терапевтично ефективної кількості фармацевтичної композиції даного винаходу безпосередньо пацієнтові. В інших варіантах здійснення спосіб містить модифікацію фармацевтичної композиції даного винаходу до введення, наприклад, за допомогою розчинення композиції у воді або іншому розчиннику до введення. У цих варіантах здійснення спосіб містить введення пацієнтові терапевтично ефективної кількості препарату, отриманого з фармацевтичної композиції даного винаходу. Переважно, препарат являє собою ін'єкційний препарат. Ін'єкційний препарат може бути введений підшкірно, у шкіру, внутрішньовенно, внутрішньом'язово, інтраартрикулярно, інтрасиновіально, надчревно, інтратекально, усередину уражених тканин, інтракраніально або за допомогою інфузії. Інші стани, які піддаються лікуванню з використанням композицій і 11 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 ін'єкційних препаратів даного винаходу, включають дрібноклітинний рак легенів, гіперпроліферативні розлади й аутоімунні захворювання, такі як ревматоїдний артрит, розсіяний склероз і червоний вовчак. Ін'єкційні препарати, описані в даному документі, перебувають у формі стерильного ін'єкційного препарату, наприклад, у вигляді стерильної, ін'єкційної водної або що містить масло суспензії, складеної згідно з техніками, відомими в даному рівні техніки. Типово, фармацевтичні композиції даного винаходу, що містять, щонайменше, одну з Форми 1, Форми 2, Форми 3, Форми 4, Форми 5, Форми 6, Форми 7, Форми 8, Форми 9, Форми 10, Форми 11, Форми 12, Форми 13, Форми 14, Форми 15 або аморфну вільну основу бендамустину, складають у вигляді ліофілізованих порошків, які можуть забезпечуватися, наприклад, в ампулах, що містять 100 мг лікарського засобу на 50 мл ампулу. Ін'єкційний препарат може бути отриманий шляхом відновлення висушеної заморожуванням або ліофілізованої композиції стерильною водою для ін'єкцій і потім додаткового розведення фармацевтично прийнятним внутрішньовенним розчином, таким як, наприклад, 0,9 % хлорид натрію, 5 % декстроза у воді (D5W), розчин Рінгера з лактатом або 0,45 % хлориду натрію/2,5 % декстрози. Переважно, фармацевтичні композиції вільної основи бендамустину, описані в даному документі, відновлюють в ін'єкційний препарат, наприклад, за допомогою стерильної води, протягом менше ніж близько 20 хвилин. Більш переважно, відновлення проводять за менше ніж близько 10 хвилин, найбільше переважно близько 5 хвилин. Типовий процес відновлення буде включати відтворення, переважно в стерильних умовах, 100 мг вільної основи бендамустину за допомогою 20 мл стерильної води для ін'єкцій. Це дає на виході прозорий розчин від безбарвного до блідо-жовтого кольору, що має концентрацію бендамустину 5 мг/мл. Якщо відновлюють ліофілізовану вільну основу бендамустину, то вільна основа бендамустину має повністю розчинитися за приблизно 5 хвилин. Об'єм, що потребується для необхідної дози (на основі 5 мг/мл концентрації), може бути в стерильних умовах витягнутий і перенесений в 500 мл інфузійний мішок з 0,9 % хлориду натрію (або іншого фармацевтично прийнятного внутрішньовенного розчину) для ін'єкції. Переважно, відновлений розчин переносять в інфузійний мішок у межах 30 хвилин відновлення. Після переносу вміст інфузійного мішку ретельно перемішують. Введення за допомогою внутрішньовенної інфузії типово проводять протягом періоду часу від близько 30 до близько 60 хвилин. Передбачається, що фармацевтичні композиції даного винаходу можуть бути введені в комбінації з одним або більше антинеопластичними засобами, де антинеопластичний засіб дають до, одночасно з або послідовно після введення композиції даного винаходу. Фармацевтично прийнятні антинеопластичні засоби відомі в даному рівні техніки. Переважні антинеопластичні засоби є такими, як описано в одночасно розглянутій заявці на патент США № 11/330868, поданій 12 січня 2006, повнота якої включається в даний документ за допомогою посилання. Терапевтично ефективні кількості бендамустину можуть легко бути визначені лікуючим діагностом за допомогою застосування загальноприйнятих технік. Ефективна доза може змінюватися залежно від ряду факторів, включаючи тип і ступінь прогресування хвороби або порушення, загального стану здоров'я конкретного пацієнта, біологічної ефективності бендамустину, складу бендамустину і шляху введення форм бендамустину. Бендамустин може також бути введений у більш низьких рівнях дози з поступовими збільшеннями, поки не досягнуть необхідного ефекту. ТЕРМІНОЛОГІЯ "Поліморфізм", як використовується в даному документі, визначають як існування різних кристалічних конфігурацій для однакових молекул. "Сольват", як використовується в даному документі, являє собою кристалічний матеріал, який містить молекули розчинника, наприклад, води, етанолу, 3-пентанону, етилацетату, дихлорметану, діетилового ефіру й подібного, у кристалічній структурі. Вираз "розчинник", як використовується в даному документі, означає речовину, типово рідину, яка здатна повністю або частково розчиняти іншу речовину, типово тверду. Наступні розчинники використовувалися в експериментах, описаних у даному документі: 1-бутанол Гептан 1,4-діоксан Ізопропілацетат 1-пропанол Метанол 2-бутанол Метилізобутилкетон Метил-трет-бутиловий 3-пентанон ефір Ацетон N, N-диметилформамід 12 UA 109109 C2 Ацетонітрил Хлороформ Циклогексан Дихлорметан Етанол Етилацетат 5 10 15 20 25 30 35 40 45 50 N-бутилацетат Пропанонітрил Тетрагідрофуран Тетрагідропіран Толуол Вода Вираз "кристалічний", як використовується в даному документі, означає присутність регулярно повторюваного угруповання молекул або граней зовнішньої поверхні. "Некристалічний", як використовується в даному документі, відноситься до аморфного матеріалу, що не має регулярно повторюваного угруповання молекул або граней зовнішньої поверхні, що виявляються. Вираз "кристалічна композиція", як використовується тут, відноситься до твердої хімічної сполуки або суміші сполук, що забезпечує характерну картину піків, коли проводили аналіз за допомогою порошкової рентгенівської дифракції; вона включає, але не обмежується наступним: поліморфи, сольвати, гідрати, сокристали й десольватовані сольвати. Вираз "виділення", як використовується в даному документі, означає відділення сполуки від розчинника для забезпечення твердої, напівтвердої речовини або сиропу. Його типово здійснюють за допомогою, наприклад, центрифугування, фільтрації з або без вакууму, фільтрації при позитивному тиску, дистиляції, випарювання або їх комбінації. Виділення може супроводжуватися або не супроводжуватися очищенням, під час якого хімічна, хіральна або хімічна й хіральна чистота виділеного речовини підвищується. Очищення типово проводять за допомогою, наприклад, кристалізації, дистиляції, екстракції, фільтрації через кислотний, основний або нейтральний оксид алюмінію, фільтрації через кислотне, основне або нейтральне деревне вугілля, колонкової хроматографії на колонці, заповненою хіральною стаціонарною фазою, фільтрації через пористий папір, пластиковий або скляний бар'єр, колонкової хроматографії на силікагелі, іонообмінної хроматографії, рекристалізації, високоефективної рідинної хроматографії нормальними фазами, високоефективної рідинної хроматографії зворотними фазами, порошкування й подібного. Вираз "фармацевтично прийнятний наповнювач", як використовується в даному документі, включає будь-який і всі розчинники, дисперсійні середовища, оболонки, антибактеріальні й протигрибкові засоби, ізотонічні засоби й засоби, що затримують абсорбцію й подібне, прийнятні для фармацевтичного застосування, наприклад, ті, яким був наданий статус "Визнані безпечними" (GRAS) Управлінням США за наглядом за якістю харчових продуктів і лікарських засобів. Застосування таких середовищ і засобів для фармацевтичних активних речовин добре відоме в даному рівні техніки, наприклад, в Remington: The Science and Practice of Pharmacy, th 20 ed.; Gennaro, A. R., Ed.; Lippincott Williams & Wilkins: Philadelphia, PA, 2000. За винятком випадків, коли будь-які загальноприйняті середовища або засіб є несумісним з активним інгредієнтом, їх застосування передбачається в терапевтичних композиціях. Додаткові активні інгредієнти можуть також бути включені в композиції. Вираз "розчин", як використовується в даному документі, відноситься до суміші, що містить, щонайменше, один розчинник і, щонайменше, одну сполуку, яка, щонайменше, частково розчиняється в розчиннику. Вираз "сублімація", як використовується в даному документі, відноситься до переходу із твердої фази в газоподібну фазу без проміжної рідкої стадії. Вираз “ по суті, вільні", як використовується в даному документу відносно композицій, які містять конкретну форму бендамустину, у той же час є "по суті, вільними" від інших форм сполук, означає, що зазначена форма пов'язана з менш ніж 10 %, переважно менше ніж 5 %, особливо менше ніж 2 % і найбільше переважно менше ніж 1 % інших перерахованих форм бендамустину. Вираз "терапевтично ефективна кількість", як використовується в даному документі, відноситься до кількості, яка, як визначили, є необхідною для того, щоб викликати фізіологічний ефект, передбачуваний і пов'язаний з даним лікарським засобом, що вимірюється відповідно до загальноприйнятих фармакокінетичних способів і технік, для даного шляху введення. Прийнятні й специфічні терапевтично ефективні кількості можуть легко бути визначені лікуючим діагностом, як фахівцем у даній області, за допомогою застосування загальноприйнятих технік. Ефективна доза буде змінюватися залежно від ряду факторів, включаючи тип і ступінь прогресування хвороби або порушення, загальний стан здоров'я конкретного пацієнта, відносну біологічну ефективність вибраної сполуки, склад активного засобу із прийнятними наповнювачами й шлях введення. 13 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 55 60 Експериментальна частина ВИМІРЮВАЛЬНІ ПРИЛАДИ Порошкова рентгенівська дифракція Panalytical X Pert Pro Порошкові дифракційні рентгенограми записували на Panalytical X Pert Pro дифрактометрі, оснащеному індикатором X celerator, використовуючи Cu Kα випромінювання при 40 кВ і 40 мА. Kα1 випромінювання одержували з монохроматором падаючого променю високо орієнтованого кристалу (Ge111). 10 мм променеву маску й фіксовані (1/4°) щілини розходження і щілини, що відсівають (1/8°), вставляли на сторону падаючого променю. Фіксовану 0,10 мм приймальну щілину вставляли на сторону дифрагованого променю. Сканування порошкової рентгенограми збирали від приблизно 2-40° 2θ з 0,0080° розміром кроку й 96,06 сек. часом рахунку, що призводить до швидкості сканування приблизно 0,5°/хв. Зразки розпорошували на силіконову пластину нульового фону (ZBG) для вимірювання. Зразок обертали при 4°/хв на Panalytical PW3064 Spinner. Вимірювання Si стандартного зразка до збору даних давало в результаті значення для 2θ і інтенсивності, які були в межах допусків 28,44 < 2θ < 28,50 і суттєво більше, ніж висота мінімального піка, що дорівнює 150 відліків/сек. Bruker AXS/Siemens D5000 Порошкові рентгенограми збирали на Siemens D5000 дифрактометрі, використовуючи Cu Ka випромінювання (40 кВ, 40 мА), 600 нм гоніометр, автоматичні щілини розходимості й приймальні щілини, графітовий вторинний монохроматор і сцинтиляційний лічильник. Перевірку технічних характеристик інструмента проводять з використанням сертифікованого стандарту корунду (NIST 1976). Зовнішні умови Зразки, отримані при зовнішніх умовах, готували як зразки у вигляді плоских пластин, використовуючи порошок безпосередньо після одержання. Приблизно 35 мг зразка акуратно вкладали в розріз порожнини у відполіровану, (510) кремнієву пластину нульового фону й покриття MYLAR® поміщали над зразком. Зразок обертали у власній площині під час аналізу. Bruker AXS C2 GADDS Порошкові рентгенограми збирали на Bruker AXS C2 GADDS дифрактометрі, використовуючи Cu Ka випромінювання (40 кВ, 40 мА), автоматізовану XYZ стадію, лазерний відеомікроскоп для установки автосамплера й HiStar 2-мірний площовий індикатор. Рентгенівські оптичні прилади складаються з одного багатошарового дзеркала Göbel, з'єднаного із точковим коліматором 0,3 мм. Розходимість променя, тобто ефективний розмір рентгенівського променя на зразку, становила приблизно 5 мм. θ-θ метод безперервного сканування застосовували з відстанню зразок - індикатор 20 см, що дає ефективний 2θ діапазон 3,2°–29,7°. Типово, зразок піддають дії рентгенівського променя протягом 120 секунд. Зовнішні умови Зразки, отримані при зовнішніх умовах, готували як зразки у вигляді плоских пластин, використовуючи порошок безпосередньо після одержання без помолу. Приблизно 1-2 мг зразка злегка придавлювали на предметному склі для одержання плоскої поверхні. Порошкова рентгенівська дифракція зі змінною температурою (VT-XRPD) Дослідження зі змінною температурою були проведені з Anton Paar TTK450 температурною камерою при комп'ютерному контролі за допомогою Anton Paar TCU100 одиниці температурного контролю. Типово, вимірювання проводили із продуванням камери азотом. Використовували дві схеми вимірів, обмежену й безперервну. В обмеженому методі вимірювання робили тільки після того, як TK450 камера досягала необхідної температури. У безперервному методі зразок нагрівали при 10 °C/хвилина й вимірювали швидкі сканування, тому що температура змінювалась. Після того, як досягалася попередньо вибрана температура, зразок охолоджували при 35 °C/хвилина. Для контролю змін під час охолодження знову вимірювали швидкі сканування. При 25 °C вимірювали повільне сканування. Вибрані температури ґрунтувалися на DSC результатах. Для установки дифрактометра 10 мм променеву маску, 0,04 радіана щілини Солера й фіксовані (1/4°) щілини розходимості і щілини, що відсівають (1/8°), вставляли на сторону падаючого променю. Фіксовану 0,10 мм приймальну щілину, 0,04 радіана щілини Солера й 0,02 мм нікелевий фільтр вставляли на сторону дифрагованого променю. Повільні сканування збирали від приблизно 3-30° 2θ з 0,0080° розміром кроку й 100,97 сек часу рахунків, що призводило до швидкості сканування приблизно 0,5°/хв. Швидкі сканування збирали від приблизно 3-30° 2θ з 0,0167° розміром кроку й 1,905 сек часів рахунків, що призводило до швидкості сканування приблизно 44°/хв. Як тільки виключали подачу газоподібного азоту, камера поверталася до умов зовнішнього середовища. Вологість у стані в умовах зовнішнього середовища змінюється з вологістю в лабораторії, типово 30-40 %, і з температурою в камері. 14 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 Якщо температура піднімається, то відносна вологість буде падати. Диференціальна скануюча калориметрія (DSC) Термічні криві одержували, використовуючи Perkin-Elmer Sapphire DSC одиницю, оснащену автосамплером, що працює у версії 6.0 програмного забезпечення Pyris, відкалібровану з індієм до аналізу. Тверді зразки 1-11 мг зважували в 20 мкл алюмінієвих відкритих кюветах для зразків. DSC комірку потім продували азотом і температуру нагрівали від 0° до 275 °C при 10 °C/хв. Термогравіметрична мас-спектрометрія - (TGA/MS) Термічні криві одержували з використанням Perkin-Elmer Pyris 1 TGA одиниці, що працює у версії 6.0 програмного забезпечення Pyris, відкаліброваної з моногідратом оксалату кальцію. TGA зразки 1-5 мг перевіряли на процентну втрату ваги, нагріваючи від 25° до 300 °C при 10 °C/хв у печі, що продувається гелієм при приблизно 50 мл/хв. Для одночасного відстеження за утворенням газоподібних продуктів розпаду в досліджуваному діапазоні температур, термоваги з'єднували з ThermoStar мас-спектрометром (Asslar, Німеччина). Потокова лінія для введення газоподібних продуктів розпаду в мас-спектрометр була дезактивованою капілярною із плавленого кварцу, контрольованою за температурою до 200 °C, щоб уникнути можливої конденсації газів, що виділяються. Таким чином, термогравіметричні (TG) і мас-спектрометричні криві іонної інтенсивності вибраних іонних видів можуть бути записані одночасно. Термогравіметричний аналіз- (TGA) TGA дані збирали на TA Instruments Q500 TGA, оснащеному 16 позиційним автосамплером. Прилад був відкалібрований за температурою з використанням сертифікованого алюмелю. Типово 1-2 мг кожного зразка завантажували в герметично запаяну алюмінієву DSC чашу з -1 отворами на попередньо тарований платиновий тигель і нагрівали при 10 °C.хв від -1 навколишньої температури до 200 °C. Продувку азотом при 60 мл.хв підтримували над зразком. Програмне забезпечення системи керування приладом являло собою Thermal Advantage v4.6.6 і дані аналізували з використанням Universal Analysis v4.3A. 1 H ЯМР 1 Спектри H ЯМР збирали на Bruker 400MГz приладі, оснащеному автосамплером і контрольованому за допомогою DRX400 пульта керування. Автоматизовані експерименти одержували, використовуючи ICON-NMR v4.0.4 (конфігурація 1), який працює з Topspin v 1.3 (рівень плями 6), використовуючи стандартні Bruker завантажені експерименти. Для нерутинної спектроскопії дані одержували за допомогою застосування тільки Topspin. Зразки готували в d6ДМСО, якщо немає інших вказівок. Аналіз в автономному режимі проводили, використовуючи ACD Specmanager v 9.09 (конфігурація 7703). Скринінг поліморфів Дослідження кристалізації проводили на вільній основі бендамустину для вивчення поліморфізму в 24 різних розчинниках. Розчинники вибирали на основі переносимості (ICH Клас 3 і 2) і щоб одержати діапазон діелектричних констант, дипольних моментів і функціональних груп. Дозрівання, повільне охолодження й кристалізацію суспензій також використовували для одержання різних форм вільної основи бендамустину. Коли це можливо, повне визначення параметрів проводили на нових формах, які утворювалися під час скринінгу поліморфізму на вільній основі бендамустину. Це визначення параметрів складається з наступного: порошкова рентгенівська дифракція; термічний аналіз; GVS; і чистота за допомогою ВЕPХ. Кристалізація за допомогою експериментів з дозрівання Приблизно 40 мг вільної основи бендамустину (вільна основа бендамустину Форми 2 або вільна основа бендамустину Форми 3) в 800 мкл розчинника (25 об'ємів) суспендували в 24 різних розчинниках. Ці суміші суспендували протягом 48 годин з 4 годинними періодами, що чергуються, при 50 °C і 5 °C (-0,5 °C/хв.). Твердий матеріал виділяли фільтрацією й аналізували за допомогою XRPD і термічного аналізу. Матеріал висушували при 40 °C протягом 3 годин. Результати показано в Таблиці 16 і Таблиці 17 нижче. 15 UA 109109 C2 Таблиця 16 Дозрівання з Формою 3 Розчинник 1-бутанол 1-пропанол 3-пентанон Хлороформ Циклогексан Дихлорметан Етанол XRPD Статус Форма 6 Форма 13 Форма 13 Форма 13 Форма 3 Форма 3 Форма 8 Розчинник Гептан Метил-трет-бутиловий ефір N, N-диметилформамід Тетрагідропіран Толуол Вода XRPD Статус Форма 3 Форма 13 Форма 7 Форма 3 Форма 3 Нема кристалізації Таблиця 17 Дозрівання з Формою 2 Розчинник 1- бутанол 1, 4-діоксан 1-пропанол Ацетон Хлороформ Циклогексан Етанол Гептан 5 10 XRPD Статус Форма 1 Форма 1 Форма 1 Форма 1 Форма 1 Форма 1 Форма 1 Форма 2 Розчинник Метилізобутилкетон Метил-трет-бутиловий ефір N-бутилацетат Пропанонітрил Тетрагідропіран Толуол XRPD Статус Форма 1 Форма 1 Форма 1 Форма 1 Форма 1 Форма 1 Кристалізація за допомогою повільного охолодження Приблизно 40 мг вільної основи бендамустину (Форма 2 або Форма 3) в 800 мкл розчинника (25 об'ємів) суспендували в 24 різних розчинниках. Зразки нагрівали від 20 °C до 80C зі швидкістю 4,8C/хв і через 30 хвилин охолоджували з повільною швидкістю (0,25C/хв.) до кінцевої температури 5 °C, і витримували при цій температурі протягом 18 годин. Твердий матеріал з кожної ампули виділяли за допомогою фільтрації й оцінювали за допомогою XRPD і термічного аналізу. Матеріал висушували при 40 °C протягом 3 годин. Результати показані в Таблиці 18 і Таблиці 19 нижче. Таблиця 18 Повільне охолодження з Формою 3 Розчинник 1-бутанол 1-пропанол XRPD Статус Форма 6 Форма 6 Розчинник Ізопропілацетат N, N-диметилформамід Толуол XRPD Статус Форма 7 Форма 7 Форма 3 Таблиця 19 Повільне охолодження з Формою 2 Розчинник 2-бутанол 3-пентанон Ацетонітрил Циклогексан Етилацетат 15 XRPD Статус Форма 1 Форма 9 Форма 1 Форма 1 Форма 1 Розчинник Метил-трет-бутиловий ефір N-бутилацетат Пропанонітрил Тетрагідропіран Толуол XRPD Статус Форма 1 Форма 1 Форма 1 Форма 1 Форма 10 Кристалізація за допомогою експериментів з зависями Зависі (40 мг вільної основи бендамустину в 400 мкл) струшували при 25 °C протягом 48 16 UA 109109 C2 годин. Тверду речовину виділяли фільтрацією й висушували при 40 °C протягом 3 годин. XRPD результати від виділеної твердої речовини записані в Таблиці 20. Таблиця 20 Експерименти з зависями з Формою 3 Розчинник 1-бутанол 1, 4-діоксан 2-бутанол 3-пентанон Ацетон Ацетонітрил Хлороформ Циклогексан Дихлорметан Етилацетат 5 10 15 20 25 30 35 40 45 XRPD Статус Форма 11 Форма 11 Форма 3 Форма 3 Форма 3 Форма 7 Форма 3 Форма 3 Форма 3 Форма 3 Розчинник Ізопропілацетат Метилізобутилкетон Метил-трет-бутиловий ефір N, N-диметилформамід N-бутилацетат Пропанонітрил Тетрагідропіран Толуол XRPD Статус Форма 11 Форма 3 Форма 3 Форма 12 Форма 3 Форма 3 Форма 3 Форма 3 Форма 1 Одержання Експерименти з повільним охолодженням Приблизно 40 мг вільної основи бендамустину Форми 2 в 800 мкл розчинника (20 об'ємів) суспендували в 2-бутанолі, ацетонітрилі, циклогексані, етилацетаті, метил-трет-бутиловому ефірі, n-бутилацетаті, пропіонітрилі й тетрагідропірані. Зразки нагрівали від 20 °C до 80C зі швидкістю 4,8C/хв і через 30 хвилин охолоджували з низькою швидкістю (0,25C/хв.) до кінцевої температури 5 °C, і витримували при цій температурі протягом 18 годин. Твердий матеріал виділяли за допомогою фільтрації й висушували при 40 °C протягом 3 годин. Матеріал аналізували за допомогою XRPD і термічного аналізу. Кристалізація за допомогою експериментів з дозрівання Приблизно 40 мг вільної основи бендамустину Форми 2 в 800 мкл розчинника (20 об'ємів) суспендували в 1-бутанолі, 1-4 діоксані, 1-пропанолі, ацетоні, хлороформі, циклогексані, етанолі, метилізобутилкетоні, метил-трет-бутиловому ефірі, n-бутилацетаті, пропіонітрилі, тетрагідропірані й толуолі. Ці суміші суспендували протягом 48 годин з 4 годинними періодами, що чергуються, при 50 °C і 5 °C (-0,5 °C/хв.). Твердий матеріал виділяли за допомогою фільтрації й висушували при 40 °C протягом 3 годин. Матеріал аналізували за допомогою XRPD і термічного аналізу. Характеристика дифракційної рентгенограми кристалічної форми 1 показана в Таблиці 1 (вище) і ФІГ. 1. Визначення параметрів Форми 1 за допомогою термічного аналізу Форма 1 показує одиничний пік приблизно при 142,3 °C з ентальпією плавлення (ΔHFus) 114,3 Дж/г. Відсутність втрати маси визначають за допомогою TGA. Існування процесу десольватації не брали до уваги, тому що відсутність втрати ваги визначали за допомогою TGA (ФІГ. 1A). Форма 2 Одержання Експерименти повільного охолодження 1,08 г бендамустину гідрохлориду розчиняли в 100 мл деіонізованої води. Еквівалент одного моля NaOH (1 молярний у воді) додавали по краплях, викликаючи осадження. Тверду речовину потім швидко виділяли за допомогою фільтрації й відмивали на фільтрі з 2 частинами деіонізованої води й 2 частинами гептану для видалення надлишку води. Тверду речовину висушували під вакуумом при навколишній температурі протягом 18 годин. 752 мг твердої речовини одержували й аналізували за допомогою XRPD. Характеристика дифракційної рентгенограми кристалічної форми 2 показана в Таблиці 2 (вище) і ФІГ. 2. Визначення параметрів Форми 2 за допомогою термічного аналізу Вільна основа бендамустину Форми 2 показує одиничний пік приблизно при 132,8 °C з ентальпією плавлення (ΔHFus) 89,1 Дж/г. Відсутність втрати маси визначають за допомогою TGA. Існування процесу десольватації не брали до уваги, тому що відсутність втрати ваги визначали за допомогою TGA (ФІГ. 3) 17 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 55 60 Форма 3 Одержання Експерименти з повільним охолодженням Вільну основу бендамустину одержували шляхом гідролізу, опосередкованого основою, етилового складного ефіру бендамустину. Після того, як гідроліз був завершений, реакційну суміш нейтралізували водною соляною кислотою. Близько pH 6-7 продукт, осаджений у вигляді твердої речовини, збирали за допомогою фільтрації й відмивали водою. Сирий продукт розтирали в порошок за допомогою суміші ацетону (20 мл) і метил-трет-бутилового ефіру (5 мл). Після фільтрації тверду речовину висушували при 60 °C. Характеристика дифракційної рентгенограми кристалічної форми 3 показана в Таблиці 3 (вище) і ФІГ. 4. Визначення параметрів Форми 3 за допомогою термічного аналізу Форма 3 показує багаторазові початки приблизно при 29,1 і 101,8 з ентальпією плавлення (ΔHFus) 142,5 і 76,2 Дж/г (ФІГ. 5). Експеримент TGA втрачає середню вагу на 8,8 % від 20 до 150 °C. Теоретичне значення для включення двох молів води з одним молем вільної основи бендамустину становить 9,1 % (ФІГ. 5). Форма 4 Одержання за допомогою переходу тверда речовина-тверда речовина Приблизно 100 мг вільної основи бендамустину Форми 3 піддавали дії 0 % відносної вологості (RH) при 25 °C протягом 30 хвилин. Характеристика дифракційної рентгенограми кристалічної форми 4 показана в Таблиці 4 (вище) і ФІГ. 6. Форма 5 Одержання за допомогою переходу тверда речовина-тверда речовина Приблизно 100мг вільної основи бендамустину Форми 3 піддавали дії 85 % RH (відносної вологості) при 25 °C протягом 1 дня. Характеристика дифракційної рентгенограми кристалічної форми 5 показана в Таблиці 5 (вище) і ФІГ. 7. Визначення параметрів Форми 5 за допомогою термічного аналізу Форма 5 показує багаторазові початки приблизно при 25,9, 82,6 і 123,0 з ентальпією плавлення (ΔHFus) 255,1, 20,6 і 23,4 Дж/г (ФІГ. 8). Експеримент TGA втрачає середню вагу на 15,6 % від 20 до 150 °C. Теоретичне значення для включення чотирьох молів води з одним молем вільної основи бендамустину становить 16,7 % (ФІГ. 8). Форма 6 Одержання Експерименти з повільним охолодженням Приблизно 40 мг вільної основи бендамустину Форми 3 в 800 мкл розчинника (20 об'ємів) суспендували в 1-бутанолі або 1-пропанолі. Зразки нагрівали від 20 °C до 80C зі швидкістю 4,8C/хв і через 30 хвилин охолоджували з низькою швидкістю (0,25C/хв.) до кінцевої температури 5 °C і витримували при цій температурі протягом 18 годин. Твердий матеріал виділяли за допомогою фільтрації й висушували при 40 °C протягом 3 годин. Матеріал аналізували за допомогою XRPD і термічного аналізу. Кристалізація за допомогою експериментів з дозрівання Приблизно 40 мг вільної основи бендамустину Форми 3 в 800 мкл розчинника (20 об'ємів) суспендували в 1-бутанолі. Суміші суспендували протягом 48 годин з 4 годинними періодами, що чергуються, при 50 °C і 5 °C (-0,5 °C/хв.). Твердий матеріал виділяли за допомогою фільтрації й висушували при 40 °C протягом 3 годин. Матеріал аналізували за допомогою XRPD і термічного аналізу. Характеристика дифракційної рентгенограми кристалічної форми 6 показана в Таблиці 6 (вище) і ФІГ. 9. Визначення параметрів Форми 6 за допомогою термічного аналізу Форма 6 показує одиничний початок приблизний при 207,8 °C з ентальпією плавлення (ΔHFus) 28,0 Дж/г. Відсутність втрати маси визначають за допомогою TGA. Існування процесу десольватації не брали до уваги, тому що відсутність втрати ваги визначали за допомогою TGA (ФІГ. 10). Форма 7 Одержання Експерименти з повільним охолодженням Приблизно 40 мг вільної основи бендамустину Форми 3 в 800 мкл розчинника (20 об'ємів) суспендували в N, N-диметилформаміді або ізопропілацетаті. Зразки нагрівали від 20 °C до 80C зі швидкістю 4,8C/хв. і через 30 хвилин охолоджували з низькою швидкістю (0,25C/хв.) до кінцевої температури 5 °C і витримували при цій температурі протягом 18 годин. Твердий 18 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 55 60 матеріал виділяли за допомогою фільтрації й висушували при 40 °C протягом 3 годин. Матеріал аналізували за допомогою XRPD і термічного аналізу. Кристалізація за допомогою експериментів з дозрівання Приблизно 40 мг вільної основи бендамустину Форми 3 в 800 мкл розчинника (20 об'ємів) суспендували в N, N-диметилформаміді. Ці суміші суспендували протягом 48 годин з 4 годинними періодами, що чергуються, при 50 °C і 5 °C (-0,5 °C/хв.). Твердий матеріал виділяли за допомогою фільтрації й висушували при 40 °C протягом 3 годин. Матеріал аналізували за допомогою XRPD і термічного аналізу. Характеристика дифракційної рентгенограми кристалічної форми 7 показана в Таблиці 7 (вище) і ФІГ. 11. Визначення параметрів Форми 7 за допомогою термічного аналізу Форма 7 показує одиничний початок приблизно при 200,6 °C з ентальпією плавлення (ΔHFus) 12,7 Дж/г. Відсутність втрати маси визначають за допомогою TGA. Існування процесу десольватації не брали до уваги, тому що відсутність втрати ваги визначали за допомогою TGA (ФІГ. 12). Форма 8 Одержання Кристалізація за допомогою експериментів з дозрівання Приблизно 40 мг вільної основи бендамустину Форми 3 додавали в 800 мкл етанолу (20 об'ємів). Суміш суспендували протягом 48 годин з 4 годинними періодами, що чергуються, при 50 °C і 5 °C (-0,5 °C/хв.). Твердий матеріал виділяли за допомогою фільтрації й висушували при 40 °C протягом 3 годин. Матеріал аналізували за допомогою XRPD і термічного аналізу. Характеристика дифракційної рентгенограми кристалічної форми 8 показана в Таблиці 8 (вище) і ФІГ. 13. Визначення параметрів Форми 8 за допомогою термічного аналізу Форма 8 показує одиничний початок приблизно при 77,6 °C з ентальпією плавлення (ΔHFus) 94,6 Дж/г. Форма 8 в експерименті TGA втрачає середню вагу на 5,5 % від 20 до 150 °C. Теоретичне значення для включення одного моля етанолу із двома молями вільної основи бендамустину становить 5,4 %. (ФІГ. 14). Форма 9 Одержання Експерименти з повільним охолодженням Приблизно 40 мг вільної основи бендамустину Форми 2 додавали в 800 мкл 3-пентанону (20 об'ємів). Зразок нагрівали від 20 °C до 80C зі швидкістю 4,8C/хв. і через 30 хвилин охолоджували з низькою швидкістю (0,25C/хв.) до кінцевої температури 5 °C, і витримували при цій температурі протягом 18 годин. Твердий матеріал виділяли за допомогою фільтрації й висушували при 40 °C протягом 3 годин. Матеріал аналізували за допомогою XRPD і термічного аналізу. Характеристику дифракційної рентгенограми кристалічної форми 9 показано в Таблиці 9 (вище) і ФІГ. 15. Визначення параметрів Форми 9 за допомогою термічного аналізу Форма 9 показує одиничний початок приблизно при 138,3 °C з ентальпією плавлення (ΔHFus) 37,0 Дж/г. Форма 9 в експерименті TGA втрачає середню вагу на 5,5 % від 20 до 140 °C. Теоретичне значення для включення одного моля 3-пентанону із чотирма молями вільної основи бендамустину становить 5,7 %. (ФІГ. 16) Форма 10 Одержання Експерименти з повільним охолодженням Приблизно 40 мг вільної основи бендамустину Форми 2 додавали в 800 мкл толуолу (20 об'ємів). Зразок нагрівали від 20 °C до 80C зі швидкістю 4,8C/хв. і через 30 хвилин охолоджували з низькою швидкістю (0,25C/хв.) до кінцевої температури 5 °C і витримували при цій температурі протягом 18 годин. Твердий матеріал виділяли за допомогою фільтрації й висушували при 40 °C протягом 3 годин. Матеріал аналізували за допомогою XRPD і термічного аналізу. Характеристику дифракційної рентгенограми кристалічної форми 10 показано в Таблиці 10 (вище) і ФІГ. 17. Визначення параметрів Форми 10 за допомогою термічного аналізу Форма 10 показує два початки приблизно при 109,3 і 144,9 °C з ентальпією плавлення (ΔHFus) 5,6 і 98,3 Дж/г. (ФІГ. 18). Відсутність втрати маси визначають за допомогою TGA. Існування процесу десольватації не брали до уваги, тому що відсутність втрати ваги визначали 19 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 55 60 за допомогою TGA. Форма 11 Одержання Кристалізація за допомогою експериментів із зависями Приблизно 40 мг вільної основи бендамустину Форми 3 в 400 мкл 1-бутанолу або 1-4 діоксану або ізопропілацетату перемішували при 25 °C протягом 48 годин. Тверду речовину виділяли за допомогою фільтрації й висушували при 40 °C протягом 3 годин. Матеріал аналізували за допомогою XRPD і термічного аналізу. Характеристику дифракційної рентгенограми кристалічної форми 11 показано в Таблиці 11 (вище) і ФІГ. 19. Визначення параметрів Форми 11 за допомогою термічного аналізу Форма 11 показує багаторазові початки приблизно при 30,5, 70,9 і 112,3 °C з ентальпією плавлення (ΔHFus) 49,3, 51,0 і 74,9 Дж/г. (ФІГ. 20) Форма 12 Одержання Кристалізація за допомогою експериментів із зависями Приблизно 40 мг вільної основи бендамустину Форми 3 додавали в 400 мкл N, Nдиметилформаміду. Завись перемішували при 25 °C протягом 48 годин. Тверду речовину виділяли за допомогою фільтрації й висушували при 40 °C протягом 3 годин. Матеріал аналізували за допомогою XRPD і термічного аналізу. Характеристику дифракційної рентгенограми кристалічної форми 12 показано в Таблиці 12 (вище) і ФІГ. 21. Визначення параметрів Форми 12 за допомогою термічного аналізу Форма 12 показує багаторазові початки приблизно при 56,8, 72,0, 111,5 і 206,7 з ентальпією плавлення (ΔHFus) 3,3, 1,6, 1,7 і 13,2 Дж/г (ФІГ. 22). Форма 13 Одержання Експерименти з повільним охолодженням Приблизно 40 мг вільної основи бендамустину Форми 3 в 800 мкл розчинника (20 об'ємів) суспендували в метил-трет-бутиловому ефірі, 3-пентаноні й 1-пропанолі. Зразки нагрівали від 20 °C до 80C зі швидкістю 4,8C/хв. і через 30 хвилин охолоджували з низькою швидкістю (0,25C/хв.) до кінцевої температури 5 °C і витримували при цій температурі протягом 18 годин. Твердий матеріал виділяли за допомогою фільтрації й висушували при 40 °C протягом 3 годин. Матеріал аналізували за допомогою XRPD і термічного аналізу. Характеристику дифракційної рентгенограми кристалічної форми 13 показано в Таблиці 13 (вище) і ФІГ. 23. Визначення параметрів Форми 13 за допомогою термічного аналізу Форма 13 показує одиничний початок приблизно при 93,4 °C з ентальпією плавлення (ΔHFus) 118,2 Дж/г. Експеримент TGA втрачає середню вагу на 9,4 % від 20 до 150 °C. Теоретичне значення для включення двох молів води з одним молем вільної основи бендамустину становить 9,1 % (ФІГ. 24). Форма 14 Одержання Кристалізація за допомогою експерименту із зависями Приблизно 40 мг вільної основи бендамустину Форми 3 в 400 мкл ацетонітрилу струшували при 25 °C протягом 48 годин. Тверду речовину виділяли за допомогою фільтрації й висушували при 40 °C протягом 3 годин. Матеріал аналізували за допомогою XRPD і термічного аналізу. Характеристику дифракційної рентгенограми кристалічної форми 14 показано в Таблиці 14 (вище) і ФІГ. 25. Визначення параметрів Форми 14 за допомогою термічного аналізу Форма 14 показує багаторазові початки приблизно при 25,8, 83,2 і 123,2 з ентальпією плавлення (ΔHFus) 215,4, 51,9 і 30,0 Дж/г. Експеримент TGA втрачає середню вагу на 11,1 % від 20 до 150 °C. Теоретичне значення для включення п'яти молів води із двома молями вільної основи бендамустину становить 11,2 % (ФІГ. 26). Форма 15 Одержання Кристалізація за допомогою експериментів із зависями Приблизно 25 мг вільної основи бендамустину Форми 1 в 1,25 мл тетрагідрофурану розчиняли при 50 °C. При охолодженні до навколишньої температури відбувалося осадження. Тверду речовину виділяли й швидко аналізували за допомогою XRPD. 20 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 55 60 Характеристику дифракційної рентгенограми кристалічної форми 15 показано в Таблиці 15 (вище) і ФІГ. 27. Визначення параметрів Форми 15 за допомогою термогравіметричного аналізу Термогравіметричнмй аналіз відповідає сольвату тетрагідрофурану (THF) вільної основи бендамустину (ФІГ. 28). 1 Визначення параметрів Форми 15 за допомогою H ЯМР 1 H ЯМР спектр підтвердив, що є присутнім THF (0,05 еквівалентів) (ФІГ 29). Аморфна вільна основа бендамустину Одержання Під час визначення параметрів Форми 3 за допомогою VT-XRPD, була утворена аморфна вільна основа бендамустину. Значні трансформації тверда речовина-тверда речовина не мають місце в температурному діапазоні від 25 °C до 50 °C для Форми 3. Дегідратація гідрату Форми 4 має місце в температурному діапазоні від 50 °C до 66 °C. Кристалічність зникає в температурному діапазоні від 124 °C до 133 °C. ФІГ. 30. Після 133 °C зразок перетворюється в аморфний матеріал. ФІГ. 31. Перший варіант здійснення даного винаходу забезпечує фармацевтичну композицію, що містить вільну основу бендамустину, вибрану з групи, що включає аморфну вільну основу бендамустину, Форму 1 вільної основи бендамустину, Форму 2 вільної основи бендамустину, Форму 3 вільної основи бендамустину, Форму 4 вільної основи бендамустину, Форму 5 вільної основи бендамустину, Форму 6 вільної основи бендамустину, Форму 7 вільної основи бендамустину, Форму 8 вільної основи бендамустину, Форму 9 вільної основи бендамустину, Форму 10 вільної основи бендамустину, Форму 11 вільної основи бендамустину, Форму 12 вільної основи бендамустину, Форму 13 вільної основи бендамустину, Форму 14 вільної основи бендамустину, Форму 15 вільної основи бендамустину або їх суміш. Другий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою аморфну вільну основу бендамустину. Третій варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 1 вільної основи бендамустину. Четвертий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 2 вільної основи бендамустину. П'ятий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 3 вільної основи бендамустину. Шостий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 4 вільної основи бендамустину. Сьомий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 5 вільної основи бендамустину. Восьмий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 6 вільної основи бендамустину. Дев'ятий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 7 вільної основи бендамустину. Десятий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 8 вільної основи бендамустину. Одинадцятий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 9 вільної основи бендамустину. Дванадцятий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 10 вільної основи бендамустину. Тринадцятий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 11 вільної основи бендамустину. Чотирнадцятий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 12 вільної основи бендамустину. П'ятнадцятий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 13 вільної основи бендамустину. Шістнадцятий варіант здійснення забезпечує фармацевтичну композицію першого варіанта здійснення, де вільна основа бендамустину являє собою Форму 14 вільної основи бендамустину. Сімнадцятий варіант здійснення забезпечує фармацевтичну композицію першого варіанта 21 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 55 60 здійснення, де вільна основа бендамустину являє собою Форму 15 вільної основи бендамустину. Вісімнадцятий варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, де зазначена вільна основа бендамустину вибрана з групи, що включає Форму 1 вільної основи бендамустину, Форму 2 вільної основи бендамустину, Форму 3 вільної основи бендамустину, Форму 4 вільної основи бендамустину, Форму 5 вільної основи бендамустину, Форму 6 вільної основи бендамустину, Форму 7 вільної основи бендамустину, Форму 8 вільної основи бендамустину, Форму 9 вільної основи бендамустину, Форму 10 вільної основи бендамустину, Форму 11 вільної основи бендамустину, Форму 12 вільної основи бендамустину, Форму 13 вільної основи бендамустину, Форму 14 вільної основи бендамустину, Форму 15 вільної основи бендамустину або їх суміш. Дев'ятнадцятий варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 1 вільної основи бендамустину. Двадцятий варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 2 вільної основи бендамустину. Двадцять перший варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 3 вільної основи бендамустину. Двадцять другий варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 4 вільної основи бендамустину. Двадцять третій варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 5 вільної основи бендамустину. Двадцять четвертий варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 6 вільної основи бендамустину. Двадцять п'ятий варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 7 вільної основи бендамустину. Двадцять шостий варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 8 вільної основи бендамустину. Двадцять сьомий варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 9 вільної основи бендамустину. Двадцять восьмий варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 10 вільної основи бендамустину. Двадцять дев'ятий варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 11 вільної основи бендамустину. Тридцятий варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 12 вільної основи бендамустину. Тридцять перший варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 13 вільної основи бендамустину. Тридцять другий варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 14 вільної основи бендамустину. Тридцять третій варіант здійснення забезпечує кристалічну форму вісімнадцятого варіанта здійснення, де вільна основа бендамустину являє собою Форму 15 вільної основи бендамустину. Тридцять четвертий варіант здійснення забезпечує кристалічну форму за кожним з варіантів здійснення від вісімнадцятого до тридцять третього, що додатково містить аморфну вільну основу бендамустину. Тридцять п'ятий варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 10,34, 22,30, 24,03, 28,43 і 29,50±0,2 градусів 2θ. Тридцять шостий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно тридцять п'ятому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 16,69, 20,53 і 22,67±0,2 градусів 2θ. Тридцять сьомий варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 1. 22 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 55 60 Тридцять восьмий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів здійснення від тридцять п'ятого до тридцять сьомого. Тридцять дев'ятий варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 10,28, 20,59, 21,55, 21,69 і 24,78±0,2 градусів 2θ. Сороковий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно тридцять дев'ятому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 12,54, 13,51, 15,40 і 22,39±0,2 градусів 2θ. Сорок перший варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 2. Сорок другий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів здійснення від тридцять восьмого до сорок першого. Сорок третій варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 9,41, 9,46, 14,15, 23,42 і 23,65±0,2 градусів 2θ. Сорок четвертий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно сорок третьому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 14,15, 18,78 і 24,83±0,2 градусів 2θ. Сорок п'ятий варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 4. Сорок шостий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів здійснення від сорок третього до сорок п'ятого. Сорок сьомий варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 9,88, 15,13, 19,92, 22,99, 24,72 і 24,98±0,2 градусів 2θ. Сорок восьмий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно сорок сьомому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 19,44 і 20,70±0,2 градусів 2θ. Сорок дев'ятий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 6. П'ятдесятий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів здійснення від сорок сьомого до сорок дев'ятого. П'ятдесят перший варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 8,94, 13,39, 16,04, 21,31 і 22,38±0,2 градусів 2θ. П'ятдесят другий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно п'ятдесят першому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 17,90, 19,29 і 25,37±0,2 градусів 2θ. П'ятдесят третій варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 7. П'ятдесят четвертий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів здійснення від п'ятдесят першого до п'ятдесят третього. П'ятдесят п'ятий варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 8,67, 18,15, 20,94, 22,55 і 25,46±0,2 градусів 2θ. П'ятдесят шостий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно п'ятдесят п'ятому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 19,40, 22,95, 26,21, 27,74 і 34,62±0,2 градусів 2θ. П'ятдесят сьомий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 9. П'ятдесят восьмий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів 23 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 55 60 здійснення від п'ятдесят п'ятого до п'ятдесят сьомого. П'ятдесят дев'ятий варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 8,51, 17,97, 21,25, 28,09 і 36,31±0,2 градусів 2θ. Шістдесятий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно п'ятдесят дев'ятому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 11,42, 14,23, 23,29, 24,04 і 28,09±0,2 градусів 2θ. Шістдесят перший варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 11. Шістдесят другий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів здійснення від п'ятдесят дев'ятого до шістдесят першого. Шістдесят третій варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 9,34, 10,45, 11,17, 15,32, 22,48, 24,98 і 26,40±0,2 градусів 2θ. Шістдесят четвертий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно шістдесят третьому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 15,72, 21,01, 21,30 і 30,87±0,2 градусів 2θ. Шістдесят п'ятий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 13. Шістдесят шостий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів здійснення від шістдесят третього до шістдесят п'ятого. Шістдесят сьомий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 4,44, 13,34, 16,73, 19,54 і 22,32±0,2 градусів 2θ. Шістдесят восьмий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно шістдесят сьомому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 22,98, 23,45 і 24,80±0,2 градусів 2θ. Шістдесят дев'ятий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 15. Сімдесятий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів здійснення від шістдесят сьомого до шістдесят дев'ятого. Сімдесят перший варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 16,82, 16,93, 17,06, 19,68, 19,83, 22,87, 24,24, 28,63 і 29,72±0,2 градусів 2θ. Сімдесят другий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно сімдесят першому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 16,13, 25,75 і 37,71±0,2 градусів 2θ. Сімдесят третій варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 17. Сімдесят четвертий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів здійснення від сімдесят першого до сімдесят третього. Сімдесят п'ятий варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 8,90, 9,28, 13,94, 22,36 і 23,33±0,2 градусів 2θ. Сімдесят шостий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно сімдесят п'ятому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 16,01, 19,30, 21,29 і 25,38±0,2 градусів 2θ. Сімдесят сьомий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 19. Сімдесят восьмий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів 24 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 55 здійснення від сімдесят п'ятого до сімдесят сьомого. Сімдесят дев'ятий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить одие або кілька наступних кутів відбиття: 9,31, 9,35, 13,97, 14,03 і 23,38±0,2 градусів 2θ. Вісімдесятий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно сімдесят дев'ятому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 4,71, 24,75 і 26,06±0,2 градусів 2θ. Вісімдесят перший варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 21. Вісімдесят другий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів здійснення від сімдесят дев'ятого до вісімдесят першого. Вісімдесят третій варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 9,84, 14,76, 19,67 і 24,62±0,2 градусів 2θ. Вісімдесят четвертий варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину згідно вісімдесят третьому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 21,35, 22,21, 23,20 і 26,91±0,2 градусів 2θ. Вісімдесят п'ятий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 23. Вісімдесят шостий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів здійснення від вісімдесят третього до вісімдесят п'ятого. Вісімдесят сьомий варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 9,14, 17,72, 19,19, 21,13, 22,10, 23,12 і 23,61±0,2 градусів 2θ. Вісімдесят восьмий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно вісімдесят сьомому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 8,74, 15,85, 24,59, 25,28 і 27,16±0,2 градусів 2θ. Вісімдесят дев'ятий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 25. Дев'яностий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів здійснення від вісімдесят сьомого до вісімдесят дев'ятого. Дев'яносто перший варіант здійснення даного винаходу забезпечує кристалічну форму вільної основи бендамустину, яка має порошкову рентгенограму, що містить один або кілька наступних кутів відбиття: 24,56, 19,92, 10,26, 8,10 і 4,09±0,2 градусів 2θ. Дев'яносто другий варіант здійснення забезпечує кристалічну форму вільної основи бендамустину згідно дев'яносто першому варіанту здійснення, яка має порошкову рентгенограму, що додатково містить один або кілька наступних кутів відбиття: 17,96, 23,83, 26,01, 28,39 і 29,43±0,2 градусів 2θ. Дев'яносто третій варіант здійснення забезпечує кристалічну форму вільної основи бендамустину, що має порошкову рентгенограму, по суті, як зображено на ФІГ. 27. Дев'яносто четвертий варіант здійснення забезпечує фармацевтичну композицію, що містить кристалічну форму вільної основи бендамустину відповідно до будь-якого одного з варіантів здійснення від дев'яносто першого до дев'яносто третього. Дев'яносто п'ятий варіант здійснення забезпечує спосіб лікування хронічного лімфоцитарного лейкозу, хвороби Ходжкіна, неходжкінської лімфоми, множинної мієломи або рака молочної залози, що включає введення пацієнтові, якому необхідно, терапевтично ефективної кількості препарату, отриманого з композиції відповідно до будь-якого одного з варіантів здійснення від першого до дев'яносто четвертого. Як зрозуміло фахівцям у даній області техніки, численні модифікації й зміни даного винаходу можливі у вигляді вищевикладених відомостей. Отже, зрозуміло, що в межах об'єму прикладеної формули винаходу, даний винахід може бути реалізований практично іншим способом, ніж конкретно описано в даному документі, й мається на увазі, що об'єм даного винаходу включає всі такі зміни. 60 25 UA 109109 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 60 1. Кристалічна форма 1 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 10,34, 22,30, 24,03, 28,43 і 29,50±0,2 градуса 2. 2. Кристалічна форма вільної основи бендамустину за п. 1, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 16,69, 20,53 і 22,67±0,2 градуса 2. 3. Кристалічна форма вільної основи бендамустину за п. 1, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 1. 4. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 1-3. 5. Кристалічна форма 2 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 10,28, 20,59, 21,55, 21,69 і 24,78±0,2 градуса 2. 6. Кристалічна форма вільної основи бендамустину за п. 5, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 12,54, 13,51, 15,40 і 22,39±0,2 градуса 2. 7. Кристалічна форма вільної основи бендамустину за п. 5, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 2. 8. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 5-7. 9. Кристалічна форма 3 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 9,41, 9,46, 14,15, 23,42 і 23,65±0,2 градуса 2. 10. Кристалічна форма вільної основи бендамустину за п. 9, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 14,15, 18,78 і 24,83±0,2 градуса 2. 11. Кристалічна форма вільної основи бендамустину за п. 9, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 4. 12. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 9-11. 13. Кристалічна форма 4 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 9,88, 15,13, 19,92, 22,99, 24,72 і 24,98±0,2 градуса 2. 14. Кристалічна форма вільної основи бендамустину за п. 13, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 19,44 і 20,70±0,2 градуса 2. 15. Кристалічна форма вільної основи бендамустину за п. 13, що має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 6. 16. Фармацевтична композиція для лікування раку, що містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 13-15. 17. Кристалічна форма 5 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 8,94, 13,39, 16,04, 21,31 і 22,38±0,2 градуса 2. 18. Кристалічна форма вільної основи бендамустину за п. 17, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 17,90, 19,29 і 25,37±0,2 градуса 2. 19. Кристалічна форма вільної основи бендамустину за п. 17, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 7. 20. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 17-19. 21. Кристалічна форма 6 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 8,67, 18,15, 20,94, 22,55 і 25,46±0,2 градуса 2. 22. Кристалічна форма вільної основи бендамустину за п. 21, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 19,40, 22,95, 26,21, 27,74 і 34,62±0,2 градуса 2. 23. Кристалічна форма вільної основи бендамустину за п. 21, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 9. 26 UA 109109 C2 5 10 15 20 25 30 35 40 45 50 55 60 24. Фармацевтична композиція для лікування раку, що містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 21-23. 25. Кристалічна форма 7 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 8,51, 17,97, 21,25, 28,09 і 36,31±0,2 градуса 2. 26. Кристалічна форма вільної основи бендамустину за п. 25, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 11,42, 14,23, 23,29, 24,04 і 28,09±0,2 градуса 2. 27. Кристалічна форма вільної основи бендамустину за п. 25, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 11. 28. Фармацевтична композиція для лікування раку, що містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 25-27. 29. Кристалічна форма 8 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 9,34, 10,45, 11,17, 15,32, 22,48, 24,98 і 26,40±0,2 градуса 2. 30. Кристалічна форма вільної основи бендамустину за п. 29, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 15,72, 21,01, 21,30 і 30,87±0,2 градуса 2. 31. Кристалічна форма вільної основи бендамустину за п. 29, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 13. 32. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 29-31. 33. Кристалічна форма 9 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 4,44, 13,34, 16,73, 19,54 і 22,32±0,2 градуса 2. 34. Кристалічна форма вільної основи бендамустину за п. 33, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 22,98, 23,45 і 24,80±0,2 градуса 2. 35. Кристалічна форма вільної основи бендамустину за п. 33, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 15. 36. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 33-35. 37. Кристалічна форма 10 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 16,82, 16,93, 17,06, 19,68, 19,83, 22,87, 24,24, 28,63 і 29,72±0,2 градуса 2. 38. Кристалічна форма вільної основи бендамустину за п. 37, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 16,13, 25,75 і 37,71±0,2 градуса 2. 39. Кристалічна форма вільної основи бендамустину за п. 37, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 17. 40. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 37-39. 41. Кристалічна форма 11 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 8,90, 9,28, 13,94, 22,36 і 23,33±0,2 градуса 2. 42. Кристалічна форма вільної основи бендамустину за п. 41, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 16,01, 19,30, 21,29 і 25,38±0,2 градуса 2. 43. Кристалічна форма вільної основи бендамустину за п. 41, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 19. 44. Фармацевтична композиція для лікування раку, що містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 41-43. 45. Кристалічна форма 12 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 9,31, 9,35, 13,97, 14,03 і 23,38±0,2 градуса 2. 46. Кристалічна форма вільної основи бендамустину за п. 45, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 4,71, 24,75 і 26,06±0,2 градуса 2. 47. Кристалічна форма вільної основи бендамустину за п. 45, що має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 21. 27 UA 109109 C2 5 10 15 20 25 30 35 48. Фармацевтична композиція для лікування раку, що містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 45-47. 49. Кристалічна форма 13 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 9,84, 14,76, 19,67 і 24,62±0,2 градуса 2. 50. Кристалічна форма вільної основи бендамустину за п. 49, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 21,35, 22,21, 23,20 і 26,91±0,2 градуса 2. 51. Кристалічна форма вільної основи бендамустину за п. 49, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 23. 52. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 49-51. 53. Кристалічна форма 14 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 9,14, 17,72, 19,19, 21,13, 22,10, 23,12 і 23,61±0,2 градуса 2. 54. Кристалічна форма вільної основи бендамустину за п. 53, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 8,74, 15,85, 24,59, 25,28 і 27,16±0,2 градуса 2. 55. Кристалічна форма вільної основи бендамустину за п. 53, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 25. 56. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 53-55. 57. Кристалічна форма 15 вільної основи бендамустину, яка має порошкову рентгенівську дифрактограму, що містить один або декілька наступних кутів відбиття: 24,56, 19,92, 10,26, 8,10 і 4,09±0,2 градуса 2. 58. Кристалічна форма вільної основи бендамустину за п. 57, яка має порошкову рентгенівську дифрактограму, що додатково містить один або декілька наступних кутів відбиття: 17,96, 23,83, 26,01, 28,39 і 29,43±0,2 градуса 2. 59. Кристалічна форма вільної основи бендамустину за п. 57, яка має порошкову рентгенівську дифрактограму, по суті, як зображено на фіг. 27. 60. Фармацевтична композиція для лікування раку, яка містить кристалічну форму вільної основи бендамустину за будь-яким з пп. 57-59. 61. Спосіб лікування хронічного лімфоцитарного лейкозу, хвороби Ходжкіна, неходжкінської лімфоми, множинної мієломи або раку молочної залози, який включає введення пацієнтові, що потребує цього, терапевтично ефективної кількості препарату, отриманого з композиції за будьяким з попередніх пунктів. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel rorms of bendamustine free base
Автори російськоюCourvoisier, Laurent, D., Eddleston, Mark, Haltiwanger, Curtis, R., Mckean, Robert, E.
МПК / Мітки
МПК: A61K 31/4184, C07D 235/16
Мітки: композиція, форма, вільної, фармацевтична, лікування, основі, бендамустину, варіанти, кристалічна, раку
Код посилання
<a href="https://ua.patents.su/41-109109-kristalichna-forma-vilno-osnovi-bendamustinu-varianti-ta-farmacevtichna-kompoziciya-dlya-likuvannya-raku-varianti.html" target="_blank" rel="follow" title="База патентів України">Кристалічна форма вільної основи бендамустину (варіанти) та фармацевтична композиція для лікування раку (варіанти)</a>
Попередній патент: Антитіло до pd-l1 та його застосування для посилення функції t-клітин
Наступний патент: Полінуклеотид, який забезпечує можливість специфічної експресії у цілому насінні однодольної рослини
Випадковий патент: Бронежилет