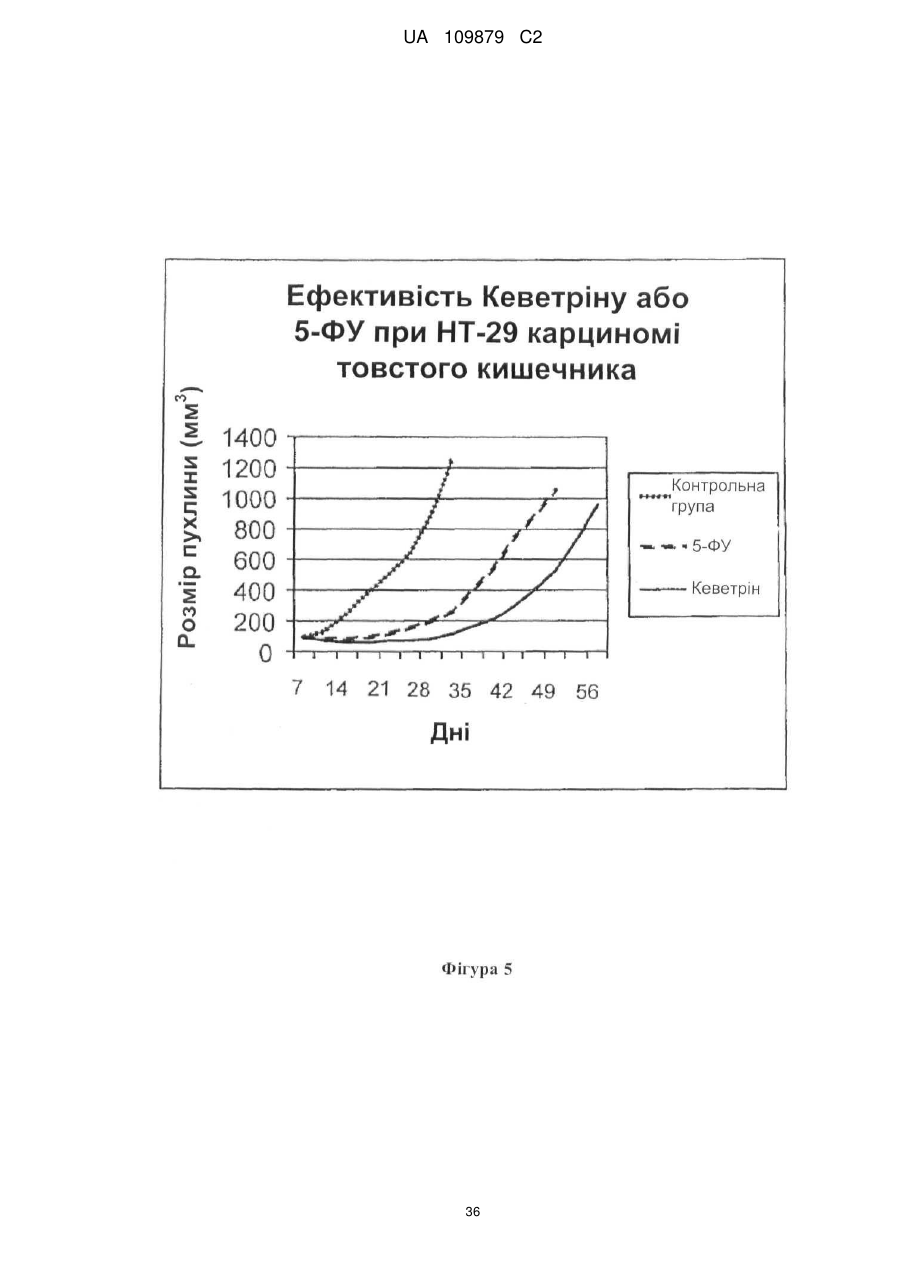
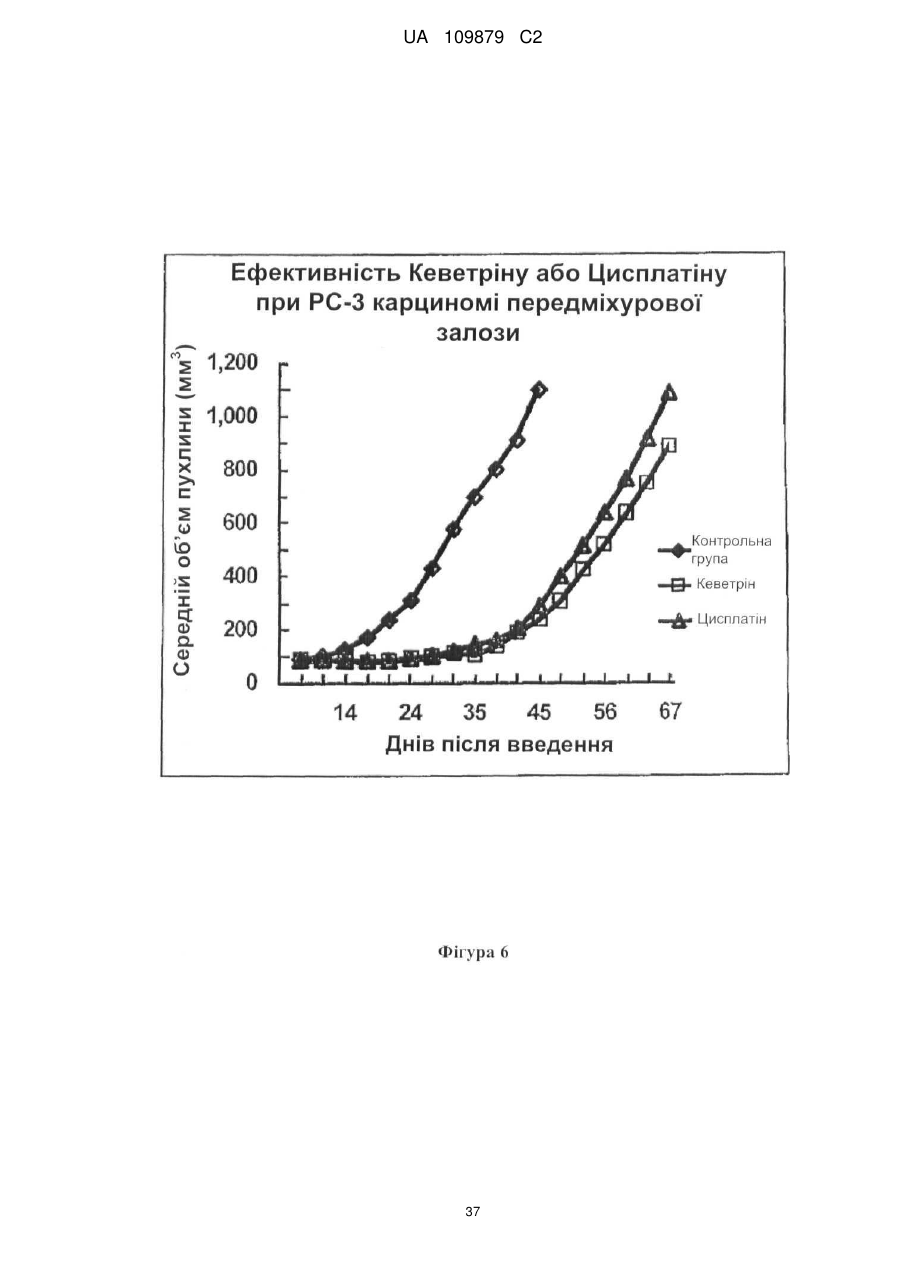
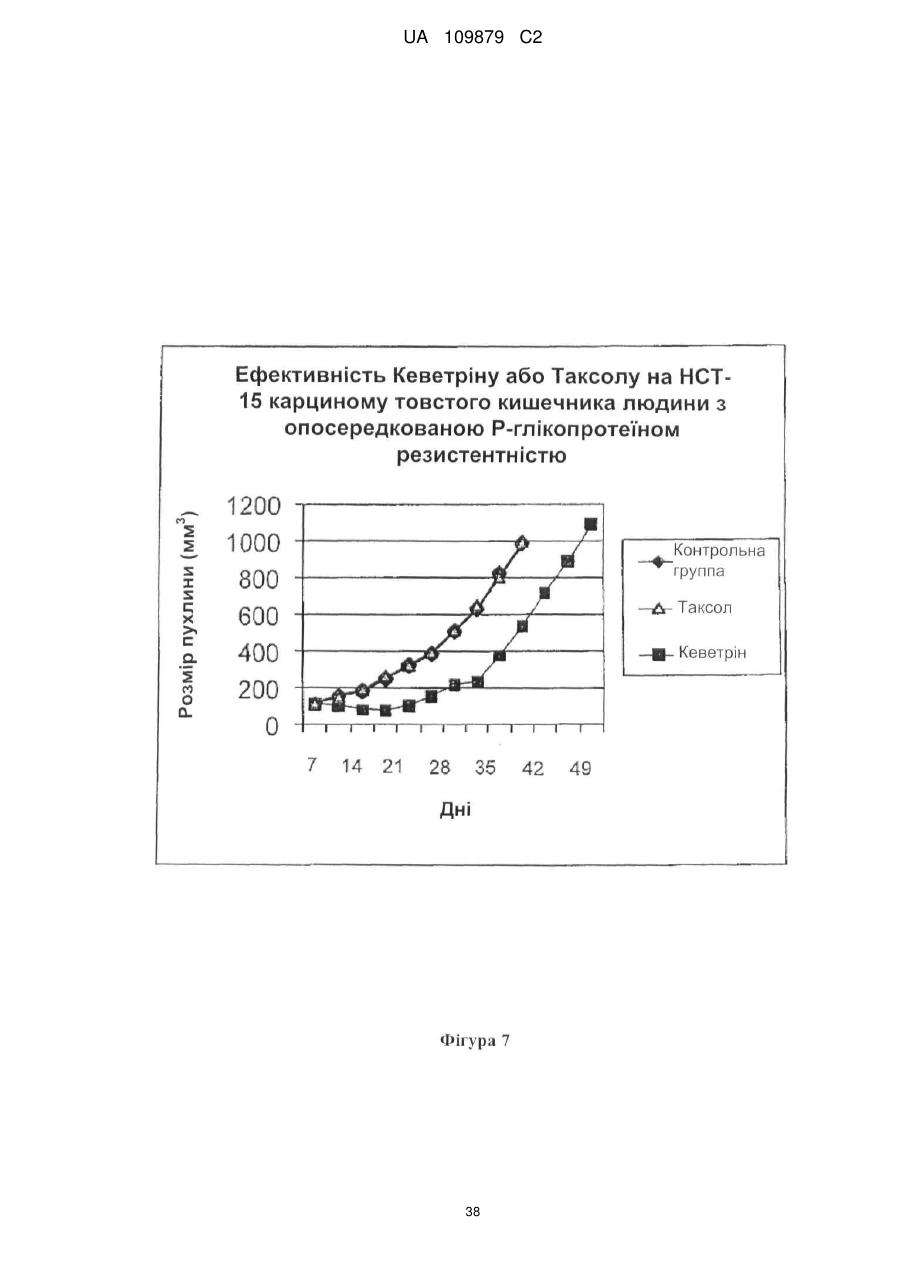
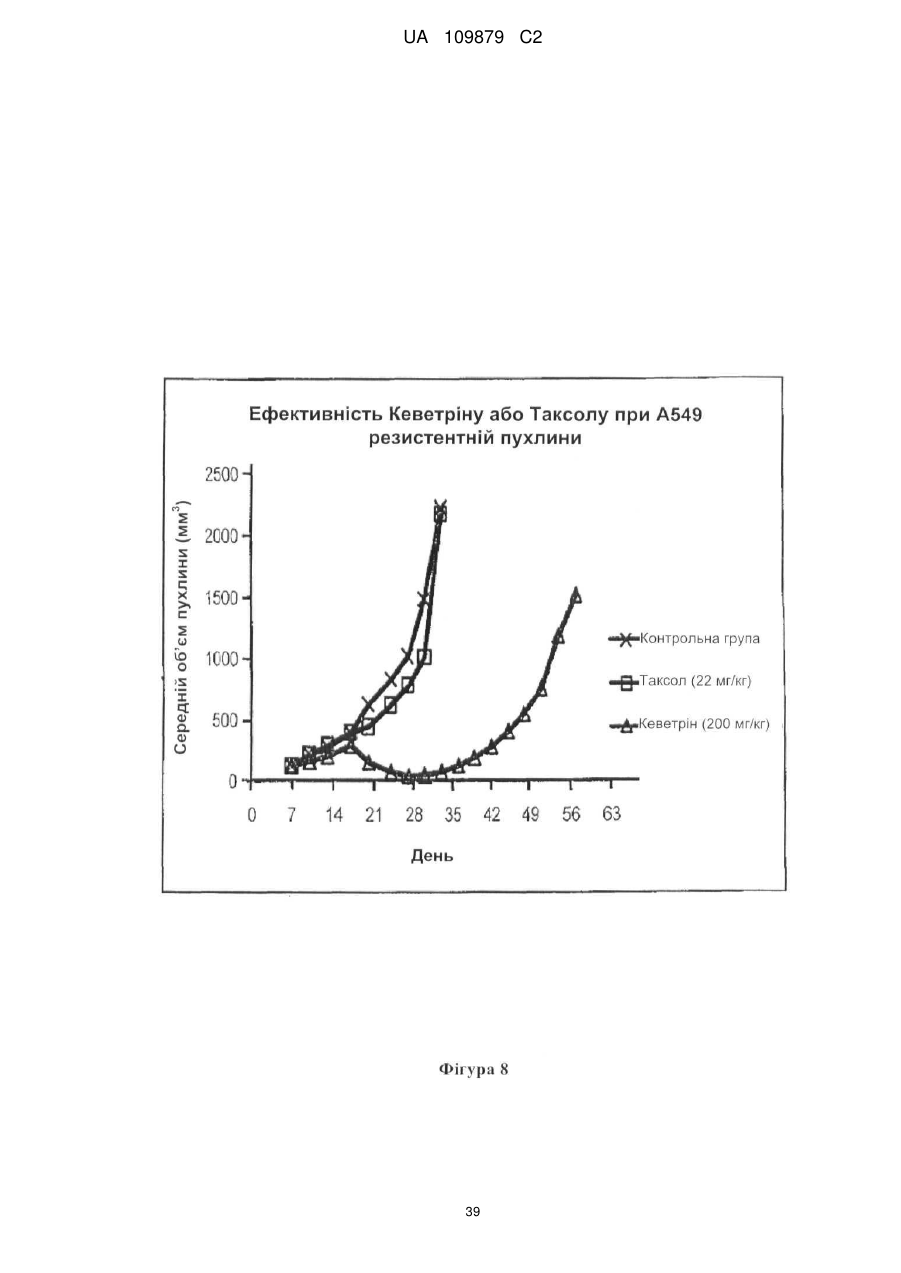
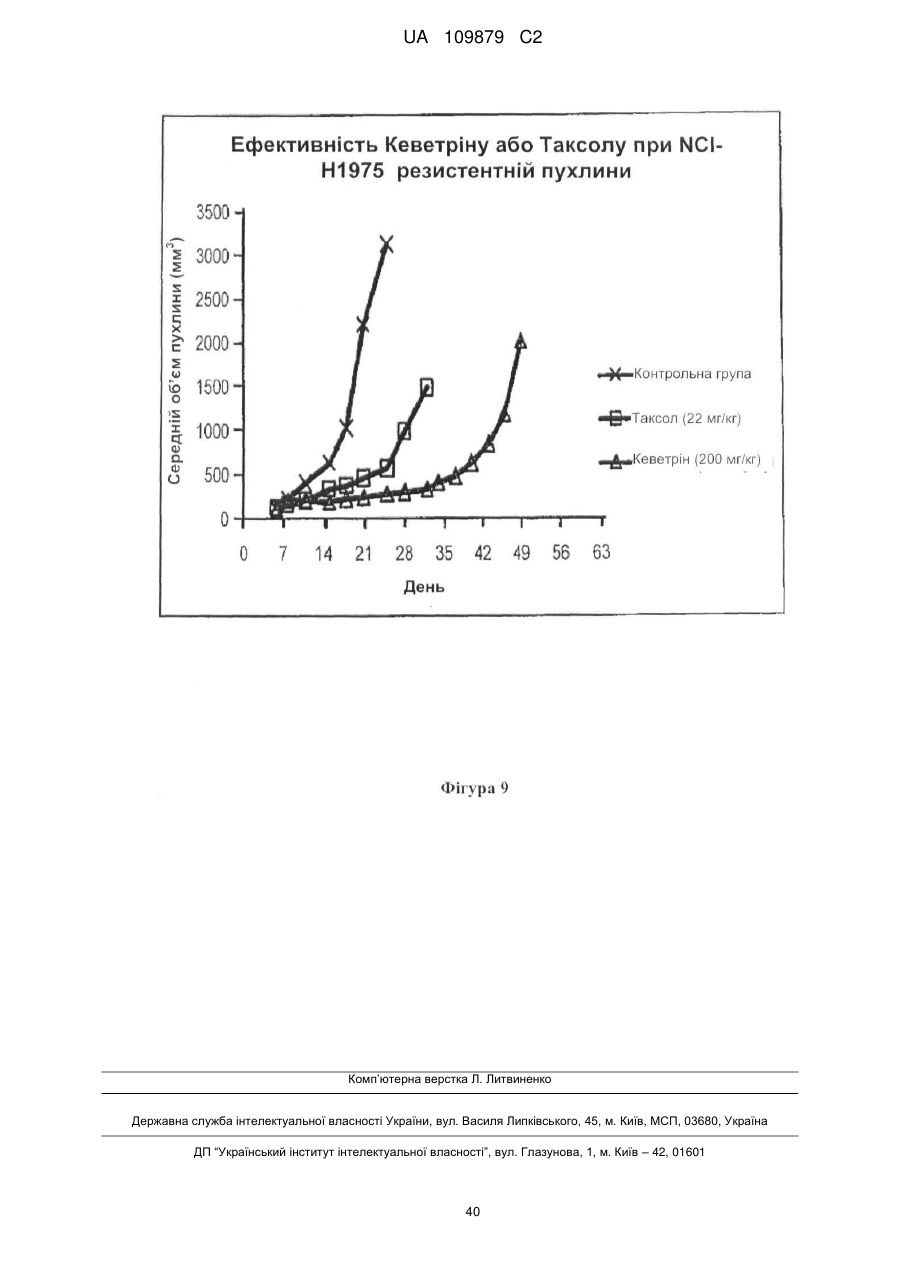
Похідні нітрилу, їх застосування у фармацевтичних цілях і в композиції
Формула / Реферат
1. Застосування сполуки формули І або її фармацевтично прийнятної солі, наприклад гідрохлориду або гідроброміду,
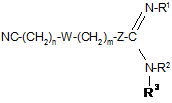 , I
, I
де Z є сіркою,
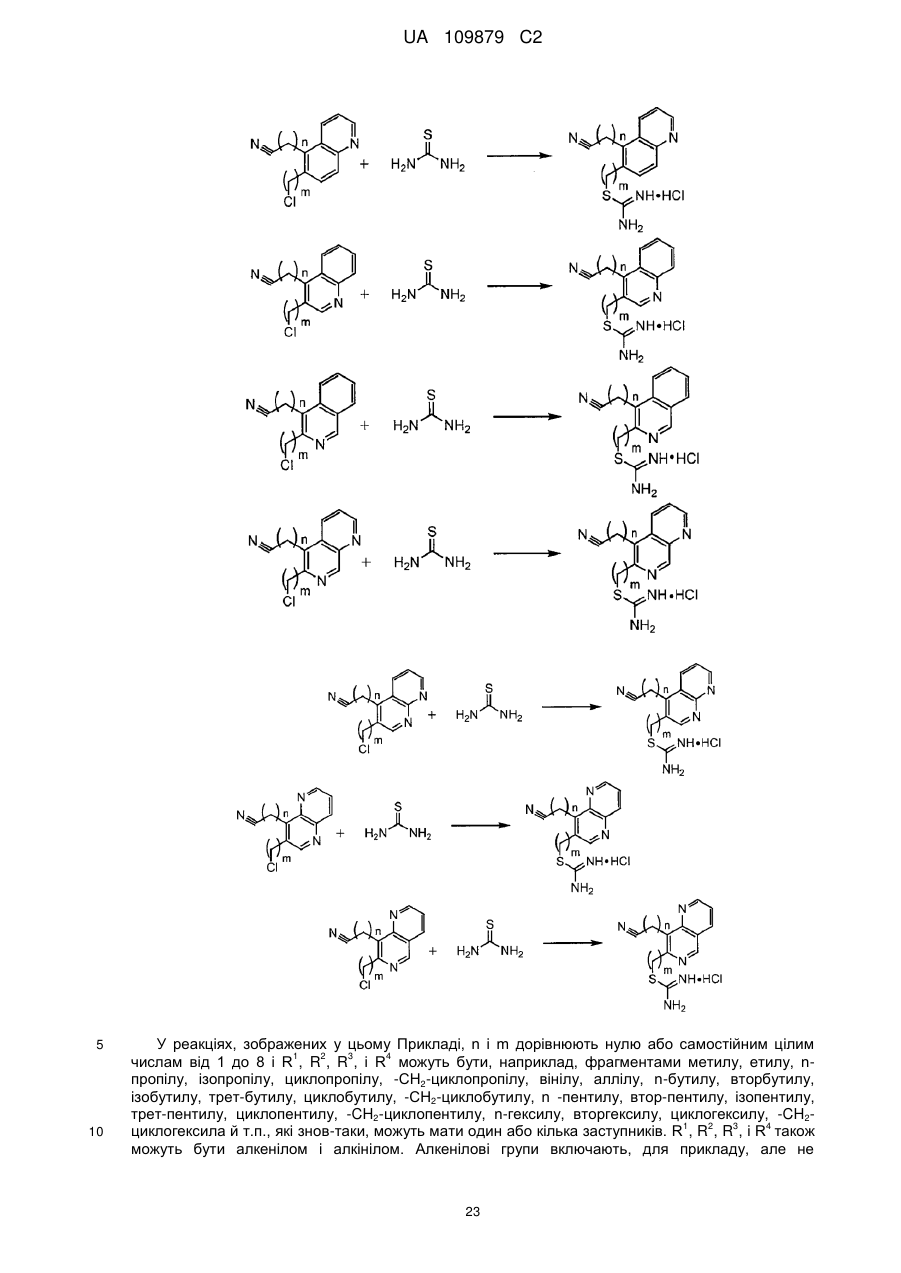
де n дорівнює нулю або цілому числу від 1 до 8 і m дорівнює нулю або цілому числу від 1 до 8;
R1, R2 і R3 є незалежно вибраними з водню та С1-С6алкілу, де алкільні фрагменти можуть бути лінійними, розгалуженими й циклічними та комбінаціями лінійних, розгалужених й циклічних;
W відсутній або W є вибраним з -СН2-, -СН2-СН2-, транс-СН=СН-, цис-СН=СН-, -СºС-, або
W являє собою дизаміщений фрагмент, у якому термін "дизаміщений" використовується, щоб показати як W приєднується до груп (СН2)m і (СН2)n, вибраних із групи дизаміщених фрагментів, що складаються із
(а) 1,2-, 1,3- або 1,4-дизаміщеного шестичленного кільця, яке може бути насиченим або ненасиченим з одним, двома або трьома подвійними зв'язками; як показує наступна формула, де замісники на зазначених дизаміщених кільцях являють собою групи, приєднані до W у формулі І
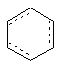 ,
,
де штрихові лінії вказують на необов'язкові подвійні зв'язки;
для приготування композиції для лікування гіперпроліферативних захворювань, запальних захворювань, вірусних інфекцій або бактеріальних інфекцій.
2. Застосування за п. 1, де сполука формули І є сполукою формули II
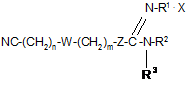 , II
, II
де n, m, W, Z, R1, R2 і R3 є такими, як визначено в п. 1, та X є фармацевтично прийнятною кислотою.
3. Застосування за будь-яким із пп. 1-2, за умови, що зазначена композиція не містить S-ціанометилізотіосечовини НВr.
4. Застосування за будь-яким із пп. 1-3, де сполука вибрана з групи, що складається з:
S-(3-ціанопропіл)ізотіосечовини,
S-(2-ціаноетил)ізотіосечовини,
S-(4-ціанобутил)ізотіосечовини,
S-(5-ціанопентил)ізотіосечовини,
S-(4-ціанометилфеніл)метилізотіосечовини,
S-2(4-[2-ціаноетил]феніл)етилізотіосечовини,
S-(2-ціанометилфеніл)метилізотіосечовини,
S-(3-ціанометилфеніл)метилізотіосечовини
або їх фармацевтично прийнятних солей.
5. Застосування за будь-яким з пп. 1-4, де гіперпроліферативне захворювання є клітинною гіперпроліферацією, такою як рак, включаючи рак молочної залози, сечового міхура, кісток, мозку, центральної та периферичної нервової системи,товстої кишки, ендокринних залоз, стравоходу, ендометрія, статевих клітин, голови та шиї, наприклад гліоми, нирок, печінки, легенів, гортані і глотки, мезотеліоми, саркома, яєчників, підшлункової залози, передміхурової залози, прямої кишки, тонкої кишки, м'яких тканин, сім'яників, шлунка, шкіри, сечоводу, піхви і вульви; успадкований рак, ретинобластома і пухлина Вільмса; лейкоз, лімфома, неходжкінська хвороба, хронічний і гострий мієлоїдний лейкоз, гострий лімфобластний лейкоз, хвороба Ходжкіна, множинні мієломи і Т-клітинна лімфома; МДС, неоплазія плазми клітин, паранеопластичні синдроми, рак невідомої первинної локалізації, стійкий до ліків рак і пов'язані зі СНІДом злоякісні новоутворення.
6. Фармацевтична композиція, що містить сполуку, яку визначено в будь-якому з пп. 1-4, за умови, що ця сполука не є S-(ціанометил)ізотіосечовини HBr.
7. Фармацевтична композиція за п. 6, яка відрізняється тим, що вона призначена для лікування раку і містить ефективну кількість сполуки за формулою І або її фармацевтично прийнятної солі та фармацевтично прийнятний носій, яка індукує апоптоз.
8. Фармацевтична композиція за будь-яким з пп. 6-7, яка відрізняється тим, що вона знаходиться у формі разової дози або для парентерального застосування.
9. Фармацевтична композиція за будь-яким із пп. 6-8, яка відрізняється тим, що вона містить ефективну кількість антигіперпроліферативної, протизапальної, противірусної або антибактеріальної сполуки формули І
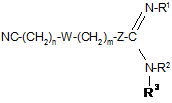 , I
, I
де Z є сіркою;
де n дорівнює нулю або цілому числу від 1 до 8 і m дорівнює нулю або цілому числу від 1 до 8;
R1, R2 і R3 є незалежно вибраними з водню та С1-С6алкілу, де алкільні фрагменти можуть бути лінійними, розгалуженими й циклічними;
W відсутній або W є вибраним з -СН2-, -СН2-СН2-, транс-СН=СН-, цис-СН=СН-, -СºC-, або W являє собою дизаміщений фрагмент, у якому термін "дизаміщений" використовується, щоб показати як W приєднується до груп (СН2)m і (СН2)n, вибраних з групи дизаміщених фрагментів, що складаються з
(а) 1,2-, 1,3- або 1,4-дизаміщеного шестичленного кільця, яке може бути насиченим або ненасиченим з одним, двома або трьома подвійними зв'язками; як показує наступна формула, де замісники на зазначених дизаміщених кільцях являють собою групи, приєднані до W у формулі І
 ,
,
де штрихові лінії вказують на необов'язкові подвійні зв'язки;
або її фармацевтично прийнятної солі.
10. Сполука формули І
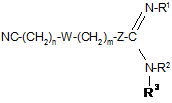 , I
, I
де Z є сіркою;
де n дорівнює нулю або цілому числу від 1 до 8 і m дорівнює нулю або цілому числу від 1 до 8;
R1, R2 і R3 є незалежно вибраними з водню та С1-С6алкілу, де алкільні фрагменти можуть бути лінійними, розгалуженими й циклічними;
W відсутній або W є вибраним з -СН2-, -СН2-СН2-, транс-СН=СН-, цис-СН=СН-, -CºC-, або W являє собою дизаміщений фрагмент, у якому термін "дизаміщений" використовується, щоб показати як W приєднується до груп (СН2)m і (СН2)n, вибраних з групи дизаміщених фрагментів, що складаються з
(а) 1,2-, 1,3- або 1,4-дизаміщеного шестичленного кільця, яке може бути насиченим або ненасиченим з одним, двома або трьома подвійними зв'язками; як показує наступна формула, де замісники на зазначених дизаміщених кільцях являють собою групи, приєднані до W у формулі І
 ,
,
де штрихові лінії вказують на необов'язкові подвійні зв'язки;
або її фармацевтично прийнятної солі, за умови, що сполука не є
S-(ціанометил)ізотіосечовини НСl,
S-(ціанометил)ізотіосечовини НВr,
S-(2-ціаноетил)ізотіосечовини НСl,
S-(2-ціаноетил)ізотіосечовини НВr,
S-(2-ціаноетил)ізотіосечовини р-толуолсульфонатом,
S-(3-ціанопропіл)ізотіосечовини НСl,
S-(3-ціанопропіл)ізотіосечовини пікратом або
S-пара-ціанобензилізотіосечовини НСl.
11. Сполука за п. 10, де вона вибрана з групи, що складається з:
S-(4-ціанобутил)ізотіосечовини,
S-(5-ціанопентил)ізотіосечовини,
S-(4-ціанометилфеніл)метилізотіосечовини,
S-2(4-[2-ціаноетил]феніл)етилізотіосечовини,
S-(2-ціанометилфеніл)метилізотіосечовини,
S-(3-ціанометилфеніл)метилізотіосечовини
та їх фармацевтично прийнятних солей.
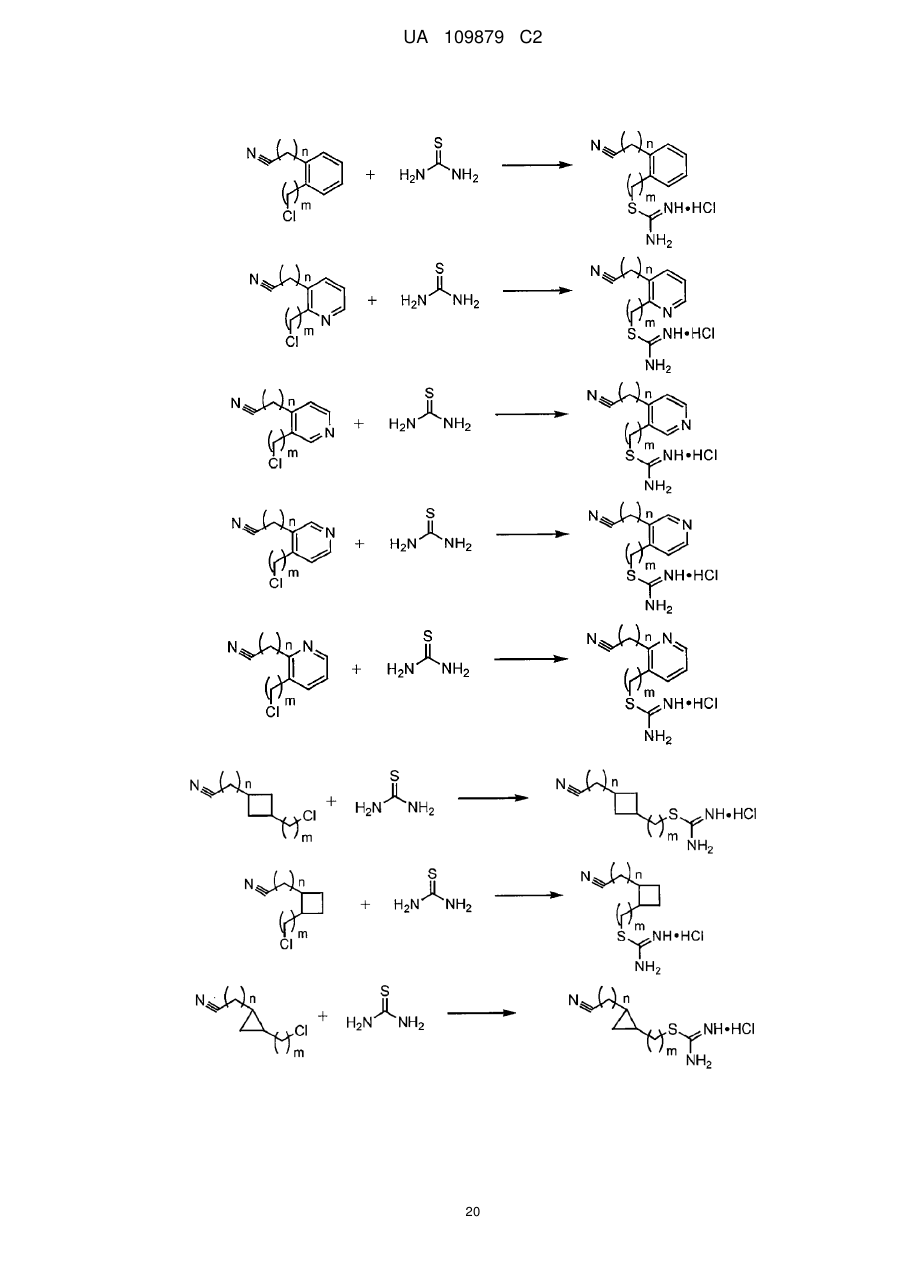
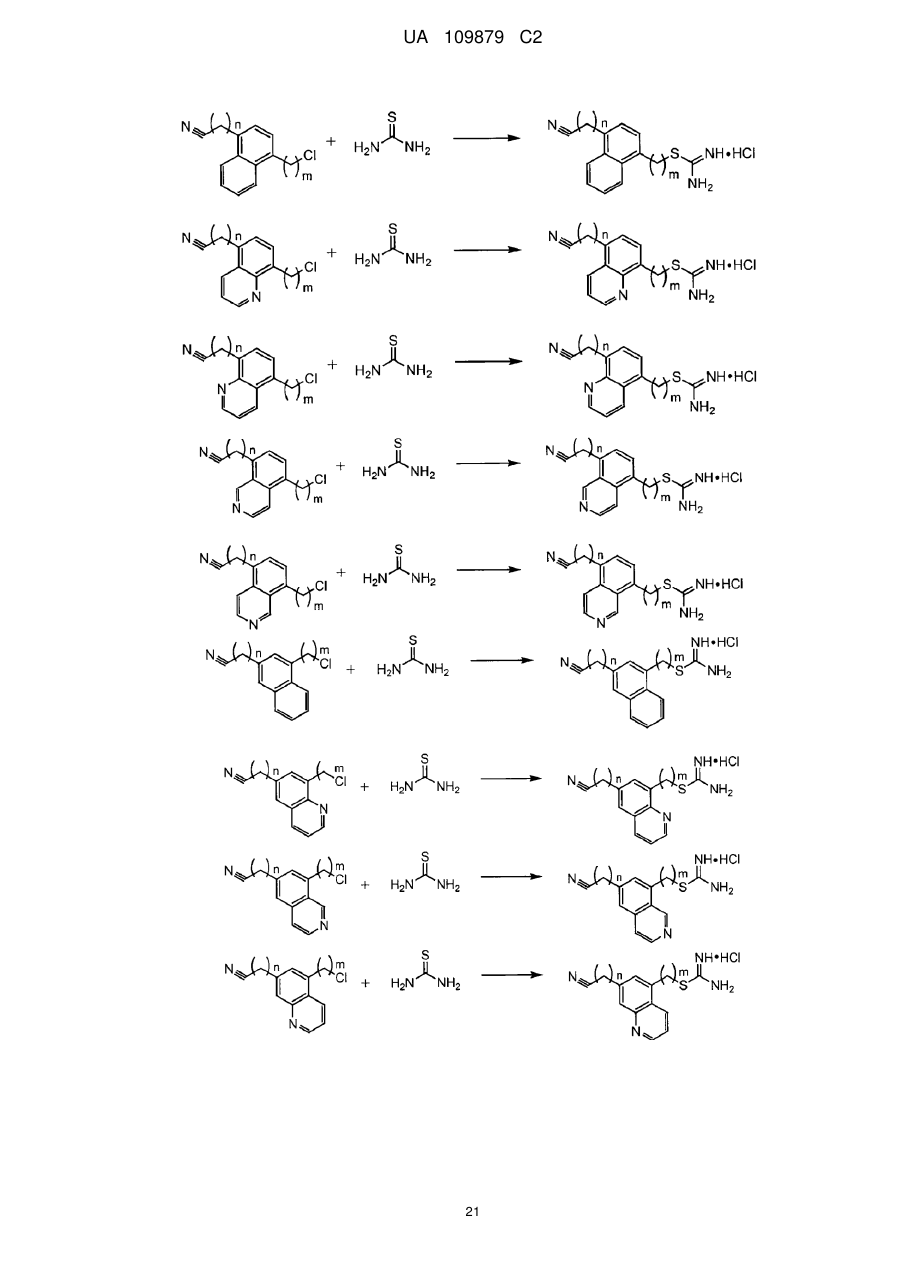
12. Сполука за п. 10, де її формула вибрана з групи, що складається з наступних сполук:
![]() ,
,
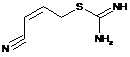 ,
,
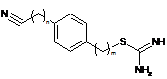 ,
,
 ,
,
 ,
,
 ,
,

та їх фармацевтично прийнятних солей, де n і m дорівнюють нулю або є незалежними цілими числами від 1 до 8.
13. Фармацевтична композиція для лікування гілерпроліферативних захворювань, запальних захворювань, вірусних інфекцій або бактеріальних інфекцій у ссавців, яка містить ефективну кількість антигіперпроліферативної, протизапальної, противірусної або протибактеріальної сполуки за п. 12 та фармацевтично прийнятний носій.
14. Застосування 4-ізотіоуреїдобутиронітрилу гідрохлориду для лікування гіперпроліферативних захворювань.
Текст
Реферат: Розкритий винахід являє собою похідні нітрилу та фармацевтичні композиції, які містять похідні нітрилу. Фармацевтичні композиції містять сполуку формули І N-R1 NC-(CH2)n-W-(CH2)m-Z-C N-R2 R 3 I і фармацевтично прийнятні солі таких сполук. Також розкритий винахід являє собою засоби одержання таких сполук, проміжні продукти, використовувані у виготовленні таких сполук, а також використання таких сполук у лікуванні гіперпроліферативних захворювань, запальних захворювань, вірусних і бактеріальних інфекцій і індукції апоптозу в ракових клітинах. UA 109879 C2 5 10 15 20 25 30 35 40 45 Рівень техніки Даний винахід відноситься до похідних нітрилу й фармацевтичних композицій, що містять похідні нітрилу. Винахід також відноситься до фармацевтично прийнятних солей таких сполук, процесів одержання таких сполук, проміжних продуктів, використовуваних у підготовці даних сполук, а також до використання таких сполук для лікування гіперпроліферативних захворювань, запальних захворювань, вірусних і бактеріальних інфекцій. Вищезгадані похідні і їх фармацевтично прийнятні солі мають одну або декілька з наступних властивостей: інгібування AKT, інгібування клітинного циклу гіперпроліферації, клітинного циклу специфічної індукції апоптозу в ракових клітинах, інгібування активності LTB4, а також антиангіогенну дію, що демонструє значне зменшення розміру пухлини в експериментальних тваринах. Ці сполуки, отже, є придатними для лікування широкого спектра захворювань у ссавців, включаючи, але не обмежуючись цим, гіперпроліферативні захворювання, такі як рак голови й шиї, включаючи гліоми, стійкий до лікарських засобів рак легенів, естроген залежні або незалежні види раку в людей, недрібноклітинний рак легенів і рак товстого кишечнику. Необмежуючими прикладами естрогензалежних видів раку є рак молочної залози й рак яєчників. У результаті інгібування ними активності LTB4, ці сполуки використовуються в лікуванні запальних захворювань, таких як алергія, астма й артрит, і, як результат інгібування цими сполуками AKT і активації цитокінів, вони також є придатними для лікування вірусних і бактеріальних інфекцій. У цей час існує великий інтерес у пошуку нових методів лікування вищезгаданих захворювань. Солі заміщених сполук ізотіосечовини згадуються в роботах Miller et al., JACS, Vol. 62, 20992103 (1940); Shapiro, et al., Radiation Research, Vol. 7, No. 1, 22-34 (1957); King et al., Biochemistry, Vol. 17, No. 8, 1499 – 1506 (1978); Bauer and Welsh, J. Org. Chem. Vol. 26, No. 5, 1443-1445 (1961); Southan, et al., Br. J. Pharmacol., Vol. 114, 510-516 (1995); and Gerber, et al., Organic Synthesis, Vol. 77, 186 (2000). Сутність винаходу У конкретному варіанті, даний винахід відноситься до фармацевтичної композиції для лікування гіперпроліферативних захворювань, включаючи, але не обмежуючись цим, рак, запальні захворювання, вірусні й бактеріальні інфекції в ссавців, у тому числі, але не обмежуючись цим, у людей, включаючи ефективну проти гіперпроліферативних захворювань, протизапальну, противірусну або антибактеріальну кількість сполуки формули I. де, Z являється вибраним із сірки, міді, срібла, золота й платини, або Z являє собою галогенутримуючий фрагмент, вибраний з ClО2, BrО2, і IO2; де n дорівнює нулю або цілому числу від 1 до 8 і m дорівнює нулю або цілому числу від 1 до 8; 1 2 3 R , R і R є незалежно вибраними з водню, -CH2-циклогексилу, C1-C6 алкілу, C2-C6 алкенілу, і C2-C6 алкінілу, де алкільні фрагменти зазначених груп алкілу, алкенілу й алкінілу можуть бути лінійними, розгалуженими й циклічними, а також комбінацією лінійних, розгалужених і циклічних фрагментів алкілу, алкенілу й алкінілу, і названі групи можуть бути заміщені групами, вибраними з метилу, етилу, пропілу, ізопропілу, n-бутилу, трет-бутилу, метоксі, етоксі, О-n-пропілу, Oізопропілу, О-n-бутилу й O-t-бутилу; або 1 2 R і R , у комбінації з атомами азоту, до яких вони безпосередньо приєднані, і вуглецем, який приєднаний до азоту, утворюють кільце з п'яти або більш членів, у якому р є ціле число від 1 до 7, як продемонстровано нижче 1 UA 109879 C2 5 10 15 20 25 30 35 де ламана лінія необов'язково представляє подвійний зв'язок, за умови, що при наявності 3 такого подвійного зв'язку R відсутній, і група СН2, розташована поруч із подвійним зв'язком, має один атом водню, а не два атоми водню, 2 3 або R і R у комбінації з атомами азоту, до яких вони безпосередньо приєднані, утворюють кільце із трьох- або більше членів, у якому р є ціле число від 1 до 7, як продемонстровано нижче ; W відсутнє або W є вибраним з 4 5 4 -CH2-, -CH2-CH2-, транс -CH=CH-, цис -CH=CH-, -C C-, або –CHR -CHR -, транс -C R =C 5 4 5 4 5 R -, цис -CR =CR -, де R , і R є незалежно вибраними з -CH2 - циклогексилу, C1-C6 алкілу, C2-C6 алкенілу, C2-C6 алкінілу, і C1-C6 алкіл ефіру (також згадується як C1-C6 алкіл -O-); або W являє собою дізаміщений фрагмент, у якому термін "дізаміщений" використовується, щоб показати як W приєднується до груп (CH2)m і (CH2)n, вибраним із групи дізаміщених фрагментів, що складаються із (a) 1,2-, 1,3-, або 1,4- дізаміщеного шестичленного кільця, яке може бути насиченим або ненасиченим з одним, двома або трьома подвійними зв'язками; 1,2- або 1,3- дізаміщеного п'ятичленного кільця, яке може бути насиченим або ненасиченим з одним або двома подвійними зв'язками; 1,2-, або 1,3- дізаміщеного чотиричленного кільця, яке може бути насиченим або ненасиченим з одним або двома подвійними зв'язками; або 1,2- дізаміщеного тричленного кільця, яке може бути насиченим або ненасиченим з подвійним зв'язком як показують наступні формули, де заступники на зазначених дізаміщених кільцях являють собою групи, приєднані до W у формулі I де ламані лінії вказують на факультативні подвійні зв'язки; (b) 1,2-, 1,3-, або 1,4- дізаміщеного шестичленного кільця, яке може бути насиченим або ненасиченим з одним, двома або трьома подвійними зв'язками; 1,2-, або 1,3- дізаміщеного п'ятичленного кільця, яке може бути насиченим або ненасиченим з одним або двома подвійними зв'язками; 1,2-, або 1,3- дізаміщеного чотиричленного кільця, яке може бути насиченим або ненасиченим з одним або двома подвійними зв'язками; або 1,2- дізаміщеного тричленного кільця, яке може бути насиченим або ненасиченим з подвійним зв'язком, як показують наступні формули, де заступники на зазначених дізаміщених кільцях являють собою групи, приєднані до W у формулі I, і названі дізаміщені кільця можуть мати додаткові заступники 6 7 8 9 R , R , R , і R , як продемонстровано в наступних формулах R7 R6 R7 R6 R6 R7 R6 R7 R6 6 R Y Y 8 R7 R8 R9 R8 R 6 7 8 9 де ламані лінії вказують на факультативні подвійні зв'язки; де R , R , R і R є незалежно вибраними з водню, -CH2-циклогексилу, C1-C6 алкілу, C2-C6 алкенілу, C2-C6 алкінілу, або C1-C6 алкіл ефіру; шестичленне кільце може бути насиченим або мати один, два або три подвійних зв'язка, п'яти- і чотиричленні кільця можуть бути насиченими або мати один або два подвійних 2 UA 109879 C2 5 зв'язка й тричленне кільце може бути насиченим або мати один подвійний зв'язок; де Y являє собою азот, кисень або сірку; (c) кільця, вибраного з 1,2-, 1,3-, 1,4-, 1,5-, 1,6-, або 1,7- дізаміщених насичених і ненасичених дев'ятичленних кілець із одним або декількома подвійними зв'язками, з позиціями кільця, пронумерованими, як показано нижче на першім кільці, зазначене кільце вибране із представлених нижче кілець із другого по тринадцяте, де заступники на названих дізаміщених кільцях являють собою групи, приєднані до W у формулі I, і названі дізаміщені кільця можуть 6 7 8 9 10 мати додаткові заступники R , R , R , R і R , як показано в наступних формулах 10 15 20 25 де ламані лінії вказують на необов'язкові подвійні зв'язки; 6 7 8 9 10 де R , R , R , R , і R являються незалежно вибраними з водню, -CH2-циклогексилу, C1-C6 алкілу, C2-C6 алкенілу, C2-C6 алкінілу, або C1-C6 алкіл ефіру; де Y являє собою азот, кисень або сірку; (d) кільця, вибраного з 1,2-, 1,3-, 1,4-, 1,5-, 1,6-, 1,7-, або 1,8- дізаміщених насичених і ненасичених нафталінових кілець із одним або декількома подвійними зв'язками, з позиціями кільця, пронумерованими, як показано нижче на першім кільці, зазначене кільце вибране із представлених нижче кілець з другого по шосте, де заступники на названих дізаміщених кільцях представляють собою групи, приєднані до W у формулі I і названі дізаміщені кільця можуть 6 7 8 9 10 11 мати додаткові заступники R , R , R , R , R і R як показано в наступних формулах 6 7 8 9 10 11 де ламані лінії вказують на факультативні подвійні зв'язки; де R , R , R , R , R і R є незалежно вибраними з водню, -CH2-циклогексилу, C1-C6 алкілу, C2-C6 алкенілу, C2-C6 алкінілу, або C1-C6 алкіл ефіру; де Y являє собою азот, кисень або сірку; і 3 UA 109879 C2 5 (e) кільця, вибраного з 1,2-, 1,3-, 1,4-, 1,5-, 1,6-, 1,7-, 1,8-, 1,9-, 1,10-, 2,5-, 3,5-, 4,5-, або 5,10дізаміщених насичених і ненасичених антраценових кілець із одним або декількома подвійними зв'язками, з позиціями кільця, пронумерованими, як показано нижче на першім кільці, зазначене кільце вибране із представлених нижче кілець із другого по дев'яте, де заступники на названих дізаміщених кільцях являють собою групи, приєднані до W у формулі I і названі дізаміщені 6 7 8 9 10 11 12 13 кільця можуть мати додаткові заступники R , R , R , R , R , R , R і R як показано в наступних формулах 10 15 20 25 30 35 40 де ламані лінії вказують на факультативні подвійні зв'язки; 6 7 8 9 10 11 12 13 де R , R , R , R , R , R , R , і R являються незалежно вибраними з водню, -CH2циклогексилу, C1-C6 алкілу, C2-C6 алкенілу, C2-C6 алкінілу, або C1-C6 алкіл ефіру; де Y являє собою азот, кисень або сірку; або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій. 1 2 3 В одному варіанті, R , R і R є незалежно вибраними з водню, метилу, етилу, n-пропілу, ізопропілу, циклопропілу, -CH2-циклопропілу, n-бутилу, вторбутилу, ізобутилу, трет-бутилу, циклобутилу, -CH2-циклобутилу, n-пентилу, втор-пентилу, ізопентилу, трет-пентилу, циклопентилу, -CH2-циклопентилу, n-гексилу, втор-гексилу, циклогексилу, -CH2-циклогексилу, етенілу, пропенілу, бутенілу, 1-метил-2-бутен-1-ілу, етинілу, 2-пропинілу (пропаргілу), і 1пропинілу, які можуть мати один або кілька заступників, вибраних з метилу, етилу, пропілу, ізопропілу, n-бутилу, t-бутилу, метоксі, етоксі, O-n-пропілу, O-ізопропілу, O-n-бутилу, і O-tбутилу. В одному з варіантів здійснення даного винаходу, сполука формули I є сполукою формули II 1 2 3 де n, m, W, Z, R , R , і R визначені вище й X являється фармацевтично прийнятною кислотою. В одному варіанті, кислота являє собою HСl. В іншому варіанті, кислота являє собою HВr. В одному варіанті винаходу, Z є сіркою, міддю, сріблом, золотом або платиною. В іншому варіанті винаходу, Z є сіркою. В іншому варіанті винаходу, Z є міддю. В іншому варіанті винаходу, Z є золотом. В іншому варіанті винаходу, Z є галогенутримуючим фрагментом, як 1 2 3 визначено вище. В іншому варіанті винаходу, кожний з R , R і R є воднем. В одній конкретній 1 2 3 сполуці винаходу, Z є міддю, R , R і R , кожний, є воднем, m рівний 1, n рівний 1, і W являє собою CH2. 4 5 6 7 8 9 10 11 12 13 В одному варіанті винаходу, R , R , R , R , R , R , R , R , R , і R є незалежно вибраними з водню, метилу, етилу, n-пропілу, ізопропілу, циклопропілу, -CH2-циклопропілу, вінілу, аллілу, n-бутилу, вторбутилу, ізобутилу, трет-бутилу, циклобутилу, -CH2-циклобутилу, n-пентилу, вторпентилу, ізопентилу, трет-пентилу, циклопентилу, -CH2-циклопентилу, n-гексилу, втор-гексилу, циклогексилу, -CH2-циклогексилу, етенілу, пропенілу, бутенілу, 1-метил-2-бутен-1-ілу, етинілу, 2пропинілу (пропаргілу), і 1-пропинілу, які можуть мати один або декілька заступників, вибраних з 4 UA 109879 C2 5 10 15 20 25 30 35 40 45 50 55 метилу, етилу, пропілу, ізопропілу, n-бутилу, t-бутилу, метоксі, етоксі, O-n-пропілу, O-ізопропілу, O-n-бутилу, і О-t-бутилу. В одному варіанті винаходу W являє собою алліл або вініл. Один з варіантів здійснення даного винаходу відноситься до фармацевтичної композиції для лікування гіперпроліферативних захворювань, включаючи, але не обмежуючись цим, рак, запальні захворювання, вірусні й бактеріальні інфекції в ссавців і включає ефективну проти гіперпроліферативних захворювань, протизапальну, противірусну або антибактеріальну кількість 4 - ізотіоуреідобутиронітрила (також називаний S-(3-ціанопропіл)ізотіосечовина або S(γ-ціанопропіл)ізотіосечовина) або її фармацевтично прийнятної солі й фармацевтично прийнятного носія. У конкретному варіанті, композиція містить хлористоводневу сіль приєднання кислоти 4-ізотіоуреідобутиронітрила, яка також відома як "Кеветрін". Ця сіль має наступну формулу В іншому варіанті, композиція містить гідробромідну сіль приєднання кислоти 4ізотіоуреідобутиронітрилу. В іншому варіанті, даний винахід відноситься до фармацевтичної композиції для лікування гіперпроліферативних захворювань, включаючи, але не обмежуючись цим, рак, запальні захворювання, вірусні й бактеріальні інфекції в ссавців, що містить ефективну проти гіперпроліферативних захворювань, протизапальну, противірусну або антибактеріальну кількість сполуки, вибрану з S-(2-ціаноетил)ізотіосечовини, S-(4-ціанобутил)ізотіосечовини, S-(5ціанопентил)ізотіосечовини або їх фармацевтично прийнятної солі й фармацевтично прийнятного носія. В іншому варіанті, даний винахід відноситься до фармацевтичної композиції для лікування гіперпроліферативних захворювань, включаючи, але не обмежуючись цим, рак, запальні захворювання, вірусні й бактеріальні інфекції в ссавців, що містить ефективну проти гіперпроліферативних захворювань, протизапальну, противірусну або антибактеріальну кількість сполуки, вибраної з S-(4-ціанометилфеніл) метилізотіосечовини гідрохлориду, S-2(4-[2ціаноетил] феніл) етилізотіосечовини мезилату, S-(2-ціанометилфеніл) метилізотіосечовини гідрохлориду, S-(6-ціанометилпірідин-2-іл)метилізотіосечовини гідрохлориду, S-(3ціанометилфеніл)метилізотіосечовини гідрохлориду, S-(1-ціанометилнафт-2-іл) метилізотіосечовини гідрохлориду або їх іншої фармацевтично прийнятної солі й фармацевтично прийнятного носія. В іншому варіанті, фармацевтична композиція включає сполуку, вибрану із сполук, отриманих, як описано в Прикладі 11, викладеному нижче, або їх іншої фармацевтично прийнятної солі або їх вільної основи й фармацевтично прийнятного носія. В одному варіанті винаходу, фармацевтична композиція не включає Sціанометилізотіосечовини HВr. В іншому варіанті винаходу, фармацевтична композиція не включає S-ціанометилізотіосечовини HСl або S-ціанометилізотіосечовини HВr. В іншому варіанті винаходу, фармацевтична композиція не включає фармацевтично прийнятні солі Sціанометилізотіосечовини. В іншому варіанті винаходу, фармацевтична композиція не включає S-ціанометилізотіосечовину у вигляді вільної основи або у вигляді солі. В одному варіанті винаходу, фармацевтична композиція не включає S-(2ціаноетил)ізотіосечовини HСl, S-ціанометилізотіосечовини HBr і S-ціанометилізотіосечовини HСl. В іншому варіанті винаходу, фармацевтична композиція не включає S-(2ціаноетил)ізотіосечовини HСl, S-(2-ціаноетил)ізотіосечовини HВr, S-ціанометилізотіосечовини HСl або S-ціанометилізотіосечовини HВr. В іншому варіанті винаходу, фармацевтична композиція не включає фармацевтично прийнятні солі S-(2-ціаноетил)ізотіосечовини й Sціанометилізотіосечовини. В іншому варіанті винаходу, фармацевтична композиція не включає S-(2-ціаноетил)ізотіосечовину у вигляді вільної основи або у вигляді солі й не включає Sціанометилізотіосечовину у вигляді вільної основи або у вигляді солі. В іншому варіанті здійснення цього винаходу, фармацевтична композиція не включає S(ціанометил) ізотіосечовини HСl, S-(ціанометил)ізотіосечовини HВr, S-(2ціаноетил)ізотіосечовини HСl, S-(2-ціаноетил)ізотіосечовини HВr, S-(2-ціаноетил)ізотіосечовини p-толуолсульфонат, S-(3-ціанопропіл)ізотіосечовини HСl, S-(3-ціанопропіл) ізотіосечовини пікрат, і S-пара-ціанобензилізотіосечовини HСl. В іншому варіанті даного винаходу, 5 UA 109879 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтична композиція також не включає гидробромідну сіль S-(3ціанопропіл)ізотіосечовини або S-пара-ціанобензилізотіосечовини. В іншому варіанті даного винаходу, фармацевтична композиція не включає фармацевтично прийнятну сіль S-(ціанометил)ізотіосечовини, S-(2-ціаноетил) ізотіосечовини, S-(3ціанопропіл)ізотіосечовини, або S-пара-ціанобензилізотіосечовини. В іншому варіанті винаходу, сполука не являється вибраною із S-(ціанометил) ізотіосечовини, S-(2-ціаноетил)ізотіосечовини, S-(3-ціанопропіл) ізотіосечовини й S-пара-ціанобензилізотіосечовини і їх фармацевтично прийнятних солей. Фармацевтично прийнятні солі сполук формули I включають їх солі приєднання кислоти й основні солі (у тому числі дисолі). Підходящі солі приєднання кислоти утворюються з кислот, які утворюють нетоксичні солі. Приклади включають такі солі, як ацетат, аспартат, бензоат, бесилат, бікарбонат/карбонат, бісульфат/сульфат, борат, камзилат, цитрат, едізилат, езилат, форміат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гібензат, гідрохлорид/хлорид, гідробромід/бромід, гідройодид/йодид, ізетіонат, лактата, малат, малеат, малонат, мезілат, метилсульфат, нафтилат, 2-напсілат, нікотінат, нітрат, оротат, оксалат, пальмітат, памоат, фосфат/водень фосфат/диводень фосфат, сахарат, стеарат, сукцінат, тартрат, тозілат і трифторацетат. Підходящі основні солі утворюються з основ, які утворюють нетоксичні солі. Приклади включають солі алюмінію, аргініну, бензатіну, кальцію, холіну, діетиламіну, діоламіну, гліцину, лізину, магнію, меглуміну, оламіну, калію, натрію, трометаміну й цинку. Для огляду підходящих солей дивіться "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" by Stahl and Wermuth (Wiley-vch, Weinheim, Germany, 2002). Фармацевтично прийнятна сіль сполуки формули I, при необхідності, може бути легко отримана шляхом змішування розчинів сполуки формули I і бажаної кислоти або основи. Сіль може випадати з розчину в осад і бути зібраною шляхом фільтрації або може бути відновлена шляхом випарювання розчинника. Ступінь іонізації в солі може варіюватися від повністю іонізованої до майже неіонізованої. Сполука формули I і їх фармацевтично прийнятні солі (далі також називані активні сполуки) можуть існувати як у несольватованих, так і в сольватованих формах. Активні сполуки (у тому числі, у вигляді солей, вільних основ, вільних кислот і нейтральних сполук) можуть утворювати гідрати й інші сольвати. Термін "сольват" використовується тут для опису молекулярного комплексу, що включає сполуку винаходу й одну або більш фармацевтично прийнятних молекул розчинника, наприклад, етанолу. Термін "гідрат" використовується, коли названим розчинником є вода. Фармацевтично прийнятні сольвати включають гідрати й інші сольвати, де розчинник кристалізації може бути ізотопічно заміщеним, наприклад, D 2O, d6-ацетон, d6-ДМСО. Активні сполуки можуть існувати у вигляді клатратів або інших комплексів. Загалом, сольватовані, гідратовані й подібні форми являються еквівалентними несольватованим, негідратованим/безводним і подібним формам, і сполуки, композиції й способи застосування, заявлені в даному документі, у рамках цього винаходу призначені для охоплення цих форм, а також ізомерних, кристалічних і аморфних форм і ізотопно-мічених сполук, обговорюваних нижче. Сполуки формули I, що містять один або кілька асиметричних атомів вуглецю можуть існувати у вигляді двох і більш стереоізомерів. Якщо сполука формули I містить групу алкеніла або алкенілена або групу циклоалкенілу, можлива наявність геометричних цис/транс (або Z/E) ізомерів. Якщо сполука містить, наприклад, кето- або оксім- групу або ароматичний залишок, може відбутися таутомерна ізомерія ('таутомерія'). Звідси випливає, що одна сполука може проявляти більше ніж один тип ізомерії. Сполука формули I можуть існувати і як ізомери, якщо вони утворюють солі приєднання кислоти або основні солі, у яких противоіон являється оптично активним, наприклад, D-лактатом або L-лізином, або рацемічним, наприклад, DL-тартратом или DL-аргініном. Суміші стереоізомерів можуть бути розділені звичайними способами, відомими фахівцям у даній галузі техніки. Дивися, наприклад, "Stereochemistry of Organic Compounds" by E. L. Eliel (Wiley, New York, 1994). Цис/транс-ізомери можуть бути розділені звичайними способами, добре відомими фахівцям у даній галузі техніки, наприклад, за допомогою хроматографії й дробової кристалізації. Загалом, енантіомерно чисті сполуки цього винаходу можуть бути підготовлені й можуть бути виділені відповідно до відомих у даній галузі техніки процесами, такими як, наприклад, хіральний синтез із підходящих оптично чистих попередників і розкладання рацемата (або рацемата солі або деривата). Наприклад, рацемат (або рацемічний попередник) може бути розділений з використанням хіральної рідинної хроматографії високого тиску (РХВТ). Крім того, рацемат (або рацемічний попередник) може реагувати з підходящою оптично активною 6 UA 109879 C2 5 10 15 20 25 30 35 40 45 50 55 сполукою, наприклад, зі спиртом, або, у випадку, коли сполука формули I містить кислотний або основний фрагмент, з кислотою або основою, таким як винна кислота або 1-фенілетиламін. Отримана в результаті діастереомерна суміш може бути розділена за допомогою хроматографії або дробової кристалізації або обох способів, і один або обидва діастереоізомера можуть бути перетворені у відповідний чистий енантіомер(и) за допомогою способів, добре відомих фахівцям у даній галузі техніки. Хіральні сполуки цього винаходу (і їх хіральні попередники) можуть бути отримані в енантіомерно збагаченій формі з використанням хроматографії, як правило, ВЕРХ, на смолі з асиметричною стаціонарною фазою й з рухливою фазою, що складається з вуглеводнів, звичайно гептану або гексану, що містить від 0 % до 50 % ізопропанолу, як правило, від 2 % до 20 %, і від 0 % до 5 % алкиламіну, як правило, 0,1 % диетиламіну. Концентрація елюата дозволяє одержати збагачену суміш. У твердому стані, сполуки цього винаходу можуть існувати в кристалічній або аморфній формі. Даний винахід включає всі фармацевтично прийнятні ізотопно-мічені сполуки формули I, заявлені тут, що відрізняються тим, що один або кілька атомів заміщені атомами, що мають такий же атомний номер, але атомну масу або масове число, відмінні від атомної маси або масового числа, що звичайно зустрічаються в природі. Приклади ізотопів, що підходять для включення в сполуку винаходу, включають ізотопи 2 3 11 13 14 36 18 водню, такі, як H і H, вуглецю, такі, як C, C і C, хлору, такі, як Cl, фтору, такі, як F, йоду, 123 125 13 15 15 17 18 32 такі, як I і I, азоту, такі, як N і N, кисню, такі, як O, O і O, фосфору, такі, як P, і сірки, 35 такі, як S. Деякі ізотопно-мічені сполуки формули I, наприклад, ті, які включають радіоактивний ізотоп, являються застосовними в лікарських засобах і/або дослідженнях розподілу субстрату в 3 14 тканинах. Радіоактивні ізотопи тритію, тобто Н і вуглецю-14, тобто С, особливо придатні для цієї мети в силу простоти їх включення й доступних способів виявлення. Заміщення більш 2 важкими ізотопами, такими, як дейтерій, тобто Н, може надати певні терапевтичні переваги, що випливають із більшої метаболічної стабільності, наприклад, збільшення періоду напіврозпаду in vivo або зниження потреб дозування, і, отже, у деяких обставинах може бути переважніше. 11 18 15 13 Заміщення ізотопами, що випромінюють позитрони, такими, як C, F, О і N, може бути використане для досліджень позитроно-емісійної топографії (ПЕТ) для вивчення розміщення субстрату рецептора. Ізотопічно мічені сполуки формули I, як правило, можуть бути отримані звичайними способами, відомими фахівцям у даній галузі техніки або за допомогою процесів, аналогічних описаним у супровідних Прикладах з використанням відповідного ізотопно-міченого реагенту замість застосовуваного раніше неміченого реагенту. Даний винахід також відноситься до фармацевтичної композиції для лікування клітинної гіперпроліферації, що містить антигіперпроліферативну ефективну кількість сполуки формули I або її фармацевтично прийнятної солі й фармацевтично прийнятний носій. В іншому варіанті, цей винахід відноситься до фармацевтичної композиції для лікування раку, що містить протиракову ефективну кількість сполуки формули I або її фармацевтично прийнятної солі й фармацевтично прийнятний носій. В іншому варіанті, цей винахід відноситься до фармацевтичної композиції для лікування раку, що містить ефективну кількість сполуки формули I, що індукує апоптоз або її фармацевтично прийнятну сіль й фармацевтично прийнятний носій. В інших варіантах, одне або кілька сполук, виключених з фармацевтичних композицій розглянутих вище, можуть бути також виключені з фармацевтичних композицій, зазначених у даному параграфі. Цей винахід також відноситься до фармацевтичної композиції у формі одиниці дози для лікування клітинної гіперпроліферації, включаючи, але не обмежуючись цим, рак, що містить антигіперпроліферативну або протипухлинну ефективну кількість сполуки формули I або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій. В інших варіантах, одне або кілька сполук, виключених з фармацевтичних композицій, розглянутих вище, можуть бути також виключені з вищезгаданої фармацевтичної композиції. Цей винахід також відноситься до парентеральної фармацевтичної композиції для лікування клітинної гіперпроліферації, у тому числі, але не обмежуючись цим, раку, що містить антигіперпроліферативну або протиракову ефективну кількість сполуки формули I або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій, що підходить для парентерального введення. Фармацевтичний продукт може бути отриманий шляхом розчинення бажаної кількості продукту в стерильному ізотонічному розчині, який може бути легко введений будь-яким бажаним шляхом уведення. В інших варіантах, одне або кілька 7 UA 109879 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполук, виключених з фармацевтичних композицій розглянутих вище, можуть бути також виключені з вищезгаданої фармацевтичної композиції. Цей винахід також відноситься до способу лікування гіперпроліферативних захворювань, включаючи, але не обмежуючись цим, рак, запальні захворювання й вірусні й бактеріальні інфекції в ссавців, у тому числі в людей, що включає введення пацієнту, який потребує таке лікування, ефективну проти гіперпроліферативного захворювання, протизапальну, противірусну й антибактеріальну кількість сполуки формули I або її фармацевтично прийнятну сіль. В одному варіанті сполуку вибрано з S-(3-ціанопропіл) ізотіосечовини, S-(2ціаноетил)ізотіосечовини, S-(4-ціанобутил)ізотіосечовини, S-(5-ціанопентил) ізотіосечовини, S(4-ціанометилфеніл)метилізотіосечовини, S-2(4-[2-ціаноетил] феніл) етилізотіосечовини, S-(2ціанометилфеніл) метилізотіосечовини, S-(6-ціанометилпірідин 2-іл) метилізотіосечовини, S-(3ціанометилфеніл) метилізотіосечовини, і S-(1-ціанометилнафт-2-іл) метилізотіосечовини і їх фармацевтично прийнятних солей. В іншому варіанті, сполука являє собою S-(3-ціанопропіл) ізотіосечовини гідрохлорид. В іншому варіанті, сполуку вибрано із сполук, отриманих, як описано в Прикладі 11, викладеному нижче, або їх іншу фармацевтично прийнятну сіль або їх вільну основу. Цей винахід також відноситься до способу лікування гіперпроліферативних захворювань, що включає введення пацієнтові, який потребує таке лікування, антигіперпроліферативну ефективну кількість сполуки формули I або її фармацевтично прийнятної солі. В іншому варіанті, даний винахід відноситься до способу лікування раку, що включає введення пацієнтові, який потребує такого лікування антиракову ефективну кількість сполуки формули I або її фармацевтично прийнятну сіль. В іншому варіанті, даний винахід відноситься до способу лікування раку, що включає введення пацієнтові, який потребує таку, ефективну кількість сполуки формули I, що індукує апоптоз або її фармацевтично прийнятну сіль. В інших варіантах, одне або кілька сполук, виключених з фармацевтичних композицій, розглянутих вище, можуть бути також виключені зі способів, зазначених у даному параграфі. Цей винахід також відноситься до способу лікування раку голови й шиї, недрібноклітинного раку легені, дрібноклітинного раку легені, резистентних типів раку легені й будь-яких типів раку в жінок, раку яєчників, раку молочної залози або раку товстого кишечнику в ссавців, які потребують такого лікування, що включає введення названим ссавцям антиракової ефективної кількості сполуки формули I або її фармацевтично прийнятної солі. В одному варіанті даного винаходу, рак вибраний з раку голови й шиї, недрібноклітинного раку легені, раку яєчників і раку товстого кишечнику. В одному варіанті даного винаходу, рак голови є гліомою. Цей винахід також відноситься до способу лікування гіперпроліферативного захворювання, сприйнятливого до індукції апоптоза в ссавців, які потребують такого лікування, що включає введення роздільно, одночасно, паралельно, послідовно або хронологічно зміщеним чином зазначеному ссавцеві, який це потребує, кількості активної сполуки, яке являє собою сполуку формули I або її фармацевтично прийнятну сіль і кількості не менш однієї другої сполуки або іонізуючого випромінювання. Зазначену другу сполуку, що є протираковим лікарським засобом, із групи, що складається з хіміотерапевтичних протиракових лікарських засобів і мішеньспецифічних протиракових лікарських засобів, де кількості активної сполуки й зазначеної другої сполуки або іонізуючого випромінювання в результаті дають терапевтичний ефект. В одному варіанті винаходу, зазначена друга сполука вибрана із групи, що складається з (i) алкілуючих/арбамілуючих лікарських засобів; (ii) похідних платини; (iii) антимітотичних лікарських засобів/інгібіторів тубуліна; (iv) інгібіторів топоізомерази; (v) пірімідинових антагоністів; (vi) пуринових антагоністів; (vii) антагоністів фолієвої кислоти; і (viii) ін'єкцій радіоактивних матеріалів. В одному варіанті винаходу, названий мішень-специфічний протираковий лікарський засіб є вибраним із групи, що складається з (i) інгібіторів кінази; (ii) інгібіторів протеасом; (iii) інгібіторів гістонових деацетілу, з; (iv) інгібіторів білків теплового шоку 90; (v) агентів васкулярного таргетинга (АВТ) антиангіогенних лікарських засобів, і інгібіторів тирозин кінази KDR; (vi) моноклональних антитіл, а також мутантів і кон’югатів моноклональних антитіл і фрагментів антитіл; (vii) терапевтичних засобів на основі олігонуклеотидів; (viii) Tollподібного рецептора/ТПР 9 агоністів, ТПР 7 агоністів і їх аналогів, або ТПР 7/8 агоністів а також імуностимуляторів РНК, таких як ТПР 7/8 агоністи; (ix) інгібіторів протеази; (x) гормональних терапевтичних засобів; (xi) блеоміцина; (xii) ретіноідів; (xiii) інгібіторів метилтрансферази ДНК; (xiv) аланозина; (xv) цитокінів; (xvi) інтерферонів; і (xvii) агоністів рецептора смерті. В одному варіанті винаходу, зазначена сполука формули I або її фармацевтично прийнятну сіль вводять роздільно, одночасно, паралельно, послідовно або хронологічно зміщеним чином із протираковою ефективною кількістю іонізуючого випромінювання. З вищевикладеного ясно, що 8 UA 109879 C2 5 10 15 20 25 30 35 40 45 50 використовуваний тут термін "ефективна кількість" включає кількість активної речовини, яка являється ефективною при введенні саме по собі, а також кількість активної речовини, яка є ефективною при введенні в комбінації з іншим терапевтичним лікарським засобом. Гіперпроліферативні захворювання, які можна лікувати способами даного винаходу, включають, але не обмежуються цим, рак молочної залози, сечового міхура, кісток, мозку, центральної й периферичної нервової системи, товстого кишечнику, ендокринних залоз, стравоходу, ендометрію, статевих клітин, голови й шиї, нирок, печінки, легенів, гортані й гіпофарінкса, мезотеліому, саркому, яєчників, підшлункової залози, передміхурової залози, прямої кишки, тонкого кишечнику, м'яких тканин, яєчка, шлунка, шкіри, сечоводів, піхви й вульви; уроджений рак, ретінобластому й пухлину Вільмса; лейкемію, лімфому, неходжкинську хворобу, хронічний і гострий мієлоідний лейкоз, гострий лімфобластний лейкоз, хворобу Ходжкина, множинну мієлому й Т-клітинну лімфому, мієлодиспластичний синдром, неоплазію плазматичних клітин, паранеопластичні синдроми, рак невідомої первинної локалізації, рак резистентний до дії лікарських засобів, і зв'язані зі СНІДом злоякісні утворення і захворювання, які лікуються шляхом уведення ссавцям, які потребують такого лікування, антигіперпроліферативної або протипухлинної ефективної кількості сполуки формули I або її фармацевтично прийнятної солі. В одному варіанті винаходу, гіперпроліферативне захворювання є вибраним із групи, що складається з раку голови й шиї, недрібноклітинного раку легені, дрібноклітинного раку легені, резистентних типів раку легені й будь-яких типів раку в жінок, раку молочної залози, раку яєчників і раку товстого кишечнику. Цей винахід також відноситься до сполуки формули I як зазначено вище, або до її фармацевтично прийнятної солі за умови, що сполука не являється S(ціанометил)ізотіосечовини HСl, S-(ціанометил)ізотіосечовини HВr, S-(2-ціаноетил) ізотіосечовини HСl, S-(2-ціаноетил)ізотіосечовини HВr, S-(2-ціаноетил)ізотіосечовини pтолуолсульфонатом, S-(3-ціанопропіл)ізотіосечовини HСl, S-(3-ціанопропіл) ізотіосечовини пікратом, і S-пара-ціанобензилізотіосечовини HСl. В іншому варіанті цього винаходу, сполука також не являються гідробромідною сіллю S-(3-ціанопропіл) ізотіосечовини або S-параціанобензилізотіосечовини. В іншому варіанті цього винаходу, сполука не являється фармацевтично прийнятною сіллю S-(ціанометил)ізотіосечовини, S-(2-ціаноетил)ізотіосечовини, S-(3-ціанопропіл) ізотіосечовини, або S-пара-ціанобензилізотіосечовини. В іншому варіанті винаходу, сполука не являється вибраним з S-(ціанометил)ізотіосечовини, S-(2-ціаноетил)ізотіосечовини, S-(3ціанопропіл)ізотіосечовини й S-пара-ціанобензил-ізотіосечовини і їх фармацевтично прийнятних солей. Слід зазначити, що S-ціанометилізотіосечовину також називають карбамімідотіоєвої кислоти ціанометил ефіром; S-(2-ціаноетил)ізотіосечовину також називають карбамімідотіоєвої кислоти ціаноетил ефіром; S-(3-ціанопропіл)ізотіосечовину також називають карбамімідотіоєвої кислоти ціанопропіл ефіром; і S-пара-ціанобензилізотіосечовину також називають карбамімідотіоєвої кислоти (4-ціанофеніл)метил ефіром. В одному варіанті даного винаходу, сполука являється вибраним з S-(4ціанобутил)ізотіосечовини й S-(5-ціанопентил)ізотіосечовини і їх фармацевтично прийнятних солей. В іншому варіанті даного винаходу, сполука вибрана з S-(4ціанометилфеніл)метилізотіосечовини гідрохлориду, S-2(4-[2-ціаноетил] феніл)етилізотіосечовини мезілату, S-(2-ціанометилфеніл)метилізотіосечовини гідрохлориду, S(6-ціанометилпірідин-2-іл)метилізотіосечовини гідрохлориду, S-(3ціанометилфеніл)метилізотіосечовини гідрохлориду, S-(1-ціанометилнафт-2іл))метилізотіосечовини гідрохлориду або їх інших фармацевтично прийнятних солей. В іншому варіанті, сполука вибрана із сполук, отриманих, як описано у викладеному нижче Прикладі 11, або їх іншої фармацевтично прийнятної солі або їх вільної основи. Цей винахід також відноситься до способу одержання гідрохлоридної солі приєднання кислоти сполуки формули I, де Z являє собою утримуючу сірку реактивну тіосечовину або похідне тіосечовини з формулою 1 55 2 3 де R , R і R визначені вище для формули I з відповідним до похідних нітрилу формули NC(CH2)n-W-(CH2)mCl, де n, m, і W визначені вище для сполуки формули I, у воді або розчиннику вода/спирт або в полярному розчиннику, при температурі кипіння, щоб забезпечити одержання сполуки формули I, у якому Z є сіркою, і, при бажанні, готування вільної основи або іншої солі 9 UA 109879 C2 5 10 15 20 25 30 35 40 45 50 55 приєднання кислоти. В одному варіанті винаходу, розчинник вибраний зі спирту, вибраного з метанолу, етанолу, ізопропанолу й суміші одного або більш із вищезгаданих спиртів з водою. Цей винахід також відноситься до способу виготовлення гідрохлорідної солі приєднання кислоти сполуки формули I, де Z є вибраним з міді, срібла, золота, платини, а галогенутримуючі фрагменти вибрані з ClО2, BrО2 і IO2, що включають реактивну сполуку формули NC-(CH2)n-W(CH2)mCl, де n, m, і W є такими, як описано вище для сполуки формули I, із сіллю відповідних металів або галоген-утримуючого фрагмента для утворення проміжної сполуки, а потім реагування проміжної сполуки з тіосечовиною або похідним тіосечовини з формулою 1 2 3 де R , R і R визначені вище для формули I, щоб видати сполуку формули I, де Z є міддю, сріблом, золотом, платиною або галогенутримуючим фрагментом, вибраним з ClО 2, BrО2, і IO2, де утворення проміжної речовини й утворення солі приєднання кислоти проводиться у воді або розчиннику вода/спирт або в полярному розчиннику, при температурі кипіння, і, при бажанні, приготувати вільну основу або іншу сіль приєднання кислоти. В одному варіанті винаходу, розчинник вибраний зі спирту, вибраного з метанолу, етанолу, ізопропанолу й суміші одного або більше із вищезгаданих спиртів з водою. Даний винахід також відноситься до способу одержання гідробромідної солі приєднання кислоти сполуки формули I і мезілатної солі сполуки формули I. Гідробромідні солі приєднання кислоти готовлять шляхом заміщення бромутримуючого вихідного матеріалу в процесах, описаних вище. Мезілатні солі готовлять шляхом заміщення мезілату вихідного матеріалу в способах, описаних вище. Дисіль даного винаходу може бути виготовлена подібним чином з використанням солі в якості вихідного матеріалу. Утворення таких солей може бути можливим, якщо вільна основа має два базисних центри. Короткий опис креслень Фігура 1 демонструє залежність цитотоксичності Кеветріну від часу. Клітини карциноми людини зазнали впливу різних концентрацій Кеветріну на 5, 10, 20, 30, або 45 хвилин або 1, 2, 6, 24, або 120 годин. Клітинна життєздатність, виражена як IC 50, побудована залежно від часу експозиції Кеветріну, обмірюваного за допомогою MСT тесту. Фігура 2 демонструє спектри активності Кеветріну й цисплатіна. Вплив Кеветріну й цисплатіна на життєздатність зазначених пухлинних клітинних ліній вимірявся за допомогою МСТ тесту після безперервного впливу Кеветріну тричі протягом подвоєного часу. Зазначені значення розраховуються в такий спосіб: log (IC50 окрема клітинна лінія - IC50 середня). Негативні значення показують, що клітинна лінія є більш чутливою, у порівнянні із середнім показником, тоді як позитивні значення вказують, що клітинна лінія є більш резистентною, у порівнянні із середнім показником. Середні показники IC 50 для всіх тестируваних клітинних ліній -7 -6 склали 4,9 × 10 M для Кеветріну, і 2,1 × 10 M для цисплатіна. Фігура 3 демонструє зміни маси мишей у результаті впливу Кеветріну. Представлені маси тварин (мишей) після лікування Кеветріном у дозі 100 або 200 мг/кг внутрішньовенно на День 0. Фігура 4 демонструє ефективність Кеветріну або Таксола при карциномі молочної залози. Мишей, що переносять MDA-MB-231 карциному молочної залози людини, пролікованих Кеветріном у дозі 200 мг/кг ВВ на дні 7, 9, і 11 порівнювали з мишами, яких лікували Таксолом у дозі 22 мг/кг ВВ на Дні 7, 9, 11 і 13. Фігура 5 демонструє ефективність Кеветріну або 5-ФУ при карциномі товстого кишечнику. У голих мишей, що переносять пухлину HT-29, пролікованих або Кеветріном ВВ у дозі 200 мг/кг або 5-ФУ на Дні 7, 9, і 11. Фігура 6 демонструє ефективність Кеветріну або цисплатіна при раку передміхурової залози. У голих мишей, що переносять пухлину PC-3, пролікованих або Кеветріном ВВ у дозі 200 мг/кг на Дні 7, 9, і 11 або цисплатіном у дозі 10 мг/кг на День 7. Фігура 7 демонструє ефективність Кеветріну або Таксола при людській P-глікопротеїн опосередкованій резистентній карциномі товстого кишечнику. У голих мишей, що переносять пухлину HCT-15, пролікованих Кеветріном у дозі 200 мг/кг ВВ на Дні 7, 9, 11 або Таксолом у дозі 22 мг/кг на Дні 7, 9, 11 і 13 після закінчення лікування пухлини. Фігура 8 демонструє ефективність Кеветріну в дозі 200 мг/кг на Дні 7, 9 і 11 і в порівнянні з Таксолом у дозі 22 мг/кг на Дні 7, 9, 11 і 13 при A549 карциномі легенів людини із множинною лікарською стійкістю. 10 UA 109879 C2 5 10 15 20 25 30 35 40 45 50 55 Фігура 9 демонструє ефективність Кеветріну в дозі 200 мг/кг на дні 7, 9 і 11 і в порівнянні з Таксолом у дозі 22 мг/кг на Дні 7, 9, 11 і 13 при NCI-H1975 карциномі легенів людини із множинною лікарською стійкістю. Докладний опис винаходу Сполуки, використовувані в цьому винаході, у яких Z є сіркою, одержують при реакції тіосечовини з відповідним до похідних нітрилу формули NC-(CH2)n-W-(CH2)mCl, де n, m, і W визначені вище для сполуки формули I у воді. Рівні кількості тіосечовини й нітрилу додають в 10 кратний обсяг води або розчинника вода/спирт, або полярного розчинника, і нагрівають до кипіння протягом приблизно 4 годин при тиску навколишнього середовища. Необмежуючі приклади підходящих спиртів для підготовки суміші води й спирту або для використання в якості полярних розчинників включають метанол, етанол і ізопропанол. Випар реакційної суміші дає вихід необхідного продукту. Цей продукт очищають рекристалізацією з етанолу або іншого підходящого розчинника, наприклад, ізопропанолу або метанолу, або суміші одного з вищевказаних спиртів з ацетоном. Кристалічну речовину збирають за допомогою фільтрування й висушують у високому вакуумі. Сполука формули I, де Z є вибраною з міді, срібла, золота й платини або Z являється галоген утримуючим фрагментом, вибраним з ClО 2, BrО2, і IO2, виготовляють однаковим чином. Сполука формули I, де Y в W фрагменті являє собою сірку, кисень або азот, виготовляють, вибравши відповідне похідне нітрилу, у якому сірка, кисень або азот перебуває в потрібному положенні на кільці в W фрагменті. Будь-який фахівець у даній галузі техніки знає, як вибрати умови з розглянутих вище або внести в них зміни, щоб виготовити специфічні сполуки, що представляють інтерес. Залежно від захворювання й стану пацієнта, термін "лікування", використовуваний у даному документі, може включати один або кілька видів лікувальної, паліативної й профілактичної терапії. Активні сполуки можуть бути введені при лікуванні пацієнтів, разом з іонізучим випромінюванням або з одним або декількома іншими антигіперпроліферативними сполуками, такими, як циклофосфамід, цисплатін, карбоплатин, Таксол і Ербітукс, а також з іншими затвердженими антигіперпроліферативними сполуками, у комбінації або послідовно. Залежно від конкретного розладу й стану пацієнта, таке лікування може бути більш ефективним, ніж монотерапія сполукою або монотерапія іонізуючим випромінюванням. Точне дозування кожної активної сполуки, що вводиться для антигіперпроліферативного, протизапального, антибактеріального або противірусного застосування буде змінюватися залежно від ряду факторів, включаючи, але не обмежуючись цим, тип пацієнта й тип стану захворювання, що підлягають лікуванню, віку пацієнта, і шляху (шляхів) уведення. Для введення пацієнтам-людям, загальна добова доза активних сполук, як очікується, буде перебувати в діапазоні від 1 мг до 300 мг на кг маси тіла, залежно від способу введення. Наприклад, необхідна загальна добова доза для перорального введення може становити від 100 мг до 300 мг на кг маси тіла, у той час як необхідна доза для внутрішньовенного введення може становити тільки від 20 мг до 200 мг на кг маси тіла. Загальна добова доза може бути введена у вигляді єдиної дози або дробових доз. Для середнього суб'єкта людини, що має масу тіла приблизно 70 кг, дозування буде становити приблизно від 1400 мг до 21000 мг для перорального введення й приблизно від 140 мг до 1400 мг для внутрішньовенного введення. Лікар легко зможе визначити дози для таких пацієнтів, як діти й люди похилого віку, вага яких виходить за межі цього діапазону. Ветеринар зможе легко визначити дози для інших ссавців. В одному варіанті, винахід включає внутрішньовенне введення розчину або суспензії, що містить 200 мг активної сполуки на кг маси тіла. Для вищезгаданих терапевтичних застосувань, дози для введення будуть, звичайно, мінятися залежно від використовуваної сполуки, способу введення, необхідного лікування й зазначеного розладу. Загальна добова доза може бути введена у вигляді єдиної дози або дробових доз. Даний винахід також включає композиції з уповільненим (пролонгованим) вивільненням. Фармацевтична композиція може, наприклад, бути у формі, що підходить для перорального введення, наприклад у вигляді таблеток, капсул, пігулок, порошків, рецептур з уповільненим вивільненням, у формі розчину, суспензії для парентерального введення у вигляді стерильного розчину, суспензії або емульсії, у формі для місцевого застосування у вигляді мазі або крему, або у формі для ректального введення у вигляді свіч. Фармацевтична композиція може бути у формі стандартного порціонного дозування, що підходить для однократного введення точних доз. Фармацевтична композиція буде включати звичайний фармацевтичний носій або наповнювач і активну сполуку. Крім того, вона може містити в собі інші лікарські або фармацевтичні агенти, носії, допоміжні речовини і т.д. 11 UA 109879 C2 5 10 15 20 25 30 35 40 45 50 55 60 Типові форми для парентерального введення включають розчини або суспензії активних сполук у стерильних водяних розчинах, наприклад, у розчинах водного пропіленгліколю або декстрози. Такі лікарські форми, якщо це необхідно, можуть бути підходящим чином буферизовані. Підходящі фармацевтичні носії включають інертні розріджувачі або наповнювачі, воду й різні органічні розчинники. Фармацевтичні композиції можуть, якщо потрібно, містити додаткові інгредієнти, такі як ароматизатори, зв'язувальні речовини, наповнювачі і їм подібні. Таким чином, таблетки для перорального введення, що містять різні наповнювачі, такі як лимонна кислота, можуть бути використані разом з різними агентами, що викликають дезінтеграцію, такими як крохмаль, альгінова кислота й певні складні силікати, і зі зв'язувальними речовинами, такими як сахароза, желатин і гумміарабік. Крім того, мастильні речовини, такі як стеарат магнію, лаурилсульфат натрію й тальк часто використовуються для цілей таблетування. Тверді композиції подібного типу можуть бути також використані в м'яких і твердих заповнених желатинових капсулах. Придатні компоненти цих композицій включають лактозу або молочний цукор, а також поліетиленгліколі з високою молекулярною масою. Якщо водні суспензії або еліксири призначені для перорального введення, активна сполука в них може сполучатися з різними підсолоджуючими або ароматичними речовинами, барвними речовинами або барвниками й, при бажанні, емульгуючими або суспендуючими речовинами, разом з розріджувачами, такими як вода, етанол, пропіленгліколь, гліцерин, або їх комбінації. Способи одержання різних фармацевтичних композицій з певною кількістю активної речовини являються відомими, або повинні бути очевидними для фахівців у даній галузі техніки. Наприклад, дивіться Remington's Pharmaceutical Sciences, Mack Publishing Company, Easter, Pa., 15th Edition (1975). Діапазони доз, викладені в цьому документі, являються тільки приблизними й не призначені для обмеження обсягу або здійснення формули винаходу. Наприклад, дози можуть бути скоректовані на основі фармакокінетичних або фармакодинамічних параметрів, які можуть включати клінічні ефекти, такі як токсичний ефект і/або дані лабораторних досліджень. Таким чином, даний винахід містить у собі ескалацію дози в організмі пацієнта, як це визначене фахівцями в даній галузі. Визначення відповідних доз і схем уведення хіміотерапевтичних лікарських засобів добре відомо в даній галузі техніки й фахівцеві, за умови вивчення розкритого тут здійснення, буде зрозуміло, що воно охоплює. Фармацевтична композиція винаходу може бути приготовлена, упакована, або продана як нерозфасований лікарський засіб, як одиниця дози для однократного введення, або як безліч одиниць доз для однократного введення. Як використовується тут, "одиниця дози" є дискретною кількістю фармацевтичної композиції, що містить певну кількість активної сполуки. Кількість активної сполуки, як правило, дорівнює дозі активної речовини, яка буде вводитися суб'єктові, або зручній частці такої дози, такої як, наприклад, половина або одна третина такої дози. Відносна кількість активної речовини, фармацевтично прийнятного носія й будь-яких додаткових інгредієнтів у фармацевтичній композиції винаходу буде змінюватися залежно від особливості, розміру й стану суб'єкта, підданого лікуванню, і далі залежно від шляху введення композиції. Як приклад, композиція може містити від 0,1 % до 100 % (по масі) активного інгредієнта. На додаток до активної сполуки, фармацевтична композиція винаходу може додатково містити одне або декілька додаткових терапевтично ефективних сполук, як описано вище. Як використовується тут, "парентеральне введення" фармацевтичної композиції включає будь-який шлях введення, що характеризується фізичним порушенням цілісності тканини суб'єкта й введення фармацевтичної композиції через отвір у тканині. Парентеральне введення, таким чином, включає, але не обмежуючись цим, введення фармацевтичної композиції у вигляді ін'єкції композиції, аплікації композиції через хірургічний розріз, аплікації композиції через проникаючу через тканину нехірургічну рану, і т.п. Таким чином, активні речовини можна вводити прямо в кров'яне русло, у м'язи, або у внутрішній орган. Підходящі способи парентерального введення включають внутрішньовенний, внутрішньоартеріальний, внутрішньочеревинний, інтратекальний, внутрішньожелудочковий, інтрауретральний, інтрастернальний, внутрішньочерепний, внутрішньом'язовий і підшкірний, і за допомогою ниркового діалізу способи вливання. Підходящі обладнання для такого парентерального введення включають голкові (у тому числі мікроголки), інжектори (шприци), безголкові інжектори й апарати для інфузії. Парентеральні лікарські засоби являються, як правило, водяними розчинами, які можуть містити наповнювачі, такі як солі, вуглеводи й агенти, що буферизують (бажано, зі значеннями рН у діапазоні від 3 до 9), але, для деяких способів застосування, вони можуть бути виготовлені 12 UA 109879 C2 5 10 15 20 25 30 35 40 45 50 55 більш відповідніше, як стерильний безводний розчин або як висушена форма, які будуть використовуватися в комбінації з підходящим носієм, таким як стерильна, апірогенна вода. Підготовка парентерального лікарського засобу в стерильних умовах, наприклад, шляхом ліофілізації, може бути легко виконана за допомогою стандартних фармацевтичних способів, добре відомих фахівцям у даній галузі техніки. Рецептури фармацевтичних композицій для парентерального введення включають активний інгредієнт у комбінації з фармацевтично прийнятним носієм, таким як, наприклад, стерильна вода або стерильний ізотонічний розчин хлориду натрію. Такі композиції можуть бути приготовлені, упаковані, або продані у формі, придатної для болюсного введення або для тривалого введення. Ін'єкційні лікарські засоби можуть бути приготовлені, упаковані, або продані у вигляді одиниці дози, наприклад, в ампулах або в багатодозових контейнерах, що містять консерванти. Препарати для парентерального введення включають, але не обмежуючись цим, суспензії, розчини, емульсії в масляних або водних носіях, пасти, і лікарські засоби, що імплантують, пролонгованого вивільнення або препарати, що біорозкладають, як описано нижче. Такі композиції можуть додатково містити один або кілька додаткових інгредієнтів, включаючи, але не обмежуючись цим, агенти, що суспендують, стабілізують, диспергують. В одному варіанті лікарського засобу для парентерального введення, активний інгредієнт утримується в сухій формі (наприклад, у вигляді порошку або гранул) для відновлення в підходящому транспортному засобі (наприклад, стерильній апірогенній воді) до парентерального введення відновленої композиції. Фармацевтичні композиції можуть бути приготовлені, упаковані, або продані у формі стерильної ін'єкційної водної або масляної суспензії або розчину. Ця суспензія або розчин може бути виготовлена відповідно до існуючої галузі техніки, і може включати, крім активного інгредієнта, додаткові інгредієнти, такі як диспергатори, зволожувачі, або агенти, що суспендують, описані в цьому документі. Такі стерильні ін'єкційні препарати можуть бути отримані з використанням нетоксичного, прийнятного для парентерального введення розріджувача або розчинника, наприклад, такого як вода або 1,3 бутандіол. Інші прийнятні розріджувачі й розчинники включають, але не обмежуючись цим, розчин Рінгера, ізотонічний розчин хлориду натрію, і жирні масла, такі як синтетичні моно- або дигліцериди. Інші корисні лікарські засоби, придатні для парентерального введення, включають ті, які містять активний інгредієнт у мікрокристалічній формі, у ліпосомальному препараті, або в якості компонента системи полімерів, що біорозкладають. Композиції для вповільненого вивільнення або імплантації можуть містити фармацевтично прийнятні полімерні або гідрофобні матеріали, такі як емульсії, смоли іонного обміну, важкорозчинний полімер, або важкорозчинну сіль. Активні сполуки являються інгібіторами клітинної гіперпроліферації або є специфічними регуляторами клітинного циклу й індукторами апоптоза в ракових клітинах, або тим і іншим. Тому, ці сполуки придатні для лікування гіперпроліферативних захворювань і розладів, таких як рак, і придатні для лікування захворювань і розладів, які являються сприйнятливими до індукції апоптозу, як, наприклад, рак. Маючи специфічний механізм дії відносно клітинного циклу, ці сполуки повинні мати більш високий терапевтичний індекс у порівнянні зі стандартними хіміотерапевтичними лікарськими засобами, націленими на основні клітинні процеси, такі як реплікація ДНК або інтерферування з основними клітинними молекулами, такими як ДНК. Так, наприклад, активні сполуки, які обговорювалися вище, як очікується, будуть застосовані в цільовій терапії раку. Активні сполуки також можуть бути ефективними проти ангіогенезу. У контексті даного винаходу, термін "гіперпроліферація" і аналогічні терміни використовуються для опису аберрантного або дизрегуляційного, або аберрантного й дизрегуляційного клітинного росту, відмітної риси таких захворювань, як рак. Термін "інгібування клітинної проліферації" і аналогічні терміни використовуються тут для позначення здатності сполуки сповільнювати ріст і/або вбивати клітку, що контактує з даною сполукою у порівнянні із клітинами, що не контактують із даною сполукою. Найбільше переважно, якщо це інгібування проліферації клітин становить 100 %, що означає, що проліферація всіх клітин зупиняється, і/або клітини зазнають запрограмованої загибелі клітин. У деяких варіантах клітина, що контактує, являється неопластичною клітиною. Неопластична клітина визначається як клітина з аберрантною клітинною проліферацією. Доброякісне новоутворення характеризується гіперпроліферацією клітин, нездатних до формування агресивної пухлини, що метастазує invivo. На відміну від цього, злоякісне новоутворення характеризується клітинами з різними клітинними й біохімічними порушеннями, наприклад, здатними утворювати метастази пухлини. Придбані функціональні порушення злоякісних неопластичних клітин (також визначених як "критерії раку") являють собою реплікативний потенціал ("гіперпроліферацію"), самодостатність 13 UA 109879 C2 5 10 15 20 25 30 35 40 45 50 55 60 сигналів росту, нечутливість до сигналів анти-росту, відхилення від апоптозу, стійкий ангіогенез і тканинна інвазія, і метастази. Термін "індуктор апоптозу" і аналогічні терміни використовуються тут для ідентифікації сполуки, яке здійснює запрограмовану загибель клітин, що контактують із зазначеною сполукою. Апоптоз визначається складними біохімічними подіями усередині контактуючих клітин, такими, як, наприклад, активація цистеін специфічних протеїназ ("каспаз") і фрагментація хроматину. Індукція апоптозу в клітинах, які контактують із сполукою, може бути не обов'язково пов'язана з інгібуванням проліферації клітин. Переважно, інгібування проліферації клітин і/або індукція апоптозу являються специфічними для клітин з аберрантним клітинним ростом (гіперпроліферацією). Таким чином, у порівнянні із клітинами з аберрантним клітинним ростом, клітини, що нормально проліферують або пригноблені клітини менш чутливі або навіть нечутливі до активності сполуки, що інгібує проліферацію, або що індукує апоптоз. Нарешті, цитотоксичні засоби використовуються в більш загальному змісті для ідентифікації сполук, які вбивають клітини за допомогою різних механізмів, включаючи індукцію апоптозу/запрограмовану загибель клітин залежним від клітинного циклу або незалежним від клітинного циклу чином. Термін "специфічний для клітинного циклу" і аналогічні терміни використовуються тут для ідентифікації сполуки, що індукує апоптоз тільки в клітинах, що постійно проліферують, які активно проходять специфічну фазу клітинного циклу, але, що не перебувають у стані спокою клітин, що не діляться. Клітини, що постійно проліферують являються типовими для таких захворювань, як рак і характеризуються клітинами у всіх фазах циклу ділення клітин, а саме у фазах G1 ("проміжна"), S ("синтез ДНК"), G2 і M ("мітоз"). AKT (також відомий як протеїнкіназа В (PKB)), і продукція її сімейства генів, була визначена як серін/треонін протеїнкіназа. Testa et al., Proc. Natl. Acad. Sci., 2001, 98, 10983-10985; Lawlor et al., J. Cell Sci., 2001, 114, 2903-2910; Duan, Circ. Res., 2000, 86, 15-23. PKB відіграє важливу роль у клітинній проліферації, апоптозі й реакції на інсулін. Відповідно, модуляція PKB становить інтерес у лікуванні онкогенезу, порушенні клітинної проліферації й діабету. У контексті цього винаходу, термін "гіперпроліферація" і аналогічні терміни використовуються для опису аберрантного/дизрегуляційного клітинного росту, що є відмінною рисою таких захворювань, як рак. Аналіз PKB Аналіз кінази для оцінки активності PKB включає дослідження активних PKB ферментів, 33 PPKB специфічного субстрату й P -міченого АТФ. Використовують дві форми PKBα ферментів, PKBα повної довжини й домен кінази PKBα з вилученим плекстрін доменом (амінокислоти 1117). Обидва PKB фермента доступні від Upstate Cell Signaling Solutions (номера по каталогу 14-276 і 14-341). Використовуваний субстрат PKB являє собою синтетичний пептид (ARKRERTYSFGHHA), як описано в роботі Obata et al., J. Biol. Chem. 2000, 275, 36108-36115. Фосфорильований субстрат захоплюється фосфоцелюлозним мембранним фільтрувальним планшетом (Millipore) і виміряється за допомогою рідкого сцинтиляційного лічильника Wallac Microbeta (Perkin Elmer). Активність PKB у клітинах досліджують в PTEN нульової клітинної лінії пухлини молочної залози людини MDA-MB-468. Статус фосфорилювання PKB субстрату FKHRL1, GSK3a/b, і Туберин вимірюють за допомогою імунологічних аналізів, що використовують фосфорноспецифічні антитіла (технологія клітинної сигналізації). Вплив інгібування PKB на життєздатність клітин вимірюють у ряді пухлинних клітинних ліній людини, включаючи, але не обмежуючись цим, MDA-MB-468, MDA-MB-231, U87-MG, LN-229, PC-3, DU145. Клітини піддають обробці в стандартному живильному середовищі на протязі 72 годин і вимірюють життєздатність клітин за допомогою апарата Alamar Blue (Biosource, UK). Наступні не обмежуючі приклади ілюструють готування активних сполук. 1 H спектри ядерного магнітного резонансу (ЯМР, Меркурій-300) були сумісні із запропонованими структурами. Характеристика хімічних зрушень (δ) наведена в частинах за мільйон по напрямкові від тетраметилсілану з використанням загальноприйнятих скорочень для позначення основних піків, наприклад: s - сінглет; d - дублет; t - триплет; q - квартет; m мультиплет; br - широкий. Мас-спектри (m/z) були записані на мас-спектрометр моделі 1100 компанії Agilent з використанням або іонізації електророзпиленням (ESI), або хімічної іонізації при атмосферному тиску (APCI). Наступні скорочення використовують для звичайних розчинників: CDCl3 дейтерохлороформ; D6-DMSO дейтеродиметилсульфоксид; CD3OD дейтерометанол. Приклад 1 S-(3-ціанопропіл)ізотіосечовини гідрохлорид (також відомий як Кеветрін) 14 UA 109879 C2 Мол. Маса: 103,55 5 10 15 20 25 30 Мол. Маса: 76,12 Мол. Маса: 179,67 Змішують γ- хлорбутиронітрил (5,0 г, 48,3 ммоль) і тіосечовину (4,04 г, 53,1 ммоль) в 40 мл води. Суміш нагрівають до кипіння протягом від 3 до 4 годин. Реакційну суміш випарюють і додають 20 мл етанолу, а потім також випарюють. Цю процедуру повторюють тричі. Після чого додають 10 мл метанолу й 30 мл ацетону й перемішують суміш протягом однієї години. Кристалічний матеріал фільтрують, і продукт висушують при високому вакуумі протягом ночі з одержанням 5,44 г (30,3 ммоль, вихід 62,7 %) продукту у вигляді білих кристалів, крапка 1 плавлення 134-135 °C, із чистотою більше ніж 97 %. H ЯМР (300 МГц, d6DMSO) δ 1,89 (m, 2 H), 2,63 (t, 2H, J=7,2 Гц), 3,23 (t, 2H, J=7,2 Гц), 3,38 (s, 3H). 13 C ЯМР (75 МГц) δ 15,3, 25,0, 28,8, 119,8, 169,7. Формула: C5H10ClN3S Точна маса: 179,03 Молекулярна маса: 179,67 m/e: 179,03 (100,0 %), 181,03 (32,1 %), 180,03 (7,4 %), 181,02 (4,5 %), 182,03 (2,0 %), 183,02 (1,5 %). C, 33,42; H, 5,61; Cl, 19,73; N, 23,39; S, 17,85 Анал. роз.: 33,42 5,61 23,39 17,85 Знайдене: 33,44 5,48 23,40 18,31 Приклад 2 S-(2-ціаноетил)ізотіосечовини гідрохлорид Змішують 3-хлорпропаннітрил (4,32 г, 48,3 ммоль) і тіосечовину (4,04 г, 53,1 ммоль) в 40 мл води. Суміш нагрівають до кипіння протягом від 3 до 4 годин. Реакційну суміш випарюють і додають 20 мл етанолу, а потім також випарюють. Цю процедуру повторюють тричі. Після чого додають 10 мл метанолу й 30 мл ацетону й перемішують суміш протягом однієї години. Кристалічний матеріал фільтрують і продукт висушують при високому вакуумі протягом ночі щоб одержати S-(2-ціаноетил)ізотіосечовини гідрохлорид. Приклад 3 S-(4-ціанобутил)ізотіосечовини гідро хлорид 35 40 Змішують 5-хлорпентаннітрил (5,68 г, 48,3 ммоль) і тіосечовину (4,04 г, 53,1 ммоль) в 40 мл води. Суміш нагрівають до кипіння протягом від 3 до 4 годин. Реакційну суміш випарюють і додають 20 мл етанолу, а потім також випарюють. Цю процедуру повторюють тричі. Після чого додають 10 мл метанолу й 30 мл ацетону й перемішують суміш протягом однієї години. Кристалічний матеріал фільтрують і продукт висушують при високому вакуумі протягом ночі з одержанням S-(4-ціанобутил)ізотіосечовини гідрохлориду. Приклад 4 15 UA 109879 C2 S-(5-ціанопентил)ізотіосечовини гідрохлорид 5 10 Змішують 6-хлоргексаннітрил (6,36 г, 48,3 ммоль) і тіосечовину (4,04 г, 53,1 ммоль) в 40 мл води. Суміш нагрівають до кипіння протягом від 3 до 4 годин. Реакційну суміш випарюють і додають 20 мл етанолу, а потім також випарюють. Цю процедуру повторюють тричі. Після чого додають 10 мл метанолу й 30 мл ацетону й перемішують суміш протягом однієї години. Кристалічний матеріал фільтрують і продукт висушують при високому вакуумі протягом ночі з одержанням S-(5-ціанопентил)ізотіосечовини гідрохлориду. Приклад 5 S-(4-ціанометилфенил)метилізотіосечовина гідрохлорид 15 20 25 30 35 40 Змішують 4-хлорметилфенілацетонітрил (200 мг, 1,21 ммоль) і тіосечовину (101 мг, 1,33 ммоль) в 1 мл метанолу. Суміш нагрівають до кипіння протягом від 3 до 4 годин. Реакційну суміш випарюють. Після чого додають 1 мл метанолу й 4 мл ацетону, і суміш перемішують протягом однієї години. Кристалічний матеріал фільтрують, і продукт висушують при високому вакуумі протягом ночі з одержанням 219 мг (0,91 ммоль, вихід 75 %) продукту у вигляді білих з 1 жовтуватим або сіруватим відтінком кристалів, із чистотою більше ніж 95 %. H ЯМР (300 МГц, d6-DMSO) δ 4,03 (s, 2 H), 4,50 (s, 2H), 7,35 (d, 2H, J=8,23 Гц), 7,45 (d, 2H, J=8,23 Гц), 9,22 (s, 4H). (M+H) 206,00 Формула: C10H12ClN3S Точна маса: 241,04 (205,07) Молекулярна маса: 241,74 m/e: 241,04 (100,0 %), 243,04 (36,6 %), 242,05 (11,0 %), 244,04 (4,6 %), 242,04 (1,9 %), 245,04 (1,5 %) Приклад 6 S-2(4-[2-ціаноетил]феніл)етилізотіосечовини мезілат Змішують мезілат (200 мг, 0,79 ммоль) і тіосечовину (66 мг, 0,87 ммоль) в 1 мл метанолу. Суміш нагрівають до кипіння протягом від 3 до 4 годин. Реакційну суміш випарюють. Після чого додають 1 мл метанолу й 4 мл ацетону, і суміш перемішують протягом однієї години. Кристалічний матеріал фільтрують, і продукт висушують при високому вакуумі протягом ночі з одержанням 203 мг (0,62 ммоль, вихід 78 %) продукту у вигляді білих з жовтуватим або 1 сіруватим відтінком кристалів, із чистотою більше ніж 95 %. H ЯМР (300 МГц, d6-DMSO) δ 2,35 (s, 3H), 2,80 (m, 2H), 2,85 (m, 2H), 2,91 (t, 2H, J=7,4), 3,42 (t, 3H, J=7,4), 7,24 (s, 4H), 9,04 (s, 4H), (M+H) 234,07 Формула: C13H19N3O3S2 16 UA 109879 C2 5 10 15 20 Точна маса: 329,09 (233,10) Молекулярна маса: 329,44 m/e: 329,09 (100,0 %), 330,09 (16,0 %), 331,08 (9,1 %), 331,09 (1,9 %), 332,09 (1,4 %), 330,08 (1,1 %) Приклад 7 S-(2-ціанометилфеніл)метилізотіосечовини гідрохлорид Змішують 2-хлорметилфенілацетонітрил (200 мг, 1,21 ммоль) і тіосечовину (101 мг, 1,33 ммоль) в 1 мл метанолу. Суміш нагрівають до кипіння протягом від 3 до 4 годин. Реакційну суміш випарюють. Після чого додають 1 мл метанолу й 4 мл ацетону, і суміш перемішують протягом однієї години. Кристалічний матеріал фільтрують, і продукт висушують при високому вакуумі протягом ночі з одержанням 231 мг (0.95 ммоль, вихід 79 %) продукту у вигляді білих з 1 жовтуватим або сіруватим відтінком кристалів, із чистотою більше ніж 95 %. H ЯМР (300 МГц, d6-DMSO) δ 4,14 (s, 2H), 4,56 (s, 2H), 7,37 (m, 2H), 7,45 (m, 2H), 9,23 (s, 4H). (M+H) 205,97 Формула: C10H12ClN3S Точна маса: 241,04 (205,07) Молекулярна маса: 241,74 m/e: 241,04 (100,0 %), 243,04 (36,6 %), 242,05 (11,0 %), 244,04 (4,6 %), 242,04 (1,9 %), 245,04 (1,5 %) Приклад 8 S-(6-ціанометилпірідин 2-іл)метилізотіосечовини гідрохлорид 25 30 35 40 Змішують 6-хлорметил-2-пірідилацетонітрил (200 мг, 1.20 ммоль) і тіосечовину (101 мг, 1,32 ммоль) в 1 мл метанолу. Суміш нагрівають до кипіння протягом від 3 до 4 годин. Реакційну суміш випарюють. Після чого, додають 1 мл метанолу й 4 мл ацетону, і перемішують суміш протягом однієї години. Кристалічний матеріал фільтрують, і продукт висушують при високому вакуумі протягом ночі з одержанням 216 мг (0.89 ммоль, вихід 74 %) продукту у вигляді білих з 1 жовтуватим або сіруватим відтінком кристалів, із чистотою більше ніж 95 %. H ЯМР (300 МГц, d6-DMSO) δ 4,29 (s, 2H), 4,64 (s, 2H), 7,41 (d, 1H, J=7,78), 7,51 (d, 1H, J=7,78), 7,91 (t, 1H, J=7,78), 9,46 (s, 4H). (M+H) 207,00 Формула: C9H11ClN4S Точна маса: 242,04 (206,06) Молекулярна маса: 242,73 m/e: 242,04 (100,0 %), 244,04 (36,7 %), 243,04 (12,0 %), 245,04 (3,9 %), 246,03 (1,5 %) Приклад 9 S-(3-ціанометилфеніл)метилізотіосечовини гідрохлорид 17 UA 109879 C2 5 10 15 20 25 30 35 Змішують 3-бромметилфенілацетонітрил (200 мг, 0,95 ммоль) і тіосечовину (80 мг, 1,05 ммоль) в 1 мл метанолу. Суміш нагрівають до кипіння протягом від 3 до 4 годин. Реакційну суміш випарюють. Після чого додають 1 мл метанолу й 4 мл ацетону, і перемішують суміш протягом однієї години. Кристалічний матеріал фільтрують, і продукт висушують при високому вакуумі протягом ночі з одержанням 215 мг (0,75 ммоль, вихід 79 %) продукту у вигляді білих з 1 жовтуватим або сіруватим відтінком кристалів, із чистотою більше ніж 95 %. H ЯМР (300 МГц d6-DMSO), δ 4,08 (s, 2H), 4,53 (s, 2H), 7,31 (m, 2H), 7,40 (m, 2H), 9,25 (s, 4H). (M+H) 206,00 Формула: C10H12BrN3S Точна маса: 284,99 (205,07) Молекулярна маса: 286,19 m/e: 286,99 (100,0 %), 284,99 (98,1 %), 287,99 (12,7 %), 286,00 (10,7 %), 288,99 (4,5 %), 285,99 (1,9 %) Приклад 10 S-(1-ціанометилнафт 2-іл))метилізотіосечовини гідрохлорид Змішують 2-бромометил-1-нафтилацетонітрил (200 мг, 0,77 ммоль) і тіосечовину (64 мг, 0,85 ммоль) в 1 мл метанолу. Суміш нагрівають до кипіння протягом від 3 до 4 годин. Реакційну суміш випарюють. Після чого додають 1 мл метанолу й 4 мл ацетону й перемішують суміш протягом однієї години. Кристалічний матеріал фільтрують, і продукт висушують при високому вакуумі протягом ночі з одержанням 215 мг (0,64 ммоль, вихід 83 %) продукту у вигляді білих з 1 жовтуватим або сіруватим відтінком кристалів, із чистотою більше ніж 95 %. H ЯМР (300 МГц, d6-DMSO) δ 4,57 (s, 2H), 4,83 (s, 2H), 7,63 (m, 2H), 7,72 (m, 1H), 8,05 (m, 2H), 8,2 (d, 1H, J=8,24), 9,1 (s, 2H), 9,28 (s, 2H). (M+H) 256,00. Формула: C14H14BrN3S Точна маса: 335,01 (255,08) Молекулярна маса: 336,25 m/e: 335,01 (100,0 %), 337,01 (97,6 %), 336,01 (17,1 %), 338,01 (16,4 %), 337,00 (4,5 %), 339,00 (4,4 %), 339,01 (1,4 %), 338,00 (1,1 %), 337,02 (1,1 %) Приклад 11 Зображення нижче демонструє хімічні реакції одержання сполук винаходу. Як видно, ці сполуки можуть бути отримані шляхом, аналогічним такому, як у Прикладі 1 шляхом взаємодії відповідних похідних нітрилу з тіосечовиною. Тіосечовина може бути замінена похідними, де один, два або три із чотирьох заступників на атомах азоту, є атомами, відмінними від водню, щоб надати інші сполуки формули I. 18 UA 109879 C2 19 UA 109879 C2 20 UA 109879 C2 21 UA 109879 C2 22 UA 109879 C2 5 10 У реакціях, зображених у цьому Прикладі, n і m дорівнюють нулю або самостійним цілим 1 2 3 4 числам від 1 до 8 і R , R , R , і R можуть бути, наприклад, фрагментами метилу, етилу, nпропілу, ізопропілу, циклопропілу, -СН2-циклопропілу, вінілу, аллілу, n-бутилу, вторбутилу, ізобутилу, трет-бутилу, циклобутилу, -СН2-циклобутилу, n -пентилу, втор-пентилу, ізопентилу, трет-пентилу, циклопентилу, -CH2-циклопентилу, n-гексилу, вторгексилу, циклогексилу, -CH21 2 3 4 циклогексила й т.п., які знов-таки, можуть мати один або кілька заступників. R , R , R , і R також можуть бути алкенілом і алкінілом. Алкенілові групи включають, для прикладу, але не 23 UA 109879 C2 5 10 15 20 25 30 35 40 45 50 55 обмежуючись цим, етеніл, пропеніл, бутеніл, 1-метил-2-бутен-1-іл, і їм подібні. Типові представники алкинілових груп включають, але не обмежуючись цим, етиніл, 2-пропиніл (пропаргіл), і 1-пропиніл. Гідрохлоридні солі, отримані, як описано вище, можуть бути перетворені у відповідні вільні основи або в інші фармацевтично прийнятні солі за допомогою відомих способів. Інші фармацевтично прийнятні солі можуть бути також отримані шляхом заміщення відповідного вихідного матеріалу (наприклад, бромутримуючого нітрилу, а не хлорутримуючого нітрилу) для нітрилу в кожній з вищезгаданих реакцій. Приклад 12 - Вивчення ефективності Кеветріну Хімічні речовини, клітини й живильні середовища Кеветрін синтезують як описано в Прикладі 1. Цисплатін, вінкристин, 5-ФУ й Таксол закуповують у компанії Sigma Scientific. H460 і H522 клітини карциноми легенів; HT-29, SW-620, і Colo 205, і HCT-15 клітини карциноми товстого кишечнику; OvСar-3, і SKOv-3 клітини карциноми яєчників; DU-145 і PC-3 клітини карциноми передміхурової залози; а також SNB-19 і U-251 клітини гліоми, HT-1080 клітини фібросаркоми й SW-480 клітини карциноми товстого кишечнику закуповують в американській колекції типових культур (American Type Culture Collection (ATCC) (Rockville, MD)). A2780 клітини карциноми яєчників і їх цисплатін-резистентні варіанти A2780/CP1 і A2780/CP2 роблять і характеризують власними силами. Клітини карциноми товстого кишечнику HCT-116 товстого кишечнику і їх p53 -/- і p21 -/- сублінії були люб'язно надані доктором Gangadharan із Центрального науково-дослідного інституту, Салем, штат Огайо, у той час як HCT-116 клітини, доповнені хромосомою 3 були отримані із Центру по дослідженню раку імені Раджива Ганді (Рохіні, Делі, Індія). Якщо не зазначене інше, живильне середовище й інші реагенти закуповують у компанії Becton Dickinson. Базальне культуральне середовище (РПМІ-1640) виробництва Bio Whittaker стерилізують через 0,22 мкм Millex-GV фільтрувальну установку (Millipore). Готове середовище зберігають у маленьких аліквотах при температурі 5 °C у темряві. Базальне живильне середовище для культур збагачують додаванням 10 % ембріональної телячої сироватки (ЕТС-інактивується нагріванням при температурі 56 °C протягом 30 хвилин), для використання в якості живильного середовища й мітогена, тобто, ліпополісахарид (ЛПС; 10-50 мкг/мл), додають для проліферації клітин. Аналізи інгібування росту Цитотоксичність визначають за допомогою аналізу максимально стерпного титру (МСТ). Коротко, клітини висівають в 24-ямковий планшет культури тканин із щільністю 10000-15000 клітин/лунка й інкубують протягом ночі. Експоненціально зростаючі клітини потім піддають впливу різних концентрацій лікарських засобів від трьох до чотирьох раз за час життя покоління. Клітинну життєздатність визначають, піддаючи клітини впливу MСT солі тетразолія протягом 4 годин при температурі 37 °C, а утворення формазану вимірюють за допомогою мікропланшетного читача при довжині хвилі 560 нм. Концентрацію, що інгібує ріст клітин на 50 % у порівнянні з неопрацьованим контролем визначають по кривим графіка виживання залежно від дози. Усі значення в середньому являються результатом не менш трьох незалежних експериментів, кожний з яких виконаний дублетом. Аналіз клітинної проліферації MСT розчин (10 мкл) додають в усі лунки з лімфоцитами культивованими протягом 48 годин і інкубують протягом 4 годин при температурі 37 °C. Наготовлюють два набори культур; ЛПС додають тільки до одному набору. Протягом цього періоду на дні кожної лунки утворюються кристали формазану. Відпрацьовані живильні середовища поряд із суспензією культивованих клітин видаляють за допомогою піпетки. Потім в усі лунки додають підкислений ізопропанол (100 мкл 0,1 N HСl у безводному ізопропанолі), ретельно перемішуючи, щоб розчинити темносині кристали. Через кілька хвилин при кімнатній температурі, планшети читають за допомогою планшетного аналізатора з подвійною системою виміру довжини хвилі: тестова довжина хвилі 540 нм, еталонна довжина хвилі 630 нм. Планшети читають протягом 1 години додавання підкисленого ізопропанолу. Проліферацію клітин розраховують як індекс стимуляції. А 540 нм з ЛПС Індекс стимуляції = А 540 нм без ЛПС Де A 540 = оптична щільність при довжині хвилі 540 нм. Імунолокалізація p53 Для визначення локалізації р53, білка, який викликає проліферацію клітин, проводять імуноцитохімічне дослідження. Коротко, HCT-116 клітини (АТСС) прикріплюють на предметні стекла протягом ночі й піддають впливу ізотоксичної концентрації Кеветріну (300 нг/мл), або цисплатіна (11 мкг/мл) протягом 6 годин. Після впливу лікарських засобів, клітини фіксують 3,7 % формальдегідом, пермеабілізують 0,25 % Triton X-100, і блокують 1 % БСА (бичим 24 UA 109879 C2 5 10 15 20 25 сироватковим альбуміном). Потім клітини інкубують протягом 1 години з анти-р53 поліклональними антитілами (Sc-6243; Santa Cruz Biotechnology, California) а потім вторинними анти-кролячими ФІТЦ-кон’югованими антитілами (Amersham Life Sciences, U.K.). Покривні стекла встановлюють у середовищі Vectashield (Vector Laboratories Vector, U.K.) і аналізують за допомогою епіфлюоресцентного мікроскопа Axiovert 100M, оснащеного відповідними фільтрами й лазерною конфокальною системою LSM 510, що сканує, використовуючи плановий апохроматичний об'єктив x63 (Zeiss). Вестерн-блот аналіз Виконують Вестерн-блот аналіз. Цільний лізат клітин готовлять із клітин, оброблених ізотоксичними концентраціями Кеветріну (300 нг/мл) або цисплатіна (11 мкг/мл) протягом 6 годин. Білки (50 мкг/доріжка) розділяють в 4-12 % поліакриламіднім гелі додецилсульфату натрію й переносять на мембрани PolyScreen (Millipore, Bedford, MA). Присутність р53, р21, і бета-актину виявляють за допомогою анти-р53 антитіл (Sc-6243; Santa Cruz Biotechnology), анти-р21 антитіл (Sc-3976; Santa Cruz Biotechnology) і анти-актинових антитіл (Sc-1616, Santa Cruz Biotechnology), відповідно, з наступною інкубацією з кон`югованими з пероксидазою вторинними антитілами (Jackson Immunoresearch, West Grove, PA) і виявленням посиленої хемілюмінесценції (New England Nuclear, Hebron, CT). Вплив Кеветріну на життєздатність пухлинних клітинних ліній людини. Вплив Кеветріну на життєздатність 10 різних типів пухлинних клітин людини, включаючи клітини карциноми легенів, товстого кишечнику, молочної залози, яєчників, передміхурової залози, саркоми, гліоми, і лейкемії, визначають із використанням аналізу клітинної проліферації, описаного вище. Клітинну життєздатність вимірюють після безперервного впливу Кеветріну протягом тричі подвоєного часу. Зазначені концентрації Кеветріну відповідають середнім значенням IC50. Результати представлені нижче. Як правило, Кеветрін має потужну активність відносно пухлинних клітин людини епітеліального походження. Цитотоксичний ефект Кеветріну був найбільш вираженим відносно недрібноклітинного раку легені, карциноми товстої кишки і яєчників з IC50 у межах від 11 нг/мл до 68 нг/мл. Цікаво, що Кеветрін також продемонстрував високу активність відносно злоякісних клітин гліоми (IC50 ~30 нг/мл). Цитотоксичність Кеветріну у відношенні 10 різних пухлинних клітинних ліній людини 30 Клітинний тип карцинома товстого кишечнику плоскоклітинний рак карцинома товстого кишечнику карцинома товстого кишечнику карцинома передміхурової залози карцинома яєчників карцинома товстого кишечнику карцинома передміхурової залози плоскоклітинний рак карцинома молочної залози 35 40 45 Клітинна лінія Colo 205 SCC 15 HCT-116 HT-29 LnСap SKOV-3 SW-480 DU-145 SCC-61 MCF-7 IC50 концентрація 6 мкг/мл 12 мкг/мл 21 мкг/мл 29 мкг/мл 52 мкг/мл 58 мкг/мл 62 мкг/мл 64 мкг/мл 64 мкг/мл 68 мкг/мл Залежність цитотоксичності Кеветріну від часу Для визначення впливу часу експозиції на цитотоксичні ефекти Кеветріну, DU-145, HCT-116, або HT-29 клітини карциноми піддають впливу різних концентрацій Кеветріну протягом 5, 10, 20, 30 або 45 хвилин, або 1, 2, 6, 24, або 120 годин. Чітко залежні від часу цитотоксичні ефекти Кеветріну спостерігають у всіх трьох клітинних лініях з більш тривалим часом експозиції, що є пов'язаними з підвищеною цитотоксичністю. Результати показано на Фігурі 1. Тимчасова залежність була особливо істотною для часу експозиції ≤ 30-45 хвилин. На противагу цьому, продовження часу впливу лікарського засобу більш 24 годин не впливає на цитотоксичність. Спектри активності Кеветріну й Цисплатіна Вплив Кеветріну та цисплатіна на життєздатність зазначених ліній пухлинних клітин вимірюють за допомогою аналізу MСT після безперервного впливу Кеветріну протягом тричі подвоєного часу, результати вимірів представлено на Фігурі 2. Указані значення розраховують у такий спосіб: log (IC50 окремої лінії клітин - IC50 середня). Негативні значення показують, що клітинна лінія є більш чутливою, у порівнянні із середнім показником, тоді як позитивні значення вказують, що клітинна лінія є більш резистентною, у порівнянні із середнім показником. Середні -7 -6 показники IC50 для всіх тестованих клітинних ліній склали 4,9 × 10 M для Кеветріну, і 2,1 × 10 M для цисплатіна. Враховуючи результати аналізу MСT, порівняння спектрів активності цисплатіна й Кеветріну у відношенні 10 різних типів пухлинних клітин людини на Фігурі 2 25 UA 109879 C2 5 10 15 20 25 30 35 40 45 50 55 60 демонструє чіткі відмінності між цими двома лікарськими засобами. Активність Кеветріну була більш вираженою, у порівнянні із цисплатіном, відносно ліній клітин легенів, голови й шиї, молочної залози, яєчників, товстого кишечнику. Цікаво, що Кеветрін продемонстрував активність у відношенні всіх тестованих клітинних ліній голови й шиї, недрібноклітинного раку легені, яєчників, товстої кишки й гліоми в порівнянні із цисплатіном, який звичайно проявляє більш неоднорідну відповідь у межах даного типу пухлинних клітин. Різниця між Кеветріном і цисплатіном була особливо видатною у відношенні трьох клітинних ліній раку голови й шиї, де Кеветрін продемонстрував активність у відношенні всіх клітинних ліній, у той час як цисплатін був активний стосовно одній із трьох ліній клітин. Дивно, але Кеветрін мав порівняно обмежену активність відносно лейкемії, чутливої до алкілуючих агентів у відмінності від результатів, отриманих при спостереженні за цисплатіном. Дослідження ефективності Кеветріну в голих мишей із ксенотрансплантатами пухлини людини in vivo Тварини й догляд за тваринами Утримання мишей відбувається при циклі 12 годин світла й 12 годин темряви, при кімнатній температурі рівної 18-26 °C і відносної вологості повітря 30-70 %. Їжу й воду тваринам дають досхочу. Протягом періоду акліматизації, кожна тварина спостерігається, щонайменше, один раз у день на наявність яких-небудь відхилень або відносно розвитку інфекційних захворювань. Тільки тварин, які визнані придатними для використання, визначають до участі в данім дослідженні. Будь-яких тварин, які вважаються неприйнятними для використання в данім дослідженні, заміняють на тварин того ж віку й ваги від того ж виробника. При досягненні 3 пухлинної маси, у середньому, близько 100 мм , мишей рандомізують і групують відповідно до розміру пухлини. Пухлинні клітинні лінії людини MDA-MB-231 карциноми молочної залози людини (HTB-26), HT-29 карциноми товстого кишечнику (HTB-38), PC-3 карциноми передміхурової залози (CRL-1435), HCT-15 P-глікопротеїн стійкої карциноми товстого кишечнику закуповують в Американської колекції типових культур (Rockville, MD). Клітинна лінія MDA-MB-231 була спочатку ізольована із плевральної рідини 51-літньої жінки європеоїдної раси з аденокарциномою молочної залози. Ці клітини, очевидно, являються по природі морфологічно епітеліальними. Клітинна лінія HT-29 була спочатку ізольована в 1964 році від 44- літньої жінки європеоїдної раси з колоректальною аденокарциномою. Ці клітини, очевидно, є по природі морфологічно епітеліальними. Клітинна лінія PC-3 була спочатку ізольована з кісткових метастазів від 62-літнього чоловіка європеоїдної раси з метастазуючою аденокарциномою передміхурової залози IV стадії. Ці клітини демонструють низьку активність кислої фосфатази й тестостерон-5-альфа-редуктази, і, очевидно, є по природі морфологічно епітеліальними. Батьківська Клітинна лінія HCT-15 була спочатку ізольована від чоловіка з колоректальною аденокарциномою типу C по Дюке. Ці клітини, очевидно, є по природі морфологічно епітеліальними. Лінії A549 і NCI-H1975 карциноми легенів людини із множинною лікарською стійкістю були подаровані інститутом раку Дани Фарбер, Boston, MA. Тестова система Клітини культивують в 10 % ЕТС РПМІ живильному середовищі Клітини одержують при пасажі 5 для подальшого збільшення для зазначеного вивчення ефективності. Голих мишей (Nu/Nu), як самців (від 20 г до 24 г), так і самок (від 19 г до 22 г), закуповують у віці від 6 до 8 тижнів в Charles River Laboratories. Такі миші є незараженими на початку дослідження й ідентифіковані за допомогою перфорації вуха. Мишей залишають на п'ять днів, щоб вони акліматизувалися в новій обстановці. Мишам імплантують клітини пухлини людини в 50:50 суміші РПМІ:Матригель підшкірно в правий бочок кожної миші. Уведення лікарського засобу 3 починають, коли пухлина досягає середнього обсягу 100 мм . Прижиттєві спостереження й виміри Мишей спостерігають щодня на наявність будь-яких побічних ефектів. Маси тіла мишей вимірюють до початку лікування й через день, під час і після лікування. Якщо тварина стала нездоровою, припиняють яке-небудь лікування цієї тварини. Якщо видужання не відбувається, тварину вбивають. Будь-яка тварина, що демонструє втрату ваги більш ніж на 15 %, уважається нездоровою. Будь-яку тварину, що демонструє втрату ваги більш ніж на 20 %, убивають. Будьяку тварину, що демонструє тривалу виразку шкіри над місцем розташування пухлини вбивають. Виміри розмірів пухлини мишей роблять до початку лікування, і через день під час і 26 UA 109879 C2 5 10 15 20 25 30 35 40 45 50 55 після лікування. Один і той же самий учений являється відповідальним за виміри пухлини протягом усього дослідження. Термінальні процедури 3 Як тільки пухлина в групі носіїв досягає 1000 мм , усіх тварин із усіх груп вбивають за допомогою асфіксії СО2 газом. Після вмертвіння тварин, пухлини видаляють і зважують. Режим дослідження 6 Голим мишам імплантують 5 × 10 пухлинних клітин у суміші 50:50 РПМІ: Матригель підшкірно в правий бочок кожної миші. Уведення лікарського засобу починають, коли пухлина 3 досягає середнього обсягу 100 мм , як правило, цей обсяг досягається к 14-му дню після імплантації, і введення лікарського засобу здійснюють протягом 8 днів. Розтин проводять через 41 день після закінчення лікування. Матеріали Кеветрін виготовляють як описано в Прикладі 1. Його зберігають при температурі навколишнього середовища (або ≤-20 °C) у захищеному від світла місці. Для введення піддослідним тваринам, Кеветрін суспендують у фосфатно-сольовому буфері (ФСБ) (стерильний, з рівнем рН = 7,4). Перед використанням ФСБ зберігають при температурі навколишнього середовища. Після приготування кожної суспензії, його зберігають при температурі ≤-20 °C і в захищеному від світла місці. Дозування Процедуру дозування починають у той день, коли мишей рандомізують і групують. Дозу вводять, як описано в наступному параграфі, у Дні, 7, 9 і 11 після імплантації пухлини. Кожну дозу вводять через хвостову вену. Втрата маси тіла у зв'язку із введенням Кеветріну Коли Кеветрін уводять внутрішньовенно (ВВ) тваринам, що переносять пухлини, втрата маси тіла у зв'язку із уведенням сполуки перебуває в припустимих межах. Введення лікарського засобу в дозі 100 мг/кг внутрішньовенно в Дні, 7, 9, 11 приводить до втрати маси тіла, що становить 6,8 % від маси тіла, а в дозі 200 мг/кг по тій же схемі приводить до втрати маси тіла 9,3 %. Обидві ці концентрації можуть бути використані для встановлення ефективності Кеветріну. Зазначені результати представлено на Фігурі 3. Ефективність ВВ введення Кеветріну в дозі 200 мг/кг у Дні 7, 9 і 11 у порівнянні із ВВ уведенням Таксола в дозі 22 мг/кг у Дні 7, 9, 11 і 13 при MDA-MB-231 карциномі молочної залози людини Тваринам підшкірно імплантують карциному молочної залози людини MDA-MB-231, і сполуки вводять ВВ у відповідності зі схемою лікування. Тварини, яким уводили Кеветрін, продемонстрували більшу ефективність, ніж тварини проліковані Таксолом. Ріст пухлини був затриманий на 12 днів більше, ніж у тварин, яких лікували Таксолом і на 32 дні більше, ніж у контрольної групи, що не зазнала лікування. Результати представлено на Фігурі 4. Ефективність ВВ введення Кеветріну в дозі 200 мг/кг у Дні 7, 9 і 11 у порівнянні із введенням 5-ФУ в Дні з 7 по 12 при HT-29 карциномі товстого кишечнику. Тваринам підшкірно імплантують карциному товстого кишечника людини HT-29, і сполуки вводять ВВ у відповідності зі схемою лікування. Тварини, яким уводили Кеветрін, продемонстрували більшу ефективність, ніж тварини проліковані 5-ФУ. Ріст пухлини був затриманий на 10 днів більше, ніж у тварин, яких лікували 5-ФУ, і на 33 дні більше, ніж у контрольної групи, що не зазнала лікування. Результати представлено на Фігурі 5. Ефективність ВВ введення Кеветріну в дозі 200 мг/кг у Дні 7, 9 і 11 у порівнянні із введенням цисплатіна в дозі 10 мг/кг на День 7 при PC-3 раці передміхурової залози людини. Тваринам підшкірно імплантують карциному передміхурової залози людини PC-3. Кеветрін вводять ВВ, а Цисплатін інтраперитонеально (ІП) у відповідності зі схемою лікування. Тварини, яким уводили Кеветрін, продемонстрували більшу ефективність, ніж тварини, проліковані Цисплатіном. Ріст пухлини був затриманий на 8 днів більше, ніж у тварин, яких лікували Цисплатіном, і на 34 дня більше, ніж у контрольної групи, що не зазнала лікування. Результати представлено на Фігурі 6. Ефективність ВВ введення Кеветріну в дозі 200 мг/кг у Дні 7, 9 і 11 у порівнянні із уведенням Таксола в дозі 22 мг/кг у Дні 7, 9, 11 і 13 при HCT-15 карциномі товстого кишечнику людини з Pглікопротеїн опосередкованою резистентністю. Тваринам підшкірно імплантують карциному товстого кишечника людини HCT-15, із клітинною моделлю P- глікопротеїн опосередкованої резистентності й сполуки вводять ВВ у відповідності зі схемою лікування. Таксол мало впливає на такий вид раку, тоді як тварини, яким уводили Кеветрін, продемонстрували ефективність у тварин. Ріст пухлини був затриманий на 15 27 UA 109879 C2 5 10 15 20 25 днів більше, ніж у тварин, яких лікували Таксолом, і ніж в контрольної групи, що не зазнала лікування. Результати представлено на Фігурі 7. Ефективність ВВ введення Кеветріну в дозі 200 мг/кг у Дні 7, 9 і 11 у порівнянні із введенням Таксола в дозі 22 мг/кг у Дні 7, 9, 11 і 13 при A549 раці легенів людини із множинною лікарською стійкістю. Тваринам підшкірно імплантують рак легенів людини із множинною лікарською стійкістю й сполуки вводять ВВ у відповідності зі схемою лікування. Таксол мало впливає на такий вид раку, тоді як тварини, яким вводили Кеветрін, продемонстрували потужну ефективність у тварин. Ріст пухлини був затриманий приблизно на 26 днів більше, ніж у контрольної групи, що не зазнала лікування. Результати представлено на Фігурі 8. Ефективність ВВ введення Кеветріну в дозі 200 мг/кг у Дні 7, 9 і 11 у порівнянні із уведенням Таксола в дозі 22 мг/кг у Дні 7, 9, 11 і 13 при NCI-H1975 раці легенів людини із множинною лікарською стійкістю. Тваринам підшкірно імплантують інший вид раку легенів людини із множинною лікарською стійкістю й сполуки вводять ВВ у відповідності зі схемою лікування. Таксол мало впливає на такий вид раку, тоді як тварини, яким вводили Кеветрін, продемонстрували потужну ефективність у тварин. Ріст пухлини був затриманий приблизно на 9 днів більше, ніж у тварин, яких лікували Таксолом, і приблизно на 24 дня більше, ніж у контрольної групи, що не зазнала лікування. Результати представлено на Фігурі 9. Кожна із усіх публікацій, включаючи, але не обмежуючись цим, книги й журнальні статті, наведені в даній заявці, включена в даний документ як посилання у всій своїй повноті. Хоча винахід був описаний вище з посиланням на розкриті варіанти, фахівці в даній галузі техніки легко зрозуміють, що конкретні детальні експерименти є тільки ілюстративними для винаходу. Слід розуміти, що різні модифікації можуть бути виконані без відхилення від сутності винаходу. Таким чином, винахід обмежується тільки наступною формулою. ФОРМУЛА ВИНАХОДУ 30 1. Застосування сполуки формули І або її фармацевтично прийнятної солі, наприклад гідрохлориду або гідроброміду, N-R1 NC-(CH2)n-W-(CH2)m-Z-C N-R2 R 35 40 45 3 ,I де Z є сіркою, де n дорівнює нулю або цілому числу від 1 до 8 і m дорівнює нулю або цілому числу від 1 до 8; 1 2 3 R , R і R є незалежно вибраними з водню та С1-С6алкілу, де алкільні фрагменти можуть бути лінійними, розгалуженими й циклічними та комбінаціями лінійних, розгалужених й циклічних; W відсутній або W є вибраним з -СН2-, -СН2-СН2-, транс-СН=СН-, цис-СН=СН-, -СС-, або W являє собою дизаміщений фрагмент, у якому термін "дизаміщений" використовується, щоб показати як W приєднується до груп (СН2)m і (СН2)n, вибраних із групи дизаміщених фрагментів, що складаються із (а) 1,2-, 1,3- або 1,4-дизаміщеного шестичленного кільця, яке може бути насиченим або ненасиченим з одним, двома або трьома подвійними зв'язками; як показує наступна формула, де замісники на зазначених дизаміщених кільцях являють собою групи, приєднані до W у формулі І , де штрихові лінії вказують на необов'язкові подвійні зв'язки; для приготування композиції для лікування гіперпроліферативних захворювань, запальних захворювань, вірусних інфекцій або бактеріальних інфекцій. 2. Застосування за п. 1, де сполука формули І є сполукою формули II 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNitrile derivatives and their use for pharmaceutical purposes and in compositions
Автори англійськоюMenon, Krishna, Aruda Wayne O.
Назва патенту російськоюПроизводные нитрила, их применение в фармацевтических целях и в композиции
Автори російськоюМенон Кришна, Аруда Уэйн О.
МПК / Мітки
МПК: C07C 335/00, A61P 35/00, A61K 31/275, A61K 31/277
Мітки: композиції, похідні, цілях, нітрилу, фармацевтичних, застосування
Код посилання
<a href="https://ua.patents.su/42-109879-pokhidni-nitrilu-kh-zastosuvannya-u-farmacevtichnikh-cilyakh-i-v-kompozici.html" target="_blank" rel="follow" title="База патентів України">Похідні нітрилу, їх застосування у фармацевтичних цілях і в композиції</a>