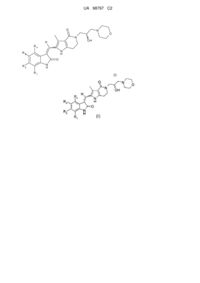
2-(2-оксоіндолін-3-іліден)метил-5-(2-гідрокси-3-морфолін-4-ілпропіл)-6,7-дигідро-1н-пірол[3,2-с]піридин-4(5н)-они і їх застосування як інгібіторів протеїнкінази
Номер патенту: 98797
Опубліковано: 25.06.2012
Автори: Танг Пенг Чо, Су Їдонг, Жао Фуквянг, Янг Джялянг
Формула / Реферат
1. Похідні піролоконденсованого шестичленного азагетероциклілгідроксиморфоліну формули (І) або їх фармацевтично прийнятні солі:
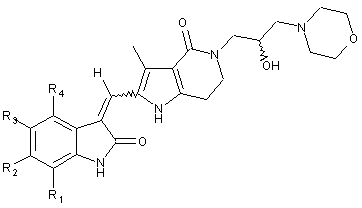 , (I)
, (I)
де:
R1, R2, R3, R4 кожен незалежно вибирають з групи, що містить водень, галоген, алкіл, арил, гетероарил, -OR5, -O[CH2CH2O]rR7, -NR5R6, -COR5 і -NR5COR6, де згаданий арил або гетероарил може бути додатково заміщеним однією або більше групами, що вибирають з групи, яка містить алкіл, алкоксил і галоген;
R5 і R6 кожен незалежно вибирають з групи, що містить водень і алкіл, де згаданий алкіл може бути додатково заміщеним однією або більше групами, що вибирають з групи, яка містить арил, гетероарил, галоарил, гідрокси, алкоксил, арилоксил, карбонову кислоту і естер карбонової кислоти;
R7 є водень або алкіл; і
r є цілим числом від 1 до 6.
2. Похідні піролоконденсованого шестичленного азагетероциклілгідроксиморфоліну або їх фармацевтично прийнятні солі за пунктом 1, де згаданими сполуками є:
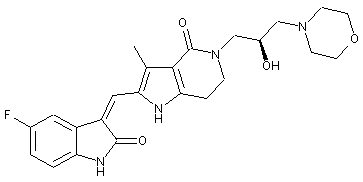 ,
,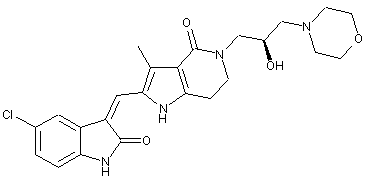 ,
,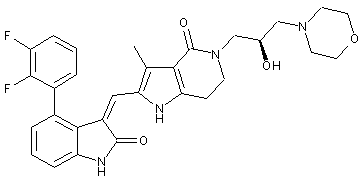 ,
,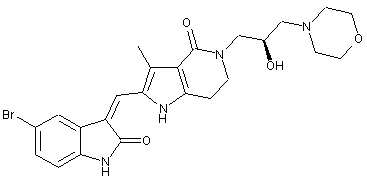 ,
,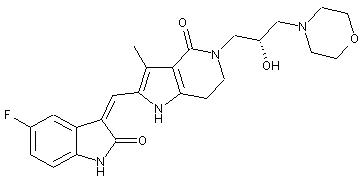 ,
,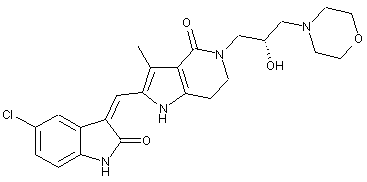 ,
,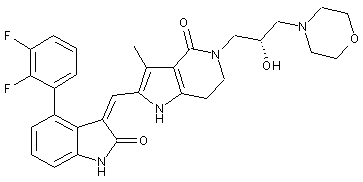 ,
,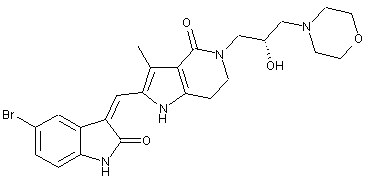 ,
,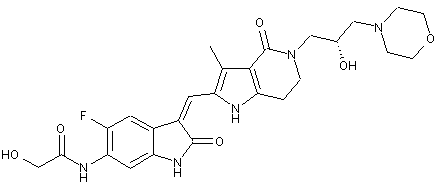 ,
,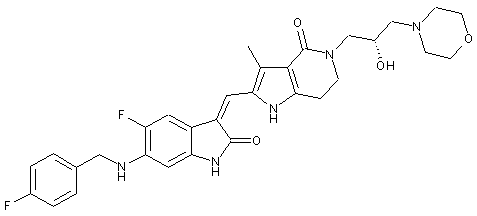 ,
,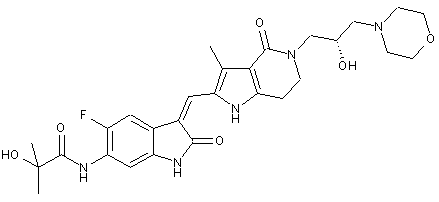 ,
,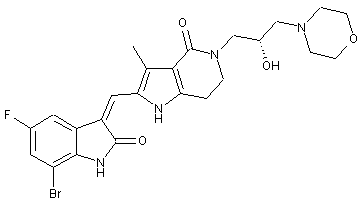 ,
,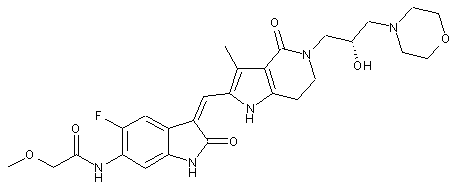 ,
,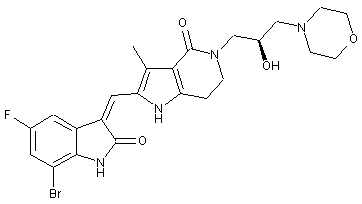 ,
,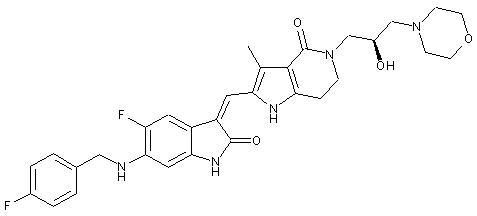 ,
,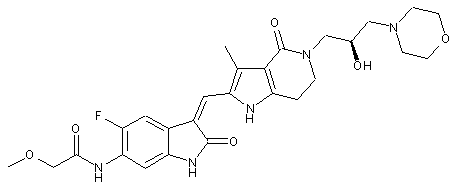 ,
,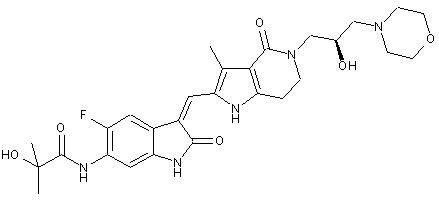 ,
,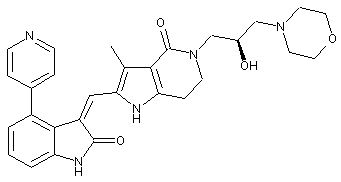 ,
,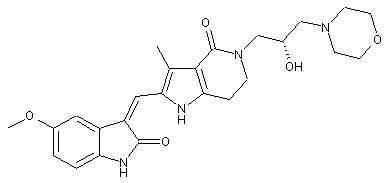 ,
,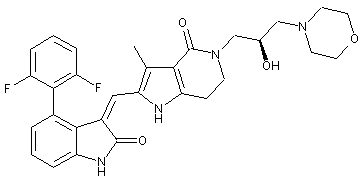 ,
,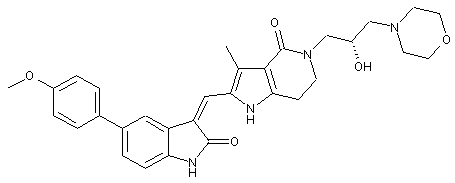 ,
,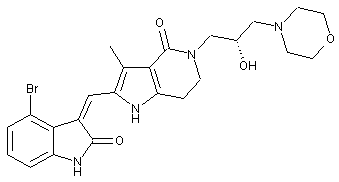 ,
, ,
, .
.
3. Похідні піролоконденсованого шестичленного азагетероциклілгідроксиморфоліну або їх фармацевтично прийнятні солі за пунктом 1, де згаданими фармацевтично прийнятними солями є солі, утворені із згаданими сполуками і кислотами, що вибирають з групи, що містить яблучну кислоту, молочну кислоту, малеїнову кислоту, хлорводневу кислоту, метансульфонову кислоту, сірчану кислоту, фосфорну кислоту, лимонну кислоту, винну кислоту, оцтову кислоту і трифтороцтову кислоту.
4. Похідні піролоконденсованого шестичленного азагетероциклілгідроксиморфоліну або їх фармацевтично прийнятні солі за пунктом 4, де згаданими кислотами є яблучна кислота або малеїнова кислота.
5. Фармацевтична композиція, що містить похідні піролоконденсованого шестичленного азагетероциклілгідроксиморфоліну або їх фармацевтично прийнятні солі за будь-яким з пунктів 1 або 2 в ефективній терапевтичній дозі і фармацевтично прийнятний носій.
6. Спосіб одержання похідних піролоконденсованого шестичленного азагетероциклілгідроксиморфоліну або їх фармацевтично прийнятних солей за пунктом 1, при якому здійснюють:
нагрівання оптично активного 1-аміно-3-морфолін-4-ілпропан-2-олу (Іа) з 5-карбоксиметил-3-метил-1Н-пірол-2,4-дикарбонової кислоти 2-трет-бутиловим естером 4-етиловим естером в ацетонітрилі, в атмосфері азоту, в присутності 1-гідроксибензотриазолу і N-етил-N'-(диметиламінопропіл)карбодііміду з одержанням хірального діестеру піроламіддикарбонової кислоти (Іb)
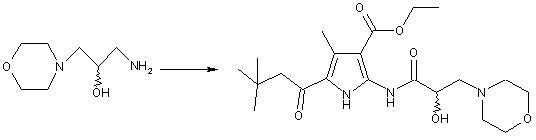 ;
;
(Ia)
(Ib)
нагрівання хірального діестеру піроламіддикарбонової кислоти (Іb) з хлорводневою кислотою із зворотнім холодильником в етанолі, в атмосфері аргону, з одержанням оптично активного етилового естеру піроламіду (Іс)
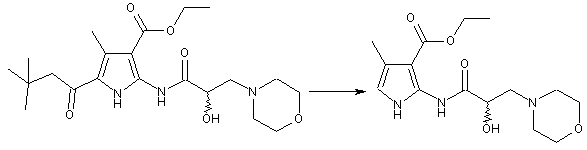 ;
;
(Ib)
(Ic)
подальше нагрівання оптично активного етилового естеру піроламіду (Іс) з бораном, для селективного відновлення, із зворотнім холодильником в безводному тетрагідрофурані з одержанням хірального заміщеного етилового естеру піролу (Id)
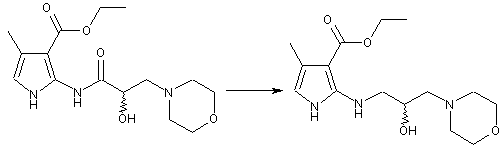 ;
;
(Ic)
(Id)
потім, нагрівання хірального заміщеного етилового естеру піролу (Id) з моногідратом гідроксиду літію із зворотнім холодильником в атмосфері аргону в гліколі з одержанням циклізованого продукту - оптично активного піролоконденсованого шестичленного азагетероциклу (Іе)
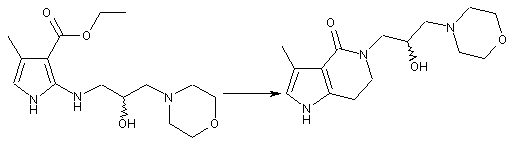 ;
;
(Id)
(Ie)
взаємодію оптично активного піролоконденсованого шестичленного азагетероциклу (Іе) з оксихлоридом фосфору і N,N-диметилформамідом в безводному дихлорметані при кімнатній температурі, за умов реакції формілування, з одержанням оптично активного піролоконденсованого шестичленного азагетероциклформальдегіду (If)
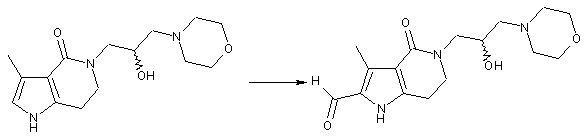 ;
;
(Ie)
(If)
нагрівання оптично активного піролоконденсованого шестичленного азагетероциклоформальдегіду (If) з різними індолінонами в присутності основи, такої як триетиламін або піперидин, протягом 2-12 годин з одержанням цільового продукту -похідних хірального піролоконденсованого шестичленного азагетероциклілгідроксиморфоліну формули (І)
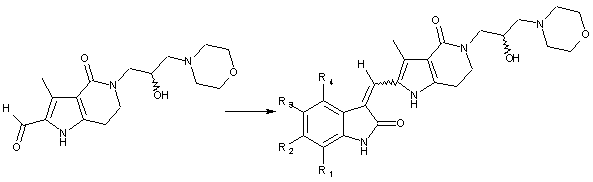 .
.
(If)
(I)
7. Спосіб модулювання каталітичної активності протеїнкінази, в якому здійснюють контактування згаданої протеїнкінази із згаданими похідними піролоконденсованого шестичленного азагетероциклілгідроксиморфоліну або їх фармацевтично прийнятними солями за будь-яким з пунктів 1-5.
8. Спосіб за пунктом 7, де згадані протеїнкінази вибирають з групи, що містить рецепторні тирозинкінази (RTK), нерецепторні протеїнтирозинкінази (СТK) і серин/треонінпротеїнкінази (STK).
9. Застосування сполук за пунктом 1, при одержанні медикаменту для лікування розладів, залежних від протеїнкіназ.
10. Застосування за пунктом 9, де згадані розлади, залежні від протеїнкінази, вибирають з розладів, залежних від VEGFR-2, EGFR, HER-2, HER-3, HER-4, PDGFR, c-Kit, c-Met, FGFR і FIt3.
11. Спосіб модулювання каталітичної активності протеїнкінази, в якому піддають контактуванню згадану протеїнкіназу із згаданою фармацевтичною композицією за пунктом 5.
Текст
Реферат: Описуються піроло[3,2-с]піридин-4-он-2-індолінони, переважно 2-(2-оксоіндолін-3-іліден)метил5-(2-гідрокси-3-морфолін-4-ілпропіл)-6,7-дигідро-1Н-пірол[3,2-с]піридин-4(5Н)-они, їх одержання, фармацевтична композиція і фармацевтичне застосування як інгібіторів протеїнкінази. UA 98797 C2 (12) UA 98797 C2 O N O N OH H R4 N H R3 O N H R2 R1 (I) UA 98797 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід стосується ряду нових похідних піролоконденсованого шестичленного азагетероциклогідроксиморфоліну, особливо нових похідних 2-(2-оксоіндолін-3-іліден)метил-5-(2гідрокси-3-морфолін-4-іл-пропіл)-6,7-дигідро-1Н-пірол[3,2-с]піридин-4(5Н)-ону, їх одержання, фармацевтичних композицій, що містять такі похідні і застосування таких похідних як терапевтичних агентів, особливо, як інгібіторів протеїнкінази. Передача клітинного сигналу є фундаментальним механізмом, до допомогою якого зовнішньоклітинна стимуляція передається до клітин і в подальшому регулює різноманіття клітинних процесів. Ці сигнали регулюють широкий перелік фізичних відповідей в клітині включаючи проліферацію, диференціацію, апоптоз і рухливість. Зовнішньоклітинні сигнали приймають форму різних видів розчинних факторів включаючи фактори росту, також як паракринні, аутокринні і ендокринні фактори. При зв'язуванні із специфічними трансмембранними рецепторами, ліганди фактора росту передають зовнішньоклітинні сигнали до внутрішньоклітинних сигнальних шляхів, викликаючи таким чином в окремій клітині відповіді на зовнішньоклітинні сигнали. Багато з цих процесів передачі сигналу використовують зворотний спосіб фосфорилювання протеїнів, в який втягнуті специфічні протеїнкінази і фосфатази. Протеїнкінази (РК) відіграють критичну роль в процесі передачі сигналу. Вони переносять гама-фосфатну групу від АТФ до певного амінокислотного залишку у функціональному протеїні, що призводить до ряду біологічних відповідей. Протеїнкінази розподіляються на дві групи, за амінокислотною специфічністю до субстрату в процесі фосфорилювання: серин/треонінкінази (STK) і протеїнтирозинкінази (РТК). Механізм фосфорилювання тирозину широко представлений в процесі передачі сигналу і контролює декілька функцій клітини, таких як мітоз, розвиток клітинного циклу і диференціація і т.і. (Hanks and Hunter, 1995, FASEB J. 9:576-596; Cadena and Gill, 1992, FASEB J. 6:2332-2337; Schlessinger and Ullrich, 1992, Neuron 9:383-391; Vandergeer et al., 1994, Annu. Rev. Cell Biol. 10:251-337). Було показано, що мутація, неконтрольоване або ненормально високий рівень експресії протеїнтирозинкіназ приводить до перетворення нормальної клітини на клітину неопластичного фенотипу (Chiao et al., 1994, Cancer Metast. Rev. 9:63-80; Hunter, 1991, Cell 64:249-270). Фактор росту васкулярного ендотелію (VEGF) ідентифікований як неспецифічний фактор росту, що діє на васкулярні ендотеліальні клітини, і має різні функції, такі як стимулювання проліферації ендотеліальних клітин, підвищує мікроваскулярну проникність і індукує ангіогенез (Hanks and Hunter, 1995, FASEB J. 9:576-596). VEGF відомий як найбільш ефективний і безпосередньо діючий ангіогенний протеїн. Він є здатним до дифузії специфічним до ендотеліальних клітин міогеном і васкулярним фактором росту (Ferrara N et al., EndocrRev, 1997, 18, 4-25; Tofimura T et al., Hum Pharthol, 1998, 29, 986-991). Відома на сьогодні родина VEGF включає шість відомих членів: VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF-E і плацентарний фактор росту (PDF), всі з яких утворюють химерний глікопротеїн. Всі члени родини VEGF містять характеристичні регулярно розташовані восьми-цистеїнові залишки, що згадуються як "цистеїновий вузол". Li Ling et al. (Li Ling et al., Acta Biochimica et Biophysica Sinica, 2002, 34(1), 21-27) показали високу експресію VEGF в злоякісних клітинах пухлин, також як і високу експресію Flk-1, які втягнуті в існування і аутокринної, паракринної VEGF петель з межах пухлини. Експресія VEGF чітко корелюється з внутрішньо-пухлинною мікросудинною щільністю і концентрація VEGF в тканинах корелюється з прогнозуванням солідних пухлин, таких як рак молочної залози, рак легені, рак простати і рак товстої кишки. Відомо, що гіпоксія відіграє критичну роль в стимулюванні експресії VEGF. На додаток до підвищення швидкості транскрипції гену, гіпоксія індукує експресію гену VEGF в клітинах пухлини також сприяючи стабілізації мРНК VEGF. Було ідентифіковано три різні члени, що належать до родини VEGFR: VEGFR-1/Flt-1, VEGFR-2/FIk-1/KDR і VEGFR-4/Flt-4. VEGFR-1 і VEGFR-2 належать до клітинноповерхневих рецепторів тирозинкіназ, чия експресія в основному обмежена ендотеліальними клітинами судин пухлини. Фактора росту васкулярного ендотелію (VEGF) і рецептор фактора росту васкулярного ендотелію (VEGFR) відіграють важливу роль в процесі ангіогенезу і визнаються як важлива ціль для протиракової біотерапії. Було розроблено п'ять стратегій націлювання VEGF і VEGFR для протипухлинної терапії, а саме: 1. Генна терапія (Ellis LM et al. J Biol Chem 1998, 273, 1052-1057): VEGF і VEGFR втягнутий в позитивне регулювання ангіогенезу пухлини. Генна терапія зменшує експресію VEGF/VEGFR або руйнує шляхи передачі сигналу, що інгібує їх біологічні активності. 2. ПротиVEGF/VEGFR моноклональні антитіла (Gordon М et al. Proc Am Soc Clin Oncol, 1998, 17, 2lla): моноклональні антитіла проти VEGF/VEGFR блокують секретування VEGF і VEGFR і руйнують внутрішньоклітинну передачу сигналу VEGF інгібуючи ангіогенез. 3. Низькомолекулярні 1 UA 98797 C2 5 10 інгібітори: ряд сполук запропонованих Шуген. 4. Розчинний VEGFR: він зв'язує VEGF, але не приймає участь в передачі сигналу. 5. Направлене лікування: два основні рецептори VEGF FIt-1 і FIk-1/KDR надмірно експресуються ендотеліальних клітинах судин пухлини, але не можуть бути детектовані в сусідній нормальній ендотеліальній тканині судин. Тому, VEGF і VEGFR забезпечують специфічну ціль для направленого на пухлини лікування. VEGF можуть бути поєднані з іншими протипухлинними агентами, токсинами, радіонуклідами для направленого на пухлини лікування. Базуючись на структурі інгібітору тирозинкінази SU-11248 та протираковій ефективності похідних піролоконденсованого шестичленного аза-гетероциклу А, представлений винахід спрямовано на створення аналогів формули (І). Сполуки винаходу мають очевидну структурну відмінність від існуючих сполук, описаних в попередньому рівні техніки, і вони також проявляють більшу ефективність та більш широку дію. 15 20 25 30 35 Представлений винахід стосується деяких похідних піролоконденсованих шестичленних аза-гетероциклілгідроксиморфоліну формули (І), особливо, нових інгібіторів протеїнтирозинкінази 2-(2-оксоіндолін-3-іліден)метил-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-6,7дигідро-1Н-пірол[3,2-с]піридин-4(5Н)-онів, їх таутомерів, енантоімерів, фізіологічно прийнятних солей, метаболітів, проліків метаболітів і їх активностей в регулюванні активності протеїнкінази. де: R1, R2, R3, R4 кожен незалежно вибирають з групи, що містить водень, галоген, алкіл, арил, гетероарил, -OR5, -O[CH2CH2O]rR7, -NR5R6, -COR5 і -NR5COR6, де згаданий арил або гетероарил може бути додатково заміщений однією або більше груп, що вибирають з групи, яка містить алкіл, алкоксил і галоген; R5 і R6 кожен незалежно вибирають з групи, що містить водень і алкіл, де згаданий алкіл може бути додатково заміщений однією або більше груп, що вибирають з групи, яка містить арил, гетероарил, галоарил, гідрокси, алкоксил, арилоксил, карбоксильна група і естер карбонової кислоти; R7 є водень або алкіл; і r є цілим числом від 1 до 6. Зразками сполук цього винаходу є, але не обмежується ними: 2 UA 98797 C2 Таблиця Приклад № Структура Назва 1 (R,Z)-2-(5-Фтор-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 2 (R,Z)-2-(5-Хлор-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 3 2-[(Z)-4-(2,3-Дифтор-феніл)-2-оксо-1,2-дигідро-індол3-іліденметил]-5-[(R)-2-гідрокси-3-морфолін-4-ілпропіл]-3-метил-1,5,6,7-тетрагідро-піроло[3,2с]піридин-4-он 4 (R,Z)-2-(5-Бром-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 5 (S,Z)-2-(5-Фтор-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 6 (S,Z)-2-(5-Хлор-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 7 2-(Z)-[4-(2,3-Дифтор-феніл)-2-оксо-1,2-дигідро-індол3-іліденметил]-5-[(S)-2-гідрокси-3-морфолін-4-ілпропіл]-3-метил-1,5,6,7-тетрагідро-піроло[3,2с]піридин-4-он 8 (S,Z)-2-(5-бром-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 3 UA 98797 C2 9 (S,Z)-N-{5-Фтор-3-[5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3-дигідро1Н-індол-6-іл}-2-гідрокси-ацетамід 10 (S,Z)-2-[5-Фтор-6-(4-фтор-бензиламіно)-2-оксо-1,2дигідро-індол-3-іліденметил]-5-(2-гідрокси-3морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідропіроло[3,2-с] піридин-4-он 11 (S,Z)-N-{5-Фтор-3-[5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3-дигідро1Н-індол-6-іл}-2-гідрокси-2-метил-пропіонамід 12 (S,Z)-2-(7-Бром-5-фтор-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 13 (S,Z)-N-{5-Фтор-3-[5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3-дигідро1Н-індол-6-іл}-2-метокси-ацетамід 14 (R,Z)-2-(7-Бром-5-фтор-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 15 (R,Z)-2-[5-Фтор-6-(4-фтор-бензиламіно)-2-оксо-1,2дигідро-індол-3-іліденметил]-5-(2-гідрокси-3морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідропіроло[3,2-с]піридин-4-он 16 (R,Z)-N-{5-Фтор-3-[5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3-дигідро1Н-індол-6-іл}-2-метокси-ацетамід 17 (R,Z)-N-{5-Фтор-3-[5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3-дигідро1Н-індол-6-іл}-2-гідрокси-2-метил-пропіонамід 4 UA 98797 C2 18 19 (S,Z)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-2-[5-(4метокси-феніл)-2-оксо-1,2-дигідро-індол-3іліденметил]-3-метил-1,5,6,7-тетрагідро-піроло[3,2с]піридин-4-он 22 (S,Z)-2-(4-Бром-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 23 (R,Z)-2-(5-Фтор-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-ону малеат 24 15 (S,Z)-2-[4-(2,6-Дифтор-феніл)-2-оксо-1,2-дигідро-індол3-іліденметил]-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 21 10 (S,Z)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-2-(5метокси-2-оксо-1,2-дигідро-індол-3-іліденметил)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 20 5 (R,Z)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-2(2-оксо-4-піридин-4-іл-1,2-дигідро-індол-3-іліденметил)1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он (R,Z)-2-(5-Фтор-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-ону малат або їх фармацевтично прийнятні солі. Де, фармацевтично прийнятними солями згідно з представленим винаходом є солі утворені з представлених сполук і кислот, що вибирають з яблучної кислоти, молочної кислоти, малеїнової кислоти, хлорводневої кислоти, метансульфонової кислоти, сірчаної кислоти, фосфорної кислоти, лимонної кислоти, винної кислоти, оцтової кислоти або трифтороцтової кислоти, переважно, кислотами є яблучна кислота або малеїнова кислота. Інший аспект цього винаходу стосується фармацевтичної композиції, що містить похідні піролоконденсованого шестичленного аза-гетероциклілгідроксиморфоліну формули (І) або їх фармацевтично прийнятні солі, носії або екціпієнти. Інший аспект цього винаходу стосується способу модулювання каталітичної активності протеїнкінази, що включає контактування згаданої протеїнкінази з похідними піролоконденсованого шестичленного аза-гетероциклілгідроксиморфоліну формули (І) або їх фармацевтично прийнятними солями, носіями або екціпієнтами. Згадані протеїнкінази вибирають з рецепторних тирозинкіназ (RTK), нерецепториних протеїнтирозинкіназ (СТК) і серин/треонін протеїнкіназ (STK). В іншому аспекті, цей винахід стосується застосування похідних піролоконденсованого шестичленного аза-гетероциклілгідроксиморфоліну формули (І) при одержанні медикаменту для лікування розладів залежних від протеїнкіназ. Де згадані розлади залежні від протеїнкіназ 5 UA 98797 C2 5 10 15 20 вибирають з розладів залежних від EGFR, HER-2, HER-3, HER-4, PDGFR, VEGFR-2, c-Kit, c-Met, FGFR і Flt3. Іншим аспектом цього винаходу є спосіб одержання похідних піролоконденсованого шестичленного аза-гетероциклілгідроксиморфоліну формули (І) або їх фармацевтично прийнятних солей, де спосіб одержання включає наступні стадії: нагрівання оптично активного 1-аміно-3-морфолін-4-іл-пропан-2-олу (Іа) з 5-карбоксиметил3-метил-1Н-пірол-2,4-дикарбонової кислоти 2-трет-бутиловим естером 4-етиловим естером в ацетонітрилі в атмосфері азоту в присутності 1-гідроксибензотриазолу і N-етил-N'(диметиламінопропіл)-карбодііміду з одержанням хірального діестеру піроламіддикарбонової кислоти (Іb); нагрівання хірального діестеру піроламіддикарбонової кислоти (Іb) з хлорводневою кислотою, із зворотнім холодильником, в етанолі в атмосфері аргону з одержанням оптично активного етилового естеру піроламіду (Іс); подальше нагрівання оптично активного етилового естеру піроламіду (Іс) з бораном, для селективного відновлення, із зворотнім холодильником в безводному тетрагідрофурані з одержанням хірального заміщеного етилового естеру піролу (Id); 25 потім, нагрівання хірального заміщеного етилового естеру піролу (Id) з моногідратом гідроксиду літію із зворотнім холодильником в атмосфері аргону в гліколі з одержанням циклізованого продукту оптично активного піролоконденсованого шестичленного азагетероциклу (Іе); 30 35 взаємодію оптично активного піролоконденсованого шестичленного аза-гетероциклу (Іе) з оксихлоридом фосфору і N, N-диметилформамідом в безводному дихлорметані при кімнатній температурі за умов реакції формілювання з одержанням оптично активного піролоконденсованого шестичленного аза-гетероциклформальдегіду (lf); 6 UA 98797 C2 5 10 15 20 25 30 35 40 45 на кінець, нагрівання оптично активного піролоконденсованого шестичленного аза-азагетероциклформальдегіду (If) з різними індолінонами в присутності основи, такої як триетиламін або піперидин, протягом 2~12 годин з одержанням цільового продукту - похідних хірального піролоконденсованого шестичленного аза-гетероциклілгідроксиморфоліну формули (І); де: R1, R2, R3, R4 є такими як визначено вище. Якщо не вказано інше, наступні терміни використовувані в описі і пунктах формули винаходу мають значення розкриті далі. "Алкіл" стосується насиченої аліфатичної вуглеводневої групи, що включає нерозгалужені і розгалужені групи з 1-20 атомами вуглецю. Переважно, алкільна група є алкілом середнього розміру, що має 1-10 атомів вуглецю, наприклад, метил, етил, пропіл, 2-пропіл, н-бутил, ізобутил, трет-бутил, пентил, і т.і… Більш переважно, він є нижчим алкілом, що має 1-4 атомів вуглецю, наприклад, метил, етил, пропіл, 2-пропіл, н-бутил, ізо-бутил або трет-бутил і т.і.. Алкільна група може бути заміщеною або незаміщеною. Коли заміщена, групу(и) замісник можна вибрати з групи, що містить гало, гідрокси, алкоксил, арил, гетероарил, галоарил, арилоксил, карбонову кислоту, естер карбонової кислоти, -OR5, -O[CH2CH2O]rR7, -NR5R6, -COR5 i-NR5COR6. "Арил" стосується груп, що мають принаймні одне ароматичне кільце, тобто, що мають кон'юговану -електронну систему, включаючи повністю вуглецевий циклічний арил, гетероарил і біарил. Згадана арильна група може бути заміщеною або незаміщеною. Коли заміщена, групу(и) замісник можна вибрати з групи, що містить гало, алкоксил, алкіл, гідрокси, арилоксил, карбонову кислоту, естер карбонової кислоти, -OR5, -O[CH2CH2O]rR7, -NR5R6, -COR5 і -NR5COR6. "Гетероарил" стосується арилу, що має одну - три кільцевих гетероатоми, що вибирають з групи, яка містить О, S, і N, як атоми кільця, атомами, що залишились, є С. Згадане кільце є 5 або 6 членним кільцем. Прикладами гетероарильних груп є фурил, тієніл, піридил, піроліл, Nалкілпіроліл, піримідил, піразиніл, імідазоліл і т.і.. Гетероарильна група може бути заміщеною або незаміщеною. Коли заміщена, групу(и) замісник можна вибрати з групи, що містить гало, алкоксил, алкіл, гідрокси, арилоксил, карбонову кислоту, естер карбонової кислоти, -OR5, O[CH2CH2O]rR7, -NR5R6, -COR5 і -NR5COR6. "Гідрокси" стосується -ОН групи. "Алкоксил" стосується і -О-(алкілу), і -О-(незаміщеного циклоалкілу). Наочними прикладами є, але не обмежується ними, метокси, етокси, пропокси, бутокси, циклопропілокси, циклобутилокси, циклопентилокси, циклогексилокси, і т.і.. Алкоксильна група може бути заміщеною або незаміщеною. Коли заміщена, групу(и) замісник можна вибрати з групи, що містить гало, гідрокси, алкоксил, арил, гетероарил, галоарил, арилоксил, карбонову кислоту, естер карбонової кислоти, -OR5, -O[CH2CH2O]rR7, -NR5R6, -COR5 і -NR5COR6. "Арилоксил" стосується і -О-арилу, і -О-гетероарилу, де арил і гетероарил є такими як визначено вище. Характерними прикладами є, але не обмежується ними, фенокси, піридинілокси, фуранілокси, тієнілокси, піримідинілокси, піразинілокси, і т.і., і їх похідні. Арилоксильна група може бути заміщеною або незаміщеною. Коли заміщена, групу(и) замісник можна вибрати з групи, що містить гало, алкоксил, алкіл, гідрокси, арилоксил, карбонову кислоту, естер карбонової кислоти, -OR5, -O[CH2CH2O]rR7, -NR5R6, -COR5 і -NR5COR6. "Гало" стосується фтору, хлору, брому або йоду, переважно фтору або хлору. "Галоалкокси" стосується -О-(галоалкілу). Характерними прикладами є, але не обмежується ними, трифторметокси, триброметокси, і т.і… 7 UA 98797 C2 5 10 15 "Карбонова кислота" стосується (алкіл)С(=О)ОН. "Карбоксилат" стосується (алкіл)С(=О)О(алкілу). "Необов'язковий" або "необов'язково" означає, що описане далі подія або обставина може мати місце або може не мати місце, і що опис включає випадки, коли подія або обставина може мати місце або може не мати місце. Наприклад, "гетероциклічна група необов'язково заміщена алкільною групою" означає, що алкіл може бути присутній або може бути відсутній, і опис включає випадки, коли гетероциклічна група є заміщеною алкільною групою і випадки, коли гетероциклічна група є не заміщеною алкільною групою. "Фармацевтична композиція" стосується суміші однієї або більше сполук описаних тут або фізіологічно/фармацевтично прийнятних солей або їх проліків, з іншими хімічними компонентами, такими як фізіологічно/фармацевтично прийнятні екціпієнти. Ціллю фармацевтичної композиції є полегшення введення сполуки в організм. Способи одержання Для того щоб досягти цілі представленого винаходу, винахід використовує наступне технічне рішення: Спосіб одержання похідних піролоконденсованого шестичленного азагетероциклілгідроксиморфоліну формули (І) або їх фармацевтично прийнятних солей, включає наступні стадії: 20 25 30 35 40 45 Оптично активний 1-аміно-3-морфолін-4-іл-пропан-2-ол (Іа) (одержаний згідно із US20040209937), як вихідний матеріал, нагрівають з 5-карбоксиметил-3-метил-1Н-пірол-2,4дикарбонової кислоти 2-трет-бутиловим естером 4-етиловим естером із зворотнім холодильником в атмосфері азоту в присутності 1-гідроксибензотриазолу і N-етил-N'(диметиламінопропіл)-карбодііміду в ацетонітрилі одержуючи хіральний діестер піроламіддикарбонової кислоти (Іb); нагрівають хіральний діестер піроламіддикарбонової кислоти (Іb) з хлорводневою кислотою в атмосфері аргону із зворотнім холодильником в етанолі одержуючи оптично активний етиловий естер піроламіду (Іс); потім, нагрівають оптично активний етиловий естер піроламіду (Іс) з бораном, за умов селективного відновлення, із зворотнім холодильником в безводному тетрагідрофурані одержуючи хіральний етиловий естер заміщеного піролу (Id); потім, нагрівають хіральний етиловий естер заміщеного піролу (Id) з моногідратом гідроксиду літію із зворотнім холодильником в атмосфері аргону в гліколі одержуючи циклізований продукт - оптично активний піролоконденсований шестичленний азагетероцикл (Іе); оптично активний піролоконденсований шестичленний аза-гетероцикл (Іе) реагує з оксихлоридом фосфору і N, N-диметилформамідом в безводному дихлорметані при кімнатній температурі за умов реакції формілювання одержуючи оптично активний піролоконденсований шестичленний аза-гетероциклічний формальдегід (If); і на кінець, нагрівають оптично активний піролоконденсований шестичленний аза-гетероциклічний формальдегід (If) з різними індолінонами в присутності основи, такої як триетиламін або піперидин, протягом 2-12 годин одержуючи цільовий продукт - хіральні похідні піролоконденсованого шестичленного гетероциклогідроксиморфоліну формули (І). Де, ключовою методикою є селективне відновлення субстрату (Іс) бораном і каталізована циклізація субстрату (Id) основою - моногідратом гідроксиду літію. Стосовно останнього, відсутні посилання щодо підходу до конструювання такого піролоконденсованого шестичленного лактаму. Цей винахід також стосується фармацевтичної композиції, що містить сполуку формули (І) або її сіль в ефективній дозі, також як фармацевтично прийнятні носії. 8 UA 98797 C2 5 10 15 20 Цей винахід також стосується застосування сполук винаходу формули (І) або їх солей при одержанні медикаменту, що використовується як інгібітор протеїнкінази. Наступні приклади слугують ілюстрацією винаходу, і приклади не повинні розглядатись як обмеження рамок винаходу. Структури сполук визначали за допомогою ядерного магнітного резонансу (ЯМР) або масспектрометрії (МС). Хімічні зсуви ЯМР () виражали в мільйонних частках (м.ч.). ЯМР знімали на пристрої Bruker AVANCE-400. Розчинником був дейтерований хлороформ (CDCl3) і дейтерований диметилсульфоксид (ДМСО-d6) з тетраметилсиланом (ТМС) як внутрішній стандарт. Хімічні зсуви виражали в мільйонних частках (м.ч.). МС знімали на масспектрометрі FINNIGAN LCQAd (ECI). Для тонкошарової хроматографії використовували пластинки Yantai Huanghai HSGF254 або Qingdao GF254. Для колонкової хроматографії зазвичай використовували силікагель Yantai Huanghai 200300 меш, як носій. ДMCO-D6: дейтерований диметилсульфоксид. CDCl3: дейтерований хлороформ. ПРИКЛАДИ Приклад 1 (R,Z)-2-(5-Фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 25 30 35 40 Стадія 1 5-[(2-Гідрокси-3-морфолін-4-іл-пропілкарбамоїл)-метил]-3-метил-1Н-пірол-2,4-дикарбонової кислоти (S)-2-трет-бутиловий естер 4-етиловий естер (S)-1-Аміно-3-морфолін-4-іл-пропан-2-ол 1а (15,125 г, 94,5 ммоль), 5-карбоксиметил-3метил-1Н-пірол-2,4-дикарбонової кислоти 2-трет-бутиловий естер 4-етиловий естер (32,34 г, 104 ммоль), 1-гідроксибензотриазол (25,5 г, 189,06 ммоль) і N-етил-N'-(диметиламінопропіл)карбодіімід (36,2 г, 189,06 ммоль) розчиняли в 450 мл ацетонітрилу при перемішуванні при кімнатній температурі, і реакційну суміш перемішували при 50 °C на масляній бані протягом 3 годин. Реакція завершилась за тонкошаровою хроматографією (ТШХ) що показала відсутність вихідних матеріалів, і розчинник упарювали при пониженому тиску і до залишку потім додавали 150 мл насиченого розсолу. Суміш екстрагували сумішшю розчинників етилацетат і тетрагідрофуран (O:O=4:1, 200 мл 5). Об'єднані органічні екстракти промивали насиченим розсолом (100 мл), сушили над безводним сульфатом магнію і фільтрували для видалення осушника. Фільтрат концентрували при пониженому тиску одержуючи масло (75 г). Масло очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку 5[(2-гідрокси-3-морфолін-4-іл-пропілкарбамоїл)-метил]-3-метил-1Н-пірол-2,4-дикарбонової 9 UA 98797 C2 5 10 15 20 25 30 35 40 45 50 55 кислоти (S)-2-трет-бутиловий естер 4-етиловий естер 1b (30 г, вихід 70 %) як світло-коричневу тверду речовину. MC m/z (ECI): 454,4[M+1] Стадія 2 (S)-2-[(2-Гідрокси-3-морфолін-4-іл-пропілкарбамоїл)-метил]-4-метил-1Н-пірол-3-карбонової кислоти етиловий естер 5-[(2-Гідрокси-3-морфолін-4-іл-пропілкарбамоїл)-метил]-3-метил-1Н-пірол-2,4-дикарбонової кислоти (S)-2-трет-бутиловий естер 4-етиловий естер 1b (25,7 г, 56,7 ммоль) розчиняли в 70 мл безводного етанолу при перемішуванні в атмосфері аргону і потім до розчину на бані лід-вода по краплям додавали 71 мл хлор водневої кислоти (12 N). Після завершення додавання, баню лід-вода видаляли. Реакційну систему перемішували при 60 °C на масляній бані 1,5 годин. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів, і реакційну систему доводили до рН приблизно 7 використовуючи 10N розчин гідроксиду натрію в бані сухий лідацетон і утворювалось багато осаду. Суміш фільтрували і фільтрувальний залишок промивали етанолом. Фільтрат концентрували при пониженому тиску до видалення розчинника і залишок доводили до рН приблизно 10 використовуючи 10N розчин гідроксиду натрію. Суміш екстрагували дихлорметаном (150 мл 3). Об'єднані органічні екстракти промивали насиченим розсолом (100 мл), сушили над безводним сульфатом магнію, фільтрували для видалення осушника і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (S)-2[(2-гідрокси-3-морфолін-4-іл-пропілкарбамоїл)-метил]-4-метил-1Н-пірол-3-карбонової кислоти етиловий естер 1с (16,9 г, вихід 84 %) як темне-зелене масло. MC m/z (ECI): 354,3[M+1] Стадія 3 (S)-2-[2-(2-Гідрокси-3-морфолін-4-іл-пропіламіно)-етил]-4-метил-1Н-пірол-3-карбонової кислоти етиловий естер (S)-2-[(2-Гідрокси-3-морфолін-4-іл-пропілкарбамоїл)-метил]-4-метил-1Н-пірол-3-карбонової кислоти етиловий естер 1с (16,9 г, 47,9 ммоль) розчиняли в 143,6 мл безводного тетрагідрофурану в атмосфері аргону, і потім до розчину на бані лід-вода додавали комплекс боран-тетрагідрофуран в тетрагідрофурані (143,6 мл, 1 моль/л, 143,6 ммоль). після завершення додавання, баню лід-вода видаляли. Реакційну систему залишали нагріватись до кімнатної температури і кип'ятили при 95 °C на масляній бані 1 годину. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. Розчинник упарювали при пониженому тиску і потім до залишку додавали 150 мл хлорводневої кислоти (2N). Суміш перемішували протягом 0,5 голини і потім додавали 50 мл льоду. Суміш доводили до рН приблизно 10 використовуючи 10N розчин гідроксиду натрію і екстрагували етилацетатом (200 мл 2). Об'єднані органічні екстракти промивали насиченим розсолом (100 мл), сушили над безводним сульфатом магнію, фільтрували для видалення осушника і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (S)-2-[2-(2-гідрокси-3-морфолін-4-іл-пропіламіно)-етил]-4-метил-1Нпірол-3-карбонової кислоти етиловий естер 1d (15,6 г, вихід 96 %) як коричневе масло. MC m/z (ECI): 340,3[M+1] Стадія 4 (R)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4он (S)-2-[2-(2-Гідрокси-3-морфолін-4-іл-пропіламіно)-етил]-4-метил-1Н-пірол-3-карбонової кислоти етиловий естер 1d (16,2 г, 47,9 ммоль) і моногідрат гідроксиду літію (8 г, 190,6 ммоль) розчиняли в 50 мл гліколю при перемішуванні в атмосфері аргону. Реакційну систему перемішували при 135 °C на масляній бані 50 хвилин. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. Розчинник упарювали при пониженому тиску і потім до залишку додавали 150 мл насиченого розсолу. Суміш екстрагували дихлорметаном (150 мл 5). Об'єднані органічні екстракти промивали насиченим розсолом (150 мл), сушили над безводним сульфатом магнію, фільтрували для видалення осушника і концентрували при пониженому тиску одержуючи масло (12,3 г). Масло очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 1е (7,9 г, вихід 60,6 %) як білу тверду речовину. MC m/z (ECI): 294,2[M+1] Стадія 5 (R)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2с]піридин-2-карбальдегід 10 UA 98797 C2 5 10 15 20 25 30 35 40 Оксихлорид фосфору (674 мкл, 4,04 ммоль) і N, N-диметилформамід (963 мкл, 12,32 ммоль) розчиняли в 21,18 мл дихлорметану при перемішуванні при кімнатній температурі і реакційний розчин перемішували протягом 15 хвилин підтримуючи температуру -10 °C на бані лід-вода. (R)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 1е (790 мг, 2,7 ммоль) розчиняли в 10 мл дихлорметану при перемішуванні, і потім розчин додавали по краплям до згаданої вище реакційної системи. Після завершення додавання, баню лід-вода видаляли і реакційну систему залишали нагріватись до кімнатної температури і перемішували ще 2 години. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів, і реакційну систему гасили льодяною водою і перемішували протягом 15 хвилин. Суміш доводили до рН приблизно 12 використовуючи 10N розчин гідроксиду натрію і екстрагували сумішшю розчинників дихлорметан і метанол (O:O=20:1, 100 мл 8). Об'єднані органічні екстракти промивали насиченим розсолом (150 мл), сушили над безводним сульфатом магнію, фільтрували для видалення осушника і концентрували при пониженому тиску одержуючи неочищений продукт (800 мг). Неочищений продукт очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)-5-(2-гідрокси-3морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2-с]піридин-2-карбальдегід 1f (650 мг, вихід 75 %) як білу тверду речовину. МС m/z (ECI): 322,6[М+1] Стадія 6 (R,Z)-2-(5-Фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он (R)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2с]піридин-2-карбальдегід 1f (200 г, 0,623 ммоль), 5-фтор-1,3-дигідро-індол-2-он (84,67 мг, 0,56 ммоль) і піперидин (30,8 мкл, 0,31 ммоль) розчиняли в 1,09 мл етанолу при перемішуванні при кімнатній температурі. Реакційну систему перемішували при 80 °C на масляній бані в темноті 2 години. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів, і масляну баню видаляли. Реакційну систему залишали охолоджуватись до кімнатної температури для утворення осаду. Одержану тверду речовину фільтрували одержуючи вказану в заголовку сполуку (R, Z)-2-(5-фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 1 (256 мг, 90 %) як жовту тверду речовину. MC m/z (ECI): 455,2[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,674(с, 1Н, пірол-NH), 10,945(с, 1Н, індол-NH), 7,771~7,800(м, 1Н, -АrН), 7,762(с, 1Н, -СН=С), 6,927~6,978(дд, 1Н, -АrН), 6,842~6,874(д, 1Н, -АrН), 4,707~4,719(д, 1Н, -ОН), 3,900~3,915(м, 1Н, -СНО), 3,704~3,748(дд, 2Н, амід N шестичленне кільце внутрішній-СН2-), 3,616~3,695(дд, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,563~3,585(т, 4Н, морфолін 2 -СН2О), 3,105~3,158(дд, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,433(т, 2Н, шестичленне кільце приєднане до пірол-СН2-), 2,545(с, 3Н, піролСН3), 2,420~2,431 (м, 2Н, -CH2N, морфолін-СН2N), 2,420~2,431 (м, 2Н, -CH2N, морфолін зовнішній-СН2N), 2,304~2,330(т, 2Н, морфолін внутршній-СН2N) Приклад 2 (R,Z)-2-(5-Хлор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 45 50 Вказану в заголовку сполуку одержували за тих же самих умов як описано на стадії 6 Прикладу 1 з (R)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 1f одержаного на стадії 5 Прикладу 1 і 5-хлор-1,3-дигідроіндол-2-ону, як вихідних матеріалів, одержуючи (R, Z)-2-(5-хлор-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2с]піридин-4-он 2 (42 мг, вихід 64 %) як жовту тверду речовину. 11 UA 98797 C2 5 MC m/z (ECI): 471,2[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,727(с, 1Н, пірол-NH), 11,039(с, 1Н, індол-NH), 8,003(м, 1Н, АrН), 7,814(с, 1Н, -СН=С), 7,166-7,141 (дд, 1Н, -АrН), 6,890-6,869(д, 1Н, -АrН), 4,713~4,700(д, 1Н, -ОН), 3,907~3,892(м, 1Н, -СНО), 3,626~3,567(т, 4Н, морфолін 2 -CH2O), 3,152~3,099(дд, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,027~2,994(т, 2Н, шестичленне кільце приєднане до пірол-СН2), 2,547 (с, 3Н, пірол-СН3), 2,328~2,290(т, 2Н, морфолін внутршній-СН2N) Приклад 3 2-[(Z)-4-(2,3-Дифтор-феніл)-2-оксо-1,2-дигідро-індол-3-іліденметил]-5-[(R)-2-гідрокси-3морфолін-4-іл-пропіл]-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 10 15 20 25 30 35 Стадія 1 4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-1Н-індол 4-Бром-1Н-індол 3а (29,4 г, 150 ммоль) розчиняли в 600 мл диметилсульфоксиду при перемішуванні в атмосфері аргону і потім до розчину додавали біс(пінаколато)диборон (41,9 г, 165 ммоль), ацетат калію (44,1 г, 450 ммоль) і [1,1’-біс(дифенілфосфіно)фероцен]дихлорпаладій (3,6 г, 4,8 ммоль). Після завершення додавання, реакційну суміш перемішували при 80 °C на масляній бані 22 години. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів, і до реакційної суміші додавали 2 л води. Суміш екстрагували етилацетатом (2 л 3). Об'єднані органічні екстракти промивали насиченим розсолом (2 л 5), сушили над безводним сульфатом натрію, фільтрували для видалення осушника і концентрували при пониженому тиску. Залишок очищали колонковою хроматографією на силікагелі і перекристалізували одержуючи вказану в заголовку сполуку 4-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1Н-індол 3b (20 г, вихід 60 %) як білу тверду речовину. MC m/z (ECI): 243,9[M+1] Стадія 2 4-(2,3-дифтор-феніл)-1Н-індол 4-(4,4,5,5-Тетраметил-[1,3,2]діоксаборолан-2-іл)-1Н-індол 3b (1,22 г, 5 ммоль) розчиняли в 20 мл тетрагідрофурану при перемішуванні в атмосфері аргону і потім до розчину додавали 1бром-2,3-дифтор-бензол (0,97 г, 5 ммоль), тетракіс(трифенілфосфін)паладій (0,17 г, 0,15 ммоль) і 7 мл розчину гідроксиду натрію (2М). Після завершення додавання, реакційну систему перемішували при 75 °C на масляній бані протягом ночі. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. Реакційну суміш природно охолоджували до кімнатної температури і екстрагували етилацетатом (20 мл 3). Об'єднані органічні екстракти промивали насиченим розсолом (10 мл), сушили над безводним сульфатом натрію, фільтрували для видалення осушника і концентрували при пониженому тиску. Одержану тверду речовину очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку 4(2,3-дифтор-феніл)-1Н-індол 3с (800 мг, вихід 70 %) як білу тверду речовину. 12 UA 98797 C2 5 10 15 20 25 30 35 40 45 50 MC m/z (ECI): 228,4[M-1] Стадія 3 4-(2,3-Дифтор-феніл)-1,3-дигідро-індол-2-он 4-(2,3-Дифтор-феніл)-1Н-індол 3с (744 мг, 3,25 ммоль) розчиняли в 12 мл етанолу при перемішуванні при кімнатній температурі і потім до розчину послідовно додавали 21 мл третбутанолу, 6,4 мл льодяної оцтової кислоти і триброміду піридинію (3,12 г, 9,7 ммоль). Після завершення додавання, реакційну суміш перемішували протягом 3 годин і потім до суміші додавали 16 мл льодяної оцтової кислоти і цинковий пил (1,1 г, 16,25 ммоль). Реакційну суміш перемішували протягом ще 1 години, фільтрували до видалення залишку і концентрували при пониженому тиску. До залишку додавали 30 мл етилацетату, послідовно промивали 10 мл води, 10 мл насиченого розчину бікарбонату натрію і 10 мл насиченого розсолу, сушили над безводним сульфатом натрію і фільтрували для видалення осушника. Фільтрат концентрували при пониженому тиску одержуючи вказану в заголовку сполуку 4-(2,3-дифтор-феніл)-1,3дигідро-індол-2-он 3d (780 мг, вихід 97 %) як білу тверду речовину. MC m/z (ECI): 246,6[M+1] Стадія 4 2-[(Z)-4-(2,3-Дифтор-феніл)-2-оксо-1,2-дигідро-індол-3-іліденметил]-5-[(R)-2-гідрокси-3морфолін-4-іл-пропіл]-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он (R)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2с]піридин-2-карбальдегід 1f (50 мг, 0,156 ммоль), 4-(2,3-дифтор-феніл)-1,3-дигідро-індол-2-он 3d (34,3 мг, 0,14 ммоль) і піперидин (7,7 мкл, 0,078 ммоль) розчиняли в 0,3 мл етанолу при перемішуванні при кімнатній температурі. Реакційну систему перемішували при 80 °C на масляній бані в темноті протягом 2 годин. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів, і масляну баню видаляли. Реакційну систему природно охолоджували до кімнатної температури для утворення осаду. Одержану тверду речовину фільтрували одержуючи вказану в заголовку сполуку 2-[(Z)-4-(2,3-дифтор-феніл)-2-оксо-1,2дигідро-індол-3-іліденметил]-5-[(R)-2-гідрокси-3-морфолін-4-іл-пропіл]-3-метил-1,5,6,7тетрагідро-піроло[3,2-с]піридин-4-он 3 (56 мг, вихід 73 %) як жовту тверду речовину. МС m/z (ЕСІ): 549,3 [М+1] 1 Н ЯМР (400МГц, ДMCO-d6): 13,583(с, 1Н, пірол-NH), 11,164(с, 1Н, індол-NH), 7,647~7,604(м, 1Н, -АrН), 7,462~7,411(м, 1Н, -АrН), 7,342~7,308(м, 1Н, -АrН), 7,277~7,239(м, 1Н, -АrН), 7,017~6,997(д, 1Н, -АrН), 6,898~6,879(д, 1Н, -АrН), 6,716(с, 1Н, -СН=С), 4,671 (с, 1Н, -ОН), 3,854(м, 1Н, -СНО), 3,673~3,540(м, 7Н, шестичленне кільце внутрішній-СН2N, амід N шестичленне кільце зовнішній-СН2, морфолін 2 -СН2О), 3,124~3,077(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 2,986~2,954(т, 2Н, шестичленне кільце внутрішній-СН2), 2,402~2,392(м, 4Н, морфолін-СН2N, морфолін зовнішній-CH2N), 2,279~2,265(д, 2Н, морфолінСН2N), 1,884(с, 3Н, пірол-СН3) Приклад 4 (R,Z)-2-(5-Бром-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он Вказану в заголовку сполуку одержували за тих же самих умов як описано на стадії 6 Прикладу 1 з (R)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 1f, одержаного на стадії 5 Прикладу 1, і 5-бром-1,3-дигідроіндол-2-ону, як вихідних матеріалів, одержуючи (R, Z)-2-(5-бром-2-окco-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2с]піридин-4-он 4 (24 мг, вихід 50 %) як жовту тверду речовину. MCm/z (ECI): 517,6[M+1] 1 Н ЯМР (400МГЦ, ДМСО-d6): 13,723(с, 1Н, пірол-NH), 11,047(с, 1Н, індол-NH), 8,131(с, 1Н, АrН), 7,820(с, 1Н, -СН=С), 7,292~7,271 (дд, 1Н, -АrН), 6,847~6,827(д, 1Н, -АrН), 4,713~4,702(д, 1Н, -ОН), 3,897(м, 1Н, -СНО), 3,626~3,569(т, 4Н, морфолін 2 -СН2О), 3,153~3,101 (дд, 1Н, амід 13 UA 98797 C2 5 10 15 20 25 30 35 40 N шестичленне кільце зовнішній-СН2-), 3,029~2,995(т, 2Н, шестичленне кільце приєднане до пірол-СН2-), 2,549(с, 3Н, пірол -СН3), 2,308(т, 2Н, морфолін-CH2N) Приклад 5 (S,Z)-2-(5-Фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он Стадія 1 5-[(2-Гідрокси-3-морфолін-4-іл-пропілкарбамоїл)-метил]-3-метил-1Н-пірол-2,4-дикарбонової кислоти (R)-2-трет-бутиловий естер 4-етиловий естер (R)-1-Аміно-3-морфолін-4-іл-пропан-2-ол 5а (15,125 г, 94,5ммоль), 5-карбоксиметил-3-метил-1Н-пірол-2,4-дикарбонової кислоти 2-трет6утиловий естер 4-етиловий естер (32,34 г, 104 ммоль), 1-гідроксибензотриазол (25,5 г, 189,06 ммоль) і N-етил-N'-(диметиламінопропіл)-карбодіімід (36,2 г, 189,06 ммоль) розчиняли в 450 мл ацетонітрилу при перемішуванні при кімнатній температурі. Реакційну суміш перемішували при 50 °C на масляній бані 3 години. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. Розчинник упарювали при пониженому тиску і потім до залишку додавали 150 мл насиченого розсолу. Суміш екстрагували сумішшю розчинників етилацетат і тетрагідрофуран (O:O=4:1, 200 мл 5). Об'єднані органічні екстракти промивали насиченим розсолом (100 мл), сушили над безводним сульфатом магнію, фільтрували для видалення осушника і концентрували одержуючи масло (75 г). Масло очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку 5-[(2-гідрокси-3-морфолін-4-іл-пропілкарбамоїл)-метил]-3-метил-1Н-пірол-2,4дикарбонової кислоти (R)-2-трет-бутиловий естер 4-етиловий естер 5b (30 г, вихід 70 %) як світло-коричневу тверду речовину. MC m/z (ECI): 454,4[M+1] Стадія 2 (R)-2-[(2-Гідрокси-3-морфолін-4-іл-пропілкарбамоїл)-метил]-4-метил-1Н-пірол-3-карбонової кислоти етиловий естер В атмосфері аргону, 5-[(2-гідрокси-3-морфолін-4-іл-пропілкарбамоїл)-метил]-3-метил-1Нпірол-2,4-дикарбонової (R)-кислоти 2-трет-бутиловий естер 4-етиловий естер 5b (23 г, 50,77 ммоль) розчиняли в 60 мл безводного етанолу при перемішуванні і потім до розчину на бані лідвода по краплям додавали 63,5 мл хлорводневої кислоти (12 N). Після завершення додавання, баню лід-вода видаляли і реакційну систему перемішували при 60 °C на масляній бані 1,5 годин. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. Реакційну систему доводили до рН приблизно 7 використовуючи 10N розчин гідроксиду натрію в бані сухий лід-ацетон і утворювалось багато осаду. Суміш фільтрували і фільтрований залишок промивали етанолом. Фільтрат концентрували при пониженому тиску до видалення розчинника і залишок доводили до рН приблизно 10 використовуючи розчин гідроксиду натрію (10N). Суміш екстрагували дихлорметаном (150 мл 3). Об'єднані органічні екстракти промивали насиченим розсолом (100 мл), сушили над безводним сульфатом магнію, фільтрували для видалення осушника і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-2 14 UA 98797 C2 5 10 15 20 25 30 35 40 45 50 55 60 [(2-гідрокси-3-морфолін-4-іл-пропілкарбамоїл)-метил]-4-метил-1Н-пірол-3-карбонової кислоти етиловий естер 5с (14,6 г, вихід 81,6 %) як жовто-зелене масло. MC m/z (ECI): 354,8[M+1] Стадія 3 (R)-2-[2-(2-Гідрокси-3-морфолін-4-іл-пропіламіно)-етил]-4-метил-1Н-пірол-3-карбонової кислоти етиловий естер (R)-2-[(2-гідрокси-3-морфолін-4іл-пропілкарбамоїл)-метил]-4-метил-1Н-пірол-3-карбонової кислоти етиловий естер 5с (2,332 г, 6,6 ммоль) розчиняли в 23 мл безводного тетрагідрофурану в атмосфері аргону і потім до розчину на бані лід-вода додавали комплекс борантетрагідрофуран в тетрагідрофурані (23,12 мл, 1 моль/л, 23,12 ммоль). Після завершення додавання, баню лід-вода видаляли. Реакційну систему залишали нагріватись до кімнатної температури і кип'ятили при 95 °C на масляній бані 1 годину. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. Розчинник упарювали при пониженому тиску і потім до залишку додавали 5 мл хлорводневої кислоти (2N). Суміш перемішували протягом 0,5 годин і потім до суміші додавали 5 мл льодяної води. Суміш доводили до рН приблизно 10 використовуючи 10N розчин гідроксиду натрію. Суміш екстрагували етилацетатом (100 мл 2). Об'єднані органічні екстракти промивали насиченим розсолом (50 мл), сушили над безводним сульфатом магнію, фільтрували для видалення осушника і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-2-[2-(2-гідрокси-3-морфолін-4-іл-пропіламіно)етил]-4-метил-1Н-пірол-3-карбонової кислоти етиловий естер 5d (2,1 г, вихід 93,75 %) як білу тверду речовину. MC m/z (ECI):340,9[M+1] Стадія 4 (S)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4он (R)-2-[2-(2-Гідрокси-3-морфолін-4-іл-пропіламіно)-етил]-4-метил-1Н-пірол-3-карбонової кислоти етиловий естер 5d (2,1 г, 6,2 ммоль) і моногідрат гідроксиду літію(1,56 г, 37 ммоль) розчиняли в 25 мл гліколю при перемішуванні в атмосфері аргону. Реакційну систему перемішували при 140 °C на масляній бані 50 хвилин. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. Після того як тонкошарова хроматографія показала зникнення вихідного матеріалу, розчинник упарювали при пониженому тиску і потім до залишку додавали 50 мл насиченого розсолу. Суміш екстрагували дихлорметаном (80 мл 3). Об'єднані органічні екстракти промивали насиченим розсолом (80 мл), сушили над безводним сульфатом магнію, фільтрували для видалення осушника і концентрували при пониженому тиску. Залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (S)5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 5е (610 г, вихід 33,9 %) як білу тверду речовину. MC m/z (ECI): 294,5[M+1] Стадія 5 (S)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2с]піридин-2-карбальдегід Оксихлорид фосфору (500 мкл, 1,3 ммоль) і N, N-диметилформамід (704 мкл, 9 ммоль) розчиняли в 15 мл безводного дихлорметану при перемішуванні при кімнатній температурі і реакційний розчин перемішували протягом 15 хвилин підтримуючи температуру -10 °C на бані лід-вода. (S)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2с]піридин-4-он 5е (586 мг, 2 ммоль) розчиняли в 8 мл дихлорметану при перемішуванні і потім розчин по краплям додавали до згаданої вище реакційної системи. Після завершення додавання, баню лід-вода видаляли. Реакційну систему залишали нагріватись до кімнатної температури і перемішували ще 2 години. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. Реакційну суміш гасили льодяною водою і перемішували протягом 15 хвилин. Суміш доводили до рН приблизно 12 використовуючи 10N розчин гідроксиду натрію. Суміш екстрагували сумішшю розчинників дихлорметан і метанол (O:O=20:1, 100 мл 5). Об'єднані органічні екстракти промивали насиченим розсолом (100 мл), сушили над безводним сульфатом магнію, фільтрували для видалення осушника і концентрували при пониженому тиску. Залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (S)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7тетрагідро-1Н-піроло[3,2-с]піридин-2-карбальдегід 5f (490 мг, вихід 78,8 %) як білу тверду речовину. MC m/z (ECI): 322,1[M+1] Стадія 6 15 UA 98797 C2 5 10 15 20 (S,Z)-2-(5-Фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он (S)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2с]піридин-2-карбальдегід 5f (490 мг, 1,53 ммоль), 5-фтор-1,3-дигідро-індол-2-он (219 мг, 1,45 ммоль) і піперидин (100 мкл, 1,0 ммоль) розчиняли в 5 мл етанолу при перемішуванні при кімнатній температурі. Реакційну систему перемішували при 80 °C на масляній бані в темноті протягом 2 годин. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів, і масляну баню видаляли. Реакційну суміш природно охолоджували до кімнатної температури для утворення осаду. Одержану тверду речовину фільтрували одержуючи вказану в заголовку сполуку (S, Z)-2-(5-фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 5 (460 мг, 69,9 %) як жовту тверду речовину. MC m/z (ECI): 455,2[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,674(с, 1Н, пірол-NH), 10,945(с, 1Н, індол-NH), 7,771 ~7,800(м, 1Н, -АrН), 7,762(с, 1Н, -СН=С), 6,927~6,978(дд, 1Н, -АrН), 6,842~6,874(д, 1Н, -АrН), 4,707~4,719(д, 1Н, -ОН), 3,900~3,915(м, 1Н, -СНО), 3,704~3,748(дд, 2Н, амід N шестичленне кільце внутрішній-СН2-), 3,616~3,695(дд, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,563~3,585(т, 4Н, морфолін 2 -СН2О), 3,105~3,158(дд, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,433(т, 2Н, шестичленне кільце приєднане до пірол-СН2-), 2,545(с, 3Н, піролСН3), 2,420~2,431 (м, 2Н, -CH2N, морфолін внутрішній-CH2N), 2,420~2,431 (м, 2Н, -CH2N, морфолін зовнішній-СН2N), 2,304~2,330(т, 2Н, морфолін внутрішній-СН2N) Приклад 6 (S,Z)-2-(5-Хлор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 25 30 35 40 45 Вказану в заголовку сполуку одержували за тих же самих умов як описано на стадії 6 Прикладу 5 з (S)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 5f, одержаного на стадії 5 Прикладу 5, і 5-хлор-1,3-дигідроіндол-2-ону, як вихідних матеріалів, одержуючи (S,Z)-2-(5-xлор-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2с]піридин-4-он 6 (87 мг, вихід 85 %) як жовту тверду речовину. MC m/z (ECI): 471,6[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,727(с, 1Н, пірол-NH), 11,038(с, 1Н, індол-NH), 8,006~8,001 (м, 1Н, -АrН), 7,813(с, 1Н, -СН=С), 7,166~7,140(дд, 1Н, -АrH), 6,889~6,869(д, 1Н, -АrН), 4,712~4,700(д, 1Н, -ОН), 3,893(м, 1Н, -СНО), 3,723~3,689(дд, 2Н, амід N шестичленне кільце внутрішній-СН2-), 3,657~3,641 (дд, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,578~3,556(т, 4Н, морфолін 2 -СН2О), 3,152-3,099(дд, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,026~2,993(т, 2Н, шестичленне кільце приєднане до пірол-СН2-), 2,547(с, 3Н, пірол -СН3), 2,424~2,412(м, 4Н, -CH2N, морфолін внутрішній-CH2N, морфолін зовнішній-СН2N), 2,311~2,290(т, 2Н, морфолін внутрішній-СН2N) Приклад 7 2-(Z)-[4-(2,3-Дифтор-феніл)-2-оксо-1,2-дигідро-індол-3-іліденметил]-5-[(S)-2-гідрокси-3морфолін-4-іл-пропіл]-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 16 UA 98797 C2 5 10 15 20 25 30 35 Вказану в заголовку сполуку одержували за тих же самих умов як описано на стадії 6 Прикладу 5 з (S)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 5f, одержаного на стадії 5 Прикладу 5, і 4-(2,3-дифторфеніл)-1,3-дигідро-індол-2-ону 3d, як вихідних матеріалів, одержуючи 2-(Z)-[4-(2,3-дифторфеніл)-2-оксо-1,2-дигідро-індол-3-іліденметил]-5-[(S)-2-гідрокси-3-морфолін-4-іл-пропіл]-3метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 7 (49 мг, вихід 73 %) як червону тверду речовину. MC m/z (ECI): 549,2[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,583(с, 1Н, пірол-NH), 11,164(с, 1Н, індол-NH), 7,604~7,647(м, 1Н, -АrН), 7,411~7,464(м, 1Н, -АrН), 7,308~7,342(м, 1Н, -АrН), 7,239~7,277(м, 1Н, -АrН), 6,997~7,017(д, 1Н, -АrН), 6,879~6,898(д, 1Н, -АrН), 6,716(с, 1Н, -СН=С), 4,671 (с, 1Н, -ОН), 3,854(м, 1Н, -СНО), 3,540~3,673(м, 7Н, шестичленне кільце внутрішній-СН2N, амід N шестичленне кільце зовнішній-СН2, морфолін 2 -СН2О), 3,095~3,124(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 2,954~2,986(т, 2Н, шестичленне кільце внутрішній-СН2), 2,392~2,402(м, 4Н, морфолін-СН2N, морфолін зовнішній-CH2N), 2,265~2,279(д, 2Н, морфолінСН2N), 1,884(с, 3Н, пірол-СН3) Приклад 8 (S,Z)-2-(5-бром-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он Вказану в заголовку сполуку одержували за тих же самих умов як описано на стадії 6 Прикладу 5 з (S)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 5f, одержаного на стадії 5 Прикладу 5, і 5-бром-1,3-дигідроіндол-2-ону, як вихідних матеріалів, одержуючи (S, Z)-2-(5-6poм-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2с]піридин-4-он 8 (49 мг, вихід 78 %), як жовту тверду речовину. MC m/z (ECI): 515,2[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,720(с, 1Н, пірол-NH), 11,042(с, 1Н, індол-NH), 8,127(с, 1Н, АrН), 7,813(с, 1Н, -СН=С), 7,290~7,265(дд, 1Н, -АrН), 6,844~6,823(д, 1Н, -АrН), 4,712~4,699(д, 1Н, -ОН), 3,907(м, 1Н, -СНО), 3,578~3,555(т, 4Н, морфолін 2 -СН2О), 3,151~3,098(дд, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,025~2,992(т, 2Н, шестичленне кільце приєднане до пірол-СН2-), 2,547(с, 3Н, пірол -СН3), 2,306~2,290(т, 2Н, морфолін внутрішній-СН2N) Приклад 9 (S,Z)-N-{5-Фтор-3-[5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро1Н-піроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3-дигідро-1Н-індол-6-іл}-2-гідрокси-ацетамід 40 17 UA 98797 C2 5 10 15 20 25 30 35 Стадія 1 (5-Фтор-2,4-динітро-феніл)-оцтова кислота (3-Фтор-феніл)-оцтову кислоту 9а (31,5 г, 0,204 моль) додавали до 64 мл сірчаної кислоти (98 %) при кімнатній температурі і до розчину по краплям підтримуючи температуру 35 °C додавали 100 мл суміші азотної кислоти (65 %-68 %) і сірчаної кислоти (98 %) (O:O=1:1). Після завершення додавання, реакційну суміш перемішували при 35 °C. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. До реакційної суміші додавали лід і суміш фільтрували після розтавання льоду одержуючи вказану в заголовку сполуку (5-фтор-2,4динітро-феніл)-оцтову кислоту 9b (49 мг) як світло-жовте масло. МС m/z (ECI): 243,5[М-1] Стадія 2 (2,4-Діаміно-5-фтор-феніл)-оцтова кислота (5-Фтор-2,4-динітро-феніл)-оцтову кислоту 9b (10 г, 38,7 ммоль) розчиняли в 150 мл метанолу при перемішуванні при кімнатній температурі і потім до розчину додавали паладій на активованому вугіллі (5 %, 1,5 г). Реакційну суміш гідрували при 0,3 мПа водню. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. Згадану вище суміш двічі фільтрували і фільтрат концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (2,4-діаміно-5-фтор-феніл)-оцтову кислоту 9с (7,12 г) як коричневу тверду речовину, яку безпосередньо використовували в наступній реакції. Стадія 3 6-Аміно-5-фтор-індол-2-он (2,4-Діаміно-5-фтор-феніл)-оцтову кислоту 9с (7,12 г, 38,7 ммоль) розчиняли в 100 мл хлорводневої кислоти (1 М) при перемішуванні при кімнатній температурі і реакційний розчин нагрівали із зворотнім холодильником 1 годину. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. Реакційну суміш природно охолоджували до кімнатної температури, поміщали на баню лід-вода і по краплям для нейтралізації реакційного розчину додавали 100 мл розчину гідроксиду натрію (1М). Суміш екстрагували етилацетатом (125 мл 4). Об'єднані органічні екстракти промивали насиченим розсолом (100 мл), сушили над безводним сульфатом магнію, фільтрували і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку 5-фтор-6-аміно-1,3-дигідро-індол-2-он 9d (5,3 г, вихід 82,8 %) як жовту тверду речовину. МС m/z (ECI): 165,3[М-1] 18 UA 98797 C2 5 10 15 20 25 30 35 40 Стадія 4 Оцтової кислоти (5-фтор-2-оксо-2,3-дигідро-1Н-індол-6-ілкарбамоїл)-метиловий естер 5-Фтор-6-аміно-індол-2-он 9d (500 мг, 3,0 ммоль) розчиняли в 10 мл тетрагідрофурану при перемішуванні при кімнатній температурі і потім до розчину додавали 0,4 мл піридину. Після доброго перемішування, реакційну систему охолоджували до -40 °C на бані сухий лід-ацетон. Хлоркарбонілметиловий естер (420 мг, 3,0 ммоль) розчиняли в 10 мл тетрагідрофурану і розчин по краплям додавали до згаданої вище реакційної системи. Після завершення додавання, баню сухий лід-ацетон видаляли. Реакційну систему залишали нагріватись до кімнатної температури і перемішували протягом ночі за ТШХ, що показала відсутність вихідних матеріалів. Реакційну суміш фільтрували і фільтрувальний залишок тричі промивали водою одержуючи вказану в заголовку сполуку оцтової кислоти (5-фтор-2-оксо-2,3-дигідро-1Н-індол-6-ілкарбамоїл)метиловий естер 9е (562 мг, вихід 70,4 %) як сіру тверду речовину. МС: 265,3[М-1] Стадія 5 N-(5-Фтор-2-оксо-2,3-дигідро-1Н-індол-6-іл)-2-гідрокси-ацетамід Оцтової кислоти (5-фтор-2-оксо-2,3-дигідро-1Н-індол-6-ілкарбамоїл)-метиловий естер 9е (58 мг, 0,22 ммоль) розчиняли в 1 мл метанолу при перемішуванні при кімнатній температурі і потім до розчину додавали 1 мл води і гідроксид натрію (15 мг, 0,375 ммоль). Після завершення додавання, реакційну суміш перемішували протягом ще 1 години. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. Згадану вище суміш фільтрували, фільтрувальний залишок тричі промивали водою і сушили одержуючи вказану в заголовку сполуку N-(5-фтор-2оксо-2,3-дигідро-1Н-індол-6-іл)-2-гідрокси-ацетамід 9f (46 мг, вихід 93,8 %) як сіру тверду речовину. МС: 223,7[М-1] Стадія 6 (S,Z)-N-{5-Фтор-3-[5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро1Н-піроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3-дигідро-1Н-індол-6-іл}-2-гідрокси-ацетамід (S)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2с]піридин-2-карбальдегід 5f (40 мг, 0,125 ммоль) розчиняли в 2 мл етанолу при перемішуванні при кімнатній температурі і потім до розчину додавали N-(5-фтор-2-оксо-2,3-дигідро-1Н-індол-6іл)-2-гідрокси-ацетамід 9f (25,1 мг, 0,112 ммоль). Після завершення додавання, суміш перемішували до повного розчинення і потім до реакційного розчину додавали піперидин (50 мкл, 0,5 ммоль). Після завершення додавання, реакційну систему перемішували при 80 °C на масляній бані в темноті протягом 2 годин. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів, і масляну баню видаляли. Реакційну систему природно охолоджували до кімнатної температури для утворення осаду. Одержану тверду речовину фільтрували одержуючи вказану в заголовку сполуку (S, Z)-N-{5-фтор-3-[5-(2-гідрокси-3морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2-с]піридин-2-ілметилен]-2оксо-2,3-дигідро-1Н-індол-6-іл}-2-гідрокси-ацетамід 9 (51 мг, вихід 80 %) як жовту тверду речовину. MC m/z (ECI): 528,3[M+1] Приклад 10 (S,Z)-2-[5-Фтор-6-(4-фтор-бензиламіно)-2-оксо-1,2-дигідро-індол-3-іліденметил]-5-(2-гідрокси3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 45 Стадія 1 5-Фтор-6-(4-метил-бензиламіно)-1,3-дигідро-індол-2-он 19 UA 98797 C2 5 10 15 20 25 30 35 40 5-Фтор-6-Аміно-1,3-дигідро-індол-2-он 9d (2,26 г, 13,6 ммоль) розчиняли в 40 мл етанолу при перемішуванні при кімнатній температурі. Розчин охолоджували до 0 °C на бані лід-вода і потім до розчину додавали 4-фтор-бензальдегід (1,5 мл, 13,6 ммоль). Після завершення додавання, реакційну суміш перемішували при кімнатній температурі 1 годину і потім до суміші додавали боргідрид натрію (1,08 г, 28,5 ммоль). Реакційну суміш кип'ятили 18 годин. Реакційну суміш природно охолоджували до кімнатної температури і додавали льодяну воду для утворення осаду. Одержану тверду речовину фільтрували. Фільтрувальний залишок промивали водою (50 мл 3) і очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку 5-фтор-6-(4-метил-бензиламіно)-1,3-дигідро-індол-2-он 10а (1,67 г, 45 %) як білу тверду речовину. MC m/z (ECI): 275[M+1] Стадія 2 (S,Z)-2-[5-Фтор-6-(4-фтор-бензиламіно)-2-оксо-1,2-дигідро-індол-3-іліденметил]-5-(2-гідрокси3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он (S)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2с]піридин-2-карбальдегід 5f (40 мг, 0,125 ммоль) розчиняли в 2 мл етанолу при перемішуванні при кімнатній температурі і потім до розчину додавали 5-фтор-6-(4-метил-бензиламіно)-1,3дигідро-індол-2-он 10а (30,7 мг, 0,112 ммоль). Після завершення додавання, реакційну суміш перемішували до повного розчинення і потім до реакційного розчину додавали піперидин (0,05 мл, 0,5 ммоль). Після завершення додавання, реакційну суміш кип'ятили на масляній бані 2 години. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів, і реакційну суміш природно охолоджували до кімнатної температури, фільтрували при пониженому тиску одержуючи вказану в заголовку сполуку (S, Z)-2-[5-фтор-6-(4-фтор-6ензиламіно)-2-оксо-1,2дигідро-індол-3-іліденметил]-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідропіроло[3,2-с]піридин-4-он 10 (18 мг, 27,8 %) як сіру тверду речовину. MC m/z (ECI): 578,6[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,503(с, 1Н, пірол-NH), 10,557(с, 1Н, індол-NH), 7,584~7,614(д, 1Н, -АrН), 7,359~7,400(м, 2Н, -АrН), 7,359(с, 1Н, -СН=С), 7,140~7,184(т, 2Н, -АrН), 6,426(м, 1Н, NH), 6,039~6,057(д, 1Н, -АrН), 4,684~4,696(д, 1Н, -ОН), 4,346-4,361 (д, 2Н, -C=CCH2N), 3,893(м, 1Н, -СНО), 3,667-3,713(д, 2Н, шестичленне кільце внутрішній-CH2N), 3,596~3,627(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,564(т, 4Н, морфолін 2 -СН2О), 3,07~3,12(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 2,928~2,961 (т, 2Н, шестичленне кільце внутрішній-СН2), 2,468(с, 3Н, пірол-СН3), 2,417(м, 4Н, морфолін-СН2N, морфолін зовнішній-СН2N), 2,297(м, 2Н, морфолін-СН2N) Приклад 11 (S,Z)-N-{5-Фтор-3-[5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро1Н-піроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3-дигідро-1Н-індол-6-іл}-2-гідрокси-2-метилпропіонамід Стадія 1 20 UA 98797 C2 5 10 15 20 25 30 35 40 45 50 Оцтової кислоти 1-(5-фтор-2-оксо-2,3-дигідро-1Н-індол-6-ілкарбамоїл)-1-метил-етиловий естер 5-Фтор-6-аміно-індол-2-он 9d (410 мг, 2,47 ммоль) розчиняли в 10 мл тетрагідрофурану при перемішуванні при кімнатній температурі, розчин охолоджували до -45 °C в бані сухий лідацетон, і потім до розчину додавали 332 мкл піридину. 2-ацетоксиізобутирилхлорид (423 мг, 2,71 ммоль) розчиняли в 10 мл тетрагідрофурану і розчин потім по краплям додавали до згаданого вище реакційного розчину. Після завершення додавання, баню сухий лід-ацетон видаляли. Реакційну систему залишали нагріватись до кімнатної температури і перемішували протягом ночі. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. Реакційну суміш фільтрували і фільтрувальний залишок промивали водою і сушили одержуючи вказану в заголовку сполуку оцтової кислоти 1-(5-фтор-2-оксо-2,3-дигідро-1Н-індол-6ілкарбамоїл)-1-метил-етиловий естер 11а (792 мг) як білу тверду речовину, яку безпосередньо використовували на наступній стадії. MC m/z (ECI): 293,7[M-1] Стадія 2 N-(5-Фтор-2-оксо-2,3-дигідро-1Н-індол-6-іл)-2-гідрокси-2-метил-пропіонамід Оцтової кислоти 1-(5-фтор-2-оксо-2,3-дигідро-1Н-індол-6-ілкарбамоїл)-1-метил-етиловий естер 11а (2,035 мг, 6,9 ммоль) розчиняли в 20 мл метанолу при перемішуванні при кімнатній температурі і потім до розчину додавали 20 мл розчину гідроксиду натрію (0,7 М). Реакційний розчин перемішували протягом 4 годин. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів, і згаданий вище розчин нейтралізували хлор водневою кислотою (1М) і розчинник упарювали при пониженому тиску. Залишок очищали колонковою хроматографією на силікагелі і сушили одержуючи N-(5-фтор-2-оксо-2,3-дигідро-1Н-індол-6-іл)-2-гідрокси-2-метилпропіонамід 11b (900 мг, вихід 59,2 %) як білу тверду речовину. MC m/z (ECI): 253,6[M+1] Стадія 3 (S,Z)-N-{5-Фтор-3-[5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро1Н-піроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3-дигідро-1Н-індол-6-іл}-2-гідрокси-2-метилпропіонамід (S)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2с]піридин-2-карбальдегід 5f (40 мг, 0,125 ммоль), N-(5-фтор-2-оксо-2,3-дигідро-1Н-індол-6-іл)-2гідрокси-2-метил-пропіонамід 11b (28,3 мг, 0,112 ммоль) і піперидин (50 мкл, 0,5 ммоль) розчиняли в 2 мл етанолу при перемішуванні при кімнатній температурі. Реакційну систему перемішували при 80 °C на масляній бані в темноті протягом 2 годин. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів, і масляну баню видаляли. Реакційну систему природно охолоджували до кімнатної температури для утворення осаду. Одержану тверду речовину фільтрували одержуючи вказану в заголовку сполуку (S, Z)-N-{5-фтор-3-[5-(2-гідрокси3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2-с]піридин-2-ілметилен]2-оксо-2,3-дигідро-1Н-індол-6-іл}-2-гідрокси-2-метил-пропіонамід 11 (46 мг, 74 %) як жовту тверду речовину. MC m/z (ECI): 556,9[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,656(с, 1Н, пірол-NH), 10,951 (с, 1Н, індол-NH), 9,282(с, 1Н, NHCO), 7,873~7,901 (д, 1Н, -АrН), 7,778~7,794(м, 1Н, -АrН), 7,670(с, 1Н, -СН=С), 6,052(с, 1Н, ОНС(СН3)2), 4,698(д, 1Н, ОН), 3,893(м, 1Н, -СНО), 3,667~3,713(д, 2Н, шестичленне кільце внутрішній-СН2N), 3,596~3,627(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,557~3,578(т, 4Н, морфолін 2 -СН2О), 3,09~3,125(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 2,961~3,012(т, 2Н, шестичленне кільце внутрішній-СН2), 2,524(с, 3Н, пірол-СН3), 2,412~2,424(м, 4Н, морфолін-СН2N, морфолін зовнішній-СН2N), 2,297~2,308(м, 2Н, морфолін-СН2N), 1,376(с, 6Н, 2 -СН3) Приклад 12 (S,Z)-2-(7-Бром-5-фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 21 UA 98797 C2 5 10 15 20 25 30 35 Стадія 1 7-Бром-5-фтор-1,3-дигідро-індол-2-он 5-Фтор-1,3-дигідро-індол-2-он 12а (1,5 г, 0,01 ммоль) розчиняли в 15 мл ацетонітрилу при перемішуванні при кімнатній температурі і потім по краплям до розчину додавали Nбромсукцинімід (1,8 г, 0,01 ммоль). Після завершення додавання, реакційну суміш перемішували протягом ночі і утворювалось багато осаду. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів, і реакційну суміш фільтрували одержуючи 7-бром-5фтор-1,3-дигідро-індол-2-он 12b (2 г, 87 %) як сіру тверду речовину. MC m/z (ECI): 228,3[M-1] Стадія 2 (S,Z)-2-(7-Бром-5-фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он (S)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2с]піридин-2-карбальдегід 5f (40 мг, 0,125 ммоль) розчиняли в 2 мл етанолу при перемішуванні при кімнатній температурі і потім до розчину додавали 7-бром-5-фтор-1,3-дигідро-індол-2-он 12b (25,8 мг, 0,112 ммоль). Після завершення додавання, реакційну суміш перемішували до повного розчинення і потім до розчину додавали піперидин (0,05 мл, 0,5 ммоль). Після завершення додавання, реакційну суміш нагрівали із зворотнім холодильником на масляній бані 2 години. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів, і реакційну суміш природно охолоджували до кімнатної температури і фільтрували при пониженому тиску одержуючи вказану в заголовку сполуку (S, Z)-2-(7-бром-5-фтор-2-оксо-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2с]піридин-4-он 12 (45 мг, 75,4 %) як жовту тверду речовину. MC m/z (ECI): 533,6[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,689(с, 1Н, пірол-NH), 11,196(с, 1Н, індол-NH), 7,860~7,866(д, 1Н, -АrН), 7,784(с, 1Н, -СН=С), 7,232~7,260(м, 1Н, -АrН), 4,703~4,716(д, 1Н, -ОН), 3,896~2,909(м, 1Н, -СНО), 3,631 ~3,747(м, 3Н, шестичленне кільце внутрішній-СН2N, амід N шестичленне кільце зовнішній-СН2-), 3,555~3,578(т, 4Н, морфолін 2 -СН2О), 3,097~3,150(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,015~3,048(т, 2Н, шестичленне кільце внутрішній-СН2), 2,548(с, 3Н, пірол-СН3), 2,411~2,424(м, 4Н, морфолін-CH2N, морфолін зовнішній-СН2N), 2,291~2,307(м, 2Н, морфолін-СН2N) Приклад 13 (S,Z)-N-{5-Фтор-3-[5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро1Н-піроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3-дигідро-1Н-індол-6-іл}-2-метокси-ацетамід Стадія 1 22 UA 98797 C2 5 10 15 20 25 30 35 5-Фтор-6-метоксиацетамідо-2-оксоіндол 5-Фтор-6-Аміно-індол-2-он 9d (2,028 г, 12,2 ммоль) розчиняли в 30 мл тетрагідрофурану при перемішуванні при кімнатній температурі і потім до розчину додавали 1,3 мл піридину. Реакційну систему охолоджували до -50 °C на бані сухий лід-етанол. Метокси-ацетилхлорид (1,35 г, 12,5 ммоль) розчиняли в 20 мл тетрагідрофурану при перемішуванні і розчин потім додавали по краплям до згаданої вище реакційної системи. Після завершення додавання, баню сухий лід-етанол видаляли. Реакційну систему залишали нагріватись до кімнатної температури і перемішували протягом ночі за ТШХ, що показала відсутність вихідних матеріалів. Одержану тверду речовину фільтрували, промивали водою (10 мл 3) і перекристалізували з метанолу одержуючи вказану в заголовку сполуку 5-фтор-6-метоксиацетамідо-2-оксоіндол 13а (1,18 г, вихід 40,6 %) як сіру тверду речовину. МС m/z (ECI): 239,3[М+1] Стадія 2 (S,Z)-N-{5-Фтор-3-[5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро1Н-піроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3-дигідро-1Н-індол-6-іл}-2-метокси-ацетамід (S)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2с]піридин-2-карбальдегід 5f (40 мг, 0,125 ммоль) розчиняли в 2 мл етанолу при перемішуванні при кімнатній температурі і потім до розчину додавали 5-фтор-6-метоксиацетамідо-2-оксоіндол 13а (26,7 мг, 0,112 ммоль). Після завершення додавання, реакційну суміш перемішували до повного розчинення і потім до розчину додавали піперидин (0,05 мл, 0,5 ммоль). Після завершення додавання, реакційну суміш нагрівали із зворотнім холодильником на масляній бані 2 години. Реакція завершилась за ТШХ, що показала відсутність вихідних матеріалів. Реакційну суміш природно охолоджували до кімнатної температури, і фільтрували при пониженому тиску одержуючи вказану в заголовку сполуку (S, Z)-N-{5-фтор-3-[5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3дигідро-1Н-індол-6-іл}-2-метокси-ацетамід 13 (52 мг, вихід 85,8 %) як жовту тверду речовину. MC m/z (ECI): 542,2[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,666(с, 1Н, пірол-NH), 10,919(с, 1Н, індол-NH), 9,313(с, 1Н, NHCO), 7,841~7,869(д, 1Н, -АrН), 7,672(с, 1Н, -СН=С), 7,546~7,562(м, 1Н, -АrН), 4,703~4,716(д, 1Н, -ОН), 4,062(с, 2Н, -СН2О), 3,896~2,909(м, 1Н, -СНО), 3,652~3,720(м, 3Н, шестичленне кільце внутрішній-СН2N, амід N шестичленне кільце зовнішній-СН2-), 3,556~3,578(т, 4Н, морфолін 2 СН2О), 3,404(с, 3Н, -СН3О), 3,097~3,150(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 2,982~3,015(т, 2Н, шестичленне кільце внутрішній-СН2), 2,523(с, 3Н, пірол-СН3), 2,414~2,425(м, 4Н, морфолін-СН2N, морфолін зовнішній-СН2N), 2,291~2,307(м, 2Н, морфолін-СН2N) Приклад 14 (R,Z)-2-(7-Бром-5-фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 40 45 50 Вказану в заголовку сполуку одержували за тих же самих умов як описано на стадії 6 Прикладу 1 з (R)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 1f одержаного на стадії 5 Прикладу 1 і 7-бром-5-фтор-1,3дигідро-індол-2-ону 12b, як вихідних матеріалів, одержуючи (R, Z)-2-(7-6poм-5-фтор-2-оксо-1,2дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідропіроло[3,2-с]піридин-4-он 14 (20 мг, вихід 40 %) як жовту тверду речовину. МС m/z (ЕСІ): 533,6[М+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,691 (с, 1Н, пірол-NH), 11,204(с, 1Н, індол-NH), 7,874~7,851 (д, 1Н, -АrН), 7,797(с, 1Н, -СН=С), 7,269~7,243(м, 1Н, -АrН), 4,710~4,698(д, 1Н, -ОН), 3,900~3,890(м, 1Н, -СНО), 3,759-3,611(м, 3Н, шестичленне кільце внутрішній-СН2N, амід N шестичленне кільце зовнішній-СН2-), 3,572~3,550(т, 4Н, морфолін 2 -СН2О), 3,148~3,095(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,047~3,014(т, 2Н, шестичленне кільце внутрішній 23 UA 98797 C2 5 10 15 20 25 СН2), 2,548(с, 3Н, пірол-СН3), 2,418~2,323(м, 4Н, морфолін-CH2N, морфолін зовнішній-СН2N), 2,302~2,285(м, 2Н, морфолін-СН2N) Приклад 15 (R,Z)-2-[5-Фтор-6-(4-фтор-бензиламіно)-2-оксо-1,2-дигідро-індол-3-іліденметил]-5-(2гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он Вказану в заголовку сполуку одержували за тих же самих умов як описано на стадії 6 Прикладу 1 з (R)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 1f, одержаного на стадії 5 Прикладу 1, і 5-фтор-6-(4-метилбензиламіно)-1,3-дигідро-індол-2-ону 10а, як вихідних матеріалів, одержуючи (R, Z)-2-[5-фтор-6(4-фтор-бензиламіно)-2-оксо-1,2-дигідро-індол-3-іліденметил]-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 15 (53 мг, вихід 65,6 %) як темночервону тверду речовину. MC m/z (ECI): 578,7[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,504(с, 1Н, пірол-NH), 10,558(с, 1Н, індол-NH), 7,614~7,585(д, 1Н, -АrН), 7,400~7,379(м, 2Н, -АrН), 7,359(с, 1Н, -СН=С), 7,140~7,191(т, 2Н, -АrН), 6,431 (м, 1Н, NH), 6,058~6,040(д, 1Н, -АrН), 4,698~4,686(д, 1Н, -ОН), 4,346~4,361 (д, 2Н, -C=CCH2N), 3,894(м, 1Н, -СНО), 3,731~3,668(д, 2Н, шестичленне кільце внутрішній-CH2N), 3,644~3,612(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,596~3,553(т, 4Н, морфолін 2 -СН2О), 3,135~3,082(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 2,928~2,961 (т, 2Н, шестичленне кільце внутрішнійСН2), 2,468(с, 3Н, пірол-СН3), 2,419~2,408(м, 4Н, мopфoлiн-CH2N, морфолін зовнішній-СН2N), 2,299~2,289(м, 2Н, мopфoлiн-CH2N) Приклад 16 (R,Z)-N-{5-Фтор-3-[5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро1Н-піроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3-дигідро-1Н-індол-6-іл}-2-метокси-ацетамід 30 35 40 Вказану в заголовку сполуку одержували за тих же самих умов як описано на стадії 6 Прикладу 1 з (R)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 1f, одержаного на стадії 5 Прикладу 1, і 5-фтор-6метоксиацетамідо-2-оксоіндолу 13а, як вихідних матеріалів, одержуючи (R, Z)-N-{5-фтор-3-[5-(2гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Н-піроло[3,2-с]піридин-2ілметилен]-2-оксо-2,3-дигідро-1Н-індол-6-іл}-2-метокси-ацетамід 16 (60 мг, вихід 87 %) як жовту тверду речовину. MC m/z (ECI): 543,0[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,668(с, 1Н, пірол-NH), 10,923(с, 1Н, індол-NH), 9,320(с, 1Н, NHCO), 7,875~7,847(д, 1Н, -АrН), 7,678(с, 1Н, -СН=С), 7,562~7,546(м, 1Н, -АrН), 4,711~4,699(д, 1Н, -ОН), 4,063(с, 2Н, -СН2О), 3,729~3,653(м, 3Н, шестичленне кільце внутрішній-СН2N, амід N шестичленне кільце зовнішній-СН2-), 3,579~3,556(т, 4Н, морфолін 2 -СН2О), 3,404(с, 3Н, СН3О), 2,983~3,017(т, 2Н, шестичленне кільце внутрішній-СН2), 2,525(с, 3Н, пірол-СН3), 2,4122,424(м, 4Н, морфолін-СН2N, морфолін зовнішній-СН2N), 2,289~2,306(м, 2Н, морфолін-СН2N) 24 UA 98797 C2 Приклад 17 (R,Z)-N-{5-Фтор-3-[5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро1Н-піроло[3,2-с]піридин-2-ілметилен]-2-оксо-2,3-дигідро-1Н-індол-6-іл}-2-гідрокси-2-метилпропіонамід 5 10 15 20 25 30 35 40 Вказану в заголовку сполуку одержували за тих же самих умов як описано на стадії 6 Прикладу 1 з (R)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 1f, одержаного на стадії 5 Прикладу 1, і N-(5-фтор-2-оксо2,3-дигідро-1Н-індол-6-іл)-2-гідрокси-2-метил-пропіонаміду 11b, як вихідних матеріалів одержуючи (R, Z)-N-{5-фтор-3-[5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7тетрагідро-1Н-піроло[3,2-c]-сіпіридин-2-ілметилен]-2-оксо-2,3-дигідро-1H-індол-6-іл}-2-гідрокси2-метил-пропіонамід 17 (71 мг, вихід 82 %) як жовту тверду речовину. MC m/z (ECI): 556,2[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,658(с, 1Н, пірол-NH), 10,954(с, 1Н, індол-NH), 9,289(с, 1Н, NHCO), 7,875~7,903(д, 1Н, -АrН), 7,796~7,780(м, 1Н, -АrН), 7,672(с, 1Н, -СН=С), 6,055(с, 1Н, ОНС(СН3)2), 4,701(д, 1Н, ОН), 3,722(м, 1Н, -СНО), 3,655~3,691 (д, 2Н, шестичленне кільце внутрішній-СH2N), 3,639(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,559~3,580(т, 4Н, морфолін 2 -СН2О), 2,986~3,019(т, 2Н, шестичленне кільце внутрішній-СН2), 2,526(с, 3Н, піролСН3), 2,415~2,425(м, 4Н, морфолін-СН2N, морфолін зовнішній-СН2N), 2,299~2,309(м, 2Н, морфолін-СН2N), 1,378(с, 6Н, 2 -СН3) Приклад 18 (R,Z)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-3-метил-2-(2-оксо-4-піридин-4-іл-1,2-дигідроіндол-3-іліденметил)-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он Вказану в заголовку сполуку одержували за тих же самих умов, як описано на стадії 6 Прикладу 1 з (R)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 1f, одержаного на стадії 5 Прикладу 1, і 4-піридин-4-іл-1,3дигідро-індол-2-ону, як вихідних матеріалів, одержуючи (R, Z)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-2-(2-оксо-4-піридин-4-іл-1,2-дигідро-індол-3-іліденметил)-1,5,6,7-тетрагідропіроло[3,2-с]піридин-4-он 18 (58 мг, вихід 72,5 %) як жовту тверду речовину. МС m/z (ECI): 514,2[М+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,573(с, 1Н, пірол-NH), 11,149(с, 1Н, індол-NH), 7,742~7,770(д, 2Н, піридин N-CH=), 7,500-7,513(д, 2Н, піридин -СН=), 7,226~7,265(т, 1Н, -АrН), 6,976~6,995(т, 1Н, -АrН), 6,813~6,834(д, 2Н, -СН=С, -АrН), 4,666~4,677(д, 1Н, -ОН), 3,854(м, 1Н, -СНО), 3,541~3,688(м, 7Н, шестичленне кільце внутрішній-СН2N, амід N шестичленне кільце зовнішнійСН2, морфолін 2 -СН2О), 3,063~3,115(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 2,946~2,979(т, 2Н, шестичленне кільце внутрішній-СН2), 2,394(м, 4Н, морфолін-СН2N, морфолін зовнішній-СН2N), 2,264~2,278(д, 2Н, морфолін-CH2N), 1,810-1,822(с, 3Н, пірол-СН3) Приклад 19 25 UA 98797 C2 (S,Z)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-2-(5-метокси-2-оксо-1,2-дигідро-індол-3іліденметил)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 5 10 15 20 Вказану в заголовку сполуку одержували за тих же самих умов, як описано на стадії 6 Прикладу 5 з (S)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 5f, одержаного на стадії 5 Прикладу 5, і 5-метокси-1,3дигідро-індол-2-ону, як вихідних матеріалів, одержуючи (S, Z)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-2-(5-метокси-2-оксо-1,2-дигідро-індол-3-іліденметил)-3-метил-1,5,6,7-тетрагідропіроло[3,2-с]піридин-4-ону 19 (40 мг, вихід 76,6 %) як червону тверду речовину. MC m/z (ECI): 467,2[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,846(с, 1Н, пірол-NH), 10,742(с, 1Н, індол-NH), 7,696(с, 1Н, СН=С), 7,490~7,495(м, 1Н, -АrН), 6,728~6,792(м, 2Н, -АrН), 4,699~4,711(д, 1Н, -ОН), 3,896~3,909(м, 1Н, -СНО), 3,783(с, 3Н, -СН3О), 3,689~3,732(м, 2Н, шестичленне кільце внутрішній-СН2N), 3,654(м, 1Н, амід N шестичленне кільце зовнішній-СН2), 3,558~3,580(т, 4Н, морфолін 2 -СН2О), 3,097~3,150(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 2,978~3,011(т, 2Н, шестичленне кільце внутрішній-СН2), 2,543(с, 3Н, пірол-СН3), 2,414~2,425(м, 4Н, морфолін-СН2N, морфолін зовнішній-СН2N), 2,299~2,308(м, 2Н, морфолін-СН2N) Приклад 20 (S,Z)-2-[4-(2,6-Дифтор-феніл)-2-оксо-1,2-дигідро-індол-3-іліденметил]-5-(2-гідрокси-3морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 25 30 35 40 Вказану в заголовку сполуку одержували за тих же самих умов, як описано на стадії 6 Прикладу 5 з (S)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 5f, одержаного на стадії 5 Прикладу 5, і 4-(2,6-дифторфеніл)-1,3-дигідро-індол-2-ону, як вихідних матеріалів, одержуючи (S, Z)-2-[4-(2,6-дифторфеніл)-2-оксо-1,2-дигідро-індол-3-іліденметил]-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 20 (52 мг, вихід 84,7 %) як жовту тверду речовину. MC m/z (ECI): 549,3[М+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,604(с, 1Н, пірол-NH), 11,171(с, 1Н, індол-NH), 7,646~7,666(м, 1Н, -АrН), 7,338~7,380(м, 2Н, -АrН), 7,244~7,282(м, 1Н, -АrН), 7,008~7,027(м, 1Н, -АrН), 6,900~6,919(м, 1Н, -АrН), 6,657(с, 1Н, -СН=С), 4,672~4,683(д, 1Н, -ОН), 3,855~3,868(м, 1Н, СНО), 3,541~3,673(м, 7Н, шестичленне кільце внутрішній-СH2N, амід N шестичленне кільце зовнішній-СН2, морфолін 2 -СН2О), 3,077~3,130(к, 1Н, амід N шестичленне кільце зовнішнійСН2-), 2,955~2,988(т, 2Н, шестичленне кільце внутрішній-СН2), 2,394(м, 4Н, морфолін-СН2N, морфолін зовнішній-СН2N), 2,266~2,280(м, 2Н, морфолін-СН2N), 1,856(с, 3Н, пірол-СН3) Приклад 21 (S,Z)-5-(2-Гідрокси-3-морфолін-4-іл-пропіл)-2-[5-(4-метокси-феніл)-2-оксо-1,2-дигідро-індол3-іліденметил]-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 26 UA 98797 C2 5 10 15 20 25 30 35 40 Вказану в заголовку сполуку одержували за тих же самих умов, як описано на стадії 6 Прикладу 5 з (S)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 5f, одержаного на стадії 5 Прикладу 5, і 5-(4-метоксифеніл)-1,3-дигідро-індол-2-ону, як вихідних матеріалів, одержуючи (S, Z)-5-(2-гідрокси-3морфолін-4-іл-пропіл)-2-[5-(4-метокси-феніл)-2-оксо-1,2-дигідро-індол-3-іліденметил]-3-метил1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 21 (53 мг, вихід 87,2 %) як жовту тверду речовину. MC m/z (ECI): 543,3[M+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,708(с, 1Н, пірол-NH), 11,004(с, 1Н, індол-NH), 7,321 ~7,852(м, 1Н, -АrН), 7,673(с, 1Н, -СН=С), 7,582~7,604(м, 2Н, -АrН), 7,254-7,277(м, 1Н, -АrН), 7,070(м, 1Н, -АrН), 7,016~7,038(д, 2Н, -АrН), 4,704~4,716(д, 1Н, -ОН), 3,855~3,868(м, 1Н, -СНО), 3,806(с, 3Н, -СН3О), 3,659~3,728(м, 3Н, шестичленне кільце внутрішній-СН2N, амід N шестичленне кільце зовнішній-СН2), 3,559~3,581 (т, 4Н, морфолін 2 -СН2О), 3,077~3,130(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 2,990~3,024(т, 2Н, шестичленне кільце внутрішнійСН2), 2,539(с, 3Н, пірол-СН3), 2,415~2,427(м, 4Н, морфолін-CH2N, морфолін зовнішній-СН2N), 2,294~2,311(м, 2Н, морфолін-СН2N) Приклад 22 (S,Z)-2-(4-Бром-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он Вказану в заголовку сполуку одержували за тих же самих умов, як описано на стадії 6 Прикладу 5 з (S)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-4-оксо-4,5,6,7-тетрагідро-1Нпіроло[3,2-с]піридин-2-карбальдегіду 5f, одержаного на стадії 5 Прикладу 5, і 4-бром-1,3-дигідроіндол-2-ону, як вихідних матеріалів, одержуючи (S, Z)-2-(4-6poм-2-oкco-1,2-дигідро-індол-3іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2с]піридин-4-он 22 (43 мг, вихід 74,5 %) як жовту тверду речовину. МС m/z (ECI): 515,2[М+1] 1 Н ЯМР (400МГц, ДМСО-d6): 13,670(с, 1Н, пірол-NH), 11,189(с, 1Н, індол-NH), 8,562(с, 1Н, СН=С), 7,201~7,221(м, 1Н, -АrН), 7,042-7,081 (м, 1Н, -АrН), 6,920-6,938(м, 1Н, -АrН), 4,709~4,721 (д, 1Н, -ОН), 3,902~3,915(м, 1Н, -СНО), 3,631~3,745(м, 3Н, шестичленне кільце внутрішній-СН2N, амід N шестичленне кільце зовнішній-СН2), 3,558~3,580(т, 4Н, морфолін 2 -СН2О), 3,090~3,143(к, 1Н, амід N шестичленне кільце зовнішній-СН2-), 3,011~3,035(т, 2Н, шестичленне кільце внутрішній-СН2), 2,479(с, 3Н, пірол-СН3), 2,413~2,426(м, 4Н, морфолін-СН2N, морфолін зовнішній-СН2N), 2,293~2,311(м, 2Н, морфолін-СН2N) Приклад 23 (R,Z)-2-(5-Фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-ону мале ат 27 UA 98797 C2 5 10 15 (R,Z)-2-(5-Фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-он 1 (709 мг, 1,562 ммоль) і цисбутендіонову кислоту (217 мг, 1,874 ммоль) розчиняли в 150 мл метанолу при перемішуванні при кімнатній температурі. Після доброго перемішування, реакційну суміш нагрівали при 40 °C на масляній бані 20 хвилин і фільтрували при пониженому тиску. Фільтрат концентрували при пониженому тиску і потім до залишку додавали 50 мл ацетонітрилу. Після завершення додавання, суміш нагрівали із зворотнім холодильником 20 хвилин. Реакційну суміш охолоджували до кімнатної температури і фільтрували при пониженому тиску одержуючи вказану в заголовку сполуку (R, Z)-2-(5-фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-ону малеат 23 (811 мг, вихід 91,1 %) як жовту тверду речовину. MC m/z (ECI): 455,2[M+1] Приклад 24 (R,Z)-2-(5-Фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-ілпропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-ону малат 20 25 30 35 40 2-Гідрокси-бурштинову кислоту (231 мг, 1,72 ммоль) розчиняли в 100 мл метанолу при перемішуванні при кімнатній температурі і потім до розчину порціями додавали (R, Z)-2-(5-фтор2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3-морфолін-4-іл-пропіл)-3-метил-1,5,6,7тетрагідро-піроло[3,2-с]піридин-4-он 1 (560 мг, 1,233 ммоль) в 200 мл метанолу і 100 мл води. Після завершення додавання, реакційну систему нагрівали при 50 °C на масляній бані в темноті до утворення прозорого розчину. Реакційну суміш фільтрували і фільтрат концентрували при пониженому тиску до видалення розчинника одержуючи жовту тверду речовину. Одержану тверду речовину розчиняли в 100 мл ацетонітрилу і суміш нагрівали із зворотнім холодильником в темноті протягом 1,5 годин. Масляну баню видаляли. Реакційну систему природно охолоджували до кімнатної температури і фільтрували одержуючи вказану в заголовку сполуку (R, Z)-2-(5-фтор-2-оксо-1,2-дигідро-індол-3-іліденметил)-5-(2-гідрокси-3морфолін-4-іл-пропіл)-3-метил-1,5,6,7-тетрагідро-піроло[3,2-с]піридин-4-ону малат 24 (718 мг, вихід 99 %) як жовту тверду речовину. MC m/z (ECI): 455,2[M+1] БІОЛОГІЧНІ ДОСЛІДЖЕННЯ ПРИКЛАД 1: Дослідження інгібування клітинної проліферації Наступні in vitro дослідження можуть бути використані для визначення рівня активності і дії різних сполук цього винаходу за допомогою експерименту по інгібуванню проліферації (клітинна токсичність) в HUVEC клітинах людини, які сильно експресують VEGFR. Клітинні дослідження, описані тут, призначені для дослідження анти-ангіогенезу та інгібувальної активності щодо проліферації і впливу сполук через VEGFR на ракові клітини in vitro. Дія та активність представлені значеннями ІС50, при яких відбувається знищення ракових 28
ДивитисяДодаткова інформація
Назва патенту англійською2-(2-oxoindoline-3-ylidene)methyl-5-(2-hydroxy-3-morpholin-4-yl-propyl)-6,7-dihydro -1h-pyrrol[3,2-c]pyridine-4(5h)-one compounds and use as protein kinase inhibitors
Автори англійськоюTang, Peng Cho, Yang, Jialiang, Su, Yidong, Zhao, Fuqiang
Назва патенту російською2-(2-оксоиндолин-3-илиден)метил-5-(2-гидрокси-3-морфолин-4-илпропил)-6,7-дигидро-1н-пирол[3,2-с]пиридин-4(5н)-оны и их применение в качестве ингибиторов протеинкиназы
Автори російськоюТанг Пенг Чо, Янг Джялянг, Су Идонг, Жао Фуквянг
МПК / Мітки
МПК: A61P 33/00, C07D 209/30, C07D 209/04, A61K 31/437, C07D 417/04
Мітки: застосування, 2-(2-оксоіндолін-3-іліден)метил-5-(2-гідрокси-3-морфолін-4-ілпропіл)-6,7-дигідро-1н-пірол[3,2-с]піридин-4(5н)-они, інгібіторів, протеїнкінази
Код посилання
<a href="https://ua.patents.su/42-98797-2-2-oksoindolin-3-ilidenmetil-5-2-gidroksi-3-morfolin-4-ilpropil-67-digidro-1n-pirol32-spiridin-45n-oni-i-kh-zastosuvannya-yak-ingibitoriv-protenkinazi.html" target="_blank" rel="follow" title="База патентів України">2-(2-оксоіндолін-3-іліден)метил-5-(2-гідрокси-3-морфолін-4-ілпропіл)-6,7-дигідро-1н-пірол[3,2-с]піридин-4(5н)-они і їх застосування як інгібіторів протеїнкінази</a>
Попередній патент: Система фіксації, яка призначена для фіксації користувача на засобі пересування по воді, і засіб пересування по воді з системою фіксації
Наступний патент: Гарячекатаний сталевий лист або деталь, спосіб їх виготовлення та застосування, зварене з’єднання із сталевого листа або деталі