Заміщені дигідропіразолони як інгібітори нif-проліл-4-гідроксилази
Номер патенту: 105487
Опубліковано: 26.05.2014
Автори: Єске Маріо, Штолль Фрідеріке, Фламме Інго, Акбаба Метін, Бекк Хартмут
Формула / Реферат
1. Сполука формули
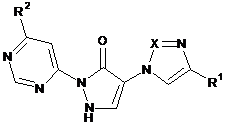 , (I)
, (I)
де
X означає N або СН,
R1 означає водень або ціано,
R2 означає насичений 4-7-членний гетероцикліл, приєднаний через атом азоту, що містить від 1 до 2 гетероатомів, вибраних із групи, що складається з N та О,
де гетероцикліл заміщений одним замісником, вибраним з групи, що складається з С3-С6-циклоалкілу,
або
де гетероцикліл може бути заміщений 1-4 атомами фтору,
або одна з її фармацевтично прийнятних солей.
2. Сполука за п. 1, яка відрізняється тим, що
X означає N або СН,
R1 означає водень або ціано,
R2 означає насичений 4-7-членний гетероцикліл, приєднаний через атом азоту, що містить від 1 до 2 гетероатомів, вибраних із групи, що складається з N та О,
де гетероцикліл заміщений 1-4 атомами фтору,
або
R2 означає піперазин-1-іл,
де піперазин-1-іл заміщений одним замісником, вибраним з групи, що складається з С3-С6-циклоалкілу,
або
R2 означає азетидин-1-іл,
де азетидин-1-іл заміщений одним замісником, вибраним з групи, що складається з С3-С6-циклоалкілу,
або одна з її фармацевтично прийнятних солей.
3. Сполука за п. 1 або 2, яка відрізняється тим, що
X означає N або СН,
R1 означає водень або ціано,
R2 означає азетидин-1-іл, піролін-1-іл або піперидин-1-іл,
де азетидин-1-іл, піролін-1-іл та піперидин-1-іл заміщені 1-4 атомами фтору,
або
R2 означає піперазин-1-іл,
де піперазин-1-іл у 4-положенні заміщений одним замісником, вибраним з групи, що складається з С3-С6-циклоалкілу,
або одна з її фармацевтично прийнятних солей.
4. Сполука за п. 1, яка відрізняється тим, що
X означає N або СН,
R1 означає водень або ціано,
R2 означає піперазин-1-іл,
де піперазин-1-іл заміщений одним замісником, де замісник вибирають з групи, що складається з С3-С6-циклоалкілу,
або одна з її фармацевтично прийнятних солей.
5. Сполука за п. 4, яка відрізняється тим, що
X означає N або СН,
R1 означає водень або ціано,
R2 означає піперазин-1-іл,
де піперазин-1-іл у 4-положенні заміщений одним замісником, де замісник вибирають з групи, що складається з С3-С6-циклоалкілу,
або одна з її фармацевтично прийнятних солей.
6. Сполука за п. 1, яка відрізняється тим, що
X означає N або СН,
R1 означає водень або ціано,
R2 означає азетидин-1-іл,
де азетидин-1-іл заміщений одним замісником, вибраним з групи, що складається з С3-С6-циклоалкілу,
або одна з її фармацевтично прийнятних солей.
7. Сполука за п. 1, яка відрізняється тим, що
R2 означає 4-циклобутилпіперазин-1-іл.
8. 1-{2-[6-(4-Циклобутилпіперазин-1-іл)піримідин-4-іл]-3-оксо-2,3-дигідро-1Н-піразол-4-іл}-1Н-імідазол-4-карбонітрил за п. 1, що має формулу
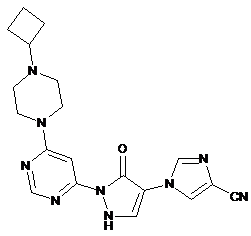 ,
,
та його фармацевтично прийнятні солі.
9. 1-{2-[6-(4-Циклобутилпіперазин-1-іл)піримідин-4-іл]-3-оксо-2,3-дигідро-1Н-піразол-4-іл}-1Н-імідазол-4-карбонітрил за п. 1, що має формулу
 .
.
10. 2-[6-(4-Циклобутилпіперазин-1-іл)піримідин-4-іл]-4-(1Н-1,2,3-триазол-1-іл)-1,2-дигідро-3H-піразол-3-он за п. 1, що має формулу
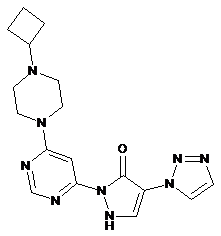 ,
,
або одна із його фармацевтично прийнятних солей.
11. 2-[6-(4-Циклобутилпіперазин-1-іл)піримідин-4-іл]-4-(1Н-1,2,3-триазол-1-іл)-1,2-дигідро-3H-піразол-3-он за п. 10, що має формулу
 .
.
12. Сполука формули (І)
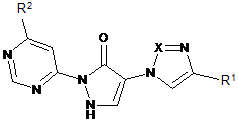 ,
,
в якій залишки Х, R1 та R2 мають вказані в одному із пунктів 1-11 значення і яка має властивості селективних інгібіторів HIF-проліл-4-гідроксилази, для лікування та/або профілактики хвороб, опосередкованих активністю HIF-проліл-4-гідроксилази.
13. Сполука формули (І)
 ,
,
в якій залишки Х, R1 та R2 мають вказані в одному із пунктів 1-11 значення, для отримання лікарського засобу, придатного для застосування в способі лікування та/або профілактики серцево-судинних захворювань, серцевої недостатності, анемії, хронічних захворювань нирок та ниркової недостатності.
14. Спосіб одержання сполуки формули (І) або однієї з її фармацевтично прийнятних солей за п. 1, який відрізняється тим, що сполуку формули
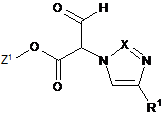 , (II)
, (II)
в якій R1 має значення, вказане в п. 1, та
Z1 означає метил або етил,
в інертному розчиннику, у разі потреби, в присутності кислоти шляхом взаємодії зі сполукою формули
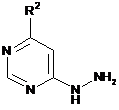 , (III)
, (III)
в якій R2 має значення, вказане в п. 1, перетворюють на
сполуку формули
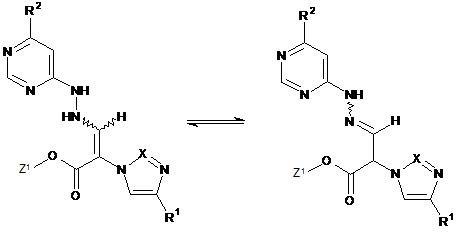 , (IV)
, (IV)
в якій Z1, R1 та R2 мають вказані в п. 1 значення,
яку вже при цих умовах реакції або у наступній реакції під дією основи перетворюють на циклічну сполуку формули (І),
та сполуку формули (І), у разі потреби, за допомогою відповідного (і) розчинника та/або (іі) основи або кислоти перетворюють на одну з її солей.
15. Спосіб одержання сполуки формули (І) або однієї з її фармацевтично прийнятних солей за п. 1, який відрізняється тим, що сполуку формули
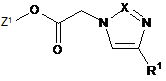 , (V)
, (V)
в якій Z1 та R1 мають вказані в п. 1 значення,
конденсують зі сполукою формули
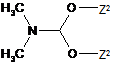 , (VI)
, (VI)
в якій
Z2 означає метил або етил,
з отриманням сполуки формули
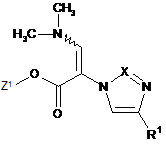 , (VII)
, (VII)
в якій Z1 та R1 мають вказані в п. 1 значення,
та потім в присутності однієї з кислот зі сполукою формули (III) перетворюють на сполуку формули (IV), яку вже при цих умовах реакції або у наступній реакції під дією основи перетворюють на циклічну сполуку формули (І),
та сполуку формули (І), у разі потреби, за допомогою відповідного (і) розчинника та/або (іі) основи або кислоти перетворюють на одну з її солей.
16. Лікарський засіб, що має властивості селективних інгібіторів HIF-проліл-4-гідроксилази і містить сполуку за будь-яким з пп. 1-11 в ефективній кількості у комбінації з інертним, нетоксичним, фармацевтично прийнятним допоміжним агентом.
17. Лікарський засіб за п. 16 у комбінації з однією або кількома іншими активними сполуками, вибраними з групи, що включає АКФ-інгібітори, антагоністи рецептора ангіотензину AII, блокатори бета-рецептора, антагоністи кальцію, інгібітори ФДЕ, антагоністи мінералокортикоїдного рецептора, діуретики, аспірин, добавки заліза, вітаміну В12 і фолієвої кислоти, статини, похідні дигоксину Digitalis, протипухлинні хіміотерапевтичні засоби та антибіотики.
18. Лікарський засіб за п. 16 або 17 для лікування та/або профілактики серцево-судинних захворювань, серцевої недостатності, анемії, хронічних захворювань нирок та ниркової недостатності.
Текст
Реферат: Дана заявка стосується заміщених похідних дигідропіразолону, способу їх одержання, їх застосування для лікування та/або профілактики захворювань, а також їх застосування для одержання лікарських засобів для лікування та/або профілактики захворювань, зокрема серцево-судинних та гематологічних захворювань, захворювань нирок, а також для сприяння загоєнню ран. 2 R O N N N N H X N N 1 R UA 105487 C2 (12) UA 105487 C2 UA 105487 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дана заявка стосується нових заміщених похідних дигідропіразолону, способу їх одержання, їх застосування для лікування та/або профілактики захворювань, а також їх застосування для одержання лікарських засобів для лікування та/або профілактики захворювань, зокрема серцево-судинних та гематологічних захворювань, захворювань нирок, а також для сприяння загоєнню ран. Недостатнє забезпечення організму людини або його частин киснем, тривалість та/або об'єм якого негативно впливають на регулярні функції організму або його частин або повністю паралізують ці функції, називають гіпоксією. Гіпоксія може бути спричинена зменшенням кількості доступного кисню у повітрі, що вдихається (наприклад, при перебуванні на висоті), порушеннями зовнішнього дихання (наприклад, внаслідок порушеної роботи легенів або закупорки дихальних шляхів), зменшенням хвилинного об'єму серця (наприклад, у випадку серцевої недостатності, перевантаження правого шлуночка серця при емболії легеневої артерії), дуже обмеженою киснево-транспортною функцією крові (наприклад, у результаті недокрів'я (анемії) або інтоксикації, наприклад, моноксидом вуглецю), локально зменшеним кропостачанням у результаті закупорки судин (ішемічні хвороби зазвичай, наприклад, серця, нижніх кінцівок або мозку, діабетична макро- та мікроангіопатія) або також підвищеною потребою тканини у кисні (наприклад, у результаті активною м'язової роботи або місцевих запалень) [Eder, Gedigk (видав.), Allgemeine Pathologie und pathologische Anatomie, 33 видання, Springer Verlag, Berlin, 1990]. Організм людини умовно здатний швидко та хронічно пристосовуватися до ситуації зменшення постачання киснем. Поряд із миттєвою реакцією, яка включає зокрема збільшення хвилинного об'єму серця та хвилинного об'єму дихання за допомогою контрольних механізмів вегетативної нервової системи, а також локальне розширення кровоносних судин, гіпоксія спричиняє зміну транскрипції численних генів. При цьому функція генних продуктів компенсує недостатність кисню. Спостерігається збільшення експресії багатьох ферментів гліколізу та транспортерів глюкози 1, в результаті чого підвищується анаеробне одержання АТФ і вдається пережити недостатність кисню [Schmidt, Thews (видавн.), Physiologie des Menschen, 27 видання, Springer Verlag, Berlin, 1997; Löffler, Petrides (видавн.), Biochemie und Pathobiochemie, 7 видання, Springer Verlag, Berlin, 2003]. Крім того гіпоксія спричиняє збільшення експресії фактора росту ендотелію судин, VEGF, що викликає новоутворення кровоносних судин у гіпоксичних тканинах (ангіогенез). В результаті цього кровопостачання ішемічних тканин на тривалий час покращується. У випадку різних серцево-судинних захворювань та захворювань, спричинених закупоркою судин, така регуляторна функція є недостатньою [див. Simons und Ware, Therapeutic angiogenesis in cardiovascular disease, Nat. Rev. Drug. Discov. 2 (11), 863-71 (2003)]. Крім того у випадку системної гіпоксії спостерігається збільшення експресії пептидного гормону еритропоетину, утвореного переважно в інтерстиціальних фібробластах нирок. Таким чином стимулюється утворення червоних клітин крові у кісному мозку та киснево-транспортна функція крові покращується. Цей ефект використовували і до цього часу використовують спортсмени у так званих висотних тренуваннях. Погіршення киснево-транспортної функції крові, наприклад, у результаті постгеморрагічної анемії зазвичай викликає збільшення вироблення еритропоетину у нирках. При певних формах анемії цей регуляторний механізм може бути порушений або його задані значення є нижчими. Так, наприклад, у випадку пацієнтів, що страждають на ниркову недостатність, еритропоетин виробляється у паренхімі нирок, однак з огляду на киснево-транспортну функцію крові у дуже незначних кількостях, що спричиняє так звану ниркову анемію. Ниркову анемію зокрема, а також анемії, обумовлені пухлинами і ВІЛінфекціями, зазвичай лікують шляхом парентерального введення рекомбінантного еритропоетину людини (rhEPO). На даний момент не існує альтернативи такому дорогому лікуванню за умови перорального введення лікарського засобу [див. Eckardt, The potential of erythropoietin and related strategies to stimulate erythropoiesis, Curr. Opin. Investig.Drugs 2(8), 1081-5 (2001); Berns, Should the target hemoglobin for patients with chronic kidney disease treated with erythropoietic replacement therapy be changed?, Semin. Dial. 18 (1), 22-9 (2005).]. Більш пізні дослідження підтверджують, що еритропоетин поряд зі своєю регулятивною дією по відношенню еритропоезу проявляє також незалежну від цього захисну (антиапоптотичну) дію по відношенню до гіпоксичних тканин, зокрема серця та мозку. Крім того, як показали останні дослідження, лікування еритропоетином зменшує ступінь тяжкості захворювань у пацієнтів, що страждають на серцеву недостатність [див. Caiola und Cheng, Use of erythropoietin in heart failure management, Ann. Pharmacother. 38 (12), 2145-9 (2004); Katz, Mechanisms and treatment of anemia in chronic heart failure, Congest. Heart. Fail. 10 (5), 243-7 (2004)]. Спільною рисою описаних вище індукованих гіпоксією генів є те, що збільшення їх експресії 1 UA 105487 C2 5 10 15 20 25 30 35 40 45 50 55 60 при гіпоксії викликане так званим індукованим при гіпоксії фактором (HIF). Під HIF розуміють гетеродимерний фактор, який складається із альфа- і бета-субодиниць. Описані три HIF-альфаізоформи, серед яких HIF-1 альфа і HIF-2 альфа є гомологічними та відіграють особливу роль у випадку індукованої гіпоксією генної експресії. В той час як експресія бета-субодиниця (описана 2 ізоформами), яку також називають ARNT (aryl hydrocarbon receptor nuclear translocator транслокатор арилгідрокарбонового ядерного рецептора) є основною, експресія альфасубодиниць залежить від вмісту кисню в клітині. При нормоксії відбувається поліубіквітинація HIF-альфа-білка, після чого білок розкладається протеасомально. При гіпоксії це розкладення уповільнюється, так що HIF-альфа може димеризуватися ARNT та активувати цільові гени. HIFдимер зв'язується із так званими елементами, що відповідають за гіпоксію, (HRE) у регуляторних послідовностях своїх цільових генів. HRE визначаються консенсусною послідовністю. Функціональні HRE були виявлені у регуляторних елементах численних індукованих гіпоксією генів [див.: Semenza, Hypoxia-inducible factor 1: oxygen homeostasis and disease pathophysiology, Trends Mol. Med. 7 (8), 345-50 (2001); Wenger und Gassmann, Oxygen(es) and the hypoxia-inducible factor-1, Biol. Chem. 378 (7), 609-16 (1997)]. Молекулярний механізм, який лежить в основі такої регуляції HIF-альфа, був описаний у роботах кількох незалежних дослідницьких груп. Механізм розповсюджується на різні види: HIFальфа гідроксилюється підкласом кисень-залежних проліл-4-гідроксилаз, які позначають PHD або EGLN, біля двох специфічних пролільних залишків (P402 і P564 HIF-1-альфа-субодиниць людини). Під HIF-проліл-4-гідроксилазами розуміють залізо-залежні діоксигенази, що перетворюють 2-оксоглютарат [Epstein et al., C. elegans EGL-9 and mammalian homologs define a family of dioxygenases that regulate HIF by prolyl hydroxylation, Cell 107 (1), 43-54 (2001); Bruick und McKnight, A conserved family of prolyl-4-hydroxylases that modify HIF, Science 294 (5545), 1337-40 (2001); Ivan et al., Biochemical purification and pharmacological inhibition of a mammalian prolyl hydroxylase acting on hypoxia-inducible factor, Proc. Natl. Acad. Sci. U.S.A. 99 (21), 13459-64 (2002)]. Ферменти вперше у 2001 році назвали проліл-гідроксилазами [Aravind und Koonin, The DNA-repair protein AlkB, EGL-9, and leprecan define new families of 2-oxoglutarate-and irondependent dioxygenases, Genome Biol. 2 (3), research0007.1-0007.8, Epub 2001 Feb 19]. З пролілгідроксильованими HIF-альфа-субодиницями зв'язується білок pVHL пухлинниого супресора, який разом із елонгіном B і C утворює так званий VBC-комплекс, який адаптує субодиниці HIF-альфа до E3 убіквітин-лігази. Оскільки проліл-4-гідроксилювання субодиниць HIF-альфа та їх наступне розкладення відбувається залежно від внутрішньоклітинної концентрації кисню, HIF-проліл-4-гідроксилази називають також клітинними сенсорами кисню. Були визначені три ізоформи цих ферментів: EGLN1/PHD2, EGLN2/PHD1 та EGLN3/PHD3. У випадку двох з цих ферментів (EGLN2/PHD1 і EGLN3/PHD3) спостерігається транскрипційна індукція при гіпоксії та вони ймовірно відповідають за зниження рівня HIF-альфа, що відбувається при хронічній гіпоксії [див. Schofield und Ratcliffe, Oxygen sensing by HIF hydroxylases, Nat. Rev. Mol. Cell. Biol. 5 (5), 343-54 (2004)]. Селективне фармакологічне інгібування HIF-проліл-4-гідроксилаз викликає підвищення експресії HIF-залежних цільових генів і таким чином є дуже корисним для лікування численних картин хвороб. Зокрема у випадку серцево-судинних захворювань при індукції нових кровоносних судин, а також зміні ситуації, пов'язаної з обміном речовин у ішемічних органах від аеробного до анаеробного вироблення АТФ, можна очікувати покращення перебігу захворювання. Покращення васкуляризації хронічних ран сприяє процесу загоєння, зокрема у випадку складно виліковних Ulcera cruris (хронічна венозна недостатність, що супроводжується трофічними порученнями) та інших хронічних ран шкіри. Індукція еротропоетину людини при певних формах захворювання, зокрема у пацієнтів, хворих на ниркову анемію, також належить до поставлених терапевтичних цілей. Описані до цього часу у науковій літературі інгібітори HIF-проліл-4-гідроксилази не задовольняють усім вимог, які висуваються до лікарського засобу. При цьому йдеться або про конкурентні аналоги оксоглютарату (такі як, наприклад, N-оксалілгліцин), які характеризуються своєю дуже незначною дією і тому у дослідженнях in vivo до цього часу не показали ніякої дії щодо індукування HIF-генів. Або йдеться про речовини, що утворюють комплексні сполук із залізом (хелатори), такі як десферроксамін, які діють як неспецифічні інгібітори діоксигенази, що містять залізо, та незважаючи на індукування цільових генів, таких як, наприклад, еритропоетин, in vivo, протидіють еритропоезу шляхом утворення комплексних сполук із доступним залізом. 2-гетероарил-4-арил-1,2-дигідропіразолони, що проявляють бактерицидну та/або фунгіцидну дію, описані в EP 165 448 і EP 212 281. Застосування 2-гетероарил-4-арил-1,2дигідропіразолонів як інігібіторів ліпоксигенази для лікування захворювань дихальних шляхів, серцево-судинної системи та запальних захворювань описане в EP 183 159. 2,4-дифеніл-1,2 2 UA 105487 C2 5 10 15 20 25 дигідропіразолони, що проявляють гербіцидну активність, описані в DE 2 651 008. Одержання та фармакологічні властивості певних 2-піридил-1,2-дигідропіразолонів розкриті в Helv. Chim. Acta 49 (1), 272-280 (1966). У WO 96/12706, WO 00/51989 і WO 03/074550 описані сполуки з частковою структурою дигідропіразолону для лікування різних захворювань, а у WO 2006/101903 представлені гідрокси- або алкокси-заміщені біпіразоли для лікування нервовопсихічних захворювань. Крім того у WO 03/051833 і WO 2004/089303 описані гетероарилзаміщені похідні піразолу для лікування болю і різних захворювань центральної нервової системи. Крім того відповідно до WO 2006/114213 2,4-дипіридил-1,2-дигідропіразолони визначені як інгібітори HIF-проліл-4-гідроксилаз. У Acta Crystallogr., Section E: Structure Reports Online E57 (11), o1126-o1127 (2001) [Chem. Abstr. 2001:796190] описана рентгено-кристалічна структура сполуки 3-метил-1-(піридин-2-іл)-4(1-піридин-2-іл-3-метил-1H-піразол-5-іл)-2H-3-піразолін-5(1H)-он (інша назва: 5,5'-диметил-2,2'дипіридин-2-іл-1',2'-дигідро-2H, 3'H-3,4'-біпіразол-3'-он). Синтез певних похідних 3',5-диметил-2феніл-1'-(1,3-тіазол-2-іл)-1'H, 2H-3,4'-біпіразол-5'-олу описаний в Indian J. Heterocyclic Chem. 3 (1), 5-8 (1993) [Chem. Abstr. 1994:323362]. Одержання та таутомерія окремих похідних 4(піразол-5-іл)піразолін-5-ону описані в J. Heterocyclic Chem. 27 (4), 865-870 (1990) [Chem. Abstr. 1991:428557]. Терапевтичне застосування сполук, зазначених у даних публікаціях, до цього часу не було описані. У WO 2007/008541 наведена сполука 2-трет-бутил-1'-[4-(4-хлорфеніл)-1,3тіазол-2-іл]-3',5-диметил-1'H, 2H-3,4'-біпіразол-5'-ол як тестовий приклад. Задача даного винаходу полягала у одержанні нових сполук, які б можна було використовувати для лікування захворювань, зокрема серцево-судинних та гематологічних захворювань. В рамках даного винаходу описані сполуки, які діють як специфічні інгібітори HIF-проліл-4гідроксилаз та завдяки такому специфічному механізму дію in vivo після парентерального або перорального введення викликають індукцію цільових генів HIF, таких як, наприклад, еритропоетин, і спричинені нею біологічні процеси, такі як, наприклад, еритропоез. Об'єктом винаходу є сполуки формули R 2 O X N N N N N H 30 35 40 45 50 N R 1 (I), в якій X означає N або CH, 1 R означає водень або ціано, 2 R означає насичений 4- - 7-членний гетероциклільний залишок, приєднаний через атом азоту, причому гетероциклільний залишок може бути заміщений одним замісником, причому замісник вибраний із групи, що включає гідрокси, гідроксикарбоніл, C1-C3-алкіл, C1-C3-алкіламіно та C3-C6-циклоалкіл, або причому гетероциклільний залишок може бути заміщений 1-4 атомами фтору, та їх солі, їх сольвати і сольвати їх солей. Відповідними винаходу сполуками є сполуки формули (I) та їх солі, сольвати і сольвати солей, а також сполуки та їх солі, сольвати і сольвати солей, охоплені формулою (I), які надалі називають прикладами виконання, якщо під охопленими формулою (I) сполуки вже не розуміють солі, сольвати і сольвати солей. Сполуки згідно з винаходом залежно від їх структури можуть існувати у різних стереоізомерних формах (енантіомери, діастереомери). Тому даний винахід включає енантіомери і діастереомери та їх будь-які суміші. Із таких сумішей енантіомерів та/або діастереомерів стереоізомерні компоненти можуть бути виділені відомими способами. Якщо сполуки згідно з винаходом можуть існувати у таутомерних формах, то даний винахід включає всі таутомерні форми. Як солям в рамках даного винаходу перевагу надають фізіологічно прийнятним солям сполук згідно з винаходом. До них належать також солі, які самі є непридатними для застосування у фармацевтичних цілях, однак, наприклад, можуть бути використані для виділення або очищення сполук згідно з винаходом. 3 UA 105487 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фізіологічно прийнятними солями сполук згідно з винаходом є кислотно-адитивні солі мінеральних, карбонових та сульфонових кислот, наприклад, солі хлорводневої, бромводневої, сірчаної, фосфорної, метансульфонової, етансульфонової, толуолсульфонової, бензолсульфонової, нафталіндисульфонової, оцтової, трифтороцтової, пропіонової, молочної, винної, яблучної, лимонної, фумарової, малеїнової та бензойної кислоти. Фізіологічно прийнятними солями сполук згідно з винаходом є також солі звичайних основ, такі як, наприклад, і переважно солі лужних металів (наприклад, солі натрію та калію), солі лужноземельних металів (наприклад, солі кальцію та магнію) та солі амонію, похідні від аміаку або органічних амінів, що містять від 1 до 16 атомів вуглецю, як, наприклад, і переважно етиламін, діетиламін, триетиламін, етилдіізопропіламін, моноетаноламін, діетаноламін, триетаноламін, дициклогексиламін, диметиламіноетанол, прокаїн, дибензиламін, Nметилморфолін, аргінин, лізин, етилендіамін та N-метилпіперидин. Під сольватами в рамках даного винаходу розуміють такі форми сполук згідно з винаходом, які у твердому або рідкому стані шляхом координації з молекулами розчинника утворюють комплекс. Гідратами є спеціальна форма сольватів, в яких координація відбувається з водою. Як сольватам в рамках даного винаходу перевагу надають гідратам. Крім того даний винахід включає також проліки сполук згідно з винаходом. Поняття "проліки" включає сполуки, які самі можуть бути біологічно активними або неактивними, однак під час їх перебування у тілі перетворюються на сполуки згідно з винаходом (наприклад, метаболічно або гідролітично). В рамках даного винаходу замісники, якщо не зазначено нічого іншого, мають такі значення: Алкіл як такий та "алкіл" в алкіламіно означають лінійний або розгалужений алкільний залишок, що містить від 1 до 3 атомів вуглецю, наприклад, та переважно метил, етил, н-пропіл, ізопропіл. Алкіламіно означає алкіламінозалишок, що містить один або два (вибраних незалежно один від одного) алкільних замісники, наприклад, та переважно метиламіно, етиламіно, нпропіламіно, ізопропіламіно, N, N-диметиламіно, N, N-діетиламіно, N-етил-N-метиламіно, Nметил-N-н-пропіламіно та N-ізопропіл-N-н-пропіламіно. C1-C3-алкіламіно означає, наприклад, моноалкіламінозалишок, що містить від 1 до 3 атомів вуглецю, або діалкіламінозалишок, що містить відповідно від 1 до 3 атомів вуглецю на алкільний замісник. Циклоалкіл означає моноциклічну циклоалкільну групу, що містить, як правило, від 3 до 6 атомів вуглецю, наприклад, та переважно циклоалкіл, циклопропіл, циклобутил, циклопентил та циклогексил. Приєднаний через атом азоту насичений 4- - 7-членний гетероциклільний залишок означає моноциклічний, насичений, гетероциклічний залишок, що містить від 4 до 7 кільцевих атомів та атом азоту, через який вони приєднані, та до 2, переважно до одного іншого гетероатома та/або гетерогрупи з ряду N, O, S, SO, SO2, причому атом азоту може також утворювати N-оксид. Перевагу надають 4- - 7-членним, моноциклічним насиченим гетероциклільним залишкам, що містять до одного іншого гетероатома з ряду O, N та S, наприклад, та переважно азетидин-1-іл, піролін-1-іл, піперидин-1-іл, морфолін-4-іл, тіоморфолін-4-іл, піперизин-1-іл, 1,2-оксазинан-2-іл, 1,4-оксазепан-4-іл, 1,4-тіазепан-4-іл. Перевагу надають сполукам формули (I), в якій X означає N або CH, 1 R означає водень або ціано, 2 R означає насичений 4- - 7-членний гетероциклільний залишок, приєднаний через атом азоту, причому гетероциклільний залишок заміщений 1-4 атомами фтору, або 2 R означає піперазин-1-іл, причому піперазин-1-іл заміщений одним замісником, причому замісник вибраний із групи, що включає C3-C6-циклоалкіл, або 2 R означає ацетидин-1-іл, причому азетидин-1-іл заміщений одним замісником, причому замісник вибраний із групи, що включає гідроксикарбоніл, C1-C3-алкіл, C1-C3-алкіламіно та C3-C6-циклоалкіл, або 2 R означає 1,2-оксазинан-2-іл або 1,4-оксазепан-4-іл, та їх солям, їх сольватам і сольватам їх солей. Перевагу надають сполукам формули (I), в якій X означає N або CH, 4 UA 105487 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 R означає водень або ціано, 2 R означає азетидин-1-іл, піролін-1-іл або піперидин-1-іл, причому азетидин-1-іл, піролін-1-іл та піперидин-1-іл заміщені 1-4 атомами фтору, або 2 R означає піперазин-1-іл, причому піперазин-1-іл у положенні 4 заміщений одним замісником, причому замісник вибраний із групи, що включає C3-C6-циклоалкіл, або 2 R означає азетидин-1-іл, причому азетидин-1-іл у положенні 3 заміщеним одним замісником, причому замісник вибраний із групи, що включає гідроксикарбоніл, метил та диметиламіно, або 2 R означає 1,2-оксазінан-2-іл або 1,4-оксазепан-4-іл, та їх солям, їх сольватам і сольватам їх солей. Перевагу надають також сполукам формули (I), в якій X означає N або CH, 1 R означає водень або ціано, 2 R означає насичений 4- - 7-членний гетероциклільний залишок, приєднаний через атом азоту, причому гетероциклільний залишок заміщений 1-4 атомами фтору, та їх солям, їх сольватам і сольватам їх солей. Перевагу надають також сполукам формули (I), в якій X означає N або CH, 1 R означає водень або ціано, 2 R означає азетидин-1-іл, піролін-1-іл або піперидин-1-іл, причому азетидин-1-іл, піролін-1-іл та піперидин-1-іл заміщені 1-4 атомами фтору, та їх солям, їх сольватам і сольватам їх солей. Перевагу надають також сполукам формули (I), в якій X означає N або CH, 1 R означає водень або ціано, 2 R означає азетидин-1-іл, піролін-1-іл або піперидин-1-іл, причому азетидин-1-іл, піролін-1-іл та піперидин-1-іл заміщені 2 атомами фтору, причому ці замісники приєднані до одного й того ж атому вуглецю, та їх солям, їх сольватам і сольватам їх солей. Перевагу надають також сполукам формули (I), в якій X означає N або CH, 1 R означає водень або ціано, 2 R означає піперазин-1-іл, причому піперазин-1-іл заміщений одним замісником, причому замісник вибраний із групи, що включає С3-C6-циклоалкіл, та їх солям, їх сольватам і сольватам їх солей. Перевагу надають також сполукам формули (I), в якій X означає N або CH, 1 R означає водень або ціано, 2 R означає піперазин-1-іл, причому піперазин-1-іл у положенні 4 заміщений одним замісником, причому замісник вибраний із групи, що включає C3-C6-циклоалкіл, та їх солям, їх сольватам і сольватам їх солей. Перевагу надають також сполукам формули (I), в якій X означає N або CH, 1 R означає водень або ціано, 2 R означає азетидин-1-іл, причому азетидин-1-іл заміщений одним замісником, причому замісник вибраний із групи, що включає гідроксикарбоніл, C1-C3-алкіл, C1-C3-алкіламіно та C3-C6-циклоалкіл, та їх солям, їх сольватам і сольватам їх солей. Перевагу надають також сполукам формули (I), в якій X означає N або CH, 1 R означає водень або ціано, 2 R означає азетидин-1-іл, причому азетидин-1-іл заміщений одним замісником, причому замісник вибраний із групи, 5 UA 105487 C2 5 10 15 20 25 30 35 що включає гідроксикарбоніл, метил та диметиламіно, та їх солям, їх сольватам і сольватам їх солей. Перевагу надають також сполукам формули (I), в якій X означає N або CH, 1 R означає водень або ціано, 2 R означає азетидин-1-іл, причому азетидин-1-іл у положенні 3 заміщений одним замісником, причому замісник вибраний із групи, що включає гідроксикарбоніл, метил та диметиламіно, та їх солям, їх сольватам і сольватам їх солей. Перевагу надають також сполукам формули (I), в якій X означає N або CH, 1 R означає водень або ціано, 2 R означає 1,2-оксазинан-2-іл або 1,4-оксазепан-4-іл. Перевагу надають також сполукам формули (I), в якій X означає N. 1 Перевагу надають також сполукам формули (I), в якій R означає водень. 1 Перевагу надають також сполукам формули (I), в якій R означає ціано. 2 Перевагу надають також сполукам формули (I), в якій R означає 4-циклобутил-піперазин-1іл. Перевагу надають також сполукам формули (I), в якій X означає N або CH, 1 R означає ціано, 2 R означає насичений 4- - 7-членний гетероциклільний залишок, приєднаний через атом азоту, причому гетероциклільний залишок заміщений одним замісником, причому замісник вибраний із групи, що включає гідрокси, гідроксикарбоніл, C1-C3-алкіл, C1-C3-алкіламіно та C3-C6циклоалкіл, або причому гетероциклільний залишок заміщений 1-4 атомами фтору, та їх солям, їх сольватам і сольватам їх солей. Значення залишків, окремо наведені у відповідних або переважних комбінаціях залишків, незалежно від відповідних зазначених комбінацій залишків можуть бути довільно замінені значеннями залишків інших комбінацій. Найбільшу перевагу надають комбінаціям двох або більше наведених вище переважних областей значень. Відповідні винаходу похідні 1,2-дигідропіразол-3-ону формули (I) можуть також існувати у таутомерній 1H-піразол-5-ольній формі (I') (див. наведену нижче схему 1); обидві таутомерні форми охоплені даним винаходом. Схема 1 R 2 R O N N X N OH N N 2 N R 1 N N N H N R 1 N (I) 40 X N (I') Об'єктом винаходу є також спосіб одержання сполук формули (I) або їх солей, їх сольватів або сольватів їх солей, причому [A] сполуки формули H O Z 1 X O N N O R 1 45 1 (II), в якій R має вказані вище значення, а 1 Z означає метил або етил, у інертному розчиннику, необов'язково в присутності кислоти піддають взаємодії зі сполукою 6 UA 105487 C2 формули R 2 N N H N NH2 (III), 2 в якій R має вказані вище значення, до одержання сполук формули R R 2 2 N N HN Z N NH N N H X O 1 NH Z N N 10 N N O O 5 X O 1 H R R 1 1 (IV), 1 1 2 в якій Z , R та R мають вказані вище значення, які вже в цих умовах реакції або на наступній стадії під впливом основи циклізують до сполук формули (I), та сполуки формули (I) необов'язково за допомогою відповідних (i) розчинників та/або (ii) основ або кислот переводять у їх солі, їх сольвати або сольвати їх солей, або [B] сполуки формули X O 1 N N Z O R 1 15 1 (V), 1 в якій Z та R мають вказані вище значення, конденсують зі сполукою формули H 3C O Z 2 N H 3C O Z 2 (VI), в якій 2 Z означає метил або етил, до одержання сполук формули CH3 H3C Z 1 N X O N N O 20 R 1 1 1 (VII), в якій Z та R мають вказані вище значення, та після цього в присутності кислоти піддають взаємодії зі сполукою формули (III) до одержання сполук формули (IV), які вже в цих умовах реакції або на наступній стадії під впливом основи циклізують до сполук формули (I), 7 UA 105487 C2 та сполуки формули (I) необов'язково за допомогою відповідних (i) розчинників та/або (ii) основ або кислот переводять у їх солі, їх сольвати або сольвати їх солей, або [C] сполуку формули Cl N N 5 N H NH2 (VIII), у воді як розчиннику в ході одностадійної реакції спочатку піддають взаємодії зі сполукою формули R 2 H (IX), 2 10 15 20 25 30 35 40 45 50 в якій R має вказані вище значення, та після цього зі сполукою формули (VII) до одержання сполук формули (I), та сполуки формули (I) необов'язково за допомогою відповідних (i) розчинників та/або (ii) основ або кислот переводять у їх солі, їх сольвати або сольвати їх солей. Вільна основа солей може бути одержана шляхом взаємодії солей сполук або сольватів солей сполук з основою. Як основи придатними є гідроксиди лужних металів, такі як, наприклад, гідроксид натрію або калію, карбонати лужних або лужноземельних металів, такі як карбонат натрію, калію, кальцію або цезію, або водний розчин аміаку. У альтернативному способі вільна основа солей може, наприклад, бути одержана хроматографією на колонці з оберненою фазою, градієнт ацетонітрил-вода при додаванні основи, зокрема при використанні колонки ОФ-С18 Phenomenex Luna C18(2) та діетиламіну як основи. Іншим об'єктом винаходу є спосіб одержання сполук формули (I) або їх сольватів, за яким солі сполук або сольвати солей сполук шляхом взаємодії з основою або хроматографією при додаванні основи перетворюють на сполуки. Інші відповідні винаходу сполуки можуть бути необов'язково також одержані шляхом 1 2 перетворення функціональних груп окремих замісників, зокрема зазначених для R та R , виходячи зі сполук формули (І), одержаних наведеними вище способами. Ці перетворення можуть бути здійснені звичайними, відомими фахівцям способами та включають, наприклад, такі реакції, як нуклеофільне або електрофільне заміщення, окислення, відновлення, гідрування, реакції сполучення в присутності перехідного металу як каталізатора, алкілування, ацилювання, амінування, переестерифікація, відщеплення естеру, переетерифікація, відщеплення етеру, утворення карбонамідів, сульфонамідів, карбаматів та карбамідів, а також введення та виділення тимчасових захисних груп. Як інертні розчинники для стадій (II) + (III) (IV), (VII) + (III) (IV) та (IV) (I) придатними є зокрема етери, такі як діетиловий етер, метил-трет-бутиловий етер, 1,2-диметоксиетан, тетрагідрофуран та діоксан, або спирти, такі як метанол, етанол, н-пропанол, ізопропанол, нбутанол та трет-бутанол, або вода або суміші розчинників або суміш розчинника та води. Перевагу надають метанолу, етанолу, тетрагідрофурану або воді. Стадію (V) + (VI) (VII) здійснюють переважно в диметилформаміді як розчиннику або також в присутності надлишку (VI) без додаткового розчинника. Необов'язково реакцію можна також здійснювати при опроміненні мікрохвилями. Реакцію здійснюють загалом при температурі від +20 °C до +150 °C, переважно від +80 °C до +120 °C [див. також J.P. Bazureau et al., Synthesis 1998, 967; ibid. 2001 (4), 581]. Стадію (II) + (III) (IV) та (VII) + (III) (IV) можна необов'язково здійснювати при додаванні кислоти. Придатними для цього є звичайні неорганічні або органічні кислоти, такі як, наприклад, хлороводень, оцтова, трифтороцтова, метансульфонова, п-толуолсульфонова або камфер-10сульфонова кислота. Переважно використовують оцтову або зокрема трифтороцтову кислоту або п-толуолсульфонову кислоту. Взаємодію (II) + (III) (IV) здійснюють загалом при температурі від 0 °C до +100 °C, переважно від +10 °C до +50 °C. Реакцію (VII) + (III) (IV) здійснюють загалом при температурі від +20 °C до +120 °C, переважно від +50 °C до +100 °C. Способи (II) + (III) (IV) (I) та (VII) + (III) (IV) (I) можуть бути здійснені в дві або в одну стадію, без виділення проміжної сполуки (IV). Для останнього варіанту особливо 8 UA 105487 C2 5 10 15 20 25 30 придатною є взаємодію компонентів при опроміненні мікрохвилями; при цьому реакцію здійснюють загалом при температурі від +50 °C до +200 °C, переважно від +100 °C до +180 °C. Частково циклізація до (I) спостерігається вже при одержанні (IV); в такому випадку циклізація може бути необов'язково завершена шляхом обробки in situ реакційної суміші основою. Як основа для такої окремої стадії циклізації (IV) (I) придатними є всі звичайні неорганічні або органічні основи. Сюди належать зокрема гідроксиди лужних металів, такі як, наприклад, гідроксид натрію або калію, карбонати лужних або лужноземельних металів, такі як карбонат натрію, калію, кальцію або цезію, алкоголяти лужних металів, такі як метилат натрію або калію, етилат натрію або калію або трет-бутилат натрію або калію, або гідриди лужних металів, такі як гідрид натрію. Переважно використовують метилат або етилат натрію. Індуковану основою взаємодію (IV) (I) здійснюють загалом при температурі від 0 °C до +60 °C, переважно від 0 °C до +30 °C. Взаємодію (VIII) + (IX) + (VII) (I) здійснюють загалом при використанні від 1,1 до 2,0 еквівалентів (IX), у перерахунку на 1 еквівалент (VIII), необов'язково в присутності 1,1-2,0 еквівалентів основи. Переважно взаємодію здійснюють з використанням від 1,1 до 1,5 еквівалентів (IX). Як основи для здійснення реакції (VIII) + (IX) + (VII) (I) придатними є звичайні неорганічні або органічні основи. Сюди належать зокрема гідроксиди лужних металів, такі як, наприклад, гідроксид натрію або калію, або амінооснови, такі як, наприклад, N-етил-N-(пропан-2-іл)пропан2-амін. Перевагу надають N-етил-N-(пропан-2-іл)пропан-2-аміну. Реакцію (VIII) + (IX) + (VII) (I) здійснюють загалом при температурі від +20 °C до +100 °C, переважно від +70 °C до +100 °C. Всі стадії способу можна здійснювати при нормальному, підвищеному або пониженому тиску (наприклад, від 0,5 до 5 бар). Загалом працюють при нормальному тиску. Сполуки формули (II) можуть бути одержані відомими з літературних джерел методами Cацилювання естерів карбонових кислот зі сполук формули (V). Сполуки формул (III), (V), (VI), (VIII) і (IX) наявні у продажу, відомі з літературних джерел або можуть бути одержані аналогічно описаним у літературних джерелах способам. Одержання відповідних винаходу сполук можна наочно продемонструвати на такій схемі 2: Схема 2 2 R CH 3 OEt H3C N X O N N H3C OEt R 1 N H 3C N a) N H N X O OEt R N N 2 NH2 O N b) OEt R N 1 N X N N R 1 N H 2 R R 2 N N b) N H NH2 c) N N NH HN X O N N OEt R 35 40 1 [a): ДМФА, 16 год., +100 °C; b): етанол, трифтороцтова кислота, +78 °C; c): NaOEt, етанол, 1 год., кімнатна температура]. Сполуки згідно з винаходом мають неочікуваний цінний фармакологічний спект дії. Тому вони є придатними для застосування як лікарські засоби для лікування та/або профілактики захворювань людей і тварин. Відповідні винаходу сполуки є специфічними інгібіторами HIF-проліл-4-гідроксилаз. Відповідні винаходу сполуки завдяки своїм фармакологічним властивостям можуть бути застосовані для лікування та/або профілактики серцево-судинних захворювань, зокрема серцевої недостатності, ішемічної хвороби серця, стенокардії, інфаркту міокарду, апоплексії, артеріосклерозу, есенціальної, легеневої і злоякісної гіпертонії, а також облітерувального периферійного ендартеріїту. 9 UA 105487 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідні винаходу сполуки також придатні для лікування та/або профілактики порушень кровотворення, таких як, наприклад, ідіопатичні анемії, ниркова анемія та анемії, які супроводжують онкологічні захворювання (зокрема анемія внаслідок хіміотерапії), інфекції (зокрема ВІЛ-інфекцію) або інші запальні захворювання, такі як, наприклад, ревматоїдний артрит. Крім того сполуки згідно з винаходом придатні для підтримувального лікування анемій внаслідок втрати крові, залізодефіцитної анемії, авітамінозної анемії (наприклад, через дефіцит вітаміну B12 або фолієвої кислоти), гіпопластичної та апластичної анемії, гемолітичної анемії або для підтримувального лікування анемій внаслідок порушення переробки заліза (залізорефрактерна анемія) або анемій внаслідок інших ендокринних порушень (наприклад, гіпотиреоз). Крім того сполуки є придатними для підвищення гематокриту з метою збирання власної крові перед операціями. Крім того відповідні винаходу сполуки можуть бути застосовані для лікування та/або профілактики обумовлених оперативним втручанням ішемічних станів та їх наслідків після хірургічного втручання, зокрема втручання у серце при використанні штучного серця і легенів (наприклад, шунтування, імплантація серцевих клапанів), втручання у сонну артерію, втручання у аорту та втручання при інструментальному розтинанні або проникненні у череп. Сполуки є також придатними для загального лікування та/або профілактики при хірургічних втручаннях з метою прискорення загоєння ран та скорочення часу, необхідного для одужання. Крім того сполуки є придатними для лікування та профілактики наслідків гострих і затяжних ішемічних станів мозку (наприклад, апоплексії, родової асфіксії). Сполуки також можуть бути застосовані для лікування та/або профілактики раку та для лікування та/або профілактики порушень стану здоров'я внаслідок лікування раку, зокрема після лікування цитостатичними засобами, антибіотиками і опроміненням. Крім того сполуки є придатними для лікування та/або профілактики ревматичних захворювань та інших форм захворювань, які відносять до аутоімунних захворювань, зокрема для лікування та/або профілактики погіршення стану здоров'я, пов'язаного із медикаментозним лікуванням таких захворювань. Крім того сполуки можуть бути використані для лікування та/або профілактики захворювань очей (наприклад, глаукоми), мозку (наприклад, хвороби Паркінсона, хвороби Альцгеймера, слабоумства, хронічних больових станів), хронічних захворювань нирок, ниркової недостатності та гострої ниркової недостатності, а також для сприяння загоєнню ран. Сполуки є також придатними для лікування та/або профілактики загальної слабкості тіла, яка зокрема часто зустрічається у людей похилого віку, до кахексії. Крім того сполуки є придатними для лікування та/або профілактики сексуальної дисфункції. Крім того сполуки придатні для лікування та/або профілактики цукрового діабету та його наслідків, таких як, наприклад, діабетична макро- і мікроангіопатія, діабетична нефропатія і нейропатія. Відповідні винаходу сполуки є також придатними для лікування та/або профілактики фібротичних захворювань, наприклад, серця, легенів і печінки. Зокрема сполуки згідно з винаходом є придатними для профілактики та лікування ретинопатії недоношених дітей (Retinopathia praematurorum). Ще одним об'єктом даного винаходу є застосування відповідних винаходу сполук для лікування та/або запобігання захворюванням, зокрема вказаним вище захворюванням. Ще одним об'єктом даного винаходу є застосування відповідних винаходу сполук для одержання лікарського засобу для лікування та/або запобігання захворюванням, зокрема вказаним вище захворюванням. Ще одним об'єктом даного винаходу є спосіб лікування та/або запобігання захворюванням, зокрема вказаним вище захворюванням, при використанні ефективної кількості щонайменше однієї зі сполук згідно з винаходом. Сполуки згідно з винаходом можуть бути застосовані окремо або в разі потреби у комбінації з іншими активними речовинами. Ще одним об'єктом даного винаходу є лікарські засоби, що містять щонайменше одну зі сполук згідно з винаходом та одну або кілька інших активних речовин, зокрема для лікування та/або запобігання вказаним вище захворюванням. Придатними компонентами для комбінування є, наприклад, переважно такі: АКФ-інгібітори, антагоністи рецептора ангіотензину AII, блокатори бета-рецептора, антагоністи кальцію, інгібітори ФДЕ, антагоністи мінералокортикоїдного рецептора, діуретики, аспірин, добавки заліза, вітаміну В12 і фолієвої кислоти, статини, похідні дигоксину Digitalis, хіміотерапевтичні засоби, а також антибіотики. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у 10 UA 105487 C2 5 10 15 20 25 30 35 40 45 50 55 60 комбінацію з АКФ-інгібітором, таким як, наприклад, переважно еналаприл, каптоприл, лізиноприл, раміприл, делаприл, фозиноприл, квіноприл, периндоприл або трандоприл. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з антагоністом ангіотензину AII, таким як, наприклад, переважно лозартан, кандезартан, валзартан, тельмізартан або ембузартан. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з блокаторами бета-рецептора, такими як, наприклад, переважно пропранолол, атенолол, тимолом, піндолол, альпренолол, окспренолол, пенбутолол, бупранолол, метипранолол, надолол, мепіндолол, каразалол, соталол, метопролол, бетаксолол, целіпролол, бісопролол, картеолол, есмолол, лабеталол, карведилол, адапролол, ландіолол, небіволол, епанолол або буциндолол. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з антагоністом кальцію, таким як, наприклад, переважно ніфедипін, амлодипін, верапаміл або дилтіазем. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з інгібітором фосфодіестерази (ФДЕ), таким як, наприклад, переважно мілринон, амринон, пімобендан, цилостазол, силденафіл, варденафіл або тадалафіл. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з антагоністами мінералокортикоїдного рецептора, такими як, наприклад, переважно спіронолактон, еплеренон, канренон або канреноат калію. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з діуретином, таким як, наприклад, фуроземід, буметанід, торсемід, бендрофлуметіазид, хлортіазид, гідрохлортіазид, гідрофлуметіазид, метиклотіазил, політіазид, трихлорметіазид, хлорталідон, індапамід, метолазон, квінетазон, ацетазоламід, дихлорфенамід, метазоламід, гліцерин, ізосорбід, маніт, амілорид або триамтерен. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з інгібітором HMG-CoA-редуктази з класу статинів, таких як, наприклад, переважно ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, розувастатин, церивастатин або пітавастатин. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію із хіміотерапевтичним засобом, наприклад, переважно з групи комплексу платини, таким як, наприклад, цисплатина та карбоплатина, алкілантів, таких як, наприклад, циклофосфамід і хлорамбуцил, антиметаболітів, таких як, наприклад, 5-фторурацил і метотрексат, інгібіторів топоізомерази, таких як, наприклад, етопосид і камптотецин, антибіотиків, таких як, наприклад, доксорубіцин і даунорубіцин, або інгібіторів кінази, таких як, наприклад, сорафеніб і сунітиніб. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з антибіотиком, таким як, наприклад, переважно з групи пеніциліні, цефалоспоринів або хінолінів, наприклад, ципрофлоксацин та моксифлоксацин. Ще одним об'єктом даного винаходу є лікарські засоби, що містять щонайменше одну сполуку згідно з винаходом, зазвичай разом із однією або кількома інертними нетоксичними фармацевтично прийнятними допоміжними речовинами, а також їх застосування для описаних вище цілей. Сполуки згідно з винаходом можуть проявляти систематичну та/або локальну дію. З цією метою їх вводять відповідним чином, наприклад, перорально, парентерально, легеневим способом, назально, під язик, на язик, за щоку, ректально, дермально, трансдермально, кон'юктивально, у вухо або у вигляді імплантату чи стенту. Для таких видів застосування сполуки згідно з винаходом можуть бути використані у відповідних формах. Для перорального застосування згідно з рівнем техніки придатними є форми, здатні до швидкого та/або модифікованого вивільнення сполук згідно з винаходом, до складу яких сполуки згідно з винаходом входять у кристалічній та/або аморфній та/або розчиненій формі, такі як, наприклад, таблетки (не покриті або покриті оболонками, наприклад, оболонками, стійкими до шлункового соку, або оболонками, які повільно розчиняються або не розчиняються взагалі, які контролюють вивільнення сполук згідно з винаходом), таблетки або плівки/облатки, плівки/ліофілізати, капсули (наприклад, тверді або м'які желатинові капсули), які швидко розчиняються у ротовій порожнині, драже, грануляти, гранули, порошки, емульсії, суспензії, аерозолі або розчини. Парентеральне застосування може відбуватися при виключенні стадії всмоктування (наприклад, внутрішньовенно, внутрішньоартеріально, внутрішньосерцево, інтраспінально або 11 UA 105487 C2 5 10 15 20 25 30 35 40 інтралюмбально) або за умови включення стадії всмоктування (наприклад, внутрішньом'язово, підшкірно, у шкіру, перкутанно або внутрішньобрюшинно). Придатними для парентерального застосування є такі форми, як ін'єкційні та інфузійні композиції у формі розчинів, суспензій, емульсій, ліофілізатів або стерильних порошків. Для інших видів застосування придатними є, наприклад, лікарські засоби для інгаляції (а саме порошкові інгалятори, розпилювачі), краплі, розчини або спреї в ніс, таблетки під язик, на язик або за щоку, плівки/облатки або капсули, супозиторії, композиції для вух або очей, вагінальні капсули, водні суспензії (лосьйони, мікстури "бовтушки"), ліпофільні суспензії, мазі, креми, трансдермальні терапевтичні системи (наприклад, пластирі), молочко, пасти, піни, присипки, імплантати або стенти. Перевагу надають пероральному або парентеральному застосуванню, зокрема пероральному та внутрішньовенному застосуванню. Сполуки згідно з винаходом можуть бути переведені у згадані форми застосування. Це можна здійснювати відомими способами шляхом змішування з інертними, нетоксичними фармацевтично прийнятними допоміжними речовинами. До таких допоміжних речовин належать зокрема носії (наприклад, мікрокристалічна целюлоза, лактоза, маніт), розчинники (наприклад, рідкі поліетиленгліколі), емульгатори та диспергатори або змочувальні агенти (наприклад, додецилсульфат натрію, олеат поліоксисорбіту), зв'язувальні агенти (наприклад, полівінілпіролідон), синтетичні та природні полімери (наприклад, альбумін), стабілізатори (наприклад, антиоксиданти, такі як, наприклад, аскорбінова кислота), барвники (наприклад, неорганічні пігменти, такі як оксиди заліза) та речовини, що коригують смак та/або запах. Загалом виявили, що при парентеральному застосуванні для досягнення бажаних результатів кількість активної речовини переважно становить від приблизно 0,001 до 1 мг/кг ваги тіла, переважно від приблизно 0,01 до 0,5 мг/кг ваги тіла. При пероральному застосуванні дозування становить від приблизно 0,01 до 100 мг/кг, переважно від приблизно 0,01 до 20 мг/кг та особливо переважно від 0,1 до 10 мг/кг ваги тіла. Крім того необов'язково може виникати необхідність відступати від вказаних кількостей залежно від ваги тіла, форми застосування, індивідуальної реакції на активну речовину, виду композиції та моменту або інтервалу її застосування. Так, наприклад, у деяких випадках достатнім може виявитися застосування меншої кількості, ніж вказана вище мінімальна гранична кількість, а у інших випадках необхідно перевищувати максимальну граничну кількість. У випадку застосування більших кількостей варто розподілити цю кількість на кілька окремих доз для застосування протягом дня. Наведені нижче приклади виконання пояснюють винахід, не обмежуючи обсяг його охорони. Всі показники в % у дослідженнях та прикладах, якщо не зазначено нічого іншого, відносяться до мас. %; частини відносяться до мас. частин. Співвідношення розчинників, розріджувачів та показники концентрації розчинів рідина/рідина відповідно відносяться до об'єму, якщо не зазначено нічого іншого. A. Приклади Скорочення: водн. водний, водний розчин кат. каталітичний д день ПХІ пряма хімічна іонізація (при МС) ДМФА диметилформамід ДМСО диметилсульфоксид від теор. від теоретичного (на виході) EI іонізація електронним ударом (при МС) ЕРІ іонізація електростатичним розпилюванням (при МС) Et етил ГХ-МС газова хроматографія при мас-спектроскопії год. година(ни) ВЕРХ рідинна хроматографія високого тиску конц. концентрований РХ-МС рідинна хроматографія при мас-спектроскопії мет. метод хв. хвилина(ни) МС мас-спектроскопія ЯМР ядерно-магнітний резонанс Чу час утримування (при ВЕРХ) 12 UA 105487 C2 КТ ТФО ТГФ 5 10 15 20 25 30 35 40 45 50 55 кімнатна температура трифтороцтова кислота тетрагідрофуран Методи РХ-МС, ГХ-МС та ВЕРХ: Метод 1 (РХ-МС): прилад: Micromass Platform LCZ з приладом ВЕРХ: Agilent 1100; колонка: Thermo Hypersil GOLD 3 мкм, 20 мм x 4 мм; елюент A: 1 л вода + 0,5 мл 50 %-ної мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50 %-ної мурашиної кислоти; градієнт: 0,0 хв. 100 % A 0,2 хв. 100 % A 2,9 хв. 30 % A 3,1 хв. 10 % A 5,5 хв. 10 % A; термостат колонок: 50 °C; потік: 0,8 мл/хв.; УФ-детектування: 210 нм. Метод 2 (РХ-МС): тип приладу МС: Micromass ZQ; тип приладу ВЕРХ: Waters Alliance 2795; колонка: Phenomenex Synergi 2 мкм Hydro-RP Mercury 20 мм x 4 мм; елюент A: 1 л води + 0,5 мл 50 %-ної мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50 %-ної мурашиної кислоти; градієнт: 0,0 хв. 90 % A 2,5 хв. 30 % A 3,0 хв. 5 % A 4,5 хв. 5 % A; потік: 0,0 хв. 1 мл/хв. 2,5 хв./3,0 хв./4,5 хв. 2 мл/хв.; термостат колонок: 50 °C; УФ-детектування: 210 нм. Метод 3 (РХ-МС): тип приладу МС: Micromass ZQ; тип приладу ВЕРХ: Waters Alliance 2795; колонка: Phenomenex Synergi 2,5 мкм MAX-RP 100A Mercury 20 мм x 4 мм; елюент А: 1 л води + 0,5 мл 50 %-ної мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50 %-ної мурашиної кислоти; градієнт: 0,0 хв. 90 % A 0,1 хв. 90 % A 3,0 хв. 5 % A 4,0 хв. 5 % A 4,01 хв. 90 % A; потік: 2 мл/хв.; термостат колонок: 50 °C; УФ-детектування: 210 нм. Метод 4 (РХ-МС): прилад: Micromass Quattro Micro MS з приладом ВЕРХ: Agilent 1100; колонка: Thermo Hypersil GOLD 3 мкм 20 мм x 4 мм; елюент А: 1 л води + 0,5 мл 50 %-ної мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50 %-ної мурашиної кислоти; градієнт: 0,0 хв. 100 % A 3,0 хв. 10 % A 4,0 хв. 10 % A 4,01 хв. 100 % A (потік 2,5 мл/хв.) 5,00 хв. 100 % A; термостат колонок: 50 °C; потік: 2 мл/хв.; УФ-детектування: 210 нм. Метод 5 (РХ-МС): прилад: Micromass QuattroPremier з Waters UPLC Acquity; колонка: Thermo Hypersil GOLD 1,9 мкм 50 мм x 1 мм; елюент А: 1 л води + 0,5 мл 50 %-ної мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50 %-ної мурашиної кислоти; градієнт: 0,0 хв. 90 % A 0,1 хв. 90 % A 1,5 хв. 10 % A 2,2 хв. 10 % A; потік: 0,33 мл/хв.; термостат колонок: 50 °C; УФдетектування: 210 нм. Метод 6 (ВЕРХ): прилад: HP 1100 з діодно-матричним детектором; колонка: Kromasil 100 RP-18, 60 мм x 2,1 мм, 3,5 мкм; елюент А: 5 мл перхлорної кислоти (70 %-ної) / л води, елюент B: ацетонітрил; градієнт: 0 хв. 2 % B 0,5 хв. 2 % B 4,5 хв. 90 % B 6,5 хв. 90 % B 6,7 хв. 2 % B 7,5 хв. 2 % B; потік: 0,75 мл/хв.; термостат колонок: 30 °C; УФ-детектування: 210 нм. Метод 7 (ГХ-МС): прилад: Micromass GCT, GC6890; колонка: Restek RTX-35, 15 м x 200 мкм x 0,33 мкм; постійний потік гелію: 0,88 мл/хв.; термостат колонок: 70 °C; термостат колонок: 250 °C; градієнт: 70 °C, 30 °C/хв. 310 °C (3 хв. утримування). Метод 8 (препаративна ВЕРХ): колонка: Kromasil 100 C18 5 мкм, 250 мм x 20 мм; елюент А: Milli-Q-вода, елюент B: водна 0,1 %-на трифтороцтова кислота, елюент C: ацетонітрил; градієнт: 0,0 хв. 76 % A, 5 % B, 19 % C 15 хв. 4 % A, 95 % B, 1 % C 15,1 хв. 76 % A, 5 % B, 19 % C 20 хв. 76 % A, 5 % B, 19 % C; термостат колонок: 40 °C; потік: 25 мл/хв.; УФ-детектування: 210 нм. Метод 9 (препаративна ВЕРХ): колонка: Sunfire C18 5 мкм, 19 мм x 150 мм; елюент А: водна 0,2 %-на трифтороцтова кислота, елюент B: ацетонітрил; градієнт: 0,0 хв. 95 % A 8 хв. 50 % A 8,01 хв. 95 % A 12 хв. 95 % A; КТ; потік: 25 мл/хв.; УФ-детектування: 210 нм. Метод 10 (препаративна ВЕРХ): колонка: Sunfire C18 5 мкм, 19 мм x 150 мм; елюент А: водна 0,2 %-на трифтороцтова кислота, елюент B: ацетонітрил; 0 хв. 90 % A 13 хв. 90 % A; термостат колонок: 40 °C; потік: 25 мл/хв.; УФ-детектування: 210 нм. Метод 11 (препаративна ВЕРХ): колонка: XBridge C18 5 мкм, 19 мм x 150 мм; елюент А: водна 0,2 %-на мурашина кислота, елюент B: ацетонітрил; 0 хв. 75 % A 6 хв. 75 % A; КТ; потік: 25 мл/хв.; УФ-детектування: 210 нм. Метод 12 (препаративна ВЕРХ): колонка: XBridge C18 5 мкм, 19 мм x 150 мм; елюент А: водна 0,2 %-на мурашина кислота, елюент B: ацетонітрил; 0 хв. 93 % A 4 хв. 93 % A; КТ; потік: 25 мл/хв.; УФ-детектування: 210 нм. Метод 13 (препаративна ВЕРХ): колонка: XBridge C18 5 мкм, 19 мм x 150 мм; елюент А: водна 0,2 %-на трифтороцтова кислота, елюент B: ацетонітрил; 0 хв. 90 % A 12 хв. 90 % A; термостат колонок: 40 °C; потік: 25 мл/хв.; УФ-детектування: 210 нм. Вихідні сполуки Приклад 1A 13 UA 105487 C2 Етиловий естер (4-ціано-1H-імідазол-1-іл)оцтової кислоти O N N CH3 O NC 5 10 15 3,3 г (35,3 ммоль) 1H-імідазол-4-карбонітрилу [Matthews et al., J. Org. Chem. 1986, 51, 32283231] поміщають в 13,2 мл (11,5 г, 35,3 ммоль) 21 %-ного розчину етилату натрію в етанолі та додають 4,3 мл (6,5 г, 38,9 ммоль) етилового естеру бромоцтової кислоти. Реакційну суміш перемішують протягом 16и годин при кімнатній температурі. Для обробки тверду речовину, що випала в осад, відфільтровують, залишок на фільтрі промивають етанолом, а фільтрат концентрують у вакуумі. Залишок змішують з діізопропіловим етером, ще раз фільтрують, фільтрат знову концентрують на ротаційному випарнику та сушать у вакуумі. Вихід: 3,8 г (60 % від теор.) + РХ-МС (метод 1): Чу = 1,17 хв.; МС (ESI-поз): m/z=180 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,12 (с, 1H), 7,88 (с, 1H), 5,06 (с, 2H), 4,18 (кв, 2H), 1,22 (т, 3H). Приклад 2A Етиловий естер 2-(1H-1,2,3-триазол-1-іл)оцтової кислоти N N O N CH3 O 20 25 129,2 г (5,6 моль) натрію повільно додають до 4,0 л етанолу. Після цього додають 00,0 г (5,6 моль) 1,2,3-1H-триазолу, а також по краплях додають 623 мл (938,2 г, 5,6 моль) етилового естеру бромоцтової кислоти при внутрішній температурі 20-25 °C. Протягом 48 годин перемішують при кімнатній температурі. Тверду речовину, що випала в осад, відфільтровують, етанол видаляють у вакуумі та знову фільтрують. Залишок поміщають в етилацетат, фільтрують, знову концентрують у вакуумі та очищують перегонкою на 30 см-колонці. Продукт одержують при температурі бані 140 °C, температурі верху колонки 60-115 °C та тиску 1 мбар. Вихід: 440,0 г (50 % від теор.) ВЕРХ (метод 6): Чу = 1,58 хв.; + РХ-МС (метод 1): Чу = 0,71 хв.; МС (ESI-поз): m/z=156 [M+H] . Приклад 3A Етиловий естер 1H-імідазол-1-ілоцтової кислоти O N N CH3 O 30 35 118,2 г (5,1 моль) натрію повільно додають до 2,5 л етанолу. Потім додають 350,0 г (5,1 моль) імідазолу, а також по краплях додають 570 мл (858,6 г, 5,1 моль) етилового естеру бромоцтової кислоти при внутрішній температурі 20-25 °C. Протягом 24 годин перемішують при кімнатній температурі. Тверду речовину, що випала в осад, відфільтровують, етанол видаляють у вакуумі та знову фільтрують. Залишок очищують колонковою хроматографією на силікагелі (розчинник: етилацетат). Вихід: 639,0 г (81 % від теор.) + ГХ-МС (метод 7): Чу = 4,55 хв.; МС (ESI-поз): m/z=155 [M+H] . Приклад 4A Етиловий естер (4-ціано-1H-1,2,3-триазол-1-іл)оцтової кислоти N N O N CH3 O NC 40 45 4,1 г (31,9 ммоль) етилового естеру азидооцтової кислоти та 2,8 г (31,9 ммоль) нітрилу 2хлоракрилової кислоти протягом 16 годин перемішують в 32 мл води при температурі бані 80 °C. Після охолодження до кімнатної температури розчин підкислюють 1 N соляною кислотою та екстрагують етилацетатом. Органічну фазу сушать над сульфатом натрію, фільтрують та концентрують у вакуумі. Залишок змішують з 50 мл етанолу та 10 краплями концентрованої сірчаної кислоти та протягом 16 годин перемішують при кипінні зі зворотнім холодильником. Для 14 UA 105487 C2 5 обробки реакційну суміш концентрують у вакуумі, залишок змішують з етилацетатом, суспензію промивають напівконцентрованим розчином гідрокарбонату натрію та органічну фазу сушать над сульфатом натрію. Розчинник повністю видаляють на ротаційному випарнику, а тверду речовину сушать у вакуумі. Вихід: 1,5 г (25 % від теор.) + РХ-МС (метод 3): Чу = 0,96 хв.; МС (ESI-поз): m/z=181 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 9,06 (с, 1H), 5,57 (с, 2H), 4,19 (кв, 2H), 1,22 (т, 3H). Приклад 5A Етиловий естер 3-(N, N-диметиламіно)-2-(1H-імідазол-1-іл)акрилової кислоти CH 3 N O N N CH 3 CH 3 O 10 15 38,0 г (244,9 ммоль) сполуки з прикладу 3A протягом 16 годин перемішують в 126 мл (108,1 г, 734,7 ммоль) N, N-диметилформаміду діетилацеталю при температурі бані 90 °C. Після охолодження концентрують у вакуумі, змішують з діізопропіловим етером, тверду речовину відфільтровують та промивають діізопропіловим етером. Вихід: 49,0 г (95 % від теор.) + РХ-МС (метод 2): Чу = 2,42 хв.; МС (ESI-поз): m/z=211 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 7,52 (с, 1H), 7,49 (с, 1H), 7,05 (с, 1H), 6,91 (с, 1H), 4,02 (кв, 2H), 2,63 (ш. с, 6H), 1,12 (т, 3H). Приклад 6A Етиловий естер 3-(N, N-диметиламіно)-2-(4-ціано-1H-імідазол-1-іл)акрилової кислоти CH3 N O N N CH3 CH3 O NC 20 25 3,8 г (21,4 ммоль) сполуки з прикладу 1A та 7,4 мл (6,3 г, 42,8 ммоль) N, Nдиметилформаміду діетилацеталю протягом 16 годин перемішують при температурі бані 100 °C. Для обробки охолоджений реакційний розчин концентрують на ротаційному випарнику, а залишок сушать у вакуумі. Вихід: 5,0 г (чистота 73 %, 73 % від теор.) + РХ-МС (метод 1): Чу = 2,69 хв.; МС (ESI-поз): m/z=235 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,13 (с, 1H), 7,85 (с, 1H), 7,58 (с, 1H), 4,03 (кв, 2H), 2,69 (ш. с, 6H), 1,12 (т, 3H). Приклад 7A Етиловий естер 3-(диметиламіно)-2-(4-ціано-1H-1,2,3-триазол-1-іл)акрилової кислоти CH3 N N N CH3 O N CH3 O NC 30 35 1,3 г (7,5 ммоль) сполуки з прикладу 4A та 1,4 мл (1,2 г, 8,2 ммоль) N, N- диметилформаміду діетилацеталю протягом 16 годин перемішують при температурі бані 100 °C. Для обробки охолоджений реакційний розчин концентрують на ротаційному випарнику, а залишок сушать у вакуумі. Вихід: 1,5 г (86 % від теор.). + РХ-МС (метод 4): Чу = 1,55 хв.; МС (ESI-поз): m/z=236 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 9,14 (с, 1H), 7,75 (с, 1H), 4,04 (кв, 2H), 3,15 (ш. с, 3H), 2,18 15 UA 105487 C2 (ш. с, 3H), 1,13 (т, 3h). Приклад 8A Етиловий естер 3-(диметиламіно)-2-(1H-1,2,3-триазол-1-іл)акрилової кислоти CH3 N N N CH3 CH3 O N O 5 10 20,0 г (128,9 ммоль) сполуки з прикладу 2A змішують з 44,2 мл (38,0 г, 257,8 ммоль) N, Nдиметилформамід-діетилацеталю та протягом 16 годин перемішують при 100 °C. Після охолодження до кімнатної температури реакційну суміш концентрують у вакуумі. Залишок змішують з діетиловим етером, фільтрують та промивають діетиловим етером. Вихід: 18,0 г (67 % від теор.) + РХ-МС (метод 4): Чу = 1,20 хв.; МС (ESI-поз): m/z=211 [M+H] . 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,10 (д, 1H), 7,78 (д, 1H), 7,65 (с, 1H), 4,03 (кв, 2H), 3,06 (ш. с, 3H), 2,10 (ш. с, 3H), 1,12 (т, 3H). Приклад 9A 4-(4-циклобутилпіперазин-1-іл)-6-гідразинопіримідин N N N N H N 15 NH 2 Стадія a): 4-хлор-6-(4-циклобутилпіперазин-1-іл)піримідин N N N Cl N 20 25 1,8 г (8,4 ммоль) 1-циклобутилпіперазиндигідрохлориду (Zaragoza et al., J. Med. Chem. 2004, 47, 2833) поміщають в 18 мл води та змішують з 2,9 мл (2,1 г, 16,9 ммоль) N-етил-N-(пропан-2іл)пропан-2-аміну. Протягом 30 хвилин перемішують при кімнатній температурі та додають 1,3 г (8,4 ммоль) 4,6-дихлорпіримідину. Реакційну суміш протягом 1 години перемішують при 115 °C, охолоджують до кімнатної температури, змішують з 25 мл етилацетату та екстрагують 25 мл насиченого водного розчину гідрокарбонату натрію. Органічну фазу відокремлюють, сушать над сульфатом натрію, фільтрують та концентрують у вакуумі. Неочищений продукт очищують колонковою хроматографією на силікагелі (розчинник: дихлорметан/метанол 100/3). Вихід: 1,9 г (89 % від теор.) 16 UA 105487 C2 + ВЕРХ (метод 6): Чу = 2,79 хв.; MS (ПХІ): m/z=254 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,32 (с, 1H), 6,95 (с, 1H), 3,65-3,58 (м, 4H), 2,70 (квінтет, 1H), 2,27 (т, 4H), 2,00-1,93 (м, 2H), 1,87-1,75 (м, 2H), 1,67-1,55 (м, 2H). Стадія b): 4-(4-циклобутилпіперазин-1-іл)-6-гідразинопіримідин N N N N H N 5 10 15 NH 2 У розчин 1,9 г (7,5 ммоль) 4-хлор-6-(4-циклобутилпіперазин-1-іл)піримідину в 28 мл етанолу при перемішуванні по краплях при кімнатній температурі додають 4,4 мл (4,5 г, 89,7 ммоль) гідразингідрату. Реакційний розчин протягом 16 годин перемішують при 80 °C. Для обробки концентрують у вакуумі, залишок кілька разів перемішують у діетиловому етері, тверду речовину, що випала в осад, відфільтровують та сушать у вакуумі. Потім залишок очищують колонковою хроматографією на силікагелі (розчинник: дихлорметан/метанол 10/2). Вихід: 1,5 г (80 % від теор.) + РХ-МС (метод 6): Чу = 1,36 хв.; МС (ESI-поз): m/z=249 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 7,92 (с, 1H), 7,63 (с, 1H), 5,90 (NH), 4,09 (с, NH 2), 3,45 (т, 4H), 2,69 (квінтет, 1H), 2,26 (т, 4H), 2,00-1,93 (м, 2H), 1,82-1,75 (м, 2H), 1,67-1,60 (м, 2H). Приклад 10A 1-(6-гідразинілпіримідин-4-іл)азетидин-3-ол OH N N N H N NH2 Стадія a): 1-(6-хлорпіримідин-4-іл)азетидин-3-ол OH N N 20 25 Cl N 7,3 г (48,7 ммоль) 4,6-дихлорпіримідину суспендують в 140 мл води та змішують з 47 мл 1 N розчину їдкого натру. Додають 5,3 г (48,7 ммоль) 3-гідроксиазетидину та реакційну суміш протягом 3 днів перемішують при 90 °C. Після охолодження до кімнатної температури реакційну суміш концентрують у вакуумі та без очищення вводять у наступну реакцію. + РХ-МС (метод 5): Чу = 0,36 хв.; МС (ESI-поз): m/z=1.87 [M+H] . Стадія b): 1-(6-гідразинілпіримідин-4-іл)азетидин-3-ол 17 UA 105487 C2 OH N N 5 NH2 N H N У розчин 10,4 г (55,8 ммоль) 1-(6-хлорпіримідин-4-іл)азетидин-3-олу в 100 мл етанолу при перемішуванні при кімнатній температурі по краплях додають 27,2 мл (27,9 г, 279,1 ммоль) гідразингідрату. Реакційний розчин протягом 16 годин перемішують при 80 °C. Для обробки концентрують у вакуумі, осад відфільтровують та двічі промивають відповідно 10 мл етанолу. Вихід: 2,0 г (19 % від теор.) + РХ-МС (метод 1): Чу = 2,06 хв.; МС (ESI-поз): m/z=194 [M+H] . Приклад 11A 4-хлор-6-гідразинопіримідин Cl N 10 15 20 NH2 N H N У розчин 20,0 г (134,3 ммоль) 4,6-дихлорпіримідину в 300 мл етанолу при перемішуванні при кімнатній температурі по краплях додають 11,8 мл (12,1 г, 241,6 ммоль) гідразингідрату. Якщо під час додавання гідразингідрату спостерігається помутніння розчину, то додають ще певну кількість етанолу (прибл. 400 мл). Реакційний розчин протягом 12 годин перемішують при кімнатній температурі. Для обробки тверду речовину, що випала в осад, відфільтровують, залишок на фільтрі двічі промивають відповідно 150 мл води і двічі відповідно 100 мл діетилового етеру та продукт сушать у вакуумі. Із концентрованого маткового лугу одержують іншу кристалічну фракцію продукту. Вихід: 16,8 г (87 % від теор.). + РХ-МС (метод 1): Чу = 1,17 хв.; МС (ESI-поз): m/z=145 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,81 (с, 1H), 8,17 (ш. с, 1H), 6,75 (с, 1H), 4,48 (ш. с, 2H). Приклад 12A Гідрохлорид 2-(6-хлорпіримідин-4-іл)-4-(1H-1,2,3-триазол-1-іл)-1,2-дигідро-3H-піразол-3-ону Cl O N N N N N N x HCl N H 25 30 35 10,0 г (47,7 ммоль) сполуки з прикладу 8A та 8,3 г (57,1 ммоль) сполуки з прикладу 11A поміщають в 100 мл етанолу та змішують з 1,5 мл (2,2 г, 19,0 ммоль) трифтороцтової кислоти. Перемішують протягом 12 годин при кипінні зі зворотнім холодильником. Після цього у охолоджену реакційну суміш додають 4 M розчин хлороводню в діоксані у надлишку, перемішують протягом приблизно 1 години, кристали, що випали в осад, відфільтровують, а залишок на фільтрі промивають діоксаном і етанолом. Одержаний таким чином проміжний продукт розчиняють в 150 мл етанолу, змішують з 50 мл 25 %-ного метанольного розчину метилату натрію та протягом 2 годин перемішують при кімнатній температурі. Після цього у реакційній суміші за допомогою 1 N соляної кислоти встановлюють значення pH=5, протягом наступних 2 годин перемішують при кімнатній температурі, тверду речовину відфільтровують, залишок на фільтрі промивають етанолом, а продукт сушать у вакуумі. Вихід: 7,0 г (49 % від теор.). + РХ-МС (метод 5): Чу = 1,20 хв.; МС (ESI-поз): m/z=264 [M+H] . 18 UA 105487 C2 Приклад 13A Гідрохлорид 2-(6-хлорпіримідин-4-іл)-4-(1H-імідазол-1-іл)-1,2-дигідро-3H-піразол-3-ону Cl O N N N N N x HCl N H 5 10 15 10,0 г (47,8 ммоль) сполуки з прикладу 5A та 8,3 г (57,3 ммоль) сполуки з прикладу 11A поміщають в 100 мл етанолу та змішують з 1,5 мл (2,2 г, 19,0 ммоль) трифтороцтової кислоти. Протягом 12 годин перемішують при кипінні зі зворотнім холодильником. Кристали, що випали в осад, відфільтровують, залишок на фільтрі промивають етанолом, а проміжний продукт протягом ночі сушать у вакуумі. Потім його суспендують в 20 мл метанолу, змішують з 100 мл 4 M розчину хлороводню в діоксані та протягом 1 години перемішують при кімнатній температурі. Тверду речовину відфільтровують, залишок на фільтрі промивають діоксаном, етилацетатом і діізопропіловим етером та продукт сушать у вакуумі. Вихід: 4,6 г (32 % від теор.). + ВЕРХ (метод 6): Чу = 2,81 хв.; МС (ESI-поз): m/z=263 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 9,46 (с, 1H), 8,96 (с, 1H), 8,56 (с, 1H), 8,51 (д, 1H), 8,07-8,04 (м, 1H), 7,85-7,82 (м, 1H). Приклад 14A 4-(6-гідразинілпіримідин-4-іл)-1,4-оксазепан O N N N H N NH2 Стадія a): 4-(6-хлорпіримідин-4-іл)-1,4-оксазепан O N N N 20 25 Cl Суміш 3,0 г (20,1 ммоль) 4,6-дихлорпіримідину, 2,8 г (20,1 ммоль) 1,4-оксазепангідрохлориду та 6,4 г (60,4 ммоль) карбонату натрію в 45 мл води протягом 16 годин перемішують при кипінні зі зворотнім холодильником. Після охолодження до кімнатної температури реакційну суміш екстрагують етилацетатом. Органічну фазу промивають насиченим розчином хлориду натрію, сушать над сульфатом натрію та фільтрують. Фільтрат концентрують у вакуумі досуха. Одержують продукт у вигляді масла. Вихід: 3,9 г (86 % від теор.). + РХ-МС (метод 4): Чу = 1,32 хв.; МС (ESI-поз): m/z=214 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,33 (с, 1H), 6,86 (с, 1H), 3,99-3,52 (м, 8H), 1,84 (м, 2H). Стадія b): 4-(6-гідразинілпіримідин-4-іл)-1,4-оксазепан 19 UA 105487 C2 O N N NH 2 N H У розчин 3,9 г (18,0 ммоль) 4-(6-хлорпіримідин-4-іл)-1,4-оксазепана в 25 мл етанолу при перемішуванні при кімнатній температурі по краплях додають 8,8 мл (9,0 г, 180,2 ммоль) гідразингідрату. Через 16 годин перемішування при 80 °C реакційний розчин концентрують у вакуумі. Залишок перемішують у холодному етанолі, тверду речовину, що випала в осад, відфільтровують, а залишок на фільтрі промивають 25 мл діетилового етеру. Продукт сушать у вакуумі. Вихід: 1,4 г (36 % від теор.). + ВЕРХ (метод 11): Чу = 2,48 хв.; МС (ESI-поз): m/z=210 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 7,91 (с, 1H), 7,56 (ш. с, 1H), 5,81 (с, 1H), 4,12 (ш. с, 2H), 3,75-3,55 (м, 8H), 1,85 (квінтет, 2H). Приклади виконання Приклад 1 2-[6-(4-циклобутилпіперазин-1-іл)піримідин-4-іл]-4-(1H-імідазол-1-іл)-1,2-дигідро-3H-піразол3-он N 5 10 N N O N N N 15 20 25 30 N N N H Суміш 211 мг (1,0 ммоль) сполуки з прикладу 5A та 250 мг (1,0 ммоль) сполуки з прикладу 9A в 4 мл етилацетату змішують з 16 мкл (23 мл, 0,2 ммоль) трифтороцтової кислоти та протягом 20 годин перемішують при 100 °C. Реакційну суміш концентрують у вакуумі, знову змішують з такою ж кількістю етилацетату і трифтороцтової кислоти та знову протягом 20 годин перемішують при 100 °C. Реакційну суміш охолоджують до кімнатної температури, тверду речовину, що випала в осад, відфільтровують та промивають діетиловим етером. Залишок попередньо очищують колонковою хроматографією на силікагелі (розчинник: дихлорметан/метанол/аміак 10/2/0.2) та очищують препаративною ВЕРХ (ОФ-С18-колонка; розчинник: градієнт ацетонітрил/вода). Вихід: 137 мг (36 % від теор.). + ВЕРХ (метод 6): Чу = 2,73 хв.; МС (ESI-поз): m/z=367 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,40 (с, 1H), 8,12 (с, 1H), 7,90 (с, 1H), 7,74 (с, 1H), 7,50 (с, 1H), 7,07 (с, 1H), 3,65-3,58 (м, 4H), 2,77 (квінтет, 1H), 2,38-2,35 (м, 4H), 2,01-1,96 (м, 2H), 1,891,79 (м, 2H), 1,67-1,62 (м, 2H). Приклад 2 2-[6-(4-циклобутилпіперазин-1-іл)піримідин-4-іл]-4-(1H-1,2,3-триазол-1-іл)-1,2-дигідро-3Hпіразол-3-он 20 UA 105487 C2 N N O N N N N N N N H 5 10 15 Суміш 211 мг (1,0 ммоль) сполуки з прикладу 8A та 250 мг (1,0 ммоль) сполуки з прикладу 9A в 4 мл етилацетату змішують з 16 мкл (23 мг, 0,2 ммоль) трифтороцтової кислоти та протягом 20 годин перемішують при 100 °C. Реакційну суміш концентрують у вакуумі, знову змішують з такою ж кількістю етилацетату і трифтороцтової кислоти та протягом 3 днів перемішують при 100 °C. Реакційну суміш охолоджують до кімнатної температури, тверду речовину, що випала в осад, відфільтровують та промивають діетиловим етером. Залишок суспендують в 2 мл води, розчиняють шляхом додавання водного 1 N розчину їдкого натру (pH=9-10) та очищують препаративною ВЕРХ (ОФ-С18-колонка; розчинник: градієнт ацетонітрил/вода). Вихід: 195 мг (51 % від теор.). + ВЕРХ (метод 6): Чу = 2,90 хв.; МС (ESI-поз): m/z=368 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,41 (с, 1H), 8,40 (с, 1H), 7,88 (с, 1H), 7,82 (с, 1H), 7,75 (с, 1H), 3,70-3,65 (м, 4H), 3,03-2,97 (м, 1H), 2,60-2,57 (м, 4H), 2,06-2,02 (м, 2H), 1,98-1,90 (м, 2H), 1,70-1,64 (м, 2H). Приклад 3 1-{2-[6-(4-циклобутилпіперазин-1-іл)піримідин-4-іл]-3-оксо-2,3-дигідро-1H-піразол-4-іл}-1Hімідазол-4-карбонітрил N N O N N N 20 25 30 N N CN N H Суміш 236 мг (1,0 ммоль) сполуки з прикладу 6A та 250 мг (1,0 ммоль) сполуки з прикладу 9A в 4 мл етилацетату змішують з 16 мкл (23 мг, 0,2 ммоль) трифтороцтової кислоти та протягом 20 годин перемішують при 100 °C. Реакційну суміш концентрують у вакуумі, знову змішують з такою ж кількістю етилацетату і трифтороцтової кислоти та протягом 3 днів перемішують при 100 °C. Реакційну суміш охолоджують до кімнатної температури, тверду речовину, що випала в осад, відфільтровують та промивають діетиловим етером. Залишок суспендують в 2 мл води, розчиняють шляхом додавання водного 1 N розчину їдкого натру (pH=9-10) та очищують препаративною ВЕРХ (ОФ-С18-колонка; розчинник: градієнт ацетонітрил/вода). Вихід: 219 мг (56 % від теор.). + ВЕРХ (метод 6): Чу = 3,10 хв.; МС (ESI-поз): m/z=392 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,38 (д, 1H), 8,37 (д, 1H), 8,17 (д, 1H), 7,82 (с, 1H), 7,80 (с, 1H), 3,68-3,62 (м, 4H), 3,38-3,30 (м, 4H), 2,96-2,91 (м, 1H), 2,06-2,00 (м, 2H), 1,95-1,85 (м, 2H), 1,70-1,63 (м, 2H). Приклад 4 1-{2-[6-(3-гідроксиазетидин-1-іл)піримідин-4-іл]-3-оксо-2,3-дигідро-1H-піразол-4-іл}-1H 21 UA 105487 C2 імідазол-4-карбонітрил HO N O N N N N N CN N H 5 10 15 20 Суміш 700 мг (3,0 ммоль) сполуки з прикладу 6A та 541 мг (3,0 ммоль) сполуки з прикладу 10A в 10 мл етилацетату змішують з 46 мкл (68 мг, 0,6 ммоль) трифтороцтової кислоти та протягом 10 годин перемішують при 100 °C. Реакційну суміш концентрують у вакуумі, поміщають в 5 мл етанолу, а осад відфільтровують. Тверду речовину суспендують в 10 мл води та змішують з 1 N розчином їдкого натру до розчинення (pH=9). Потім за допомогою 1 N розчину соляної кислоти встановлюють значення pH=7, концентрують до об'єму приблизно 5 мл, а утворений осад відфільтровують. Залишок промивають водою і діізопропіловим етером та хроматографують препаративною ВЕРХ (метод 8). Після цього тверду речовину суспендують в 10 мл води та до розчинення змішують з 1 N розчином їдкого натру (pH=9). Після цього 1 N розчином соляної кислоти встановлюють значення pH=7, концентрують до прибл. 2,5 мл об'єму, а утворений осад відфільтровують. Фільтрат концентрують до прибл. 2 мл та знову фільтрують. Обидва залишки об'єднують, промивають водою і етилацетатом та сушать у вакуумі. Вихід: 78 мг (8 % від теор.). + ВЕРХ (метод 6): Чу = 2,90 хв.; МС (ESI-поз): m/z=325 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,35 (с, 1H), 8,29 (с, 1H), 8,17 (с, 1H), 7,66 (с, 1H), 7,34 (с, 1H), 5,80-5,75 (м, 1H), 4,63-4,58 (м, 1H), 4,24-4,20 (м, 2H), 3,75-3,73 (м, 2H). Приклад 5 1-{6-[4-(1H-імідазол-1-іл)-5-оксо-2,5-дигідро-1H-піразол-1-іл]піримідин-4-іл}-азетидин-3карбонова кислота OH O N O N N N N N N H 25 30 35 46 мг (0,3 ммоль) гідрохлориду азетидин-3-карбонової кислоти поміщають у суміш 1 мл води і 0,3 мл етанолу. Додають 100 мг (0,3 ммоль) сполуки з прикладу 13A та протягом 1 години перемішують при 100 °C. Після цього у реакційній суміші за допомогою водного 1 N розчину їдкого натру встановлюють значення pH=7 та протягом 16 годин перемішують при 100 °C. Знову за допомогою водного 1 N розчину їдкого натру встановлюють значення pH=7 та протягом 1 години перемішують при 150 °C в однорежимній мікрохвильовій печі (Emrys Optimizer). Реакційну суміш концентрують у вакуумі та очищують препаративною ВЕРХ (ОФ-С18-колонка; розчинник: градієнт ацетонітрил/вода). Вихід: 23 мг (21 % від теор.). + РХ-МС (мтод 8): Чу = 0,86 хв.; МС (ESI-поз): m/z=328 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,41 (с, 1H), 7,79 (с, 1H), 7,47 (с, 1H), 7,36 (с, 1H), 7,31 (с, 1H), 6,89 (с, 1H), 4,09 (т, 2H), 3,99 (т, 2H). Приклад 6 1-{6-[5-оксо-4-(1H-1,2,3-триазол-1-іл)-2,5-дигідро-1H-піразол-1-іл]піримідин-4-іл}-азетидин-3карбонова кислота 22 UA 105487 C2 OH O N O N N N N N N N H 5 10 55 мг (0,4 ммоль) гідрохлориду азетидин-3-карбонової кислоти поміщають в 2 мл води. Додають 100 мг (0,3 ммоль) сполуки з прикладу 12A та за допомогою водного 1 N розчину їдкого натру встановлюють значення pH=7. Протягом 1 години піддають взаємодії в однорежимній мікрохвильовій печі (Emrys Optimizer) при 150 °C. Реакційну суміш концентрують у вакуумі та очищують препаративною ВЕРХ (ОФ-С18-колонка; розчинник: градієнт ацетонітрил/вода). Вихід: 15 мг (13 % від теор.). + ВЕРХ (метод 6): Чу = 2,81 хв.; МС (ESI-поз): m/z=329 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,42 (с, 1H), 8,26 (с, 1H), 7,70 (с, 1H), 7,67 (с, 1H), 7,34 (с, 1H), 4,05-3,96 (м, 2H і 2H), 3,13-3,07 (м, 1H). Приклад 7 4-(1H-імідазол-1-іл)-2-[6-(3-метилазетидин-1-іл)піримідин-4-іл]-1,2-дигідро-3H-піразол-3-он H3C N O N N N N N N H 15 20 25 43 мг (0,4 ммоль) 3-метилазетидингідрохлориду, 100 мг (0,3 ммоль) сполуки з прикладу 13A і 174 мкл (130 мг, 1,0 ммоль) N-етил-N-(пропан-2-іл)пропан-2-аміну суспендують в 2 мл тетрагідрофурану та протягом 4,5 годин піддають взаємодії в однорежимній мікрохвильовій печі (Emrys Optimizer) при 120 °C. Реакційну суміш концентрують у вакуумі, поміщають у воду при додаванні водного 1 N розчину їдкого натру (pH=9-10) та очищують препаративною ВЕРХ (ОФС18-колонка; розчинник: градієнт ацетонітрил/вода). Вихід: 30 мг (30 % від теор.) + ВЕРХ (метод 6): Чу = 3,07 хв.; МС (ESI-поз): m/z=298 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,25 (с, 1H), 7,81 (с, 1H), 7,46 (с, 1H), 7,39 (с, 1H), 7,31 (с, 1H), 6,88 (с, 1H), 4,10 (т, 2H), 3,54 (дд, 2H), 2,86-2,75 (м, 1H), 1,25 (д, 3H). Приклад 8 2-[6-(3-метилазетидин-1-іл)піримідин-4-іл]-4-(1H-1,2,3-триазол-1-іл)-1,2-дигідро-3H-піразол-3он H3C N O N N N N N N N H 43 мг (0,4 ммоль) 3-метилазетидингідрохлориду, 100 мг (0,3 ммоль) сполуки з прикладу 12A і 174 мкл (130 мг, 1,0 ммоль) N-етил-N-(пропан-2-іл)пропан-2-аміну суспендують в 2 мл 23 UA 105487 C2 5 10 тетрагідрофурану та протягом 1,5 годин піддають взаємодії в однорежимній мікрохвильовій печі (Emrys Optimizer) при 120 °C. Реакційну суміш концентрують у вакуумі, поміщають у воду при додаванні водного 1 N розчину їдкого натру (pH=9-10) та очищують препаративною ВЕРХ (ОФС18-колонка; розчинник: градієнт ацетонітрил/вода). Вихід: 25 мг (25 % від теор.). + ВЕРХ (метод 6): Чу = 3,00 хв.; МС (ESI-поз): m/z=299 [M+H] ; 1 H-ВЕРХ (400 МГц, ДМСО-d6): δ = 8,41 (с, 1H), 8,27 (с, 1H), 7,70 (с, 1H), 7,67 (с, 1H), 7,41 (с, 1H), 4,11 (т, 2H), 3,56 (дд, 2H), 2,86-2,78 (м, 1H), 1,25 (д, 3H). Приклад 9 2-{6-[3-(диметиламіно)азетидин-1-іл]піримідин-4-іл}-4-(1H-1,2,3-триазол-1-іл)-1,2-дигідро-3Hпіразол-3-ону дигідрохлорид H3C CH3 N N O N N N N 15 20 25 N N N x 2 HCl H 271 мг (1,5 ммоль) N, N-диметилазетидин-3-аміндигідрохлориду, 400 мг (1,5 ммоль) сполуки з прикладу 12A і 847 мг (6,1 ммоль) карбонату калію суспендують в 8 мл N, Nдиметилформаміду та протягом 16 годин перемішують при 100 °C. Реакційну суміш концентрують у вакуумі та очищують препаративною ВЕРХ (ОФ-С18-колонка; розчинник: градієнт ацетонітрил/вода при додаванні 0,1 %-ної трифтороцтової кислоти). Подальше очищення здійснюють препаративною ВЕРХ (ОФ-С18-колонка; розчинник: градієнт ацетонітрил/вода при додаванні 0,1 %-ної мурашиної кислоти). Фракції, що містять продукт, змішують з 2 мл 1 N розчину соляної кислоти та протягом 1 години перемішують при кімнатній температурі. Тверду речовину відфільтровують та сушать у високому вакуумі. Вихід: 62 мг (17 % від теор.). + РХ-МС (метод 5): Чу = 0,19 хв.; МС (ESI-поз): m/z=328 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,42 (с, 1H), 8,28 (с, 1H), 7,69 (с, 1H), 7,66 (с, 1H), 7,52 (с, 1H), 4,02 (т, 2H), 3,76 (дд, 2H), 3,24-3,18 (м, 1H), 2,12 (с, 6H). Приклад 10 2-[6-(4,4-дифторпіперидин-1-іл)піримідин-4-іл]-4-(1H-імідазол-1-іл)-1,2-дигідро-3H-піразол-3он F F N O N N N N N N H 30 35 100 мг (0,3 ммоль) сполуки з прикладу 13A, 63 мг (0,4 ммоль) 4,4дифторпіперидингідрохлориду і 116 мкл (86 мг, 0,7 ммоль) N-етил-N-(пропан-2-іл)пропан-2аміну поміщають в 2 мл тетрагідрофурану та протягом 2,5 годин піддають взаємодії в однорежимній мікрохвильовій печі (Emrys Optimizer) при 120 °C. Після концентрування у вакуумі залишок поміщають у суміш ацетонітрил/вода та очищують препаративною ВЕРХ (ОФ-С18колонка; розчинник: градієнт ацетонітрил/вода). Вихід: 82 мг (71 % від теор.). + ВЕРХ (метод 6): Чу = 3,37 хв.; МС (ESI-поз): m/z=348 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,49 (с, 1H), 8,38 (с, 1H), 8,15 (с, 1H), 7,76 (с, 1H), 7,64 (с, 1H), 7,22 (с, 1H), 3,80 (т, 4H), 2,06 (гептет, 4H). 24 UA 105487 C2 Приклад 11 2-[6-(4,4-дифторпіперидин-1-іл)піримідин-4-іл]-4-(1H-1,2,3-триазол-1-іл)-1,2-дигідро-3Hпіразол-3-он F F N O N N N N N N N H 5 10 15 250 мг (0,8 ммоль) сполуки з прикладу 12A, 158 мг (1,0 ммоль) 4,4дифторпіперидингідрохлориду та 435 мкл (323 мг, 2,5 ммоль) N-етил-N-(пропан-2-іл)-пропан-2аміну поміщають в 5 мл тетрагідрофурану та протягом 30 хвилин піддають взаємодії в однорежимній мікрохвильовій печі (Emrys Optimizer) при 120 °C. Після попереднього очищення препаративною ВЕРХ (ОФ-С18-колонка; розчинник: градієнт ацетонітрил/вода) продукт додатково очищують колонковою хроматографією на силікагелі (розчинник: дихлорметан/метанол, 10/1). Вихід: 29 мг (10 % від теор.). + ВЕРХ (метод 6): Чу = 3,49 хв.; МС (ESI-поз): m/z=349 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,56 (с, 1H), 8,39 (с, 1H), 8,30 (с, 1H), 7,87 (с, 1H), 7,57 (с, 1H), 3,91-3,81 (м, 4H), 2,09 (гептет, 4H). Приклад 12 1-{2-[6-(4,4-дифторпіперидин-1-іл)піримідин-4-іл]-3-оксо-2,3-дигідро-1H-піразол-4-іл}-1Hімідазол-4-карбонітрил F F N O N N N N N CN N H 20 25 30 Суміш 200 мг (1,4 ммоль) сполуки з прикладу 11A, 262 мг (1,7 ммоль) 4,4дифторпіперидингідрохлориду і 289 мкл (215 мг, 1,7 ммоль) N-етил-N-(пропан-2-іл)-пропан-2аміну в 3 мл води протягом 16 годин перемішують при 100 °C. Після додавання 53 мкл (79 мг, 0,7 ммоль) трифтороцтової кислоти і 324 мг (1,4 ммоль) сполуки з прикладу 6A реакційну суміш протягом 16 годин перемішують при 100 °C. Тверду речовину, що випала в осад, відфільтровують та помивають спочатку водою, а потім діетиловим етером. Продукт сушать у вакуумі. Вихід: 111 мг (21 % від теор.). + РХ-МС (метод 4): Чу = 1,69 хв.; МС (ESI-поз): m/z=373 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,55 (с, 1H), 8,44 (д, 1H), 8,33 (с, 1H), 8,22 (д, 1H), 7,60 (ш. с, 1H), 3,84 (ш. с, 4H), 2,09 (гептет, 4H). Приклад 13 1-{2-[6-(4,4-дифторпіперидин-1-іл)піримідин-4-іл]-3-оксо-2,3-дигідро-1H-піразол-4-іл}-1H1,2,3-триазол-4-карбонітрил 25 UA 105487 C2 F F N O N N N N N N CN N H 5 10 Суміш 200 мг (1,4 ммоль) сполуки з прикладу 11A, 262 мг (1,7 ммоль) 4,4дифторпіперидингідрохлориду та 289 мкл (215 мг, 1,7 ммоль) N-етил-N-(пропан-2-іл)пропан-2аміну в 3 мл води протягом 16 годин перемішують при 100 °C. Після додавання 53 мкл (79 мг, 0,7 ммоль) трифтороцтової кислоти і 325 мг (1,4 ммоль) сполуки з прикладу 7A реакційну суміш протягом 16 годин перемішують при 100 °C. Тверду речовину, що випала в осад, відфільтровують та промивають спочатку водою, а потім діетиловим етером. Продукт сушать у вакуумі. Вихід: 34 мг (7 % від теор.). + РХ-МС (метод 4): Чу = 1,77 хв.; МС (ESI-поз): m/z=374 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 9,24 (с, 1H), 8,59 (с, 1H), 8,27 (с, 1H), 7,54 (с, 1H), 3,90 (ш. с, 4H), 2,12 (гептет, 4H). Приклад 14 2-[6-(3,3-дифторпіролідин-1-іл)піримідин-4-іл]-4-(1H-імідазол-1-іл)-1,2-дигідро-3H-піразол-3он F F N O N N N 15 20 25 N N N H 100 мг (0,3 ммоль) сполуки з прикладу 13A, 58 мг (0,4 ммоль) 3,3-дифторпіролідингідрохлориду і 175 мкл (130 мг, 1,0 ммоль) N-етил-N-(пропан-2-іл)пропан-2-аміну поміщають у 2 мл тетрагідрофурану та протягом 1 години піддають взаємодії в однорежимній мікрохвильовій печі (Emrys Optimizer) при 120 °C. Після концентрування у вакуумі залишок поміщають у суміш ацетонітрил/вода та очищують препаративною ВЕРХ (ОФ-С18-колонка; розчинни: градієнт ацетонітрил/вода). Вихід: 111 мг (99 % від теор.). + ВЕРХ (метод 6): Чу = 3,18 хв.; МС (ESI-поз): m/z=334 [M+H] ; 1 H-ЯМР (400 МГц, метанол-d4): δ = 8,41 (с, 1H), 7,85 (с, 1H), 7,62 (с, 1H), 7,56 (с, 1H), 7,29 (с, 1H), 7,03 (с, 1H), 3,91 (т, 2H), 3,76 (т, 2H), 2,55 (гептет, 2H). Приклад 15 2-[6-(3,3-дифторпіролідин-1-іл)піримідин-4-іл]-4-(1H-1,2,3-триазол-1-іл)-1,2-дигідро-3Hпіразол-3-он 26 UA 105487 C2 F F N O N N N N N N N H 5 10 100 мг (0.8 ммоль) сполуки з прикладу 12A, 57 мг (0,4 ммоль) 3,3-дифторпіролідингідрохлориду і 174 мкл (129 мг, 1,0 ммоль) N-етил-N-(пропан-2-іл)пропан-2-аміну поміщають в 2 мл тетрагідрофурану та протягом 30 хвилин години піддають взаємодії в однорежимній мікрохвильовій печі (Emrys Optimizer) при 120 °C. Після концентрування у вакуумі залишок поміщають у суміш ацетонітрил/вода та очищують препаративною ВЕРХ (ОФ-С18-колонка; розчинник: градієнт ацетонітрил/вода). Вихід: 13 мг (12 % від теор.). + ВЕРХ (метод 6): Чу = 3,33 хв.; МС (ESI-поз): m/z=335 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,42 (с, 1H), 8,35 (с, 1H), 7,72-7,66 (м, 3H), 3,87 (т, 2H), 3,65 (т, 2H), 2,64-2,50 (м, частково перекривається сигналом ДМСО, 2H). Приклад 16 1-{2-[6-(3,3-дифторпіролідин-1-іл)піримідин-4-іл]-3-оксо-2,3-дигідро-1H-піразол-4-іл}-1Hімідазол-4-карбонітрил F F N O N N N 15 20 25 30 N N CN N H Суміш 200 мг (1,4 ммоль) сполуки з прикладу 11A, 238 мг (1,7 ммоль) 3,3дифторпіролідингідрохлориду та 289 мкл (215 мг, 1,7 ммоль) N-етил-N-(пропан-2-іл)-пропан-2аміну в 3 мл води протягом 16 годин перемішують при 100 °C. Після додавання 53 мкл (79 мг, 0,7 ммоль) трифтороцтової кислота і 324 мг (1,4 ммоль) сполуки з прикладу 6A реакційну суміш протягом 16 годин перемішують при 100 °C. Потім реакційну суміш змішують з 1 мл 1 N розчином соляної кислоти. Гідрохлорид неочищеного продукту, який при цьому випадає в осад, відфільтровують, промивають діетиловим етером і сушать. Неочищений продукт містить також неперетворену вихідну сполуку (сполуку з прикладу 11A). Тому неочищений продукт разом з 108 мкл (80 мг, 0,6 ммоль) N-етил-N-(пропан-2-іл)пропан-2-аміну, 10 мг (0,1 ммоль) 3,3дифторпіролідингідрохлориду і 2 мл води протягом 15 хвилин піддають взаємодії в однорежимній мікрохвильовій печі (Emrys Optimizer) при 170 °C. Реакційний розчин очищують препаративною ВЕРХ (ОФ-С18-колонка; розчинник: градієнт ацетонітрил/вода). Вихід: 30 мг (6 % від теор.). + РХ-МС (метод 4): Чу = 1,58 хв.; МС (ESI-поз): m/z=359 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,55 (с, 1H), 8,44 (д, 1H), 8,33 (с, 1H), 8,21 (д, 1H), 7,26 (ш. с, 1H), 3,99 (т, 2H), 3,75 (ш. с, 2H), 2,66-2,54 (м, частково перекривається сигналом ДМСО, 2H). Приклад 17 1-{2-[6-(3,3-дифторпіролідин-1-іл)піримідин-4-іл]-3-оксо-2,3-дигідро-1H-піразол-4-іл}-1H-1,2,3триазол-4-карбонітрил 27 UA 105487 C2 F F N O N N N N N N CN N H 5 10 Суміш 200 мг (1,4 ммоль) сполуки з прикладу 11A, 238 мг (1,7 ммоль) 3,3дифторпіролідингідрохлориду і 289 мкл (215 мг, 1,7 ммоль) N-етил-N-(пропан-2-іл)пропан-2аміну в 3 мл води протягом 16 годин перемішують при 100 °C. Після додавання 53 мкл (79 мг, 0,7 ммоль) трифтороцтової кислоти і 325 мг (1,4 ммоль) сполуки з прикладу 7A реакційну суміш протягом 16 годин перемішують при 100 °C. Тверду речовину, що випала в осад, відфільтровують та промивають спочатку водою, а потім діетиловим етером. Продукт сушать у вакуумі. Вихід: 137 мг (27 % від теор.). + РХ-МС (метод 4): Чу = 1,66 хв.; МС (ESI-поз): m/z=360 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 9,5 (с, 1H), 8,61 (с, 1H), 8,29 (с, 1H), 7,21 (ш. с, 1H), 4,06 (т, 2H), 3,82 (ш. с, 2H), 2,69-2,55 (м, частково перекривається сигналом ДМСО, 2H). Приклад 18 2-[6-(3,3-дифторазетидин-1-іл)піримідин-4-іл]-4-(1H-імідазол-1-іл)-1,2-дигідро-3H-піразол-3он F F N O N N N 15 20 25 N N N H 100 мг (0,3 ммоль) сполуки з прикладу 13A, 52 мг (0,4 ммоль) 3,3-дифторазетидингідрохлориду і 175 мкл (130 мг, 1,0 ммоль) N-етил-N-(пропан-2-іл)пропан-2-аміну поміщають в 2 мл тетрагідрофурану та протягом 3 годин піддають взаємодії в однорежимній мікрохвильовій печі (Emrys Optimizer) при 120 °C. Тверду речовину, що випала в осад, відфільтровують, а фільтрат концентрують у вакуумі. Залишок поміщають у суміш ацетонітрил/вода та очищують препаративною ВЕРХ (ОФ-С18-колонка; розчинник: градієнт ацетонітрил/вода). Вихід: 36 мг (32 % від теор.). + ВЕРХ (метод 6): Чу = 3,00 хв.; МС (ESI-поз): m/z=320 [M+H] ; 1 H-ЯМР (400 МГц, ДМСО-d6): δ = 8,42 (с, 1H), 8,16 (с, 1H), 7,79 (с, 1H), 7,56 (с, 1H), 7,50 (с, 1H), 7,07 (с, 1H), 4,49 (т, 4H). Приклад 19 2-[6-(3,3-дифторазетидин-1-іл)піримідин-4-іл]-4-(1H-1,2,3-триазол-1-іл)-1,2-дигідро-3Hпіразол-3-он 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted dihydropyrazolones as inhibitors of hif-prolyl-4-hydroxylases
Автори англійськоюJeske Mario, Flamme, Ingo, Stoll Friederike, Beck Hartmut, Akbaba, Metin
Автори російськоюЕске Марио, Штолль Фридерике, Бекк Хартмут
МПК / Мітки
МПК: A61K 31/5355, C07D 403/14, A61K 31/506, A61P 9/00, A61P 7/06, C07D 401/14, C07D 413/14, A61P 13/12, A61K 31/553
Мітки: заміщені, дигідропіразолони, нif-проліл-4-гідроксилази, інгібітори
Код посилання
<a href="https://ua.patents.su/45-105487-zamishheni-digidropirazoloni-yak-ingibitori-nif-prolil-4-gidroksilazi.html" target="_blank" rel="follow" title="База патентів України">Заміщені дигідропіразолони як інгібітори нif-проліл-4-гідроксилази</a>
Попередній патент: Спосіб кріплення поворотного редуктора до корпуса гірничого очисного комбайна
Наступний патент: Регульований вставний навушник з двома елементами динаміка
Випадковий патент: Спосіб приготування порошкоподібного напівфабрикату на основі пряних овочів












