Спосіб одержання глюкопіранозилзаміщених похідних бензилбензолу, проміжні продукти та способи їх одержання
Номер патенту: 99896
Опубліковано: 25.10.2012
Автори: Сенанаяке Кріс Х., Тан Вен'юнь, Чжан Лі, Екхардт Маттіас, Хан Чженсюй, Сунь Сюфен, Крішнамурті Дхілеепкумар, Хіммельсбах Франк, Ван Сяо-цзюнь
Формула / Реферат
1. Спосіб одержання сполуки загальної формули І
 , I
, I
у якій
R1 означає R-тетрагідрофуран-3-іл, S-тетрагідрофуран-3-іл або тетрагідропіран-4-іл; і
R3 означає водень;
що характеризується тим, що в сполуці загальної формули II
 , II
, II
у якій R1 є таким, як визначено вище, і
R2 незалежно один від одного означають водень, (С1-С18-алкіл)карбоніл, (С1-С18-алкіл)оксикарбоніл, арилкарбоніл, арил-(С1-С3-алкіл)-карбоніл, арил-С1-С3-алкіл, аліл, RaRbRcSi, CRaRbORc, де дві сусідні групи R2 можуть бути зв'язані одна з одною з утворенням місткової групи SiRaRb, CRaRb або CRaORb-CRaORb; за умови, що щонайменше один замісник R2 не означає водень;
Ra, Rb, Rc незалежно один від одного означають С1-С4-алкіл, арил або арил-С1-С3-алкіл, де алкільні групи можуть бути моно- або полізаміщеними галогеном;
де арильні групи, вказані у визначенні приведених вище груп, означають фенільні або нафтильні групи, які можуть бути моно- або полізаміщеними за допомогою L1;
L1 незалежно один від одного вибрані з групи, що включає фтор, хлор, бром, С1-С3-алкіл, С1-С4-алкоксигрупу і нітрогрупу;
захисні групи R2, що не означають водень, відщеплюють.
2. Спосіб одержання сполуки загальної формули II
 , II
, II
у якій
R1 є таким, як визначено вище, і
R2 незалежно один від одного означають водень, (С1-С18-алкіл)карбоніл, (С1-С18-алкіл)оксикарбоніл, арилкарбоніл, арил-(С1-С3-алкіл)-карбоніл, арил-С1-С3-алкіл, аліл, RaRbRcSi, CRaRbORc, де дві сусідні групи R2 можуть бути зв'язані одна з одною з утворенням місткової групи SiRaRb, CRaRb або CRaORb-CRaORb;
Ra, Rb, Rc незалежно один від одного означають С1-С4-алкіл, арил або арил-С1-С3-алкіл, де алкільні групи можуть бути моно- або полізаміщеними галогеном;
де арильні групи, вказані у визначенні приведених вище груп, означають фенільні або нафтильні групи, які можуть бути моно- або полізаміщеними за допомогою L1;
L1 незалежно один від одного вибрані з групи, що включає фтор, хлор, бром, С1-С3-алкіл, С1-С4-алкоксигрупу і нітрогрупу;
що характеризується тим, що сполуку загальної формули III
 , ІІІ
, ІІІ
у якій R1 і всі R2 є такими, як визначено вище, і
R' означає водень, С1-С6-алкіл, (С1-С4-алкіл)карбоніл, (С1-С4-алкіл)оксикарбоніл, арилкарбоніл, арил-(С1-С3-алкіл)карбоніл;
де "арил" є таким, як визначено вище;
вводять в реакцію з відновлюючим реагентом.
3. Спосіб одержання сполуки загальної формули III
 , ІІІ
, ІІІ
у якій
R1 означає R-тетрагідрофуран-3-іл, S-тетрагідрофуран-3-іл або тетрагідропіран-4-іл; і
R2 незалежно один від одного означають водень, (С1-С18-алкіл)карбоніл, (С1-С18-алкіл)оксикарбоніл, арилкарбоніл, арил-(С1-С3-алкіл)-карбоніл, арил-С1-С3-алкіл, аліл, RaRbRcSi, CRaRbORc, де дві сусідні групи R2 можуть бути зв'язані одна з одною з утворенням місткової групи SiRaRb, CRaRb або CRaORb-CRaORb; і
R' означає водень, С1-С6-алкіл, (С1-С4-алкіл)карбоніл, (С1-С4-алкіл)оксикарбоніл, арилкарбоніл, арил-(С1-С3-алкіл)карбоніл;
Ra, Rb, Rc незалежно один від одного означають С1-С4-алкіл, арил або арил-С1-С3-алкіл, де алкільні групи можуть бути моно- або полізаміщеними галогеном;
де арильні групи, вказані у визначенні приведених вище груп, означають фенільні або нафтильні групи, які можуть бути моно- або полізаміщеними за допомогою L1;
L1 незалежно один від одного вибрані з групи, що включає фтор, хлор, бром, С1-С3-алкіл, С1-С4-алкоксигрупу і нітрогрупу;
що характеризується тим, що металоорганічну сполуку формули VI
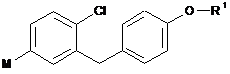 , VI
, VI
у якій R1 є таким, як визначено, і М означає Li або MgHal, де Hal означає Сl, Вr або І;
або її похідну, одержану переметалюванням;
де вказану сполуку формули VI можна одержати шляхом обміну галоген-метал або шляхом впровадження металу в зв'язок вуглець-галоген галогенобензилбензолу загальної формули V
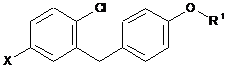 , V
, V
у якій R1 є таким, як визначено вище, і X означає Вr або І;
додають до глюконолактону загальної формули IV
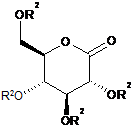 , ІV
, ІV
у якій R2 є таким, як визначено вище,
потім одержаний аддукт вводять в реакцію з водою або спиртом R'-OH, де R' означає С1-С6-алкіл, у присутності кислоти і необов'язково продукт, одержаний за реакцією з водою, де R' означає Н, в подальшій реакції з ацилуючим реагентом перетворюють на продукт формули III, в якій R' означає (С1-С4-алкіл)карбоніл, (С1-С4-алкіл)оксикарбоніл, арилкарбоніл або арил-(С1-С3-алкіл)карбоніл, де "арил" є таким, як визначено вище.
4. Спосіб за п. 3, в якому перед здійсненням реакції з глюконолактоном загальної формули ІV додатково здійснюють переметалювання.
5. Спосіб одержання сполуки загальної формули II
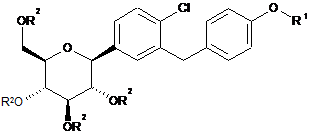 , II
, II
у якій R1 і R2 є такими, як визначено в п. 2, що характеризується тим, що похідну бензоїлхлориду формули XII
 , XII
, XII
у якій X означає атом брому або атом йоду; або її похідну, таку як ангідрид, складний ефір бензойної кислоти або бензонітрил; вводять в реакцію з галогенбензолом формули XXVII
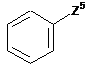 , XXVII
, XXVII
у якій Ζ5 означає атом фтору, хлору або йоду;
у присутності каталізатора й одержують проміжну сполуку формули XXVI
 , XXVI
, XXVI
у якій X і Ζ5 є такими, як визначено вище; й
проміжну сполуку формули XXVI вводять в реакцію з R1-OH, де R1 є таким, як визначено вище, або його аніоном, у присутності основи й одержують похідну бензофенону формули VII
 , VII
, VII
у якій X та R1 є такими, як визначено вище; й
похідну бензофенону формули VII вводять в реакцію з відновним реагентом у присутності кислоти Льюїса й одержують аглікон формули V
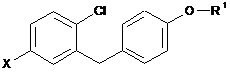 , V
, V
у якій
X і R1 є такими, як визначено вище; та
вказану сполуку загальної формули V перетворюють на металоорганічну сполуку формули VI
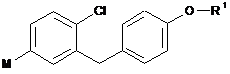 , VI
, VI
у якій R1 є таким, як визначено вище, і Μ означає Li або MgHal, де Hal означає Сl, Br або І;
шляхом обміну галоген-метал або шляхом впровадження металу в зв'язок вуглець-галоген сполуки загальної формули V; і
вказану металоорганічну сполуку формули VI вводять в реакцію з глюконолактоном загальної формули IV
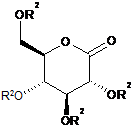 , ІV
, ІV
у якій R2 є таким, як визначено вище, способом за п. 3, і одержують проміжний продукт формули III
 , ІІІ
, ІІІ
у якій R2, R' і R1 є такими, як визначено в п. 3, і
вказаний проміжний продукт формули III вводять в реакцію з відновлюючим реагентом за п. 2, і одержують сполуку формули II.
6. Спосіб за п. 5, в якому при перетворенні сполуки загальної формули V після стадії обміну галоген-метал або впровадження металу в зв'язок вуглець-галоген додатково здійснюють переметалювання.
7. Спосіб за п. 5, в якому у формулі II замісник R2 означає водень і у формулі IV замісник R2 означає захисну групу, визначену в п. 3, і у формулі III замісник R2 має таке ж значення, як у формулі IV, або означає водень.
8. Спосіб за одним з попередніх пунктів, в якому R1 означає R-тетрагідрофуран-3-іл або S-тетрагідрофуран-3-іл.
9. Сполука загальної формули II
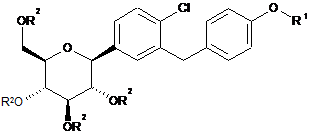 , II
, II
у якій
R1 означає R-тетрагідрофуран-3-іл, S-тетрагідрофуран-3-іл або тетрагідропіран-4-іл; і
R2 незалежно один від одного означають водень, (С1-С18-алкіл)карбоніл, (С1-С18-алкіл)оксикарбоніл, арилкарбоніл, арил(С1-С3-алкіл)карбоніл, арил-С1-С3-алкіл, аліл, RaRbRcSi, CRaRbORc, де дві сусідні групи R2 можуть бути зв'язані одна з одною з утворенням місткової групи SiRaRb, CRaRb або CRaORb-CRaORb; за умови, що щонайменше один замісник R2 не означає водень;
Ra, Rb, Rc незалежно один від одного означають С1-С4-алкіл, арил або арил-С1-С3-алкіл, де алкільні групи можуть бути моно- або полізаміщеними галогеном;
де арильні групи, вказані у визначенні приведених вище груп, означають фенільні або нафтильні групи, які можуть бути моно- або полізаміщеними за допомогою L1;
L1 незалежно один від одного вибрані з групи, що включає фтор, хлор, бром, С1-С3-алкіл, С1-С4-алкоксигрупу і нітрогрупу.
10. Сполука загальної формули II за п. 9, в якій
R2 незалежно один від одного означають водень, (С1-С4-алкіл)карбоніл або (С1-С4-алкіл)оксикарбоніл; за умови, що щонайменше один замісник R2 не означає водень.
11. Сполука загальної формули II за п. 9, вибрана з групи, що включає
1-хлоро-4-(2,3,4,6-тетра-O-ацетил-D-глюкопіраноз-1-ил)-2-(4-(R)-тетрагідрофуран-3-ілоксибензил)бензол;
1-хлоро-4-(2,3,4,6-тетра-О-ацетил-D-глюкопіраноз-1-ил)-2-(4-(S)-тетрагідрофуран-3-ілоксибензил)бензол.
12. Сполука загальної формули V
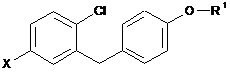 , V
, V
у якій
R1 означає R-тетрагідрофуран-3-іл, S-тетрагідрофуран-3-іл або тетрагідропіран-4-іл; і
X означає Br або І.
13. Сполука формули V за п. 12, вибрана з групи, що включає
(S)-4-бромо-1-хлоро-2-(4-тетрагідрофуран-3-ілоксибензил)бензол;
(R)-4-бромо-1-хлоро-2-(4-тетрагідрофуран-3-ілоксибензил)бензол;
4-бромо-1-хлоро-2-(4-тетрагідропіран-4-ілоксибензил)бензол;
(S)-4-йодо-1-хлоро-2-(4-тетрагідрофуран-3-ілоксибензил)бензол;
(R)-4-йодо-1-хлоро-2-(4-тетрагідрофуран-3-ілоксибензил)бензол;
4-йодо-1-хлоро-2-(4-тетрагідропіран-4-ілоксибензил)бензол.
14. Сполука загальної формули VII
 , VII
, VII
або формули XIX
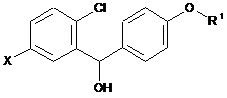 , XIX
, XIX
у якій
R1 означає R-тетрагідрофуран-3-іл, S-тетрагідрофуран-3-іл або тетрагідропіран-4-іл; і
X означає Br або І.
15. Сполука формули VII за п. 14, вибрана з групи, що включає
(5-бромо-2-хлорофеніл)-(4-(R)-тетрагідрофуран-3-ілоксифеніл)метанон;
(5-бромо-2-хлорофеніл)-(4-(S)-тетрагідрофуран-3-ілоксифеніл)метанон;
(5-йодо-2-хлорофеніл)-(4-(R)-тетрагідрофуран-3-ілоксифеніл)метанон;
(5-йодо-2-хлорофеніл)-(4-(S)-тетрагідрофуран-3-ілоксифеніл)метанон.
Текст
Реферат: У заявці описані способи одержання сполук загальної формули І Cl OR3 O R1 O R3O OR3 OR3 ,I 1 3 в якій групи R і R є такими, як визначено в п. 1 формули винаходу. Крім того, в заявці описані проміжні продукти, одержані в цих способах. UA 99896 C2 (12) UA 99896 C2 UA 99896 C2 Дійсний винахід відноситься до способу одержання глюкопіранозилзаміщених похідних бензилбензолу формули I 3 Cl O 1 OR R O I 3 RO OR 3 3 5 10 OR 1 3 у якій замісники R і R є такими, як визначено нижче в дійсному винаході. Крім того, дійсний винахід відноситься до способів одержання проміжних продуктів і початкових речовин для способу одержання глюкопіранозилзаміщених похідних бензилбензолу. Крім того, дійсний винахід відноситься до таких проміжних продуктів і початкових речовин. Рівень техніки У заявці на міжнародний патент 2005/092877 описані глюкопіранозилзаміщені похідні бензолу загальної формули 4 2 1 R R R 3 R O 6 RO 5 R 7a 7c R O OR 7b OR 1 15 20 25 6 7a 7b 7c у якій групи R - R і R , R , R є такими, як визначено в дійсному винаході. Такі сполуки надають корисну інгібуючу дію на натрійзалежний співпереносник глюкози SGLT, особливо SGLT2. Завдання винаходу Завданням справжнього винаходу є розробка нових способів одержання глюкопіранозилзаміщених похідних бензилбензолу формули I; зокрема, способів, за допомогою яких продукт можна одержати з високими виходами, високою енантіомерною або діастереоізомерною чистотою і які забезпечують одержання продукту в комерційному масштабі при низьких виробничих витратах і з високим виходом з одиниці виробничої потужності і за одиницю часу. Іншим завданням справжнього винаходу є розробка способів одержання початкових речовин для вказаного вище способу одержання. Додаткові завдання справжнього винаходу відносяться до нових проміжних продуктів і початкових речовин для способу, пропонованого в дійсному винаході. Інші завдання справжнього винаходу будуть зрозумілі для фахівця в даній області техніки безпосередньо з приведеного вище і нижче опису. Об'єкти винаходу Першим об'єктом справжнього винаходу є спосіб одержання сполук загальної формули I 3 Cl O 1 OR R O I 3 RO 30 35 OR OR 3 3 у якій 1 R означає циклобутил, циклопентил, циклогексил, тетрагідрофуран-3-іл або тетрагідропіран-4-іл; і 3 R означає водень; що характеризується тим, що в сполуці загальної формули II 1 R-тетрагідрофуран-3-іл, S UA 99896 C2 OR 2 Cl O R 1 O II 2 RO OR 2 2 OR у якій R є таким, як визначено вище в дійсному винаході, і 2 R незалежно один від одного означають водень, (C1-C18-алкіл) карбоніл, (C1-C18алкіл)оксикарбоніл, арилкарбоніл, арил-(C1-C3-алкіл)-карбоніл, арил-C1-C3-алкіл, алліл, a b c a b c 2 R R R Si, CR R OR , де дві сусідні групи R можуть бути зв’язані одна з одною з утворенням a b a b a b a b 2 місткової групи SiR R , CR R або CR OR -CR OR ; за умови, що щонайменше один замісник R не означає водень; a b c R , R , R незалежно один від одного означають C1-C4-алкіл, арил або арил-C1-C3-алкіл, де алкіл може бути моно- або полізаміщений галогеном; L1 незалежно один від одного вибрані з групи, що включає фтор, хлор, бром, C 1-C3-алкіл, C1-C4-алкоксигрупу і нітрогрупу; де арильні групи, вказані у визначенні приведених вище груп, означають фенільні або нафтильні групи, переважно - фенільні групи, які можуть бути моно- або полізаміщеними за допомогою L1; 2 захисні групи R , що не означають водень, відщеплюють, переважно - гідролізують. Другим об'єктом справжнього винаходу є спосіб одержання сполук загальної формули II 2 Cl O 1 OR R O 1 5 10 15 II 2 RO OR OR 20 25 30 2 2 у якій 1 R означає циклобутил, циклопентил, циклогексил, R-тетрагідрофуран-3-іл, Sтетрагідрофуран-3-іл або тетрагідропіран-4-іл; і 2 R незалежно один від одного означають водень, (C1-C18-алкіл) карбоніл, (C1-C18алкіл)оксикарбоніл, арилкарбоніл, арил-(C1-C3-алкіл)-карбоніл, арил-C1-C3-алкіл, алліл, a b c a b c 2 R R R Si, CR R OR , де дві сусідні групи R можуть бути зв’язані одна з одною з утворенням a b a b a b a b місткової групи SiR R , CR R або CR OR -CR OR ; a b c R , R , R незалежно один від одного означають C 1-C4-алкіл, арил або арил-C1-C3-алкіл, де алкільні групи можуть бути моно- або полізаміщеними галогеном; L1 незалежно один від одного вибрані з групи, що включає фтор, хлор, бром, C 1-C3-алкіл, C1-C4-алкоксигрупу і нітрогрупу; де арильні групи, вказані у визначенні приведених вище груп, означають фенільні або нафтильні групи, переважно - фенільні групи, які можуть бути моно- або полізаміщеними за допомогою L1; що характеризується тим, що сполука загальної формули III 2 Cl O 1 OR R OR' O III 2 RO OR 2 2 35 OR 1 2 у якій R і все R є такими, як визначено вище в дійсному винаході, і R' означає водень, C1-C6-алкіл, (C1-C4-алкіл) карбоніл, (C1-C4-алкіл)оксикарбоніл, арилкарбоніл, арил-(C1-C3-алкіл)-карбоніл; де "арил" є таким, яквизначено вище в дійсному винаході; вводять в реакцію з відновлюючим реагентом. Третім об'єктом справжнього винаходу є спосіб одержання сполук загальної формули III 2 UA 99896 C2 OR 2 Cl O O OR' R 1 III 2 RO OR OR 5 10 15 2 2 у якій 1 R означає циклобутил, циклопентил, циклогексил, R-тетрагідрофуран-3-іл, Sтетрагідрофуран-3-іл або тетрагідропіран-4-іл; і 2 R незалежно один від одного означають водень, (C1-C18-алкіл) карбоніл, (C1-C18алкіл)оксикарбоніл, арилкарбоніл, арил-(C1-C3-алкіл)-карбоніл, арил-C1-C3-алкіл, алліл, a b c a b c 2 R R R Si, CR R OR , де дві сусідні групи R можуть бути зв’язані одна з одною з утворенням a b a b a b a b місткової групи SiR R , CR R або CR OR -CR OR ; і a b c R , R , R незалежно один від одного означають C 1-C4-алкіл, арил або арил-C1-C3-алкіл, де алкільні групи можуть бути моно- або полізаміщеними галогеном; L1 незалежно один від одного вибрані з групи, що включає фтор, хлор, бром, C 1-C3-алкіл, C1-C4-алкоксигрупу і нітрогрупу; де арильні групи, вказані у визначенні приведених вище груп, означають фенільні або нафтильні групи, переважно - фенільні групи, які можуть бути моно- або полізаміщеними за допомогою L1; що характеризується тим, що металоорганічна сполука формули VI 1 Cl O R VI M 1 20 у якій R є таким, як визначено вище в дійсному винаході, і M означає Li або MgHal, де Hal означає Cl, Br або I; або її похідна, одержана переметалюванням; вказану сполуку формули VI можна одержати шляхом обміну галоген-метал або шляхом впровадження металу в зв'язок вуглець-галоген галогенобензилбензолу загальної формули V 1 Cl O R V X 1 25 у якій R є таким, як визначено вище в дійсному винаході, і X означає Br або I; і необов'язково подальшим переметалюванням, додають до глюконолактону загальної формули IV OR 2 O O IV 2 RO OR OR 2 2 2 30 35 у якій R є таким, як визначено вище в дійсному винаході потім одержаний аддукт вводять у реакцію з водою або спиртом R'-OH, де R' означає C1-C6алкіл, у присутності кислоти і необов'язково продукт, одержаний за реакцією з водою, де R' означає H, в подальшій реакції з ацилуючим реагентом перетворюють на продукт формули III в якій R' означає (C1-C4-алкіл) карбоніл, (C1-C4-алкіл)оксикарбоніл, арилкарбоніл або арил-(C1-C3алкіл)-карбоніл, де "арил" є таким, як визначено вище в дійсному винаході. Четвертим об'єктом справжнього винаходу є спосіб одержання сполук загальної формули XXXIII 3 UA 99896 C2 OR Cl 2 O R 1 O XXXIII 2 R O OH 2 OR 1 2 у якій R , R є такими, як визначено вище і нижче в дійсному винаході; що характеризується тим, що захищений D-глюкаль формули XXX 2 OR O XXX 2 R O 2 5 OR у якій R є таким, як визначено вище в дійсному винаході; металюють з одержанням метальованого D-глюкалю формули XXXI 2 OR 2 M O XXXI 2 R O 2 10 OR 2 у якій R є таким, як визначено вище в дійсному винаході, і M означає літій- або магнійвмісний фрагмент; який необов'язково переметальовують з одержанням метальованого D-глюкалю формули XXXI, в якій M означає магній-, цинк-, індій-, бор-, олово-, кремній- або хромвмісний фрагмент; і метальований або переметальований D-глюкаль формули XXXI вводять в реакцію з агліконом формули V Cl 1 O R V X 15 1 у якій R є таким, як визначено вище в дійсному винаході, і X означає групу, що відщеплюється; у присутності каталізатору, що містить перехідний метал і одержують похідну глюкалю формули XXXII Cl O 1 2 OR R O XXXII 2 R O 2 20 25 OR 2 у якій R і R є такими, як визначено вище в дійсному винаході; і похідну глюкалю формули XXXII перетворюють на продукт формули XXXIII шляхом приєднання молекули води по подвійному зв'язку глюкального фрагменту, переважно - шляхом гідроборування подвійного зв'язку з подальшим розщепленням зв'язку вуглець-бор або шляхом епоксидування або дигідроксилювання подвійного зв'язку з подальшим відновленням утвореного аномерного зв’язку вуглець-кисень. П'ятим об'єктом справжнього винаходу є спосіб одержання сполук загальної формули XXXIII 1 4 UA 99896 C2 OR Cl 2 O R 1 O XXXIII 2 R O OH 2 OR 1 2 у якій R , R є такими, як визначено вище і нижче в дійсному винаході; що характеризується тим, що захищений D-глюкаль формули XXX 2 OR O XXX 2 R O 2 5 OR у якій R є таким, як визначено вище в дійсному винаході; епоксидують з одержанням відповідного глюкальоксиду формули XXXIV 2 OR 2 O O XXXIV 2 R O 2 OR у якій R є таким, як визначено вище в дійсному винаході; і глюкальоксид формули XXXIV вводять в реакцію з метальованим агліконом формули VI 2 1 Cl O R VI 10 M 1 у якій R є таким, як визначено вище в дійсному винаході, і M означає літій-, магній-, цинк-, індій-, алюміній- або боровмісний фрагмент; і одержують продукт формули XXXIII. Шостим об'єктом справжнього винаходу є спосіб одержання сполук загальної формули II 2 Cl O 1 OR R O II 2 RO OR 2 2 15 OR 1 2 у якій R , R є такими, як визначено вище і нижче в дійсному винаході; що характеризується тим,що похідна глюкози формули XXXV 2 OR O Hal XXXV 2 R O OR 2 2 20 OR 2 у якій R є таким, як визначено вище в дійсному винаході, і Hal означає F, Cl, Br, C1-C3-алкілкарбонілоксигрупу, C1-C3-алкілоксикарбонілоксигрупу або C1-C3-алкілоксигрупу; вводять в реакцію з метальованим агліконом формули VI 5 UA 99896 C2 1 Cl O R VI M 1 5 у якій R є таким, як визначено вище в дійсному винаході, і M означає літій-, магній-, цинк-, індій- або боровмісний фрагмент; і одержують продукт формули II. Сьомим об'єктом справжнього винаходу є спосіб одержання сполук загальної формули V 1 Cl O R V X 1 10 у якій R означає циклобутил, циклопентил, циклогексил, R-тетрагідрофуран-3-іл, Sтетрагідрофуран-3-іл або тетрагідропіран-4-іл; і X означає атом брому або атом йоду; що характеризується тим, що похідна бензоїлхлориду формули XII Cl XII Cl X O у якій X є таким, як визначено вище; або її похідна, така як ангідрид, складний ефір бензойної кислоти або бензонітрил; вводять в реакцію з галогенобензолом формули XXVII Z 5 XXVII 15 5 у якій Z означає атом фтору, хлору або йоду; у присутності каталізатору і одержують проміжну сполуку формули XXVI 5 Cl Z XXVI X 20 O 5 у якій X і Z є такими, як визначено вище в дійсному винаході; і 1 1 проміжну сполуку формули XXVI вводять в реакцію з R -OH, де R є таким, як визначено вище в дійсному винаході, або з його аніоном, переважно - в розчиннику або суміші розчинників, у присутності основи і одержують похідну бензофенону формули VII Cl O R 1 VII X O 1 25 у якій X і R є такими, як визначено вище в дійсному винаході; і похідну бензофенону формули VII вводять в реакцію з відновлюючим реагентом, переважно - в розчиннику або суміші розчинників, у присутності кислоти Льюїса і одержують сполуку формули V, визначену вище. Восьмим об'єктом справжнього винаходу є спосіб одержання сполук загальної формули II 2 Cl O 1 OR R O II 2 RO OR OR 2 2 6 UA 99896 C2 1 2 у якій R і R є такими, як визначено вище в дійсному винаході що характеризується тим, що аглікон формули V 1 Cl O R V X 1 5 у якій X і R є такими, як визначено вище в дійсному винаході, одержують способом, відповідним сьомому об'єкту справжнього винаходу, і вказаний галогенобензилбензол загальної формули V перетворюють на металоорганічну сполуку формули VI 1 Cl O R VI M 1 10 у якій R є таким, як визначено вище в дійсному винаході, і M означає Li або MgHal, де Hal означає Cl, Br або I; шляхом обміну галоген-метал або шляхом впровадження металу в зв'язок вуглець-галоген галогенобензилбензолу загальної формули V і необов'язково подальшого переметалювання; і вказану металоорганічну сполуку формули VI вводять в реакцію з глюконолактоном загальної формули IV OR 2 O O IV 2 RO 15 OR OR 2 2 2 у якій R є таким, як визначено вище в дійсному винаході, способом, відповідним третьому об'єкту справжнього винаходу, і одержують проміжний продукт формули III 2 Cl O 1 OR R OR' O III 2 RO OR 2 2 OR 1 у якій R , R' і R є такими, як визначено вище в дійсному винаході, і вказаний проміжний продукт формули III вводять в реакцію з відновлюючим реагентом відповідно до другого об'єкту справжнього винаходу і одержують сполуку формули II. Дев'ятим об'єктом справжнього винаходу є сполуки загальної формули II 2 Cl O 1 OR R O 2 20 II 2 RO OR 2 2 25 30 OR 1 у якій R означає циклобутил, циклопентил, циклогексил, R-тетрагідрофуран-3-іл, Sтетрагідрофуран-3-іл або тетрагідропіран-4-іл; і 2 R незалежно один від одного означають водень, (C1-C18-алкіл) карбоніл, (C1-C18алкіл)оксикарбоніл, арилкарбоніл, арил-(C1-C3-алкіл)-карбоніл, арил-C1-C3-алкіл, алліл, a b c a b c 2 R R R Si, CR R OR , де дві сусідні групи R можуть бути зв’язані одна з одною з утворенням a b a b a b a b 2 місткової групи SiR R , CR R або CR OR -CR OR ; за умови, що щонайменше один замісник R не означає водень; a b c R , R , R незалежно один від одного означають C 1-C4-алкіл, арил або арил-C1-C3-алкіл, де алкільні групи можуть бути моно- або полізаміщеними галогеном; L1 незалежно один від одного вибрані з групи, що включає фтор, хлор, бром, C 1-C3-алкіл, 7 UA 99896 C2 5 C1-C4-алкоксигрупу і нітрогрупу; де арильні групи, вказані у визначенні приведених вище груп, означають фенільні або нафтильні групи, переважно - фенільні групи, які можуть бути моно- або полізаміщеними за допомогою L1. Іншим об'єктом справжнього винаходу є сполуки загальної формули III 2 Cl O 1 OR R OR' O III 2 RO OR 2 2 10 15 20 OR 1 у якій R означає циклобутил, циклопентил, циклогексил, R-тетрагідрофуран-3-іл, Sтетрагідрофуран-3-іл або тетрагідропіран-4-іл; і 2 R незалежно один від одного означають водень, (C1-C18-алкіл) карбоніл, (C1-C18алкіл)оксикарбоніл, арилкарбоніл, арил-(C1-C3-алкіл)-карбоніл, арил-C1-C3-алкіл, алліл, a b c a b c 2 R R R Si, CR R OR , де дві сусідні групи R можуть бути зв’язані одна з одною з утворенням a b a b a b a b місткової групи SiR R , CR R або CR OR -CR OR ; a b c R , R , R незалежно один від одного означають C 1-C4-алкіл, арил або арил-C1-C3-алкіл, де алкільні або арильні групи можуть бути моно- або полізаміщеними галогеном; L1 незалежно один від одного вибрані з групи, що включає фтор, хлор, бром, C 1-C3-алкіл, C1-C4-алкоксигрупу і нітрогрупу; R' означає водень, C1-C6-алкіл, (C1-C4-алкіл) карбоніл, (C1-C4-алкіл)оксикарбоніл, арилкарбоніл, арил-(C1-C3-алкіл)-карбоніл; де арильні групи, вказані у визначенні приведених вище груп, означають фенільні або нафтильні групи, переважно - фенільні групи, які можуть бути моно- або полізаміщеними за допомогою L1. Іншим об'єктом справжнього винаходу є сполуки загальної формули VI 1 Cl O R VI M 1 25 у якій R означає циклобутил, циклопентил, циклогексил, R-тетрагідрофуран-3-іл, Sтетрагідрофуран-3-іл або тетрагідропіран-4-іл; і M означає Li або MgHal, де Hal означає Cl, Br або I. Іншим об'єктом справжнього винаходу є сполуки загальної формули V 1 Cl O R V X 1 30 у якій R означає циклобутил, циклопентил, циклогексил, R-тетрагідрофуран-3-іл, Sтетрагідрофуран-3-іл або тетрагідропіран-4-іл; і X означає Br або I. Іншим об'єктом справжнього винаходу є сполуки формули VII Cl O 1 R VII X O або формули XIX Cl O R 1 XIX X 35 OH 1 у якій R означає циклобутил, циклопентил, циклогексил, R-тетрагідрофуран-3-іл, Sтетрагідрофуран-3-іл або тетрагідропіран-4-іл; і 8 UA 99896 C2 X означає Br або I. Іншим об'єктом справжнього винаходу є сполуки формули XXVI Cl Z XXVI X 5 O у якій X означає Br або I; і Z означає гідроксигрупу, фтор, хлор, бром, йод, C 1-C4-алкілсульфонілоксигрупу, арилсульфонілоксигрупу, арил-C1-C3-алкілсульфонілоксигрупу, ди-(C1-C6-алкілокси)-бороніл, дигідроксибороніл, KF3B, NaF3B або LiF3B; і "арил" є таким, як визначено вище в дійсному винаході. Іншим об'єктом справжнього винаходу є сполуки формули XXXII Cl O 1 2 OR R O XXXII 2 R O 2 10 15 20 25 30 35 40 OR 1 у якій R означає циклобутил, циклопентил, циклогексил, R-тетрагідрофуран-3-іл, Sтетрагідрофуран-3-іл або тетрагідропіран-4-іл; і 2 R незалежно один від одного означають водень, (C1-C18-алкіл) карбоніл, (C1-C18алкіл)оксикарбоніл, арилкарбоніл, арил-(C1-C3-алкіл)-карбоніл, арил-C1-C3-алкіл, алліл, a b c a b c 2 R R R Si, CR R OR , де дві сусідні групи R можуть бути зв’язані одна з одною з утворенням a b a b a b a b місткової групи SiR R , CR R або CR OR -CR OR ; a b c R , R , R незалежно один від одного означають C 1-C4-алкіл, арил або арил-C1-C3-алкіл, де алкільні групи можуть бути моно- або полізаміщеними галогеном; L1 незалежно один від одного вибрані з групи, що включає фтор, хлор, бром, C1-C3-алкіл, C1-C4-алкоксигрупу і нітрогрупу; де арильні групи, вказані у визначенні приведених вище груп, означають фенільні або нафтильні групи, переважно - фенільні групи, які можуть бути моно- або полізаміщеними за допомогою L1. Докладний опис винаходу 1 2 3 a b c Якщо не вказане інше, то групи, залишки і замісники, зокрема, R , R , R , R', R , R , R , L1, M, X і Z, є такими, як визначено вище і нижче в дійсному винаході. Якщо залишки, замісники або групи містяться в сполуці кілька разів, то вони можуть володіти однаковими або різними значеннями. У способах і сполуках, пропонованих у дійсному винаході, переважними є вказані нижче значення груп і замісників. 1 R переважно означає R-тетрагідрофуран-3-іл або S-тетрагідрофуран-3-іл. 2 R переважно означає водень, метилкарбоніл, етилкарбоніл або триметилсиліл. a b c R , R , R незалежно один від одного переважно означають метил, етил, н-пропіл або ізопропіл, терт-бутил або феніл; найпереважніше - метил. R' переважно означає водень, метил або етил. Способи, пропоновані в дійсному винаході, детально описані нижче. На схемі 0 представлено перетворення сполуки II в сполуку I шляхом видалення захисних 2 1 2 3 груп R , що не означають водень, і які містяться в сполуці II, в якій R , R і R є такими, як визначено вище в дійсному винаході. Схема 0: Синтез C-глюкозиду формули I шляхом видалення захисних груп OR 2 Cl O R OR 1 Cl O O 2 RO OR OR 3 3 2 RO 2 OR OR 3 3 I II 9 O R 1 UA 99896 C2 2 5 10 15 20 25 30 35 40 Використовувану ацильну захисну групу R відщеплюють, наприклад, гідролітично у водному розчиннику, наприклад, у воді, суміші ізопропанол/вода, оцтова кислота/вода, тетрагідрофуран/вода або діоксан/вода, у присутності кислоти, такої як трифторооцтова кислота, хлористоводнева кислота або сірчана кислота або у присутності основи лужного металу, такої як гідроксид літію, гідроксид натрію або гідроксид калію або апротонно, наприклад, у присутності йододержетилсилану, при температурах від 0 до 120°C, переважно - при температурах від 10 до 100°C. 2 Трифторацильну групу R переважно відщеплюють шляхом обробки кислотою, такою як хлористоводнева кислота, необов'язково у присутності розчинника, такого як оцтова кислота, при температурах від 50 до 120°C або шляхом обробки розчином гідроксиду натрію необов'язково у присутності розчинника, такого як тетрагідрофуран або метанол, при температурах від 0 до 50°C. 2 Будь-яку використовувану ацетальну або кетальну захисну групу R відщеплюють, наприклад, гідролітично у водному розчиннику або водній суміші розчинників, наприклад, у воді, суміші ізопропанол/вода, оцтова кислота/вода, тетрагідрофуран/вода або діоксан/вода, у присутності кислоти, такої як трифторооцтова кислота, хлористоводнева кислота або сірчана кислота або апротонно, наприклад, у присутності йододержетилсилану, при температурах від 0 до 120°C, переважно - при температурах від 10 до 100°C. 2 Силільну групу R , наприклад, триметилсиліл, відщеплюють, наприклад, у воді, водній суміші розчинників або в нижчому спирті, такому як метанол або етанол у присутності основи, такої як гідроксид літію, гідроксид натрію, карбонат калію або метоксид натрію. Для використання у водних або спиртових розчинниках також підходять кислоти, такі як, наприклад, хлористоводнева кислота, трифторооцтова кислота або оцтова кислота. Для розщеплення в органічних розчинниках, таких як, наприклад, діетиловий ефір, тетрагідрофуран або дихлорометан, також можна використовувати фторовмісні реагенти, такі як, наприклад, тетрабутиламонійфторид. 2 Бензильну, метоксибензильну або бензилоксикарбонільну групу R переважно відщеплюють гідрогенолітично, наприклад, воднем у присутності каталізатору, такого як паладій на вугіллі, у відповідному розчиннику, такому як метанол, етанол, етилацетат або крижана оцтова кислота, необов'язково з додаванням кислоти, такої як хлористоводнева кислота, при температурах від 0 до 100°C, але переважно - при температурах навколишнього середовища, рівних від 20 до 60°C, і при тиску водню, рівному від 1 до 7 бар, але переважно - від 3 до 5 бар. Проте 2,4диметоксибензильну групу переважно відщеплюють в трифторооцтовій кислоті у присутності анізолу. 2 Трет-бутильну або трет-бутоксикарбонільну групу R переважно відщеплюють шляхом обробки кислотою, такою як трифторооцтова кислота або хлористоводнева кислота, або шляхом обробки йододержетилсиланом необов'язково з використанням розчинника, такого як метиленхлорид, діоксан, метанол або діетиловий ефір. Похідні глюкози формули II можна синтезувати шляхом відновлення аномерного зв’язку вуглець-кисень сполуки III (схема 1). Схема 1: Відновлення сполуки III OR 2 Cl O OR' 2 RO OR OR O R OR 1 2 Cl відновлення 2 2 OR OR III 50 R 1 O аномерного зв'зку 2 RO C-OR' 2 2 II 1 45 O 2 R' і R є такими, як визначено вище в дійсному винаході. R є таким, як визначено вище в дійсному винаході, і означає, наприклад, водень, ацетил, півалоїл, бензоїл, третбутоксикарбоніл, бензилоксикарбоніл, триалкілсиліл, бензил або заміщений бензил. У випадку, 2 якщо дві сусідні групи R зв’язані одна з одною з утворенням місткової групи, вони переважно утворюють ацеталь, такий як, наприклад, бензиліденацеталь, кеталь, такий як, наприклад, ізопропіліденацеталь, або етиленову групу, що приводить до утворення діоксану, як, наприклад, комбінація з 2,3-диметоксибутиленом, який по положеннях 2 і 3 бутиленових груп приєднаний 2 до атомів кисню піранози. Переважним значенням R є водень або три-(C1-C3-алкіл) силіл, такий як триметилсиліл або триізопропілсиліл. R' переважно означає водень або C 1-C4-алкіл, переважніше - метил або етил. 10 UA 99896 C2 5 10 15 20 25 Відновлення можна проводити відновлюючим реагентом у присутності кислоти Льюїса або без неї. Відповідні відновлюючі реагенти включають, наприклад, силани, такі як, наприклад, триетилсилан, трипропілсилан, триізопропілсилан або дифенілсилан, борогідрид натрію, ціаноборогідрид натрію, борогідрид цинку, комплекси борану, літійалюмінійгідрид, діізобутилалюмінійгідрид або йодид самарію. Відповідними кислотами Льюїса є, такі як, наприклад, ефірат трифториду бору, триметилсилілтрифлат, тетрахлорид титану, тетрахлорид олова, трифлат скандію, трифлат міді (II) або йодид цинку; або відповідними кислотами Льюїса є кислоти Бренстеда, такі як, наприклад, хлористоводнева кислота, толуолсульфонова кислота, трифторооцтова кислота або оцтова кислота. Залежно від відновлюючого реагенту відновлення можна проводити без кислоти Льюїса. Реакцію можна проводити в розчиннику, такому як, наприклад, метиленхлорид, хлороформ, ацетонітрил, толуол, гексан, діетиловий ефір, тетрагідрофуран, діоксан, етанол, вода або їх суміші. Розчинник переважно вибрати з урахуванням використовуваного відновлюючого реагенту і необов'язкової кислоти Льюїса. Переважні температури реакції складають від -80 до 120 °C, переважніше - від -30 до 80 °C. Одна особливо підходяща комбінація реагентів включає, наприклад, триетилсилан та ефірат трифториду бору, які зазвичай використовують в ацетонітрилі, дихлорометані або їх суміші при температурах від -60 до 60 °C. Відновлення переважно проводять за відсутності води, переважно - при вмісті води в реакційній суміші, що становить менше 2000 част./млн, ще переважніше - менше 1000 част./млн. На додаток до вказаних вище відновлюючих реагентів для вказаного відновлення можна використовувати водень. Це перетворення можна проводити у присутності каталізатору, що містить перехідний метал, такого як, наприклад, паладій на вугіллі, оксид паладію, оксид платини або нікель Ренея, в розчинниках, таких як, наприклад, тетрагідрофуран, етилацетат, метанол, етанол, вода або оцтова кислота при температурах від -40 до 100 °C і при тиску водню, рівному від 1 до 10 торр. Похідні глюкози формули III можна синтезувати з D-глюконолактону або його похідних за реакцією необхідного бензилбензолу у вигляді металоорганічної сполуки (схема 2a). Схема 2a: Приєднання металоорганічної сполуки до глюконолактону Cl O R 1 X V обмін галоген - метал Cl OR M 2 O 2 OR OR 35 40 2 R 1 OR VI O R O 30 O 2 2 Cl O X = I, Br Hal =Cl, Br, I M = Li, MgHal OR' 2 R O OR OR O R 1 2 2 IV III На схемі 2a і в подальших розділах описані переважні умови і варіанти здійснення способу, відповідного третьому об'єкту справжнього винаходу. Реагент Гриньяра або літієву похідну бензилбензолу (VI) можна одержати з бромованого або йодованого бензилбензолу V за так званою реакцією обміну галоген-метал або шляхом впровадження металу в зв'язок вуглець-галоген. Обмін галоген-метал для синтезу відповідної літієвої сполуки VI можна проводити, наприклад, з використанням літійорганічної сполуки, такої як, наприклад, н-, втор- або трет-бутиллітію. Переважна кількість літійорганічної сполуки знаходиться в діапазоні приблизно від 1 до 2 моль, переважніше зразкова еквімолярна кількість в перерахунку на бензилбензол V. Аналогічну сполуку магнію також можна одержати шляхом обміну галоген-метал з відповідним реагентом Гриньяра, таким як C3-C4-алкілмагнійхлорид або -бромід, наприклад, 11 UA 99896 C2 5 10 15 20 25 30 35 40 45 50 55 60 ізопропіл- або втор-бутилмагнійбромід або -хлорид або діізопропіл- або ди-втор-бутилмагній за відсутності або у присутності додаткової солі, такої як, наприклад, хлорид літію, який може прискорювати реакцію металювання. Конкретні переметальовуючі магнійорганічні сполуки також можна утворити in situ з відповідних вихідних (див., наприклад, публікації Angew. Chem. 2004, 116, 3396-3399 і Angew. Chem. 2006, 118, 165-169 і цитовану в них літературу). Реагент Гриньяра переважно використовувати в кількості, що знаходиться в діапазоні приблизно від 1 до 5 моль на 1 моль бензилбензолу V. Реакції обміну галоген-метал переважно проводять при температурі від -100 до 40°C, особливо переважно - від -80 до 10 °C. Переважніший діапазон температур для реакції обміну галоген-літій складає від -80 до -15 °C. Реакцію обміну галоген-метал переважно проводять в інертному розчиннику або їх сумішах, таких як, наприклад, діетиловий ефір, діоксан, тетрагідрофуран, диметиловий ефір діетиленгліколю, толуол, гексан, диметилсульфоксид, дихлорометан або їх суміші. Особливо переважні розчинники вибрані з групи, що включає тетрагідрофуран, диметиловий ефір діетиленгліколю, гексан та їх суміші. Одержані таким чином сполуки, що містять магній або літій, необов'язково можна переметалювати солями металів, такими як, наприклад, трихлорид церію, хлорид або бромід цинку, хлорид або бромід індію, і одержати альтернативні металоорганічні сполуки (VI), придатні для проведення реакції приєднання. Альтернативно, металоорганічну сполуку VI також можна одержати шляхом впровадження металу по зв'язку вуглець-галоген галогеноароматичної сполуки V. Елементами, підходящими для такого перетворення, є літій і магній. Впровадження можна провести в розчинниках, таких як, наприклад, діетиловий ефір, діоксан, тетрагідрофуран, толуол, гексан, диметилсульфоксид та їх суміші при температурах в діапазоні від -80 до 100 °C, переважно - від -70 до 40 °C. У випадках, коли реакція не протікає самодовільно без активації металу, може бути потрібна його активація, така як, наприклад, обробка 1,2-дибромоетаном, йодом, триметилсилілхлоридом, оцтовою кислотою, хлористоводневою кислотою і/або обробка ультразвуком. Додавання металоорганічної сполуки VI до глюконолактону або його похідних (IV) переважно проводять при температурах від -100 до 40 °C, особливо переважно - від -80 до -10 °C, в інертному розчиннику або їх сумішах, і одержують сполуку формули III. У випадку, якщо сполука VI є літійорганічною сполукою, додавання ще переважніше проводити при температурах в діапазоні від -80 до -20°C. У випадку, якщо сполука VI є магнійорганічною сполукою, особливо переважні температури під час додавання знаходяться в діапазоні від -30 до -15°C. Всі вказані вище реакції можна проводити на повітрі, хоча переважне проведення в атмосфері інертного газу. Переважними інертними газами є аргон і азот. Реакції металювання і/або сполучення також можна проводити в мікрореакторах і/або мікрозмішувачах, які забезпечують високі швидкості обміну, наприклад, за методиками, описаними в WO 2004/076470. Підходящими розчинниками для приєднання метальованої сполуки VI до відповідним чином захищеного глюконолактону IV є, наприклад, діетиловий ефір, толуол, метиленхлорид, гексан, тетрагідрофуран, діоксан, N-метилпіролідон та їх суміші. Реакції приєднання можна проводити без яких-небудь додаткових допоміжних речовин або у присутності промотору, такого як, наприклад, BF3*OEt2 або Me3SiCl, що може бути корисним в разі повільно реагуючих компонентів реакції сполучення (див. публікацію M. Schlosser, Organometallics in Synthesis, John Wiley & Sons, Chichester/New York/Brisbane/Toronto/Singapore, 1994). 2 Переважними значеннями замісників R на схемі 2a є бензил, заміщений бензил, триалкілсиліл, особливо переважно - три-(C1-C3-алкіл) силіл, такий як триметилсиліл, 2 триізопропілсиліл, 4-метоксибензил і бензил. Якщо два сусідніх замісники R зв'язані один з одним, то ці два замісники переважно є частиною бензиліденацеталю, 4метоксибензиліденацеталю, ізопропілкеталю або утворюють діоксан з 2,3-диметоксибутиленом, який по положеннях 2 і 3 бутану приєднаний до сусідніх атомів кисню піранози. Група R' переважно означає водень, C1-C4-алкіл, C1-C4-алкілкарбоніл або C1-C4-алкілоксикарбоніл, особливо переважно - водень, метил або етил. Групу R’ вводять після приєднання металоорганічної сполуки VI або її похідної до глюконолактону IV. Якщо R’ означає водень або C1-C4-алкіл, то реакційну суміш оброблюють спиртом, переважно - C1-C4-алканолом, таким як, наприклад, метанол або етанол, або водою у присутності кислоти, такої як, наприклад, оцтова кислота, метансульфонова кислота, толуолсульфонова кислота, сірчана кислота, трифторооцтова кислота або хлористоводнева 12 UA 99896 C2 5 10 кислота. Цю реакцію зі спиртом або водою переважно проводять при температурах в діапазоні приблизно від 0 до 80°C, особливо переважно - приблизно від 20 до 60°C. Під час включення R’ 2 захисні групи R можуть відщепитися, якщо вони нестійкі за використаних умов проведення 2 реакції, що приводить до відповідної протонованої сполуки, тобто до сполуки III, в якій R 2 означає H. Наприклад, захисні групи, в яких R означає триалкілсиліл, такий як триметилсиліл, зазвичай відщеплюють під час обробки реакційної суміші спиртом і/або водою у присутності 2 кислоти і таким чином одержують сполуку III, в якій R означає H. R’ також можна ввести після одержання сполуки III (R' = H), що містить водень, за реакцією аномерної гідроксигрупи з підходящим електрофілом, таким як, наприклад, метилйодид, диметилсульфат, етилйодид, діетилсульфат, ацетилхлорид або оцтовий ангідрид, у присутності основи, такої як, наприклад, триетиламін, етилдіізопропіламін, карбонат натрію, калію або цезію, гідроксид натрію, калію або цезію. Гідроксигрупу також можна депротонувати до додавання електрофілу, наприклад, гідридом натрію. Схема 2b: Синтез C-глюкозидів - методика 2 15 Cl OR 2 OR 2 M O сполучення R O OR 2 OR XXX OR 2 XXXI Cl 2 O R 1 OR "приєднання води" O 2 25 30 35 O R 1 O R O OH OR XXXII 20 Cl 2 2 2 R O OR 1 V 2 R O R X 2 металювання я O O 2 XXXIII Методика 2, представлена на схемі 2b, ілюструє синтез C-глюкозидів, в якому початковою речовиною є відповідним чином захищений D-глюкаль XXX (див. публікації Synlett 2004, pp. 1235-1238; Org. Lett. 2003, 5, pp. 405-2408 і цитовану в них літературу, в якій описані аналогічні методики). Захищений D-глюкаль XXX металюють з одержанням похідної D-глюкалю XXXI, в якій M означає літій-, магній-, цинк-, індій-, бор-, олово-, кремній- або хромвмісний фрагмент; переважно - літій, галогенід магнію, галогенід цинку, галогенід індію, боронову кислоту, ефір боронової кислоти. Металювання глюкалю XXX по атому C-1 можна проводити шляхом депротонування сильною основою. Сильними основами, здатними депротонувати глюкаль, можуть бути літійвмісні основи, такі як, наприклад, н-бутиллітій, втор-бутиллітій або третбутиллітій. Одержаний таким чином літійований по атому C-1 глюкаль можна переметалювати за допомогою різних електрофільних джерел металу і одержати відповідні метальовані по атому C-1 похідні глюкалю. Джерелами металу, відповідними для подальшого перетворення, сполучення, з агліконовим фрагментом, є системи, що містять, наприклад, літій, магній, цинк, індій, бор, олово, кремній і хром. Переметалювання глюкалю із заміною літію на один з вказаних вище металів можна проводити, наприклад, за допомогою відповідних галогенідів, таких як хлорид, бромід або йодид, сульфонатів, таких як, наприклад, трифторометансульфонат, і алкоксидів, таких як, наприклад, метоксид, етоксид, пропоксид та ізопропоксид металу, що вводиться. Залежно від замінюючого металу можна використовувати сполуку металу, що містить більше одного глюкального залишку, таку як відповідний триглюкальіндій або диглюкальцинк. Також можна використовувати відповідні моноглюкальпохідні металів. Металювання глюкалю за допомогою сильної основи, переважно - літійвмісної основи, переважно проводять в інертних розчинниках, таких як, наприклад, тетрагідрофуран, ефір, 13 UA 99896 C2 5 10 15 20 25 30 35 40 45 50 55 60 діоксан, диметоксіетан, гексан і толуол. Переважні температури знаходяться в діапазоні від -80 до 50 °C. Переметалювання можна проводити в тих же розчинниках залежно від електрофільних металовмісних сполук і в тому ж діапазоні температур. З числа електрофільних металовмісних сполук, застосовних для переметалювання, до найбільш підходящих відносяться наступні: триалкілхлоростанан, тетрахлоростанан, триалкілхлоросилан, триалкоксихлоросилілхлорид або -бромід, трихлорид бору, триалкілборати, діалкілхлороборат, трихлорид індію, хлорид, трифлат або бромід цинку, хлорид або бромід магнію. Ці переліки жодним чином не означають обмеження використовуваних електрофільних металовмісних сполук вказаними вище, а приведені для того, щоб вказати електрофіли, які можна 2 використовувати. Для описаних вище і нижче за реакцій захисні групи R переважно вибирати з 2 урахуванням їх стабільності в лужних середовищах, переважно, якщо групи R незалежно одна a b c 2 від одної означають -SiR R R , де дві сусідні групи R можуть бути зв’язані одна з одною з a b a b c утворенням місткової групи SiR R , в якій R , R , R є такими, як визначено вище в дійсному винаході, переважно, якщо вони означають ізопропіл. Одержані таким чином метальовані похідні глюкалю формули XXXI можна ввести в реакцію сполучення з агліконом V, в якому група X означає групу, що відщеплюється, переважно вибрану з групи, що включає хлор, бром, йод, сульфонат, такий як, наприклад, трифторометансульфонат, тозилат, бензолсульфонат і мезилат, хлоросульфонат, сульфонову кислоту та її солі, гідроксикарбоніл або його солі, нітрил і солі діазонію. Реакції сполучення переважно проводять у присутності каталізатору, що містить перехідний метал, такого як, наприклад, солі, комплекси або різні форми елементарного паладію, міді, заліза і нікелю. Комплекси можна утворити in situ або до додавання перехідного металу до реакційної суміші. Лігандами в комплексах перехідного металу можуть бути, наприклад, триарилфосфін, арилдіалкілфосфін, триалкілфосфін, фосфіт, 1,3-дизаміщений дигідроімідазолійкарбен, 1,3дизаміщений імідазолійкарбен і алкени. Реакцію переважно проводять в інертному органічному розчиннику або їх сумішах. Підходящими розчинниками можуть бути, наприклад, тетрагідрофуран, діоксан, диметоксіетан, гексан, толуол, бензол, диметилформамід, диметилацетамід, N-метилпіролідинон, ацетон, етилацетат, вода, метанол, етанол, пропанол, ізопропанол, етиленгліколь, поліетиленгліколь. Реакції сполучення переважно проводять при температурі від -80 до 180 °C, переважніше - від -20 до 120 °C. Завершальною стадією синтезу на схемі 2b є формальне приєднання води по подвійному зв'язку глюкального фрагменту. Це приєднання можна провести, наприклад, шляхом гідроборування, яке приводить до утворення 2-боро-2-дезоксипохідної глюкози, яку можна перетворити на відповідну сполуку глюкози окисненням зв'язку вуглець-бор. Боранами, підходящими для гідроборування, є, наприклад, боран або його аддукти з простими ефірами, простими тіоефірами або амінами, алкілборани або діалкілборани, такі як, наприклад, гексилборан, тексилборан, діетилборан і 9-BBN (9борабіцикло[3.3.1]нонан), пінаколборан, катехінборан, галогено- або дигалогеноборан, такий як, наприклад, дихлороборан. Гідроборування можна проводити, наприклад, в тетрагідрофурані, гексані, циклогексані, ефірі, толуолі, бензолі, дихлорометані. Переважний діапазон температур складає від -50 до 150 °C, переважніший - від -20 до 50 °C. Окиснювальне розщеплення зв'язку вуглець-бор можна проводити окиснювальним реагентом, таким як, наприклад, пероксид водню, трет-бутилпероксид водню, перборат натрію і триалкіламін-N-оксид. Залежно від окиснювального реагенту реакцію переважно проводять у присутності основи, такої як, наприклад, гідроксид натрію. Реакцію переважно проводять в інертному органічному розчиннику або їх сумішах. Переважні розчинники вибрані з групи, що включає тетрагідрофуран, воду, спирти, діоксан, диметоксіетан, циклогексан, гексан, толуол, дихлорометан та їх суміші. Переважний діапазон температур складає від -30 до 150 °C, переважніший - від 0 до 110 °C. Для приєднання води по подвійному зв'язку альтернативою гідроборуванню є комбінація епоксидування або дигідроксилювання подвійного зв'язку з відновленням утвореного аномерного зв’язку вуглець-кисень. Підходящим для епоксидування окиснювальними реагентами є, наприклад, диметилдіоксиран, трифтородиметилдіоксиран, 3-хлоропербензойна кислота, пероксид водню і кисень у присутності каталізатору, що містить перехідний метал. Іншим підходящим окиснювальним реагентом є пероксомоносірчана кислота, пероксодисірчана кислота та їх солі в присутності щонайменше одного кетону, переважно - потрійних солей формули 2KHSO5KHSO4K2SO4, які є у продажу, наприклад, під торгівельними назвами OXONE® (товарний знак фірми E.I. du Pont de Nemours) and CAROAT® (товарний знак фірми Degussa, Peroxid-Chemie GMBH & Co. KG, Dr.-Gustav-Adolph-Str. 3, D-82049 Pullach, Germany) в комбінації з кетоном, переважно - ацетоном. Дигідроксилювання можна проводити, наприклад, за допомогою тетраоксиду осмію і дикалійосмійтетраоксиду, переважно у присутності допоміжного окиснювача, такого як, наприклад, гексаціаноферрат калію, пероксид водню або N 14 UA 99896 C2 5 10 15 20 метилморфолін N-оксид; гідролітичне розкриття оксирану, що відбувається в результаті епоксидування, також дозволяє одержати продукт дигідроксилювання. Окиснення можна проводити в інертних органічних розчинниках або їх сумішах, таких як, наприклад, дихлорометан, тетрагідрофуран, ефір, гексан, циклогексан, діоксан, ацетон, етилацетат, ацетонітрил, вода, спирти та їх суміші. Переважний діапазон температур складає від -80 до 100 °C, переважно - від -50 до 50 °C. Відновлення аномерного зв’язку вуглець-кисень оксирану або продукту дигідроксилювання можна проводити за допомогою відновлюючих реагентів, таких як, наприклад, триалкілсилани, такі як, наприклад, триетилсилан, борогідридів, таких як, наприклад, борогідрид натрію, і гідридів алюмінію, таких як, наприклад, діізобутилалюмінійгідрид. Залежно від відновлюючого реагенту необхідно або щонайменше сприятлива присутність кислоти Льюїса, такої як, наприклад, ефірат трифториду бору, хлорид цинку, триметилсилілхлорид або трифлат, алкіл-, діалкілгалогенід або галогенід алюмінію, трифлат міді, і кислот Бренстеда, таких як, наприклад, хлористоводнева кислота, оцтова кислота, алкіл- або арилсульфонові кислоти, трифторооцтова кислота. Дихлорометан, ацетонітрил, тетрагідрофуран, ефір, гексан входять до числа переважних розчинників. Переважний діапазон температур складає від -80 до 120 °C. Також можна використовувати водень в комбінації з каталізатором, що містить перехідний метал, таким як, наприклад, паладій на вугіллі, нікель Ренея і гідроксид паладію. Потім продукт формули XXXIII можна перетворити на продукт формули I шляхом 2 відщеплення, переважно - гідролізу захисних груп R , що не означають водень, переважно - з використанням методик, описаних вище в дійсному винаході. Схема 2c: Синтез C-глюкозидів - методика 3 OR 2 OR O 2 O эпоксидування O 2 2 R O R O OR 2 OR XXX 2 XXXIV Cl O R 1 OR M VI сполучення Cl 2 O R 1 O 2 R O OH OR 2 XXXIII 25 30 35 На схемі 2c проілюстрований альтернативний шлях одержання C-глюкозидів, в якому початковою речовиною є глюкаль XXX (див. наприклад, публікації Synlett 2003, pp. 870-872; Tetrahedron 2002, 58, pp. 1997-2009 і цитовану в них літературу, в якій описані аналогічні методики). Епоксидування за допомогою відповідного окиснювального реагенту перетворює глюкаль XXX на відповідний глюкальоксид XXXIV. Умови реакції, відповідні для цього перетворення, вже описані для аналогічного перетворення глюкалю XXXII, показаного на схемі 2b. З числа описаних окиснювальних реагентів переважними є диметилдіоксиран і трифтородиметилдіоксиран, одержані окремо або що утворилися in situ. Вказане окиснення можна провести за допомогою, наприклад, пероксомоносірчаної кислоти, пероксодисірчаної кислоти їх солей в присутності щонайменше одного кетону, переважно - потрійних солей формули 2KHSO5KHSO4K2SO4, які є у продажу, наприклад, під торгівельними назвами OXONE® (товарний знак фірми E.I. du Pont de Nemours) і CAROAT® (товарний знак фірми Degussa, Peroxid-Chemie GMBH & Co. KG, Dr.-Gustav-Adolph-Str. 3, D-82049 Pullach, Germany) в комбінації з кетоном, переважно - ацетоном. Реакцію переважно проводять при температурах в діапазоні від -80 до 0 °C в інертному органічному розчиннику або їх сумішах. Переважні розчинники вибрані з групи, що включає діоксан, 1,2-диметоксіетан, толуол, гексан, 15 UA 99896 C2 5 10 15 20 тетрагідрофуран, діетиловий ефір, дихлорометан та їх суміші. У описаних вище і нижче 2 реакціях захисні групи R переважно незалежно одна від одної вибрані з групи, що включає C 1a b c a b c C4-алкілкарбоніл, C1-C4-алкілоксикарбоніл, арилметил і R R R Si, де арил, R , R і R є такими, як визначено вище в дійсному винаході. Подальша реакція, розкриття епоксиду метальованим агліконом формули VI, в якій M означає літій-, магній-, цинк-, індій-, алюміній- або боровмісний фрагмент, дає шуканий Cглюкозид. Для цього перетворення переважним значенням M є літій, галогенід магнію, галогенід цинку, галогенід індію, галогенід алюмінію, діалкілалюмінійгалогенід або похідна боронової кислоти. Синтез літієвої або магнієвої похідної сполуки VI детально описаний на схемі 2a, і переметалювання цих сполук з утворенням альтернативних сполук, що містять метал, можна провести аналогічно переметалюванню літійованого глюкалю в металовмісні похідні, приведені на схемі 2b. Реакція розкриття епоксиду може протікати без допоміжної речовини або у присутності солі або комплексу перехідного металу, такого як, наприклад, ціанід або галогенід міді, або у присутності кислоти Льюїса, такої як, наприклад, ефірат трифториду бору або триметилсилілхлорид або трифлат. Відповідними інертними розчинниками можуть бути, наприклад, ацетон, ефір, тетрагідрофуран, ацетонітрил, дихлорометан, толуол, гексан та їх суміші. Переважний діапазон температур складає від -80 до 60 °C. Потім продукт формули XXXIII можна перетворити на продукт формули I шляхом 2 відщеплення, переважно - гідролізу захисних груп R , що не означають водень, переважно - з використанням методик, описаних вище в дійсному винаході. Схема 2d: Синтез C-глюкозиду - методика 4 Cl OR O R 1 M 2 Hal O 2 R O OR OR OR VI Cl 2 O R 1 O 2 2 OR R O 2 OR XXXV 2 2 II Hal = F,Cl, Br, OAc, OAlk 25 30 35 40 45 Похідна глюкози XXXV, таке, що містить групу Hal, що можливо відщеплюється, у аномерного атома вуглецю, також можна використовувати як початкову речовину для сполучення з метальованим арилагліконом VI (див. публікацію J. Carbohydr. Chem. 1994, 13, pp. 303-321 і цитовану в ній літературу, в якій описані аналогічні методики). Відповідними групами Hal, що відщеплюються, можуть бути галогенідні, алкоксидні, ацильние групи, такі як карбоксилатні або карбонатні; переважно - F, Cl, Br, C1-C3-алкілкарбонілоксигрупа, C1-C3алкілоксикарбонілоксигрупа або C1-C3-алкілоксигрупа, така як, наприклад, Cl, Br, метоксид, ацетат або метилкарбонат. Відповідними металами M, приєднаними до арильного фрагменту, є, наприклад, літій, магній, у вигляді, наприклад, галогеніду магнію, цинк, у вигляді, наприклад, галогеніду цинку, індій, у вигляді, наприклад, дигалогеніду індію, бор, у вигляді, наприклад, боронової кислоти або ефіру боронової кислоти. Одержання цих метальованих арилів з відповідних галогенованих ароматичних сполук описано на схемі 2c. Реакції заміщення можна проводити за відсутності або у присутності додаткової кислоти Льюїса, такої як, наприклад, ефірат трифториду бору, триметилсилілхлорид або трифлат залежно від металовмісної сполуки, що використовується, або донора глюкозилу. Реакцію переважно проводять в інертних органічних розчинниках або їх сумішах. Переважний розчинник переважно вибирають з урахуванням необхідних метальованого аглікону, донора глюкозилу і допоміжних речовин; переважними можуть бути наступні розчинники: тетрагідрофуран, діоксан, толуол, гексан, ефір, N-метилпіролідинон, диметилацетамід, диметилформамід, ацетонітрил, дихлорометан та їх суміші. Реакцію сполучення зазвичай проводять при температурі від -80 до 120 °C, переважно 2 від -60 до 60 °C. В описаних вище і нижче реакціях захисні групи R переважно незалежно одна від одної вибрані з групи, що включає C1-C4-алкілкарбоніл, C1-C4-алкілоксикарбоніл, арилметил і a b c a b c R R R Si, де арил, R , R і R є такими, як визначено вище в дійсному винаході. Потім продукт формули II можна перетворити на продукт формули I шляхом відщеплення, 2 переважно - гідролізу захисних груп R , що не означають водень, переважно - з використанням методик, описаних вище в дійсному винаході. Синтез галогеноароматичної сполуки V можна проводити за допомогою стандартних 16 UA 99896 C2 5 10 15 20 25 30 35 40 45 50 55 60 методик органічної хімії або щонайменше методик, відомих із спеціальної літератури з органічного синтезу (див. зокрема, публікацію J. March, Advanced Organic Reactions, Reactions, Mechanisms, and Structure, 4th Edition, John Wiley & Sons, Chichester/New York/Brisbane/Toronto/Singapore, 1992 і цитовану в ній літературу). Приклади таких методик наведені в описаних нижче методологіях синтезу. На приведених нижче схемах X означає бром або йод Alk означає C1-C4-алкіл R означає C1-C4-алкіл, C1-C4-алкоксигрупу, CF3, арил або арил-C1-C3-алкіл, де арильні групи можуть бути моно- або полізаміщеними за допомогою L1; 1 R є таким, як визначено вище в дійсному винаході; і L1 є таким, як визначено вище в дійсному винаході; якщо не вказане інше. На схемі 3 описаний синтез аглікону V з використанням як вихідної речовини похідної бензофенону IX, яку можна одержати з похідної бензойної кислоти і фенілалкілового ефіру або метальованого фенілалкілового ефіру (див. схеми 5, 8 і 9). Першою стадією є відщеплення ефірного фрагменту в сполуці IX, яке можна провести в нейтральному, кислому і лужному середовищі. Підходящими для цього перетворення кислими реагентами є, наприклад, трихлорид або трибромід, або трийодид бору, триметилсиліл йодид, хлорид або бромід алюмінію, бромистоводнева кислота, хлористоводнева кислота, хлорид церію, трифторооцтова кислота і трифторометансульфонова кислота, які можна використовувати спільно з нуклеофілом, таким як, наприклад, галогеніди металів, такі як, наприклад, йодид натрію, вода, алкілтіоли, тіоанізол і діалкілсульфіди, які можуть зв'язувати алкільну групу, що відщеплюється. Залежно від кислоти, що використовується, переважними є розчинники вибрані з групи, що включає галогеновані вуглеводні, такі як, наприклад, дихлорометан, хлороформ або 1,2дихлороетан, ацетонітрил, толуол, гексан, оцтову кислоту та їх комбінації. Також можливе проведення реакцій без додаткового розчинника. Реакції зазвичай проводять при температурі від -90 до 150 °C, переважно - від -80 до 50°C. Відщеплення в нейтральному або лужному середовищі можна проводити, наприклад, за допомогою тіолятів металів, таких як, наприклад, сульфід натрію, етантіолят натрію, триметилсилілтіолят натрію, тіофенолят натрію, ціанід натрію і йодид літію, в розчинниках, таких як, наприклад, диметилформамід, диметилацетамід, 1,3-диметил-2-оксогексагідропіримідин, N-метилпіролідон, тетрагідрофуран, колідин і хінолін при температурах від 0 до 250 °C, переважно - від 50 до 180 °C. Друга стадія, представлена на 1 схемі 3, включає приєднання залишку R до фенольного атома кисню сполуки VIII. Це перетворення можна провести в лужному середовищі, як класичну реакцію нуклеофільного заміщення. Відповідно, фенол депротонують основою з утворенням відповідного феноляту. Підходящими основами є, наприклад, солі металів групи I або II, переважно - карбонати, гідроксиди, алкоголяти, такі як, наприклад, метоксид, етоксид або трет-бутоксид, і гідриди металів, такі як, наприклад, гідрид натрію. Реакцію можна провести в полярних і неполярних розчинниках, а також без розчинника, переважно - в спиртах, таких як, наприклад, етанол, ізопропанол або бутанол, ацетон, вода, диметилформамід, диметилацетамід, Nметилпіролідон, диметилсульфоксид, тетрагідрофуран, дихлорометан та їх суміші. Потім 1 одержаний фенолят вводять в реакцію з електрофільним реагентом для R при температурах 1 від 20 до 180 °C, переважно - від 40 до 120 °C. Підходящими електрофілами для R є, наприклад, галогеніди, такі як хлориди, броміди або йодиди, алкілсульфонати, такі як, наприклад, метансульфонат, трифторометансульфонат, арилсульфонати, такі як, наприклад, 4бромофенілсульфонат, 4-метилфенілсульфонат або фенілсульфонат. Альтернативною 1 1 методикою приєднання R до фенолу VIII є приєднання фенолу VIII до групи R , в якій є відповідним чином розташований подвійний зв'язок C=C. Цю реакцію можна проводити у присутності кислоти Бренстеда, такої як, наприклад, трифторометансульфонова кислота, хлористоводнева кислота, сірчана кислота, або каталізаторів, що містять перехідні метали, такі як, наприклад, солі платини, паладію або золота або їх комплекси; переважними солями є трифлат, хлорид, бромід і йодид (див. наприклад, публікацію Cai-Guang Yang and Chuang He; J. Am Chem. S°C. 2005, 127 і цитовану в ній літературу). Розчинник, найбільш підходящий для приєднання, залежить від використовуваної кислоти або перехідного металу. Можуть бути відповідними такі розчинники, як, наприклад, толуол, бензол, дихлорометан, 1,2-дихлороетан, ацетонітрил, тетрагідрофуран, диметилацетамід, N-метилпіролідон, гексан і етилацетат. Реакцію проводять при температурі від 0 до 200 °C, переважно - від 20 до 140 °C. На схемі 3 завершальним є відновлення бензофенону VII з одержанням аглікону V. Відновлюючими реагентами, підходящими для цього перетворення, є, наприклад, силан, такий як, наприклад, 17 UA 99896 C2 5 10 15 20 Et3SiH і триізопропілсилан, борогідрид, такий як, наприклад, NaBH4, і гідрид алюмінію, такий як, наприклад, LiAlH4, у присутності кислоти Льюїса, такої як, наприклад, BF3*OEt2, трис(пентафторофеніл) боран, трифторооцтова кислота, хлористоводнева кислота, хлорид алюмінію або InCl3. Реакції переважно проводять в розчинниках, таких як, наприклад, галогеновані вуглеводні, такі як дихлорометан і 1,2-дихлороетан, толуол, бензол, гексан, ацетонітрил та їх суміші при температурах від -30 до 150 °C, переважно від 20 до 100 °C. Відновлення воднем у присутності каталізатору, що містить перехідний метал, такого як, наприклад, Pd на вугіллі, є іншою можливою методикою синтезу, але в даному випадку воно може виявитися менш підходящим внаслідок конкурентних реакцій відновлення, що протікають для решти частини молекули. Також можливе відновлення за Вольфом-Кіжнером або його варіантами. Таким чином, кетон перетворюється гідразином або його похідним, такими як, наприклад, 1,2-біс(трет-бутилдиметилсиліл) гідразин, в гідразон, який в сильно лужному реакційному середовищі і при нагріванні розкладається з утворенням дифенілметану V і азоту. Реакцію можна проводити в одному реакторі або після виділення гідразону або його похідної за допомогою двох окремих стадії реакції. Відповідні основи включають, наприклад, KOH, NaOH або KOt-Bu в розчинниках, таких як, наприклад, етиленгліколь, толуол, ДМСО (диметилсульфоксид), 2-(2-бутоксіетокси) етанол або трет-бутанол; також можна проводити реакції без використання розчинників. Реакції можна проводити при температурах від 20 до 250 °C, переважно - від 80 до 200 °C. Альтернативою відновленню, що проводиться в лужному середовищі, за Вольфом-Кіжнером є відновлення за Клеменсеном, яке протікає в кислому середовищі і яке також можна використовувати в дійсному винаході, якщо одночасно не протікає дегалогенування. Схема 3: Синтез аглікону V - методика 1 OAl k Cl эфірної групи X OH Cl розщеплення этерифікація X O O IX VIII Cl O 1 R O Cl відновлення 1 R X X O V VII 25 На схемі 4 представлена трохи інша методика синтезу аглікону V, ніж на схемі 3. Проте розщеплення ефіру і етерифікацію, приведену на схемі 4, можна в основному провести за умов проведення реакцій, аналогічних використаним в методиці синтезу, описаній вище для одержання сполук VIII і VII. Схема 4: Синтез аглікону V - методика 2 Cl Cl OAlk розщеплення OH эфірної групи X X XV XI этерифікація Cl X V 30 18 O R 1 UA 99896 C2 5 10 15 На схемі 5 описано одержання аглікону V з використанням як вихідної речовини відомого бензоїлхлориду XII і фенілового ефіру XIII. Першу стадію, одержання бензофенону VII, можна охарактеризувати, як реакцію Фріделя-Крафтса або ацилування типу Фріделя-Крафтса, що є добре відомою методикою органічного синтезу, що широко застосовується. В принципі, бензоїлхлорид XII можна замінити іншими похідними бензойної кислоти, такими як, наприклад, ангідриди, ефіри або бензонітрил. У цій класичній реакції можна використовувати найрізноманітніші субстрати та її зазвичай проводять у присутності каталізатору, такого як, наприклад, AlCl3, FeCl3, йод, залізо, ZnCl2, сірчана кислота або трифторометансульфонова кислота, яку використовують в каталітичних або стехіометричних кількостях. Реакції переважно проводять в хлорованих вуглеводнях, таких як, наприклад, дихлорометан або 1,2-дихлороетан, у вуглеводнях, таких як, наприклад, гексан при температурах в діапазоні від -30 до 140 °C, переважно - від 30 до 100 °C. Проте можна використовувати інші розчинники і суміші розчинників, а також проводити реакції без розчинника або реакції в мікрохвильовій печі. Друга стадія реакції на схемі 5 аналогічна останній реакції на схемі 3, як це описано вище в дійсному винаході. Схема 5: Синтез аглікону V - методика 3 ацилування за Cl Cl O 1 Фріделем-Крафтсом Cl X O + R R 1 X O O XIII XII VII відновлення Cl O R 1 X V 20 25 30 На схемі 6 представлений альтернативний синтез аглікону V за реакцією типу ФріделяКрафтса шляхом алкілування фенілового ефіру XIII електрофілом XIV, що містить бензильну групу (див. публікації Angew. Chem. 2005, 117, pp. 242-246 і Syn. Commun. 2004, 34, pp. 31613165 і цитовану в них літературу). Реакцію зазвичай проводять у присутності каталізатору, переважно - кислоти Льюїса, такої як, наприклад, хлорид скандію, хлорид цинку, хлорид алюмінію або трифторид бору, кислоти Бренстеда, такої як, наприклад, сірчана кислота, хлористоводнева кислота або фторид водню, солі лантаніду, такої як, наприклад, сульфат церію або хлорид ітербію, солі актиніду, солі або комплексу перехідного металу, такого як, наприклад, IrCl3*nH2O, RhCl3*nH2O, H2[PtCl6]*6H2O або H2[PdCl6]*6H2O. Каталізатори можна використовувати в стехіометричних або надлишкових кількостях, хоча у багатьох випадках достатні стехіометричні або навіть каталітичні кількості. Реакції зазвичай проводять при надлишку ароматичної сполуки XIII по відношенню до електрофілу, що містить бензильну групу, без розчинника; хоча також можна використовувати інертні розчинники, такі як, наприклад, галогеновані вуглеводні або вуглеводні. Реакцію зазвичай проводять при температурах від 0 до 200 °C, переважно - від 20 до 140 °C. Схема 6: Синтез аглікону V - методика 4 алкілування типу Cl Cl O 1 O 1 Фріделя -Крафтса Z X XIV 35 1 R R + X XIII V Z1 = OH, OR, OCOR, Cl, Br, I, OCOOR, OSO2R, OPO(OR)2, За методикою, представленою на схемі 7, спочатку синтезують феніловий ефір XVI з монозаміщеного фенолу XV, що можна виконати аналогічно етерифікації, представленій на 19 UA 99896 C2 2 5 10 15 20 25 30 35 40 схемі 3. На другій стадії, вказаній на схемі 7, залишок Z замінюють на метал або заміщений металовмісний залишок. Літій- або магнійзаміщені ароматичні сполуки XVII можна одержати з хлорованих, бромованих або йодованих ароматичних сполук XV так само, як в разі метальованого аглікону VI, описаного на схемі 2a. Відповідна борозаміщена сполука, така як, наприклад, боронова кислота, ефір боронової кислоти або діалкіларилборан, можна одержати з цих метальованих фенілів XVII за реакцією з відповідним боровмісним електрофілом, таким як, наприклад, ефір боронової кислоти, ефір галогеноборонової кислоти, ефір алкілборонової кислоти, ефір діалкілборонової кислоти, тригалогеноборан та їх похідні. Крім того, бороніловану ароматичну сполуку XVII також можна одержати з відповідних хлорованих, бромованих, йодованих або псевдогалогенованих вихідних, таких як, наприклад, трифторометансульфонільовану або тозильовану похідну і диборопохідну, таку як, наприклад, біс(пінаколято)дибор і біс(неопентилгліколято)дибор, або борану, такого як, наприклад, пінаколборан, за допомогою каталізованої перехідним металом реакції (див. наприклад, публікацію Tetrahedron Lett. 2003, р. 4895-4898 і цитовану в ній літературу). Перехідним металом є, наприклад, паладій, який використовують у вигляді металу, солі або комплексу; звичайними джерелами Pd є, наприклад, паладій на вугіллі, ацетат паладію, хлорид паладію, бромід паладію, дибензиліденацетонат паладію, які використовують поодинці або в комбінації з лігандом, таким як, наприклад, фосфіни, такі як, наприклад, трициклогексилфосфін, трифенілфосфін, 1,1’-біс(дифенілфосфіно)фероцен і тритолілфосфін, або фосфіти, або солі імідазолію, такі як 1,3-діарил- або діалкілімідазолійгалогеніди або -псевдогалогеніди, або солі дигідроімідазолію. Такий комплекс перехідного металу з лігандом можна одержати in situ або за допомогою окремої стадії. Реакції переважно проводять у присутності основи, такої як, наприклад, триетиламін, ацетат калію, карбонат калію, фосфат калію, гідроксид натрію, триетиламін або етилдіізопропіламін, в розчинниках, таких як, наприклад, ацетонітрил, тетрагідрофуран, диметилсульфоксид, диметилформамід, диметилацетамід, N-метилпіролідон, діоксан, толуол та їх суміші при температурі від 0 до 180 °C, переважно - від 60 до 140 °C. Літійабо магнійзаміщені феніли XVII самовільно приєднуються до бензальдегіду XVIII з утворенням діарилметанолу XIX. Цю реакцію можна провести в розчинниках, таких як, діетиловий ефір, тетрагідрофуран, толуол, дихлорометан, діоксан, вуглеводні, такі як, наприклад, гексан та їх суміші при температурах в діапазоні від -100 до 20 °C, переважно - від -80 до 0 °C. Арилборонові кислоти XVII можна приєднати до похідної бензальдегіду XVIII за допомогою реакції, що каталізується родієм, і одержати відповідний діарилметанол XIX (див. наприклад, публікацію Adv. Synth. Catal. 2001, р. 343-350 і цитовану в ній літературу). Завершальною стадією, представленою на схемі 7, є відновлення діарилметанолу XIX в аглікон V. Відповідними для цього перетворення відновлюючими реагентами є, наприклад, NaBH 4, LiAlH4, iBu2AlH, Et3SiH, iPr3SiH або Ph2SiClH. Реакцію зазвичай проводять у присутності кислоти Льюїса, такої як, наприклад, BF3*OEt2, трифторооцтова кислота, хлористоводнева кислота, InCl3 або AlCl3, в розчиннику, такому як галогеновані вуглеводні, такі як, наприклад, дихлорометан або 1,2-дихлороетан, толуол, вуглеводні, такі як, наприклад, гексан, ацетонітрил або їх суміші при температурах від -80 до 150 °C, переважно - від -20 до 100 °C. Відновлення воднем у присутності каталізатору, що містить перехідний метал, такий як, наприклад, Pd на вугіллі, в принципі, також можливо, хоча при використанні цієї методики необхідно додержуватися особливої обережності, щоб повністю зберегти цілісність решти частини молекули. Схема 7: Синтез аглікону V - методика 5 20 UA 99896 C2 OH Z O этерифікація 2 Z R 1 O "металювання " 2 R 1 1 M XVI XV XVII Cl Cl O X XVIII O R 1 X Cl відновлення O R 1 X OH V XIX M1 = Li, MgHal, ZnHal, InHal2, CrHal2, B(OH)2, BR2, CeHal2 Z2 = Hal, OSO2R, OSO2CF3 Hal = Cl, Br, I 5 10 15 20 25 30 35 40 За методикою синтезу, представленій на схемі 8, спочатку метальовану похідну фенілового ефіру XXI приєднують до бензойної кислоти або її похідної (XX), такої як ефіри бензойної кислоти, ангідриди бензойної кислоти, бензаміди, такі як, наприклад, типу Вайнреба, бензонітрил або бензоїлхлориди, і одержують бензофенон VII. Літієві або магнієві похідні фенілових ефірів XXI в більшості випадків можна приєднати до бензамідів, ефірів бензойної кислоти, бензоїлхлоридів, ангідридів бензойної кислоти, і бензонітрилу і одержати шуканий бензофенон VII, але тільки літійовані фенілові ефіри взаємодіють з бензойними кислотами з одержанням цієї ж сполуки. Останню реакцію можна провести, наприклад, в тетрагідрофурані, діоксані, діетиловому ефірі, бензолі, толуолі, гексані та їх суміші при температурі від -80 до 100 °C, переважно - від -30 до 40 °C. Бензонітрил і бензаміди, такі як, наприклад, відповідний амід типу Вайнреба або близьку до нього похідну переважно вводити в реакцію з тетрагідрофурані, діоксані, толуолі, гексані, ефірі та їх суміші при температурах в діапазоні від -90 до 50 °C, переважно - від -80 до 20 °C. Бензоїлхлориди і ангідриди і ефіри бензойної кислоти зазвичай використовують в інертних розчинниках, таких як тетрагідрофуран, діетиловий ефір, толуол, дихлорометан, діоксан, вуглеводні, такі як, наприклад, гексан або їх сумішах при низьких температурах, переважно - від -80 до 0 °C. Для виключення подвійного приєднання металоорганічної сполуки до бензоїлхлоридів, ангідридів або ефірів бензойної кислоти з утворенням відповідного спирту приєднання можна переважно проводити у присутності поглинаючого реагенту, такого як, наприклад, триметилсилілхлорид. Альтернативною методикою виключення подвійного приєднання у вказаних вище випадках може бути переметалювання з утворенням менш реакційноздатного нуклеофілу XXI. Відповідними металами є, наприклад, цинк, церій, хром або індій, які вводять, наприклад, у вигляді хлориду, броміду, йодиду або псевдогалогеніду, такого як, наприклад, трифторометансульфонат, для переметалювання літій- або магнійвмісної сполуки з одержанням відповідного менш реакційноздатної, більш селективної металоорганічної сполуки XXI. Переметалювання переважно проводять в розчиннику, в якому утворилася початкова металоорганічна сполука (див. вище), при температурах від -90 до 0 °C. Переметалювання не обмежується вказаними металами і боровмісними сполуками, вже вказаними на схемі 7, і можна використовувати, наприклад, станани або силани. Деякі з переметальованих сполук самовільно взаємодіють з відповідним електрофілом, що містить бензоїльну групу, особливо з бензоїлхлоридом і ангідридом бензойної кислоти, але може бути корисним додавання каталізатору, що містить перехідний метал. Зокрема, для одержання діарилкетонів VII можна використовувати похідні сполук XXI, одержані за допомогою арилборонових кислот, їх ефірів, діалкілборанів, арилтрифтороборатів, стананів, силанів, індію, хрому і цинку, і провести їх сполучення з похідними бензоїлхлориду XX при каталізі перехідним металом, таким як, наприклад, паладій, мідь, залізо, нікель, який можна використовувати у вигляді елементу або солі, такої як, наприклад, ацетат, хлорид, бромід, йодиди, ацетилацетонат, трифторометансульфонат і ціанід, у поєднанні з лігандами, такими як, наприклад, фосфіти, фосфіни, такі як, наприклад, трифенілфосфін, трициклогексилфосфін, тритолілфосфін, 1,3-заміщені імідазолієві або дигідроімідазолієві сполуки. Сполуки, що містять активний перехідний метал, можна одержати до додавання до компонентів реакції сполучення, а також у присутності компонентів реакції in 21 UA 99896 C2 5 situ. Відповідними розчинниками є, наприклад, диметилформамід, диметилацетамід, Nметилпіролідон, диметилсульфоксид, діоксан, ефір, гексан, толуол, тетрагідрофуран, дихлорометан або їх суміші, які переважно використовують при температурі від -50 до 150 °C, особливо переважно - при температурі від 0 до 120 °C. Завершальне перетворення з одержанням аглікону V детально описане вище і його аналогічним чином можна використовувати в цьому випадку. Схема 8: Синтез аглікону V - методика 6 Cl Z X 3 O + R 1 Cl ацилування 2 O R 1 X M O XX XXI Z3 = наприклад, COOH, COOR, CONR2, CONROR, CN, COCl VII відновлення = наприклад, Li, MgHal, B(OH)2, BR2, SiR3, SnR3, CeHal2, InHal2, ZnHal Hal = I, Br, Cl Cl O R 1 M2 10 15 20 25 30 35 40 45 X V Відповідно до схеми 9 метальовані арили XXIII, які можна синтезувати так, як описано вище, також можна ввести в реакцію з електрофілами XXII, що містять бензильну групу, такими як, наприклад, бензилхлориди, -броміди, -йодиди, -сульфонати, -фосфонати, -карбонати або карбоксилати, і одержати діарилметани V. Літієві або магнієві похідні фенілвмісних сполук XXIII корисно (але не завжди обов'язково) вводити в реакцію у присутності перехідного металу, такого як, наприклад, мідь, залізо, нікель або паладій (див. наприклад, публікації Org. Lett. 2001, 3, 2871-2874 і Tetrahedron Lett. 2004, р. 8225-8228 і цитовану в них літературу). Відповідними розчинниками є, наприклад, тетрагідрофуран, діоксан, толуол, дихлорометан, гексан, ефір або їх суміші. Температури, при яких проводять реакції, знаходяться в діапазоні від -90 до 20 °C, переважно - від -80 до -20 °C. Перехідний метал можна використовувати у вигляді елементу, наприклад, на вугіллі, у вигляді солі, такої як, наприклад, ацетат, ацетилацетонат, ціанід, хлорид, бромід, йодид, трифторометансульфонат, або у вигляді комплексу, такого як, наприклад, з дибензиліденацетонами, фосфітами, фосфінами, такими як, наприклад, трифенілфосфін, трициклогексилфосфін або тритолілфосфін, або з карбенами, одержаними, наприклад, з 1,3-заміщених імідазолієвих або дигідроімідазолієвих сполук. Сполуки, що містять активний перехідний метал, можна одержати in situ у присутності компонентів реакції або до додавання до компонентів реакції сполучення. Арили XXIII, що містять метал, і які включають, наприклад, залишок, що містить бор, олово, кремній, цинк, індій, хром, переважно використовують в комбінації з каталізатором, що містить перехідний метал. Відповідними сполуками цього типу, що містять метал, є, наприклад, боронові кислоти, ефіри боронових кислот, діалкілборани, трифтороборати, триалкілстанани, трихлоростанани, триалкоксисилани, дигалогеноіндійзаміщені або галогеноцинкзаміщені сполуки. Заміщені металом сполуки XXIII можна синтезувати, як це описано вище, шляхом переметалювання виходячи з відповідних літій- або магнійвмісних похідних сполук або, як в разі цинку, хрому та індію, також безпосередньо з відповідного арилхлориду, -броміду або -йодиду шляхом впровадження елементарного металу. Реакцію сполучення з електрофілом, що містить бензильну групу, можна проводити в тетрагідрофурані, диметилформаміді, диметилацетаміді, N-метилпіролідоні, диметилсульфоксиді, толуолі, ефірі, діоксані, дихлорометані, ацетонітрилі, гексані, воді, спиртах, таких як, наприклад, етанол, ізопропанол або їх сумішах, при температурах проведення реакції, рівних від -30 до 180 °C, переважно - від 20 до 150 °C. Залежно від металу може бути корисним або навіть важливим використання додаткової основи, такої як, наприклад, триетиламін, етилдіізопропіламін, карбонат цезію або калію, або натрію, або літію, третбутоксид натрію або літію, фосфат калію, фторид калію або цезію або тетрабутиламонійфторид, гідроксид натрію, гідроксид талію, метоксид натрію і/або інших добавок, таких як, наприклад, хлорид літію, солі срібла, такі як, наприклад, карбонат або оксид, тетрабутиламонійбромід і бромід натрію (див., наприклад, публікацію M. Schlosser, Organometallics in Synthesis, John Wiley & Sons, Chichester/New York/Brisbane/Toronto, 1994 і цитовану в ній літературу). Схема 9: Синтез аглікону V - методика 7 22 UA 99896 C2 Cl O + X Z XXII 5 10 15 20 25 30 35 4 M R Cl промотор 1 O R 1 X 3 XXIII V Z4 = OR, OCOR, Cl, Br, I, OCOOR, OSO2R, OPO(OR)2, 3 = наприклад, Li, MgHal, B(OH) , BR , BF M4, SiR , M 2 2 3 3 SnR3, CeHal2, InHal2, InHal2, ZnHal, CrHal 2 Hal = I, Br, Cl M4 = K, Na, Li На схемі 10 описано одержання аглікону V через проміжний продукт XXVI, який можна 5 одержати відповідно до схеми 8. Якщо Z означає галоген, такий як F, то проміжний продукт XXVI альтернативно можна одержати ацилуванням за Фріделем-Крафтсом відповідно до схеми 5 1 5 5. Заміну Z в сполуці XXVI на O-R можна провести за різними методиками. У випадках, коли Z 1 переважно означає фтор, хлор, йод, трифторометансульфонат O-R можна приєднати шляхом 1 електрофільного заміщення по ароматичному кільцю, при якому R -OH або його аніон заміщує 5 Z за схемою приєднання/відщеплення. Реакцію зазвичай проводять в розчинниках, таких як, наприклад, диметилформамід, диметилацетамід, диметилсульфоксид, тетрагідрофуран, діоксан, трет-бутанол, толуол, N-метилпіролідон, вода, спирт або їх суміші у присутності основи, такої як, наприклад, трет-бутоксид літію або натрію, або калію, карбонат натрію, калію або цезію, гідроксид натрію або калію, трикалійфосфат, триетиламін, етилдіізопропіламін або діазабіциклоундецен, при температурах в діапазоні від 0 до 180 °C, переважно - від 40 до 140 1 °C. R -OH також можна використовувати як розчинник і його можна депротонувати, наприклад, гідридом натрію або натрієм і одержати алкоксид до приєднання сполуки XXVI. Для посилення 1 нуклеофільності системи R -O-метал може бути корисним додавання краун-ефірів, таких як, 1 наприклад, 18-краун-6. Сполучення проміжного продукту XXVI, що виділяється, з R -OH також можна проводити у присутності солі або комплексу перехідного металу, такого як, наприклад, 5 одержаний з Pd або Cu (реакція Ульмана або типу Ульмана). В цьому випадку Z переважно означає йод або трифторометансульфонат. Ті ж самі розчинники, основи, добавки і температури, вказані для некаталітичної реакції, можна використовувати для каталітичної, за тим виключенням, що останню переважно проводити в атмосфері інертного газу, такого як аргон або азот. Каталізатор зазвичай використовується у вигляді елементу як такого або на вугіллі, у вигляді солі, такої як, наприклад, хлорид, бромід, ацетат, ціанід, або у воді комплексу з лігандами, такими як, наприклад, фосфіти, фосфіни, дибензиліденацетон, 1,3-дизаміщені 5 імідазол- або дигідроімідазолкарбени. Якщо Z означає арилборонову кислоту або 1 трифтороборат, то R -OH можна приєднати за допомогою каналізованої міддю(II) реакції з використанням джерела міді, такого як, наприклад, ацетат міді(II), у присутності основи, такої як, наприклад, триетиламін або піридин, в розчинниках, таких як, наприклад, тетрагідрофуран, дихлорометан, 1,2-дихлороетан, ацетонітрил, діоксан, диметилформамід, диметилацетамід або N-метилпіролідон. Реакцію можна проводити із стехіометричними кількостями каталізатору, що містить мідь, або у присутності допоміжного окиснювача, такого як, наприклад, кисень, піридинN-оксид або тетраметилпіперидиноксид, з використанням тільки каталітичних кількостей каталізатору. Корисні сухі розчинники і присутність осушуючих реагентів, таких як, наприклад, молекулярні сита (див. наприклад, публікацію Angew. Chem. 2003, 115, pp. 5558-5607 і цитовану в ній літературу). Схема 10: Синтез аглікону V - методика 8 23 UA 99896 C2 Cl Z X 3 Z + 5 Cl ацилування 3 Z 5 X M O XXIV XXV XXVI Z3 = наприклад, COOH, COOR, CONR2, CONROR, CN, COCl "O-R1" M3 = наприклад Li, MgHal, B(OH) 2, BR2, BF3M4, SiR3, SnR3, CeHal 2, InHal 2, InHal 2, ZnHal, CrHal 2 Hal = I, Br, Cl M4 = Li, Na, K Cl O X V Z5 = наприклад, F, Cl, I, B(OH) 2, BF3K, BF3Na, OSO 2CF3 5 10 15 20 25 30 35 40 На схемі 11 представлена переважна методика одержання аглікону V, яка відповідає схемі 10, але проміжний продукт XXVI одержують ацилуванням за Фріделем-Крафтсом відповідно до схеми 5. На схемі 11 і в подальших розділах описані переважні умови і варіанти здійснення способу, відповідного сьомому об'єкту справжнього винаходу. Для одержання аглікону V як початкові речовини використовують відомі бензоїлхлорид XII і галогенобензол XXVII. Замісник X переважно означає атом брому або йоду. Переважним 5 значенням замісника Z є атом фтору. Першу стадію, одержання бензофенону XXVI, можна охарактеризувати, як реакцію Фріделя-Крафтса або ацилування типу Фріделя-Крафтса, що є добре відомою методикою органічного синтезу. В принципі, бензоїлхлорид XII можна замінити іншими похідними бензойної кислоти, такими як, наприклад, ангідриди, ефіри або бензонітрил. Цю реакцію переважно проводять у присутності каталізатору, такого як, наприклад, AlCl 3, FeCl3, йод, залізо, ZnCl2, сірчана кислота або трифторометансульфонова кислота, яку використовують в каталітичних або таких, що доходять до стехіометричних кількостях. Переважним каталізатором є AlCl3. Реакцію можна проводити з використанням і без використання додаткових розчинників. Переважними додатковими розчинниками є хлоровані вуглеводні, такі як, наприклад, дихлорометан або 1,2-дихлороетан, вуглеводні, такі як, наприклад, гексан або їх суміші. У переважному варіанті здійснення реакцію проводять з використанням надлишку галогенобензолу XXVII, який додатково виступає як розчинник. Переважні температури проведення реакції складають від -30 до 140 °C, переважно - від 30 до 85 °C. Після завершення реакції її можна зупинити водою. Органічні розчинники переважно видаляти. Проміжний продукт XXVI можна виділити, переважно - шляхом кристалізації, наприклад, з води. 5 1 Друга стадія реакції на схемі 11, яка є заміщенням Z на O-R , аналогічна другій стадії реакції на схемі 10, приведеній вище в дійсному винаході. У переважному варіанті здійснення O1 R відповідно до правил нуклеофільного заміщення приєднується по ароматичному кільцю, в 1 5 якому R -OH або його аніон заміщує Z за схемою приєднання/відщеплення. Реакцію переважно проводять в розчиннику, такому як, наприклад, диметилформамід, диметилацетамід, диметилсульфоксид, тетрагідрофуран, діоксан, трет-бутанол, толуол, гептан, N-метилпіролідон, вода, спирт або їх суміші. Переважні розчинники вибрані з групи, що включає диметилформамід, тетрагідрофуран і диметилацетамід. Цю реакцію переважно проводять у присутності основи, такої як C 1-C4-алкоксиди лужних металів, карбонати лужних металів, гідроксиди лужних металів, фосфати лужних металів, три(C1-C3 алкіл) аміни та інші N-вмісні органічні основи. Прикладами переважних основ є третбутоксид літію або натрію, або калію, карбонат натрію, калію або цезію, гідроксид натрію або калію, трикалійфосфат, триетиламін, етилдіізопропіламін, біс(триметилсиліл) амід натрію (NAHMDS), діазабіциклоундецен (DBU), 1,4-діазабіцикло[2.2.2]октан (DABCO) або їх суміші. Переважніші основи вибрані з групи, що включає трет-бутоксид натрію або калію, гідроксид натрію або калію, карбонат цезію, суміш карбонату цезію і карбонату калію або їх суміші. Кількість основи переважно знаходиться в діапазоні від 1 до 5 моль основи на 1 моль проміжного продукту XXVI. У випадку, якщо основою є карбонат, фосфат або їх суміші, переважніше, якщо повна кількість основи знаходиться в діапазоні від 2 до 4 моль основи, найпереважніше - приблизно 3 моля основи на 1 моль проміжного продукту XXVI. Реакцію переважно проводять при температурах в діапазоні приблизно від -20 до 60 °C, 24 R 1 UA 99896 C2 5 10 15 20 25 переважніше - приблизно від -10 до 40 °C, ще переважніше - приблизно від 0 до 30°C. Проміжний продукт VII можна виділити з реакційної суміші, переважно - кристалізацією, наприклад, з суміші етанолу і води. Шлях синтезу, відповідний схемі 11, завершується відновленням бензофенону VII з утворенням аглікону V. Відновлюючими реагентами, підходящими для цього перетворення, є силани, переважно - три(C1-C3-алкіл) силани, такі як, наприклад, триетилсилан, диметилетилсилан і триізопропілсилан, борогідриди, такі як, наприклад, NaBH 4, і гідриди алюмінію, такі як, наприклад, LiAlH4, у присутності кислоти Льюїса, таких як, наприклад, BF3*OEt2, трис(пентафторофеніл)боран, трифторооцтова кислота, хлористоводнева кислота, хлорид алюмінію або InCl3. Особливо переважним відновлюючим реагентом є Et3SiH у присутності кислоти Льюїса, такої як, наприклад, BF3*OEt2. Іншим особливо переважним відновлюючим реагентом є NaBH4 у присутності кислоти Льюїса, такої як, наприклад, трифторооцтова кислота. Кількість відновлюючого реагенту, переважно - Et3SiH, переважно складає приблизно від 1 до 5 моль, ще переважніше - приблизно від 2 до 4 моль, найпереважніше - приблизно 3 моля на 1 моль бензофенону VII. Кількість кислоти Льюїса, переважно - BF3*OEt2, переважно складає приблизно від 1 до 5 моль, ще переважніше - приблизно від 1 до 3 моль на 1 моль бензофенону VII. Реакцію відновлення переважно проводять в розчиннику, такому як галогеновані вуглеводні, наприклад, дихлорометан і 1,2-дихлороетан, толуол, бензол, гексан, ацетонітрил та їх суміші. Відновлення переважно проводять при температурах приблизно від -30 до 100 °C, переважніше - приблизно від -20 до 50 °C, ще переважніше - приблизно від -10 до 25°C. Аглікон формули V можна виділити і очистити або можна використовувати для синтезу кінцевого продукту формули I без додаткового очищення. З використанням аглікону формули V як початкову речовину продукт формули I можна одержати за методиками, описаними вище в дійсному винаході, переважно - за методиками, описаними і представленими на схемі 2a. Схема 11: Синтез аглікону V - Переважний варіант здійснення Cl Cl X Z + 5 ацилування за Фріделем-Крафтсом Cl Z5 = F, Cl, I 5 X O XII Z O XXVII XXVI "O-R1" Cl O R 1 X O VII відновлення Cl O R 1 X V 30 35 У реакціях, описаних вище в дійсному винаході, будь-яку наявну реакційноздатну групу, таку як етиніл, гідроксигрупа, аміногрупа, алкіламіногрупа або іміногрупа, можна захистити під час реакції за допомогою звичайних захисних груп, які відщеплюються після проведення реакції. Наприклад, захисною групою гідроксигрупи можуть бути триметилсилільна, ацетильна, тритильна, бензильна або тетрагідропіранільна група. Захисними групами для аміногрупи, алкіламіногрупи або іміногрупи можуть бути, наприклад, формільна, ацетильна, трифтороацетильна, етоксикарбонільна, трет-бутоксикарбонільна, бензилоксикарбонільна, бензильна, метоксибензильна або 2,4- диметоксибензильна група. Крім того, одержані сполуки і проміжні продукти можна розділити на енантіомери і/або діастереоізомери, як вказано вище в дійсному винаході. Так, наприклад, цис/транс-суміші 25 UA 99896 C2 5 10 15 20 25 30 35 40 45 50 можна розділити на цис- і транс-ізомери і сполуки, що містять щонайменше один оптично активний атом вуглецю можна розділити на енантіомери. Так, наприклад, цис/транс-суміші можна розділити за допомогою хроматографії на цис- і транс-ізомери, одержані сполуки і проміжні продукти, що утворюються у вигляді рацематів, можна розділити за методиками, які самі по собі відомі (див. Allinger N. L. and Eliel E. L. in "Topics in Stere°Chemistry", Vol. 6, Wiley Interscience, 1971) на їх оптичні антиподи і сполуки або проміжні продукти, які містять щонайменше 2 асиметричних атома вуглецю, можна розділити на діастереоізомери на основі відмінностей їх физико-хімічних характеристик за методиками, які самі по собі відомі, наприклад, за допомогою хроматографії і/або фракційної кристалізації, і, якщо ці сполуки утворюються у вигляді рацематів, то їх потім можна розділити на енантіомери так, як це вказано вище. Енантіомери переважно розділяють за допомогою колонок, що містять хіральні фази, або за допомогою перекристалізації з оптично активного розчинника, або за реакцією з оптично активною речовиною, яка утворює з рацемічною сполукою солі або похідні, такі як, наприклад, складні ефіри або аміди, переважно - з кислотами та їх активованими похідними, або спиртами з розділенням одержаної таким чином суміші діастереоізомерів солей або похідних, наприклад, на основі відмінності їх розчинності, і вільні антиподи можна виділити з чистих діастереоізомерів солей або похідних шляхом обробки відповідними реагентами. Зазвичай оптично активними кислотами, що використовуються, є, наприклад, D- і L- форми винної кислоти або дибензоїлвинної кислоти, ди-o-толілвинної кислоти, яблучної кислоти, мигдалевої кислоти, камфорсульфонової кислоти, глутамінової кислоти, аспарагінової кислоти або хінної кислоти. Оптично активним спиртом може бути, наприклад, (+) - або (-) - ментол і оптично активною ацильною групою в амідах, наприклад, можливо (+) - або (-) - ментилоксикарбонільна група. Крім того, сполуки і проміжні продукти пропоновані в дійсному винаході, можна перетворити на їх солі, для застосування у фармацевтиці - переважно у фізіологічно прийнятні солі з неорганічними або органічними кислотами. Кислоти, які можна використовувати з цією метою, включають, наприклад, хлористоводневу кислоту, бромистоводневу кислоту, сірчану кислоту, метансульфонову кислоту, фосфорну кислоту, фумарову кислоту, янтарну кислоту, молочну кислоту, лимонну кислоту, винну кислоту і малеїнову кислоту. Сполуки пропоновані в дійсному винаході, також з успіхом можна одержати за методиками, описаними в наведених нижче прикладах, які з цією метою можна поєднувати з методиками, відомими фахівцям з літератури, наприклад, переважно - з методиками, описаними в WO 98/31697, WO 01/27128, WO 02/083066, WO 03/099836 і WO 2004/063209. Вище і нижче в дійсному описі в структурних формулах не завжди явно вказані атоми H гідроксигруп. Наведені нижче приклади призначені для ілюстрації справжнього винаходу без його обмеження. У випадку, якщо тиск вказаний в одиницях "торр", відповідні значення можна перерахувати в одиниці СІ за співвідношенням 1 торр = 133,322 Па. Вирази "кімнатна температура" і "температура навколишнього середовища" означають температуру, рівну приблизно 20°C. Ac ацетил Bu бутил Et етил EtOAc етилацетат i-Pr ізопропіл Me метил MeOH метанол МТБЕ метил-трет-бутиловий ефір ТГФ тетрагідрофуран. Експериментальні методики: Приклад I Cl O O Br (5-бромо-2-хлорофеніл)-(4-метоксифеніл)-метанон 38,3 мл оксалілхлориду і 0,8 мл диметилформаміду додають до суміші 100 г 5-бромо-2 26 UA 99896 C2 5 10 15 хлоробензойної кислоти з 500 мл дихлорометану. Реакційну суміш перемішують протягом 14 год., потім фільтрують і відокремлюють від всіх летких компонентів на роторному випаровувачі. Залишок розчиняють в 150 мл дихлорометану, одержаний розчин охолоджують до -5 °C і додають 46,5 г анізолу. Потім 51,5 г трихлориду алюмінію порціями додають, так щоб температура не перевищувала 5 °C. Розчин перемішують протягом ще 1 год. при температурі від 1 до 5 °C і потім виливають в подрібнений лід. Органічну фазу відокремлюють і водну фазу тричі екстрагують дихлорометаном. Об'єднані органічні фази промивають водним розчином 1 M хлористоводневої кислоти, двічі 1 M розчином гідроксиду натрію і розсолом. Органічну фазу сушать, розчинник видаляють у вакуумі і залишок перекристалізовують з етанолу. Вихід: 86,3 г (64% від теоретичного) + + Мас-спектр (ІЕР (іонізація електророзпиленням)): m/z = 325/327/329 (Br+Cl) [M+H] Вказані нижче сполуки можна одержати аналогічно тому, як це виконано в прикладі I: (1) (5-Бромо-2-хлорофеніл)-(4-(R)-тетрагідрофуран-3-ілоксифеніл)-метанон Реакцію проводять за описаною вище методикою, за тим виключенням, що використовують 2 екв. трихлориду алюмінію. Реакційну суміш перемішують при кімнатній температурі після додавання трихлориду алюмінію. Cl O O Br 20 O + + Мас-спектр (ІЕР ): m/z = 382/384/386 (Br+Cl) [M+H] (2) (5-Бромо-2-хлорофеніл)-(4-(S)-тетрагідрофуран-3-ілоксифеніл)-метанон Реакцію проводять за описаною вище методикою, за тим виключенням, що використовують 2 екв. трихлориду алюмінію. Реакційну суміш перемішують при кімнатній температурі після додавання трихлориду алюмінію. Cl O O Br O Приклад II Cl O F 25 30 35 40 45 Br (5-бромо-2-хлорофеніл)-(4-фторофеніл)-метанон Варіант A: 8,7 мл оксалілхлориду і 0,3 мл диметилформаміду додають до суміші 24 г 5-бромо-2хлоробензойної кислоти з 150 мл дихлорометану. Реакційну суміш перемішують протягом 14 год., потім фільтрують і відокремлюють від всіх летких компонентів на роторному випаровувачі. Залишок розчиняють в 105 мл фторобензолу і нагрівають до 85 °C. Потім порціями додають 13,3 г трихлориду алюмінію і одержану реакційну суміш перемішують протягом 16 год. при 85 °C. Після охолодження до температури навколишнього середовища реакційну суміш виливають в суміш 300 г подрібненого льоду і 100 мл концентрованої хлористоводневої кислоти. Одержану суміш двічі екстрагують етилацетатом. Об'єднані органічні екстракти промивають 1 M водним розчином гідроксиду натрію, 1 M водним розчином хлористоводневої кислоти і розсолом. Після сушки над сульфатом магнію розчинник видаляють у вакуумі. Затверділий залишок промивають петролейним ефіром і сушать у вакуумі. Вихід: 25,0 г (80% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 313/315/317 (Br+Cl) [M+H] Варіант B: До розчину 9,42 г 5-бромо-2-хлоробензойної кислоти в 40 мл фторобензолу і 0,1 мл N,Nдиметилформаміду при температурі від 0 до 10 °C додають 4 мл оксалілхлориду. Розчин перемішують приблизно при 20 °C протягом 2 год. Надлишкову кількість оксалілхлориду випаровують. Залишок розбавляють за допомогою 38 мл фторобензолу і при 0 °C п'ятьма 27 UA 99896 C2 5 порціями додають 5,87 г хлориду алюмінію. Розчин перемішують при 80 °C протягом 5 год. і реакцію зупиняють за допомогою 60 мл води при температурі від 0 до 25 °C. Продукт екстрагують за допомогою 50 мл ізопропілацетату і двічі промивають за допомогою 40 мл 3 мас.% розсолу. Розчинник видаляють випаровуванням і продукт кристалізують з гептану і води. Вихід: 11,94 г (92,4 % від теоретичного) + + Мас-спектр (ІЕР ): m/z = 314/316 (Cl) [M+H] Приклад III Cl F I O 10 15 20 (2-Хлоро-5-йодофеніл)-(4-фторофеніл)-метанон До розчину 48,94 г 2-хлоро-5-йодобензойної кислоти в 180 мл фторобензолу і 0,3 мл N,Nдиметилформаміду при температурі від 0 до 10 °C додають 16,2 мл оксалілхлориду. Розчин перемішують приблизно при 20°C протягом 2 год. Надлишкову кількість оксалілхлориду випаровують. Залишок розбавляють за допомогою 166 мл фторобензолу і при 0 °C п'ятьма порціями додають 25,93 г хлориду алюмінію. Розчин перемішують при 75 °C протягом 1,5 год. і реакцію зупиняють за допомогою 300 мл води при температурі від 0 до 25 °C. Продукт екстрагують за допомогою 300 мл ізопропілацетату і двічі промивають за допомогою 200 мл розсолу (3 мас.%). Залишок води і розчинник видаляють випаровуванням. Вихід: 60,56 г (95 % від теоретичного) + + Мас-спектр (ІЕР ): m/z = 361/363 (Cl)[M+H] Приклад IV Cl O O Br O 25 30 35 40 (5-бромо-2-хлорофеніл)-(4-(S)-тетрагідрофуран-3-ілоксифеніл)-метанон Варіант A: До розчину 8,1 г (S)-3-гідрокситетрагідрофурану у 200 мл диметилформаміду додають 10,3 г трет-бутоксиду калію. Суміш перемішують при кімнатній температурі протягом 10 хв. і потім додають 24,0 г (5-бромо-2-хлорофеніл)-(4-фторофеніл)-метанону при охолодженні на водяній бані, так щоб температура розчину була нижча 35 °C. Реакційну суміш перемішують протягом 14 год. при кімнатній температурі і потім розбавляють за допомогою 1000 мл води. Одержану суміш екстрагують етилацетатом і об'єднані екстракти промивають водою і розсолом. Після сушки над сульфатом магнію розчинник видаляють і залишок перекристалізовують з етанолу. Вихід: 22,5 г (77% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 382/384/386 (Br+Cl) [M+H] Варіант B: До розчину 19,00 г (5-бромо-2-хлорофеніл)-(4-фторофеніл)-метанону в 60 мл тетрагідрофурану і 5,87 г (S)-3-гідрокситетрагідрофурану додають 9,60 г трет-бутоксиду калію в 90 мл тетрагідрофурану при температурі від 0 до 5 °C. Розчин перемішують при 10 °C протягом 0,5 год. Реакцію зупиняють за допомогою 60 мл води і 40 мл метил-трет-бутилового ефіру при температурі від 0 до 25 °C. Продукт промивають за допомогою 80 мл розсолу (3 мас.%). Розчинник видаляють випаровуванням і речовину кристалізують з 135 мл суміші 2:1 ізопропілацетат/вода. Вихід: 20,1 г (87 % від теоретичного) + + Мас-спектр (ІЕР ): m/z = 382/384 (Cl) [M+H] Приклад V 28
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparaton of glucopyranosyl-substituted phenyl derivatives, intermediates and processes for the production thereof
Автори англійськоюEckhardt Matthias, Himmelsbach Frank, Van Syao-tsyun', Sun' Syufen, Chgan Lee, Tang, Wenjun, Krishnamurthy, Dhileepkumar, Senanayake, Chris H., Han' Chgensyuy
Назва патенту російськоюСпособ получения глюкопиранозилзамещенных производных бензилбензола, промежуточные продукты и способы их получения
Автори російськоюЭкхардт Маттиас, Химмельсбах Франк, Ван Сяо-цзюнь, Сунь Сюфен, Чжан Ли, Тан Веньюнь, Кришнамурти Дхилеепкумар, Сенанаяке Крис Х., Хань Чженсюй
МПК / Мітки
МПК: C07H 15/203
Мітки: глюкопіранозилзаміщених, продукти, спосіб, похідних, способи, бензилбензолу, одержання, проміжні
Код посилання
<a href="https://ua.patents.su/46-99896-sposib-oderzhannya-glyukopiranozilzamishhenikh-pokhidnikh-benzilbenzolu-promizhni-produkti-ta-sposobi-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання глюкопіранозилзаміщених похідних бензилбензолу, проміжні продукти та способи їх одержання</a>
Попередній патент: Пептидоміметичний інгібітор протеаз
Наступний патент: Модулятори індоламін-2,3-діоксигенази та їх застосування
Випадковий патент: Апарат для вирощування мікроорганізмів