Похідні к-252а та спосіб покращення функціонування та підвищення виживання клітини
Номер патенту: 67725
Опубліковано: 15.07.2004
Автори: Мураката Тікара, Хадкінз Роберт Л., Танака Рейко, Хамано Масамі, Малламо Джон П.
Формула / Реферат
1. Соединения, представленные следующей формулой (I)
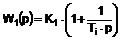 ,
,
где:
один из R1 и R2 выбран из группы, включающей:
a) -CO(CH2)jR4, где j равен от 1 до 6 и R4 выбран из группы, включающей:
1) галоген;
2) –NR5R6, где R5 и R6 независимо представляют водород, замещенный низший алкил, незамещенный низший алкил, замещенный арил, незамещенный арил, замещенный гетероарил, незамещенный гетероарил, замещенный аралкил, незамещенный аралкил, низший алкиламинокарбонил или низший алкоксикарбонил; или R5 и R6 объединены вместе с атомом азота с образованием гетероциклической группы;
3) N3;
4) -SR27, где R27 выбран из группы, включающей:
і) водород;
іі) замещенный низший алкил;
ііі) незамещенный низший алкил;
iv) замещенный арил;
v) незамещенный арил;
vi) замещенный гетероарил;
vii) незамещенный гетероарил;
viii) замещенный аралкил;
ix) незамещенный аралкил;
х) тиазолинил;
xi) - (CH2)aCO2R28, где а равно 1 или 2 и R28 выбран из группы, включающей: водород и низший алкил;
и
xii) -(CH2)aCONR5R6; и
5) OR29 (где R29 представляет водород, замещенный низший алкил, незамещенный низший алкил или COR30 (где R30 представляет водород, низший алкил, замещенный арил, незамещенный арил, замещенный гетероарил или незамещенный гетероарил));
b) -СН(ОН)(CH2)bR4A, где b равно от 1 до 6 и R4A представляет водород или имеет те же значения, что R4;
c) - (CH2)dCHR31CO2R32, где d равно от 0 до 5 и R31 представляет водород, -CONR5R6 или –СО2R33 (где R33 представляет водород или низший алкил) и R32 представляет водород или низший алкил;
d) -(CH2)dCHR31CONR5R6;
e) -(CH2)kR7, где k равно от 2 до 6 и R7 представляет галоген, CO2R8 (где R8 представляет водород, низший алкил, замещенный арил, незамещенный арил, замещенный гетероарил или незамещенный гетероарил), CONR5R6, замещенный арил, незамещенный арил, замещенный гетероарил, незамещенный гетероарил, OR9 (где R9 представляет водород, замещенный низший алкил, незамещенный низший алкил, ацил, замещенный арил или незамещенный арил), SR27B (где R27B имеет те же значения, что R27), NR10R11 (где R10 и R11 имеют те же значения, что и R5 и R6) или N3;
f) –СH=СH(CH2)mR12, где m равно от 0 до 4 и R12 представляет водород, низший алкил, СО2R8A (где R8A имеет те же значения, что и R8) , -CONR5R6, замещенный арил, незамещенный арил, замещенный гетероарил, незамещенный гетероарил, OR9A (где R9A имеет те же значения, что и R9) или NR10AR11A (где R10A и R11A имеют те же значения, что и R5 и R6);
g) –СН=C(CO2R33A)2 где R33A имеет те же значения, что и R33;
h) -C≡C (CH2)nR13, где n равно от 0 до 4 и R13 имеет те же значения, что и R12;
і) –СН2OR44, где R44 представляет замещенный низший алкил;
и другие R1 и R2 выбраны из группы, включающей:
j ) водород, низший алкил, галоген, ацил, нитро, NR14R15 (где один из R14 или R15 представляет водород или низший алкил, а другой представляет водород, низший алкил, ацил, карбамоил, низший алкиламинокарбонил, замещенный ариламинокарбонил или незамещенный ариламинокарбонил);
k) –CH(SR34)2, где R34 представляет низший алкил или алкилен;
l) –CH2R35, где R35 представляет OR36 (где R36 представляет три-низший алкилсилил, в котором три низшие алкильные группы являются одинаковыми или различными, или имеет те же значения, что и R29) , или SR37 (где R37 имеет те же значения, что и R27);
m) -CO(CH2)qR16, где q равно от 1 до 6 и R16 имеет те же значения, что R4;
n) -СН(ОН)(CH2)eR38, где е равно от 1 до 6 и R38 имеет те же значения, что R4A;
о) - (CH2)fCHR39CO2R40 , где f равно от 0 до 5 и R39 имеет те же значения, что R31 и R40 имеет те же значения, что R32;
р) -(СН2)rR17 где г равно от 2 до 6 и R17 имеет те же значения, что и R7;
q) -СН=СН(СН2)tR18, где t равно от 0 до 4 и R18 имеет те же значения, что и R12;
r) -СН=С(CO2R33B)2, где R33B имеет те же значения, что и R33;
s) -C ≡ C (СН2)uR19, где u равно от 0 до 4 и R19 имеет те же значения, что и R13;
R3 представляет водород, ацил или низший алкил;
Х выбран из группы, включающей:
a) водород;
b) формил;
c) низший алкоксикарбонил;
d) –CONR20R21, где:
R20 и R21, независимо представляют:
водород;
низший алкил;
e) -CH2R22, где R22 представляет гидрокси, или
f) -NR23R24 (где один из R23 или R24 представляет водород или низший алкил, а другой представляет водород, низший алкил или остаток ![]() -аминокислоты, в которой гидроксигруппа карбоксильной группы исключена, или R23 и R24 объединены с атомом азота с образованием гетероциклической группы); и
-аминокислоты, в которой гидроксигруппа карбоксильной группы исключена, или R23 и R24 объединены с атомом азота с образованием гетероциклической группы); и
g) -CH=N-R25, где R25 представляет гидрокси, низший алкокси, амино, гуанидино или имидазолиламино;
Y представляет гидрокси, низший алкокси, аралкилокси или ацилокси; или
объединенные Х и Y представляют -Х-Y-, =O, -CH2O(C=O)O-, -CH2OC(=S)O-, -CH2NR26C(=O) - (где R26 представляет водород или низший алкил), -СН2NНС(=S)O-, -СН2OS(=O)O- или –CH2OC(СН3)2О-;
и
W1 и W2 представляют водород, или W1 и W2 вместе представляют кислород;
или их фармацевтически приемлемые соли.
2. Соединение по п. 1, где:
а) один из R1 и R2 выбран из группы, включающей -(CH2)kR7, -СН=СН(СН2)mR12, -CH≡CH(CH2)nR13, -СО(СН2)jSR27 и -CH2OR44, где R44 обозначает метоксиметил, этоксиметил или метоксиэтил;
и другой из R1 и R2 выбран из группы, включающей -(CH2)rR17, -CH=CH(CH2)tR18, -CH≡CH(CH2)uR19, NR14R15, водород, галоген, нитро, -СН2O-(замещенный низший алкил или незамещенный низший алкил), -CO(CH2)qSR27, -CH2R35, где R35 представляет OR36, и –CH2SR37, где R37 выбран из группы, включающей низший алкил, пиридил и бензимидазолил;
b) k и r, каждый, равны 2, 3 или 4;
c) j и q, каждый, равны 1 или 2;
d) R7 и R17 выбраны:
1) независимо из группы, включающей фенил, пиридил, имидазолил, тиазолил или тетразолил; или
2) попарно из группы, включающей:
i) –CO2R8 и CO2R8A, где R8 и R8A, независимо, обозначают водород, метил, этил или фенил;
ii) -OR9 и OR9A, где R9 и R9A, независимо, обозначают водород, метил, этил, фенил или ацил;
iii) -SR27B, где R27B выбран из группы, включающей незамещенный низший алкил, 2-тиазолин и пиридил; и
iv) –NR10R11 и NR14R15, где R10, R11, R14 и R15, независимо, выбраны из группы, включающей водород, метил, этил, фенил, карбамоил и низший алкиламинокарбоснил.
e) R27 выбран из группы, включающей замещенный низший алкил, незамещенный низший алкил, замещенный фенил, незамещенный фенил, пиридил, пиримидинил, тиазол и тетразол;
f) R36 выбран из группы, включающей метоксиметил, этоксиметил и метоксиэтил;
g) m, n, t и u, каждый, равны 0 или 1; и
h) R12, R13, R18 и R19, независимо, выбраны из группы, включающей водород, метил, этил, фенил, пиридил, имидазол, тиазол, тетразол, -CO2R8, -OR8 и NR10R11, где R8, R9, R10 и R11, каждый, представляют водород, метил, этил или фенил.
3. Соединение по п. 2, где R3 обозначает водород или ацетил, Х обозначает гидроксиметил или низший алкоксикарбонил, Y обозначает гидрокси или ацетилокси, W1 и W2 обозначают водород.
4. Соединение по п. 3, где Х обозначает метоксикарбонил, Y обозначает гидрокси и R3 обозначает водород.
5. Соединение по п. 3, где один из R1 и R2 выбран из группы, включающей метоксикарбонилвинил, этоксикарбонилвинил, стирил, 2-пиридилвинил, 4-пиридилвинил, 2-пиридилэтил, 4-пиридилэтил, фенилэтил, метоксипропинил, гидроксипроспинил, -COCH2SEt, - C ≡ C CH2NMeBn, -CH=CHEt, -(CH2)2SMe, - (СН2)2S-2-тиазолин, -(СН2)3SMе, -CH=CHEt, -СН=СН-2-имидазол, (CH2)2ОС(=O)Н, метоксиметоксиметил, этоксиметоксиметил, метоксиэтоксиметил и 2-гидроксиэтил;
и другой из R1 и R2 выбран из группы, включающей водород, галоген, метоксикарбонилвинил, этоксикарбонилвинил, стирил, 2-пиридилвинил, 4-пиридилвинил, 2-пиридилэтил, 4-пиридилэтил, фенилэтил, нитро, амино, N-этилмочевина, метоксипропинил, гидроксипропинил, -COCH2SEt, - C ≡ C CH2NMeBn, -CH=CHEt, -(CH2)2SMe, -(СН2)2S-2-тиазолин, -(СН2)3SМе, -СН2OМе, -CH2OEt, -CH2SEt, пиридилтиометил, -СН2S-2-бензимидазол, -CH=CHEt, -СН=СН-2-имидазол, (СН2)2ОС(=O)Н, метоксиметоксиметил, этоксиметоксиметил, метоксиэтоксиметил и 2-гидроксиэтил.
6. Способ улучшения функционирования и/или повышения выживания клетки, ответственной за трофический фактор, включающий стадию контактирования указанной клетки с соединением, представленным общей формулой (I)
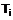 ,
,
где:
один из R1 и R2 выбран из группы, включающей:
a) -CO(CH2)jR4, где j равен от 1 до 6 и R4 выбран из группы, включающей:
1) галоген;
2) –NR5R6, где R5 и R6 независимо представляют водород, замещенный низший алкил, незамещенный низший алкил, замещенный арил, незамещенный арил, замещенный гетероарил, незамещенный гетероарил, замещенный аралкил, незамещенный аралкил, низший алкиламинокарбонил или низший алкоксикарбонил; или R5 и R6 объединены вместе с атомом азота с образованием гетероциклической группы;
3) N3;
4) –SR27, где R27 выбран из группы, включающей:
і) водород;
ii) замещенный низший алкил;
iii) незамещенный низший алкил;
iv) замещенный арил;
v) незамещенный арил;
vi) замещенный гетероарил;
vii) незамещенный гетероарил;
viii) замешенный аралкил;
ix) незамещенный аралкил;
х) тиазолинил;
xi) -(CH2)aCO2R28, где а равно 1 или 2 и R28 выбран из группы, включающей: водород и низший алкил;
и
xii) -(CH2)aCONR5R6; и
5) OR29 (где R29 представляет водород, замещенный низший алкил, незамещенный низший алкил или COR30 (где R30 представляет водород, низший алкил, замещенный арил, незамещенный арил, замещенный гетероарил или незамещенный гетероарил));
b) -СН(ОН)(СН2)bR4A, где b равно от 1 до 6 и R4A представляет водород или имеет те же значения, что R4;
c) - (CH2)dCHR31CO2R32, где d равно от 0 до 5, R31 представляет водород, -CONR5R6 или –CO2R33 (где R33 представляет водород или низший алкил) и R32 представляет водород или низший алкил;
d) -(CH2)dCHR31CONR5R6;
e) -(CH2)kR7, где k равно от 2 до 6 и R7 представляет галоген, СО2R8 (где R8 представляет водород, низший алкил, замещенный арил, незамещенный арил, замещенный гетероарил или незамещенный гетероарил), CONR5R6, замещенный арил, незамещенный арил, замещенный гетероарил, незамещенный гетероарил, OR9 (где R9 представляет водород, замещенный низший алкил, незамещенный низший алкил, ацил, замещенный арил или незамещенный арил), SR27B (где R27B имеет те же значения, что R27), NR10R11 (где R10 и R11 имеют те же значения, что и R5 и R6) или N3;
f) -CH=CH(CH2)mR12, где m равно от 0 до 4 и R12 представляет водород, низший алкил, CO2R8A (где R8A имеет те же значения, что и R8) , -CONR5R6, замешенный арил, незамешенный арил, замещенный гетероарил, незамещенный гетероарил, OR9A (где R9A имеет те же значения, что и R9) или NR10AR11A (где R10A и R11A имеют те же значения, что и R5 и R6);
g) -CH=C(CO2R33A)2, где R33A имеет те же значения, что и R33;
h) - C ≡ C (СН2)nR13, где n равно от 0 до 4 и R13 имеет те же значения, что и R12;
i) –CH2OR44, где R44 представляет замещенный низший алкил;
и другие R1 и R2 выбраны из группы, включающей:
j) водород, низший алкил, галоген, ацил, нитро, NR14R15 (где один из R14 или R15 представляет водород или низший алкил, а другой представляет водород, низший алкил, ацил, карбамоил, низший алкиламинокарбонил, замещенный ариламинокарбонил или незамещенный ариламинокарбонил);
k) –СH(SR34)2, где R34 представляет низший алкил или алкилен;
l) –CH2R35, где R35 представляет OR36 (где R36 представляет тринизший алкилсилил, в котором три низшие алкильные группы являются одинаковыми или различными, или имеет те же значения, что и R29) , или SR37 (где R37 имеет те же значения, что и R27);
m) -CO(CH2)qR16, где q равно от 1 до 6 и R16 имеет те же значения, что R4;
n) -CH(OH)(CH2)eR38, где е равно от 1 до 6 и R38 имеет те же значения, что R4A;
о) - (CH2)fCHR39CO2R40 , где f равно от 0 до 5 и R39 имеет те же значения, что R31 и R40 имеет те же значения, что R32;
р) -(CH2)rR17 где r равно от 2 до 6 и R17 имеет те же значения, что и R7;
q) –СН=НС(CН2)tR18, где t равно от 0 до 4 и R18 имеет те же значения, что и R12;
r) -CH=C(CO2R33B)2, где R33B имеет те же значения, что и R33;
s) - C ≡ C (CH2)uR19, где u равно от 0 до 4 и R19 имеет те же значения, что и R13;
R3 представляет водород, ацил или низший алкил;
Х выбран из группы, включающей:
a) водород;
b) формил;
c) низший алкоксикарбонил;
d) -CONR20R21, где:
R20 и R21, независимо, представляют:
водород;
низший алкил;
-СН2R22, где R22 представляет гидрокси, или –NR23R24 (где один из R23 или R24 представляет водород или низший алкил, а другой представляет водород, низший алкил или остаток ![]() -аминокислоты, в которой гидроксигруппа карбоксильной группы исключена, или R23 и R24 объединены с атомом азота с образованием гетероциклической группы); и
-аминокислоты, в которой гидроксигруппа карбоксильной группы исключена, или R23 и R24 объединены с атомом азота с образованием гетероциклической группы); и
е) -CH=N-R25, где R25 представляет гидрокси, низший алкокси, амино, гуанидино или имидазолиламино;
Y представляет гидрокси, низший алкокси, аралкилокси или ацилокси; или
объединенные Х и Y представляют -X-Y-, =O, -СН2О(С=O)O-, -CH2OC(=S)O-, -CH2NR26C(=O)- (где R26 представляет водород или низший алкил), -CH2NHC(=S)O-, -СН2OS(=O)O- или –СН2ОС(СН3)2O-;
и
W1 и W2 представляют водород, или W1 и W2 вместе представляют
кислород;
или с его фармацевтически приемлемой солью.
7. Способ по п. 6, где соединением является соединение по п. 2.
8. Способ по п. 6, где соединением является соединение по п. 5.
9. Способ по п. 6, где указанной клеткой, ответственной за трофический фактор, является клетка млекопитающего.
10. Способ по п. 6, где указанной клеткой, ответственной за трофический фактор, является нейрон.
11. Способ по п. 10 повышения выживания клеток, где указанным нейроном является холинергический нейрон.
12. Способ повышения выживания клетки при риске гибели включающий стадию контактирования указанной клетки с соединением, представленным общей формулой (I)
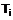 ,
,
где:
один из R1 и R2 выбран из группы, включающей:
а) -СО(СН2)jR4, где j равен от 1 до 6 и R4 выбран из группы, включающей:
1) галоген;
2) –NR5R6, где R5 и R6 независимо представляют водород, замещенный низший алкил, незамещенный низший алкил, замещенный арил, незамещенный арил, замещенный гетероарил, незамещенный гетероарил, замещенный аралкил, незамещенный аралкил, низший алкиламинокарбонил или низший алкоксикарбонил; или R5 и R6 объединены вместе с атомом азота с образованием гетероциклической группы;
3) N3;
4) -SR27, где R27 выбран из группы, включающей:
і) водород;
ii) замещенный низший алкил;
iii) незамещенный низший алкил;
iv) замещенный арил;
v) незамещенный арил;
vi) замещенный гетероарил;
vii) незамещенный гетероарил;
viii) замещенный аралкил;
ix) незамещенный аралкил;
х) тиазолинил;
xi) - (CH2)aCOR28, где а равно 1 или 2 и R28 выбран из группы, включающей: водород и низший алкил;
и
хіі) -(СH2)aCONR5R6; и
5) OR29 (где R29 представляет водород, замещенный низший алкил, незамещенный низший алкил или COR30 (где R30 представляет водород, низший алкил, замещенный арил, незамещенный арил, замещенный гетероарил или незамещенный гетероарил));
b) -СН(ОН)(СН2)bR4A, где b равно от 1 до 6 и R4a представляет водород или имеет те же значения, что R4;
c) -(CH2)dCHR31CO2R32, где d равно от 0 до 5, R31 представляет водород, -CONR5R6 или –CO2R33 (где R33 представляет водород или низший алкил) и R33 представляет водород или низший алкил;
d) -(CH2)dCHR31CONR5R6;
e) -(CH2)kR7, где k равно от 2 до 6 и R7 представляет галоген, CO2R8 (где R8 представляет водород, низший алкил, замещенный арил, незамещенный арил, замещенный гетероарил или незамещенный гетероарил), CONR5R6, замещенный арил, незамещенный арил, замещенный гетероарил, незамещенный гетероарил, OR9 (где R9 представляет водород, замещенный низший алкил, незамещенный низший алкил, ацил, замешенный арил или незамещенный арил), SR27B (где R27B имеет те же значения, что R27) , NR10R11 (где R10 и R11 имеют те же значения, что и R5 и R6) или N3;
f) -CH=CH(CH2)mR12, где m равно от 0 до 4 и R12 представляет водород, низший алкил, CO2R8A (где R8A имеет те же значения, что и R8), -CONR5R6, замещенный арил, незамещенный арил, замещенный гетероарил, незамещенный гетероарил, OR9A (где R9A имеет те же значения, что и R9) или NR10AR11A (где R9A имеет те же значения, что и R9) или NR10AR11A (где R10A и R11A имеют те же значения, что и R5 и R6);
g) -СН=С(CO2R33A)2, где R33A имеет те же значения, что и R33;
h) - C ≡ C (CH2)nR13, где n равно от 0 до 4 и R13 имеет те же значения, что и R12;
i) –CH2OR44, где R44 представляет замещенный низший алкил; и другие R1и R2 выбраны из группы, включающей:
j) водород, низший алкил, галоген, ацил, нитро, NR14R15 (где один из R14 или R15 представляет водород или низший алкил, а другой представляет водород, низший алкил, ацил, карбамоил, низший алкиламинокарбонил, замещенный ариламинокарбонил или незамещенный ариламинокарбонил);
k) –СН(SR34)2, где R34 представляет низший алкил или алкилен;
l) –CH2R35, где R35 представляет OR36 (где R36 представляет тринизший алкилсилил, в котором три низшие алкильные группы являются одинаковыми или различными, или имеет те же значения, что и R29), или SR37 (где R37 имеет те же значения, что и R27);
m) -CO(CH2)qR16, где q равно от 1 до 6 и R16 имеет те же значения, что и R4;
n) -СН(ОН)(СН2)еR38, где е равно от 1 до 6 и R38 имеет те же значения, что и R4A ;
о) -(CH2)fCHR39CO2R40, где f равно от 0 до 5 и R39 имеет те же значения, что R31 и R40 имеет те же значения, что и R32;
р) -(CH2)rR17 где r равно от 2 до 6 и R17 имеет те же значения, что и R7;
q) -CH=CH(CH2)tR18, где t равно от 0 до 4 и R18 имеет те же значения, что и R12;
r) -CH=C(CO2R33B)2, где R33B имеет те же значения, что и R33;
s) - C ≡ C (CH2)uR19, где u равно от 0 до 4 и R19 имеет те же значения, что и R13;
R3 представляет водород, ацил или низший алкил;
Х выбран из группы, включающей:
a) водород;
b) формил;
c) низший алкоксикарбонил;
d) CONR20R21, где:
R20 и R21, независимо, представляют:
водород;
низший алкил;
-CH2R22, где R22 представляет гидрокси, или –NR23R24 (где один из R23 или R24 представляет водород или низший алкил, а другой представляет водород, низший алкил или остаток ![]() -аминокислоты, в которой гидроксигруппа карбоксильной группы исключена, или R23 и R24 объединены с атомом азота с образованием гетероциклической группы); и
-аминокислоты, в которой гидроксигруппа карбоксильной группы исключена, или R23 и R24 объединены с атомом азота с образованием гетероциклической группы); и
е) –CH=N-R25, где R25 представляет гидрокси, низший алкокси, амино, гуанидино или имидазолиламино;
Y представляет гидрокси, низший алкокси, аралкилокси или ацилокси; или
объединенные Х и Y представляют -X-Y-, =O, -СН2О(С=O)O-, -CH2OC(=S)O-, -CH2NR26C(=O)- (где R26 представляет водород или низший алкил), -CH2NHC(=S)O-, -CH2OS(=O)О- или -СН2OС(СН3)2О-;
и
W1 и W2 представляют водород, или W1 и W2 вместе представляют
кислород;
или с его фармацевтически приемлемой солью.
13. Способ повышения выживания клетки при риске гибели по п. 12, включающий стадию контактирования указанной клетки с соединением по п. 2.
14. Способ повышения выживания клетки при риске гибели по п. 12, включающий стадию контактирования указанной клетки с соединением по п. 5.
15. Способ по п. 12, где указанная клетка находится в состоянии риска гибели, вызванном процессом, выбранном из группы, включающей: старение, травму и болезнь.
16. Способ по п. 15 , где указанной клеткой является нейрон.
17. Способ по п. 6 , где указанный метод используют при лечении болезни Хантингтона.
Текст
40 Данная заявка является частичным продолжением заявки серийный №08/657366, поданной 3 июня 1996. Настоящее изобретение относится к некоторым производным К-252а и их применению при лечении нейрологических заболеваний. К-252А является соединением, имеющим индолокарбазольную структуру, представленную следующей формулой [не прошедшая экспертизу опубликованная патентная заявка Японии №4148 9/85 (US №4555402)]. Сообщалось, что К-252а сильно ингибирует протеинкиназу С(РКС), которая играет центральную роль в регулировании деятельности клеток, и имеет различные виды активности, такие как действие по ингибированию сокращения гладких мышц (Jpn. J. Pharmacol. 43 (suppl.): 284, 1987), действие по ингибированию секреции серотонина (Biochem. Biophys. Res. Commun., 144: 35, 1987), действие по ингибированию элонгации нейраксона (J. Neuroscience, 8: 715, 1988), действие по ингибированию высвобождение гистамина (Allergy, 43: 100, 1988), действие по ингибированию гладкой мускулатуры MLCK (J. Biol. Chem., 263: 6215, 1988), противовоспалительное действие (Acta Ph ysiol. Hung., 80: 423, 1992), активность по выживанию клеток (J. Neurochemistry, 64: 1502, 1995) и т.д. В Experimental Cell Research, 193: 175-182, 1991 также было описано, что К-252а обладает активностью по ингибированию продуцирования ИЛ-2. Также был осуществлен полный синтез К-252а (J. Am. Chem. Soc, 117: 10413, 1995). С другой стороны, было описано, что К-252а обладает ингибирующей РКС активностью, активностью по ингибированию освобождения гистамина (не прошедшая экспертизу опубликованная патентная заявка Японии №295588/88), противоопухолевой активностью (не прошедшая экспертизу опубликованная патентная заявка Японии №168689/89 (US №4977776), WO 88/07045 (US 4923986) и т.д., действием по уменьшению образования бляшек в крови [WO 94/06799 (ЕР 630898А)], вазодепрессорной активностью (не прошедшая экспертизу опубликованная патентная заявка Японии №120388/87), действием по усилению функционирования холинергических нейронов. [WO 94/02488 (US 5461146)], целебным действием на рак простаты [WO 94/27982 (US 55166771)] и т.д. Настоящее изобретение относится к некоторым производным К-252а, представленным общей формулой: Структурные фрагменты описаны подробно далее. Описаны также предпочтительные способы получения этих соединений и способы их применения. I. Рисунки На фигурах 1 и 3 изображена структура замещенных производных К-252а. На фигуре 2 изображена структура К-252а. Фигура 4 представляет собой схему синтеза замещенного в кольце производного К-252а исходя из незамещенного в кольце исходного продукта. Фигура 5 представляет собой схему синтеза соединения, содержащего, по меньшей мере, один заместитель в кольце -CH=CH(CH2)mR12 или -CH=CH(CH2)tR13. Фигура 6 представляет собой схему синтеза соединения, содержащего, по меньшей мере, один заместитель в кольце –CH=CH(CH2)nR13 или -CH=CH(CH 2)uR19. Фигура 7 представляет собой схему синтеза соединения, содержащего, по меньшей мере, один заместитель в ' кольце -(CH2)kR7 или -(CH2)rR17. Фигура 8 представляет собой схему синтеза соединения, содержащего заместитель галоген или нитро в кольце. На фигуре 9 изображены структуры некоторых производных К-252а, которые используются в качестве исходных продуктов при получении соединений по изобретению. II. Некоторые замещенные в кольце производные К-252а Далее описаны некоторые замещенные в кольце производные К-252а, которые представлены следующей формулой: 41 где один из R1 и R2 выбран из группы, включающей: a) -CO(CH 2)jR4, где j равен от 1 до 6 и R4 выбран из группы, включающей: 1) водород и галоген; 2) –NR5R6, где R5 и R6 независимо представляют водород, замещенный низший алкил, незамещенный низший алкил, замещенный арил, незамещенный арил, замещенный гетероарил, незамещенный гетероарил, замещенный аралкил, незамещенный аралкил, низший алкиламинокарбонил или низший алкоксикарбонил; или R5 и R6 объединены вместе с атомом азота с образованием гетероциклической группы; 3) N 3; . 4) -SR27, где R27 выбран из группы, включающей: і) водород; ii) замещенный низший алкил; iii) незамещенный низший алкил; iv) замещенный арил; v) незамещенный арил; vi) замещенный гетероарил; vii) незамещенный гетероарил; viii) замещенный аралкил; ix) незамещенный аралкил; х) тиазолинил; xi) -(CH2)aCO 2R28 , где а равно 1 или 2 и R28 выбран из группы, включающей: водород и низший алкил; и xii) -(CH2)aCONR5R6; и 5) OR 29 (где R29 представляет водород, замещенный низший алкил, незамещенный низший алкил или COR30 (где R30 представляет водород, низший алкил, замещенный арил, незамещенный арил, "замещенный гетероарил или незамещенный гетероарил)); b) -СН(ОН) (CH2)bR4A, где b равно от 1 до б и R4A представляет водород или имеет те же значения, что R4; c) -(CH2)dCHR31CO2R32, где d равно от 0 до 5 и R31 представляет водород, -CONR5R6 или -CO2R33 (где R33 представляет водород или низший алкил) и R32 представляет водород или низший алкил; d) - (СН2)dCHR31CONR5R6; e) -(CH2)kR7, где к равно от 2 до б и R 7 представляет галоген, CO2R (где R представляет водород, низший алкил, замещенный арил, незамещенный арил, замещенный гетероарил или незамещенный гетероарил), CONR5R6, замещенный арил, незамещенный арил, замещенный гетероарил, незамещенный гетероарил, OR9 (где R9 представляет водород, замещенный низший алкил, незамещенный низший алкил, ацил, замещенный арил или незамещенный арил), SR278 (где R278 имеет те же значения, что R27), NR10R11 (где R10 и R11 имеют те же значения, что и R5 и R6) или N3; f) -CH=CH(CH2)mR12, где m равно от 0 до 4 и R12 представляет водород, низший алкил, CO2R8A (где R8A имеет те же значения, что и R8), -CONR5R6/ замещенный арил, незамещенный арил, замещенный гетероарил, незамещенный гетероарил, 0R9A (где R9A имеет те же значения, что и R9) или NR10AR11A (где R9A имеет те же значения, что и R9) или NR10AR11A (где R 10A и R11A имеют те же значения, что и R5 и R6); g) -CH=C(CO2R33A)2, где R33A имеет те же значения, что и R33; h) -C=C(CH 2)nR13, где п равно от 0 до 4 и R13 имеет те же значения, что и R12 ; і) -CH2OR44, где R44 представляет замещенный низший алкил; и другие R 1и R2 выбраны из группы, включающей: j) водород, низший алкил, галоген, ацил, нитро, NR14R15 (где R14 или R15 представляет водород или низший алкил, а другой представляет водород, низший алкил, ацил, карбамоил, низший алкиламинокарбонил, замещенный ариламинокарбонил или незамещенный ариламинокарбонил); k) -CH(SR34)2, где R34 представляет низший алкил или алкилен; 1) -CH2R35, где R 35 представляет OR36 (где R 36 представляет три-низший алкилсилил, в котором три низшие алкильные группы являются одинаковыми или различными, или имеет те же значения, что и R29), или SR37 (где R37 имеет те же значения, что и R27); m) -CO(CH 2)qR16, где q равно от 1 до 6 и R16 имеет те же значения, что R4; n) -СН(ОН) (CH2)eR38/ где е равно от 1 до 6 и R38 имеет те же значения, что R4A; о) -(CH2)fCHR39CO2R40 , где f равно от 0 до 5 и R 33 имеет те же значения, что R31 и R40 имеет те же значения, что R32; р) -(CH2)rR17 где r равно от 2 до 6 и R17 имеет те же значения, что и R7; q) -CH=CH(CH2)tR18, где t равно от 0 до 4 и R18 имеет те же значения, что и R12 ; r) -CH=C(CO2R33B)2 , где R33B имеет те же значения, что и R33; 42 s) -C=C(CH 2)uR19, где и равно от 0 до 4 и R19 имеет те же значения, что и R13; R3 представляет водород, ацил или низший алкил; X выбран из группы, включающей: а) водород; b) формил; с) низший алкоксикарбонил; d) -CONR20R21, где: R20 и R21, независимо представляет: водород; низший алкил; -CH2R22, где R22 представляет гидрокси, или -NR23R24 (где R23 или R24 представляет водород или низший алкил, или остаток a-аминокислоты, в которой отсутствует гидроксигруппа карбоксильной группы, или R23 и R24 объединены вместе с образованием атомом азота с образованием гетероциклической группы); и е) -CH=N-R 25, где R25 представляет гидрокси, низший алкокси, амино, гуанидино или имидазолиламино; Y представляет гидрокси, низший алкокси, аралкилокси или ацилокси; или объединенные X и Y представляют -X-Y-, =O, -СН2О(С=O)O0-, -CH2OC(=S)O-, -CH 2NR26C(=O)- (где R26 представляет водород или низший алкил), -CH2NHC (=S)O-, CH2OS(=O)O- или -СН2ОС(СНз)2О-; и W1 и W 2 представляют водород или W1 и W2 зместе представляют кислород; или их фармацевтически приемлемые соли. Соединения, представленные формулой (I), указываются здесь как соединение (I), и то же относится к соединениям с другими номерами. При определении значений групп в формуле (I) низший алкил обозначает линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, неопентил, 1-этоксипропил и гексил. Низший алкильный радикал в низшем алкокси, низшем алкокси карбониле, низшем алкиламинокарбониле и три-низшем алкилсилиле имеет те же значения, что и низший алкил, указанный выше. Ацильная часть в ацильных и ацилокси группах обозначает линейную или разветвленную алканоильную группу, содержащую от 1 до 6 атомов углерода, такую как формил, ацетил, пропаноил, бутирил, валерил, пивалоил и гексаноил, арилкарбонильная группа описана далее, и гетероарилкарбонильная группа описана далее. Арильная часть в арильных и арилкарбонильных и ариламинокарбонильных гр уппах обозначает гр уппу, содержащую от 6 до 12 атомов углерода, такую как фенил, бифенил и нафтил. Гетероарильная часть в гетероарильных и гетероарилкарбонильных группах содержит по меньшей мере один гетероатом, выбранный из О, S и N, и включает пиридил, пиримидил, пирролил, фурил, тиенил, имидазолил, триазолил, тетразолил, хинолил, изохинолил, бензимидазолил, триазолил и бензтиазолил. Аралкильная часть в аралкильных и аралкилокси группах обозначает аралкильную группу, содержащую от 7 до 15 атомов углерода, такую как бензил, фенетил, бензгидрил и нафтилметил. Замещенная низшая алкильная группа содержит от 1 до 3 независимо выбранных заместителей, такие как гидрокси, низший aлкокси, карбоксил, низший алкоксикарбонил, нитро, амино, моно- или динизший алкиламино, диоксолан, диоксан, дитиолан и дитион. Низшая алкильная часть в замещенном низшем алкиле и низшая алкильная часть в низшем алкокси, низшем алкоксикарбониле и моноили динизшем алкиламико в заместителях замещенной низшей алкильной группе имеет те же значения, что и низший алкил, указанный выше. Замещенные арильные, замещенные гетероарильные и замещенные аралкильные группы, каждая, имеет от 1 до 3 независимо выбранных заместителей, такие как низший алкил, гидрокси, низший алкокси, карбокси, низший алкоксикарбонил, нитро, амино, моно- или динизший алкиламино и галоген. Из заместителей низшая алкильная часть в низших алкильных, низших алкокси, низших алкоксикарбонильных и моно- или динизших алкиламино группах имеет те же значения, что и низший алкил, указанный выше. Гетероциклическая группа, образованная с атомом азота, включает пирролидинил, пиперидинил, пиперидино, морфолинил, морфолино, тиоморфолино, N-метилпиперазинил, индолил и изоиндолил. ос-Аминогруппы включают глицин, аланин, пролин, глутамин, аланин, пролин, глутаминовая кислота и лизин, которые могут быть в L-форме, D-форме или в виде рацемата. Галогены включают фтор, хлор, бром и иод. Предпочтительно, один из R1 и R2 выбран из группы, включающей -(CH2)kR7, -СН=СН (CH2)mR12, CH=CH(CH2)nR13, -СО(СН 2)jSR27 . и -CH 2R44, где R44 обозначает метоксиметил, этоксиметил или метоксиэтил; и другой из R1 и R2 выбран из группы, включающей -(CH2)rR17, -СН=СН(СН 2)tR18, -CH=CH (CH2)uR19, NR14R15, водород, галоген, нитро, -СН2О- (замещенный или незамещенный) низший алкил, -СО (CH 2)q SR27, -CH2R35, CH2OH и -CH 2SR37, где R37 выбран из группы, включающей низший алкил, пиридил и бензимидазол. Предпочтительно, R35 обозначает OR36, где R36, предпочтительно, выбран из группы, включающей метоксиметил, этоксиэтил и метоксиэтил. Предпочтительно, R37 выбран из группы, включающей замещенный или незамещенный низший алкил, замещенный или незамещенный фенил, пиридил, пиримидинил, тиазол и тетразол. Предпочтительно, k и r, независимо, каждый, равны 2, 3 и 4. Предпочтительно, і и q, независимо, каждый, равны 1 или 2. Предпочтительно, R7 и R17, независимо, каждый выбраны из группы, включающей (1) CO2R8 и CO2R8A, где 8 R и R8A, независимо, обозначают водород, метил, этил или фенил; (2) фенил, пиридил, имидазолил, тиазолил или тетразолил; (3) OR9 и 0R9A, где R9 и R9A, независимо, обозначают водород, метил, этил, фенил или ацил; (4) SR27B, где R27B выбран из группы, включающей незамещенный низший алкил, 2-тиазолин и пиридил; и (5) NR 10R11 и NR14R15 , где R 10, R11 , R14 и R15, независимо, выбраны из группы, включающей водород, метил, этил, фенил, карбамоил и низший алкиламинокарбонил. Предпочтительно, m, n, t и u, независимо, равны 0 или 1. Предпочтительно, R12, R13, R18 и R19, независимо, выбраны из группы, включающей водород, метил, этил, 43 фенил, пиридил, имидазол, тиазол, тетразол, CO2R8, OR8 и NR10R11, где R8, R9 , R10 и R11 имеют значения, указанные выше. Предпочтительно, R3 обозначает водород или ацетил, наиболее предпочтительно, водород. Предпочтительно, X обозначает гидроксиметил или низший алкоксикарбонил, при этом метоксикарбонил особенно предпочтителен. Предпочтительно, Y обозначает гидрокси или ацетилокси, особенно предпочтителен гидрокси. Предпочтительно, каждый из W1 и W2 обозначает водород. Более предпочтительными являются значения заместителей, показанные в таблице 1, при этом соединения 1-157 особенно предпочтительны. III Применение Некоторые замещенные в кольце производные К-252а обладают доказанной ценной фармакологической активностью, которая находит различное применение, включая как разработку, так и терапевтическое использование. Обычно, активность соединений показывает положительное действие на функционирование и/или продолжительность жизни клеток, ответственных за тро фический фактор. Действие на функционирование и/или продолжительность жизни клеток, ответственных за трофический фактор, например, клеток нейронального происхождения, может быть определено с помощью следующи х исследований: (1) анализ холинацетилтрансферазы на культуре спинного мозга ("СhАТ"); или (2) анализ активности СhАТ на культуре Оазальных нейронов переднего мозга ("BFN"). Как здесь используется, термин "действие", используемый здесь как вариант терминов "функционирование" и "выживание", означает положительное или отрицательное изменение или перемену. Действие, которое является положительным, может быть указано здесь как "улучшение" или "улучшающий", и действие, которое является отрицательным, может быть указано здесь как "ингибирование" или "ингибирующий". Как указано здесь, термин "улучшение" или "улучшающий", используемый здесь как вариант терминов "действие" и "продолжительность жизни", означает, что присутствие замещенного производного К-252а имеет положительное действие на функционирование и/или выживание клеток, ответственных за трофический фактор по сравнению с отсутствием производного. Например, а не в целях ограничения каким-либо образом, относительно выживания, например, холинергического нейрона, указанное производное с очевидностью улучшает выживаемость холинергической нейрональной популяции при риске гибели (вызванном, например, повреждением, болезненным состоянием, дегенеративным состоянием-природной прогрессии), по сравнению с холинергической нейрональной популяцией, где не присутствует такое производное, если обработанная популяция имеет сравнительно больший период функционирования по сравнению с необработанной популяцией. Как здесь используется, "ингибирование" и "ингибирующий" означает, что специфическая реакция целевого материала (например, ферментативная активность) относительно снижается в присутствии замещенного производного К-252а. Как здесь используется, термин "нейрон", "клетки нейронального происхождения" и "нейрональные клетки" включают, но не ограничиваются ими, гетерогенную популяцию нейрональных типов, имеющих сингулярную или множественную передачу и/или сингулярное или множественное действие; предпочтительно, они представляют холинергические и сенсорные нейроны. Как здесь используется, фраза "холинергический нейрон" означает нейроны центральной нервной системы (ЦНС) и периферической нервной системы (ПНС), нейротрансмиттером которой является ацетилхолин; примерами являются базальные нейроны переднего мозга, стриарные и спинномозговые нейроны. Как здесь используется, фраза* "сенсорный нейрон" включает нейроны, ответственные за реакцию в ответ на внешнюю среду (например, температура, движение), например, кожи, мускул и связок, примером является нейрон от ганглий дорсального корня. "Клетками, ответственными за трофический фактор", как здесь указано, являются клетки, которые включают рецептор, который может специфически связывать трофический 'фактор; примеры включают нейроны (например, холинергические и сенсорные нейроны) и не-нейрональный клетки (например, моноциты и неопластические клетки). Описанные замещенные в ароматическом кольце производные К-252а могут быть использованы для улучшения функционирования и/или выживания клеток нейронального происхождения. Они могут также быть использованы для улучшения функционирования и/или выживания клеток нейронального происхождения у млекопитающих, например, у человека. В этом контексте производные могут быть использованы индивидуально или вместе с другими производными, или в сочетании с другими подходящими молекулами, которые также с очевидностью улучшают функционирование и/или выживание указанных клеток. Множество неврологических расстройств связаны с нейрональными клетками, которые являются умирающими, поврежденными, функционально задействованными, подвергающимися аксональному разрушению при риске умирания и т.д. Эти заболевания включают, но не ограничиваются ими: болезнь Альцгеймера; моторные нейрональные заболевания (например, амиотрофический боковой склероз); болезнь Паркинсона; цереброваскулярные заболевания (например, удар, ишемия); Болезнь Хантингтона; связанную со СПИДом деменцию; эпилепсию; рассеянный склероз; периферические нейропатии (например, которые воздействуют на DRG нейроны при ассоциированной с химиотерапией периферической нейропатии), включая диабетическую нейропатию; заболевания, вызванные возбуждающими аминокислотами; заболевания, вызванные сотрясением или проникающим поражением головного или спинного мозга. ChAT катализирует синтез нейротрансмиттерного ацетилхолина и рассматривается как ферментный маркер для функционального холинергического нейрона. Функциональный нейрон также способен к выживанию. Выживание нейронов анализируют количественно по специфическому поглощению и ферментативной конверсии красителя (например, кальцеин AM) живыми нейронами. 44 Ввиду и х различных применений производные К-252а описаны здесь как находящие применение в различных областях. Соединения могут использоваться при разработке in vitro моделей выживания нейрональных клеток, функционирования, идентификации или для скрининга других синтетических соединений, которые обладают активностью, подобной производным К-252а. Соединения могут использоваться при разработке среды для исследования, установления и определения молекулярных мишеней, ассоциированным с функциональной реакцией. Например, путем радиоактивного мечения производного К-252а, ассоциированного со специфической клеточной функцией (например, митогенез), мишень, с которой производные связываются, может быть идентифицирована, выделена и очищена для того, чтобы ее охарактеризовать. Фармацевтически приемлемые соли соединений формулы (I) включают фармацевтически приемлемые соли присоединения кислот, соли металлов, соли аммония, соли присоединения органических аминов и соли присоединения аминокислот. Примерами солей присоединения кислот являются неорганические соли присоединения кислот, такие как гидрохлорид, сульфат и фосфат, и органические соли присоединения кислот, такие как ацетат, малеат, фумарат, тартрат, цитрат и лактат; примерами солей металлов являются соли щелочных металлов, такие как соль лития, соль натрия и соль калия, соли щелочноземельных металлов, такие как соль магния и соль кальция, соль аммония и соль цинка; примерами аммонийных солей являются соль аммония и соль тетрабутиламмония; примеры солей присоединения органического амина являются соли с морфолином и пиперидином; и примерами солей присоединения аминокислот являются соли с глицином, фенилаланином, глутаминовой кислоты и лизина. Предложенные здесь соединения могут быть включены в состав фармацевтических композиций путем смешивания с фармацевтически приемлемыми нетоксичными эксципиентами и носителями. Такие композиции могут быть приготовлены для парентерального введения, в частности, в виде жидких растворов или суспензий; или для перорального введения, в частности, в виде таблеток или капсул; или интраназально, в частности, в виде порошков, назальных капель или аэрозолей; или дермально, посредством, например, кожных пластырей. Соединения могут быть удобно введены в виде стандартных лекарственных форм и могут быть приготовлены любым из методов, хорошо известными в фармацевтической области, например, как описано в Remington’s Pharmaceutical Science (Mack Pub.Co., Easton, PA, 1980). Составы для парентерального введения могут содержать в качестве общеизвестных эксципиентов стерильную воду или физиологический раствор, полиэтиленгликоли, такие как полиэтиленгликоль, масла и растительный продукт, гидрированные нафталины и тому подобное. В частности, биосовместимые, биоразлагающиеся лактидные полимеры, сополимеры лактида/гликолида или сополимеры полиоксиэтилена-полиоксипропилена могут быть использованы как эксципиенты для контролирования высвобождения активных соединений. Другие возможные используемые парентеральные системы высвобождения этих активных соединений включают частицы сополимера этиленавинилацетата, осмотические насосы, имплантируемые инфузионные системы и липосомы. Составы для ингаляционного введения содержат в качестве эксципиентов, например, лактозу., или могут быть водными растворами,- содержащими, например, эфир полиоксиэтилен-9-лаурила, гликохолат и деоксихолат, или масляные растворы для введения в виде назальных капель, или в качестве геля для интраказального применения. Составы для парентерального введения могут также включать гликохолат для буквального введения, салицилат для ректального введения, или лимонная кислота для вагинального введения. Составы для трансдермальных пластырей являются предпочтительными липофильными эмульсиями. Соединения по этому изобретению могут применяться в виде отдельного активного агента в фармацевтических композициях. Альтернативно, они могут быть использованы в сочетании с другими активными ингредиентами, например, другие факторы роста, которые облегчают нейрональную продолжительность жизни или регенерацию при заболеваниях или поражениях. Соединение (I) и его фармацевтически приемлемые соли могут быть введены перорально или неперорально, например, в виде мази или инъекции. Концентрации соединений по данному изобретению в терапевтической композиции может варьироваться. Концентрация будет зависеть от факторов, таких как общая доза лекарственного средства, которое должно быть введено, химические характеристики (например, гидрофобность) используемых соединений, путь введения, возраст, масса тела и симптомы пациента и т.д. Соединения по данному изобретению обычно представлены в растворе водного физиологического буфера, содержащего от около 0,1 до 10% мас/об, соединения для парентерального введения. Типичные дозы колеблются от около 1мкг/кг до 1г/кг массы тела в день, предпочтительная доза колеблется от около 0,01мкг/кг до 100мг/кг массы тела в день, и предпочтительно от около 0,1 до 20мг/кг от одного до четырех раз в день. Предпочтительная доза лекарства, которая должна быть назначена, вероятно зависит от таких параметров, как вид и длительность развития заболевания или поражения, общего состояния здоровья пациента, относительной биологической активности выбранного соединения и состава эксципиента соединения и их путь введения. Соединения (I) и его фармацевтически приемлемые соли могут быть введены как таковые, или в виде различных фармацевтических композиций, в соответствии с фармакологической активностью и исходя из целей введения. Фармацевтические композиции в соответствии с настоящим изобретением могут быть получены путем однородного смешивания эффективного количества соединения (I) или его фармацевтически приемлемой соли, в качестве активного компонента, с фармацевтически приемлемым носителем. Носитель может быть взят из широкого спектра форм для создания композиций, подходящих для введения. Желательно, чтобы фармацевтические композиции готовились в виде стандартной лекарственной формы, приемлемой для перорального или неперорального введения. Формы для не-перорального введения включают мазь и инъекцию. Таблетки могут быть получены обычными методами с использованием эксципиентов, таких как лактоза, глюкоза, маннитол и метилцеллюлоза, разрыхляющих агентов, таких как крахмал, альгинат натрия, кальций карбоксиметилцеллюлоза и кристаллическая целлюлоза, смазывающие агенты, такие как стеарат магния и 45 тальк, связующие, такие как желатин, поливинилпирролидон, гидроксипропилцеллюлоза и метилцеллюлоза, поверхностно-активные средства, такие как сложный эфир жирной кислоты и сахарозы и сложный эфир жирной кислоты и сорбита и тому подобное. Предпочтительно, чтобы каждая таблетка содержала 15-300мг активного ингредиента. Гранулы могут быть получены обычными методами с использованием эксципиентов, таких как лактоза и сахароза, разрыхляющих агентов, таких как крахмал, связующие, такие как желатин и тому подобное. Порошки могут быть получены обычными методами с использованием эксципиентов, таких как лактоза и маннитол и тому подобное. Капсулы могут быть получены обычными методами с использованием желатина, воды, сахароза, гуммиарабик, сорбит, глицерин, кристаллическая целлюлоза, стеарат магния, тальк и тому подобное. Предпочтительно, чтобы каждая капсула содержала 15-300мг активного ингредиента. Составы из сиропа могут быть получены обычными методами с использованием Сахаров, таких как сахароза, вода, этанол и тому подобное. Мазь могут быть получена обычными методами с использованием мазевых основ, таких как вазелин, жидкий парафин, ланолин и макрогол, эмульгаторов, таких как нитрий лауриллактат, бензалконий хлорид, сложный эфир моно жирной кислоты и сорбита, натрий карбоксиметилцеллюлоза и гуммиарабик и тому подобное. Инъекционные составы могут быть получены обычными методами с использованием растворителей, таких как вода, физиологический раствор, растительные масла (например, оливковое масло и арахисовое масло), этилолеат и пропиленгликоль, солюбилизирующие агенты, такие как бекзоат натрия, салицилат и уретан натрия, изотонические агенты, такие как хлорид натрия и глюкоза, консерванты, такие как фенол, крезол, эфир п-гидроксибензойной кислоты и хлорбутанола, антиоксиданты, такие как аскорбиновая кислота и пиросульфат натрия и тому подобное. ІV Общее описание синтетических способов Способы получения соединения (I) описаны далее. Me, Et, Ph, Ac, Bn, Вос и трет-Bu структурных формула х и таблицах представляют метил, этил, фенил, ацетил, бензил, трет-бутоксикарбонил и трет-бутил, соответственно. Соединения по настоящему изобретению могут быть обычно получены из оптически активного К-252а в качестве исходного соединения, но все возможные стереоизомеры и их смеси также входят в объем настоящего изобретения. В способах, показанных ниже, если определенные группы преобразуют в усло виях способов или они не подходят для осуществления способов, желаемые соединения могут быть получены путем использования значений для введения защитных групп обычно используемых в органической синтетической химии [Смотри, например, T.W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons Inc. (1981)]. Могут быть проведены окисление, восстановление, присоединение, элиминирование, конденсация или гидролиз, которые обычно используются в органической синтетической химии, и, если необходимо, может быть изменена последовательность реакционных стадий для введения заместителей и тому подобное. Далее, преобразование функциональных гр упп может проводиться более одного раза. Способ 1 Соединение (1-1), то есть, соединение (I), где по крайней мере один из R1 и R2 обозначает -CO(CH2)jR4 (где j и R4 имеют те же значения, что указаны выше), могут быть получены в соответствии со следующими стадиями реакции. [В формулах R 3, W1 , W 2, X и Y имеют те же значения, что указаны выше; и по меньшей мере один из R1a и R2a представляет CO(CH2)jR4 (где j и R4 Y имеют те же значения, что указаны выше).] Стадия 1-1 Соединение (І-la), то есть, соединение (1-1), где R4 обозначает галоген, может быть получено, когда соединение (II), которое является известным соединением, описанным далее, подвергают реакции ФриделяКрафтца с соединением (III), представленным формулой (III): R4a-(CH2)jCO-Hal (III) (где j имеет те же значения, что указаны выше; R4a обозначает галоген, как указано выше; и Hal обозначает хлор или бром) или акрилоилхлоридом в растворителе, таком как метиленхлорид и хлороформ в присутствии кислоты Льюиса, такой как хлорид алюминия. Соединение (III) и кислота Льюиса используются, соответственно, в количестве от 1 до 20 эквивалентов относительно соединения (II). Реакцию обычно проводят при от 0 до 80°С в течение от 1 до 24 часов. Исходное соединение (II) может быть получено согласно способам, описанным в не прошедших экспертизу опубликованных патентных заявках Японии №№295588/88, 295589/88 и 807045/88. Стадия 1-2 Соединение (I-lb), то есть, соединение (1-1), где R4 обозначает NR5R6 (где R5 и R6 имеет те же значения, что указаны выше), N3, OR29 (где R29 имеет те же значения, что указаны выше) или SR27 (где R27 имеет те же значения, что указаны выше), может быть получено, когда соединение (1-1а) подвергают взаимодействию с 46 солью металла соединения (IVa), представленным формулой (IVa): HNR5R6 (IVa) (где R5 и R6 имеют те же значения, что указаны выше), азидом натрия, соединением (IVb), представленным формулой (IVb): R29OH (IVb) (где R29 имеет те же значения, что указаны выше), или соединением (IVc), представленным формулой (IVc): R27SH (IVc) (где R27 имеет те же значения, что указаны выше) в растворителе, таком как метиленхлорид, хлороформ, диметилсульфоксид или Ы,Ы-диметилформамид, или взаимодействию с соединением (IVa), (IVb) или (IVc) в присутствии карбоната калия и триэтиламина. Соединение (IVa), соединение (IVb), соединение (IVc) или их металлическая соль используются в количестве от 1 эквивалента до избыточного количества относительно соединения (І-la), предпочтительно от 1 до 20 эквивалентов относительно соединения (І-la). Основание используют в количестве от 1 до 20 эквивалентов. Реакцию обычно проводят при от 0 до 100°С в течение от 1 до 24 часов. Способ 2 Соединение (1-2), то есть, соединение (I), где по крайней мере один из R1 и R2 обозначает -СН=СН (CH2)mR12 (где m и R12 имеют те же значения, что указаны выше) или -CH=C(CO2R33A)2 (где R33A имеет те же значения, что указаны выше), может быть получено в соответствии со следующими стадиями реакции: [В формулах R3 , W 1, W 2, X и Y имеют те же значения, что указаны выше; по меньшей мере один из R B1 и RB2 представляет формил, гидроксиметил, галоген или -C=C(CH 2)mR12 (где m и R12 имеют те же значения, что указаны выше) или -С=С(CO2R33A)2 (где R33А имеет те же значения, что указаны выше).] Сдадия 2-1 Соединение (1-2) может быть получено, когда соединение (Va), где по крайней мере один из RB1 и RB2 обозначает формил, подвергают взаимодействию с соединением (VІa), представленным формулой (VІa): (Ph)3P=CH(CH2)mR12 (Via) (где m и R12 имеют те же значения, что указаны выше; и Ph обозначает фенил) в растворителе, таком как метиленхлорид и хлороформ. Альтернативно, соединение (1-2) может быть получено, когда соединение (Va) подвергают взаимодействию с соединением (VIb), представленным формулой (VIb): (Ph)3P+CH2(CH2)mR12Hal (VIb) (где m, R12, Ph и Hal имеют те же значения, что указаны выше) в растворителе, таком как метиленхлорид и хлороформ, в присутствии основания, такого как карбонат калия и бутиллитий. Когда используют основание, которое имеет слабую растворимость в растворителе, например, карбонат калия, реакцию предпочтительно проводят в присутствии катализатора межфазного переноса, такого как 18-краун-6. Соединение (VIa), соединение (VIb) и основание используются, соответственно, в количестве от 1 до 20 эквивалентов относительно соединения (V) , и катализатор межфазного переноса используют в количестве от 0,01 до 1 эквивалентов относительно соединения (Va). Реакцию обычно проводят при от -10 до 100°С в течение от 1 до 100 часов. Соединение (Va) может быть получено согласно способам, описанным в не прошедшей экспертизу опубликованной патентной заявке Японии №295588/88. Стадия 2-2 Соединение (1-2) может быть получено, когда соединение (Vb) , где по крайней мере один из RB1 и RB2 обозначает гидроксиметил и гидробромид трифенилфосфина, подвергают взаимодействию с соединением (VIc), представленным формулой (VIc): R12(CH2)mCHO (VIc) (где m и R12 имеют те же значения, что указаны выше) в растворителе, таком как метиленхлорид и хлороформ в присутствии основания, такого как карбонат калия и бутиллитий. Соединение (Vb.) может быть получено согласно способам, описанным в не прошедшей экспертизу опубликованной патентной заявке Японии №295588/88, WO94/02488 и т.д. Когда используют основание, которое имеет слабую растворимость в растворителе, например, карбонат калия, реакцию предпочтительно проводят в присутствии катализатора межфазного переноса, такого как 18-краун-6. Как соединение (VIc), так и основание используются в количестве от 1 до 20 эквивалентов относительно фосфониевой соли (VIb), и катализатор межфазного переноса используют в количестве от 0,01 до 1 эквивалентов относительно соединения (Vb). Реакцию обычно проводят при от -10 до 100°С в течение от 1 до 100 часов. Стадия 2-3 Соединение (1-2) может быть получено, когда соединение (Vc), где по крайней мере один из RB1 и RB2 обозначает галоген, подвергают реакции Хека (Heck) с соединением (VId), представленным формулой (VId): 47 H2C=CH(CH2)mR12 (VIb) (где m и R12 имеют те же значения, что указаны выше) в растворителе, таком как N,N-диметилформамид, в присутствии соединения палладия, такого как" ацетат палладия (II) и хлорид бистрифенилфосфинпалладия (II), производного фосфора, такого как трифенилфосфин и трис(2-метилфенил)фосфин, и основания, такого как триэтиламин. Основываясь на соединение (Vc), соединение (Vld) используется в количестве от 1 до 40 эквивалентов, палладиевое соединение и фосфорное соединение используется в количестве от 0,1 до 5 эквивалентов относительно соединения (Vc) и основание используется в количестве от 1 до 500 эквивалентов. Когда используемое соединение палладия содержит соединение фосфора в качестве лиганда, как в случае хлорида бистрифенилфосфинпалладия (II), иногда нет необходимости прибавлять соединение фосфора. Реакцию обычно проводят при от 0 до 100°С в течение от 1 до 10 часов. Стадия 2-4 Соединение (1-2) может быть получено, когда соединение (1-3), синтезированное в соответствии со стадией 3, описанной далее для каталитической реакции в растворителе, таком как N,N-диметилформаммд в токе водорода в присутствии катализатора восстановления, такого как палладий/углерод. Катализатор восстановления используют в количестве от 10 до 100% по массе относительно соединения (1-3). Реакцию обычно проводят при от 0 до 100°С в течение от 1 до 72 часов. Стадия 2-5 Соединение (1-2) может быть получено, когда соединение (Va) подвергают взаимодействию с соединением, представленным формулой (VIe): CH2(CO2R33A) (VIe) (где R33A имеет те же значения, что указаны выше) в растворителе, таком как метиленхлорид, в присутствии основания, такого как пиперидин. Соединение (VIe) используется в количестве от 1 до 40 эквивалентов относительно соединения (Va) и основание используется в количестве от 0,1 эквивалентов относительно соединения (Va) до эквивалентного количества растворителя. Реакцию обычно проводят при от 20 до 100°С в течение от 1 до 24 часов. Способ 2 Соединение (1-3), то есть, соединение (I), где по крайней мере один из R1 и R2 обозначает -СНºСН (CH2)nR13 (где n и R1 имеют те же значения, что указаны выше) может быть получено в соответствии со следующими стадиями реакции: [В формулах R3 , W x, W2, X и Y имеют те же значения, что указаны выше; по меньшей мере один из RC1 и RC2 представляет йод; и, по крайней мере, один из R C1 и RC2 представляет -CHºCH (CH2)nR13 (где n и R13 имеют те же значения, что указаны вьше).] Способ 3 Соединение (1-3) может быть получено, когда соединение (VII) подвергают реакции Соногазира (Sonogasira) с соединением (VIII), представленным формулой (VIII): НСºC(СН2)nR13 (VIII) (где n и R13 имеют те же значения, что указаны выше) в растворителе, таком как метиленхлорид и хлороформ, в присутствии соединения меди, такого как йодид меди, соединения палладия, такого как такого как ацетат палладия (II) и хлорид бистрифенилфосфинпалладия (II), производного фосфора, такого как трифенилфосфин, и основания, такого как диэтиламин и триэтиламин. Соединение (VIII) используется в количестве от 1 до 40 эквивалентов относительно соединения (VII), соединение меди, соединение палладия и фосфорное соединение используются, соответственно, в количестве от 0,1 до 5 эквивалентов, и основание используется в количестве от 1 до 500 эквивалентов. Когда соединение палладия содержит соединение фосфора в качестве лиганда, как в случае хлорида бистрифенилфосфинпалладия (II), нет необходимости прибавлять соединение фосфора. Реакцию обычно проводят при от 0 до 100°С в течение от 1 до 10 часов. Соединение (VII) может быть получено, когда соединение (II) подвергают взаимодействию с йодом в растворителе, таком как смесь метиленхлорид/метанол (4/1), в присутствии соединения ртути, такого как нитрат ртути и хлорид ртути. Соединение ртути и йод, используются, соответственно, в количестве от 1 до 3 эквивалентов относительно соединения (II). Реакцию обычно проводят при от 0 до 50°С в течение от 1 до 24 часов. Способ 4 Соединение (1-4), то есть, соединение (I), где по крайней мере один из R1 и R2 обозначает -(CH2)kR7 (где k 7 и R имеют те же значения, что указаны выше) или –СН2СН(СО2RЗЗА)2 (где R33A имеют те же значения, что указаны выше) может быть получено в соответствии со следующими стадиями реакции: 48 [В формулах R1b , R2b, R1c, R2c, R3, W 1, W2 , X и Y имеют те же значения, что указаны выше; по меньшей мере один из R1d и R2d представляет -(CH2)kR7 (где k и R7 имеют те же значения, что указаны выше) или СН2СН(CO2R33A) 2 (где R33A имеют те же значения, что указаны выше).] Стадия 4-1 Соединение (1-4) может быть получено, когда соединение (1-2) или соединение (1-3) подвергают восстановлению в растворителе, таком как N,N-диметилформамид в токе водорода в присутствии катализатора восстановления, такого как 10% палладий/углерод и оксид платины. Катализатор восстановления используют в количестве от 10 до 100% (мас/мас) относительно соединения (1-2) или соединения (1-3). Реакцию обычно проводят при от 0 до 100°С в течение от 1 до 72 часов. Стадия 4-2 Соединение (1-4) может быть получено, когда соединение (1-1) подвергают взаимодействию с алкилсиланом, таком как этилсилан в трифтор уксусной кислоте. Стадия 5 Соединение (1-5), то есть- соединение (I), где либо R1 , либо R2 обозначает галоген или нитро, может быть получено, когда соединение (IX) подвергают реакциям по стадиям 1-4 способов 1-4, описанных выше. Соединение (IX) может быть получено согласно способам, описанным в не прошедших экспертизу опубликованных патентных заявках Японии №№120388/87 и 2955889/88. [В формулах R3 , W1 , W2, X и Y имеют те же значения, что указаны выше; и либо один из RE1 и RE2 представляет галоген или нитро, а другой представляет водород; и либо один из R le и R2e представляет галоген, нитро или амин, а другой представляет -СО(СН2)JR4 (где j и R4 имеют те же значения, что указаны выше) или -CO(CH2)kR7 (где k и R4 имеют те же значения, что указаны выше), -СН=СН(CH2)mR12 (где m и R12 имеют те же значения, что указаны выше), -СН=С (CO2R33B)2 (где R33B имеет те же значения, что указаны выше) или -CºC(CH2)nR13 (где n и R13 имеют те же значения, что указаны выше).] Способ 6 Соединение (1-6), то есть, соединение (I), где либо один из R1 и R2 представляет NR14R15 (где R 14 и R15 имеют те же значения, что указаны выше), и другой представляет -CO(CH2)jR4 (где j и R4 имеют те же значения, что указаны выше), -(CH2)kR7 (где k и R4 имеют те же значения, что указаны выше), CH=CH(CH2)mR12 (где m и R12 имеют те же значения, что указаны выше), -CH=C(CO2R33A)2 (где R33A имеет те же значения, что указаны выше) или -CºC(CH2)nR13 (где n и R13 имеют те же значения, что указаны выше), могут быть получены из соединения (1-5), где либо один из R1e и R2e представляет нитро согласно способу, описанному в не прошедшей экспертизу опубликованной патентной заявке Японии №295588/88. Способ 7 Соединение (Ib), то есть, соединение (I), где R3 представляет водород, могут быть также получены из соединения (1а), то есть, соединение (I), где R3 представляет ацил, как указано выше, согласно способу, описанному в не прошедшей экспертизу опубликованной патентной заявке Японии №295588/88. Способ 8 Соединение (1-7), то есть, соединение (I), по крайней мере один из R 1 и R2 представляет 49 СН(ОН)(CH2)bR4A (где b и R4A имеют те же значения, что указаны выше), могут быть получены восстановлением соединения, которое может быть синтезировано в соответствии со стадией 1-1 или 1-2, например, взаимодействием с восстанавливающим агентом, таким как метагол и метанол/хлороформ. Восстанавливающий агент используют в количестве от 1 до 20 эквивалентов относительно сырого продукта. Реакцию обычно проводят при от -10 до 50°С в течение от 0,5 до 24 часов. Способ 9 Соединение (1-6), то есть, соединение (I), где либо один из R1 и R2 представляет формил, и другой представляет -(CH2)kR7 (где k и R4 имеют те же значения, что указаны выше), -СН=СН (CH2)mR12 (где m и R12 имеют те же значения, что указаны выше), CºC(CH2)nR13 (где п и R13 имеют те же значения, что указаны выше), могут быть получены согласно способам 2-4 после формулирования производного К-252а (которое может быть получено согласно способу, описанному в ссылочных примерах), где либо один из R1 и R2 представляет водород, и другой представляет бром или йод или оба R1 и R2 представляют бром или йод. Способ 10 Соединение (1-9), то есть, соединение (I), где либо один из R1 и R2 представляет –CH(SR34)2 (где R34 имеет те же значения, что указаны выше), и другой представляет -(CH2)kR7 (где k и R4 имеют те же значения, что указаны выше), -СН=СН (CH2)mR12 (где m и R12 имеют те же значения, что указаны выше) или СºС(CH2)nR13 (где n и R13 имеют те же значения, что указаны выше), могут быть получены, когда соединение (1-8) подвергают взаимодействию с соединением (X), представленным формулой (X): R34SH (X) (где В34 имеет те же значения, что указаны выше) в присутствии кислотного катализатора, такого как BF3 OEt2. Как соединение (X), так и кислотный катализатор, используют в количестве от 1 до 20 эквивалентов относительно соединения (1-8). Реакцию обычно проводят при от 0 до 80°С в течение от 1 до 24 часов. Способ 11 Соединение (1-10), то есть, соединение (I), где либо один из R1 и R2 представляет -CH2R35A (где R35A имеет те же значения, что и R35, за исключением тринизшего алкилсилилокси) , а другой представляет (CH2)kR7 (где k и R7 имеют те же значения, что указаны выше), -СН=СН (CH2)mR12 (где m и R12 имеют те же значения, что указаны выше), -CºC(CH2)nR13 (где n и R13 имеют те же значения, что указаны выше), могут быть получены восстановлением соединения (1-9) взаимодействием с восстанавливающим агентом, таким как боргидрид натрия, с образованием соединения, Соединение (1-10), то есть, соединение (I), где либо один из R1 и R2 представляет -CH2R35A (где R35A имеет те же значения, что и R35, за исключением тринизшего алкилсилилокси), а другой представляет -(CH2)kR7 (где k и R7 имеют те же значения, что указаны выше), CH=CH(CH2)mR12 (где m и R12 имеют те- же значения, что указаны выше), -СºС(СН2)nR13 (где n и R13 имеют те же значения, что указаны выше), могут быть получены восстановлением соединения (1-9) с восстанавливающим агентом, таким как боргидрид натрия, с* образованием соединения, где либо один из R1 и R2 представляет СН2ОН, и затем взаимодействием с соединением (XI), представленным формулой (XI): R27SH (XI) (где R27 имеет те же значения, что указаны выше) или соединением (XII), представленным (XII): R29 OH (XII) (где R29 имеет те же значения, что указаны выше) в присутствии кислотного катализатора, такого как камфорсульфоновая кислота. Кислотный катализатор используют в количестве от 0,1 до 5 эквивалентов относительно соединения (1-9) и соединение (XI) и (XII) используют Б количестве от 1 до 20 эквивалентов относительно соединения (1-9). Реакцию обычно проводят при от 0 до 80°С в течение от 1 до 100 часов. Преобразование функциональных групп в заместителях R1 и R2 может быть проведено в соответствии со стадиями или известными методами [см., например, R.C.Larock, Comprehensive Organic Transformations (1989)]. Например, преобразование функциональных групп может быть проведено путем взаимодействия соединения (I), содержащего удаляемую группу (например, хлор, бром, йод или сульфонилокси, такой как метилсульфонилокси, трифторметансульфонилокси и п-толуолсульфонилокси) в R1 и R2 с н уклеофильным реагентом, таким как амин, спирт, тиол и азид, в присутствии основания, - такого как карбонат калия, с получением соединения (I). Альтернативно, когда соединение (I) содержит азидогруппу в R 1 и R2, функциональные группы могут быть преобразованы в аминогруппы с помощью восстанавливающего агента, такого как трифенилфосфин, или аминогруппы могут быть подвергнуты взаимодействию с низшим алкилизоцианатом или ди-низшим алкилкарбонатом с получением производного мочевины или карбамата. Желаемые соединения по способам, описанным выше, могут быть выделены и очищены с помощью комбинаций способов очистки, обычно используемых в органической синтетической химии, например, фильтрацией, экстракцией, промыванием, сушкой, концентрированием, кристаллизацией и различными видами хроматографии. Промежуточные соединения могут быть подвергнуты взаимодействию без очистки. У соединения (I) могут быть стереоизомеры, такие как геометрические изомеры и оптические изомеры, и настоящее изобретение охватывает все возможные изомеры и их смеси в любых соотношениях. В случае, когда желательна соль соединения (I) и его получают в виде желаемой соли, она может быть подвергнута очистке как таковая. В случае, когда соединение (I) получают в свободном виде желательна его соль, соединение (I) растворяют или суспендируют в подходящем растворителе с последующим прибавлением кислоты с образованием соли. Соединение (I) и его фармацевтически приемлемые соли могут быть в виде аддуктоз с водой или различными растворителями без ограничения объема изобретения. Примеры соединения (I) показаны в таблице 1, а производные соединения показаны в таблице 2. Таблица 1(1) 50 Соединение R1 R2 R3 Y 1 CH=CHCO2Me CH=CHCO2Me H OH 2 CH=CHCO2Et H H OH 3 CH=CHCO2Et CH=CHCO2Et H OH 4 CH=CHCO2Me H H OH 5 CH=CH-C6H5 H H OH 6 CH=CH-C6H5 CH=CH-C6H5 H OH 7 CH=CH-2-Pyr H H OH 8 CH=CH-2-Pyr CH=CH-2-Pyr H OH 9 CH2CH2-C6H5 CH2CH2-C6H5 H OH 10 CH2CH2-C6H5 H H OH 11 CH2CH2-2-Pyr CH2CH2-2-Pyr H OH Таблица 1(2) Соединение R1 R2 R3 Y 12 H CH=CHCO2Et H OH 13 H CH=CH-2-Pyr H OH 14 H CH2CH2-2-Pyr H OH 15 NO2 CH=CH-2-Pyr Ac OAc 16 NO2 CH=CH-2-Pyr H OH 17 NН2 CH2CH2-2-Pyr Ac OAc 18 NН2 CH2CH2-2-Pyr H OH 19 NHCONHEt CH2CH2-2-Pyr H OH Pyr = пиридил Таблица 1(3) 51 Соединение R1 R2 R3 Y 20 C≡CCH2NMe2 C≡CCH2NMe2 H OH 21 C≡CCH2OMe I H OH 22 C≡CCH2OMe C≡CCH2OMe H OH 23 C≡CCH2OH C≡CCH2OH H OH 24 COCH2Cl COCH2Cl Ac OAc 25 COCH2-1-Pip COCH2-1-Pip H OH 26 COCH2CH2Cl H Ac OAc 27 COCH2CH2Cl COCH2CH2Cl Ac OAc 28 COCH2CH2-1-Pip H H OH 29 COCH2CH2-1-Pip COCH2CH2-1-Pip H OH 30 COCH2CH2-1-Morph COCH2CH2-1-Morph H OH 31 COCH2-1-Morph COCH2-1-Morph H OH 32 COCH2NMe2 COCH2NMe2 H OH Pip = пиперидин Morph = морфолин Таблица 1(4) Соединение R1 R2 R3 Y 33а COСH2Cl H Ac OAc 33b H COСH2Cl Ac OAc 34 COCH2NMe2 H H OH 35 COCH2-1-THP H H OH 36a COCH2-1-Morph H Ac OAc 36b H COCH2-1-Morph Ac OAc 37a COCH2-1-Morph H H OH 37b H COCH2-1-Morph H OH 52 38 COCH2-1-THP COCH2-1-THP H OH 39 COCH2-1-Pipz(4-Me) COCH2-1-Pipz(4-Me) Ac OAc 40 COCH2-1-Pipz(4-Me) COCH2-1-Pipz(4-Me) H OH 41 H COCH2SEt H OH 42a COCH2S-4-Pyr H H OH 42b H COCH2S-4-Pyr H OH 43 COCH2SMe COCH2SMe H OH 44 COCH2SEt COCH2SEt H OH 45 COCH2SCH2Et COCH2SCH2Et H OH 46 COCH2S(CH2)2OH COCH2S(CH2)2OH H OH 47 COCH2S-4-Pyr COCH2S-4-Pyr H OH 48 COCH2S-2-Pyr COCH2S-2-Pyr H OH 49 COCH2S-2-Pyrm COCH2S-2-Pyrm H OH 50 COCH2S-C6H4(4-OH) COCH2S-C6H4(4-OH) H OH THP = тетрагидропиррол Pipz = пиперазин Pyrm = пиримидин Таблица 1(5) Соединение R1 R2 R3 Y 51 COCH2S-2-Thiazl COCH2S-2-Thiazl H OH 52 COCH2S-5-Tet(1-Me) COCH2S-5-Tet(1-Me) H OH 53 CO(CH2)2SMe CO(CH2)2SMe H OH 54 CO(CH2)2OMe CO(CH2)2OMe H OH 55 Br CO(CH2)3H H OH 56 CO(CH2)4H CO(CH2)4H Ac OAc 57 COCH2Br COCH2Br Ac OAc 58 CH(OH)Me H Ac OAc 59 CH(OH)(CH2)2Cl CH(OH)(CH2)2Cl H OH 60 CH(OH)CH2-1-Pipz(4-Me) CH(OH)CH2-1-Pipz(4-Me) H OH 61 C≡CCH2NMe2 H H OH 62 Br C≡CCH2NMeBn H OH 63 CH=CHCH2NMe2 CH=CHCH2NMe2 Ac OAc 53 64 CH=CHCH2NMe2 CH=CHCH2NMe2 H OH 65 CH=CHEt H Ac OAc 66 CH=CHEt H H OH 67 CH=CHEt I Ac OAc 68 CH=CHEt CH=CHEt H OH 69 (CH2)2Cl (CH2)2Cl H OH 70a (CH2)2I (CH2)2I H OH 70b (CH2)2OCOH (CH2)2OCOH H OH Thiazl = тиазолин Tet = тетразол Таблица 1(6) Соединение R1 R2 R3 Y 70c (CH2)2OH (CH2)2OH H OH 71 (CH2)2OCO-4-Pyr (CH2)2OCO-4-Pyr H OH 72a CH2CO2Me H H OH 72b CH2CO2Me CH2CO2Me H OH 73a (CH2)3I (CH2)3I H OH 73b (CH2)3OCOH (CH2)3OCOH H OH 73c (CH2)3OH (CH2)3OH H OH 74 (CH2)3OMe (CH2)3OMe H OH 75 (CH2)2-1-Pip (CH2)2-1-Pip H OH 76 (CH2)2-1-Morph (CH2)2-1-Morph H OH 77 (CH2)2NEt2 (CH2)2NEt2 H OH 78 (CH2)2NMe(CH2)2OH (CH2)2NMe(CH2)2OH H OH 79 (CH2)2NHMe (CH2)2NHMe H OH 80 (CH2)2NHCH2C6H4(4-MeO) (CH2)2NHCH2C6H4(4-MeO) H OH 81 (CH2)2N3 (CH2)2N3 H OH 82 (CH2)3-1-Pip (CH2)3-1-Pip H OH 83 (CH2)3-1-Morph (CH2)3-1-Morph H OH 84 (CH2)3NEt2 (CH2)3NEt2 H OH 85 (CH2)3NHCONHEt (CH2)3NHCONHEt H OH 86 (CH2)3NHCO2-трет-Bu (CH2)3NHCO2-трет-Bu H OH 54 87 (CH2)2SMe (CH2)2SMe H OH 88 (CH2)2SEt (CH2)2SEt H OH 89 (CH2)2SCH2CO2 Me (CH2)2SCH2CO2 Me H OH Таблица 1(7) Соединение R1 R2 R3 Y 90 (CH2)2S(CH2)2CO2Et (CH2)2S(CH2)2CO2Et H OH 91 (CH2)2S-C6H4(4-OH) (CH2)2S-C6H4(4-OH) H OH 92 (CH2)2S-2-Thiazl (CH2)2S-2-Thiazl H OH 93 (CH2)2S-4-Pyr (CH2)2S-4-Pyr H OH 94 (CH2)2S-2-Pyr (CH2)2S-2-Pyr H OH 95 (CH2)2SMe (CH2)2SMe H OH 96 (CH2)2S-2-(Benz)Thiazole (CH2)2S-2-(Benz)Thiazole H OH 97 CH=CH-2-Pyr CHO Ac OAc 98 CH=CH-2-Pyr CH2OH Ac OAc 99 CH=CH-2-Pyr CH2OH H OH 100 CH=CH-2-Pyr CH2OSiMe 2-трет-Bu Ac OAc 101 CH=CH-2-Pyr CH2OSiMe 2-трет-Bu H OH 102 CH=CH-2-Pyr CH2OMe H OH 103 CH=CH-2-Pyr CH2OEt H OH 104 CH=CH-2-Pyr CH2O(CH2)2NMe2 H OH 105 CH=CH-2-Pyr CH2SEt H OH 106 CH=CH-2-Pyr CH2S(CH2)2NMe2 H OH 107 CH=CH-2-Pyr CH2S-2-(Benz)Imid H OH 108 CH=CH-2-Pyr CH2S-2-Pyr H OH 109 CH=CH-2-Pyr CH(SEt)2 Ac OAc 110 CH=CH-2-Pyr CH(SEt)2 H OH 111 CHO CH=CH-2-Pyr Ac OAc 112 CH2OH CH=CH-2-Pyr Ac OAc Imid = имидазол (Benz)Thiazole = бензотиазол 55 Таблица 1(8) Соединение R1 R2 R3 Y 113 CH2OH CH=CH-2-Pyr H OH 114 CH2OSiMe 2-трет-Bu CH=CH-2-Pyr Ac OAc 115 CH2OSiMe 2-трет-Bu CH=CH-2-Pyr H OH 116 CH2OMe CH=CH-2-Pyr H OH 117 CH2OEt CH=CH-2-Pyr H OH 118 CH2SEt CH=CH-2-Pyr H OH 119 CH2S-2-Pyr CH=CH-2-Pyr H OH 120 CH2S-2-(Benz)Imid CH=CH-2-Pyr H OH 121 CH=CHEt CH=CH-2-Pyr Ac OAc 122 CH=CHEt CH=CH-2-Pyr H OH 123 (CH2)2-2-Pyr CH2OSiMe 2-трет-Bu Ac OAc 124 (CH2)2-2-Pyr CH2OSiMe 2-трет-Bu H OH 125a (CH2)2-2-Pyr CH2OMe Ac OAc 125b (CH2)2-2-Pyr CH2OMe H OAc 126 (CH2)2-2-Pyr CH2OMe H OH 127a (CH2)2-2-Pyr CH2OEt H OH 127b (CH2)2-2-Pyr CH2OH H OH 128 (CH2)2-2-Pyr CH2S-2-Pyr Ac OAc 129 (CH2)2-2-Pyr CH2S-2-Pyr H OH 130 CH2OSiMe 2-трет-Bu (CH2)2-2-Pyr Ac OAc 131 CH2OSiMe 2-трет-Bu (CH2)2-2-Pyr H OH 132 CH2OMe (CH2)2-2-Pyr H OH 133 CH2OEt (CH2)2-2-Pyr H OH (Benz)Imid = бензимидазол Таблица 1(9) Соединение R1 R2 R3 Y 134 CH2SEt (CH2)2-2-Pyr H OH 135 CH2S(СH2)2NMe2 (CH2)2-2-Pyr H OH 136 CH2S-2-Pyr (CH2)2-2-Pyr Ac OAc 56 137 CH2S-2-Pyr (CH2)2-2-Pyr H OH *138 C≡CCH2OMe C≡CCH2OMe H OH 139 CH2CH2CO2Me CH2CH2CO2Me H OH 140 CH2CH2CO2Et CH2CH2CO2Et H OH 141 Br CH=CH-2-Pyr Ac OAc 142 Br CH=CH-2-Pyr H OH 143 Br CH2CH2-2-Pyr H OH 144 CH=CH-4-Pyr CH=CH-4-Pyr Ac OAc 145 CH=CH-4-Pyr CH=CH-4-Pyr H OH 146 CH2CH2-4-Pyr CH2CH2-4-Pyr H OH 147 CH=CH-2-Imid H Ac OAc 148 CH=CH-2-Imid H H OH 149 CH2CH2-2-Imid H H OH 150 CH=C(CO2Me)2 CH=C(CO2Me)2 Ac OAc 151 CH2CH(CO2Me)2 CH2CH(CO2Me)2 Ac OAc 152 CH2CH(CO2Me)2 CH2CH(CO2Me)2 H OH 153 н-C4H9 (CH2)2-2-Pyr H OH 154 CH2OCH2OMe H H OH 155 CH2OCH2OMe CH2OCH2OMe H OH 156 CH2OCH2OEt CH2OCH2OEt H OH 157 CH2O(CH2)2OMe CH2O(CH2)2OMe H OH * Группа СО2СН3 заменена СН2ОН. Таблица 2 Соединение R1 R2 R3 Y A Br H Ac OAc B Br CHO Ac OAc 57 C H CHO Ac OAc D NO2 H Ac OAc E NO2 CHO Ac OAc F I I Ac OAc G I I H OH H I H Ac OAc I Br I Ac OAc J CHO I Ac OAc K CH2OH I Ac OAc Примеры Некоторые варианты осуществления изобретения проиллюстрированы в следующих примерах и ссылочных примерах. Соединения а-е и g, которые являются известными соединениями в качестве исходных соединений, описаны в не прошедшей экспертизу опубликованной патентной заявке Японии №295588/88. Соединения f и h описаны в WО94/02488. Структуры показаны далее на фиг.9. Фиг.9 Соединение R1 R2 R3 Y a CHO CHO Ac OAc b CHO H Ac OAc c H H Ac OAc d Ac H Ac OAc e CH2OH H Ac OAc f CH2OH CH2OH Ac OAc g Ac Ac Ac OAc h CH2OH CH2OH H OH Пример 1 Синтез соединения 1 Стадия А: К раствору 50,0мг (0,0824ммоль) соединения а (не прошедшая экспертизу опубликованная патентная заявка Японии №295588/88) в 5мл хлороформа прибавляют 198мг (0,592ммоль) метил(трифенилфосфоранилиден)ацетата с последующим перемешиванием при кипячении с обратным холодильником в течение 4 часов. После охлаждения растворитель упаривают при пониженном давлении и остаток очищают хроматографией на силикагеле (хлороформ/метанол =98/2), с получением диацетилированного соединения 1. 58 FAB-MS (m/z): 720 (М+1)+ Стадия В: К раствору 71,0мг диацетилированного соединения 1 в смеси 4мл 1,2-дихлорметана и 1мл метанола прибавляют 18мл (0,09ммоль) 5,1 н. раствора метоксида натрия/метанола и смесь перемешивают при комнатной температуре в течение 30 минут. Реакционную смесь выливают в воду с последующей экстракцией тетрагидрофураном. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над суль фатом магния. После выпаривания растворителя при пониженном давлении остаток кристаллизуют из хлороформа/метанола, с получением 16,3мг (выход из соединения а: 31%) соединения 1. 1 Н-ЯМР (ДМСО-d6) δ: 2,04 (дд, 1H, J=4,9, 14,1 Гц), 2,12 (с, 3H), 3,42 (дд, 1H, J=7,5, 14,1 Гц), 3,77 (с, 6H), 3,93 (с, 3H), 5,10 (с, 2H), 6,43 (с, 1H), 6,59 (д, 1H, J=15,9 Гц), 6,78 (д, 1H, J=15,9 Гц), 7,21 (дд, 1H, J=4,9, 7,5 Гц), 7,85 (д, 1H, J=15,9 Гц), 7,95 (д, 1H, J=15,9 Гц), 7,88-8,00 (м, 4H), 8,40 (д, 1H, J=1,2 Гц), 8,79 (с, 1H), 9,48 (д, 1H, J=1,7 Гц). FAB-MS (m/z): 636 (М+1)+ Пример 2 Синтез соединения 2 Повторяют процедуру, что и в примере 1, стадия А, используя 55,7мг (0,0962ммоль) соединения b (не прошедшая экспертизу опубликованная патентная заявка Японии №295588/88) и 92,1мг (0,264ммоль) этил(трифенилфосфоранилиден)ацетата, с получением диацетилированного соединения 2. FAB-MS (m/z): 650 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя диацетилированное соединение 2, с получением 27,5мг (выход из соединения b: 51%) соединения 2. 1 Н-ЯМР (ДМСО-d6) δ: 1,31 (т, 3H, J=7,1 Гц), 2,05 (дд, 1H, J=4,9, 14,1 Гц), 2,15 (с, 3H), 3,41 (дд, 1H, J=7,3, 14,1 Гц), 3,93 (с, 3H), 4,23 (кв, 2H, J=7,1 Гц), 5,00 (д, 1H, J=17,5 Гц), 5,06 (д, 1H, J=17,5 Гц), 6,36 (с, 1H), 6,56 (д, 1H, J=15,9 Гц), 7,19 (дд, 1H, J=4,9, 7,3 Гц), 7,84 (д, 1H, J=15,9 Гц), 7,36-8,08 (м, 6H), 8,69 (с, 1H), 9,47 (д, 1H, J=1,5 Гц). FAB-MS (m/z): 565 (М)+, 566 (М+1)+ Пример 3 Синтез соединения 3 Повторяют процедуру, что и в примере 1, стадия А, используя 50,0мг (0,0824ммоль) соединения а и 225мг (0,645ммоль) этил(трифенилфосфоранилиден)ацетата, с получением диацетилированного соединения 3. FAB-MS (m/z): 747 (М)+, 748 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя диацетилированное соединение 3, с получением 29,7 мг (выход из соединения а: 54%) соединения 3. 1 Н-ЯМР (ДМСО-d6) δ: 1,31 (т, 6H, J=7,1 Гц), 2,04 (дд, 1H, J=4,9, 14,2 Гц), 2,15 (с, 3H), 3,42 (дд, 1H, J=7,4, 14,2 Гц), 3,93 (с, 3H), 4,23 (кв, 2H, J=7,1 Гц), 4,23 (кв, 2H, J=7,1 Гц), 5,10 (с, 2H), 6,43 (с, 1H), 6,58 (д, 1H, J=15,9 Гц), 6,77 (д, 1H, J=16,0 Гц), 7,21 (дд, 1H, J=4,9, 7,4 Гц), 7,83 (д, 1H, J=15,9 Гц), 7,93 (д, 1H, J=16,0 Гц), 7,88-8,00 (м, 4H), 8,40 (д, 1H, J=1,5 Гц), 8,78 (с, 1H), 9,47 (д, 1H, J=1,6 Гц). FAB-MS (m/z): 664 (М+1)+ Пример 4 Синтез соединения 4 Повторяют процедуру, что и в примере 1, стадия А, используя 50,0мг (0,0824ммоль) соединения b и 104 мг (0,311ммоль) метил(трифенилфосфоранилиден)ацетата, с получением диацетилированного соединения 4. FAB-MS (m/z): 636 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя диацетилированное соединение 4, с получением 14,6 мг (выход из соединения b: 31%) соединения 4. 1 Н-ЯМР (ДМСО-d6) δ: 2,05 (дд, 1H, J=4,9, 14,2 Гц), 2,15 (с, 3H), 3,41 (дд, 1H, J=7,5, 14,2 Гц), 3,77 (с, 3H), 3,93 (с, 3H), 5,00 (д, 1H, J=17,6 Гц), 5,06 (д, 1H, J=17,6 Гц), 6,36 (с, 1H), 6,59 (д, 1H, J=15,8 Гц), 7,19 (дд, 1H, J=4,9, 7,5 Гц), 7,85 (д, 1H, J=15,8 Гц), 7,36-8,08 (м, 6H), 8,70 (с, 1H), 9,47 (д, 1H, J=1,5 Гц). FAB-MS (m/z): 552 (М+1)+ Пример 5 Синтез соединения 5 К раствору 215мг (0,553ммоль) бензилтрифенилфосфоний хлорида в 2мл дихлорметана прибавляют 165мг (1,19ммоль) карбоната калия и 12мг (0,045ммоль) 18-краун-6 и смесь перемешивают при комнатной температуре в течение 5 минут. После прибавления раствора 80,0мг (0,138ммоль) соединения b в 8мл дихлорметана, смесь перемешивают в течение ночи при комнатной температуре. Нерастворимые продукты реакционной смеси отфильтровывают и растворитель упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (хлороформ) и затем препаративной ТСХ (хлороформ/метанол =99/1), с получением 80,0мг (89%) диацетилированного соединения 5. FAB-MS (m/z): 564 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 80,0мг (0,123ммоль) диацетилированного соединения 5, с получением 26,1мг (37%) соединения 5 (E/Z =3/7). 1 Н-ЯМР (ДМСО-d6) δ: 2,00-2,57 (м, 1H), 2,13 (с, 2,1H), 2,14 (с, 0,9H), 3,37 (дд, 0,7H, J=7,5, 14,2 Гц), 3,40 (дд, 0,3Н, J=7,6, 13,7 Гц), 3,90 (с, 2,1H), 3,92 (с, 0,9H), 4,93-5,60 (м, 2H), 6,33 (с, 0,7H), 6,34 (с, 0,3H), 6,621 (д, 0,7H, J=12,4 Гц), 6,849 (д, 0,7H, J=12,4 Гц), 7,072 (дд, 0,7H, J=4,9, 7,5 Гц), 7,132-8,064 (м, 11,9H), 8,58 (с, 0,7H), 8,63 (с, 0,3H), 9,15 (м, 0,7H), 9,38 (д, 0,3H, J=1,7 Гц). FAB-MS (m/z): 570 (М+1)+ Пример 6 Синтез соединения 6 Повторяют процедуру, что и в примере 5, используя 250мг (0,643ммоль) бензилтрифенилфосфоний хлорида и 50,0мг (0,0824ммоль) соединения а, с получением 63,5мг диацетилированного соединения 6. FAB-MS (m/z): 756 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 63,5мг (0,0841ммоль) диацетилированного соединения 6, с получением 49,9мг (выход из соединения а: 90%) соединения 6 (R1, R2: цис, транс/R1, R2: цис, цис/R1, R2: транс, цис/R1, R 2: транс, транс = 2/1/1/1). 1 Н-ЯМР (ДМСО-d 6) δ: 1,99-2,08 (м, 1H), 2,10, 2,12, 2,15, 2,17 (4×с, 3H), 3,35-3,45 (м, 1H), 3,89, 3,92, 3,92, 59 3,93 (4×с, 3H), 4,50-5,03 (м, 2H), 6,35, 6,36, 6,40, 6,41 (4×с, 1H), 6,61-8,23 (м, 20H), 8,59, 8,57, 8,67, 8,72 (м, 1H), 9,13, 9,17, 9,36, 9,40 (м, 1H). FAB-MS (m/z): 672 (М+1)+ Пример 7 Синтез соединения 7 Повторяют процедуру, что и в примере 5, используя 61,8мг (0,142ммоль) 2пиридинметилтрифенилфосфоний бромида и 26,5мг (0,0458ммоль) соединения b, с получением 47,3мг диацетилированного соединения 7. FAB-MS (m/z): 655 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 47мг диацетилированного соединения 7, с получением 13,3мг (выход из соединения b: 51%) соединения 7. 1 Н-ЯМР (ДМСО-d6) δ: 2,05 (дд, 1H, J=5,0, 14,1 Гц), 2,16 (с, 3H), 3,42 (дд, 1H, J=7,3, 14,1 Гц), 3,94 (с, 3H), 5,00 (д, 1H, J=18,0 Гц), 5,06 (д, 1H, J=18,0 Гц), 6,35 (с, 1H), 7,17 (дд, 1H, J=5,0, 7,3 Гц), 7,23-7,97 (м, 8H), 7,30 (д, 1H, J=16,0 Гц), 7,89 (д, 1H, J=16,0 Гц), 8,07 (д, 1H, J=7,3 Гц), 8,59 (м, 1H), 8,67 (с, 1H), 9,46 (д, 1H, J=1,2 Гц). FAB-MS (m/z): 571 (М+1)+ Пример 8 Синтез соединения 8 Повторяют процедуру, что и в примере 5, используя 244мг (0,561ммоль) 2пиридинметилтрифенилфосфоний бромида и 50,0мг (0,0824ммоль) соединения а, с получением 75,3мг диацетилированного соединения 8. FAB-MS (m/z): 757 (М)+ Повторяют процедуру, что и в примере 1, стадия В, используя 75,3мг диацетилированного соединения 8, с получением 22,6мг (выход из соединения а: 41%) соединения 8. 1 Н-ЯМР (ДМСО-d6) δ: 2,06 (дд, 1H, J=5,0, 14,4 Гц), 2,18 (с, 3H), 3,43 (дд, 1H, J=7,6, 14,4 Гц), 3,95 (с, 3H), 5,08-5,17 (м, 2H), 6,42 (с, 1H), 7,19 (дд, 1H, J=5,0, 7,6 Гц), 7,30 (д, 1H, J=16,0 Гц), 7,42 (д, 1H, J=16,0 Гц), 7,229,46 (м, 17H). FAB-MS (m/z): 674 (М+1)+ Пример 9 Синтез соединения 9 К раствору 36,9мг (0,0550ммоль) соединения 6 в 4мл N,N-диметилформамида прибавляют 25мг 10% Pd/C с последующим перемешиванием при 60°С в течение 2 часов в атмосфере водорода. Нерастворимые продукты реакционной смеси отфильтровывают и растворитель упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (хлороформ), с получением 31,1мг (84%) соединения 9. 1 Н-ЯМР (ДМСО-d6) δ: 1,98 (дд, 1H, J=5,1, 14,1 Гц), 2,12 (с, 3H), 2,99-3,14 (м, 8H), 3,36 (дд, 1H, J=7,5, 14,1 Гц), 3,92 (с, 3H), 4,92 (д, 1H, J=17,6 Гц), 4,97 (д, 1H, J=17,6 Гц), 6,28 (с, 1H), 7,08 (дд, 1H, J=5,1, 7,5 Гц), 7,177,38 (м, 12H), 7,78-7,84 (м, 3H), 8,59 (с, 1H), 9,09 (м, 1H). FAB-MS (m/z): 676 (М+1)+ Пример 10 Синтез соединения 10 Повторяют процедуру, что и в примере 9, используя 43,6мг (0,0766ммоль) соединения 5, с получением 24,2мг (55%) соединения 10. 1 Н-ЯМР (ДМСО-d6) δ: 2,00 (дд, 1H, J=4,9, 14,1 Гц), 2,15 (с, 3H), 2,99-3,11 (м, 4H), 3,37 (дд, 1H, J=7,3, 14,1 Гц), 3,92 (с, 3H), 4,97 (д, 1H, J=17,9 Гц), 5,03 (д, 1H, J=17,9 Гц), 6,32 (с, 1H), 7,10 (дд, 1H, J=4,9, 7,3 Гц), 7,178,06 (м, 11H), 8,58 (с, 1H), 9,11 (м, 1Н). FAB-MS (m/z): 572 (М+1)+ Пример 11 Синтез соединения 11 Повторяют процедуру, что и в примере 9, используя 15,0мг (0,0223ммоль) соединения 8, с получением 9,8 мг (65%) соединения 11. 1 H-ЯМР (CDCl3) δ: 2,19 (с, 3H), 2,42 (дд, 1H, J=4,8, 14,4 Гц), 3,21-3,29 (м, 8H), 3,31 (дд, 1H, J=7,5, 14,4 Гц), 4,08 (с, 3H), 4,19 (шир., 1H), 4,83 (д, 1H, J=16,2 Гц), 4,88 (д, 1H, J=16,2 Гц), 5,98 (с, 1H), 6,84 (дд, 1H, J=4,8, 7,5 Гц), 7,11-7,33 (м, 7H), 7,56-7,62 (м, 2H), 7,68 (с, 1H), 7,73 (д, 1H, J=8,6 Гц), 8,58-8,61 (м, 2H), 9,08 (м, 1H). FAB-MS (m/z): 678 (М+1)+ Пример 12 Синтез соединения 12 Повторяют процедуру, что и в примере 1, стадия А, используя 25,0мг (0,0432ммоль) соединения С, полученного в ссылочном примере 3, и 52,0мг (0,156ммоль) этил(трифенилфосфоранилиден)ацетата, с получением 17,2мг (63%) диацетилированного соединения 12. FAB-MS (m/z): 650 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя диацетилированное соединение 12, с получением 8,1мг (54%) соединения 12. 1 Н-ЯМР (ДМСО-d6) δ: 1,31 (т, 3H, J=7,1 Гц), 2,00 (дд, 1H, J=4,9, 14,1 Гц), 2,15 (с, 3H), 3,41 (дд, 1H, J=7,3, 14,1 Гц), 3,93 (с, 3H), 4,23 (кв, 2H, J=7,1 Гц), 5,08 (с, 2H), 6,41 (с, 1H), 6,76 (д, 1H, J=15,9 Гц), 7,16 (дд, 1H, J=4,9, 7,3 Гц), 7,93 (д, 1H, J=15,9 Гц), 7,28-7,96 (м, 4H), 8,39 (с, 1H), 8,71 (с, 1H), 9,23 (д, 1H, J=7,8 Гц). FAB-MS (m/z): 566 (М+1)+ Пример 13 Синтез соединения 13 Повторяют процедуру, что и в примере 5, используя 118мг (0,855ммоль) 2пиридинметилтрифенилфосфоний бромида и 39,6мг (0,0684ммоль) соединения С, полученного в ссылочном примере 3, с получением диацетилированного соединения 13. FAB-MS (m/z): 655 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя диацетилированное соединение 13, с получением 30,0мг (выход из соединения С: 77%) соединения 13 (E/Z = 8/2). 1 Н-ЯМР (ДМСО-d6) δ: 2,02 (дд, 1H, J=4,9, 14,1 Гц), 2,13 (с, 0,6H), 2,17 (с, 2,4H), 3,41 (дд, 1H, J=7,3, 14,1 Гц), 3,92 (с, 0,6H), 3,94 (с, 2,4H), 5,03 (д, 0,8H, J=18,8 Гц), 5,13 (д, 0,8H, J=18,8 Гц), 6,35 (с, 0,2H), 6,39 (с, 0,8H), 6,69 (д, 0,2H, J=12,9 Гц), 6,98 (д, 0,2H, J=12,9 Гц), 7,15 (дд, 1H, J=4,9, 7,3 Гц), 7,24-7,97 (м, 8H), 7,42 (д, 0,8H, J=16,0 60 Гц), 7,96 (д, 0,8H, J=16,0 Гц), 8,23 (с, 0,2H), 8,30 (с, 0,8H), 8,60 (м, 1H), 8,70 (с, 1H), 9,18 (д, 0,2H, J=7,8 Гц), 9,23 (д, 0,8H, J=7,8 Гц). FAB-MS (m/z): 571 (М+1)+ Пример 14 Синтез соединения 14 Повторяют процедуру, что и в примере 9, используя 19,9мг (0,0349ммоль) соединения 13, с получением 16,4мг (82%) соединения 14. 1 H-ЯМР (CDCl3) δ: 1,99 (дд, 1H, J=4,9, 14,2 Гц), 2,13 (с, 3H), 3,16-3,24 (м, 4H), 3,38 (дд, 1H, J=7,4, 14,2 Гц), 3,92 (с, 3H), 4,30 (д, 1H, J=17,4 Гц), 4,98 (д, 1H, J=17,4 Гц), 6,29 (с, 1H), 7,12 (дд, 1H, J=4,9, 7,4 Гц), 7,21-7,89 (м, 9H), 8,55 (м, 1H), 8,61 (с, 1H), 9,21 (д, 1H, J=7,6 Гц). FAB-MS (m/z): 573 (М+1)+ Пример 15 Синтез соединения 15 Повторяют процедуру, что и в примере 5, используя 144мг (0,331ммоль) 2пиридинметилтрифенилфосфоний бромида и соединение Е, полученное в ссылочном примере 5, с получением 36,3мг (выход из соединения D: 62%) соединения 15 (E/Z = 9/1). 1 H-ЯМР (CDCl3) δ: 1,81 (с, 0,3H), 1,84 (с, 2,7H), 2,25 (дд, 1H, J=5,2, 14,7 Гц), 2,29 (с, 0,3H), 2,33 (с, 2,7H), 2,65 (с, 2,7H), 2,68 (с, 0,3H), 4,01 (с, 0,3H), 4,04 (с, 2 ,7H), 4,07 (дд, 1H, J=7,6, 14,7 Гц), 5,08 (м, 0,2H), 5,34 (м, 1,8H), 6,81 (д, 0,1H, J=12,6 Гц), 6,98 (дд, 1H, J=5,2, 7,6 Гц), 7,19 (м, 1H), 7,32 (д, 0,9H, J=16,1 Гц), 7,87 (д, 1H, J=16,1 Гц), 7,95 (д, 1H, J=8,8 Гц), 8,13 (м, 1H), 8,35 (м, 1H), 8,66 (м, 1H), 9,93 (м, 1H). FAB-MS (m/z): 700 (М+1)+ Пример 16 Синтез соединения 16 Повторяют процедуру, что и в примере 1, стадия В, используя 33,1мг (0,0474ммоль) соединения 15, с получением 24,5мг (84%) соединения 16 (E/Z = 9/1). FAB-MS (m/z): 616 (М+1)+ 1 Н-ЯМР (ДМСО-d6) δ: 2,13 (дд, 1H, J=5,0, 14,3 Гц), 2,18 (с, 3H), 3,47 (дд, 1H, J=7,5, 14,3 Гц), 3,93 (с, 0,3H), 3,95 (с, 2,7H), 5,13 (д, 0,9H, J=18,1 Гц), 5,18 (д, 0,9H, J=18,1 Гц), 6,45 (с, 0,1H), 6,49 (с, 0,9H), 6,71 (д, 0,1H, J=12,6 Гц), 6,99 (д, 0,1H, J=12,6 Гц), 7,30 (дд, 1H, J=5,0, 7,5 Гц), 7,24-8,60 (м, 9H), 7,43 (д, 0,9H, J=16,0 Гц), 7,96 (д, 0,9H, J=16,0 Гц), 8,74 (с, 0,1H), 8,88 (с, 0,9H), 10,14 (д, 0,1H, J=2,4 Гц), 10,17 (д, 0,9H, J=2,4 Гц). Пример 17 Синтез соединения 17 Соединение 15 (133мг, 0,190ммоль) подвергают каталитическому восстановлению тем же способом, что и по примеру 9, с получением 93,2мг (73%) соединения 17. 1 Н-ЯМР (ДМСО-d6) δ: 1,68 (с, 3H), 2,09 (дд, 1H, J=4,9, 14,6 Гц), 2,18 (с, 3H), 2,71 (с, 3H), 3,15-3,21 (м, 2H), 3,82 (дд, 1H, J=7,4, 14,6 Гц), 3,93 (с, 3H), 4,97 (шир., 2H), 5,35 (с, 2H), 7,11 (дд, 1H, J=4,2, 7,4 Гц), 6,90-7,87 (м, 8H), 8,32 (д, 1H, J=2,2 Гц), 8,55 (м, 1H). FAB-MS (m/z): 672 (М+1)+ Пример 18 Синтез соединения 18 Повторяют процедуру, что и в примере 1, стадия В, используя 23,6мг (0,0352ммоль) соединения 17, с получением 16,3мг (79%) соединения 18. FAB-MS (m/z): 588 (М+1)+ Пример 19 Синтез соединения 19 К раствору 66,2мг (0,0987ммоль) соединения 17 в 4мл хлороформа прибавляют 0,02мл триэтиламина и 0,1мл этилизоцианата и смесь перемешивают при комнатной температуре в течение 2 часов. После прибавления воды реакционную смесь экстрагируют хлороформом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над суль фатом магния. Растворитель упаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 99/1 - 98/2), с получением 68,7мг (94%) диацетилированного соединения 19. FAB-MS (m/z): 743 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 25,5мг (0,0344ммоль) диацетилированного соединения 19, с получением 17,7мг (78%) соединения 19. 1 Н-ЯМР (ДМСО-d 6) δ: 1,08 (т, 3H, J=7,1 Гц), 1,94 (дд, 1H, J=4,6, 14,1 Гц), 2,11 (с, 3H), 3,10-3,22 (м, 4H), 3,34 (дд, 1H, J=7,2, 14,1 Гц), 3,90 (с, 3H), 4,90 (д, 1H, J=17,5 Гц), 4,96 (д, 1H, J=17,5 Гц), 6,00 (т, 1H, J=5,4 Гц), 6,26 (с, 1H), 7,03 (дд, 1H, J=4,6, 7,2 Гц), 7,22-7,86 (м, 8H), 8,43 (с, 1H), 8,55 (м, 1H), 8,58 (с, 1H), 8,84 (д, 1H, J=2,2 Гц). FAB-MS (m/z): 659 (М+1)+ Пример 20 Синтез соединения 20 К раствору 40мг (0,05ммоль) соединения F, полученного в ссылочном примере 6, в смеси 3мл дихлорметана/диэтиламина (2/1) прибавляют 26мг (0,025ммоль) палладий (II) ацетата, 13мг (0,05ммоль) трифенилфосфина и 9,5мг (0,05ммоль) йодида меди в токе аргона и затем перемешивают при комнатной температуре в течение 10 минут. После прибавления 0,16мл (1,5ммоль) N,N-диметилпропаргиламина смесь перемешивают при комнатной температуре в течение одного часа. Растворитель упаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 96/4), с получением 15,1мг (42%) диацетилированного соединения 20. FAB-MS (m/z): 714 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 6,5мг (0,0091ммоль) диацетилированного соединения 20, с получением 2,0мг (35%) соединения 20. 1 H-ЯМР (CDCl3) δ: 2,14 (с, 3H), 2,46 (с, 6H), 2,48 (с, 6H), 3,05 (дд, 1H, J=4,5, 14,4 Гц), 3,55 (с, 2H), 3,56 (с, 2H), 3,62 (дд, 1H, J=7,5, 14,4 Гц), 4,08 (с, 3H), 4,54 (д, 1H, J=16,9 Гц), 4,70 (д, 1H, J=16,9 Гц), 5,33 (м, 2H), 6,76 (дд, 1H, J=4,5, 7,5 Гц), 7,15 (д, 1H, J=8,5 Гц), 7,34 (дд, 1H, J=1,3, 8,5 Гц), 7,61 (дд, 1H, J=1,3, 8,5 Гц), 7,91 (д, 1H, J=8,8 Гц), 7,96 (д, 1H, J=0,97 Гц), 8,85 (с, 1H). FAB-MS (m/z): 630 (М+1)+ Пример 21 Синтез соединения 21 и соединения 22 61 Смесь 2,2мг (0,01ммоль) палладий (II) ацетата, 5,0мг (0,02ммоль) трифенилфосфина и 1мл дихлорметана перемешивают при комнатной температуре в течение 5 минут в токе аргона. К смеси прибавляют раствор 72мг (0,1ммоль) соединения G, полученного в ссылочном примере 7, и 3,8мг (0,02ммоль) йодида меди в смеси 3мл дихлорметана/диэтиламина (2/1) с последующим перемешиванием при комнатной температуре в течение 10 минут. После прибавления 0,056мл (1ммоль) 1-метокси-2-пропина смесь перемешивают при комнатной температуре в течение 1,5 часа. Растворитель упаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (хлороформ), с получением 23,0мг (38%) соединения 21 и 2,6мг (4,3%) соединения 22. Соединение 21: 1 H-ЯМР (CDCl3) δ: 2,15 (с, 3H), 3,13 (дд, 1H, J=4,5, 14,7 Гц), 3,57 (с, 3H), 3,79 (дд, 1H, J=7,7, 14,7 Гц), 4,09 (с, 3H), 4,46 (с, 2H), 4,53 (д, 1H, J=6,6 Гц), 4,58 (д, 1H, J=6,6 Гц), 5,11 (с, 1H), 5,69 (с, 1H), 6,77 (дд, 1H, J=4,5, 7,7 Гц), 7,10 (д, 1H, J=8,6 Гц), 7,46 (дд, 1H, J=1,7, 8,3 Гц), 7,63 (дд, 1H, J=1,5, 8,5 Гц), 7,92 (д, 1H, J=8,8 Гц), 7,98 (д, 1H, J=1,2 Гц), 8,83 (д, 1H, J=1,5 Гц). FAB-MS (m/z): 703 (М+1)+ Соединение 22: 1 H-ЯМР (CDCl3) δ: 2,15 (с, 3H), 2,95 (дд, 1H, J=4,9, 14,7 Гц), 3,54 (с, 3H), 3,55 (с, 3H), 3,60 (дд, 1H, J=7,6, 14,7 Гц), 4,09 (с, 3H), 4,42 (с, 2H), 4,45 (с, 2H), 4,53 (д, 1H, J=17,0 Гц), 4,70 (д, 1H, J=17,0 Гц), 5,19 (шир., 1H), 5,32 (шир., 1H), 6,78 (дд, 1H, J=4,9, 7,6 Гц), 7,20 (д, 1H, J=8,3 Гц), 7,36 (дд, 1H, J=1,5, 8,3 Гц), 7,61 (дд, 1H, J=1,7, 8,8 Гц), 7,89 (д, 1H, J=8,5 Гц), 7,97 (д, 1H, J=1,5 Гц), 8,85 (д, 1H, J=1,0 Гц). FAB-MS (m/z): 603 (М+1)+ Пример 22 Синтез соединения 23 К раствору 40мг (0,05ммоль) соединения F, полученного в ссылочном примере 6, в смеси 3мл дихлорметана/диэтиламина (2/1) прибавляют 126мг (0,18ммоль) бис(трифенилфосфин)палладий(II)хлорида и 42мг (0,22ммоль) йодида меди в токе аргона и затем перемешивают при комнатной температуре в течение 20 минут. После прибавления 0,16мл (1,5ммоль) пропаргилового спирта смесь перемешивают при комнатной температуре в течение одного часа. Реакционную смесь фильтруют через целит и растворитель упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол =96/4), с получением 456,0мг (23%) диацетилированного соединения 23. FAB-MS (m/z): 659 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 30,0 мг диацетилированного соединения 23, с получением 8,0 мг (33%) соединения 23. 1 Н-ЯМР (CD3OD) δ: 1,90 (с, 1H), 1,93 (с, 1H), 2,14 (дд, 1H, J=5,0, 14,2 Гц), 2,19 (с, 3H), 3,41 (дд, 1H, J=7,5, 14,2 Гц), 4,01 (с, 3H), 4,78 (м, 4H), 4,98 (д, 1H, J=17,6 Гц), 5,03 (д, 1H, J=17,6 Гц), 7,02 (дд, 1H, J=5,0, 7,5 Гц), 7,35 (дт, 1H, J=0,7, 7,8 Гц), 7,49 (м, 2H), 7,63 (д, 1H, J=8,3 Гц), 7,97 (д, 1H, J=9,2 Гц), 7,99 (д, 1H, J=1,1, 8,6 Гц), 9,26 (д, 1H, J=1,0 Гц). FAB-MS (m/z): 576 (М+1)+ Пример 23 Синтез соединения 24 Хлорацетилхлорид (0,95мл, 10ммоль) прибавляют к 5мл суспензии 1,06г (8ммоль) алюминийхлорида в дихлорметане и смесь перемешивают при комнатной температуре в течение 5 минут. К смеси прибавляют по каплям 10мл раствора 500мг (1ммоль) соединения с (не прошедшая экспертизу опубликованная патентная заявка Японии №295588/88) в дихлорметане и затем перемешивают при комнатной температуре в течение 2,5 часа. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом (9/1). Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом магния. После выпаривания растворителя при пониженном давлении полученный порошок смешивают с 1н. соляной кислотой. Смесь перемешивают в течение одного часа и затем фильтруют. Фильтрат очищают хроматографией на колонке с силикагелем (хлороформ), с получением 270мг (38%) соединения 24. 1 H-ЯМР (CDCl3) δ: 1,82 (с, 3H), 2,20 (дд, 1H, J=5,4, 14,5 Гц), 2,32 (с, 3H), 2,81 (с, 3H), 4,05 (с, 3H), 4,06 (дд, 1H, J=7,3, 14,5 Гц), 4,87 (дд, 1H, J=14,1, 15,6 Гц), 5,03 (д, 1H, J=14,1, 15,6 Гц), 5,45 (м, 2H), 7,03 (дд, 1H, J=5,1, 7,3 Гц), 7,61 (д, 1H, J=8,8 Гц), 8,02 (д, 1H, J=8,8 Гц), 8,21 (дд, 1H, J=1,7, 8,8 Гц), 8,27 (дд, 1H, J=1,7, 8,8 Гц), 8,63 (д, 1H, J=1,5 Гц), 9,87 (д, 1H, J=1,0 Гц). FAB-MS (m/z): 704 (М+1)+ Пример 24 Синтез соединения 25 К 1,5мл раствора 36мг (0,05ммоль) соединения 24 в хлороформе прибавляют 0,025мл (0,25ммоль) пиперидина и смесь кипятят с обратным холодильником в течение 2 часов. Растворитель упаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол =10/1), с получением диацетилированного соединения 25. FAB-MS (m/z): 802 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя диацетилированное соединение 25, с получением 16мг (42%) соединения 25. 1 Н-ЯМР (CDCl3) δ: 1,42 (м, 4H), 1,56 (м, 8H), 2,07 (дд, 1H, J=4 ,8, 14,2 Гц), 2,18 (с, 3H), 2,56 (м, 8H), 3,45 (дд, 1H, J=7,5, 14,2 Гц), 3,86 (м, 4H), 3,94 (с, 3H), 5,12 (м, 2H), 6,48 (с, 1H), 7,25 (дд, 1H, J=4,8, 7,5 Гц), 8,02 (д, 2H, J=9,0 Гц), 8,14 (дд, 1H, J=1,7, 7,1 Гц), 8,16 (дд, 1H, J=1,7, 7,1 Гц), 8,78 (шир., 1H), 8,84 (шир., 1H), 9,99 (д, 1H, J=1,5 Гц). FAB-MS (m/z): 718 (М+1)+ Пример 25 Синтез соединения 26 и соединения 27 Повторяют процедуру, что и в примере 23, используя 55мг (0,1ммоль) соединения с (не прошедшая экспертизу опубликованная патентная заявка Японии №295588/88) и 3-хлорпропионилхлорида, с получением 4мг (6%) соединения 26 и 26мг (36%) соединения 27. Соединение 26: 62 FAB-MS (m/z): 642 (М+1)+ Соединение 27: FAB-MS (m/z): 732 (М+1)+ Пример 26 Синтез соединения 28 К 1,5мл раствора 200мг (0,25ммоль) соединения 26 в хлороформе прибавляют 0,025мл (0,25ммоль) пиперидина и смесь кипятят с обратным холодильником в течение 2 часов. Растворитель упаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол =10/1), с получением соединения 28. FAB-MS (m/z): 689 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя диацетилированное соединение 28, с получением 17мг (11%) соединения 28. 1 H-ЯМР (CDCl3) δ: 1,48 (шир., 2H), 1,65 (т, 4H, J=5,2 Гц), 2,18 (с, 3H), 2,47 (шир., 4H), 2,60 (шир., 1H), 3,00 (шир., 1H), 3,57 (дд, 1H, J=8,1, 15,4 Гц), 4,07 (с, 3H), 4,15 (д, 1H, J=15,4 Гц), 4,40 (д, 1H, J=15,8 Гц), 5,73 (шир., 2H), 6,71 (дд, J=4,6, 7,3 Гц), 7,02 (д, 1H, J=8,1 Гц), 7,30 (дд, 1H, J=5,2, 8,1 Гц), 7,43 (дд, 1H, J=5,2, 8,2 Гц), 7,56 (шир., 1H), 7,63 (шир., 1H), 7,88 (д, 1H, J=8,2 Гц), 8,84 (с, 1H). FAB-MS (m/z): 605 (М+1)+ Пример 27 Синтез соединения 29 К 1,5мл раствора 60мг (0,03ммоль) соединения 27 в хлороформе прибавляют 0,025мл (0,25ммоль) пиперидина и смесь кипятят с обратным холодильником в течение 2 часов. Растворитель упаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 10/1), с получением диацетилированного соединения 29. FAB-MS (m/z): 830 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя диацетилированное соединение 29, с получением 5,1мг (8,3%) соединения 29. 1 Н-ЯМР (ДМСО-d6) δ: 2,06 (дд, 4H, J=4,4, 13,9 Гц), 2,17 (с, 3H), 2,49 (шир., 12H), 3,29 (шир., 4H), 3,44 (дд, 1H, J=7,3, 13,9 Гц), 3,93 (с, 3H), 5,13 (д, 1H, J=18,4 Гц), 5,80 (д, 1H, J=18,4 Гц), 6,48 (м, 1H), 7,25 (дд, 1H, J=5,4, 6,3 Гц), 8,00-8,16 (м, 4H), 8,62 (шир., 1H), 8,77 (шир., 1H), 9,96 (с, 1H). FAB-MS (m/z): 746 (М+1)+ Пример 28 Синтез соединения 30 К 1,5мл раствора 40мг (0,05ммоль) соединения 27 в хлороформе прибавляют 0,02мл (0,23ммоль) морфолина и смесь кипятят с обратным холодильником в течение 2 часов. Растворитель упаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол =10/1), с получением диацетилированного соединения 30. FAB-MS (m/z): 834 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя диацетилированное соединение 30, с получением 35,5мг (31%) соединения 30. 1 Н-ЯМР (ДМСО-d6) δ: 2,07 (дд, 1H, J=5,0, 14,7 Гц), 2,16 (с, 3H), 2,45 (м, 8H), 2,77 (шир., 4H), 3,30 (м, 4H), 3,44 (дд, 1H, J=7,5, 14,7 Гц), 3,59 (м, 8H), 3,93 (с, 3H), 5,16 (м, 2H), 6,48 (с, 1H), 7,24 (дд, 1H, J=5,0, 7,5 Гц), 8,02 (дд, 1H, J=2,2, 5,5 Гц), 8,11 (дд, 1H, J=1,7, 5,8 Гц), 8,14 (дд, 1H, J=1,7, 5,8 Гц), 8,61 (д, 1H, J=1,0 Гц), 8,76 (шир., 1H), 9,96 (д, 1H, J=1,2 Гц). FAB-MS (m/z): 750 (М+1)+ Пример 29 Синтез соединения 31 К 3мл раствора 100мг (0,14ммоль) соединения 24 в хлороформе прибавляют 1мл морфолина и смесь кипятят с обратным холодильником в течение 3 часов. Растворитель упаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол =15/1), с получением диацетилированного соединения 31. FAB-MS (m/z): 806 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя диацетилированное соединение 31, с получением 27мг (26%) соединения 31. 1 Н-ЯМР (ДМСО-d6) δ: 2,06 (дд, 1H, J=5,0, 14,1 Гц), 2,62 (м, 8H), 3,45 (дд, 1H, J=7,3, 14,1 Гц), 3,63 (м, 8H), 3,91 (м, 2H), 3,98 (м, 2H), 5,13 (д, 2H, J=7,3 Гц), 6,49 (с, 1H), 7,25 (дд, 1H, J=5,0, 7,3 Гц), 8,02 (д, 1H, J=8,9 Гц), 8,13 (дд, 1H, J=1,7, 9,0 Гц), 8,15 (дд, 1H, J=1,7, 8,8 Гц), 8,62 (д, 1H, J=1,7 Гц), 8,77 (с, 1H), 8,78 (д, 1H, J=1,5 Гц), 10,01 (дд, 1H, J=0,49, 1,2 Гц). FAB-MS (m/z): 722 (М+1)+ Пример 30 Синтез соединения 32 К 3мл раствора 110мг (0,16ммоль) соединения 24 в N,N-диметилформамиде прибавляют 54мл 50%-ного водного раствора диметиламина и смесь кипятят с обратным холодильником в течение 3 часов. Растворитель упаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 10/1), с получением 13,7мг (14%) соединения 32. 1 Н-ЯМР (ДМСО-d 6) δ: 2,06 (дд, 1H, J=4,9, 14,1 Гц), 2,18 (с, 3H), 2,35 (с, 6H), 2,36 (с, 6H), 3,40 (дд, 1H, J=7,5, 14,1 Гц), 3,87 (м, 2H), 3,93 (м, 2H), 3,94 (с, 3H), 5,13 (м, 2H), 6,47 (с, 1H), 7,25 (дд, 1H, J=4,9, 7,5 Гц), 8,01 (д, 2H, J=9,0 Гц), 8,13 (дд, 1H, J=1,7, 5,6 Гц), 8,16 (дд, 1H, J=1,7, 5,4 Гц), 8,69 (д, 1H, J=1,7 Гц), 8,76 (шир., 1H), 9,97 (д, 1H, J=1,2 Гц). FAB-MS (m/z): 638 (М+1)+ Пример 31 Синтез соединений 33а и 33b К суспензии 1,06г (8,0ммоль) хлорида алюминия в 10мл метиленхлорида прибавляют 0,48мл (5,0ммоль) хлорацетилхлорида и смесь перемешивают при комнатной температуре в течение 5 минут. К смеси постепенно прибавляют раствор 551мг (1,0 ммоль) соединения с в 10мл метиленхлорида и перемешивают в течение 2,5 часа. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом (9/1). Экстракт промывают насыщенным водным раствором хлорида натрия и 63 сушат над сульфатом натрия. После выпаривания растворителя при пониженном давлении полученный порошок смешивают с 1 н. соляной кислотой. Смесь перемешивают в течение одного часа и затем нерастворимые продукты удаляют фильтрацией. Фильтрат очищают хроматографией на колонке с силикагелем (хлороформ), с получением 110мг (17%) смеси соединений 33а и 33b. Соединение 33а: FAB-MS (m/z): 628, 630 (М+1)+ Соединение 33b: FAB-MS (m/z): 628, 630 (М+1)+ Пример 32 Синтез соединения 34 К раствору 64 мг (0,1 ммоль) смеси соединений 33а и 33b в 1,5мл N,N-диметилформамида прибавляют 30 мг (0,02ммоль) йодида натрия и 1мл 50%-ного водного раствора диметиламина и смесь кипятят с обратным холодильником в течение 2 часов. Растворитель упаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 9/1), с получением 3,2г (5,8%) соединения 34. 1 H-ЯМР (CDCl3) δ: 1,73 (шир., 1H), 2,20 (с, 3H), 2,44 (с, 6H), 2,85 (дд, 1H, J=4,9, 13,7 Гц), 3,61 (дд, 1H, J=7,8, 13,7 Гц), 3,70 (м, 2H), 4,09 (с, 3H), 4,50 (д, 1H, J=16,6 Гц), 4,70 (д, 1H, J=16,6 Гц), 5,70 (шир., 1H), 6,85 (дд, 1H, J=4,9, 7,3 Гц), 7,29 (д, 1H, J=8,3 Гц), 7,39 (т, 1H, J=7,6 Гц), 7,51 (т, 1H, J=7,6 Гц), 7,83 (т, 1H, J=7,6 Гц), 7,89 (д, 1H, J=8,3 Гц), 7,90 (д, 1H, J=7,6 Гц), 9,36 (с, 1H). FAB-MS (m/z): 553 (М+1)+ Пример 33 Синтез соединения 35 К раствору 63мг (0,1ммоль) смеси соединений 33а и 33b в 2мл N,N-диметилформамида прибавляют 90мг (0,6ммоль) йодида натрия и смесь перемешивают при комнатной температуре в течение 2часов. После выпаривания растворителя при пониженном давлении остаток обрабатывают также, как в примере 1, стадия В, с получением 6,8мг (12%) соединения 35. 1 Н-ЯМР (ДМСО-d6) δ: 2,00-2,40 (м, 7Н), 2,70-2,80 (м, 4H), 3,40 (шир., 1H), 3,94 (с, 3H), 4,22 (шир., 2H), 5,02 (д, 1H, J=18,0 Гц), 5,07 (д, 1H, J=18,0 Гц), 6,42 (с, 1H), 6,90 (шир., 1H), 7,38 (т, 1H, J=7,5 Гц), 7,51 (дд, 1H, J=7,5, 8,5 Гц), 7,95 (д, 1H, J=8,5 Гц), 8,00 (д, 1H, J=8,7 Гц), 8,08 (д, 1H, J=7,5 Гц), 8,12 (дд, 1H, J=1,7, 8,7 Гц), 8,69 (с, 1H), 9,95 (д, 1H, J=1,4 Гц). FAB-MS (m/z): 579 (М+1)+ Пример 34 Синтез соединений 36а и 36b Повторяют процедуру, что и в примере 28, используя 40мг (0,064ммоль) смеси соединений 33а и 33b, с получением 17мг (40%) соединения 36а и 10мг (23%) соединения 36b. Соединение 36а: 1 H-ЯМР (CDCl3) δ: 1,80 (с, 3H), 2,18 (дд, 1H, J=5,1, 10,2 Гц), 2,29 (с, 3H), 2,77 (с, 3H), 3,07 (шир., 4H), 3,93 (шир., 4H), 4,00 (дд, 1H, J=7,5, 10,1 Гц), 4,07 (с, 3H), 4,35 (шир., 2H), 5,38 (д, 2H, J=5,4 Гц), 6,90 (м, 1H), 7,00 (дд, 1H, J=5,1, 7,5 Гц), 7,46 (тд, 1H, J=0,5, 7,5 Гц), 7,56 (д, 1H, J=8,5 Гц), 7,57 (тд, 1H, J=1,1, 7,5 Гц), 7,94 (д, 1H, J=8,5 Гц), 8,07 (д, 1H, J=7,5 Гц), 8,22 (дд, 1H, J=1,6, 7,5 Гц), 9,94 (шир., 1H). FAB-MS (m/z): 679 (М+1)+ Соединение 36b: 1 H-ЯМР (CDCl3) δ: 1,80 (с, 3H), 2,15 (дд, 1H, J=5,1, 12,2 Гц), 2,29 (с, 3H), 2,79 (с, 3H), 2,94 (шир., 4H), 3,92 (т, 4H, J=4,5 Гц), 4,09 (дд, 1H, J=7,2, 12,2 Гц), 4,02 (с, 3H), 4,35 (шир., 2H), 5,38 (шир., 2H), 7,03 (дд, 1H, J=5,1, 7,2 Гц), 7,38 (шир., 1H), 7,56 (шир., 1H), 7,95 (д, 1H, J=8,9 Гц), 8,21 (д, 1H, J=1,7, 8,9 Гц), 8,78 (шир., 1H), 9,21 (д, 1H, J=8,0 Гц). FAB-MS (m/z): 679 (М+1)+ Пример 35 Синтез соединения 37а Повторяют процедуру, что и в примере 1, стадия В, используя 17мг (0,025ммоль) соединения 36а, с получением 3,2мг (22%) соединения 37а. 1 Н-ЯМР (ДМСО-d6) δ: 2,23 (с, 3H), 2,56 (дд, 1H, J=4,5, 14,7 Гц), 2,72 (шир., 4H), 3,43 (дд, 1H, J=7,6, 14,7 Гц), 3,82 (т, 4H, J=4,6 Гц), 4,01 (шир., 1H), 4,11 (с, 3H), 4,86 (д, 1H, J=16,0 Гц), 4,95 (д, 1H, J=16,0 Гц), 5,96 (шир., 1H), 6,91 (дд, 1H, J=4,8, 7,4 Гц), 7,41 (т, 1H, J=7,6 Гц), 7,50 (д, 1H, J=7,6 Гц), 7,51 (т, 1H, J=7,6 Гц), 7,85 (д, 1Н, J=8,6 Гц), 7,92 (д, 1H, J=7,6 Гц), 8,11 (д, 1H, J=8,6 Гц), 9,81 (шир., 1H). FAB-MS (m/z): 595 (М+1)+ Пример 36 Синтез соединения 37b Повторяют процедуру, что и в примере 1, стадия В, используя 10мг (0,015ммоль) соединения 36b, с получением 1,0мг (11%) соединения 37b. 1 Н-ЯМР (ДМСО-d6) δ: 2,23 (с, 3H), 2,42 (дд, 1H, J=4,9, 14,5 Гц), 2,64 (шир., 4H), 3,35 (дд, 1H, J=7,6, 14,5 Гц), 3,80 (т, 4H, J=4,6 Гц), 3,85 (д, 2H, J=5,3 Гц), 4,12 (с, 3H), 4,29 (шир., 1H), 4,80 (д, 1H, J=16,5 Гц), 4,90 (д, 1H, J=16,5 Гц), 6,21 (шир., 1H), 6,93 (дд, 1H, J=4,9, 7,4 Гц), 7,30 (шир., 1H), 7,49 (м, 2H), 7,83 (д, 1H, J=8,9 Гц), 8,11 (д, 1H, J=8,9 Гц), 8,55 (с, 1H), 8,5 (с, 1H), 9,20 (д, J=8,1 Гц, 1H). FAB-MS (m/z): 595 (М+1)+ Пример 37 Синтез соединения 38 Повторяют процедуру, что и в примере 33, используя 162мг (0,23ммоль) соединения 24, с получением 32мг (46%) соединения 38. 1 Н-ЯМР (ДМСО-d6) δ: 1,95 (с, 3H), 2,30 (м, 9H), 2,65 (м, 8H), 3,45 (дд, 1H, J=7,1, 14,4 Гц), 3,94 (с, 3H), 4,13 (м, 4H), 5,12 (м, 2H), 6,52 (с, 1H), 7,24 (дд, 1H, J=4,9, 7,3 Гц), 8,02 (д, 2H, J=8,8 Гц), 8,29 (м, 2H), 8,72 (с, 1H), 8,76 (шир., 1H), 9,97 (с, 1H). FAB-MS (m/z): 689 (М+1)+ Пример 38 Синтез соединения 39 К раствору 211мг (0,30ммоль) соединения 24 в 2мл N,N-диметилформамида прибавляют 300мг (3,0ммоль) N-метилпиперазина и 90мг (0,6ммоль) йодида натрия и смесь перемешивают при комнатной 64 температуре в течение 2 часов. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 9/1), с получением 190мг (76%) соединения 39. FAB-MS (m/z): 832 (М+1)+ Пример 39 Синтез соединения 40 Повторяют процедуру, что и в примере 1, стадия В, используя 17мг (0,02ммоль) соединения 39, с получением 5,1мг (34%) соединения 40. 1 Н-ЯМР (ДМСО-d6) δ: 2,06 (дд, J=4,6, 14,4 Гц, 4H), 2,18 (с, 3Н), 2,30 (шир., 6H), 2,50 (шир., 8H), 2,67 (шир., 8H), 3,45 (дд, 1H, J=7,1, 14,4 Гц), 3,94 (с, 3H), 3,98 (шир., 4H), 5,13 (шир., 2H), 6,49 (с, 1H), 7,25 (дд, 1H, J=4,6, 7,1 Гц), 8,02 (д, 2H, J=8,5 Гц), 8,13 (дд, 1H, J=1,7, 6,8 Гц), 8,16 (дд, 1H, J=1,7, 6,8 Гц), 8,78 (шир., 2H), 9,99 (д, 1H, J=1,7 Гц). FAB-MS (m/z): 748 (М+1)+ Пример 40 Синтез соединения 41 К раствору 50мг (0,078ммоль) смеси соединений 33а и 33b в 2мл метиленхлорида прибавляют 66мг (0,78ммоль) этаниодида натрия и смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/этанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 99,8/0,2), с получением 17,0мг (33%) диацетилированного соединения 41. FAB-MS (m/z): 654 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 17мг (0,026ммоль) диацетилированного соединения 41, с получением 5,3мг (35%) соединения 41. 1 Н-ЯМР (ДМСО-d6) δ: 1,23 (т, 3Н, J=7,3 Гц), 2,00 (дд, 1H, J=4,7, 13,9 Гц), 2,33 (с, 3H), 2,59 (кв, 2H, J=7,3 Гц), 3,42 (дд, 1H, J=7,3, 13,9 Гц), 3,94 (с, 3H), 4,19 (д, 2H, J=3,4 Гц), 5,10 (д, 2H, J=5,1 Гц), 6,44 (шир., 1H), 7,18 (дд, 1H, J=4,9 Гц), 8,31 (т, 1H, J=8,2 Гц), 7,51 (дт, 1H, J=1,4, 8,3 Гц), 7,92 (д, 1H, J=8,2 Гц), 8,02 (д, 1H, J=9,0 Гц), 8,11 (дд, 1H, J=1,9, 9,0 Гц), 8,63 (д, 1H, J=1,4 Гц), 8,72 (шир., 1H), 9,23 (д, 1H, J=8,1 Гц). FAB-MS (m/z): 570 (М+1)+ Пример 41 Синтез соединений 42а и 42b К раствору 100мг (0,16ммоль) смеси соединений 33а и 33b в 2мл N,N-диметилформамида прибавляют 100мг (0,9ммоль) 4-меркаптопиридина и 22мг (0,16ммоль) карбоната калия и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/этанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 99,8/0,2), с получением 70мг (63%) смеси диацетилированных соединений 42а и 42b. FAB-MS (m/z): 703 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 70мг (0,10ммоль) смеси диацетилированных соединений, с получением 3,3мг (5,3%) соединения 42а и 5,2мг (8,4%) соединения 42b. Соединение 42а: 1 Н-ЯМР (ДМСО-d6) δ: 2,09 (дд, 1H, J=4,9, 13,9 Гц), 2,19 (с, 3H), 3,44 (дд, 1H, J=7,3, 13,9 Гц), 3,94 (с, 3H), 4,99 (с, 2H), 5,05 (д, 2H, J=5,9 Гц), 6,39 (с, 1H), 7,25 (дд, 1H, J=4,9, 7,3 Гц), 7,39 (т, 1H, J=8,6 Гц), 7,41 (д, 1H, J=6,4 Гц), 7,52 (т, 1H, J=8,6 Гц), 7,96 (д, 1H, J=8,6 Гц), 8,071 (д, 1H, J=8,8 Гц), 8,074 (д, 1H, J=8,6 Гц), 8,25 (дд, 1H, J=1,7, 8,8 Гц), 8,40 (д, 2H, J=6,4 Гц), 8,71 (с, 1H), 9,98 (д, 1H, J=1,0 Гц). FAB-MS (m/z): 619 (М+1)+ Соединение 42b: 1 H-ЯМР (CDCl3) δ: 2,24 (с, 3H), 2,39 (дд, 1H, J=5,1, 14,4 Гц), 3,36 (дд, 1H, J=7,3, 14,4 Гц), 4,12 (с, 3H), 4,46 (д, 2H, J=3,4 Гц), 4,83 (д, 1H, J=16,4 Гц), 4,93 (д, 1H, J=16,4 Гц), 6,15 (с, 1H), 6,93 (дд, 1H, J=4,9, 7,3 Гц), 7,117,29 (шир., 5H), 7,22-7,58 (шир., 2H), 7,86 (д, 1Н, J=8,3 Гц), 8,04 (д, 1H, J=8,3 Гц), 8,48 (д, 1H, J=2,7 Гц), 8,51 (с, 1H), 9,22 (д, 1H, J=8,3 Гц). FAB-MS (m/z): 619 (М+1)+ Пример 42 Синтез соединения 43 К раствору 211мг (0,30ммоль) соединения 24 в 4мл хлороформа/метанола (3/1) прибавляют 56г (0,80 ммоль) метантиолата натрия и смесь перемешивают при комнатной температуре в течение 30 минут. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/этанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфа том натрия. Растворитель выпаривают при пониженном давлении, с получением 125мг (57%) диацетилированного соединения 43. FAB-MS (m/z): 728 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 125мг (0,017ммоль) диацетилированного соединения 43, с получением 48 мг (44%) соединения 43. 1 Н-ЯМР (ДМСО-d 6) δ: 2,07 (дд, 1H, J=4,9, 14,4 Гц), 2,13 (с, 3H), 2,14 (с, 3H), 2,18 (с, 3H), 3,45 (дд, 1H, J=7,3, 14,4 Гц), 3,94 (с, 3H), 4,04 (с, 2H), 4,17 (д, 2H, J=2,9 Гц), 5,14 (д, 2H, J=4,6 Гц), 6,50 (шир., 1H), 7,26 (дд, 1H, J=4,9, 7,3 Гц), 8,03 (д, 1H, J=8,8 Гц), 8,04 (д, 1H, J=8,8 Гц), 8,13 (дд, 1H, J=2,0, 8,8 Гц), 8,17 (дд, 1H, J=2,0, 8,8 Гц), 8,65 (д, 1H, J=1,7 Гц), 8,78 (шир., 1H), 9,93 (д, 1H, J=1,5 Гц). FAB-MS (m/z): 644 (М+1)+ Пример 43 Синтез соединения 44 К раствору 50мг (0,07ммоль) соединения 24 в 2мл метиленхлорида прибавляют 59мг (0,07ммоль) этантиолата натрия и смесь перемешивают при комнатной температуре в течение 3 часов. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол =99,8/0,2), с получением 19,7мг (36%) диацетилированного соединения 44. 65 FAB-MS (m/z): 756 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 19мг (0,025ммоль) диацетилированного соединения 44, с получением 12,5мг (67%) соединения 44. 1 Н-ЯМР (ДМСО-d6) δ: 1,22 (т, 3H, J=7,5 Гц), 1,23 (т, 3H, J=7,5 Гц), 2,08 (дд, 1H, J=4,9, 13,9 Гц), 2,18 (с, 3H), 2,60 (шир., 4H), 3,45 (дд, 1H, J=7,3, 13,9 Гц), 3,94 (с, 3H), 4,07 (шир., 2H), 4,19 (д, 2H, J=4,2 Гц), 5,14 (шир., 2H), 6,49 (шир., 1H), 7,26 (дд, 1H, J=4,9, 7,3 Гц), 8,03 (д, 1Н, J=9,0 Гц), 8,04 (дд, 1H, J=8,8 Гц), 8,13 (дд, 1H, J=1,7, 9,0 Гц), 8,16 (дд, 1H, J=2,0, 8,8 Гц), 8,65 (д, 1H, J=1,7 Гц), 8,79 (шир., 1H), 9,94 (д, 1H, J=1,7 Гц). FAB-MS (m/z): 672 (M+1)+ Пример 44 Синтез соединения 45 К раствору 100мг (0,16ммоль) смеси соединения 24 в 3,5мл N,N-диметилформамида/метанола (6/1) прибавляют 0,038мл (0,32ммоль) пропантиола и 44мг (0,32ммоль) карбоната калия и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол =95/5), с получением 32мг (23%) соединения 45. 1 Н-ЯМР (ДМСО-d 6) δ: 0,93 (т, 3H, J=7,3 Гц), 0,94 (т, 3H, J=7,3 Гц), 1,59 (квт, 2H, J=7,2, 7,3 Гц), 1,60 (ткв, 2H, J=7,3, 7,2 Гц), 2,07 (дд, 1H, J=5,0, 13,1 Гц), 2,18 (с, 3H), 2,57 (т, 2H, J=7,2 Гц), 2,58 (т, 2H, J=7,2 Гц), 3,45 (дд, 1H, J=7,6, 13,1 Гц), 3,94 (с, 3H), 4,04 (с, 2H), 4,15 (д, 2H, J=5,1 Гц), 5,14 (д, 2H, J=8,0 Гц), 6,50 (шир., 1H), 7,26 (дд, 1H, J=5,0, 7,3 Гц), 8,03 (д, 1H, J=8,9 Гц), 8,04 (д, 1H, J=8,7 Гц), 8,12 (дд, 1H, J=1,7, 8,9 Гц), 8,16 (дд, J=1,7, 8,7 Гц), 8,65 (д, 1H, J=1,6 Гц), 8,80 (шир., 1H), 9,93 (д, 1H, J=1,6 Гц). FAB-MS (m/z): 700 (М+1)+ Пример 45 Синтез соединения 46 К раствору 70мг (0,10ммоль) соединения 24 в 3,5мл N,N-диметилформамида/метанола (6/1) прибавляют 23мг (0,30ммоль) 2 гидроксиэтантиола и 50мг (0,36ммоль) карбоната калия и смесь перемешивают при комнатной температуре в течение 1 дня. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфа том натрия. Растворитель выпаривают при пониженном давлении, с получением 40мг (51%) диацетилированного соединения 46. FAB-MS (m/z): 784 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 40мг (0,051ммоль) диацетилированного соединения 46, с получением 20мг (56%) соединения 46. 1 Н-ЯМР (ДМСО-d6) δ: 2,07 (дд, 1H, J=5,1, 14,3 Гц), 2,18 (с, 3H), 2,67 (шир., 4H), 3,45 (дд, 1H, J=7,6, 14,3 Гц), 3,59 (шир., 4H), 3,94 (с, 3H), 4,10 (с, 2H), 4,22 (д, 2H, J=5,9 Гц), 4,82 (шир., 2H), 6,50 (с, 1H), 7,26 (дд, 1H, J=5,1, 7,6 Гц), 8,04 (д, 1H, J=9,0 Гц), 8,05 (д, 1H, J=8,7 Гц), 8,13 (дд, 1H, J=1,7, 9,0 Гц), 8,16 (дд, 1H, J=1,7, 8,7 Гц), 8,65 (д, 1H, J=1,7 Гц), 8,81 (с, 1H), 9,93 (д, 1H, J=1,7 Гц). FAB-MS (m/z): 700 (М+1)+ Пример 46 Синтез соединения 47 К раствору 100мг (0,16ммоль) соединения 24 в 2мл N,N-диметилформамида прибавляют 100мг (0,9ммоль) 4-меркаптопиридина и 44мг (0,32ммоль) карбоната калия и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол =99,8/0,2), с получением 67мг (63%) соединения 47. FAB-MS (m/z): 854 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 67мг (0,10ммоль) диацетилированного соединения 47, с получением 45мг (58%) соединения 47. 1 Н-ЯМР (ДМСО-d6) δ: 2,08 (дд, 1H, J=4,8, 14,3 Гц), 2,19 (с, 3H), 3,47 (дд, 1H, J=7,5, 14,3 Гц), 3,95 (с, 3H), 4,97 (с, 2H), 5,12 (д, 2H, J=4,9 Гц), 5,18 (с, 2H), 6,53 (с, 1H), 7,30 (дд, 1H, J=4,8, 7,5 Гц), 7,37 (шир., 4H), 8,07 (д, 1H, J=9,0 Гц), 8,10 (д, 1H, J=8,7 Гц), 8,19 (дд, 1H, J=1,7, 9,0 Гц), 8,29 (дд, 1H, J=1,8, 8,7 Гц), 8,21-8,57 (шир., 4H), 8,76 (д, 1H, J=1,7 Гц), 8,86 (с, 1H), 9,99 (д, 1H, J=1,8 Гц). FAB-MS (m/z): 770 (М+1)+ Пример 47 Синтез соединения 48 К раствору 160мг (0,26ммоль) соединения 24 в 2мл N,N-диметилформамида прибавляют 290мг (2,6ммоль) 2-меркаптопиридина и 83мг (0,6ммоль) карбоната калия и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол =99,8/0,2), с получением 123мг (55%) диацетилированного соединения 48. FAB-MS (m/z): 854 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 20мг (0,023ммоль) диацетилированного соединения 48, с получением 10мг (53%) соединения 48. 1 Н-ЯМР (ДМСО-d6) δ: 2,09 (дд, 1H, J=4,8, 14,2 Гц), 2,19 (с, 3H), 3,47 (дд, 1H, J=7,3, 14,2 Гц), 3,95 (с, 3H), 4,94 (с, 2H), 5,02 (д, 2H, J=3,4 Гц), 5,10 (д, 2H, J=7,7 Гц), 6,52 (с, 1H), 7,01-7,27 (шир., 5H), 7,41 (д, 2H, J=8,0 Гц), 7,66 (дт, 2H, J=1,1, 8,0 Гц), 8,06 (д, 1H, J=8,8 Гц), 8,29 (д, 1H, J=8,8 Гц), 8,37 (ддд, 2H, J=0,8, 4,1, 8,0 Гц), 8,72 (с, 1H), 8,81 (с, 1H), 10,02 (с, 1H). FAB-MS (m/z): 770 (М+1)+ Пример 48 Синтез соединения 49 66 К раствору 140мг (0,10ммоль) соединения 24 в 3мл N,N-диметилформамида прибавляют 70мг (0,60ммоль) 2-меркаптопиридина и 50мг (0,36ммоль) карбоната калия и смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 95/5), с получением 17мг (16%) диацетилированного соединения 49 и 15мг (18%) моноацетилированного соединения 49. Диацетилированное соединение FAB-MS (m/z): 856 (М+1)+ Моноацетилированное соединение FAB-MS (m/z): 814 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 17мг (0,020ммоль) диацетилированного соединения 49, с получением 8,7мг (56%) соединения 49. 1 Н-ЯМР (ДМСО-d 6) δ: 2,09 (дд, 1H, J=4,9, 14,0 Гц), 2,19 (с, 3H), 3,30 (шир., 1H), 3,95 (с, 3H), 4,96 (с, 2H), 5,03 (с, 2H), 5,15 (д, 2H, J=2,7 Гц), 6,52 (с, 1H), 7,28-7,30 (м, 3H), 8,08 (д, 1H, J=8,8 Гц), 8,09 (д, 1H, J=8,8 Гц), 8,19 (дд, 1H, J=1,7, 8,8 Гц), 8,23 (дд, 1H, J=1,7, 8,8 Гц), 8,59 (д, 2H, J=4,9 Гц), 8,61 (д, 2H, J=4,9 Гц), 8,74 (д, 1H, J=1,7 Гц), 8,80 (шир., 1H), 10,0 (д, 1H, J=1,7 Гц). FAB-MS (m/z): 772 (М+1)+ Пример 49 Синтез соединения 50 К раствору 105мг (0,15ммоль) соединения 24 в 1,8мл N,N-диметилформамида/метанола (5/1) прибавляют 38мг (0,30ммоль) 4-гидроксимеркаптобензола и 50мг (0,36ммоль) карбоната калия и смесь перемешивают при комнатной температуре в течение 12 часов. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 9/1), с получением 76мг (63%) соединения 50. 1 Н-ЯМР (ДМСО-d6) δ: 2,08 (с, 3H), 2,09 (дд, 1H, J=2,7, 7,6 Гц), 3,45 (дд, 1H, J=7,6, 14,2 Гц), 3,94 (с, 3H), 4,44 (шир., 2H), 4,56 (д, 2H, J=5,1 Гц), 5,11 (д, 2H, J=4,4 Гц), 6,50 (с, 1H), 6,73 (тд, 4Н, J=2,2, 8,9 Гц), 7,27 (м, 3H), 8,02 (д, 1H, J=8,9 Гц), 8,04 (д, 1H, J=1,7, 8,9 Гц), 8,09 (дд, 1H, J=1,7, 5,9 Гц), 8,14 (дд, 1H, J=1,9, 8,9 Гц), 8,61 (д, 1H, J=1,7 Гц), 8,77 (с, 1H), 9,58 (с, 2H), 9,92 (д, 1H, J=1,4 Гц). FAB-MS (m/z): 800 (М+1)+ Пример 50 Синтез соединения 51 К раствору 70мг (0,10ммоль) соединения 24 в 2мл N,N-диметилформамида прибавляют 25мг (0,21ммоль) 2-меркаптотиазолина и 28мг (0,20ммоль) карбоната калия и смесь перемешивают при комнатной температуре в течение 1 часа. Смесь прибавляют к раствору метоксида натрия в метаноле и затем перемешивают в течение 30 минут. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 9/1), с получением 30мг (38%) соединения 51. 1 Н-ЯМР (ДМСО-d6) δ: 2,07 (шир., 1H), 2,18 (с, 3H), 3,48 (шир., 5H), 3,95 (с, 3H), 4,11 (т, 2H, J=8,0 Гц), 4,15 (т, 2H, J=8,0 Гц), 4,96 (с, 2H), 5,02 (с, 2H), 5,16 (д, 2H, J=2,7 Гц), 6,51 (с, 1H), 7,27 (дд, 1H, J=4,9, 7,2 Гц), 8,06 (д, 2H, J=8,8 Гц), 8,13 (дд, 1H, J=1,7, 8,8, Гц), 8,17 (дд, 1H, J=1,7, 8,8 Гц), 8,68 (д, 1H, J=1,7 Гц), 8,82 (с, 1H), 9,96 (д, 1H, J=1,7 Гц). FAB-MS (m/z): 786 (М+1)+ Пример 51 Синтез соединения 52 К раствору 160мг (0,26ммоль) соединения 24 в 2мл N,N-диметилформамида прибавляют 290мг (2,6 моль) 5-меркапто-1-метилтетразола и 83мг (0,6ммоль) карбоната калия и перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь выливают в охлажденную льдом воду и выпавший осадок удаляют фильтрацией. Фильтрат очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 9/1), с получением 50 мг (23%) диацетилированного соединения 52. FAB-MS (m/z): 864 (М+1)+ Повторяют процедуру, что и в примере 1, стадия В, используя 50мг (0,058ммоль) диацетилированного соединения 52, с получением 20мг (44%) соединения 52. 1 Н-ЯМР (ДМСО-d6) δ: 2,10 (дд, 1Н, J=4,8, 14,2 Гц), 2,19 (с, 3H), 3,47 (дд, 1H, J=7,5, 14,2 Гц), 3,95 (с, 3H), 4,05 (с, 6H), 5,20 (с, 2H), 5 ,24 (с, 2H), 5,33 (с, 2H), 6,54 (с, 1H), 7,30 (дд, 1H, J=4 ,8, 7,5 Гц), 8,08 (д, 1H, J=9,0 Гц), 8,10 (д, 1H, J=9,0 Гц), 8,16 (д, 1H, J=9,0 Гц), 8,21 (д, 1H, J=9,0 Гц), 8,72 (с, 1H), 8,84 (с, 1H), 9,98 (с, 1H). FAB-MS (m/z): 780 (М+1)+ Пример 52 Синтез соединения 53 К раствору 211мг (0,30ммоль) соединения 27 в 5мл хлороформа/метанола (1/1) прибавляют 56мг (0,80ммоль) метантиолата натрия и смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфа том натрия. Растворитель выпаривают при пониженном давлении, с получением 52мг (26%) соединения 53. 1 Н-ЯМР (ДМСО-d 6) δ: 2,07 (дд, 1H, J=4,9, 14,1 Гц), 2,16 (с, 3H), 2,17 (с, 3H), 2,18 (с, 3H), 2,87 (дд, 1H, J=7,4, 14,1 Гц), 2,88 (т, 2Н, J=7,1 Гц), 2,89 (т, 2H, J=7,1 Гц), 3,44 (т, 2H J=7,1 Гц), 3,53 (т, 2Н, J=7,1 Гц), 3,94 (с, 3H), 5,16 (д, 2Н, J=3,9 Гц), 6,49 (с, 1H), 7,25 (дд, 1H, J=4,9, 7,4 Гц), 8,03 (д, 1H, J=9,0 Гц), 8,04 (д, 1H, J=8,8 Гц), 8,12 (дд, 1H, J=1,7, 9,0 Гц), 8,14 (дд, 1H, J=1,7, 8,8 Гц), 8,61 (д, 1H, J=1,7 Гц), 8,77 (шир., 1H), 9,96 (д, 1H, J=1,5 Гц). FAB-MS (m/z): 672 (М+1)+ Пример 53 Синтез соединения 54 К раствору 110мг (0,2ммоль) соединения с в 5мл метиленхлорида прибавляют 0,16мл (2ммоль) акрилоилхлорида и перемешивают при комнатной температуре в течение 5 минут. К смеси постепенно 67 прибавляют 0,40г (3ммоль) алюминийхлорида и затем перемешивают в течение 2,5 часа. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфа том натрия. Растворитель выпаривают при пониженном давлении, с получением диацетилированного соединения 54. Повторяют процедуру, что и в примере 1, стадия В, используя диацетилированное соединение 54, с получением 32мг (25%) соединения 54. 1 Н-ЯМР (ДМСО-d6) δ: 2,07 (дд, 1H, J=4,9, 14,4 Гц), 2,17 (с, 3H), 2,50 (с, 6H), 3,37 (т, 2H, J=6,2 Гц), 3,45 (шир., 1H), 3,46 (т, 2H, J=6,2 Гц), 3,80 (дт, 4H, J=1,2, 6,2 Гц), 3,94 (с, 3H), 5,16 (д, 2H, J=3,9 Гц), 6,49 (с, 1H), 7,25 (дд, 1H, J=4,9, 7,2 Гц), 8,03 (дд, 2H, J=1,9, 9,0 Гц), 8,11 (дд, 1H, J=1,5, 9,0 Гц), 8,13 (дд, 1H, J=1,5, 9,0 Гц), 8,62 (д, 1Н, J=1,6 Гц), 8,77 (шир., 1H), 9,96 (д, 1Н, J=1,7 Гц). FAB-MS (m/z): 640 (М+1)+ Пример 54 Синтез соединения 55 К раствору 126мг (0,2 ммоль) соединения А в 5мл метиленхлорида прибавляют 0,21мл (2,0ммоль) нбутирилхлорида и перемешивают при комнатной температуре в течение 5 минут. К смеси постепенно прибавляют 0,40г (3ммоль) алюминийхлорида и затем перемешивают в течение 2,5 часа. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфа том натрия. Растворитель выпаривают при пониженном давлении, с получением диацетилированного соединения 55. Повторяют процедуру, что и в примере 1, стадия В, используя диацетилированное соединение, с получением 21мг (25%) соединения 55. 1 Н-ЯМР (ДМСО-d6) δ: 1,01 (т, 2H, J=7,3 Гц), 1,74 (ткв, 2H, J=7,1, 7,3 Гц), 2,01 (дд, 1Н, J=4,9, 14,2 Гц), 2,17 (с, 3H), 2,19 (т, 2H, J=7,1 Гц), 3,41 (дд, 1H, J=7,3, 14,2 Гц), 3,93 (с, 3H), 5,13 (д, 2H, J=3,9 Гц), 6,45 (с, 1H), 7,19 (дд, 1H, J=4,9, 7,3 Гц), 7,64 (дд, 1H, J=2,0, 8,8 Гц), 7,95 (д, 1H, J=8,8 Гц), 8,02 (д, 1H, J=9,0 Гц), 8,12 (дд, 1H, J=1,7, 9,0 Гц), 8,59 (д, 1H, J=1,5 Гц), 8,78 (с, 1H), 9,41 (д, 1Н, J=1,7 Гц). FAB-MS (m/z): 616, 618 (М+1)+ Пример 55 Синтез соединения 56 К раствору 82мг (0,15ммоль) соединения с в 2мл метиленхлорида прибавляют 0,18мл (1,5ммоль) валероилхлорида и перемешивают при комнатной температуре в течение 5 минут. К смеси постепенно прибавляют 0,27г (2,0ммоль) алюминийхлорида и затем перемешивают в течение 3 часов. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 99/1), с получением 59мг (45%) соединения 56. 1 H-ЯМР (CDCl3) δ: 1,01 (т, 3Н, J=7,6 Гц), 1,02 (т, 3H, J=7,6 Гц), 1,51 (шир., 4H), 1,80 (с, 3H), 1,82 (шир., 4H), 2,17 (дд, 1H, J=5,1, 14,7 Гц), 2,31 (с, 3H), 2,77 (с, 3H), 3,15 (шир., 4H), 4,02 (дд, 1H, J=7,4, 14,7 Гц), 4,03 (с, 3H), 5,38 (д, 2H, J=2,32 Гц), 6,99 (дд, 1H, J=5,1, 7,4 Гц), 7,52 (д, 1H, J=8,7 Гц), 7,96 (д, 1H, J=8,8 Гц), 8,18 (дд, 1H, J=1,7, 8,7 Гц), 8,19 (дд, 1H, J=1,8, 8,8 Гц), 8,57 (д, 1H, J=1,5 Гц), 9,82 (д, 1H, J=1,6 Гц). FAB-MS (m/z): 720 (М+1)+ Пример 56 Синтез соединения 57 К раствору 127мг (0,2ммоль) соединения g в 3,0мл хлороформа прибавляют 48мг (0,1ммоль) тетрабутиламмоний бромида и 1мл метанола и кипятят с обратным холодильником в течение 5 часов. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом (9/1). Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 99/1), с получением 21мг (13%) соединения 57. 1 H-ЯМР (CDCl3) δ: 1,82 (с, 3H), 2,18 (дд, 1H, J=5,1, 14,5 Гц), 2,33 (с, 3H), 2,77 (с, 3H), 4,04 (с, 3H), 4,05 (дд, 1H, J=7,3, 14,5 Гц), 4,62 (д, 2H, J=4,9 Гц), 4,76 (д, 2H, J=1,0 Гц), 5,41 (д, 2H, J=1,5 Гц), 7,02 (дд, 1H, J=5,1, 7,3 Гц), 7,58 (д, 1H, J=8,8 Гц), 8,01 (д, 1H, J=8,8 Гц), 8,23 (дд, 1H, J=1,7, 8,8 Гц), 8,25 (дд, 1H, J=1,7, 8,8 Гц), 8,64 (д, 1H, J=1,7 Гц), 9,88 (д, 1H, J=1,7 Гц). FAB-MS (m/z): 794, 796, 798 (М+1)+ Пример 57 Синтез соединения 58 К раствору 105мг (0,18 ммоль) соединения d в 3мл метанола/хлороформа (1/1) прибавляют 6,8мг (0,18ммоль) боргидрида натрия и затем перемешивают при охлаждении льдом в течение 30 минут. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом (9/1). Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 99/1), с получением 85мг (81%) соединения 58. FAB-MS (m/z): 596 (М+1)+ Пример 58 Синтез соединения 59 Повторяют процедуру, что и в примере 1, стадия В, используя продукт, полученный повторением процедуры по примеру 57 с использованием 73мг (0,1ммоль) соединения 27, с получением 37мг (65%) соединения 59. 1 Н-ЯМР (ДМСО-d6) δ: 1,98 (шир., 1H), 2,10 (шир., 2H), 2,14 (с, 3H), 2,22 (шир., 2H), 3,37 (дд, 1H, J=7,3, 13,9 Гц), 3,65 (шир., 2H), 3,80 (шир., 2H), 3,93 (с, 3H), 4,85 (шир., 2H), 5,10 (шир., 2H), 5,43 (шир., 1H), 5,48 (шир., 1H), 6,31 (с, 1H), 7,12 (дд, 1H, J=6,8, 7,3 Гц), 7,48 (шир., 2H), 7,85 (шир., 2H), 7,96 (д, 0,5H, J=1,5 Гц), 7,97 (д, 0,5Н, J=1,5 Гц), 8,59 (с, 1H), 9,16 (д, 0,5Н, J=1,5 Гц), 9,19 (д, 0,5Н, J=1,5 Гц). FAB-MS (m/z): 652 (М+1)+ Пример 59 Синтез соединения 60 Повторяют процедуру, что и в примере 57, используя 100мг (0,12ммоль) соединения 40, с получением 47 мг (51%) соединения 60. FAB-MS (m/z): 640 (М+1)+ Пример 60 Синтез соединения 61 68 Повторяют процедуру, что и в примере 20, используя 68мг (0,10ммоль) соединения Н, с получением 8,7мг (16%) соединения 61. 1 Н-ЯМР (ДМСО-d6) δ: 2,18 (с, 3H), 2,46 (с, 6H), 2,83 (дд, 1Н, J=4,9, 14,4 Гц), 3,52 (дд, 1H, J=7,3, 14,4 Гц), 3,56 (с, 2H), 4,08 (с, 3H), 4,71 (д, 1H, J=15,9 Гц), 4,80 (д, 1H, J=15,9 Гц), 4,90 (шир., 1H), 5,46 (шир., 1H), 6,80 (дд, 1H, J=4,9, 7,3 Гц), 7,24 (д, 1H, J=8,3 Гц), 7,41 (шир., 2H), 7,53 (дт, 1H, J=1,1, 7,1 Гц), 7,93 (шир., 2H), 9,06 (с, 1H). FAB-MS (m/z): 549 (М+1)+ Пример 61 Синтез соединения 62 В 30мл двугорлую колбу помещают 12,6мг (0,018ммоль) бистрифенилфосфинпалладий (II) хлорида и 4,2мг (0,022ммоль) CuI и воздух вытесняют аргоном. К смеси прибавляют раствор 40мг (0,059ммоль) соединения I в 3мл метиленхлорида/диэтиламина (2/1) и затем перемешивают при комнатной температуре в течение 20 минут. К смеси прибавляют 0,16мл (1,5ммоль) N-метил-N-пропаргилбензиламина и затем перемешивают при комнатной температуре в течение 3 часов. После удаления нерастворимых продуктов фильтрацией фильтрат упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (метанол/хлороформ =1/25), с получением 12,3 мг (Z-форма, 30%) соединения 62. 1 Н-ЯМР (ДМСО-d6) δ: 2,02 (дд, 1H, J=4,9, 13,7 Гц), 2,14 (с, 3H), 2,34 (с, 3H), 3,28 (д, 2H, J=9,5 Гц), 3,40 (дд, 1H, J=7,3, 13,7 Гц), 3,57 (с, 2H), 3,66 (с, 2H), 3,93 (с, 3H), 5,05 (д, 1H, J=18,2 Гц), 5,10 (д, 1H, J=18,2 Гц), 6,42 (с, 1H), 7,17 (дд, 1H, J=4,9, 7,3 Гц), 7,29 (шир., 1H), 7,37 (шир., 4H), 7,58 (д, 1H, J=1,5, 8,8 Гц), 7,63 (д, 1H, J=2,2, 8,8 Гц), 7,94 (д, 2H, J=8,8 Гц), 8,11 (д, 1H, J=1,5 Гц), 8,74 (с, 1H), 9,40 (д, 1H, J=2,2 Гц). FAB-MS (m/z): 704, 706 (М+1)+ Пример 62 Синтез соединения 63 К раствору 71,4мг (0,1ммоль) диацетилированного соединения 20 в 3мл метанола прибавляют 25мг 10% Pd/C и затем кипятят в атмосфере водорода в течение 1 часа. Нерастворимые продукты удаляют фильтрацией и фильтрат упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (хлороформ), с получением 23,0мг (Z-форма, 33%) соединения 63. FAB-MS (m/z): 718 (М+1)+ Пример 63 Синтез соединения 64 Повторяют процедуру, что и в примере 1, стадия В, используя 23мг (0,033ммоль) соединения 63, с получением 8,7мг (41%) соединения 64. 1 H-ЯМР (CD3OD) δ: 2,11 (дд, 1H, J=5,0, 14,1 Гц), 2,21 (с, 3H), 2,34 (с, 6H), 2,44 (с, 6H), 3,43 (дд, 1H, J=7,7, 14,4 Гц), 3,55 (дд, 2H, J=1,5, 6,5 Гц), 3,67 (дд, 2H, J=1,5, 6,5 Гц), 4,02 (с, 3H), 5,03 (д, 2H, J=5,8 Гц), 5,74 (дт, 1Н, J=6,5, 11,7 Гц), 5,80 (с, 1H), 6,87 (д, 1H, J=11,7 Гц), 6,88 (д, 1Н, J=11,7 Гц), 7,05 (дд, 1H, J=5,0, 7,7 Гц), 7,20-7,58 (м, 2H), 7,68 (д, 1H, J=8,4 Гц), 7,86 (с, 1H), 7,95 (д, 1Н, J=8,8 Гц), 9,16 (с, 1H). FAB-MS (m/z): 634 (М+1)+ Пример 64 Синтез соединения 65 К раствору 1,16г (0,64ммоль) соединения е в 100мл ацетонитрила прибавляют 823мг (2,4ммоль) гидробромида трифенилфосфина и затем перемешивают при 80°С в течение 1 часа. К смеси прибавляют этилацетат и выпавшую фосфониевую соль собирают фильтрацией и суша т при пониженном давлении, с получением 1,22г (67%) сырой фосфониевой соли. К раствору 91мг (0,1ммоль) фосфониевой соли в 3мл метиленхлорида прибавляют 16,5мг (1,3ммоль) карбоната калия и 3,0мг (0,011ммоль) 18-краун-6 и затем перемешивают при комнатной температуре в течение 30 минут. К смеси прибавляют 2,3мл (5,0 ммоль) пропиональдегида и затем перемешивают при комнатной температуре в течение 4 дней. Реакционную смесь выливают в насыщенный водный раствор хлорида аммония и затем экстрагируют хлороформом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 200/1), с получением 22,6мг (E/Z = 1/1, 37%) соединения 65. FAB-MS (m/z): 606 (М+1)+ Пример 65 Синтез соединения 66 Повторяют процедуру, что и в примере 1, стадия В, используя 22,6мг (0,037ммоль) соединения 65, с получением 13,1мг (E/Z = 1/1, 68%) соединения 66. FAB-MS (m/z): 522 (М+1)+ Пример 66 Синтез соединения 67 Повторяют процедуру, что и в примере 64, используя 450мг (0,64ммоль) соединения K, с получением 367мг (E/Z = 1/1, 78%) соединения 67. FAB-MS (m/z): 732 (М+1)+ Пример 67 Синтез соединения 68 К раствору 120мг (0,02ммоль) соединения f в 100мл ацетонитрила прибавляют 823мг (2,4ммоль) гидробромида трифенилфосфина и затем перемешивают при 80°С в течение 1 часа. К смеси прибавляют этилацетат и выпавшую фосфониевую соль собирают фильтрацией и суша т при пониженном давлении, с получением сырой фосфониевой соли. К раствору фосфониевой соли в 3мл метиленхлорида прибавляют 26 мг (0,2ммоль) трет-бутоксида калия и 6,0мг (0,022ммоль) 18-краун-6 и затем перемешивают при комнатной температуре в течение 30 минут. К смеси прибавляют 0,12мл (0,25ммоль) пропиональдегида и затем перемешивают при комнатной температуре в течение 4 дней. Реакционную смесь выливают в насыщенный водный раствор хлорида аммония и затем экстрагируют хлороформом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. Растворитель выпаривают при пониженном давлении, с получением диацетилированного соединения 68. Повторяют процедуру, что и в примере 1, стадия В, используя диацетилированное соединение, с получением 17,0мг (смесь Е и Z, 13%) соединения 68. FAB-MS (m/z): 576 (М+1)+ Пример 68 Синтез соединения 69 69 К раствору 211мг (0,3ммоль) соединения 24 в 2мл трифторуксусной кислоты прибавляют 0,19мл (1,5ммоль) триэтилсилана и затем перемешивают при охлаждении льдом в течение 2 часов. Реакционную смесь выливают в охлажденную льдом воду и выпавший осадок собирают фильтрацией и промывают гексаном. Продукт очищают хроматографией на колонке с силикагелем (хлороформ), с получением 150мг (73%) диацетилированного соединения 69. Повторяют процедуру, что и в примере 1, стадия В, используя 68 мг (0,1ммоль) диацетилированного соединения 69, с получением 48мг (81%) соединения 69. 1 Н-ЯМР (ДМСО-d6) δ: 1,98 (дд, 1H, J=3,8, 5,5 Гц), 2,13 (с, 3H), 3,24 (м, 5H), 3,92 (с, 3H), 3,93 (т, 2H, J=7,2 Гц), 3,97 (т, 2H, 7,5 Гц), 5,01 (шир., 2H), 6,30 (с, 1H), 7 ,11 (дд, 1H, J=3,8, 7,2 Гц), 7,40 (дд, 1H, J=1,5, 8,3 Гц), 7,42 (дд, 1H, J=1,5, 8,3 Гц), 7,84 (д, 1H, J=8,3 Гц), 7,86 (д, 1H, 8,3 Гц), 7,97 (д, 1H, J=1,2 Гц), 8,63 (шир., 1H), 9,08 (д, 1H, J=1,2 Гц). FAB-MS (m/z): 592, 594, 596 (М+1)+ Пример 69 Синтез соединений 70а, 70b и 70с К раствору 679мг (1,2ммоль) соединения 69 в 10мл N,N-диметилформамида прибавляют 380мг (23 ммоль) йодида калия и смесь перемешивают при 90°С в течение 3 часов. Реакционную смесь выливают в охлажденную льдом воду, затем экстрагируют хлороформом/метанолом (9/1). Экстракт промывают насыщенным водным раствором хлорида натрия и затем суша т над сульфатом натрия. После выпаривания при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ), с получением 300мг (67%) соединения 70а, 89мг (15%) соединения 70b и 42 мг (5%) соединения 70с. Соединение 70а: 1 H-ЯМР (CDCl3) δ: 2,20 (с, 3H), 2,47 (дд, 1H, J=4,8, 8,3 Гц), 3,40 (шир., 9H), 4 ,10 (с, 3H), 4,26 (шир., 1H), 4,86 (д, 1H, J=16,7 Гц), 4,93 (д, 1H, J=16,7 Гц), 5,91 (шир., 1H), 6,85 (дд, 1H, J=4,8, 7,5 Гц), 7,28 (шир., 2H), 7,37 (д, 1Н, J=8,3 Гц), 7,72 (шир., 1H), 7,78 (д, 1H, J=8,6 Гц), 8,97 (шир., 1H). FAB-MS (m/z): 776 (M+1)+ Соединение 70b: 1 Н-ЯМР (ДМСО-d6) δ: 2,20 (с, 3H), 2,43 (дд, 1H, J=4,8, 14,3 Гц), 3,17 (т, 2H, J=7,1 Гц), 3,21 (т, 2H, J=7,1 Гц), 3,32 (дд, 1H, J=7,4, 14,3 Гц), 4,00 (с, 3H), 4,23 (шир., 1H), 4,50 (шир., 4H), 4,84 (д, 1H, J=15,9 Гц), 4,93 (д, 1H, J=15,9 Гц), 6,00 (шир., 1H), 6,87 (дд, 1H, J=4,8, 7,4 Гц), 7,32 (дд, 1H, J=1,7, 8,3 Гц), 7,34 (дд, 1H, J=1,7, 8,4 Гц), 7,39 (д, 1H, J=8,3 Гц), 7,72 (с, 1H), 7,76 (д, 1H, J=8,4 Гц), 8,08 (с, 1H), 8,09 (с, 1H), 9,04 (шир., 1H). FAB-MS (m/z): 612 (М+1)+ Соединение 70с: 1 H-ЯМР (CDCl3) δ: 1,95 (дд, 1H, J=4,8, 14,0 Гц), 2,13 (с, 3H), 2,92 (т, 2H, J=7,1 Гц), 3,16 (т, 2H, J=7,1 Гц), 3,34 (дд, 1H, J=7,4, 14,0 Гц), 3,70 (м, 4H), 3,92 (с, 3H), 4,67 (т, 2H, J=5,3 Гц), 4,99 (д, 1H, J=5,8 Гц), 6,28 (шир., 1H), 7,08 (дд, 1H, J=4,8, 7,4 Гц), 7,32 (дд, 1H, J=1,7, 8,4 Гц), 7,34 (дд, 1H, J=1,7, 8,4 Гц), 7,78 (д, 1H, J=8,4 Гц), 7,82 (д, 1H, J=8,4 Гц), 8,59 (с, 1H), 9,03 (шир., 1H). FAB-MS (m/z): 556 (М+1)+ Пример 70 Синтез соединения 71 К раствору 55мг (0,1ммоль) соединения 70с в 5мл метиленхлорида прибавляют 0,5мл триэтиламина и 71мг (0,4ммоль) гидрохлорида изоникотиноилхлорида и затем перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выливают в охлажденную льдом 1 н. соляную кислоту, затем экстрагируют хлороформом/метанолом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над суль фатом натрия. После выпаривания при пониженном давлении остаток очищают хроматографией на колонке с силикагелем (хлороформ/метанол = 20/1), с получением 32мг (42%) соединения 71. 1 H-ЯМР (CDCl3) δ: 1,97 (дд, 1Н, J=4,9, 13,9 Гц), 2,12 (с, 3H), 3,30 (шир., 5H), 3,91 (с, 3H), 4,58 (дт, 2H, J=2,2, 6,7 Гц), 4,65 (т, 2H, J=6,7 Гц), 4,97 (шир., 2H), 6,29 (с, 1H), 7,09 (дд, 1Н, J=4,9, 7,1 Гц), 7,45 (д, 2H, J=8,6 Гц), 7,85 (шир., 5H), 8,66 (с, 1H), 8,77 (д, 4Н, J=6,1 Гц), 8,81 (д, 4H, J=6,1 Гц), 9,01 (д, 1H, J=1,5 Гц). FAB-MS (m/z): 766 (М+1)+ Пример 71 Синтез соединений 72а и 72b Повторяют процедуру, что и в примере 23, используя 110мг (0,2ммоль) соединения с и 0,32мл (2,0ммоль) метилоксалилхлорида, с получением продукта. Повторяют процедуру, что и в примере 68, используя полученный продукт, с получением 12,2мг (11%) соединения 72а и 37,2мг (31%) соединения 72b. Соединение 72а: 1 H-ЯМР (CDCl3) δ: 2,16 (с, 3H), 2,72 (дд, 1H, J=4,8, 14,4 Гц), 3,43 (дд, 1H, J=7,6, 14,4 Гц), 3,77 (с, 3H), 3,78 (с, 2H), 4,09 (с, 3H), 4,64 (д, 1Н, J=16,3 Гц), 4,75 (д, 1Н, J=16,3 Гц), 4,85 (шир., 1H), 5,54 (шир., 1H), 6,80 (дд, 1Н, J=4,8, 7,6 Гц), 7,36 (д, 1Н, J=7,3 Гц), 7,39 (дт, 1Н, J=0,8, 7,3 Гц), 7,50 (с, 2H), 7,88 (д, 1Н, J=7,3 Гц), 7,91 (д, 1Н, J=8,3 Гц), 8,82 (шир., 1H). FAB-MS (m/z): 540 (М+1)+ Соединение 72b: 1 H-ЯМР (CDCl3) δ: 2,00 (дд, 1H, J=4,7, 14,0 Гц), 2,15 (с, 3H), 3,30 (с, 1H), 3,65 (с, 6H), 3,84 (с, 2H), 3,90 (с, 2H), 3,93 (с, 3H), 5,00 (д, 2H, J=5,4 Гц), 6,33 (с, 1H), 7,12 (дд, 1H, J=4,7, 7,1 Гц), 7,36 (д, 1H, J=7,3 Гц), 7,85 (д, 1H, J=7,3 Гц), 7,94 (д, 1Н, J=7,3 Гц), 7,95 (с, 1Н), 8,05 (д, 1Н, J=7,3 Гц), 8,62 (шир., 1Н), 9,08 (с, 1Н). FAB-MS (m/z): 612 (М+1)+ Пример 72 Синтез соединений 73а, 73b и 73с Повторяют процедуру, что и в примерах 68 и 69, используя 141мг (0,2ммоль) соединения 27, с получением 56мг (67%) соединения 73а, 3,0мг (2,4%) соединения 73b и 27 мг (23%) соединения 73с. Соединение 73а: FAB-MS (m/z): 804 (М+1)+ Соединение 73b: 1 H-ЯМР (CDCl3) δ: 2,10-2,18 (м, 4H), 2,21 (с, 3H), 2,29 (дд, 1H, J=4,9, 14,3 Гц), 2,92 (т, 2H, J=7,4 Гц), 2,94 (т, 2H, J=7,4 Гц), 3,27 (дд, 1H, J=7,5, 14,3 Гц), 4,24 (с, 3H), 4,26 (т, 2H, J=7,4 Гц), 4,28 (т, 2H, J=7,4 Гц), 5,02 (д, 2H,
ДивитисяДодаткова інформація
Назва патенту англійськоюК-252а derivatives and a method for improvement of functioning and cell survival enhancement
Автори англійськоюHudkins Robert L.
Назва патенту російськоюПроизводные к-252а и способ улучшения функционирования и повышения выживания клетки
Автори російськоюХадкинз Роберт Л.
МПК / Мітки
МПК: A61P 25/00, A61P 25/28, A61P 9/10, A61P 25/16, C07D 498/22, A61P 43/00, A61K 31/00, A61K 31/55, A61K 31/553, A61P 25/08, A61P 25/02, A61P 25/14, A61P 9/00
Мітки: похідні, виживання, підвищення, спосіб, функціонування, к-252а, покращення, клітині
Код посилання
<a href="https://ua.patents.su/47-67725-pokhidni-k-252a-ta-sposib-pokrashhennya-funkcionuvannya-ta-pidvishhennya-vizhivannya-klitini.html" target="_blank" rel="follow" title="База патентів України">Похідні к-252а та спосіб покращення функціонування та підвищення виживання клітини</a>
Попередній патент: Ранозагоювальний препарат “флотоксан” та спосіб його одержання
Наступний патент: Спосіб виготовлення ніобій-титанового надпровідника
Випадковий патент: Сепаратор зернового вороху












