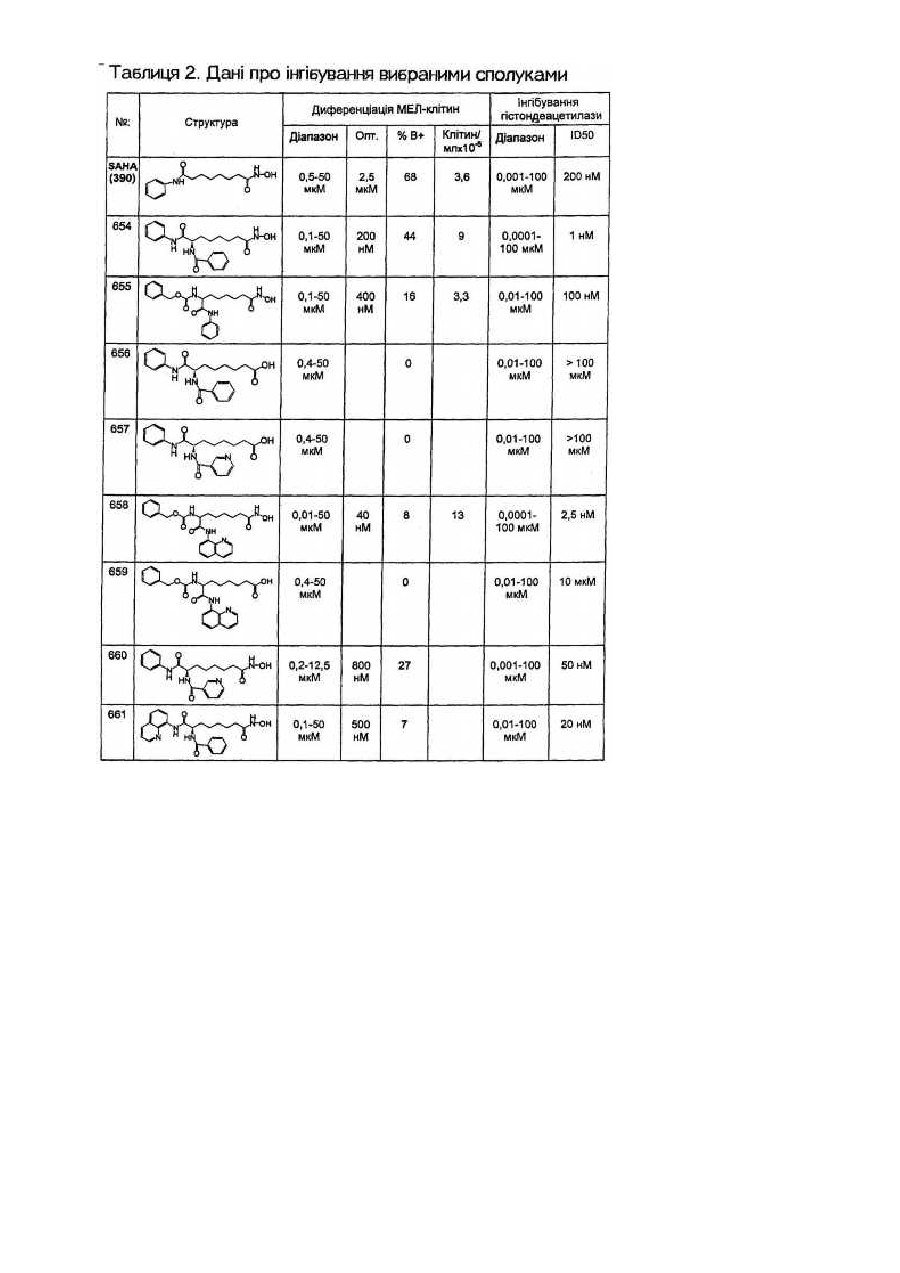
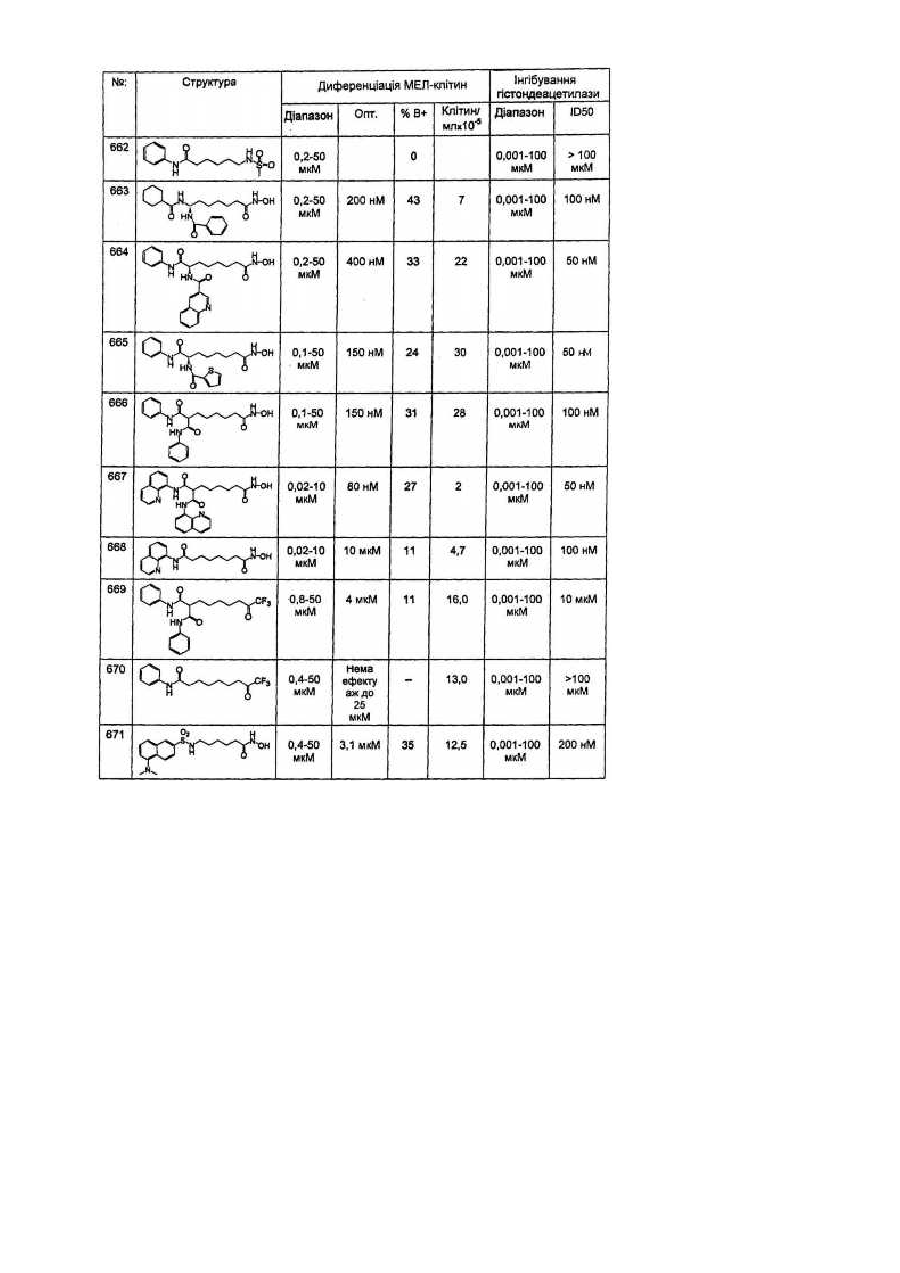
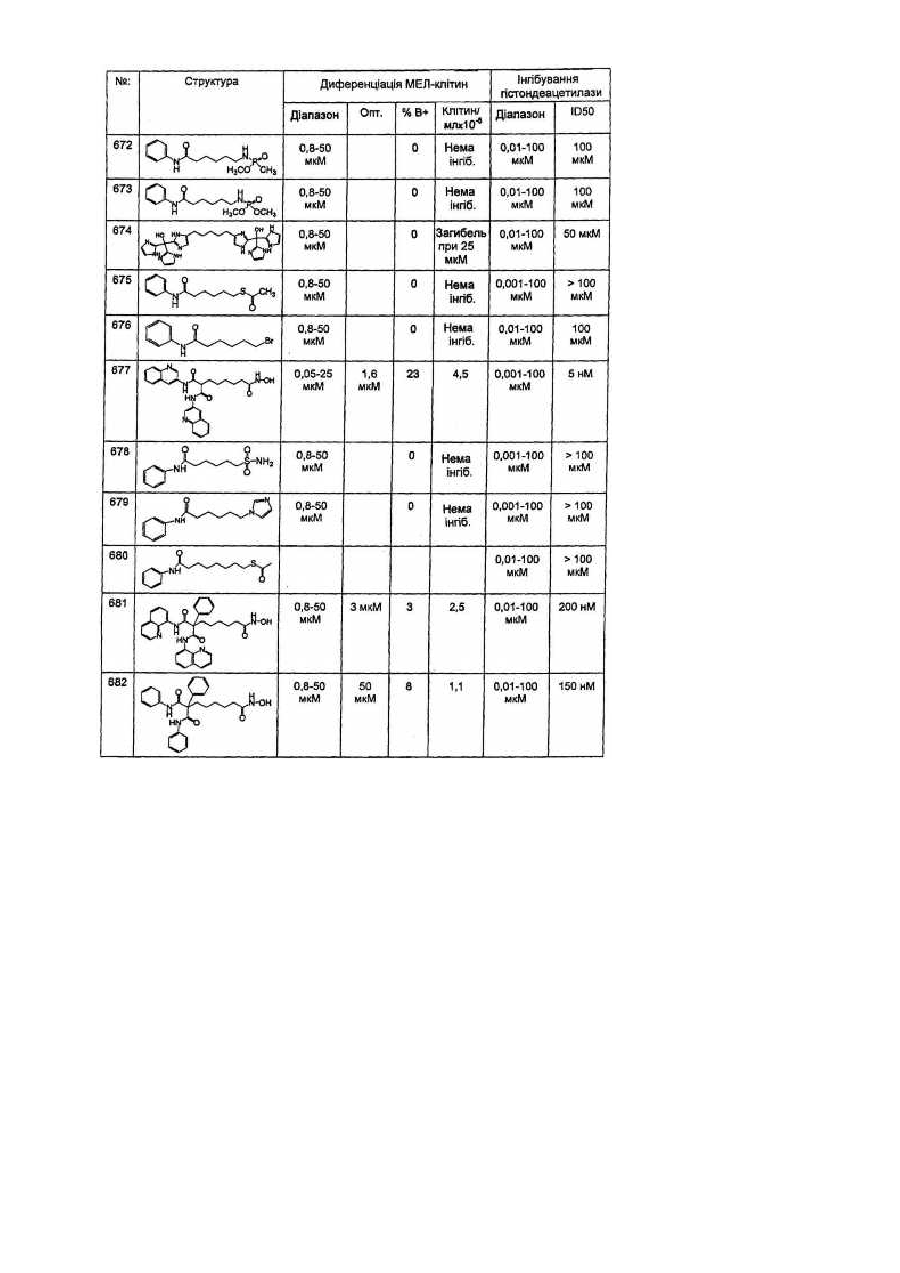
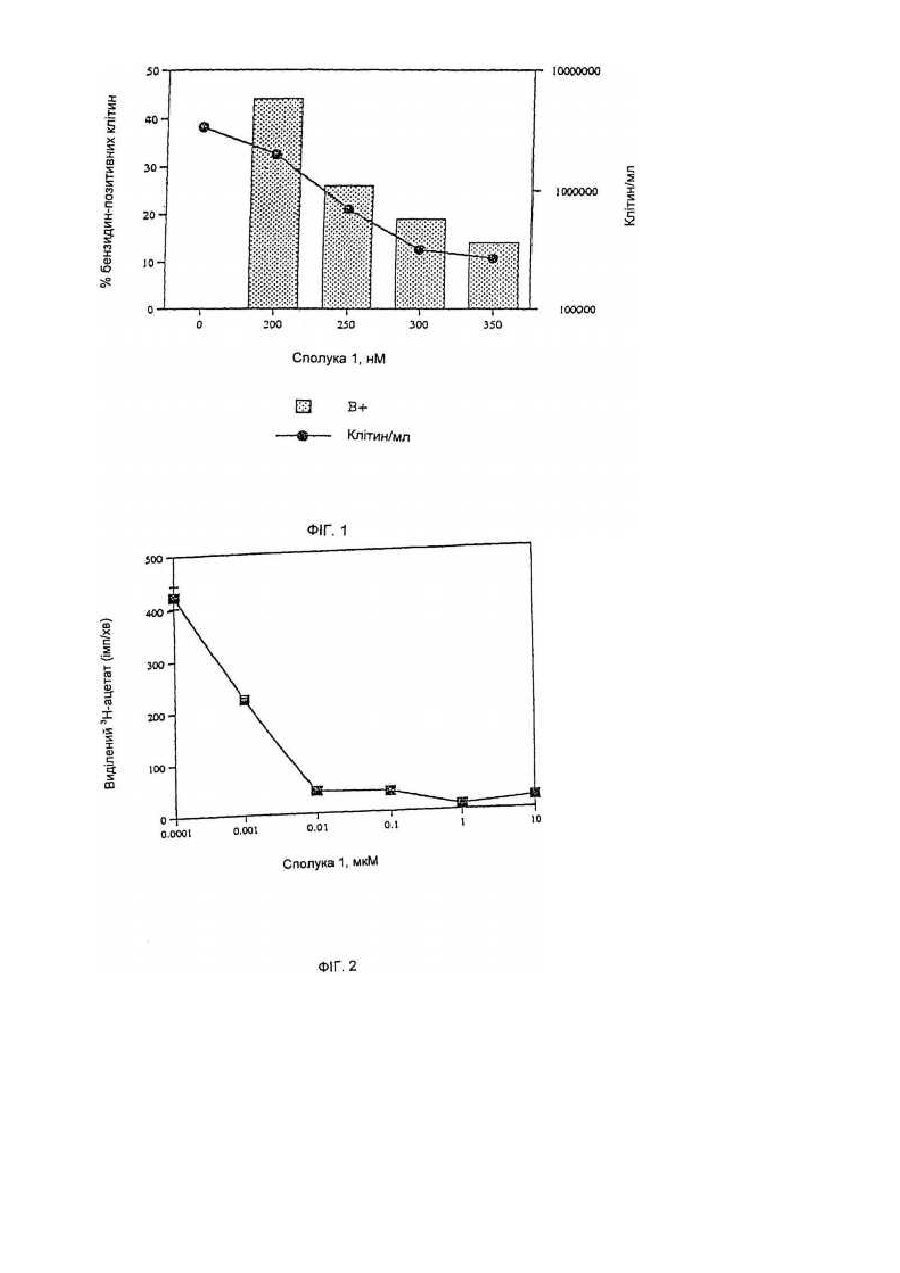
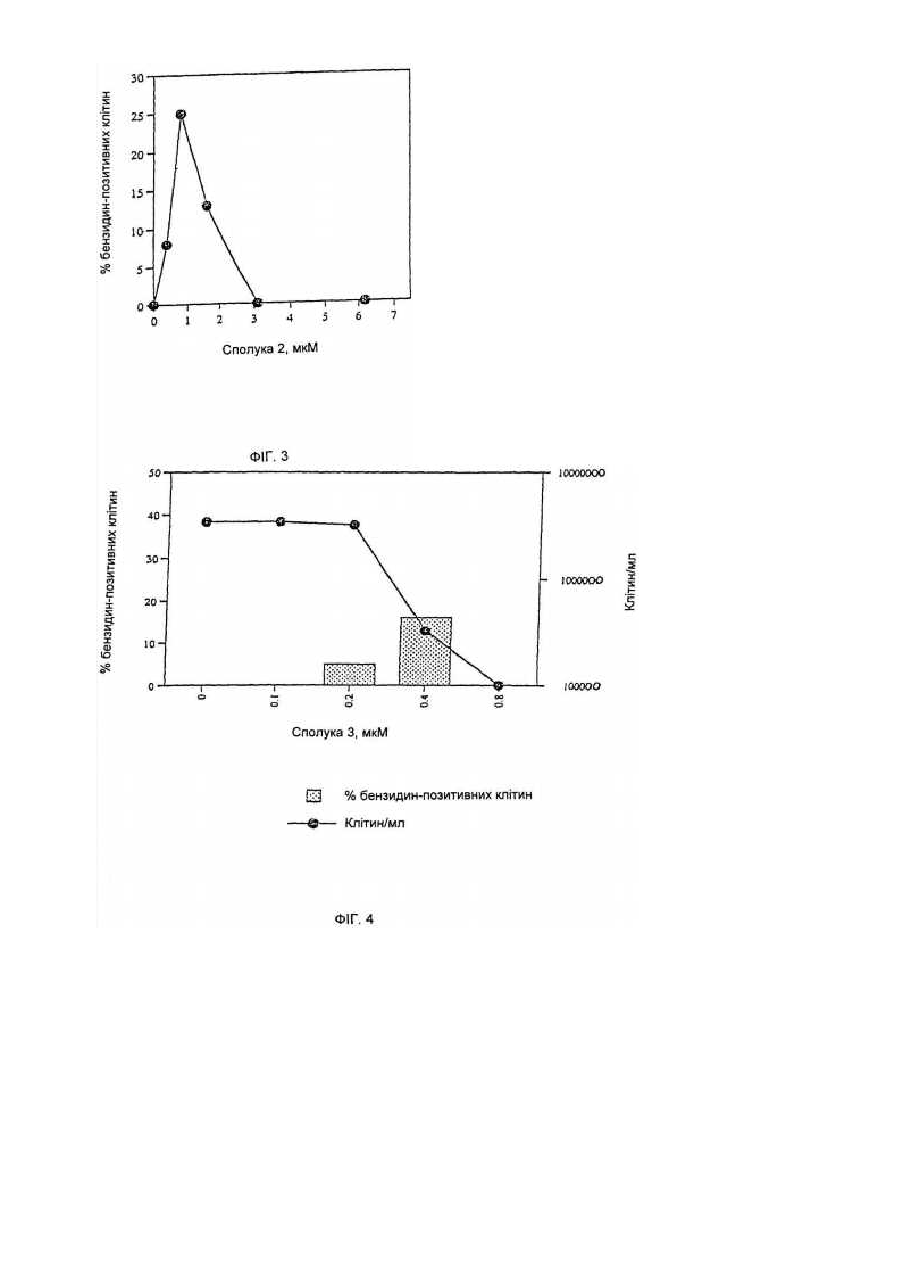
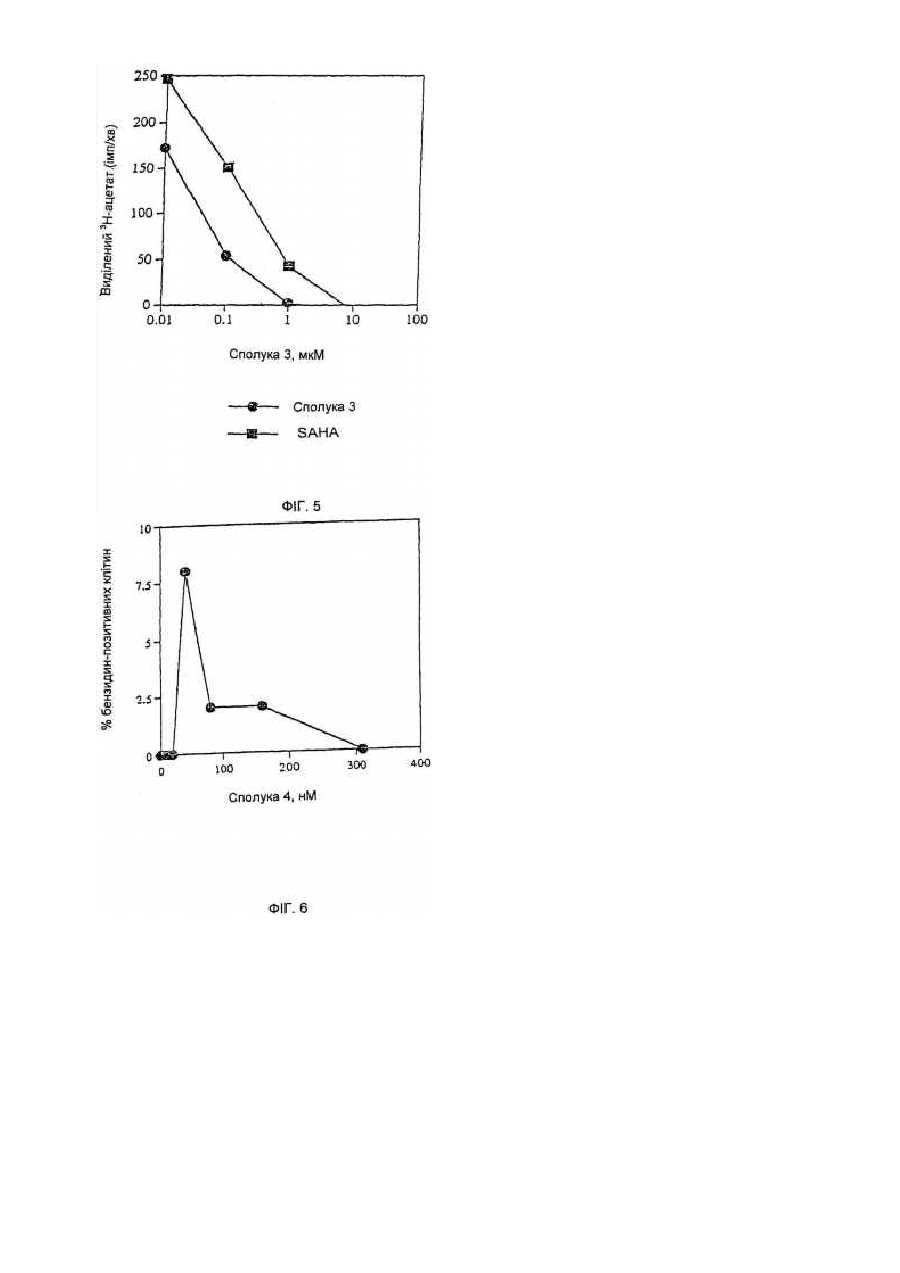
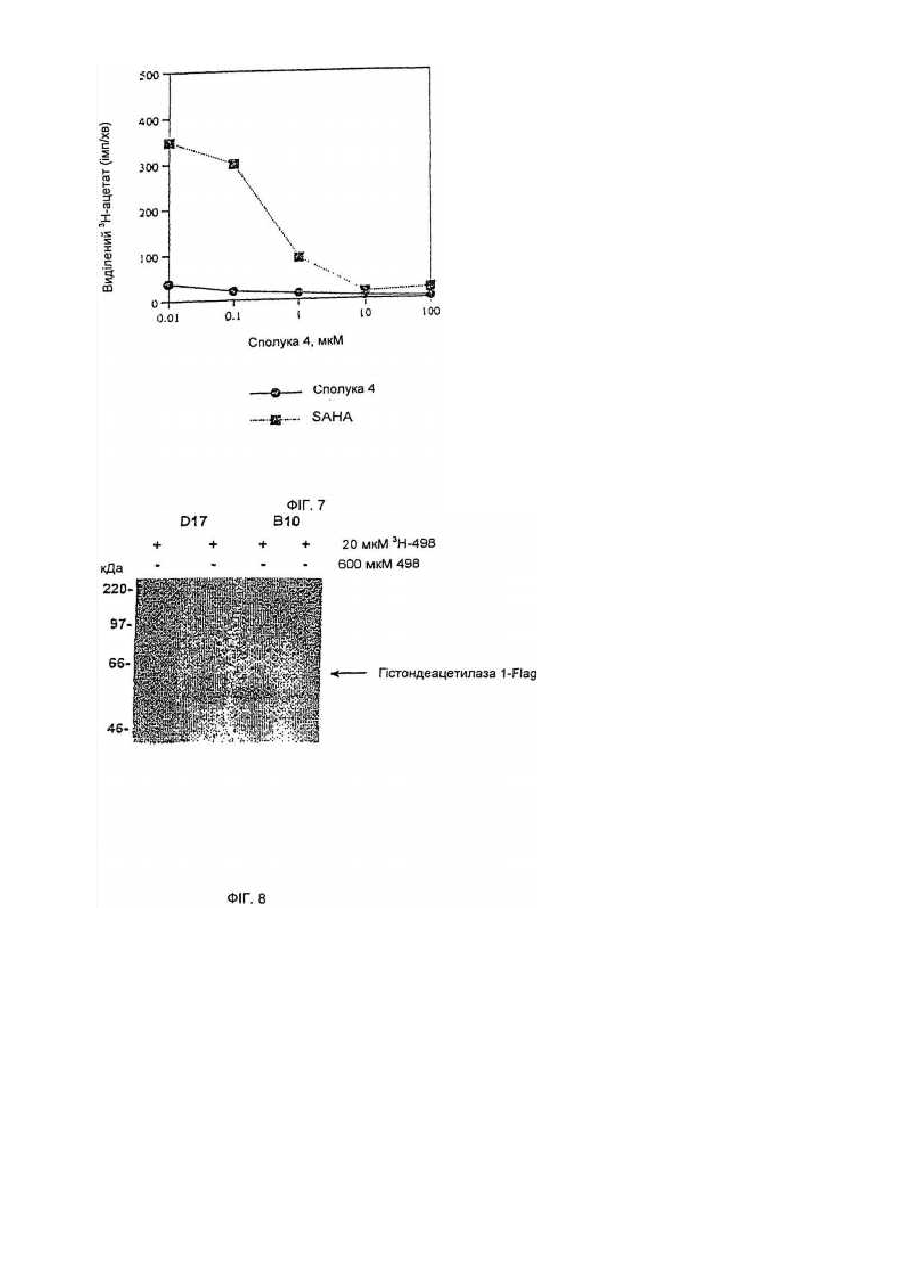
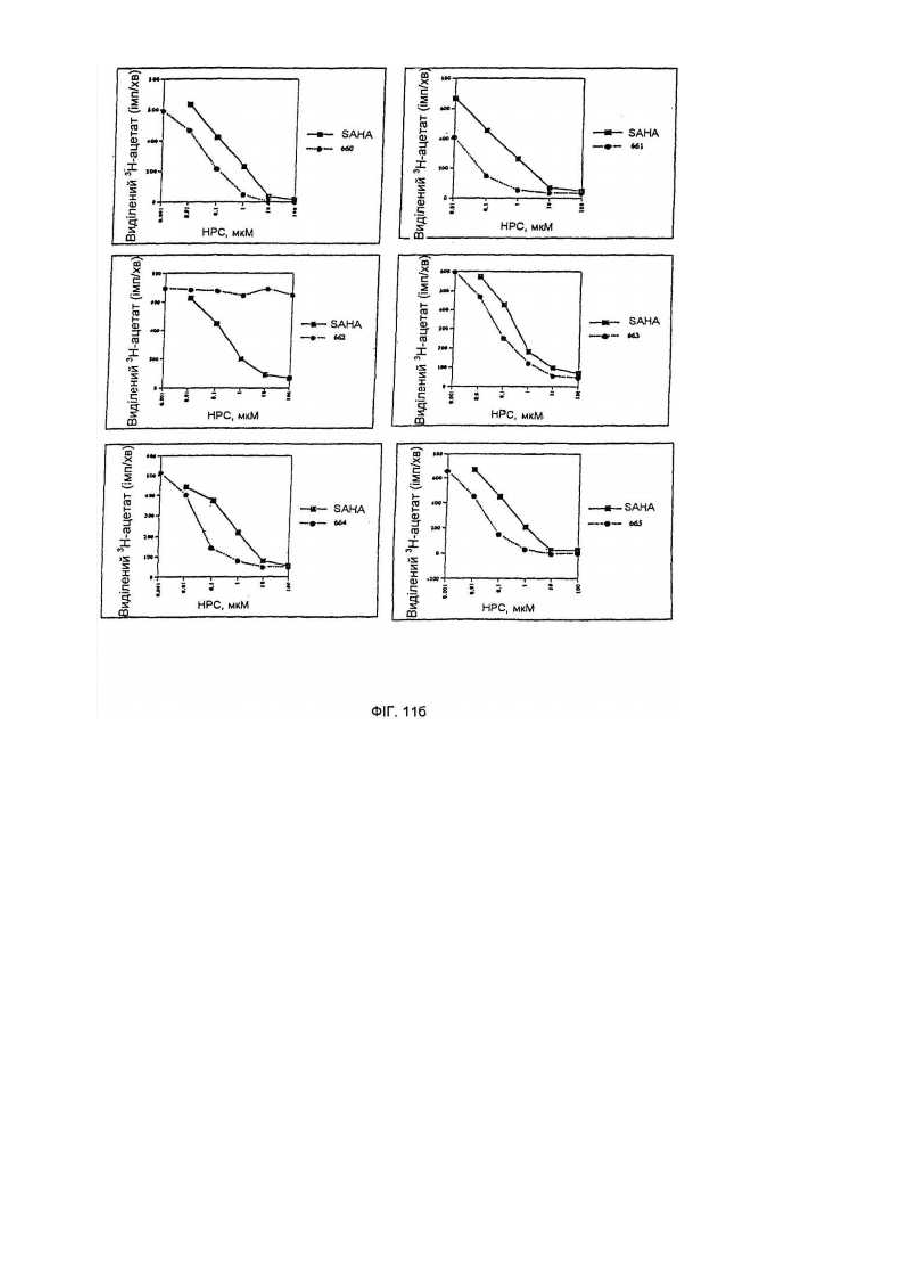
Засоби клітинної диференціації і інгібітори гістонової деацетилази та способи їх використання
Номер патенту: 74345
Опубліковано: 15.12.2005
Автори: Міллер Томас А., Маркс Поль А., Бельведере Сандро, Гершелль Леланд, Бреслоу Рональд, Ріфкайнд Річард А., Річон Вікторія М.
Формула / Реферат
1. Сполука, що має формулу:
,
де радикали R1 і R2 є однаковими чи різними, і обидва радикали є гідрофобними групами;
радикал R3 є гідроксамовою кислотою, гідроксиламіно-, гідроксильною, аміно-, алкіламіно- чи алкілоксигрупою; і n є цілим числом від 3 до 10;
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, яка відрізняється тим, що кожен із радикалів R1 і R2 приєднаний безпосередньо чи через лінкер і є заміщеною чи незаміщеною арильною, циклоалкільною, циклоалкіламіно-, нафталіновою, піридинаміно-, піперидиновою, 9-пурин-6-аміно-, тіазоламіно-, гідроксильною, розгалуженою чи нерозгалуженою алкільною, алкенільною, алкілокси-, арилокси-, арилалкілокси- чи піридиновою групою.
3. Сполука за п. 2, яка відрізняється тим, що лінкер є амідною групою, -О-, -S-, -NH- чи –СН2-.
4. Сполука за п. 1, яка відрізняється тим, що вона має формулу:
,
де кожний з радикалів R4 є заміщеною чи незаміщеною арильною, циклоалкільною, циклоалкіламіно-, нафталіновою, піридинаміно-, піперидиновою, 9-пурин-6-аміно-, тіазоламіно-, гідроксильною, розгалуженою чи нерозгалуженою алкільною, алкенільною, алкілокси-, арилокси-, арилалкілокси- чи піридиновою групою.
5. Сполука за п. 4, яка відрізняється тим, що радикал R2 є групою -амід-R5, де радикал R5 є заміщеною чи незаміщеною арильною, циклоалкільною, циклоалкіламіно-, нафталіновою, піридинаміно-, піперидиновою, 9-пурин-6-аміно-, тіазоламіно-, гідроксильною, розгалуженою чи нерозгалуженою алкільною, алкенільною, алкілокси-, арилокси-, арилалкілокси- чи піридиновою групою.
6. Сполука, що має формулу:
,
де кожний з радикалів R1 і R2 є заміщеною чи незаміщеною арильною, циклоалкільною, циклоалкіламіно-, нафталіновою, піридинаміно-, піперидиновою, 9-пурин-6-аміно-, тіазоламіно-, гідроксильною, розгалуженою чи нерозгалуженою алкільною, алкенільною, алкілокси-, арилокси-, арилалкілокси- чи піридиновою групою;
радикал R3 є гідроксамовою кислотою, гідроксиламіно-, гідроксильною, аміно-, алкіламіно- чи алкілоксигрупою;
радикал R4 є атомом водню, галогеном, фенільною групою чи циклоалкільною групою;
де А можуть бути однаковими чи різними і являти собою амідну групу чи групи -О-, -S-, -NR5- чи -СН2-, де радикал R5 є заміщеним чи незаміщеним С1-С5 -алкілом; і n є цілим числом від 3 до 10;
чи її фармацевтично прийнятна сіль.
7. Сполука за п. 6, яка відрізняється тим, що має формулу:
.
8. Сполука за п. 6, яка відрізняється тим, що має формулу:
.
9. Сполука за п. 6, яка відрізняється тим, що має формулу:
,
де кожний з радикалів R1 і R2 є заміщеною чи незаміщеною арильною, циклоалкільною, циклоалкіламіно-, нафталіновою, піридинаміно-, піперидиновою, t-бутильною, арилокси-, арилалкілокси- чи піридиновою групою; і
де n є цілим числом від 3 до 8.
10. Сполука за п. 9, яка відрізняється тим, що арильна чи циклоалкільна група заміщена метильною, ціано-, нитро-, трифторметильною, аміно-, амінокарбонільною чи метилціаногрупою, хлором, фтором, бромом, йодом, 2,3-дифтор-, 2,4-дифтор-, 2,5-дифтор-, 3,4-дифтор-, 3,5-дифтор-, 2,6-дифтор-, 1,2,3-трифтор-, 2,3,6-трифтор-, 2,4,6-трифтор-, 3,4,5-трифтор-, 2,3,5,6-тетрафтор-, 2,3,4,5,6-пентафтор-, азидо-, гексильною, t-бутильною, фенільною, карбоксильною, гідроксильною, метокси-, фенілокси-, бензилокси-, феніламіноокси-, феніламінокарбонільною, метилоксикарбонільною, метиламінокарбонільною, диметиламіно-, диметиламінокарбонільною чи гідроксиламінокарбонільною групами.
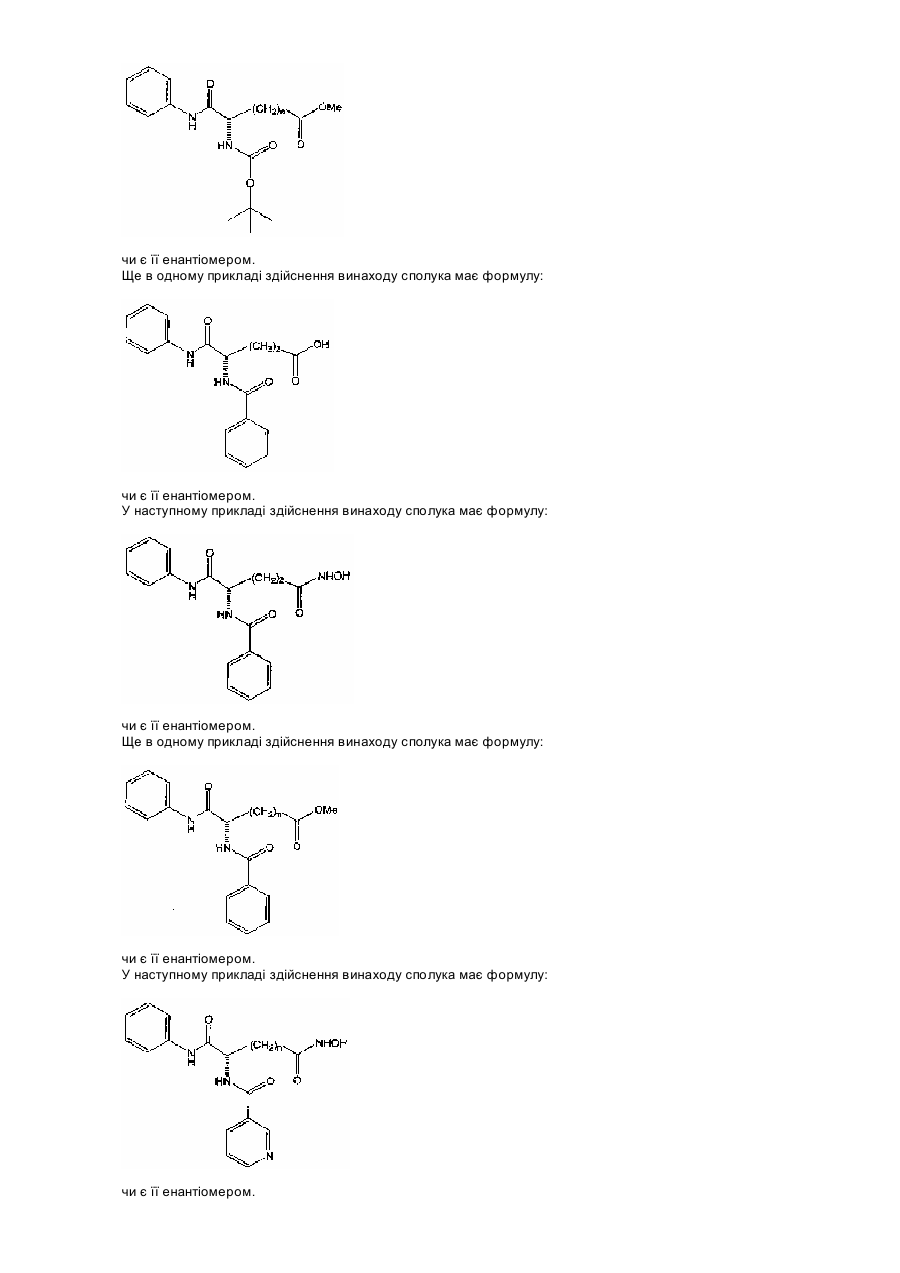
11. Сполука за п. 6, яка відрізняється тим, що має формулу:
,
або її енантіомер.
12. Сполука за п. 11, яка відрізняється тим, що n = 5.
13. Сполука за п. 6, яка відрізняється тим, що має формулу:
,
або її енантіомер.
14. Сполука за п. 13, яка відрізняється тим, що n = 5.
15. Сполука за п. 6, яка відрізняється тим, що має формулу:
,
або її енантіомер.
16. Сполука за п. 15, яка відрізняється тим, що n = 5.
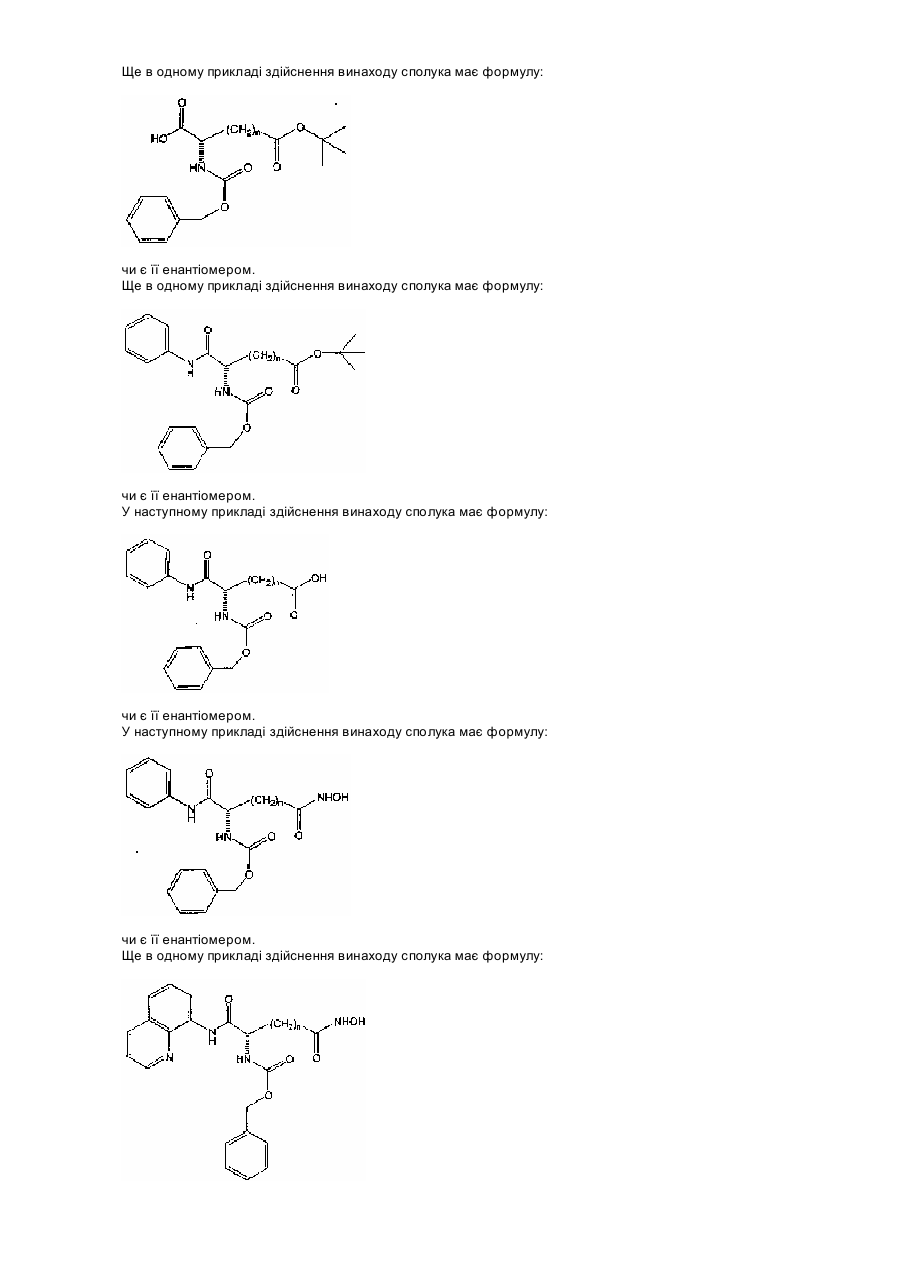
17. Сполука за п. 6, яка відрізняється тим, що має формулу:
,
або її енантіомер.
18. Сполука за п. 17, яка відрізняється тим, що n = 5.
19. Сполука за п. 6, яка відрізняється тим, що має формулу:
,
або її енантіомер.
20. Сполука за п. 19, яка відрізняється тим, що n = 5.
21. Сполука за п. 6, яка відрізняється тим, що має формулу:
,
або її енантіомер.
22. Сполука за п. 21, яка відрізняється тим, що n = 5.
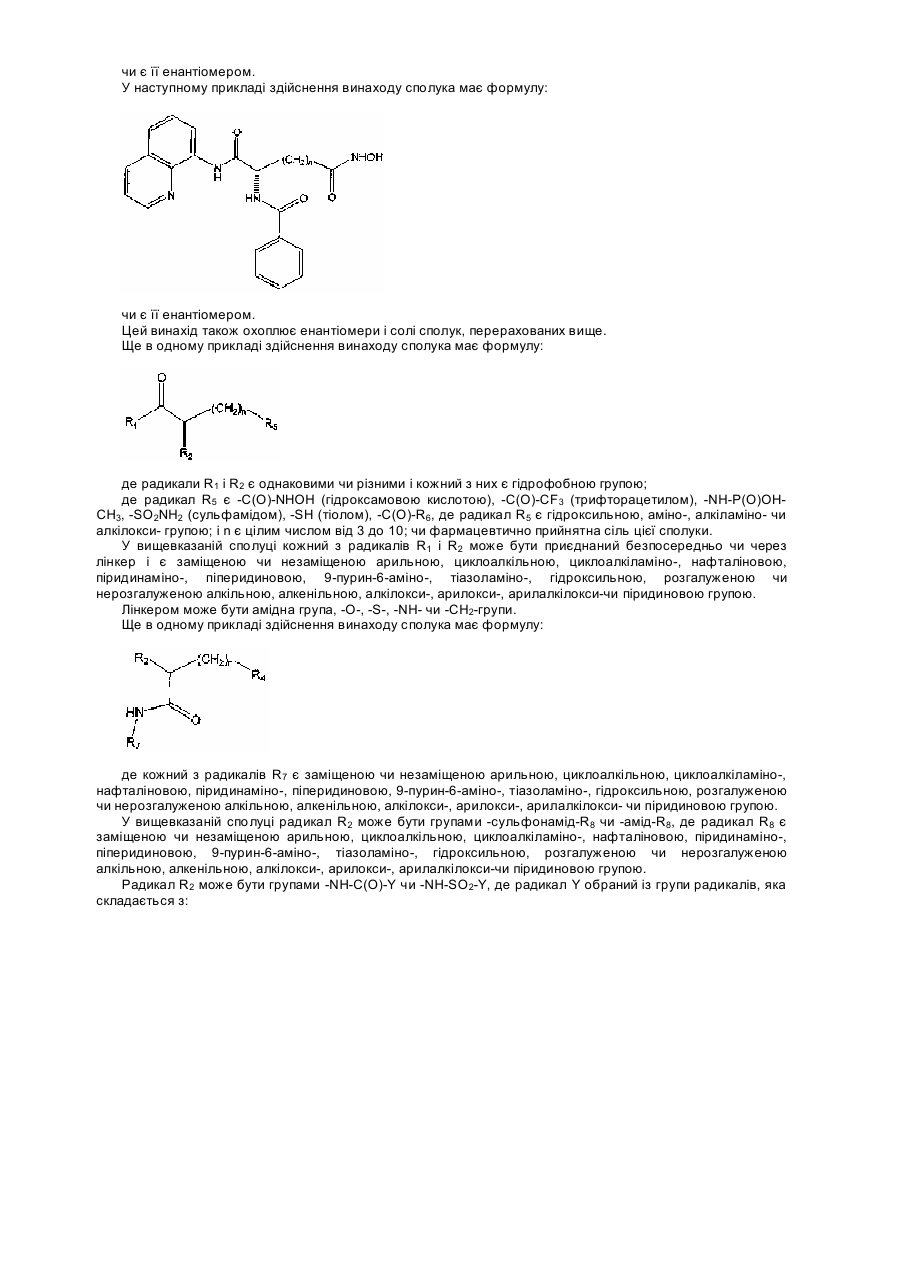
23. Сполука за п. 6, яка відрізняється тим, що має формулу:
,
або її енантіомер.
24. Сполука за п. 23, яка відрізняється тим, що n = 5.
25. Сполука за п. 6, яка відрізняється тим, що має формулу:
,
або її енантіомер.
26. Сполука за п. 25, яка відрізняється тим, що n = 5.
27. Сполука за п. 6, яка відрізняється тим, що має формулу:
,
або її енантіомер.
28. Сполука за п. 27, яка відрізняється тим, що n = 5.
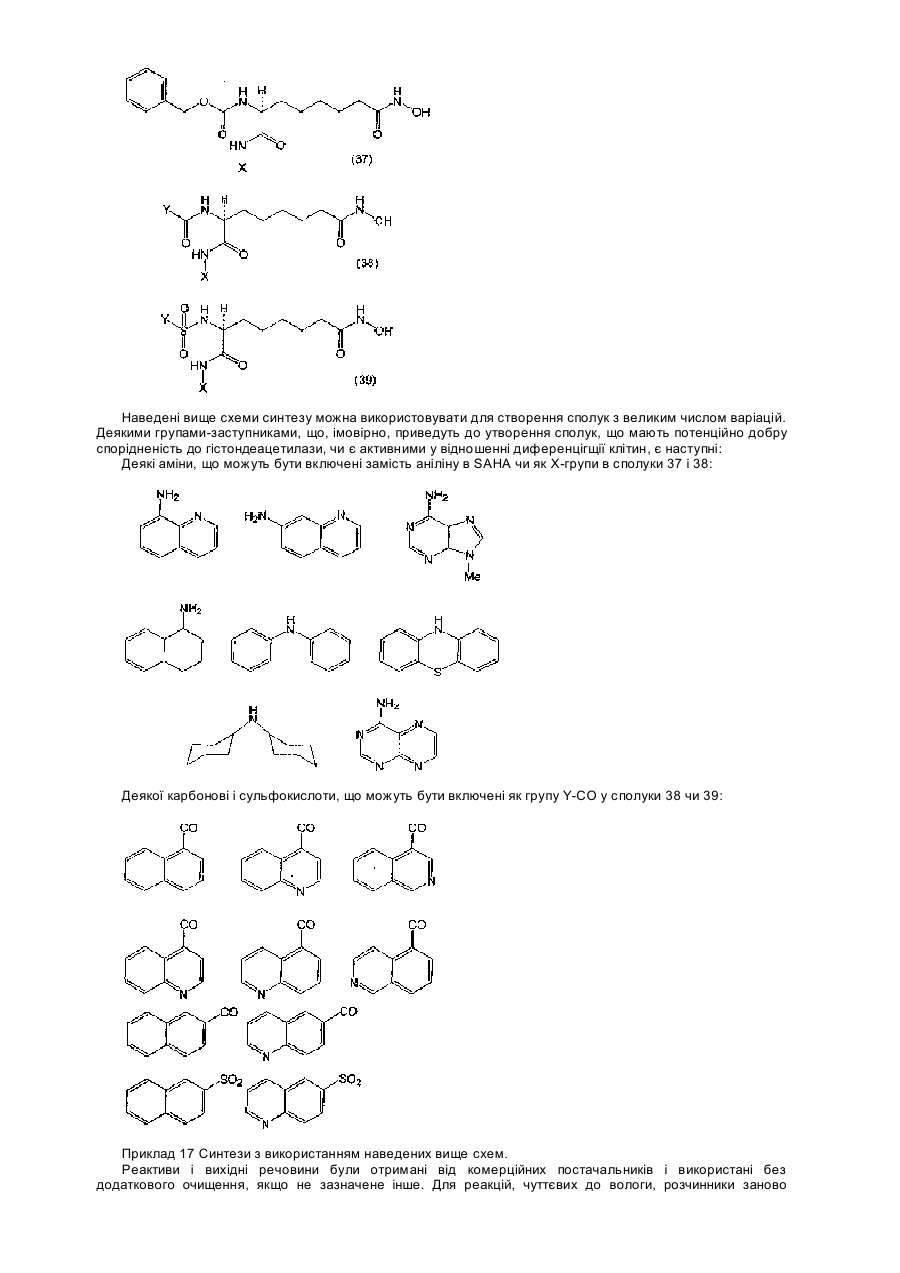
29. Сполука за п. 6, яка відрізняється тим, що має формулу:
,
або її енантіомер.
30. Сполука за п. 29, яка відрізняється тим, що n = 5.
31. Сполука за п. 6, яка відрізняється тим, що має формулу:
,
або її енантіомер.
32. Сполука за п. 31, яка відрізняється тим, що n = 5.
33. Фармацевтична композиція, яка містить фармацевтично ефективну кількість сполуки за будь-яким із пп. 1-9 і фармацевтично прийнятний носій.
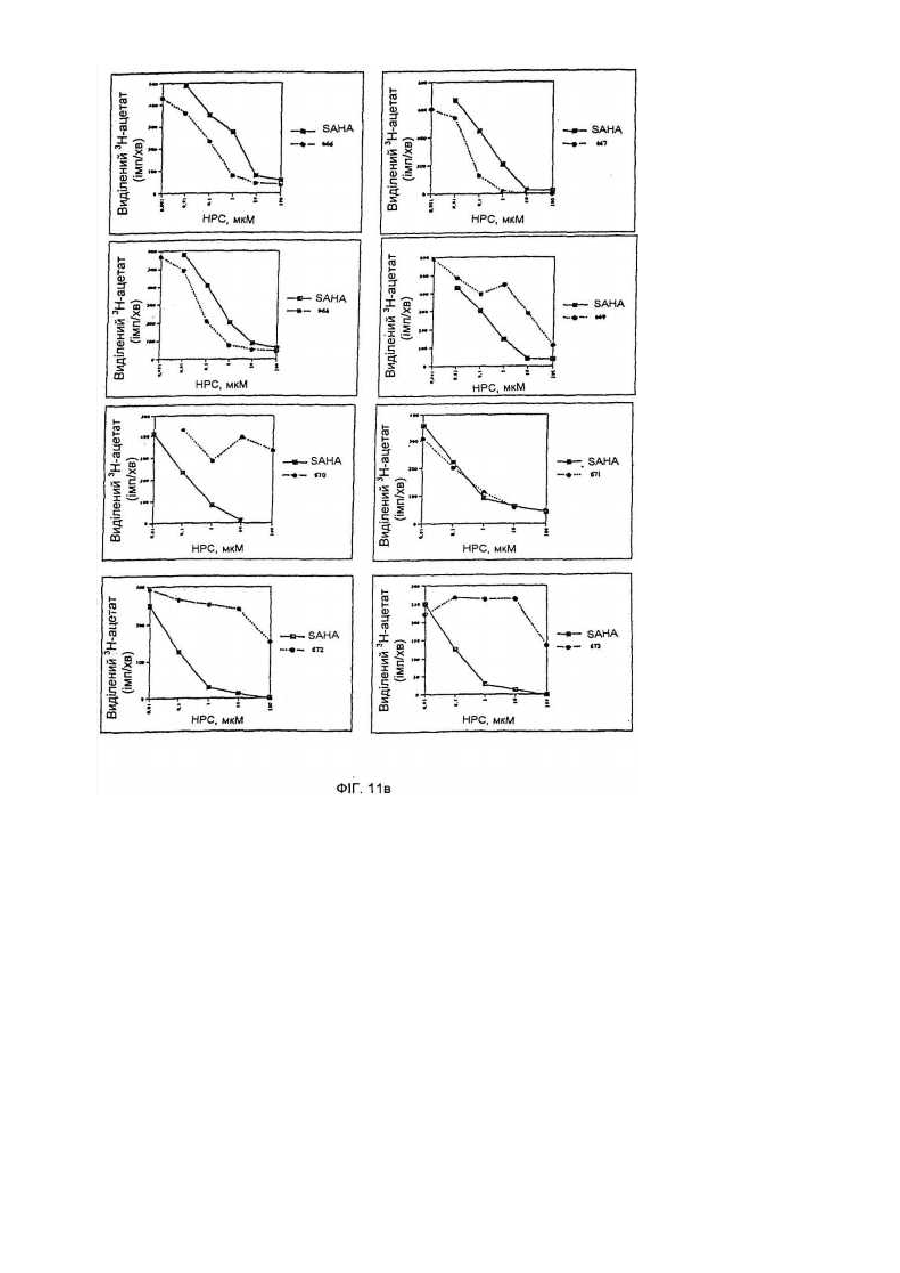
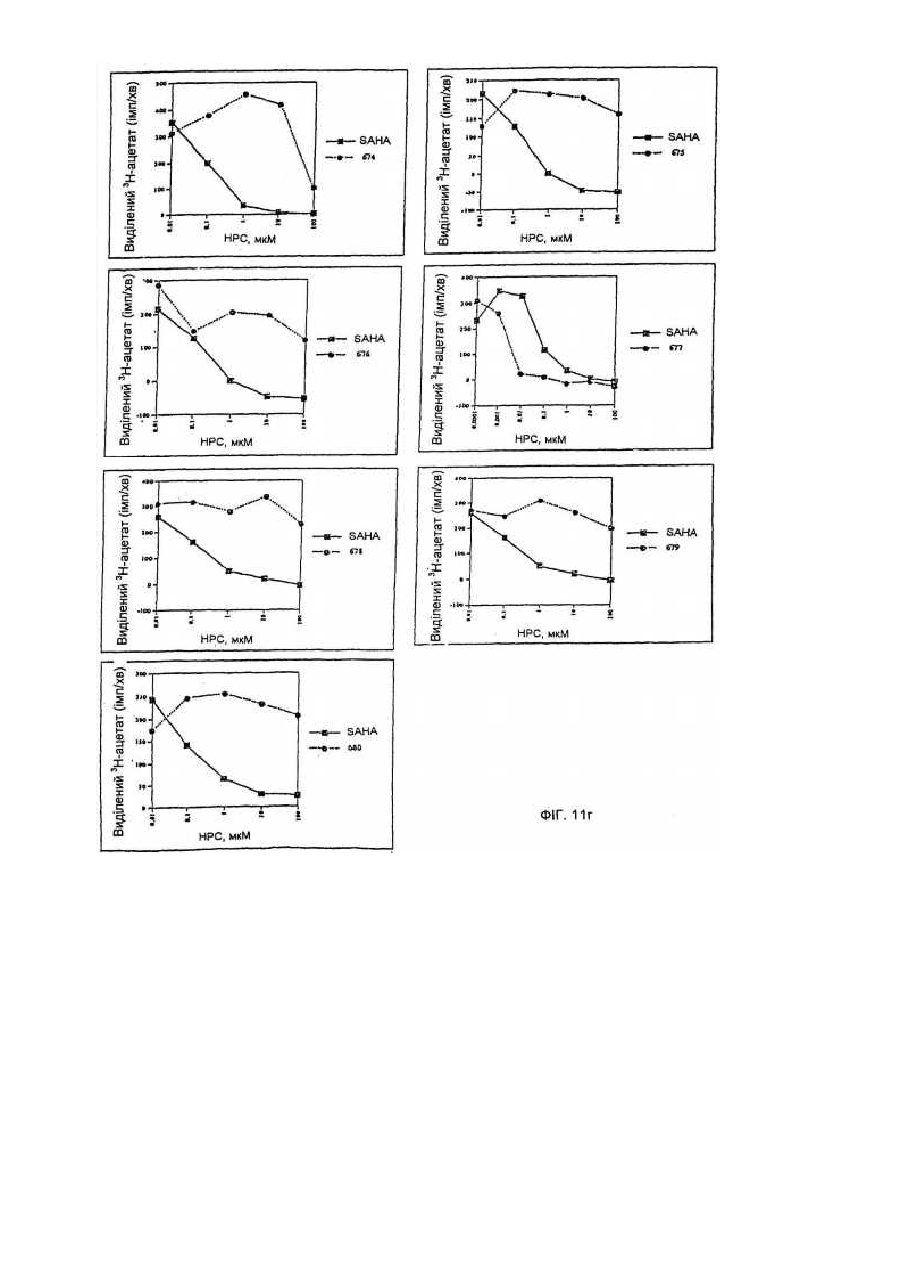
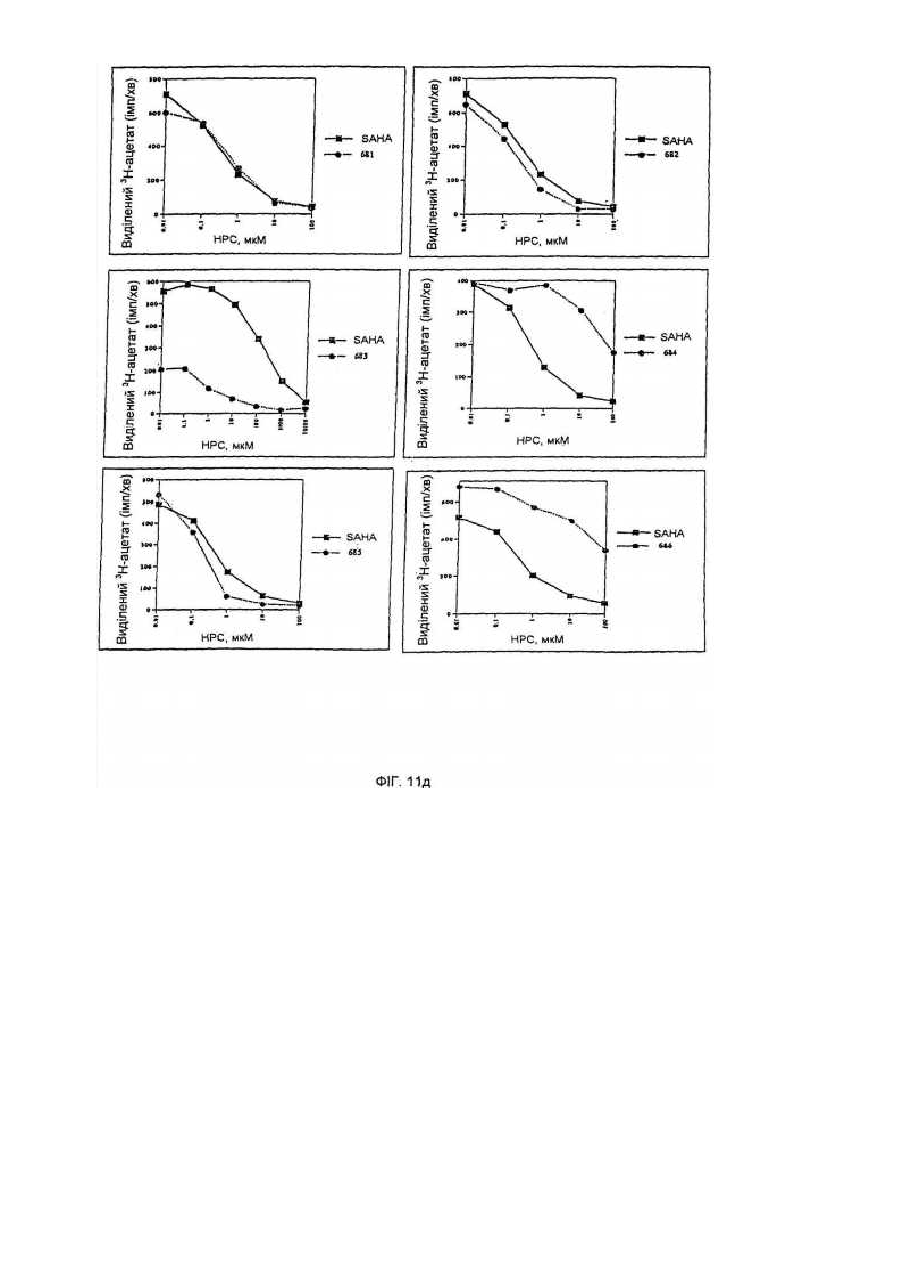
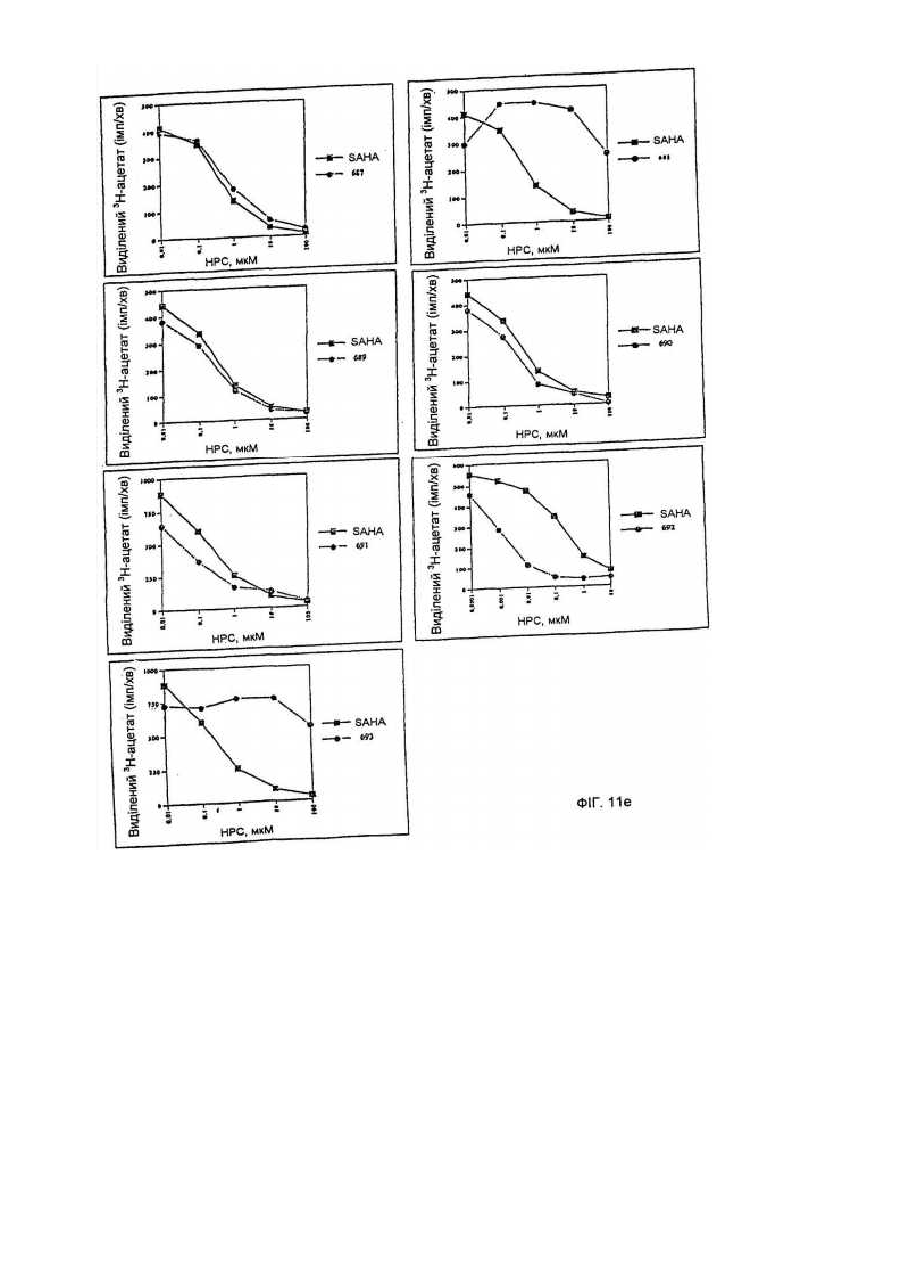
34. Спосіб вибіркового індукування кінцевої диференціації неопластичних клітин і обумовленого цим інгібування проліферації цих клітин, який включає введення у контакт клітин при придатних умовах з ефективною кількістю сполуки за будь-яким із пп. 1-9.
35. Спосіб лікування хворого, що має пухлину, що характеризується проліферацією неопластичних клітин, який включає уведення хворому ефективної кількості сполуки за будь-яким із пп. 1-9.
36. Сполука, що має формулу:
,
де радикали R1 і R2 є однаковими чи різними і кожний з них є гідрофобною групою;
радикал R5 являє собою -C(O)-NHOH (гідроксамову кислоту), -C(O)-CF3 (трифторацетил), -NH-P(О)ОН-СН3, -SO2NH2 (сульфамід), -SH (тіол), -С(O)-R6, де радикал R6 є гідроксильною, аміно-, алкіламіно- чи алкілоксигрупами; і n є цілим числом від 3 до 10, або її фармацевтично прийнятна сіль.
37. Сполука за п. 36, яка відрізняється тим, що кожен із радикалів R1 і R2 приєднаний безпосередньо чи через лінкер і є заміщеною чи незаміщеною арильною, циклоалкільною, циклоалкіламіно-, нафталіновою, піридинаміно-, піперидиновою, 9-пурин-6-аміно-, тіазоламіно-, гідроксильною, розгалуженою чи нерозгалуженою алкільною, алкенільною, алкілокси-, арилокси-, арилалкілокси- чи піридиновою групою.
38. Сполука за п. 37, яка відрізняється тим, що лінкер є амідною групою чи -О-, -S-, -NH- чи -СН2- групою.
39. Сполука за п. 36, яка відрізняється тим, що має формулу:
,
де кожний з радикалів R7 є заміщеною чи незаміщеною арильною, циклоалкільною, циклоалкіламіно-, нафталіновою, піридинаміно-, піперидиновою, 9-пурин-6-аміно-, тіазоламіно-, гідроксильною, розгалуженою чи нерозгалуженою алкільною, алкенільною, алкілокси-, арилокси-, арилалкілокси- чи піридиновою групою.
40. Сполука за п. 39, яка відрізняється тим, що радикал R8 є групою -сульфонамід-R8 чи -амід-R8, де радикал R8 є заміщеною чи незаміщеною арильною, циклоалкільною, циклоалкіламіно-, нафталіновою, піридинаміно-, піперидиновою, 9-пурин-6-аміно-, тіазоламіно-, гідроксильною, розгалуженою чи нерозгалуженою алкільною, алкенільною, алкілокси-, арилокси-, арилалкілокси- чи піридиновою групою.
41. Сполука за п. 39, яка відрізняється тим, що радикал R2 є -NH-C(О)-Y чи -NH-SO2-Y, причому радикал Y вибраний із групи, що складається з:
, ,
, ,
, ,
, ,
, .
42. Сполука за п. 39, яка відрізняється тим, що радикал R7 вибраний із групи, що складається з:
, ,
, ,
, ,
, .
43. Сполука, що має формулу:
,
де радикали R1 і R2 є однаковими чи різними і кожний з них є гідрофобною групою;
радикал R5 являє собою -С(О)-NHOН (гідроксамову кислоту), -C(O)-CF3 (трифторацетил) , -NH-P(О)ОН-СН3, -SO2NH2 (сульфамід), -SH (тіол), -С(О)-R6, де радикал R6 є гідроксильною, аміно-, алкіламіно- чи алкілоксигрупою; і
де L являє собою лінкер із групи, що складається з -(СН2)-, -С(О)-, -S-, -О-, -(СН=СН)-, -феніл- чи -циклоалкілгрупи чи будь-якої їхньої комбінації,
або її фармацевтично прийнятна сіль.
44. Сполука за п. 43, яка відрізняється тим, що n має значення від 4 до 7, a m має значення від 1 до 3.
45. Сполука за п. 43, яка відрізняється тим, що кожен із радикалів R1 і R2 приєднаний безпосередньо чи через лінкер і є заміщеною чи незаміщеною арильною, циклоалкільною, циклоалкіламіно-, нафталіновою, піридинаміно-, піперидиновою, 9-пурин-6-аміно-, тіазоламіно-, гідроксильною, розгалуженою чи нерозгалуженою алкільною, алкенільною, алкілокси-, арилокси-, арилалкілокси- чи піридиновою групою.
46. Сполука за п. 43, яка відрізняється тим, що лінкер є амідною групою чи -О-, -S-, -NH- чи -СН2- групою.
47. Сполука за п. 43, яка відрізняється тим, що має формулу:
,
де L являє собою лінкер, що складається з -(СН2)-, -(СН=СН)-, -феніл- чи -циклоалкілгрупи, чи будь-якої їхньої комбінації, і де кожний з радикалів R7 чи R8 незалежно є заміщеною чи незаміщеною арильною, циклоалкільною, циклоалкіламіно-, нафталіновою, піридинаміно-, піперидиновою, 9-пурин-6-аміно-, тіазоламіно-, гідроксильною, розгалуженою чи нерозгалуженою алкільною, алкенільною, алкілокси-, арилокси-, арилалкілокси- чи піридиновою групою.
48. Сполука за п. 47, яка відрізняється тим, що лінкер L включає групу
.
49. Сполука за п. 43, яка відрізняється тим, що має формулу:
.
50. Фармацевтична композиція, що містить сполуку за п. 1, 36 чи 43 і фармацевтично прийнятний носій.
51. Фармацевтично прийнятна сіль сполуки за п. 1, 36 чи 43.
52. Речовина-попередник сполук за п. 1, 36 чи 43.
53. Спосіб індукування диференціації пухлинних клітин у пухлини, який включає контактування клітин з ефективною кількістю сполуки за п. 1, 36 чи 43, за допомогою чого здійснюється диференціація пухлинних клітин.
54. Спосіб інгібування активності гістондеацетилази, що включає введення у контакт гістондеацетилази з ефективною кількістю сполуки за п. 1, 36 чи 43, за допомогою чого здійснюється інгібування активності гістондеацетилази.
Текст
До розчину сполуки 5 (81мг, 0,214ммоль) у СН2СІ 2 (10мл) додавали трифтороцтову кислоту (0,5мл) і перемішували розчин протягом 2 годин. Суміш концентрували при зниженому тиску. До розчину цього аміну (62мг, 0,223ммоль) і циклогексанкарбонової кислоти (31мкл, 0,245ммоль) у СН2СІ 2 (4мл) додавали РуВОР (140мг, 0,268ммоль) і DIEA (58мкп, 0,335ммоль). Розчин перемішували протягом 2 годин, концентрували при зниженому тиску й очищали продукт за допомогою випарної хроматографії (40% етилацетат/гексан). Після випаровування залишалася неочищена речовина 57 у вигляді білої твердої речовини (95мг), яка містила невелику кількість забруднення у вигляді циклогексанової кислоти, що не вступила у реакцію. Цей матеріал використовували на наступній стадії без додаткового очищення. Тонкошарова хроматографія Rf 0,58 (50% етилацетат/гексан); 1Η-ЯМР (400МГц, CDCl3) d 8,58 (s, 1H), 7,50 (d, 2H), 7,28 (t, 2H), 7,07 (t, 1H), 6,14 (d, 1H), 4,56 (dt, 1H), 3,64 (s, 3H), 2,28 (t, 2H), 2,13 (tt, 1H), 1,94 (m, 1H), 1,85 (m, 2H), 1,76 (m, 2H), 1,64 (m, 4H), 1,41 (m, 5 H), 1,22 (m, 4H). (7S)-(Циклогексанкарбоніл-аміно)-7-фенілкарбамоІл-гептанова кислота (58) До розчину ефіру 57 (95мг) у метиловому спирті (2,5мл) при 0°С додавали розчин NaOH (1М, 2,5мл). Після додавання утворювався білий осад, який повторно розчиняли шляхом додавання ТГФ (2,5мл). Через 3 години додавали додаткову кількість NaOH (1Μ, 1,0мл) і підтримували температуру на рівні 0°С. Після повного зникнення вихідного матеріалу за результатами аналізу шляхом тонкошарової хроматографії, реакційну суміш підкисляли НСІ (1N) з одержанням білого осаду. Супернатант видаляли, а з твердої речовини відсмоктували рідину через фільтр. Об'єднані рідини екстрагували етилацетатом (3´5мл), екстракти поєднували, промивали розсолом, сушили над MgSО4 і фільтрували. Після концентрування при зниженому тиску залишилася біла тверда речовина, яку поєднували з осадом на фільтрі і сушили під вакуумом з одержанням карбонової кислоти 58 (75мг, 0,200ммоль, 90%). 1 Η-ЯМР (400МГц, ДМСО-d6) d 11,95 (s, 1Н), 9,98 (s, 1H), 7,90 (d, 1H), 7,58 (d, 1H), 7,28 (t, 2H), 7,02 (t, 1H), 4,33 (dt, 1H), 2,22 (tt, 1H), 2,17 (t, 2H), 1,67 (m, 6H), 1,60 (m, 2H), 1,46 (m, 2H), 1,22 (m, 9H). (2S)-2-(Циклогексанкарбоніл-аміно)-октандіоєвої кислоти 8-гідроксамід 1-феніламід (59) Кислоту 58 (70мг, 0,187ммоль), TBDPSO-NH2 (61мг, 0,224ммоль) і DMAP (5мг) розчиняли в СН2СІ 2 (4мл) і додавали EDC (47мг, 0,243ммоль). Розчин перемішували протягом ночі. Після концентрування при зниженому тиску матеріал очищали за допомогою випарної хроматографії (50% етилацетат/гексан). Випаровування об'єднаних фракцій продукту дало білу піну (80мг, 0,131ммоль, вихід 70%). До розчину цього захищеного гідроксамату в СН2СІ 2 (4мл) і ТГФ (3мл) додавали трифтороцтову кислоту (0,25мл) і перемішували протягом 1,5 годин. При тонкошаровій хроматографії спостерігали нову пляму, яку негайно офарблювали FeCl3. Розчин концентрували і видаляли всі летучі речовини під вакуумом. Залишок розтирали з етилацетатом і одержували осад у вигляді білого гелю, який переносили в пластмасову пробірку за допомогою етилацетату (5мл). Пробірку центрифугували з одержанням гранули осаду, супернатант зливали і додавали етилацетат (10мл). Осад повторно суспендували шляхом обробки ультразвуком, потім повторно центрифугували й осад сушили під вакуумом. Була отримана біла тверда речовина 59 (18мг, 0,046ммоль, 35%). 1 Η-ΗΜΡ (400ЯМР, ДМСО-d6) d 10,31 (s, 1Н), 9,97 (s, 1Η), 7,89 (d, 1H), 7,57 (d, 2H), 7,28 (t, 2H), 7,02 (t, 1H), 4,33 (dt, 1H), 2,22 (t, 2H), 1,91 (t, 2H), 1,61 (m, 6H), 1,68 (m, 2H), 1,45 (m, 2H), 1,21 (9H). Гідроксиаміду октандіоєвої кислоти хінолін-8-іламід (60) Ця сполука була отримана з монометилового ефіру пробкової кислоти аналогічно 48 з використанням 8-амінохіноліну. Неочищений осад, отриманий після видалення захисту з захищеного гідроксамату за допомогою трифтороцтової кислоти, переносили в невеликий об'єм етилацетату й осаджували гексаном з одержанням сполуки 60 у вигляді білої твердої речовини (18мг, 0,057ммоль, 21% від карбонової кислоти). 1 Н-ЯМР (400МГц, ДMCO-d6) d 10,31 (s, 1H), 10,02 (s, 1H), 8,92 (dd, 1H), 8,61 (dd, 1H), 8,40 (dd, 1H), 7,65 (dd, 1H), 7,63 (dd, 1H), 7,56 (t, 1H), 2,56 (t, 1H), 1,93 (t, 1H), 1,63 (m, 2H), 1,49 (m, 2H), 1,28 (m, 4H). Масспектроскопія (ESI+): розрахован для С17Н21N3О3 315, отримано 316 [М+Н]+. 2-t-Бутоксикарбоніл-октандіоєвої кислоти 1-t-бутилового ефіру 8-етиловий ефір (61) До суспензії Na, що перемішується, (60%-на дисперсія, 197мг, 4,913ммоль) у ТГФ (25мл) при 0°С додавали ди-t-бутилмалонат (1,00мл, 4,466ммоль) і суміші давали нагрітися до температури навколишнього середовища. Через 1 годину виділення газу припинялося, після чого по краплях додавали етил-6-бромгексаноат (0,88мл, 4,913ммоль). Реакцію проводили при нагріванні зі зворотним холодильником протягом ночі. Реакцію обережно гасили за допомогою Н2О (10мл) і розводили етилацетатом. Після поділу фаз водяну фазу екстрагували етилацетатом (3´10мл). Екстракти поєднували і промивали Н2О, потім розсолом, сушили над MgSO4 і фільтрували. Концентрування при зниженому тиску дало жовту олію, яку пропускали через шар силікагелю (10% етилацетат/гексан). Після випаровування залишався ясно-жовтий сироп сполуки 61 (1,52м, 4,24ммоль, вихід 95%). Тонкошарова хроматографія Rf 0,44 (10% етилацетат/гексан); 1Η-ЯМР (400МГц, CDCl3) d 4,10 (q, 2H), 3,08 (t, 1Η), 2,26 (t, 2H), 1,76 (m, 2H), 1,63 (m, 2H), 1,43 (s, 18H), 1,32 (m, 4H), 1,23 (m, 3Н). 2-Карбокси-октандіоєвої кислоти 8-етиловий ефір (62) До розчину потрійного ефіру 61 (500мг, 1,395ммоль) у СН2СІ 2 (20мл) додавали трифтороцтову кислоту (2,0мл) і реакційну суміш перемішували протягом ночі. Летучі компоненти випаровували під вакуумом, а залишок повторно розчиняли в СН2СІ 2 і випаровували з метою видалення всіх слідових кількостей трифтороцтової кислоти. Одержували тверду речовину 62 (327мг, 1,33ммоль) і використовували прямо в наступній стадії без додаткового очищення. 1 Η-ЯМР (400МГц, ДМСО-d6) d 12,62 (br s, 2H), 4,03 (q, 2Η), 3,16 (t, 1H), 2,25 (t, 2H), 1,67 (m, 2H), 1,49 (m, 2H), 1,25 (m, 4Η), 1,16 (t, 3H). 7,7-біс-(хінолін-8-ілкарбамоїл)-гептанової кислоти етиловий ефір (65) Двухосновну кислоту 62 (150мг, 0,609ммоль), 8-амінохінолін (211мг, 1,462ммоль) і DMAP (5мг) розчиняли в ТГФ (6мл). До цього розчину додавали EDC (350мг, 1,827ммоль) і реакцію залишали для протікання на ніч. Суміш концентрували при зниженому тиску й очищали продукт за допомогою випарної хроматографії (40% етилацетат/гексан). Після випаровування об'єднаних фракцій продукту залишилася речовина 63 у вигляді ясно-коричневої твердої речовини (100мг, 0,201ммоль, 14%). 1 Η-ЯМР (400МГц, ДМСО-d6) d 10,85 (s, 2Н), 8,92 (dd, 2H), 8,64 (dd, 2Η), 8,40 (dd, 2Н), 7,68 (dd, 2H), 7,62 (dd, 2Η), 7,57 (t, 2H), 4,35 (t, 1H), 3,98 (q, 2H), 2,24 (t, 2H), 2,00 (m, 2H), 1,51 (m, 2H), 1,37 (m, 4H), 1,12 (t, 3H). 7,7-біс-(хінолін-8-ілкарбамоїл)-гептанова кислота (64) До розчину ефіру 63 (94мг, 0,212ммоль) у метиловому спирті (3мл) і ТГФ (1мл) додавали розчин LiOHH2O (44мг, 1,062ммоль) у Н2О (1мл) і перемішували суміш протягом 5 годин. Після підкислення НСІ (1N) до рН 7, додавали етилацетат (10мл) і розділяли фази. Водяну фазу екстрагували етилацетатом (3´5мл), екстракти поєднували, промивали насиченим розчином NH4CІ (3мл), Н2О (3мл), потім - розсолом, сушили над MgSO4 і фільтрували. Після концентрування при зниженому тиску залишилася сполука 64 у вигляді білої твердої речовини (94мг, 0,200ммоль, вихід 94%). Тонкошарова хроматографія Rf 0,21 (50% етилацетат/гексан); 1Η-ЯМР (400МГц, ДМСО-d6) d 11,88 (s, 1Н), 10,85 (s, 2Н), 8,93 (dd, 2H), 8,65 (dd, 2H), 8,40 (dd, 2H), 7,69 (dd, 2Н), 7,63 (dd, 2H), 7,58 (t, 2H), 4,35 (t, 1H), 2,16 (t, 2H), 2,00 (m, 2Н), 1,49 (m, 2Н), 1,38 (m, 4Н). 2-(Хінолін-8-ілкарбамоїл)-октандіоєвої кислоти 8-гідроксамід 1-хінолін-8-іламід (65) Кислоту 64 (94мг, 0,200ммоль), TBDPSO-NH2 (74мг, 0,272ммоль) і DMAP (5мг) розчиняли в СН2СІ 2 (4мл) і додавали EDC (57мг, 0,295ммоль). Розчин перем:.шували протягом ночі, потім концентрували при зниженому тиску. Очищення за допомогою випарної хроматографії (30-50% етилацетат/гексан) і випаровування об'єднаних фракцій продукту дали білу піну. До розчину цього захищеного гідроксамату в СН2СІ 2 (4мл) додавали трифтороцтову кислоту (0,2мл) і перемішували розчин протягом 4 годин. Тонкошарова хроматографія показала повне зникнення вихідного матеріалу і нову пляму, що офарблювали FeCl3. Розчин концентрували при зниженому тиску, а залишок розводили мінімальною кількістю етилацетату. Додавання гексану давало білий осад, з якого видаляли вихідну рідину. Після промивання гексаном осад сушили під вакуумом з одержанням сполуки 65 у вигляді білої твердої речовини (30мг, 0,061ммоль, 22% від карбонової кислоти). 1 Н-ЯМР (400МГц, CDCІ 3) d 10,85 (s, 2H), 10,30 (s, 1Η), 8,93 (dd, 2H), 8,65 (dd, 2H), 8,40 (dd, 2Η), 7,69 (dd, 2H), 7,63 (dd, 2H), 7,58 (t, 2H), 4,35 (t, 1Η), 1,99 (m, 2H), 1,92 (t, 2H), 1,48 (m, 2H), 1,35 (m, 4H). Macспектроскопія (ESI+): розраховано для C27H27 N5O4 485, отримано 486 [М+Н]+. 2-(Хінолін-3-ілкарбамоїл)-октандіоєвої кислоти 8-гідроксиамід 1-хінолін-3-іламід (68) 65. Зазначену в заголовку сполуку одержували з двохосновної кислоти 62 аналогічно одержанню сполуки 1 Н-ЯМР (400МГц, ДМСО-d6) d 10,60 (s, 1Н), 10,34 (s, 1H), 8,95 (dd, 2H), 8,74 (s, 2H), 7,93 (dd, 2H), 7,64 (dd, 2H), 7,56 (dd, 2H), 3,71 (t, 1H), 1,96 (m, 4H), 1,51 (m, 2H), 1,34 (m, 4H). 6-Бромгексанової кислоти феніламід (76) До розчину 6-бромгексаноїлхлориду (1,00мл, 6,53ммоль) у ΤГΦ (35мл) при 0°С по краплях додавали розчин аніліну (0,60мл, 6,53ммоль) і TEA (1,09мл, 7,84ммоль) у ТГФ (5мл). Реакційній суміші давали не.грітися до температури навколишнього середовища і перемішували протягом 2 годин. Суміш фільтрували, тверді речовини промивали етилацетатом, і фільтрат концентрували при зниженому тиску. Залишок розподіляли між Н2О (15мл) і етилацетатом (20мл) і розділяли фази. Водяну фазу екстрагували етилацетатом (3´10мл), органічні фази поєднували, промивали НСІ (1Ν), розсолом, сушили над MgSО4 і фільтрували. Після концентрування при зниженому тиску залишалася коричнева олія, яку пропускали через шар силікагелю (30% етилацетат/гексан) при відсмоктуванні. Після концентрування при зниженому тиску залишалася сполука 67 у вигляді твердої речовини (1,55м, 5,74ммоль, вихід 88%). Тонкошарова хроматографія: Rf 0,36 (25% етилацетат/гексан); 1 Н-ЯМР (400МГц, ДМСО-d6) d 9,85 (s, 1Н), 7,57 (d, 2H), 7,27 (t, 2Η), 7,01 (t, 1H), 3,53 (t, 2H), 2,30 (t, 2H), 1,81 (t, 2H), 1,63 (m, 2H), 1,42 (m, 2H); масспекгрометрия (ESI+): розраховано для C12H16BrNO 268+270, отримано 269+271 [М+Н]+. Тіооцтової кислоти S-(5-фенілкарбамоїл)-пентиловий ефір (68) Бромід сполуки 67 (200мг, 0,74ммоль), тіоацетат калію (110мг, 0,96ммоль) і йодид натрію (10мг) спільно розчиняли в ТГФ (6мл) і суміш, що інтенсивно перемішується, нагрівали зі зворотним холодильником протягом ночі. Реакційну суміш концентрували і пропускали через шар силікагелю (20% етилацетат/гексан, 200мл) за допомогою відсмоктування. Після випаровування при зниженому тиску залишалася сполука 68 у вигляді жовтогарячої кристалічної твердої речовини (190мг, 0,72ммоль, 97%). Тонкошарова хроматографія Rf 0,22 (25% етилацетат/ гексан); 1 Н-ЯМР (400МГц, ДМСО-d6) d 9,83 (s, 1Н), 7,56 (d, 2H), 7,27 (t, 2H), 7,00 (t, 1H), 2,82 (t, 2H), 2,30 (s, 3H), 2,28 (t, 2H), 1,57 (m, 2H), 1,52 (m, 2H), 1,35 (m, 2H). 6-Метансульфоніламіногексанова кислота (69) 6-аміногексанову кислоту (904мг, 6,89ммоль) і NaOH (415мг, 10,34ммоль) розчиняли в Н2О (30мл) і охолоджували до 0-5°С. По краплях додавали метансульфонілхлорид (0,586мл, 7,58ммоль) і реакційну суміш перемішували протягом 2 годин, потім нагрівали до температури навколишнього середовища і перемішували протягом ще 2 годин. Суміш підкисляли НСІ (1N) і екстрагували етилацетатом (3´15мл). Екстракти поєднували, промивали Н2О, потім - розсолом, сушили над MgSO4 і фільтрували. Випаровування при зниженому тиску дало сполуку 69 у вигляді білої кристалічної твердої речовини (207мг, 0,99ммоль, вихід 14%). 1 Н-ЯМР (400МГц, ДМСО-d6) d 11,95 (s, 1H), 6,91 (t, 1H), 2,90 (dt, 2H), 2,87 (s, 3Н), 2,20 (t, 2H), 2,48 (m, 2H), 2,43 (m, 2Н), 1,27 (m, 2Н). 6-Метансульфоніламіногексанової кислоти феніламід (70) До розчину кислоти 69 (100мг, 0,48ммоль), аніліну (60мкл, 0,66ммоль) і ОМАР (5мг) у ТГФ (5мл) додавали EDC (119мг, 0,57ммоль). Реакційну суміш перемішували протягом ночі, а потім розподіляли між Н2О (10мл) і етилацетатом (15мл). Фази розділяли і водяну фазу екстрагували етилацетатом (3´10мл). Органічні фази поєднували, промивали насиченим розчином NH4Cl (5мл), потім розсолом, сушили над MgSO4 і фільтрували. Концентрування при зниженому тиску дало сполуку 70 у вигляді білої кристалічної твердої речовини (130мг, 0,46ммоль, 95%). 1 Η-ΗΜΡ (400МГц, ДМСО-d6) d 9,84 (s, 1H), 7,57 (d, 2H), 7,26 (t, 2H), 7,00 (t, 1H), 6,92 (t, 1H), 2,91 (dt, 2H), 2,85 (s, 3H), 1,58 (m, 2H), 1,47 (m, 2H), 1,31 (m, 2H). 9,9,9-трифтор-8-оксононанової кислоти метиловий ефір (71) До розчину монометилового ефіру пробкової кислоти (1,00м, 5,31ммоль) у ТГФ (15мл) додавали оксалілхлорид (2мл), а потім ДМФ (1 краплю). Розчин перемішували протягом 2 годин, потім концентрували при зниженому тиску. Летучі речовини видаляли протягом ночі під глибоким вакуумом, після чого залишалася жовта олія (1,08м, 5,22ммоль, вихід 98%). Цей неочищений хлорид кислоти потім перетворювали в трифторметилкетон описаним у літературі способом таким чином [65]. До розчину хлориду кислоти (1,08м, 5,22ммоль) у СН2СІ 2 (45мл) при 0°С додавали трифтороцтовий ангідрид (4,64мл, 32,81ммоль) і піридин (3,54мл, 43,74ммоль). Суміші надавали можливість нагрітися до температури навколишнього середовища і перемішували протягом 2 годин. Після повернення температури до 0°С обережно додавали воду при температурі танення льоду (20мл). Додавали додаткову кількість води (100мл) і розділяли фази. Водяну фазу екстрагували СН2СІ 2 (2´30мл), а органічні фази поєднували, промивали розсолом, сушили над MgSO4 і фільтрували. Після випаровування прій зниженому тиску залишалася коричнева олія, яку очищали за допомогою випарної хроматографії (2-4% метиловий спирт/СН2СІ 2) з одержанням сполуки 71 у вигляді прозорої олії (641мг, 2,67ммоль, вихід 49%). Тонкошарова хроматографія Rf 0,24 (2% метиловий спирт/СН2СІ 2); 1Η-ЯМР (400МГц, CDCl3) d 3,67 (s, 3H), 2,71 (t, 2Η), 2,31 (t, 2H), 1,65 (m, 4Η), 1,35 (m, 4H). 9,9,9-Трифтор-8-оксо-нонанової кислоти феніламід (72) До розчину ефіру 71 (300мг, 1,25ммоль) у ТГФ (18мл) додавали розчин LiOH·H2O (262мг, 6,24ммоль) у Н2О (6мл) і перемішували суспензію протягом ночі. Потім суміш підкисляли НСІ (1N) до рН 2, після чого екстрагували етилацетатом (3´15мл). Екстракти поєднували, промивали розсолом, сушили над MgSO4 і фільтрували. Після концентрування при зниженому тиску залишалася біла тверда речовина (211мг, 0,93ммоль, вихід 75%). До розчину цієї кислоти (109мг, 0,48ммоль), EDC (11мг, 0,58ммоль) і DMAP (5мг) у СН2СІ 2 (5мл) додавали анілін (49мкл, 0,53ммоль) і реакцію залишали для протікання на ніч. Розчин розподіляли між Н2О (5мл) і етилацетатом (10мл). Фази розділяли, і водяну фазу екстрагували етилацетатом (3´5мл). Органічні фази поєднували, промивали розсолом, сушили над MgSO4 і фільтрували. Після випаровування при зниженому тиску залишалася тверда речовина, яку очищали за допомогою препаративної тонкошарової хроматографії (30% етилацетат/гексан) з виділенням найменш полярної смуги за допомогою екстракції етилацетатом. Екстракт концентрували з одержанням сполуки 72 у вигляді жовтуватої твердої речовини (92мг, 0,31ммоль, вихід 65%). Тонкошарова хроматографія Rf 0,48 (50% етилацетат/гексан); 1 Η-ЯМР (400МГц, CDCІ 3) d 7, 51 (d, 2H), 7,32 (t, 2H), 7,10 (t, 1H), 2,72 (t, 2H), 2,36 (t, 2H), 1,72 (m, 4H), 1,40 (m, 4H); 19F-HMP (? МГц, CDCІ 3) -78,40 (s, 3F); Mac-спектрометрія (АРСІ+): розрахован для C15H19F3NO2 301, отримано 325 [M+Na]+. (5-Фенілкарбамоїл-пентил)-карбамінової кислоти t-бутиловий ефір (73) До розчину N-Boc-6-аміногексанової кислоти (2,50м, 10,81ммоль), EDC (2,69м, 14,05ммоль) і DMAP (20мг) у СН2СІ 2 (100мл) додавали анілін (1,04мл, 11,35ммоль) і суміш перемішували протягом ночі. Розчин випаровували при зниженому тиску до малого обсягу, потім розподіляли між Н2О (20мл) і етилацетатом (30мл). Фази розділяли і водяну фазу екстрагували етилацетатом (3´15мл). Органічні фази поєднували, промивали насиченим розчином NH4CI (5мл), потім розсолом, сушили над MgSO4 і фільтрували. Після концентрування при зниженому тиску залишалася чиста сполука 73 у вигляді білої твердої речовини (3,14м, 10,25ммоль, 95%). Тонкошарова хроматографія Rf 0,40 (50% етилацетат/ гексан); 1 Η-ЯМР (400МГц, ДМСО-d6) d 9,81 (s, 1Н), 7,56 (d, 2H), 7,26 (t, 2H), 7,00 (t, 1H), 6,74 (t, 1H), 2,89 (dt, 2H), 2,27 (t, 2H), 1,56 (m, 2H), 1,38 (m, 2H), 1,35 (s, 9H), 1,25 (m, 2H). 6-Аміногексанової кислоти фенілгімід, сіль трифтороцтової кислоти (74) До розчину карбамату 73 (300мг, 0,98ммоль) у СН2СI 2 (15мл) додавали трифтороцтову кислоту (0,75мл) і перемішувала розчин протягом ночі. Повне використання вихідного матеріалу підтверджували за допомогою тонкошарової хроматографії. Суміш випаровували при зниженому тиску для видалення всіх летучих речовин, після чого залишалася грязно-біла речовина (295мг, 0,92ммоль, вихід 94%). Неочищену сполуку 74 використовувала без подальшого очищення. N-(N-Фенілкарбамоїл-5-пентил)фосфорамідної кислоти дим етиловий ефір (75) До суспензії солі амонію 74, що перемішується, (197мг, 0,62ммоль) і DIEA (148мкл, 0,85ммоль) у СН2СІ 2 (7мл) при 0°С по краплях додавали диметилхлорфосфат (77мкл, 0,72ммоль). Суміші давали нагрітися до температури навколишнього середовища і перемішували протягом ночі. Розчин розводили Н2О (10мл) і розділяли фази. Водяну фазу екстрагували СН2СІ 2 (3´10мл), органічні фази поєднували, промивали насиченим розчином NH4CІ (5мл), потім розсолом, сушили над MgSО4 і фільтрували. Після концентрування залишок очищали за допомогою випарної хроматографії (2-5% метиловий спирт/СН2СІ 2) і фракції, що містили більш полярну з двох активних в УФ-області смуг на тонкошарової хроматограмі, поєднували і концентрували з одержанням сполуки 75 у вигляді прозорої олії (40мг, 0,13ммоль, вихід 20%). Тонкошарова хроматографія Rf 0,23 (5% метиловий спирт/СН2СІ 2); 1Η-ЯМР (400МГц, ДМСО-d6) d 9,84 (s, 1H), 7,57 (d, 2H), 7,26 (t, 2H), 7,00 (t, 1H), 4,90 (dt, 1H), 3,51 (d, 6H), 2,71 (m, 2H), 2,28 (t, 2Н), 1,56 (m, 2H),
ДивитисяДодаткова інформація
Назва патенту англійськоюMeans for cell differentiation and inhibitors of histone deacetylase and methods for their use
Автори англійськоюRicon Victoria M., Miller Thomas A.
Назва патенту російськоюСредства клеточной дифференцировки и ингибиторы гистоновой деацетилазы и способы их применения
Автори російськоюРичон Виктория М., Миллер Томас A.
МПК / Мітки
МПК: C07D 233/54, A61K 31/165, C07D 215/40, A61K 31/47, A61K 31/4406, C07D 213/82, C07F 9/44, C07D 277/46, C07D 333/38, C07C 259/00, C07C 271/22, C07D 215/54, C07C 311/03, C07D 215/38, A61P 43/00, C07C 237/22, C07C 237/52, C07C 69/604, A61K 31/27, C07D 213/75, C07C 69/716, C07C 233/30, C07D 521/00, C07C 311/06, C07F 9/24, C07F 9/36, A61P 35/00, C07C 311/42, C07C 233/12, C07C 327/00, C07C 69/602, C07C 323/67, C07C 233/13, C07D 231/40
Мітки: використання, гістонової, диференціації, інгібітори, клітинної, засоби, деацетилази, способи
Код посилання
<a href="https://ua.patents.su/48-74345-zasobi-klitinno-diferenciaci-i-ingibitori-gistonovo-deacetilazi-ta-sposobi-kh-vikoristannya.html" target="_blank" rel="follow" title="База патентів України">Засоби клітинної диференціації і інгібітори гістонової деацетилази та способи їх використання</a>
Попередній патент: Гетероциклічні інгібітори р38, фармацевтична композиція, що їх містить, та спосіб лікування за їх допомогою
Наступний патент: Похідні амінодикарбонових кислот, їх застосування та лікарський засіб
Випадковий патент: Спосіб дренування ран