Піперидиніл-заміщені похідні ізохінолону як інгібітори rнo-кінази
Номер патенту: 93882
Опубліковано: 25.03.2011
Автори: Брендель Йоахім, Плеттенбург Олівер, Хофмайстер Армін, Лен Маттіас, Кадерайт Дітер
Формула / Реферат
1. Сполука формули (І)
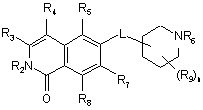 , (I)
, (I)
де
R2 являє собою Н, (С1-С6)алкіл, [(С1-С6)алкілен]0-1-R', [(С1-С6)алкілен]0-1-О-(С1-С6)алкіл, [(С1-С6)алкеніл]0-1-O-R', [(С1-С6)алкілен]0-1-NН2, [(С1-С6)алкілен]0-1-NH(С1-С6)алкіл, [(С1-С6)алкілен]0-1-N[(С1-С6)алкіл]2, [(С1-С6)алкілен]0-1СН[R']2, [(С1-С6)алкілен]0-1-C(O)-R', [(С1-С6)алкілен]0-1-C(O)NH2, [(С1-С6)алкілен]0-1-C(O)NH-R' або [(C1-C6)алкілен]0-1-C(O)N[R']2;
R3 являє собою Н, галоген, CN, (С1-С6)алкіл, (С1-С6)алкілен-R', ОН, O-R", NH2, NHR", NR"R" або NH-C(O)-R";
R4 являє собою Н, галоген, гідрокси, CN, (С1-С6)алкіл, (С3-С8)циклоалкіл, (С1-С6)алкілен-R';
R5 являє собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С1-С6)алкілен-(С6-С10)арил, (С2-С6)алкенілен-(С6-С10)арил, (С1-С6)алкілен-(С5-С10)гетероцикліл, NH2, NH-R', NH-SO2H, NН-SО2-(С1-С6)алкіл, NH-SO2-R', NH-С(О)-(С1-С6)алкіл, NH-C(O)-R', С(О)N[(С1-С6)алкіл]2, С(О)ОН або С(О)О-(С1-С6)алкіл;
R6 являє собою Н, R', (С1-С8)алкіл, (С1-С6)алкілен-R', (С1-С6)алкілен-О-(С1-С6)алкіл, (С1-С6)алкілен-О-R', (С1-С6)алкілен-СН[R']2, (С1-С6)алкілен-С(О)R', (С1-С6)алкілен-С(О)NH2, (С1-С6)алкілен-C(O)NH-R' або (С1-С6)алкілен-C(O)N[R']2;
R7 і R8 незалежно один від одного являють собою Н, галоген, CN, NO2, (С1-С6)алкіл, О-(С1-С6)алкіл, О-[(С1-С6)алкілен]0-1-R', (С2-С6)алкеніл, R', (С2-С6)алкенілен-(С6-С10)арил, (С1-С6)алкілен-R', NH2, NH-R', NH-SO2H, NH-SO2-(С1-С6)алкіл, NH-SO2-R', SO2-NH2, SO2-NH-R', NН-С(О)-(С1-С6)алкіл, NH-C(O)-R', C(O)N[(С1-С6)алкіл]2, C(O)OH або С(О)О-(С1-С6)алкіл;
R9 являє собою галоген або (С1-С6)алкіл;
n дорівнює 0, 1, 2, 3 або 4; і
L являє собою О або О-(С1-С6)алкілен;
де R' являє собою (С3-С8)циклоалкіл, (С5-С10)гетероцикліл або (С6-С10)арил; і
R" являє собою (С3-С8)циклоалкіл, (С5-С10)гетероцикліл, (С6-С10)арил, (С1-С6)алкіл, (С1-С6)алкілен-R', (С1-С6)алкілен-О-(С1-С6)алкіл, (С1-С6)алкілен-О-R' або (С1-С6)алкілен-NRxRy; і
де Rx і Ry незалежно один від одного являють собою (С1-С6)алкіл, (С5-С10)гетероцикліл, (С6-С10)арил, (С1-С4)алкілен-(С5-С10)гетероцикліл, (С1-С4)алкілен-(С6-С10)арил, (С1-С4)алкілен-NН(С1-С6)алкіл, (С1-С4)алкілен-N[(С1-С6)алкіл]2, (С1-С4)алкілен-N[(С6-С10)арил]2 або (С1-С4)алкілен-N[(С5-С10)гетероцикліл]2; і
де в групах R4, R5, R7 і R8 один алкільний або алкіленовий атом водню може бути необов'язково замінений на ОН, ОСН3, СООН, СООСН3, NH2, NHCH3, N(CH3)2, CONH2, CONHCH3 або CON(CH3)2, або алкіл або алкілен може бути галогенований в одному або більше положеннях;
або її фармацевтично прийнятні солі і/або стереоізомерні форми, і/або фізіологічно функціональні похідні.
2. Сполука формули (І) за п. 1, що являє собою сполуку формули (II)
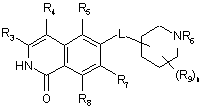 (II).
(II).
3. Сполука за будь-яким із пп. 1, 2, в якій R6 являє собою Н, (С1-С6)алкіл, R', (С1-С4)алкілен-(С3-С8)циклоалкіл, (С1-С4)алкілен-(С5-С10)гетероцикліл, (С1-С4)алкілен-С(O)-(С5-С10)гетероцикліл, (С1-С4)алкілен-С(О)-(С6-С10)арил або (С1-С6)алкілен-(С6-С10)арил.
4. Сполука за будь-яким із пп. 1-3, в якій R6 являє собою Н, (С1-С6)алкіл, (С5-С10)гетероцикліл, (С3-С8)циклоалкіл, (С1-С4)алкілен-(С3-С8)циклоалкіл, (С1-С4)алкілен-(С5-С10)гетероцикліл або (С1-С6)алкілен-(С6-С10)арил.
5. Сполука за будь-яким із пп. 1-4, в якій R6 являє собою Н, (С1-С6)алкіл, (С3-С8)циклоалкіл, (С1-С4)алкілен-(С3-С8)циклоалкіл, (С1-С4)алкілен-(С5-С10)гетероцикліл, в якому гетероцикліл є незаміщеним або заміщений (С1-С4)алкілом, або (С1-С4)алкілен-(С6-С10)арил, в якому арил є незаміщеним або заміщений галогеном, (С1-С4)алкілом, О-(С1-С4)алкілом, SО2-(С1-С4)алкілом або N[(С1-С4)алкіл]2.
6. Сполука за будь-яким із пп. 1-5, в якій R6 являє собою Н, (С1-С6)алкіл, (С3-С6)циклоалкіл або (С1-С4)алкілен-(С3-С6)циклоалкіл.
7. Сполука за будь-яким із пп. 1-6, в якій R6 являє собою Н або (С1-С6)алкіл.
8. Сполука за будь-яким із пп. 1-7, в якій R6 являє собою Н.
9. Сполука за будь-яким із пп. 1-8, в якій R5 являє собою Н, галоген, CN, (С1-С6)алкіл, R', NH-(C6-C10)apил або (С1-С6)алкілен-R'.
10. Сполука за будь-яким із пп. 1-9, в якій R5 являє собою Н, галоген, (С1-С6)алкіл, R', NH-(C6-C10)арил або (С1-С6)алкілен-R'.
11. Сполука за будь-яким із пп. 1-10, в якій R5 являє собою Н, галоген, (С1-С6)алкіл, (С6-С10)арил, (С5-С10)гетероарил, NH-(С6-С10)арил або (С1-С2)алкілен-(С6-С10)арил.
12. Сполука за будь-яким із пп. 1-11, в якій R5 являє собою Н, галоген, (С1-С6)алкіл, феніл або (С5-С6)гетероарил.
13. Сполука за будь-яким із пп. 1-12, в якій R5 являє собою Н, галоген або (С1-С6)алкіл.
14. Сполука за будь-яким із пп. 1-13, в якій R5 являє собою Н або галоген.
15. Сполука за будь-яким із пп. 1-14, в якій R5 являє собою Н.
16. Сполука за будь-яким із пп. 1-15, в якій R4 являє собою Н, галоген, CN, (С1-С6)алкіл, NH-(С6-С10)арил або (С1-С6)алкілен-R'.
17. Сполука за будь-яким із пп. 1-16, в якій R4 являє собою Н, галоген, (С1-С6)алкіл, NН-(С6-С10)арил або (С1-С6)алкілен-R'.
18. Сполука за будь-яким із пп. 1-17, в якій R4 являє собою Н, галоген, (С1-С6)алкіл, NH-(C6-C10)арил або (С1-С2)алкілен-(С6-С10)арил.
19. Сполука за будь-яким із пп. 1-18, в якій R4 являє собою Н, галоген або (С1-С6)алкіл.
20. Сполука за будь-яким із пп. 1-19, в якій R4 являє собою Н.
21. Сполука за будь-яким із пп. 1-20, в якій R7 і R8, кожен незалежно один від одного, являють собою Н, галоген, CN, (С1-С6)алкіл, О-(С1-С6)алкіл, (С2-С6)алкеніл, R' або (С1-С6)алкілен-(С3-С8)циклоалкіл.
22. Сполука за будь-яким із пп. 1-21, в якій R7 і R8, кожен незалежно один від одного, являють собою Н, галоген, CN, (С1-С4)алкіл, О-(С1-С4)алкіл, (С2-С4)алкеніл, феніл, (С5-С6)гетероарил, (С3-С6)циклоалкіл або (С1-С4)алкілен-(С3-С6)циклоалкіл.
23. Сполука за будь-яким із пп. 1-22, в якій R7 і R8, кожен незалежно один від одного, являють собою Н, галоген, (С1-С4)алкіл, О-(С1-С4)алкіл або феніл.
24. Сполука за будь-яким із пп. 1-23, в якій R7 і R8 являють собою Н.
25. Сполука за будь-яким із пп. 1-24, в якій R9 являє собою галоген або (С1-С4)алкіл.
26. Сполука за будь-яким із пп. 1-25, в якій R9 являє собою Сl, F, метил або етил.
27. Сполука за будь-яким із пп. 1-26, в якій R9 являє собою метил.
28. Сполука за будь-яким із пп. 1-27, в якій n дорівнює 0, 1, 2 або 3.
29. Сполука за будь-яким із пп. 1-28, в якій n дорівнює 0 або 1.
30. Сполука за будь-яким із пп. 1-24, в якій n дорівнює 0.
31. Сполука за будь-яким із пп. 1-30, в якій R3 являє собою Н, галоген, (С1-С6)алкіл, (С1-С4)алкілен-R', O-R" або NНR".
32. Сполука за будь-яким із пп. 1-31, в якій R3 являє собою Н, (С1-С4)алкіл або NHR".
33. Сполука за будь-яким із пп. 1-32, в якій R3 являє собою Н, (С1-С4)алкіл, NН-(С5-С6)гетероцикліл або NH-феніл.
34. Сполука за будь-яким із пп. 1-33, в якій R3 являє собою Н, (С1-С4)алкіл, NН-(С5-С6)гетероарил, що містить один або декілька атомів N, або NH-феніл.
35. Сполука за будь-яким із пп. 1-34, в якій R3 являє собою Н.
36. Сполука за будь-яким із пп. 1-35, в якій L приєднаний у положенні 4 циклогексильного кільця
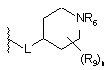 , або
, або
L приєднаний у положенні 3 циклогексильного кільця
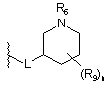 .
.
37. Сполука за будь-яким із пп. 1-36, в якій L приєднаний у положенні 4 циклогексильного кільця.
38. Сполука за будь-яким із пп. 1-37, в якій L являє собою О-метилен, О-етилен або О.
39. Сполука за будь-яким із пп. 1-38, в якій L являє собою О-метилен, О-етилен або О, приєднаний у положенні 4 циклогексильного кільця.
40. Сполука за будь-яким із пп. 1-39, в якій L являє собою О.
41. Сполука за будь-яким із пп. 1, 2, в якій
R3 являє собою Н, галоген, CN, (С1-С6)алкіл, (С1-С6)алкілен-R', ОН, O-R", NH2 aбo NHR";
R4 являє собою Н, галоген, гідрокси, CN, (С1-С6)алкіл, (С3-С8)циклоалкіл, (С1-С6)алкілен-R';
R5 являє собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С1-С6)алкілен-(С6-С10)арил, (С2-С6)алкенілен-(С6-С10)арил, (С1-С6)алкілен-(С5-С10)гетероцикліл, NH2, NH-R', NH-SO2H, NH-SO2-(С1-С6)алкіл, NH-SO2-R', NH-С(О)-(С1-С6)алкіл, NH-C(O)-R', С(О)N[(С1-С6)алкіл]2, С(О)ОН або С(О)О-(С1-С6)алкіл;
R6 являє собою Н, (С3-С8)циклоалкіл, (С1-С8)алкіл, (С1-С6)алкілен-R', (С1-С6)алкілен-О-(С1-С6)алкіл, (С1-С6)алкілен-О-R', (С1-С6)алкілен-СН[R']2, (С1-С6)алкілен-С(О)NH2, (С1-С6)алкілен-С(О)NН-R' або (С1-С6)алкілен-С(О)N[R']2;
R7 і R8, кожен незалежно один від одного, являють собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С2-С6)алкенілен-(С6-С10)арил, (С1-С6)алкілен-R', NH2, NH-R', NH-SO2-(С1-С6)алкіл, NH-SO2-R', SO2-NH2, SO2-NHR', NH-C(O)-(С1-С6)алкіл, NH-C(O)-R', С(О)N[(С1-С6)алкіл]2, С(О)ОН або С(О)О-(С1-С6)алкіл;
R9 являє собою галоген або (С1-С6)алкіл;
n дорівнює 0, 1, 2; і
L являє собою О або О-(С1-С3)алкілен;
або її фармацевтично прийнятні солі і/або стереоізомерні форми, і/або фізіологічно функціональні похідні.
42. Сполука за будь-яким із пп. 1, 2, в якій
R3 являє собою Н, галоген, CN, (С1-С6)алкіл, (С1-С2)алкілен-R' або NHR";
R4 являє собою Н, галоген, CN, (С1-С6)алкіл, (С3-С8)циклоалкіл, (С1-С2)алкілен-R';
R5 являє собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С1-С6)алкілен-(С6-С10)арил, (С2-С6)алкенілен-(С6-С10)арил, (С1-С6)алкілен-(С5-С10)гетероцикліл, NH2, NH-R', NН-С(О)-(С1-С6)алкіл або С(О)N[(С1-С6)алкіл]2;
R6 являє собою Н, (С3-С8)циклоалкіл, (С1-С8)алкіл або (С1-С3)aлкiлeн-R';
R7 і R8, кожен незалежно один від одного, являють собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С2-С3)алкенілен-(С6-С10)арил, (С1-С3)алкілен-R', NH-R', NH-SO2-(С1-С6)алкіл або SO2-NH2;
R9 являє собою галоген або (С1-С6)алкіл;
n дорівнює 0 або 1; і
L являє собою О або О-метилен;
або її фармацевтично прийнятні солі і/або стереоізомерні форми, і/або фізіологічно функціональні похідні.
43. Сполука за будь-яким із пп. 1, 2, в якій
R3 являє собою Н, галоген, CN, (С1-С6)алкіл, (С1-С2)алкілен-R' або NHR";
R4 являє собою Н, галоген, CN, (С1-С4)алкіл, (С3-С6)циклоалкіл, (С1-С2)алкілен-R';
R5 являє собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С1-С6)алкілен-(С6-С10)арил, (С2-С6)алкенілен-(С6-С10)арил, (С1-С6)алкілен-(С5-С10)гетероцикліл, NH-R';
R6 являє собою Н, (С3-С6)циклоалкіл або (С1-С4)алкіл;
R7 і R8, кожен незалежно один від одного, являють собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С2-С3)алкенілен-(С6-С10)арил, (С1-С3)алкілен-R', NH-SО2-(С1-С6)алкіл або SO2-NH2;
n дорівнює 0, і R9 відсутній, або
n дорівнює 1, і R9 являє собою галоген або (С1-С4)алкіл; і
L являє собою О;
або її фармацевтично прийнятні солі і/або стереоізомерні форми, і/або фізіологічні функціональні похідні.
44. Сполуки формули (І) або їхні фізіологічно прийнятні солі і/або стереоізомерні форми за будь-яким із пп. 1-43 для застосування як лікарського засобу.
45. Застосування принаймні однієї сполуки формули (І) або її фізіологічно прийнятних солей і/або стереоізомерних форм за будь-яким із пп. 1-43 для одержання лікарського засобу.
46. Застосування принаймні однієї сполуки формули (І) або її фізіологічно прийнятних солей і/або стереоізомерних форм за будь-яким із пп. 1-43 для одержання фармацевтичного засобу для лікування і/або запобігання захворюванням, пов'язаним з Rho-кіназою і/або активованим Rho-кіназою фосфорилуванням фосфатази легких ланцюгів міозину.
47. Застосування принаймні однієї сполуки формули (І) або її фізіологічно прийнятних солей і/або стереоізомерних форм за будь-яким із пп. 1-43 для одержання лікарського засобу для лікування і/або запобігання легеневій гіпертензії, гіпертензії, офтальмологічній гіпертензії, ретинопатії, глаукомі, порушенню периферичного кровообігу, периферичному оклюзійному ураженню артерії (PAOD), коронарній хворобі серця, стенокардії, гіпертрофії серця, серцевій недостатності, ішемічним захворюванням, ішемічній недостатності органа (пошкодження органа-мішені), пневмофіброзу, фіброзу печінки, печінковій недостатності, нефропатії, нирковій недостатності, фіброзу нирки, нирковому гломерулосклерозу, гіпертрофії органа, астмі, хронічному обструктивному захворюванню легень (COPD), синдрому розладу дихання у дорослих, тромботичним порушенням, удару, спазму судин головного мозку, ішемії судин головного мозку, болю, неврональній деградації, пошкодженню спинного мозку, хворобі Альцгеймера, передчасним пологам, порушенню ерекції, ендокринним порушенням, атеросклерозу, гіпертрофії простати, діабету та ускладненням діабету, метаболічному синдрому, рестенозу кровоносних судин, атеросклерозу, запаленню, автоімунним захворюванням, СНІДу, остеопатії, бактеріальній інфекції травного тракту, сепсису або розвитку і прогресії раку.
Текст
1. Сполука формули (І) R4 R5 C2 2 (19) 1 3 R4 93882 R5 R3 L NR6 R7 (R9)n HN O R8 (II). 3. Сполука за будь-яким із пп. 1, 2, в якій R6 являє собою Н, (С1-С6)алкіл, R', (С1-С4)алкілен(С3-С8)циклоалкіл, (С1-С4)алкілен-(С5-С10)гетероцикліл, (С1-С4)алкілен-С(O)-(С5-С10)гетероцикліл, (С1-С4)алкілен-С(О)-(С6-С10)арил або (С1-С6)алкілен-(С6-С10)арил. 4. Сполука за будь-яким із пп. 1-3, в якій R6 являє собою Н, (С1-С6)алкіл, (С5-С10)гетероцикліл, (С3-С8)циклоалкіл, (С1-С4)алкілен-(С3-С8)циклоалкіл, (С1-С4)алкілен-(С5-С10)гетероцикліл або (С1-С6)алкілен-(С6-С10)арил. 5. Сполука за будь-яким із пп. 1-4, в якій R6 являє собою Н, (С1-С6)алкіл, (С3-С8)циклоалкіл, (С1-С4)алкілен-(С3-С8)циклоалкіл, (С1-С4)алкілен(С5-С10)гетероцикліл, в якому гетероцикліл є незаміщеним або заміщений (С1-С4)алкілом, або (С1-С4)алкілен-(С6-С10)арил, в якому арил є незаміщеним або заміщений галогеном, (С1-С4)алкілом, О-(С1-С4)алкілом, SО2-(С1-С4)алкілом або N[(С1-С4)алкіл]2. 6. Сполука за будь-яким із пп. 1-5, в якій R6 являє собою Н, (С1-С6)алкіл, (С3-С6)циклоалкіл або (С1-С4)алкілен-(С3-С6)циклоалкіл. 7. Сполука за будь-яким із пп. 1-6, в якій R6 являє собою Н або (С1-С6)алкіл. 8. Сполука за будь-яким із пп. 1-7, в якій R6 являє собою Н. 9. Сполука за будь-яким із пп. 1-8, в якій R5 являє собою Н, галоген, CN, (С1-С6)алкіл, R', NH-(C6-C10)apил або (С1-С6)алкілен-R'. 10. Сполука за будь-яким із пп. 1-9, в якій R5 являє собою Н, галоген, (С1-С6)алкіл, R', NH-(C6-C10)арил або (С1-С6)алкілен-R'. 11. Сполука за будь-яким із пп. 1-10, в якій R5 являє собою Н, галоген, (С1-С6)алкіл, (С6-С10)арил, (С5-С10)гетероарил, NH-(С6-С10)арил або (С1-С2)алкілен-(С6-С10)арил. 12. Сполука за будь-яким із пп. 1-11, в якій R5 являє собою Н, галоген, (С1-С6)алкіл, феніл або (С5-С6)гетероарил. 13. Сполука за будь-яким із пп. 1-12, в якій R5 являє собою Н, галоген або (С1-С6)алкіл. 14. Сполука за будь-яким із пп. 1-13, в якій R5 являє собою Н або галоген. 15. Сполука за будь-яким із пп. 1-14, в якій R5 являє собою Н. 16. Сполука за будь-яким із пп. 1-15, в якій R4 являє собою Н, галоген, CN, (С1-С6)алкіл, NH-(С6-С10)арил або (С1-С6)алкілен-R'. 17. Сполука за будь-яким із пп. 1-16, в якій R4 являє собою Н, галоген, (С1-С6)алкіл, NН-(С6-С10)арил або (С1-С6)алкілен-R'. 18. Сполука за будь-яким із пп. 1-17, в якій R4 являє собою Н, галоген, (С1-С6)алкіл, NH-(C6-C10)арил або (С1-С2)алкілен-(С6-С10)арил. 4 19. Сполука за будь-яким із пп. 1-18, в якій R4 являє собою Н, галоген або (С1-С6)алкіл. 20. Сполука за будь-яким із пп. 1-19, в якій R4 являє собою Н. 21. Сполука за будь-яким із пп. 1-20, в якій R7 і R8, кожен незалежно один від одного, являють собою Н, галоген, CN, (С1-С6)алкіл, О-(С1-С6)алкіл, (С2-С6)алкеніл, R' або (С1-С6)алкілен-(С3-С8)циклоалкіл. 22. Сполука за будь-яким із пп. 1-21, в якій R7 і R8, кожен незалежно один від одного, являють собою Н, галоген, CN, (С1-С4)алкіл, О-(С1-С4)алкіл, (С2-С4)алкеніл, феніл, (С5-С6)гетероарил, (С3-С6)циклоалкіл або (С1-С4)алкілен-(С3-С6)циклоалкіл. 23. Сполука за будь-яким із пп. 1-22, в якій R7 і R8, кожен незалежно один від одного, являють собою Н, галоген, (С1-С4)алкіл, О-(С1-С4)алкіл або феніл. 24. Сполука за будь-яким із пп. 1-23, в якій R7 і R8 являють собою Н. 25. Сполука за будь-яким із пп. 1-24, в якій R9 являє собою галоген або (С1-С4)алкіл. 26. Сполука за будь-яким із пп. 1-25, в якій R9 являє собою Сl, F, метил або етил. 27. Сполука за будь-яким із пп. 1-26, в якій R9 являє собою метил. 28. Сполука за будь-яким із пп. 1-27, в якій n дорівнює 0, 1, 2 або 3. 29. Сполука за будь-яким із пп. 1-28, в якій n дорівнює 0 або 1. 30. Сполука за будь-яким із пп. 1-24, в якій n дорівнює 0. 31. Сполука за будь-яким із пп. 1-30, в якій R3 являє собою Н, галоген, (С1-С6)алкіл, (С1-С4)алкіленR', O-R" або NНR". 32. Сполука за будь-яким із пп. 1-31, в якій R3 являє собою Н, (С1-С4)алкіл або NHR". 33. Сполука за будь-яким із пп. 1-32, в якій R3 являє собою Н, (С1-С4)алкіл, NН-(С5-С6)гетероцикліл або NH-феніл. 34. Сполука за будь-яким із пп. 1-33, в якій R3 являє собою Н, (С1-С4)алкіл, NН-(С5-С6)гетероарил, що містить один або декілька атомів N, або NHфеніл. 35. Сполука за будь-яким із пп. 1-34, в якій R3 являє собою Н. 36. Сполука за будь-яким із пп. 1-35, в якій L приєднаний у положенні 4 циклогексильного кільця NR6 L (R9)n , або L приєднаний у положенні 3 циклогексильного кільця R6 N L (R9)n . 37. Сполука за будь-яким із пп. 1-36, в якій L приєднаний у положенні 4 циклогексильного кільця. 5 38. Сполука за будь-яким із пп. 1-37, в якій L являє собою О-метилен, О-етилен або О. 39. Сполука за будь-яким із пп. 1-38, в якій L являє собою О-метилен, О-етилен або О, приєднаний у положенні 4 циклогексильного кільця. 40. Сполука за будь-яким із пп. 1-39, в якій L являє собою О. 41. Сполука за будь-яким із пп. 1, 2, в якій R3 являє собою Н, галоген, CN, (С1-С6)алкіл, (С1-С6)алкілен-R', ОН, O-R", NH2 aбo NHR"; R4 являє собою Н, галоген, гідрокси, CN, (С1-С6)алкіл, (С3-С8)циклоалкіл, (С1-С6)алкілен-R'; R5 являє собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С1-С6)алкілен-(С6-С10)арил, (С2-С6)алкенілен-(С6-С10)арил, (С1-С6)алкілен(С5-С10)гетероцикліл, NH2, NH-R', NH-SO2H, NHSO2-(С1-С6)алкіл, NH-SO2-R', NH-С(О)-(С1-С6)алкіл, NH-C(O)-R', С(О)N[(С1-С6)алкіл]2, С(О)ОН або С(О)О-(С1-С6)алкіл; R6 являє собою Н, (С3-С8)циклоалкіл, (С1-С8)алкіл, (С1-С6)алкілен-R', (С1-С6)алкілен-О-(С1-С6)алкіл, (С1-С6)алкілен-О-R', (С1-С6)алкілен-СН[R']2, (С1-С6)алкілен-С(О)NH2, (С1-С6)алкілен-С(О)NН-R' або (С1-С6)алкілен-С(О)N[R']2; R7 і R8, кожен незалежно один від одного, являють собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С2-С6)алкенілен-(С6-С10)арил, (С1-С6)алкілен-R', NH2, NH-R', NH-SO2-(С1-С6)алкіл, NH-SO2-R', SO2-NH2, SO2-NHR', NH-C(O)(С1-С6)алкіл, NH-C(O)-R', С(О)N[(С1-С6)алкіл]2, С(О)ОН або С(О)О-(С1-С6)алкіл; R9 являє собою галоген або (С1-С6)алкіл; n дорівнює 0, 1, 2; і L являє собою О або О-(С1-С3)алкілен; або її фармацевтично прийнятні солі і/або стереоізомерні форми, і/або фізіологічно функціональні похідні. 42. Сполука за будь-яким із пп. 1, 2, в якій R3 являє собою Н, галоген, CN, (С1-С6)алкіл, (С1-С2)алкілен-R' або NHR"; R4 являє собою Н, галоген, CN, (С1-С6)алкіл, (С3-С8)циклоалкіл, (С1-С2)алкілен-R'; R5 являє собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С1-С6)алкілен-(С6-С10)арил, (С2-С6)алкенілен-(С6-С10)арил, (С1-С6)алкілен(С5-С10)гетероцикліл, NH2, NH-R', NН-С(О)(С1-С6)алкіл або С(О)N[(С1-С6)алкіл]2; R6 являє собою Н, (С3-С8)циклоалкіл, (С1-С8)алкіл або (С1-С3)aлкiлeн-R'; R7 і R8, кожен незалежно один від одного, являють собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С2-С3)алкенілен-(С6-С10)арил, (С1-С3)алкілен-R', NH-R', NH-SO2-(С1-С6)алкіл або SO2-NH2; R9 являє собою галоген або (С1-С6)алкіл; n дорівнює 0 або 1; і L являє собою О або О-метилен; або її фармацевтично прийнятні солі і/або стереоізомерні форми, і/або фізіологічно функціональні похідні. 43. Сполука за будь-яким із пп. 1, 2, в якій R3 являє собою Н, галоген, CN, (С1-С6)алкіл, (С1-С2)алкілен-R' або NHR"; R4 являє собою Н, галоген, CN, (С1-С4)алкіл, 93882 6 (С3-С6)циклоалкіл, (С1-С2)алкілен-R'; R5 являє собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С1-С6)алкілен-(С6-С10)арил, (С2-С6)алкенілен-(С6-С10)арил, (С1-С6)алкілен(С5-С10)гетероцикліл, NH-R'; R6 являє собою Н, (С3-С6)циклоалкіл або (С1-С4)алкіл; R7 і R8, кожен незалежно один від одного, являють собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С2-С3)алкенілен-(С6-С10)арил, (С1-С3)алкілен-R', NH-SО2-(С1-С6)алкіл або SO2NH2; n дорівнює 0, і R9 відсутній, або n дорівнює 1, і R9 являє собою галоген або (С1-С4)алкіл; і L являє собою О; або її фармацевтично прийнятні солі і/або стереоізомерні форми, і/або фізіологічні функціональні похідні. 44. Сполуки формули (І) або їхні фізіологічно прийнятні солі і/або стереоізомерні форми за будьяким із пп. 1-43 для застосування як лікарського засобу. 45. Застосування принаймні однієї сполуки формули (І) або її фізіологічно прийнятних солей і/або стереоізомерних форм за будь-яким із пп. 1-43 для одержання лікарського засобу. 46. Застосування принаймні однієї сполуки формули (І) або її фізіологічно прийнятних солей і/або стереоізомерних форм за будь-яким із пп. 1-43 для одержання фармацевтичного засобу для лікування і/або запобігання захворюванням, пов'язаним з Rho-кіназою і/або активованим Rho-кіназою фосфорилуванням фосфатази легких ланцюгів міозину. 47. Застосування принаймні однієї сполуки формули (І) або її фізіологічно прийнятних солей і/або стереоізомерних форм за будь-яким із пп. 1-43 для одержання лікарського засобу для лікування і/або запобігання легеневій гіпертензії, гіпертензії, офтальмологічній гіпертензії, ретинопатії, глаукомі, порушенню периферичного кровообігу, периферичному оклюзійному ураженню артерії (PAOD), коронарній хворобі серця, стенокардії, гіпертрофії серця, серцевій недостатності, ішемічним захворюванням, ішемічній недостатності органа (пошкодження органа-мішені), пневмофіброзу, фіброзу печінки, печінковій недостатності, нефропатії, нирковій недостатності, фіброзу нирки, нирковому гломерулосклерозу, гіпертрофії органа, астмі, хронічному обструктивному захворюванню легень (COPD), синдрому розладу дихання у дорослих, тромботичним порушенням, удару, спазму судин головного мозку, ішемії судин головного мозку, болю, неврональній деградації, пошкодженню спинного мозку, хворобі Альцгеймера, передчасним пологам, порушенню ерекції, ендокринним порушенням, атеросклерозу, гіпертрофії простати, діабету та ускладненням діабету, метаболічному синдрому, рестенозу кровоносних судин, атеросклерозу, запаленню, автоімунним захворюванням, СНІДу, остеопатії, бактеріальній інфекції травного тракту, сепсису або розвитку і прогресії раку. 7 Даний винахід стосується нових похідних ізохінолону та ізохіноліну, як описано у формулі винаходу, їхнього одержання і застосування для лікування і/або запобігання захворюванням, пов'язаним з інгібуванням Rho-кінази і/або активованого Rho-кіназою фосфорилування фосфатази легких ланцюгів міозину. Активування малої ГТФази RhoA під дією агоністичного впливу призводить до перетворення RhoA із неактивної ГДФ-зв'язаної форми в активну ГТФ-зв'язану форму з подальшим зв'язуванням і активуванням Rho-кінази. Відомі дві ізоформи, Rho-кіназа 1 і Rho-кіназа 2. Rho-кіназа 2 експресується в гладких м'язових клітинах кровоносних судин і ендотеліальних клітинах. Активація Rhoкінази 2 активної ГТФ-зв'язаної RhoA призводить до кальцієвої сенсибілізації клітин гладкої мускулатури за рахунок викликаного фосфорилуванням інгібування активності фосфатази легких ланцюгів міозину і, таким чином, підвищуючої регуляції активності регуляторних легких ланцюгів міозину (Uehata et al., Nature 1997, 389, 990-994). Відомо, що Rho-кіназа задіяна у звуженні кровоносних судин, включаючи розвиток міогенного тонусу і гіперскорочуваність гладкої мускулатури (Gokina et al. J. Appl. Physiol. 2005, 98, 1940-8), скорочуваність гладкої мускулатури бронхів (Yoshii et al. Am. J. Resp. Cell Mol. Biol. 20, 1190-1200), астму (Setoguchi et al. Br J Pharmacol. 2001, 132, 111-8; Nakahara, et al. Eur J 2000,389, 103) і хронічне обструктивне захворювання легень (COPD, Maruoka, Nippon Rinsho, 1999, 57, 1982-7), гіпертензію, легеневу гіпертензію (Fukumoto et al. Heart, 91, 391-2, 2005, Mukai et al. Nature 1991,389, 990-4) та офтальмологічну гіпертензію і регулювання внутрішньоочного тиску (Honjo et al. Invest. Ophthalmol. Visual Sсi. 2001, 42, 137-144), дисфункцію ендотелію (Steioff et al. Eur. J. Pharmacol. 2005, 512, 247-249), стенокардію (Masumoto et al. Circ 2002, 105, 1545-47, Shimokawa et al. JCP, 2002, 40, 751-761), нефропатію, включаючи індуковану гіпертензією, не індуковану гіпертензією і діабетичну нефропатії, ниркову недостатність і периферичне оклюзійне ураження артерії (PAOD) (Wakino et al. Drug News Perspect. 2005, 18, 63943), інфаркт міокарда (Demiryurek et al. Eur J Pharmacol. 2005, 527, 129-40, Hattori et al. Circulation, 2004, 109, 2234-9), гіпертрофію серця і серцеву недостатність (Yamakawa, et al. Hypertension 2000, 35, 313-318, Liao et al. Am J Physiol Cell Physiol. 2006, 290, C661-8, Kishi et al. Circ 2005, 111, 2741-2747), коронарну хворобу серця, атеросклероз, реностеноз (Pacaud et al. Arch. Mal. Coeur 2005, 98, 249-254, Retzer, et al. FEBS Lett 2000, 466, 70, Negoro, et al. Biochem Biophys Res Commun 1999, 262, 211), діабет, ускладнення діабету, утилізацію глюкози і метаболічний синдром (Sandu, et al. Diabetes 2000, 49, 2178, Maeda et al. Cell Metab. 2005, 2, 119-29), сексуальні дисфункції, наприклад, порушення ерективної здатності пенісу (Chitaley et al. Nature Medicine 2001, 7, 119 93882 8 122), ретинопатії, запалення, імунологічні захворювання, СНІД, остеопороз, ендокринні порушення, наприклад, гіперальдостеронізм, порушення центральної нервової системи, такі як недоумство і пошкодження спинного мозку (Hara, et al. J Neurosurg 2000, 93, 94), ішемія головного мозку (Uehata, et al. Nature 1997, 389, 990; Satoh et al. Life Sei. 2001, 69, 1441-53; Hitomi, et al. Life Sei 2000, 67, 1929; Yamamoto, et al. J Cardiovasc Pharmacol. 2000, 35, 203-11), спазм судин головного мозку (Sato, et al. Circ Res 2000, 87, 195; Kim, et al. Neurosurgery 2000, 46, 440), біль, наприклад, невропатичний біль (Tatsumi, et al. Neuroscience 2005, 131, 491, Inoue, et al. Nature medicine 2004, 10, 712), бактеріальну інфекцію травного тракту (WO 98/06433), розвиток і прогресію раку, неоплазію, де було показано, що інгібування Rho-кінази призводить до інгібування зростання пухлинних клітин і метастазів (Itoh, et al. Nature Medicine 1999, 5, 221; Somlyo, et al. Res Commun 2000, 269, 652), ангіогенез (Uchida, et al. Biochem Biophys Res 2000, 269, 633-40; Gingras, et al. Biochem J 2000, 348, 273), проліферацію і скорочувальну здатність клітин гладкої мускулатури кровоносних судин (Tammy et al. Circ. Res. 1999, 84, 1186-1193; Tangkijvanich et al. Atherosclerosis 2001, 155, 321327), проліферацію ендотеліальних клітин, скорочення і скорочувальну здатність ендотеліальних клітин (Oikawa et al. Biochem. Biophys. Res. Commun. 2000, 269, 633-640), утворення тонофібрил (Kimura et al. Science 1997, 275, 1308-1311; Yamashiro et al. J. Cell Biol. 2000, 150, 797-806), тромбозні порушення (Kikkawa, et al. FEBS Lett. 2000, 466, 70-74; Bauer et al. Blood 1999, 94, 16651672, Klages, et al. J Cell Biol. 1999, 144, 745; Retzer, et al. Cell Signal 2000, 12, 645) й агрегацію лейкоцитів (Kawaguchi, et al. Eur J Pharmacol. 2000, 403:203-8; Sanchez-Madrid, et al. J Immunol. 2003, 171:1023-34, Sanchez-Madrid, et al. J Immunol. 2002, 168:400-10), і резорбцію кістки (Chellaiah, et al. J Biol. Chem. 2003, 278:29086-97), активацію Na/H обмінної транспортної системи (Kawaguchi, et al. Eur J Pharmacol. 2000, 403:2038), хворобу Альцгеймера (Zhou et al. Science 2003, 302, 1215-1217), активацію адуцину (Fukata et al. J. Biol. Chem., 1998, 273, 5542-5548), і у SREB (чутливий до стеролу зв'язувальний елемент) сигнальної системи та її дії на метаболізм ліпідів (Lin et al. Circ. Res., 92, 1296-304, 2003). Таким чином, сполука, що має інгібуючий вплив на Rho-кіназу і/або активоване Rho-кіназою фосфорилування фосфатази легких ланцюгів міозину є придатним для лікування і/або запобігання серцево-судинним або не серцево-судинним захворюванням, в яких Rho-кіназа є первинною або вторинною причиною захворювань, таких як гіпертензія, легенева гіпертензія, офтальмологічна гіпертензія, ретинопатія і глаукома, порушення периферичного кровообігу, периферичне оклюзійне ураження артерії (PAOD), коронарна хвороба серця, стенокардія, гіпертрофія серця, серцева недо 9 статність, ішемічні захворювання, ішемічна недостатність органу (пошкодження органу-мішені), пневмофіброз, фіброз печінки, печінкова недостатність, нефропатія, включаючи викликану гіпертензією, не викликану гіпертензією і діабетичну нефропатії, ниркова недостатність, фіброз нирок, нирковий гломерулосклероз, гіпертрофія органу, астма, хронічне обструктивне захворювання легень (COPD), синдром розладу дихання у дорослих, тромботичні порушення, удар, спазм судин головного мозку, ішемія судин головного мозку, біль, наприклад, невропатичний біль, нервова деградація, ушкодження спинного мозку, хвороба Альцгеймера, передчасні пологи, порушення ерекції, ендокринні порушення, атеросклероз, гіпертрофія простати, діабет і ускладнення діабету, метаболічний синдром, рестеноз кровоносних судин, атеросклероз, запалення, автоімунні захворювання, СНІД, остеопатія, така як остеопороз, бактерільна інфекція травного тракту, сепсис, розвиток і прогресія раку, наприклад раку грудей, товстої кишки, простати, яєчників, мозку і легень та їхні метастази. У WO 01/64238 описані похідні ізохінолін-5сульфонаміду, необов'язково заміщені -(CH2)1-6-O(CH2)0-6-, -(CH2)1-6-S-(CH2)0-6- або -(СН2)0-6-зв'язаної гетероциклічною групою, придатні як нейропротекторні агенти. У WO 2004/106325 (Schering AG) описані проліки інгібітора Rho-кінази фазудилу, що мають просту або складну ефірну групу в положенні-1 ізохінолінового кільця. У WO 2001/039726 загалом описані -O-(С0С10)алкіл-гетероарил заміщені циклогексильні похідні, придатні для лікування мікробних інфекцій. У JP 10087629 А описані похідні ізохіноліну, придатні для лікування захворювань, викликаних Heliobacter pylori, таких як, наприклад, гастрит, рак або виразка. Похідні ізохіноліну можуть бути заміщені ОН у положенні-1 і переважно являють собою 5-заміщені Х-[(С1-С6)алкілен)]0-1-Y, де X може являти собою кисень і Υ може являти собою арил або гетероциклічну групу. Yoshida et al. (Bioorg. Med. Chem. 1999, 7, 2647-2666) описують 6-бензилоксі-ізохінолін для лікування інфекцій, викликаних Heliobacter pylori. У патенті США 5480883 загалом описані як інгібітори EGF і/або PDGF рецептора, що придатні для інгібування клітинної проліферації, сполуки формули "Аr 1-Х-Аr ll", де X може являти собою (CHR1)m-Z-(CHR1)n, наприклад, Z-CH2, де Ζ може являти собою О, R1 являє собою водень або алкіл, Аr І може серед іншого являти собою необов'язково заміщений ізохінолон, і Аr II може серед іншого являти собою необов'язково заміщену С3-7 моноциклічну насичену гетероциклічну систему. У WO 2005/030791 (Merck & Co.) загалом описані як інгібітори калієвих каналів для лікування аритмій серця, удару, гострої серцевої недостатності і т.д. похідні ізохінолону, які необов'язково можуть бути заміщені в положенні-6 групою (CReRf)pOR43, де p може дорівнювати нулю і R43 являє собою, наприклад, групу R81, визначену як 46 членне ненасичене або насичене моноциклічне гетероциклічне кільце з 1, 2, 3 або 4 гетероатома 93882 10 ми, вибраними з Ν, Ο або S; і заміщені безпосередньо зв'язаним у положенні-4 з необов'язково заміщеним арильним або гетероарильним кільцем. У WO 2005/030130 (Merck & Co.) загалом описані як інгібітори калієвих каналів для лікування аритмій серця, удару, гострої серцевої недостатності і т.д. похідні ізохіноліну, які можуть бути заміщені гідроксилом у положенні-1 і необов'язково заміщені в положенні-6 групою (CReRf)pOR43, де p може дорівнювати нулю і R43 являє собою, наприклад, групу R81, визначену як 4-6-членне ненасичене або насичене моноциклічне гетероциклічне кільце з 1,2,3 або 4 гетероатомами, вибраними з N, О або S; і заміщені безпосередньо зв'язаним у положенні-4 із необов'язково заміщеним арильним або гетероарильним кільцем. У WO 03/053330 (Ube) описані похідні ізохінолону формули як інгібітори Rho-кінази. Один з варіантів даного винаходу являє собою сполуку формули (І) де R2 являє собою Н, (С1-С6)алкіл, [(С1-С6)алкілен]0-1-R', [(С1-С6)алкілен]0-1-О-(С1-С6)алкіл, [(С1-С6)алкеніл]0-1-O-R', [(С1-С6)алкілен]0-1-NН2, [(С1-С6)алкілен]0-1-NH(С1-С6)алкіл, [(С1-С6)алкілен]0-1-N[(С1-С6)алкіл]2, [(С1-С6)алкілен]0-1СН[R']2, [(С1-С6)алкілен]0-1-C(O)-R', [(С1-С6)алкілен]0-1C(O)NH2, [(С1-С6)алкілен]0-1-C(O)NH-R' або [(C1-C6)алкілен]0-1-C(O)N[R']2; R3 являє собою Н, галоген, CN, (С1-С6)алкіл, (С1-С6)алкілен-R', ОН, O-R", NH2, NHR", NR"R" або NH-C(O)-R"; R4 являє собою Н, галоген, гідрокси, CN, (С1-С6)алкіл, (С3-С8)циклоалкіл, (С1-С6)алкілен-R'; R5 являє собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2-С6)алкеніл, R', (С1-С6)алкілен-(С6С10)арил, (С2-С6)алкенілен-(С6-С10)арил, (С1С6)алкілен-(С5-С10)гетероцикліл, NH2, NH-R', NHSO2H, NН-SО2-(С1-С6)алкіл, NH-SO2-R', NH-С(О)(С1-С6)алкіл, NH-C(O)-R', С(О)N[(С1-С6)алкіл]2, С(О)ОН або С(О)О-(С1-С6)алкіл; R6 являє собою Н, R', (С1-С8)алкіл, (С1С6)алкілен-R', (С1-С6)алкілен-О-(С1-С6)алкіл, (С1С6)алкілен-О-R', (С1-С6)алкілен-СН[R']2, (С1С6)алкілен-С(О)-R', (С1-С6)алкілен-С(О)NH2, (С1С6)алкілен-C(O)NH-R' або (С1-С6)алкіленC(O)N[R']2; 11 R7 і R8 незалежно один від одного являють собою Н, галоген, CN, NO2, (С1-С6)алкіл, О-(С1С6)алкіл, О-[(С1-С6)алкілен]0-1-R', (С2-С6)алкеніл, R', (С2-С6)алкенілен-(С6-С10)арил, (С1-С6)алкілен-R', NH2, NH-R', NH-SO2H, NH-SO2-(С1-С6)алкіл, NHSO2-R', SO2-NH2, SO2-NHR', NН-С(О)-(С1-С6)алкіл, NH-C(O)-R', C(O)N[(С1-С6)алкіл]2, C(O)OH або С(О)О-(С1-С6)алкіл; R9 являє собою галоген або (С1-С6)алкіл; n дорівнює 0, 1, 2, 3 або 4; і L являє собою О або О-(С1-С6)алкілен; де R' являє собою (С3-С8)циклоалкіл, (С5С10)гетероцикліл або (С6-С10)арил; і R" являє собою (С3-С8)циклоалкіл, (С5С10)гетероцикліл, (С6-С10)арил, (С1-С6)алкіл, (С1С6)алкілен-R', (С1-С6)алкілен-О-(С1-С6)алкіл, (С1С6)алкілен-О-R' або (С1-С6)алкілен-NRxRy; і де Rx і Ry незалежно один від одного являють собою (С1-С6)алкіл, (С5-С10)гетероцикліл, (С6С10)арил, (С1-С4)алкілен-(С5-С10)гетероцикліл, (С1С4)алкілен-(С6-С10)арил, (С1-С4)алкілен-NН(С1С6)алкіл, (С1-С4)алкілен-N[(С1-С6)алкіл]2, (С1С4)алкілен-N[(С6-С10)арил]2 або (С1-С4)алкіленN[(С5-С10)гетероцикліл]2; і де в групах R4, R5, R7 і R8 один алкільний або алкіленовий атом водню може бути необов'язково замінений на ОН, ОСН3, СООН, СООСН3, NH2, NHCH3, N(CH3)2, CONH2, CONHCH3 або CON(CH3)2, або алкіл або алкілен може бути галогенований в одному або більше положеннях; або її фармацевтично прийнятні солі і/або стереоізомерні форми, і/або фізіологічно функціональні похідні. В іншому варіанті здійснення сполуки формули (І) у групах R4, R5, R7 і R8 один алкільний або алкіленовий атом водню може бути необов'язково замінений на ОН, F, ОСН3, СООН, СООСН3, NH2, NHCH3, N(CH3)2, CONH2, CONHCH3 або CON(CH3)2. Стереоізомерні форми похідних ізохіноліну формули (І) включають відповідні таутомерні 1гідрокси-заміщені ізохінолінові похідні формули (l') де R1 являє собою Н, (С1-С6)алкіл, (С2С6)алкеніл, (С2-С6)алкініл, [(С1-С6)алкілен]0-1-(С3С8)циклоалкіл, [(С1-С6)алкілен]0-1-(С5С10)гетероцикліл, [(С1-С6)алкілен]0-1-(С6-С10)арил, С(О)-(С1-С6)алкіл, С(О)(С2-С6)алкеніл, С(О)(С2С6)алкініл, С(О)-[(С1-С6)алкілен]0-1-(С3С8)циклоалкіл, С(О)-[(С1-С6)алкілен]0-1-(С5С10)гетероцикліл, або С(О)-[(С1-С6)алкілен]0-1-(С6С10)арил, і де R3, R4, R5, R6, R7, R8, R9, n і L являють собою такі самі, як описано вище. 93882 12 У переважному варіанті здійснення винаходу R2 у сполуці формули (І) являє собою Н, сполука, таким чином, характеризується формулою (II) У додатковому переважному варіанті здійснення винаходу R1 у сполуці формули (l') являє собою Н, сполука, таким чином, характеризується формулою (II') Сполуки формули (II) і (Іl') являють собою взаємно таутомерні форми. Наприклад, сполука формули являє собою таутомерну форму сполуки формули Наступні переважні варіанти здійснення стосуються формул (І), (l'), (II) і (Іl'): R3 переважно являє собою Н, галоген, (С1С6)алкіл, (С1-С4)алкілен-R', O-R'' або NHR". Переважніше R3 являє собою Н, (С1-С6)алкіл або NRH". Переважніше, R3 являє собою Н, (С1-С4)алкіл, NH(С5-С6)гетероцикліл або NH-феніл, особливо переважно R3 являє собою Н, (С1-С4)алкіл, NH-(С5С6)гетероарил, що містить один або декілька атомів N, або NH-феніл. Переважніше R3 являє собою Н. Переважно R4 являє собою Н, галоген, CN, (С1-С6)алкіл, NH-(С6-С10)арил або (С1-С6)алкіленR'. Переважніше, R4 являє собою Н, галоген, (С1С6)алкіл, NH-(C6-С10)арил або (С1-С6)алкілен-R'. У додатковому переважному варіанті здійснення R4 являє собою Н, галоген, (С1-С6)алкіл, NH-(С6С10)арил або (С1-С2)алкілен-(С6-С10)арил. Най 13 більш переважно, R4 являє собою Н, галоген або (С1-С6)алкіл. Особливо переважно, R4 являє собою Н, галоген або (С1-С6)алкіл. Найбільш переважно, R4 являє собою Н. Переважно, R5 являє собою Н, галоген, CN, (С1-С6)алкіл, R', NH-(С6-С10)арил або (С1С6)алкілен-R'. Переважніше, R5 являє собою Н, галоген, (С1-С6)алкіл, R', NH-(С6-С10)арил або (С1С6)алкілен-R'. У додатковому переважному варіанті здійснення R5 являє собою Н, галоген, (С6С10)арил, NH-(С6-С10)арил, (С1-С2)алкілен-(С6С10)арил, (С1-С6)алкіл або (С5-С10)гетероарил. Найбільш переважно, R5 являє собою Н, галоген, феніл, (С1-С6)алкіл або (С5-С6)гетероарил. Особливо переважно, R5 являє собою Н, галоген або (С1-С6)алкіл. Більшою мірою переважно R5 являє собою Η або галоген. Найбільш переважно, R5 являє собою Н. Переважно, R6 являє собою Н, (С1-С6)алкіл, R', (С1-С4)алкілен-(С3-С8)циклоалкіл, (С1-С4)алкілен(С5-С10)гетероцикліл, (С1-С4)алкілен-С(О)-(С5С10)гетероцикліл, (С1-С4)алкілен-С(О)-(С6-С10)арил або (С1-С6)алкілен-(С6-С10)арил. У додатковому переважному варіанті здійснення R6 являє собою Н, (С1-С6)алкіл, (С5-С10)гетероцикліл, (С3С8)циклоалкіл, (С1-С4)алкілен-(С3-С8)циклоалкіл, (С1-С4)алкілен-(С5-С10)гетероцикліл або (С1С6)алкілен-(С6-С10)арил. Переважніше, R6 являє собою Н, (С1-С6)алкіл, (С3-С8)циклоалкіл, (С1С4)алкілен-(С3-С8)циклоалкіл, (С1-С4)алкілен-(С5С10)гетероцикліл або (С1-С6)алкілен-(С6-С10)арил. У переважнішому варіанті здійснення винаходу R6 являє собою Н, (С1-С6)алкіл, (С3-С8)циклоалкіл, 93882 14 (С1-С4)алкілен-(С3-С8)циклоалкіл, (С1-С4)алкілен(С5-С10)гетероцикліл, в якому гетероцикліл є незаміщеним або заміщений (С1-С4)алкілом або являє собою (С1-С4)алкілен-(С6-С10)арил, в якому арил є незаміщеним або заміщений, переважно в одномутрьох положеннях, галогеном, (С1-С4)алкілом, особливо метилом, етилом, ізопропілом, або 3,3,3трифторметилом, О-( С1-С4)алкілом, особливо метокси, SО2-(С1-С4)алкілом, особливо SO2-CH3 або SO2-CF3, або N[(С1-С4)алкілом]2, особливо N(CH3)2. Більшою мірою у переважному варіанті здійснення R6 являє собою Н, (С1-С6)алкіл, (С3С8)циклоалкіл, (С1-С4)алкілен-(С3-С8)циклоалкіл, (С1-С2)алкілен-тієніл, (С1-С2)алкілен-піридил, (С1С2)алкілен-піперидиніл, (С1-С2)алкілен-піролідиніл, (С1-С2)алкілен-1-метил-піроліл, (С1-С2)алкілен-1метил-піразоліл, (С1-С2)алкілен-фураніл, (С1С2)алкілен-тетрагідрофураніл або (С1-С2)алкілен1Н-індазоліл, (С1-С2)алкілен-нафтил або (С1С2)алкілен-феніл, де феніл є незаміщеним або заміщений галогеном, метилом, етилом, ізопропілом, 3,3,3-трифторметилом, метокси, SO2-CH3, SO2-CF3 або N(CH3)2; переважно (С1-С2)алкілен являє собою метилен. У переважнішому варіанті здійснення R6 являє собою Н, (С1-С6)алкіл, (С3С8)циклоалкіл або (С1-С4)алкілен-(С3С6)циклоалкіл. У додатковому переважнішому варіанті здійснення R6 являє собою Н, (С1-С6)алкіл. У найпереважнішому варіанті здійснення R6 являє собою Н. Прикладами R6 груп є водень, метил, етил, пропіл, ізопропіл, циклопропіл, 3метилбутил, бутил, ізобутил, 3,3,3-трифторпропіл або замісники, вибрані з групи, що складається з 15 Зірочка (*) означає місце приєднання до Nатома піперидину. Переважно, R7 і R8, кожен незалежно один від одного, являє собою Н, галоген, CN, (С1-С6)алкіл, О-(С1-С6)алкіл, (С2-С6)алкеніл, R' або (С1С6)алкілен-(С3-С8)циклоалкіл. Переважніше, R7 і R8 незалежно один від одного являють собою Н, галоген, CN, (С1-С4)алкіл, О-(С1-С4)алкіл, (С2С4)алкеніл, феніл, (С3-С6)циклоалкіл, (С1С4)алкілен-(С3-С6)циклоалкіл або (С5С6)гетероарил. Ще переважніше, R7 і R8 незалежно один від одного являють собою Н, галоген, (С1С4)алкіл, О-(С1-С4)алкіл або (С3-С6)циклоалкіл. Найбільш переважно, R7 являє собою Н, галоген, (С1-С4)алкіл або О-(С1-С4)алкіл, і R8 являє собою Н. У ще одному навіть переважнішому варіанті здійснення, R7 і R8 незалежно один від одного являють собою Н, галоген, (С1-С4)алкіл, О-(С1С4)алкіл або феніл. Особливо переважно, R7 і R8 являють собою Н. R9 переважно являє собою галоген або (С1С4)алкіл. Переважніше, R9 являє собою СІ, F, метил або етил. Переважніше, R9 являє собою метил. Переважно, n дорівнює 0, 1, 2 або 3. Переважніше, n дорівнює 0 або 1. Переважніше, n дорівнює 0. Лінкерна група L може бути зв'язана з піперидинільним кільцем у будь-якому положенні через атом вуглецю піперидинільного кільця і може, таким чином, утворювати (R)- або (S)-стереоізомер сполуки згідно з винаходом. У переважному варіанті здійснення L приєднана в положенні-4 піперидинільного кільця 93882 16 L приєднаний у положенні-3 піперидинільного кільця у всіх їхніх стереохімічних формах. Зокрема в переважному варіанті здійснення L приєднана в положенні-4 піперидинільного кільця. Переважно, L являє собою О-метилен, Оетилен або О. Переважніше, L являє собою Ометилен, О-етилен або, найбільш переважно, О, приєднані в положенні-4 піперидинільного циклу. Найбільш переважно L являє собою О. У переважних варіантах здійснення даного винаходу одна або декілька, або всі групи, що містяться в сполуках формул (І) або (l'), можуть незалежно один від одного мати переважні, більш переважні або найбільш переважні визначення груп, зазначені вище, або будь-яке або деяке конкретне значення, яке включене у визначення груп і зазначене вище, всі комбінації переважних визначень, переважніших або найбільш переважних і/або конкретних значень являють собою предмет даного винаходу. Також стосовно всіх переважних варіантів здійснення винахід включає сполуки формул (І) або (l') у всіх стереоізомерних формах і 17 суміші стереоізомерних форм у будь-яких співвідношеннях і/або їхні фізіологічно прийнятні солі. Переважний варіант здійснення даного винаходу являє собою сполуку формули (І), (l'), (ll) або (II'), де R3 являє собою Н, галоген, CN, (С1-С6)алкіл, (С1-С6)алкілен-R', ОН, O-R", NH2 або NHR"; R4 являє собою Н, галоген, гідрокси, CN, (С1С6)алкіл, (С3-С8)циклоалкіл, (С1-С6)алкілен-R'; R5 являє собою Н, галоген, CN, NO2, (С1С6)алкіл, (С2-С6)алкеніл, R', (С1-С6)алкілен-(С6С10)арил, (С2-С6)алкенілен-(С6-С10)арил, (С1С6)алкілен-(С5-С10)гетероцикліл, NH2, NH-R', NHSO2H, NН-SО2-( С1-С6)алкіл, NH-SO2-R', NH-С(О)(С1-С6)алкіл, NH-C(O)-R', С(О)N[(С1-С6)алкіл]2, С(О)ОН або С(О)О-(С1-С6)алкіл; R6 являє собою Н, (С3-С8)циклоалкіл, (С1С8)алкіл, (С1-С6)алкілен-R', (С1-С6)алкілен-О-(С1С6)алкіл, (С1-С6)алкілен-О-R', (С1-С6)алкіленСН[R']2, (С1-С6)алкілен-С(О)NH2, (С1-С6)алкіленС(О)NН-R' або (C1-C6)алкілен-C(O)N[R']2; R7 і R8 незалежно один від одного являють собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2С6)алкеніл, R', (С2-С6)алкенілен-(С6-С10)арил, (С1С6)алкілен-R', NH2, NH-R', NH-SO2-(C1-C6)алкіл, NH-SO2-R', SO2-NH2, SO2-NHR', NH-C(O)-(С1С6)алкіл, NH-C(O)-R', С(О)N[(С1-С6)алкіл]2, С(О)ОН або С(О)О-(С1-С6)алкіл; R9 являє собою галоген або (С1-С6)алкіл; n дорівнює 0, 1, 2; і L являє собою О або О-(С1-С3)алкілен; де R1, R2, R', R", Rx і Ry такі самі, як визначено вище; або їхні фармацевтично прийнятні солі і/або стереоізомерні форми і/або фізіологічні функціональні похідні. Додатковий переважний варіант здійснення даного винаходу являє собою сполуку формули (І), (l'), (II) або (ll'), де R3 являє собою Н, галоген, CN, (С1-С6)алкіл, (С1-С2)алкілен-R' або NHR"; R4 являє собою Н, галоген, CN, (С1-С6)алкіл, (С3-С8)циклоалкіл, (С1-С2)алкілен-R'; R5 являє собою Н, галоген, CN, NO2, (С1С6)алкіл, (С2-С6)алкеніл, R', (С1-С6)алкілен-(С6С10)арил, (С2-С6)алкенілен-(С6-С10)арил, (С1С6)алкілен-(С5-С10)гетероцикліл, NH2, NH-R', NHС(О)-( С1-С6)алкіл або С(О)N[(С1-С6)алкіл]2; R6 являє собою Н, (С3-С8)циклоалкіл, (С1С8)алкіл або (C1-C3)aлкiлeн-R'; R7 і R8 незалежно один від одного являють собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2С6)алкеніл, R', (С2-С3)алкенілен-(С6-С10)арил, (С1С3)алкілен-R', NH-R', NH-SО2-(С1-С6)алкіл або SO2NH2; R9 являє собою галоген або (С1-С6)алкіл; n дорівнює 0 або 1; і L являє собою О- або О-метилен; де R1, R2, R', R", Rx і Ry такі ж, як визначено вище; або їхні фармацевтично прийнятні солі і/або стереоізомерні форми і/або фізіологічні функціональні похідні. 93882 18 Найбільш переважний варіант здійснення даного винаходу являє собою сполуку формули (І), (l'), (II) або (ll'), де R3 являє собою Н, галоген, CN, (С1-С6)алкіл, (С1-С2)алкілен-R' або NHR"; R4 являє собою Н, галоген, CN, (С1-С4)алкіл, (С3-С6)циклоалкіл, (С1-С6)алкілен-R'; R5 являє собою Н, галоген, CN, NO2, (С1С6)алкіл, (С2-С6)алкеніл, R', (С1-С6)алкілен-(С6С10)арил, (С2-С6)алкенілен-(С6-С10)арил, (С1С6)алкілен-(С5-С10)гетероцикліл, NH-R'; R6 являє собою Н, (С3-С8)циклоалкіл або (С1С4)алкіл; R7 і R8 незалежно один від одного являють собою Н, галоген, CN, NO2, (С1-С6)алкіл, (С2С6)алкеніл, R', (С2-С3)алкенілен-(С6-С10)арил, (С1С3)алкілен-R', NH-SО2-(С1-С6)алкіл або SO2-NH2; n дорівнює 0, і R9 відсутній, або n дорівнює 1, і R9 являє собою галоген або (С1-С4)алкіл; і L являє собою О; де R1, R2, R', R", Rx і Ry такі ж, як визначено вище; або їхні фармацевтично прийнятні солі і/або стереоізомерні форми і/або фізіологічні функціональні похідні. Інший переважний варіант здійснення даного винаходу являє собою сполуку формули (І), (l'), (II) або (Іl'), де R3 являє собою Н, галоген, CN, (С1-С6)алкіл, (С1-С6)алкілен-R', ОН, O-R", NH2 або NHR"; R4 являє собою Н, галоген, гідрокси, CN, (С1С6)алкіл, (С3-С8)циклоалкіл, (С1-С6)алкілен-R'; R5 являє собою Н, галоген, CN, NO2, (С1С6)алкіл, (С2-С6)алкеніл, R', (С1-С6)алкілен-(С6С10)арил, (С2-С6)алкенілен-(С6-С10)арил, (С1С6)алкілен-(С5-С10)гетероцикліл, NH2, NH-R', NHSO2H, NН-SО2-(С1-С6)алкіл, NH-SO2-R', NH-С(О)-( С1-С6)алкіл, NH-C(O)-R', С(О)N[(С1-С6)алкіл]2, С(О)ОН або С(О)О-(С1-С6)алкіл; R6 являє собою Η, (С3-С8)циклоалкіл, (С1С8)алкіл, (С1-С6)алкілен-R', (С1-С6)алкілен-О-(С1С6)алкіл, (С1-С6)алкілен-О-R', (С1-С6)алкіленСН[R']2, (С1-С6)алкілен-С(О)NH2, (С1-С6)алкіленС(О)NН-R' або (С1-С6)алкілен-С(О)N[R']2; R7 і R8 незалежно один від одного являють собою Н, галоген, CN, NO2, (С1-С6)алкіл, О-(С1С6)алкіл, (С2-С6)алкеніл, R', (С2-С6)алкенілен-(С6С10)арил, (С1-С6)алкілен-R', NH2, NH-R', NН-SО2(С1-С6)алкіл, NH-SO2-R', SO2-NH2, SO2-NHR', NНС(О)-( С1-С6)алкіл, NH-C(O)-R', С(О)N[(С1С6)алкіл]2, С(О)ОН або С(О)О-(С1-С6)алкіл; R9 являє собою галоген або (С1-С6)алкіл; n дорівнює 0, 1, 2; і L являє собою О або О-(С1-С4)алкілен; де R1, R2, R', R", Rx і Ry такі ж, як визначено вище; або їхні фармацевтично прийнятні солі і/або стереоізомерні форми і/або фізіологічні функціональні похідні. Додатковий переважний варіант здійснення даного винаходу являє собою сполуку формули (І), (l'), (II) або (Іl'), де R3 являє собою Н, галоген, CN, (С1-С6)алкіл або (С1-С2)алкілен-R'; 19 R4 являє собою Н, галоген, CN, (С1-С6)алкіл або (С1-С2)алкілен-R'; R5 являє собою Н, галоген, CN, NO2, (С1С6)алкіл; R6 являє собою Н, (С3-С8)циклоалкіл, (С1С8)алкіл, (С1-С3)алкілен-(С3-С6)циклоалкіл, (С1С3)алкілен-(С6-С10)арил або (С1-С3)алкілен-(С5С10)гетероцикліл; R7 і R8 незалежно один від одного являють собою Н, галоген, CN, NO2, (С1-С6)алкіл, О-(С1С6)алкіл, (С3-С6)циклоалкіл або феніл; R9 являє собою галоген або (С1-С6)алкіл; n дорівнює 0 або 1; і L являє собою О або О-метилен; де R1, R2, R' такі ж, як визначено вище; або їхні фармацевтично прийнятні солі і/або стереоізомерні форми і/або фізіологічні функціональні похідні. Найбільш переважний варіант здійснення даного винаходу являє собою сполуку формули (І), (l'), (II) або (Іl'), де R3 являє собою Н; R4 являє собою Н, галоген або (С1-С4)алкіл; R5 являє собою Н, галоген або (С1-С6)алкіл; R6 являє собою Н, (С3-С6)циклоалкіл, (С1С4)алкіл, (С1-С2)алкілен-(С3-С6)циклоалкіл, (С1С4)алкілен-(С5-С10)гетероцикліл, в якому гетероцикліл являє собою незаміщений або заміщений (С1С4)алкілом або являє собою (С1-С4)алкілен-(С6С10)арил, в якому арил незаміщений або заміщений галогеном, (С1-С4)алкілом, О-(С1-С4)алкілом, SО2-(С1-С4)алкілом або N[(С1-С4)алкілом]2; R7 і R8 незалежно один від одного являють собою Н, галоген, (С1-С4)алкіл, О-(С1-С4)алкіл або феніл; R9 являє собою (С1-С4)алкіл; n дорівнює 0 або 1; і L являє собою О; де R1, R2 такі самі, як визначено вище, переважно R1 являє собою Н, і R2 являє собою Н; або їхні фармацевтично прийнятні солі і/або стереоізомерні форми і/або фізіологічні функціональні похідні. Як і в будь-якому варіанті здійснення винаходу, у попередніх варіантах здійснення, які містять переважні, переважніші, найбільш переважні або наведені як приклад визначення сполук згідно з винаходом, одна або декілька або всі групи можуть мати будь-які з їх переважних, переважніших, найбільш переважних визначень, зазначених вище, або будь-яке одне або деякі конкретні значення, які включені в їхні визначення і зазначені вище. Фізіологічні прийнятні солі сполук формул (І) і (l') означають як їхні органічні, так і неорганічні солі, як описано в Remington's Pharmaceutical Sciences (17th edition, p. 1418 (1985)). Через фізичну і хімічну стабільність і розчинність для кислотних груп перевагу віддають, серед інших, натрієвим, калієвим, кальцієвим і амонієвим солям; для основних груп перевагу віддають солям малеїнової кислоти, бурштинової кислоти, яблучної кислоти, винної кислоти, метилсульфонової кислоти, соляної кислоти, сірчаної кислоти, фосфорної кислоти або карбонової кислоти, або сульфонових кислот, наприклад, у вигляді гідрохлоридів, гідроб 93882 20 ромідів, фосфатів, сульфатів, метансульфонатів, ацетатів, лактатів, малеатів, фумаратів, малатів, глюконатів і солей амінокислот, природних основ або карбонових кислот. Одержання фізіологічно прийнятних солей сполук формул (І) або (l'), які здатні утворювати солі, включаючи їхні стереоізомерні форми, проводять відомими способами. Сполуки формули (І) утворюють стабільні солі лужних металів, лужноземельних металів або необов'язково заміщені амонієві солі з основними реагентами, такими як гідроксиди, карбонати, бікарбонати, алкоголяти та аміак або органічні основи, наприклад, триметил- або триетиламін, етаноламін, діетаноламін або триетаноламін, трометамол або інші основні амінокислоти, наприклад, лізин, орнітин або аргінін. Якщо сполуки формул (І) і (l') містять основні групи, можуть також бути одержані стабільні кислотно-адитивні солі з сильними кислотами. Придатні фармацевтично прийнятні кислотно-адитивні солі сполук за винаходом являють собою солі неорганічних кислот, таких як соляна кислота, бромистоводнева, фосфорна, метафосфорна, азотна і сірчана кислота, та органічних кислот, таких як, наприклад, оцтова кислота, бензолсульфонова, бензойна, лимонна, етансульфонова, фумарова, глюконова, гліколева, ізотіонова, молочна, лактобіонова, малеїнова, яблучна, метансульфонова, бурштинова, п-толуолсульфонова і винна кислота. Солі фізіологічно неприйнятних аніонів, такі як, наприклад, трифторацетат, також входять в обсяг застосування винаходу як важливі проміжні сполуки для одержання або очищення фармацевтично прийнятних солей і/або для використання в не терапевтичних цілях, наприклад, in vitro. Термін "фізіологічні функціональні похідні", що використовується тут, стосується будь-якої фізіологічно переносимої похідної сполуки формул (І) і (l') за винаходом, наприклад, N-оксиду, який при введенні ссавцеві, такому як, наприклад, людина, здатний утворювати (безпосередньо або через проміжну стадію) сполуку формули (І) і (l') або їхній активний метаболіт. Фізіологічні функціональні похідні включають проліки сполук за винаходом, як описано, наприклад, у Н. Okada et al., Chem. Pharm. Bull. 1994, 42, 57-61. Такі проліки можуть зазнавати метаболізму in vivo з утворенням сполуки за винаходом. Такі проліки можуть бути активними або неактивними. Винахід стосується сполук формули (І) або (l') у формі їх рацематів, рацемічних сумішей і чистих енантіомерів, та їхніх діастереомерів, і їхніх сумішей. Якщо радикали або замісники присутні більш ніж в одному положенні в сполуці формул (І) і (l'), вони можуть все, незалежно один від іншого, мати зазначені значення і бути однаковими або різними. Сполуки за винаходом можуть також існувати у вигляді різних поліморфних форм і/або сольватів, наприклад, у вигляді аморфних і кристалічних поліморфних форм. Всі поліморфні форми сполук за винаходом входять до обсягу застосування винаходу та являють собою додатковий об'єкт винаходу. 21 Всі посилання на "сполуку(и) формули (І)" або "сполуку(и) формули (l')" тут і далі стосуються сполук формули (І) і (l'), як описано вище, та їхніх фізіологічно прийнятних солей, сольватів і фізіологічних функціональних похідних, як описано тут. Термін "алкіл" і відповідні алкіленові замісники означають вуглеводневий залишок, який може бути лінійним, тобто з прямим ланцюгом, або розгалуженим і має 1, 2, 3, 4, 5 або 6 атомів вуглеводню, відповідно, якщо є застосовним. Цей термін також застосовують, якщо алкільна група присутня як замісник іншої групи, наприклад, в алкокси групі (О-алкіл), S-алкіл або О(С1-С6)алкілен-О-, алкоксикарбонільній групі або арилалкільній групі. Прикладами алкільних груп є метил, етил, пропіл, бутил, пентил або гексил, н-ізомери всіх зазначених груп, ізопропіл, ізобутил, 1-метилбутил, ізопентил, неопентил, 2,2-диметилбутил, 2-метилпентил, 3метилпентил, ізогексил, втор-бутил, трет-бутил або трет-пентил. Алкільні групи можуть бути, якщо не зазначено інакше, галогенованими в одному або декількох положеннях, наприклад, алкільні групи можуть бути фторованими, наприклад, перфторованими. Прикладами галогенованих алкільних груп є CF3 і CH2CF3, OCF3, SCF3 або O-(CF2)2O. Алкеніл являє собою, наприклад, вініл, 1пропеніл, 2-пропеніл (=аліл), 2-бутеніл, 3-бутеніл, 2-метил-2-бутеніл, 3-метил-2-бутеніл, 5-гексеніл або 1,3-пентадієніл. Алкініл являє собою, наприклад, етиніл, 1-пропініл, 2-пропініл (=пропаргіл) або 2-бутиніл. Галоген означає фтор, хлор, бром або йод. (С3-С8)циклоалкільні групи являють собою циклічні алкільні групи, що містять 3, 4, 5, 6, 7 або 8 атомів вуглецю в циклі, як циклопропіл, циклобутил, циклопентил, циклогексил або циклооктил, які також можуть бути заміщеними і/або містять 1 або 2 подвійні зв'язки (незаміщені циклоалкільні групи), як, наприклад, циклопентенил або циклогексеніл можуть бути зв'язані через будь-який атом вуглецю. (С6-С10)арильна група означає ароматичний цикл або циклічну систему, яка включає два ароматичних кільця, які конденсовані або зв'язані іншим способом, наприклад, феніл, нафтил, біфеніл, тетрагідронафтил, альфа- або бета-тетралон-, інданіл- або індан-1-он-іл група. Переважна (С6С10)арильна група являє собою феніл. (С5-С10)гетероциклічна група означає моноабо біциклічну кільцеву систему, яка включає крім вуглецю один або декілька гетероатомів, таких як, наприклад, 1, 2 або 3 атоми азоту, 1 або 2 атоми кисню, 1 або 2 атоми сірки або комбінацію різних гетероатомів. Гетероциклічні залишки можуть бути зв'язані в будь-якому положенні, наприклад, у положенні-1, положенні-2, положенні-3, положенні-4, положенні-5, положенні-6, положенні-7 або положенні-8. (С5-С10)гетероциклічні групи можуть являти собою (1) ароматичну [=гетероарильну групи] або (2) насичену або (3) змішану ароматичну/насичену. Придатні (С5-С10)гетероциклічні групи включають акридиніл, азоциніл, бензімідазоліл, бензофурил, бензоморфолініл, бензотієніл, бензотіофеніл, 93882 22 бензоксазоліл, бензтіазоліл, бензтриазоліл, бензтетразоліл, бензізоксазоліл, бензізотіазоліл, карбазоліл, 4аН-карбазоліл, карболініл, фураніл, хіназолініл, хінолініл, 4Н-хінолізиніл, хіноксалініл, хінуклідиніл, хроманіл, хроменіл, хромен-2-оніл, цинолініл, декагідрохінолініл, 2Н, 6Н-1,5,2дитіазиніл, дигідрофуро[2,3,b]-тетрагідрофуран, фурил, фуразаніл, гомоморфолініл, гомопіперазиніл, імідазолідиніл, імідазолініл, імідазоліл, 1Ніндазоліл, індолініл, індолізиніл, індоліл, 3Ніндоліл, ізобензофураніл, ізохроманіл, ізоіндазоліл, ізоіндолініл, ізоіндоліл, ізохінолініл (бензімідазоліл), ізотіазоліл, ізоксазоліл, морфолініл, нафтиридиніл, октагідроізохінолініл, оксадіазоліл, 1,2,3оксадіазоліл, 1,2,4-оксадіазоліл, 1,2,5оксадіазоліл, 1,3,4-оксадіазоліл, оксазолідиніл, оксазоліл, оксазолідиніл, піримідиніл, фенантридиніл, фенантролініл, феназиніл, фенотіазиніл, феноксатієніл, феноксазиніл, фталазиніл, піперазиніл, піперидиніл, пролініл, птеридиніл, пуриніл, піраніл, піразиніл, піразолідиніл, піразолініл, піразоліл, піридазиніл, піридоніл, піридооксазоли, піридоімідазоли, піридотіазоли, піридиніл, піридил, піримідиніл, піролідиніл, піролініл, 2Н-піроліл, піроліл, тетрагідрофураніл, тетрагідроізохінолініл, тетрагідрохінолініл, 6Н-1,2,5-тіадазиніл, тіазоліл, 1,2,3-тіадіазоліл, 1,2,4-тіадіазоліл, 1,2,5тіадіазоліл, 1,3,4-тіадіазоліл, тієніл, триазоліл, тетразоліл і ксантеніл. У ролі піридилу розуміють як 2-, так 3- і 4-піридил. Тієніл означає як 2-, так і 3тієніл. Фурил означає як 2-, так і 3-фурил. Також включені відповідні N-оксиди зазначених сполук, наприклад, 1-окси-2-, 3-або 4-піридил. Замісники в (С5-С10)гетероциклічних залишках можуть розташовуватися на вільних атомах вуглецю або на атомах азоту. Переважними прикладами (С5С10)гетероциклічних залишків є піразиніл, піридил, піримідиніл, піразоліл, морфолініл, піролідиніл, піперазиніл, піперидиніл, тієніл, бензофурил, хінолініл, тетразоліл і триазоліл. (С6-С10)арильні і (С5-С10)гетероциклічні групи є незаміщеними або, якщо не зазначено інакше, заміщені придатними групами в одному або декількох положеннях придатними групами, незалежно вибраними з галогену, CF3, NO2, N3, CN, С(О)(С1-С6)алкілу, С(О)-(С1-С6)арилу, СООН, СОО(С1С6)алкілу, CONH2, СОNH(С1-С6)алкілу, СОN[(С1С6)алкілу]2, (С3-С8)циклоалкілу, (С1-С6)алкілу, (С1С6)алкілен-ОН, (С1-С6)алкілен-NH2, (С1-С6)алкіленNН(С1-С6)алкілу, (С1-С6)алкілен-N[(С1-С6)алкілу]2, (С2-С6)алкенілу, (С2-С6)алкінілу, О-(С1-С6)алкілу, О-С(О)-(С1-С6)алкілу, О-С(О)(С6-С10)арилу, ОС(О)-(С5-С10)гетероциклілу, РО3Н2, SO3H, SO2-NH2, SО2NН(С1-С6)алкілу, SО2N[(С1-С6)алкілу]2, S-(С1С6)алкілу, S-(С1-С6)алкілен-(С6-С10)арилу, S-(С1С6)алкілен-(С5-С10)гетероциклілу, SО-(С1С6)алкілу, SO-(С1-С6)алкілен-(С6-С10)арилу, SO(С1-С6)алкілен-(С5-С10)гетероциклілу, SO2-(С1С6)алкілу, SО2-(С1-С6)алкілен-(С6-С10)арилу, SО2(С1-С6)алкілен-(С5-С10)гетероциклілу, SO2-NН(С1С6)алкілен-(С6-С10)арилу, SО2-NН(С1-С6)алкілен(С5-С10)гетероциклілу, SO2-N[(С1-С6)алкіл][(С1С6)алкілен-(С6-С10)арилу], SO2-N[(C1-С6)алкіл][(С1С6)алкілен-(С5-С10)гетероциклілу], SO2-N[(C1 23 С6)алкілен-(С6-С10)арилу]2, SО2-N[(С1-С6)алкілен(С5-С10)гетероциклілу]2, C(NH)(NH2), NH2, NH-(С1С6)алкілу, N[(С1-С6)алкілу]2, NН-С(О)-(С1-С6)алкілу, NH-С(О)О-(С1-С6)алкілу, NН-С(О)-(С6-С10)арилу, NН-С(О)-(С5-С10)гетероциклілу, NН-С(О)О-(С6С10)арилу, NH-C(O)O-(C5-C10)гетероциклілу, NHC(O)-NH-(С1-C6)алкілу, NH-C(O)-NH-(C6-С10)арилу, NН-С(О)-NН-(С5-С10)гетероциклілу, NН-SО2-(С1С6)алкілу, NH-SO2-(C6-С10)арилу, NН-SO2-(С5С10)гетероциклілу, N(С1-С6)алкіл-С(О)-(С1С6)алкілу, N(С1-С6)алкіл-С(О)О-(С1-С6)алкілу, N(С1С6)алкіл-С(О)-(С6-С10)арилу, N(С1-С6)алкіл-С(О)гетероциклілу, N(С1-С6)алкіл-С(O)O-(С6-С10)арилу, N(С1-С6)алкіл-С(O)O-(С5-С10)гетероциклілу, N(C1С6)алкіл-C(O)-NH-(C1-С6)алкілу, N(C1-С6)алкілС(О)-NН-(С6-С10)арилу, N(С1-С6)алкіл-С(О)-NН-(С5С10)гетероциклілу, N[(С1-С6)алкіл]-С(О)-N[С1С6)алкілу]2, N[(С1-С6)алкіл]-С(О)-N[(С1-С6)алкіл](С6-С10)арилу, N[(C1-С6)алкіл]-С(O)-N[(С1-С6)алкіл](С5-С10)гетероциклілу, N[(С1-С6)алкіл]-С(O)-N[(С6С10)арилу]2, N[(С1-С6)алкіл]-С(О)-N(С5С10)[гетероциклілу]2, N[(С6-С10)арил]-С(О)-(С1С6)алкілу, N[(С5-С10)гетероцикліл]-С(О)-(С1С6)алкілу, N[(C6-C10)арил]-C(O)O-(С1-С6)алкілу, N[(С5-С10)гетероцикліл]-С(O)O-(С1-С6)алкілу, N(арил)-С(О)-(С6-С10)арилу, N[(С5С10)гетероцикліл]-С(О)-С6-С10)арилу, N[С6С10)арил]-С(O)O-(С6-С10)арилу, N[(С5С10)гетероцикліл]-С(O)O-(С6-С10)арилу, N[(C6C10)арил]-C(O)-NH-(С1-С6)алкілу, N[(С5С10)гетероцикліл]-С(О)-NН-(С1-С6)алкілу, N(арил)C(O)-NH-(С6-С10)арилу, N[С5-С10)гетероцикліл]С(О)-NН-(С6-С10)арилу, N[С6-С10)арил]-С(О)-N[С1С6)алкілу]2, N[(С5-С10)гетероцикліл]-С(О)-N[(С1С6)алкілу]2, N[(C6-С10)арил]-С(O)-N[(С1-С6)алкіл](С6-С10)арилу, N[(С5-С10)гетероцикліл]-С(О)-N[С1С6)алкіл]-(С6-С10)арилу, N[(С6-С10)арил]-С(О)N[(С6-С10)арилу]2, N[(C5-С10)гетероцикліл]-С(O)N[(С6-С10)арилу]2, (С6-С10)арилу, (С1-С6)алкілен(С6-С10)арилу, О-(С1-С6)алкілен-(С6-С10)арилу, (С5С10)гетероциклілу, (С1-С6)алкілен-(С5С10)гетероциклілу, О-(С1-С6)алкілен-(С5С10)гетероциклілу, де (С6-С10)арил або (С5С10)гетероцикліл може бути заміщеним у від одного до трьох положеннях галогеном, ОН, NO2, CN, О-(С1-С6)алкілом, (С1-С6)алкілом, NH2, NH(С1С6)алкілом, N[С1-С6)алкілом]2, SO2CH3, СООН, С(О)О-(С1-С6)алкілом, CONH2, (С1-С6)алкілен-О(С1-С6)алкілом, (С1-С6)алкілен-О-(С6-С10)арилом, О-(С1-С6)алкілен-(С6-С10)арилом; або де (С6С10)арил заміщений у віцинальному положенні О(С1-С4)алкілен-O групою, за рахунок чого утворюється 5-8-членний цикл разом з атомами вуглецю, до яких приєднані атоми кисню. Арильні або гетероциклільні замісники (С6-С10)арильної і (С5С10)гетероциклільної груп не можуть мати додаткових замісників, що містять арильну або гетероциклільну групу. У разі заміщення переважними замісниками (С6-С10)арильних груп є (С1-С4)алкіл, О-(С1С4)алкіл, О-феніл, С(О)О-(С1-С6)алкіл, С(О)ОН, С(О)-(С1-С4)алкіл, галоген, NO2, SO2NH2, CN, SО2(С1-С4)алкіл, NH-SO2-(С1-C4алкіл, NH2, NH-C(O)(С1-С4)алкіл, (С3-С8)циклоалкіл, (С1-С4)алкіл-ОН, С(О)N[(С1-С4)алкіл]2, C(O)NH2, N[(C1-C4)aлкiл]2, 93882 24 (С1-С4)алкенілен-(С6-С10)арил, де (С6-С10)арил може бути додатково заміщеним (С1-С4)алкілом, (С1-С4)алкілен-О-(С1-С6)алкілом, О-(С1-С6)алкіл(С6-С10)арилом або може бути заміщений у віцинальному положенні О-(С1-С4)алкілен-O групою, за рахунок чого утворюється 5-8-членний цикл разом з атомами вуглецю, до яких приєднані атоми кисню. Переважніше, замісники (С6-С10)арилу являють собою галоген, (С1-С4)алкіл, особливо метил, етил, ізопропіл або 3,3,3-трифторметил, О-(С1С4)алкіл, особливо метокси, SО2-(С1-С4)алкіл, особливо SO2-CH3 або SO2-CF3, або Н[(С1-С4)алкіл]2, особливо N(CH3)2. У монозаміщених фенільних групах замісник може знаходитися в положенні-2, положенні-3 або в положенні-4, де переважні положення-3 і положення-4. У фенільних групах, які несуть два замісники, вони можуть розташовуватися в положеннях-2,3, положеннях-2,4, положеннях-2,5, положеннях-2,6, положеннях-3,4 або положеннях3,6. У фенільних групах, які несуть три замісники, замісники можуть розташовуватися в положеннях2,3,4, положеннях-2,3,5, положеннях-2,3,6, положеннях-2,4,5, положеннях-2,4,6 або положеннях3,4,6. Викладені вище положення, що стосуються фенільних груп, відповідним чином є застосовними до двовалентних груп, одержаних із фенільних груп, тобто фенілену, який може бути незаміщеним або заміщеним 1,2-феніленом, 1,3-феніленом або 1,4-феніленом. Викладені вище положення також відповідним чином є застосовними до арильних підгруп в арилалкіленових групах. Приклади арилалкіленових груп, які також можуть бути заміщеними або незаміщеними в арильній підгрупі, як і в алкіленовій підгрупі, являють собою бензил, 1фенілетилен, 2-фенілетилен, 3-фенілпропілен, 4фенілбутилен, 1-метил-3-фенілпропілен. У разі наявності замісників переважні замісники для (С5-С10)гетероциклічних груп являють собою (С1-С4)алкіл, О-(С1-С4)алкіл, (С1-С4)алкіленфеніл, галоген, (С1-С4)алкілен-О-(С1-С4)алкіл, (С5С10)гетероцикліл, (С1-С4)алкілен-N[(С1-С4)алкіл]2 або (С6-С10)арил, в яких (С6-С10)арил може бути додатково заміщений (С1-С4)алкілом, (С1С4)алкілен-О-(С1-С6)алкілом, О-(С1-С6)алкіл-(С6С10)арилом або може бути заміщений у віцинальному положенні O-(С1-С4)алкілен-O групою, за рахунок чого утворюється 5-8-членний цикл разом з атомами вуглецю, до яких приєднані атоми кисню. Переважніше, замісники (С5-С10)гетероциклілу являють собою (С1-С4)алкіл. Загальні і переважні замісники (С6С10)арильної і (С5-С10)гетероциклільної груп можна комбінувати із загальними і переважними визначеннями R1, R2, R3, R4, R5, R6, R7, R8, R9, n і L, як описано вище. Даний винахід таким чином також стосується сполук формул (І) або (l') або їх фізіологічно прийнятних солей і/або стереоізомерних форм для застосування у ролі фармацевтичних засобів (або лікарських засобів), застосування сполук формул (І) або (l') або їхніх фізіологічно прийнятних солей і/або стереоізомерних форм для одержання фармацевтичних засобів для лікування і/або запобігання захворюванням, пов'язаним із Rho-кіназою 25 і/або Rho-кіназою фосфорилуванням фосфатази легких ланцюгів міозину, що активується, тобто для лікування і/або запобігання гіпертензії, легеневої гіпертензії, офтальмологічної гіпертензії, ретинопатії, глаукоми, порушення периферичного кровообігу, периферичного оклюзійного ураження артерії (PAOD), коронарної хвороби серця, стенокардії, гіпертрофії серця, серцевої недостатності, ішемічних хвороб, ішемічної недостатності органу (пошкодження органу-мішені), пневмофіброзу, фіброзу печінки, печінкової недостатності, нефропатії, включаючи викликану гіпертензією, не викликану гіпертензією і діабетичну нефропатії, ниркової недостатності, фіброзу нирок, ниркового гломерулосклерозу, гіпертрофії органу, астми, хронічного обструктивного захворювання легень (COPD), синдрому розладу дихання у дорослих, тромботичних порушень, удару, спазму судин головного мозку, ішемії судин головного мозку, болю, наприклад, невропатичного болю, нервової деградації, ушкодження спинного мозку, хвороби Альцгеймера, передчасних пологів, порушення ерекції, ендокринних порушень, атеросклерозу, гіпертрофії простати, діабету та ускладнень діабету, метаболічного синдрому, рестенозу кровоносних судин, атеросклерозу, запалення, автоімунних захворювань, СНІДу, остеопатії, такої як остеопороз, бактеріальної інфекції травного тракту, сепсису, розвитку і прогресії раку, наприклад, раку грудей, товстої кишки, простати, яєчників, мозку і легені та їхніх метастазів. Лікування і/або запобігання захворюванням у людини являє собою переважний варіант здійснення, але при використанні сполук за даним винаходом можна також лікувати теплокровних тварин, таких як коти, собаки, щурі, коні та ін. Даний винахід додатково стосується фармацевтичних складів (або фармацевтичних композицій), які містять ефективну кількість принаймні однієї сполуки формули (І) або (l') або їхніх фізіологічно прийнятних солей і/або стереоізомерних форм і фармацевтично прийнятний носій, тобто одну або декілька фармацевтично прийнятних речовин носія (або наповнювача) і/або добавок (або ексципієнтів). Необов'язково, фізіологічні функціональні похідні, включаючи проліки, сполуки формули (І) або (l') можна використовувати для зазначених вище застосувань і фармацевтичних складів. Фармацевтичні засоби можна вводити перорально, наприклад у формі пілюль, таблеток, таблеток із гладким покриттям, таблеток із покриттям, гранул, твердих і м'яких желатинових капсул, розчинів, сиропів, емульсій, суспензій або аерозольних сумішей. У той же час введення можна провести ректально, наприклад, у формі супозиторіїв, або парентерально, наприклад, внутрішньовенно, внутрішньом'язово або підшкірно, у формі розчинів для ін'єкцій або розчинів для інфузії, мікрокапсул, імплантантів або стрижнеподібних капсул, або черезшкірно або місцево, наприклад, у формі мазей, розчинів або настойок, або іншими способами, наприклад, у формі аерозолів або назальних спреїв. 93882 26 Фармацевтичні склади згідно з винаходом одержують при використанні способів, відомих у даній галузі і фахівцеві в даній галузі техніки, додатково до сполуки(ук) формул (І) або (l') або її(їхніх) фізіологічно прийнятних солей і/або її(їхніх) стереоізомерних форм, а також їхніх проліків використовують фармацевтично прийнятні інертні неорганічні і/або органічні сполуки носія і/або добавки. Для одержання пілюль, таблеток, покритих таблеток і твердих желатинових капсул можна використовувати, наприклад, лактозу, кукурудзяний крохмаль або його похідні, тальк, стеаринову кислоту або її солі і т.д. Сполуки носіїв для м'яких желатинових капсул і супозиторіїв являють собою, наприклад, жири, воски, напівтверді та рідкі поліоли, природні або гідровані масла і т.д. Придатні сполуки носіїв для приготування розчинів, наприклад, розчини для ін'єкцій або емульсій або сиропи, являють собою, наприклад, воду, фізіологічний розчин, спирти, гліцерин, поліоли, сахарозу, інвертований цукор, глюкозу, рослинні олії і т.д. Придатні сполуки носіїв для мікрокапсул, імплантантів або стрижнеподібних капсул являють собою, наприклад, співполімери гліколевої кислоти і молочної кислоти. Фармацевтичні склади звичайно містять від приблизно 0,5 до приблизно 90% за масою сполук формул (І) або (l') або їх фізіологічно прийнятних солей і/або стереоізомерних форм. Кількість активного інгредієнта формул (І) або (l') і/або їх фізіологічно прийнятних солей і/або стереоізомерних форм у фармацевтичних складах звичайно складає від приблизно 0,5 до приблизно 1000 мг, переважно від приблизно 1 до приблизно 500 мг. Додатково до активних інгредієнтів формул (І) або (l') і/або їхніх фізіологічно прийнятних солей і/або стереоізомерних форм і сполук носія фармацевтичні склади можуть містити одну або декілька добавок, таких як, наприклад, наповнювачі, агенти, що викликають дезінтеграцію, зв'язувальні, змащувальні агенти, змочувальні агенти, стабілізатори, емульгатори, консерванти, підсолоджувачі, барвники, смакові добавки, ароматизатори, загусники, розріджувачі, буферні сполуки, розчинники, солюбілізатори, агенти для досягнення депоефекту, солі, що змінюють осмотичний тиск, засоби для глазурування, та антиоксиданти. Фармацевтичні склади також можуть містити дві або більше сполук формул (І) і/або (l') і/або їхні фізіологічно прийнятні солі і/або їхні стереоізомерні форми. У разі фармацевтичних складів, що містять дві або більше сполук формул (І) і/або (l'), вибір конкретної сполуки може ґрунтуватися на конкретному загальному фармацевтичному профілі фармацевтичного препарату. Наприклад, високоактивну сполуку з коротким періодом дії можна об'єднувати зі сполукою з низькою активністю, діючою протягом тривалого часу. Легкість із точки зору вибору замісників у сполуках формул (І) або (l') дозволяє значною мірою контролювати біологічні і фізикохімічні властивості сполук, таким чином дозволяючи вибирати такі цільові сполуки. Більше того додатково до принаймні однієї сполуки формул (І) або (l') і/або їх фізіологічно прийнятних солей і/або стереоізомерних форм, фармацевтичні склади 27 також можуть містити один або декілька інших терапевтично або профілактично активних інгредієнтів. При використанні сполук формули (І) або (l') доза може змінюватися в широкому діапазоні і, як прийнято і добре відомо терапевту, її потрібно підбирати, виходячи з індивідуальних умов у кожному конкретному випадку. Доза залежить, наприклад, від конкретної сполуки, що використовується, природи і важкості захворювання, що піддається лікуванню, від типу і графіка введення і залежить від того, гострий або хронічний стан піддають лікуванню або здійснюють профілактику. Придатну дозу можна визначити при використанні клінічних способів, добре відомих у медицині. Загалом денна доза для досягнення заданих результатів для дорослої людини вагою приблизно 75 кг складає від приблизно 0,01 до приблизно 100 мг/кг, переважно від приблизно 0,1 до приблизно 50 мг/кг, особливо від приблизно 0,1 до приблизно 10 мг/кг (у кожному випадку мг на кг маси тіла). Денна доза може бути розділена, особливо у разі введення відносно великих кількостей, на декілька, наприклад 2, 3 або 4, прийомів. Як звичайно, залежно від індивідуального стану може виявитися необхідним відхилення у більший або менший бік від зазначеної денної дози. Більше того, сполуки формул (І) або (l') можуть використовуватися як синтетичні проміжні сполуки для одержання інших сполук, особливо інших фармацевтичних активних інгредієнтів, які можна одержати зі сполуки формули І, наприклад, шляхом введення замісника або модифікацією функціональних груп. Необхідно розуміти, що модифікації, які не впливають значним чином на активність у різних варіантах здійснення винаходу, включені у винахід, що описується тут. Не обмежуючи обсяг винаходу, сполуки формул (І) або (l') можуть бути одержані подібним чи 93882 28 ном із наступними сполуками, наведеними як приклад. У загальному випадку, захисні групи, які можуть залишатися в продуктах, одержаних у реакціях сполучення, потім видаляють при використанні стандартних способів. Наприклад, трет-бутильні захисні групи, особливо трет-бутоксикарбонільна група, яка являє собою захисну групу для аміногрупи, може бути знята, тобто перетворена в аміногрупи за допомогою обробки трифтороцтовою кислотою. Як вже пояснювалося вище, після реакції сполучення також можуть бути одержані функціональні групи з придатних груп-попередників. Додатково, потім можна провести перетворення сполуки формули (І) або (l') у фізіологічно прийнятну сіль або проліки, при використанні відомих способів. У загальному випадку обробляють реакційну суміш, що містить кінцеву сполуку формул (І) або (l') або проміжну сполуку, і, якщо бажано, продукт потім очищають при використанні звичайних способів, відомих фахівцям у даній галузі техніки. Наприклад, синтезована сполука може бути очищена при використанні добре відомих способів, таких як кристалізація, хроматографія або високоефективна рідинна хроматографія із оберненою фазою (RP-HPLC), або інших способів розділення, які базуються, наприклад, на розмірі, заряді або гідрофобності сполуки. Подібним чином, для характеризації сполуки за винаходом можна використовувати добре відомі способи, такі як аналіз амінокислотної послідовності, ЯМР, ІЧ і масспектрометрія (MC). Ізохінолінони можуть бути синтезовані при використанні різних способів. Наступна загальна схема ілюструє деякі можливі шляхи одержання ізохінолонів, але не обмежує даний винахід. Схема 1 29 93882 30 Придатним чином заміщений альдегід, наприклад, заміщений X або Y, що являють собою, незалежно один від одного, водень, алкіл, алкокси або галоген, приєднані у придатному положенні, можна вводити в реакцію з придатною сполукою, такою як, наприклад, ацеталь аміноацетальдегіду в розчиннику, такому як ТГФ, хлороформ або толуол при кислотному каталізі толуолсульфоновою кислотою або іншою придатною кислотою з одержанням іміну (іі), де Q' може являти собою, наприклад, метил або етил, який, у свою чергу, може бути циклізований різними способами в ізохінолін (ііі). Наприклад, циклізацію можна здійснити каталізом кислотою Льюїса під дією придатних кислот Льюїса, таких як тетрахлорид титану, хлориди заліза, хлориди алюмінію і т.д., при температурах, що змінюються в діапазоні від кімнатної до 100°С, або шляхом відновлення іміну у відповідний амін під дією придатного відновника, такого як боргідрид натрію, перетворенням аміну в амід або сульфонамід реакцією з придатним хлоридом кислоти і подальшою циклізацією в ізохінолін під дією придатної кислоти Льюїса. Ізохінолін (ііі) сам по собі потім може бути перетворений у відповідний Nоксид (iv) під дією придатного окисника, такого як пероксид водню, м-хлор пербензойної кислоти або інших, при кімнатній температурі або при підвищеній температурі. N-оксид (iv) потім може бути перетворений у 1-хлорізохінолінову похідну (ν) шляхом його реакції з реагентом, таким як оксихлорид фосфору в присутності або за відсутності пентахлориду фосфору. Похідна (ν) потім може бути перетворена у придатну 1-алкокси похідну шляхом її реакції з різними спиртами Q-OH, такими як метанол, етанол або бензиловий спирт, у присутності придатної основи, такої як гідрид натрію, і у придатному розчиннику, такому як диметилформамід, диметилацетамід або інші. Як альтернатива, (ν) може бути безпосереднім чином перетворена в ізохінолінонову похідну (vii) її реакцією з реагентом, таким як ацетат амонію. Схема 2 У ролі альтернативи ізохіноліни можуть бути одержані реакцією придатних 3-формілованих або ацилованих фторбензолів (viii), де z являє собою, наприклад, Η або алкіл, такий як метил або етил, із реагентом, таким як триетилфосфоноацетат у присутності придатної основи, такої як гідрид натрію, з одержанням відповідного ефіру коричної кислоти, який потім розщеплюють під дією придатної основи, такої як гідроксид калію, гідроксид натрію або гідроксид літію, у придатному розчиннику з одержанням кислоти (іх). Кислота (іх) потім може бути перетворена у відповідний хлорангідрид при використанні добре відомих способів, який може бути перетворений в азид кислоти реакцією з азидом натрію у придатному розчиннику, такому як ефір, хлороформ або ацетон, у присутності або за відсутності води. Відповідний азид потім може бути перетворений в ізохінолінон (х) його реакцією у відповідному розчиннику, такому як дифенілметан або дифеніловий ефір, при придатній температурі. Схема 3 Одержані вище 6-фторізохінолони, наприклад, (vi), можна вводити в реакцію з придатним чином Р-заміщеними аміноспиртами, де Ρ являє собою, наприклад, водень, алкіл або захисну групу, таку як, наприклад, Вос, у присутності основи, такої як DBU, карбонат цезію або гідрид натрію, з одержанням відповідних алкокси-заміщених похідних (хі). За відповідних умов це перетворення можна провести вже на ранніх стадіях синтезу (наприклад, шляхом реакції з придатною проміжною сполукою). Потрібно розуміти, що, у випадку незахищених ізохінолонів, це може вимагати захисту азоту або кисню ізохінолонівого фрагмента за допомогою відомих способів, таких як реакція з при 31 датним чином заміщеними алкіл- або бензилгалогенідами в присутності основи. Продукти, такі як (хі), одержані при використанні зазначеного способу, можна потім, якщо присутня придатна амінофункціональна група, вводити в реакцію з придатними альдегідами або кетонами у присутності відновника, такого як триацетокси боргідрид натрію, боргідрид натрію або ціаноборгідрид натрію у придатному розчиннику і в присутності водопоглинаючого агента, такого як молекулярні сита або придатного ортоефіру. Із зазначеної аміногрупи можливо потрібно зняти захисну групу в початковій стадії, як, наприклад, видаленням Вос-груп під дією кислоти. У разі використання захищених ізохінолонів, для вивільнення заданого ізохінолону (хіі) є необхідним розщеплення використаних захисних груп. Зазначене вивільнення, однак, можна провести до або після стадії відновного амінування, залежно від природи альдегіду/кетону, що використовується, і захисної групи, що використовується. Ізохінолонові похідні, такі як (хіі), можуть бути одержані у вигляді вільних основ або у вигляді різних солей, таких як гідрохлориди, гідроброміди, фосфати, сульфати або фумарати. Одержані солі можуть бути потім перетворені у відповідні вільні основи або шляхом проведення іонообмінної хроматографії, або, наприклад, обробкою водним лугом і подальшою екстракцією придатними органічними розчинниками, такими як, наприклад, метиловий трет-бутиловий простий ефір, хлороформ, етилацетат або сумішами ізопропанол/дихлорметан і подальшим випарюванням досуха. Загальні способи одержання заміщених похідних ізохінолону, як описано вище, можуть бути легко адаптовані для одержання сполук формули (І) або формули (l'). У наступних прикладах детальніше описане одержання сполук за даним винаходом. Таким чином, наступні приклади являють собою частину даного винаходу і призначені для ілюстрації, але не обмежують даний винахід. (2,2-диметоксіетил)-(4-фторбензил)амін (1) 12,4 г 4-фторбензальдегіду розчиняли в 100 мл толуолу і вводили в реакцію з 10,5 г 2аміноацетальдегід диметилацеталю і 1,90 г (10 ммоль) моногідрату п-толуолсульфонової кислоти протягом двох годин в апараті Діна Старка. Розчин залишали охолоджуватися, екстрагували насиченим бікарбонатом натрію, водою і розсолом, сушили над сульфатом магнію та упарювали досуха. Неочищений продукт розчиняли в 100 мл етанолу. Додавали порціями 1,89 г боргідриду натрію. Перемішування продовжували протягом ночі. Для обробки додавали оцтову кислоту до припинення виділення газу. Потім розчин упарювали досуха, поглинали дихлорметаном і двічі промивали водою. Органічний шар екстрагували розсолом, су 93882 32 шили над сульфатом магнію та упарювали досуха. Одержаний неочищений продукт (20 г) використовували для подальших реакцій без очищення. Rt=0,86 хвилин (спосіб В). Детектована маса: 182,1 + (М-ОМе ), 214,2 (М+Н ). N-(2,2-диметоксіетил)-N-(4-фторбензил)-4метилбензолсульфонамід (2) 20 г (2,2-диметоксіетил)-(4-фторбензил)амін (1) розчиняли у 120 мл дихлорметану. Додавали 20 мл піридину. При 0°С по краплях додавали розчин 23,8 г хлориду п-толуолсульфонової кислоти в дихлорметані. Реакційну суміш потім залишали охолоджуватися до кімнатної температури і продовжували перемішування до повної конверсії. Для обробки реакційну суміш двічі екстрагували 2М соляної кислоти, двічі бікарбонатом натрію та один раз розсолом. Органічний шар сушили над сульфатом магнію, упарювали досуха та одержаний неочищений продукт очищали хроматографією на силікагелі з одержанням 22,95 г сполуки 2 у вигляді оранжевого масла. Rt= 1,71 хв (спосіб С). Детектована маса: 336,1 (М-ОМе ). 6-фторізохінолін (3) 41,6 г АlСl3 суспендували в 400 мл дихлорметану. При кімнатній температурі додавали 22,95 г розчину N-(2,2-диметоксіетил)-N-(4-фторбензил)4-метилбензолсульфонамід (2) у 150 мл дихлорметану. Перемішування продовжували при кімнатній температурі протягом ночі, розчин виливали на лід, органічний шар відділяли, водну фазу двічі екстрагували дихлорметаном і об'єднані органічні шари двічі екстрагували бікарбонатом натрію. Органічний шар сушили над сульфатом магнію, упарювали досуха та одержаний неочищений продукт (8,75 г) очищали хроматографією на силікагелі з одержанням 2,74 г сполуки (3). Rt=0,30 хв (спосіб С). Детектована маса: 148,1 (М+Н+). 7-хлор-6-фторізохінолін (4) Виходячи з 3-хлор-4-фторбензальдегіду, необхідна сполука була одержана тією послідовністю реакцій, що і використана для синтезу 6фторізохіноліну (3). Rt=0,77 хв (спосіб А). Детектована маса: 181,1/184,1 (М+Н+). 33 93882 34 7-хлор-6-фторізохінолін 2-оксид (5) 25 г (137,7 ммоль) 7-хлор-6-фторізохіноліну (4) розчиняли в 500 мл дихлорметану. Додавали 50,9г (206,5 ммоль) м-хлор пербензойної кислоти (70%) при кімнатній температурі, і суміш перемішували при кімнатній температурі до досягнення повної конверсії. Для обробки осад фільтрували і промивали дихлорметаном. Фільтрат промивали двічі розчином бікарбонату натрію. Шари розділяли і водну фазу двічі екстрагували дихлорметаном. Органічні фази сушили над MgSO4 та упарювали. Одержану таким чином тверду речовину (18,4 г) використовували без подальшого очищення. Rt=0,87 хв (спосіб С). Детектована маса: 198,1/200,1 (М+Н+). 1,7-дихлор-6-фторізохінолін (6) 2,6 г (12,0 ммоль) 7-хлор-6-фторізохінолін 2оксиду (5) нагрівали в 40 мл РОСІ3 і кип'ятили зі зворотним холодильником протягом 4 годин. Після того як суміші давали охолонути до кімнатної температури, її виливали на лід. Водний розчин екстрагували три рази дихлорметаном. Об'єднані органічні шари сушили над MgSO4 та упарювали з одержанням 2,91 г цільової сполуки, яку використовували без додаткового очищення. Rt-2,34 хв (спосіб А). Детектована маса: 216,0/218,0 (М+Н+) Трет-бутиловий ефір 4-(ізохінолін-6ілокси)піперидин-1-карбонової кислоти (7) 7,49 г трет-бутилового ефіру 4гідроксипіперидин-1-карбонової кислоти розчиняли у 20 мл безводного диметилацетаміду. Додавали 1,49 г гідриду натрію (60%). Потім додавали по краплях 3,65 г 6-фторізохіноліну (3) у диметилацетаміді. Розчин нагрівали при 80°С протягом 2 годин, потім розчинник видаляли та осад поглинали дихлорметаном. Органічний шар двічі екстрагували водою і потім розсолом, сушили над сульфатом магнію та упарювали досуха. Неочищений продукт очищали хроматографією на силікагелі з одержанням 6,22 г трет-бутилового ефіру 4-(ізохінолін-6ілокси)піперидин-1-карбонової кислоти (7). Rt=1,32 хв (спосіб В). Детектована маса: 329,1 (М+Н+). Трет-бутиловий ефір 4-(2-оксі-ізохінолін-6ілокси)піперидин-1-карбонової кислоти (8) Розчиняли 3,97 г (12,1 ммоль) трет-бутилового ефіру 4-(ізохінолін-6-ілокси)піперидин-1-карбонової кислоти (7) у 100 мл дихлорметану і при кімнатній температурі додавали 4,47 г (18,1 ммоль) м-хлор пербензойної кислоти (70%). Реакційну суміш перемішували протягом 1 години і потім промивали насиченим розчином бікарбонату натрію. Водну фазу відділяли та екстрагували дихлорметаном. Об'єднані органічні фази сушили над MgSO4 та упарювали з одержанням 4,19 г неочищеної речовини, яка може бути використана для подальшого перетворення без очищення. Rt=1,46 хв (спосіб В). Детектована маса: 345,2 (М+H+). 1-хлор-6-(піперидин-4-ілокси)ізохінолінгідрохлорид (9) Розчиняли при 50°С 3,5 г (10,16 ммоль) третбутилового ефіру 4-(2-оксі-ізохінолін-6ілокси)піперидин-1-карбонової кислоти (8) у 250 мл етанолу, насиченого НСl. Прозорий розчин концентрували під вакуумом, і залишок кип'ятили зі зворотним холодильником у 50 мл РОСl3. Після 3 годин РОСІ3 видаляли під вакуумом і залишок поглинали водою. pH встановлювали при 11 шляхом додавання гідроксиду натрію і водний розчин двічі екстрагували дихлорметаном. Об'єднані органічні шари сушили над сульфатом магнію та упарювали досуха. Залишок очищали препаративною ВЕРХ, за допомогою якої цільову сполуку одержували у вигляді трифторацетату. Одержану речовину перетворювали у відповідну сіль НСl шляхом розчинення продукту у 2Н НСl, з подальшою ліофілізацією. Вихід: 950 мг. Rt=1,03 хв (спосіб В). Детектована маса: 263,1/265,1 (М+Н+). Трет-бутиловий ефір 4-(1-хлорізохінолін-6ілокси)піперидин-1-карбонової кислоти (10) Розчиняли 1,23 г (4,11 ммоль) 1-хлор-6(піперидин-4-ілокси)ізохінолінгідрохлориду (9) у 50 мл дихлорметану і додавали 0,85 мл (6,15 ммоль) діетиламіну. При 0°С додавали по краплях 1,09 г (5,0 ммоль) ди-трет-бутилдикарбонату в 10 мл дихлорметану і суміш залишали при кімнатній температурі протягом ночі. Для обробки суміш двічі промивали водою, сушили над сульфатом магнію і 35 випарювали з одержанням 1,1 г цільового продукту, який можна було використовувати без подальшого очищення. Rt=1,86 хв (спосіб С). Детектована маса: 363,1/365,2 (М+Н+). Трет-бутиловий ефір 4-(1-бензилоксіізохінолін6-ілокси)піперидин-1-карбонової кислоти (11) Розчиняли 0,70 г (6,49 ммоль) бензилового спирту в 10 мл диметилацетаміду. Додавали 260 мг (6,49 ммоль) гідриду натрію (60%) і розчин перемішували прі кімнатній температурі. Через 30 хвилин додавали розчин 1,57 г (4,33 ммоль) третбутилового ефіру 4-(1-хлорізохінолін-6ілокси)піперидин-1-карбонової кислота (10) у 10 мл диметилацетаміду та одержану суміш нагрівали при 90°С (температура бані). Через 8 годин і витримуванні при кімнатній температурі протягом ночі додавали 1,0 додаткові еквіваленти бензилового спирту і гідриду натрію і продовжували нагрівання при 90°С протягом 8 годин. Для обробки розчинник видаляли під вакуумом і залишок розчиняли в дихлорметані. Органічний розчин двічі промивали водою, сушили над MgSO4 та упарювали. Одержаний неочищений продукт очищали препаративною ВЕРХ. Rt=2,13 хв (спосіб С). Детектована маса 435,2 (М+Н+). 6-(піперидин-4-ілокси)-2Н-ізохінолін-1-он (12) Сполуку (11) розчиняли в суміші етанол/2Н НСl (1:1) і перемішували при кімнатній температурі до досягнення повної конверсії. Розчинник видаляли під вакуумом і осад очищали препаративною ВЕРХ. Одержаний трифторацетат розчиняли в 2Н НСl і ліофілізували. Після подальшої ліофілізації з води може бути одержано 850 мг цільової сполуки у вигляді солі НСl. Rt=0,75 хв (спосіб В). Детектована маса: 245,1 (М+Н+). Альтернативний спосіб синтезу: 6-фтор-ізохінолінон (13) 4,8 мл (90,3 ммоль, 1,5 екв.) тіоніл хлориду додавали по частинах до розчину 10 г (60,2 ммоль) 3-фторкоричної кислоти в 44 мл хлороформу та 1 мл ДМФА. Реакцію нагрівали до кипіння зі зворотним холодильником протягом 2,5 годин. 93882 36 Потім розчинники переганяли з одержанням 11,4 г неочищеного хлорангідриду, який використовували без додаткового очищення. Хлорид кислоти розчиняли в 45 мл ацетону. Додавали по частинах при 0°С 8,03 г NaN3 (123,5 ммоль, 2 екв.). Потім додавали 41 мл води і при цьому температуру підтримували нижче за 5°С. Реакцію перемішували ще 1,5 годин. Потім додавали 55 мл хлороформу. Суміш екстрагували 80 мл води і потім 40 мл розсолу. Після сушіння над NaSO4 і фільтрації додавали 14 мл дифенілового простого ефіру і велику частину хлороформу видаляли під вакуумом (без нагрівання). Необхідно уникати повного видалення хлороформу. Розчин, що містить азид, дифеніловий простий ефір і хлороформ, що залишився, додавали по краплях при 260°С протягом 15 хвилин до розчину 10 мл трибутил аміну в 97 мл дифенілового простого ефіру. При додаванні спостерігалася інтенсивна реакція. Реакцію перемішували протягом додаткових 20 хвилин при 260°С. Після охолодження до кімнатної температури додавали 270 мл нгептану. Осаджений продукт фільтрували і промивали простим ефіром з одержанням 5,65 г цільової сполуки. MC (DCI) Детектована маса: 164,0 (М+Н+). 6-фтор-2-(4-метоксибензил)-2Н-ізохінолін-1-он (14) Додавали 169 мкл п-метоксибензилхлориду (1,24 ммоль, 1,1 екв.) до суспензії 200 мг 6фторізохінолінону (13) (1,13 ммоль) і 368 мг Cs2CO3 (1,36 ммоль, 1,2 екв.) у 3 мл ДМФА. Суміш перемішували протягом 2 годин і потім виливали на лід. Осад фільтрували, промивали водою і сушили з одержанням 300 мг цільової сполуки. РХ/МС спосіб В, час утримування 1,76 хв, детектована маса: 284,14 (М+Н+). 6-(піперидин-4-ілокси)-2Н-ізохінолін-1-он (12) Розчиняли 117 мг (0,58 ммоль) третбутилового ефіру 4-гідроксипіперидин-1карбонової кислоти у 2 мл Ν,Ν-диметилацетаміду. Додавали в атмосфері аргону 63,6 мг (2,7 ммоль) гідриду натрію і перемішували суміш при кімнатній температурі. Через 30 хвилин додавали 150 мг (0,53 ммоль) 6-фтор-2-(4-метоксибензил)-2Нізохінолін-1-ону (14) і розчин нагрівали до 80°С протягом 1 години. Суміш виливали у воду та екстрагували хлороформом. Об'єднані органічні шари сушили над Na2SO4, фільтрували та упарювали. Неочищену проміжну сполуку очищали препарати 37 вною ВЕРХ. Захисні групи видаляли шляхом розчинення захищеної проміжної сполуки в 2 мл ТФО (трифтороцтова кислота) і нагрівали реакцію до 150°С протягом 2 годин у мікрохвильовому реакторі. Реакційну суміш гасили метанолом і упарювали досуха. Осад, що залишився, поглинали дихлорметаном, екстрагували три рази 1Н НСl і комбінований водний шар один раз екстрагували дихлорметаном. Комбінований водний шар ліофілізували, залишок двічі поглинали водою і знову ліофілізували з одержанням продукту у вигляді солі НСl. Чистота одержаного продукту є достатньою, але в деяких випадках присутні домішки можуть бути видалені при використанні хроматографії на силікагелі або ВЕРХ. 7-бром-6-фторізохінолін (15) Виходячи з 3-бром-4-фторбензальдегіду, цільову сполуку одержували згідно з тією ж послідовністю реакцій, як і використана для синтезу 6фторізохіноліну (3). Rt=0,91 хв (спосіб В). Детектована маса: 226,0/228,0 (М+Н+). 7-метил-6-(піперидин-4-ілокси)-2Н-ізохінолін-1он (16) a) 6-фтор-7-метил-2Н-ізохінолін-1-он До розчину 10,0 г (55 ммоль) 3-фтор-4-метилкоричної кислоти у 80 мл ацетону послідовно додавали при 0°С 6,74 г (66,6 ммоль) триетиламіну в 10 мл ацетону, потім 7,83 г (72,2 ммоль) етилхлорформіату. Після перемішування протягом 2 годин при від 0 до 5°С додавали розчин 4,0 г (61,1 ммоль) азиду натрію в 9,5 мл води. Після перемішування протягом однієї додаткової години реакційну суміш вливали у 200 мл льодяної води і двічі екстрагували хлороформом. Органічну фазу сушили над сульфатом магнію, додавали 40 мл дифенілового ефіру і хлороформ акуратно видаляли під вакуумом. Залишок потім додавали по краплях у 50 мл дифенілового ефіру, який попередньо нагрівали до 245°С. Після повного додавання суміш перемішували протягом однієї додаткової години при 230-250°С. Після охолодження до 150°С реакційну суміш вливали в 270 мл гептану і, після додаткового охолодження на льодяній бані, осаджений продукт фільтрували з відсмоктуванням і одержували 4,1 г 6-фтор-7-метил-2Н-ізохінолін-1ону. b) 6-фтор-2-(4-метоксибензил)-7-метил-2Нізохінолін-1-он До розчину 9,17 г (51,8 ммоль) 6-фтор-7метил-2Н-ізохінолін-1-ону у 80 мл ДМФА додавали 20,2 г (62,1 ммоль) карбонату цезію і потім 8,92 г 93882 38 (56,9 ммоль) 4-метоксибензилхлориду. Після перемішування при кімнатній температурі протягом 90 хвилин реакційну суміш вливали в 600 мл води, перемішували протягом 1 години і потім осаджений продукт фільтрували з відсмоктуванням. Із маточного розчину виділяли додатковий продукт за допомогою хроматографії сумішшю гептан/етилацетат (80:20). Комбіновані продукти перекристалізовували з етилацетату та одержували 8,39 г 6-фтор-2-(4-метоксибензил)-7-метил-2Нізохінолін-1-ону. c) трет-бутиловий ефір 4-[2-(4-метоксибензил)7-метил-1-оксо-1,2-дигідроізохінолін-6ілокси]піперидин-1-карбонової кислоти Розчин 3,2 г (15,9 ммоль) 1-третбутоксикарбоніл-4-гідроксипіперидину в 110 мл диметилацетаміду перемішували з 1,36 г (45,4 ммоль) 80% гідриду натрію протягом 1 години при кімнатній температурі. Потім додавали суспензію 4,5 г (15,1 ммоль) 6-фтор-2-(4-метоксибензил)-7метил-2Н-ізохінолін-1-ону в диметилацетаміді. Реакційну суміш нагрівали до 80°С протягом 2 годин, протягом яких був одержаний прозорий розчин. Реакційну суміш повільно додавали до 160 мл води і після 1 години перемішування продукт виділяли фільтрацією і сушили протягом ночі під вакуумом. Одержували 6,4 г трет-бутилового ефіру 4-[2-(4-метоксибензил)-7-метил-1-оксо-1,2дигідроізохінолін-6-ілокси]піперидин-1-карбонової кислоти. d) 7-метил-6-(піперидин-4-ілокси)-2Нізохінолін-1-он гідрохлорид 6,4 г (13,4 ммоль) трет-бутилового ефіру 4-[2(4-метоксибензил)-7-метил-1-оксо-1,2дигідроізохінолін-6-ілокси]піперидин-1-карбонової кислоти розчиняли в 30,5 г (267,4 ммоль) трифтороцтової кислоти. Після 1 години при кімнатній температурі суміш нагрівали протягом 2 годин у мікрохвильовій печі при 150°С. Потім надлишок трифтороцтової кислоти відганяли під вакуумом і залишок розводили 130 мл 1М соляної кислоти. Водну фазу промивали 3 рази хлористим метиленом і потім її піддавали ліофільному сушінню для одержання гідрохлориду, який кристалізували з ізопропанолу. Це призводило до одержання 3,2 г 7-метил-6-(піперидин-4-ілокси)-2Н-ізохінолін-1-ону (16) у вигляді гідрохлориду. Rt=1,24 хв (спосіб В). Детектована маса: 259,1 (М+Н+). 7-бром-6-(піперидин-4-ілокси)-2Н-ізохінолін-1он (17) а) етиловий ефір 3-(4-бром-3фторфеніл)акрилової кислоти До розчину 13,4 г (60 ммоль) триетилфосфонацетату в 80 мл толуолу додавали 1,8 г (60 ммоль) 80% гідрид натрію при 0°С. Після 30 хвилин додавали 11,0 г (54 ммоль) 4-бром-3фторбензальдегіду в 40 мл толуолу та одержану густу суміш перемішували протягом ночі при вико 39 ристанні механічної мішалки. Після розведення 500 мл етилацетату і 200 мл води органічну фазу відділяли і промивали розчином бікарбонату натрію і розсолом. Після висушування над сульфатом магнію з подальшим упарюванням і очищенням флеш-хроматографією одержували 10,6 г етилового ефіру 3-(4-бром-3-фторфеніл)акрилової кислоти. b) 3-(4-бром-3-фторфеніл)акрилова кислота 10,5 г (38,6 ммоль) етилового ефіру 3-(4-бром3-фторфеніл)акрилової кислоти розчиняли в 100 мл метанолу і перемішували протягом ночі з 97 мл водного 1М розчину гідроксиду натрію. Після видалення метанолу під вакуумом залишок підкисляли концентрованою соляною кислотою. Осад виділяли відсмоктуванням і сушінням під вакуумом при 5°С, що призводило до одержання 8,0 г 3-(4бром-3-фторфеніл)акрилової кислоти. c) 7-бром-6-фтор-2Н-ізохінолін-1-он До розчину 4,0 г (16,3 ммоль) 3-(4-бром-3фторфеніл)акрилової кислоти в 60 мл ацетону послідовно додавали при від 0 до 5°С 2,0 г (19,6 ммоль) триетиламіну в 10 мл ацетону і потім 2,3 г (21,2 ммоль) етилхлорформіату в 10 мл ацетону. Після перемішування протягом 1 години при від 0 до 5°С додавали 1,6 г (24,5 ммоль) азиду натрію в 9 мл води. Після перемішування протягом додаткової 1 години реакційну суміш вливали у 200 мл льодяної води і двічі екстрагували хлороформом. Органічну фазу сушили над сульфатом магнію, додавали 24 мл дифенілового простого ефіру та Додавали по частинах 213 мг (5,6 ммоль) NaBH4 при 0°С до розчину 1,0 г (4,7 ммоль) 1-Вос2-метилпіперидин-4-ону в 10 мл етанолу. Суміш перемішували при кімнатній температурі протягом 2 годин. Розчинник видаляли перегонкою і залишок розчиняли у воді та етилацетаті. Водний розчин двічі екстрагували етилацетатом, та об'єднані органічні шари сушили над Na2SO4. Після фільтрації розчинник видаляли перегонкою, і неочищений продукт очищали колонковою хроматографією (сумішшю н-гептан/етилацетат 1/1) з одержанням 367 мг (36%) цис-ізомеру 18 і 205 мг (20%) трансізомеру 19 додатково до 97 мг (10%) суміші обох ізомерів. цис-ізомер (18): 1 Н-ЯМР (CDCl3): δ = 4,28 (1Н, м), 4,17 (1Н, м), 3,82 (1H, м), 3,26 (1Н, м), 1,85 (1Н, ддд, J=14,7, 6,6, нижче за 3,4 Гц), 1,77 (1Н, м), 1,66 (2Н, м), 1,33 (3Н, д, J=7,1 Гц). транс-ізомер (19): 1 Н-ЯМР (CDCl3): δ = 4,50 (1H, м), 4,04 (1H, м), 3,95 (1Н, м), 2,87 (1Н, дт, J=2,9 нижче за 13,6 Гц), 1,93 (1H, м), 1,83 (1H, м), 1,53 (1Н, м), 1,32 (1H, м), 1,14 (3Н, д, J=7,1 Гц). 1-циклопропілпіперидин-4-ол (20) 93882 40 акуратно видаляли хлороформ під вакуумом. Залишок потім додавали по краплях у 60 мл дифенілового ефіру, який попередньо нагрівали до 250°С. Після повного додавання реакційну суміш перемішували протягом додаткових 30 хвилин при 230-250°С. Після охолодження до 100°С реакційну суміш вливали в 100 мл гептану і, після додаткового охолодження на льодяній бані, осаджений продукт фільтрували з відсмоктуванням і одержували 2,4 г неочищеного 7-бром-6-фтор-2Н-ізохінолін-1ону. d) 7-бром-6-фтор-2-(4-метоксибензил)-2Нізохінолін-1-он Із 2,4 г неочищеного 7-бром-6-фтор-2Нізохінолін-1-ону, 3,9 г (11,9 ммоль) карбонату цезію і 1,7 г (10,9 ммоль) 4-метоксибензилхлориду одержували 0,93 г 7-бром-6-фтор-2-(4метоксибензил)-2Н-ізохінолін-1-ону аналогічно до способу, описаному в стадії b) прикладу 16. e) 7-бром-6-(піперидин-4-ілокси)-2Н-ізохінолін1-он гідрохлорид З 0,93 г (2,6 ммоль) 7-бром-6-фтор-2-(4метоксибензил)-2Н-ізохінолін-1-ону і 0,54 г (2,7 ммоль) 1-трет-бутоксикарбоніл-4гідроксипіперидину одержували 0,35 г 7-бром-6(піперидин-4-ілокси)-2Н-ізохінолін-1-ону у вигляді гідрохлориду аналогічно до способів, описаних у стадіях с і d прикладу 16. Rt=0,84 хв (спосіб А). Детектована маса: 323,1/325,1 (М+Н+). Цис і транс N-Вос-2-метилпіперидин-4-ол (18 і 19) 5 г 4-гідроксипіперидину розчиняли в метанолі. Додавали 23,8 мл 1[(1-етоксициклопропіл)окси]триметилсилану і 5,8 г ціанборгідриду натрію і суміш вводили в реакцію при 60°С протягом 12 годин. Потім додавали такі ж кількості двох реагентів і продовжували перемішування при 60°С протягом додаткових 12 годин. Суміш розводили метанолом, фільтрували через целіт і упарювали досуха. Залишок поглинали етилацетатом, двічі екстрагували 2Н гідроксидом натрію і один раз розсолом, сушили над сульфатом натрію та упарювали досуха. Залишок очищали хроматографією на силікагелі з одержанням 2 г продукту 20, MC: 141 (М+). Наступні сполуки одержували у вигляді їхніх НСl солей подібним чином, як описано в синтезах 12, 16 або 17, виходячи з кислот і амінів, наведених у подальшій таблиці 1. Використані акрилові кислоти або являли собою комерційно доступні або були синтезовані з відповідних альдегідів способами, схожими з описаними в літературі (див., наприклад, J. Med. Chem. 2005, 48, 71-90). Один із прикладів описаний у синтезі 17 стадія а. 41 93882 42 43 93882 44 45 93882 46 47 93882 48 4-бром-6-(піперидин-4-ілокси)-2Н-ізохінолін-1он (52) Суспендували 200 мг (12) у 25 мл хлороформу. Додавали 100 мкл триетиламіну і продовжували перемішування протягом 2 годин. Розчин упарювали і залишок очищали хроматографією на силікагелі (дихлорметан:метанол:триетиламін 10:1:0,1). Інше очищення ВЕРХ і заміна аніона на НВr призвели до виходу 73 мг продукту у вигляді гідроброміду. Rt=1,35 хв (спосіб А). Детектована маса: 407,1/409,1 (М+Н+). Трет-бутиловий ефір 4-(1-бензилокси-7хлорізохінолін-6-ілокси)піперидин-1-карбонової кислоти (53) Розчиняли 289,8 мг (1,44 ммоль) третбутилового ефіру 4-гідроксипіперидин-1карбонової кислоти в 10 мл диметилацетаміду і додавали 57,6 мг (1,44 ммоль) гідриду натрію (60%). Реакційну суміш перемішували при кімнатній температурі. Через 30 хвилин додавали розчин 310 мг (1,44 ммоль) 1,7-дихлор-6-фторізохіноліну (6) у 3 мл диметилацетаміду і суміш перемішували при кімнатній температурі протягом 1 години до повного перетворення. Потім додавали 155,7 мг (1,44 ммоль) бензилового спирту з подальшим додаванням 57,6 мг (1,44 ммоль) гідриду натрію (60%) і продовжували перемішування при кімнатній температурі. Для досягнення повної конверсії двічі додавали по 0,5 еквіваленти бензилового спирту і гідриду натрію через 2 години і після ви 49 тримування протягом ночі. Для обробки розчинник упарювали, а залишок поглинали дихлорметаном, двічі промивали водою, сушили над MgSO4 і упарювали. Остаточне очищення здійснювали за допомогою препаративної ВЕРХ. 7-хлор-6-(піперидин-4-ілокси)-2Н-ізохінолін-1он (54) Перемішували 254 мг (0,52 ммоль) третбутилового ефіру 4-(1-бензилокси-7хлорізохінолін-6-ілокси)піперидин-1-карбонової кислоти (53) у суміші метанол/2Н НСl (1:1) при кімнатній температурі протягом ночі. Розчинник упарювали під вакуумом, і залишок очищали препаративною ВЕРХ. Фракції продукту упарювали і розчиняли в 2Н НСl. Ліофілізація призвела до одержання 57 мг цільової сполуки у вигляді гідрохлориду. Rt=0,95 хв (спосіб В). Детектована маса: 279,1 (М+Н+). 7-хлор-6-(1-ізопропілпіперидин-4-ілокси)-2Нізохінолін-1-он (55) Розчиняли 64 мг (0,23 ммоль) 7-хлор-6(піперидин-4-ілокси)-2Н-ізохінолін-1-ону (54) у 5 мл метанолу. Додавали 41,4 мг (0,41 ммоль) триетиламіну і суміш перемішували при кімнатній температурі протягом 10 хвилин. Після додавання свіжовисушених молекулярних сит, 122,4 мг (2,04 ммоль) оцтової кислоти, 26,7 мг (0,46 ммоль) аце 93882 50 тону і 43,3 мг (0,69 ммоль) ціанборгідриду натрію, реакційну суміш кип'ятили зі зворотним холодильником протягом 8 годин. Після додавання 2 екв. ацетону і 2 екв. ціанборгідриду натрію при кімнатній температурі реакцію кип'ятили зі зворотним холодильником протягом додаткових 2 годин до повної конверсії. Для обробки суміш фільтрували і фільтрат упарювали. Залишок розчиняли в дихлорметані, двічі промивали 2Н NaOH і водою і сушили над MgSO4. Після упарювання розчинника та очищення препаративною ВЕРХ одержували 13 мг цільової сполуки у вигляді трифторацетату. Rt=0,96 хв (спосіб В). Детектована маса: 321,1/323,2 (М+Н+). Загальний спосіб А реакції відновного амінування: У 3 мл НС(ОМе)3 перемішують протягом 1 години при кімнатній температурі: 0,243 ммоль гідрохлориду 6-(піперидин-4-ілокси)-2Н-ізохінолін-1ону (12) або іншого придатного аміну, 0,243 ммоль альдегіду і 0,365 ммоль триетиламіну. Суміш охолоджують до -10°С, додають 1,75 мл свіжоодержаного розчину ДМФА, що містить 1,215 ммоль NaHB(OAc)3 і 1,215 ммоль НОАс. Перемішування продовжують при 10°С протягом 30 хв, потім суміш залишають нагріватися до кімнатної температури і залишають при кімнатній температурі протягом ночі. Додають 0,5 мл води і суміш упарюють, розчиняють у ДМФА та очищають препаративною ВЕРХ. Очищені продукти розчиняють у 1 мл НСl в ізопропанолі (5-6 М) і залишають протягом ночі при кімнатній температурі (розщеплення Boc/tBu складноефірних груп деяких продуктів). Додають 2 мл води і розчин піддають ліофільному сушінню з одержанням гідрохлоридів продуктів. Наступні сполуки, показані в подальшій таблиці 2, синтезували способом, який подібний до описаного загального способу, та одержували у вигляді солей гідрохлориду. 51 93882 52 53 93882 54 55 93882 56 57 93882 58 59 93882 60
ДивитисяДодаткова інформація
Назва патенту англійськоюPiperidinyl-substituted isoquinolone derivatives as rho-kinase inhibitors
Автори англійськоюPlettenburg Oliver, Hofmeister Armin, Loehn Matthias, Kadereit Dieter, Brendel Joachim
Назва патенту російськоюПиперидинил-замещенные производные изохинолона kak ингибиторы rнo-киназы
Автори російськоюПлеттенбург Оливер, Хофмайстер Армин, Кадерайт Дитер, Брендель Йоахим, Лен Маттиас
МПК / Мітки
МПК: A61P 9/12, C07D 401/12, A61K 31/4725
Мітки: піперидиніл-заміщені, rнo-кінази, інгібітори, похідні, ізохінолону
Код посилання
<a href="https://ua.patents.su/49-93882-piperidinil-zamishheni-pokhidni-izokhinolonu-yak-ingibitori-rno-kinazi.html" target="_blank" rel="follow" title="База патентів України">Піперидиніл-заміщені похідні ізохінолону як інгібітори rнo-кінази</a>
Попередній патент: Похідні n-(арилалкіл)-1н-піролопіридин-2-карбоксамідів, їх одержання та застосування в терапії
Наступний патент: Похідні піразину, корисні як антагоністи аденозинового рецептора
Випадковий патент: Датчик вібрацій












