Діетиламіноетиламіда 1-пропіл-2-оксо-4-гідроксіхінолін-3-карбонової кислоти гідрохлорид, що проявляє анестезуючу, протиаритмічну, антиоксидантну, антимікробну та фунгіцидну активність
Номер патенту: 19287
Опубліковано: 25.12.1997
Автори: Лемешко Віктор Васильович, Георгієвський Віктор Петрович, Украінець Ігор Васильович, Падалко Володимир Ілліч, Нікітченко Юрій Вікторович, Скубко Тамара Порфирівна, Слободзян Сергій Володимирович, Гризодуб Олександр Іванович, Гладченко Світлана Василівна, Туров Олександр Всеволодович, Оболенцева Галина Володимирівна, Кривобок Віктор Іванович, Литовкіна Олена Георгієвна, Кобзар Ганна Іванівна, Трескач Володимир Йосипович, Сухінін Валерій Миколайович, Левін Михайло Григорович, Безуглий Петро Авксентійович, Бутенко Ірина Григорівна
Формула / Реферат
Диэтиламиноэтиламида-1-пропил-2-оксо-4- гидроксихинолин-3-карбоновой кислоты гидрохлорид
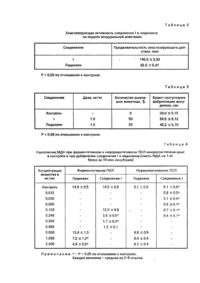
проявляющий анастезирующую, противо-аритмическую, антиоксидантную, антимикробную и фунгицидную активность.
Текст
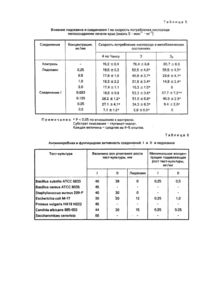
Изобретение относится к химико-фармацевтической промышленности и касается биологически-активных веществ, конкретно, диэтиламиноэтиламида 1-пропил-2-оксо-4-гидроксихинолин-3-карбоновой кислоты гидрохлорида формулы проявляющего анестезирующее, противо-аритмическое, антиоксидантное, антимикробное и фунгицидное действие. Указанные свойства позволяют предположить возможность его применения в медицине, в частности, в хирургии в качестве лекарственного препарата комплексного действия. Аналогом по структуре и действию является диэтиламиноэтиламида 1-этил-2-оксо-4-гидроксихинолин-3карбоновой кислоты гидрохлорид формулы: проявляющий местноанестезирующую, антимикробную и противогрибковую активность [1]. Аналогом по действию является широко применяемый в медицинской практике препарат - лидокаин [2]. Задачей настоящего изобретения является изыскание в ряду производных 2-оксо-4-гидроксихинолин-3карбоновых кислот нового соединения с более высокой анестезирующей, противоаритмической, антиоксидантной, антимикробной и фунгицидной активностью. Решение поставленной задачи обеспечивает диэтиламиноэтиламида-1-пропил-2-оксо-4гидроксихинолин-3-карбоновой кислоты гидрохлорид. Сущность изобретения иллюстрируется следующими примерами. Пример 1. Диэтиламиноэтиламида 1-пропил-2-оксо-4-гидроксихинолин-3-карбоновой кислоты гидрохлорид формулы 1. К раствору 2,75 г (0,01 моль) 1-пропил-2-оксо-3-карбэтокcи-4-гидроксихинолина в 10 мл метанола прибавляют 1,3 г (0,012 моль) диэтиламиноэтиламина и кипятят с обратным холодильником 5 ч. Охлаждают, прибавляют 30 мл ледяной воды. Выпавший осадок отфильтровывают, промывают водой, сушат. Затем растворяют в 15 мл метанола, содержащего 0,011 моль НСІ. Прибавляют 5 мл гексана и охлаждают. выпавшие кристаллы отфильтровывают, промывают, суша т. Вы ход 3,20 г (84%). Т.пл. 160-2°С. Найдено, %: С 59,62; Η 7,50; N 11,10; СІ 9,17; С19Н27N3 О3 × НСІ. Вычислено,%: С 59,76; Η 7,39; N 11,00; Cl 9,28. Спектр ПМР: 16,92 (1H,c,OH); 10,69 (1Η,c,ΝΗ); 10,48(1Η,τ,ΝΗ); 8,11(1Η,дд,Η-5); 7,81 (1Н, тд, Н-7); 7,66 (1Н, д, Н-8); 7,37 (1Н, тд, Н-6); 4,21 (2Н, к, NCH2-C2H5); 3,77(2H, к, NHCH2); 3,23 (6Н, М, Ν, (СН2)3; 1.65 (2Н,М,NСН2,СН2СН3); 1,26 (6H,т,NCH2CH3 x 2); 0,97 (3Н, т, СН2СН2СH3)· Пример 2. 1-Пропил-2-оксо-3-карбэтокси-4-гидроксихинолин. К раствору 2,0,7 г (0,01 моль) этилового эфира N-пропилантраниловой кислоты в 15 мл ацетона прибавляют 1,4 мл (0,01 моль) триэтиламина и 1,51 г (0,01 моль) этоксималонилхлорида. Оставляют на ночь. Ацетон удаляют, к остатку прибавляют радтвор 2,0 г КОН в 20 мл воды. Перемешивают в течение 1 ч при 50°С. Охлаждают, подкисляют HCI до рН 4. Осадок отфильтровывают, промывают водой, сушат. Вы ход 2,09 г (76%). Т.пл. 76-8° С (водный этанол). Найдено, %: С 65,51; Η 6,16; N 5,14. C15H17NO 4. Вычислено,%: С 65,44; Η 6,22; N 5,09. Спектр ПМР: 13,07 (1Н, с, ОН); 8,05 (1Н, дд. Н-5); 7,76 (1Н, тд, Н-7); 7.56 (1Н.д.Н-8); 7,29 (1 Н,тд, Н-6); 4,35 (2Н,к, ОСН2); 4,14 (2Н, т, NCH2); 1,60 (2Н, м, NСН2СН2)/ 1,31 (3Н, т, ОСН2СН3); 0,95 (3Н, т, NСН2СН2СН3). Спектры ПМР синтезированных соединений записаны на приборе "Bruker WP-100 SY" (ФРГ), рабочая частота 100 МГц, растворитель ДМСО-D6 , химические сдвиги приведены в шкале δ по отношению к ТМС. Пример 3. Острую токсичность соединения I и препаратов сравнения определяли на белых мышах обоего пола массой 20-25 г по 5 животных в серии с каждой дозой. Исследуемые вещества растворяли в 0,9%-ном растворе NaCI и вводили внутрибрюшинно в объеме, не превышающем 0,55 мл, в диапазоне доз от 40 до 150 мг/кг. Наблюдения за животными велись в течение 14 дней. ЛД50 (табл.1) рассчитывали по методу Кербера. Пример 4. Анестезирующую активность каждого соединения в условиях инфильтрационной анестезии изучали на 6 морских свинках рыже-черно-белой масти, стандартизованных по массе и полу, по методу Бальбринга. Исследуемые соединения в виде 0,5%-ного раствора, приготовленного на 0,9%-ном растворе NaCI, вводили внутрикожно в объеме 0,25 мл. Анестезирующую активность оценивали через каждые 10 мин, проводя серию уколов в место инъекции исследуемого соединения (5-6 уколов иглой). Адекватной считалась анестезия, если животные не проявляли признаков беспокойства, отсутствовала вокализация и реакция сердечно-сосудистой системы (учащение числа сердечных сокращений): Пример 5. Изучение анестезирующей активности соединения I и лидокаина на модели эпидуральной анестезии проводили на кроликах породы Шиншилла массой 2,0-2,5 кг. Для этого депилировали участок кожи в проекции 3-5 поясничных позвонков и обрабатывали этанолом. Анестезию кожи и подкожной клетчатки проводили 0,25%-ным раствором новокаина. В области 3-4 поясничных позвонков иглой TUOHY-PERIDUR фирмы VYGON проводилась пункция эпидурального пространства. Соединение I и лидокаин в виде 2%-ного раствора вводили в эпидуральное пространство вобъеме, рассчитанном по формуле Результаты учитывали по отсутствию глубокой болевой чувствительности и двигательной активности в соответствующи х группах мышц в области действия эпидуральной анестезии. Пример 6. Изучение противоаритмической активности соединения I и лидокаина проводилось на модели хлоркальциевой аритмии на белых беспородных крысах массой 120-160 г. Животные наркотизировались этаминал-натрием в дозе 60 мг/кг. Исследуемые вещества медленно вводили в виде 1 %-ного раствора внутривенно. Через 2 мин внутривенно вводили 10%-ный раствор кальция хлорида из расчета 2 мл/кг. Регистрацию электрокардиограмм проводили с помощью кардиоэнцефалоскопа КЭС 01 и прибора быстродействующего самопишущего Н3021. Результаты противоаритмического действия соединения I и лидокаина оценивали в процентах выживших животных и по времени до наступления фибрилляции желудочков (табл.3). Пример 7. Изучение местнораздражающего действия соединения I проводили на кроликах породы Шиншилла. Однократно на конъюктиву глаза наносили 1%-ный раствор соединения I. Наблюдение проводили в течение 6 ч, через каждые 30 мин. Инъекции сосудов конъюнктивы и склеры не наблюдалось, т.е. соединение I местнораздражающего действия не оказывает. Пример 8. Изучение влияния соединения I и лидокаина на интенсивность перекисного окисления липидов мембран (ПОЛ) и митохондриальную энергетику проводили на крысах-самках линии Вистар массой 200-250 г. Мито хондрии выделяли одновременно с микросомами методом дифференцированного центрифугирования по Комату в модификации В.В.Лемешко. Исследование интенсивности ПОЛ проводили в микросомальной фракции гомогената печени крыс. Интенсивность НАДФ-зависимого ПОЛ мембран микросом определяли в среде следующего состава: 100мМ трис-НСІ-буфер(рН 7,4), 1мМ НАДФ, 4мМ АДФ, 12 мкМ соль Мора. При аскорбатзависимом ПОЛ среда содержала 100мМ трис-НСІ-буфер(рН 7,4), 0,5мМ аскорбата, 12 мкМ соль Мора. В некоторых опытах в среду инкубации дополнительно вносили 4мМ АДФ. Концентрация белка микросом в инкубационной смеси составляла 0,5-0,6 мг на 1 мл. В инкубационную смесь постоянно продували прогретый до 37°С воздух, обеспечивая насыщение среды кислородом воздуха и перемешивание. Концентрацию соединения І и лидокаина определяли с помощью реакции с тиобарбитуровой кислотой, после осаждения белка трихлоруксусной кислотой. Белок определяли по Лоури и соавт. в модификации Миллера. Результаты исследования влияния соединения I и лидокаина на интенсивность ферментативного и неферментативного ПОЛ мембран микросом печени крыс представлены в табл.4. Отмечалось, что введение соединения I в среду инкубации приводит к значительному ингибированию ферментативного и неферментативного ПОЛ. При этом эффективность соединения I при неферментативном ПОЛ была выше, чем при ферментативном ПОЛ. 50%-ное ингибирование (рассчитана графическим методом) неферментативного и ферментативного ПОЛ наблюдалось при концентрации соединения I, 0,015 мг/мл (15 мг/л) и 0,195 мг/мл (195 мг/л) соответственно. Лидокаин при неферментативном ПОЛ даже в концентрации 2 мг/мл (2 г/л) достоверно не снижал интенсивность свободно-радикального окисления липидов. При ферментативном ПОЛ лидокаин снижал накопление малонового диальдегида (МДА) на 50% при концентрации 1 мг/мл (1 г/л), что вероятно, обусловлено ингибирующим действием препарата НАДФ-зависимой редокс-цепи микросом. Полученные данные свидетельствуют, что соединение І, в отличие от лидокаина, проявляет выраженное антиоксидантное действие. Дыхание митохондрий измеряли полярографически с помощью закрытого кислородного электрода, регистрируя кривые убыли кислорода на ленте самописца КСП-4. Состав реакционной среды: 100мМ сахароза, 75мМ KCI, 10 мМ КН2РО4, 2мМ MgCI2, 10мМ трис-НСІ-буфер (рН 7,4). Субстрат окисления глутамат-малат (5+5 мМ). АДФ добавляли в концентрации 200 мкМ, ЭДТА - 0,5мМ. По кривым потребления кислорода рассчитывали скорость дыхания в метаболических состояниях 2 по Ларди и Вэлману (4 по Чансу, V2), 3 по Чансу (V3), й в разобщенном состоянии (V3p) при использовании 2,4динитрофенола (ДНФ) в концентрации 10-4 М. Белок в пробах определяли по Лоури в модификации Миллера. Полученные данные (табл.5) свидетельствуют о том, что внесение в ячейку соединения І в количестве 0,125-0,25 мг/мл) приводит к выраженному ускорению потребления кислорода в состоянии 4 по Чансу. Дальнейшее же увеличение содержания этого вещества в ячейке приводило к резкому ингибированию дыхания митохондрий. Обращает на себя внимание также весьма существенное ингибирование дыхания в состоянии 3 (т.е. в присутствии АДΦ и Ф н), что, в принципе, может свидетельствовать о замедлении скорости синтеза АТФ благодаря снижению активности АТФ-синтетазы либо переносчика аденозиннуклеотидов. Но поскольку добавление разобщителя в ячейку (состояние Зр) не приводит к увеличению интенсивности потребления кислорода митохондриями, наблюдаемое явление, вероятно, не связано с ингибированием митохондриальной АТФ-синтетазы, а обусловлено ингибированием дыхательной цепи. При внесении в ячейку 0,5 мг/мл соединения I это ингибирование было максимальным. Сравнение действия на митохондриальную энергетику клетки соединения 1 и лидокаина свидетельствует о том, что лидокаин в исследованных концентрациях (до 2 мг/мл) не оказывает существенного разобщающего действия, но ингибировал активность дыхательной цепи, причем, максимальный эффект наблюдался при внесении в ячейку 2 мг/мл указанного агента. Следовательно, представленные данные свидетельствуют о том, что соединение I оказывает на митохондриальную энергетику клетки значительно более выраженное действие, чем лидокаин, чем объясняется его более выраженное антимикробное и фунгицидное действие. Пример 9. Антимикробную активность соединения I и препаратов сравнения изучали используя метод диффузии в питательный агар и метод серийных разведений в жидкой питательной среде. Для бактериальных культур использовали мясо-пептонный бульон, для дрожжеподобного гриба - авизированную и жидкую среду Сабуро. Суспензию микробных культур готовили в физиологическом растворе. Концентрацию клеток в 1 мл определяли пользуясь оптическим стандартом мутности, полученным в ГНИИСИКМЕП им. Л А.Тарасевича. В стерильные чашки Петри разлили по 10 мл питательного агара. На застывшие пластинки агара ставили цилиндры из нержавеющей стали диаметром 8 мм. Затем 20 мл расплавленного и охлажденного до 40°С питательного агара контаминиовали суспензией клеток, исследуемой тест-культуры до концентрации 10 кл/мл. Распределив равномерно суспензию культуры по всему объему агара, его быстро выливали на застывший 1-й слой. После застывания контаминированного агара (2-го слоя) из него извлекали цилиндры. В образовавшиеся лунки вносили по 0,1 мл растворов исследуемых соединений, используя концентрацию 100 мг/мл. Чашки оставляли на 2 ч при комнатной температуре, затем инкубировали 48 ч при 37°С. Антимикробную активность оценивали по величине зоны угнетения роста тест-культуры. При использовании метода серийных разведений для каждой исследуемой тест-культуры в штати в ставят 6 стерильных пробирок. Затем готовят рабочий раствор каждого соединения в мясо-пептонном бульоне концентрация 1 мг/мл. В первую пробирку вносят 4 мл рабочего раствора, в остальные - по 2 мл мясопептонного бульона. Из первой пробирки стерильной пипеткой переносят 2 мл раствора во вторую и хорошо перемешивают. Затем методом перекатки переносят 2 мл в следующую пробирку и т.д., каждый раз используя новую пипетку. Из пятой пробирки 2 мл раствора выливали. Шестая пробирка служила контролем. В каждую пробирку вносят по 0,2 мл суспензии клеток, используя концентрацию 107 кл/мл. Таким образом, концентрация микробных клеток в используемых растворах составила 106 кл/мл. Все пробирки инкубировали в термостате при 37°С в течение 48 ч. Антимикробную активность оценивали по наличию и интенсивности роста тест-культуры, сравнивая с контрольными пробирками. Проведенные исследования позволили установить высокую антимикробную активность соединения I по отношению к стафилококку золотистому, кишечной палочке, спорообразующей сапрофитной палочке, протею и дрожжеподобному патогенному грибу (табл.6). Таким образом, соединение формулы I по анестезирующей, противоаритмической, антиоксидантной, антимикробной и фунгицидной активности значительно превосходит препараты сравнения практически не уступая им по токсичности, что позволяет предположить возможность его применения в практической медицине, в частности, в хир ургии.
ДивитисяДодаткова інформація
Автори англійськоюUkrainets Ihor Vasyliovych, Bezuhlyi Petro Avksentiiovych, Treskach Volodymyr Yosypovych, Slobodzian Serhii Volodymyrovych, Turov Oleksandr Vsevolodovych, Heorhiievskyi Viktor Petrovych, Hryzodub Oleksandr Ivanovych, Levin Mykhailo Hryhorovych, Obolentseva Halyna Volodymyrivna, Hladchenko Svitlana Vasylivna, Kryvobok Viktor Ivanovych, Butenko Iryna Hryhorivna, Lemeshko Viktor Vasyliovych, Padalko Volodymyr Illich, Skubko Tamara Porfyrivna, Kobzar Hanna Ivanivna, Sukhinin Valerii Mykolaiovych, Lytovkina Olena Heorhiivna
Автори російськоюУкраинец Игорь Васильевич, Безуглый Петр Аксентиевич, Трескач Владимир Иосифович, Слободзян Сергей Владимирович, Туров Александр Всеволодович, Георгиевский Виктор Петрович, Гризодуб Александр Иванович, Левин Михаил Григорьевич, Оболенцева Галина Владимировна, Гладченко Светлана Васильевна, Кривобок Виктор Иванович, Бутенко Ирина Григорьевна, Лемешко Виктор Васильевич, Падалко Владимир Ильич, Скубко Тамара Порфирьевна, Кобзарь Анна Ивановна, Сухинин Валерий Николаевич, Литовкина Елена Георгиевна
МПК / Мітки
МПК: A61P 9/06, C07D 215/20, A01P 3/00, A61P 39/06, A61P 31/04, A61K 31/47
Мітки: кислоти, активність, антиоксидантну, антимікробну, протиаритмічну, фунгіцидну, анестезуючу, гідрохлорид, проявляє, 1-пропіл-2-оксо-4-гідроксихінолін-3-карбонової, діетиламіноетиламіда
Код посилання
<a href="https://ua.patents.su/5-19287-dietilaminoetilamida-1-propil-2-okso-4-gidroksikhinolin-3-karbonovo-kisloti-gidrokhlorid-shho-proyavlyaeh-anestezuyuchu-protiaritmichnu-antioksidantnu-antimikrobnu-ta-fungicidnu-ak.html" target="_blank" rel="follow" title="База патентів України">Діетиламіноетиламіда 1-пропіл-2-оксо-4-гідроксіхінолін-3-карбонової кислоти гідрохлорид, що проявляє анестезуючу, протиаритмічну, антиоксидантну, антимікробну та фунгіцидну активність</a>
Попередній патент: Пристрій для контролю імпульсів перешкоди електричного сигналу
Наступний патент: Спосіб одержання макроциклічних сполук
Випадковий патент: Спосіб доступу до зовнішньої сонної артерії