Похідні 7-гідрокси-5,6-діарил-4,5,6,7-тетрагідроазоло[1,5-а]піримідин-7-карбонових кислот та спосіб їх одержання
Номер патенту: 88504
Опубліковано: 26.10.2009
Автори: Афанасіаді Людмила Михайлівна, Десенко Сергій Михайлович, Чебанов Валентин Анатолійович, Сахно Яна Ігорівна
Формула / Реферат
1. Похідні 7-гідрокси-5,6-діарил-4,5,6,7-тетрагідроазоло[1,5-а]піримідин-7-карбонових кислот загальної формули І
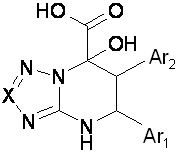 , I
, I
де Х= СН, N;
Ar1=C6H5, 4-Cl-C6H4, 4-CH3O-C6H4;
Ar2=C6H5, 4-CH3-C6H4.
2. Спосіб одержання сполук загальної формули І
 , I
, I
де Х= СН, N;
Ar1=C6H5, 4-Cl-C6H4, 4-CH3O-C6H4;
Ar2=C6H5, 4-CH3-C6H4;
що включає конденсацію рівномолярних кількостей аміноазолу з карбонільною сполукою в органічному розчиннику, який відрізняється тим, що як аміноазольну складову використовують 5-аміно-1,2,4-триазол або 5-амінотетразол, як карбонільну сполуку використовують арилпіровиноградні кислоти, що мають замісники Аr2, і ароматичні альдегіди формули Аr1СНО, як органічний розчинник використовують етиловий спирт, конденсацію проводять у присутності каталізатора НСl в умовах мікрохвильового опромінення при температурі 145-150 °С протягом 8-10 хвилин.
Текст
1. Похідні 7-гідрокси-5,6-діарил-4,5,6,7тетрагідроазоло[1,5-а]піримідин-7-карбонових кислот загальної формули І 2 ,I O HO OH X N N N N H де X=CH, N Ar2 Ar1 I, Ar1=C6H5, 4-Cl-C6H4,, 4-CH3O-C6H4; Ar2=C6H5, 4-CH3-C6H4. Сполуки, що заявляються, являють собою складні азотовмісні гетероциклічні системи і мають високу реакційну здатність. Наявність вільної кар боксильної групи припускає можливість модифікації структури, що заявляється, шляхом утворення різних хлорангідридів кислот, амідів, ефірних угруповань. Це розширює можливості використання сполук І як проміжних продуктів (інтермедіатів, білдінг-блоків) у препаративному органічному синтезі при вирішенні низки важливих практичних задач, у тому числі і в області комбінаторної хімії. Наявність фармакофорних фрагментів обумовлює перспективність пошуку у низці сполук формули І речовин з різними видами фізіологічної активності, що робить їх дуже корисними і інтересними з точки зору медичної і фармакологі (19) Винахід відноситься до області хімії і являє собою нові похідні азолопіримідинів, а саме 7гідрокси-5,6-діарил-4,5,6,7-тетрагідроазоло [1,5а]піримідин-7-карбонові кислоти загальної формули І UA (11) де Х= СН, N; 3 88504 4 Me чної хімії. Так, різні гетероциклічні похідні піразолів і піримідинів використовуються як терапевтичні засоби проти гострого і хронічного запалення, ішемічних процесів, призначені для лікування патологічних станів, насамперед, ревматоїдного артриту, розсіяного склерозу, астми, запалення кишечника [Пат. РФ 2266901, CO7D239/54; А61К31/513]. Аліфатичні, ароматичні і гетероароматичні похідні піровиноградної кислоти використовуються як прекурсори для неприродних амінокислот, які грають важливу роль у проміжному метаболізмі (обміну речовин), при уремії. Вони також інтересні як проміжні продукти (інтермедіати) в органічному синтезі при розробці інгібіторів ензимів і лікарських препаратів [P. Busca, F. Paradisi et. al., Org. Biomol. Сhem., 2, 2684 (2004)]. Сполучення в одній молекулі фрагментів піразолу, піримідину і похідних піровиноградної кислоти дозволить розширити асортимент нових потенційних лікарських препаратів і фізіологічно активних речовин з новими властивостями і практичними застосуваннями. Відомий структурний аналог сполук, що заявляються, 2,5,7-триметил-4,5,6,7тетрагідропіразоло[1,5-а]піримідин формули II N N Me II N H Me і спосіб його одержання [С. Beltec, G. Zlommet, J. Heterocycl. Chem., 32, №6, 1793(1995)]. Сполука формули II - безкольорова речовина, що розчиняється в органічних розчинниках (спиртах, хлороформі), в сильно полярних розчинниках (диметилфорамід, диметилсульфоксид), не розчиняється у воді, ефірі, в оцтовій кислоті. Недоліком структури сполуки формули II є неможливість різноманітності структури аналога шляхом введення замісників різної електронної природи (автори вводять у положення 2,5,7 тільки два замісника -СН3- і -С6Н5- групи). Крім того, модифікація структури аналога ускладнюється, оскільки є тільки один реакційний центр -NH-група. Спосіб одержання відомої сполуки формули II складається із трьох стадій і здійснюється за схемою: Схема ІІ NH N Me O Me N2H4 . H2O HCl H2N N H N O Me Me HCl N N N Me N N N H На першій стадії суміш b-амінокротонітрилу і 85% гідразингідрату нагрівають 8 годин, додають концентровану НСl і кип'ятять протягом 2 годин. Охолоджують і нейтралізують твердим NaOH, після чого випадають кристали амінопіразолу. Після охолодження суміші кристали відфільтровують, промивають водою, кип'ятять ЗО хвилин у воді, знову охолоджують. Для очистки аминопіразол розчиняють при кипінні у суміші бензолу і гексану, а потім розганяють у вакуумі (основний продукт відганяють при т. кип. 152-153°С/6мм.рт.ст.). Вихід 77%. На другій стадії еквімолярні кількості 2,3бутандіону, 5-аміно-3-метилпіразолу нагрівають упродовж 3 годин в концентрованій НСl. Реакційну масу охолоджують, нейтралізують концентрованим розчином NaOH і двічі екстрагують хлороформом. Екстракт хлороформу сушать над безводним MgSO4, розчинник упарюють. Одержують 2,5,7-триметилпиразоло[1,5-а]піримідин з виходом 90%, т. пл. 78°С. На третій стадії суміш піразоло[1,5а]піримідину, одержаного на попередній стадії, і алюмогідриду літію нагрівають у свіжоперегнаному тетрагідрофурані протягом 48 годин. Після охолодження суміш розбавляють водою і фільтрують. Me LiAIH4 Me Me Me Me Розчин екстрагують тричі хлороформом. Органічний шар сушать над безводним Na2SO4, потім упарюють. Технічний вихід 2,5,7-триметил-4,5,6,7тетрагідропіразоло[1,5-а]піримідину складає 68%, т. пл. 85°С. Загальний час синтезу з урахуванням виділення проміжних продуктів на кожній стадії і основного продукту на останній стадії складає приблизно 80 годин. До недоліків відомого способу одержання сполук формули II слід віднести тривалість і трудоємність процесу, пов'язані з виділенням продуктів на кожній технологічній стадії (нейтралізація, екстракція, упарювання, вакуумна перегонка, очистка розчинника - тетрагідрофурану). Крім того, використання легкозаймистих (бензол, гексан) розчинників, шкідливих, отруйних і вибухових речовин обмежує використання відомого методу у лабораторних і виробничих умовах. Відомий аналог за хімічною структурою - діоли 5,7-дигідрокси-5-метил-7-трифторметил-4,5,6,7тетрагідропіразоло[1,5-а]піримідинів формули III і спосіб їх одержання [Е.Е. Хмелина, А.А.Петров, А.В.Фирсов, Ж. органической химии, 39, вып.2, с.299 (2003)]. 5 R HO N N R1 88504 лів формули III вище 50°С або тривалому стоянні при кімнатній температурі відбувається виділення води і утворення 5-метил-7трифторметилпіразоло[1,5-а]піримідинів - гетероароматизованих сполук з довгим ланцюгом подвійних спряжених зв'язків. Спосіб одержання сполук формули III здійснюється за схемою: CF3 N H Me OH де R=CH3, C6H5, 4-Cl-C6H4; III, 6 R1=H, C6H5. Діоли формули III являють собою безкольорові кристалічні сполуки, що погано розчинні у малополярних середовищах, добре розчиняються у спиртах, диметилсульфоксиді. При нагріванні діо Схема ІІІ N O NH NH2 + Me R HO O CH2Cl2 CF3 R N N -150C R1 Реакція проходить в одну стадію шляхом взаємодії еквімолярних кількостей відповідного заміщеного 5-амінопіразолу з 1,1,1-трифторпентан-2,4діоном у дихлорметані при охолодженні (-15°С). Суміш видержують в залежності від природи замісника протягом 3-24 годин при цій температурі. Осад, що випав, відфільтровують, промивають холодним СН2Сl2. Виходи складають 38-48%. Недоліком сполук формули III є їхня нестійкість вже при кімнатної температурі (при тривалому стоянні) і миттєва дегідратація при 50°С з утворенням гетероароматизованих продуктів. Недоліком відомого способу одержання сполук формули III є тривалість процесу за часом (в деяких випадках до 24 годин), використання глибокого охолодження до (-15°С) при проведенні реакції і видержуванні реакційної маси з використанням низькотемпературних холодоагентів (суміш льоду з СаСl2, рідкого азоту і т.ін.), участь у реакції фторорганічних сполук. У синтезі використовується дихлорметан - розчинник отруйної дії на організм людини. При освітленні дихлорметан розкладається з виділенням НСl, визиваючи поразку внутрішніх органів; токсичний і може визивати нудоту, подразнення слизової оболонки очей. Наркотичні і смертельні концентрації при вдиханні людиною близькі одні одних. Фторорганічні сполуки негативно впливають на організм людини з порушенням окислювальних процесів. Сполуки формули III і спосіб їх одержання як найбільш близький за технічною суттю обрано нами в якості прототипу. В основу винаходу поставлено задачу пошуку нових сполук в низці азолопіримідинів, що мають постійний склад і структуру при кімнатної температурі і нагріванні, а також розробки простого і доступного способу одержання похідних 7-гідрокси5,6-діарил-4,5,6,7-тетрагідроазоло[1,5-а]піримідин7-карбонових кислот, що дозволяє скоротити тривалість технологічного процесу, виключити застосування отруйних, вогненебезпечних розчинників, підвищити вихід кінцевих продуктів. Рішення поставленої задачі забезпечується розробкою похідних 7-гідрокси-5,6-діарил-4,5,6,7тетрагідроазоло[1,5-а]піримідин-7-карбонових кислот загальної формули І Me OH N H R1 t 0C N N R N Me R1 O HO OH X CF3 CF3 N N N N H де X=CH, N Ar2 I, Ar1=C6H5, 4-Cl-C6H4,, 4-CH3O-C6H4; Ar2=C6H5, 4-CH3-C6H4. Ar1 Рішення поставленої задачі забезпечується також тим, що у способі одержання сполук загальної формули І, O HO OH X N N N N H де X=CH, N Ar2 Ar1 I, Ar1=C6H5, 4-Cl-C6H4,, 4-CH3O-C6H4; Ar2=C6H5, 4-CH3-C6H4. що включає конденсацію рівномолярних кількостей аміноазолу з карбонільною сполукою в органічному розчиннику, згідно винаходу, в якості аміноазольної складової використовують 5-аміно1,2,4-тріазол або 5-амінотетразол, в якості карбонільної сполуки використовують арилпіровиноградні кислоти, що мають замісники Аr2, і ароматичні альдегіди формули Аr1СНО, в якості органічного розчинника використовують етиловий спирт, конденсацію проводять в присутності каталізатора НСl в умовах мікрохвильового опромінення при температурі 145-150°С протягом 8-10 хвилин. Модифікація структури сполук, що заявляються, шляхом конденсації 5-аміно-1,2,4-тріазолу або 5-амінотетразолу з арилпіровиноградними кислотами і ароматичними альдегідами приводить до появи нової структури сполук з неочевидними властивостями. Так, при нагріванні сполук, що заявляються, до 50°С и вище процес дегідратації не відбувається (на відміну від сполук за прототипом, де таке явище присутнє). Проведене нами видержування сполук формули І при кімнатній температурі протягом 90 днів не привело до будь-якої деструктивної зміни сполук, що заявляються, що підтверджено даними ЯМР 1Н спектроскопії, постійністю елементного аналізу і температури плавлення. Таким чином, сполуки, що заявляються, стійки до дії температури і при тривалому зберіганні при кімнатній температурі мають постійну хімічну структуру. Можливість видозміни хімічної структури сполук формули І варіюванням замісників як в альдегідній складовій, так і в складовій арилпіровиног 7 88504 радной кислоти, які формують тетрагідропіримідиновий цикл, а також можливість варіювання структур нових сполук через карбоксильну групу відкриває перспективи синтезу великого асортименту нових корисних речовин з новими властивостями і застосуванням. Вибір реагентів і проведення реакції їх взаємодії в умовах мікрохвильового опромінення дозволяє підвищити чистоту і вихід кінцевих продуктів, значно зменшити енергозатрати, а також забезпечує високу швидкість протікання реакції, що приводить до зменшення тривалості технологічного процесу. У способі, що заявляється, у реакційному сосуді в умовах мікрохвильового опромінення не спостерігається локальних перегрівів реакційної суміші. Така сталість температури при проведенні синтезу сполук формули І у способі, що заявляється, приводить до постійності складу і структури цих сполук. Так, у прототипі - навіть при зніманні спектрів ЯМР 1Н і 13С відразу після синтезу і через 1 добу, а потім через 2-3 доби в спектрах спостерігається наявність різних наборів сигналів з різними хімічними зсувами, що свідчить про непостійність сполуки за часом. У способі, що заявляється, протягом 8-10 хвилин (у способі-прототипі 3-24 години) одностадійним методом одержують чисті сполуки формули І, що не потребують перекристалізації, з достатньо високими виходами 65-80% (у способі-прототипі 38-48%). Крім того, спосіб, що заявляється, дозволяє уникнути застосування глибокого заморожування і використання отруйних розчинників і речовин. При проведенні досліджень виявлено оптимальний температурно-часовий режим синтезу. Так, проведення реакції в умовах, що заявляються, при температурі 145-150°С протягом 8-10 хвилин забезпечує високу швидкість реагування складових речовин і приводить, відповідно, до зменшення тривалості технічного процесу. Підвищення температури до 160°С дає значне зниження виходу 8 цільових продуктів через утворення у реакційній масі суміші вихідних і кінцевих речовин. При зниженні температури (нижче 145°С) необхідно збільшити час реакції в умовах мікрохвильового опромінення для утворення відповідного кінцевого продукту, що є недоцільним. Час протікання реакції в умовах мікрохвильового опромінення складає 8-10 хвилин, що встановлено експериментальним шляхом, причому зменшення часу приводить до значного зниження виходів сполук формули І, що заявляються. Збільшення часу перебігу реакцій є недоцільним, адже вже 10 хвилин достатньо для утворення цільових продуктів реакції. Проведення взаємодії вихідних речовин у спиртовому середовищі в умовах кислотного каталізу дозволяє виділяти із реакційної маси чисті продукти, що не потребують додаткової перекристалізації, а також сприяє проходженню реакції у необхідному напрямку. В умовах основного каталізу реакція супроводжується утворенням смолистих напівпродуктів, що приводить до неможливості виділення цільових продуктів реакції. Проведення реакції при мікрохвильовому опроміненні в етиловому спирті виключає утворення шкідливих технологічних стоків. Етиловий спирт, що залишився після проведення реакції, утилізують розбавленням водою (у прототипі отруйний розчинник дихлорметан автори не утилізують). Для повного проходження реакції у напрямку, що визначено структурою сполук формули І, суміш компонентів реакції (аміноазол:ароматичний альдегід:арилпіровиноградна кислота) беруть у співвідношенні 1:1:1. Застосування будь-якого із компонентів у співвідношенні меншому або більшому, ніж потребується за реакцією, приводить до утворення суміші вихідних, кінцевих продуктів і продуктів, що не прореагували. Таку суміш практично не можна розділити. Спосіб, що заявляється здійснюється за схемою: Схема І HO N X N O O NH NH2 + Ar1 H + Ar2 OH O OH EtOH HCl O X N N N N H Ar2 Ar1 де X=CH, N Ar1=C6H5, 4-Cl-C6H4,, 4-CH3O-C6H4; Ar2=C6H5, 4-CH3-C6H4. Синтез проходить в умовах кислотного каталізу і полягає в тому, що проводять конденсацію 5аміно-1,2,4-тріазолу або 5-амінотетразолу з відповідними ароматичними альдегідами і арилпіровиноградними кислотами в етиловому спирті в присутності каталітичних кількостей (0,1мл.) НСl при мікрохвильовому опроміненні при температурі 145-150°С протягом 8-10 хвилин в одну стадію до утворення цільових продуктів. У таблиці 1 наведено порівняльні характеристики способу, що заявляється, і способу за прототипом. У таблиці 2 дано характеристики деяких сполук, що заявляються, і сполуки, одержаної за прототипом. 9 88504 Приклад 1 Одержання 7-гідрокси-5,6-дифеніл-4,5,6,7тетрагідро-[1,2,4]-тріазоло[1,5-а]піримідин-7карбонової кислоти. Суміш 0,2г (2,3ммоль) 1,2,4-амінотріазолу, 0,24мл (2,3ммоль) бензальдегіду і 0,39г (2,3ммоль) фенілпіровиноградної кислоти в 2мл етилового спирту поміщають у пробірку для мікрохвильового опромінення, об'ємом 10мл. Після перемішування додають 0,1мл НСl. Пробірку містять у мікрохвильовий реактор. Час реакції -8 хвилин при температурі 145°С. Продукт, що випадає при охолодженні, відфільтровують, промивають 5мл етилового спирту і сушать. Вихідні дані: вихід 0,62г (79%). Т.пл. 193195°С. Спектр ЯМР1Н, d(м.ч.) 3.74 (1H, d, J=11.7Hz, 6СН), 4.99 (1H, d, J=11.7Hz, 5-СН), 7.43 (s, 1Н, 2СН), 7.76 (1Н, у.с, NH), 6.92-7.38 (10Н, м, АrН) Приклад 2 Одержання 7-гідрокси-5,6-дифеніл-4,5,6,7тетрагідротетразоло[1,5-а]піримідин-7-карбонової кислоти. У пробірку для проведення мікрохвильового синтезу об'ємом 10мл містять 0,22г (2,35ммоль) 5амінотетразолу, 0,25мл (2,35ммоль) бензальдегіду і 0,4г (2,35ммоль) фенілпіровиноградної кислоти у 2мл етанолу. Після перемішування додають 0,1мл НСl і містять у мікрохвильовий реактор. Час реакції - 10 хвилин при температурі 150°С. Продукт після охолодження відфільтровують, промивають 5мл етилового спирту і сушать. Вихідні дані: вихід 0,59г (67%). Т.пл. 204206°С. Спектр ЯМР1Н, d(м.ч.) 3.82 (1Н, d, J=11.8Hz, 6СН), 4.37 (1H, d, J=11.8Hz, 5-СН), 7.76 (1Н, y.c.,NH), 7.08-7.28 (10Н, м, АrН) Решту прикладів зведено у таблиці 2. Дані матеріалів опису винаходу і таблиці 1, 2 показують, що сполуки формули І мають високу 10 стійкість при кімнатній температурі і температурі вище 50°С (сполуки за прототипом в цих умовах дегідратуються з утворенням зовсім нової гетероароматизованої системи). Структура сполук, що заявляються, забезпечує одержання широкого асортименту похідних 7-гідрокси-5,6-діарил4,5,6,7-тетрагідроазоло[1,5-а]піримідин-7- карбонових кислот з покращеними характеристиками і високим ступенем чистоти, що не потребує додаткової очистки. Спосіб одержання сполук формули І, що пропонується, дозволяє: - значно зменшити тривалість процесу до 8-10 хвилин (прототип 3-24 години); - збільшити виходи і якість сполук формули І за рахунок проведення реакції у спиртовому середовищі у присутності каталітичних кількостей кислотного каталізатора; - широко варіювати у молекулі Аr1 і Аr2 замісники; - забезпечити відсутність отруйних і шкідливих речовин; - використовувати у синтезі доступні реактиви і розчинники, що випускаються вітчизняною промисловістю; - зменшити шкідливі технологічні стоки шляхом їх утилізації водою. Всі ці переваги нових сполук і способу їх одержання розширяють можливості їх потенційного використання в якості фізіологічно активних речовин, в медицині (в якості лікарських препаратів), в біології, фармації, в препаративному органічному синтезі, в сільському господарстві в якості хімічних засобів захисту рослин і т. ін. Спосіб одержання сполук формули І простий, здійснюється в одну стадію, пройшов апробацію в лабораторних умовах і може легко відтворюватися в умовах промислових мікрохвильових устаткувань. Таблиця 1 Кількість стадій реакції Тривалість процесу Вихід основного продукту, % Використання токсичних речовин, хладагентів Очищення осн. продукту Спосіб, що заявляється 1 8-10хв. 65-80 не застосовуються не потрібно Спосіб прототип 1 3-24год. 38-48 дихлорметан, охолоджування до -15°С неможливо, при t>50°C сполуки дегідратуються Таблиця 2 № п/п 1 1 X 2 CH 2 CH Сполуки, що заявляються Аr1 Аr2 3 4 С6 Н5 С6 Н5 4-Сl-С6Н5 С6 Н5 Т.пл., °С Вихід, % ЯМР% d(м.ч.) 5 193-195 6 79 206-208 76 7 3.74 (1H, d, J=11.7Hz,6-СН), 4.99 (1Н, d,J=11.7Hz, 5-СН), 7.43(s, 1H, 2-СН), 7.76 (1H, у. c., NH), 6.927.38 (10Н,м, АrН) 3.70 (1Н, d, J=11.5Hz,6-СН), 5.02 (1Н, d, J=11.5Hz, 5-CH), 7.45 (s, 1H, 2-CH), 7.84 (1H,y.c, NH), 6.987.39 (9H, m, ArH) 11 88504 12 Продовження таблиці 2 3 CH 4-СН3О-С6Н4 С6 Н5 216-218 65 4 CH С6 Н5 4-СН3-С6Н4 215-217 68 5 CH 4-Сl-С6Н4 4-СН3-С6Н4 197-199 72 6 СН 4-СН3О-С6Н4 4-СН3-С6Н4 196-198 80 7 N С6 Н5 С6 Н5 204-206 67 8 N 4-СН3О-С6Н4 С6 Н5 210-212 66 Сполука за прототипом Не наведено 48 HO Ph CF3 N N N H Me OH Комп’ютерна верстка Н. Лиcенко Підписне 3.60 (3H, s, OCH3), 3.70(1H, d, J=11.9Hz, 6-CH),5.02 (1H, d, J=11.9Hz, 5-CH), 7.44 (s, 1H, 2CH), 7.73 (1H, y.c, NH),6.58-7.28 (9H, m, ArH)13,42 (bs, 1H, COOH) 2.12 (3H, s, CH3), 3.71(1H, d, J=11.7Hz,6-CH),4.98 (1H, d, J=11.7Hz,5-CH), 7.44 (s, 1H, 2-CH), 7.78 (1H, y.c, NH),6.76-7.40 (9H, m, ArH),13,10 (bs, 1H, COOH) 2.12 (3H, s, CH3), 3.70(1H,d, J=11.6Hz,6-CH),5.01 (1H, d, J=11.6Hz, 5-CH), 7.44 (s, 1H, 2СН), 7.80 (1Н, у.с,NH), 6.83-7.38 (8Н, м, АrН), 13,18 (bs, 1H, СООН) 2.12 (3Н, s, СН3), 3.61(3Н, s, ОСН3), 3.67 (1H,d, J=12.1Hz, 6СН), 4.92(1H,d, J=12.1Hz, 5СН),7.42 (s, 1H, 2-СН), 7.68(1Н, у.с, NH), 5.69-7.27(8Н, м, АrН) 13,16 (bs, 1Н, СООН) 3.82 (1H, d, J=11.8Hz,6-СН), 4.37 (1Н, d, J=11.8Hz, 5-СН), 7.76 (1Н,у.с, NH), 7.08-7.28 (10Н,м, АrН) 3.61 (3Н, s, ОСН3), 3.62(1H, d, J=11.7Hz, 6-CH),4.87 (1H, d, J=11.7Hz, 5-СН), 7.73 (1H, у.с, NH), 6.78-8.05 (9Н, м, АrН) 13,22 (bs, 1H, СООН) 1.87 (3Н, s, СН3), 2.25,2,42 (2Н, d, J= 13.7 Hz, 6-СН), 5.73 (1Н, s, 3CH),6.75 (1H, с, ОН), 6.69(1H, с, ОН), 7.56 (1H, у.с, NH), 7.16-7.68 (5Н, м, АrН) Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 7-hydroxy-5,6-diaryl-4,5,6,7-tetrahydroazolo[1,5-a]pyrimidine-7-carboxylic acids and process for the preparation thereof
Автори англійськоюSakhno Yana Ihorivna, Chebanov Valentyn Anatoliiovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюПроизводные 7-гидрокси-5,6-диарил-4,5,6,7-тетрагидроазоло[1,5-а]пиримидин-7-карбоновых кислот и способ их получения
Автори російськоюСахно Яна Игоревна, Чебанов Валентин Анатолиевич, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 487/04
Мітки: кислот, похідні, одержання, спосіб, 7-гідрокси-5,6-діарил-4,5,6,7-тетрагідроазоло[1,5-а]піримідин-7-карбонових
Код посилання
<a href="https://ua.patents.su/6-88504-pokhidni-7-gidroksi-56-diaril-4567-tetragidroazolo15-apirimidin-7-karbonovikh-kislot-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні 7-гідрокси-5,6-діарил-4,5,6,7-тетрагідроазоло[1,5-а]піримідин-7-карбонових кислот та спосіб їх одержання</a>
Попередній патент: Установка для переробки відходів
Випадковий патент: Насадка для введення лікарського препарату у зону мигдалин










