Спосіб і пристрій для фотодинамічної інактивації вірусів у біологічних рідинах
Номер патенту: 82786
Опубліковано: 12.05.2008
Автори: Степанюк Світлана Володимірівна, Бондар Володимир Васильович, Сергутіна Світлана Юріївна, Рибка Володимир Миколайович
Формула / Реферат
1. Спосіб фотодинамічної інактивації вірусів у крові та її компонентах шляхом змішування розчину біологічної рідини з фенотіазиновим барвником і наступного опромінення їх світлом, який відрізняється тим, що перед опроміненням суміш витримують у темноті від 1 до 2 годин, причому концентрація барвника в суміші складає від 1 до 100 мкмоль/л, а опромінення світлом проводять в ультрафіолетовій і червоній областях дозою від 30 до 75 Дж в проточному режимі.
2. Пристрій для фотодинамічної інактивації вірусів, що містить корпус, на внутрішній поверхні якого нанесене покриття, що відбиває світло, і в якому розташована кювета у вигляді кварцової трубки, джерело ультрафіолетового випромінювання, а також системи відбору й зберігання рідини, який відрізняється тим, що джерело випромінювання світла додатково містить лампу червоного світла, а система для зберігання рідини додатково обладнана перистальтичним насосом, вихід якого з'єднаний із входом кювети.
Текст
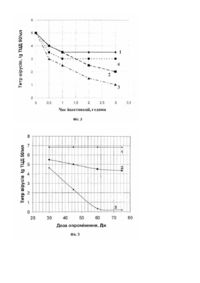
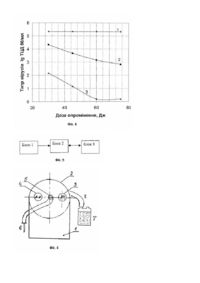
Винахід, що пропонується, відноситься до медицини і може бути використаний для інактивації вірусів у плазмі донорської крові, в розчинах білків і водних середовищах при виробництві біопрепаратів і при гемотрансфузіях. Інфекційна безпека є однією з основних вимог при гемотрансфузіях, при лікувальному застосуванні біопрепаратів, які виготовляються з плазми донорської крові. Відомий спосіб інактивації вірусів, при якому віруси в культуральній рідині змішують у колбі з розчином фенотіазинового барвника, який сенсибілізує їх при подальшому опроміненні розчину видимим світлом (див. В. Снайпс і ін. - Photochem. and Photobiol. - 1979, vol. 29, p.785-790). При використанні цього способу інактивації вірусів у крові та її компонентах було встановлено, що при застосуванні способу спостерігалась не тільки їх інактивація, а й денатурація білків плазми крові, таких як фактори згортання VIII і IX. Відомий також спосіб (див. патент России №2036235 от 27.05. 1995г., МКИ 7 А 61 N 5/00) інактивації вірусів у крові та її компонентах, за яким різні типи вірусів знезаражуються без суттєвого впливу на функціональні властивості білків плазми крові. Спосіб полягає в додаванні до крові та її компонентів фенотіазинового барвника з наступним опроміненням суспензії видимим світлом, при цьому барвник використовують у концентрації 0,1-10мкмоль/л, а опромінення здійснюють безпосередньо в прозорих ємностях, які використовуються для взяття й зберігання крові. Інактивація вірусів зазначеним способом не може бути використана в технологічному процесі через її довготривалість (більше 5 годин), а схема опромінення не забезпечує можливості зменшення дози опромінення біопроб. Мета винаходу - розробка способу фотодинамічної інактивації вірусів у донорській крові та її компонентах, який може використовуватись у технологічному процесі виробництва біопрепаратів. Поставлена мета досягається тим, що в способі фотодинамічної інактивації вірусів у донорській крові та її компонентах, який полягає в змішуванні розчину або суспензії з фенотіазиновим барвником та наступним опроміненням її світлом, перед цим суміш витримують в темноті від 1 до 2 годин, причому концентрація барвника складає від 1 до 100мкмоль/л, а опромінення світлом проводять в ультрафіолетовій і червоній областях спектра дозою від 30 до 75Дж у проточному режимі. Витримування суміші в темноті від 1 до 2 годин дозволяє молекулам барвника продифундувати до активних центрів оболонок, нуклеінових кислот (ДНК і РНК) вірусів і утворити з ними стійкі комплекси (темнова фаза), що сприяє інактивації оболонкових (складних) і безоболонкових (простих) вірусів. Наступне опромінення суміші в ультрафіолетовій та червоній областях, де барвник - метиленовий синій, - має інтенсивні смуги поглинання, переводить його молекули в збуджений стан, що призводить до генерації активного кисню в плазмі донорської крові, який приймає участь в інактивації вірусів. Так, опромінення в проточному режимі дозами від 30 до 75Дж суміші (контамінованої вірусами плазми донорської крові з метиленовим синім у вищезазначених концентраціях) дозволило повністю інактивувати віруси поліомієліту та везикулярного стоматиту. Одночасне опромінення суміші світлом двох спектральних областей дозволяє зменшити дозу, при якій відбувається повна інактивація вірусів (див. Таблицю 1). Винахід підтверджується малюнками, на яких наведені графіки, що отримані експериментальним шляхом і демонструють процеси фотодинамічної інактивації безоболонкових (наприклад, вірус поліомієліту) та оболонкових (наприклад, вірус везикулярного стоматиту) вірусів. Ступінь інактивації вірусів оцінювалась методом кінцевого (граничного) розведення і характеризувалась титром тканевих цитопатичних доз (ТЦД 50/мл). На Фіг. 1 наведені графіки залежності ступеня інактивації вірусів поліомієліту (ВП) в плазмі донорської крові від терміну витримки її з метиленовим синім (МС) в темноті для різних концентрацій (крива 1 відповідає концентрації МС=103 моль/л, крива 2-10-4моль/л, крива 3-10-5моль/л, крива 4-10-6моль/л); на Фіг. 2 наведені дані інактивації вірусу везикулярного стоматиту (ВВС) в плазмі донорської крові для тих же концентрацій МС (крива 1 відповідає концентрації МС=10-3моль/л, крива 2-10-4моль/л, крива 3-10-5моль/л, крива 4-10-6моль/л). Як видно з графіків, наведених на Фіг. 1 і 2, витримування при кімнатній температурі в темноті суміші плазми донорської крові з розчинами МС зазначених концентрацій, призводить до значного зменшення величини ТЦД 50/мл на початковій стадії, а після витримування суміші терміном від 1 до 2 годин настає стабілізація, і криві приймають постійні значення титру вірусів, що можна інтерпретувати як закінчення процесів їх інактивації. При цьому не досягається повна інактивація вірусів у плазмі донорської крові. Більш чутливим до сенсибілізатора МС є оболонковий вірус ВВС. На Фіг. 3 наведені графіки залежності ступеня інактивації вірусів поліомієліту (ВП) в плазмі донорської крові від дози (від 30 до 75Дж) ультрафіолетового опромінення (крива 2) та опроміненої такими ж дозами контамінованої плазми крові, попередньо обробленої розчином МС з концентрацією 10-6моль/л (крива 3). Крива 1 показує ступінь інактивації зазначених вірусів самою плазмою донорської крові, яка містить антитіла до цього вірусу. Визначення ступеня інактивації вірусів ВП під дією цих факторів проводилось для кожної дози з урахуванням значень кривої 1. На Фіг. 4 наведені графіки залежності ступеня інактивації вірусів ВВС в плазмі донорської крові від дози (від 30 до 75Дж) ультрафіолетового опромінення (крива 2), а також - для опроміненої тими ж дозами контамінованої плазми крові, попередньо обробленої розчином МС з концентрацією 10-6моль/л (крива 3). Визначення ступеня інактивації вірусів ВВС під дією цих факторів також проводилось для кожної дози з урахуванням значень кривої 1. Наведені на Фіг. 3 і 4 дані показують, що тільки ультрафіолетове опромінення зазначеними дозами контамінованої вказаними вірусами плазми донорської крові в обох випадках зменшує концентрацію вірусів в ній більш, ніж в 10 разів, однак не досягається їх повної інактивації. В той же час, наявність в суміші фотосенсибілізатора МС призводить до повного їх знезараження при опроміненні світлом дозою 60Дж. Опромінення контамінованої і обробленої сенсибілізатором МС плазми донорської крові червоним світлом також викликає повну інактивацію вказаних вірусів, при цьому динаміка зменшення титру вірусів зростає. Одночасне опромінення контамінованої плазми донорської крові в двох областях спектру призводить до зменшення дози опромінення, при якій відбувається повне знезараження вірусів, наприклад, для ВП вона становила 50Дж, а для ВВС - 40Дж, відповідно. Спосіб інактивації вірусів, що пропонується, може бути реалізований в пристрої спеціальної конструкції. Так, відомо пристрій для ультрафіолетового опромінення рідини (див. патент України на корисну модель №41 від 28.02.1997p.), що містить кювету у вигляді кварцової трубки, в якій відбувається опромінення рідини, і джерело ультрафіолетового випромінювання - ртутна лампа низького тиску, що розташовані в корпусі, який виконано у вигляді еліптичного порожнистого циліндру. Один кінець кювети з'єднано еластичною трубкою з ін'єкційною голкою, а другий - з ємністю для збору рідини. Однак, вказаний пристрій не може реалізувати спосіб, що пропонується. Мета винаходу - розробка пристрою, що реалізує спосіб, який пропонується, в повному обсязі. Поставлена мета досягається тим, що в пристрої для опромінення рідини, який містить корпус у вигляді порожнистого циліндру, де розташована кювета (кварцова трубка), джерело опромінення світлом, а також системи для відбору й зберігання рідини. Джерело опромінення додатково містить лампу червоного світла, а система для відбору й зберігання рідини додатково обладнана перистальтичним насосом, вихід якого з'єднаний через трійник із вхідним отвором кювети. Додаткове обладнання джерела опромінення лампою червоного світла дозволяє опромінювати донорську кров та її компоненти в двох областях, в яких інтенсивно поглинає барвник - метиленовий синій, що дозволяє максимально використовувати сенсибілізатор для фотодинамічної інактивації вірусів. Перистальтичний насос, за допомогою якого створюється ламінарний потік рідини в зоні опромінення з заданою швидкістю, дозволяє забезпечувати однакову дозу опромінення в двох областях спектра і багаторазову циркуляцію рідини через зону опромінення, що зменшує час процедури й дозволяє використовувати пристрій у технологічному процесі. Винахід ілюструється кресленнями, на яких на Фіг. 5 представлена блок-схема пристрою, на Фіг. 6 - схема опромінення рідини, а в Таблиці 1 наведені результати вірусологічних досліджень. Схема пристрою (див. Фіг. 5) містить: Блок 1 - блок опромінювачів ультрафіолетового й червоного світла; Блок 2 - разові системи для відбору й зберігання донорської крові та її компонентів, які з'єднані з кюветою опромінення силіконовою трубкою, що забезпечує як разове, так і багаторазове протікання суміші через зону опромінення; Блок 3 - перистальтичний насос, який забезпечує перепад тиску на вході та виході з кювети кварцової трубки, та створює рівномірний і ламінарний потік плазми крові в кюветі зі швидкістю в інтервалі 0,220мл/с, а термін опромінення - від 30 секунд до 40 хвилин. На схемі опромінення суміші (див. Фіг. 6) зображені: позиція 1 - корпус пристрою, де знаходяться блоки живлення ламп; позиція 2 - порожнистий циліндр, в якому розміщуються лампи й кварцова трубка; позиція 3 - лампа ДРБ-8 (джерело ультрафіолетового випромінювання з довжиною хвилі переважно 254нм); позиція 4 - лампа з неоном (джерело випромінювання червоного світла в області 650-700нм). Поміж цих джерел знаходиться кювета у вигляді кварцової трубки діаметром 5-7мм, в якій опромінюється суміш (позиція 5). До одного кінця кювети приєднана разова система для відбору крові та її компонентів (позиція 6), а до другого - ємність для зберігання опроміненої рідини з повітряним клапаном (позиція 7). Для багаторазового опромінення суміші другий кінець кювети з'єднують з ємністю 7 за допомогою силіконової трубки - позиція 8, частина якої вставляється в перистальтичний насос. (Блок 3, Фіг. 5). Пристрій працює таким чином. В ємність наливають контаміновану вірусами плазму донорської крові, додають фенотіазиновий барвник фотосенсибілізатор (наприклад, МС) і витримують в темноті від 1 до 2 годин. Потім вставляють в ємність голку одноразового пристрою для відбору крові 6, підпалюють розряд у ртутній або неоновій лампах і включають перистальтичний насос (див. Фіг. 6). Рідина надходить у кварцову трубку й опромінюється від кожної лампи окремо або разом із визначеною дозою. Після цього рідина збирається в накопичувальній ємності 7, а для досягнення однакової з УФ-областю дози опромінення червоним світлом рідина прокачується через зону опромінення декілька разів. Доза опромінення залежить від конструкції пристрою, часу або швидкості протікання суміші через зону опромінення. При цьому важливо забезпечити ламінарний потік рідини для рівномірного її опромінення по перерізу трубки 5. Цей режим протікання суміші необхідний для розрахунку однакового дозового навантаження опроміненої суміші в двох спектральних областях. Дозу опромінення розраховували за формулою: D=EпадxSxTопр=EпадxSxVодинx(Vповн/Vодин-1)/vпр, де Епад - енергетична освітленість у місці протікання рідини, Вт/см2; S - площа внутрішньої поверхні кварцевої трубки, см2; Топр - загальний час опромінення рідини, секунди або хвилини; Vодин - одноразовий об'єм рідини, що опромінюється, мл; Vповн - повний об'єм рідини, що опромінюється, мл; vпр - швидкість прокачування рідини в кварцовій трубці, мл/с. Із формули видно, що при незмінних енергетичній освітленості й площі опромінення, які задаються конструкцією пристрою, однакову дозу опромінення повного об'єму біологічної рідини в двох спектральних областях можна досягти при одній швидкості потоку рідини в кварцовій трубці шляхом її циркуляції декілька разів або змінюючи швидкість прокачки рідини через зону опромінення. У Таблиці 1 наведені значення доз опромінення біологічних рідин у проточному режимі, при яких спостерігається повна інактивація оболонкових та безоболонкових вірусів. Таблиця 1. Результати вірусологічних досліджень Назва вірусів Доза УФопромінення, Дж Вірус поліомієліту (ВП) Вірус везикулярного 75 60 Доза опромінення червоним світлом, Дж 75 60 Доза опромінення двома лампами, Дж 50 40 Ступінь інактивації вірусів 100% 100% стоматиту (ВВС) Вірус без оболонки: ВП. Вірус з ліпідною оболонкою: ВВС. Було встановлено, що безоболонковий вірус поліомієліту, що не піддається знезараженню хімічним методом, повністю (в межах похибки застосованого методу визначення) інактивується за допомогою описаного фотодинамічного способу знезараження при дозі опромінення 75Дж, а оболонковий вірус везикулярного стоматиту інактивується при дозі опромінення 60Дж. Таким чином, спосіб, який пропонується, можна здійснити простими технічними засобами, і тому він може легко інтегруватись у технологічний процес виробництва біопрепаратів із плазми донорської крові, тим самим забезпечується більш повна її переробка.
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod and device for photodynamic inactivation of viruses in biologic fluid
Автори англійськоюBondar Volodymyr Vasyliovych, Rybka Volodymyr Mykolaiovych, Serhutina Svitlana Yuriivna, Stepaniuk Svitlana Volodymyrivna
Назва патенту російськоюСпособ и устройство для фотодинамической инактивации вирусов в биологических жидкостях
Автори російськоюБондар Владимир Васильевич, Рыбка Владимир Николаевич, Сергутина Светлана Юрьевна, Степанюк Светлана Владимировна
МПК / Мітки
МПК: A61N 5/06
Мітки: вірусів, спосіб, інактивації, рідинах, фотодинамічної, пристрій, біологічних
Код посилання
<a href="https://ua.patents.su/5-82786-sposib-i-pristrijj-dlya-fotodinamichno-inaktivaci-virusiv-u-biologichnikh-ridinakh.html" target="_blank" rel="follow" title="База патентів України">Спосіб і пристрій для фотодинамічної інактивації вірусів у біологічних рідинах</a>
Попередній патент: 7(6)-трифторометокси-3-метил-2н-1,2,4-бензотіадіазин-1,1-діоксид
Наступний патент: Застосування фармацевтичної композиції для лікування хронічного отодектозу
Випадковий патент: Спосіб радіозв'язку