2,3-дигідробензо[1,4]діоксин-2-ілметилові похідні як альфа2c антагоністи для застосування в лікуванні захворювань периферичної й центральної нервової системи
Номер патенту: 100695
Опубліковано: 25.01.2013
Автори: Вольфарт Герд, Толванен Арто, Карльялайнен Арто, Дін Белл Девід, Руммакко Петтері, Хольм Патрік
Формула / Реферат
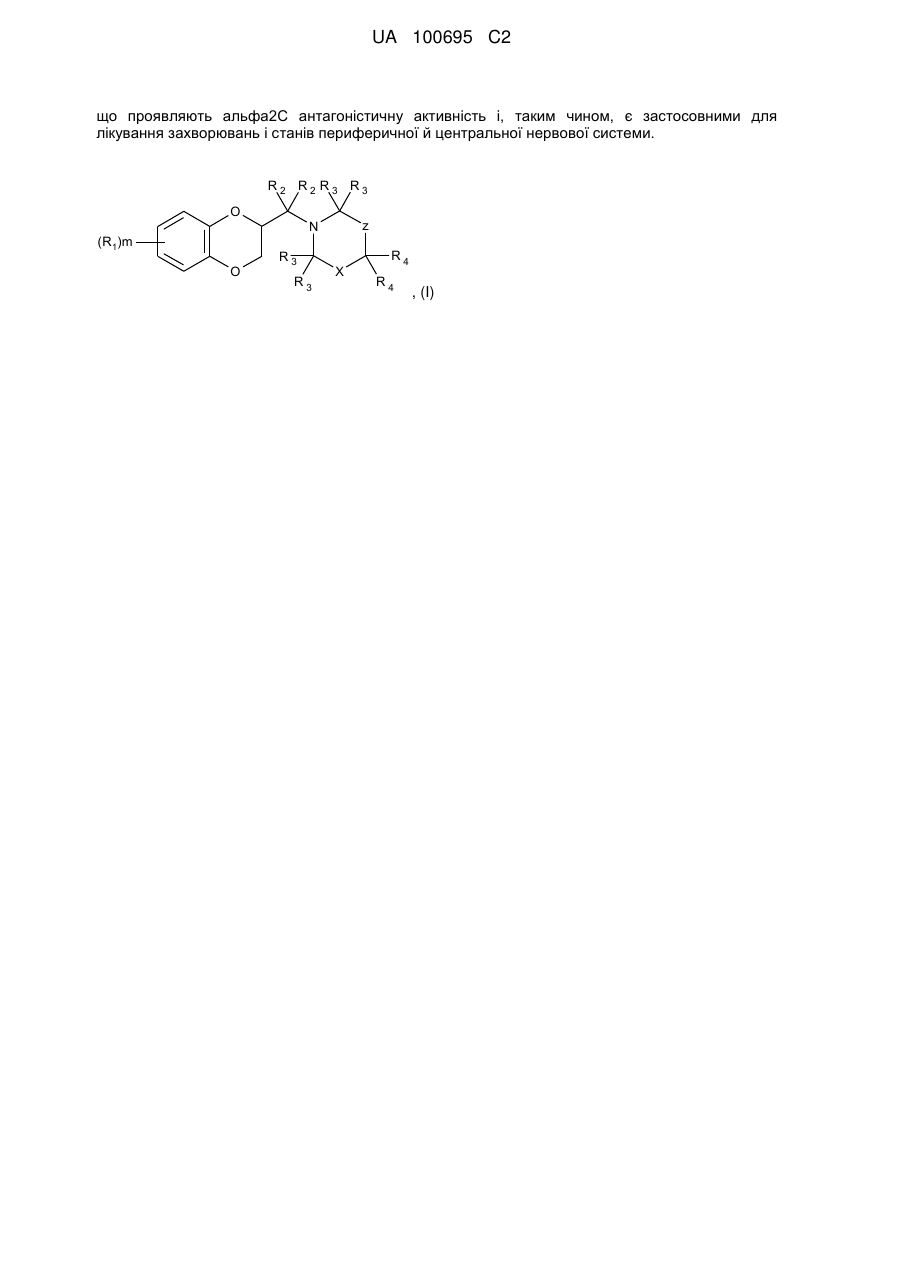
1. Сполука формули I
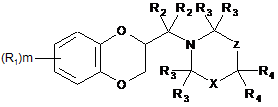 , I
, I
де
X являє собою C(R5)(R6) або C(R7)(R8);
Z являє собою -[C(R4)2]n- або одинарний зв'язок;
R1 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, галоген, галоген(C1-C6)алкіл, феніл(C1-C6)алкокси, (C1-C6)алкокси-(C=O)-, CN, NO2, NH2, моно- або ді(C1-C6)алкіламіно або карбокси;
R2 являє собою, незалежно в кожному випадку, H;
R3 являє собою, незалежно в кожному випадку, H;
R4 являє собою, незалежно в кожному випадку, H, гідрокси, (C1-C6)алкіл;
R5 являє собою H або гідрокси;
або R4 і R5 утворюють зв'язок між атомами вуглецю кільця, до яких вони приєднані;
R6 являє собою феніл, незаміщений або заміщений 1 або 2 замісником(ами) R9;
R7 являє собою H, (C1-C6)алкіл, гідроксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл або (C1-C6)алкокси-(C=O)-;
або R4 і R7 утворюють зв'язок між атомами вуглецю кільця, до яких вони приєднані;
R8 являє собою гідрокси, (C1-C6)алкіл, (C2-C6)алкеніл, (C1-C6)алкокси, галоген, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C1-C6)алкокси, галоген(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкіл, (C2-C6)алкенілоксі(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-, (C1-C6)алкокси(C=O)-, (C1-C6)алкоксі(C=O)-(C1-C6)алкіл, (C1-C6)алкіл-S-, (C1-C6)алкіл-(C=O)-O-, (C1-C6)алкіл-(C=O)-O-(C1-C6)алкіл, гідроксі(C=O)-(C1-C6)алкокси, гідроксі(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-S-(C1-C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкіл(C=O)-S-(C1-C6)алкіл, гідроксі(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкоксі(C1-C6)алкіл, галоген(C1-C6)алкоксі(C1-C6)алкіл, CN, (R10)2N-, (R10)2N-(C1-C6)алкіл, (R10)2N-(C=O)-, карбокси, R11-(O=S=O)-, R11-(O=S=O)-O- або (C1-C6)алкоксі(C1-C6)алкокси;
або R4 і R8, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване фенільне кільце, де вказане фенільне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), кожний з яких незалежно являє собою гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл(C=O)- або (C1-C6)алкокси(C=O)-;
або R4 і R8, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване 5- або 6-членне насичене або ненасичене карбоциклічне кільце, де вказане карбоциклічне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), кожний з яких незалежно являє собою гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл(C=O)-, (C1-C6)алкокси(C=O)- або оксо;
R9 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, галоген, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C1-C6)алкокси, галоген(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкіл, (C2-C6)алкенілоксі(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-, (C1-C6)алкокси(C=O)-, (C1-C6)алкоксі(C=O)-(C1-C6)алкіл, (C1-C6)алкіл(C=O)-O-, (C1-C6)алкіл(C=O)-O-(C1-C6)алкіл, гідроксі(C=O)-(C1-C6)алкокси, гідроксі(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкоксі(C1-C6)алкіл, галоген(C1-C6)алкоксі(C1-C6)алкіл, CN, (R10)2N-, (R10)2N-(C1-C6)алкіл, (R10)2N-(C=O)-, карбокси, R11-(O=S=O)- або R11-(O=S=O)-O-;
або R9 і R9, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване 5- або 6-членне ненасичене гетероциклічне кільце, що містить 1 або 2 гетероатом(и), вибраний(і) з O і S, де вказане гетероциклічне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), кожний з яких незалежно являє собою гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл(C=O)- або (C1-C6)алкокси(C=O)-;
R10 являє собою, незалежно в кожному випадку, H;
R11 являє собою, незалежно в кожному випадку, (C1-C6)алкіл або галоген(C1-C6)алкіл;
m дорівнює 0, 1 або 2; і
n дорівнює 1 або 2;
або її фармацевтично прийнятна сіль;
за умови, що сполука не являє собою 1-(6-трет-бутил-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,5-диметилпіперидин, 1-(7-трет-бутил-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,5-диметилпіперидин, 1-[1-(7-трет-бутил-2,3-дигідробензо[1,4]діоксин-2-іл)етил]-3,5-диметилпіперидин, 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,5-диметилпіперидин, 1-(7-трет-бутил-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,3-диметилпіперидин, 1-(6-трет-бутил-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,3-диметилпіперидин, 1-(7-трет-бутил-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин, 1-(6-трет-бутил-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин, метиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-карбонової кислоти, метиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,5,6-тетрагідропіридин-3-карбонової кислоти, метиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-4-гідрокси-1,2,5,6-тетрагідропіридин-3-карбонової кислоти, 2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-6,7-диметокси-1,2,3,4-тетрагідроізохінолін, 2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,3,4-тетрагідроізохінолін або 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил-3-(3-трифторметилфеніл)піролідин.
2. Сполука за п. 1, де Z являє собою -[C(R4)2]n-, і n дорівнює 1.
3. Сполука за будь-яким з пп. 1 або 2, де R2 являє собою H, і R3 являє собою H.
4. Сполука за будь-яким з пп. 1-3, де R4 являє собою, незалежно в кожному випадку, H, гідрокси або (C1-C6)алкіл.
5. Сполука за будь-яким з пп. 1-4, де m дорівнює 0.
6. Сполука за будь-яким з пп. 1-4, де m дорівнює 1 і R1 являє собою гідрокси, (C1-C6)алкіл або галоген.
7. Сполука за будь-яким з пп. 1-6, де X являє собою C(R5)(R6).
8. Сполука за будь-яким з пп. 1-7, де R5 являє собою H.
9. Сполука за будь-яким з пп. 1-8, де
R6 являє собою феніл, заміщений 1 замісником R9; і
R9 являє собою гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, галоген, гідроксі(C1-C6)алкокси або (R10)2N-.
10. Сполука за будь-яким з пп. 1-6, де X являє собою C(R7)(R8).
11. Сполука за п. 10, де R7 являє собою H або (C1-C6)алкіл.
12. Сполука за будь-яким з пп. 10 або 11, де R8 являє собою гідроксі(C1-C6)алкіл, гідроксі(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкіл або гідроксі(C1-C6)алкоксі(C1-C6)алкіл.
13. Сполука за п. 1, де
X являє собою C(R5)(R6) або C(R7)(R8);
Z являє собою -[C(R4)2]n- або одинарний зв'язок;
R1 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, галоген, феніл(C1-C6)алкокси або NO2;
R2 являє собою, незалежно в кожному випадку, H;
R3 являє собою, незалежно в кожному випадку, H;
R4 являє собою, незалежно в кожному випадку, H, гідрокси або (C1-C6)алкіл;
R5 являє собою H;
або R4 і R5 утворюють зв'язок між атомами вуглецю кільця, до яких вони приєднані;
R6 являє собою феніл, незаміщений або заміщений 1 або 2 замісником(ами) R9;
R7 являє собою H, (C1-C6)алкіл, гідроксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл або (C1-C6)алкокси(C=O)-;
або R4 і R7 утворюють зв'язок між атомами вуглецю кільця, до яких вони приєднані;
R8 являє собою гідрокси, (C1-C6)алкіл, (C2-C6)алкеніл, (C1-C6)алкокси, галоген, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкіл, (C2-C6)алкенілоксі(C1-C6)алкіл, (C1-C6)алкіл(C=O)-, (C1-C6)алкокси(C=O)-, (C1-C6)алкоксі(C=O)-(C1-C6)алкіл, (C1-C6)алкіл(C=O)-O-(C1-C6)алкіл, гідроксі(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкіл(C=O)-S-(C1-C6)алкіл, (C1-C6)алкіл(O=S=O)-O-(C1-C6)алкіл, гідроксі(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкоксі(C1-C6)алкіл, галоген(C1-C6)алкоксі(C1-C6)алкіл, CN, (R10)2N-(C1-C6)алкіл, (R10)2N-(C=O)-, карбокси або (C1-C6)алкоксі(C1-C6)алкокси;
або R4 і R8, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване фенільне кільце, де вказане фенільне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), кожний з яких незалежно являє собою гідроксі(C1-C6)алкіл або (C1-C6)алкокси(C=O)-;
або R4 і R8, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване 6-членне насичене карбоциклічне кільце, де вказане карбоциклічне кільце є незаміщеним;
R9 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, галоген, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C1-C6)алкокси, галоген(C1-C6)алкокси, (C1-C6)алкокси(C=O)-, (C1-C6)алкіл(C=O)-O-, гідроксі(C=O)-(C1-C6)алкокси, CN, (R10)2N-, (R10)2N-(C=O)-, R11-(O=S=O)- або R11-(O=S=O)-O-;
або R9 і R9, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване 5- або 6-членне ненасичене гетероциклічне кільце, що містить 1 або 2 гетероатом(и), вибраний(і) з O, де вказане гетероциклічне кільце є незаміщеним;
R10 являє собою, незалежно в кожному випадку, H,
R11 являє собою, незалежно в кожному випадку, (C1-C6)алкіл або галоген(C1-C6)алкіл;
m дорівнює 0, 1 або 2; і
n дорівнює 1 або 2.
14. Сполука за п. 13,
де
X являє собою C(R5)(R6) або C(R7)(R8);
Z являє собою -[C(R4)2]n-;
R1 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл або галоген;
R2 являє собою, незалежно в кожному випадку, H;
R3 являє собою, незалежно в кожному випадку, H;
R4 являє собою, незалежно в кожному випадку, H;
R5 являє собою H;
R6 являє собою феніл, незаміщений або заміщений 1 або 2 замісником(ами) R9;
R7 являє собою (C1-C6)алкіл;
R8 являє собою гідроксі(C1-C6)алкіл, гідроксі(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкіл або гідроксі(C1-C6)алкоксі(C1-C6)алкіл,
R9 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, галоген, гідроксі(C1-C6)алкокси або (R10)2N-;
R10 являє собою, незалежно в кожному випадку, H,
m дорівнює 0 або 1;
n дорівнює 1.
15. Сполука за п. 13,
де
X являє собою C(R5)(R6) або C(R7)(R8);
Z являє собою одинарний зв'язок;
R1 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл або галоген;
R2 являє собою, незалежно в кожному випадку, H;
R3 являє собою, незалежно в кожному випадку, H;
R4 являє собою, незалежно в кожному випадку, H;
R5 являє собою H;
R6 являє собою феніл, незаміщений або заміщений 1 або 2 замісником(ами) R9;
R7 являє собою H або (C1-C6)алкіл;
R8 являє собою гідроксі(C1-C6)алкіл, гідроксі(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкіл або гідроксі(C1-C6)алкоксі(C1-C6)алкіл,
R9 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, галоген, гідроксі(C1-C6)алкокси або (R10)2N-;
R10 являє собою, незалежно в кожному випадку, H,
m дорівнює 0 або 1;
n дорівнює 1.
16. Сполука за п. 1, де сполука являє собою
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-5-феніл-1,2,3,6-тетрагідропіридин, 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-фенілпіперидин,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(2-метоксифеніл)піперидин,
3-(4-хлорфеніл)-1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(3-метоксифеніл)піперидин,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-п-толілпіперидин,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(4-метоксифеніл)піперидин,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-o-толілпіперидин,
4-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(3-фторфеніл)піперидин,
3-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол,
2-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол,
(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(2-фторфеніл)піперидин,
(S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(2-фторфеніл)піперидин,
(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3-фторфеніл)піперидин,
(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3-фторфеніл)піперидин∙HCl,
(S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3-фторфеніл)піперидин,
(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(4-фторфеніл)піперидин,
(S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(4-фторфеніл)піперидин,
(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3-трифторметилфеніл)піперидин,
(S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3-трифторметилфеніл)піперидин,
(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(4-трифторметилфеніл)піперидин,
(S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(4-трифторметилфеніл)піперидин,
(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3-метоксифеніл)піперидин,
(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3-метоксифеніл)піперидин∙HCl,
(S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3-метоксифеніл)піперидин,
(R*)-3-{1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}фенол,
(R*)-3-{1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}фенол∙HCl,
(3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}феніл)метанол,
3-{(S)-1-[(R*)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}феніловий ефір оцтової кислоти∙HCl,
2-(3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}феноксі)етанол,
3-(3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}фенокси)пропан-1-ол,
3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}феніловий ефір трифторметансульфонової кислоти,
(3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}феноксі)оцтову кислоту,
3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}бензонітрил,
3-бензо[1,3]діоксол-5-іл-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин,
3-[(R*)-1-((S)-6-бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол,
(S)-2-[(R*)-3-(3-гідроксифеніл)піперидин-1-ілметил]-2,3-дигідробензо[1,4]діоксин-6-ол,
3-[(R*)-1-((S)-7-бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол,
(S)-3-[(R*)-3-(3-гідроксифеніл)піперидин-1-ілметил]-2,3-дигідробензо[1,4]діоксин-6-ол,
3-[(R*)-1-((S)-8-бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол,
(S)-3-[(R*)-3-(3-гідроксифеніл)піперидин-1-ілметил]-2,3-дигідробензо[1,4]діоксин-5-ол,
(R*)-3-[1-((S)-7-фтор-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-5-метил-1,2,3,6-тетрагідропіридин,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,5-диметил-1,2,3,6-тетрагідропіридин,
[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,5,6-тетрагідропіридин-3-іл]метанол,
2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,3,4,5,6,7,8-октагідроізохінолін,
2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)декагідроізохінолін,
етиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-карбонової кислоти,
[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]метанол,
етиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-карбонової кислоти,
етиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин-3-карбонової кислоти,
[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-іл]метанол,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метоксиметил-3-метилпіперидин,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етоксиметил-3-метилпіперидин,
3-хлорметил-1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин,
2-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-іл]пропан-2-ол,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(1-метокси-1-метилетил)-3-метилпіперидин,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-гідроксиметил-3-метилпіперидин-4-ол,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-ілметиловий ефір оцтової кислоти,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-ілметиловий ефір метансульфонової кислоти,
[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин-3-іл]метанол,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етил-3-метоксиметилпіперидин,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метоксиметоксиметил-3-метилпіперидин,
1-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин-3-іл]етанон,
1-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин-3-іл]етанол,
3-алілоксиметил-1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин,
2-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин-3-ілметоксі]етанол,
3-алілоксиметил-1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин,
етиловий ефір 3-аліл-1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-карбонової кислоти,
[3-аліл-1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]метанол,
3-аліл-1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метоксиметилпіперидин,
3-аліл-1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етоксиметилпіперидин,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метил-3-(2,2,2-трифторетоксиметил)піперидин,
2-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-ілметоксі]етанол,
етиловий ефір [1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]оцтової кислоти,
2-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]етанол,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(2-метоксіетил)піперидин,
амід 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-карбонової кислоти,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-карбонітрил,
C-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]метиламін,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-ол,
метиловий ефір 2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,3,4-тетрагідроізохінолін-8-карбонової кислоти,
[2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,3,4-тетрагідроізохінолін-8-іл]метанол,
етиловий ефір (S)-1-((R)-2,3-дигідробензо[1,4]діоксин-2-карбоніл)-3-метилпіперидин-3-карбонової кислоти,
(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3-карбоксилат літію,
{(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3-іл}метанол,
2-{(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3-ілметоксі}етанол,
D-тартрат 2-{(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3-ілметоксі}етанолу,
(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(2-метоксіетоксиметил)-3-метилпіперидин,
(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метил-3-(2,2,2-трифторетоксиметил)піперидин,
(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3-ілметиловий ефір метансульфонової кислоти,
S-{(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3-ілметил}овий ефір тіооцтової кислоти,
2-{(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3-ілметилсульфаніл}етанол,
трет-бутиловий ефір {(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3-ілметоксі}оцтової кислоти,
{(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3-ілметоксі}ацетат натрію,
2-[(S)-1-((S)-7-фтор-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-ілметоксі]етанол,
етиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-фторпіперидин-3-карбонової кислоти,
[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-фторпіперидин-3-іл]метанол,
етиловий ефір (S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3-карбонової кислоти,
[(S)-1-((S)-7-фтор-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-іл]метанол,
(S)-1-((S)-7-фтор-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метоксиметил-3-метилпіперидин,
(S)-1-((S)-7-фтор-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метоксиметил-3-метилпіперидин∙HCl,
(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метоксиметил-3-метилпіперидин,
3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}фенілaмін,
оксалат (R*)-3-{1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}фенолу,
(S)-2-[(R*)-3-(3-гідроксифеніл)піперидин-1-ілметил]-2,3-дигідробензо[1,4]діоксин-5-ол,
1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(2-метоксифеніл)піролідин,
(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(2-фторетоксиметил)-3-метилпіперидин∙HCl,
(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3-фторметоксифеніл)піперидин,
метиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піролідин-3-карбонової кислоти,
[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піролідин-3-іл]метанол,
2-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піролідин-3-ілметоксі]етанол,
метиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіролідин-3-карбонової кислоти,
[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіролідин-3-іл]метанол,
2-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіролідин-3-ілметоксі]етанол,
1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метоксиметил-3-метилпіролідин або
3-[(R)-1-((S)-7-нітро-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол.
17. Застосування сполуки за будь-яким з пп. 1-16 як лікарського засобу.
Текст
Реферат: Сполуки формули І R2 R2 R3 R3 O (R1)m O z N R3 R3 X R4 R4 , (I) де X, Z, R1-R4 і m мають значення, визначені у формулі винаходу, UA 100695 C2 (12) UA 100695 C2 що проявляють альфа2С антагоністичну активність і, таким чином, є застосовними для лікування захворювань і станів периферичної й центральної нервової системи. R2 R2 R3 R3 O (R1)m O z N R3 R3 X R4 R4 , (I) UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Даний винахід належить до фармакологічно активних 3-заміщених 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)азациклів або їх фармацевтично прийнятних солей і складних ефірів, а також до фармацевтичних композицій, що містять їх, і їх застосування як антагоністів альфа2С. Передумови для створення винаходу Широко відомим і загальноприйнятим у даній галузі техніки є те, що сполуки, які проявляють альфа-адренергічну активність, можуть бути використані для лікування широкої розмаїтості захворювань і станів периферичної нервової системи й центральної нервової системи (ЦНС). На підставі фармакологічного принципу альфа-адренергічні рецептори можуть бути розділені на альфа1 і альфа2 адренорецептори, кожний з яких додатково може бути розділений на підтипи. У людини були виявлені три генетично кодованих підтипи, а саме, альфа2A, альфа2B і альфа2C адренорецептори. Четвертий фармакологічно визначений підтип, а саме, альфа2D адренорецептор, відомий у деяких інших ссавців і гризунів, він відповідає генетично визначеному альфа2A адренорецептору. Підтипи адренорецептора альфа2 мають різний розподіл у тканинах і функціональні ролі. Наприклад, у той час як альфа2A адренорецептори широко представлені в різних тканинах, альфа2C адренорецептори концентруються в ЦНС і, мабуть, відіграють роль у модуляції специфічних ЦНС-опосередкованих поведінкових і фізіологічних відповідей. У даній галузі техніки відомі деякі сполуки, які є неспецифічними для будь-яких з вищезгаданих підтипів альфа2, і деякі сполуки, які є специфічними для певних підтипів альфа2. Наприклад, атипамезол, розкритий в EP 183492 A1 (сполука XV на сторінці 13) являє собою неспецифічний альфа2 антагоніст. Сполуки, які являють собою селективні антагоністи для підтипу альфа2C і є прийнятними для лікування психічного розладу, наприклад, розладу вищої нервової діяльності, викликаного стресом, розкриті в US 5902807. Такими сполуками є, наприклад, МK-912 і BAМ-1303. Похідні імідазолу, які мають агоністичну активність до альфа2B або 2B/2C адренорецепторів, розкриті в WO 99/28300. Похідні хіноліну, що підходять як альфа2 антагоністи, розкриті в WO 01/64645 і WO 2004/067513. Похідні арилхінолізину, що підходять як альфа2 антагоністи, розкриті в WO 03/082866. З метою можливості зменшення ризику несприятливих явищ під час лікування буде бажаною збільшена селективність альфа2 антагоністів. Наприклад, використання неселективних альфа2 антагоністів характеризується побічними ефектами, такими як підвищення артеріального тиску, частоти серцевих скорочень, секреції слини, шлунковокишкової секреції й тривога. Також буде бажаною збільшена активність альфа2C антагоністів з метою можливості зниження необхідної дози. Як відомо, 3-заміщені 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)азацикли, 1-(6-трет-бутил2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,5-диметилпіперидин, 1-(7-трет-бутил-2,3дигідробензо[1,4]діоксин-2-ілметил)-3,5-диметилпіперидин, 1-[1-(7-трет-бутил-2,3дигідробензо[1,4]діоксин-2-іл)етил]-3,5-диметилпіперидин, 1-(2,3-дигідробензо[1,4]діоксин-2ілметил)-3,5-диметилпіперидин, 1-(7-трет-бутил-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,3диметилпіперидин, 1-(6-трет-бутил-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,3диметилпіперидин, 1-(7-трет-бутил-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин, 1-(6-трет-бутил-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин і 1-[1-(6-трет-бутил2,3-дигідробензо[1,4]діоксин-2-іл)етил]-3,5-диметилпіперидин розкриті в WO 90/02122. Метиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-карбонової кислоти, метиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-4-оксопіперидин-3-карбонової кислоти, метиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,5,6-тетрагідропіридин-3карбонової кислоти і метиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-4-гідрокси1,2,5,6-тетрагідропіридин-3-карбонової кислоти розкриті в US 4957928. 2-(2,3дигідробензо[1,4]діоксин-2-ілметил)-6,7-диметокси-1-метил-1,2,3,4-тетрагідроізохінолін і 2-(2,3дигідробензо[1,4]діоксин-2-ілметил)-6,7-диметокси-1,2,3,4-тетрагідроізохінолін розкриті в DD 250930 A1. 2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,3,4-тетрагідроізохінолін раскрит в J. Org. Chem., 26 (1961) 339. 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил-3-(3трифторметилфеніл)піролідин розкритий в US 3644414. Короткий виклад суті винаходу Метою даного винаходу є надання додаткових альфа2C антагоністів, які можуть бути використані для лікування захворювань або станів периферичної або центральної нервової системи, де альфа2С антагоністи показані як корисні. Відповідно, метою даного винаходу є надання додаткових сполук, використовуваних як альфа2С антагоністи при лікуванні ссавців. Крім того, надаються фармацевтичні композиції, що містять сполуки за даним винаходом. 1 UA 100695 C2 Альфа2 антагоністи за даним винаходом мають поліпшену селективність до альфа2С підтипу адренорецепторів і/або збільшену активність. Докладний опис винаходу Даний винахід належить до нових альфа2C антагоністів, що мають загальну формулу I, R2 R2 R3 R3 O (R1)m O 5 10 15 20 25 30 35 40 45 50 z N R3 R3 X R4 R4 , (I), де X являє собою C(R5)(R6) або C(R7)(R8); Z являє собою -[C(R4)2]n- або одинарний зв'язок; R1 являє собою, незалежно в кожному випадку, гідрокси, (C 1-C6)алкіл, (C1-C6)алкокси, галоген, галоген(C1-C6)алкіл, феніл(C1-C6)алкокси, (C1-C6)алкокси-(C=O)-, CN, NO2, NH2, моноабо ді(C1-C6)алкіламіно або карбокси; R2 являє собою, незалежно в кожному випадку, H або (C1-C6)алкіл; R3 являє собою, незалежно в кожному випадку, H або (C1-C6)алкіл; R4 являє собою, незалежно в кожному випадку, H, гідрокси, (C 1-C6)алкіл, (C2-C6)алкеніл, гідроксі(C1-C6)алкіл, гідроксі(C2-C6)алкеніл, (C1-C6)алкоксі(C1-C6)алкіл, (C2-C6)алкенілоксі(C1C6)алкіл, (C1-C6)алкіл-(C=O)-, (C1-C6)алкокси-(C=O)-, гідроксі(C1-C6)алкоксі(C1-C6)алкіл або (C1C6)алкоксі(C1-C6)алкоксі(C1-C6)алкіл; або R4 і R4, обидва приєднані до того самого атома вуглецю кільця, утворюють разом з атомом вуглецю кільця, до якого вони приєднані, -(C=O)-групу; R5 являє собою H або гідрокси; або R4 і R5, приєднані до сусідніх атомів вуглецю кільця, утворюють зв'язок між атомами вуглецю кільця, до яких вони приєднані; R6 являє собою феніл, незаміщений або заміщений 1 або 2 замісником(ами) R9; R7 являє собою H, (C1-C6)алкіл, гідроксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл або (C1C6)алкокси-(C=O)-; або R4 і R7, приєднані до сусідніх атомів вуглецю кільця, утворюють зв'язок між атомами вуглецю кільця, до яких вони приєднані; R8 являє собою гідрокси, (C1-C6)алкіл, (C2-C6)алкеніл, (C1-C6)алкокси, галоген, гідроксі(C1C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C2-C6)алкеніл, гідроксі(C1-C6)алкокси, галоген(C1C6)алкокси, феніл(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкіл, (C2-C6)алкенілоксі(C1-C6)алкіл, (C1C6)алкіл-(C=O)-, (C1-C6)алкокси-(C=O)-, (C1-C6)алкоксі-(C=O)-(C1-C6)алкіл, (C1-C6)алкіл-S-, (C1C6)алкіл-(C=O)-O-, (C1-C6)алкіл-(C=O)-O-(C1-C6)алкіл, гідроксі-(C=O)-(C1-C6)алкокси, гідроксі(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі-(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-S(C1-C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1C6)алкіл-(C=O)-S-(C1-C6)алкіл, (C1-C6)алкоксі-(C=O)-(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкіл-S(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1C6)алкіл-S-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)-(C1-C6)алкіл, гідроксі(C1-C6)алкіл(O=S=O)-(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл-(O=S=O)-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл-(O=S=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1C6)алкоксі(C1-C6)алкіл-(O=S=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-O-(O=S=O)-(C1-C6)алкіл, гідроксі(C1-C6)алкіл-O-(O=S=O)-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)-O-(C1-C6)алкіл, гідроксі(C1C6)алкіл-(O=S=O)-O-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)-N(R10)-(C1-C6)алкіл, гідроксі(C1C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкоксі(C1-C6)алкіл, галоген(C1-C6)алкоксі(C1C6)алкіл, CN, NO2, (R10)2N-, (R10)2N-(C1-C6)алкіл, (R10)2N-(C=O)-, (R10)2N-(C=O)-(C1-C6)алкоксі(C1C6)алкіл, (R10)2N-(C=O)-(C1-C6)алкіл-S-(C1-C6)алкіл, (R10)2N-(C=O)-(C1-C6)алкіл-(O=S=O)-(C1C6)алкіл, карбокси, R11-(O=S=O)-, R11-(O=S=O)-O- або (C1-C6)алкоксі-(C1-C6)алкокси; або R4 і R8, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване фенільне кільце, де вказане фенільне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), причому кожний незалежно являє собою гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, (C1C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-(C=O)- або (C1-C6)алкокси-(C=O)-; або R4 і R8, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване 5 або 6-членне насичене або ненасичене карбоциклічне кільце або конденсоване 5 або 6-членне насичене або ненасичене 2 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 гетероциклічне кільце, що містить один або два гетератом(и), вибраних з N, O і S, де вказане карбоциклічне або гетероциклічне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), причому кожний незалежно являє собою гідрокси, (C 1-C6)алкіл, (C1-C6)алкокси, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-, (C1C6)алкокси-(C=O)- або оксо; або R7 і R8 утворюють разом з атомом вуглецю кільця, до якого вони приєднані, 5 або 6членне насичене карбоциклічне кільце або 5 або 6-членне насичене гетероциклічне кільце, що містить 1 або 2 гетероатом(и), вибраних з N, O і S, де вказане карбоциклічне або гетероциклічне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), причому кожний незалежно являє собою гідрокси, (C1-C6)алкіл або оксо; R9 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл, (C2-C6)алкеніл, (C1C6)алкокси, галоген, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C2-C6)алкеніл, гідроксі(C1C6)алкокси, галоген(C1-C6)алкокси, феніл(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкіл, (C2C6)алкенілоксі(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-, (C1-C6)алкокси-(C=O)-, (C1-C6)алкоксі-(C=O)-(C1C6)алкіл, (C1-C6)алкіл-S-, (C1-C6)алкіл-(C=O)-O-, (C1-C6)алкіл-(C=O)-O-(C1-C6)алкіл, гідроксі(C=O)-(C1-C6)алкокси, гідроксі-(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі-(C=O)-(C1C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-S-(C1-C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1C6)алкоксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-S-(C1-C6)алкіл, (C1-C6)алкоксі-(C=O)(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкіл-S-(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл-S-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл(O=S=O)-(C1-C6)алкіл, гідроксі(C1-C6)алкіл-(O=S=O)-(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл(O=S=O)-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)-(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл(O=S=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл-(O=S=O)-(C1-C6)алкоксі(C1C6)алкіл, (C1-C6)алкіл-O-(O=S=O)-(C1-C6)алкіл, гідроксі(C1-C6)алкіл-O-(O=S=O)-(C1-C6)алкіл, (C1C6)алкіл-(O=S=O)-O-(C1-C6)алкіл, гідроксі(C1-C6)алкіл-(O=S=O)-O-(C1-C6)алкіл, (C1-C6)алкіл(O=S=O)-N(R10)-(C1-C6)алкіл, гідроксі(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкоксі(C1C6)алкіл, галоген(C1-C6)алкоксі(C1-C6)алкіл, CN, NO2, (R10)2N-, (R10)2N-(C1-C6)алкіл, (R10)2N-(C=O)-, (R10)2N-(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (R10)2N-(C=O)-(C1-C6)алкіл-S-(C1C6)алкіл, (R10)2N-(C=O)-(C1-C6)алкіл-(O=S=O)-(C1-C6)алкіл, карбокси, R11-(O=S=O)- або R11(O=S=O)-O-; або R9 і R9, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване фенільне кільце, конденсоване 5 або 6членне ненасичене карбоциклічне кільце або конденсоване 5 або 6-членне ненасичене гетероциклічне кільце, що містить 1 або 2 гетероатом(и), вибраних з O і S, де вказане фенільне, карбоциклічне або гетероциклічне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), причому кожний незалежно являє собою гідрокси, (C 1-C6)алкіл, (C1-C6)алкокси, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-(C=O)- або (C1C6)алкокси-(C=O)-; R10 являє собою, незалежно в кожному випадку, H, (C1-C6)алкіл, гідроксі(C1-C6)алкіл, (C1C6)алкіл-(C=O)- або R11-(O=S=O)-; R11 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, галоген(C1-C6)алкіл або моно- або ді(C1-C6)алкіламіно; m дорівнює 0, 1 або 2; і n дорівнює 1 або 2; або їх фармацевтично прийнятної солі або складного ефіру; за умови, що дана сполука не являє собою 1-(6-трет-бутил-2,3-дигідробензо[1,4]діоксин-2ілметил)-3,5-диметилпіперидин, 1-(7-трет-бутил-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,5диметилпіперидин, 1-[1-(7-трет-бутил-2,3-дигідробензо[1,4]діоксин-2-іл)етил]-3,5диметилпіперидин, 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,5-диметилпіперидин, 1-(7-третбутил-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,3-диметилпіперидин, 1-(6-трет-бутил-2,3дигідробензо[1,4]діоксин-2-ілметил)-3,3-диметилпіперидин, 1-(7-трет-бутил-2,3дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин, 1-(6-трет-бутил-2,3дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин, 1-[1-(6-трет-бутил-2,3дигідробензо[1,4]діоксин-2-іл)етил]-3,5-диметилпіперидин, метиловий ефір 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-карбонової кислоти, метиловий ефір 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-4-оксопіперидин-3-карбонової кислоти, метиловий ефір 1(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,5,6-тетрагідропіридин-3-карбонової кислоти, метиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-4-гідрокси-1,2,5,6-тетрагідропіридин3-карбонової кислоти, 2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-6,7-диметокси-1-метил-1,2,3,4тетрагідроізохінолін, 2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-6,7-диметокси-1,2,3,4 3 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 тетрагідроізохінолін, 2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,3,4-тетрагідроізохінолін або 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил-3-(3-трифторметилфеніл)піролідин. У можливій підгрупі сполук формули I Z являє собою -[C(R4)2]n-. У додатково можливій підгрупі сполук формули I n дорівнює 1. В іншій можливій підгрупі сполук формули I n дорівнює 2. У додатково можливій підгрупі сполук формули I Z являє собою одинарний зв'язок. У додатково можливій підгрупі сполук формули I R2 являє собою H. У додатково можливій підгрупі сполук формули I R3 являє собою H. У додатково можливій підгрупі сполук формули I R4 являє собою, незалежно в кожному випадку, H, (C1-C6)алкіл, (C2-C6)алкеніл, гідроксі(C2-C6)алкеніл, (C1-C6)алкоксі(C1-C6)алкіл, (C2C6)алкенілоксі(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-, (C1-C6)алкокси-(C=O)-, гідроксі(C1-C6)алкоксі(C1C6)алкіл або (C1-C6)алкоксі(C1-C6)алкоксі(C1-C6)алкіл; наприклад, H. В іншій можливій підгрупі сполук формули I R 4 являє собою, незалежно в кожному випадку, H, гідрокси або (C1-C6)алкіл; наприклад, H. У додатково можливій підгрупі сполук формули I m дорівнює 0. У додатково можливій підгрупі сполук формули I m дорівнює 1. У додатково можливій підгрупі сполук формули I R 1 являє собою, незалежно в кожному випадку, гідрокси, феніл(C1-C6)алкокси, (C1-C6)алкокси-(C=O)-, CN, NO2, NH2, моно- або ді(C1C6)алкіламіно або карбокси. У додатково можливій підгрупі сполук формули I R 1 являє собою, незалежно в кожному випадку, гідрокси, галоген, феніл(C1-C6)алкокси або NO2. В іншій можливій підгрупі сполук формули I R 1 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл, (C1-C6)алкокси або галоген; наприклад, гідрокси або галоген. У додатково можливій підгрупі сполук формули I X являє собою C(R 5)(R6). У додатково можливій підгрупі сполук формули I R5 являє собою H. В іншій можливій підгрупі сполук формули I R5 являє собою гідрокси. В іншій можливій підгрупі сполук формули I R4 і R5, приєднані до сусідніх атомів вуглецю кільця, утворюють зв'язок між атомами вуглецю кільця, до яких вони приєднані. У додатково можливій підгрупі сполук формули I R6 являє собою незаміщений феніл. В іншій можливій підгрупі сполук формули I R6 являє собою феніл, заміщений 1 або 2 замісником(ами) R9; R9 являє собою, незалежно в кожному випадку, гідрокси, (C 2-C6)алкеніл, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C2-C6)алкеніл, гідроксі(C1-C6)алкокси, галоген(C1-C6)алкокси, феніл(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкіл, (C2-C6)алкенілоксі(C1-C6)алкіл, (C1-C6)алкіл(C=O)-, (C1-C6)алкокси-(C=O)-, (C1-C6)алкоксі-(C=O)-(C1-C6)алкіл, (C1-C6)алкіл-S-, (C1-C6)алкіл(C=O)-O-, (C1-C6)алкіл-(C=O)-O-(C1-C6)алкіл, гідроксі-(C=O)-(C1-C6)алкокси, гідроксі-(C=O)-(C1C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі-(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-S-(C1C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1C6)алкіл-(C=O)-S-(C1-C6)алкіл, (C1-C6)алкоксі-(C=O)-(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкіл-S(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1C6)алкіл-S-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)-(C1-C6)алкіл, гідроксі(C1-C6)алкіл(O=S=O)-(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл-(O=S=O)-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл-(O=S=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1C6)алкоксі(C1-C6)алкіл-(O=S=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-O-(O=S=O)-(C1-C6)алкіл, гідроксі(C1-C6)алкіл-O-(O=S=O)-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)-O-(C1-C6)алкіл, гідроксі(C1C6)алкіл-(O=S=O)-O-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)-N(R10)-(C1-C6)алкіл, гідроксі(C1C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкоксі(C1-C6)алкіл, галоген(C1-C6)алкоксі(C1C6)алкіл, CN, NO2, (R10)2N-, (R10)2N-(C1-C6)алкіл, (R10)2N-(C=O)-, (R10)2N-(C=O)-(C1-C6)алкоксі(C1C6)алкіл, (R10)2N-(C=O)-(C1-C6)алкіл-S-(C1-C6)алкіл, (R10)2N-(C=O)-(C1-C6)алкіл-(O=S=O)-(C1C6)алкіл, карбокси, R11-(O=S=O)- або R11-(O=S=O)-O-; або R9 і R9, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване фенільне кільце, конденсоване 5 або 6членне ненасичене карбоциклічне кільце або конденсоване 5 або 6-членне ненасичене гетероциклічне кільце, що містить 1 або 2 гетератом(и), вибраних з O і S, де вказане фенільне, карбоциклічне або гетероциклічне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), причому кожний незалежно являє собою гідрокси, (C 1-C6)алкіл, (C1-C6)алкокси, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-(C=O)- або (C1C6)алкокси-(C=O)-. В іншій можливій підгрупі сполук формули I R6 являє собою феніл, заміщений 1 або 2 замісником(ами) R9; 4 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 R9 являє собою, незалежно в кожному випадку, гідрокси, (C 1-C6)алкіл, (C1-C6)алкокси, галоген, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C1-C6)алкокси, галоген(C1-C6)алкокси, феніл(C1-C6)алкокси, (C1-C6)алкокси-(C=O)-, (C1-C6)алкіл-(C=O)-O-, гідроксі-(C=O)-(C1C6)алкокси, CN, (R10)2N-, (R10)2N-(C=O)-, R11-(O=S=O)- або R11-(O=S=O)-O-; або R9 і R9, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване 5-членне ненасичене гетероциклічне кільце, що містить 2 гетероатоми, вибраних з O, де вказане гетероциклічне кільце є незаміщеним; наприклад, R6 являє собою феніл, заміщений 1 замісником R 9, і R9 являє собою гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, галоген, гідроксі(C1-C6)алкокси або (R10)2N-. В іншій можливій підгрупі сполук формули I X являє собою C(R 7)(R8). У додатково можливій підгрупі сполук формули I R 7 являє собою H, гідроксі(C1-C6)алкіл, (C1C6)алкоксі(C1-C6)алкіл або (C1-C6)алкокси-(C=O)-; наприклад, H. У додатково можливій підгрупі сполук формули I R 7 являє собою (C1-C6)алкіл, гідроксі(C1C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл або (C1-C6)алкокси-(C=O)-; наприклад, (C1-C6)алкіл. В іншій можливій підгрупі сполук формули I R4 і R7,приєднані до сусідніх атомів вуглецю кільця, утворюють зв'язок між атомами вуглецю кільця, до яких вони приєднані. У додатково можливій підгрупі сполук формули I R 8 являє собою (C2-C6)алкеніл, галоген, галоген(C1-C6)алкіл, гідроксі(C2-C6)алкеніл, гідроксі(C1-C6)алкокси, галоген(C1-C6)алкокси, феніл(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкіл, (C2-C6)алкенілоксі(C1-C6)алкіл, (C1-C6)алкіл(C=O)-, (C1-C6)алкоксі-(C=O)-(C1-C6)алкіл, (C1-C6)алкіл-S-, гідроксі-(C=O)-(C1-C6)алкокси, гідроксі(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі-(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-S(C1-C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1C6)алкіл-(C=O)-S-(C1-C6)алкіл, (C1-C6)алкоксі-(C=O)-(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкіл-S(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1C6)алкіл-S-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)-(C1-C6)алкіл, гідроксі(C1-C6)алкіл(O=S=O)-(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл-(O=S=O)-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл-(O=S=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1C6)алкоксі(C1-C6)алкіл-(O=S=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-O-(O=S=O)-(C1-C6)алкіл, гідроксі(C1-C6)алкіл-O-(O=S=O)-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)-O-(C1-C6)алкіл, гідроксі(C1C6)алкіл-(O=S=O)-O-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)-N(R10)-(C1-C6)алкіл, гідроксі(C1C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкоксі(C1-C6)алкіл, галоген(C1-C6)алкоксі(C1C6)алкіл, CN, NO2, (R10)2N-, (R10)2N-(C1-C6)алкіл, (R10)2N-(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (R10)2N(C=O)-(C1-C6)алкіл-S-(C1-C6)алкіл, (R10)2N-(C=O)-(C1-C6)алкіл-(O=S=O)-(C1-C6)алкіл, R11(O=S=O)- або R11-(O=S=O)-O-; наприклад, (C2-C6)алкеніл, галоген, гідроксі(C2-C6)алкеніл, гідроксі(C1-C6)алкокси, галоген(C1-C6)алкокси, (C2-C6)алкенілоксі(C1-C6)алкіл, гідроксі-(C=O)-(C1C6)алкокси, гідроксі-(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі-(C=O)-(C1-C6)алкоксі(C1C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1C6)алкоксі-(C=O)-(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкіл-S-(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл-S-(C1-C6)алкоксі(C1C6)алкіл, гідроксі(C1-C6)алкіл-(O=S=O)-(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл-(O=S=O)-(C1C6)алкіл, (C1-C6)алкіл-(O=S=O)-(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл-(O=S=O)-(C1C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл-(O=S=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1C6)алкіл-O-(O=S=O)-(C1-C6)алкіл, гідроксі(C1-C6)алкіл-O-(O=S=O)-(C1-C6)алкіл, (C1-C6)алкіл(O=S=O)-O-(C1-C6)алкіл, гідроксі(C1-C6)алкіл-(O=S=O)-O-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)N(R10)-(C1-C6)алкіл, гідроксі(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкоксі(C1-C6)алкіл, CN, NO2, (R10)2N-(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (R10)2N-(C=O)-(C1-C6)алкіл-S-(C1-C6)алкіл, (R10)2N-(C=O)-(C1-C6)алкіл-(O=S=O)-(C1-C6)алкіл або R11-(O=S=O)-O . В іншій можливій підгрупі сполук формули I R8 являє собою гідрокси, (C1-C6)алкіл, (C2C6)алкеніл, галоген, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C1-C6)алкокси, (C1C6)алкоксі(C1-C6)алкіл, (C2-C6)алкенілоксі(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-, (C1-C6)алкокси-(C=O), (C1-C6)алкоксі-(C=O)-(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-O-(C1-C6)алкіл, гідроксі-(C=O)-(C1C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі-(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл-S(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-S-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)-O-(C1-C6)алкіл, гідроксі(C1C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкоксі(C1-C6)алкіл, галоген(C1-C6)алкоксі(C1C6)алкіл, CN, (R10)2N-(C1-C6)алкіл, (R10)2N-(C=O)- або карбокси; наприклад, гідрокси, (C2C6)алкеніл, галоген, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C1-C6)алкокси, (C1C6)алкоксі(C1-C6)алкіл, (C2-C6)алкенілоксі(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-, (C1-C6)алкоксі-(C=O)(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-O-(C1-C6)алкіл, гідроксі-(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1C6)алкоксі-(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкіл(C=O)-S-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)-O-(C1-C6)алкіл, гідроксі(C1-C6)алкоксі(C1-C6)алкіл, 5 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 (C1-C6)алкоксі(C1-C6)алкоксі(C1-C6)алкіл, галоген(C1-C6)алкоксі(C1-C6)алкіл, CN, (R10)2N-(C1C6)алкіл, (R10)2N-(C=O)- або карбокси; такі як гідроксі(C1-C6)алкіл, гідроксі(C1-C6)алкокси, (C1C6)алкоксі(C1-C6)алкіл або гідроксі(C1-C6)алкоксі(C1-C6)алкіл. В іншій можливій підгрупі сполук формули I R4 і R8, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване фенільне кільце, де вказане фенільне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), причому кожний незалежно являє собою гідрокси, (C 1-C6)алкіл, (C1-C6)алкокси, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-(C=O)- або (C1C6)алкокси-(C=O)-; наприклад, R4 і R8, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване фенільне кільце, де вказане фенільне кільце є заміщеним 1 замісником, що являє собою гідроксі(C1-C6)алкіл або (C1-C6)алкокси-(C=O)-. В іншій можливій підгрупі сполук формули I R4 і R8, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване 5 або 6-членне насичене або ненасичене карбоциклічне кільце або конденсоване 5 або 6-членне насичене або ненасичене гетероциклічне кільце, що містить 1 або 2 гетератом(и), вибраних з N, O і S, де вказане карбоциклічне або гетероциклічне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), причому кожний незалежно являє собою гідрокси, (C 1-C6)алкіл, (C1C6)алкокси, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл(C=O)-, (C1-C6)алкокси-(C=O)- або оксо. У ще одній можливій підгрупі сполук формули I R4 і R8, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване 6членне насичене карбоциклічне кільце, де вказане карбоциклічне кільце є незаміщеним. У ще одній можливій підгрупі сполук формули I R 4 і R8, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване 5 або 6-членне насичене або ненасичене гетероциклічне кільце, що містить 1 або 2 гетератом(и), вибраних з N, O і S, де вказане гетероциклічне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), причому кожний незалежно являє собою гідрокси, (C 1-C6)алкіл, (C1-C6)алкокси, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-, (C1C6)алкокси-(C=O)- або оксо. В іншій можливій підгрупі сполук формули I R7 і R8 утворюють разом з атомом вуглецю кільця, до якого вони приєднані, 5 або 6-членне насичене карбоциклічне кільце або 5 або 6членне насичене гетероциклічне кільце, що містить 1 або 2 гетероатом(и), вибраних з N, O і S, де вказане карбоциклічне або гетероциклічне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), причому кожний незалежно являє собою гідрокси, (C 1-C6)алкіл або оксо; наприклад, R7 і R8 утворюють разом з атомом вуглецю кільця, до якого вони приєднані, 5 або 6членне насичене гетероциклічне кільце, що містить 1 або 2 гетероатом(и), вибраних з N, O і S, де вказане гетероциклічне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), причому кожний незалежно являє собою гідрокси, (C1-C6)алкіл або оксо. У додатково можливій підгрупі сполук формули I X являє собою C(R 5)(R6) або C(R7)(R8); Z являє собою -[C(R4)2]n- або одинарний зв'язок; R1 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, галоген, феніл(C1-C6)алкокси або NO2; R2 являє собою, незалежно в кожному випадку, H; R3 являє собою, незалежно в кожному випадку, H; R4 являє собою, незалежно в кожному випадку, H, гідрокси або (C 1-C6)алкіл; або R4 і R4, обидва приєднані до того самого атома вуглецю кільця, утворюють разом з атомом вуглецю кільця, до якого вони приєднані, -(C=O)-групу; R5 являє собою H; або R4 і R5, приєднані до сусідніх атомів вуглецю кільця, утворюють зв'язок між атомами вуглецю кільця, до яких вони приєднані; R6 являє собою феніл, незаміщений або заміщений 1 або 2 замісником(ами) R 9; R7 являє собою H, (C1-C6)алкіл, гідроксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкіл або (C1C6)алкокси-(C=O)-; або R4 і R7, приєднані до сусідніх атомів вуглецю кільця, утворюють зв'язок між атомами вуглецю кільця, до яких вони приєднані; R8 являє собою гідрокси, (C1-C6)алкіл, (C2-C6)алкеніл, (C1-C6)алкокси, галоген, гідроксі(C1C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкіл, (C2C6)алкенілоксі(C1-C6)алкіл, (C1-C6)алкіл-(C=O)-, (C1-C6)алкокси-(C=O)-, (C1-C6)алкоксі-(C=O)-(C1C6)алкіл, (C1-C6)алкіл-(C=O)-O-(C1-C6)алкіл, гідроксі-(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, (C1 6 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 C6)алкоксі-(C=O)-(C1-C6)алкоксі(C1-C6)алкіл, гідроксі(C1-C6)алкіл-S-(C1-C6)алкіл, (C1-C6)алкіл(C=O)-S-(C1-C6)алкіл, (C1-C6)алкіл-(O=S=O)-O-(C1-C6)алкіл, гідроксі(C1-C6)алкоксі(C1-C6)алкіл, (C1-C6)алкоксі(C1-C6)алкоксі(C1-C6)алкіл, галоген(C1-C6)алкоксі(C1-C6)алкіл, CN, (R10)2N-(C1C6)алкіл, (R10)2N-(C=O)-, карбокси або (C1-C6)алкоксі-(C1-C6)алкокси; або R4 і R8, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване фенільне кільце, де вказане фенільне кільце є незаміщеним або заміщеним 1 або 2 замісником(ами), причому кожний незалежно являє собою гідроксі(C1-C6)алкіл або (C1-C6)алкокси-(C=O)-; або R4 і R8, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване 6-членне насичене карбоциклічне кільце, де вказане карбоциклічне кільце є незаміщеним; R9 являє собою, незалежно в кожному випадку, гідрокси, (C 1-C6)алкіл, (C1-C6)алкокси, галоген, гідроксі(C1-C6)алкіл, галоген(C1-C6)алкіл, гідроксі(C1-C6)алкокси, галоген(C1-C6)алкокси, феніл(C1-C6)алкокси, (C1-C6)алкокси-(C=O)-, (C1-C6)алкіл-(C=O)-O-, гідроксі-(C=O)-(C1C6)алкокси, CN, (R10)2N-, (R10)2N-(C=O)-, R11-(O=S=O)- або R11-(O=S=O)-O-; або R9 і R9, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване 5 або 6-членне ненасичене гетероциклічне кільце, що містить 1 або 2 гетератом(и), вибраних з O, де вказане фенільне, карбоциклічне або гетероциклічне кільце є незаміщеним; R10 являє собою, незалежно в кожному випадку, H або (C1-C6)алкіл, R11 являє собою, незалежно в кожному випадку, (C1-C6)алкіл або галоген(C1-C6)алкіл; m дорівнює 0, 1 або 2; і n дорівнює 1 або 2. В іншій можливій підгрупі сполук формули I X являє собою C(R 5)(R6) або C(R7)(R8); Z являє собою -[C(R4)2]n-; R1 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл або галоген; R2 являє собою, незалежно в кожному випадку, H; R3 являє собою, незалежно в кожному випадку, H; R4 являє собою, незалежно в кожному випадку, H; R5 являє собою H; R6 являє собою феніл, незаміщений або заміщений 1 або 2 замісником(ами) R 9; R7 являє собою (C1-C6)алкіл; R8 являє собою гідроксі(C1-C6)алкіл, гідроксі(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкіл або гідроксі(C1-C6)алкоксі(C1-C6)алкіл, R9 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл, (C1-C6)алкокси, галоген, гідроксі(C1-C6)алкокси або (R10)2N-; R10 являє собою, незалежно в кожному випадку, H або (C1-C6)алкіл, m дорівнює 0 або 1; n дорівнює 1. У ще одній можливій підгрупі сполук формули I X являє собою C(R5)(R6) або C(R7)(R8); Z являє собою одинарний зв'язок; R1 являє собою, незалежно в кожному випадку, гідрокси, (C1-C6)алкіл або галоген; R2 являє собою, незалежно в кожному випадку, H; R3 являє собою, незалежно в кожному випадку, H; R4 являє собою, незалежно в кожному випадку, H; R5 являє собою H; R6 являє собою феніл, незаміщений або заміщений 1 або 2 замісником(ами) R 9; R7 являє собою H або (C1-C6)алкіл; R8 являє собою гідроксі(C1-C6)алкіл, гідроксі(C1-C6)алкокси, (C1-C6)алкоксі(C1-C6)алкіл або гідроксі(C1-C6)алкоксі(C1-C6)алкіл, R9 являє собою, незалежно в кожному випадку, гідрокси, (C 1-C6)алкіл, (C1-C6)алкокси, галоген, гідроксі(C1-C6)алкокси або (R10)2N-; R10 являє собою, незалежно в кожному випадку, H або (C1-C6)алкіл, m дорівнює 0 або 1; n дорівнює 1. У додатково можливій підгрупі сполук формули I сполука являє собою 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-5-феніл-1,2,3,6-тетрагідропіридин, 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-фенілпіперидин, 1-(2,3-дигідробензо[1,4]діоксин-2ілметил)-3-(2-метоксифеніл)піперидин, 3-(4-хлорфеніл)-1-(2,3-дигідробензо[1,4]діоксин-2 7 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 ілметил)піперидин, 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(3-метоксифеніл)піперидин, 1(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-п-толілпіперидин, 1-(2,3-дигідробензо[1,4]діоксин-2ілметил)-3-(4-метоксифеніл)піперидин, 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-oтолілпіперидин, 4-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол, 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-(3-фторфеніл)піперидин, 3-[1-(2,3дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол, 2-[1-(2,3-дигідробензо[1,4]діоксин-2ілметил)піперидин-3-іл]фенол, (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(2фторфеніл)піперидин, (S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(2фторфеніл)піперидин, (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3фторфеніл)піперидин, (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3фторфеніл)піперидин∙HCl, (S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3фторфеніл)піперидин, (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(4фторфеніл)піперидин, (S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(4фторфеніл)піперидин, (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3трифторметилфеніл)піперидин, (S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3трифторметилфеніл)піперидин, (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(4трифторметилфеніл)піперидин, (S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(4трифторметилфеніл)піперидин, (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3метоксифеніл)піперидин, (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3метоксифеніл)піперидин∙HCl, (S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3метоксифеніл)піперидин, (R*)-3-{1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3іл}фенол, (R*)-3-{1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}фенол∙HCl, (3{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}феніл)метанол, 3-{(S)-1[(R*)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}феніловий ефір оцтової кислоти∙HCl, 2-(3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3іл}фенокси)етанол, 3-(3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3іл}фенокси)пропан-1-ол, 3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3іл}феніловий ефір трифторметансульфонової кислоти, (3-{(R*)-1-[(S)-1-(2,3дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}фенокси)оцтову кислоту, 3-{(R*)-1-[(S)-1-(2,3дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}бензонітрил, 3-бензо[1,3]діоксол-5-іл-1-[(S)1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин, 3-[(R*)-1-((S)-6-бензилокси-2,3дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол, (S)-2-[(R*)-3-(3гідроксифеніл)піперидин-1-ілметил]-2,3-дигідробензо[1,4]діоксин-6-ол, 3-[(R*)-1-((S)-7бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол, (S)-3-[(R*)-3-(3гідроксифеніл)піперидин-1-ілметил]-2,3-дигідробензо[1,4]діоксин-6-ол, 3-[(R*)-1-((S)-8бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол, (S)-3-[(R*)-3-(3гідроксифеніл)піперидин-1-ілметил]-2,3-дигідробензо[1,4]діоксин-5-ол, (R*)-3-[1-((S)-7-фтор-2,3дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол, 1-(2,3-дигідробензо[1,4]діоксин-2ілметил)-5-метил-1,2,3,6-тетрагідропіридин, 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,5диметил-1,2,3,6-тетрагідропіридин, [1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,5,6тетрагідропіридин-3-іл]метанол, 2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,3,4,5,6,7,8октагідроізохінолін, 2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)декагідроізохінолін, етиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-карбонової кислоти, [1-(2,3дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]метанол, етиловий ефір 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-карбонової кислоти, етиловий ефір 1(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин-3-карбонової кислоти, [1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-іл]метанол, 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-метоксиметил-3-метилпіперидин, 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-етоксиметил-3-метилпіперидин, 3-хлорметил-1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин, 2-[1-(2,3-дигідробензо[1,4]діоксин-2ілметил)-3-метилпіперидин-3-іл]пропан-2-ол, 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(1метокси-1-метилетил)-3-метилпіперидин, 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3гідроксиметил-3-метилпіперидин-4-ол, 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3метилпіперидин-3-ілметиловий ефір оцтової кислоти, 1-(2,3-дигідробензо[1,4]діоксин-2ілметил)-3-метилпіперидин-3-ілметиловий ефір метансульфонової кислоти, [1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин-3-іл]метанол, 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-етил-3-метоксиметилпіперидин, 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-метоксиметоксиметил-3-метилпіперидин, 1-[1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин-3-іл]етанон, 1-[1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин-3-іл]етанол, 3-алілоксиметил-1-(2,3 8 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин, 2-[1-(2,3-дигідробензо[1,4]діоксин-2ілметил)-3-етилпіперидин-3-ілметокси]етанол, 3-алілоксиметил-1-(2,3-дигідробензо[1,4]діоксин2-ілметил)-3-метилпіперидин, етиловий ефір 3-аліл-1-(2,3-дигідробензо[1,4]діоксин-2ілметил)піперидин-3-карбонової кислоти, [3-аліл-1-(2,3-дигідробензо[1,4]діоксин-2ілметил)піперидин-3-іл]метанол, 3-аліл-1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3метоксиметилпіперидин, 3-аліл-1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3етоксиметилпіперидин, 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метил-3-(2,2,2трифторетоксиметил)піперидин, 2-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3метилпіперидин-3-ілметокси]етанол, етиловий ефір [1-(2,3-дигідробензо[1,4]діоксин-2ілметил)піперидин-3-іл]оцтової кислоти, 2-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин3-іл]етанол, 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(2-метоксіетил)піперидин, амід 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-карбонової кислоти, 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-карбонітрил, C-[1-(2,3-дигідробензо[1,4]діоксин2-ілметил)піперидин-3-іл]метиламін, 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-ол, метиловий ефір 2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,3,4-тетрагідроізохінолін-8карбонової кислоти, [2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,3,4-тетрагідроізохінолін-8іл]метанол, етиловий ефір (S)-1-((R)-2,3-дигідробензо[1,4]діоксин-2-карбоніл)-3-метилпіперидин3-карбонової кислоти, (S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3карбоксилат літію, {(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3іл}метанол, 2-{(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3ілметокси}етанол, D-тартрат 2-{(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3метилпіперидин-3-ілметокси}етанолу, (S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(2метоксіетоксиметил)-3-метилпіперидин, (S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3метил-3-(2,2,2-трифторетоксиметил)піперидин, (S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2іл)метил]-3-метилпіперидин-3-ілметиловий ефір метансульфонової кислоти, S-{(S)-1-[(S)-1-(2,3дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3-ілметил}овий ефір тіооцтової кислоти, 2-{(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3ілметилсульфаніл}етанол, трет-бутиловий ефір {(S)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2іл)метил]-3-метилпіперидин-3-ілметокси}оцтової кислоти, {(S)-1-[(S)-1-(2,3дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3-ілметокси}ацетат натрію, 2-[(S)-1-((S)7-фтор-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-ілметокси]етанол, етиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-фторпіперидин-3-карбонової кислоти, [1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-фторпіперидин-3-іл]метанол, етиловий ефір (S)-1-[(S)-1(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-метилпіперидин-3-карбонової кислоти, [(S)-1-((S)-7фтор-2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-іл]метанол, (S)-1-((S)-7-фтор2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метоксиметил-3-метилпіперидин, (S)-1-((S)-7-фтор2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метоксиметил-3-метилпіперидин∙HCl, (S)-1-[(S)-1-(2,3дигідробензо[1,4]-діоксин-2-іл)метил]-3-метоксиметил-3-метилпіперидин, 3-{(R*)-1-[(S)-1-(2,3дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}феніламін, оксалат (R*)-3-{1-[(S)-1-(2,3дигідробензо[1,4]діоксин-2-іл)метил]піперидин-3-іл}фенолу, (S)-2-[(R*)-3-(3гідроксифеніл)піперидин-1-ілметил]-2,3-дигідробензо[1,4]діоксин-5-ол, 1-[(S)-1-(2,3дигідробензо[1,4]діоксин-2-іл)метил]-3-(2-метоксифеніл)піролідин, (S)-1-[(S)-1-(2,3дигідробензо[1,4]діоксин-2-іл)метил]-3-(2-фторетоксиметил)-3-метилпіперидин∙HCl, (R*)-1-[(S)-1(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3-фторметоксифеніл)піперидин, метиловий ефір 1(2,3-дигідробензо[1,4]діоксин-2-ілметил)піролідин-3-карбонової кислоти, [1-(2,3дигідробензо[1,4]діоксин-2-ілметил)піролідин-3-іл]метанол, 2-[1-(2,3-дигідробензо[1,4]діоксин-2ілметил)піролідин-3-ілметокси]етанол, метиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2ілметил)-3-метилпіролідин-3-карбонової кислоти, [1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3метилпіролідин-3-іл]метанол, 2-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіролідин-3ілметокси]етанол, 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метоксиметил-3-метилпіролідин або 3-[(R)-1-((S)-7-нітро-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол. Для фахівця в даній галузі техніки очевидно, що в сполуках формули I, якщо замісники R 9 і R9, приєднані до сусідніх атомів вуглецю кільця, утворюють разом з атомами вуглецю кільця, до яких вони приєднані, конденсоване 5 або 6-членне ненасичене карбоциклічне кільце або конденсоване 5 або 6-членне ненасичене гетероциклічне кільце, то вказане карбоциклічне кільце або гетероциклічне кільце може мати додаткові ненасичені зв'язки на додаток до ненасиченого зв'язку між атомами вуглецю кільця, до яких приєднані вказані замісники. Терміни, використовувані в даному описі, мають значення, вказані нижче. Термін "щонайменше один", використовуваний у значеннях нижче, належить до одного або декількох 9 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 значень, таких як один. Наприклад, термін "щонайменше один галоген" належить до одного або декількох галогенів, таких як один галоген. Термін "гідрокси", використовуваний у даному описі як такий або як частина іншої групи, належить до -OH-групи. Термін “(C1-C6)алкіл", використовуваний у даному описі як такий або як частина іншої групи, належить до насиченої вуглеводневої групи із прямим або розгалуженим ланцюгом, що має 1, 2, 3, 4, 5 або 6 атом(ів) вуглецю. Представницькі приклади (C1-C6)алкілу включають, але не обмежуються ними, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, н-пентил, ізопентил і н-гексил. Термін “(C1-C6)алкокси", використовуваний у даному описі як такий або як частина іншої групи, належить до (C1-C6)алкільної групи, що, як визначено в даному описі, приєднана до вихідного фрагмента молекули через атом кисню. Представницькі приклади (C 1-C6)алкокси включають, але не обмежуються ними, метокси, етокси, н-пропокси, н-бутокси, ізобутокси, вторбутокси, трет-бутокси, 2,2-диметилпропокси, 3-метилбутокси, і н-гексокси. Термін "гало" або "галоген", використовуваний у даному описі як такий або як частина іншої групи, належить до фтору, хлору, брому або йоду. Термін "галоген(C1-C6)алкіл", використовуваний у даному описі, належить щонайменше до одного галогену, як визначено в даному описі, приєднаного до вихідного фрагмента молекули через (C1-C6)алкільну групу, як визначено в даному описі. Якщо є декілька галогенів, то галогени можуть бути однаковими або різними. Представницькі приклади галоген(C 1-C6)алкілу включають, але не обмежуються ними, фторметил, хлорметил, дифторметил, трифторметил, 2хлоретил, 3-бромпропіл і 2-хлорпропіл. Термін "феніл(C1-C6)алкокси", використовуваний у даному описі, належить щонайменше до однієї фенільної групи, приєднаної до вихідного фрагмента молекули через групу (C 1C6)алкокси, як визначено в даному описі. Представницькі приклади феніл(C 1-C6)алкокси включають, але не обмежуються ними, фенілметокси, 2-фенілетокси й 3-фенілпропокси. Термін "аміно", використовуваний у даному описі як частина іншої групи, належить до групи NH2. Термін "моно(C1-C6)алкіламіно", використовуваний у даному описі, належить до однієї (C 1C6)алкільної групи, як визначено в даному описі, приєднаної до вихідного фрагмента молекули через аміногрупу, як визначено в даному описі. Представницькі приклади моно(C 1-C6)алкіламіно включають, але не обмежуються ними, N-метиламіно, N-етиламіно, і N-бутиламіно. Термін "ді(C1-C6)алкіламіно", використовуваний у даному описі, належить до двох (C1C6)алкільних груп, як визначено в даному описі, приєднаних до вихідного фрагмента молекули через аміногрупу, як визначено в даному описі. (C 1-C6)алкільні групи можуть бути однаковими або різними. Представницькі приклади ді(C1-C6)алкіламіно включають, але не обмежуються ними, N,N-диметиламіно й N,N-діетиламіно. Термін "карбокси", використовуваний у даному описі, належить до групи -COOH. Термін “(C2-C6)алкеніл", використовуваний у даному описі як такий або як частина іншої групи, належить до вуглеводневої групи із прямим або розгалуженим ланцюгом, що має 2, 3, 4, 5 або 6 атомів вуглецю і має щонайменше один подвійний зв'язок вуглець-вуглець. Представницькі приклади (C2-C6)алкенілу включають, але не обмежуються ними, етеніл і проп2-еніл. Термін "гідроксі(C1-C6)алкіл", використовуваний у даному описі як такий або частина іншої групи, належить щонайменше до однієї гідроксигрупи, як визначено в даному описі, приєднаної до вихідного фрагмента молекули через (C1-C6)алкільну групу, як визначено в даному описі. Представницькі приклади гідроксі(C1-C6)алкілу включають, але не обмежуються ними, гідроксиметил, 1-гідроксіетил, 2-гідроксіетил, 2,2-дигідроксіетил, 1-гідроксипропіл, 3гідроксипропіл, 1-гідрокси-1-метилетил і 1-гідрокси-1-метилпропіл. Термін "гідроксі(C2-C6)алкеніл", використовуваний у даному описі, належить щонайменше до однієї гідроксигрупи, як визначено в даному описі, приєднаної до вихідного фрагмента молекули через (C2-C6)алкенільну групу, як визначено в даному описі. Представницькі приклади гідроксі(C2-C6)алкенілу включають, але не обмежуються ними, 1-гідроксіетеніл, 2-гідроксіетеніл і 1-гідроксипроп-2-еніл. Термін “(C1-C6)алкоксі(C1-C6)алкіл", використовуваний у даному описі як такий або як частина іншої групи, належить щонайменше до однієї групи (C1-C6)алкокси, як визначено в даному описі, приєднаної до вихідного фрагмента молекули через (C 1-C6)алкільну групу, як визначено в даному описі. Якщо є декілька груп (C 1-C6)алкокси, то групи (C1-C6)алкокси можуть бути однаковими або різними. Представницькі приклади (C1-C6)алкоксі(C1-C6)алкілу включають, але не обмежуються ними, метоксиметил, етоксиметил, пропоксиметил, 2-метоксіетил, 2 10 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 етоксіетил, 2,2-диметоксіетил, 1-метил-2-пропоксіетил, 1-метокси-1-метилетил і 4метоксибутил. Термін “(C2-C6)алкенілокси", використовуваний у даному описі як частина іншої групи, належить до (C2-C6)алкенільної групи, як визначено в даному описі, приєднаної до вихідного фрагмента молекули через атом кисню. Представницькі приклади (C 2-C6)алкенілокси включають, але не обмежуються ними, етенілокси, проп-2-енілокси, буте-2-нілокси й гекс-3енілокси. Термін “(C2-C6)алкенілоксі(C1-C6)алкіл", використовуваний у даному описі, належить щонайменше до однієї групи (C2-C6)алкенілокси, як визначено в даному описі, приєднаної до вихідного фрагмента молекули через (C1-C6)алкільну групу, як визначено в даному описі. Якщо є декілька груп (C2-C6)алкенілокси, то групи (C2-C6)алкенілокси можуть бути однаковими або різними. Представницькі приклади (C2-C6)алкенілоксі(C1-C6)алкілу включають, але не обмежуються ними, проп-2-енілоксиметил і етенілоксіетил. Термін "гідроксі(C1-C6)алкокси", використовуваний у даному описі як такий або як частина іншої групи, належить щонайменше до однієї гідроксигрупи, як визначено в даному описі, приєднаної до вихідного фрагмента молекули через групу (C 1-C6)алкокси, як визначено в даному описі. Представницькі приклади гідроксі(C 1-C6)алкокси включають, але не обмежуються ними, гідроксиметокси, дигідроксиметокси, 2-гідроксіетокси, 2-гідроксипропокси, 3гідроксипропокси, 2-гідроксибутокси і 2-гідрокси-1-метилетокси. Термін “(C1-C6)алкоксі(C1-C6)алкокси", використовуваний у даному описі як такий або як частина іншої групи, належить щонайменше до однієї групи (C 1-C6)алкокси, як визначено в даному описі, приєднаної до вихідного фрагмента молекули через групу (C 1-C6)алкокси, як визначено в даному описі. Групи (C1-C6)алкокси можуть бути однаковими або різними. Представницькі приклади (C1-C6)алкоксі(C1-C6)алкокси включають, але не обмежуються ними, метоксиметокси, пропоксиметокси, 2-метоксіетокси, 2-етоксіетокси, 2-бутоксіетокси, 2,2диметоксіетокси, 1-метил-2-пропоксіетокси, 2-метоксипропокси і 4-метоксибутокси. Термін "галоген(C1-C6)алкокси", використовуваний у даному описі як такий або як частина іншої групи, належить щонайменше до одного галогену, як визначено в даному описі, приєднаному до вихідного фрагмента молекули через групу (C 1-C6)алкокси, як визначено в даному описі. Якщо є декілька галогенів, то галогени можуть бути однаковими або різними. Представницькі приклади галоген(C1-C6)алкокси включають, але не обмежуються ними, фторметокси, хлорметокси, дифторметокси, трифторметокси, 2-брометокси, 2,2,2трихлоретокси, 3-бромпропокси, 2-хлорпропокси, і 4-хлорбутокси. Термін "оксо", використовуваний у даному описі, належить до групи =O. Вираз "сполуки за винаходом", використовуваний у даному описі, належить до сполук формули I. Фармацевтично прийнятні солі, наприклад, солі металів і кислотно-адитивні солі з органічними й неорганічними кислотами, відомі в галузі фармацевтики. Представницькі приклади фармацевтично прийнятних солей металів включають, але не обмежуються ними, солі літію, натрію, калію, кальцію, магнію, алюмінію й цинку. Представницькі приклади фармацевтично прийнятних кислотно-адитивних солей включають, але не обмежуються ними, хлориди, броміди, сульфати, нітрати, фосфати, сульфонати, метансульфонати, форміати, тартрати, малеати, цитрати, бензоати, саліцилати, аскорбати, ацетати й оксалати. Фармацевтично прийнятні складні ефіри, якщо вони є прийнятними, можуть бути отримані відомими способами з використанням фармацевтично прийнятних кислот, які є традиційними в галузі фармацевтики й зберігають фармакологічні властивості в незв'язаній формі. Необмежуючі приклади цих складних ефірів включають складні ефіри аліфатичних або ароматичних спиртів. Представницькі приклади фармацевтично прийнятних складних ефірів включають, але не обмежуються ними, метиловий, етиловий, н-пропіловий, ізопропіловий, нбутиловий, ізобутиловий, втор-бутиловий, трет-бутиловий і бензиловий складні ефіри. Даний винахід включає у свій обсяг всі можливі геометричні ізомери, наприклад, Z і E ізомери (цис- і трансізомери), сполук, а також всі можливі оптичні ізомери, наприклад, діастереомери й енантіомери, сполук. Крім того, даний винахід включає у свій обсяг як індивідуальні ізомери, так і будь-які їх суміші, наприклад, рацемічні суміші. Індивідуальні ізомери можуть бути отримані з використанням відповідних ізомерних форм вихідних речовин, або вони можуть бути розділені після одержання кінцевої сполуки відповідно до традиційних способів розділення. Для розділення оптичних ізомерів, наприклад енантіомерів, з їхньої суміші можуть бути використані традиційні способи розділення, наприклад, фракціонована кристалізація. Сполуки формули I можуть бути отримані за допомогою різноманітних синтетичних шляхів, аналогічно або відповідно до способів, відомими в літературі, використовуючи прийнятні вихідні 11 UA 100695 C2 речовини. Вихідні речовини, зображені нижче у формулах A, B, C і D, є комерційно доступними або можуть бути отримані за допомогою синтетичних шляхів, відомих у літературі. Прийнятні вихідні речовини, що містять бензодіоксановий фрагмент, являють собою сполуки формул A і B: 5 10 15 20 25 30 , де R1 і m визначені вище й L являє собою відхідну групу, наприклад, галоген, мезилат або тозилат. 2,3-Дигідробензо[1,4]діоксин-2-карбонова кислота (формула A) є комерційно доступною й може бути легко розділена на її енантіомери, як описано в Tetrahedron: Asymmetry, 16 (2005) 1639. Сполуки формули B можуть бути отримані відповідно до відомих способів. Прийнятні вихідні речовини, що містять фрагмент азациклу, являють собою прийнятні заміщені піперидини або гомопіперидини, а також, у деяких випадках, піридини. Такі сполуки являють собою сполуки формул C, D, і E: , де X і Z визначені вище, R означає R6 або R8, визначені вище, і R" і R" означають алкільні групи. Незважаючи на те, що їхні формули не показані, гетероциклічні кільця в сполуках формул C, D і E можуть містити додаткові прийнятні замісники. Сполуки формули E, що мають два замісники, приєднаних до того самого атома вуглецю, можуть бути отримані, наприклад, за допомогою -алкілування прийнятних карбоксилатів піперидину, як описано в Org. Lett., 7 (2005) 55, або за допомогою створення піперидинового кільця з відповідного попередника з відкритим ланцюгом, наприклад, відновленням прийнятного алкілованого 2-ціаноацетату. Складноефірна група в сполуках формули E може трансформуватися надалі в широке різноманіття інших функціональних груп. Як правило, сполуки формули I можуть бути отримані аналогічно або відповідно до схеми 1, де X і Z визначені вище: Схема 1 Інший шлях одержання проміжних амідів схеми 1, де Z являє собою одинарний зв'язок, здійснюється за допомогою реакції прийнятного аміну й прийнятного ітеконатного аналога, як описано в J. Org. Chem., 26 (1961) 1519-1524. 12 UA 100695 C2 Додатковий шлях одержання сполук формули I показаний на схемі 2, де X, Z, R 1 і m визначені вище: Схема 2 5 Сполуки формули I, де R5 або R7 являють собою H, можуть бути отримані за допомогою Nалкілування прийнятних заміщених піридинів з наступним відновленням, як продемонстровано на схемі 3, де R1, m, L і R визначені вище: Схема 3 10 Розділення сполук формули I, які являють собою рацемати, може бути проведено, якщо це бажано, наприклад, шляхом перетворення рацемічної сполуки в суміш її діастереомерних солей у результаті реакції з оптично активною кислотою й наступним розділенням діастереомерів кристалізацією. Представницькі приклади вказаних оптично активних кислот включають, але не обмежуються ними, D-винну кислоту й дибензоїл-D-винну кислоту. Фахівець у даній галузі уявляє собі, що будь-яка вихідна речовина або проміжна сполука в реакціях, описаних вище, може бути захищена, якщо необхідно, способом, відомим у техніці. З будь-якої захищеної функціональної групи захист може бути згодом знятий способом, відомим у техніці. Мається на увазі, що шляхи синтезу, описані вище, ілюструють одержання сполук формули I, і одержання жодним чином не обмежується ними, наприклад, також є інші можливі способи синтезу, які знаходяться у межах звичайних пізнань фахівця в даній галузі. Сполуки формули I можуть бути перетворені, якщо бажано, у форму їх фармацевтично прийнятної солі або складного ефіру з використанням способів, відомих у техніці. Даний винахід буде розкритий більш докладно за допомогою наступних прикладів. Приклади призначені тільки для ілюстративних цілей і не обмежують обсяг даного винаходу, зумовлений формулою винаходу. Абревіатури: ДХМ = дихлорметан, DIPEA=N,N-діізопропілетиламін, ДМФА = N,Nдиметилформамід, EtOAc = етилацетат, IPA = ізопропанол, РХ-МС = рідинна хроматографіямас-спектрометрія, КТ = кімнатна температура, ТГФ = тетрагідрофуран, ТШХ = тонкошарова хроматографія. Колонкову хроматографію виконували на силікагелі 60, отриманому від Merck, або використовували апарат CombiFlash разом з колонками Redisep, наданими Teledyne ISCO. Мікрохвильове нагрівання виконували з використанням мікрохвильового реактора Emrys Optimiser від Personal Chemistry або мікрохвильового реактора Initiator 2.0 від Biotage. Структури 1 продуктів підтверджували даними H ЯМР. Спектр вимірювали на апараті Bruker Avance 400. РХ-МС аналізи виконували за допомогою Waters 2690 Alliance HPLC і одноквадрупольного масспектрометра Waters Micromass ZQ4000 з використанням ЕРИ. Одержання вихідних речовин 3-(Піперидин-3-іл)фенол∙HBr може бути отриманий з 3-(3-метоксифеніл)піперидину, як описано в J. Med. Chem., 24 (1981) 1475. 2-(Піперидин-3-іл)фенол∙HBr отримували шляхом нагрівання 3-(2метоксифеніл)піперидину∙HCl (46 мг, 0,20 ммоль) з 48 % HBr у мікрохвильовому реакторі при 15 20 25 30 35 40 13 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 120C протягом однієї години. Після упарювання одержували 61 мг вказаної в заголовку сполуки. 4-(Піперидин-3-іл)фенол∙HBr одержували шляхом нагрівання 3-(4метоксифеніл)піперидин∙HCl (46 мг, 0,20 ммоль) з 48 % HBr у мікрохвильовому реакторі при 120C протягом однієї години. Після упарювання одержували 53 мг вказаної в заголовку сполуки. (R*)-3-(3-метоксифеніл)піперидин одержували кристалографічним розділенням з D-(-)винною кислотою, як описано для аналогічного субстрату в Tetrahedron Lett., 35 (1994) 9063. (R*)-3-(піперидин-3-іл)фенол∙HBr або HCl одержували з (R*)-3-(3-метоксифеніл)піперидину способом, описаним вище для рацемату. Концентровану HCl можна використовувати замість 48 % HBr. (R)-2,3-дигідробензо[1,4]діоксин-2-карбонову кислоту одержували з комерційно доступного рацемату, як описано в Tetrahedron: Asymmetry, 16 (2005) 1639. (R)-2,3-дигідробензо[1,4]діоксин-2-карбонілхлорид може бути отриманий шляхом нагрівання (R)-2,3-дигідробензо[1,4]діоксин-2-карбонової кислоти при 70C у присутності надлишку тіонілхлориду протягом 1-8 годин. Може бути додана каталітична кількість ДМФА. Упарюванням досуха одержують вказану в заголовку сполуку з високим виходом. ((R)-(7-фтор-2,3-дигідробензо[1,4]діоксин-2-іл)метиловий ефір метансульфонової кислоти одержували в чотири стадії з 5’-фтор-2’-гідроксіацетофенону відповідно до аналогічних способів, описаних в літературі (J. Med. Chem., 30 (1987) 814 і US 5935973). Одержання проміжних сполук Проміжна сполука A1: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(2-фторфеніл)піперидин1-іл]метанон Проміжна сполука A2: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(S*)-3-(2-фторфеніл)піперидин1-іл]метанон (R)-2,3-дигідробензо[1,4]діоксин-2-карбонілхлорид (46 мг, 0,23 ммоль) у ДХМ (1 мл) додавали до холодного розчину 3-(2-фторфеніл)піперидину·HCl (50 мг, 0,23 ммоль) і ДХМ (1 мл). Додавали триетиламін (56 мг, 0,55 ммоль). Суміш перемішували протягом 50 хв. Додавали воду (1 мл) і водну фазу екстрагували ДХМ (31 мл). Об'єднані органічні шари абсорбували на діоксиді кремнію. Суміш очищали методом флеш-хроматографії, використовуючи гептан/EtOAc як елюент. Перший елюйований діастереомер збирали з отриманням 24 мг A1 (ротамерна суміш). 1 H ЯМР (CDCl3): 1,63-1,73 (м, 1H), 1,79-1,96 (м, 2H), 2,03-2,14 (м, 1H), 2,63-2,75 (м, 0,5H), 2,80 (т, 0,5H), 2,98-3,16 (м, 1,5H), 3,20 (т, 0,5H), 4,14-4,26 (м, 1H), 4,29-4,38 (м, 1H), 4,48-4,55 (м, 1H), 4,67-4,75 (м, 1H), 4,84-4,93 (м, 1H) 6,78-7,06 (м, 7H), 7,26-7,33 (м, 1H). Другий елюйований діастереомер збирали з одержанням 25 мг A2 (ротамерна суміш). 1 H ЯМР (CDCl3): 1,60-1,76 (м, 1H), 1,78-1,95 (м, 2H), 2,02-2,13 (м, 1H), 2,62-2,71 (м, 0,7H), 2,80 (т, 0,3H), 2,98-3,35 (м, 2H), 4,14-4,25 (м, 1H), 4,29-4,39 (м, 1H), 4,45-4,57 (м, 1H), 4,65-4,74 (м, 1H), 4,76-4,82 (м, 0,7H), 4,86-4,93 (м, 0,3H), 6,81-7,30 (м, 8H). Проміжна сполука A3: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(3-фторфеніл)піперидин1-іл]метанон Проміжна сполука A4: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(S*)-3-(3-фторфеніл)піперидин1-іл]метанон (R)-2,3-дигідробензо[1,4]діоксин-2-карбонілхлорид (46 мг, 0,23 ммоль) у ДХМ (1 мл) додавали до холодного розчину 3-(3-фторфеніл)піперидину·HCl (50 мг, 0,23 ммоль) і ДХМ (1 мл). Додавали триетиламін (56 мг, 0,55 ммоль) і суміш перемішували протягом 50 хв. Після водної обробки, як описано для проміжної сполуки A1, неочищену суміш очищали методом флеш-хроматографії, використовуючи гептан/EtOAc як елюент. Перший елюйований діастереомер збирали з отриманням 29 мг A3. 1 H ЯМР (CDCl3): 1,61-2,00 (м, 2H), 2,06-2,17 (м, 1H), 2,58-2,82 (м, 2H), 3,04-3,12 (м, 0,7H), 3,18-3,28 (т, 0,3H), 4,10-4,25 (м, 2H), 4,27-4,39 (м, 1H), 4,46-4,54 (м, 1H), 4,65-4,76 (м, 1H), 4,844,90 (м, 1H) 6,80-7,06 (м, 7H), 7,26-7,33 (м, 1H). Другий елюйований діастереомер збирали з одержанням 19 мг A4. 1 H ЯМР (CDCl3): 1,59-1,81 (м, 2H), 1,86-1,96 (м, 1H), 2,08-2,20 (м, 1H), 2,61-3,30 (м, 3H), 4,14-4,25 (м, 1H), 4,30-4,41 (м, 1H), 4,48-4,57 (м, 1H), 4,65-4,72 (м, 1H), 4,77-4,83 (м, 0,7H), 4,864,90 (м, 0,3H), 6,80-7,09 (м, 7H), 7,26-7,34 (м, 1H). Проміжна сполука A5: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(4-фторфеніл)піперидин1-іл]метанон Проміжна сполука A6: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(S*)-3-(4-фторфеніл)піперидин1-іл]метанон 14 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 (R)-2,3-дигідробензо[1,4]діоксин-2-карбонілхлорид (46 мг, 0,23 ммоль) у ДХМ (1 мл) додавали до холодного розчину 3-(4-фторфеніл)піперидину·HCl (50 мг, 0,23 ммоль) і ДХМ (1 мл). Додавали триетиламін (56 мг, 0,55 ммоль) і суміш перемішували протягом 50 хв. Після водної обробки, як описано для проміжної сполуки A1, неочищену суміш очищали методом флеш-хроматографії, використовуючи гептан/EtOAc як елюент. Далі, перший елюйований діастереомер збирали з отриманням 37 мг A5. 1 H ЯМР (CDCl3): 1,60-2,00 (м, 3H), 2,04-2,16 (м, 1H), 2,56-2,81 (м, 2H), 3,05-3,15 (м, 0,6H), 3,20 (т, 0,4H), 4,13-4,24 (м, 1H), 4,28-4,40 (м, 1H), 4,47-4,55 (м, 1H), 4,65-4,74 (м, 1H), 4,84-4,89 (м, 1H) 6,70-6,95 (м, 4H), 6,98-7,05 (м, 2H), 7,15-7,24 (м, 2H). Другий елюйований діастереомер збирали з одержанням 20 мг A6. 1 H ЯМР (CDCl3): 1,60-1,76 (м, 1H), 1,78-1,95 (м, 2H), 2,02-2,13 (м, 1H), 2,62-2,71 (м, 0,7H), 2,80 (т, 0,3H), 2,98-3,35 (м, 2H), 4,14-4,25 (м, 1H), 4,29-4,39 (м, 1H), 4,45-4,57 (м, 1H), 4,65-4,74 (м, 1H), 4,76-4,82 (м, 0,7H), 4,86-4,93 (м, 0,3H), 6,81-7,30 (м, 8H). Проміжна сполука A7: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(3гідроксифеніл)піперидин-1-іл]метанон Проміжна сполука A8: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(S*)-3-(3гідроксифеніл)піперидин-1-іл]метанон Суміш (R)-2,3-дигідробензо[1,4]діоксин-2-карбонової кислоти (5,06 г, 28,1 ммоль), толуолу (25 мл) і тіонілхлориду (6,68 мл, 56,2 ммоль) нагрівали при кипінні зі зворотним холодильником. Через 1,5 години реакційну суміш охолоджували й упарювали досуха. До упареного залишку додавали толуол і упарювали досуха. Упарений залишок у ТГФ (10 мл) повільно додавали до суміші гідрохлориду (R*)-3-(піперидин-3-іл)фенолу (5,0 г, 23,4 ммоль), карбонату калію (4,85 г, 35,1 ммоль), води (16,5 мл) і ТГФ (33,5 мл). Після додавання реакційну суміш перемішували при КТ протягом 10 хвилин, шари розділяли й органічну фазу промивали водним розчином NaCl. Органічну фазу упарювали досуха й упарений залишок кристалізували з етилацетату з одержанням 6,79 г A7. 1 H ЯМР (CDCl3): 1,60-1,97 (м, 3H), 2,05-2,15 (м, 1H), 2,62-2,76 (м, 2H), 3,05-3,27 (м, 1H), 4,15-4,18 (м, 1H), 4,31-4,37 (м, 1H), 4,48-4,52 (м, 1H), 4,66-4,68 (м, 1H), 4,86-4,89 (м, 1H), 5,25 і 5,40 (2× с, 1H), 6,71-6,94 (м, 7H), 7,16-7,20 (м, 1H). (R)-2,3-дигідробензо[1,4]діоксин-2-карбонілхлорид (475 мг, 2,4 ммоль) у ДХМ (4 мл) додавали до суміші 3-(піперидин-3-іл)фенолу·HBr (259 мг, 1,06 ммоль), триетиламіну (307 мг, 3,01 ммоль) і ДХМ (4 мл). Суміш перемішували протягом 2 год., після чого додавали 1 М HCl (5 мл). Фази розділяли і органічну фазу абсорбували на діоксиді кремнію. Суміш очищали методом флеш-хроматографії, використовуючи гептан/EtOAc як елюент. Фракції, які містили другий елюйований діастереомер, збирали. Виділений продукт (199 мг) являв собою сполуку, яка ацильована як по aміну, так і по фенолу. Складноефірний зв'язок гідролізували обробкою сполуки двома еквівалентами KOH в MeOH (5 мл) протягом однієї години. Суміш упарювали досуха, неочищений продукт поглинали EtOAc (10 мл), промивали 1 М K 2CO3, сушили і упарювали досуха з отриманням 77 мг A8. 1 H ЯМР (CDCl3): 1,59-1,95 (м, 3H), 2,06-2,15 (м, 1H), 2,61-3,30 (м, 3H), 4,13-4,23 (м, 1H), 4,31-4,39 (м, 1H), 4,46-4,55 (м, 1H), 4,65-4,71 (м, 1H), 4,80-4,92 (м, 2H), 6,65-6,98 (м, 7H), 7,157,28 (м, 1H). Проміжна сполука A9: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(3трифторметилфеніл)піперидин-1-іл]метанон Проміжна сполука A10: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(S*)-3-(3трифторметилфеніл)піперидин-1-іл]метанон (R)-2,3-дигідробензо[1,4]діоксин-2-карбонілхлорид (44 мг, 0,22 ммоль) у ДХМ (1 мл) додавали до суміші 3-(3-трифторметилфеніл)піперидину·HCl (50 мг, 0,19 ммоль) і ДХМ (1 мл). Додавали триетиламін (54 мг, 0,53 ммоль) і суміш перемішували протягом 1 год. Додавали 1 М HCl (2 мл) і фази розділяли. Органічну фазу абсорбували на діоксиді кремнію і неочищену суміш очищали методом флеш-хроматографії, використовуючи гептан/EtOAc як елюент. Фракції, які містять перший елюйований діастереомер, збирали з отриманням 30 мг A9. 1 H ЯМР (CDCl3): 1,72-2,00 (м, 3H), 2,06-2,20 (м, 1H), 2,60-2,87 (м, 2H), 3,06-3,16 (м, 0,7H), 3,26 (т, 0,3H), 4,16-4,26 (м, 1H), 4,27-4,40 (м, 1H), 4,46-4,55 (м, 1H), 4,67-4,80 (м, 1H), 4,84-4,91 (м, 1H) 6,79-6,95 (м, 4H), 7,40-7,56 (м, 4H). Другий елюйований діастереомер збирали з одержанням 19 мг A10. 1 H ЯМР (CDCl3): 1,59-1,99 (м, 3H), 2,08-2,19 (м, 1H), 2,61-3,34 (м, 3H), 4,14-4,25 (м, 1H), 4,30-4,41 (м, 1H), 4,48-4,57 (м, 1H), 4,65-4,72 (м, 1H), 4,77-4,83 (м, 0,7H), 4,86-4,90 (м, 0,3H), 6,807,09 (м, 7H), 7,26-7,34 (м, 1H). 15 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 Проміжна сполука A11: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(4-трифторметилфеніл) піперидин-1-іл]метанон Проміжна сполука A12: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(S*)-3-(4-трифторметилфеніл) піперидин-1-іл]метанон (R)-2,3-дигідробензо[1,4]діоксин-2-карбонілхлорид (44 мг, 0,22 ммоль) розчиняли в ДХМ (4 мл). Додавали 3-(4-трифторметилфеніл)піперидин·HCl (51 мг, 0,19 ммоль) і триетиламін. Суміш перемішували протягом 1 год., додавали 1 М HCl (2 мл) і фази розділяли. Органічну фазу абсорбували на діоксиді кремнію і суміш очищали методом флеш-хроматографії, використовуючи гептан/EtOAc як елюент. Фракції, які містять перший елюйований діастереомер, збирали з отриманням 21 мг A11. 1 H ЯМР (CDCl3): 1,64-2,01 (м, 3H), 2,07-2,18 (м, 1H), 2,62-2,75 (м, 1H), 2,77-2,88 (м, 1H), 3,07-3,18 (м, 0,6H), 3,26 (т, 0,4H), 4,16-4,27 (м, 1H), 4,26-4,40 (м, 1H), 4,47-4,58 (м, 1H), 4,67-4,77 (м, 1H), 4,84-4,91 (м, 1H) 6,77-6,99 (м, 4H), 7,32-7,42 (м, 2H), 7,55-7,65 (м, 2H). Другий елюйований діастереомер збирали з одержанням 21 мг A12. 1 H ЯМР (CDCl3): 1,59-1,97 (м, 3H), 2,06-2,19 (м, 1H), 2,59-3,36 (м, 3H), 4,16-4,26 (м, 1H), 4,33-4,40 (м, 1H), 4,46-4,55 (м, 1H), 4,65-4,75 (м, 1H), 4,78-4,83 (м, 0,7H), 4,86-4,93 (м, 0,3H), 6,826,94 (м, 4H), 7,27-7,46 (м, 2H), 7,54-7,64 (м, 2H). Проміжна сполука A13: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(3-метоксифеніл) піперидин-1-іл]метанон Проміжна сполука A14: (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(S*)-3-(3-метоксифеніл) піперидин-1-іл]метанон (R)-2,3-дигідробензо[1,4]діоксин-2-карбонілхлорид (3,04 г, 15,3 ммоль) розчиняли в ДХМ (50 мл). Додавали (R*)-3-(3-метоксифеніл)піперидин (2,92 г, 15,3 ммоль) і триетиламін (1,87 г, 18,36 ммоль). Після перемішування протягом 40 хв. суміш промивали водою (50 мл), 1 М Na 2CO3 (50 мл) і 1 М HCl (50 мл). Після сушіння (Na2SO4) і упарювання одержували 5,12 г A13. 1 H ЯМР (CDCl3): 1,58-1,99 (м, 3H), 2,06-2,17 (м, 1H), 2,58-2,82 (м, 2H), 3,05-3,17 (м, 0,6H), 3,20-3,29 (м, 0,4H), 3,80 (с, 3H), 4,15-4,23 (м, 1H), 4,27-4,39 (м, 1H), 4,48-4,52 (м, 1H), 4,65-4,77 (м, 1H), 4,84-4,90 (м, 1H), 6,71-6,96 (м, 7H), 7,23-7,30 (м, 1H). (R)-2,3-дигідробензо[1,4]діоксин-2-карбонілхлорид (54 мг, 0,27 ммоль) розчиняли в ДХМ (4 мл). Додавали 3-(3-метоксифеніл)піперидин·HCl (72 мг, 0,26 ммоль) і триетиламін (59 мг, 0,58 ммоль). Після перемішування протягом 1 год. кислотною обробкою, як описано вище, отримували неочищений продукт, який очищали методом флеш-хроматографії, використовуючи гептан/EtOAc як елюент. Другий елюйований діастереомер збирали з отриманням 19 мг A14. 1 H ЯМР (CDCl3): 1,57-1,99 (м, 3H), 2,08-2,21 (м, 1H), 2,60-3,31 (м, 3H), 3,81 (с, 3H), 4,17-4,25 (м, 1H), 4,31-4,40 (м, 1H), 4,45-4,55 (м, 1H), 4,66-4,75 (м, 1H), 4,77-4,85 (м, 0,7H), 4,86-4,90 (м, 0,3H), 6,78-7,01 (м, 7H), 7,23-7,33 (м, 1H). Відновлення проміжних сполук: загальна методика Проміжну сполуку (A1-A14) розчиняли в безводному ТГФ (c=0,1-0,5 М). Додавали BH3·ТГФ (1 М в ТГФ, 5-7 еквівалентів) і суміш перемішували при 60-90C, використовуючи мікрохвильове нагрівання або масляну баню (час реакції від 20 хв. аж до 16 год.). Утворення амін-боранових комплексів реєстрували по ТШХ або РХ-МС. В баню з льодом додавали охолоджену суміш 1 М HCl у великому надлишку і суміш перемішували при 40-60C протягом 20 хв.-12 год. Протікання гідролізу боран-комплексів реєстрували по ТШХ або РХ-МС. Суміш вміщували на баню з льодом і додавали твердий KOH або Na2CO3 до тих пір, поки суміш не стане лужною. ТГФ видаляли випарюванням до або після додавання основи. Водну фазу, яка залишилася, екстрагували EtOAc або ДХМ. Органічні фази збирали, сушили (Na 2SO4) і упарювали досуха. Неочищений продукт очищали методом колонкової хроматографії, використовуючи градієнт EtOAc/гептан, з додаванням 1 % триетиламіну або без нього, або кристалізацією з прийнятного розчинника. Одержання сполук за винаходом Приклад 1: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-5-феніл-1,2,3,6-тетрагідропіридин Суміш 2-бромметил-2,3-дигідробензо[1,4]діоксину (500 мг, 2,18 ммоль) і 3-фенілпіридину (339 мг, 2,18 ммоль) у ксилолі (2 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 год. Після охолодження розчинник декантували з одержанням неочищеної масляної солі піридинію, що розчиняли в MeOH (5 мл). До охолодженої суміші додавали малими порціями NaBH4 (330 мг, 4 екв). Після перемішування протягом 2 год. при КТ випарювали MeOH, додавали воду й суміш екстрагували EtOAc. Сушінням (Na2SO4) і упарюванням одержували неочищений продукт, що очищали методом флеш-хроматографії (гептан/EtOAc). 1 H ЯМР (CDCl3): 2,36 (м, 1H), 2,66-2,92 (м, 4H), 3,40-3,55 (м, 2H), 4,04 (м, 1H), 4,30-4,45 (м, 2H), 6,13 (м, 1H), 6,80-6,95 (м, 4H), 7,20-7,35 (м, 5H). 16 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 2: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-фенілпіперидин Відтворювали вищевказану методику, за винятком того, що неочищену сіль піридинію гідрували в MeOH при нормальному тиску (6,5 год., КТ), використовуючи PtO 2 як каталізатор. Після лужної обробки неочищений продукт очищали методом флеш-хроматографії (гептан/EtOAc). 1 H ЯМР (CDCl3): 1,40-1,51 (м, 1H), 1,60-1,85 (м, 2H), 2,11 (шир.д, 1H), 2,05-2,28 (м, 2H), 2,58 (ддд, 1H), 2,66-2,75 (м, 1H), 2,78-3,10 (м, 3H), 3,92-4,05 (м, 1H), 4,25-4,37 (м, 2H), 6,77-6,90 (м, 4H), 7,15-7,32 (м, 5H). Приклад 3: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(2-метоксифеніл)піперидин Суміш 2-бромметил-2,3-дигідробензо[1,4]діоксину (34 мг, 0,15 ммоль), 3-(2метоксифеніл)піперидину·HCl (38 мг, 0,165 ммоль) і триетиламіну (41 мг, 0,39 ммоль) в ацетонітрилі (2 мл) нагрівали в мікрохвильовому реакторі при 110-150C протягом 90 хв. Після упарювання досуха неочищений продукт очищали методом флеш-хроматографії, використовуючи градієнт гептану і EtOAc як елюент, з отриманням 12 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,40-1,53 (м, 1H), 1,71-1,81 (м, 2H), 1,82-1,90 (м, 1H), 2,06-2,18 (м, 2H), 2,54-2,65 (м, 1H), 2,67-2,75 (м, 1H), 2,90-3,02 (м, 1H), 3,02-3,09 (м, 1H), 3,21-3,33 (м, 1H), 3,80 (с, 3H), 3,96-4,04 (м, 1H), 4,26-4,38 (м, 2H), 6,80-6,95 (м, 6H), 7,16-7,23 (м, 2H). Приклад 4: 3-(4-хлорфеніл)-1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин Суміш 2-бромметил-2,3-дигідробензо[1,4]діоксину (34 мг, 0,15 ммоль), 3-(4хлорфеніл)піперидину (38 мг, 0,165 ммоль) і триетиламіну (38 мг, 0,38 ммоль) в ацетонітрилі (2 мл) нагрівали в мікрохвильовому реакторі при 110-150ºC протягом 290 хв. Після упарювання досуха неочищений продукт очищали методом флеш-хроматографії, використовуючи градієнт гептану й EtOAc як елюент, з одержанням 36 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,35-1,48 (м, 1H), 1,63-1,83 (м, 2H), 1,86-1,94 (м, 1H), 2,06-2,24 (м, 2H), 2,53-2,65 (м, 1H), 2,66-2,75 (м, 1H), 2,77-2,86 (м, 1H), 2,90-2,97 (м, 1H), 2,99-3,08 (м, 1H), 3,954,03 (м, 1H), 4,26-4,37 (м, 2H), 6,78-6,91 (м, 4H), 7,13-7,20 (м, 2H), 7,23-7,30 (м, 2H). Приклад 5: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(3-метоксифеніл)піперидин Суміш 2-бромметил-2,3-дигідробензо[1,4]діоксину (36 мг, 0,16 ммоль), 3-(3метоксифеніл)піперидину·HCl (36 мг, 0,16 ммоль) і триетиламіну (40 мг, 0,39 ммоль) в ацетонітрилі (2 мл) нагрівали в мікрохвильовому реакторі при 140-150C протягом 300 хв. Після упарювання досуха неочищений продукт очищали методом флеш-хроматографії, використовуючи градієнт гептану і EtOAc як елюент, з отриманням 17 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,39-1,51 (м, 1H), 1,67-1,83 (м, 2H), 1,89-1,96 (м, 1H), 2,07-2,25 (м, 2H), 2,53-2,64 (м, 1H), 2,68-2,75 (м, 1H), 2,76-2,87 (м, 1H), 2,91-3,02 (м, 1H), 3,03-3,09 (м, 1H), 3,80 (с, 3H), 3,95-4,04 (м, 1H), 4,28-4,38 (м, 2H), 6,74-6,90 (м, 7H), 7,22 (т, 1H). Приклад 6: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-п-толілпіперидин Суміш 2-бромметил-2,3-дигідробензо[1,4]діоксину (36 мг, 0,16 ммоль), 3-(4метилфеніл)піперидину∙HCl (35 мг, 0,16 ммоль) і триетиламіну (38 мг, 0,38 ммоль) в ацетонітрилі (2 мл) нагрівали в мікрохвильовому реакторі при 140-150C протягом 9 год. Суміш абсорбували на діоксиді кремнію й очищали методом флеш-хроматографії, використовуючи градієнт гептану й EtOAc як елюент, з одержанням 20 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,38-1,50 (м, 1H), 1,65-1,83 (м, 2H), 1,86-1,96 (м, 1H), 2,06-2,23 (м, 2H), 2,32 (с, 3H), 2,53-2,63 (м, 1H), 2,67-2,75 (м, 1H), 2,75-2,85 (м, 1H), 2,91-3,00 (м, 1H), 3,01-3,09 (м, 1H), 3,95-4,03 (м, 1H), 4,27-4,37 (м, 2H), 6,79-6,90 (м, 4H), 7,09-7,15 (м, 4H). Приклад 7: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(4-метоксифеніл)піперидин Суміш 2-бромметил-2,3-дигідробензо[1,4]діоксину (35 мг, 0,15 ммоль), 3-(4метоксифеніл)піперидину∙HCl (38 мг, 0,17 ммоль) і триетиламіну (41 мг, 0,39 ммоль) в ацетонітрилі (2 мл) нагрівали в мікрохвильовому реакторі при 160C протягом 3 год. Суміш абсорбували на діоксиді кремнію й очищали методом флеш-хроматографії, використовуючи градієнт гептану й EtOAc як елюент, з одержанням 18 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,33-1,45 (м, 1H), 1,62-1,82 (м, 2H), 1,83-1,94 (м, 1H), 2,05-2,20 (м, 2H), 2,51-2,65 (м, 1H), 2,66-2,82 (м, 2H), 2,90-2,99 (м, 1H), 2,99-3,09 (м, 1H), 3,78 (с, 3H), 3,93-4,03 (м, 1H), 4,26-4,38 (м, 2H), 6,80-6,93 (м, 6H), 7,10-7,20 (м, 2H). Приклад 8: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-o-толілпіперидин Суміш 2-бромметил-2,3-дигідробензо[1,4]діоксину (35 мг, 0,15 ммоль), 3-(2метилфеніл)піперидину∙HCl (35 мг, 0,16 ммоль) і триетиламіну (38 мг, 0,38 ммоль) в ацетонітрилі (2 мл) нагрівали в мікрохвильовому реакторі при 140-150C протягом 12,5 год. Суміш абсорбували на діоксиді кремнію й очищали методом флеш-хроматографії, 17 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовуючи градієнт гептану й EtOAc як елюент, з одержанням 29 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,40-1,53 (м, 1H), 1,72-1,90 (м, 3H), 2,10-2,27 (м, 2H), 2,36 (с, 3H), 2,53-2,65 (м, 1H), 2,69-2,76 (м, 1H), 2,90-3,11 (м, 3H), 3,95-4,03 (м, 1H), 4,28-4,37 (м, 2H), 6,80-6,91 (м, 4H), 7,08-7,24 (м, 4H). Приклад 9: 4-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил) піперидин-3-іл]фенол Суміш 2-бромметил-2,3-дигідробензо[1,4]діоксину (47 мг, 0,20 ммоль), 4-(піперидин-3іл)фенолу∙HBr (53 мг, 0,20 ммоль) і KHCO3 (84 мг, 0,84 ммоль) в ацетонітрилі (2 мл) нагрівали в мікрохвильовому реакторі при 160C протягом 6,5 год. Суміш абсорбували на діоксиді кремнію й очищали методом флеш-хроматографії, використовуючи градієнт ДХМ і MeOH як елюент, з одержанням 6 мг вказаної в заголовку сполуки. 1 H ЯМР (CD3OD): 1,38-1,45 (м, 1H), 1,67-1,90 (м, 3H), 2,07-2,21 (м, 2H), 2,56-2,79 (м, 3H), 2,93-3,14 (м, 2H), 3,89-3,96 (м, 1H), 4,24-4,29 (м, 1H), 4,39-4,39 (м, 1H), 6,68-6,73 (м, 2H), 6,766,84 (м, 4H), 7,01-7,08 (м, 2H). Приклад 10: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(3-фторфеніл)піперидин Суміш 2-бромметил-2,3-дигідробензо[1,4]діоксину (340 мг, 0,48 ммоль), 3-(3фторфеніл)піперидину (323 мг, 2,50 ммоль) і триетиламіну (455 мг, 4,50 ммоль) в ацетонітрилі (3 мл) нагрівали в мікрохвильовому реакторі при 140C протягом 60 хв. Суміш абсорбували на діоксиді кремнію й очищали методом флеш-хроматографії, використовуючи градієнт гептану й EtOAc як елюент, з одержанням 213 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,35-1,50 (м, 1H), 1,64-1,83 (м, 2H), 1,88-1,97 (м, 1H), 2,08-2,25 (м, 2H), 2,53-2,65 (м, 1H), 2,67-2,75 (м, 1H), 2,79-2,89 (м, 1H), 2,89-2,99 (м, 1H), 2,99-3,09 (м, 1H), 3,954,04 (м, 1H), 4,28-4,38 (м, 2H), 6,80-6,98 (м, 6H), 6,97-7,01 (м, 7H), 7,21-7,29 (м, 1H). Приклад 11: 3-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил) піперидин-3-іл]фенол Суміш 2-бромметил-2,3-дигідробензо[1,4]діоксину (54 мг, 0,24 ммоль), 3-(піперидин-3іл)фенолу∙HBr (60 мг, 0,23 ммоль) і KHCO3 (84 мг, 0,84 ммоль) в ацетонітрилі (2 мл) нагрівали в мікрохвильовому реакторі при 160C протягом 5,5 год. Суміш абсорбували на діоксиді кремнію й очищали методом флеш-хроматографії, використовуючи градієнт ДХМ і MeOH (1 % триетиламін) як елюент, з одержанням 74 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,38-1,53 (м, 1H), 1,68-1,84 (м, 2H), 1,87-1,97 (м, 1H), 2,06-2,24 (м, 2H), 2,53-2,65 (м, 1H), 2,66-2,75 (м, 1H), 2,77-2,86 (м, 1H), 2,90-2,97 (м, 1H), 2,99-3,08 (м, 1H), 3,954,03 (м, 1H), 4,26-4,37 (м, 2H), 6,78-6,91 (м, 4H), 7,13-7,20 (м, 2H), 7,23-7,30 (м, 2H). Приклад 12: 2-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил) піперидин-3-іл]фенол Суміш 2-бромметил-2,3-дигідробензо[1,4]діоксину (54 мг, 0,24 ммоль), 2-(піперидин-3іл)фенолу∙HBr (61 мг, 0,24 ммоль) і KHCO3 (84 мг, 0,84 ммоль) в ацетонітрилі (2 мл) нагрівали в мікрохвильовому реакторі при 160C протягом 5,5 год. Суміш абсорбували на діоксиді кремнію й очищали методом флеш-хроматографії, використовуючи градієнт ДХМ і MeOH (1 % триетиламін) як елюент, з одержанням 11 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,51-1,63 (м, 1H), 1,69-1,87 (м, 3H), 2,20-2,41 (м, 2H), 2,57-2,75 (м, 2H), 2,86-3,14 (м, 2H), 2,66-2,75 (м, 1H), 3,22-3,31 (м, 1H), 3,88-3,95 (м, 1H), 4,24-4,30 (м, 1H), 4,314,39 (м, 1H) 6,78-6,91 (м, 4H), 7,13-7,20 (м, 2H), 7,23-7,30 (м, 2H). Приклад 13: (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(2-фторфеніл)піперидин (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(2-фторфеніл)піперидин-1-іл]метанон (10 мг, 0,0035 ммоль) обробляли BH3·ТГФ згідно з вищеописаною загальною методикою. Методом флеш-хроматографії отримували 2,7 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,45-1,57 (м, 1H), 1,73-1,81 (м, 2H), 1,87-1,94 (м, 1H), 2,18-2,29 (м, 2H), 2,59-2,68 (м, 1H), 2,68-2,75 (м, 1H), 2,76-2,85 (м, 1H), 2,91-2,98 (м, 1H), 3,00-3,09 (м, 1H), 3,974,06 (м, 1H), 4,28-4,37 (м, 2H), 6,79-6,80 (м, 4H), 6,97-7,05 (м, 1H), 7,06-7,12 (м, 1H), 7,15-7,23 (м, 1H), 7,23-7,33 (м, 1H). Приклад 14: (S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(2-фторфеніл)піперидин (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(S*)-3-(2-фторфеніл)піперидин-1-іл]метанон (25 мг, 0,073 ммоль) обробляли BH3·ТГФ згідно з вищеописаною загальною методикою. Методом флеш-хроматографії отримували 18 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,44-1,57 (м, 1H), 1,61-1,82 (м, 2H), 1,84-1,94 (м, 1H), 2,11-2,17 (м, 1H), 2,22-2,32 (м, 1H), 2,55-2,61 (м, 1H), 2,68-2,76 (м, 1H), 2,92-2,98 (м, 1H), 3,01-3,08 (м, 1H), 3,143,24 (м, 1H), 3,96-4,06 (м, 1H), 4,28-4,38 (м, 2H), 6,79-6,92 (м, 4H), 6,98-7,30 (м, 4H). Приклад 15: (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3-фторфеніл)піперидин (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(3-фторфеніл) піперидин-1-іл]метанон (1,21 г, 3,51 ммоль) обробляли BH3·ТГФ згідно з вищеописаною загальною методикою. Отримували 1,28 г неочищеного продукту. 18 UA 100695 C2 H ЯМР (CDCl3): 1,45-1,57 (м, 1H), 1,73-1,81 (м, 2H), 1,87-1,94 (м, 1H), 2,18-2,29 (м, 2H), 2,59-2,68 (м, 1H), 2,68-2,75 (м, 1H), 2,76-2,85 (м, 1H), 2,91-2,98 (м, 1H), 3,00-3,09 (м, 1H), 3,974,06 (м, 1H), 4,28-4,37 (м, 2H),6,79-6,80 (м, 4H), 6,97-7,05 (м, 1H), 7,06-7,12 (м, 1H), 7,15-7,23 (м, 1H), 7,23-7,33 (м, 1H). Приклад 16: (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3фторфеніл)піперидин∙HCl (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3-фторфеніл)піперидин (1,28 г, 3,91 ммоль) обробляли великим надлишком суміші 8 % HCl/EtOAC і упарювали досуха. Неочищену сіль розчиняли в киплячій суміші EtOAC/IPA. Осад утворювався при охолодженні. Фільтруванням одержували 657 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,45-1,57 (м, 1H), 1,73-1,81 (м, 2H), 1,87-1,94 (м, 1H), 2,18-2,29 (м, 2H), 2,59-2,68 (м, 1H), 2,68-2,75 (м, 1H), 2,76-2,85 (м, 1H), 2,91-2,98 (м, 1H), 3,00-3,09 (м, 1H), 3,974,06 (м, 1H), 4,28-4,37 (м, 2H), 6,79-6,80 (м, 4H), 6,97-7,05 (м, 1H), 7,06-7,12 (м, 1H), 7,15-7,23 (м, 1H), 7,23-7,33 (м, 1H). Приклад 17: (S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3-фторфеніл)піперидин (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(S*)-3-(3-фторфеніл) піперидин-1-іл]метанон (19 мг, 0,056 ммоль) обробляли BH3·ТГФ згідно з вищеописаною загальною методикою. Методом флеш-хроматографії отримували 11 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,38-1,49 (м, 1H), 1,65-1,82 (м, 2H), 1,88-1,97 (м, 1H), 2,07-2,25 (м, 2H), 2,53-2,63 (м, 1H), 2,67-2,76 (м, 1H), 2,80-2,90 (м, 1H), 2,92-3,10 (м, 2H), 3,94-4,04 (м, 1H), 4,274,40 (м, 2H), 6,76-7,04 (м, 7H), 7,20-7,30 (м, 1H). Приклад 18: (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(4-фторфеніл)піперидин (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(4-фторфеніл) піперидин-1-іл]метанон (20 мг, 0,058 ммоль) обробляли BH3·ТГФ згідно з вищеописаною загальною методикою. Методом флеш-хроматографії отримували 16 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,35-1,48 (м, 1H), 1,64-1,82 (м, 2H), 1,86-1,94 (м, 1H), 2,07-2,24 (м, 2H), 2,57-2,65 (м, 1H), 2,66-2,75 (м, 1H), 2,76-2,85 (м, 1H), 2,91-2,98 (м, 1H), 3,00-3,09 (м, 1H), 3,954,08 (м, 1H), 4,28-4,38 (м, 2H), 6,80-6,89 (м, 4H), 6,94-7,03 (м, 2H), 7,16-7,23 (м, 2H). Приклад 19: (S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(4-фторфеніл)піперидин (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(S*)-3-(4-фторфеніл) піперидин-1-іл]метанон (20 мг, 0,058 ммоль) обробляли BH3·ТГФ згідно з вищеописаною загальною методикою. Методом флеш-хроматографії отримували вказану в заголовку сполуку. 1 H ЯМР (CDCl3): 1,35-1,43 (м, 1H), 1,65-2,23 (м, 3H), 2,05-2,22 (м, 2H), 2,53-2,62 (м, 1H), 2,67-2,75 (м, 1H), 2,77-2,88 (м, 1H), 2,92-3,00 (м, 1H), 3,00-3,10 (м, 1H), 3,93-4,03 (м, 1H), 4,284,40 (м, 2H), 6,81-6,92 (м, 4H), 6,95-7,03 (м, 2H), 7,15-7,24 (м, 2H). Приклад 20: (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3трифторметилфеніл)піперидин (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(3-трифторметилфеніл) піперидин-1-іл]метанон (30 мг, 0,077 ммоль) обробляли BH3·ТГФ згідно з вищеописаною загальною методикою. Методом флеш-хроматографії отримували 16 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,40-1,55 (м, 1H), 1,65-1,85 (м, 2H), 1,89-1,99 (м, 1H), 2,15-2,28 (м, 2H), 2,59-2,64 (м, 1H), 2,70-2,77 (м, 1H), 2,84-2,99 (м, 2H), 3,03-3,12 (м, 1H), 3,98-4,04 (м, 1H), 4,294,38 (м, 2H), 6,78-6,90 (м, 4H), 7,38-7,54 (м, 4H). Приклад 21: (S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3трифторметилфеніл)піперидин (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(S*)-3-(3-трифторметилфеніл) піперидин-1-іл]метанон (29 мг, 0,074 ммоль) обробляли BH3·ТГФ згідно з вищеописаною загальною методикою. Методом флеш-хроматографії отримували 15 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,40-1,55 (м, 1H), 1,61-1,87 (м, 2H), 1,87-1,99 (м, 1H), 2,09-2,30 (м, 2H), 2,52-2,64 (м, 1H), 2,66-2,77 (м, 1H), 2,84-3,12 (м, 3H), 3,94-4,07 (м, 1H), 4,24-4,41 (м, 2H), 6,786,96 (м, 4H), 7,36-7,53 (м, 4H). Приклад 22: (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(4трифторметилфеніл)піперидин (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(4-трифторметилфеніл) піперидин-1-іл]метанон (18 мг, 0,046 ммоль) обробляли BH3·ТГФ згідно з вищеописаною загальною методикою. Методом флеш-хроматографії отримували 7,6 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,40-1,52 (м, 1H), 1,68-1,84 (м, 2H), 1,80-1,98 (м, 1H), 2,15-2,27 (м, 2H), 2,59-2,65 (м, 1H), 2,67-2,76 (м, 1H), 2,86-3,00 (м, 2H), 3,01-2,15 (м, 1H), 3,95-4,01 (м, 1H), 4,294,37 (м, 2H), 6,78-6,93 (м, 4H), 7,31-7,39 (м, 2H), 7,51-7,59 (м, 2H). 1 5 10 15 20 25 30 35 40 45 50 55 19 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 23: (S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(4трифторметилфеніл)піперидин (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(S*)-3-(4-трифторметилфеніл) піперидин-1-іл]метанон (13 мг, 0,033 ммоль) обробляли BH3·ТГФ згідно з вищеописаною загальною методикою. Методом флеш-хроматографії отримували 6 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,39-1,53 (м, 1H), 1,65-1,86 (м, 2H), 1,88-1,97 (м, 1H), 2,09-2,29 (м, 2H), 2,55-2,64 (м, 1H), 2,68-2,77 (м, 1H), 2,84-3,11 (м, 3H), 3,95-4,05 (м, 1H), 4,27-4,38 (м, 2H), 6,786,95 (м, 4H), 7,31-7,38 (м, 2H), 7,51-7,61 (м, 2H). Приклад 24: (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3метоксифеніл)піперидин (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(3-метоксифеніл) піперидин-1-іл]метанон (21 мг, 0,059 ммоль) обробляли BH3·ТГФ згідно з вищеописаною загальною методикою. Методом флеш-хроматографії отримували 7,0 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,40-1,51 (м, 1H), 1,69-1,82 (м, 2H), 1,89-1,96 (м, 1H), 2,15-2,23 (м, 2H), 2,56-2,64 (м, 1H), 2,67-2,75 (м, 1H), 2,75-2,85 (м, 1H), 2,91-2,84 (м, 1H), 3,02-3,10 (м, 1H), 3,80 (с, 3H), 3,95-4,01 (м, 1H), 4,28-4,35 (м, 2H), 6,73-6,92 (м, 7H), 7,19-7,25 (м, 1H). Приклад 25: (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3метоксифеніл)піперидин∙HCl Неочищений (R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3метоксифеніл)піперидин (2,5 г) тричі обробляли сумішшю 8 % HCl/EtOAc і упарювали досуха. Після кристалізації з гарячої суміші EtOAc/IPA (10 мл/2,5 мл) одержували 1,24 г вказаної в заголовку сполуки у вигляді майже білих кристалів. 1 H ЯМР (CD3OD): 1,72-1,88 (м, 1H), 1,93-2,22 (м, 3H), 3,04-3,27 (м, 4H), 3,39-3,56 (м, 2H), 3,64-3,79 (м, 2H), 3,99-4,08 (м, 1H), 4,29-4,35 (м, 1H), 4,29-4,40 (м, 1H), 4,75-4,90 (м, 1H), 6,846,94 (м, 4H), 7,00-7,17 (м, 3H), 7,34-7,43 (м, 1H). Приклад 26: (S*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]-3-(3метоксифеніл)піперидин (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(S*)-3-(3-метоксифеніл) піперидин-1-іл]метанон (21 мг, 0,059 ммоль) обробляли BH3·ТГФ згідно з вищеописаною загальною методикою. Методом флеш-хроматографії отримували 7,0 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,38-1,52 (м, 1H), 1,67-1,83 (м, 2H), 1,88-1,97 (м, 1H), 2,06-2,16, (м, 1H), 2,16-2,25 (м, 1H), 2,53-2,61 (м, 1H), 2,69-2,75 (м, 1H), 2,76-2,87 (м, 1H), 2,94-3,01 (м, 2H), 3,80 (с, 3H), 3,93-4,02 (м, 1H), 4,27-4,37 (м, 2H), 6,71-6,90 (м, 7H), 7,18-7,27 (м, 1H). Приклад 27: (R*)-3-{1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3-іл}фенол (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(3-гідроксифеніл) піперидин-1-іл]метанон (17,8 г, 54,7 ммоль) обробляли BH3·ТГФ згідно з вищеописаною загальною методикою. Кристалізацією з гарячого EtOH отримували 8,5 г вказаної в заголовку сполуки у вигляді майже білих кристалів. 1 H ЯМР (CD3OD): 1,40-1,54 (м, 1H), 1,71-1,82 (м, 2H), 1,84-1,93 (м, 1H), 2,12-2,23 (м, 2H), 2,59-2,74 (м, 2H), 2,74-2,83 (м, 1H), 2,99-3,14 (м, 1H), 3,92-3,98 (м, 1H), 4,24-4,31 (м, 1H), 4,334,39 (м, 1H), 6,59-6,63 (м, 1H), 6,66-6,68 (м, 1H), 6,69-6,74 (м, 1H), 6,76-6,83 (м, 4H), 7,06-7,12 (м, 1H). Приклад 28: (R*)-3-{1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3іл}фенол∙HCl (R)-2,3-дигідробензо[1,4]діоксин-2-іл-[(R*)-3-(3-гідроксифеніл) піперидин-1-іл]метанон (200 мг, 0,615 ммоль) розчиняли в EtOAc (4 мл). Додавали надлишок суміші 1 М HCl/діетиловий ефір. Осад фільтрували з одержанням 172 мг бажаної солі. 1 H ЯМР (CDCl3): 1,52-1,62 (м, 1H), 1,89-2,11 (м, 2H), 2,35-2,53 (м, 1H), 2,69-2,96 (м, 2H), 3,10-3,21 (м, 1H), 3,35-3,62 (м, 3H), 3,89-4,00 (м, 1H), 4,07-4,15 (м, 1H), 4,20-4,32 (м, 1H), 6,646,72 (м, 1H), 6,80-7,01 (м, 7H), 7,12-7,19 (м, 1H), 12,45 (шир., 1H). Приклад 29: (3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3іл}феніл)метанол Метиловий ефір (R*)-3-[1-((R)-2,3-дигідробензо[1,4]діоксин-2-карбоніл) піперидин-3іл]бензойної кислоти (R)-2,3-дигідробензо[1,4]діоксин-2-карбонілхлорид (240 мг, 1,21 ммоль) у ДХМ (5 мл) додавали до охолодженого льодом суміші метилового ефіру 3-(піперидин-3-іл)бензойної кислоти (267 мг, 1,21 ммоль), триетиламіну (59 мг, 0,58 ммоль) і ДХМ (10 мл). Після перемішування протягом 2 год. при КТ суміш промивали 1 М HCl (10 мл) і 1 М Na 2CO3. Органічну фазу сушили над Na2SO4, упарювали досуха й залишок очищали методом флешхроматографії, використовуючи гептан/EtOAc як елюент. Перший елюйований діастереомер збирали з одержанням 98 мг вказаної в заголовку сполуки. 20 UA 100695 C2 H ЯМР (CDCl3): 1,72-2,02 (м, 3H), 2,09-2,19 (м, 1H), 2,65-2,89 (м, 2H), 3,07-3,19 (м, 0,6H), 3,24-3,33 (м, 0,4H), 3,92 (с, 3H), 4,16-4,27 (м, 1H), 4,30-4,39 (м, 1H), 4,48-4,54 (м, 1H), 4,68-4,76 (м, 1H), 4,76-4,89 (м, 1H) 6,79-6,99 (м, 4H), 7,38-7,46 (м, 2H), 7,90-7,73 (м, 2H). (3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3-іл}феніл)метанол Метиловий ефір ((R*)-3-[1-((R)-2,3-дигідробензо[1,4]діоксин-2-карбоніл) піперидин-3іл]бензойної кислоти (54 мг, 0,147 ммоль) розчиняли в безводному ТГФ (4 мл) і охолоджували до 0C. Додавали LiAlH4 (26 мг, 0,680 ммоль) і суміш перемішували при КТ протягом 2 год. Повільно додавали воду (1 мл), 1 М NaOH (1 мл) і знову воду (1 мл). Суміш фільтрували через целіт і упарювали. Методом флеш-хроматографії, використовуючи градієнт гептан/EtOAc, одержували 3,5 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,47-1,60 (м, 1H), 1,72-1,85 (м, 2H), 1,89-1,96 (м, 1H), 2,17-2,26 (м, 2H), 2,60-2,74 (м, 2H), 2,59-2,75 (м, 2H), 2,82-2,91 (м, 1H), 4,06-4,14 (м, 1H), 4,25-4,31 (м, 1H), 4,324,30 (м, 1H), 4,58 (с, 2H), 6,75-6,85 (м, 4H), 7,13-7,22 (м, 2H), 7,23-7,35 (м, 2H). Приклад 30: 3-{(S)-1-[(R*)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3іл}феніловий ефір оцтової кислоти∙HCl Ацетилхлорид (58 мг, 0,74 ммоль) додавали до розчину (R*)-3-{1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3-іл}фенолу (198 мг, 0,608 ммоль) і триетиламіну (75 мг, 0,74 ммоль) у ДХМ (5 мл). Суміш перемішували протягом 40 хв, промивали водою, сушили над Na2SO4 і упарювали досуха. Неочищений продукт обробляли надлишком суміші EtOAc/HCl і упарювали досуха. Перекристалізацією з гарячої суміші EtOAc/IPA одержували 60 мг вказаної в заголовку сполуки. 1 H ЯМР (CD3OD): 1,69-1,85 (м, 1H), 1,91-2,18 (м, 3H), 2,28 (с, 3H), 3,05-3,36 (м, 4H), 3,453,60 (м, 1H), 3,64-3,86 (м, 1H), 4,00-4,08 (м, 1H), 4,25-4,42 (м, 1H), 4,71-4,80 (м, 2H), 6,84-6,94 (м, 4H), 7,01-7,10 (м, 2H), 7,18-7,23 (м, 1H), 7,37-7,43 (м, 1H). Приклад 31: 2-(3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3іл}фенокси)етанол (R*)-3-{1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3-іл}фенол (51 мг), K2CO3 (28 мг, 0,20 ммоль), 2-хлоретанол і MeCN (2 мл) нагрівали з використанням мікрохвильового випромінювання при 80-105C протягом 6 год. Розчинник видаляли й залишок поглинали ДХМ. Даний розчин промивали водою й 1 М NaOH і упарювали досуха. Методом флеш-хроматографії (гептан/EtOAc) одержували 3 мг вказаноїв заголовку сполуки. 1 H ЯМР (CD3OD): 1,44-1,56 (м, 1H), 1,69-1,84 (м, 2H), 1,85-1,94 (м, 1H), 2,14-2,26 (м, 2H), 2,58-2,74 (м, 2H), 2,76-2,87 (м, 1H), 2,98-3,16 (м, 2H), 3,83-3,89 (м, 2H), 3,89-3,97 (м, 2H), 3,994,06 (м, 2H), 4,24-4,31 (м, 1H), 4,33-4,39 (м, 1H), 6,76-6,88 (м, 7H), 7,16-7,23 (м, 1H). Приклад 32: 3-(3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3іл}фенокси) пропан-1-ол (R*)-3-{1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3-іл}фенол (208 мг, 0,64 ммоль), K2CO3 (103 мг, 0,74 ммоль), 1-пропанол (86 мг, 0,62 ммоль) і MeCN (5 мл) нагрівали з використанням мікрохвильового випромінювання при 105C протягом 6 год. Додавали ще K2CO3 (103 мг) і 1-пропанол (86 мг) і нагрівання продовжували протягом 2 год. Розчинник видаляли й залишок поглинали ДХМ. Цей розчин промивали водою й 1 М NaOH і упарювали досуха. Методом флеш-хроматографії (гептан/EtOAc) одержували 76 мг вказаної в заголовку сполуки. 1 H ЯМР (CD3OD): 1,44-1,56 (м, 1H), 1,64-1,84 (м, 2H), 1,84-1,93 (м, 1H), 1,93-2,00 (м, 2H), 2,15-2,26 (м, 2H), 2,59-2,74 (м, 2H), 2,76-2,86 (м, 1H), 2,98-3,16 (м, 2H), 3,70-3,76 (м, 2H), 3,903,97 (м, 1H), 4,02-4,09 (м, 2H), 4,25-4,30 (м, 1H), 4,32-4,38 (м, 1H), 6,72-6,84 (м, 7H), 7,14-7,22 (м, 1H). Приклад 33: 3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3іл}феніловий ефір трифторметансульфонової кислоти (R*)-3-{1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3-іл}фенол (1,77 г, 5,44 ммоль) розчиняли в ДХМ (10 мл) в інертній атмосфері. Додавали триетиламін (0,58 г, 5,71 ммоль) і суміш охолоджували до -30C. По краплях додавали ангідрид трифторметансульфонової кислоти (1,61 г, 5,71 ммоль). Охолоджуючу баню видаляли й суміш перемішували протягом 1 год. Суміш промивали водою (210 мл) і упарювали досуха. Методом колонкової хроматографії, використовуючи градієнт ДХМ:MeOH як елюент, одержували 1,1 г вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,38-1,51 (м, 1H), 1,65-1,84 (м, 2H), 1,89-1,99 (м, 1H), 2,11-2,28 (м, 2H), 2,57-2,64 (м, 1H), 2,68-2,75 (м, 1H), 2,83-3,09 (м, 3H), 3,96-4,03 (м, 1H), 4,26-4,38 (м, 2H), 6,806,92 (м, 4H), 7,08-7,18 (м, 2H), 7,25-7,34 (м, 1H), 7,36-7,41 (м, 1H). Приклад 34: (3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3іл}фенокси)оцтова кислота 1 5 10 15 20 25 30 35 40 45 50 55 60 21 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 До розчину (R*)-3-{1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3-іл}фенолу (201 мг, 0,62 ммоль) у безводному ДМФА (2 мл) додавали NaH (60 % розчин у маслі, 30 мг, 0,75 ммоль) в атмосфері азоту й суміш перемішували при 0C протягом 5 хв., потім давали нагрітися до КТ і додатково перемішували протягом 2,5 год. Реакційну суміш охолоджували до 0C, додавали етилбромацетат (106 мг, 0,62 ммоль) і суміш перемішували при КТ протягом ночі. Додавали трет-бутоксид калію (69 мг, 0,61 ммоль) і суміш перемішували протягом 3 год. при КТ і фільтрували. Осад розчиняли в безводному MeOH, розчин фільтрували й упарювали досуха з одержанням 170 мг вказаної в заголовку сполуки. 1 H ЯМР (ДМСО-d6): 1,33-1,46 (м, 1H), 1,52-1,73 (м, 2H), 1,74-1,83 (м, 1H), 2,04-2,17 (м, 2H), 2,56-2,73 (м, 3H), 2,88-2,98 (м, 2H), 3,93-3,99 (м, 1H), 4,06 (с, 2H), 4,27-4,39 (м, 2H), 6,59-6,64 (м, 1H), 6,69-6,88 (м, 6H), 7,11 (т, 1H, J=6,8 Гц). Приклад 35: 3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3іл}бензонітрил Суміш 3-{(R*)-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил] піперидин-3-іл}фенілового ефіру трифторметансульфонової кислоти (51 мг, 0,11 ммоль), ціаніду трибутилолова (142 мг, 0,45 ммоль) і тетракіс(трифенілфосфін)паладію (189 мг, 0,164 ммоль) в 1, 2-дихлоретані (15 мл) нагрівали в мікрохвильовому реакторі при 80C протягом 80 год. Твердий осад відфільтровували й суміш упарювали досуха. Залишок перерозчиняли в ДХМ, фільтрували й двічі промивали 1 М HCl. Об'єднані органічні фази промивали насиченим розчином солі, сушили (Na2SO4) і упарювали досуха. Неочищений продукт очищали методом флеш-хроматографії, спочатку використовуючи градієнт ДХМ і MeOH, а потім використовуючи градієнт гептану й EtOAc як елюент, з одержанням 2,8 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,48-1,59 (м, 1H), 1,70-1,84 (м, 2H), 1,89-1,94 (м, 1H), 2,19-2,32 (м, 2H), 2,61-2,75 (м, 2H), 2,89-3,10 (м, 3H), 3,93-3,98 (м, 1H), 4,26-4,35 (м, 1H), 4,35-4,40 (м, 1H), 6,766,84 (м, 3H), 7,43-7,60 (м, 5H). Приклад 36: 3-бензо[1,3]діоксол-5-іл-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2іл)метил]піперидин 3-Бензо[1,3]діоксол-5-ілпіридин Суміш 3,4-(метилендіокси)фенілборонової кислоти (500 мг, 3,0 ммоль), 3-бромпіридину (290 мкл, 476 мг, 3,0 ммоль), 2 М Na2CO3 (3,05 мл, 6,0 ммоль), тетракіс(трифенілфосфін)паладію (35 мг, 0,03 ммоль), EtOH (0,75 мл) і толуолу (3 мл) нагрівали у мікрохвильовому реакторі при 120C протягом 40 хв. Додавали іншу порцію 3,4-(метилендіокси)фенілборонової кислоти (250 мг, 1,5 ммоль) і суміш нагрівали з використанням мікрохвильового випромінювання при 120C протягом 10 хв. Реакційну суміш фільтрували й шари розділяли. Органічну фазу екстрагували двічі 1 М HCl. Всі водні фази об'єднували, підлуговували 5 М NaOH і екстрагували двічі EtOAc. Об'єднані органічні фази сушили (Na2SO4), фільтрували й упарювали з одержанням 585 мг вказаної в заголовку сполуки. 1 H ЯМР (ДМСО-d6): 6,08 (с, 2H), 7,03-7,06 (м, 1H), 7,19-7,24 (м, 1H), 7,33-7,35 (м, 1H), 7,427,46 (м, 1H), 7,99-8,03 (м, 1H), 8,52 (дд, 1H, J=1,77, 4,80 Гц), 8,84 (дд, 1H, J=2,65, 0,88 Гц). 3-Бензо[1,3]діоксол-5-ілпіперидин∙HCl 3-бензо[1,3] діоксол-5-ілпіридин (578 мг, 2,9 ммоль), гідрат PtO2 (58 мг), метанол (20 мл) і концентровану HCl (2 мл) завантажували в реакційну посудину Парра й гідрували (55 фунтів на кв. дюйм) протягом 4 год. Реакційну суміш фільтрували й упарювали досуха. Неочищений продукт кристалізували із суміші EtOAc/IPA з одержанням 226 мг вказаної в заголовку сполуки. 1 H ЯМР (CD3OD): 1,71-1,91 (м, 2H), 1,96-2,08 (м, 2H), 2,85-2,95 (м, 1H), 2,96-3,06 (м, 2H), 3,32-3,46 (м, 2H), 5,92 (с, 2H), 6,73-6,83 (м, 3H). (3-Бензо[1,3]діоксол-5-ілпіперидин-1-іл-(R)-2,3-дигідробензо[1,4]діоксин-2-ілметанон Суміш (R)-2,3-дигідробензо[1,4]діоксин-2-карбонової кислоти (167 мг, 0,93 ммоль), тіонілхлориду (338 мкл, 551 мг, 4,63 ммоль) і безводного толуолу нагрівали при 95C протягом 1,5 год. і потім упарювали досуха. Додавали толуол і упарювання повторювали. Упарений залишок розчиняли в ДХМ (2 мл) і повільно додавали до холодного розчину (0C) 3-бензо[1,3] діоксол-5-ілпіперидину·HCl (224 мг, 0,93 ммоль) і DIPEA (0,324 мл, 240 мг, 1,85 ммоль) в ДХМ (5 мл). Реакційну суміш перемішували протягом 1 год. 45 хв. при КТ. Додавали воду, шари розділяли і органічну фазу промивали двічі 1 М HCl і насиченим NaHCO 3. Органічну фазу сушили (Na2SO4), фільтрували і упарювали з отриманням 290 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,56-1,77 (м, 2H), 1,82-1,97 (м, 1H), 2,03-2,14 (м, 1H), 2,52-2,73 (м, 2H), 2,85-3,25 (м, 1H), 4,10-4,22 (м, 1H), 4,29-4,38 (м, 1H), 4,45-4,55 (м, 1H), 4,63-4,73 (м, 1H), 4,784,91 (м, 1H), 5,94 (с, 2H), 6,64-6,97 (м, 7H). 3-Бензо[1,3]діоксол-5-іл-1-[(S)-1-(2,3-дигідробензо[1,4]діоксин-2-іл)метил]піперидин 22 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 (3-Бензо[1,3]діоксол-5-ілпіперидин-1-іл-(R)-2,3-дигідробензо[1,4]діоксин-2-ілметанон (285 мг, 0,77 ммоль) розчиняли в безводному ДМФА (2,5 мл) і 1 М BH 3·ТГФ (3,10 мл, 3,10 ммоль) повільно додавали в атмосфері азоту. Реакційну суміш перемішували протягом 4,5 год. при КТ і потім охолоджували до 0C. Повільно додавали воду, суміш підлуговували 2,5 М NaOH і екстрагували три рази EtOAc. Об'єднані органічні фази сушили (Na 2SO4), фільтрували і упарювали досуха. Неочищений продукт розчиняли в метанолі (25 мл) і повільно додавали 5 М HCl (1,5 мл). Суміш перемішували протягом 1 год. при КТ і потім при 60C протягом 2 год. Реакційну суміш упарювали досуха, перерозчиняли в EtOAc і промивали двічі 1 М Na 2CO3 і водою. Об'єднані органічні фази сушили (Na2SO4), фільтрували і упарювали досуха з отриманням 228 мг вказаної в заголовку сполуки. 1 H ЯМР (CDCl3): 1,33-1,46 (м, 1H), 1,63-1,82 (м, 2H), 1,85-1,94 (м, 1H), 2,05-2,21 (м, 2H), 2,53-2,63 (м, 1H), 2,66-2,81 (м, 2H), 2,90-2,98 (м, 1H), 2,98-3,07 (м, 1H), 3,94-4,03 (м, 1H), 4,274,36 (м, 2H), 5,92 (с, 2H), 6,66-6,71 (м, 1H), 6,72-6,76 (м, 2H), 6,79-6,90 (м, 4H). Приклад 37: 3-[(R*)-1-((S)-6-бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3іл]фенол 1-[4-Бензилокси-2-((R)-1-оксиранілметокси)феніл]етанон До перемішуваного розчину 1-(4-(бензилокси)-2-гідроксифеніл)етанону (3,36 г, 13,9 ммоль) у безводному ДМФА (15 мл) додавали NaH (0,62 г, 15,5 ммоль). Суміші давали перемішуватися при КТ протягом 30 хв і по краплях додавали розчин (R)-оксиран-2-ілметил-4метилбензолсульфонату (3,17 г, 13,9 ммоль) у ДМФА при КТ. Суміш повільно нагрівали до 60C і перемішували протягом 3 год. Реакцію гасили додаванням води (80 мл) і екстрагували три рази EtOAc. Об'єднані органічні шари екстрагували двічі водним 1 М NaOH і промивали водою й насиченим розчином солі. Органічний шар сушили Na2SO4 і концентрували. Отриманий неочищений продукт очищали методом колонкової хроматографії із сумішшю EtOAc/гептан (1:1) як елюент, одержуючи вказану в заголовку сполуку (2,64 г) у вигляді твердої речовини білого кольору. 1 H ЯМР (CDCl3): 2,63 (с, 3H), 2,76 (м, 1H), 2,94 (т, 1H), 3,39 (м, 1H), 3,96 (дд, 1H), 4,32 (дд, 1H), 5,10 (с, 2H), 6,52 (д, 1H), 6,62 (дд, 1H), 7,34-7,44 (м, 5H), 7,84 (д, 1H). 4-Бензилокси-2-((R)-1-оксиранілметокси)феніловий ефір оцтової кислоти До перемішуваного розчину 1-[4-бензилокси-2-((R)-1-оксиранілметокси)феніл]етанону (1,62 г, 5,43 ммоль) у ДХМ (60 мл) додавали м-хлорпербензойну кислоту (2,15 г) і твердий NaHCO 3 (3,24 г). Перемішування продовжували при 40C протягом 1 год. Суміш фільтрували й фільтрат однократно промивали 10 % розчином NaHSO4, а потім двічі розчином NaHCO3. Органічний шар промивали водою й насиченим розчином солі, сушили Na2SO4. Розчинник видаляли при зниженому тиску. Отриманий неочищений продукт (1,34 г) був досить чистим для використання на наступній стадії. 1 H ЯМР (CDCl3): 2,30 (с, 3H), 2,71 (м, 1H), 2,87 (т, 1H), 3,30 (м, 1H), 3,94 (дд, 1H), 4,21 (дд, 1H), 5,02 (с, 2H), 6,54 (дд, 1H), 6,64 (д, 1H), 6,94 (д, 1H), 7,33-7,42 (м, 5H). ((S)-6-Бензилокси-2,3-дигідробензо[1,4]діоксин-2-іл)метанол До перемішуваного розчину 4-бензилокси-2-((R)-1-оксиранілметокси)фенілового ефіру оцтової кислоти (1,34 г, 4,26 ммоль) у ТГФ (30 мл) додавали водний 2 М NaOH (2,45 мл). Суміш перемішували протягом ночі при КТ, ТГФ видаляли при зниженому тиску й додавали воду (50 мл). Потім водний розчин екстрагували три рази EtOAc і об'єднані екстракти промивали водою й насиченим розчином солі. Органічний шар сушили (Na 2SO4) і упарювали у вакуумі. Неочищений продукт (1,07 г) використовували без очищення. 1 H ЯМР (CDCl3): 1,96 (шир.с, 1H), 3,80-3,91 (м, 2H), 4,08 (м, 1H), 4,11 (м, 1H), 4,27 (дд, 1H), 4,99 (с, 2H), 6,50-6,54 (м, 2H), 6,80 (д, 1H), 7,30-7,42 (м, 5H). (R)-6-Бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметиловий ефір метансульфонової кислоти До перемішуваного розчину неочищеного ((S)-6-бензилокси-2,3-дигідробензо[1,4]діоксин-2іл)метанолу (1,65 г, 6,06 ммоль) у безводному ДХМ (10 мл) додавали триетиламін (0,88 мл). Суміш охолоджували до 0C і в реакційну суміш повільно по краплях додавали метансульфонілхлорид (0,49 мл). Суміш перемішували при КТ протягом 1 год. і потім додавали 10 мл водної 1 М HCl. Суміш екстрагували двічі ДХМ. Об'єднані органічні шари промивали водою й насиченим розчином солі, сушили Na2SO4. Розчинники видаляли при зниженому тиску й неочищений продукт (2,22 г) кристалізували з IPA (15 мл), одержуючи тверду речовину білого кольору (1,50 г). 1 H ЯМР (CDCl3): 3,08 (с, 3H), 4,11 (м, 1H), 4,28 (д, 1H), 4,42 (с, 3H), 4,98 (с, 2H), 6,51-6,55 (м, 2H), 6,79 (д, 1H), 7,31-7,42 (м, 5H). 3-[(R*)-1-((S)-6-бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол 23 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 До розчину (R)-6-бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметилового ефіру метансульфонової кислоти (129 мг, 0,368 ммоль) і (R*)-3-(піперидин-3-іл)фенолу∙HBr (100 мг, 0,387 ммоль) в ацетонітрилі додавали твердий KI (40 мг) і NaHCO 3 (98 мг 1,162 ммоль). Суміш нагрівали з використанням мікрохвильового випромінювання при 150C протягом 1 год. Твердий продукт відфільтровували й розчинник випарювали при зниженому тиску. Залишок розчиняли в ДХМ і промивали двічі водою й насиченим розчином солі. Органічну фазу сушили (Na 2SO4) і упарювали у вакуумі. Залишок очищали методом колонкової флеш-хроматографії (EtOAc/гептан) з одержанням бажаного продукту (66,2 мг). 1 H ЯМР (CDCl3): 1,42-1,49 (м, 1H), 1,74-1,77 (м, 2H), 1,91 (д, 1H), 2,14-2,20 (м, 2H), 2,59 (дд, 1H), 2,68-2,73 (дд, 1H), 2,79-2,85 (м, 1H), 2,97 (д, 1H), 3,13 (д, 1H), 3,96 (дд, 1H), 4,24-4,29 (м, 2H), 4,96 (с, 2H), 6,46 (дд, 1H), 6,53 (д, 1H), 6,66-6,80 (м, 4H), 6,75 (1H, м), 7,17 (т, 1H), 7,30-7,42 (м, 5H). Приклад 38: (S)-2-[(R*)-3-(3-гідроксифеніл)піперидин-1-ілметил]-2,3дигідробензо[1,4]діоксин-6-ол До 10 % розчину Pd/C (33 мг) в EtOAc (10 мл) додавали 3-[(R*)-1-((S)-6-бензилокси-2,3дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол (66 мг, 0,125 ммоль). Суміш перемішували в атмосфері водню протягом 3 год. при нормальному тиску. Суміш потім фільтрували й упарювали з одержанням масла. Після розтирання з діетиловим ефіром одержували вказану в заголовку сполуку у вигляді твердої речовини білого кольору (40 мг). 1 H ЯМР (ДМСО-d6): 1,30-1,40 (м, 1H), 1,53-1,69 (м, 2H), 1,78 (д, 1H), 2,04-2,11 (м, 2H), 2,56 (м, 2H), 2,61-2,67 (м, 1H), 2,90 (дд, 2H), 3,89 (дд, 1H), 4,21-4,26 (м, 2H), 6,20-6,25 (м, 2H), 6,576,68 (м, 4H), 7,06 (т, 1H), 8,90 (с, 1H), 9,21 (с, 1H). Приклад 39: 3-[(R*)-1-((S)-7-бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3іл]фенол 1-[5-Бензилокси-2-((R)-1-оксиранілметокси)феніл]етанон До перемішуваного розчину 1-(5-бензилокси-2-гідроксифеніл)етанону (3,0 г, 12,4 ммоль) у безводному ДМФА (15 мл) додавали NaH (0,55 г, 13,6 ммоль). Суміші давали перемішуватися при КТ протягом 30 хв. і потім нагрівали до 60C. Розчин (R)-оксиран-2-ілметил 4метилбензолсульфонату (2,83 г, 12,4 ммоль) у ДМФА додавали по краплях при 60C протягом 1 год. Потім перемішування продовжували при 60C протягом 3 год. Охолоджену реакцію гасили додаванням води (80 мл) і екстрагували три рази EtOAc. Об'єднані органічні шари екстрагували двічі водним 1 М NaOH і промивали водою й насиченим розчином солі. Органічний шар сушили Na2SO4 і концентрували. Отриманий неочищений продукт очищали методом колонкової хроматографії із сумішшю EtOAc/толуол як елюент, одержуючи вказану в заголовку сполуку (2,35 г) у вигляді твердої речовини білого кольору. 1 H ЯМР (CDCl3): 2,67 (с, 3H), 2,75 (м, 1H), 2,93 (т, 1H), 3,37-3,40 (м, 1H), 3,96 (дд, 1H), 4,32 (дд, 1H), 5,04 (с, 2H), 6,89 (д, 1H), 7,08 (дд, 1H), 7,32-7,43 (м, 6H). 5-Бензилокси-2-((R)-1-оксиранілметокси)феніловий ефір оцтової кислоти До перемішуваного розчину 1-[5-бензилокси-2-((R)-1-оксиранілметокси)феніл]етанону (1,0 г, 3,36 ммоль) у ДХМ (20 мл) додавали м-хлорпербензойну кислоту (1,24 г) і твердий NaHCO 3 (3,24 г). Суміш перемішували при КТ протягом 3 днів. Суміш фільтрували й фільтрат промивали однократно 10 % розчином NaHSO4 і потім двічі розчином NaHCO3. Органічний шар промивали водою й насиченим розчином солі й сушили Na 2SO4. Розчинник видаляли при зниженому тиску. Залишок розтирали з ефіром, одержуючи вказану в заголовку сполуку (0,55 г) у вигляді твердої речовини білого кольору, що використовували без очищення. 1 H ЯМР (CDCl3): 2,32 (с, 3H), 2,70 (м, 1H), 2,86 (дд, 1H), 3,29-3,30 (м, 1H), 3,92 (дд, 1H), 4,19 (дд, 1H), 5,00 (с, 2H), 6,73 (д, 1H), 6,79 (дд, 1H), 6,94 (д, 1H), 7,33-7,42 (5H, м). ((S)-7-бензилокси-2,3-дигідробензо[1,4]діоксин-2-іл)метанол До перемішуваного розчину 5-бензилокси-2-((R)-1-оксиранілметокси)фенілового ефіру оцтової кислоти (0,5 г, 1,59 ммоль) у ТГФ (10 мл) додавали водний 2 М NaOH (1,04 мл). Після перемішування протягом ночі при КТ ТГФ видаляли при зниженому тиску й додавали воду (20 мл). Водний розчин потім двічі екстрагували EtOAc. Об'єднані органічні шари промивали водою й насиченим розчином солі, сушили (Na2SO4) і упарювали у вакуумі. Неочищений продукт (0,45 г) використовували без очищення. 1 H ЯМР (CDCl3): 1,89 (т, 1H), 3,83-3,91 (м, 2H), 4,06 (дд, 1H), 4,23-4,28 (м, 2H), 4,99 (с, 2H), 6,50 (дд, 1H), 6,56 (д, 1H), 6,79 (д, 1H), 7,26-7,41 (м, 5H). (R)-7-бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметиловий ефір метансульфонової кислоти Одержували відповідно до методики, описаної вище для (R)-6-бензилокси-2,3дигідробензо[1,4]діоксин-2-ілметилового ефіру метансульфонової кислоти. 24 UA 100695 C2 H ЯМР (CDCl3): 3,07 (с, 3H), 4,07 (дд, 1H), 4,27 (д, 1H), 4,44-4,49 (м, 3H), 4,99 (с, 2H), 6,516,54 (м, 2H), 6,81 (д, 1H), 7,32-7,37 (м, 5H). 3-[(R*)-1-((S)-7-бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол Одержували відповідно до методики, описаної вище для 3-[(R*)-1-((S)-6-бензилокси-2,3дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенолу. 1 H ЯМР (CDCl3): 1,38-1,48 (м, 1H), 1,75 (м, 2H), 1,89 (д, 1H), 2,10-2,16 (м, 2H), 2,55 (дд, 1H), 2,70 (дд, 1H), 2,83 (т, 1H), 3,01 (д, 1H), 3,11 (д, 1H), 3,90 (дд, 1H), 4,18 (дд, 1H), 4,33-4,38 (м, 1H), 4,99 (с, 2H), 6,43-6,78 (м, 6H), 7,14 (т, 1H), 7,28-7,41 (м, 5H). Приклад 40: (S)-3-[(R*)-3-(3-гідроксифеніл)піперидин-1-ілметил]-2,3дигідробензо[1,4]діоксин-6-ол Одержували відповідно до методики, описаної вище для (S)-2-[(R*)-3-(3гідроксифеніл)піперидин-1-ілметил]-2,3-дигідробензо[1,4]діоксин-6-олу. 1 H ЯМР (ДМСО-d6): 1,33-1,37 (м, 2H), 1,57-1,79 (м, 2H), 2,02-2,12 (м, 1H), 2,55-2,67 (м, 2H), 2,91 (дд, 2H), 3,86 (дд, 1H), 4,19 (дд, 1H), 4,29 (м, 1H), 6,20-6,22 (м, 2H), 6,57-6,68 (м, 4H), 7,06 (т, 1H), 8,90 (с, 1H), 9,21 (с, 1H). Приклад 41: 3-[(R*)-1-((S)-8-бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3іл]фенол (R)-8-бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметиловий ефір метансульфонової кислоти Одержували відповідно до методики, описаної вище для (R)-6-бензилокси-2,3дигідробензо[1,4]діоксин-2-ілметилового ефіру метансульфонової кислоти. 1 H ЯМР (CDCl3): 2,96 (с, 3H), 4,08 (дд, 1H), 4,29 (д, 1H), 4,41-4,54 (м, 3H), 5,06 (с, 2H), 6,58 (дд, 2H), 6,79 (т, 1H), 7,32-7,41 (м, 5H). 3-[(R*)-1-((S)-8-бензилокси-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенол Одержували відповідно до методики, описаної вище для 3-[(R*)-1-((S)-6-бензилокси-2,3дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-іл]фенолу. 1 H ЯМР (CDCl3): 1,35-1,45 (м, 1H), 1,71-1,75 (м, 2H), 1,87 (д, 1H), 2,20-2,28 (м, 2H), 2,65 (дд, 1H), 2,75-2,80 (м, 2H), 2,94 (д, 1H), 3,10 (д, 1H), 3,99 (дд, 1H), 4,27 (дд, 1H), 4,37-4,40 (м, 1H), 5,08 (с, 2H), 6,49-6,59 (м, 2H), 6,63-6,78 (м, 4H), 7,11 (т, 1H), 7,25-7,47 (м, 5H). Приклад 42: (S)-3-[(R*)-3-(3-гідроксифеніл)піперидин-1-ілметил]-2,3дигідробензо[1,4]діоксин-5-ол Одержували відповідно до методики, описаної вище для (S)-2-[(R*)-3-(3гідроксифеніл)піперидин-1-ілметил]-2,3-дигідробензо[1,4]діоксин-6-олу. 1 H ЯМР (CDCl3): 1,52-1,56 (м, 1H), 1,70-2,17 (м, 4H), 2,14 (т, 1H), 2,41 (дд, 1H), 2,93 (дд, 1H), 3,06 (т, 1Н), 3,32-3,35 (м, 2H), 3,89 (дд, 1H), 4,25 (дд, 1H), 4,48 (т, 1H), 6,42 (дд, 1H), 6,54 (дд, 1H), 6,69-6,77 (м, 2H), 6,85-6,87 (м, 2H), 7,23 (т, 1H), 8,2-8,9 (шир.с, 2H). Приклад 43: (R*)-3-[1-((S)-7-фтор-2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3іл]фенол Суміш (R)-(7-фтор-2,3-дигідробензо[1,4]діоксин-2-іл)метилового ефіру метансульфонової кислоти (51 мг, 0,19 ммоль), (R*)-3-(піперидин-3-іл)фенолу·HBr (50 мг, 0,19 ммоль) і NaHCO3 (33 мг, 0,39 ммоль) в ДМФА (3,5 мл) нагрівали при 120C протягом 1,5 год. Воду (10 мл) додавали до охолодженої суміші, яку потім екстрагували EtOAc (310 мл). Об'єднані органічні шари промивали декілька раз водою і вкінці двічі насиченим розчином солі. Сушінням (Na2SO4), фільтруванням і випарюванням розчинника отримували неочищений продукт, який перекристалізовували из EtOH з отриманням 24 мг вказаної в заголовку сполуки у вигляді твердої речовини білого кольору. 1 H ЯМР (CDCl3): 1,35-1,82 (м, 4H), 1,92 (шир.д, 1H), 2,10-2,22 (м, 2H), 2,58 (дд, J=13,2 і 6 Гц, 1H), 2,69 (дд, J=13,2 і 6 Гц, 1H), 2,75-2,85 (м, 1H), 2,95 (шир.д, 1H), 3,06 (шир.д, 1H), 3,92-3,99 (м, 1H), 4,25-4,37 (м, 2H), 6,50-6,82 (м, 6H), 7,17 (дд, J=7,5 Гц, 1H). Приклад 44: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-5-метил-1,2,3,6-тетрагідропіридин 2-Бромметил-2,3-дигідробензо[1,4]діоксин (500 мг, 2,18 ммоль) і 3-піколін (203 мг, 2,18 ммоль) нагрівали при кипінні зі зворотним холодильником у ксилолі (2 мл) протягом 4 год. Після охолодження розчинник декантували з одержанням неочищеної маслянистої солі піколінію, що розчиняли в MeOH (5 мл). У суміш, охолоджену льодом, додавали малими порціями NaBH 4 (330 мг, 4 екв.). Після перемішування протягом 2 год. при КТ випарювали MeOH, додавали воду й суміш екстрагували EtOAc. Сушінням (Na2SO4), фільтруванням і упарюванням одержували неочищений продукт, що очищали методом флеш-хроматографії (гептан/EtOAc). 1 H ЯМР (CDCl3): 1,65 (с, 3H), 2,10-2,18 (м, 2H), 2,50-2,80 (м, 4H), 2,86-3,04 (м, 2H), 3,95-4,05 (м, 1H), 4,28-4,40 (м, 2H), 5,45 (м, 1H), 6,77-6,90 (м, 4H). Приклад 45: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3,5-диметил-1,2,3,61 5 10 15 20 25 30 35 40 45 50 55 60 25 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 тетрагідропіридин Слідуючи вищеописаній методиці, 2-бромметил-2,3-дигідробензо[1,4]діоксин (856 мг, 3,73 ммоль) і 3, 5-лутидин (400 мг, 3,73 ммоль) нагрівали при кипінні зі зворотним холодильником у ксилолі (2 мл) протягом 4,5 год. Відновленням неочищеної солі лутидинію з використанням NaBH4 в MeOH одержували неочищений вказаний у заголовку продукт, що очищали методом флеш-хроматографії (гептан/EtOAc). 1 H ЯМР (CDCl3): 0,95 (д, J=7 Гц, 3H), 1,64 (с, 3H), 2,08 (м, 1H), 2,35 (м, 1H), 2,60-3,08 (м, 5H), 3,95-4,03 (м, 1H), 4,28-4,37 (м, 2H), 5,31 (с, 1H), 6,78-6,90 (м, 4H). Приклад 46: [1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,5,6-тетрагідропіридин-3іл]метанол Як описано вище, 2-бромметил-2,3-дигідробензо[1,4]діоксин (500 мг, 2,18 ммоль) і піридин3-ілметанол (238 мг, 2,18 ммоль) нагрівали при кипінні зі зворотним холодильником у ксилолі (2 мл) протягом 4 год. Відновленням неочищеної солі піридинію з використанням NaBH 4 в MeOH одержували неочищений вказаний у заголовку продукт, що очищали методом флешхроматографії (гептан/EtOAc). 1 H ЯМР (CDCl3): 2,15-2,25 (м, 2H), 2,55-2,82 (м, 4H), 3,03-3,18 (м, 2H), 3,95-4,05 (м, 1H), 4,03 (с, 2H), 4,27-4,40 (м, 2H), 5,75 (м, 1H), 6,77-6,90 (м, 4H). Приклад 47: 2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,3,4,5,6,7,8-октагідроізохінолін Як описано вище, 2-бромметил-2,3-дигідробензо[1,4]діоксин (500 мг, 2,18 ммоль) і 5,6,7,8тетрагідроізохінолін (290 мг, 2,18 ммоль) нагрівали при кипінні зі зворотним холодильником у ксилолі (2 мл) протягом 4 год. Відновленням неочищеної солі тетрагідроізохіноліния з використанням NaBH4 в MeOH одержували неочищений вказаний у заголовку продукт, що очищали методом флеш-хроматографії (гептан/EtOAc). 1 H ЯМР (CDCl3): 1,50-1,65 (м, 4H), 1,77-1,92 (м, 4H), 2,03 (м, 2H), 2,55-2,78 (м, 4H), 2,802,98 (м, 2H), 3,95-4,02 (м, 1H), 4,30-4,38 (м, 2H), 6,78-6,90 (м, 4H). Приклад 48: 2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)декагідроізохінолін Описаний вище 2-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-1,2,3,4,5,6,7,8-октагідроізохінолін (195 мг, 0,68 ммоль) гідрували в MeOH (20 мл) при нормальному тиску (12 год., 50C) з одержанням неочищеної вказаної в заголовку сполуки, яку очищали методом флешхроматографії (гептан/EtOAc). 1 H ЯМР (CDCl3): 1,15-1,95 (м, 12H), 2,10-2,42 (м, 2H), 2,45-2,80 (м, 4H), 3,92-4,02 (м, 1H), 4,18-4,36 (м, 2H), 6,75-6,90 (м, 4H). Приклад 49: етиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил) піперидин-3карбонової кислоти До суміші 2-бромметил-2,3-дигідробензо[1,4]діоксину (3,0 г, 13,09 ммоль) і етилніпекотату (2,65 мл, 17,02 ммоль) у ДМФА (15 мл) додавали DIPEA (7,5 мл). Реакційну суміш опромінювали в мікрохвильовому реакторі при 110C протягом 3 хв. Потім додавали воду (20 мл). Реакційну суміш екстрагували ДХМ (3×20 мл). Об'єднані органічні фази сушили над Na 2SO4, фільтрували й упарювали з одержанням неочищеної вказаної в заголовку сполуки, яку очищали методом колонкової хроматографії (ДХМ/MeOH, 95:5). 1 H ЯМР (ДМСО-d6): 1,14 (т, 3H), 1,14-1,46 (м, 5H), 2,10-2,80 (м, 6H), 3,94 (м, 1H), 4,05 (м, 2H), 4,28 (м, 2H), 6,82 (м, 4H). Приклад 50: [1-(2,3-дигідробензо[1,4]діоксин-2-ілметил) піперидин-3-іл]метанол До суспензії LiAlH4 (0,11 г, 2,78 ммоль) у безводному ТГФ (1 мл) додавали етиловий ефір 1(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3-карбонової кислоти (0,17 г, 0,55 ммоль) у безводному ТГФ (10 мл). Реакційну суміш нагрівали при кипінні зі зворотним холодильником протягом 2 год. При охолодженні повільно додавали воду й реакційну суміш екстрагували EtOAc (320 мл). Об'єднані органічні фази сушили (Na 2SO4), фільтрували й фільтрат упарювали з одержанням вказаної в заголовку сполуки. 1 H ЯМР (ДМСО-d6): 0,90 (м, 1H), 1,48 (м, 1H), 1,64 (м, 3H), 1,70-2,20 (м, 3H), 2,80 (м, 2H), 3,20 (м, 3H), 3,95 (дд, 1H), 4,30 (м, 2H), 4,36 (м, 1H), 6,82 (м, 4H). Приклад 51: етиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3карбонової кислоти До розчину етилового ефіру 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)піперидин-3карбонової кислоти (10,05 г, 32,90 ммоль) у безводному ТГФ (100 мл) при -78C повільно додавали LDA (20,1 мл, 1,8 М). Реакційну суміш перемішували при даній температурі протягом 1 год. Потім додавали метилйодид (2,25 мл, 36,21 ммоль), видаляли охолоджуючу баню й продовжували перемішування протягом 10 год. Після додавання води реакційну суміш екстрагували EtOAc (325 мл). Об'єднані органічні фази сушили над Na2SO4, фільтрували й 26 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 фільтрат упарювали з одержанням вказаної в заголовку сполуки, яку очищали методом колонкової хроматографії (EtOAc/гептан, 70:30). 1 H ЯМР (ДМСО-d6): 1,06 (с, 3H), 1,15 (т, 3H), 1,58 (м, 2H), 1,94 (м, 1H), 2,10 (м, 2H), 2,402,70 (м, 4H), 3,01 (дд, 1H) 3,94-4,05 (м, 3H), 4,28 (м, 2H), 6,85 (м, 4H). Приклад 52: етиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин-3карбонової кислоти Одержували відповідно до методики, описаної вище для етилового ефіру 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-карбонової кислоти, за винятком того, що етилйодид використовували замість метилйодиду. 1 H ЯМР (ДМСО-d6): 0,74 (т, 3H), 1,04 (м, 1H), 1,10-1,20 (м, 3H), 1,38 (м, 1H), 1,48-1,62 (м, 3H), 1,90-2,02 (м, 3H), 2,40-2,82 (м, 3H), 3,05 (м, 1H), 3,80-4,12 (м, 3H), 4,20-4,32 (м, 2H), 6,82 (м, 4H). Приклад 53: [1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-іл]метанол До суспензії LiAlH4 (0,59 г, 15,54 ммоль) у безводному ТГФ (45 мл) додавали етиловий ефір 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-карбонової кислоти (1,0 г, 3,13 ммоль) у безводному ТГФ (5 мл). Реакційну суміш нагрівали при кипінні зі зворотним холодильником протягом 1 год. Повільно додавали воду й реакційну суміш екстрагували EtOAc (320 мл). Об'єднані органічні фази сушили над Na2SO4, фільтрували й фільтрат упарювали з одержанням бажаного продукту, що очищали методом колонкової хроматографії (EtOAc/гептан, 50:50). 1 H ЯМР (ДМСО-d6): 0,85 (с, 3H), 1,06 (м, 1H), 1,31 (м, 1H), 1,50 (м, 2H), 1,85-2,45 (м, 6H), 3,22 (м, 2H), 3,95 (м, 1H), 4,30 (м, 2H), 4,40 (м, 1H), 6,86 (м, 4H). Приклад 54: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метоксиметил-3-метилпіперидин Розчин [1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-іл]метанолу (0,1 г, 0,36 ммоль) у ТГФ (5 мл) додавали до NaH (60 % у маслі, 79,0 мг, 1,79 ммоль), що попередньо промивали гептаном. Реакційну суміш перемішували при 70C протягом 1 год. і потім охолоджували до КТ із наступним додаванням по краплях розчину метилйодиду (0,034 мл, 0,54 ммоль) у ТГФ (1 мл). Перемішування продовжували протягом 1 год. Повільно додавали воду й реакційну суміш екстрагували ДХМ (320 мл). Об'єднані органічні фази сушили над Na2SO4, фільтрували й фільтрат упарювали з одержанням вказаної в заголовку сполуки, яку очищали методом колонкової хроматографії (ДХМ/MeOH, 90:10). 1 H ЯМР (ДМСО-d6): 0,88 (с, 3H), 1,08 (м, 1H), 1,35 (м, 1H), 1,49 (м, 2H), 1,85-2,45 (м, 6H), 3,15 (м, 2H), 3,31 (с, 3H), 3,95 (м, 1H), 4,27 (м, 2H), 6,86 (м, 4H). Приклад 55: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етоксиметил-3-метилпіперидин Одержували відповідно до методики, описаної для 1-(2,3-дигідробензо[1,4]діоксин-2ілметил)-3-метоксиметил-3-метилпіперидину, за винятком того, що використовували етилйодид замість метилйодиду. 1 H ЯМР (ДМСО-d6): 0,88 (с, 3H), 1,08 (м, 3H), 1,35 (м, 1H), 1,52 (м, 2H), 1,85-2,45 (м, 4H), 3,15 (м, 2H), 3,31 (с, 3H), 3,40 (м, 2H), 3,95 (м, 1H), 4,28 (м, 2H), 6,86 (м, 4H). Приклад 56: 3-хлорметил-1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин Суміш оксихлориду фосфору (1,93 мл, 0,02 ммоль) і [1-(2,3-дигідробензо[1,4]діоксин-2ілметил)-3-метилпіперидин-3-іл]метанолу (0,2 г, 0,72 ммоль) нагрівали при кипінні зі зворотним холодильником протягом 3 год. Надлишок оксихлориду фосфору випарювали. Повільно додавали воду й реакційну суміш робили лужною водним NaOH і екстрагували ДХМ (3×5 мл). Об'єднані органічні фази сушили над Na2SO4, фільтрували й фільтрат упарювали з одержанням вказаної в заголовку сполуки, яку очищали методом колонкової хроматографії (ДХМ/MeOH, 90:10). 1 H ЯМР (ДМСО-d6): 0,93 (с, 3H), 1,19 (м, 1H), 1,50 (м, 3H), 1,85-2,45 (м, 6H), 3,66 (м, 2H), 3,95 (м, 1H), 4,31 (м, 2H), 6,83 (м, 4H). Приклад 57: 2-[1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-іл]пропан-2-ол До розчину етилового ефіру 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3карбонової кислоти (1,13 г, 3,53 ммоль) у безводному ТГФ (50 мл) в атмосфері азоту при 0C додавали по краплях розчин метилмагнійхлориду в ТГФ (3,53 мл, 3,0 М). Отриманий у результаті розчин нагрівали при кипінні зі зворотним холодильником протягом 2,5 год. Потім повільно додавали воду при охолодженні, продукт екстрагували ДХМ і очищали методом колонкової хроматографії (ДХМ/MeOH, 95:5) з одержанням вказаної в заголовку сполуки. 1 H ЯМР (ДМСО-d6): 0,94 (с, 3H), 1,04 (д, 6H), 1,24 (м, 1H), 1,50 (м, 2H), 1,70-2,48 (м, 7H), 2,52 (шир.д, 1H), 3,97 (м, 1H), 4,31 (м, 2H), 6,82 (м, 4H). Приклад 58: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-(1-метокси-1-метилетил)-3метилпіперидин 27 UA 100695 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одержували відповідно до методики, описаної для 1-(2,3-дигідробензо[1,4]діоксин-2ілметил)-3-метоксиметил-3-метилпіперидину, за винятком того, що 2-[1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-іл]пропан-2-ол використовували замість [1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-іл]метанолу. 1 H ЯМР (ДМСО-d6): 0,90-1,05 (м, 9H), 1,08-2,50 (м, 9H), 2,56 (шир.д, 1H), 3,09 (с, 3H), 3,97 (м, 1H), 4,28 (м, 2H), 6,83 (м, 4H). Приклад 59: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-гідроксиметил-3-метилпіперидин-4ол До суміші 2,3-дигідробензо[1,4]діоксин-2-карбонілхлориду (2,0 г, 10,0 ммоль) і метилового ефіру 4-oксoпіперидин-3-карбонової кислоти (2,14 г, 11,0 ммоль) у ДМФА (5 мл) додавали триетиламін (1,54 мл). Реакційну суміш перемішували при КТ протягом 5 год. Реакційну суміш поглинали водою, підлуговували водним NaOH і екстрагували ДХМ із одержанням метилового ефіру 1-(2,3-дигідробензо[1,4]діоксин-2-карбоніл)-4-оксопіперидин-3-карбонової кислоти. Суміш даного продукту (0,2 г, 0,62 ммоль), K2CO3 (0,17 г, 1,23 ммоль) і метилйодиду (0,08 мл, 1,25 ммоль) в ацетоні (20 мл) опромінювали в мікрохвильовому реакторі при 56C протягом 90 хв. Додавали воду й реакційну суміш екстрагували EtOAc (35 мл). Об'єднані органічні фази сушили над Na2SO4, фільтрували й фільтрат упарювали з одержанням метилового ефіру 1-(2,3дигідробензо[1,4]діоксин-2-карбоніл)-3-метил-4-оксопіперидин-3-карбонової кислоти, що остаточно відновлювали з використанням LiAlH4 у ТГФ, одержуючи вказану в заголовку сполуку. 1 H ЯМР (ДМСО-d6): 0,88 (с, 3H), 1,06 (м, 1H), 1,15-3,80 (м, 11H), 3,95 (м, 1H), 4,32 (м, 2H), 4,42 (м, 1H), 6,84 (м, 4H). Приклад 60: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-ілметиловий ефір оцтової кислоти До розчину [1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-іл]метанолу (0,5 г, 1,80 ммоль), піридину (0,29 мл) і ДХМ (40 мл) при 0C додавали оцтовий ангідрид (0,34 мл). Реакційну суміш перемішували при КТ протягом 6 год. Повільно додавали воду й реакційну суміш екстрагували ДХМ (320 мл). Об'єднані органічні фази сушили над Na2SO4, фільтрували й фільтрат упарювали з одержанням вказаної в заголовку сполуки. 1 H ЯМР (ДМСО-d6): 0,85 (с, 3H), 1,08 (м, 1H), 1,33 (м, 1H), 1,50 (м, 2H), 1,85-2,45 (м, 7H), 2,49 (с, 3H), 3,95 (м, 1H), 4,25-4,39 (м, 3H), 6,83 (м, 4H). Приклад 61: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-ілметиловий ефір метансульфонової кислоти До розчину [1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-іл]метанолу (0,92 г, 3,31 ммоль) у ДХМ (40 мл) при 0C додавали метансульфонілхлорид (0,51 мл). Реакційну суміш перемішували при КТ протягом 12 год. Реакційну суміш підлуговували 2 М NaOH і потім екстрагували ДХМ (320 мл). Об'єднані органічні фази сушили над Na 2SO4, фільтрували й фільтрат упарювали з одержанням вказаної в заголовку сполуки. 1 H ЯМР (ДМСО-d6): 0,86 (с, 3H), 0,88-1,40 (м, 5H), 1,50 (м, 2H), 2,02-2,32 (м, 5H), 3,16 (м, 3H), 3,96 (м, 1H), 4,29 (м, 2H), 6,81 (м, 4H). Приклад 62: [1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин-3-іл]метанол Одержували відповідно до методики, описаної для [1-(2,3-дигідробензо[1,4]діоксин-2ілметил)-3-метилпіперидин-3-іл]метанолу, за винятком того, що етиловий ефір 1-(2,3дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин-3-карбонової кислоти використовували замість етилового ефіру 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3карбонової кислоти. 1 H ЯМР (ДМСО-d6): 0,74 (т, 3H), 1,10 (м, 1H), 1,23-1,50 (м, 6H), 2,01-2,32 (м, 5H), 3,27 (м, 2H), 3,95 (м, 1H), 4,28 (м, 3H), 6,83 (м, 4H). Приклад 63: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етил-3-метоксиметилпіперидин Одержували з [1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-етилпіперидин-3-іл]метанолу відповідно до методики, описаної для 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3метоксиметил-3-метилпіперидину. 1 H ЯМР (ДМСО-d6): 0,73 (т, 3H), 1,10 (м, 2H), 1,32 (м, 3H), 1,49 (м, 2H), 2,01-2,40 (м, 5H), 3,22-3,30 (м, 5H), 3,95 (м, 1H), 4,26 (м, 2H), 6,81 (м, 4H). Приклад 64: 1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метоксиметоксиметил-3метилпіперидин До розчину [1-(2,3-дигідробензо[1,4]діоксин-2-ілметил)-3-метилпіперидин-3-іл]метанолу (0,20 г, 0,72 ммоль) у безводному ДХМ (10 мл) при 0C додавали DIPEA (0,42 мл) і хлорметилметиловий ефір (0,11 мл). Реакційну суміш перемішували при КТ протягом 16 год. Додавали воду й продукт екстрагували ДХМ (3×20 мл). Об'єднані органічні фази сушили над Na2SO4, фільтрували й фільтрат упарювали з одержанням вказаної в заголовку сполуки. 28
ДивитисяДодаткова інформація
Назва патенту англійською2,3-dihydrobenzo[1,4]dioxin-2-ylmethyl derivatives as alpha2c antagonists for use in the treatment of peripheric and central nervous systeme diseases
Автори англійськоюDin Belle David, Holm, Patrik, Karljalainen, Arto, Tolvanen, Arto, Wohlfahrt, Gerd, Rummakko, Petteri
Назва патенту російською2,3-дигидробензо[1,4] диоксин-2-илметиловые производные как альфа2с антагонисты для применения в лечении заболеваний периферической и центральной нервной системы
Автори російськоюДин Белл Девид, Хольм Патрик, Карльялайнен Арто, Толванен Арто, Вольфарт Герд, Руммакко Петтери
МПК / Мітки
МПК: A61K 31/357, C07D 405/06, A61P 25/00
Мітки: лікуванні, периферичної, застосування, 2,3-дигідробензо[1,4]діоксин-2-ілметилові, альфа2c, нервової, захворювань, антагоністи, похідні, центральної, системі
Код посилання
<a href="https://ua.patents.su/52-100695-23-digidrobenzo14dioksin-2-ilmetilovi-pokhidni-yak-alfa2c-antagonisti-dlya-zastosuvannya-v-likuvanni-zakhvoryuvan-periferichno-jj-centralno-nervovo-sistemi.html" target="_blank" rel="follow" title="База патентів України">2,3-дигідробензо[1,4]діоксин-2-ілметилові похідні як альфа2c антагоністи для застосування в лікуванні захворювань периферичної й центральної нервової системи</a>
Попередній патент: Антитіло, яке специфічно зв’язується з cd79b, імунокон’югат та способи їх застосування
Наступний патент: Поверхнево модифіковані діоксиди кремнію, одержані пірогенним шляхом
Випадковий патент: Роторний лічильник газу