Заміщені ефіри 4-{3-[6-аміно-9-(3,4-дигідрокситетрагідрофуран-2-іл)-9н-пурин-2-іл]-проп-2-ініл}-піперидин-1-карбонової кислоти як a2ar агоністи
Номер патенту: 100035
Опубліковано: 12.11.2012
Автори: Шмідтманн Френк, Томпсон Роберт, Ріджер Джейсон, Бьюглхоул Ентоні
Формула / Реферат
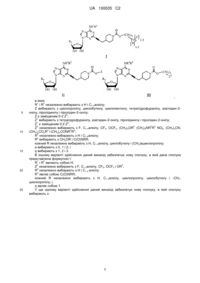
1. Сполука формули І, II або III або її стереоізомер або фармацевтично прийнятна сіль:
 , I
, I
 , II
, II
 , III
, III
де:
R1 і R2 незалежно вибирають з Н і С1-3алкілу;
Z вибирають з циклопропілу, циклобутилу, циклопентилу, тетрагідрофуранілу, азетидин-2-онілу, піролідинілу і піролідин-2-онілу;
Z є заміщеним 0-2 Z2;
Z1 вибирають з тетрагідрофуранілу, азетидин-2-онілу, піролідинілу і піролідин-2-онілу;
Z1 є заміщеним 0-2 Z2;
Z2 незалежно вибирають з F, С1-4алкілу, CF3, OCF3, (CH2)aOR3, (CH2)aNR3R3, NO2, (CH2)aCN, (CH2)aCO2R3 і (CH2)aCONR3R3;
R3 незалежно вибирають з Н і С1-6алкілу;
R4 вибирають з CH2OR і C(O)NRR;
кожний R незалежно вибирають з Н, С1-4алкілу, циклобутилу і (СН2)aциклопропілу;
а вибирають з 0, 1 і 2; і
q вибирають з 1, 2 і 3.
2. Сполука за п. 1, де сполука має формулу І, в якій:
R1 і R2 являють собою Н;
Z2 незалежно вибирають з F, С1-2алкілу, CF3, OCF3 і OR3;
R3 незалежно вибирають з Н і С1-2алкілу;
R4 являють собою C(O)NRR;
кожний R незалежно вибирають з Н, С1-4алкілу, циклопропілу, циклобутилу і -СН2-циклопропілу; а
q являє собою 1.
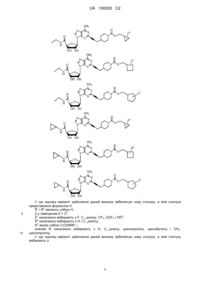
3. Сполука за п. 1, де сполуку вибирають з групи, що складається з:
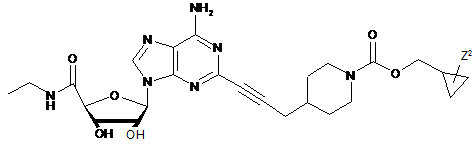 ,
,
 ,
,
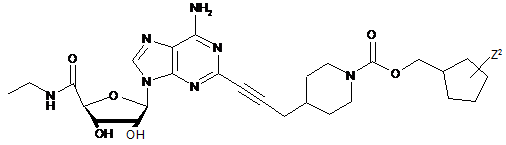 ,
,
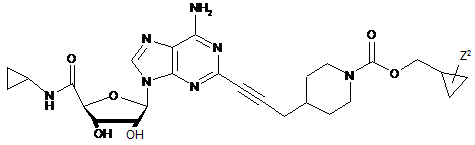 ,
,
 ,
,
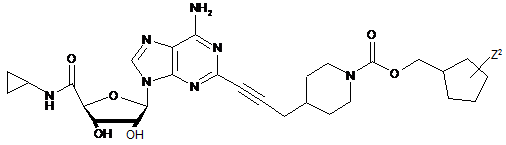 .
.
4. Сполука за п. 1, де сполука має формулу II, в якій:
R1 і R2 являють собою Н;
Z є заміщеним 0-1 Z2;
Z2 незалежно вибирають з F, С1-2алкілу, CF3, OCF3 і OR3;
R3 незалежно вибирають з Н і С1-2алкілу;
R4 являють собою C(O)NRR; і
кожний R незалежно вибирають з Н, С1-4алкілу, циклопропілу, циклобутилу і -СН2-циклопропілу.
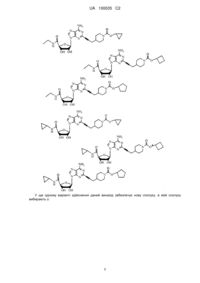
5. Сполука за п. 1, де сполуку вибирають з групи, що складається з:
 ,
,
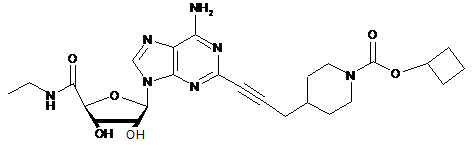 ,
,
 ,
,
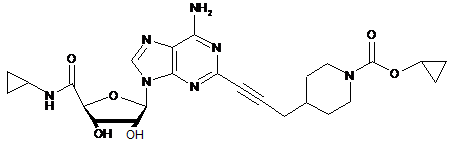 ,
,
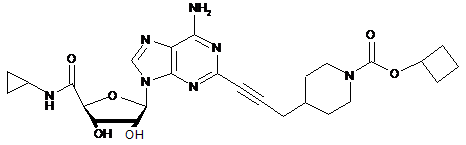 ,
,
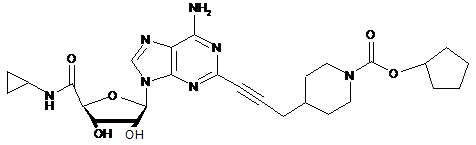 .
.
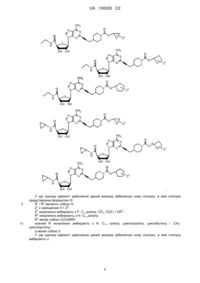
6. Сполука за п. 1, де сполуку вибирають з групи, що складається з:
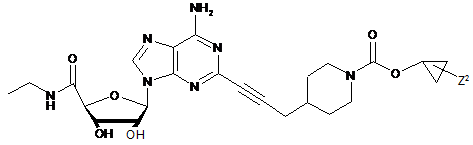 ,
,
 ,
,
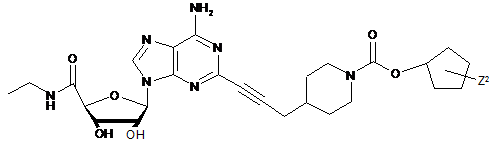 ,
,
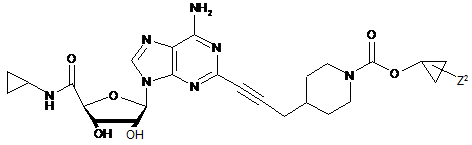 ,
,
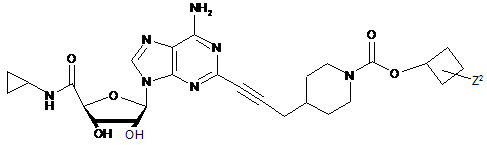 ,
,
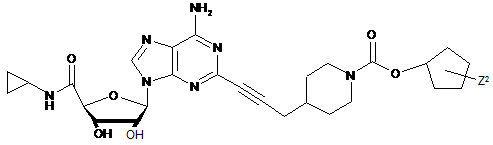 .
.
7. Сполука за п. 1, де сполука має формулу III, в якій:
R1 і R2 являють собою Н;
Z1 є заміщеним 0-1 Z2;
Z2 незалежно вибирають з F, С1-2алкілу, CF3, OCF3 і OR3;
R3 незалежно вибирають з Н і С1-2алкілу;
R4 являють собою C(O)NRR;
кожний R незалежно вибирають з Н, С1-4алкілу, циклопропілу, циклобутилу і -СН2-циклопропілу, і
q являє собою 0.
8. Сполука за п. 1, де сполуку вибирають з групи, що складається з:
 ,
,
 ,
,
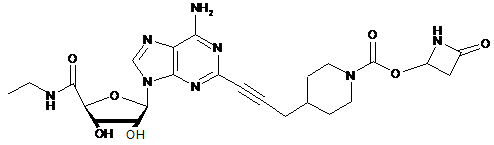 ,
,
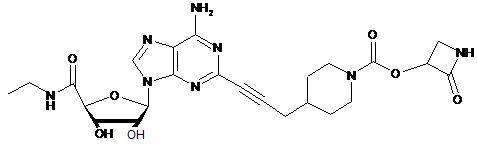 ,
,
 ,
,
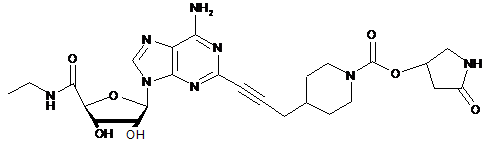 ,
,
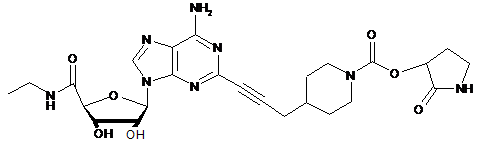 ,
,
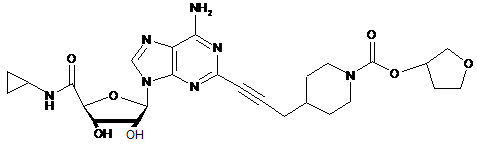 ,
,
 ,
,
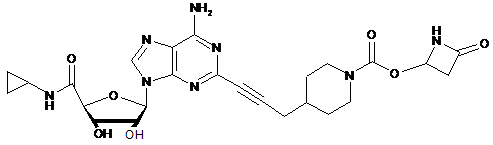 ,
,
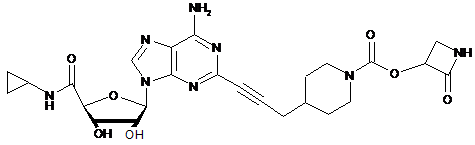 ,
,
 ,
,
 ,
,
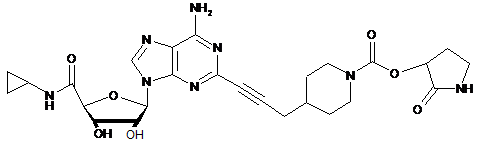 .
.
9. Сполука за п. 1, де сполуку вибирають з групи, що складається з:
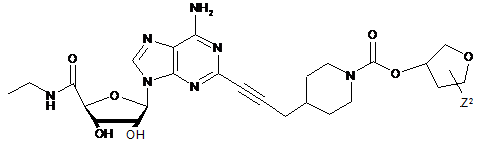 ,
,
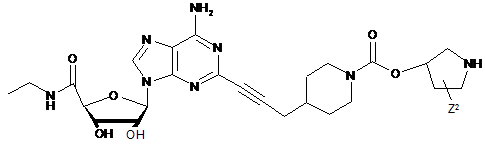 ,
,
 ,
,
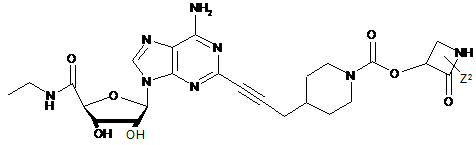 ,
,
 ,
,
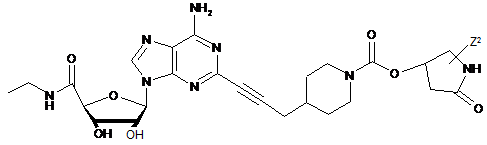 ,
,
 ,
,
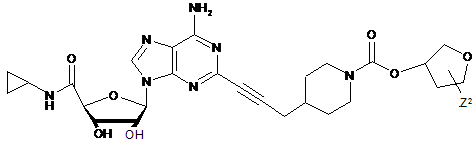 ,
,
 ,
,
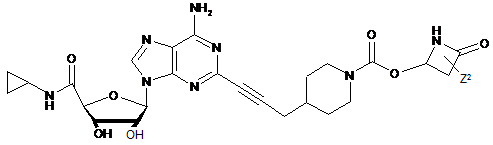 ,
,
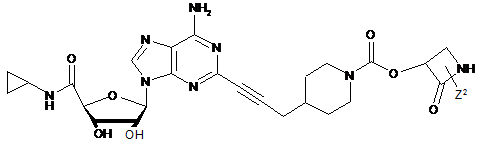 ,
,
 ,
,
 ,
,
 .
.
10. Сполука за п. 1, де сполуку вибирають з групи, що складається з:
 ,
,
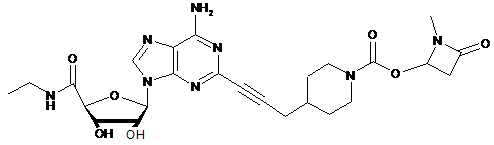 ,
,
 ,
,
 ,
,
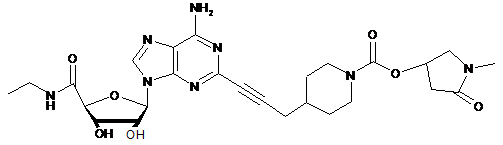 ,
,
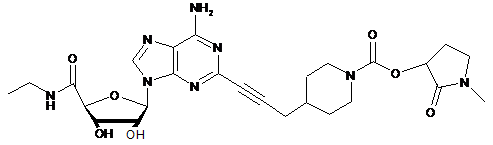 ,
,
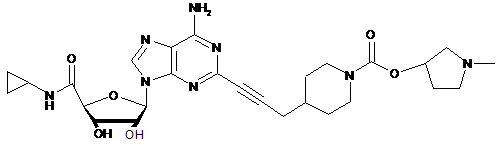 ,
,
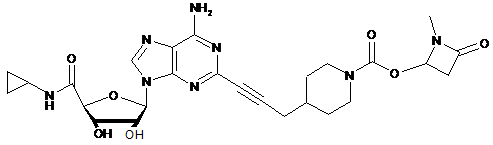 ,
,
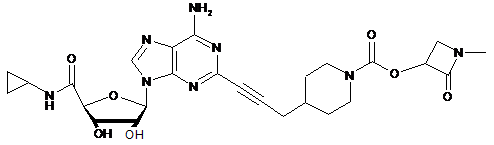 ,
,
 ,
,
 ,
,
 .
.
11. Сполука за п. 1, де сполука має формулу III, в якій:
R1 і R2 являють собою Н;
Z1 є заміщеним 0-1 Z2;
Z2 незалежно вибирають з F, С1-2алкілу, CF3, OCF3 і OR3;
R3 незалежно вибирають з Н і С1-2алкілу;
R4 являють собою C(O)NRR;
кожний R незалежно вибирають з Н, С1-4алкілу, циклопропілу, циклобутилу і -СН2-циклопропілу, q являє собою 1.
12. Сполука за п. 1, де сполуку вибирають з групи, що складається з:
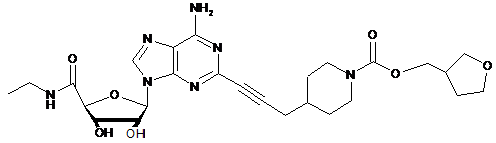 ,
,
 ,
,
 ,
,
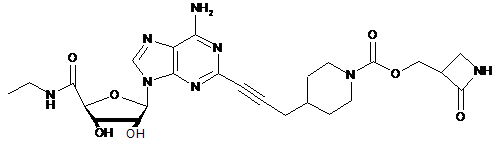 ,
,
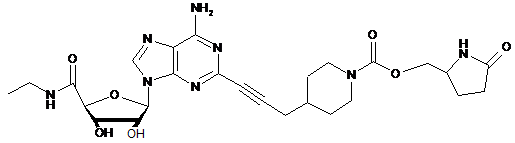 ,
,
 ,
,
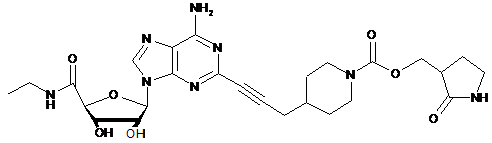 ,
,
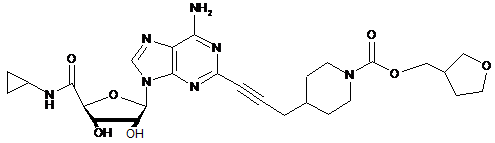 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
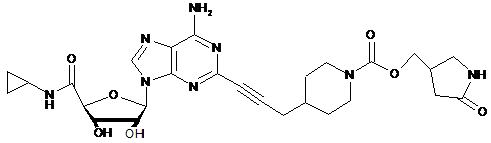 ,
,
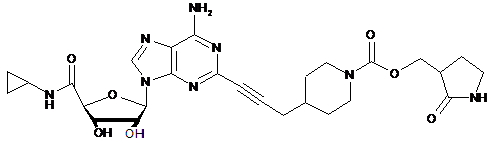 .
.
13. Сполука за п. 1, де сполуку вибирають з групи, що складається з:
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
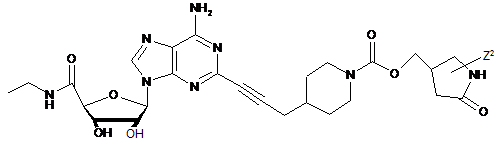 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 .
.
14. Сполука за п. 1, де сполуку вибирають з групи, що складається з:
 ,
,
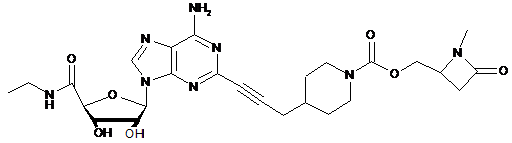 ,
,
 ,
,
 ,
,
 ,
,
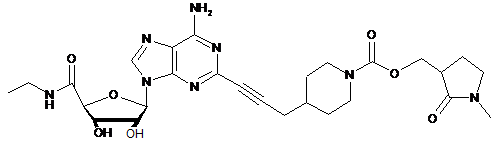 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
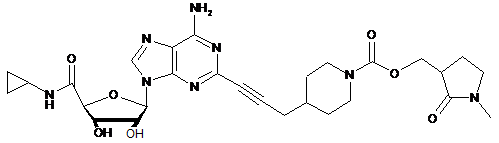 .
.
15. Фармацевтична композиція, яка містить сполуку за п. 1 і фармацевтично прийнятний носій.
16. Сполука за будь-яким з пп. 1-14 для застосування в лікарській терапії.
17. Застосування сполуки за будь-якимз пп. 1-14 для виробництва лікарського препарату, застосовного для лікування захворювання у ссавця.
Текст
Реферат: Даний винахід стосується заміщених ефірів 4-{3-[6-аміно-9-(3,4-дигідрокситетрагідрофуран-2іл)-9Н-пурин-2-іл]-проп-2-ініл}-піперидин-1-карбонової кислоти і фармацевтичні композиції, що їх містять, які є селективними агоністами А2A аденозинових рецепторів (AR). Дані сполуки і композиції застосовуються як фармацевтичні препарати. UA 100035 C2 (12) UA 100035 C2 UA 100035 C2 5 10 Затвердження державних прав Даний винахід був зроблений при державній підтримці в межах Гранту Сполучених Штатів Америки № 1 R41 AR052960 Національних інститутів охорони здоров'я. Держава може мати певні права на даний винахід. Галузь техніки, до якої належить винахід Даний винахід належить до заміщеного ефіру 4-{3-[6-аміно-9-(3,4дигідрокситетрагідрофуран-2-іл)-9H-пурин-2-іл]-проп-2-ініл}-піперидин-1-карбонової кислоти і фармацевтичних композицій, які є селективними агоністами A2A аденозинових рецепторів (AR). Дані сполуки і композиції застосовуються як фармацевтичні агенти. Рівень техніки винаходу Останнім часом стався прогресивний розвиток сполук, які є все більш і більш ефективними і/або селективними як агоністи A2A аденозинових рецепторів (AR), якщо вийти з результатів радіолігандних аналізів і фізіологічних реакцій. Наприклад, Патент США № 6232297 авторів Linden, et al. описує сполуки, що мають загальну формулу: 15 , 1 в якій кожний R може являти собою Н, X може являти собою етиламінокарбоніл, а R може являти собою 4-метоксикарбонілциклогексилметил (DWH-146e). Відомо, що дані сполуки є агоністами A2A. Патент США № 7214665 авторів Linden, et al. описує сполуки, що мають загальну формулу: 20 , 7 1 2 в якій R може являти собою Н, X може являти собою простий ефір або амід, CR R може являти собою CH2, а Z може являти собою гетероциклічне кільце. Відомо, що дані сполуки є агоністами A2A. Патентна заявка США № 2006/004088 авторів Rieger, et al. описує сполуки, що мають загальну формулу: 25 30 , 7 в якій R може являти собою Н, X може являти собою циклоалкілзаміщений ефір або амід, 1 2 CR R може являти собою CH2, а Z може являти собою гетероциклічне кільце. Відомо, що дані сполуки є агоністами A2A. Патентна заявка США № 2007/0270373 авторів Rieger, et al. описує сполуки, що мають загальну формулу: 1 UA 100035 C2 5 10 15 20 25 30 35 , 1 2 4 5 в якій NR R може являти собою NH2, R може являти собою простий ефір або амід, R може 1 являти собою етиніл, Y може являти собою О або NR , а Z може являти собою арил або гетероарил. Відомо, що дані сполуки є агоністами A2A. Навіть з урахуванням вищевикладеного продовжує існувати необхідність в агоністах A2 аденозинового рецептора для застосування в терапевтичних цілях. Суть винаходу Даний винахід забезпечує заміщений ефір 4-{3-[6-аміно-9-(3,4-дигідрокситетрагідрофуран-2іл)-9H-пурин-2-іл]-проп-2-ініл}-піперидин-1-карбонової кислоти або стереоізомери або фармацевтично прийнятні солі, які діють як агоністи A2A аденозинових рецепторів. Даний винахід також забезпечує фармацевтичні композиції, що містять сполуки даного винаходу або його стереоізомер або фармацевтично прийнятну сіль в комбінації з фармацевтично прийнятною допоміжною речовиною. Даний винахід забезпечує нові способи лікування і діагностики, сполук і композицій даного винаходу. Даний винахід забезпечує нову сполуку даного винаходу для застосування в лікарській терапії. Даний винахід також забезпечує застосування нової сполуки даного винаходу для виробництва лікарського засобу для лікування патологічного стану або симптому у ссавця, опосередкованого рецептором A2A, і при якому агонізм даного рецептора забезпечує терапевтичну користь. Ці і інші аспекти даного винаходу можна здійснити з урахуванням відкриття заміщеного ефіру 4-{3-[6-аміно-9-(3,4-дигідрокситетрагідрофуран-2-іл)-9H-пурин-2-іл]-проп-2-ініл}-піперидин1-карбонової кислоти, описаних в контексті даного документу. Докладний опис винаходу Даний винахід забезпечує новий заміщений ефір 4-{3-[6-аміно-9-(3,4дигідрокситетрагідрофуран-2-іл)-9H-пурин-2-іл]-проп-2-ініл}-піперидин-1-карбонової кислоти, які діють як агоністи на аденозиновий рецептор A2A, і способи застосування даних сполук в методах лікування захворювань і патологічних станів, які опосередковані рецептором A2A і для яких агонізм даного рецептора забезпечує терапевтичну користь. Дані сполуки можна застосовувати, наприклад, для лікування запального процесу в тканинах ссавців або для лікування серпоподібноклітинної анемії. Запальний процес в тканині може бути зумовлений патологічними агентами або може бути зумовлений фізичним, хімічним або термічним пошкодженням, або пошкодженням внаслідок медичних маніпуляцій, таких як трансплантація органу, тканини або клітин, ангіопластика (PCTA), запалення внаслідок ішемії/реперфузії, або імплантація. Сполуки даних винахідників також можна застосовувати спільно з іншими протизапальними терапіями або спільно з антипатогенними агентами. У варіанті здійснення даний винахід забезпечує нову сполуку формули I, II або III або її стереоізомер або фармацевтично прийнятну сіль: 2 UA 100035 C2 5 10 15 20 25 , в яких: 1 2 R і R незалежно вибирають з Н і C1-3алкілу; Z вибирають з циклопропілу, циклобутилу, циклопентилу, тетрагідрофуранілу, азетидин-2онілу, піролідинілу і піролідин-2-онілу; 2 Z є заміщеним 0-2 Z ; 1 Z вибирають з тетрагідрофуранілу, азетидин-2-онілу, піролідинілу і піролідин-2-онілу; 1 2 Z є заміщеним 0-2 Z ; 2 3 3 3 Z незалежно вибирають з F, C1-4алкілу, CF3, OCF3, (CH2)aOR , (CH2)aNR R , NO2, (CH2)aCN, 3 3 3 (CH2)aCO2R і (CH2)aCONR R ; 3 R незалежно вибирають з Н і C1-6алкілу; 4 R вибирають з CH2OR і C(O)NRR; кожний R незалежно вибирають з Н, C1-4алкілу, циклобутилу і (CH2)ациклопропілу; а вибирають з 0, 1 і 2; і q вибирають з 1, 2 і 3. В іншому варіанті здійснення даний винахід забезпечує нову сполуку, в якій дана сполука представлена формулою I: 1 2 R і R являють собою Н; 2 3 Z незалежно вибирають з F, C1-2алкілу, CF3, OCF3 і OR ; 3 R незалежно вибирають з Н і C1-2 алкілу; 4 R являє собою C(O)NRR; кожний R незалежно вибирають з Н, C1-4алкілу, циклопропілу, циклобутилу і -CH2циклопропілу; і, q являє собою 1. У ще одному варіанті здійснення даний винахід забезпечує нову сполуку, в якій сполуку вибирають з: 3 UA 100035 C2 5 10 У ще одному варіанті здійснення даний винахід забезпечує нову сполуку, в якій сполука представлена формулою II: 1 2 R і R являють собою Н; 2 Z є заміщеним 0-1 Z ; 2 3 Z незалежно вибирають з F, C1-2алкілу, CF3, OCF3 і OR ; 3 R незалежно вибирають з Н і C1-2алкілу; 4 R являє собою C(O)NRR; і кожний R незалежно вибирають з Н, C1-4алкілу, циклопропілу, циклобутилу і CH2циклопропілу. У ще одному варіанті здійснення даний винахід забезпечує нову сполуку, в якій сполуку вибирають з: 4 UA 100035 C2 У ще одному варіанті здійснення даний винахід забезпечує нову сполуку, в якій сполуку вибирають з: 5 UA 100035 C2 5 10 У ще одному варіанті здійснення даний винахід забезпечує нову сполуку, в якій сполука представлена формулою III: 1 2 R і R являють собою Н; 1 2 Z є заміщеним 0-1 Z ; 2 3 Z незалежно вибирають з F, C1-2алкілу, CF3, OCF3 і OR ; 3 R незалежно вибирають з Н і C1-2алкілу; 4 R являє собою C(O)NRR; кожний R незалежно вибирають з Н, C1-4 алкілу, циклопропілу, циклобутилу і -CH2циклопропілу; q являє собою 0. У ще одному варіанті здійснення даний винахід забезпечує нову сполуку, в якій сполуку вибирають з: 6 UA 100035 C2 7 UA 100035 C2 У ще одному варіанті здійснення даний винахід забезпечує нову сполуку, в якій сполуку вибирають з: 8 UA 100035 C2 9 UA 100035 C2 У ще одному варіанті здійснення даний винахід забезпечує нову сполуку, в якій сполуку вибирають з: 10 UA 100035 C2 11 UA 100035 C2 5 10 У ще одному варіанті здійснення даний винахід забезпечує нову сполуку, в якій сполука представлена формулою III: 1 2 R і R являють собою Н; 1 2 Z є заміщеним 0-1 Z ; 2 3 Z незалежно вибирають з F, C1-2алкілу, CF3, OCF3 і OR ; 3 R незалежно вибирають з Н і C1-2алкілу; 4 R являє собою C(O)NRR; кожний R незалежно вибирають з Н, C1-4 алкілу, циклопропілу, циклобутилу і -CH2циклопропілу; q являє собою 1. У ще одному варіанті здійснення даний винахід забезпечує нову сполуку, в якій сполуку вибирають з: 12 UA 100035 C2 13 UA 100035 C2 У ще одному варіанті здійснення даний винахід забезпечує нову сполуку, в якій сполуку вибирають з: 5 14 UA 100035 C2 15 UA 100035 C2 У ще одному варіанті здійснення даний винахід забезпечує нову сполуку, в якій сполуку вибирають з: 16 UA 100035 C2 17 UA 100035 C2 5 10 15 20 25 30 35 Даний винахід забезпечує нову сполуку для застосування в лікарській терапії, переважно для застосування в лікуванні запалення або профілактиці тканини ссавця від запалення, такого як запальна реакція, наприклад, внаслідок алергії, пошкодження або травма ішемії/реперфузії, а також застосування сполуки даного винаходу для виробництва лікарського засобу для лікування запальної реакції, зумовленої патологічним станом або симптомом ссавця, яка пов'язана із запаленням. Розуміється, що даний винахід включає всі ізотопи атомів, що зустрічаються в даних сполуках. Ізотопи включають атоми, що мають один і той самий номер атома, але різні масові числа. Як звичайний приклад і без обмеження ізотопи водню включають тритій і дейтерій. Ізотопи вуглецю включають С-13 і С-14. Даний винахід також включає застосування комбінації даних сполук, принаймні, з однією протизапальною сполукою. Прикладом подібної сполуки є інгібітор фосфодіестерази IV типу, а комбінацію можна застосовувати, для того щоб викликати синергічне зменшення запальної реакції, опосередкованої лейкоцитами. Даний винахід також забезпечує фармацевтичну композицію, що містить ефективну кількість сполуки даного винаходу, або її фармацевтично прийнятної солі, в комбінації з фармацевтично прийнятним розріджувачем або носієм, і необов'язково, в комбінації з протизапальною сполукою. Дана композиція може бути представлена у вигляді стандартної лікарської форми. Носієм може бути рідкий носій. Дана композиція може бути призначена для перорального, внутрішньовенного, очного, парентерального, аерозольного або трансдермального введення. Композиції даного винаходу, крім того, можуть включати інгібітор фосфодіестерази IV типу або іншу протизапальну сполуку (наприклад таку, що відрізняється від інгібітора ФДЕ). Інгібітор фосфодіестерази IV типу може являти собою, наприклад, роліпрам, циломіласт або рофлуміласт. Крім того, даний винахід забезпечує терапевтичний спосіб лікування патологічного стану або симптому у ссавця, який безпосередньо пов'язаний з активністю аденозинових рецепторів A2A, і при якому необхідний агонізм вище згаданих рецепторів, що включає введення ссавцеві, який потребує подібної терапії, ефективної кількості сполуки даного винаходу або її фармацевтично прийнятної солі. Вважається, що активація аденозинових рецепторів A2A інгібує запалення за допомогою впливу на нейтрофіли, опасисті клітини, моноцити/макрофаги, тромбоцити Т-клітини і/або еозинофіли. Інгібування даних запальних клітин забезпечує захист тканини при пошкодженнях. Крім того, даний винахід забезпечує терапевтичний спосіб лікування біологічних захворювань, який включає введення ефективної кількості відповідного антибіотичного агента, протигрибкового агента або противірусного агента спільно з агоністом аденозинового рецептора A2A. Якщо відомого антипатогенного агента немає, агоніст A2A можна застосовувати окремо для зменшення запалення, яке може виникати в процесі інфікування резистентними до 18 UA 100035 C2 5 10 15 20 25 30 35 40 45 50 55 60 антибіотиків бактеріями або деякими вірусами, такими як віруси, які викликають ВГРС або Ебола. Необов'язково даний спосіб включає введення інгібітора ФДЕ IV типу. Агоніст аденозинового рецептора A2A може забезпечити суміжну терапію для лікування патологічних станів, таких як запалення, викликане сепсисом, наприклад, людський уремічний синдром, при введенні разом з антибіотиками в лікуванні наслідків біологічної зброї, такої як антракс, туляремія, кишкова паличка, епідемічне захворювання і тому подібне. Даний винахід також забезпечує суміжну терапію для лікування смертельних бактеріальних, грибкових і вірусних інфекцій, таких як антракс, туляремія, кишкова паличка і епідемічне захворювання, що включає введення антибактерійного агента, протигрибкового агента або противірусного агента спільно з селективними агоністами аденозинового рецептора A2A. Даний винахід забезпечує терапевтичний спосіб лікування біологічних захворювань, які спричиняють запалення або самі по собі, або в комбінації з лікарським препаратом, що пригнічує захворювання. Приклади включають бактерії в комбінації з антибіотиками, в тому числі, але, не обмежуючись, бактерії, які викликають антракс, туляремію, епідемічне захворювання, хворобу Лайма і антракс. Також приклади включають віруси, в тому числі, але, не обмежуючись, віруси, які викликають РСВ (респіраторно-синцитійний вірус), важкий гострий респіраторний синдром (ВГРС), грип і Ебола в комбінації або без противірусної терапії. Також приклади включають дріжджові і грибкові інфекції в комбінації або без протидріжджових або протигрибкових агентів. Антибактерійний агент, протигрибковий агент або противірусний агент можна вводити спільно (наприклад, одночасно) з агоністом A2A аденозинового рецептора, або їх можна вводити або одночасно, або у вигляді суміші, або їх можна вводити послідовно. Послідовне введення агоністів аденозинового рецептора A2A можна здійснювати до введення агента, в межах декількох хвилин або аж до 48 годин після введення даного агента. Переважним буде введення агоністів аденозинового рецептора A2A в межах близько 24 годин, і більш переважно в межах близько 12 годин. Спосіб даного винаходу також буде застосовний для лікування пацієнтів з сепсисом, важким сепсисом, і потенційно з синдромом системної запальної реакції, на додаток до септичного шоку. Агоністи A2A аденозинового рецептора виявляють множинні протизапальні ефекти на ранній стадії запального каскаду, і, таким чином, короткий курс таких агоністів може надати принциповий сприятливий вплив при серйозних, таких, що представляють загрозу для життя, інфекційних і запальних порушеннях людини, в тому числі інгаляційному антраксі, туляремії, кишковій паличці і епідемічному захворюванні. Протизапальний ефект агоністів A2A рецептора був зареєстрований in vivo, в експериментальних моделях менінгіту, перитоніту і артриту. Потенційно смертельний синдром бактерійного сепсису стає все більш поширеною проблемою серед випадків, що вимагають невідкладної допомоги. Сепсис і септичний шок, причина смерті, що займає в даний час одинадцяте місце в Сполучених Штатах Америки, збільшується за частотою зустрічання. Поточні оцінки показують, що в Сполучених Штатах Америки щорічно зустрічається близько 900000 нових видів сепсису (приблизно на 60% грам-негативний) з оцінним загальним коефіцієнтом смертності 35%. Більш того цей коефіцієнт смертності, як було визначено в недавніх клінічних дослідженнях, складає приблизно 25%, тоді як приблизно 10% пацієнтів вмирають від свого основного захворювання. Шок розвивається в приблизно 200000 випадках щорічно з супутнім коефіцієнтом смертності 46% (92000 смертей). Сепсис нараховує за оцінюванням $5-10 мільярдів доларів щорічно у витратах на охорону здоров'я. У даний час загальновизнаним є той факт, що серед пацієнтів, які госпіталізуються в несерцевих реанімаційний відділеннях, сепсис є найпоширенішою причиною смерті. Синдром сепсису є в даний час першорядною проблемою суспільної охорони здоров'я. Передбачається, що агоністи A2AAR будуть мати застосування як новий і унікальний додатковий терапевтичний підхід до зменшення захворюваності і смертності. Вважається, що дане лікування поліпшить вихід у випадку системного антраксу, туляремії, кишкової палички і епідемічного захворювання. Агоністи аденозинових рецепторів A2A даного винаходу можуть інгібувати активацію нейтрофілов, макрофагів і Т-клітин і тим самим пригнічувати запалення, викликане бактеріальними і вірусними інфекціями. Дані сполуки спільно з антибіотиками або антивірусними агентами можуть запобігати або зменшувати смертність, що викликається сепсисом або гемолітичним уремічним синдромом або іншими запальними патологічними станами. Ефекти аденозинових агоністів A2A посилюються інгібіторами фосфодіестерази IV типу, такими як роліпрам. Даний винахід також забезпечує сполуки даного винаходу для застосування в медичній терапії (наприклад, для застосування як допоміжної речовини в лікуванні потенційно летальних 19 UA 100035 C2 5 10 15 20 25 30 35 40 45 50 55 бактеріальних інфекцій, таких як антракс, туляремія, кишкова паличка, епідемічне захворювання або інші бактеріальні або вірусні інфекції, і в лікуванні системної інтоксикації, викликаної бактеріальними і/або вірусними інфекціями), а також застосування сполуки даного винаходу для виробництва лікарського засобу для пригнічення запалення, що викликається бактеріями або вірусами або їх лікуванням у ссавців, таких як людина. Сполуки даного винаходу також застосовуються для лікування системної інтоксикації, при якій бактеріальні або вірусні агенти спричиняють запалення або безпосередньо самі, або внаслідок лікування, наприклад, антибіотичним або антивірусним агентом. Сепсис є важким захворюванням, що викликається дуже сильним інфікуванням кровотоку бактеріями або вірусами, що виробляють токсини. Дане інфікування, яке може виявлятися у вигляді запалення, може бути викликане бактеріальними або вірусними патогенами безпосередньо самими по собі або внаслідок їх лікування, тобто, руйнування патогенів, зумовленого лікуванням антибактеріальними або антивірусними агентами. Сепсис також можна розглядати як реакцію організму на інфікування. Інфікування може бути викликане впровадженням мікроорганізмів або "мікробів" (зазвичай бактерій) в організм, може бути обмежене конкретною ділянкою організму (наприклад, абсцес зуба) або може широко розповсюджуватися по кровотоку (часто називається "септицемія" або "зараження крові"). Системну інтоксикацію або запальний шок часто називають септичним шоком; бактеріальним шоком; ендотоксиновим шоком; септицемічним шоком; або тепловим шоком. Септичний шок є серйозним патологічним станом, який виникає, коли дуже сильне інфікування призводить до низького кров'яного тиску і уповільненого кровообігу. Життєво важливі органи, такі як мозок, серце, нирки і печінка можуть перестати функціонувати належно або можуть ушкоджуватися. Септичний шок найчастіше виникає у дуже немолодих і дуже молодих людей. Він також виникає у людей, в яких є основні захворювання. Будь-який бактерійний організм може викликати септичний шок. Гриби і віруси також можуть спричиняти такий патологічний стан. Токсини, що виробляються бактеріями, грибами або вірусами, можуть викликати безпосередні пошкодження тканини і можуть призводити до низького кров'яного тиску і/або поганого функціонування органів. Дані токсини можуть також виробляти бурхливу запальну реакцію організму, яка робить внесок в септичний шок. У ще одному аспекті, даний винахід також забезпечує спосіб лікування важкого гострого респіраторного синдрому (ВГРС), що включає введення ссавцеві, який потребує вищезгаданої терапії, ефективної для протизапального ефекту кількості агоністів аденозинового рецептора A2A, необов'язково спільно з ФДЕ-IV інгібітором, таким як роліпрам. Даний винахід також забезпечує способи лікування серпоподібноклітинної анемії за допомогою введення агоністів A2A, описаних в контексті даного винаходу, пацієнту, страждаючому серпоподібноклітинної анемією. Даний винахід забезпечує сполуки і способи їх застосування для визначення наявності і оцінки важкості стенозу коронарної артерії у ссавця, такого як людина або домашня тварина. Переважно сполуки даного винаходу застосовуються як фармакологічні стресові агенти або стрес-фактори, які застосовуються для фармакологічної візуалізації стресу для визначення і оцінки захворювання коронарної артерії. Специфічні сполуки даного винаходу, що застосовуються як стресові агенти, є ефективними і селективними по відношенню до A2A аденозинових рецепторів, а також є швидкодіючими, таким чином, вони швидко виводяться організмом після процесу візуалізації. Таким чином, даний винахід забезпечує спосіб визначення наявності і важкості стенозів коронарної артерії у ссавця, такого як людина, що включає (1) введення кількості однієї або більше сполуки даного винаходу і (2) здійснення методики на вище згаданому ссавці з метою визначення наявності і/або визначення важкості вище згаданих стенозів коронарної артерії. Даний винахід забезпечує сполуку даного винаходу для застосування в медичних діагностичних процедурах, переважно для застосування у визначенні наявності і оцінці важкості стенозів коронарної артерії у людини. Даний винахід забезпечує застосування сполуки даного винаходу для виробництва фармакологічного судинорозширювального агента, який можна було б застосовувати спільно з клінічними методиками візуалізації перфузії для діагностики і оцінки ступені важкості захворювання коронарної артерії. Переважними методиками візуалізації перфузії є планарна або однофотонна емісійна комп'ютерна томографія (ОФЕКТ), сцинтиграфічне дослідження на гаммі-камері, позитрон-емісійна томографія (ПЕТ), візуалізація за допомогою ядерного магнітного резонансу (ЯМР), магнітно-резонансна візуалізація (МРВ), перфузійна контрастна ехокардіографія, цифрова субтракційна ангіографія (ЦСА) і надшвидка рентгенівська комп'ютерна томографія (КІНО КТ). 20 UA 100035 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід також забезпечує фармацевтичну композицію, що містить ефективну кількість сполуки даного винахід, або її фармацевтично прийнятну сіль, в комбінації з фармацевтично прийнятним розріджувачем або носієм. Переважно дана композиція може бути представлена у вигляді стандартної лікарської форми, і може бути призначена для парентерального, наприклад, внутрішньовенного введення. Якщо не обумовлено інше, то застосовуються нижче наступні визначення. Поняття «ссавець» або «пацієнт» включає людину, коня, свиню, собаку і кішку. Поняття "заміщені" означає, що будь-який один або більше атомів водню на позначеному атомі заміщені групою, вибраною з певної групи, при умові, що не перевищується нормальна валентність позначеного атома, і що заміщення призводить до стійкої сполуки. Якщо замісник являє собою кето (тобто, =О), тоді 2 атоми водню на даному атомі заміщені. На ароматичних функціональних групах кето замісників немає. Поняття «галогено» являє собою фторо, хлоро, бромо або йодо. Поняття «алкіл» означає як лінійні, так і розгалужені алкільні групи; але посилання на окремий радикал, такий як "пропіл" включає в себе тільки радикал з прямим ланцюгом, ізомер з розгалуженим ланцюгом, таким як "ізопропіл" обумовлюється окремо. Конкретно, C1-6алкілом може бути метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, трет-бутил, пентил, 3пентил, неопентил, гексил і тому подібне в будь-якій формі з розгалуженим ланцюгом. Конкретні і переважні значення, перераховані нижчедля радикалів, замісників і їх груп, дані тільки для ілюстрації; вони не виключають інші певні значення або інші значення в межах певних груп радикалів і замісників. Поняття «обробка» або «лікування» охоплюють лікування хворобливого стану у ссавця, і включають: (a) запобігання виникненню хворобливого стану у ссавця, особливо, якщо цей ссавець має схильність до даного хворобливого стану, але йому ще не був поставлений діагноз, підтверджуючий те, що він страждає захворюванням; (b) пригнічення хворобливого стану, наприклад, пригнічення його розвитку; і/або (с) полегшення хворобливого стану, наприклад, викликаючи зворотний розвиток хворобливого стану, поки не буде досягнута бажана кінцева точка. Лікування також включає зменшення інтенсивності симптому захворювання (наприклад, зменшення болю або дискомфорту), причому подібне зменшення може безпосередньо або непрямо впливати на захворювання (наприклад, на його причину, передачу, прояв, і т.д.). Застосовуване в контексті даного документу поняття "спільно з" належить до спільного введення агента, перешкоджаючого відторгненню, і агоніста аденозинового рецептора A2A. Спільне введення агента і агоністів аденозинового рецептора A2A включає введення даного агента і агоніста або одночасно, у вигляді суміші, або послідовно. Послідовне введення агоністів аденозинового рецептора A2A можна здійснювати перед введенням даного агента, в межах хвилин або аж до близько 48 годин також до введення даного агента. Агоністи A2A аденозинового рецептора також можна вводити після агента. Переважно введення агоністів аденозинового рецептора A2A здійснюється в межах близько 24 годин або більше, переважно в межах близько 12 годин. Сполуки даного винаходу зазвичай називають відповідно до номенклатурних систем IUPAC або CAS. Можна застосовувати абревіатури, які добре відомі звичайному фахівцеві в даній галузі техніки (наприклад, "Ph" для фенілу, "Me" для метилу, "Et" для етилу, "год" для години або годин і "rt" для кімнатної температури). Фахівцями в даній галузі техніки буде оцінено за перевагами, що сполуки даного винаходу мають більше одного хірального центру і можуть бути виділені в оптично активній або рацемічній формах. Переважно, рибозидну функціональну групу даного винаходу одержують з D-рибози. Деякі сполуки можуть виявляти поліморфізм. Потрібно розуміти, що даний винахід включає в себе будь-яку рацемічну, оптично активну, поліморфічну або стереоізомерну форму, або їх суміші, сполуку даного винаходу, яка має корисні властивості, описані в контексті даного документу, при цьому на даному рівні техніки добре відомо, як одержати оптично активні форми (наприклад, за допомогою розділення рацемічної форми за методиками перекристалізації або ферментативними способами, за допомогою синтезу з оптично активних вихідних речовин, за допомогою хірального синтезу, або за допомогою хроматографічного розділення за допомогою хіральної нерухомої фази) і як визначити активність аденозинового агоніста за допомогою досліджень, описаних в контексті даного документу, або за допомогою інших схожих досліджень, які добре відомі на даному рівні техніки. Серед запальних реакцій, які можна лікувати (в тому числі провести профілактику) за допомогою сполуки даного винаходу, необов'язково інгібітора ФДЕ IV типу, запалення, зумовлене: (a) аутоімунною стимуляцією (аутоімунними захворюваннями), такими як червоний вовчак, множинний склероз, безплідність в результаті ендометріозу, цукровий діабет типу I, 21 UA 100035 C2 5 10 15 20 25 30 35 40 45 50 включаючи руйнування острівців Лангерганса, що призводить до діабету і запальних наслідків діабету, в тому числі виразок ніг, хвороби Крони, виразкового коліту, запального захворювання кишечнику, остеопорозу і ревматоїдного артриту; (b) алергічними захворюваннями, такими як астма, сінна лихоманка, риніт, сумах ядоносний, весняний кон'юнктивіт і інші патологічні стани, опосередковані еозинофілами; (с) шкіряними захворюваннями, такими як псоріаз, контактний дерматит, екзема, інфекційні шкіряні виразки, лікування відкритих ран, панікуліт; (d) інфекційними захворюваннями, включаючи сепсис, септичний шок, енцефаліт, інфекційний артрит, ендотоксиновий шок, грам-негативний шок, реакцію Яриша-Герксхаймера, антракс, епідемічне захворювання, туляремію, Ебола, оперізуючий лишай, токсичний шок, церебральну малярію, бактерійний менінгіт, синдром гострої дихальної недостатності (СГДН), хронічну обструктивну хворобу легких (ХОХЛ), хворобу Лайма, ВІЛ-інфекцію (ВІЛ реплікацію з підвищеним рівнем ФНОα, пригнічення активності інгібітора зворотної транскриптази за допомогою ФНОα); (е) захворюваннями, що спричиняють виснаження: кахексія на фоні раку і ВІЛ; (f) трансплантацією органу, тканини або клітин (наприклад, кісткового мозку, рогової оболонки ока, нирки, легені, печінки, серця, шкіри, острівців Лангерганса), включаючи відторгнення трансплантата і реакцію «трансплантат проти хазяїна»; (g) побічними ефектами внаслідок лікарської терапії, включаючи побічні ефекти лікування амфотерицином В, побічні ефекти імуносупресивної терапії, наприклад, лікування інтерлейкіном-2, побічні ефекти лікування препаратом OKT3, контрастними засобами, антибіотиками, побічні ефекти лікування ГМКСФ (гранулоцито-макрофаго-колонієстимулюючим фактором), побічні ефекти лікування циклоспорином і побічні ефекти аміноглікозидного лікування, стоматит і мукозит, зумовлений пригніченням імунітету; (h) серцево-судинними патологічними станами, включаючи розлади кровообігу, викликані або посилені запальною реакцією, такі як ішемія, атеросклероз, хвороба периферичних судин, рестеноз після ангіопластики, запальна аневризма аорти, васкуліт, інсульт, пошкодження спинного мозку, застійна серцева недостатність, геморагічний шок, травма ішемії/реперфузії, вазоспазм внаслідок субарахноїдального крововиливу, вазоспазм внаслідок інсульту, плеврит, перикардит і серцево-судинні ускладнення діабету; (i) діалізом, включаючи перикардит, зумовлений перитонеальним діалізом; (j) подагрою; і (k) хімічним або термічним пошкодженням вогнем, кислотою, лугом і тому подібне. Додаткові захворювання включають захворювання коней, такі як ламініт і кульгавість. Застосування даних сполук представляє особливий інтерес і має особливу ефективність при пригніченні запальних реакцій, при яких травма ішемії/реперфузії викликається ангіопластикою або тромболізом. Також особливий інтерес і особливу ефективність має застосування даних сполук при пригніченні запальних реакцій, зумовлених трансплантацією органів, тканин або клітин, тобто, трансплантацією алогенних або ксеногенних тканин ссавцю пацієнту, аутоімунними захворюваннями і запальними патологічними станами, зумовленими патологіями кровообігу і їх лікуванням, включаючи ангіопластику, впровадження стенту, шунтування або пересадку тканини. Несподівано виявилося, що введення однієї або більше сполук даного винаходу є ефективним після виникнення запальної реакції, наприклад, після того як пацієнт почав страждати від патології або травми, яка викликає запальну реакцію. Тканини або клітини, що містять сайти рецептора, що зв'язується з лігандом, можна застосовувати для вимірювання селективності сполук, що досліджуються по відношенню до специфічних підтипів рецептора, для вимірювання кількості біологічно активної сполуки в крові або інших фізіологічних рідинах, або їх можна застосовувати як інструмент для визначення потенційних терапевтичних агентів для лікування захворювань або патологічних станів, пов'язаних з сайтом активації рецептора, за допомогою взаємодії вище згаданих агентів з вищезгаданими комплексами ліганд-рецептор, і для вимірювання міри неправильного положення ліганду і/або зв„язування даного агента або клітинної відповіді на дію вище згаданого агента (наприклад, накопичення цАМФ). У контексті даного документу застосовувалися нижче перераховані абревіатури: 2-Aas 2-алкініладенозини; 125 6 125 I-ABA N -(4-аміно-3- йодобензил)аденозин APCI хімічна іонізація при атмосферному тиску 6 CCPA 2-хлоро-N -циклопентиладенозин; 6 Cl-IB-MECA N -3-йодо-2-хлорбензиладенозин-5'-N-метилуронамід; 6 CPA N -циклопентиладенозин ДМФА диметилформамід ДМСО диметилсульфоксид ДМСО-d6 дейтерований диметилсульфоксид EtOAc етилацетат 22 UA 100035 C2 ек. GPCR hA2AAR IADO 125 I-APE NECA IB-MECA 2-йодоаденозин 5 10 15 20 25 еквівалент рецептор, зв„язаний з G-білком; рекомбінантний людський A2A аденозиновий рецептор; 2-йодоаденозин 125 2-[2-(4-аміно-3-[ I]йодофеніл)етиламіно] аденозин; 5'-N-етилкарбоксамідоаденозин; 6 N -3-йодобензиладенозин-5'-N-метилуронамід; етиламід 5-(6-аміно-2-йодопурин-9-іл)-3,4-дигідрокситетрагідрофуран-2карбонової кислоти HPLC високоефективна рідинна хроматографія HRMS мас-спектрометрія високого розрізнення 125 125 I-ZM241385 I-4-(2-[7-аміно-2-[2-фурил][1,2,4]триазоло-[2,3-α][1,3,5]-триазин-5-іламіно]етил)фенол; INECA 2-йодо-N-етилкарбоксамідоаденозин LC/MS рідинна хроматографія/мас-спектрометрія m.p. температура плавления МГц мегагерц MRS 1220 N-(9-хлоро-2-фуран-2-іл-[1,2,4]триазоло[1,5-c]хіназолін-5-іл)-2фенілацетамід; MS мас-спектрометрія NECA N-етилкарбоксамідоаденозин ЯМР ядерний магнітний резонанс RP-HPLC зворотно-фазова хроматографія TBAF тетрабутиламоній фторид TBS трет-бутилдиметилсиліл TBDMSCl трет-бутилдиметилсилілхлорид TEA триетиламін TFA трифтороцтова кислота ТГФ тетрагідрофуран TLC тонкошарова хроматографія p-TSOH пара-толуолсульфонова кислота XAC 8-(4-((2-аміноетил)амінокарбонілметилокси)феніл)-1-3-дипропілксантин Конкретні інгібітори фосфодіестерази IV типу, що застосовуються на практиці в даному винаході, включають рацемічні і оптично активні 4-(поліалкоксифеніл)-2-піролідони, розкриті і описані в патенті США № 4193926. Роліпрам являє собою приклад придатного інгібітора ФДЕ IV типу. Даний винахід, крім того, забезпечує фармацевтичні композиції, які включають сполуки даного винаходу в комбінації з одним або більше членами, вибраними з групи, яка складається з нижче перерахованих: (a) інгібіторів біосинтез лейкотрієнів, інгібіторів 5-ліпоксигенази (5-LO), і антагоністів білка активації 5-ліпоксигенази (FLAP), вибраних з групи, що складається із зилейтону; ABT-761; фенлейтону; тепоксаліну; Abbott-79175; Abbott-85761; N-(5-заміщених)тіофен-2-алкілсульфонамідів формули (5.2.8); 2,6-ди-трет-бутилфенолгідразонів формули (5.2.10); Zeneca ZD-2138 формули (5.2.11); SB-210661 формули (5.2.12); піридинілзаміщеної 2ціанонафталінової сполуки L-739,010; 2-ціанохінолінової сполуки L-746,530; індольних і хінолінових сполук MK-591, MK-886 і BAY х 1005; (b) антагоністів рецептора для лейкотрієнів LTB4, LTC4, LTD4 і LTE4, вибраних з групи, що складається з фенотіазин-3-онової сполуки L651,392; амідиносполуки CGS-25019c; бензоксазоламінової сполуки онтазоласту; бензолкарбоксімідамідної сполуки BIIL 284/260; сполук зафірлукасту, аблукасту, монтелукасту, пранлукасту, верлукасту (MK-679), RG-12525, Ro-245913, іралукасту (CGP 45715A) і BAY х 7195; (d) інгібіторів 5-ліпоксигенази (5-LO) і антагоністів білка активації 5-ліпоксигенази (FLAP); (е) парних інгібіторів 5-ліпоксигенази (5-LO) і антагоністів фактора активації тромбоцитів (ФАТ); (f) теофіліну і амінофіліну; (g) інгібіторів ЦОГ-1 (НПВС); і НПВС оксиду азоту; (h) селективного інгібітора ЦОГ-2 Рофекоксибу; (i) інгальованих глюкокортикоїдів із зменшеними системними побічними ефектами, вибраними з групи, що складається з преднізону, преднізолону, флунізоліду, триамцинолону ацетоніду, беклометазону дипропіонату, будесоніду, флутиказону пропіонату і мометазону фуроату; (j) антагоністів фактора активації тромбоцитів (ФАТ); (k) моноклональних антитіл активних по відношенню до ендогенних запальних організмів; (l) протипухлинних агентів фактора некрозу (ФНОα), вибраних з групи, що складається з етанерцепту, інфліксимабу і D2E7; (m) інгібіторів адгезивних молекул, включаючи антагоністи VLA-4; (n) імунодепресивних речовин, вибраних з групи, що складається з циклоспорину, 23 UA 100035 C2 5 10 15 20 25 30 35 40 45 50 55 60 азатіоприну і метотрексату; або (о) речовин проти подагри, вибраних з групи що складається з колхіцинів. Прикладами фармацевтично прийнятних солей є солі приєднання органічних кислот, утворені кислотами, які дають фізіологічно прийнятний аніон, наприклад, тозилат, метансульфонат, сіль яблучної кислоти, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, α-кетоглутарат і α-гліцерофосфат. Можна також одержувати відповідні неорганічні солі, включаючи солі гідроCl, сульфат, нітрат, бікарбонат і карбонат. Фармацевтично прийнятні солі можна одержати за допомогою стандартних способів, добре відомих на даному рівні техніки, наприклад, за допомогою реакції достатньо основної сполуки, такої як амін, з відповідною кислотою, що дає фізіологічно прийнятний аніон. Також можна одержати солі карбонових кислот лужних (наприклад, натрію, калію або літію) або лужноземельних металів (наприклад, кальцію). Сполуки даного винаходу можна формулювати у вигляді фармацевтичних композицій і вводити в організм ссавця, такого як людина у множині форм, призначених для вибраного шляху введення, тобто перорально або парентерально, за допомогою внутрішньовенного, внутрішньом'язового, місцевого або підшкірного шляхів. Таким чином, дані сполуки можна вводити систематично, наприклад, перорально, в комбінації з фармацевтично прийнятним середовищем, таким як інертний розріджувач або засвоюваний придатний для вживання в їжу носій. Вони можуть бути взяті в желатинові капсули з твердою або м'якою оболонкою, можуть бути спресовані в таблетки або можуть безпосередньо входити до складу їжі раціону пацієнта. Для перорального терапевтичного введення активну сполуку можна комбінувати з однією або більше допоміжними речовинами і застосовувати в формі таблеток, що проковтуються, букальних таблеток, пастилок, капсул, еліксирів, суспензій, сиропів, пластинок і тому подібне. Подібні композиції і препарати повинні містити щонайменше 0,1% активної сполуки. Процентний вміст композицій і препаратів може, зазвичай, варіюватися і може умовно складати від близько 2 до близько 60% маси даної стандартної лікарської форми. Кількість активної сполуки в подібних терапевтично застосовних композиціях є такою, щоб досягався рівень ефективної дози. Таблетки, пастилки, пілюлі, капсули і тому подібне також можуть містити: зв'язуючі речовини, такі як трагакантову камедь, аравійську камедь, кукурудзяний крохмаль або желатин; допоміжні речовини, такі як дикальцій фосфат; розпушувач, такий як кукурудзяний крохмаль, картопляний крохмаль, альгинова кислота і тому подібне; лубрикант, такий як стеарат магнію; і підсолоджувач, такий як сахароза, фруктоза, лактоза або аспартам, або ароматизатор, такий як перцева м'ята, олія вінтергрену або вишневий ароматизатор. Якщо стандартна лікарська форма являє собою капсулу, то вона може містити, крім речовин, описаних вище, рідкий носій, такий як рослинна олія або поліетиленгліколь. Різні інші речовини можуть бути присутніми як покриття або щоб інакше модифікувати фізичну форму твердої стандартної лікарської форми. Наприклад, таблетки, пілюлі або капсули можуть бути покриті желатином, воском, шелаком або цукром і тому подібне. Сироп або еліксир може містити активну сполуку, сахарозу або фруктозу як підсолоджувач, метил і пропілпарабени як консерванти, барвник і ароматизатор, такий як вишневий або апельсиновий ароматизатор. Кінцева будь-яка речовина, яка застосовується для одержання будь-якої стандартної лікарської форми, повинна бути фармацевтично прийнятною і по суті нетоксичною в кількостях, що застосовуються. Крім того, активна сполука може бути включена в препарати і пристрої з уповільненим вивільненням. Активну сполуку можна також вводити внутрішньовенно або внутрішньочеревинно за допомогою інфузії або ін'єкції. Розчини активної сполуки або її солі можна готувати у воді, необов'язково в суміші з нетоксичним сурфактантом. Також можна одержувати дисперсії в гліцерині, рідких поліетиленгліколях, триацетилгліцерині і їх сумішах і в маслах. При звичайних умовах зберігання і застосування, дані препарати містять консервант для запобігання зростанню мікроорганізмів. Фармацевтичні лікарські форми, придатні для ін'єкції або інфузії, можуть включати стерильні водні розчини або дисперсії або стерильна порошки, що містять активний інгредієнт, які призначені для швидкого одержання стерильних ін„єктованих або інфузованих розчинів або дисперсій, необов'язково взяті в оболонки ліпосом. У всіх випадках, кінцева лікарська форма повинна бути стерильною, рідкою і стійкою в умовах виробництва і зберігання. Рідким носієм або середовищем може бути середовище розфактора або рідке дисперсійне середовище, що містить, наприклад, воду, етанол, поліол (наприклад, гліцерин, пропіленгліколь, рідкі поліетиленгліколі і тому подібне), рослинні олії, нетоксичний гліцериновий ефір і їх відповідні суміші. Належну текучість можна підтримувати, наприклад, за допомогою формування ліпосом, за допомогою забезпечення необхідного розміру частинок у випадку дисперсій або за 24 UA 100035 C2 5 10 15 20 25 30 35 40 45 50 55 60 допомогою застосування сурфактантів. Запобігання дії мікроорганізмів може бути здійснене за допомогою різних антибактеріальних і протигрибкових агентів, наприклад, парабенів, хлорбутанолу, фенолу, сорбінової кислоти, тимеросалу і тому подібне. У багатьох випадках буде переважним включати ізотонічні агенти, наприклад, цукор, буферні речовини або хлорид натрію. Пролонговане всмоктування ін„єктованих композицій може бути забезпечене за допомогою застосування в композиціях агентів, що уповільнюють абсорбцію, наприклад, моностеарату алюмінію і желатину. Стерильні ін„єктовані розчини одержують за допомогою об'єднання активної сполуки в необхідній кількості у відповідному розчиннику з різними іншими інгредієнтами, які перераховані вище, за необхідністю, після чого іде стерилізація фільтруванням. У випадку стерильних порошків для одержання стерильних ін„єктованих розчинів, переважними способами одержання є методики вакуумної сушки і ліофільної сушки, які дають порошок активного інгредієнта плюс будь-який додатковий необхідний інгредієнт, присутній в заздалегідь стерильно відфільтрованих розчинах. Для місцевого введення дані сполуки можна застосовувати в чистій формі, тобто, коли вони являють собою рідини. Однак зазвичай потрібно застосовувати їх на шкірі, як композиції або склади, в комбінації з дерматологічно прийнятним носієм, який може бути твердою речовиною, рідиною або у вигляді дерматологічного пластиру. Застосовні тверді носії включають дрібнодисперсні тверді речовини, такі як тальк, глина, мікрокристалічна целюлоза, окис кремнію, окис алюмінію і тому подібне. Застосовні рідкі носії включають воду, спирти або гліколі або суміші вода-спирт/гліколь, в яких можна розчинити або диспергувати дані сполуки в ефективних кількостях, необов'язково за допомогою нетоксичних сурфактантів. Допоміжні речовини, такі як ароматизуючі речовини, і додаткові протимікробні речовини можна додавати для оптимізації властивостей для даного застосування. Одержані рідкі композиції можна застосовувати у вигляді гігроскопічних прокладок, що застосовуються в бандажах для вагітних і інших пов'язках, або розпилювати на уражену ділянку за допомогою дозуючого насоса або аерозольних розпилювачів. Загусники, такі як синтетичні полімери, жирні кислоти, солі і ефір жирних кислот, жирні спирти, модифіковані целюлози або модифіковані мінеральні речовини, також можна застосовувати разом з рідкими носіями для формування паст, що легко намазуються, гелів, мазей, мил і тому подібне, для нанесення безпосередньо на шкіру пацієнта. Приклади застосовних дерматологічних композицій, які можна застосовувати для нанесення сполук даного винаходу на шкіру, розкриті в Jacquet et al. (Патент США № 4608392), Geria (Патент США № 4992478), Smith et al. (Патент США № 4559157) і Wortzman (Патент США № 4820508). Застосовне дозування сполук даного винаходу можна визначити, порівнюючи їх in vitro і in vivo активність на моделях тварин. На даному рівні техніки відомі способи екстраполяції ефективного дозування для мишей і інших тварин по відношенню до людей; дивись, наприклад, Патент США № 4938949. Застосовні дози інгібіторів ФДЕ IV типу відомі на даному рівні техніки. Дивись, наприклад, Патент США № 5877180, Абз. 12. Зазвичай концентрація сполуки(лук) даного винаходу в рідкій композиції, такій як лосьйон, буде складати близько 0,1-25% мас. %, переважно близько 0,5-10 мас. %. Концентрація напівтвердої або твердої композиції, такої як гель або порошок буде складати близько 0,1-5 мас. %, переважно близько 0,5-2,5 мас. %. Кількість сполуки або її активної солі або похідного, необхідна для застосування при лікуванні буде змінюватися залежно не тільки від конкретної вибраної солі, але також і від шляху введення, природи патологічного стану, який необхідно лікувати, і віку і стану пацієнта, і буде в кінцевому результаті братися на розсуд лікуючого лікаря або клініциста. Зазвичай, однак, відповідна доза лежить в діапазоні від близько 0,5 до близько 100 мкг/кг, наприклад, від близько 10 до близько 75 мкг/кг маси тіла на день, так наприклад, від 3 до близько 50 мкг на кілограм маси тіла пацієнта на день, переважно в діапазоні від 6 до 90 мкг/кг/день, найбільш переважно в діапазоні від 15 до 60 мкг/кг/день. Дану сполуку умовно вводять у вигляді стандартної лікарської форми; наприклад, що містить від 5 до 1000 мкг, умовно від 10 до 750 мкг, більш переважно від 50 до 500 мкг активного інгредієнта в одиниці лікарської форми. В ідеалі активний інгредієнт потрібно вводити до досягнення максимальних концентрацій активної сполуки в плазмі крові від близько 0,1 до близько 10 нM, переважно від близько 0,2 до 10 нM, найбільш переважно від близько 0,5 до близько 5 нM. Такого рівня можна досягнути, наприклад, за допомогою внутрішньовенної ін'єкції від 0,05 до 5% розчину активного інгредієнта, необов'язково в сольовому розчині, або, вводячи перорально у вигляді таблетки, 25 UA 100035 C2 5 10 15 20 25 30 35 40 45 50 55 60 що містить близько 1-100 мкг активного інгредієнта. Необхідні рівні активної сполуки в крові можна підтримувати за допомогою постійної інфузії для забезпечення близько 0,01-5,0 мкг/кг/годину або періодичних інфузій, що містять біля 0,4-15 мкг/кг активного інгредієнта(ів). Необхідна доза може бути переважно представлена у вигляді однократної дози або у вигляді дробових доз, що вводяться з певними інтервалами, наприклад, у вигляді двох, трьох, чотирьох більш менших доз на день. Менша доза сама по собі може бути додатково розділена, наприклад, на ряд окремих введень через невизначені проміжки часу; як наприклад, множинні інгаляції з інсуфлятора або введення множини порцій крапель в око. Наприклад, необхідним є введення даних композицій внутрішньовенно протягом тривалого періоду часу після пошкодження, яке призводить до запалення. Здатність сполуки даного винаходу діяти як агоніст аденозинового рецептора A2A може бути визначена за допомогою фармакологічних моделей, які добре відомі на даному рівні техніки, або за допомогою досліджень, описаних нижче. Дані сполуки і композиції, що містять їх, вводять як фармакологічні стресори і застосовують в поєднанні з будь-якою однією з декількома неінвазивними діагностичними процедурами для вимірювання свідчення міокардіальної перфузії. Наприклад, аденозин внутрішньовенно можна вводити в поєднанні з візуалізацією міокардіальної перфузії за допомогою Талію-201, для того щоб оцінити ступінь тяжкості ішемії міокарда. У такому випадку будь-який один з декількох різних радіофармацевтичних препаратів може бути заміщений Талієм-201 (наприклад, технецій99m-мічені радіофармацевтичні препарати (тобто: Tc-99m-сестаміби, Tc-99m-тебороксим), йод123-мічені радіофармацевтичні препарати, такі як I-123-IPPA або BMIPP, рубідій-82, азот-13 і т.д.). Аналогічно, одну з даних сполук можна вводити як фармакологічний стресор в поєднанні з радіонуклідною вентрикулографією, для того щоб оцінити ступінь тяжкості скорочувальної дисфункції міокарда. У такому випадку, спочатку можна провести радіонуклідні вентрикулографічні дослідження або синхронізовані рівноважні дослідження правого і/або лівого шлуночка. Аналогічно, сполуку даного винаходу можна вводити як фармакологічний стресор в поєднанні з ехокардіографією, для того щоб визначити наявність патологій регіонарного руху стінки. Аналогічно, активну сполуку можна вводити як фармакологічний стресор в поєднанні з інвазивними вимірюваннями коронарного кровотоку, як наприклад, за допомогою катетера для введення в порожнину серця, для того щоб оцінити функціональне значення стенозованих коронарних судин. Забезпечується також спосіб діагностики патологій перфузії міокарда у ссавця, що включає: (a) парентеральне введення вище згаданому ссавцеві будь-якої кількості сполуки або композиції, описаної вище; і (b) проведення у ссавця процедури визначення наявності стенозів коронарної артерії, оцінки ступені тяжкості стенозів коронарної артерії або і того і іншого. Дисфункція міокарда може являти собою, наприклад, захворювання коронарної артерії, шлуночкову дисфункцію і відмінності в кровотоці через здорові коронарні судини і/або стеноїзовані коронарні судини. Методика визначення наявності і оцінки ступені тяжкості захворювання коронарної артерії може являти собою, наприклад, радіофармацевтичну візуалізацію перфузії міокарда, візуалізацію функції шлуночка або методики для вимірювання швидкості коронарного кровотоку. Радіофармацевтична візуалізація перфузії міокарда може являти собою, наприклад, площинну сцинтиграфію, однофотонну емісійну комп'ютерну томографію (ОФЕКТ), позитрон-емісійну томографію (ПЕТ), візуалізацію ядерним магнітним резонансом (ЯМР), контрастну ехокардіографію перфузії, цифрову субтракційну ангіографію (ЦСА) і надшвидку рентгенівську комп'ютерну томографію (КІНО КТ). Радіофармацевтичний препарат можна застосовувати в поєднанні з радіофармацевтичною візуалізацією перфузії міокарда, і радіофармацевтичний препарат може містити, наприклад, радіонуклід, вибраний з групи, що складається з талію-201, технецію-99m, азоту-13, рубідію-82, йоду-123 і кисню-15. Якщо радіофармацевтична візуалізація перфузії міокарда являє собою сцинтиграфію, то радіофармацевтичним препаратом може бути талій-201. Методика візуалізації функції шлуночка може являти собою, наприклад, ехокардіографію, контрастну вентрикулографію або радіонуклідну вентрикулографію. Спосіб вимірювання швидкості коронарного кровотоку може являти собою, наприклад, катетер доплерівського потоку, цифрову субтракційну ангіографію і радіофармацевтичні способи візуалізації. Дані способи діагностики також можуть включати стадії: (a) введення людині за допомогою внутрішньовенної інфузії або за допомогою болюсної ін'єкції кількості сполуки або композиції, описаної вище, для забезпечення дилатації коронарної артерії; (b) введення людині радіофармацевтичного препарату, що включає талій-201 або технецій-99m; і (с) проведення сцинтиграфії у людини, для того щоб визначити наявність і оцінити ступінь тяжкості захворювання коронарної артерії. Радіофармацевтичним препаратом може бути, наприклад, Tc-99m-сестаміби. 26 UA 100035 C2 5 10 15 20 25 30 35 40 45 50 Даний спосіб зазвичай включає введення однієї або більше сполук даного винаходу за допомогою внутрішньовенної інфузії в дозах, які є ефективними для забезпечення дилатації коронарної артерії (приблизно 0,25-500, переважно 1-250 мкг/кг/хв). Однак її застосування інвазивним способом може включати інтракоронарне введення лікарського засобу в болюсних дозах 0,5-50 мкг. Переважні способи включають застосування сполуки даного винаходу як заміну фізичного навантаження в поєднанні з візуалізацією перфузії міокарда, для того щоб визначити наявність і/або оцінити ступінь тяжкості захворювання коронарної артерії у людей, у яких візуалізація перфузії міокарда здійснюється за допомогою будь-якого одного з декількох способів, включаючи радіофармацевтичну візуалізацію перфузії міокарда із застосуванням площинної сцинтиграфії або однофотонної емісійної комп'ютерної томографії (ОФЕКТ), позитроно-емісійної томографії (ПЕТ), візуалізації за допомогою ядерного магнітного резонансу (ЯМР), перфузійної контрастної ехокардіографії, цифрової субтракційної ангіографії (ЦСА) або надшвидкої рентгенівської комп'ютерної томографії (КІНО КТ). Також забезпечується спосіб, що включає застосування сполуки даного винаходу як заміни фізичного навантаження, в поєднанні з візуалізацією, для того щоб визначити наявність і/або оцінити ступінь тяжкості ішемічної шлуночкової дисфункції у людей, у яких ішемічна шлуночкова дисфункція вимірюється за допомогою будь-якого одного з декількох способів візуалізації, включаючи ехокардіографію, контрастну вентрикулографію або радіонуклідну вентрикулографію. Дисфункція міокарда може також являти собою захворювання коронарної артерії, шлуночкову дисфункцію, відмінності в кровотоці через здорові і стенозовані коронарні судини і тому подібне. Також забезпечується спосіб, що включає застосування сполуки даного винаходу як агента, що посилює коронарний кровообіг в поєднанні з засобами для вимірювання швидкості коронарного кровотоку, щоб оцінити судинорозширювальну здатність (резервну здатність) коронарних артерій у людей, у яких швидкість коронарного кровотоку вимірюється за допомогою будь-якого одного з декількох способів, включаючи катетер доплерівського потоку або цифрову субтракційну ангіографію. Даний винахід буде додатково описаний за допомогою посилання на наступні докладні приклади, які даються для ілюстрації даного винаходу, і не є обмежувальними. ПРИКЛАДИ 1 Спектри протонного ядерного магнітного резонансу ( H ЯМР) реєструвалися на 300 МГц спектрофотометрі Varian Gemini 2000 (або подібному пристрої). Значення хімічного зсуву виражені в ч/мл (частин на мільйон) відносно тетраметилсилану. Що стосується представлення даних, с=синглет, д=дублет, т=триплет, кв=квартет і м=мультиплет. Мас-спектри вимірювали на установці Finnigan LCQ Advantage. Аналітичну ВЕРХ проводили на установці Shimazdu LC10 або LC20 Systemtimes (150 мм), як описано нижче. Препаративну ВЕРХ проводили на установці Shimadzu Discovery HPLC з колонкою Shim-pack VP-ODS C18 (20×100 мм), що працює при кімнатній температурі. Сполуку елюювали зі швидкістю 30 мл/хв з градієнтом 20-80% води (що містить 0,1% ТФК) в метанолі протягом 15 хвилин з УФ-детекцією на довжині хвилі 254 нм, застосовуючи настоюваний детектор SPD10A VP. За допомогою ВЕРХ було визначено, що всі кінцеві сполуки, представлені в контексті даного документу, мають ступінь чистоти більше 98%. Флеш-хроматографію проводили на гелі Silicyle 60A (230-400 меш) або із застосуванням хроматографічних колонок багаторазового використання і системи RT Scientific, Manchester N.H. Всі реакції проводили в атмосфері азоту в прожареному скляному посуді, якщо не обумовлено інше. Приклад 1 Циклобутиловий ефір 4-{3-[6-аміно-9-(5-циклопропілкарбамоїл-3,4дигідрокситетрагідрофуран-2-іл)-9H-пурин-2-іл]-проп-2-ініл}-піперидин-1-карбонової кислоти До трифосгену (0,34 ек.), що перемішується в ТГФ при 0ºC в інертній атмосфері, повільно додавали спирт (1,0 ек.) і диметиланілін (1,1 ек.) у вигляді розчину в безводному ТГФ. Через 27 UA 100035 C2 5 10 15 20 25 30 десять хвилин реакцію нагрівали до кімнатної температури і перемішували протягом ще 3 год. Потім додавали безводний ДХМ, і одержану суміш підливали повільно до розчину Nгідроксисукцинаміду (1,3 ек.) в безводному ДХМ при 0ºC. Реакцію повільно нагрівали до кімнатної температури і перемішували протягом ночі. До одержаної суміші додавали воду, і після перемішування протягом ще 3 год одержаний розчин розбавляли EtOAc. Органічний шар промивали тричі водою, один раз сольовим розчином, потім сушили (MgSO4) і концентрували. Одержане масло (яке може являти собою суміш карбонату і симетричного ангідриду) взяли на наступну стадію без очищення. Піперидинове похідне (0,75 ек.) розчиняли в безводному ТГФ, і повільно додавали ТЕА (надлишок) при кімнатній температурі в інертній атмосфері. Карбонатну сполуку (1,0 ек.) розбавляли ТГФ і додавали по краплях до піперидинового розчину. Одержану суміш перемішували протягом 24 год, потім концентрували для проведення хроматографії на силикагелі (при цьому градієнт починався від 100% гексану аж до 80% ДХМ в гексані). Одержане масло (прибл. 60% вихід) зберігали при 4°С до подальшого застосування. Йодопохідне (1,0 ек.) розчиняли в розчині ДМФА:АЦН:ТЕА 5:5:1 (всі розфактори були сильно дегазовані) і перемішували при кімнатній температурі в інертній атмосфері. Слідом за алкіновим похідним (4,0 ек.) додавали паладієвий каталізатор (~5 мольних %) і йодид міді [I] (1,05 ек.). Одержаний темний розчин перемішували протягом ночі, потім концентрували для проведення хроматографії на силікагелі (при цьому градієнт починався від 100% ДХМ аж до 10% MeOH в ДХМ). Одержане масло додатково очищували за допомогою препаративної ВЕРХ для одержання брудно-білої твердої речовини (прибл. 30% вихід). 1 H-ЯМР (DДМСО) δ 8,56 (с, 1H), 8,30 (с, 1H), 7,52 (с, 2H), 5,97 (д, 1H, J=6,6), 5,67 (дд, 2H, J=21,3, 4,8), 4,84 (п, 1H, J=5,9), 4,64 (кв, 1H, J=4,8), 4,30 (д, 1H, J=2,1), 4,21 (м, 1H), 4,00 (д, 2H, J=12,9), 3,12 (м, 1H), 2,719 (м, 4H), 2,430 (д, 2H, J=6,3), 2,272 (м, 2H), 2,00 (м, 2H), 1,77 (м, 2H), 1,56 (м, 2H), 1,207 (м, 2H), 0,68 (м, 1H), 0,50 (м, 1H). + LRMS ESI (M+H ) 540,35. ВЕРХ: градієнт MeOH 20-95% у воді протягом 4 хвилин при 40ºC, усього 6 хвилин. Час утримування = 3,04 хв (6 хв спосіб). Приклад 2 N-циклопропіл-2-{3-[1-((тетрагідрофуран-3-ілокси)карбоніл)піперидин-4-іл]пропін-1іл}аденозин-5'-уронамід. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted 4-{3-[6-amino-9-(3,4-dihydroxy-tetrahydro-furan-2-yl)-9h-purin-2-yl]-prop-2-ynyl}-piperidine-1-carboxylic acid esters as a2ar agonists
Автори англійськоюThompson, Robert, Beauglehole, Anthony, Schmidtmann, Frank, Rieger, Jayson
Назва патенту російськоюЗамещенные эфиры 4-{3-[ amiho-9-(3, 2-ил)-9 пурин-2-ил]-проп-2-инил}-пиперидин-1-карбоновой кислоты как a2ar агонисты
Автори російськоюТомпсон Роберт, Бьюглхоул Энтони, Шмидтманн Фрэнк, Риджер Джейсон
МПК / Мітки
МПК: A01N 43/90, A61K 31/52
Мітки: агоністи, заміщені, кислоти, 4-{3-[6-аміно-9-(3,4-дигідрокситетрагідрофуран-2-іл)-9н-пурин-2-іл]-проп-2-ініл}-піперидин-1-карбонової, ефіри
Код посилання
<a href="https://ua.patents.su/53-100035-zamishheni-efiri-4-3-6-amino-9-34-digidroksitetragidrofuran-2-il-9n-purin-2-il-prop-2-inil-piperidin-1-karbonovo-kisloti-yak-a2ar-agonisti.html" target="_blank" rel="follow" title="База патентів України">Заміщені ефіри 4-{3-[6-аміно-9-(3,4-дигідрокситетрагідрофуран-2-іл)-9н-пурин-2-іл]-проп-2-ініл}-піперидин-1-карбонової кислоти як a2ar агоністи</a>
Попередній патент: Спосіб коректування коефіцієнта посилення ємкісного елемента та пристрій для його здійснення
Наступний патент: Купівельний візок, що має ручку для штовхання
Випадковий патент: Фрикційний клиновий гаситель коливань