Похідні 2-((4-аміно-3-(3-фтор-5-гідроксифеніл)-1н-піразоло[3,4-d]піримідин-1-іл)метил)-3-(2-(трифторметил)бензил)хіназолін-4(3н)-oну і їх застосування як інгібіторів фосфоінозитид-3-кінази
Номер патенту: 116002
Опубліковано: 25.01.2018
Автори: Сміт Алан Джон, Копманс Алекс Герман, Брукс Руді Лорент Марія, Таддеі Девід Мішель Адрієн, Оніонс Стюарт Томас
Формула / Реферат
1. Сполука формули (І)
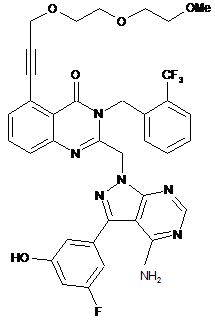 , (I)
, (I)
або її фармацевтично прийнятна сіль, включаючи всі її таутомери.
2. Сполука формули (І) за п. 1, рентгенограма XRPD якої містить характерні піки 9,7, 12,2, 14,1 і 14,3 (±0,2 градуса, значення 2-тета).
3. Сполука формули (І) за п. 2, у вигляді її форми 2 кристалічного поліморфу, рентгенограма XRPD якої містить характерні піки 8,2, 9,0, 9,2, 9,7, 12,2, 14,1, 14,3, 15,0, 16,4, 18,0, 18,5, 19,0, 19,6, 21,8, 22,3, 22,5, 24,3, 24,5, 24,8, 25,1 і 25,8 (±0,2 градуса, значення 2-тета).
4. Фармацевтична композиція, яка містить сполуку за будь-яким одним із пп. 1-3, у комбінації з одним або більше фармацевтично прийнятним розріджувачем або носієм.
5. Фармацевтична композиція за п. 4, яка містить додатково другий або додатковий активний інгредієнт, наприклад, вибраний із кортикостероїдів, бета-агоністів, ксантинів, мускаринових антагоністів і інгібіторів р38 МАР кінази.
6. Комбінований продукт, який містить:
(A) сполуку формули (І) за будь-яким одним із пп. 1-3; і
(B) додатковий активний інгредієнт, наприклад, вибраний із кортикостероїдів, бета-агоністів, ксантинів, мускаринових антагоністів, інгібіторів фосфодіестерази й інгібіторів р38 МАР кінази,
де кожний з компонентів (А) і (В) знаходиться в складі суміші з фармацевтично прийнятним розріджувачем або носієм.
7. Застосування сполуки формули (І) за будь-яким одним із пп. 1-3 як лікарського засобу.
8. Застосування сполуки формули (І) за будь-яким одним із пп. 1-3 як лікарського засобу, що підлягає введенню, у комбінації з одним або більше додатковим активним інгредієнтом, наприклад, вибраним із кортикостероїдів, бета-агоністів, ксантинів, мускаринових антагоністів і інгібіторів р38 МАР кінази.
9. Застосування сполуки формули (І) за будь-яким одним із пп. 1-3 або фармацевтичної композиції за п. 4 або за п. 5, або комбінованого продукту за п. 6 у лікуванні або профілактиці стану, вибраного із:
ХОЗЛ (включаючи хронічний бронхіт і емфізему), астми, педіатричної астми, кістозного фіброзу, саркоїдозу, ідіопатичного легеневого фіброзу, алергійного риніту, риніту, синуситу, і викликаного вірусом загострення будь-якого одного з них, респіраторних вірусних інфекцій (включаючи викликані ними ускладнення), алергійного кон'юнктивіту, кон'юнктивіту, алергійного дерматиту, контактного дерматиту, псоріазу, виразкового коліту, запалення суглобів, вторинного відносно ревматоїдного артриту або остеоартриту, ревматоїдного артриту, панкреатиту, кахексії, інгібування росту і метастазування пухлин, включаючи дрібноклітинну карциному легень, карциному грудей, карциному шлунка, колоректальну карциному і злоякісну меланому.
10. Застосування сполуки формули (І) за будь-яким одним із пп. 1-3 або фармацевтичної композиції за будь-яким одним із пп. 4 або 5, або комбінованого продукту за п. 6 для виготовлення лікарського засобу для лікування або профілактики стану, вибраного із: ХОЗЛ (включаючи хронічний бронхіт і емфізему), астми, педіатричної астми, кістозного фіброзу, саркоїдозу, ідіопатичного легеневого фіброзу, алергійного риніту, риніту, синуситу, і викликаного вірусом загострення будь-якого одного з них, респіраторних вірусних інфекцій (включаючи викликані ними ускладнення), алергійного кон'юнктивіту, кон'юнктивіту, алергійного дерматиту, контактного дерматиту, псоріазу, виразкового коліту, запалення суглобів, вторинного відносно ревматоїдного артриту або остеоартриту, ревматоїдного артриту, панкреатиту, кахексії, інгібування росту і метастазування пухлин, включаючи дрібноклітинну карциному легень, карциному грудей, карциному шлунка, колоректальну карциному і злоякісну меланому.
11. Спосіб лікування стану, вибраного із: ХОЗЛ (включаючи хронічний бронхіт і емфізему), астми, педіатричної астми, кістозного фіброзу, саркоїдозу, ідіопатичного легеневого фіброзу, алергійного риніту, риніту, синуситу, і викликаного вірусом загострення будь-якого одного з них, респіраторних вірусних інфекцій (включаючи викликані ними ускладнення), алергійного кон'юнктивіту, кон'юнктивіту, алергійного дерматиту, контактного дерматиту, псоріазу, виразкового коліту, запалення суглобів, вторинного відносно ревматоїдного артриту або остеоартриту, ревматоїдного артриту, панкреатиту, кахексії, інгібування росту і метастазування пухлин, включаючи дрібноклітинну карциному легень, карциному грудей, карциному шлунка, колоректальну карциному і злоякісну меланому, що включає введення суб'єкту ефективної кількості сполуки формули (І) за будь-яким одним із пп. 1-3, фармацевтичної композиції за будь-яким одним із пп. 4 або 5, або комбінованого продукту за п. 6.
12. Проміжна сполука формули (II):
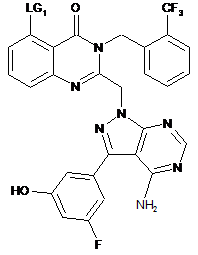 , (II)
, (II)
де LG1 являє собою відхідну групу або її захищене похідне.
13. Спосіб одержання сполуки формули (І) за будь-яким одним із пп. 1-3, який включає
здійснення взаємодії сполуки формули (II)
 , (II)
, (II)
або її захищеного похідного,
де LG1 являє собою відхідну групу, із фрагментом:

в умовах, що підходять для одержання сполуки формули (І) або її захищеного похідного, і,
за необхідності, видалення захисної групи в
захищеної сполуки з одержанням сполуки формули (І).
14. Сполука формули (Іа)
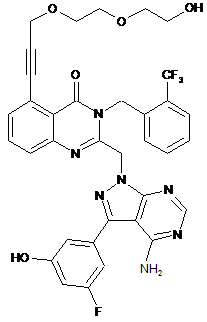 , (Ia)
, (Ia)
або її фармацевтично прийнятна сіль, включаючи всі її таутомери.
15. Сполука формули (І):
 , (I)
, (I)
у вигляді її кристалічного поліморфу Форми 2, рентгенограма XRPD якої практично відповідає рентгенограмі, представленій на ФІГ. 5.
Текст
Реферат: Даний винахід стосується, разом з іншим, сполуки формули (І) UA 116002 C2 (12) UA 116002 C2 O OMe O O CF3 N N N N N N HO H2 N F (I) і композицій, які її містять, і застосування зазначеної сполуки і композицій зазначеної сполуки для лікування, наприклад для лікування запальних захворювань, зокрема респіраторних запальних захворювань. Даний винахід також поширюється на способи одержання зазначених сполук. UA 116002 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Даний винахід стосується сполук, що інгібують фосфоїнозитид-3-кінази, (PI3 кінази, PI3K). Зокрема, винахід стосується сполук, що інгібують PI3K дельта підтип і, крім того, їх гамма підтип, і їхнього застосування в терапії, включення у фармацевтичні композиції, особливо для лікування запальних захворювань, включаючи запальні захворювання легень, такі як ХОЗЛ і астма. Даний винахід також поширюється на способи одержання зазначених сполук і на фармацевтичні композиції, які містять їх. Рівень техніки Ліпідкінази каталізують фосфорилування ліпідів з одержанням видів, що беруть участь у регуляції широкого кола фізіологічних процесів, включаючи клітинну міграцію й адгезію. PI3 кінази (PI3K) являють собою зв'язані з мембранами білки і належать до класу ферментів, що каталізують фосфорилування ліпідів, які самі зв'язані з клітинними мембранами. PI3K дельта ізозим (PI3K δ) являє собою одну з чотирьох ізоформ типу I PI3K кіназ, відповідальну за вироблення різних 3′-фосфорилованих фосфоїнозитидів, що опосередковують клітинний сигнальний шлях, і беруть участь у запаленнях, передачі сигналів фактора росту, злоякісних перетвореннях і в імунітеті [Див. огляд Rameh, L. E. and Cantley, L. C. J. Biol. Chem., 1999, 274:8347-8350.]. Участь PI3K у контролі за запаленнями було підтверджено на декількох моделях з використанням пан-активних PI3K інгібіторів, таких як LY-294002 і Wortmannin [Ito, K. et al., J Pharmacol. Exp. Ther., 2007, 321:1-8.]. Нещодавно були проведені дослідження з використанням або селективних інгібіторів PI3K або з нокаутними мишами, у яких відсутня специфічна ферментна ізоформа, як розкрито далі. Зазначені дослідження продемонстрували роль шляхів передачі сигналів, контрольованих PI3K ферментами в запаленнях. Було виявлено, що PI3K δ селективний інгібітор IC-87114 інгібує гіперзбудливість дихальних шляхів, виділення IgЕ, експресію прозапальних цитокінів, нагромадження запалених клітин у легенях і судинну проникність в овальбумін-сприйнятливих, овальбумін-заражених мишей [Lee, K. S. et al., J. Allergy Clin. Immunol., 2006, 118:403-409 і Lee, K. S. et al., FASEB J., 2006, 20:455-65.]. Крім того, IC-87114 знижує нагромадження нейтрофілів у легких мишей і функції нейтрофілів, стимульовані TNFα [Sadhu, C. et al., Biochem. Biophys. Res. Commun., 2003, 308:764-9]. PI3K δ ізоформа активується інсуліном і іншими факторами росту, також як зв'язаними з Gбілок-зв’язаними шляхами передачі сигналів білками і запальними цитокінами. Більше того: дослідження з використанням нокаутних мишей виявили той факт, що активація PI3K гамма (PI3K γ) може бути важливою в патогенезі астми. Наприклад, реакції мишиних тучних клітин підсилюються in vitro і in vivo за рахунок аутокринних сигналів, що вимагає функціональних сигналів PI3K γ. У мишей, у яких відсутні PI3K γ, не утворюються пухлини при заражені пасивною системною анафілаксією [Wymann M.P. et al., Biochem. Soc. Trans., 2003, 31:275-80.]. Так PI3K γ передають запальні сигнали через різні зв'язані з G-білком рецептори (GPCRs), особливо шляхом контролювання функцій тучних клітин. Також повідомляється, що нагромадження еозинофілів в овальбуміні сенсибілізованих і заражених мишей інгібується в таких PI3K γ-дефіцитних мишей, порівняно з мишами дикого типу [Lim D.H.etal.,Am. J. Physiol. Lung Cell. Mol. Physiol.,2009,296(2):L210-L219]. І нарешті, лікування PI3K γ інгібіторами послаблює IL-13-посилену повітряну скорочувальну здатність зрізів легень [Jiang H.etal., J. Pharmacol. Exp. Ther.,2012,342(2):305-11]. Нещодавно з'явилося повідомлення, що PI3K подвійний δ/γ інгібітор TG100-115 інгібує легеневу еозинофілію і знижує рівні інтерлейкіну-13, нагромадження слизу і гіперсприйнятливість дихальних шляхів у моделі на мишах, при введенні за допомогою аерозолей. Ті ж автори також повідомляють, що зазначена сполука здатна інгібувати легеневу нейтрофілію, викликану або LPS, або сигаретним димом [Doukas, J. et al., J Pharmacol. Exp. Ther., 2009, 328:758-765.]. Повідомляється, що інші дрібні молекули інгібіторів PI3K δ і γ роблять чудову інгібуючу дію на викликане LPS продукування TNFα і T-клітинну активацію при порівнянні з PI3K δ селективними інгібіторами [Williams O.etal.,ChemBiol., 2010,17(2):123-34.]. Тому що це також активується оксидативним стресом, PI3K δ ізоформа, очевидно, може використовуватися, відповідно, як мішень для терапевтичного втручання при таких захворюваннях, що супроводжуються високим рівнем оксидативного стресу. Медіатори, які регулюють наступні ланки сигнальних каскадів PI3K, включають Akt (серин/треонін протеїнкіназу) і мішень ссавців для рапамуцину, ферменту mTOR. У нещодавніх роботах було висловлене припущення, що активація PI3K δ, що приводить до фосфорилування Akt, здатна викликати стан несприйнятливості до кортикостероїдів в інших кортикостероїд-сприйнятливих клітинах [To, Y. et al., Am. J. Respir. Crit. Care Med., 2010, 182:897-904.]. Такі спостереження привели до гіпотези, що зазначений сигнальний каскад може бути одним механізмом, 1 UA 116002 C2 5 10 15 20 25 30 35 40 45 відповідальним за несприйнятливість до кортикостероїдів запалень, що спостерігаються в легенях пацієнтів, які страждають на ХОЗЛ, також як у тих астматиків, які палять, тим самим піддаючи свої легені підвищеному оксидативному стресу. Дійсно, було висловлене припущення, що теофілін, сполука, яку використовують при лікуванні як ХОЗЛ, так і астми, повністю змінює на зворотне несприйнятливість до стероїдів за рахунок механізмів, які включають взаємодію із сигнальними шляхами, контрольованими PI3 кіназою δ [To, Y. et al., Am. J. Respir. Crit. Care Med., 2010, 182:897-904.]. В даний час основними способами лікування як астми, так і ХОЗЛ, є інгаляційна терапія, у якій використовують комбінації кортикостероїдів, мускаринових антагоністів і 2-агоністів, як вважають, клінічно відповідної. Один шлях, адресований до незадоволених потреб медицини для лікування ХОЗЛ і астми, є ідентифікація нових лікарських засобів для інгаляцій, що були б достатньо ефективними для забезпечення значної переваги при використанні або у вигляді монотерапії, або в комбінації з одним або більше з лікарських засобів із зазначених трьох фармакологічних класів. Тому залишається необхідність в ідентифікації і розробці ізоформ селективних PI3K інгібіторів, що мали б потенціал для забезпечення підвищеної терапевтичної ефективності відносно астми, ХОЗЛ і інших запальних захворювань. WO 2012/052753 розкриває: 6-(2-((4-аміно-3-(3-гідроксифеніл)-1H-піразоло[3,4-d]піримідин-1іл)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-N,N-біс(2-метоксіетил)гекс-5-інамід, названий в описі як відома раніше Сполука A. WO 2011/048111 розкриває деякі 3-бензил-5-алкініл-хіназолін-4(3H)-они. Сполука прикладу, розкритого в описі, є 2-((4-аміно-3-(3-гідроксифеніл)-1H-піразоло[3,4d]піримідин-1-іл)метил)-3-(2-фторбензил)-5-(3-(2-(2-метоксіетоксі)етокси)проп-1-іїніл)хіназолін4(3H)-оном, названим в описі як сполука Прикладу 50. Жодна з відомих раніше сполук не має такий же вигідний профіль, як профіль розкритої в описі сполуки формули (I). Суть винаходу Відповідно до даного винаходу, запропонована сполука формули (I): або її фармацевтично прийнятна сіль, включаючи всі її стереоізомери, таутомери й ізотопні похідні. В іншому аспекті даного винаходу запропонована сполука формули (I) у твердій кристалічній формі. У наступному аспекті даного винаходу запропонована сполука формули (I) у вигляді форми 2 її кристалічного поліморфу (іноді названого в описі як “форма 2 кристалічного поліморфу”). У наступному аспекті даного винаходу запропонована сполука формули (I) у вигляді її форми 3 кристалічного поліморфу (іноді названого в описі як “форма 3 кристалічного поліморфу”). Порівняння in vitro профілів відомих раніше сполук, Сполуки A і сполуки прикладу 50, зі сполукою за даним винаходом представлене нижче (див. таблицю 5 в експериментальному розділі). Сполука за даним винаходом являє собою дуже ефективний подвійний інгібітор ізоформи PI3K δ/γ, фармакологічні характеристики якого надають йому чіткий і вигідний терапевтичний профіль порівняно з розкритими раніше сполуками. Такий аспект даного винаходу явно випливає з in vivo профілю сполук формули (I) у моделях на тваринах, що є предикторами терапевтичної ефективності і клінічної користі при запаленнях легень (див. таблиці 8-12 в експериментальному розділі). 2 UA 116002 C2 5 10 15 20 25 30 35 40 45 50 55 В одному варіанті зазначена сполука за даним винаходом має підвищену інгібуючу активність порівняно з відомими раніше сполуками при порівнянні в аналізі in vivo, у якому вимірюють здатність тестованої речовини інгібувати poly-IC-індукований приплив нейтрофілів у легенях мишей. Таке підвищення може бути 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 кратним (або більше) порівняно з відомими раніше в даній галузі сполуками. Вважають, що активність у poly-IC аналізі in vivo є показником ефективності сполуки даного винаходу відносно інгібування вірус-індукованого загострення в пацієнтів, що страждають на астму або ХОЗЛ. Вважають, що вірусні інфекції викликають загострення захворювань у результаті посилення запалення в легенях пацієнтів і за рахунок вироблення стійкого до стероїдів фенотипу. Poly-IC стимулюють один із механізмів, за рахунок яких віруси стають прозапальними. Подібні до лікарських засобів властивості розкритої в описі сполуки, включаючи властиві їй фізичну і хімічну стабільність, профіль розчинності, і особливо її чітку біологічну активність, роблять зазначену сполуку особлива придатною для використання як фармакологічного агента і, зокрема, для лікування опосередкованих запаленнями захворювань. Короткий опис креслень ФІГ. 1a: являє собою стовпчасту діаграму, що зображує ефекти лікування сполукою (I) або сполукою A відносно poly-I:C-індукованого нагромадження нейтрофілів у дихальних шляхах мишей. ФІГ. 1b: демонструє порівняння інгібуючої ефективності сполуки (I) відносно сполуки A відносно poly-I:C-індукованого нагромадження нейтрофілів у дихальних шляхах мишей. ФІГ. 2a: являє собою стовпчасту діаграму, що зображує ефекти лікування сполукою (I) або сполукою A відносно індукованого сигаретним димом нагромадження макрофагів у мишиних BALF. ФІГ. 2b: являє собою стовпчасту діаграму, що демонструє ефект лікування сполукою (I) або сполукою A відносно індукованого сигаретним димом нагромадження нейтрофілів у мишиних BALF. ФІГ. 3: являє собою порошкову дифракційну картину рентгенівських променів (XRPD), отриману для зразка форми 1 кристалічного поліморфу (див. приклад 2). ФІГ. 4: демонструє результати термогравіметричного аналізу (ТГА) (верхня крива) і диференційного скануючого калориметричного аналізу (ДСК) (нижня крива) зразка форми 1 кристалічного поліморфу (див. приклад 2) ФІГ. 5: являє собою картину XRPD, отриману для зразка форми 2 кристалічного поліморфу (див. приклад 4). ФІГ. 6: демонструє результати ТГА аналізу зразка форми 2 кристалічного поліморфу (див. приклад 4). ФІГ. 7 демонструє результати ДСК аналізу зразка форми 2 кристалічного поліморфу (див. приклад 4). ФІГ. 8: являє собою ДСП ізотермічний графік для зразка форми 2 кристалічного поліморфу (див. приклад 4). ФІГ. 9: являє собою ДСП графік зміни маси для зразка форми 2 кристалічного поліморфу (див. приклад 4). ФІГ. 10: являє собою картини XRPD, отримані до (верхня крива) і після (нижня крива) ДСП аналізу зразка форми 2 кристалічного поліморфу (див. приклад 4) ФІГ. 11: являє собою картини XRPD зразка форми 2 кристалічного поліморфу, отримані до (нижня крива) і після 1 тижня зберігання при 25°C/96 % RH (середня крива) і 40°C/75 % RH (верхня крива) (див. приклад 4). ФІГ. 12: являє собою картину XRPD, отриману для зразка форми 3 кристалічного поліморфу (див. приклад 8). ФІГ. 13: демонструє результати ТГА (верхня крива) і ДСК (нижня крива) аналізів зразка форми 3 кристалічного поліморфу (див. приклад 8). ФІГ. 14: являє собою результати ГСП аналізу зразка форми 3 кристалічного поліморфу (див. приклад 8). ФІГ. 15: являє собою картину XRPD, отриману до (нижня крива) і після (верхня крива) ГСП аналізу зразка форми 3 кристалічного поліморфу (див. приклад 8). ФІГ. 16: являє собою картини XRPD зразка форми 3 кристалічного поліморфу, отримані до (нижня крива) і після 1 тижня зберігання при 25°C/ 96 % RH (середня крива) і 40°C/75 % RH (верхня крива) (див. приклад 8). 3 UA 116002 C2 5 10 15 20 25 30 35 40 45 50 ФІГ. 17: являє собою накладення картин XRPD, отриманих від зразків форми 7 (верхня крива), форми 6, форми 5, форми 4, форми 3, форми 2 і форми 1 (нижня крива) (див. приклади 9-12). Докладний опис переважного варіанта втілення даного винаходу Термін інгібітор у тому змісті, як використаний в описі, стосується сполуки, що зменшує (наприклад, щонайменше на 10 %, 20 %, 30 %, 40 %, 50 % або більше) або виключає біологічну активність мішеневого білка, наприклад, PI3K δ ізозиму, у ферментному аналізі in vitro. Термін дельта/гамма (δ/γ) інгібітор у тому змісті, як використаний в описі, стосується того факту, що зазначена сполука інгібує, до деякого ступеня, інгібуючу активність обох ферментних ізоформ, хоча необов'язково в однаковому ступені. Зазначена сполука за даним винаходом є активною у клітинних скринуючих системах, і, тим самим, демонструє той факт, що вона має придатні властивості для проникнення в клітини, і здатна викликати внутрішньоклітинні фармакологічні ефекти (див. таблицю 6 і таблицю 7 в експериментальному розділі). Зазначена сполука за даним винаходом має терапевтично релевантні і необхідні фармацевтичні характеристики для лікарських засобів, наприклад, фізико-хімічними характеристики, включаючи адекватну хімічну і фотостабільність, придатний профіль розчинності і потенційну активність. В одному варіанті запропонована фармацевтично прийнятна сіль зазначеної сполуки даного винаходу. В одному варіанті запропонована фармацевтично прийнятна сіль приєднання кислоти зазначеної сполуки за даним винаходом. Мається на увазі, що зазначені в описі фармацевтично прийнятні солі приєднання кислот включають терапевтично активні, нетоксичні, солі приєднання кислот, що здатні утворювати сполуки формули (I). Такі фармацевтично прийнятні солі приєднання кислот звичайно одержують, обробляючи форму вільної основи сполуки формули (I), наприклад, придатними кислотами. Приклади придатних кислот включають, наприклад, неорганічні кислоти, такі як хлористоводнева кислота, бромистоводнева кислота, і сірчана і фосфорна кислоти і т. п.; або органічні кислоти, такі як, наприклад, оцтова, пропанова, гідроксіоцтова, молочна, малонова, сукцинова, малеїнова, фумарова, яблучна, винна, лимонна, метансульфонова, паратолуолсульфонова, цикламова, саліцилова, пара-аміносаліцилова, памоєва кислота і т. п. Іншим прикладом придатної кислоти є бензолсульфонова кислота. Приклади солей сполуки формули (I) включають усі фармацевтично прийнятні солі, такі як, без обмежень, солі приєднання мінеральних кислот, таких як солі HCl і HBr, і солі приєднання органічних кислот, такі як сіль метансульфонової кислоти. Подальші приклади включають солі сірчаної кислоти і солі фосфорної кислоти. В іншому варіанті запропонована фармацевтично прийнятна сіль сполуки за даним винаходом, отримана у результаті здійснення взаємодії зазначеної сполуки формули (I) із придатною основою. Приклади придатних основ включають, наприклад, гідроксид натрію, гідроксид калію, гідроксид магнію, гідроксид кальцію, L-аргінін, холін і L-лізин. В одному варіанті запропонований 2-((4-аміно-3-(3-фтор-5-гідроксифеніл)-1H-піразоло[3,4d]піримідин-1-іл)метил)-5-(3-(2-(2-метоксіетоксі)етокси)проп-1-ін-1-іл)-3-(2(трифторметил)бензил)хіназолін-4(3H)-он як вільна основа. Даний винахід також поширюється на сольвати розкритих в описі сполук. Приклади сольватів включають гідрати. Сполуки за даним винаходом включають такі, у яких зазначений атом є природним або є неприродним ізотопом. В одному варіанті ізотоп є стабільним ізотопом. Так, сполуки за даним винаходом включають, наприклад, такі, які містять один або більше з атомів дейтерію замість атомів водню і т. п. Відкриття також поширюється на всі поліморфні форми розкритих в описі сполук. Сполуки формули (I) можна зручно одержувати способом, що включає здійснення взаємодії сполуки формули (II): 4 UA 116002 C2 або її захищеного похідного, де LG1 являє собою відхідну групу, таку як галоген, зокрема бром, зі сполукою формули (III): 5 10 15 20 25 у присутності придатного каталізатора й органічної основи й у полярному апротонному розчиннику в інертній атмосфері. Придатні каталізатори включають паладієві каталізатори, такі як дихлорид біс(трифенілфосфін)паладію(II), у присутності йодиду міді. Придатним полярним апротонним розчинником для такого перетворення є ДМФ, і придатною інертною атмосферою є азот. Для способу синтезу, у якому зазначена сполука формули (II) є захищеним похідним, зазначену сполуку формули (I) піддають відповідній стадії видалення захисних груп, як добре відомо фахівцям у даній галузі. Наприклад, якщо фенол, що є присутнім у сполуці формули (I), захищений силільною групою, наприклад, трет-бутилдиметилсилільною групою, видалення захисних груп можна здійснити, обробляючи таким реагентом, як тетрабутиламонійфторид, у присутності полярного апротонного розчинника, такого як ДМФ. Реакцію можна проводити при зниженій температурі, такій як 0°C. Сполуки формули (II) можна одержати, здійснюючи взаємодію сполуки формули (IV): або її захищеного похідного, де LG1 являє собою відхідну групу, як визначено в описі для сполуки формули (II), і LG2 також являє собою відхідну групу, таку як галоген, наприклад атом галогену, і особливо хлор, зі сполукою формули (V): або її захищеним похідним, у присутності основи й у полярному апротонном розчиннику. Придатні основи для такого перетворення включають карбонат калію, і придатним полярним апротонним розчинником є ДМФ. 5 UA 116002 C2 5 Способи синтезу включають такі, для яких вигідно захистити фенольний гідроксил зазначеної сполуки формули (VII) під час стадії сполучення, і придатні захищені похідні включають трет-бутилдиметилсилільний ефір і трет-бутиловий ефір. Альтернативно сполуки формули (II) можна одержати, здійснюючи взаємодії сполуки формули (VI): або її захищеного похідного, де LG1, має ті ж значення, що зазначено для сполуки формули (II), і LG3 являє собою відхідну групу, таку як галогенід, зокрема йод, зі сполукою формули (VII): 10 15 20 25 30 35 40 або її захищеним похідним, у присутності придатного каталізатора благородного металу, неорганічної основи й у полярному протонному розчиннику, в інертній атмосфері; з наступним, у випадку потреби, видаленням захисних груп. Придатним каталізатором є тетракис(трифенілфосфін)паладій(0). Придатною неорганічною основою є карбонат натрію і придатним полярним протонним розчинником є етанол. Зазначену реакцію можна проводити при підвищеній температурі, наприклад, при 85°C протягом тривалого проміжку часу, такого як, наприклад, протягом 3 днів до охолодження до кімнатної температури. Захисні групи можуть вдало маскувати хімічно сприйнятливі групи під час однієї або більше з послідовних реакцій, як розкрито вище, для забезпечення ефективності одного або більше зі способів. Так, якщо бажано або необхідно, проміжні сполуки можна захистити, використовуючи звичайні захисні групи. Захисні групи і засоби для їхнього введення розкриті в “Protective Groups in Organic Synthesis”, Theodora W. Greene and Peter G.M. Wuts, опубліковане John Wiley & Sons th Inc; 4 Rev Ed., 2006, ISBN-10: 0471697540. Нові проміжні сполуки заявлені у вигляді аспекту даного винаходу. Бажано, щоб сполука (I) даного винаходу не виявляла атропізомеризму. Сполуку (I), отриману за способом, розкритим у прикладі 2 розглянутого опису, одержують як форму 1 кристалічного поліморфу. Форма 1 кристалічного поліморфу характеризується картиною XRPD практично відповідно до картини, представленої на ФІГ. 3. Було виявлено, що термічна поведінка зразка форми 1 кристалічного поліморфу є складною. Як обговорюється в прикладі 2 і проілюстровано в результатах ДСК аналізу, представлених на ФІГ. 4 (нижня крива), зразок форми 1 кристалічного поліморфу піддається ряду змін при нагріванні, і в кінцевому рахунку перетворюється в кристалічний поліморф, що відрізняється, — названий в описі як форма 2 кристалічного поліморфу. Було виявлено, що форма 2 кристалічного поліморфу є безводною і плавиться з розкладанням при температурі близько 190°C (максимум піка). Експерименти по суспендуванню, здійснені для форми 1 кристалічного поліморфу, привели до утворення форми 2 кристалічного поліморфу в більшості розчинників, хоча безводний кристалічний поліморф — названий в описі як форма 3 кристалічного поліморфу, — був отриманий при суспендуванні форми 1 кристалічного поліморфу в дихлорметані. Було виявлено, що форма 3 кристалічного поліморфу є безводною і плавиться з розкладанням при температурі близько 186°C (максимум 6 UA 116002 C2 5 10 15 20 25 30 35 40 45 50 55 піка; див. приклад 8). Ряд псевдополіморфів сполуки (I) (форми 4, 5, 6 і 7 псевдополіморфів) також були отримані в результаті суспендування форми 1 кристалічного поліморфу або сполуки (I) в аморфній формі з ТГФ, 1,4-діоксаном, сумішшю 10 % вода/ацетонітрил або 10 % вода/ацетон (див. приклади 9-12). З семи різних поліморфних і псевдополіморфних форм сполуки (I) форма 2 і форма 3 кристалічних поліморфів мають найбільш обіцяючі характеристики стану твердої речовини, причому форма 2 кристалічного поліморфу найбільш виграшна, тому що має найвищу температуру плавлення. Конкуруючі експерименти із суспензіями здійснюють, використовуючи суміш 50/50 форми 2 і форми 3 кристалічних поліморфів у різних розчинниках при різних температурах (див. приклад 13). Всі експерименти виділили форму 2 кристалічного поліморфу, підтверджуючи той факт, що вона є найбільш термодинамічно стабільною формою. Зважаючи, що бажано мінімізувати ризик взаємоперетворення поліморфної форми під час зберігання зазначеної сполуки і виготовлення фармацевтичних продуктів, що містять зазначену сполуку, або під час тривалого зберігання таких продуктів після виготовлення, форма 2 кристалічного поліморфу має переваги порівняно з формою 3 кристалічного поліморфу й іншими поліморфними формами сполуки (I). Бажано одержувати форму 2 кристалічного поліморфу в результаті кристалізації сполуки (I) з розчину в 1-пропанолі. Приклади способів з використанням 1-пропанолу розкриті в прикладі 3, із застосуванням затравки і без неї. Форму 2 кристалічного поліморфу можна також одержати, суспендуючи форму 1 кристалічного поліморфу в метанолі, етанолі, 2-пропанолі, 1-пропанолі, ацетоні, етилацетаті, ацетонітрилі, толуолі, ізопропілацетаті, TBME, 2-бутаноні, ДМСО, діетиловому ефірі, MIBK, гептані, нітрометані, суміші 10 % вода/етанол, суміші 10 % вода/ацетонітрил або суміші 10 % вода/2-пропанол. Альтернативно, форму 2 кристалічного поліморфу можна одержати, суспендуючи сполуку (I) в аморфній формі в метанолі, етанолі, 2-пропанолі, 1-пропанолі, ацетоні, етилацетаті, ацетонітрилі, толуолі, ізопропілацетаті, TBME, 2-бутаноні, ДМСО, діетиловому ефірі, MIBK, нітрометані, суміші 10 % вода/етанол або суміші 10 % вода/2-пропанол. Експерименти авторів показали, що суспендування сполуки (I) в аморфній формі в дихлорметані приводить до утворення форми 3 кристалічного поліморфу. Тому використання дихлорметану в умовах кристалізації для одержання форми 2 кристалічного поліморфу варто уникати. Експерименти авторів показали, що суспендування сполуки (I) в аморфній формі або у формі 1 кристалічного поліморфу в ТГФ приводить до утворення форми 4 псевдополіморфу. Тому використання ТГФ в умовах кристалізації для одержання форми 2 кристалічного поліморфу варто уникати. Експерименти авторів показали, що суспендування сполуки (I) в аморфній формі або у формі 1 кристалічного поліморфу в 1,4-діоксані, приводить до утворення форми 5 псевдополіморфу. Тому використання 1,4-діоксану в умовах кристалізації для одержання форми 2 кристалічного поліморфу зі сполуки (I) варто уникати. Експерименти авторів показали, що суспендування сполуки (I) в аморфній формі в суміші 10 % вода/ацетонітрил приводить до одержання форми 6 псевдополіморфу. Тому використання суміші 10 % вода/ацетонітрил в умовах кристалізації для одержання форми 2 кристалічного поліморфу зі сполуки (I) в аморфній формі варто уникати. Експерименти авторів показали, що суспендування сполуки (I) в аморфній формі в суміші 10 % вода/ацетонітрил приводить до одержання форми 7 псевдополіморфу. Тому використання суміші 10 % вода/ацетонітрил в умовах кристалізації для одержання форми 2 кристалічного поліморфу зі сполуки (I) в аморфній формі варто уникати. Форма 2 кристалічного поліморфу характеризується картиною XRPD практично відповідно до картини, представленої на ФІГ. 5. Основні піки на цій картині знаходяться в положеннях 8,2, 9,0, 9,2, 9,7, 12,2, 14,1, 14,3, 15,0, 16,4, 18,0, 18,5, 19,0, 19,6, 21,8, 22,3, 22,5, 24,3, 24,5, 24,8, 25,1 і 25,8 (±0,2 градуси, значення 2-тета). Звичайно щонайменше три (наприклад три, чотири, п'ять, шість, сім, вісім, дев'ять, десять, одинадцять, дванадцять, тринадцять, чотирнадцять, п'ятнадцять, шістнадцять, сімнадцять, вісімнадцять, дев'ятнадцять, двадцять або всі двадцять один) з них спостерігаються в отриманій картині XRPD. Піки на 9,7, 12,2, 14,1 і 14,3 особливо характеристичні для форми 2 кристалічного поліморфу і тому звичайно щонайменше один (наприклад один, два, три або всі чотири) із зазначених піків спостерігаються в картині XRPD. Форма 3 кристалічного поліморфу характеризується картиною XRPD практично відповідно до картини, представленої на ФІГ. 12. 7 UA 116002 C2 5 10 15 20 25 30 35 40 45 Форма 4 псевдополіморфу характеризується картиною XRPD практично відповідно до картини, представленої на ФІГ. 17. Форма 5 псевдополіморфу характеризується картиною XRPD практично відповідно до картини, представленої на ФІГ. 17. Форма 6 псевдополіморфу характеризується картиною XRPD практично відповідно до картини, представленої на ФІГ. 17. Форма 7 псевдополіморфу характеризується картиною XRPD практично відповідно до картини, представленої на ФІГ. 17. В одному аспекті зазначену сполуку можна використовувати для лікування, наприклад, ХОЗЛ і/або астми. PI3K сполуки, розроблені до даного часу, звичайно призначені для перорального введення. Звичайно така стратегія включає оптимізацію сполук фармакокінетичного профілю для досягнення адекватної тривалості дії. У такий спосіб встановлюють досить високі концентрації лікарських засобів і вони знаходяться в інтервалі доз, забезпечення безперервної клінічної вигоди. Неминучі і часто небажані наслідки такого підходу зводяться до того, що тканини організму, які не є мішенями, особливо печінка і кишечник, очевидно, піддаються фармакологічно активним концентраціям лікарських засобів. Альтернативна стратегія полягає в створенні таких режимів лікування, при яких лікарський засіб потрапляє безпосередньо в запалений орган (наприклад, при місцевій терапії). Хоча такий підхід не придатний для лікування всіх хронічних запальних станів, він інтенсивно використовувався при лікуванні легеневих захворювань (астми, ХОЗЛ, кістозного фіброзу), шкірних уражень (атопічного дерматиту і псоріазу), назальних захворювань (алергійного риніту), очних хвороб (алергійного кон’юнктивіту) і шлунково-кишкових порушень (виразкового коліту). При місцевій терапії бажаної ефективності можна іноді досягти, забезпечуючи тривалу дію лікарських засобів і збереження їх у переважно мішеневому органі, тим самим мінімізуючи ризики системної токсичності. Альтернативно можна використовувати композиції, які створюють “резервуар” активного лікарського засобу, що потім стає доступним для створення уповільнених необхідних ефектів. Прикладом першого підходу служить використання антихолінергічного лікарського засобу тіотропійброміду (Spiriva HandiHaler®), який вводять місцево в легені, як лікування при ХОЗЛ. Зазначена сполука має винятково високу спорідненість до її мішеневих рецепторів, що приводить до дуже малої швидкості виведення (швидкості дисоціації) і, отже, до уповільненої тривалої дії. Запропоновано відповідно до одного аспекту даного винаходу використання зазначеної сполуки формули (I) або фармацевтичної композиції, що містить її, як інгібітора PI3 кінази, наприклад, при місцевому введенні в легені. Так, в одному варіанті зазначена сполука за даним винаходом передбачається для використання шляхом місцевого введення в легені для досягнення максимальної терапевтичної вигоди для пацієнтів при мінімізації потенціалу небажаних системних ефектів. Тому вигідно, щоб зазначена сполука формули (I) швидко метаболізувалася після потрапляння в кровоносну систему, і щоб продукт (продукти) перетворення був (були) менш активний (активні), ніж вихідні молекули. Очевидно, основним продуктом пресистемного метаболізму сполуки формули (I) є відповідний спирт, сполука (Ia), що утворюється в результаті O-деметилування, метаболічного процесу, що є загальною рисою для структур подібного хемотипу. Такий можливий метаболічний продукт значно менш активний, ніж зазначена сполука формули (I) у вигляді інгібітору PI3K по обох α і β субтипах (див. таблицю 6 в експериментальному розділі). 8 UA 116002 C2 5 10 15 20 25 30 35 40 . Так, в одному аспекті запропонована сполука формули (Ia) або її фармацевтично прийнятна сіль, включаючи всі її стереоізомери, таутомери й ізотопні похідні. В одному аспекті даного винаходу зазначена сполука за даним винаходом особливо підходить для місцевої доставки, такої як місцева доставка в легені, зокрема, для лікування ХОЗЛ. Так в одному аспекті запропоноване використання сполуки за даним винаходом для лікування ХОЗЛ і/або астми, зокрема ХОЗЛ або важкої астми, за допомогою інгаляцій, тобто шляхом місцевого введення в легені. Вигідно, що введення в легені забезпечує сприятливі ефекти зазначеної сполуки, що реалізуються при мінімізації побічних ефектів для пацієнтів. В одному варіанті зазначені сполуки придатні для сенсибілізованих пацієнтів до лікування кортикостероїдами. Крім того, у даному винаході запропонована фармацевтична композиція, що включає сполуку відповідно до даного винаходу, необов'язково в комбінації з одним або більше з фармацевтично прийнятних розріджувачів або носіїв. Розріджувачі і носії можуть включати такі, які придатні для парентерального, перорального, місцевого, мукозального і ректального способів введення, і можуть бути різними залежно від способу введення. В одному варіанті композиції можна одержати, наприклад, для парентерального, підшкірного, внутрішньом'язового, внутрішньовенного, інтраартикулярного або періартикулярного введення, зокрема, у формі рідких розчинів або суспензій; для перорального введення, зокрема, у формі таблеток або капсул; для місцевого, наприклад, легеневого або інтраназального введення, зокрема, у формі порошків, крапель для носа або аерозолей і трандермального введення; для мукозального введення, наприклад, для букального, сублінгвального або вагінального слизу, і для ректального введення, наприклад, у формі супозиторіїв. В іншому варіанті композиції можна одержати для перорального введення у формі рідких розчинів або суспензій; для місцевого введення у формі рідких розчинів, рідких суспензій, крапель для носа, що включають розчини або суспензії, або аерозолів у контейнерах або у контейнерах під тиском. Композиції зручно вводити в одиничній дозованій формі, і їх можна одержати будь-яким зі способів добре відомих фахівцям в галузі фармацевтики, наприклад, як розкрито в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA., (1985). Композиції також зручно вводити в множинній одиничній дозованій формі. Композиції для парентерального введення можуть містити як ексципієнти стерильну воду або сольовий розчин, алкіленгліколі, такі як пропіленгліколь, поліалкіленгліколі, такі як поліетиленгліколь, олії рослинного походження, гідровані нафталіни і т. п. Композиції для назального введення можуть бути твердими речовинами і можуть містити ексципієнти, наприклад, лактозу або декстран, або можуть бути водними або масляними розчинами для використання у формі крапель для носа або мірних спреїв. Композиції для назального введення можуть також бути у формі водних суспензій. Для букального введення типові ексципієнти включають цукри, стеарат кальцію, стеарат магнію, прежелатинізований крохмаль і т. п. Композиції, що підходять для перорального введення, можуть включати один або більше з фізіологічно сумісних носіїв і/або ексципієнтів, і можуть бути у формі твердої речовини або у 9 UA 116002 C2 5 10 15 20 25 30 35 40 45 50 55 формі рідини. Таблетки і капсули можна одержати зі зв’язувальними агентами, наприклад, сиропом, смолою акації, желатином, сорбітом, трагакантом або полівінілпіролідоном; з наповнювачами, такими як лактоза, сахароза, кукурудзяний крохмаль, фосфат кальцію сорбіт або гліцин; зі змащувальними агентами, такими як стеарат магнію, тальк, поліетиленгліколь або двоокис кремнію; і з поверхнево-активними речовинами, такими як натрійлаурилсульфат. Рідкі композиції можуть містити звичайні добавки, такі як суспендуючі агенти, наприклад сироп сорбіту, метилцелюлоза, цукровий сироп, желатин, карбоксиметилцелюлоза або харчові жири; емульгуючі агенти, такі як лецитин або смола акації; рослинні олії, такі як мигдальна олія, кокосова олія, риб'ячий жир або арахісова олія; консерванти, такі як бутильований гідроксіанізол (BHA) і бутильований гідрокситолуол (BHT). Рідкі композиції можуть бути інкапсульовані, наприклад, у желатині, для створення одиничної дозованої форми. Дозовані форми твердої речовини для перорального введення включають таблетки, складені з двох частин капсули у твердій оболонці і м'які еластичні желатинові (SEG) капсули. Такі тверді, що складаються з двох частин капсули можуть бути приготовлені, наприклад, з желатину або гідроксипропілметилцелюлози (HPMC). Сухі капсули у твердій оболонці звичайно включають близько 40 %-60 % концентрації желатину, близько 20 %-30 % концентрації пластифікатора (такого як гліцерин, сорбіт або пропіленгліколь) і близько 30 %-40 % концентрації води. Можуть також бути присутніми інші матеріали, такі як консерванти, барвники, замутняючі агенти і смакові добавки. Рідкі матеріали наповнювачів включають тверду речовину лікарського засобу, що розчинена, солюбілізована або диспергована (із суспендуючими агентами, такими як бджолиний віск, гідрована касторова олія або поліетиленгліколь 4000), або рідкий лікарський засіб у носіях, або в комбінації носіїв, таких як мінеральне масло, рослинні олії, тригліцериди, гліколі, поліоли і поверхнево-активні агенти. Звичайно зазначену сполуку формули (I) вводять місцево в легені. Отже, в одному варіанті запропонована фармацевтична композиція, що включає сполуку за даним винаходом необов'язково в комбінації з одним або більше з розріджувачів або носіїв, прийнятних для місцевого застосування. Місцеве введення в легені можна здійснити, використовуючи аерозольні композиції. Аерозольні композиції звичайно включають активний інгредієнт, суспендований або розчинений у придатному аерозольному пропеланті, такому як хлорфторвуглець (CFC) або гідрофторвуглець (HFC). Придатні CFC пропеланти включають трихлормонофторметан (пропелант 11), дихлортетрафторметан (пропелант 114), і дихлордифторметан (пропелант 12). Придатні HFC пропеланти включають тетрафторетан (HFC-134a) і гептафторпропан (HFC-227). Пропелант звичайно складає 40 %-99,5 %, наприклад, 40 %-90 % за масою від всієї інгаляційної композиції. Композиції можуть включати ексципієнти, включаючи cпіврозчинники (наприклад, етанол) і поверхнево-активні речовини (наприклад, лецитин, сорбітантриолеат і т. п). Інші можливі ексципієнти включають поліетиленгліколь, полівінілпіролідон, гліцерин і т. п. Аерозольні композиції упаковують у каністри, і придатні дози відмірюють за допомогою мірних клапанів (наприклад, таких, як постачають Bespak, Valois або 3M або, альтернативно, Aptar, Coster або Vari). Місцеве введення в легені можна також здійснити, використовуючи композиції, які не знаходяться під тиском, такі як водні розчини або суспензії. Їх можна вводити, використовуючи небулайзер, наприклад, ручний і портативний, або для домашнього або госпітального використання (тобто непортативний). Композиції можуть включати ексципієнти, такі як вода, буфери, речовини, що регулюють тонічність, регулятори pН, поверхнево-активні речовини і співрозчинники. Рідкі суспензійні й аерозольні композиції (незалежно від того, знаходяться вони під тиском чи ні) звичайно містять сполуку за даним винаходом в тонкоздрібненій формі, наприклад з D50 0,5-10 мкм, наприклад, близько 1-5 мкм. Розподіл частинок по розмірах можна представити, використовуючи значення D10, D50 і D90. Середнє значення D50 розподілу частинок по розмірах визначають як розмір частинок у мікронах, який ділить розподіл навпіл. Результати вимірювань за допомогою лазерної дифракції більш точно визначають об'ємний розподіл, і відповідно, значення D50 отримане з використанням такої процедури є більш значним і представляється у вигляді значення Dv50 (середнє для розподілу по об’ємах). У тому змісті, як використано в описі, значення Dv стосуються розподілів частинок по розмірах, вимірювані за допомогою лазерної дифракції. Аналогічно, значення D 10 і D90, використовувані в контексті лазерної дифракції, означають значення Dv10 і Dv90 і стосуються розміру частинок, коли 10 % розподілу розташовано нижче значень D10, і 90 % розподілу розташовано нижче значення D90, відповідно. 10 UA 116002 C2 5 10 15 20 25 30 35 40 45 50 55 Місцеве введення в легені можна також здійснити, використовуючи сухі порошкові композиції. Сухий порошок містить сполуку за даним винаходом в тонкоздрібненій формі, звичайно з масовим середнім діаметром (MMAD) 1-10 мкм або D50 0,5-10 мкм, наприклад, близько 1-5 мкм. Порошки сполуки за даним винаходом в тонкоздрібненій формі можна одержати, використовуючи процес мікронізації або аналогічні процеси зменшення розмірів частинок. Мікронізацію можна здійснити, використовуючи струминні млини, такі як ті, що робить Hosokawa Alpine. Досягнутий розподіл частинок по розмірах можна визначити, використовуючи лазерну дифракцію (наприклад, за допомогою приладу Malvern Mastersizer 2000S). Композиції звичайно містять розріджувач, прийнятний для місцевого введення, такий як лактоза, глюкоза або маніт (переважно лактозу), звичайно з відносно кружним розміром частинок, наприклад, з масовим середнім діаметром (MMAD) 50 мкм або більше, наприклад, 100 мкм або більше, або з D50 40-150 мкм. У тому змісті, як використаний в описі, термін “лактоза” стосується утримуючого лактозу компоненту, включаючи моногідрат α-лактози, моногідрат β-лактози, безводну αлактозу, безводну β-лактозу й аморфну лактозу. Компонент лактози можна обробити шляхом мікронізації, просівання, розмелювання, компресії, агломерації або сушіння розпиленням. ® Комерційно доступні форми лактози в різних формах також включені, наприклад, Lactohale ® (лактоза інгаляційного ступеня чистоти; DFE Pharma), InhaLac 70 (просіяна лактоза для сухих ® ® порошкових інгаляторів; Meggle), Pharmatose (DFE Pharma) і Respitose (просіяна лактоза інгаляційного ступеня чистоти; DFE Pharma). В одному варіанті, компонент лактози вибирають із групи, що складається з моногідрату α-лактози, безводної α-лактози й аморфної лактози. Переважно, щоб лактозою був моногідрат α-лактози. Сухі порошкові композиції можуть також містити інші ексципієнти, такі як стеарат натрію, стеарат кальцію або стеарат магнію. Сухі порошкові композиції звичайно вводять, використовуючи сухі порошкові інгалятори (DPI). Приклади систем доставки сухих порошків включають SPINHALER®, DISKHALER®, TURBOHALER®, DISKUS®, SKYEHALER®, ACCUHALER® і CLICKHALER®. Інші приклади систем доставки сухих порошків включають ECLIPSE, NEXT, ROTAHALER, HANDIHALER, AEROLISER, CYCLOHALER, BREEZHALER/NEOHALER, MONODOSE, FLOWCAPS, TWINCAPS, X-CAPS, TURBOSPIN, ELPENHALER, MIATHALER, TWISTHALER, NOVOLIZER, PRESSAIR, ELLIPTA, ORIEL сухий порошковий інгалятор, MICRODOSE, PULVINAL, EASYHALER, ULTRAHALER, TAIFUN, PULMOJET, OMNIHALER, GYROHALER, TAPER, CONIX, XCELOVAIR і PROHALER. В одному варіанті сполука за даним винаходом представлена у вигляді мікронізованої порошкової композиції, наприклад, такої, що включає лактозу придатного ступеня чистоти, поміщену в пристрій, такий як DISKUS. Зручно, щоб такі пристрої були багатодозовими пристроями, наприклад, композицію поміщають у блістери для використання в багатодозовому пристрої, такому як DISKUS. В одному варіанті сполука за даним винаходом представлена у вигляді мікронізованої порошкової композиції, наприклад, такої, що включає лактозу придатного ступеня чистоти і стеарат магнію, поміщені в блістери для використання в багатодозовому пристрої, такому як DISKUS. Зручно, щоб такий пристрій було багатодозовим пристроєм. В іншому варіанті сполука за даним винаходом представлена у вигляді мікронізованої порошкової композиції, поміщеної в капсули з твердою оболонкою для використання в однодозовому пристрої, такому як AEROLISER. В іншому варіанті сполука за даним винаходом представлена у вигляді мікронізованої порошкової композиції, наприклад, такої, що включає лактозу придатного ступеня чистоти і стеарат магнію, поміщені в капсули з твердою оболонкою для використання в однодозовому пристрої, такому як AEROLISER. Приклади композицій сполуки (I), що придатні для використання в сухих порошкових інгаляторах, перераховані в прикладі 15. Сполуки відповідно до даного винаходу повинні мати терапевтичну активність. У наступному аспекті в даному винаході запропонована сполука за даним винаходом для використання як лікарський засіб. Сполуки відповідно до даного винаходу також можуть бути корисні при лікуванні респіраторних порушень, включаючи ХОЗЛ (включаючи хронічний бронхіт і емфізему), астму, педіатричну астму, фіброзний кістоз, саркоїдоз, ідіопатичний легеневий фіброз, алергійний риніт, риніт, синусит і викликані вірусами загострення будь-якого одного з перерахованих вище, респіраторні вірусні інфекції, особливо астму, хронічний бронхіт і ХОЗЛ. 11 UA 116002 C2 5 10 15 20 25 30 35 40 45 50 55 60 Респіраторні віруси включають вірус грипу, респіраторний синцитіальний вірус, людський вірус парагрипу, SARS коронавірус і аденовіруси. Іншим прикладом респіраторного вірусу є риновірус. Сполука за даним винаходом може також повторно сенсибілізувати стан пацієнтів до лікування кортикостероїдами, якщо попередній стан пацієнтів став до них нечутливим. В одному варіанті даного винаходу використовують дозу сполуки за даним винаходом, що дорівнює дозі, що підходить для використання у вигляді монотерапії, але яку вводять у комбінації з кортикостероїдом. В одному варіанті використовують дозу зазначеної сполуки формули (I), що була б субтерапевтичною при використанні як одного агента, у комбінації з кортикостероїдом, тим самим зберігаючи сприйнятливість пацієнта до останнього, у тих випадках, коли пацієнт раніше був до кортикостероїду несприйнятливий. В одному варіанті дозу сполуки формули (I) використовують у комбінації з дозою кортикостероїду, що була б субтерапевтичною, якби її вводили у відсутності сполуки формули (I), тим самим зберігаючи сприйнятливість пацієнта відносно кортикостероїду, у тих випадках, коли пацієнт раніше ставав до кортикостероїду несприйнятливим. Крім того, сполука за даним винаходом може виявляти противірусну активність і, наприклад, як доведено, її можна використовувати при лікуванні вірусних загострень запальних станів, таких, як астма і/або ХОЗЛ. Зазначена сполука за даним винаходом може також виявитися корисною для профілактики, лікування або ослаблення захворювання або ускладнень після захворювань, пов'язаних з вірусом грипу, риновірусом і/або респіраторним синцитіальним вірусом. В одному варіанті запропонована сполука формули (I) для використання при лікуванні або для профілактики вірусної інфекції або запальних ускладнень, викликаних вірусною інфекцією. Очікується також, що зазначена сполука формули (I), відповідно до даного винаходу може бути корисна при лікуванні деяких станів, які можна лікувати, використовуючи місцеву або локальну терапію, включаючи алергійний кон’юнктивіт, кон’юнктивіт, алергійний дерматит, контактний дерматит, псоріаз, виразковий коліт, запалення суглобів, вторинні відносно ревматоїдого артриту або остеоартриту. В одному варіанті зазначену сполуку формули (I) вважають корисною при лікуванні гепатиту C і/або ВІЛ, при введенні відповідним способом. Придатні способи введення можуть включати пероральний, внутрішньовенні ін'єкції або вливання. В одному варіанті зазначену сполуку формули (I) для лікування гепатиту C вводять у кров до її надходження в печінку. Очікують також, що сполука за даним винаходом може бути корисною при лікуванні деяких інших станів, включаючи ревматоїдний артрит, панкреатит, кахексію, інгібування росту і метастазування пухлин, включаючи дрібноклітинну карциному легень, карциному грудей, карциному шлунка, колоректальну карциному і злоякісну меланому. В одному варіанті сполуку за даним винаходом й фармацевтичні композиції, які містять її, можна використовувати при лікуванні або для профілактики раку, зокрема раку легень, особливо шляхом місцевого введення в легені. Так, у наступному аспекті в даному винаході запропонована сполука, як розкрито в описі, для використання при лікуванні одного або більше з вищевказаних станів. У наступному аспекті в даному винаході запропоноване використання зазначеної сполуки, як розкрито в описі, для виготовлення лікарського засобу для лікування одного або більше з вищевказаних станів. У наступному аспекті, у даному винаході запропонований спосіб лікування вищевказаних станів, що включає введення суб'єкту ефективної кількості сполуки за даним винаходом або її фармацевтичної композиції. Розкриту в описі сполуку можна також використовувати при виготовленні лікарських засобів для лікування одного або більше з перерахованих вище захворювань. Передбачається, що термін “лікування” включає як профілактику, так і терапевтичне лікування. Сполуки за даним винаходом можна також вводити в комбінації з одним або більше з інших активних інгредієнтів, наприклад, активних інгредієнтів, що придатні для лікування вищезгаданих станів. Наприклад, можливі комбінації для лікування респіраторних порушень включають комбінації з кортикостероїдами (наприклад, будезонідом, дипропіонатом беклометазону, пропіонатом флутиказону, фуроатом мометазону, фуроатом флутиказону), бета-агоністами (наприклад, тербуталіном, салбутамолом, салметеролом, формотеролом, індакатеролом), ксантинами (наприклад, теофіліном), мускариновими антагоністами 12 UA 116002 C2 5 10 15 20 25 30 35 (наприклад, іпратропієм) і/або інгібітором p38 MAP кінази. Іншими прикладами придатних кортикостероїдів є циклезоніл або флунізолід. Придатним бета-агоністом є бета2-агоніст. Іншими прикладами бета2-агоністів є репротерол, вілантерол, олодатерол, репротерол і фенотерол. Подальші приклади мускаринових антагоністів включають тіотропій, умеклідиній, глікопіроній, аклідиній і даратропій, причому будь-які з них, наприклад, у вигляді бромідних солей. Іншими можливими комбінаціями для лікування респіраторних порушень є сполука за даним винаходом й інгібітор фосфодіестерази. В одному варіанті сполуку за даним винаходом вводять у комбінації з противірусним ® агентом, наприклад, ацикловіром, озелтамівіром, занамавіром (Relenza ) або інтерфероном. В одному варіанті комбінацію активних інгредієнтів комбінують спільно. В одному варіанті сполуку за даним винаходом спільно комбінують з кортикостероїдом у вигляді лікарського засобу для інгаляції, наприклад, для використання при підтримуючій терапії ХОЗЛ або раку легень, включаючи профілактику останнього. В одному варіанті комбінацію активних інгредієнтів просто вводять спільно. В одному варіанті запропонований комбінований продукт, що містить: (A) сполуку за даним винаходом; і (B) інший активний інгредієнт, наприклад, вибраний з кортикостероїдів, бета-агоністів, ксантинів, мускаринових антагоністів, інгібіторів фосфодіестерази й інгібіторів p38 MAP кінази (наприклад, вибраних із кортикостероїдів, бета-агоністів, ксантинів, мускаринових антагоністів і інгібіторів p38 MAP кінази), де кожний з компонентів (A) і (B) готують у суміші з фармацевтично прийнятним розріджувачем або носієм. Такі комбінації можуть необов'язково включати відповідні додаткові ексципієнти. Переважно, щоб бета-агоністом був бета2-агоніст. В одному варіанті запропонована сполука формули (I) за п. 1 для застосування у вигляді лікарського засобу, призначеного для введення в комбінації з одним або більше з інших активних інгредієнтів, наприклад, вибраних з кортикостероїдів, бета-агоністів, ксантинів, мускаринових антагоністів і інгібіторів p38 MAP кінази. Переважно, щоб бета-агоністом був бета2-агоніст. В одному варіанті зазначену сполуку за даним винаходом вводять за допомогою інгаляцій, і кортикостероїд вводять перорально або за допомогою інгаляцій, або в комбінації або окремо. В одному варіанті зазначену сполуку за даним винаходом вводять за допомогою інгаляцій і бета2-агоніст вводять перорально або за допомогою інгаляцій, або в комбінації або окремо. ЕКСПЕРИМЕНТАЛЬНИЙ РОЗДІЛ Використані в описі скорочення представлені нижче (Таблиця 1). Будь-які скорочення, що не зазначені в таблиці, мають свої звичайно використовувані значення. Таблиця 1 Скорочення Aq водний Ac ацетил ACD кислий цитрат декстрози ATP аденозин-5'-трифосфат BALF Рідина бронхоальвеолярного лаважа br уширений BSA альбумін бичачої сироватки ХОЗЛ хронічне обструктивне захворювання легень CXCL1 CXC фрагмент хемокінінового ліганду 1 CXCL8 CXC фрагмент хемокінінового ліганду 8 d дублет DCM дихлорметан DMA диметилацетамід DMAP 4-диметиламінопіридин DMSO (ДМСО) диметилсульфоксид 13 UA 116002 C2 EDC.HCl гідрохлорид 1-етил-3-(3-диметиламінопропіл)карбодііміду ELISA Ферментний імуносорбентний аналіз + (ES ) іонізація електророзпиленням, в режимі позитивних іонів Et етил EtOAc етилацетат EtOH етанол FACS активований флуоресценцією клітинний сортинг FCS фетальна теляча сироватка FITC флуоресцинізотіоціанат FP флутиказонпропіонат HRLC-MS високоефективна рідинна хроматографія-мас-спектрометрія hr год.(години) HRP пероксидаза хрону IFNγ гамма-інтерферон i-n інтраназально i-t інтратрахеально IL-4 інтерлейкін 4 IL-5 інтерлейкін 5 IL-13 інтерлейкін 13 IL-17 інтерлейкін 17 LPS (ЛПС) ліпополісахарид IPA ізопропанол [пропан-2-ол] молярний M (M+H) + протонований молекулярний іон MCP-1 моноцитарний хемоатрактантний білок MDA малондіальдегід Me метил MeOH метанол MHz (МГц) МегаГерц min хвилина (хвилини) MIBK метилізобутилкетон MOMA-2 анти-моноцитарне і макрофагове антитіло MTT 3-(4,5-диметилтіазол-2-іл)-2,5-дифенілтетразолійбромід m/z відношення маси до заряду NH4OAc ацетат амонію nm нанометр NMP N-метилпіролідон ЯМР ядерний магнітний резонанс (спектроскопія) OVA овальбумін PBMC мононуклеарна клітина (клітини) периферичної крові PBS буферований фосфатом сольовий розчин Pd2(dba)3 тріс(дибензиліденацетон)дипаладій(0) PdCl2(PPh3)2 дихлорид біс(трифенілфосфін)паладію(II) Ph феніл 14 UA 116002 C2 PIP2 фосфатидилінозитол 4,5-біфосфат PIP3 фосфатидилінозитол 3,4,5-трифосфат PMA форболміристатацетат po пероральне введення PPh3 трифенілфосфін q квартет quin R t квінтет час утримування RH RT триплет TBME метил трет-бутиловий ефір ТГФ тетрагідрофуран TMB 3,3΄,5,5΄-тетраметилбензидин TNFα альфа-фактор некрозу пухлини TR-FRET 30 (СПС) стандартна помилка середнього значення t 25 натрійдодецилсульфат SEM 20 синглет SDS 15 Високоефективна рідинна хроматографія з оберненою фазою s 10 (КТ) кімнатна температура RP-HPLC 5 відносна вологість Резонансне перенесення енергії флуоресценції з розрізненням за часом Загальні процедури Усі вихідні матеріали і розчинники одержували або з комерційних джерел, або одержували відповідно до цитованих літературних джерел. Якщо не зазначене інше, усі реакційні розчини перемішували. Органічні розчини рутинно сушили над безводним сульфатом магнію. Колонкову хроматографію здійснювали, використовуючи попередньо набиті силікагелем (230-400 мешей, 40-63 мкм) картриджі, використовуючи зазначені кількості. Аналітичні способи Аналітична РХМС Аналітичну РХМС здійснювали, використовуючи колонку Waters Xselect CSH C18 3,5 мкм -1 (4,6×50 мм) зі швидкістю потоку 2,5-4,5 мл хв , здійснюючи градієнтне елюювання H2O-MeCN, що містить 0,1 % об./об. мурашиної кислоти протягом 4 хвилин. Інформація про градієнт: 0-3,00 хв, зменшення з 95 % H2O-5 % MeCN до 5 % H2O-95 % MeCN; 3,00-3,01 хв, витримували при -1 5 % H2O-95 % MeCN, швидкість потоку збільшували 4,5 мл хв ; 3,01 3,50 хв, витримували при 5 % H2O-95 % MeCN; 3,50-3,60 хв, повертали до 95 % H2O-5 % MeCN, швидкість потоку -1 зменшували до 3,50 мл хв ; 3,60-3,90 хв, витримували при 95 % H2O-5 % MeCN; 3,90-4,00 хв, -1 витримували при 95 % H2O-5 % MeCN, швидкість потоку зменшували до 2,5 мл хв . Фракції, що містять зразок, детектували по поглинанню УФ на 254 нм. Мас-спектри елюйованих піків вимірювали, використовуючи квадрупольний мас-спектрометр Agilent 6120, що працює в змішаних позитивних і негативних режимах розпилення іонів. 1 H ЯМР Спектроскопія 1 H ЯМР спектри одержували на спектрометрі Bruker Avance III з частотою 400 МГц, використовуючи залишковий недейтерований розчинник як стандарт, і якщо не зазначено інше, сполуки розчиняли в ДМСО-d6. Порошкова дифракція рентгенівських променів – спосіб 1 (використовуючи дифрактометр Brucker AXS C2 GADDS) Дифракційні картини одержували, використовуючи Cu Kα випромінювання (40 кВ, 40 мА), автоматичну XYZ підставку, лазерний відеомікроскоп для автопозиціонування зразка і HiStar двовимірний детектор площ. Рентгенівська оптика складалася з одиночного багатошарового дзеркала Gobel, з'єднаного з точковим коліматором 0,3 мм. Розбіжність пучка, тобто ефективний розмір рентгенівського пучка на зразок, складала приблизно 4 мм. Використовували безперервний режим сканування Θ-Θ з відстанню зразок-детектор 20 см, що забезпечувало ефективний 2 Θ інтервал 3,2°-29,7°. Звичайно зразок опромінювали пучком 15 UA 116002 C2 5 10 15 20 25 30 35 40 45 50 55 60 рентгенівських променів протягом 120 секунд. Для збору результатів використовували програмне забезпечення GADDS для XP/2004 4.1.43 і результати аналізували і представляли, використовуючи програми Diffrac Plus EVA v13.0.0.2 або v15.0.0.0. Зразки, що зберігаються при кімнатній температурі, підготовляли як плоскі зразкові пластини, використовуючи порошок, отриманий без здрібнювання. Приблизно 1-2 мг зразка злегка пресували на скляному слайді, щоб одержати плоску поверхню. Зразки, випробовувані не при умовах навколишнього середовища, встановлювали на силіконову пластину з теплопровідною сполукою. Потім зразок нагрівали до відповідної температури зі швидкістю 20°C/хв і потім витримували ізотермально протягом 1 хвилини перед початком збору даних. Порошкова дифракція рентгенівських променів – спосіб 2 (використовуючи удосконалений дифрактометр Brucker AXS D8) Дифракційні картини одержували, використовуючи Cu Kα випромінювання (40 кВ, 40 мА), Θ2Θ гоніометр, і розбіжність V4 і приймальні щілини, Ge монохроматор і Lynxeye детектор. Програмне забезпечення для збору даних являло собою Diffrac Plus XRD Commander v2.6.1 і результати аналізували і представляли, використовуючи програми Diffrac Plus EVA v13.0.0.2 або v15.0.0.0. Зразки вимірювали в умовах навколишнього середовища як плоскі пластини зразків, використовуючи порошки, як вони отримані. Зразок обережно поміщали в порожнину, вирізану в полірованій, з нульовим фоном (510) силіконовій пластині. Під час аналізу зразок обертали в його власній площині. Подробиці одержання результатів: кутовий інтервал: від 2 до 42° 2Θ; розмір кроку: 0,05° 2Θ; час нагромадження: 05 сек/крок. Порошкова дифракція рентгенівських променів – спосіб 3 (використовуючи дифрактометр PANalytical (Philips) X’PertPRO MPD) Прилад оснащували рентгенівською трубкою Cu LFF. Сполуку розподіляли на тримачеві зразків з нульовим фоном. Використані параметри приладу були наступні: генератор напруги: 45 кВ; генератор струму: 40 мА; геометрія: Bragg-Brentano; підставка: обертова підставка. Вимірювання проводили в такий спосіб: режим сканування: безперервний; інтервал сканування: від 3 до 50° 2Θ; розмір кроку: 0,02º/крок; час збору: 30 сек/крок; час обертання спінера: 1 сек; тип випромінювання: Cu Kα. Параметри падаючого пучка: програм. розбіжність щілини: 15 мм; щілина Солера: 0,04 рад; маска пучка: 15 мм; протирозсіювальна щілина: 1º; ніж пучка: +. Параметри дифрагмованого пучка наступні: довгий протирозсіювальний екран: +; щілина Солера: 0,04 рад; Ni фільтр: +; детектор: X’Celerator. Диференційна скануюча калориметрія – спосіб 1 (використовуючи прилад Mettler DSC 823e) Mettler DSC 823E оснащений 34-позиційним автоматичним пробовідбірником. Прилад калібрували по енергії і температурі, використовуючи сертифікований індій. Звичайно 0,5-3 мг кожного зразка, в алюмінієвому контейнері з голчастими отворами, нагрівали зі швидкістю 10°C/хв із 25°C до 300°C. Над зразком підтримували потік азоту зі швидкістю 50 мл/хв. Програмне забезпечення для контролю приладу й аналізу даних було STARe v9.20. Диференційна скануюча калориметрія – спосіб 2 (використовуючи прилад TA Q1000 MTДСК, оснащений охолоджувальним вузлом RCS) Контейнер зразка в TA інструменті закривали придатною кришкою, і криву DSC реєстрували на приладі TA-Instruments Q1000 MTDSWC, оснащеному RCS охолоджувальним вузлом. Використовували наступні параметри: початкова температура: 25°C; швидкість нагрівання: 10°C/хв; кінцева температура: 250°C. Термогравіметричний аналіз – спосіб 1 (використовуючи прилад MettlerTGA/SDTA 851e) Результати ТГА одержували на приладі Mettler TGA/SDTA 851e, оснащеному 34-позиційним автоматичним пробовідбірником. Температуру приладу калібрували, використовуючи сертифікований індій. Звичайно 5-30 мг кожного зразка поміщали на попередньо зважений алюмінієвий тигель і нагрівали зі швидкістю 10°C/хв із кімнатної температури до 350°C. Над зразком підтримували потік азоту зі швидкістю 50 мл/хв. Програмне забезпечення контролю приладу й аналізу даних було STARe v9.20. Термогравіметричний аналіз (ТГА) – спосіб 2 (використовуючи термогравіметр TAInstruments Q500 TGA) Результати ТГА одержували на термогравіметрі TA-Instruments Q500 TGA. Сполуку переносили в алюмінієвий тигель для зразка перед тим, як аналізували, використовуючи наступні параметри: початкова температура: кімнатна температура; швидкість нагрівання: 20°C/хв; коефіцієнт розрізнення: 4; кінцеві умови: 350°C або
ДивитисяДодаткова інформація
Назва патенту англійською2-((4-amino-3-(3-fluoro-5-hydroxyphenyl)-1h-pyrazolo[3,4-d]pyrimidin-1 -yl)methyl)-3-(2-(trifluoromet hyl)benzyl)quinazolin-4(3h)-one derivatives and their use as phosphoinositide 3-kinase inhibitors
Автори англійськоюOnions, Stuart, Thomas, Copmans, Alex Herman, Broeckx, Rudy Laurent Maria, Smith, Alun John, Taddei, David Michel Adrien
Автори російськоюОнионс Стюарт Томас, Копманс Алекс Герман, Брукс Руди Лорэнт Мария, Смит Алан Джон, Таддэи Дэвид Мишэль Адриен
МПК / Мітки
МПК: A61K 31/519, C07D 487/04
Мітки: застосування, фосфоінозитид-3-кінази, похідні, інгібіторів, 2-((4-аміно-3-(3-фтор-5-гідроксифеніл)-1н-піразоло[3,4-d]піримідин-1-іл)метил)-3-(2-(трифторметил)бензил)хіназолін-4(3н)-oну
Код посилання
<a href="https://ua.patents.su/53-116002-pokhidni-2-4-amino-3-3-ftor-5-gidroksifenil-1n-pirazolo34-dpirimidin-1-ilmetil-3-2-triftormetilbenzilkhinazolin-43n-onu-i-kh-zastosuvannya-yak-ingibitoriv-fosfoinozitid-3-kinazi.html" target="_blank" rel="follow" title="База патентів України">Похідні 2-((4-аміно-3-(3-фтор-5-гідроксифеніл)-1н-піразоло[3,4-d]піримідин-1-іл)метил)-3-(2-(трифторметил)бензил)хіназолін-4(3н)-oну і їх застосування як інгібіторів фосфоінозитид-3-кінази</a>
Попередній патент: Композиції і способи для модулювання швидкості утворення ebis з дитіокарбаматних фунгіцидів
Наступний патент: Змішувач для приготування будівельних сумішей
Випадковий патент: Молоткова дробарка












