2-{5-фтор-2-метил-3-[2-(фенілсульфоніл)бензил]-1н-індол-1-іл}оцтова кислота та її похідні, їх застосування для лікування захворювань, що опосередковуються дією pgd2 на рецептор crth2
Формула / Реферат
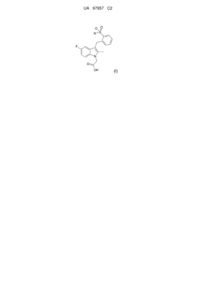
1. Сполука загальної формули (І)
 , (I)
, (I)
де R є феніл, що необов'язково заміщений однім або декількома галогенами;
або її фармацевтично прийнятна сіль, гідрат, сольват або комплекс.
2. Сполука загальної формули (II):
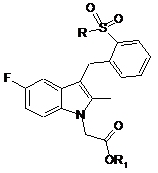 , II
, II
де R визначається у відповідності до загальної формули (І); а також
R1 є С1-С6алкіл.
3. Сполука за п. 1 та п. 2, у якій фенільна група R заміщена або не заміщена одним замісником, вибраним з галогену.
4. Сполука за п. 3, у якій галоген є фтором або хлором.
5. Сполука за п. 4 формули (I), у якій замісники фтор або хлор знаходяться у позиції 4 фенільної групи R.
6. Сполука за п. 1 та п. 2, яка вибрана з групи:
2-{5-фтор-2-метил-3-[2-(фенілсульфоніл)бензил]-1Н-індол-1-іл}оцтова кислота;
2-{3-[2-(4-хлорфенілсульфоніл)бензил]-5-фтор-2-метил-1Н-індол-1-іл}оцтова кислота;
2-{5-фтор-3-[2-(4-фторфенілсульфоніл)бензил]-2-метил-1Н-індол-1-іл}оцтова кислота;
або складні С1-С6алкілові ефіри будь-яких із зазначених сполук.
7. Спосіб одержання сполуки загальної формули (І) за будь-яким з пп. 1-6, відповідно до якого сполуку загальної формули (II) за п. 2 вводять у взаємодію з основою.
8. Сполука за будь-яким з пп. 1-6, призначена для застосування у медицині.
9. Сполука за будь-яким з пп. 1-6 для лікування таких захворювань, як астма, алергійна астма, загострення астми, хронічний кашель, пов'язаний із запальними та секреторними станами дихальних шляхів, хронічний алергійний риніт, сезонний алергійний риніт, поліпоз носа, атопічний дерматит, контактна гіперчутливість, контактний дерматит, кропивниця, кон'юнктивіт, алергійний кон'юнктивіт, еозинофільний бронхіт, езофагіт, еозинофільний гастроентерит, харчові алергії, запалення кишечнику, виразковий коліт, хвороба Крона, мастоцитоз, синдром гіперпродукції ІgЕ, синдром Черджа-Строса, розсіяний склероз, хронічне обструктивне захворювання легень та фіброзні стани.
10. Застосування сполуки за будь-яким з пп. 1-6 у приготуванні агента для лікування або профілактики таких захворювань, як астма, алергійна астма, загострення астми, хронічний кашель, пов'язаний із запальними та секреторними станами дихальних шляхів, хронічний алергійний риніт, сезонний алергійний риніт, поліпоз носа, атонічний дерматит, контактна гіперчутливість, контактний дерматит, кропивниця, кон'юнктивіт, алергійний кон'юнктивіт, еозинофільний бронхіт, езофагіт, еозинофільний гастроентерит, харчові алергії, запалення кишечнику, виразковий коліт, хвороба Крона, мастоцитоз, синдром гіперпродукції ІgЕ, синдром Черджа-Строса, розсіяний склероз, хронічне обструктивне захворювання легень та фіброзні стани.
11. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-6 разом з фармацевтичним наповнювачем або носієм.
12. Композиція за п. 11, лікарська форма якої призначена для перорального, ректального, назального, бронхіального (вдихання), місцевого (включаючи очні краплі, трансбукальне та сублінгвальне введення), вагінального або парентерального (включаючи підшкірне, внутрішньом'язове, внутрішньосудинне та інтрадермальне) призначення.
13. Композиція за п. 11 або п. 12, яка містить один або більше додаткових активних агентів, які є корисними при лікуванні захворювань та станів, опосередкованих PGD2 або іншими агоністами рецептора CRTH2.
14. Композиція за п. 13, в якій додаткові активні агенти вибрані з наступних речовин:
інші антагоністи CRTH2;
суплатаст тозилату та подібні сполуки;
агоністи b1-b4 адренорецепторів, такі як метапротеренол, ізопротеренол, ізопреналін, альбутерол, сальбутамол, формотерол, сальметерол, тербуталін, орципреналін, бітолтеролу мезилат та пірбутерол або метилксантани, такі як теофілін та амінофілін, стабілізатори тучних клітин, такі як кромоглікат натрію або антагоністи мускаринового рецептора (М1, М2 або М4);
антигістаміни, наприклад антагоністи гістамінового Н1 рецептора, такі як лоратидин, цетиризин, деслоратидин, фексофенадин, астемізол, ацеластин та хлорфенірамін, або антагоністи гістамінового рецептора Н2 або Н4;
агоністи a1 та a2 адренорецепторів, такі як пропілгекседрин, фенілефрин, фенілпропаноламін, псевдоефедрин, нафазоліну гідрохлорид, оксиметазоліну гідрохлорид, тетрагідрозоліну гідрохлорид, ксилометазоліну гідрохлорид та етилнорепінефрину гідрохлорид, міметики інсуліноподібного фактора росту (IGF-1);
інгібітори матриксної металопротеази (ММР), наприклад інгібітори стромелізинів, колагенази, желатинази та агреканази, особливо колагеназа-1, колагеназа-2, колагеназа-3, стромелізин-1, стромелізин-2, стромелізин-3 та ММР-12;
модулятори функції хемокінового рецептора, наприклад CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10 та CCR11 (для С-С сімейства) або CXCR1, CXCR2, CXCR3, CXCR4 та CXCR5 (для С-Х-С сімейства) та CX3CR1 для С-Х3-С сімейства;
антивірусні агенти, такі як Вірасепт (Viracept), азидодезокситимідин (АЗТ),
ацикловір та фаміцикловір та антисептичні сполуки, такі як Valant;
серцево-судинні агенти, наприклад блокатори кальцієвих каналів, гіполіпідемічні агенти, такі як статини, фібрати, бета-блокатори, інгібітори АСЕ (інгібітор ангіотензинперетворюючого ферменту), антагоністи рецептора Ангіотензин-2 та інгібітори агрегації тромбоцитів;
агенти ЦНС, наприклад такі антидепресанти, як сертралін, ліки проти хвороби Паркінсона, такі як депреніл, L-дигідроксифенілаланін, Requip, Міrарех, МАОВ інгібітори, такі як селегін та разагілін, інгібітори КОМП (соmР), такі як Tasmar, A-2 інгібітори, інгібітори зворотнього захоплення допаміну, антагоністи N-метил D-аспартату, антагоністи нікотину, агоністи Допаміну та інгібітори нейрональної синтази оксиду азоту та ліки проти хвороби Альцгеймера, такі як донепезил, такрин, інгібітори циклооксигенази, пропентофілін або метрифонат;
інгібітори триптази;
антагоністи фактора активації тромбоцитів (PAF);
інгібітори ензимів, конвертуючих інтерлейкіни (ICE);
інгібітори IMPDH;
інгібітори молекул адгезії, включаючи антагоністи VLA-4;
катепсини;
інгібітори МАР-кінази;
інгібітори глюкоза-6-фосфонатдегідрогенази;
антагоністи рецептора Кінін-В1 та -В2;
антиподагричні агенти, такі як колхіцин;
інгібітори ксантиноксидази, такі як алопуринол;
урикозуричні агенти, такі як пробенецид, сульфінпіразон та бензбромарон;
посилювачі секреції гормону росту;
активіни, трансформуючі b-фактори росту (TGFb);
фактор росту тромбоцитарний (PGDF);
фактор росту фібробластів, наприклад базовий фактор росту фібробластів;
гранулоцитарно-моноцитарний колонієстимулюючий фактор (GM-CSF);
калсайцини;
антагоністи рецептора тахікінінів NK1 та NK3, такі як NKP-608C, талнетант та D-4418;
інгібітори еластази, такі як UT-77 та ZD-0892;
інгібітори індукованої синтази оксиду азоту (ІСОА);
агенти остеопорозу, такі як ролоксифен, дролоксифен, лазофоксифен або фозомакс;
антихолінергічні агенти, такі як іпратропію бромід, тіотропію бромід, окситропію бромід, пірензепін та телензепін;
антагоністи лейкотриєну (LTB4, LTD4 та LTE4 антагоністи), такі як фенотіазин-3-они, такі як L-651,392, амідинові сполуки, такі як CGS-25019C, бензоксаламіни, такі як онтазоласт, бензолкарбоксимедаміди, такі як BIIL 284/260 та сполуки, такі як зафірлукаст, аблукаст, монтелукаст, пранлукаст, ферлукаст, RG-12525, Ro-245913, іралукаст та BAY x 7195;
інгібітори біосинтезу лейкотриєну, такі як інгібітори 5-ліпоксигенази або інгібітори активуючого протеїну 5-ліпоксигенази, такі як зилеутон, АВТ-761, фенлеутон, тепоксалін, Abbott-79175, N-(5-заміщений)-тіофен-2-алкілсульфонаміди, 2,6-ди-терт-бутилфенолгідразини, метокситетрагідропірани, такі як ZD2138, SB-210661, сполуки пиридинілзаміщеного 2-ціанонафталіну, такі як as L-739010, сполуки 2-ціанохіноліну, такі як L-746,530, сполуки індолу та хіноліну, такі як МK-591, МK-886 та BAY х 1005;
інгібітори фосфодіестерази, включаючи інгібітори PDE4, такі як інгібітори PDE4D;
засоби для лікування анти-ІgЕ антитілами, такий як омалізумаб;
антибактеріальні засоби, такі як фузидова кислота (особливо при лікуванні атопічного дерматиту);
фунгіциди, такі як клотримазол (особливо при лікуванні атопічного дерматиту);
імунодепресанти, такі як такролім та особливо пімекролім у випадку запального захворювання шкіри або, як альтернатива, FK-506, рапаміцин, циклоспорин, азатіоприн або метотрексат;
антипроліферативні/протипухлинні ліки, такі як алкілуючі агенти, наприклад цисплатин, карбоплатин, циклофосфамід, азотистий іприт, мелфалан, хлорамбуцил, бузульфан та нітрозосечовина, антиметаболіти, наприклад антифолати, такі як фторопіримідини, такі як 5-фтороурацил та тегафур, ралтитрексед, метотрексат, цитозин арабінозид, гідроксисечовина, гемцитабін та паклітаксел; протипухлинні антибіотики, такі як антрацикліни, такі як адріаміцин, блеоміцин, доксорубіцин, дауноміцин, епірубіцин, ідарубіцин, мітоміцин-С, дактиноміцин та метраміцін;
антимітотичні агенти, такі як алкалоїди барвінку, включаючи вінкристин, вінбластин, віндезин та вінорелбін, а також таксоїди, такі як інгібітори таксолу, таксотера та топоізомерази, такі як епіподофілотоксини, такі як етопозид та теніпозид, амсакрин, топотекан та камптотецин; цитостатики, такі як антиестрогени, такі як тамоксифен, тореміфен, ралоксифен, дролоксифен та йодоксифен, регулятори зниження кількості рецепторів естрогенів, такі як фульвестрант, антиандрогени, такі як бікалутамід, флутамід, нілутамід та ацетат ципротерону, антагоністи рецептора LHRH або такі агоністи, як гозерелін, лейпрорелін та бусерелін, прогестогени, такі як мегестролу ацетат, інгібітори ароматази, такі як анастрозол, летрозол, боразол та екземестан, а також інгібітори 5α редуктази, такі як фінастерид;
агенти, що інгібують інвазію ракових клітин, наприклад інгібітори металопротеїнази, такі як маримастат, а також інгібітори з функцією рецептора урокіназного активатору плазміногену;
інгібітори функції фактора росту, наприклад антитіла фактора росту, рецепторні антитіла фактора росту, наприклад анти-еrbb2 антитіло герцептин та анти-еrbb2 антитіло цетуксимаб, інгібітори фарнезилтрансферази, інгібітори тирозинкінази та інгібітори серин- і треонінкінази, наприклад інгібітори сімейства фактора росту епідермісу, такі як N-(3-хлор-4-фторфеніл)-7-метокси-6-(3-морфолінопропокси)хіназолін-4-амін (гефітиніб), N-(3-етинілфеніл)-6,7-бі-(2-метоксіетокси)хіназолін-4-амін (ерлотиніб) та 6-акриламідо-N-(3-хлоро-4-фторофеніл)-7-(3-морфолінопропокси)хіназолін-4-амін (СІ 1033), або інгібітори фактора росту тромбоцитів або сімейства фактора росту гепатоцитів;
антиангіогенні агенти, особливо ті, що інгібують ефекти фактора росту судин ендотелію, наприклад антитіло бевацизумаб антиваскулярного фактора росту судин ендотелію, а також сполуки, що діють згідно з іншими механізмами, наприклад ліномід, інгібітори функції інтегрину anb3 та ангіостатин;
агенти, що пошкоджують судини, такі як комбретастатин А4;
антисмислові засоби лікування, які придатні для вищезазначених цілей, наприклад ISIS 2503, анти-ras антисенс;
агенти генної терапії, включаючи агенти для заміщення аберантних генів, таких як аберант р53 або аберант BRCA1 або BRCA2, GDEPT (генно-направлена ензимна терапія), цитозин дезамінази, тимідинкіназа або бактеріальний ензим нітроредуктази, або агенти для підвищення витривалості пацієнта до хіміотерапії та променевої терапії, таких як мультирезистентна генна терапія;
агенти імунотерапії, включаючи in vivo та ex vivo підходи для підвищення імуногенності клітин пухлини пацієнта, такі як трансфекція цитокінами, такими як IL2, IL4 або GMCSF, підходи щодо зменшення анергії Т-клітин, підходи з використанням трансфікованих імунних клітин, таких як цитокін-трансфіковані дендритичні клітини, або підходи з використанням цитокін-трансфікованих клітинних ліній пухлин або антиідіотипічних антитіл;
кортикостероїди, такі як преднізон, преднізолон, флунізолід, триамцинолону ацетонід, беклометазону дипропіонат, будезонід, флутиказону пропіонат та мометазону фуроат, а також гіалуронові кислоти, такі як хіалган та синвіск, а також антагоністи рецептора Р2×7;
ліки, що сприяють відповідній реакції Th1 цитокіну, такі як інтерферони, TNF або GM-CSF;
інші антагоністи PGD2, що діють на інші рецептори, таки як антагоністи DP рецептора;
інгібітори фосфодієстерази типу 4, такі як цилоніласт;
ліки, що модулюють вироблення цитокіну, такі як інгібітори TNFα, що перетворюють ензим (ТАСЕ), анти-TNF моноклональні антитіла, імуноглобулінові молекули TNF рецептора, інгібітори інших TNF ізоформ, неселективні СОХ-1/СОХ-2 інгібітори, такі як просикам, диклофенак, пропіонові кислоти, такі як напроксен, флубіпропен, фенопрофен, кетопрофен та ібупрофен, фенамати, такі як мефенамова кислота, індометацин, суліндак та апазон, піразолони, такі як фенілбутазон, саліцилати, такі як аспірин; інгібітори СОХ-2, такі як мелоксикам, целекоксиб, фофекоксиб, вальдекоксиб та еторикоксиб, незначна доза метотрексату, лефуномід, циклезонід, гідроксилхлорохін, купреніл, ауранофін або парентеральні або оральні препарати золота;
ліки, що модулюють активність цитокінів IL-4 та IL-5, такі як блокуючі моноклональні антитіла та розчинні рецептори;
PPAR-γ агоністи, такі як розиглітазон; або
анти-RSV антитіла, такі як Synagis (павілізумаб) та агенти, що можуть використовуватись для лікування риновірусної інфекції у майбутньому, наприклад інтерферон-бета та інші інтерферони.
15. Спосіб одержання фармацевтичної композиції за будь-яким з пп. 11-14, при якому сполуку за будь-яким з пп. 1-6 сполучають або поєднують з фармацевтично або ветеринарно прийнятним носієм або наповнювачем.
16. Продукт, що містить сполуку за будь-яким з пп. 1-6 та один або більше агентів за п. 14, який є комбінованим засобом для одночасного, окремого або послідовного застосування для лікування хвороби або стану, опосередкованого дією PGD2 або інших агоністів рецептора CRTH2.
17. Застосування за п. 10, у якому такий агент також містить додатковий активний агент, що є корисним для лікування захворювань та станів, що опосередковуються PGD2 aбo іншими агоністами CRTH2 та/або DP рецепторів.
18. Застосування за п. 17, у якому додатковий активний агент є одним з агентів за п. 14.
Текст
Реферат: Сполуки загальної формули (І) O O R S F N O OH , (I) де R є фенілом, що не обов'язково заміщений одним або декількома галогенами; та їх фармацевтично прийнятні солі, гідрати, сольвати або комплекси є корисними у лікарській формі для орального введення при лікуванні алергічних захворювань, таких як астма, алергічний риніт та атопічний дерматит. UA 97957 C2 (12) UA 97957 C2 UA 97957 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується сполук, які використовуються у якості фармацевтичних речовин, способів одержання таких сполук, композицій, що містять їх, та їх використання у лікуванні та профілактиці алергічних захворювань, таких як астма, алергічний риніт та атопічний дерматит та інших запальних захворювань, опосередкованих простагландином D 2 (PGD2) та іншими агоністами, що діють на CRTH2 рецептори клітини, включаючи еозинофільні гранулоцити, базофіли та Th2 лімфоцити. PGD2 являє собою ейкозаноїд, а саме клас хімічного медіатора, що синтезується клітинами у відповідь на локальне пошкодження тканини, при звичайних або гормональних подразниках або через клітинні шляхи активації. Ейкозаноїди зв'язуються зі специфічними поверхневоклітинними рецепторами, що знаходяться у багатьох видах тканини тіла та опосередкують різні ефекти у цих тканинах. Відомо, що PGD2 продукується мастоцитами, макрофагами та Th2 лімфоцитами, та їх значні концентрації були виявлені у дихальних шляхах хворих на астму пацієнтів, яким вводились антигени (Murray et al, (1986), N. Engl. J. Med. 315: 800-804). Інстиляція PGD2 у дихальні шляхи може викликати багато ознак астматичної реакції, включаючи бронхостеноз (Hardy et al, (1984) N. Engl. J. Med. 311: 209-213; Sampson et al, (1997) Thorax 52: 513-518) та накопичення еозинофілів (Emery et al, (1989) J. Appl. Physiol. 67: 959-962). Потенціал екзогенно-застосовуваного PGD2 для викликання запальної реакції був підтверджений шляхом використання трансгенних мишей, надмірно експресуючих людські PGD 2 синтази, які демонструють надмірно збільшене еозинофільне запалення легенів та продукування Th2 цитокінів у відповідь на антиген (Fujitani et al, (2002) J. Immunol. 168: 443-449). Першим рецептором, специфічним до PGD2, було визначено DP рецептор, який зв'язаний з підвищенням міжклітинних рівнів циклічного аденозинмонофосфату. Однак, вважається, що PGD2 опосередковує значний обсяг запальної дії шляхом взаємодії з взаємозв'язаним з протеїном рецептором G, що іменується CRTH2 (хемоатрактантна рецепторно-гомологічна молекула, що експресується Th2 лімфоцитами, еозинофілами та базофілами (Hirai et al, (2001) J. Exp. Med. 193: 255-261, and EP0851030 and EP-A-1211513 and Bauer et al, EP-A-1170594). Здається зрозумілим, що дія PGD2 на активацію Th2 лімфоцитів та еозинофілів опосередкується CRTH2, так як селективні агоністи 13,14 дигідро-15-кето-PGD2 (DK- PGD2) та 15R-метил-PGD2 можуть викликати відповідну реакцію та дія PGD 2 блокується анти-CRTH2 антитілом (Hirai et al, 2001; Monneret et al, (2003) J. Pharmacol. Exp. Ther. 304: 349-355). Для порівняння, селективний DP агоніст BW245C не сприяє міграції Th2 лімфоцитів або еозинофілів (Hirai et al, 2001; Gervais et al, (2001) J. Allergy Clin. Immunol. 108: 982-988). З огляду на об'єктивні дані, викликання протидії PGD2 з боку CRTH2 рецептора є ефективним підходом для лікування Th2-залежних алергічних захворювань, таких як астма, алергичгий риніт та атопічний дерматит. У документі ЕР-А-1170594 наводиться припущення, що даний метод може застосовуватись з метою ідентифікації сполук, які використовуються при лікуванні алергічної астми, алергічного риніту, атопічного дерматиту, автоімунних, реперфузійних пошкоджень та великої кількості запальних станів, усі з яких опосередкуються дією PGD2 та інших агоністів CRTH2 рецептора. Сполуки, що зв'язуються з CRTH2 розглядаються у документі WO-A-03066046 та WO-A03066047. Дані сполуки не є новими, проте були вперше розкриті, разом з іншими сполуками, у документах GB 1356834, GB 1407658 та GB 1460348, де їх дія характеризувалася анти запальна, анальгетична та антипіретична. У документах WO-A-03066046 та WO-A-03066047 вказується, що дані сполуки являють собою модуляцію дії CRTH2 рецептора і, таким чином, використовуються у лікуванні та профілактиці захворювань непрохідності дихальних шляхів, таких як астма, хронічне обструктивне захворювання легенів (ХОЗЛ) та велика кількість інших захворювань, включаючи різні стани суглобів, кісток, шкіри та очей, шлунково-кишкового тракту, центральної та периферійної нервової систем та інших тканин, а також відторгнення алотрансплантата. Дані сполуки не є похідною індолу з вмістом заміщувача оцтової кислоти на позиції 3 індолового кільця. Документи PL 65781 та JP 43-24418 також відносяться до похідних індол-3-оцтова кислота, які схожі за структурою з індометацином та, як індометацин, мають протизапальну та антипіретичну дію. Однак, хоча можливо цьому не надавалось суттєвого значення при публікуванні даних документів, описані сполуки представляють собою інгібітори циклооксигенази, дія яких суттєво відрізняється від дії сполук у даному виноході. Дійсно, інгібітори циклооксигенази протипоказані при лікуванні багатьох хвороб та станів, напр. астми та запального захворювання кишечнику, для яких корисними виявляються саме сполуки даного винаходу, хоча вони інколи також можуть використовуватись при лікуванні артритних станів. Також існує попередній рівень техніки, що стосується сполук з індол-1-оцтова кислота, проте вони не описуються у якості антагоністів CRTH2. Наприклад, документи WO-A-9950268, WO-A 1 UA 97957 C2 5 10 15 20 25 30 35 40 45 50 55 0032180, WO-A-0151849 та WO-A-0164205 відносяться до сполук, що являють собою похідні індол-1-оцтової кислоти, проте, як зазначається, дані сполуки являють собою інгібітори альдоредуктази, ефективні при лікуванні цукрового діабету (WO-A-9950268, WO-A-0032180 та WO-A-0164205) або гіпоурікемічні агенти (WO-A-0151849). У зазначених документах не зазначається про корисність цих сполук у лікуванні хвороб та станів, що опосередковуються PGD2 та іншими агоністами рецептора CRTH2. Документ US 4,363,912 стосується похідних індоліл-1-оцтової кислоти які, як стверджується, являють собою інгібітори тромбоксан-синтетази та є корисними при лікуванні таких станів як тромбоз, ішемічна хвороба серця та порушення мозкового кровообігу. Документ WO-A-9603376 стосується сполук, які, як стверджується, являють собою інгібітори sPLA2, що є корисними у лікуванні бронхіальної астми та алергічного риніту. Усі дані сполуки містять заміщувані аміду та гідразидів замість похідного карбонової кислоти, як у цьому винаході. Документ JP 2001247570 стосується методу отримання 3-бензотіазоліл індол оцтової кислоти, яка, як стверджується, являє собою інгібітор альдоредуктази. Документ US 4,859,692 стосується сполук, які, як стверджується, являють собою антагоністи лейкотрієну, що є корисними у лікуванні таких станів як астма, алергія на пилок та алергічний риніт, а також певних запалювальних захворювань, а саме таких як бронхіт, атопічна та ектопічна екзема. Деякі із сполук у даному документі являють собою індол-1-оцтові кислоти, проте ті ж автори стверджують у J. Med. Chem., 6(33), 1781-1790 (1990), що сполуки з групою оцтової кислоти при азот індолі не мають значної пептид-лейкотриєнової активності. З огляду на вищезазначене, найбільш дивує те, що сполуки даного винаходу, які всі мають групу оцтової кислоти при азот індолі, є корисними при лікуванні таких станів як астма, алергія на пилок та алергічний риніт. Документ US 4,273,782 стосується похідних індол-1-оцтової кислоти які, як стверджується, є корисними при лікуванні таких станів, як тромбоз, ішемічна хвороба серця, порушення мозкового кровообігу, транзиторна ішемічна атака, мігрень та васкулярні ускладнення діабету. У документі не зазначаються стани, що опосередкуються дією PGD 2 або інших антагоністів СРТН2-рецептора. Документ US 3,557,142 стосується 3-заміщених-1-індол-карбонових кислот та ефірів, які, як стверджується, є корисними у лікуванні запальних станів. Документ WO-A-03/097598 стосується сполук, які є антагоністами рецептора CRTH2. Вони не мають ароматичних заміщувачів у позиції індол-3. Праця Cross et al, J. Med. Chem. 29, 342-346 (1986) стосується процесу приготування похідних індол-1-оцтової кислоти з відповідних ефірів. Стверджується, що сполуки, до яких вони відносяться, являють собою інгібітори тромбоксан-синтетази. Документ ЕР-А-0539117 стосується похідних індол-1-оцтової кислоти, які являють собою антагоністи лейкотрієнів. Документ US 2003/0153751 похідних індол-1-оцтової кислоти, що являють собою інгібітори sPLA2. Однак, всі з наведених сполук містять об'ємні заміщувачі на 2 та 5 позиціях системи індола і, таким чином, значно відрізняються від сполук даного винаходу. Документ US 2004/011648 розкриває похідні індол-1-оцтової кислоти, що являють собою інгібітори РАІ-1. При цьому, не зазначається, що дані сполуки можуть мати активність антагоністів CRTH2. Документ WO 2004/058164 стосується сполук, які, як зазначається, являють собою модулятори астматичних та алергічних запалень. Активність демонструють лише ті сполуки, які повністю відрізняються структурою від похідних індол-1-оцтової кислоти даного винаходу. Сполуки, що зв'язуються з рецептором CRTH2, наводяться у документі WO-А-03/097042 та WO-A-03/097598. Дані сполуки являють собою індол оцтові кислоти, проте у документі WO-A03/097042 система індола з'єднується у 2-3 позиціях з 5-7-членним карбоциклічним кільцем. У документі WO-A-03/097598 описується піролідинова група на позиції-3 індолу. Документи WO-A-03/101981, WO-A-03/101961 та WO-A-2004/007451 всі стосуються похідних індол-1-оцтової кислоти, які, як зазначається, являють собою антагоністи CRTH2, проте структурно відрізняються від сполук загальної формули (І), так як відсутній спейсер або група S- або -SO2- у позиції-3 індолу на місці групи СН2 сполук даного винаходу, як описано нижче. Документ WO-A-2005/019171 також стосується похідних індол-1-оцтової кислоти, які, як зазначається, являють собою антагоністи CRTH2, які є корисними при лікуванні різних захворюваннях дихання. Зазначені сполуки всі містять заміщувач, який зв'язаний з позицією-3 індолу кисневим спейсером. 2 UA 97957 C2 5 10 15 20 Документ WO-A-2005/094816 також описує похідні індол-1-оцтової кислоти, у даному випадку з аліфатичним заміщувачем в позиції-3 індолового кільця. Як зазначається, сполуки являються собою антагоністи CRTH2. Документ WO-A-2006/034419 відноситься до сполук антагоністів індола, що включають гетероциклічний або гетероароматичний заміщувач, прямо зв'язаний з позицією-3 системи індолового кільця. У нашій попередній заявці, WO-A-2005/044260, ми описуємо сполуки, що являють собою антагоністи PGD2 рецептора CRTH2. Дані сполуки являють собою похідні індол-1-оцтової 8 9 9 8 кислоти, заміщувані на позиції-3 групою CR R , у якій R - водень або алкіл, та R - ароматична складова, яка може бути заміщена однім або декількома заміщувачами. Описувані сполуки є сильнодіючими антагоністами in vitro PGD2 рецептора CRTH2. Однак, нами було виявлено при тестуванні in vivo, фармакoкінетичний профіль деяких сполук не є оптимальним та їх активність протягом всього тестування зміни вмісту еозинофілів у цільній крові, що дає можливість припускати in vivo активність сполук, часто дещо менша за очікувані від результатів in vitro зв'язування. 8 Однак, цікавим виявився той факт, що при внесенні змін до групи R сполук у документі WOA-2005/044260, нам вдається досягти покращень у in vitro активності щодо зміни вмісту еозинофілів у цільній крові та in vivo інгібуванні DK-РGD2-індукованої еозинофілії крові, а також у фармакокінетичному профілі для орального прийому суб'єктом. Таким чином, даний винахід відноситься до нових сполук, що зв'язуються з CRTH2 та які є корисними при лікуванні захворювань та станів, що опосередкуються активністю PGD 2 на рецепторі CRTH2. Даний винахід стосується сполуки загальної формули (І) 25 30 35 40 45 50 де R є феніл, що необов'язково заміщений одним або декількома галогенами; або її фармацевтично прийнятна сіль, гідрат, сольват або комплекс. Сполуки загальної формули (І) являють собою антагоністи CRTH2 рецептора та є корисними у лікуванні станів, що опосередкуються PGD 2 або іншими агоністами, що зв'язуються з CRTH2. Це включає алергічні захворювання, астматичні стани та запалювальні захворювання, серед яких алергічна астма, бронхіальна астма, загострення астми та відповідні алергічні захворювання викликані вірусною інфекцією, зокрема загострення викликані риновірусом та РСВ-вірусом, внутрішня, зовнішня, викликана фізичним навантаженням, медикаментозна та викликана пилом астма, лікування кашлю, включаючи хронічний кашель, що пов'язаний з запальними та секреторними станами дихальних шляхів та ятрогенний кашель, гострий та хронічний риніт, включаючи медикаментозний риніт, вазомоторний риніт, хронічний алергічний риніт, сезонний алергічний риніт, поліпоз носа, гостра вірусна інфекція, включаючи загальну застуду, інфекція пов'язана з РСВ-вірусом, грип, корона-вірус та аденовірус, атопічний дерматит, контактна гіперчутливість (включаючи контактний дерматит), екзематозний дерматит, фітодерматид, світловий дерматит, себорейний дерматит, хвороба Дюрінга, лишай склеротичний та атрофічний, гангренозна піодермія, саркоїд, дискоїдний червоний вовчак, пемфігус, пемфігоїд, бульозний епідермоліз, кропивниця, набряк Квінке, васкуліт, токсичні ерітеми, шкірна еозинофілія, кругова алопеція, чоловіча алопеція, синдром Світа, синбром Вебера-Крістіана, поліморфна еритема, целюліт, панікуліт, шкірні лімфоми, немеланомний рак шкіри і інші диспластичні пошкодження; блефарит, кон'юнктивіт, особливо алергічний кон'юнктивіт, передній та задній увеїт, хоріоідит, автоімунні, дегенеративні або запальні розлади, що впливають на сітківку, офтальмія; бронхіт, зокрема інфекційний і еозинофільний бронхіт, емфізема, розширення бронхів, алергічний альвеоліт у працівників сільського господарства, алергічний пневмонит, ідіопатична інтерстиціальна пневмонія, ускладнення трансплантації легені, васкулітичні і тромбічні розлади судинної системи легенів, легенева 3 UA 97957 C2 5 10 15 20 25 30 35 40 45 50 55 гіпертензія, харчова алергія, гінгівіт, запалення язика, періодонтит, запалення стравоходу, включаючи рефлюкс, еозинофільний гастроентерит, проктит, анальна сверблячка, глютеїнова хвороба, алергія на продукти харчування, запальне захворювання кишечника, виразковий коліт і захворювання Крона, мастоцитоз, а також інші хвороби опосередковані CRTH2, наприклад аутоіммунні хвороби як наприклад гіпер-IGE-синдром, тиреоїдит Хашимото, хвороба Грейвса, хвороба Адісона, цукровий діабет, ідіопатична тромбоцитопенічна пурпура, еозинофільний паучит, антифосфоліпідний синдром та системна червона вовчанка, СНІД, лепра, синдром Сезарі, паранеопластичний синдром, змішані та недиференційовані хвороби з'єднувальної тканини, запальні міопатії включаючи дерматоміозіт та поліміозіт, поліміаглія ревматична, хронічний проліартрит у дітей, ревматичний поліартрит, васкуліти включаючи гігантоклітинний артеріїт, синдром Такаясу, синдром Черджа-Строса, нодозний поліартерііт, мікроскопічний поліартерііт, темпоральний артеріїт, тяжка міастенія, гострі та хронічні болі, нейропатичний больовий синдром, невродегенерація, ускладнення злоякісних, інфекційних та автоімунних процесів центральної та периферійної нервової системи, болі спини, сімейна середземноморська лихоманка, синдром Макла-Уелса, сімейна ірландська лихоманка, хвороба Кікучі, псоріаз, запалення сальної залози, розсіяний склероз, відторгнення аллотрансплантанта, реперфузійне пошкодження, хронічне обструктивне захворювання легенів, а також ревматичний артрит, септичний артрит і інші інфекційні артопатії та кісткові розлади і остеоартрит; гострий та хронічний індукований кристалами синовіт включаючи уратну подагру, хворобу відкладення кристалів пірофосфату кальція, кальцій пептид сухожильний синдром та синовіальне запалення, хвороба Бехчета, первинний та вторинний системний склероз та обмежена склеродермія синдрому Шьогрена; гепатит, цироз печінки, холецистит, панкреатит, нефрит, нефритичний синдром, цистит та хронічна язва сечового міхура, гострий та хронічний уретрит, простатит, епідидиміт, оофорит, сальпінгіт, вульвовагинит, хвороба Пейроні, еректильна дисфункція, хвороба Альцгеймера та інші ментальні розлади; перикардит, міокардит, запальна та автоімунна кардіоміопатія включаючи міокардіальний саркоїд, ішемічне реперфузійне пошкодження, ендокардит, вальвуліт, аортит, флебіт, тромбоз, лікування розповсюджених видів раку та фіброзних станів таких як кріптогенний фіброзний альвеоліт, колоїди, надмірне фіброзне рубцювання/постхірургічне зрощування, фіброз печінки включаючи зв'язок з гепатитом В та С, фіброїди маточні, саркоїдоз включаючи нейросаркоїдоз, склеродерма, фіброз нирки на фоні діабету, фіброз пов'язаний з ревматоїдним артритом (RA), атеросклероз, включаючи церебральний атеросклероз, васкуліт, міокардіальний фіброз в результаті інфаркту міокарда, кістозний фіброз, рестеноз, системний склероз, хвороба Дюпюітрена, фіброз ускладнюючий антинеоплатичну терапію та хронічна інфекція включаючи туберкульоз, аспергілльоз та інші мікозні інфекції, фіброз ЦНС що слідує за інсультом або лікування без фіброзного рубцювання. Сполуки є особливо корисними при лікуванні або профілактиці алергічної астми, переніального алергічного риніту, сезонного алергічного риніту, атопічного дерматиту, контактної гіперчутливості (включаючи контактний дерматит), кон'юнктивіту, особливо алергічного кон'юнктивіту, еозинофільного бронхіту, алергії на продукти харчування, еозинофільного гастроентериту, запального захворювання кишечника, виразкового коліту та хвороби Крона, мастоцитоза, болей, нейродегенеративних хвороб а також інших хвороб опосередкованих PGD2, наприклад таких автоімунних хвороб як гіпер-lgЕ-синдром та системна червона вовчанка, псоріаз, запалення сальної залози, розсіяний склероз, відторгнення аллотрансплантанта, реперфузійне пошкодження, хронічне обструктивне захворювання легенів, а також ревматичний артрит, псоріатичний артрит та остеоартрит. Покращена активність при тестуванні зміни вмісту еозинофілів в цільній крові та фармацевтичний профіль сполук загальної формули (І) є досить несподіваною, так як деякі сполуки у документі WO-A-2005/044260, які мають подібну структуру до сполук загальної формули (І) не мають зазначених позитивних якостей. Зокрема, сполука у Прикладі 17 документу WO-A-2005/044260 є схожою до сполук даного винаходу та повинна мати ідентичні властивості. Однак, заміщення групи метилсульфонілу на 4 позиції бензольного кільця у прикладі 17 документу WO-A-2005/044260 групою SO2R на 2 позиції бензольного кільця у сполуках формули (І) має значний вплив на фармакокінетичність і активність сполук, так як коли Сполука 17 документу WO-A-2005/044260 приймається орально, її фармакокінетичний профіль є in vivo менш сприятливим ніж у сполук загальної формули (І). Додатково відносно великої кількості сполук у документі WO-A-2005/044260 нами було виявлено, що in vitro активність даних сполук щодо зміни вмісту еозинофілів у цільній крові є часто меншою від їх очікуваної відповідної in vitro активності згідно експериментів радіогландного зв'язування відносно рецептора CRTH2. 4 UA 97957 C2 5 10 15 20 25 30 35 40 45 50 55 60 Більш того, покращення активності є досить специфічним відносно групи сполук загальної формули (І), так як сполуки, які є навіть більш тісно співвіднесені ніж сполуки у документі WO-A2005/044260 не мають таких сприятливих властивостей. Наприклад, аналоги загальної формули (І), у яких група SO2R знаходиться у позиції 3- або 4- бензольного кільця, є менш активними при тестуванні зміни вмісту еозинофілів в цільній крові. У даній специфікації "C1-С6 алкіл" відноситься до прямого або розгалуженого вуглеводневого ланцюга, що містить від одного до шести атомів вуглецю та необов'язково заміщується одним або більше заміщувачем або одним або більше С 3-С7 груп циклоалкіл. Наприклад метил, етил, н-пропіл, ізопропіл, т-бутил, н-гексил, трифлуорометил, 2-хлороетил, метиленциклопропіл, метиленциклобутіл та метиленциклопентіл. "C1-С4 алкіл" та "С1-С18 алкіл" мають схожі значення окрім значень вмісту атомів вуглецю, а саме від одного до чотирьох та від одного до вісімнадцяти відповідно. С3-С7 циклоалкіл відноситься до насиченого від 3- до 7-членного карбоциклічного кільця. Прикладами даних груп слугують циклопропіл, циклобутил, циклопентил та циклогексил. Уданій специфікації, термін «галоген» означає фтор, хлор, бром та йод. Поняття «ароматична складова» та «арил» у контексті даної специфікації відносяться до системи ароматичного кільця, що містить від 5 до 14 атомів вуглецевого циклу та містять до 3 кілець. Прикладами ароматичних складових є бензол та нафталін. Арильні групи можуть заміщуватись одним або декількома заміщувачами обраними з галогенів, C 1-С6 алкіл, C1-С6 9 9 алкоксі, 5-7-членного гетероциклічного кільця або SO2R , де R відповідає вищезазначеному визначенню. Відповідні фармацевтично та ветеринарно прийнятні солі сполук загальних формул (І) та (II) включають основно-адитивні солі, такі як солі натрію, калію, кальцію, алюмінію, цинку, магнію та інших металів, включаючи іхолін, діетаноламін, етаноламін, етилдіамін та інші добре відомі основно-адитивні солі. У відповідному випадку, фармацевтично або ветеринарно прийнятні солі можуть також включати солі органічних кислот, включаючи але не обмежуючись наступними: ацетат, трифлюороацетат, лактат, глюклнат, сіль лимонної кислоти, татрат, малеат, малат, пантотенат, адипат, алгінат, аспартат, бензоат, бутерат, глюконат, циклопентанат, глюкогептанат, гліцерофосфат, оксалат, гептаноат, гексаноат, фумарат, нікотинат, памоат, пектинат, 3фенілпропіонат, пікрат, півалат, пропріонат, тартрат, лактобіонат, піволат, камфорат, ундеканоат ісукцинат, органічні сильфонові кислоти як наприклад метансульфонат, етансульфонат, 2-гідроксіетан сульфонат, камфорсульфлонат, 2-нафталінсульфонат, бензолсульфонат, р-хлоробензолсульфонат і р-толуолсульфонат; і неорганічні кислоти як наприклад гідрохлорид, гідробромід, йодгідрат, сульфат, бісульфат, гемісульфат, тіоцианід, персульфат, фосфорні і сульфонова кислоти. Фармацевтично та ветеринарно неприйнятні солі можуть також слугувати у якості посередників. Проліки є будь-які ковалентно зв'язані сполуки, що вивільняють активну вихідну лікарську речовину за загальною формулою (І) in vivo. Приклади проліків включають алкілові ефіри сполук загальної формули (І), наприклад ефіри загальної формули (II) як наведено нижче. У випадку наявності у сполуці даного винаходу хірального центру або іншої форми ізомерного центру, у даному документі буде розглянуто всі форми даного ізомеру або ізомерів, включаючи енантіомери та діастереоізомери. Сполуки винаходу що містять хіральний центр можуть використовуватись як рацемічні суміші, суміші збагачені енантіомерами, або ж рацемічну суміш можна відділити з використанням добре відомих технологій, а також може використовуватись один індивідуальний енантіомер. У сполуках загальної формули (І), перевага надається незаміщеній групі феніла R або ж заміщеній єдиним галогеновим заміщувачем, зазвичай фтором або хлором, який зазвичай знаходиться у 4-позиції групи фенілу R. Найбільш переважними сполуками є: 2-{5-фтор-2-метил-3-[2-(фенілсульфоніл)бензил]-1H-індол-1-іл}оцтова кислота; 2-{3-[2-(4-фторфенілсульфоніл)бензил]-5-фтор-2-метіл-1H-індол-1-іл}оцтова кислота; 2-{5-Фтор-3-[2-(4-фторфенілсульфоніл)бензил]-2-метил-1Η-індол-1-іл}оцтова кислота; 11 12 або C1-С6 алкіл, арил, (СН2)mОС(=О)С1-С6алкіл, (CH2)mN(R )2, CH((CH2)mO(C=O)R )2 естери або будь-які елементи з вищезазначених; де m є 1 або 2; 11 R є водень або метил; 12 R є С1-С18 алкіл. Відповідно до ще одного аспекту винахід стосується сполуки загальної формули (II): 5 UA 97957 C2 5 10 15 де R визначається у відповідності до загальної формули (І); та 1 R є C1-С6 алкіл. Сполуки загальної формули (II) є новими та можуть використовуватись як проліки для сполук загальної формули (І). Коли сполука загальної формули діє у якості проліків, вона згодом трансформується у ліки завдяки дії естерази у крові або у тканині пацієнта. 1 Приклади особливо підходящих груп R при застосуванні сполуки загальної формули включають: метил, етил, пропіл, феніл, CH 2OC(=O)tBu, CH2CH2N(Me)2 CH2CH2NH2 або 12 12 CH(CH2O(C=O)R )2 де R визначено вище. 1 Додатково до використання зазначених сполук у якості проліків, сполуки формули (II), де R є C1-С6 алкіл, можуть застосовуватись у процесі приготування сполуки загальної формули (І), а саме у процесі що передбачає реакцію сполуки загальної формули (II) з основою (базою), такою як гідроксид натрію або гідроксид літію. Реакція може відбуватись у водному або органічному розчиннику, або у суміші зазначених розчинників. Типовий розчинник, що застосовується для реакції є сумішшю тетрогідрофурану та води. Сполуки загальної формули (II) можуть бути одержані зі сполук загальної формули (III): 20 1 де R визначається відповідно до загальної формули (II); шляхом реакції зі сполукою загальної формули (IV): 25 30 де R визначається відповідно до загальної формули (І); в умовах кислотного гідроалкілування. Сполуки загальної формули (III) є доступними у готовому вигляді або можуть бути приготовлені при застосуванні добре відомих спеціалістам методів. Альдегіди загальної формули (IV) можуть бути отримані шляхом ацетальної захисної групи загальної формули (V). 6 UA 97957 C2 5 де R визначається відповідно до загальної формули (І). Видалення захисної групи можна досягти за допомогою реакції з водовмісною кислотою, наприклад сірчаною кислотою, за якою слідує процес нейтралізації основою, зазвичай твердим вуглекислим калієм. Реакція може проводитись за температури від 0 до 40°С, зазвичай в кімнатній температурі. Сполуки загальної формули (V) можна отримати шляхом окислення сполуки загальної формули (VI) 10 15 де R визначається у відповідності до загальної формули (І). Окислення сульфідної групи можна досягнути за використанням надлишкової кількості окислюючого агента, такого як наприклад хлоропероксібензойна кислота. Реакційна суміш може бути з самого початку охолодженою, наприклад від -5 до 5°С, а потім їй дають можливість розігрітися, зазвичай до кімнатної температури. Ацеталь загальної формули (VI) може бути отриманий шляхом введення захисту альдегіду загальної формули (VII) 20 25 де R визначається у відповідності до загальної формули (І). Захист можна забезпечити шляхом реакції з триметоксіметаном та толуол-п-сульфоновою кислотою в умовах відсутності вологості, а також в умовах інертної атмосфери, за чим слідує додання метілату натрію в метанол. Сполуки загальної формули (VII) є комерційно доступними. Як альтернатива, їх можливо отримати шляхом реагування сполуки загальної формули (VIII): 30 35 де R визначається у відповідності до загальної формули (І) з 2-фторобензальдегідом. Реакція може здійснюватись за помірних базових умов у полярному розчинювачі, такому як ДМСО та при інертній атмосфері за температури від 80 до 110°С. Сполуки загальної формули (VIII) є комерційно доступними та можуть бути отримані за допомогою добре відомих спеціалістам методів. Інший шлях отримання сполук загальної формули (VII), як зазначено вище, передбачає формулювання сполуки загальної формули (X): 7 UA 97957 C2 5 де R визначається у відповідності до загальної формули (І); при використанні n-бутил літій та диметилформаміду (ДМФА) у органічному розчинювачі, такому як тетрагідрофуран. Зазвичай, реакція відбувається при інертній атмосфері, напр. азот, що охолоджується до температури приблизно -78°С вступаючи у реакцію з n-бутил літій та розігрівається до кімнатної температури після додання (ДМФА). Сполуки загальної формули (X) можуть бути отримані шляхом реакції 2-бромотиофенолу зі сполукою загальної формули (XI): 10 R-X 15 де R визначається у відповідності до загальної формули (І) та X є групою, що може бути, зокрема галогеновою групою, наприклад хлор або бром. Реакція може здійснюватись у присутності основи (бази), наприклад карбонату цезію та при температурі 20-50°С (зазвичай при 40°С). Альтернативним шляхом отримання сполук загальної формули (IV) є реакція натрієвих солей загальної формули (IX): R-SO2Na 20 25 30 35 40 45 50 55 (XI) (IX) де R визначається у відповідності до загальної формули (І). Реакція може відбуватись у розчиннику такому як диметилсульфоксид при підвищеній температурі, зазвичай від 80 до 110°С. Тривалість реакції може сягати декількох днів. Натрієві солі загальної формули (IX) є комерційно доступними. Сполуки загальної формули (IV) можливо також приготувати безпосередньо зі сполук загальної формули (VII) без необхідності забезпечення введення або зняття захисту. У даній процедурі, охолоджений окислювальний агент, а саме мета хлоропероксібензоїдна кислота, може бути доданою до сполуки загальної формули (VII), що зазвичай супроводжується охолодженням приблизно від -5 до 5°С. Реагуючу суміш можна розігріти до 15-30°С, зазвичай до кімнатної температури, після чого здійснити реакцію з мета бісульфітом натрію. Як було зазначено вище, деякі сполуки загальної формули є комерційно доступними. Сполуки загальної формули (І) є антагоністами рецептора CRTH2 сполуки загальної формули (II) є проліками для сполук загальної формули (І). Таким чином, сполуки загальної формули (І) та (II) є корисними при застосуванні методу лікування захворювань та станів, які опосередкуються PGD2 або іншими агоністами на рецепторі CRTH2, що полягає у призначенні пацієнту відповідної кількості сполуки загальної формули (І) або (II). Щодо третього аспекту винаходу, передбачається застосування сполуки загальної формули (І) або (II) у медицині, зокрема, при лікуванні та профілактиці захворювань та станів, що опосередкуються PGD2 та іншими агоністами рецептора CRTH2. Окрім цього, також передбачається використання загальної формули (І) або (II) у приготуванні агента для лікування та профілактики захворювань та станів, що опосередкуються агоністами рецептора CRTH2, зокрема PGD2. У відповідності до вищезазначеного, ці захворювання та стани включають астму, алергійну астму, загострення астми, хронічний кашель, пов'язаний із запальними та секреторними станами дихальних шляхів, хронічний алергійний риніт, сезонний алергійний риніт, поліпоз носа, атопічний дерматит, контактну гіперчутливість, контактний дерматит, кропивницю, кон'юктивіт, алергійний кон'юктивіт, еозинофільний бронхіт, езофагіт, еозинофільний гастроентерит, харчові алергії, запалення кишківника, виразковий коліт, хвороба Крона, мастоцитоз, синдром гіперпродукції lgЕ, синдром Черджа-Строса, розсіяний склероз, хронічне обструктивне захворювання легень та фіброзні стани. Зі сполук загальної формули (І) або (II) належним чином створюється відповідна лікарська формула, що залежить від захворювань або станів, що вимагають їх застосування. Таким чином, відповідно до ще одного аспекту даний винахід стосується отримання фармацевтичної композиції, що містить сполуку загальної формули (І) або (II) разом з фармацевтичним наповнювачем або носієм. Інші активні агенти також можуть бути присутніми, в залежності від хвороби або стану, що лікується. Носій або, якщо наявно більше ніж один носій, кожен з носіїв має бути прийнятним з огляду на сумісність з іншими інгредієнтами суміші та не повинен спричиняти шкідливий вплив на реципієнта. 8 UA 97957 C2 5 10 15 20 25 30 35 40 45 50 55 Лікарська форма розроблена для можливості перорального, ректального, назального, бронхіального (вдихання), місцевого (включаючи очні краплі, трансбукальне та сублінгвальне введення), вагінального або парентерального (включаючи підшкірне, внутрішньом'язове, внутрішньосудинне та інтрадермальне) введення та може створюватись за допомогою будьяких загальновідомих спеціалістам методів у сфері фармакології. Шлях введення залежатиме від стану пацієнта, проте бажаними шляхами введення є пероральні, назальні, бронхіальні або ж шляхом місцевого введення. Сполука може бути підготовлена шляхом об'єднання вищезазначеного активного агента з носієм. У загальному аспекті, лікарська форма створюється шляхом рівномірного та безпосереднього об'єднання активного агента з рідинними носіями або високодисперсними твердими носіями, або ж з поєднанням двох вищезазначених носіїв, і після цього, при необхідності, надання форми продукту. Винахід розповсюджується на методи підготовки фармацевтичної композиції, що передбачає поєднання або об'єднання сполуки загальної формули (І) або (II) з фармацевтично або ветеринарно прийнятним носієм або середовищем. Лікарська форма для перорального введення по відношенню до даного винаходу може бути представлена як: дискретні елементи, такі як капсули, саше або таблетки, кожна з яких містить визначену частку активної речовини у водовмісній або ж безводній рідині; або ж у формі рідинної емульсії типу «масло в воді» або як водно-масляна рідинна емульсія, або у формі пілюлі і т.д. Відносно сполук для перорального введення (напр.: таблетки та капсули), термін «прийнятний носій» охоплює основи (середовища) такі як загальні допоміжні речовини, напр.: в'яжучі реагенти, напр. сироп, акація, желатин, сорбітом, трагант, полівінілперолідон (Повідон), метилцелюлоза, етилцелюлоза, натрій карбоксіметилцелюлоза, гідроксіметилцелюлоза, цукроза і крахмал; фільтри і носії, напр. кукурудзяний крохмаль, желатин, лактоза, цукроза, мікрокристалічна целюлоза, каолін, манітол, дикальцій фосфат, хлористий натрій і альгінова кислота, а також змащувальні речовини, такі як стеарат магнію та стеарат натрію та інші металічні стеарати, гліцерил стеарат стеаринова кислота, силіконова рідина, талькові масла, колоїдний окис кремнію. Ароматизатори, такі як перцева м'ята, гаультерієве масло, ароматизатор вишні та подібні сполуки також можуть застосовуватись. Також доречним може виявитись додання барвників з метою забезпечення даній лікарській формі достатньої пізнаваності. Також, за допомогою загальновідомих методів, таблетки також можуть вкриватися оболонкою. Таблетки можливо виробляти шляхом пресування та формовки, за бажанням з використанням одного або декількох допоміжних інгредієнтів. Пресовані таблетки можуть виготовлятись шляхом пресування у відповідній машині активної речовини у вільно текучому стані, як наприклад порошок або гранули, необов'язково змішувані із зв'язуючим компонентом, змащувальною речовиною, інертним розчинником, консервантом, поверхнево-активним або диспергуючим агентом. Формовка таблеток може включати формовку у спеціальній машині відповідної суміші порошкової сполуки, зволоженої інертним рідинним розчинником. За бажанням, на таблетки можна нанести покриття або риски, при чому їх лікарська форма може передбачати уповільнене або контрольоване вивільнення активних речовин. Інші лікарські форми для перорального застосування включають пастилки, що містять активну речовину у поєднанні з ароматизованою основою, зазвичай цукрозою, акацією, або трагантом; пастилки складаються з активної речовини у інертній основі, як наприклад желатин та гліцерин, або цукроза та акація; та рідини для полоскання ротової порожнини, що містять активну речовину у відповідному рідинному носії. Для місцевого застосування на шкіру, сполуки загальної формули (І) або (II) можуть бути у формі крему, мазі, желе, розчину або суспензії і т.д. Лікарські форми крему або мазі, що можуть застосовуватись у якості ліків являють собою загальноприйняті фармакологічні форми та описуються у стандартних фармацевтичних виданнях, як наприклад Британська Фармакоепія. Сполуки загальної формули (І) або (II) можуть застосовуватись для лікування дихальних шляхів способом назального, бронхіального або букального введення аерозолів або спреїв, які розповсюджують фармакологічно активну речовину у формі порошку або у формі крапель розчину або суспензії. Фармацевтичні композиції з порошкорозпилюючими властивостями зазвичай містять, окрім активної речовини, рідкий газ-витискувач (пропелянт) з температурою кипіння нижче кімнатної, та, при бажанні, допоміжні речовини, такі як рідкі та тверді неіонні та аніонні поверхнево-активні речовини та/або розбавлювачі. Фармацевтичні композиції з вмістом у суміші фармакологічно активної речовини додатково містять газ-витискувач (пропелянт), та, окрім цього, при бажанні, відповідний розчинник та/або стабілізатор. Замість газу-витискувача 9 UA 97957 C2 5 10 15 20 25 30 35 40 45 50 55 60 можливо використовувати стиснене повітря. При виробництві відповідних фармакологічних форм застосовуються спеціалізовані пристрої для стискання та розширення газів. Парентеральні форми мають бути стерильними. Типова дозування сполуки складає від 0.01 до 100 мг/кг; зазначене дозування підтримує концентрацію ліків в плазмі на достатньому дієвому рівні для забезпечення інгібування PGD 2 рецептора CRTH2. Визначення точного лікувально-дієвого дозування сполуки загальної формули (І) або (II) та оптимальний шлях введення даної сполуки визначаються за допомогою звичної процедури порівняння рівня агента (речовини) у крові з необхідною концентрацією для досягнення лікувального ефекту. Сполуки загальної формули (І) або (II) можуть застосовуватись у поєднанні з одним або декількома активними речовинами, що є корисними при лікуванні вищезазначених захворювань та станів, при чому ці активні речовини не є обов'язково інгібіторами PGD 2 рецептора CRTH2. Таким чином, вищезазначена фармацевтична композиція може вміщувати один або декілька із зазначених активних речовин. Також забезпечується використання сполук загальної формули (І) або (II) у приготуванні агента для лікування захворювань та станів, опосередкованих агоністами рецептора CRTH2, зокрема PGD2, при чому цей агент містить додатковий агент, що є корисним при лікуванні аналогічних хвороб та станів. Дані додаткові активні речовини можуть бути іншими агоністами рецептора CRTH2 або ж можуть мати зовсім інший механізм дії. Вони включають існуючі схеми лікування алергічних та інших запалювальних захворювань, включаючи: суплатаст тозилату та подібні сполуки; агоністи 1-4 адренорецепторів, такі як метапротеренол, ізопротеренол, ізопреналін, альбутерол, сальбутамол, формотерол, сальметерол, тербуталін, орципреналін, бітолтеролу мезилат та пірбутерол або метилксантани, такі як теофілін та амінофілін, стабілізатори тучних клітин, такі як кромоглікат натрію або антагоністи мускаринового рецептора (М1, М2 або М4); антигістаміни, наприклад антагоністи гістамінового Н1 рецептора, такі як лоратидин цетиризин, деслоратидин, фексофенадин, астемізол, ацеластин та хлорфенірамін або антагоністи гістамінового рецептора Η2 або Н4; агоністи 1 та 2 адренорецепторів, такі як пропілгекседрин фенілефрин, фенілпропаноламін, псевдоефедрин, нафазоліну гідрохлорид, оксиметазоліну гідрохлорид, тетрагідрозоліну гідрохлорид, ксилометазоліну гідрохлорид та етилнорепінефрину гідрохлорид, міметики інсуліноподібного фактора росту (IGF-1); інгібітори матриксної металопротеази (ММР), наприклад, інгібітори стромелізинів, колагенази желатинази та агреканази, особливо колагеназа-1, колагеназа-2, колагеназа-3, стромелізин-1, стромелізин-2, стромелізин-3 та ММР-12; модулятори функції хемокінового рецептора, наприклад CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10 та CCR11 (для С-С сімейства) або CXCR1, CXCR2, CXCR3, CXCR4 та CXCR5 (для С-Х-С сімейства) та CX3CR1 для С-Х3-С сімейства; антивірусні агенти, такі як Вірасепт (Viracept), азидодезокситимідин (АЗТ); ацикловір та фаміцикловір та антисептичні сполуки, такі як Valant; сердцево-судинні агенти, наприклад блокатори кальцієвих каналів, гіполіпідемічні агенти, такі як статини, фібрати, бета-блокатори, інгібітори АСЕ (інгібітор ангіотензинперетворюючого ферменту), антагоністи рецептора Ангіотензин-2 та інгібітори агрегації тромбоцитів; агенти ЦНС, наприклад такі антидепресанти, як сертралін, ліки проти хвороби Паркінсона, такі як депреніл, L-дигідроксифенілаланін, Requip, Mirapex, MAOB інгібітори, такі як селегін та разагілін, інгібітори КОМП (соmР), такі як Tasmar, A-2 інгібітори, інгібітори зворотного захоплення допаміну, антагоністи N-метил D-аспартату, антагоністи нікотину, агоністи Допаміну та інгібітори нейрональної синтази оксиду азоту та ліки проти хвороби Альцгеймера, такі як донепезил, такрин, інгібітори циклооксигенази, пропентофілін або метрифонат; інгібітори триптази; антагоністи фактора активації тромбоцитів (PAF); інгібітори ензимів, конвертуючих інтерлейкіни (ICE) інгібітори IMPDH інгібітори молекул адгезії, включаючи антагоністи VLA-4; катепсини; інгібітори МАР-кінази; інгібітори глюкоза-6-фосфонатдегідрогенази; антагоністи рецептора Кінін- В1 та В2; 10 UA 97957 C2 5 10 15 20 25 30 35 40 45 50 55 60 анти-подагричні агенти, такі як колхіцин; інгібітори ксантиноксидази, такі як алопуринол; урикозуричні агенти, такі як пробенецид, сульфінпіразон та бензбромарон; посилювачі секреції гормону росту; активіни, трансформуючі -фактори росту (TGF); фактор росту тромбоцитарний (PGDF) фактор росту фібробластів, наприклад базовий фактор росту фібробластів; гранулоцитарно-моноцитарний колоніє стимулюючий фактор (GM-CSF); калсайцини; антагоністи рецептора тахікінінів NK1 та NK3, такі як NKP-608C, талнетант та D-4418; інгібітори еластази, такі як UT-77 та ZD-0892; інгібітори індукованої синтази оксиду азоту (ІСОА); агенти остеопорозу, такі як ролоксифен, дролоксифен, лазофоксифен або фозомакс; антихолінергічні агенти, такі як іпратропію бромід, тіотропію бромід, окситропію бромід, пірензепін та телензепін; антагоністи лейкотриєну (LTB4, LTD4 та LTE4 антагоністи), такі як фенотіазин-3-они, такі як L651,392, амідинові сполуки, такі як CGS-25019C, бензоксаламіни, такі як онтазоласт, бензолкарбоксимедаміди, такі як BIIL 284/260 та сполуки, такі як зафірлукаст, аблукаст, монтелукаст, пранлукаст, ферлукаст, RG-12525, Ro-245913, іралукаст та BAY x 7195; інгібітори біосинтезу лейкотриєну, такі як інгібітори 5-ліпоксигенази або інгібітори активуючого протеїну 5-ліпоксигенази, такі як зилеутон, АВТ-761, фенлеутон, тепоксалін, Abbott79175, N-(5-заміщений)-тіофен-2-алкілсульфонаміди, 2,6-ди-терт-бутилфенолгідразини, метокситетрагідропірани, такі як ZD2138, SB-210661, сполуки пиридинілзаміщеного-2ціанонафталіну, такі як L-739010, сполуки 2-ціанохіноліну, такі як L-746,530, сполуки індолу та хіноліну, такі як МK-591, МK-886 та BAY x 1005; інгібітори фосфодіестерази, включаючи інгібітори PDE4, такі як інгібітори PDE4D; засоби для лікування анти-lgЕ-антитілами, такі як омалізумаб; антибактеріальні засоби, такі як фузидова кислота (особливо при лікуванні атопічного дерматиту); фунгіциди, такі як клотримазол (особливо при лікуванні атопічного дерматиту); імунодепресанти, такі як такролім та особливо пімекролім у випадку запального захворювання шкіри або, як альтернатива, FK-506, рапаміцин, циклоспорин, азатіоприн або метотрексат; антипроліферативні/протипухлинні ліки, такі як алкілуючі агенти, наприклад, цисплатин, карбоплатин, циклофосфамід, азотистий іприт, мелфалан, хлорамбуцил, бузульфан та нітрозосечовина, антиметаболіти, наприклад, антифолати, такі як фторопіримідини, такі як 5фтороурацил та тегафур, ралтитрексед, метотрексат, цитозин арабінозид, гідроксисечовина, гемцитабін та паклітаксел; протипухлинні антибіотики, такі як антрацикліни, такі як адріаміцин, блеоміцин, доксорубіцин, дауноміцин, епірубіцин, ідарубіцин, мітоміцин-С, дактиноміцин та метраміцін; антимітотичні агенти, такі як алкалоїди барвінку, включаючи вінкристин, вінбластин, віндезин та вінорелбін, а також таксоїди, такі як інгібітори таксолу, таксотера та топоізомерази, такі як епіподофілотоксини, такі як етопозид та теніпозид, амсакрин, топотекан та камптотецин; цитостатики, такі як, антиестрогени, такі як тамоксифен, тореміфен, ралоксифен, дролоксифен та йодоксифен, регулятори зниження кількості рецепторів естрогенів, такі як фульвестрант, антиандрогени, такі як бікалутамід, флутамід, нілутамід та ацетат ципротерону, антагоністи рецептора LHRH або такі агоністи як гозерелін, лейпрорелін та бусерелін, прогестогени, такі як мегестролу ацетат, інгібітори ароматази, такі як анастрозол, летрозол, боразол та екземестан, а також інгібітори 5 редуктази, такі як фінастерид; агенти, що інгібують інвазію ракових клітин, наприклад інгібітори металопротеїнази, такі як маримастат, а також інгібітори з функцією рецептора урокіназного активатору плазміногену; інгібітори функції фактора росту, наприклад, антитіла фактору росту, рецепторні антитіла фактору росту, наприклад, анти-erbb2 антитіло герцептин та анти-erbb2 антитіло цетуксимаб, інгібітори фарнезилтрансферази, інгібітори тирозинкінази та інгібітори серин- і треонінкінази, наприклад інгібітори сімейства фактору росту епідермісу, такі як N-(3-хлор-4-фторфеніл)-7метокси-6-(3-морфолінопропокси)хіназолін-4-амін (гефітиніб), N-(3-етинілфеніл)-6,7-бі-(2метоксіетокси)хіназолін-4-амін (ерлотиніб) та 6-акриламідо-N-(3-хлоро-4-фторофеніл)-7-(3морфолінопропокси)хіназолін-4-амін (СІ 1033), або інгібітори фактору росту тромбоцитів або сімейства фактору росту гепатоцитів; антиангіогенні агенти, особливо ті, що інгібують ефекти фактору росту судин ендотелію, наприклад, антитіло бевацизумаб антиваскулярного фактору 11 UA 97957 C2 5 10 15 20 25 30 35 40 45 50 55 60 росту судин ендотелію, а також сполуки, що діють згідно з іншими механізмами, наприклад, ліномід, інгібітори функції інтегрину ν3 та ангіостатин; агенти, що пошкоджують судини, такі як комбретастатин А4; антисмислові засоби лікування, які придатні для вищезазначених цілей, напр. ISIS 2503, анти-ras антисенс; агенти генної терапії, включаючи агенти для заміщення аберантних генів, таких як аберант р53, або аберант BRCA1 або BRCA2, GDEPT (генно-направлена ензимна терапія), цитозин дезамінази, тимідинкіназа або бактеріальний ензим нітроредуктази або агенти для підвищення витривалості пацієнта до хіміотерапії та променевої терапії, таких як мультирезистентна генна терапія; агенти імунотерапії, включаючи in vivo та ex vivo підходи для підвищення імуногенності клітин пухлини пацієнта, такі як трансфекція цитокінами, такими як IL2, IL4 або GMCSF, підходи щодо зменшення анергії Т-клітин, підходи з використанням трансфікованих імунних клітин, таких як цитокін-трансфіковані дендритичні клітини, або підходи з використанням цитокінтрансфікованих клітинних ліній пухлин або антиідіотипічних антитіл; кортикостероїди, такі як преднізон, преднізолон, флунізолід, триамцинолону ацетонід, беклометазону дипропіонат, будезонід, флутиказону пропіонат та мометазону фуроат, а також гіалуронові кислоти, такі як хіалган та синвіск, а також антагоністи рецептора Р2Х7; ліки, що сприяють відповідній реакції Th1 цитокіна, такі як інтерферони, TNF або GM-CSF; інші антагоністи PGD2, що діють на інші рецептори, такі як антагоністи DP рецептора; інгібітори фосфодієстерази типу 4, такі як цилоніласт; ліки, що модулюють вироблення цитокіну, такі як інгібітори TNF, що перетворюють ензим (ТАСЕ), анти-TNF моноклональні антитіла, імуноглобулінові молекули TNF рецептора, інгібітори інших TNF ізоформ, неселективні СОХ-1/СОХ-2 інгібітори, такі як просикам, диклофенак, пропіонові кислоти, такі як напроксен, флубіпропен, фенопрофен, кетопрофен та ібупрофен, фенамати, такі як мефанамова кислота, індометацин, суліндак та апазон, піразолони, такі як фенілбутазон, саліцилати, такі як аспірин; інгібітори СОХ-2, такі як мелоксикам, целекоксиб, фофекоксиб, вальдекоксиб та еторикоксиб, незначна доза метотрексату, лефуномід, циклезонід, гідроксилхлорохін, купреніл, ауранофін або парентеральні або оральні препарати золота; ліки, що модулюють активність цитокінів IL-4 та IL-5, такі як блокуючі моноклональні антитіла та розчинні рецептори; PPAR- агоністи, такі як розиглітазон; або з анти-RSV антитіла, такі як Synagis (павілізумаб) та агенти, що можуть використовуватись для лікування риновірусної інфекції у майбутньому, наприклад, інтерферон-бета та інші інтерферони. Подальший відмінний аспект винаходу передбачає отримання продукту, що складається зі сполуки загальної формули (І) або (II) та одного або декількох вищезазначених агентів та являє собою препарат для одночасного, окремого або послідовного використання при лікування захворювання або стану, що опосередкується дією PGD2 на CRTH2 рецепторі. Винахід буде описано більш детально з посиланням на наведені далі приклади, які не обмежують об'єму охорони, та малюнки, у яких: Малюнок 1 представляє ділянку концентрації у крові Сполуки 1 порівняно з часом при оральному дозуванні пацюків Сполукою 1 у пропорції 3мг/кг. Малюнок 2 представляє ділянку концентрації у крові Сполуки 2 порівняно з часом при оральному дозуванні пацюків Сполукою 2 у пропорції 3мг/кг. Малюнок 3 представляє ділянку концентрації у крові Сполуки 3 порівняно з часом при оральному дозуванні пацюків Сполукою 3 у пропорції 3мг/кг. Малюнок 4 представляє ділянку концентрації у крові Сполуки А порівняно з часом при оральному дозуванні пацюків Сполукою А у пропорції 3мг/кг. Малюнок 5 представляє ділянку концентрації у крові Компаратора В порівняно з часом при оральному дозуванні пацюків Порівняльною Сполукою В у пропорції 3мг/кг. Малюнок 6 представляє дію дозувань 0.0001, 0.001, 0.01 та 0.1 г/кг Сполуки 1 на DK-PGD2індуковану еозинофілію у пацюків. Малюнок 7 представляє дію дозувань 0.0001, 0.001, 0.01 та 0.1 г/кг Сполуки 2 на DK-PGD2індуковану еозинофілію у пацюків. Малюнок 8 представляє дію дозувань 0.0001, 0.001, 0.01 та 0.1 г/кг Сполуки 3 на DK-PGD2індуковану еозинофілію у пацюків. Малюнок 9 представляє дію дозувань 0.0001, 0.001, 0.01 та 0.1 г/кг Сполуки А на DK-PGD2індуковану еозинофілію у пацюків. 12 UA 97957 C2 Малюнок 10 представляє дію дозувань 0.0001, 0.001, 0.01 та 0.1 г/кг Сполуки В на DKPGD2-індуковану еозинофілію у пацюків. Приготування Сполук Загальної Формули І Сполуки Прикладів 1-3 були приготовані у відповідності до наступних реакційних схем: 5 10 13 UA 97957 C2 5 10 15 20 25 30 35 40 45 50 55 Приклад 1 - Приготування 2-(5-фтор-2-метил-3-(2-(фенісульфоніл)бензол)-1Н-індол-1іл)оцтова кислота (Сполука 1) З комерційно-доступних бензолсульфонова кислота натрієва сіль та 2-фторбензальдегід. a) Процедура І. (SNAr) для отримання 2-(фенілсульфоніл)бензальдегід До розчину 2-фтор-бензальдегіда (5.00 мл, 47,6 мкмоль) у диметилсульфоксиді (45 мл) було додано натрієву сіль бензол сульфінової кислоти (8,60г, 52,4 мкмоль) та отриману суміш було розігріто до 100°С Після нагрівання сіль сульфінової кислоти розчинилась. Розчин розігрівався при температурі 100°С протягом трьох днів. Реакцію було охолоджено до кімнатної температури та було додано воду (50мл). За допомогою етилацетату, з суміші було видобуто екстракт, комбіновані органічні екстракти було обмито насиченим окропом, висушено над MgSO4 та сконцентровано у вакуумі. Сировинний матеріал було рафіновано флешхроматографією на кремнієвому елююванні з 25% етилацетату: петролейний ефір (40-60°С) до 33% етилацетат: петролейний ефір (40-60°С) для надання (4.12 г, 16.7 мкмоль, 35%). Η (300 MHz, d6-DMSO) 10.68 (1Н, s, CHO), 8.26-8.17 (1Н, m, Ar), 8.08-7.99 (2Н, m, Ar), 7.99-7.89 (3H, m, Ar) та 7.80-7.62 (3H, m, Ar). b) Процедура Е. (гідроалкілування) для отримання етил 2-(5-фтор-2-метил-3-(2(фенілсульфоніл)бензол)-1Н-індол-1-іл)ацетат До розчину 2(5-фтор-2-метил-1Н-індол-1-іл)оцтова кислота (1.29 г, 1.49 мкмоль), 2(фенілсульфоніл)бензальдегід (1.50 г, 6.10 мкмоль) та триетилсілан (4.30 мл, 27.0 мкмоль) у діхлорометані (40 мл) було додано трифлурооцтову кислоту (1.25 мл, 16.5 мкмоль) по краплям під N2 при 0°С протягом 30 хвилин. Реакція була розігріта до кімнатної температури та перемішувалась протягом 2 годин. Був доданий насичений водянистий розчин бікарбонатy натрію та продукт був екстрагований дихлорометаном. Комбіновані органічні екстракти було обмито насиченим окропом, висушено над MgSO4 та сконцентровано у вакуумі, після чого було отримано коричневе масло, яке було перетерте у порошок з петролейним ефіром (40-60°С) для отримання білої сухої речовини (1.34 г, 2.88 мкмоль 52%). Η (300 MHz, CDCI3) 8.36-8.30 (1H, m, Ar), 8.00-7.93 (2H, m, Ar), 7.68-7.52 (3H, m, Ar), 7.45-7.33 (2Н, m, Ar), 7.05 (1Н, dd, J 8.6 та 4.3Hz, Ar), 6.96-6.90 (1Н, m, Ar), 6.82 (1Н, td, J 9.1 та 2.7Hz, Ar), 6.24 (1Н, dd, J 9.5 та 2.4Hz, Ar), 4.76 (2H, s, NCH2), 4.22 (2H, s, ArCH2Ar), 4.21 (2H, q, J 7.1Hz, CH 2CH3), 2.14 (3H, s, CH3) та 1.27 (3H, t, J 7.1Hz, CH2CH3). c) Процедура F (омилювання) для отримання 2-(5-фтор-2-метил-3-(2(фенілсульфоніл)бензил)-1H-індол-1-іл)оцтова кислота До перемішаного розчину (пункт b) (1.33 г, 2.86 мкмоль) у тетрагідрофурані (15мл) було додано розчин водного гідроокису калію (KОН) (500мг, 2, 86 мкмоль) у воді (15мл). Після 2годинного проміжку, тетрагідрофуран було видалено під зниженим тиском та основний водяний шар було змито етилацетатом. Залишковий водяний шар був окислений НСІ (2N) та екстрагований етилацетатом. Комбіновані органічні екстракти було обмито насиченим окропом, висушено над MgSO4 та сконцентровано у вакуумі, після чого було отримано коричневy суху речовину, якy було перетертo у порошок з сумішшю діетилового ефіру та петролейного ефіру (40-60°С) для отримання білої сухої речовини (1.14 г, 2.61 мкмоль 91%). Η (300 MHz, d6-DMSO) 13.00 (1Н, bs, СО2Н), 8.26-8.20 (1Н, m, Ar), 7.99-7.93 (2Н, m, Ar), 7.80-7.62 (3H, m, Ar), 7.55-7.48 (2H, m, Ar), 7.34 (1H, dd, J 8.6 та 4.3Hz, Ar), 6.93-6.87 (1H, m, Ar), 6.81 (1H, td, J 9.1 та 2.7Hz, Ar), 6.18 (1H, dd, J 9.7 та 2.4Hz, Ar), 4.95 (2H, s, NCH 2), 4.14 (2H, s, ArCH2Ar) та 2.06 (3H, s, CH3). + Tr=4.62 хв (95%), m/z (M+H) 438.3. Приклад 2 - Приготування 2-(3-(2-(4-хлорофенілсульфоніл)бензил)-5-фтор-2-метил-1Hіндол-1-іл)оцтова кислота (Сполука 2) З комерційно-доступного 2-(4-хлорфенілтіо)бензальдегід. а) Процедура J. (Пряме окислення) для отримання 2-(4-хлорофенілсульфоніл) бензальдегід До суміші 2-(4-хлорофенілсульфоніл) бензальдегід (2.00 г, 8.00 мкмоль) у дихлорометані (20мл) при 0°С було додано мета-хлороксібензойна кислота (77% макс, 5.40 г, 24.17 мкмоль) у порціях через 15 хвилин, потім розігріто до кімнатної температури та перемішано протягом 2 годин. Водний розчин піросульфіта натрію було обережно додано до закінчення виділення газів. Розчин було екстраговано дихлорометаном та комбіновані органічні екстракти було обмито NaOH потім насиченим окропом, висушено над MgSO 4 та сконцентровано у вакуумі з одержанням білої сухої речовини (1.05 г, 3.74 мкмоль, 46%). Η (300 MHz, d6-DMSO) 10.69 (1Н, s, СНО), 8.25-8.18 (1Н, m, Ar), 8.07-8.00 (2Н, m, Ar), 8.00-7.90 (3H, m, Ar) та 7.81-7.64 (3H, m, Ar). b) Процедура Е. (гідроалкілування) для отримання етил 2-(3-(2-(4хлорфенілсульфоніл)бензил)-5-фтор-2-метил-1Н-індол-1-іл)ацетат 14 UA 97957 C2 5 10 15 20 25 30 35 40 45 50 55 Η (300 MHz, CDCI3) 8.33-8.26 (1Н, m, Ar), 7.89-7.82 (2Н, m, Ar), 7.53-7.46 (2Н, m, Ar), 7.447.73 (2Н, m, Ar), 7.06 (1Н, dd, J 8.6 та 4.3Hz, Ar), 7.02-6.96 (1Н, m, Ar), 6.84 (1Н, td, J 9.1 та 2.7Hz, Ar), 6.33 (1Н, dd, J 9.5 та 2.4Hz, Ar), 4.76 (2H, s, NCH2), 4.23 (2H, s, ArCH2Ar), 4.22 (2H, q, J 7.2Hz, CH2CH3), 2.16 (3H, s, CH3) та 1.27 (3H, t, J 7.2Hz, CH2CH3). c) Процедура F. (омилювання) для отримання 2-(3-(2-(4-хлорофенілсульфоніл)бензил)-5фтор-2-метил-1H-індол-1-іл)оцтова кислота Η (300 MHz, d6-DMSO) 13.01 (1Н, bs, СО2Н), 8.27-8.20 (1Н, m, Ar), 7.97-7.90 (2Н, m, Ar), 7.747.67 (2Н, m, Ar), 7.57-7.51 (2Н, m, Ar), 7.34 (1Н, dd, J 8.7 та 4.3Hz, Ar), 7.00-6.93 (1Н, m, Ar), 6.81 (1Н, td, J 9.4 та 2.6Hz, Ar), 6.16 (1Н, dd, J 9.8 та 2.6Hz, Ar), 4.95 (2H, s, NCH2), 4.17 (2H, s, + ArCH2Ar) та 2.12 (3H, s, CH3). Tr=4.04 хв (96%), m/z (M+H) 472.0. Приклад 3 - Приготування 2-(5-фтор-3-(2-(4-фторфенілсульфоніл)бензил)-2-метил-1H-індол1-іл)оцтова кислота (Сполука 3) а) Процедура A. (SNAr) для отримання 2-(4-фторфенілтіо)бензальдегід До суспензії з 4-фторфенілтіол (0.86 мл, 8.06 мкмоль) та K2СО3 (2.50 г, 18.12 мкмоль) у ДМСО (5мл) було додано 2-фторбензальдегід (1.00 г, 8.06 мкмоль) при N2 та суміш знаходилась у розігрітому до 100°С стані протягом 3 годин. Реакція була охолоджена до кімнатної температури та було додано воду (20мл). Суміш було екстраговано з етилацетатом, комбіновані органічні екстракти було обмито насиченим окропом, висушено над MgSO 4 та сконцентровано у вакуумі, після чого було отримано жовту суху речовину (1.20 г, 5.17 мкмоль, 64%). Η (300 MHz, d6-DMSO) 10.23 (1Н, s, СНО), 7.98 (1Н, dd, J 7.3 та 1.7Hz, Ar), 7.63-7.49 (3H, m, Ar), 7.45-7.32 (3H, m, Ar) та 6.88 (1H, d, J 7.7Hz, Ar). b) Процедура В. (захист альдегіда) для отримання (2-(диметоксіметил)феніл)(4фторфеніл)сульфан До суміші продукту альдегіду (крок а) (1.20 г, 5.17 мкмоль) та триметоксиметану (0.62 мл, 0.58 мкмоль) у безводному метанолі (80мл) було додано р-толуолсульфоновy кислотy (0.10 г, 0.58 мкмоль) під N2 та перемішувалась при кімнатній температурі протягом 72 годин. Було додано розчин метилату натрію у метанолі (0.12 мл, 25% sol, 0.58 мкмоль) та усунуто під вакуумом весь розчинювач, з отриманням незабарвленого масла (1,50 г). Подальша рафінація не здійснювалась. Η (300 MHz, CDCI3) 7.64 (1Н, dd, J 7.3 та 2.0Hz, Ar), 7.38-7.30 (2H, m, Ar), 7.29-7.19 (2H, m, Ar), 7.15-7.10 (1H, m, Ar), 7.07-6.99 (2H, m, Ar), 5.72 (1H, s, CH(CH3)2) та 3.37 (6H, s, CH(CH3)2). c) Процедура С. (Окислення) для отримання 1-(диметоксіметил)-2-(4фторфенілсульфоніл)бензол До розчину сульфідного продукту (крок b) (1.50 г) у дихлорметані (40мл) було додано 3хлорпероксібензойнy кислотy (4.60 г, 20.59 мкмоль) порціями протягом 30 хвилин при температурі 0°С. Реакцію було розігріто до кімнатної температури та перемішували протягом 2 годин. Було додано водний розчин піфросульфату натрію (50мл) та продукт було екстраговано дихлорометаном. Комбіновані органічні екстракти було обмито NaOH (50 мл, 1N) та потім насиченим окропом, висушено над MgSO4 та сконцентровано у вакуумі, після чого було отримано жовте масло (1.40 г, 4.52 мкмоль 87% за 2 кроки). Η (300 MHz, CDCI3) 8.11 (1Н, dd, J 8.1 та 1.5Hz, Ar), 7.85 (2Н, dd, J 8.9 та 5.0Hz Ar), 7.76 (1Н, dd, J 7.9 та 1.5Hz, Ar), 7.58 (1H, ddd J 7.8, 7.6 та 1.4Hz, Ar), 7.47 (1H, ddd J 7.8, 7.6 та 1.4Hz, Ar), 7.14-7.05 (2H, m, Ar), 6.12 (1H, s, CH(CH3)2) та 3.12 (6H, s, CH(CH3)2). d) Процедура D. (зняття захиту ацеталю) для отримання 2-(4фторфенілсульфоніл)бензальдегідy До розчину 1-(диметоксіметил)-2-(4-фторфенілсульфоніл)бензол (1.40 г, 4.52 мкмоль) у тетрагідрофурані (20мл) було додано водну сірчану кислоту (20 мл, 2% розчин) та було перемішано при кімнатній температурі протягом 12 годин. Сухий K 2СО3 додавався до припинення виділення газів та перетворення у базовий розчин. Розчин було екстраговано етилацетатом, комбіновані органічні екстракти було обмито насиченим окропом, висушено над MgSO4 та сконцентровано у вакуумі, після чого було отримано жовту суху речовину (0.90 г, 340 мкмоль 75%). Η (300 MHz, CDCI3) 10.85 (1Н, s, СНО), 8.21-8.16 (1Н, m, Ar), 8.08-8.02 (1Н, m, Ar), 7.97-7.90 (2Н, m, Ar), 7.80-7.74 (2Н, m, Ar) та 7.27-7.19 (2Н, m, Ar). e) Процедура Е. (Гідроалкілування) для отримання 2-(5-фтор-3-(2-(4фторфенілсульфоніл)бензол)-2-метил-1Н-індол-1-іл)ацетатy Η (300 MHz, CDCI3) 8.32-8.26 (1Н, m, Ar), 8.00-7.90 (2Н, m, Ar), 7.43-7.37 (2Н, m, Ar), 7.267.17 (2Н, m, Ar), 7.06 (1Н, dd, J 8.8 та 4.3Hz, Ar), 7.00-6.94 (1Н, m, Ar), 6.84 (1Н, td, J 9.1 та 2.6Hz, Ar), 6.32 (1Н, dd, J 9.5 та 2.6Hz, Ar), 4.77 (2Н, s, NCH2), 4.24 (2Н, s, ArCH2Ar), 4.22 (2H, q, J 7.2Hz, CH2CH3), 2.16 (3H, s, CH3) та 1.27 (3H, t, J 7.2Hz, CH2CH3). 15 UA 97957 C2 5 10 15 20 25 30 35 40 f) Процедура F. (Омилювання) для отримання 2-(5-фтор-3-(2-(4фторфенілсульфоніл)бензол)-2-метил-1Н-індол-1-іл)оцтова кислота Η (300 MHz, d6-DMSO) 13.00 (1Н, bs, СО2Н), 8.27-8.20 (1Н, m, Ar), 8.08-8.00 (2Н, m, Ar), 7.607.45 (4Н, m, Ar), 7.35 (1Н, dd, J 8.7 та 4.3Hz, Ar), 6.99-6.93 (1H, m, Ar), 6.83 (1Н, td, J 9.0 та 2.3Hz, Ar), 6.17 (1H, dd, J 9.8 та 2.6Hz, Ar), 4.98 (2H, s, NCH2), 4.18 (2H, s, ArCH2Ar) та2.13 (3H, s, CH3). + Tr=4.60 хв (95%), m/z (M+H) 456.3 Приклад 4 Аналіз зміни вмісту еозинофілів у цільній людській крові. Сполуки 1 та 3 були перевірені на вплив на зміну вмісту еозинофілів індукованих PGD2 та були порівняні з Порівняльним Сполуками А-G. Порівняльна Сполука А являє собою (5-Фтор-2-мелил-3-хінолін-2-ілметил-індол-1-іл)-оцтову кислоту. Порівняльна сполука В являє собою [5-фтор-3-(4-метансульфоніл-бензол)-2-метил-індол-1іл]-оцтовy кислотy. Порівняльна сполука С являє собою 2-{5-Фтор-2-метил-3-[4-(фенілсульфоніл)бензол]-1Ніндол-1-іл} оцтовy кислотy (4-регіоізомер Сполуки 1). Порівняльна сполука D являє собою 2-{3-[4-(4-хлорфенілсульфоніл)бензил]-5-фтор-2-метил1Н-індол-1-іл}оцтовy кислотy (4-регіоізомер Сполуки 2) Порівняльна сполука Ε являє собою 2-{5-Фтор-3-[4-(4-фторфенілсульфоніл)бензил]-2метил-1Н-індол-1-іл}оцтовy кислотy (4-регіоізомер Сполуки 3). Порівняльна сполука F являє собою 2-{5-Фтор-2-метил-3-[3-(фенілсульфоніл)бензол]-1Ніндол-1-іл}оцтовy кислотy (3-регіоізомер Сполуки 1). Порівняльна сполука G являє собою 2-{3-[3-(4-хлорфенілсульфоніл)бензол]-5-фтор-2метил-1Н-індол-1-іл}оцтовy кислотy (3-регіоізомер Сполуки 2). Методика Аналіз зміни вмісту еозинофілів у цільній крові Сполуки (1мл, 200 x кінцева концентрація) були додані безпосередньо у 200л цільної крові, добре перемішані та інкубовані на 15 хвилин, 37°С, 5% СО 2. Після цього, форма клітин була зафіксована шляхом додавання 300л буферного розчину Cytofix (BD Biosciences), згодом розміщена на 15 хвилин на льоді. До фіксованих клітин було додано 10мл лікуючого еритроцити буферного розчину, після чого суміш було інкубовано на 5 хвилин при кімнатній температурі, за чим прослідував процес центрифугування (300 x г на 5 хв.). Супернатант (що містить візовані еритроцити) було видалено та етап лізування було повторено. Лейкоцити були перерозчинені у 250л RPMI/10% FCS (стандарт проточної цитометрії) та зміна форми проаналізована за допомогою FACS (флуоресцентно-активоване сортування клітин). Еозинофіли виділялись на основі їх аутофлуоресценції та на кожному зразку було підраховано по 2000 еозинофілів. Дані були проаналізовані тричі. Результати Результати аналізу зміни вмісту еозинофілів представлено у Таблиці 1. Всі сполуки зв'язувались з CRTH2 за допомогою Кі менш ніж на 0.012Μ. З Таблиці 1 можна побачити, що Сполуки 1 та 3 мають відмінні значення величини ІС 50 (половинна інгібуюча концентрація) у даному аналізі. Порівняльна сполука В має у даному аналізі схожу активність зі Сполуками 1 та 3, проте активність Порівняльної Сполуки А є значно нижчою. Однак, Порівняльні Сполуки С та G, які є пара- та мета- регіоізомерами Сполук 1 та 3, мають порівняно слабшу активність у даному тесті (від 10 до 1000 разів нижчу ніж у Сполук 1 та 3). 45 16 UA 97957 C2 Таблиця 1 Значення величини ІС50 щодо дії піддослідних сполук на зміну форми РGG 2-індукованого еозинофіла на 10 нм Сполука Величина 0.005 0.002 0.006 0.103 0.008 0.273 0.494 0.071 1.50 4.66 1 2 3 А В С D Ε F G 5 10 20 25 30 35 n 3 3 3 4 3 3 1 2 1 1 Приклад 5 - Дослідження фармакокінетики Сполук Загальної Формули (І) після преорального введення пацюкам Експериментальні процедури a) Зважування пацюків Пацюків було зважено на день дозування. b) Приготування дозування Піддослідний матеріал було приготовано суспензію 0.3мг/мл у 1% карбоксіметилцеллюлозі (CMC). c) Режим дозування Трьом групам пацюків (три пацюка у кожній групі) було введено сполуки у наступних дозах: Група No. 1 2 3 15 Цільна кров ІС50 (Μ) SEM (стандартна похибка середнього) 0.003 0.001 0.003 0.009 0.002 0.175 Ν/Α 0.008 Ν/Α Ν/Α Лікування Сполука 1 Сполука 2 Сполука 3 Доза (мг/кг) Шлях 3 орально 3 орально 3 орально d) Шлях введення Дози було введено орально при використанні зондової трубки з незмінним об'ємом дозування 10 мл/кг. e) Збирання проб крові На кожному етапі збирання (прибл. 0,3мл), проби крові брали за допомогою катетерів, що вводились у латеральну хвостову вену перед початком експерименту. Кінцева проба крові (прибл. 2мл) була взята за допомогою пункції серця під ізофлурановою анестезією, після якої тварина була омертвлена шляхом обезкровлення. Проби крові були розміщені у індивідуальних гепаринизуючих контейнерах. Проби крові збирались згідно нижчезазначених часових проміжків після дозування: 15, 30, 60, 120, 240, 360, 480, 720 хвилин та 24 години Після збирання, проби крові були центрифуговані (прибл. 10,000 x г, 2 хв. при 4°С) та плазму збережено як один аліквот приблизно при -20°С до проведення аналізу концентрації лікарської речовини у плазмі шляхом застосування методу рідинної хроматографії. f) Біоаналіз проби Проби плазми було проаналізувано на концентрацію піддослідного матеріалу за допомогою BioDynamics, за використанням методу рідинної хроматографії, розробленого при BioDynamics. Результати Створення фармакокінетичного профілю сполуки є важливим з огляду на визначення частки сполуки, що залишається у тілі, а також часу перебування сполуки у тілі та вплив сполуки на суб'єкта при оральному введенні. Результати дослідження концентрації у крові Сполук 1, 2, 3, А та В представлені у Таблицях 2, 3, 4, 5 та 6 відповідно. 17 UA 97957 C2 5 Оптимальний режим прийому сполуки, розрахованої для орального введення, складає один або два рази на день, так як це зменшує навантаження на організм пацієнта та підвищує рівень піддатливості до лікування. Таким чином, значна перевага надається залишковій концентрації ліків у крові через 12 годин після прийому, що дорівнює якнайменш значенню величини IC 50 для сполуки та переважно значно більша ніж зазначена величина. Та навіть ще більш сприятливий фармакокіфнетичний профіль полягає у забезпеченні залишкової концентрації ліків у крові через 24 години після прийому, що дорівнює якнайменш значенню величини ІС 50 для сполуки та переважно значно більша ніж зазначена величина. Таблиця 2 Концентрація Сполуки 1 у крові (нг/мл) після орального введення щурам при дозуванні 3мг/кг Концентрація у крові (нг/мл) Час (год) 0.25 0.5 1 2 4 6 8 12 24 Чол. 4 1161.2 2681.3 3835.5 4330.9 1890.9 1423.7 1099.9 455.4 68.5 Чол. 5 1496.0 2792.4 3895.3 3454.7 1046.5 547.5 404.7 256.6 10.2 Чол. 6 1678.0 3264.7 4262.9 4051.1 1670.8 1183.1 696.2 412.8 63.5 Середнє 1445.1 2912.8 3997.9 3945.6 1536.1 1051.4 733.6 374.9 47.4 SD (стандартне відхилення) 262.1 309.8 231.4 447.5 438.0 452.7 349.1 104.7 32.3 10 15 Результати, що наведені у Таблиці 2, свідчать, що середня величина Сполуки 1, що залишається у крові, складає 47.4нг/мл. Величина ІС50 Сполуки 1 при аналізі зміни вмісту еозинофілів у цільній крові складає 5нМ (2.2нг/мл), і, таким чином, перевищує приблизно у 21 раз значенняIC50 зміни вмісту еозинофілів у цільній крові через 24 години. З огляду на вищезазначене, результати свідчать про особливу зручність орального прийому пацієнтом Сполуки 1. Таблиця 3 Концентрація Сполуки 1 у крові (нг/мл) після орального введення щурам при дозуванні 3мг/кг Час (год) 0.25 0.5 1 2 4 6 8 12 24 20 25 Чол. 7 1569.4 2612.1 2958.2 2239.9 1128.4 519.6 423.7 144.7 60.5 Чол. 8 1297.7 1770.2 2367.1 2536.9 1319.1 368.3 186.7 28.2 0.0 Чол. 9 1608.1 2276.6 3366.1 2717.6 1666.5 1032.6 740.4 128.1 0.0 Середнє 1491.7 2219.6 2897.1 2498.1 1371.3 640.2 450.3 100.3 ND SD (стандартне відхилення) 169.1 423.8 502.3 241.2 272.8 348.2 277.8 63.0 0.0 Результати, що наведені у Таблиці 3, свідчать, що середня величина Сполуки 2, що залишається у крові, складає 100.3нг/мл. Результати через 24 години виявились менш послідовними та середнє значення не було визначене на даному етапі. Значення величини ІС 50 Сполуки 2 при аналізі зміни вмісту еозинофілів у цільній крові складає 2нМ (0.9нг/мл), і, таким чином, перевищує приблизно у 111 разів значення ІС50 зміни вмісту еозинофілів у цільній крові через 12 годин. З огляду на вищезазначене, результати свідчать про особливу зручність орального прийому пацієнтом Сполуки 2, хоча профіль є не таким сприятливим як профіль Сполуки 1. 18 UA 97957 C2 Таблиця 4 Концентрація Сполуки 3 у крові (нг/мл) після орального введення щурам при дозуванні 3мг/кг Час (год) 0.25 0.5 1 2 4 6 8 12 24 5 10 Чол. 13 835.8 2056.6 2487.6 4320.6 3132.0 1333.7 1163.7 465.3 38.2 Чол. 14 1130.7 2205.2 3547.8 3685.1 2023.1 995.0 699.5 163.3 0.0 Чол. 15 1337.2 2487.5 3393.7 4221.0 2053.8 1098.0 678.5 201.1 10.1 Середнє 1101.2 2249.8 3143.0 4075.6 2403.0 1142.2 847.2 276.6 16.1 SD (стандартне відхилення) 252.0 218.9 572.8 341.8 631.5 173.6 274.3 164.5 19.8 Результати, що наведені у Таблиці 4, свідчать, що середня кількість Сполуки 3, що залишається у крові, складає 16.1нг/мл через 24 години. Величина ІС 50 Сполуки 1 при аналізі зміни вмісту еозинофілів у цільній крові складає 6нМ (2.7нг/мл), і, таким чином, перевищує приблизно у 6 разів значення ІС50 зміни вмісту еозинофілів у цільній крові через 24 години. З огляду на вищезазначене, результати свідчать про особливу зручність орального прийому пацієнтом Сполуки 3. Результати, що наведені у Таблиці 5, свідчать, що середня величина Сполуки (А), що залишається у крові, складає 43.7нг/мл через 24 години. Значення величини ІС 50 Сполуки 1 при аналізі зміни вмісту еозинофілів у цільній крові складає 103нМ (35.8нг/мл), і, таким чином, перевищує приблизно у 1.2 рази значення ІС50 зміни вмісту еозинофілів у цільній крові через 24 години. Таблиця 5 Концентрація Сполуки (А) у крові (нг/мл) після орального введення щурам при дозуванні 3мг/кг Час (год) Чол. 13 Чол. 14 Чол. 15 Середнє 0.25 0.5 1 2 4 6 8 24 139.1 425.6 875.2 1415.1 923.1 404.3 305.6 51.8 153.9 388.4 923.2 1309.0 820.5 514.8 521.9 79.2 68.3 256.3 538.8 1013.6 827.0 432.6 235.5 0.0 120.4 356.8 779.1 1245.9 856.9 450.6 354.3 43.7 Stdev (стандартне відхилення) 45.8 89.0 209.5 208.1 57.5 57.4 149.3 40.2 15 Таблиця 6 Концентрація Сполуки (В) у крові (нг/мл) після орального введення щурам при дозуванні 3мг/кг Час (год) Чол. 31 Чол. 32 Чол. 33 Середнє 0.25 0.5 1 2 4 6 8 12 24 91.8 121.2 252.1 349.9 179.4 128.3 72.1 36.5 0 113.6 165.7 295.1 536.9 485.2 292.2 184.5 31.0 0 57.3 132.1 217.5 256.2 184.9 125.8 84.7 14.5 0 87.6 139.7 254.9 381.0 283.2 182.1 113.8 27.3 0 19 Stdev (стандартне відхилення) 28.4 23.2 38.9 142.9 175.0 95.4 61.6 11.4 0 UA 97957 C2 5 10 15 Результати, що наведені у Таблиці 6, свідчать, що середня величина Сполуки В, що залишається у крові, складає 27.3нг/мл через 12 годин. Значення величини ІС 50 Сполуки В при аналізі зміни вмісту еозинофілів у цільній крові складає 8нМ (3.0нг/мл), і, таким чином, перевищує приблизно у 9.1 разів значення ІС50 зміни вмісту еозинофілів у цільній крові через 12 годин. Малюнки 1-5 являють ділянки концентрації крові порівняно з часом по відношенню до пацюків, яким було орально введено Сполуки 1, 2, 3, А та В відповідно у пропорції 3мг/кг. Таким чином, вони представляють собою графічну репрезентацію даних, наведених у Таблицях 2-6. Значення Сmах (максимальна концентрація у крові), Т mах (час досягнення максимальної концентрації Сmах) та Т1/2 (напіврозпад) на Малюнках 1-5 представлені у Таблицях 7-11 по відношенню до Сполук 1, 2, 3, А та В відповідно. Значення Сmах та AUCinf (середня концентрація у сечі) представляють вплив на суб'єкта орально введеної дози сполуки. Таким чином, бажаним є досягнення якнайбільших показників згаданих значень Сmах та AUCinf для максимізації впливу сполуки. Таблиця 7 Фармакокінетичні параметри 3мг/кг Сполуки 1 (орально) Параметр Сmах Тmах AUCinf Т1/2 Одиниці нг/мл години нг/мл*год. години Чол. 4 4331 2 23809 4.11 Чол. 5 3895 1 14846 3.07 Чол. 6 4263 1 21731 4.59 Сер. 4163 1.3 19328 3.6 Таблиця 8 Фармакокінетичні параметри 3мг/кг Сполуки 2 (орально) Параметр Сmах Тmах AUCinf Т1/2 Одиниці нг/мл години нг/мл*год. години Чол. 7 2958.0 1.0 13153 6 Чол. 8 2537.0 2.0 10179 2 Чол. 9 3366.0 1.0 15677 2 Сер. 2954 1.3 11666 3.7 Таблиця 9 Фармакокінетичні параметри 3мг/кг Сполуки 2 (орально) Параметр Сmах Тmах AUCinf Т1/2 Одиниці нг/мл години нг/мл*год. години Чол. 13 4321 2 24379 3.26 Чол. 14 3685 2 17738 2.26 Чол.15 4221 2 19110 2.62 Сер. 4076 2.0 21059 2.8 Таблиця 10 Фармакокінетичні параметри 3мг/кг Сполуки (А) (орально) Параметр Сmах Тmах AUCinf Т1/2 Одиниці нг/мл години нг/мл*год. години Чол. 4 1415.1 2.0 8570.4 6.1 Чол. 5 1309.0 2.0 10429.2 6.1 20 20 Чол. 6 1013.6 2.0 5473.9 2.2 Сер. 1245.9 2.0 8157.8 4.8 UA 97957 C2 Таблиця 11 Фармакокінетичні параметри 3мг/кг Сполуки (А) (орально) Параметр Сmах Тmах AUCinf Т1/2 5 10 15 Одиниці нг/мл години нг/мл*год. години Чол. 4 349.9 2.0 1831.4 3.41 Чол. 5 536.9 2.0 3256.1 1.80 Чол. 6 256.2 2.0 1505.1 1.86 Сер. 381.0 2.0 2197.6 2.4 Щодо даних Таблиць 7-11, можна побачити, що Сполуки 1, 2 та 3 мають середнє значення величин Сmах - 4163, 2954 та 4076 відповідно. У порівнянні, середні величини для Сполук А та В складають лише 1245.9 та 381.0. Значення величин AUCinf Сполук 1,2 дорівнюють 19238, 11666 та 21059, при чому значення величин Сполук А та В складають 8157.8 та 2197.6. Таким чином, значення величин Сmах та AUCinf сполук даного винаходу є істотно вищими за значення відповідних величин Порівняльних Сполук А та В. Результати засвідчують, що суб'єкти, яким орально вводились сполуки А та В, значно менше відчувають дію ліків ніж суб'єкти, що отримували дозування Сполуками 1, 2 та 3. Результати з Прикладів 4 та 5 узагальнюються у Таблиці 12, де кратне перевищення значення величини ІС50 через 12 годин визначається як середній вміст сполуки у крові через 12 годин, що вимірюється у нг/мл, та розділений на значення величини ІС 50 сполуки, що вимірюється у нг/мл. Подібним чином, кратне перевищення значення величини ІС 50 через 24 години визначається як середній вміст сполуки у крові через 24 години, що вимірюється у нг/мл, та розділений на значення величини ІС50 сполуки, що вимірюється у нг/мл. Таблиця 12 Сполука ІС50 (моль) ІС50 (нг/мл) Кратне перевищення ІС50 через 12 годин Кратне перевищення ІС50 через 12 годин Сmах AUCinf 20 25 30 35 40 1 0.005 2.2 170 21 4163 19328 2 0.002 0.9 111 ND 2954 11666 3 0.006 2.7 102 6 4076 21059 А 0.103 35.8 ND 1.2 1246 8158 в 0.008 3.0 9.1 0 381 2198 Результати, що наведені у Таблиці 12, свідчать, що Порівняльна Сполука А має вище значення величини ІС50 ніж Сполуки 1, 2 та 3 та нижче значення кратності перевищення значення величини ІС50 через 24 години ніжу Сполук 1 та 3. Вплив ліків на суб'єкта після орального введення, що позначаються Сmах та AUCinf є значно слабшим по відношенню до Сполуки В у порівнянні зі Сполуками 1-3. Сполука В має порівнянні за Сполуками 1, 2, 3 значення величини IC 50. Однак, кратне перевищення ІС50 через 12 годин та через 24 години є значно менш сприятливим ніж відповідні значення Сполук 1, 2 та 3, а також вплив ліків на суб'єкта після орального введення, що характеризується Cmax та AUCinf, є значно нижчим у Сполуки В ніж у будь-якої зі Сполук 1-3. Кожна з Порівняльних Сполук А та В має порівнянні властивості зі Сполуками 1, 2 та 3. Однак, у загальному аспекті, їх властивості є менш сприятливими за властивості сполук винаходу. Приклад 6 - Оцінка Сполук Загальної Формули (І) як Інгібіторів 13,14-дигідро-15-кето простагландин D2 (DK-PGD2)- індукована еозинофілія крові у пацюків Протокол Піддослідну суміш було розчинено у ДМСО та розбавлено водою для отримання кінцевого об'єму дозування, що складає 2мл/кг. Пацюкам жіночої статі (175-250г; UH колонія) було введено дозування піддослідної сполуки (або наповнювача). Через 30 хвилин після дозування, всі тварини були анестезовані ізофлураном. Після введення анестезії, тваринам було зроблено внутрішньо серцеву ін'єкцію 10г DK-PGD2 у 0.3мл 21 UA 97957 C2 5 10 15 20 25 30 35 гепаринізованого (10U/мл) натрію хлориду. Підконтрольні тварини отримали ін'єкцію 0.3мл гепаринізованого натрію хлориду. Через 60 хвилин після внутрішньосерцевої ін'єкції, тваринам було ін'єктовано смертельну дозу пентобарбітал натрію та, за допомогою пункції серця, було взято (у гепарин) пробу крові, коли пацюк знаходився під дією анестезії (проте ще не мертвим). Аліквот крові (100л) було додано у розчин Тюрка та загальна лейкоцитна формула була визначена за допомогою рахункової камери. Слідуючий аліквот крові (500л) було змішано з аналогічним об'ємом 4% Декстрину (молек. вага 500,000) та було створено умови для осідання еритроцитів. З утвореної фракції лейкоцитів за допомогою цитоцентрифуги було приготовано препарат. Цитоцентрифужні препарати були зафіксовані метанолом (5хв.) та забарвлені фарбами May-Grunwald (5хв) та Giemsa (15 хв). На завершення, цитоцентрифужні препарати промивали у фосфатному буфері (рН6.8) та висушували повітрям. З цитоцентрифужних препаратів були отримані лейкоцитарні формули. Вміст еозинофілів у крові визначався на основі загальної лейкоцитарної формули та процентного вмісту еозинофілів (визначення лейкоцитарної формули). Схема експерименту У кожному експерименті було задіяно до 12 тварин. Було включено групи: Інтактні контролі DK-PGD2- індукована еозинофілія, лікування тварин нейтральним носієм (позитивний контроль) DK-PGD2- індукована еозинофілія, Сполука 1; дозування 0.0001, 0.001, 0.01 та 0.1г/кг (орально). DK-PGD2- індукована еозинофілія, Сполука 2; дозування 0.001, 0.01, 0.1 та 1.0г/кг (орально). DK-PGD2- індукована еозинофілія, Сполука 3; дозування 0.001, 0.01, 0.1 та 1.0г/кг (орально). DK-PGD2- індукована еозинофілія, Сполука А; дозування 0.01, 0.1 та 1.0мг/кг (орально). DK-PGD2- індукована еозинофілія, Сполука А; дозування 0.001, 0.01, 0.1 та 1.0мг/кг (орально). З огляду на неможливість отримання достатньої кількості даних у кожному представленому експерименті, дані були отримані за допомогою додаткових експериментів. Дані зазначених додаткових експериментів було об'єднано, на основі показників щонайменш п'яти тварин з кожної групи, та створено криву дозової залежності, після чого було проведено перевірку на критерії значущості (Mann Whitney) для визначення того, чи дійсно DK-PGD2 суттєве збільшення концентрації еозинофілів у крові (GraphPad, Prism). Різниця між групами була істотною при Р
ДивитисяДодаткова інформація
Назва патенту англійською2-{5-fluoro-2-methyl-3-[2-(phenylsulfonyl)benzyl]-1h-indol-1-yl}acetic acid and derivatives thereof, use thereof for the treatment of diseases mediated by pgd2 action at the crth2 receptor
Автори англійськоюArmer Richard Edward, Armer, Richard, Edward, Wynne Graham Michael
Назва патенту російською2-{5-фтор-2-метил-3-[2-(фенилсульфонил)бензил]-1н-индол-1-ил}уксусная кислота и ее производные, их применение для лечения заболеваний, опосредствованных действием pgd2 на рецептор crth2
Автори російськоюАрмер Ричард Эдвард, Вайн Грахам Михаэль
МПК / Мітки
МПК: C07D 209/10, A61K 31/405
Мітки: застосування, лікування, кислота, похідні, crth2, захворювань, дією, опосередковуються, рецептор, 2-{5-фтор-2-метил-3-[2-(фенілсульфоніл)бензил]-1н-індол-1-іл}оцтова
Код посилання
<a href="https://ua.patents.su/32-97957-2-5-ftor-2-metil-3-2-fenilsulfonilbenzil-1n-indol-1-iloctova-kislota-ta-pokhidni-kh-zastosuvannya-dlya-likuvannya-zakhvoryuvan-shho-oposeredkovuyutsya-diehyu-pgd2-na-receptor-crth2.html" target="_blank" rel="follow" title="База патентів України">2-{5-фтор-2-метил-3-[2-(фенілсульфоніл)бензил]-1н-індол-1-іл}оцтова кислота та її похідні, їх застосування для лікування захворювань, що опосередковуються дією pgd2 на рецептор crth2</a>
Наступний патент: Спосіб виробництва кондитерських виробів з попкорну і пристрій для здійснення способу
Випадковий патент: Фрикційний амортизатор