Пептидні інгібітори шляху трансдукції сигналу jnk, що мають здатність проникати в клітину
Формула / Реферат
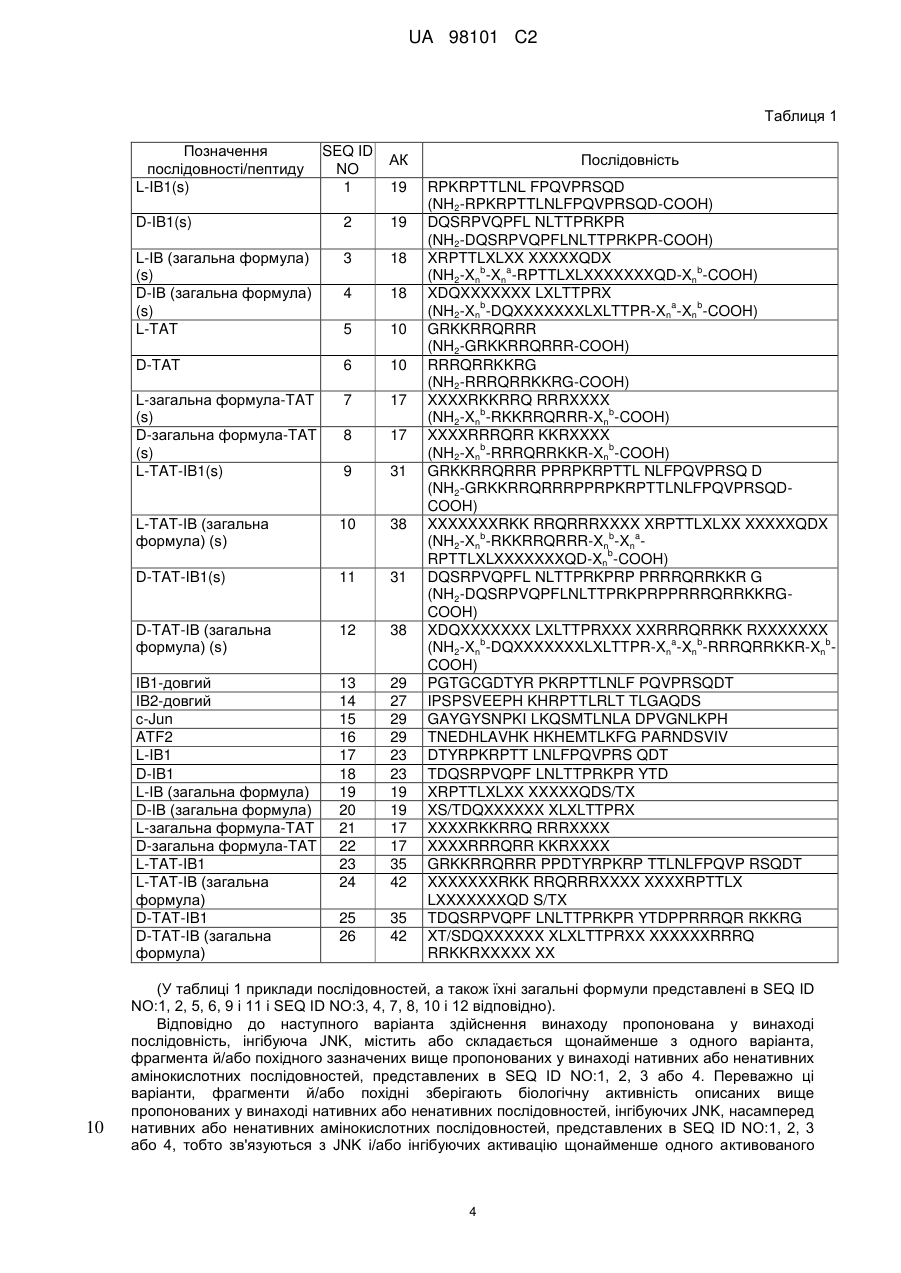
1. Послідовність, інгібуюча JNK, що містить менше 150 амінокислот, де послідовність-інгібітор містить або складається щонайменше з однієї амінокислотної послідовності, представленої в SEQ ID NO: 2 або 4, де послідовність, інгібуюча JNK, не містить послідовностей SEQ ID NO: 18, 20, 25 або 26.
2. Послідовність, інгібуюча JNK, за п. 1, де послідовність, інгібуюча JNK, містить від 5 до 150 амінокислотних залишків, більш переважно від 10 до 100 амінокислотних залишків, ще більш переважно від 10 до 75 амінокислотних залишків і найбільш переважно від 15 до 50 амінокислотних залишків.
3. Послідовність, інгібуюча JNK, за одним з пп. 1, 2, де послідовність, інгібуюча JNK, зв'язується з амінокінцевою кіназою c-Jun (JNK).
4. Послідовність, інгібуюча JNK, за одним з пп. 1-3, де послідовність, інгібуюча JNK, інгібує активацію щонайменше одного фактора транскрипції, який є мішенню для JNK, коли послідовність, інгібуюча JNK, є присутньою в експресуючій JNK клітині.
5. Послідовність, інгібуюча JNK, за одним з пп. 1-4, де фактор транскрипції, що є мішенню для JNK, вибирають із групи, що включає c-Jun, ATF2 або Elkl.
6. Послідовність, інгібуюча JNK, за одним з пп. 1-5, де послідовність, інгібуюча JNK, змінює дію JNK, коли пептид присутній у клітині, експресуючій JNK.
7. Химерний пептид, що містить щонайменше один перший домен і щонайменше один другий домен, які зв'язані ковалентним зв'язком, де перший домен містить транспортуючу послідовність, а другий домен містить послідовність, інгібуючу JNK, відповідно до будь-якого з пунктів 1-6.
8. Пептид за п. 7, у якому транспортуюча послідовність містить амінокислотну послідовність поліпептиду ТАТ вірусу імунодефіциту людини.
9. Пептид за одним з пп. 7, 8, у якому транспортуюча послідовність містить амінокислотну послідовність, представлену в SEQ ID NO: 5, 6, 7 або 8.
10. Пептид за одним з пп. 7-9, у якому транспортуючі послідовності підсилюють поглинання пептиду клітиною.
11. Пептид за одним з пп. 7-9, де транспортуюча послідовність забезпечує ядерну локалізацію пептиду.
12. Пептид за одним з пп. 7-11, у якому послідовність, інгібуюча JNK, містить амінокислотну послідовність, представлену в будь-якій з SEQ ID NO: 11 або 12.
13. Пептид за п. 12, де пептид містить амінокислотну послідовність, представлену в SEQ ID NO: 11.
14. Антитіло, що імуноспецифічно зв'язується з послідовністю, інгібуючою JNK, за одним з пп. 1-6, або з химерним пептидом за одним з пп. 7-13.
15. Фармацевтична композиція, що містить послідовність, інгібуючу JNK, за одним з пп. 1-6 або химерний пептид за одним з пп. 7-13 і фармацевтично прийнятний носій.
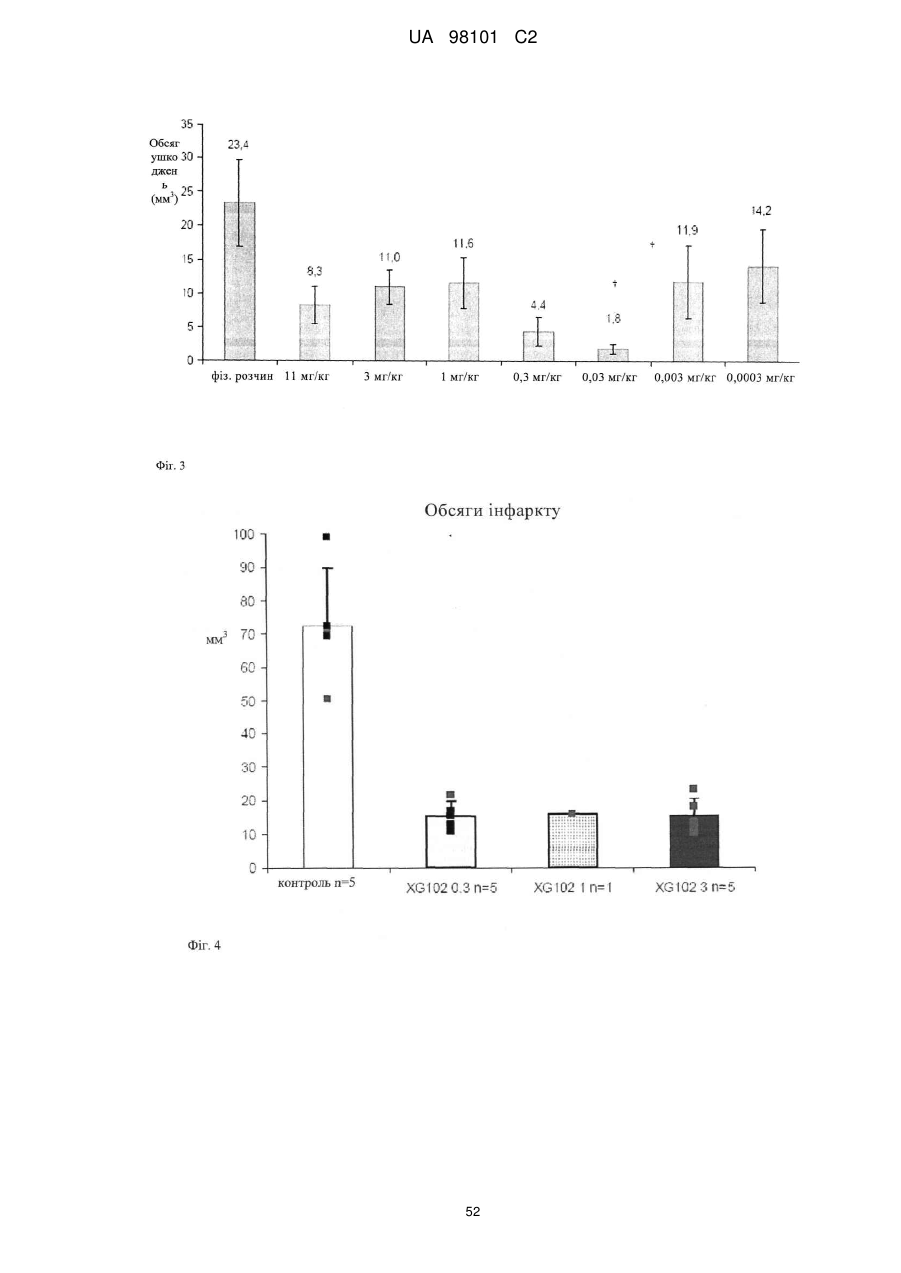
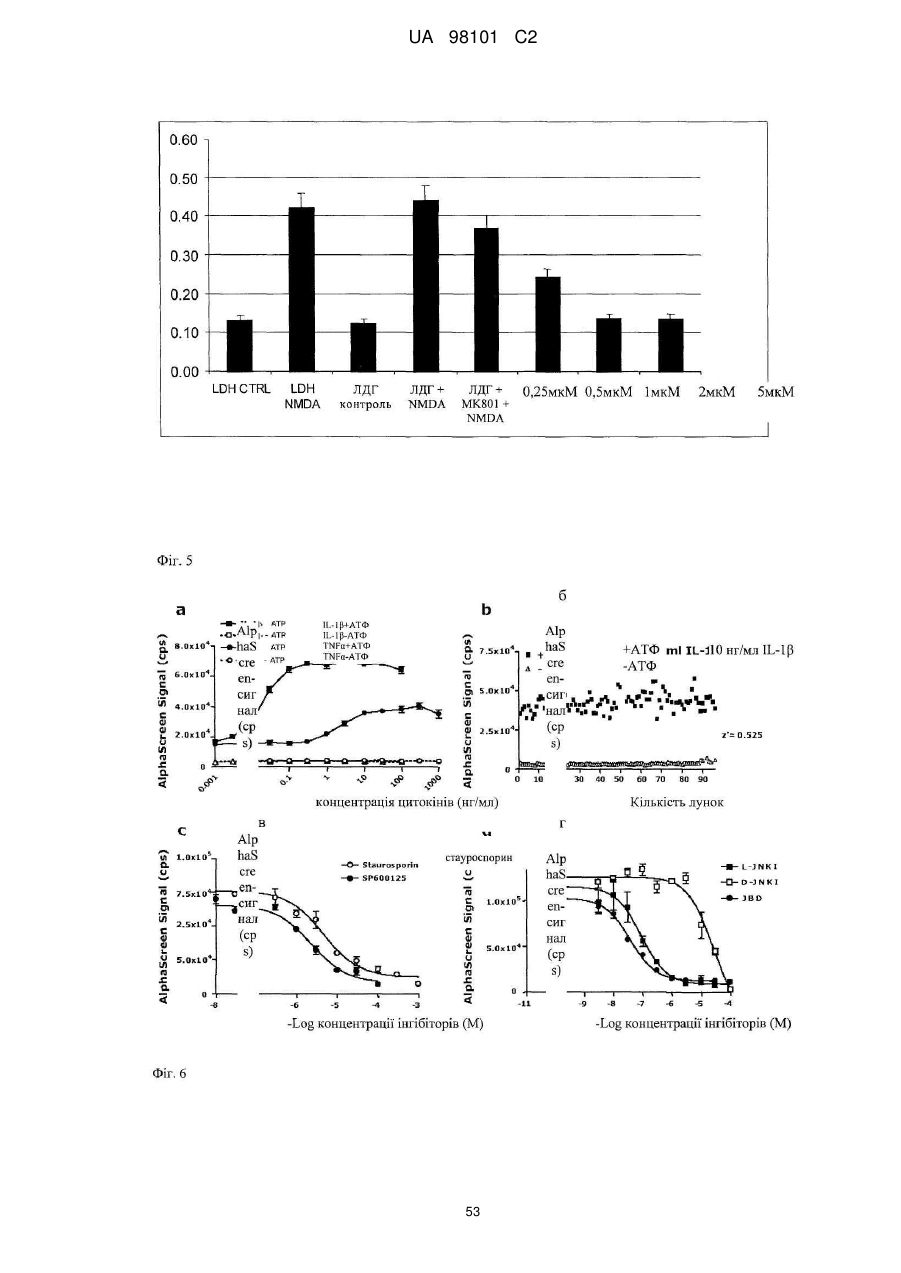
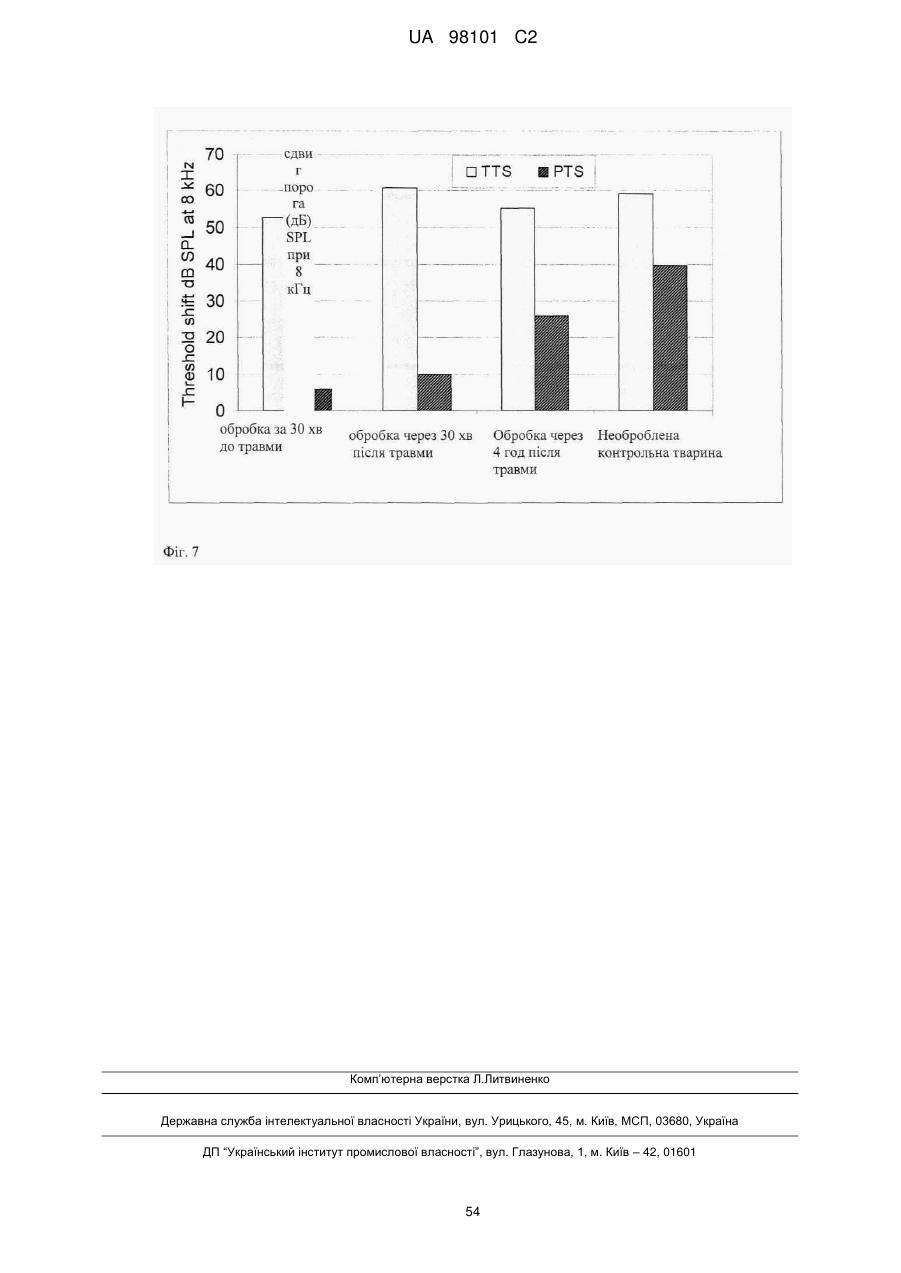
16. Застосування послідовності, інгібуючої JNK, за одним з пп. 1-6 або химерного пептиду за одним з пп. 9-13 для приготування фармацевтичної композиції, призначеної для лікування патофізіологічного стану, вибраного із групи, що включає злоякісні захворювання легені, молочної залози, лімфатичної системи, шлунково-кишкового тракту й сечостатевого шляху, а також аденокарциноми, включаючи злоякісні, такі як різні типи раку ободової кишки, нирково-клітинна карцинома, рак передміхурової залози, недрібноклітинний рак легені, рак тонкого кишечнику й рак стравоходу, а також лейкози, види раку, пов'язані з онкогенною трансформацією Bcr-Abl, псоріаз, звичайну пухирчатку, синдром Бехчета, гострий респіраторний дистрес-синдром (ARDS), ішемічне захворювання серця, синдром, пов'язаний зі станом після діалізу, ревматоїдний артрит, синдром набутого імунодефіциту, васкуліт, септичний шок, рестеноз, втрату слуху, вушну травму, ішемію, шок, ушкодження, пов'язані з реперфузією, гіпоксію, вторинні ефекти, пов'язані з лікуванням прозапальними цитокінами, діабет, серцеву гіпертрофію й зв'язані з артеріосклерозом ушкодження, патологічні стани, індуковані іонізуючою радіацією, застосовуваної при променевій терапії, ультрафіолетовим світлом (Уф-світло), патологічні стани, індуковані агентами, що ушкоджують ДНК, включаючи хіміотерапевтичні лікарські засоби, гіпо- і гіпертермію, або запальні, аутогенні запальні, імунні і аутоімунні захворювання, дегенеративні захворювання, міопатії, кардіоміопатії і відторгнення трансплантата.
17. Застосування за п. 16, у якому фармацевтичну композицію варто застосовувати шляхом введення, вибраного із групи, що включає внутрішньочеревинне, назальне, внутрішньовенне, пероральне введення й введення за допомогою бляшки.
18. Набір, що містить послідовність, інгібуючу JNK, за одним з пп. 1-6 і/або химерний пептид за одним з пп. 7-13, і/або антитіло за п. 14.
Текст
Реферат: Винахід належить до інгібіторів протеїнкінази, більш конкретно до інгібітору протеїнкінази амінокінцевої кінази c-Jun, до послідовностей інгібіторів JNK, химерних пептидів, нуклеїнових UA 98101 C2 (12) UA 98101 C2 кислот, що кодують їх, а також до фармацевтичних композицій, призначених для лікування патофізіологічних станів, асоційованих з передачею сигналу JNK. UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до інгібіторів протеїнкіназ і більш конкретно до інгібіторів протеінкінази, що представляє собою амінокінцеву кіназу c-Jun. Крім того, даний винахід відноситься до послідовностей інгібіторів JNK, химерним пептидам, нуклеїновим кислотам, що кодують їх, а також фармацевтичним композиціям, призначеним для лікування патофізіологічних станів, асоційованих з передачею сигналу JNK. Амінокінцева кіназа c-Jun (JNK) є представником групи активуємих стресом активуємих мітогеном протеїн- (MAP)-кіназ. Ці кінази беруть участь у контролі росту і диференціюванні клітин, і в більше загальному плані у відповіді клітин на стимули навколишнього середовища. Шлях трансдукції сигналу JNK активується у відповідь на пов'язаний з навколишнім середовищем стрес і при участі декількох класів рецепторів на клітинній поверхні. Ці рецептори можуть являти собою рецептори цитокінів, рецептори серпентину і рецептори тирозинкіназ. У клітинах ссавців JNK бере участь у біологічних процесах, таких як онкогенна трансформація і опосередуючі адаптивні відповіді на пов'язаний з навколишнім середовищем стрес. JNK асоційована з імунними відповідями, що модулюють, включаючи дозрівання й дифференіювання імунних клітин, а також участь у запрограмованій загибелі клітин, виявлених імунною системою як мішені для руйнування. Ця унікальна властивість робить передачу сигналу JNK перспективною мішенню при розробці засобів, призначених для фармакологічного втручання. З передачею сигналу JNK зв'язані деякі неврологічні порушення, насамперед ішемічний удар і хвороба Паркінсона. Одним із шляхів боротьби з порушеннями, у значній мірі пов'язаними з передачею сигналу JNK, є створення інгібіторів шляхів передачі сигналу JNK. До таких інгібіторів, уже відомим у даній області, відносяться, насамперед, наприклад, інгібітори, що перебувають перед кіназою у шляху передачі сигналу (наприклад, CEP-1347), низькомолекулярні хімічні інгібітори JNK (SP600125 і AS601245), які безпосередньо впливають на кіназну активність, наприклад, у результаті конкуренції із АТФ-зв'язуючим доменом протеїнкінази, і пептидні інгібітори взаємодії між JNK і її субстратами (D-JNKI і I-JIP) (див., наприклад, Kuan і ін., Current Drug Targets - CNS & Neurological Disorders, т. 4, № 1, лютий 2005 р., сс. 63-67, (5)). Інгібітор CEP-1347 (KT7515), що перебуває перед кіназою у шляху передачі сигналу, являє собою напівсинтетичний інгібітор сімейства кіназ змішаної лінії диференціювання. CEP-1347 (KT7515) підсилює виживання нейронів у дозах, які інгібують активацію амінокінцевих кіназ cJun (JNK) у первинних ембріональних культурах і диференційованих PC12-клітинах після видалення з живильного середовища й з у мишей, оброблених 1-метил-4фенілтетрагідропіридином (МФТП). Крім того, CEP-1347 (KT7515) може збільшувати тривалість виживання культивованих курячих ембріональних гангліїв заднього корінця спинного мозку, симпатичних, циліарних і моторних нейронів (див., наприклад, Borasio і ін., Neuroreport. 9(7), 11 травня 1998 р., сс. 1435-1439). Встановлено, що низькомолекулярний хімічний інгібітор SP600125 знижує рівні фосфорилювання c-Jun, захищає допамінергічні нейрони від апоптоза й частково відновлює рівень допаміну при індукованої МФТП хворобі Паркінсона (БП) у мишей лінії C57BL/6N (Wang і ін., Neurosci Res., 48(2); лютий 2004 р., сс 195-202). Ці результати свідчать також про те, що шлях JNK являє собою основний медіатор нейротоксичної дії МФТП in vivo, і інгібування JNK може стати новою й ефективною стратегією лікування БП. Іншим прикладом низькомолекулярних хімічних інгібіторів є вищевказаний інгібітор JNK AS601245. AS601245 інгібує шлях передачі сигналу JNK і збільшує виживання клітин після церебральної ішемії. In vivo AS601245 забезпечує виражена захисна дія відносно відкладеної втрати CA1-нейронів гіпокампа на моделі короткочасної загальної ішемії в піщанок. Це дія опосередкована інгібуванням JNK і, як наслідок, експресією й фосфорилюванням c-Jun (див., наприклад, Carboni і ін., J Pharmacol Exp Ther., 310(1), липень 2004 р., сс. 25-32, Epub 26 лютого 2004 р.). До третього класу інгібіторів шляху передачі сигналу JNK відносяться зазначені вище пептидні інгібітори взаємодії між JNK і її субстратами. Як відправна крапка для конструювання таких пептидних інгібіторів JNK можна використати порівняльних аналіз первинної структури білків, що зустрічаються в природних умовах, JNK. Як правило, такі білки містять JNK-єднальні домени (JBD) і зустрічаються в різних інсулінзв’язуючих (IB) білках, таких як IB1 або IB2. Прикладом такого порівняльного аналізу первинної структури послідовностей є, наприклад, порівняльний аналіз первинної структури послідовностей JNK-єднальних доменів IB1 [SEQ ID NO:13], IB2 [SEQ ID NO: 14], c-Jun [SEQ ID NO:15] і ATF2 [SEQ ID NO:16] (див., наприклад, фіг. 1A-1В). Такий порівняльний аналіз первинної структури послідовностей виявив частково консервативну послідовність, що складається з 8 амінокислот (див., наприклад, фіг. 1A). Порівняння JBD, що зустрічаються в IB1 і IB2, додатково підтвердило наявність двох 1 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 висококонсервативних для двох послідовностей блоків, що складаються з 7 і 3 амінокислот. Послідовності, сконструйовані на основі такого порівняльного аналізу первинної структури, описані, наприклад, в WO 01/27268. Зокрема, в WO 01/27268 описані низькомолекулярні злиті пептиди, що проникають у клітину, які містять так звану відповідальну за забезпечення проникнення в клітини послідовність TAT, що одержують із оснóвной здатністю, що володіє, забезпечувати перенос послідовності білка ВІЛ-TAT і що складає як мінімум з 20 амінокислот інгібуючої послідовності IB1. Обидва компоненти ковалентно зв'язують один з одним. Приклади (у цей час єдині) інгібіторів шляху передачі сигналу MAPK–JNK наведені в WO 01/27268, і вони являють собою, наприклад, L-JNKI1 (JNK - пептид-інгібітор, що складається з L-амінокислот) або стійкі до протеаз D-JNKI1-пептиди (JNK - пептид-інгібітор, що складається з ненативних Dамінокислот). Ці пептиди-інгібітори JNK (JNKI) є специфічними для JNK (JNK1, JNK2 і JNK3). На відміну від зазначених низькомолекулярних інгібіторів інгібуючі послідовності, описані в WO 01/27268, наприклад, JNKI1, більш імовірно, інгібують взаємозв'язок між JNK і її субстратом. За допомогою його послідовності, що забезпечує перенос, виведеної з TAT, злитий пептид ефективно транспортується в клітину. Завдяки новим властивостям, отриманим за допомогою переносу, що забезпечує, компонента, злиті білки активно транспортуються в клітину, де вони зберігають ефективність аж до протеолітичного розщеплення. Однак, пептиди, описані в WO 01/27268, ще легко доступні для фосфорилаз (кіназ). Будьяка амінокислота пептиду служить мішенню для кіназ і, отже, може піддаватися фосфорилюванню, що являє собою важливий фактора інактивації таких пептидів. Таким чином, першим об'єктом даного винаходу є нові інгібуючі послідовності шляху передачі сигналу JNK, які зберігають функціональні властивості пептидів, описаних в WO 01/27268, але мають підвищену стабільність у відношенні фосфорилаз (кіназ). Крім того, для одержання інгібуючих послідовностей, описаних в WO 01/27268, потрібні дорога стадія виділення й очищення, особливо при одержанні у великих масштабах (наприклад, при промисловому одержанні). Таким чином, другим об'єктом даного винаходу є інгібуючі послідовності, які можна одержувати за допомогою більше простого й ефективного з позицій вартості процесу одержання й виділення в порівнянні з відомим до теперішнього часу в даній галузі. Ці завдання вирішуються за допомогою послідовності, інгібуючої JNK, що складається менш чим з 150 амінокислот, де інгібуюча JNK послідовність містить або складається щонайменше з однієї амінокислотної послідовності, представленої в SEQ ID NO:1, 2, 3 або 4, або її варіанта, фрагмента або похідного. Переважно пропонована у винаході послідовність, інгібуюча JNK, зв'язується з JNK і/або інгібує активацію щонайменше одного активованого JNK фактора транскрипції, наприклад, cJun або ATF2 (див., наприклад, SEQ ID NO:15 і 16 відповідно), або Elk1. Як правило, пропоновані в даному винаході послідовності, інгібуючі JNK, містять у цілому менш 150 амінокислотних залишків, переважно від 5 до 150 амінокислотних залишків, більш переважно від 10 до 100 амінокислотних залишків, ще більш переважно від 10 до 75 амінокислотних залишків і найбільше переважно від 15 до 50 амінокислотних залишків. Пропонована у винаході послідовність, інгібуюча JNK, переважно містить або складається щонайменше з однієї амінокислотної послідовності, представленої в SEQ ID NO:1, 2, 3 або 4, або її варіанта, фрагмента або похідного. Болееe переважно пропонована у винаході послідовність, інгібуюча JNK, може містити 1, 2, 3, 4 або навіть більшу кількість копій амінокислотної послідовності, представленої в SEQ ID NO:1, 2, 3 або 4, або її варіанта, фрагмента або похідного. При наявності більше однієї копії пропоновані у винаході амінокислотні послідовності, представлені в SEQ ID NO:1, 2, 3 або 4, або їхні варіанти, фрагменти або похідні можна безпосередньо зв'язувати один з одним без якої-небудь лінкерної послідовності або за допомогою лінкерної послідовності, що містить 1 - 10, переважно 1 - 5 амінокислот. Амінокислоти, з яких складається лінкерна послідовність, переважно вибирають із амінокислотних залишків гліцину або проліну. Більш переважно зазначені пропоновані у винаході амінокислотні послідовності, представлені в SEQ ID NO: 1, 2, 3 або 4, або її варіанти, фрагменти або похідні можна відокремлювати один від одного за допомогою шарніра, що складається з 2, 3 або більшої кількості залишків проліну. Пропоновані у винаході послідовності, інгібуючі JNK, як вони визначені вище, можуть складатися з L-амінокислот, D-амінокислот або їхньої комбінації. Переважно пропоновані у винаході послідовності, інгібуючі JNK, містять щонайменше 1, переважно щонайменше 3, більш переважно щонайменше 6, і ще більш переважно щонайменше 10 D- і/або L-амінокислот, де Dі/або L-амінокислоти можуть входити до складу пропонованих у винаході послідовностей, інгібуючих JNK, у вигляді блоку, не у вигляді блоку або у вигляді іншої структури. 2 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 Відповідно до одного із кращих варіантів здійснення винаходу пропоновані у винаході послідовності, інгібуючі JNK, можуть складатися тільки з L-амінокислот. Пропоновані у винаході послідовності, інгібуючі JNK, можуть також містити або складатися щонайменше з однієї «нативної послідовності, інгібуючої JNK», що представлена в SEQ ID NO:1 або 3. У цьому контексті поняття «нативна або «нативна(і) послідовність(і), інгібуюча(і) JNK» відноситься до незмінених пропонованих у винаході послідовностей, інгібуючих JNK, представлених у кожній з SEQ ID NO:1 або 3, які повністю складаються з L-амінокислот. Таким чином, пропонована у винаході послідовність, інгібуюча JNK, може містити або b a складатися щонайменше з однієї (нативної) амінокислотної послідовності NH2-Xn -Xn b RPTTLXLXXXXXXXQD-Xn -COOH [SEQ ID NO:3]. У контексті даного опису X кожний означає амінокислотний залишок, переважно обраний з кожного (нативного) амінокислотного залишку. a Xn означає один амінокислотний залишок, що переважно представляє собою будь-який b амінокислотний залишок крім серину або треоніну, де n означає 0 або 1. Крім того, X n кожний може являти собою будь-який амінокислотний залишок, де n означає число від 0 до 5, від 5 до a 10, від 10 до 15, від 15 до 20, від 20 до 30 або більше, за умови, що, якщо n означає 0 в X n , те b Xn не повинен нести серин або треонін на C-кінці, для того, щоб уникати присутності серину b або треоніну в цьому положенні. Переважно X n являє собою фрагмент, що складається із суміжних пептидних залишків, виведений з SEQ ID NO:1 або 3. Більш переважно пропонована у винаході послідовність, інгібуюча JNK, може додатково містити або складатися щонайменше з однієї (нативної) амінокислотної послідовності NH 2-RPKRPTTLNLFPQVPRSQD-COOH [SEQ ID a b NO:1]. Xn і Xn позначають або D- або L-амінокислоти. Згідно іншому кращому варіанту здійснення винаходу пропоновані у винаході послідовності, інгібуючі JNK, можуть частково або повністю складатися з D-амінокислот. Більш переважно ці пропоновані у винаході послідовності, інгібуючі JNK, що складаються з D-амінокислот, являють собою ненативні послідовності описаних вище (нативних) послідовностей, інгібуючих JNK, в Dретро-інвертованій формі. Поняття «ретро-інвертовані послідовності» відноситься до ізомерів лінійної пептидної послідовності, у якій напрямок послідовності змінений на протилежний й хіральність кожного амінокислотного залишку є інвертованою (див., наприклад, Jameson і ін., Nature, 368, 1994, сс. 744-746; Brady і ін., Nature, 368, 1994, сс. 692-693). Перевагою об'єднання D енантіомерів і зворотного синтезу полягає в тому, що положення карбонільних і аміногруп у кожної амідної зв'язки міняються місцями, при цьому положення груп бічного ланцюга на кожному альфа-атомі вуглецю зберігається. Якщо спеціально не зазначене інше, передбачається, що будь-яка пропонована в даному винаході L-амінокислотна послідовність або пептид можуть бути перетворені в D-ретро-інвертовану послідовність або пептид шляхом синтезу зворотних відносно нативної L-амінокислотної послідовності або пептиду послідовності або пептиду. Пропоновані у винаході D-ретро-інвертовані послідовності, як вони певні вище, володіють рядом цінних властивостей. Наприклад, пропоновані у винаході D-ретро-інвертовані послідовності більш ефективно проникають у клітину в порівнянні з L-амінокислотними послідовностями, пропонованими в даному винаході, при цьому пропоновані у винаході Dретро-інвертовані послідовності є більше стабільними в порівнянні з відповідними Lамінокислотними послідовностями. Таким чином, пропоновані у винаході послідовності, інгібуючі JNK, можуть містити або складатися щонайменше з однієї D-ретро-інвертированої послідовності, що відповідає b a b амінокислотної послідовності NH2-Xn -DQXXXXXXXLXLTTPR-Xn -Xn -COOH [SEQ ID NO:4]. У a b контексті даного опису X, Xn і Xn мають зазначені вище значення (переважно позначають Db амінокислоти), де X n переважно означає фрагмент, що складається із суміжних залишків, отриманий з SEQ ID NO:2 або 4. Більш переважно пропоновані у винаході послідовності, інгібуючі JNK, можуть містити або складатися щонайменше з одної D-ретро-інвертованої послідовності, що відповідає амінокислотній послідовності NH2-DQSRPVQPFLNLTTPRKPRCOOH [SEQ ID NO:2]. Ппропоновані у винаході послідовності, інгібуючі JNK, як вони описані вище, представлені в таблиці 1 (SEQ ID NO:1-4). У таблиці представлені позначення пропонованих у винаході послідовностей, інгібуючих JNK, а також ідентифікаційний номер послідовності, їхня довжина й амінокислотна послідовність. Для порівняння представлені також відомі із прототипу послідовності, які описані в WO 01/27268 (SEQ ID NO:17-26). Ці відомі із прототипу послідовності не відносяться до пропонованих у винаході послідовностям, інгібуючим JNK, або пропонованим у винаході химерним пептидам, і таким чином, вони спеціально виключені з обсягу даного винаходу за допомогою письмової відмови від права на них. 60 3 UA 98101 C2 Таблиця 1 Позначення послідовності/пептиду L-IB1(s) Послідовність 19 2 19 L-IB (загальна формула) (s) D-IB (загальна формула) (s) L-TAT 3 18 4 18 5 10 D-TAT 6 10 L-загальна формула-TAT (s) D-загальна формула-TAT (s) L-TAT-IB1(s) 7 17 8 17 9 31 L-TAT-IB (загальна формула) (s) 10 38 D-TAT-IB1(s) 11 31 D-TAT-IB (загальна формула) (s) 12 38 IB1-довгий IB2-довгий c-Jun ATF2 L-IB1 D-IB1 L-IB (загальна формула) D-IB (загальна формула) L-загальна формула-TAT D-загальна формула-TAT L-TAT-IB1 L-TAT-IB (загальна формула) D-TAT-IB1 D-TAT-IB (загальна формула) 10 AК D-IB1(s) 5 SEQ ID NO 1 13 14 15 16 17 18 19 20 21 22 23 24 29 27 29 29 23 23 19 19 17 17 35 42 25 26 35 42 RPKRPTTLNL FPQVPRSQD (NH2-RPKRPTTLNLFPQVPRSQD-COOH) DQSRPVQPFL NLTTPRKPR (NH2-DQSRPVQPFLNLTTPRKPR-COOH) XRPTTLXLXX XXXXXQDX b a b (NH2-Xn -Xn -RPTTLXLXXXXXXXQD-Xn -COOH) XDQXXXXXXX LXLTTPRX b a b (NH2-Xn -DQXXXXXXXLXLTTPR-Xn -Xn -COOH) GRKKRRQRRR (NH2-GRKKRRQRRR-COOH) RRRQRRKKRG (NH2-RRRQRRKKRG-COOH) XXXXRKKRRQ RRRXXXX b b (NH2-Xn -RKKRRQRRR-Xn -COOH) XXXXRRRQRR KKRXXXX b b (NH2-Xn -RRRQRRKKR-Xn -COOH) GRKKRRQRRR PPRPKRPTTL NLFPQVPRSQ D (NH2-GRKKRRQRRRPPRPKRPTTLNLFPQVPRSQDCOOH) XXXXXXXRKK RRQRRRXXXX XRPTTLXLXX XXXXXQDX b b a (NH2-Xn -RKKRRQRRR-Xn -Xn b RPTTLXLXXXXXXXQD-Xn -COOH) DQSRPVQPFL NLTTPRKPRP PRRRQRRKKR G (NH2-DQSRPVQPFLNLTTPRKPRPPRRRQRRKKRGCOOH) XDQXXXXXXX LXLTTPRXXX XXRRRQRRKK RXXXXXXX b a b b (NH2-Xn -DQXXXXXXXLXLTTPR-Xn -Xn -RRRQRRKKR-Xn COOH) PGTGCGDTYR PKRPTTLNLF PQVPRSQDT IPSPSVEEPH KHRPTTLRLT TLGAQDS GAYGYSNPKI LKQSMTLNLA DPVGNLKPH TNEDHLAVHK HKHEMTLKFG PARNDSVIV DTYRPKRPTT LNLFPQVPRS QDT TDQSRPVQPF LNLTTPRKPR YTD XRPTTLXLXX XXXXXQDS/TX XS/TDQXXXXXX XLXLTTPRX XXXXRKKRRQ RRRXXXX XXXXRRRQRR KKRXXXX GRKKRRQRRR PPDTYRPKRP TTLNLFPQVP RSQDT XXXXXXXRKK RRQRRRXXXX XXXXRPTTLX LXXXXXXXQD S/TX TDQSRPVQPF LNLTTPRKPR YTDPPRRRQR RKKRG XT/SDQXXXXXX XLXLTTPRXX XXXXXXRRRQ RRKKRXXXXX XX (У таблиці 1 приклади послідовностей, а також їхні загальні формули представлені в SEQ ID NO:1, 2, 5, 6, 9 і 11 і SEQ ID NO:3, 4, 7, 8, 10 і 12 відповідно). Відповідно до наступного варіанта здійснення винаходу пропонована у винаході послідовність, інгібуюча JNK, містить або складається щонайменше з одного варіанта, фрагмента й/або похідного зазначених вище пропонованих у винаході нативних або ненативних амінокислотних послідовностей, представлених в SEQ ID NO:1, 2, 3 або 4. Переважно ці варіанти, фрагменти й/або похідні зберігають біологічну активність описаних вище пропонованих у винаході нативних або ненативних послідовностей, інгібуючих JNK, насамперед нативних або ненативних амінокислотних послідовностей, представлених в SEQ ID NO:1, 2, 3 або 4, тобто зв'язуються з JNK і/або інгібуючих активацію щонайменше одного активованого 4 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 JNK фактора транскрипції, наприклад, c-Jun, ATF2 або Elk1. Функціональну активність можна оцінювати за допомогою різних аналізів, наприклад, оцінюючи зв'язування пептиду з його молекулою-мішенню або за допомогою біофізичних методів, наприклад, спектроскопії, комп'ютерного модулювання, структурного аналізу і т.д. Зокрема пропоновану у винаході послідовність, інгібуючу JNK, або її варіанти, фрагменти й/або похідні можна вивчати за допомогою аналізу гідрофільности (див., наприклад, Hopp і Woods, Proc Natl Acad Sci USA 78, 1981, сс. 3824-3828), яку можна використати для ідентифікації гідрофобних і гідрофільних пептидів, що дозволяє створювати субстрати для експериментальних досліджень, таких як експерименти по зв'язуванню, або для синтезу антитіл. Для ідентифікації ділянок (пропонованої у винаході) послідовності, інгібуючої JNK, або її варіантів, фрагментів і/або похідних можна здійснювати також аналіз вторинної структури, за допомогою якого визначають специфічні структурні мотиви (див., наприклад, Chou і Fasman, Biochem 13, 1974, сс. 222-223). Для маніпуляції, трансляції, прогнозування вторинної структури, визначення профілів гідрофільности й гідрофобности, прогнозування й створення відкритих рамок зчитування й визначення гомології послідовності можна використати комп'ютерні пакети програм, що існують у даній області. Можна застосовувати також інші методи структурного аналізу, що включають, наприклад, рентгенівську кристалографію (див., наприклад, Engstrom, Biochem Exp Biol 11, 1974, сс. 7-13), мас-спектроскопію й газову хроматографію (див., наприклад, Methods in Protein Science, з J. Wiley and Sons, New York, NY, 1997) і комп'ютерне моделювання (див., наприклад, Computer Graphics and Molecular Modeling, в: Current Communications in Molecular Biology, під род. Fletterick і Zoller, з Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1986). Таким чином, пропонована у винаході послідовність, інгібуюча JNK, може містити або складатися щонайменше з одного варіанта (нативних або ненативних) амінокислотних послідовностей, представлених в SEQ ID NO:1, 2, 3 або 4. У контексті даного опису поняття «варіант (нативної або ненативної) амінокислотної послідовності, представленої в SEQ ID NO:1, 2, 3 або 4» переважно означає послідовність, виведену з кожної з послідовностей, представлених в SEQ ID NO:1, 2, 3 або 4, де варіант містить зміни амінокислот в амінокислотних послідовностях, представлених в SEQ ID NO:1, 2, 3 або 4. Такі зміни, як правило, являють собою 1 - 20, переважно 1 - 10 і більш переважно 1 - 5 замін, додавань і/або делецій амінокислот у послідовностях, представлених в SEQ ID NO:1, 2, 3 або 4, де послідовність варіанта ідентична кожній з послідовностей, представлених в SEQ ID NO:1, 2, 3 або 4 щонайменше приблизно на 30, 50, 70, 80, 90, 95, 98 або навіть 99%. Якщо пропоновані у винаході варіанти (нативних або ненативних) амінокислотних послідовностей, представлених в SEQ ID NO:1, 2, 3 або 4, одержують шляхом заміни конкретних амінокислот, такі заміни переважно являють собою консервативні амінокислотні заміни. Консервативні амінокислотні заміни можуть включати синонімічні амінокислотні залишки усередині групи, які володіють у достатньому ступені подібними фізико-хімічними властивостями, такі як заміни на залишки з розглянутої групи, що повинне зберігати біологічну активність молекули (див., наприклад, Grantham R., Science 185, 1974, сс. 862-864). Фахівцям у даній області повинно бути очевидно, що амінокислоти можна вбудовувати й/або вилучати шляхом делеції із зазначених вище послідовностей без зміни їхньої функції, зокрема, якщо інсерції й/або делеції зачіпають лише кілька амінокислот, наприклад, менш 20 і переважно менш 10, і що неприпустимо видаляти або заміняти амінокислоти, які мають вирішальне значення для функціональної активності. Крім того, з варіантів, пропонованих у винаході, варто виключати заміни, які приводять до появи додаткових залишків треоніну в положеннях амінокислотної послідовності, які доступні для фосфорілази, переважно кінази, для того, уникати інактивації пропонованої у винаході послідовності-інгібітору JNK або пропонованого у винаході химерного пептиду in vivo або in vitro. Переважно синонімічні амінокислотні залишки являють собою залишки, які віднесені до однієї й тієї ж групи і які, як правило, можна заміняти один на одного шляхом консервативних амінокислотних замін, такі групи наведені в таблиці 2. 5 UA 98101 C2 Таблиця 2 Кращі групи синонімічних амінокислотних залишків Амінокислота Ser Arg Leu Pro Thr Ala Val Gly Ile Phe Tyr Cys His Gln Asn Lys Asp Glu Met Trp 5 10 15 20 25 30 Синонімічний залишок Ser, Thr, Gly, Asn Arg, Gln, Lys, Glu, His Ile, Phe, Туr, Met, Val, Leu Gly, Ala, (Thr), Pro Pro, Ser, Ala, Gly, His, Gln, Thr Gly, Thr, Pro, Ala Met, Tyr, Phe, Ile, Leu, Val Ala, (Thr), Pro, Ser, Gly Met, Tyr, Phe, Val, Leu, Ile Trp, Met, Tyr, Ile, Val, Leu, Phe Trp, Met, Phe, Ile, Val, Leu, Tyr Ser, Thr, Cys Glu, Lys, Gln, Thr, Arg, His Glu, Lys, Asn, His, (Thr), Arg, Gln Gln, Asp, Ser, Asn Glu, Gln, His, Arg, Lys Glu, Asn, Asp Asp, Lys, Asn, Gln, His, Arg, Glu Phe, Ile, Val, Leu, Met Trp Конкретною формою варіанта SEQ ID NO:1, 2, 3 або 4, пропонованого у винаході, є фрагмент пропонованих у винаході (нативних або ненативних) амінокислотних послідовностей, представлених в SEQ ID NO:1, 2, 3 або 4, що, як правило, змінюють шляхом щонайменше однієї делеції в порівнянні з SEQ ID NO: 1, 2, 3 або 4. Переважно фрагмент містить щонайменше 4 суміжні амінокислоти кожної з SEQ ID NO:1, 2, 3 або 4, ця довжина, як правило, є достатньою для специфічного розпізнавання епітопу кожної із цих послідовностей. Ще більш переважно фрагмент містить від 4 до 18, від 4 до 15 або найбільше переважно від 4 до 10 суміжних амінокислот кожної з SEQ ID NO:1, 2, 3 або 4. Делецію амінокислот можна здійснювати в будьякім положенні SEQ ID NO:1, 2, 3 або 4, переважно на N- або C-кінці. Зокрема, у пептидах, що мають послідовність, представлену в SEQ ID NO:2 (DQSRPVQPFLNLTTPRKPR), можна вилучати шляхом делеції на N- і/або C-кінці 1, 2, 3, 4 або 5 амінокислот. Інакше кажучи, кращі вкорочені версії SEQ ID NO:2 можуть мати послідовність QSRPVQPFLNLTTPRKPR, SRPVQPFLNLTTPRKPR, RPVQPFLNLTTPRKPR, PVQPFLNLTTPRKPR або VQPFLNLTTPRKPR або відповідно DQSRPVQPFLNLTTPRKP, DQSRPVQPFLNLTTPRK, DQSRPVQPFLNLTTPR, DQSRPVQPFLNLTTP, DQSRPVQPFLNLTT, або QSRPVQPFLNLTTPRKP, SRPVQPFLNLTTPRKP, SRPVQPFLNLTTPRK, RPVQPFLNLTTPRKP, RPVQPFLNLTTPRK або PVQPFLNLTTP. Чим коротше застосовувана пептидна послідовність, пропонована у винаході, тим менше її неспецифічна клітинна токсичність. У певних варіантах здійснення винаходу застосовувані пептиди повинні мати максимально можливу коротку послідовність, що ще зберігає свою біологічну функцію, наприклад, здатність інгібувати JNK. Крім того, пропонований у винаході фрагмент (нативних або ненативних) амінокислотних послідовностей, представлених в SEQ ID NO:1, 2, 3 або 4, можна позначати як послідовність, що ідентична кожній з послідовностей, представлених в SEQ ID NO:1, 2, 3 або 4, щонайменше приблизно на 30, 50, 70, 80, 90, 95, 98 або навіть на 99%. Пропоновані у винаході послідовності, інгібуючі JNK, можуть також містити або складатися щонайменше з одного похідного (нативних або ненативних) амінокислотних послідовностей, представлених в SEQ ID NO:1, 2, 3 або 4. У цьому контексті поняття «похідне (нативних або ненативних) амінокислотних послідовностей, представлених в SEQ ID NO:1, 2, 3 або 4», переважно означає амінокислотну послідовність, виведену з кожної з послідовностей, представлених в SEQ ID NO:1, 2, 3 або 4, де похідне містить щонайменше одну модифіковану L- або D-амінокислоту (утворену з не зустрічаються(єйся) у природних умовах амінокислот(и)), 6 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 переважно від 1 до 20, більш переважно від 1 до 10, і ще більш переважно від 1 до 5 модифікованих L- або D-амінокислот. Похідні варіантів або фрагментів також підпадають під обсяг даного винаходу. Кожний із представлених у даному описі пептидів може мати кінцеву модифікацію або на C, або на N-кінці, або на обох кінцях. C-кінець переважно можна модифікувати за допомогою амідної модифікації, а N-кінець можна модифікувати за допомогою будь-якої прийнятної NH2захисної групи, наприклад, шляхом ацилювання. У цьому контексті поняття «модифікована амінокислота» може означати будь-яку амінокислоту, змінену, наприклад, у результаті різного глікозилювання в різних організмах, фосфорилювання або мічення конкретними амінокислотами. Таку мітку, як правило, вибирають із групи міток, що включає: (l) радіоактивні мітки, тобто радіоактивне фосфорилювання або радіоактивну мітку, що представляє собою радіоактивну сірку, водень, вуглець, азот і т.д.; (ll) речовини, що офарблюють (наприклад, дігоксигенін і т.д.); (lll) флуоресцентну групу (наприклад, флуоресцеин і т.д.); (lV) хемолюмінесцентні групи; (V) групи для іммобілізації на твердій фазі (наприклад, His-мітка, біотин, strep-мітка, flagмітка, антитіла, антиген і т.д.); і (Vl) комбінацію міток із двох або більшої кількість міток, зазначених у підпунктах (I) - (V). У контексті вищесказаного під амінокислотною послідовністю, «послідовність якої ідентична» щонайменше, наприклад, на 95% розглянутій амінокислотній послідовності, пропонованої в даному винаході, розуміють послідовність представленої амінокислотної послідовності, що ідентична розглянутої послідовності за винятком того, що представлена амінокислотна послідовність може нести аж до 5 амінокислотних змін на кожні 100 амінокислот розглянутої амінокислотної послідовності. Іншими словами для одержання амінокислотної послідовності, послідовність якої щонайменше на 95% ідентична розглянутої амінокислотної послідовності, аж до 5% (5 з 100) амінокислотних залишків у представленій послідовності можна вбудовувати або заміняти іншими амінокислотами або вилучати шляхом делеції. Для послідовностей, що не мають точної відповідності одна одній, можна визначати «% ідентичності» першої послідовності щодо другої послідовності. У цілому, метод полягає в тім, що ці дві підлягаючі порівнянню послідовності піддають порівняльному аналізу, домагаючись максимальної кореляції між послідовностями. Ця процедура може включати вбудовування «проломів» в одну або обидві послідовності для підвищення ефективності порівняльного аналізу первинної структури послідовностей. Далі % ідентичності можна визначати по всій довжині кожної підлягаючому порівнянню послідовності (так званий глобальний порівняльний аналіз первинної структури), що є найбільш прийнятним для послідовностей, що мають однакову або близьку довжину, або для більше коротких ділянок певної довжини (так званий локальний порівняльний аналіз первинної структури), що є найбільш прийнятним для послідовностей, що мають різну довжину. Методи порівняння ідентичності й гомології двох або більшої кількості послідовностей добре відомі в даній області. Так, наприклад, для визначення % ідентичності двох полінуклеотидів і % ідентичності й % гомології двох поліпептидних послідовностей можна використати пакет програм аналізу послідовностей Групи комп'ютерної генетики Біотехнологічного центра Університету Вісконсина (Wisconsin Sequence Analysis Package, версія 9.1. (Devereux и др., Nucleic Acids Res. 12, 1984, сс. 387-395), наприклад, програми BESTFIT і GAP. У програмі BESTFIT використаний алгоритм «локальної гомології» (Smith і Waterman, J. Mol. Biol. 147, 1981, сс. 195-197), і вона дозволяє знаходити одну ділянку, яка характеризується найбільш високим рівнем подібності у двох послідовностях. У даній галузі відомі також інші програми, призначені для визначення ідентичності й/або подібності між послідовностями, наприклад, сімейство програм BLAST (Altschul и др., J. Mol. Biol. 215, 1990, сс. 403-410), які доступні на домашній сторінці NCBI на сайті в мережі Інтернет ncbi.nlm.nih.gov) і FASTA (Pearson, Methods Enzymol. 183, 1990, сс. 63-98; Pearson і Lipman, Proc. Natl. Acad. Sci. U. S. A. 85, 1988, сс. 2444-2448.). Послідовності-інгібітори JNK, пропоновані в даному винаході, можна одержувати або створювати за допомогою методів, добре відомих у даній області, наприклад, шляхом хімічного синтезу або генної інженерії, як буде описано нижче. Наприклад, пептид, що відповідає частини пропонованої у винаході послідовності, інгібуючої JNK, що включає необхідну область зазначеної послідовності, інгібуючої JNK, або яка опосередковує необхідну активність in vitro або in vivo, можна синтезувати за допомогою пептидного синтезатора. Наступним об'єктом даного винаходу є химерний пептид, що включає щонайменше один перший домен і щонайменше один другий домен, де перший домен містить транспортуючу 7 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовність, а другий домен містить зазначену вище пропоновану у винаході послідовність, інгібуючу JNK. Як правило, химерні пептиди, пропоновані в даному винаході, складаються щонайменше з 25 амінокислотних залишків, наприклад, від 25 до 250 амінокислотних залишків, більш переважно від 25 до 200 амінокислотних залишків, ще більш переважно від 25 до150 амінокислотних залишків, від 25 до 100 амінокислотних залишків, і найбільше переважно від 25 до 50 амінокислотних залишків. Перший домен пропонованого у винаході химерного пептиду переважно містить транспортуючу послідовність, що, як правило, вибирають із будь-якої послідовності амінокислот, що забезпечує перенос пептиду (у якому вона присутня) до необхідної ділянки клітинної локалізації. Так, згідно із даним винаходом транспортуюча послідовність, як правило, забезпечує перенос пептиду через плазматичну мембрану, наприклад, з області, розташованої поза клітиною, через плазматичну мембрану в цитоплазму. В іншому або додатковому варіанті транспортуюча послідовність може забезпечувати перенос пептиду до необхідної ділянки усередині клітини, наприклад, ядру, рибосомі, ендоплазматичного ретикулуму (ЕР), лізосомі або пероксисомі, наприклад, шляхом об'єднання двох компонентів (наприклад, компонента, відповідального за клітинну проникність, і компонента, відповідального за ядерну локалізацію) або за допомогою одного компонента, що володіє, наприклад, здатністю здійснювати транспорт через клітинну мембрану й забезпечувати спрямований перенос, наприклад, внутрішньоядерний транспорт. Транспортуюча послідовність може містити також інший компонент, що має здатність зв'язуватися із цитоплазматичним компонентом або будь-яким іншим компонентом або компартментом клітини (наприклад, з ендоплазматичним ретикулумом, мітохондріями, апаратом з невідомою функцією (gloom apparatus), лізосомними пухирцями). Таким чином, послідовність, що транспортує послідовність першого домена й інгібуюча JNK, другого домена може, наприклад, бути локалізована в цитоплазмі або будь-якому іншому компартменті клітини. Це дозволяє визначати локалізацію химерного пептиду в клітині після його проникненні. Переважно амінокислотна послідовність транспортуючої послідовності (що входить до складу першого домена химерного пептиду, пропонованого у винаході) складається з 5-150 амінокислот, більш переважно з 5-100 і найбільше переважно з 5-50, 5-30 або навіть 5-15 амінокислот. Більш переважно транспортуюча послідовність (що входить до складу першого домена химерного пептиду, пропонованого у винаході) може являти собою фрагмент, що складається із суміжних амінокислот, у першому домені. В іншому варіанті транспортуюча послідовність у першому домені може бути розділена на два або декілька фрагменти, де всі ці фрагменти являють собою повну транспортуючу послідовність і можуть бути відділені друг від друга 1-10, переважно 1-5 амінокислотами, за умови, що така транспортуюча послідовність зберігає свої описані вище властивості носія. Амінокислоти, що розділяють фрагменти транспортуючої послідовності, можна, наприклад, вибирати з амінокислотних послідовностей, відмінних від амінокислот транспортуючої послідовності. В іншому варіанті перший домен може містити транспортуючу послідовність, що складається більш ніж з одного компонента, кожний компонент зі своєю власною функцією відносно транспорту свого «вантажу», тобто послідовності, інгібуючої JNK, що перебуває в другому домені, наприклад, у певний клітинний компартмент. Транспортуюча послідовність, як вона визначена вище, може складатися з L-амінокислот, Dамінокислот або їхньої комбінації. Переважно пропоновані у винаході транспортуючі послідовності містять щонайменше 1, переважно щонайменше 3, більш переважно щонайменше 6 і ще більш переважно щонайменше 10 L-амінокислот і/або D-амінокислот, де Dі/або L-амінокислоти можуть входити до складу пропонованих у винаході послідовностей, інгібуючих JNK, у вигляді блоку або не у вигляді блоку, або у вигляді іншої структури. Відповідно до одного з альтернативних варіантів здійснення винаходу транспортуюча послідовність пропонованого у винаході химерного пептиду може складатися винятково з Lамінокислот. Більш переважно транспортуюча послідовність пропонованого у винаході химерного пептиду містить або складається щонайменше з однієї «нативної» транспортуючої послідовності, як вона визначена вище. У цьому контексті поняття «нативний» відноситься до незмінених транспортуючих послідовностей, що повністю складаються із L-амінокислот. Відповідно до іншого альтернативного варіанта здійснення винаходу транспортуюча послідовність пропонованого у винаході химерного пептиду може складатися винятково з Dамінокислот. Більш переважно транспортуюча послідовність пропонованого у винаході химерного пептиду може містити D-ретро-інвертований пептид описаних вище послідовностей. 8 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 Транспортуючу послідовність першого домена химерного пептиду, пропонованого у винаході, можна одержувати із джерел, що зустрічаються в природних умовах, або можна одержувати за допомогою методів генної інженерії або хімічним синтезом (див., наприклад, Sambrook, J., Fritsch, E. F., Maniatis, T., Molecular cloning: A laboratory manual. 2-оі изд., 1989, з Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.). Джерелами транспортуючої послідовності першого домена, які можна застосовувати, є, наприклад, нативні білки, такі, наприклад, як білок TAT (наприклад, описаний в U.S. 5804604 і 5674980, кожний з яких включений у даний опис як посилання), VP22 (описаний, наприклад, в WO 97/05265; Elliott і O'Hare, Cell 88, 1997, сс. 223-233), не вірусні білки (Jackson і ін., Proc. Natl. Acad. Sci. USA 89, 1992, сс. 10691-10695), що транспортують послідовності, отримані із представників Antennapedia (наприклад, послідовність-носій з Antennapedia) або з оснóвних пептидів, наприклад, пептидів, що складаються з 5-15 амінокислот, переважно 10-12 амінокислот і утримуючих щонайменше 80%, більш переважно 85% або навіть 90% основних амінокислот, таких, наприклад, як аргінін, лізин і/або гистидин. Крім того, у якості зазначених у даному описі транспортуючих послідовностей застосовують варіанти, фрагменти й похідні одного з нативних білків. Відносно варіантів, фрагментів і похідних можна використати визначення, які зазначені вище для послідовностей, інгібуючих JNK. Варіанти, фрагменти, а також похідні відповідають викладеним вище визначенням послідовностей, інгібуючих JNK. Зокрема, у контексті транспортуючої послідовності варіант або фрагмент, або похідне можна визначати як послідовність, ідентична послідовності нативних білків, застосовуваних у якості зазначених вище транспортуючих послідовностей, щонайменше приблизно на 30, 50, 70, 80, 90, 95, 98 або навіть 99%. В кращому варіанті пропонованого у винаході химерного пептиду транспортуюча послідовність першого домена містить або складається з послідовності, отриманої з білка TAT людського вірусу імунодефіциту (ВІЛ)1, зокрема містить деякі або всі 86 амінокислот, з яких складається білок TAT. Для пропонованої у винаході транспортуючої послідовності можна використати часткові послідовності повнорозмірного білка TAT, одержуючи функціонально ефективний фрагмент білка TAT, тобто пептид TAT, що включає ділянку, що опосередковує проникнення й поглинання клітинами. Чи представляє така послідовність функціонально ефективний фрагмент білка TAT, можна визначати за допомогою відомих методів (див., наприклад, Franked і ін., Proc. Natl. Acad. Sci, USA 86, 1989, сс. 7397-7401). Так, послідовність, що транспортує першого домена пропонованого у винаході химерного пептиду можна одержувати з функціонально ефективного фрагмента або частини послідовності білка TAT, які містять менш 86 амінокислот і які поглинаються клітинами й необов'язково поглинаються ядрами клітин. Більш переважно, передбачається, що часткові послідовності (фрагменти) TAT, які можна використати як носій для опосередкування проникнення химерного пептиду через клітинну мембрану, повинні містити оснoвну частину (амінокислоти 48-57 або 49-57) повнорозмірного TAT. Відповідно до більше кращого варіанта здійснення винаходу пропонована у винаході транспортуюча послідовність може містити або складатися з амінокислотної послідовності, що містить залишки TAT 48-57 або 49-57 і найбільше переважно загальну послідовність TAT NH 2b b b Xn -RKKRRQRRR-Xn -COOH [SEQ ID NO:7], де Xn має зазначені вище значення. В іншому варіанті пропонована у винаході транспортуюча послідовність може містити або складатися з пептиду, що містить, наприклад, амінокислотну послідовність NH 2-GRKKRRQRRR-COOH [SEQ ID NO:5]. Відповідно до іншого більше кращого варіанту здійснення винаходу транспортуюча послідовність, пропонована у винаході, може містити D-ретро-інвертований пептид, що має зазначені вище послідовності, тобто D-ретро-інвертовану послідовність загальної послідовності b b TAT, що має послідовність NH2-Xn -RRRQRRKKR-Xn -COOH [SEQ ID NO:8]. І в цьому випадку b також Xn має зазначені вище значення (переважно означає D-амінокислоти). Крім того, b кількість залишків «Xn » у кожній з SEQ ID NO:7-8 не обмежено зазначеним і може варіюватися, як зазначено вище. Найбільше переважно пропонована у винаході транспортуюча послідовність може містити D-ретро-інвертовану послідовність NH2-RRRQRRKKRG-COOH [SEQ ID NO:6]. Відповідно до іншого варіанта здійснення винаходу транспортуюча послідовність, пропонована у винаході, може містити або складатися з варіантів транспортуючих послідовностей, як вони визначені вище. «Варіант транспортуючої послідовності» переважно означає послідовність, отриману із зазначеної вище транспортуючої послідовності, де варіант має модифікацію, наприклад, додавання, (внутрішню) делецію (що приводить до утворення фрагмента) і/або заміну щонайменше однієї амінокислоти, що присутня у транспортуючій послідовності, як вона визначена вище. Така(і) модифікація(ії), як правило, представляє(ють) 9 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 собою 1-20, переважно 1-10 і більш переважно 1-5 замін, додавань і/або делецій амінокислот. Крім того, для варіанта переважно характерна ідентичність послідовності транспортуючої послідовності, як вона визначена вище, більш переважно кожні з послідовностей, представлених в SEQ ID NO:5-8, щонайменше приблизно на 30, 50, 70, 80, 90, 95, 98 або навіть 99%. Переважно така модифікація транспортуючої послідовності приводить до одержання транспортуючої послідовності з підвищеною або зниженою стабільністю. Альтернативно цьому варіанти транспортуючої послідовності можна створювати для модуляції внутрішньоклітинної локалізації химерного пептиду, пропонованого у винаході. При екзогенному введенні зазначених вище варіантів їх, як правило, створюють так, щоб зберігалася здатність транспортуючої послідовності проникати в клітини (тобто поглинання клітиною варіанта транспортуючої послідовності практично таке ж, як у нативного білка застосовуваної транспортуючої послідовності). Наприклад, зміна оснoвної області, що, як передбачається, є важливою для ядерної локалізації (див., наприклад, Dang і Lee, J. Biol. Chem. 264, 1989, сс. 18019-18023; Hauber і ін., J. Virol. 63, 1989, сс. 1181-1187; Ruben і ін., J.Virol. 63, 1989, сс. 1-8), може приводити до цитоплазматичної локалізації або часткової цитоплазматичної локалізації транспортуючої послідовності, і, як наслідок, послідовності, інгібуючої JNK, як компонента пропонованого у винаході химерного пептиду. Крім вищевказаного, у варіант можна інтродукувати інші модифікації, наприклад, шляхом зв'язку, наприклад, холестерину або інших ліпідних фрагментів, із транспортуючою послідовністю з одержанням транспортуючої послідовності, що має підвищену розчинність у мембрані. Будь-які з вищевказаних варіантів транспортуючих послідовностей, пропонованих у винаході, можна одержувати за допомогою методів, які, як правило, відомі фахівцям у даній галузі (див., наприклад, Sambrook J., Fritsch E. F., Maniatis T., Molecular cloning: A laboratory manual. 2-оі изд., 1989, з Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.) Другий домен химерного пептиду, пропонованого у винаході, як правило, містить пропоновану у винаході послідовність, інгібуючу JNK, обрану з кожної із пропонованих у винаході послідовностей, інгібуючих JNK, як вони визначені вище, включаючи варіанти, фрагменти й/або похідні цих пропонованих у винаході послідовностей, інгібуючих JNK. Обидва домени, тобто перший і другий домени пропонованого у винаході химерного пептиду, можуть бути пов'язані з одержанням функціональної одиниці. Можна застосовувати будь-який метод зв'язування першого й другого домена, відомий у даній галузі. Відповідно до одного з варіантів здійснення винаходу перший і другий домени химерного пептиду, пропонованого у винаході, переважно зв'язують за допомогою ковалентного зв'язку. У контексті даного опису ковалентний зв'язок може являти собою, наприклад, пептидний зв'язок, який можна одержувати шляхом експресії пропонованого у винаході химерного білка у вигляді злитого білка. Злиті білки в контексті даного опису можна одержувати й застосовувати шляхами, аналогічними або легко одержуваними на основі стандартних методів рекомбінантної ДНК, які описані нижче. Однак обидва домена можна також зв'язувати через бічні ланцюги або їх можна зв'язувати за допомогою фрагмента, що представляє собою хімічний лінкер. Перший і/або другий домени пропонованого у винаході химерного пептиду можуть бути присутніми у пропонованому у винаході химерному пептиді у вигляді однієї або декількох копій. Якщо обоє домени присутні у вигляді однієї копії, то перший домен можна зв'язувати або з Nкінцем, або з C-кінцем другого домена. При наявності декількох копій перший і другий домени можуть розташовуватися в будь-якому можливому порядку. Наприклад, перший домен може бути присутнім у пропонованому у винаході химерному пептиді у вигляді декількох копій, наприклад, у двох, трьох або більшій кількості копій, які переважно розташовані послідовно, а другий домен може бути присутнім у вигляді однієї копії на N- або C-кінці послідовності, що містить перший домен. В альтернативному варіанті другий домен може бути присутнім у вигляді декількох копій, наприклад, у двох, трьох або більшому числі копій, а перший домен може бути присутнім у вигляді однієї копії. В обох варіантах перший і другий домени можуть перебувати в будь-якім місці й можуть розташовуватися послідовно. Нижче представлені приклади порядку розташування: наприклад, перший домен - перший домен - перший домен - другий домен; перший домен - перший домен - другий домен - перший домен; перший домен - другий домен перший домен - перший домен; або, наприклад, другий домен - перший домен - перший домен перший домен. Як повинно бути очевидно фахівцеві в даній галузі, ці приклади дані тільки з метою ілюстрації й не обмежують обсяг винаходу. Таким чином, число копій і їхнє розташування може варіюватися, як зазначено раніше. Переважно перший і другий домени можна зв'язувати один з одним безпосередньо без якого-небудь лінкера. В іншому варіанті їх можна зв'язувати один з одним через лінкерну 10 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовність, що містить від 1 до 10, переважно від 1 до 5 амінокислот. Амінокислоти, що входять у лінкерну послідовність, переважно вибирають із гліцину або проліну як амінокислотні залишки. Більш переважно перший і другий домени можна відокремлювати друг від друга за допомогою шарніра, що складає із двох, три або більшого кількості залишків проліну, між першим і другим доменами. Описаний вище химерний пептид, пропонований у винаході, що містить щонайменше один перший і щонайменше один другий домен, може складатися з L-амінокислот, D-амінокислот або їхньої комбінації. Крім того, кожний домен (а також використовувані лінкери) можуть складатися з L-амінокислот, D-амінокислот або їхньої комбінації (наприклад, D-TAT і L-IB1(s) або L-TAT і DIB1(s) і т.д.). Переважно пропонований у винаході химерний пептид містить щонайменше 1, переважно щонайменше 3, більш переважно щонайменше 6 і ще більш переважно щонайменше 10 L-амінокислот і/або D-амінокислот, де D- і/або L-амінокислоти можуть розташовуватися в химерному пептиді, пропонованому у винаході, у вигляді блоку або не у вигляді блоку або у вигляді іншої структури. Відповідно до конкретного варіанта здійснення винаходу химерний пептид, пропонований у винаході, містить або складається з L-амінокислотних химерних пептидів, що мають загальну b b a b формулу L-TAT-IB-пептиду [NH2-Xn -RKKRRQRRR-Xn -Xn -RPTTLXLXXXXXXXQD-Xn -COOH, a b SEQ ID NO:10], де X, Xn і Xn переважно мають зазначені вище значення. Більш переважно химерний пептид, пропонований у винаході, містить або складається з L-амінокислотного химерного пептиду L-TAT-IB1 [NH2-GRKKRRQRRRPPRPKRPTTLNLFPQVPRSQD-COOH, SEQ ID NO:9]. Відповідно до іншого конкретного варіанта здійснення винаходу химерний пептид, пропонований у винаході, містить або складається з D-амінокислотних химерних пептидів описаних вище L-амінокислотних химерних пептидів. Прикладами D-ретро-інвертованих химерних пептидів, пропонованих у даному винаході, наприклад, є пептиди D-TAT-IB загальної b a b b формули [NH2-Xn -DQXXXXXXXLXLTTPR-Xn -Xn -RRRQRRKKR-Xn -COOH, SEQ ID NO:12]. При a b цьому X, Xn і Xn переважно мають зазначені вище значення (переважно позначають Dамінокислоти). Більш переважно химерний пептид, пропонований у винаході, містить або складається з D-амінокислотних химерних пептидів, описуваних формулою пептиду TAT-IB1 [NH2-DQSRPVQPFLNLTTPRKPRPPRRRQRRKKRG-COOH, SEQ ID NO:11]. Однак єднальна a b область першого й другого домена (замість PP) може містити -Xn -Xn -, які мають зазначені вище значення. Зокрема, другий(і) домен(и), що(е) має(ють) послідовність, представлену в SEQ a b ID NO:11, у тому числі утримуючу -Xn -Xn - замість PP, можуть мати делецію на них N- і/або Cкінці 1, 2, 3, 4 або 5 амінокислот. В іншому кращому варіанті здійснення винаходу перший домен, що має послідовність, представлену в SEQ ID NO:11, може мати делецію на його Nі/або C-кінці 1 або 2 амінокислот. Цю(і) делецію(і) можна застосовувати в сполученні з делецією(ями), описаної(ими) для амінокислотних залишків на кінцях другого домена. Таким чином, кращими варіантами SEQ ID NO:11 є, наприклад, що випливають послідовності з a b делеціями другого домена на N- і/або C-кінці(ях): QSRPVQPFLNLTTPRKPR-Xn -Xn a b a b RRRQRRKKRG, SRPVQPFLNLTTPRKPR-Xn -Xn -RRRQRRKKRG, RPVQPFLNLTTPRKPR-Xn -Xn a b a b RRRQRRKKRG, PVQPFLNLTTPRKPR-Xn -Xn -RRRQRRKKRG або VQPFLNLTTPRKPR-Xn -Xn a b RRRQRRKKRG, або відповідно DQSRPVQPFLNLTTPRKP-Xn -Xn -RRRQRRKKRG, a b a b DQSRPVQPFLNLTTPRK-Xn -Xn -RRRQRRKKRG, DQSRPVQPFLNLTTPR-Xn -Xn -RRRQRRKKRG, a b a b DQSRPVQPFLNLTTP-Xn -Xn -RRRQRRKKRG, DQSRPVQPFLNLTT-Xn -Xn -RRRQRRKKRG, або a b a b QSRPVQPFLNLTTPRKP-Xn -Xn -RRRQRRKKRG, SRPVQPFLNLTTPRKP-Xn -Xn -RRRQRRKKRG, a b a b SRPVQPFLNLTTPRK-Xn -Xn -RRRQRRKKRG, RPVQPFLNLTTPRKP-Xn -Xn -RRRQRRKKRG, a b a b RPVQPFLNLTTPRK-Xn -Xn -RRRQRRKKRG, або PVQPFLNLTTP-Xn -Xn -RRRQRRKKRG. Кращими варіантами здійснення винаходу, у яких делеції зачіпають тільки кінець(і) першого a b домена, є наступні послідовності: QSRPVQPFLNLTTPRKPR-Xn -Xn -RRRQRRKKR, a b a b QSRPVQPFLNLTTPRKPR-Xn -Xn -RRRQRRKK, QSRPVQPFLNLTTPRKPR-Xn -Xn -RRQRRKKRG, a b a b QSRPVQPFLNLTTPRKPR-Xn -Xn -RQRRKKRG, QSRPVQPFLNLTTPRKPR-Xn -Xn -RRQRRKKR, a b a b QSRPVQPFLNLTTPRKPR-Xn -Xn -RQRRKKR, QSRPVQPFLNLTTPRKPR-Xn -Xn -RQRRKK. Прикладами послідовностей, отриманих у результаті комбінацій делецій першого й другого a b a b домена, є: QSRPVQPFLNLTTPRKPR-Xn -Xn -RRRQRRKKR, SRPVQPFLNLTTPRKPR-Xn -Xn a b a b RRRQRRKKR, RPVQPFLNLTTPRKPR-Xn -Xn -RRRQRRKKR, PVQPFLNLTTPRKPR-Xn -Xn a b RRRQRRKKR або VQPFLNLTTPRKPR-Xn -Xn -RRRQRRKKR, або відповідно a b a b DQSRPVQPFLNLTTPRKP-Xn -Xn -RRRQRRKKR, DQSRPVQPFLNLTTPRK-Xn -Xn -RRRQRRKKR, a b a b DQSRPVQPFLNLTTPR-Xn -Xn -RRRQRRKKR, DQSRPVQPFLNLTTP-Xn -Xn -RRRQRRKKR, a b a b DQSRPVQPFLNLTT-Xn -Xn -RRRQRRKKR, або QSRPVQPFLNLTTPRKP-Xn -Xn -RRRQRRKKR, a b a b SRPVQPFLNLTTPRKP-Xn -Xn -RRRQRRKKR, SRPVQPFLNLTTPRK-Xn -Xn -RRRQRRKKR, 11 UA 98101 C2 a 5 10 15 20 25 30 35 40 45 50 55 60 b a b RPVQPFLNLTTPRKP-Xn -Xn -RRRQRRKKR, RPVQPFLNLTTPRK-Xn -Xn -RRRQRRKKR, або a b a b PVQPFLNLTTP-Xn -Xn -RRRQRRKKR, QSRPVQPFLNLTTPRKPR-Xn -Xn -RRRQRRKK, a b a b SRPVQPFLNLTTPRKPR-Xn -Xn -RRRQRRKKRG, RPVQPFLNLTTPRKPR-Xn -Xn -RRRQRRKK, a b a b PVQPFLNLTTPRKPR-Xn -Xn -RRRQRRKK, або VQPFLNLTTPRKPR-Xn -Xn -RRRQRRKK, або a b a b відповідно DQSRPVQPFLNLTTPRKP-Xn -Xn -RRRQRRKK, DQSRPVQPFLNLTTPRK-Xn -Xn a b a b RRRQRRKK, DQSRPVQPFLNLTTPR-Xn -Xn -RRRQRRKK, DQSRPVQPFLNLTTP-Xn -Xn a b a b RRRQRRKK, DQSRPVQPFLNLTT-Xn -Xn -RRRQRRKK, або QSRPVQPFLNLTTPRKP-Xn -Xn a b a b RRRQRRKK, SRPVQPFLNLTTPRKP-Xn -Xn -RRRQRRKK, SRPVQPFLNLTTPRK-Xn -Xn a b a b RRRQRRKK, RPVQPFLNLTTPRKP-Xn -Xn -RRRQRRKK, RPVQPFLNLTTPRK-Xn -Xn a b a b RRRQRRKK, або PVQPFLNLTTP-Xn -Xn -RRRQRRKK, QSRPVQPFLNLTTPRKPR-Xn -Xn a b a b RRQRRKKR, SRPVQPFLNLTTPRKPR-Xn -Xn -RRQRRKKR, RPVQPFLNLTTPRKPR-Xn -Xn a b a b RRQRRKKR, PVQPFLNLTTPRKPR-Xn -Xn -RRQRRKKR, або VQPFLNLTTPRKPR-Xn -Xn a b RRQRRKKR, або відповідно DQSRPVQPFLNLTTPRKP-Xn -Xn -RRQRRKKR, a b a b DQSRPVQPFLNLTTPRK-Xn -Xn -RRQRRKKR, DQSRPVQPFLNLTTPR-Xn -Xn -RRQRRKKR, a b a b DQSRPVQPFLNLTTP-Xn -Xn -RRQRRKKR, DQSRPVQPFLNLTT-Xn -Xn -RRQRRKKR, або a b a b QSRPVQPFLNLTTPRKP-Xn -Xn -RRQRRKKR, SRPVQPFLNLTTPRKP-Xn -Xn -RRQRRKKRG, a b a b SRPVQPFLNLTTPRK-Xn -Xn -RRQRRKKRG, RPVQPFLNLTTPRKP-Xn -Xn -RRQRRKKRG, a b a b RPVQPFLNLTTPRK-Xn -Xn -RRQRRKKRG , або PVQPFLNLTTP-Xn -Xn -RRQRRKKRG, a b a b QSRPVQPFLNLTTPRKPR-Xn -Xn -RRQRRKKRG, SRPVQPFLNLTTPRKPR-Xn -Xn -RRQRRKKRG, a b a b RPVQPFLNLTTPRKPR-Xn -Xn -RRQRRKKRG, PVQPFLNLTTPRKPR-Xn -Xn -RRQRRKKRG, або a b a b VQPFLNLTTPRKPR-Xn -Xn -RRQRRKKRG, або відповідно DQSRPVQPFLNLTTPRKP-Xn -Xn a b a b RRQRRKKRG, DQSRPVQPFLNLTTPRK-Xn -Xn -RRQRRKKRG, DQSRPVQPFLNLTTPR-Xn -Xn a b a b RRQRRKKRG, DQSRPVQPFLNLTTP-Xn -Xn -RRQRRKKRG, DQSRPVQPFLNLTT-Xn -Xn a b a RRQRRKKRG, або QSRPVQPFLNLTTPRKP-Xn -Xn -RRQRRKKRG, SRPVQPFLNLTTPRKP-Xn b a b a b Xn -RRQRRKKRG, SRPVQPFLNLTTPRK-Xn -Xn -RRQRRKKRG, RPVQPFLNLTTPRKP-Xn -Xn a b a b RRQRRKKRG, RPVQPFLNLTTPRK-Xn -Xn -RRQRRKKRG, або PVQPFLNLTTP-Xn -Xn a b a b RRQRRKKRG, QSRPVQPFLNLTTPRKPR-Xn -Xn -RQRRKKRG, SRPVQPFLNLTTPRKPR-Xn -Xn a b a b RQRRKKRG, RPVQPFLNLTTPRKPR-Xn -Xn -RQRRKKRG, PVQPFLNLTTPRKPR-Xn -Xn a b RQRRKKRG, або VQPFLNLTTPRKPR-Xn -Xn -RQRRKKRG, або відповідно a b a b DQSRPVQPFLNLTTPRKP-Xn -Xn -RQRRKKRG, DQSRPVQPFLNLTTPRK-Xn -Xn -RQRRKKRG, a b a b DQSRPVQPFLNLTTPR-Xn -Xn -RQRRKKRG, DQSRPVQPFLNLTTP-Xn -Xn -RQRRKKRG, a b a b DQSRPVQPFLNLTT-Xn -Xn -RQRRKKRG, або QSRPVQPFLNLTTPRKP-Xn -Xn -RQRRKKRG, a b a b SRPVQPFLNLTTPRKP-Xn -Xn -RQRRKKRG, SRPVQPFLNLTTPRK-Xn -Xn -RQRRKKRG, a b a b RPVQPFLNLTTPRKP-Xn -Xn -RQRRKKRG, RPVQPFLNLTTPRK-Xn -Xn -RQRRKKRG, або a b PVQPFLNLTTP-Xn -Xn -RQRRKKRG. І в цьому випадку, більше короткі пептиди володіють більш низькою (неспецифічною) токсичністю для клітин. Однак пептиди повинні зберігати їхню біологічну функцію, тобто здатність проникати через клеточною мембрану (перший домен) і здатність інгібувати JNK (другий домен). Перший і другий домени пропонованого у винаході химерного пептиду, як він визначений вище, можна зв'язувати один з одним за допомогою хімічного або біохімічного зшивання, що здійснюють будь-яким прийнятним шляхом, відомим у даній області, наприклад, створюючи пептидний зв'язок між першим і другим доменами, наприклад, шляхом експресії першого й другого домена у вигляді злитого білка, або, наприклад, шляхом перехресного зшивання першого й другого домена пропонованого у винаході химерного пептиду. Багато відомих методів хімічного перехресного зшивання є неспецифічними, тобто вони не направляють крапку зшивання в конкретний сайт транспортного поліпептиду або транспортує макромолекули. У результаті, неспецифічні перехреснозшиваючі агенти у випадку їхнього використання можуть «атакувати» функціональні сайти або стерически блокувати активні сайти, приводячи до того, що злиті білки стають біологічно неактивними. Таким чином, переважно застосовувати такі методи введення перехресних зшивок, які дозволяють здійснювати більше специфічне зшивання першого й другого домена. Специфічність сполучення можна підвищувати шляхом безпосереднього хімічного сполучення з функціональною групою, що зустрічається тільки один раз або лише невелику кількість разів в одному або обох перших і других доменах, які підлягають перехресному зшиванню. Прикладом є цистеін, що являє собою єдину амінокислоту, що містить тіольну групу, і який у багатьох білках зустрічається лише невелика кількість разів. Також, наприклад, якщо поліпептид не містить залишків лізина, те перехреснозшивающий реагент, що володіє специфічністю відносно первинних амінів, буде мати виборчу дію у відношенні амінокінця зазначеного поліпептиду. Однак для успішного застосування цього підходу з метою підвищення специфічності сполучення необхідно, щоб поліпептид мав досить що рідко зустрічаються й 12 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 здатний-здатні-реакційно-здатні залишки в областях молекули, які можна змінювати без втрати біологічної активності молекули. Залишки цистеїну можна заміняти, якщо вони зустрічаються в таких частинах послідовності поліпептиду, де в противному випадку їхня участь у реакції перехресного зшивання може впливати на біологічну активність. Якщо залишок цистеїну заміняють, то, як правило, бажано мінімізувати зміни, що утворяться, складчастості поліпептиду. Зміни складчастості поліпептиду мінімальні, коли заміну є хімічно й стерически близької цистеїну. Таким чином, для заміни цистеїну переважно використати серин. Як продемонстровано нижче в прикладах, залишок цистеїну можна інтродукувати в амінокислотну послідовність поліпептиду з метою здійснення перехресного зшивання. При інтродукції залишку цистеїну кращої є інтродукція на аміно- або карбоксильний кінець або поблизу їх. У цей час доступні прийнятні методи таких модифікацій амінокислотних послідовностей, при яких інтерес, що представляє, поліпептид одержують шляхом хімічного синтезу або за допомогою експресії рекомбінантної ДНК. Сполучення першого й другого доменів можна здійснювати за допомогою сполучного або кон'югіруючого агента. Існує кілька агентів для міжмолекулярного перехресного зшивання, які можна використати (див., наприклад, Means і Feeney, Chemical Modification of Proteins, з HoldenDay, 1974, сс. 39-43). До цих реагентів відносяться, наприклад, N-сукцинімідил-3-(2пиридилдітіо)пропіонат (СПДП) або N,N'-(1,3-фенілен)бисмалеімід (обоє мають високу специфічність відносно сульфгідрильних груп і утворять необоротні зв'язки); N,N'етиленбис(йодацетамид) або інший аналогічний реагент, що має 6-11 вуглецевих метиленових містків (які мають відносну специфічність відносно сульфгідрильних груп); і 1,5-дифтор-2,4динітробензол (утворюючий необоротні зв'язки між аміногрупами й тирозиновими групами). До інших перехресно, що зшивають реагентам, придатним для цієї мети, відносяться: п,п'-дифторм,м'-динітрофенілсульфон, що утворить необоротні зв'язки з аміногрупами й фенольними групами); диметиладипімідат (який є специфічним для аміногруп); фенол-1,4дисульфонілхлорид (який вступає в реакцію головним чином з аміногрупами); гексаметилендиизоцианат або диизотиоцианат, або азофеніл-п-диизоцианат (який вступає в реакцію головним чином з аміногрупами); глутаровий альдегід (який вступає в реакцію з декількома різними бічними ланцюгами) і дисдиазобензидин (який вступає в реакцію насамперед з тирозином і гистидином). Перехреснозшиваючі реагенти можуть бути гомобіфункціональними, тобто, мати дві функціональні групи, що беруть участь в одній і тій же реакції. Кращим гомобіфункціональним перехреснозшиваючим реагентом є бісмалеімідогексан (БМГ). БМГ містить дві малеімідні функціональні групи, які специфічно взаємодіють із утримуючими сульфгидрил з'єднаннями в м'яких умовах (p 6,5-7,7). Дві малеімідні групи з'єднані вуглеводневим ланцюгом. Таким чином, БМГ можна застосовувати для необоротного перехресного зшивання поліпептидів, які містять залишки цистеїну. Перехреснозшиваючі реагенти можуть бути також гетеробіфункціональними. Гетеробіфункціональні перехреснозшиваючі реагенти мають дві різні функціональні групи, наприклад, реактивну аміногрупу й реактивну тиольную групу, які повинні перехресно зшивати два білки, що мають вільні аміни й тіоли відповідно. Прикладами гетеробіфункціональних перехреснозшиваючих агентів є сукцинімідил-4-(Nмалеімідометил)циклогексан-1-карбоксилат (СМЦК), складний м-малеімідобензоил-Nгідроксисукцинімідиловий ефір (МБС) і сукцинімід-4-(п-малеімідофеніл)бутират (СМФБ), що представляє собою аналог МБС із подовженим ланцюгом. Сукцинімідильна група цих перехреснозшиваючих лінкерів взаємодіє з первинним аміном і реактивна тіольна група малеіміда утворить ковалентний зв'язок з тиольной групою залишку цистеїну. Перехреснозшиваючі реагенти часто мають низьку розчинність у воді. До перехреснозшиваючого реагенту можна додавати гідрофільний фрагмент, такий як сульфонатна група, для підвищення його розчинності у воді. У цьому зв'язку сульфо-мбс і сульфо-смцк є прикладами перехреснозшиваючих реагентів, модифікованих з метою підвищення розчинності у воді, які можна застосовувати згідно із даним винаходом. Багато які перехреснозшиваючі реагенти приводять до утворення кон’югата, що практично не розщеплюється в умовах клітинного оточення. Тому деякі перехреснозшиваючі реагенти містять ковалентний зв'язок, такий як дисульфід, що розщеплюється в умовах клітинного оточення. Наприклад, реагент Траута, дитіобис(сукцинімідилпропіонат) (ДСП) і N-сукцинімідил3-(2-пиридилдітіо)пропіонат (СПДП) являють собою широко відомі, що розщеплюють, перехреснозшиваючі лінкери. Використання перехреснозшиваючого реагенту, що розщеплює, дозволяє транспортувати фрагменту, що відділяється від транспортного поліпептиду, після 13 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 введення в клітинку-мішень. Для цієї мети можна застосовувати також прямий дисульфідний зв'язок. У цей час надходять у продаж численні перехреснозшиваючі агенти, включаючи описані вище. Докладні інструкції з їхнього застосування легко можна одержати від комерційних постачальників. Загальні відомості про перехресне зшивання білків і одержання кон’югатов наведені в Wong, Chemistry of Protein Conjugation and Cross-Linking, з CRC Press (1991). Хімічне перехресне зшивання можна здійснювати також з використанням спейсерних плечей. Спейсерні плечі забезпечують внутрімолекулярну гнучкість або регулюють внутрімолекулярні відстані між кон’югованими фрагментами й тим самим можуть допомагати зберігати біологічну активність. Спейсерне плече може являти собою фрагмент поліпептиду, що містить спейсерні амінокислоти, наприклад, пролін. В альтернативному варіанті спейсерне плече може являти собою частину перехреснозшиваючого реагенту, такого як «СПДП із довгим ланцюгом» (фірма Pierce Chem. Co., Рокфорд, шт. Іллінойс, каталожний номер 21651 H). Крім того, даний винахід відноситься також до варіантів, фрагментам або похідним одного з описаних вище химерних пептидів. Стосовно до фрагментів і варіантів, як правило, використовують визначення, наведене вище для послідовності, інгібуючої JNK. Зокрема, у контексті даного винаходу поняття «варіант химерного пептиду» переважно означає послідовність, виведену з кожної з послідовностей, представлених в SEQ ID NO:9- 12, де химерний варіант несе зміни амінокислотних послідовностей пропонованих у винаході химерних пептидів, представлених в SEQ ID NO:9-12. Такі зміни, як правило, являють собою 120, переважно 1-10 і більш переважно 1-5 замін, додавань і/або делецій (що приводять до утворення фрагментів) амінокислот, представлених в SEQ ID NO: 9-12, де послідовність зміненого пропонованого у винаході химерного пептиду ідентична кожній з послідовностей, представлених в SEQ ID NO:9, 10, 11 або 12, щонайменше приблизно на 30, 50, 70, 80 або 95, 98 або навіть 99%. Переважно зазначені варіанти зберігають біологічну активність першого й другого домена, властиву пропонованому у винаході химерному пептиду, тобто зазначену вище транспортуючу активність першого домена й активність другого домена відносно зв'язування JNK і/або інгібування активації щонайменше одного активируємого JNK фактора транскрипції. Таким чином, пропонований у винаході химерний пептид являє собою також фрагменти описаних вище пропонованих у винаходіхимерних пептидів, насамперед послідовності пропонованих у винаході химерних пептидів, які представлені в SEQ ID NO:9, 10, 11 або 12. Таким чином, у контексті даного винаходу поняття «фрагмент пропонованого у винаході химерного пептиду» переважно означає послідовність, виведену з кожної з послідовностей, представлених в SEQ ID NO:9, 10, 11 або 12, де фрагмент містить щонайменше 4 суміжні амінокислоти кожної з послідовностей, представлених в SEQ ID NO:9, 10, 11 або 12. Зазначений фрагмент переважно має довжину, достатню для специфічного розпізнавання епітопу кожної із зазначених послідовностей і для транспорту послідовності в клітини, ядра або іншу кращу ділянку. Ще більш переважно фрагмент містить від 4 до 18, від 4 до 15 або найбільше переважно від 4 до 10 суміжних амінокислот кожної з послідовностей, представлених в SEQ ID NO:9, 10, 11 або 12. Фрагменти пропонованого у винаході химерного пептиду можна визначати також як послідовність, ідентичну кожної з послідовностей, представлених в SEQ ID NO:9, 10, 11 або 12 щонайменше приблизно на 30, 50, 70, 80 або 95, 98 або навіть 99%. І, нарешті, пропонований у винаході химерний пептид являє собою також похідні описаних вище пропонованих у винаході химерних пептидів, насамперед пропонованих у винаході химерних пептидів, послідовності яких представлені в SEQ ID NO:9, 10, 11 або 12. Даний винахід відноситься також до нуклеотидних послідовностей, які кодують пропоновані у винаході послідовності, інгібуючі JNK, пропоновані у винаході химерні пептиди або їхні фрагменти, варіанти або похідні, як вони визначені вище. Кращу придатну нуклеїнову кислоту, що кодує пропоновану у винаході послідовність, інгібуючу JNK, вибирають із нуклеїнової кислоти людського IB1 (GenBank, реєстраційний № (AF074091), нуклеїнової кислоти щурячого IB1 (GenBank, реєстраційний №. AF 108959) або людського IB2 (GenBank, реєстраційний № AF218778). Нуклеїнові кислоти, які кодують пропоновані у винаході послідовності, інгібуючі JNK, або химерні пептиди можна одержувати за допомогою будь-якого методу, відомого в даній області (наприклад, за допомогою Пцр-ампліфикації з використанням синтетичних праймерів, які гібридизуются з 3'- і 5'-кінцями послідовності, і/або шляхом клонування ДНК або геномної бібліотеки з використанням олігонуклеотидних послідовностей, специфічних для даної генної послідовності). Крім того, представлені в даному описі нуклеотидні послідовності являють собою послідовності, які гібридизуються також у строгих умовах з відповідним ланцюгом, що кодує 14 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 (нативну) пропоновану у винаході послідовність, інгібуючу JNK, або химерний пептид, як вони визначені вище. Переважно зазначені нуклеотидні послідовності містять щонайменше 6 (суміжних) нуклеїнових кислот, які мають довжину, достатню для здійснення специфічної гібридизації. Більш переважно такі нуклеотидні послідовності містять від 6 до 38, ще більш переважно від 6 до 30 і найбільше переважно від 6 до 20 або від 6 до 10 (суміжних) нуклеїнових кислот. «Строгі умови» залежать від послідовності й відрізняються в різних ситуаціях. Як правило, строгі умови можна вибирати з умов, що включають застосування температури приблизно на 5°C більш низькою, чим температура плавлення (tпл) конкретної послідовності при певній іонній силі й значенні p. tпл являє собою температуру (при певній іонній силі й значення p), при якій 50% мішень-мішені-послідовності-мішені гібридизується з повністю сумісним зондом. Як правило, строгі умови являють собою умови, при яких концентрація солі становить щонайменше приблизно 0,02М при pН 7 і температура становить щонайменше приблизно 60°C. Оскільки інші фактори можуть впливати на строгість гібридизації (у тому числі серед інший склад основ і розмір комплементарних ланцюгів), присутність органічних розчинників і рівень помилкового спарювання основ, то комбінація параметрів є більше важливою, чим абсолютний рівень кожного з них. «Дуже строгі умови» можуть являти собою, наприклад, умови, що випливають: стадія 1: утримуючі ДНК фільтри попередньо обробляють протягом проміжку часу від 8 год. до всієї ночі при 65°C у буфері, що містить 6SSC, 50мМ Трис-HCl (p 7,5), 1мМ ЕДТК, 0,02% ПВП, 0,02% Фіколла, 0,02% БСА й 500 мкг/мол денатурованої ДНК сперми лосося. Стадія 2: фільтри гібридизують протягом 48 год. при 65°C у вищевказаній суміші для попередньої гібридизації, у 32 яку додають 100 мг/мол денатурованої ДНК сперми лосося й мічений за допомогою P зонд (56 2010 cpm (імпульси у хвилину)). Стадія 3: Фільтри відмивають протягом 1 год. при 37°C у розчині, що містить 2SSC, 0,01% ПВП, 0,01% Фіколла й 0,01% БСА. Потім здійснюють відмивання в 0,1SSC при 50°C протягом 45 хв. Стадія 4: Фільтри оцінюють за допомогою авторадіографії. Можна використати інші дуже строгі умови, відомі в даній області (див., наприклад, Current Protocols in Molecular Biology, під род. Ausubel і ін., з John Wiley and Sons, NY, 1993; і Kriegler, 1990, Gene Transfer and Expression, a Laboratory Manual, з Stockton Press, NY). «Умови помірної строгості» можуть являти собою наступні умови: стадія 1: утримуючі ДНК фільтри попередньо обробляють протягом 6 год. при 55°C у розчині, що містить 6SSC, 5 розчин Денхардта, 0,5% ДСН і 100 мг/мол денатурованої ДНК сперми лосося. Стадія 2: фільтри гібридизують протягом 18-20 год. при 55°C у такому ж розчині, у якому додають мічений за 32 6 допомогою P зонд (5-2010 cpm). Стадія 3: фільтри відмивають при 37°C протягом 1 год. у розчині, що містить 2SSC, 0,1% ДСН, потім відмивають двічі протягом 30 хв. при 60°C у розчині, що містить 1SSC і 0,1% ДСН. Стадія 4: фільтри промокають досуха й експонують для авторадіографії. Можна використати інші умови помірної строгості, відомі в даній області (див., наприклад, Current Protocols in Molecular Biology, під род. Ausubel і ін., з John Wiley and Sons, NY, 1993; і Kriegler, Gene Transfer and Expression, a Laboratory Manual, з Stockton Press, NY, 1990). І, нарешті, «ослаблені умови» можуть являти собою: стадія 1: утримуючі ДНК фільтри попередньо обробляють протягом 6 год. при 40°C у розчині, що містить 35% формаміда, 5SSC, 50мМ Трис-HCl (p 7,5), 5мМ ЕДТК, 0,1% ПВП, 0,1% Фіколла, 1% БСА й 500 мкг/мол денатурованої ДНК сперми лосося. Стадія 2: фільтри гібридизують протягом 18-20 год. при 40°C у такому ж розчині, у якому додають 0,02% ПВП, 0,02% Фіколла, 0,2% БСА, 100 мкг/мол 32 ДНК сперми лосося, 10% мас./про. сульфату декстрана й мічений за допомогою P зонд (56 2010 cpm). Стадія 3: фільтри відмивають протягом 1,5 год. при 55°C у розчині, що містить 2SSC, 25мМ Трис-HCl (p 7,4), 5мМ ЕДТК і 0,1% ДСН. Розчин для відмивання заміняють свіжим розчином і інкубірують ще протягом 1,5 год. при 60°C. Стадія 4: Фільтри промокають досуха й експонують для авторадіографії. При необхідності фільтри відмивають втретє при 65-68°C і повторно експонують на плівку. Інші ослаблені умови, які можна застосовувати, добре відомі в даній галузі (наприклад, являють собою умови, що застосовують для міжвидової гібридизації) (див., наприклад, Current Protocols in Molecular Biology, під род. Ausubel і ін., з John Wiley and Sons, NY, 1993; і Kriegler, Gene Transfer and Expression, a Laboratory Manual, з Stockton Press, NY, 1990). Нуклеотидні послідовності, пропоновані в даному винаході, можна застосовувати для експресії пропонованих у винаході пептидів, тобто пропонованої у винаході послідовності, інгібуючої JNK, пропонованого у винаході химерного пептиду, з метою аналізу, характеризації й терапевтичного застосування; як маркери для тканин, у яких відповідні (пропоновані у винаході) 15 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 пептиди переважно експресуються (або конститутивно, або на певній стадії диференціювання або розвитку тканини, або в станах захворювання). Інші варіанти застосування нуклеїнових кислот включають наприклад, застосування як маркери молекулярної маси в заснованому на використанні гель-електрофорезу аналізі нуклеїнових кислот. Іншим варіантом здійснення даного винаходу є також експресійні вектори, призначені для рекомбінантної експресії однієї або декількох пропонованих у винаході послідовностей, інгібуючих JNK, і/або химерних пептидів, як вони визначені вище. Поняття «експресійний вектор» у контексті даного опису відноситься або до кільцевої, або лінійної ДНК або РНК, що бути або двохланцюговою, або одноланцюговою. Він містить також щонайменше одну пропоновану у винаході нуклеїнову кислоту для трансформації клітини-хазяїна або одноклітинного або багатоклітинного організму-хазяїна. Пропонований у винаході експресійний вектор переважно містить пропоновану у винаході нуклеїнову кислоту, що кодує пропоновану у винаході послідовність, інгібуючу JNK, або її фрагмент або варіант або пропонований у винаході химерний пептид або його фрагмент або варіант. Крім того, експресійний вектор, пропонований у даному винаході, переважно містить відповідні елементи, призначені для підтримки експресії, включаючи різні регуляторні елементи, такі як енхансери/промотори вірусів, бактерій, рослин, ссавців і інших еукаріотичних організмів, які забезпечують експресію що вбудовує полінуклеотиди клітині-хазяїні, такі як ізолятори, що зв'язують елементи, LCR (наприклад, описані в Blackwood і Kadonaga, Science 281, 1988, сс. 61-63) або області прикріплення до матриці/носію (наприклад, описані в Li, Harju і Peterson, Trends Genet. 15, 1999, сс. 403-408). У деяких варіантах здійснення винаходу регуляторні елементи є гетерологічними (тобто ненативний промотор гена). В інших варіантах необхідні сигнали транскрипції й трансляції можуть забезпечуватися нативним для генів і/або фланкуючих ділянок промотором. Поняття «промотор» у контексті даного опису відноситься до області ДНК, функціями якої є контроль транскрипції однієї або декількох пропонованих у винаході нуклеотидних послідовностей, що структурно ідентифікують по присутності сайту зв'язування ДНК-залежної РНК-полімерази й інших послідовностей ДНК, які пов'язані з регуляторною промоторною функцією. Функціональний посилюючий експресію фрагмент промотору являє собою вкорочену або процесовану промоторну послідовність, що зберігає активність як промотор. Активність промотору можна оцінювати за допомогою будь-якого аналізу, відомого в даній області (див., наприклад, Wood, de Wet, Dewji і DeLuca, Biochem Biophys. Res. Commun. 124, 1984, сс. 592596; Seliger і McElroy, Arch. Biochem. Biophys. 88, 1960, сс. 136-141) або набору, що надходить у @ продаж за назвою Promega ). Поняття «енхансерна ділянка» у контексті даного опису відносно пропонованого у винаході експресійного вектора, як правило, відноситься до області ДНК, функцією якої є підвищення транскрипції одного або декількох генів. Більш конкретне поняття «енхансер» у контексті даного опису означає регуляторний елемент ДНК, що підсилює, збільшує, удосконалює або поліпшує експресію гена поза залежністю від його локалізації й орієнтації щодо гена, що підлягає експресії, і який може підсилювати, збільшувати, удосконалювати або поліпшувати експресію більш ніж одного промотору. У якості промоторних/енхансерних послідовностей, як вони визначені вище відносно пропонованого у винаході експресійного вектора, можна застосовувати регуляторні послідовності рослин, тварин, комах або грибів. Наприклад, можна використати промоторні/енхансерні елементи із дріжджів і інших грибів (наприклад, промотор GAL4, промотор алкоголь-дегідрогенази, промотор фосфогліцеринкінази, промотор лужний фосфататази). В іншому або додатковому варіанті вони можуть включати контролюючу транскрипцію ділянки тваринного походження, наприклад, (I) контролюючу область гена інсуліну з панкреатичних ?-клітин (див., наприклад, Hanahan, і ін., Nature 315, 1985, сс. 115-122); (II) контролюючу область гена імуноглобуліну, активну в лимфоїдних клітинах (див., наприклад, Grosschedl, і ін., Cell 38, 1984, сс. 647-658); (III) контролюючу область гена альбуміну, активну в печінці (див., наприклад, Pinckert, і ін.,. Genes and Dev 1, 1987, сс. 268-276; (IV) контролюючу область гена основного білка мієліну, активну в олігодендроцитах головного мозку (див., наприклад, Readhead, і ін., 1 Cell 48, 1987, сс. 703-712); і (V) контролюючу область гена гонадотропин-рилізинг гормону, активну в гіпоталамусі (див., наприклад, Mason, і ін., Science 234, 1986, сс. 1372-1378) і т.п. Крім того, пропонований у винаході експресійний вектор може містити маркер ампліфікації. Зазначений маркер ампліфікації можна вибирати із групи, що включає, наприклад, аденозиндеамінузу (ADA), дигідрофолатредуктазу (DHFR), ген, що обумовлює стійкість до багатьох ліків (MDR), орнітіндекарбоксилазу (ODC) і ген, що обумовлює стійкість до N(фосфонацетил)-L-аспартату (CAD). Ампліфікація генів, що кодують вищевказані білки, тобто, 16 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 білки, що представляють інтерес (ПІБ), і/або злитого білка, пропонованого у винаході, дозволяє підвищувати рівень експресії цих білків при інтеграції вектора в клітину (Kaufman і ін., Mol. Cell Biol. 5, 1985, сс. 1750-1759). Прикладами експресійних векторів або їхніх похідних, які можна застосовувати в даному винаході, є, зокрема, наприклад, віруси людини або тварин (наприклад, вірус коров'ячої віспи або аденовірус); віруси комах (наприклад, бакуловіруси); вектори на основі дріжджів; вектори на основі бактеріофагів (наприклад, фага лямбда); плазмідні вектори й космідні вектори. У даному винаході запропоновані також різні системи хазяїн-вектор, які можна застосовувати для експресії пропонованих у винаході нуклеїнових кислот, які кодують послідовності пептидів, як вони визначені вище. До них відносяться (але, не обмежуючись ними): (I) системи на основі клітин ссавців, які заражають вірусом коров'ячої віспи, аденовірусом і т.п.; (II) системи на основі клітин комах, заражених бакуловірусом і т.п.; (III) дріжджі, що містять вектори на основі дріжджів, або (IV) бактерії, трансформовані бактеріофагом, ДНК, плазмідної ДНК або космідної ДНК. Залежно від застосовуваної системи хазяїн-вектор можна використати будь-які із численних придатних транскрипційних і трансляційних елементів. Переважно можна вибирати лінію клітин-хазяїв, придатну для такої системи хазяїн-вектор, що модулює експресію убудованих послідовностей, що представляють інтерес, або модифікує або процесує експресовані пептиди, кодовані послідовностями, конкретним необхідним чином. Крім того, експресію в обраної лінії-хазяїні під контролем певних промоторів можна підсилювати в присутності певних індукторів; полегшуючи тим самим контроль експресії створеного за допомогою генної інженерії пептиду. Крім того, у різних клітинах-хазяїнах експресуємий пептид може піддаватися характерним і специфічним механізмам трансляційного й посттрансляційного процесингу й модифікації (наприклад, глікозилюванню, фосфорилюванню й т.п.). Таким чином, можна вибирати відповідні лінії клітин або систем хазяїв для гарантії досягнення необхідної модифікації й процесінгу чужорідного пептиду. Наприклад, експресію пептиду в бактеріальній системі можна використати для одержання неглікозильованого корового пептиду; у той час як експресія в клітинах ссавців забезпечує «нативне» глікозилювання гетерологічного пептиду. Даний винахід відноситься також до антитіл до пропонованих у винаході послідовностям, інгібуючим JNK, і/або пропонованим у винаході химерним пептидам. Крім того, запропоновані ефективні способи одержання антитіл, специфічних відносно послідовностей, інгібуючих JNK, пропонованих у даному винаході, або пропонованих у винаході химерних пептидів, які містять таку інгібуючу послідовність. Відповідно до винаходу послідовності, інгібуючі JNK, і/або пропоновані у винаході химерні пептиди, а також їхні фрагменти, варіанти або похідні можна використати в якості імуногенов для виробництва антитіл, які імуноспецифічно зв'язуються із зазначеними пептидними компонентами. Такі антитіла включають, наприклад, поліклональні, моноклональні, химерні, одноланцюгові антитіла, Fab-фрагменти й експресійні бібліотеки Fab-фрагментів. Конкретним варіантом здійснення даного винаходу є антитіла до пропонованих у винаході химерних пептидів або до послідовностей, інгібуючих JNK, як вони визначені вище. У даній області відомі різні методики, які можна застосовувати для одержання зазначених пропонованих у винаході антитіл. Наприклад, різних тварин-хазяїв можна імунізувати для одержання поліклональних антитіл шляхом ін'єкції будь-якого пропонованого у винаході химерного пептиду або послідовності, інгібуючої JNK, як вони визначені вище. При цьому в терапії можна використати різні ад’юванти, підвищуючи тим самим імунологічну відповідь, до яких відносяться (але, не обмежуючись ними) ад’ювант Фрейнда (повні й неповний), мінеральні гелі (наприклад, гідроксид алюмінію), поверхнево-активні речовини (наприклад, лізолецитин, плюронові поліоли, поліаніони, пептиди, масляні емульсії, динітрофенол і т.д.), Cp, полімери, Плюроники й застосовувані для людини ад’юванти, такі як бацила Кальмета-Герена й Corynebacterium parvum. Для одержання моноклональних антитіл до пропонованого у винаході химерного пептиду або послідовності, інгібуючої JNK, як вони визначені вище, можна використати будь-які методики, які забезпечують одержання молекул антитіл у безперервній культурі клітинної лінії. Такі методики являють собою (але, не обмежуючись ними) метод на основі гібридом (див., Kohler і Milstein, Nature 256, 1975, сс. 495-497); метод на основі триом; метод на основі Bклітинних гібридом (див., Kozbor і ін., Immunol Today 4, 1983, с. 72) і метод на основі EBV- (вірус Епштейна-Барра)-гібридоми, які призначені для одержання людських моноклональних антитіл (див. Cole і ін., 1985. В: Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., сс. 77-96). Людські моноклональні антитіла можна застосовувати для втілення на практиці даного винаходу і їх можна одержувати за допомогою людських гібридом (див., Cote, і ін., Proc Natl 17 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 Acad Sci USA 80, 1983, сс. 2026-2030) або шляхом трансформації людських B-клітин вірусом Епштейна-Барра in vitro (див., Cole, і ін., Monoclonal Antibodies and Cancer Therapy, з Alan R. Liss, Inc. 1985, сс. 77-96). Відповідно до винаходу методики можна адаптувати для одержання одноланцюгових антитіл, специфічних у відношенні пропонованих у винаході послідовностей, інгібуючих JNK, і/або пропонованих у винаході химерних пептидів (див., наприклад, U. S. 4946778). Крім того, можна адаптувати методи конструювання експресійних бібліотек Fab-фрагментів (див., наприклад, Huse і ін., Science 246, 1989, сс. 1275-1281), що дозволяють швидко й ефективно ідентифікувати моноклональні Fab-фрагменти з необхідною специфічністю у відношенні зазначених пропонованих у винаході послідовностей, інгібуючих JNK, і/або пропонованих у винаході химерних пептидів, як вони визначені вище. Антитіла з організмів крім людини можна «гуманізувати» за допомогою методик, добре відомих у даній галузі (див., наприклад, U. S. 5225539). Фрагменти антитіл, що містять ідіотипи до послідовностей, інгібуючих JNK, і/або пропонованому у винаході химерному пептиду, які можна одержувати за допомогою відомих методик, включають, наприклад, (I) F(ab') 2-фрагмент, одержуваний шляхом розщеплення пепсином молекули антитіла; (II) Fab-фрагмент, створюваний відновленням пептидних містків F(ab')2(III) Fab-фрагмент, створюваний обробкою молекули антитіла папаїном і фрагмента; відновлювачем, і (IV) Fv-фрагменти. В одному з варіантів здійснення даного винаходу використовують методи скринінгу пропонованих у винаході антитіл, що володіють необхідною специфічністю, до яких відносяться (але, не обмежуючись ними) твердофазний імуноферментний аналіз (ELISA) і інші імунологічні аналізи, відомі в даній області. У конкретному варіанті здійснення винаходу селекція антитіл, специфічних у відношенні конкретного епітопу пропонованої у винаході послідовності, інгібуючої JNK, і/або пропонованого у винаході химерного пептиду (наприклад, їхнього фрагмента, що складає, як правило, з 5-20, переважно 8-18, і найбільше переважно 8-11 амінокислот), полегшується створенням гібридом, які зв'язуються із фрагментом пропонованої у винаході послідовності, інгібуючої JNK, і/або пропонованого у винаході химерного пептиду, які несуть зазначений епітоп. Під обсяг винаходу підпадають також зазначені антитіла, специфічні у відношенні епітопа, як вони описані вище. Пропоновані у винаході антитіла можна застосовувати в методах, відомих у даній області, для локалізації й кількісної оцінки пропонованої у винаході послідовності, інгібуючої JNK (і/або відповідно химерного пептиду, пропонованого у винаході), наприклад, для оцінки рівнів пептиду у відповідних фізіологічних зразках, для застосування в діагностичних методах або для застосування для візуалізації пептиду й т.п. Пропоновані у винаході послідовності, інгібуючі JNK, химерні пептиди й/або нуклеїнові кислоти, пропоновані у винаході, можна наготовлювати у вигляді фармацевтичних композицій, які також підпадають під обсяг винаходу. Ці композиції можуть містити крім однієї із зазначених субстанцій фармацевтично прийнятний ексципієнт, носій, буфер, стабілізатор або інші матеріали, добре відомі фахівцям у даній області. Такі матеріали повинні бути нетоксичними й не повинні впливати на ефективність діючої речовини. Точна природа носія або іншого матеріалу може залежати від шляху введення, наприклад, орального, внутрішньовенного, шкірного або підшкірного, назального, внутрім'язового, внутрішньоочеревинного шляху або нанесення за допомогою бляшки. Фармацевтичні композиції для орального введення можуть мати форму таблетки, капсули, порошку або рідини. Таблетка може включати твердий носій, такий як желатин або ад’ювант. Рідкі фармацевтичні композиції, як правило, включають рідкий носій, такий як вода, вазелін, тваринні або рослинні масла, мінеральне масло або синтетичне масло. У їхній склад можуть входити фізіологічний соляний розчин, декстроза або інший розчин сахариду або гліколі, такі як етиленгліколь, пропіленгліколь або поліетиленгліколь. Для внутрішньовенної, шкірної або підшкірної ін'єкції або ін'єкції в ділянку поразки діюча речовина повинна перебувати у формі прийнятного для парентерального введення водного розчину, що не містить пирогени й має прийнятні значення рН, ізотонічність і стабільність. Фахівці в даній області легко можуть наготовлювати прийнятні розчини з використанням, наприклад, ізотонічних наповнювачів, таких як хлорид натрію для ін'єкцій, розчин Рінгера для ін'єкцій, лактирований розчин Рінгера для ін'єкцій. При необхідності можна включати консерванти, стабілізатори, буфери, антиоксиданти й/або інші добавки. Поза залежністю від того, чи застосовують поліпептид, пептид або молекулу нуклеїнової кислоти, іншу фармацевтично придатну сполуку, пропоновану в даному винаході, що вводять індивідуумові, введення переважно здійснювати в «профілактично ефективній кількості» або в «терапевтично ефективній кількості» (у якості одного з можливих варіантів), що є достатнім для надання 18 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 сприятливої дії на індивідуума. Фактично вводити кількість, у якій швидкість і тимчасові особливості введення повинні залежати від природи й серйозності стану, що підлягає лікуванню. Рішення про схему лікування, наприклад, що стосується доз і т.д., перебуває в компетенції звичайних практикуючих лікарів і інших лікарів і, як правило, ураховує порушення, суть лікування, стан кожного пацієнта, місце введення й метод введення йінші фактори, відомі практикуючим фахівцям у даній області. Приклади методів і згаданих протоколів наведені в довіднику Remington's Pharmaceutical Sciences, 16-ої изд., під род. Osol A., 1980. В іншому варіанті прицільну терапію можна використати для введення пропонованих у винаході послідовностей, інгібуючих JNK, химерних пептидів і нуклеїнових кислот, пропонованих у винаході, більш специфічно в певний тип клітин за допомогою систем, що забезпечують спрямований перенос, таких як антитіло (проти клітинки-мішені) або специфічні для клітини ліганди. Антитіла проти клітинки-мішені, як правило, є специфічними для поверхневих клітинних білків клітин, асоційованих з кожним із зазначених нижче захворювань. Наприклад, ці антитіла можуть являти собою антитіла проти антитіл клітинної поверхні, таких, наприклад, як асоційовані з поверхнею B-клітин білки, такі як білок DR ГКГ класу II, CD18 (беталанцюг LFA-1), CD45RO, CD40 або Bgp95, або білків клітинної поверхні, обраних, наприклад, з CD2, CD2, CD4, CD5, CD7, CD8, CD9, CD10, CD13, CD16, CD19, CD20, CD21, CD22, CD23, CD24, CD25, CD30, CD33, CD34, CD38, CD39, CD4, CD43, CD45, CD52, CD56, CD68, CD71, CD138 і т.д. Що забезпечують спрямований перенос конструкції, як правило, можна одержувати шляхом ковалентного зв'язування пропонованих у винаході послідовностей, інгібуючих JNK, химерних пептидів і нуклеїнових кислот з антитілом, специфічним для білка клітинної поверхні, або шляхом зв'язування зі специфічним для клітини лігандом. Білки, наприклад, можна зв'язувати з таким антитілом або приєднувати до нього за допомогою пептидного зв'язку або шляхом хімічного сполучення, перехресного зшивання й т.д. Потім можна здійснювати прицільну терапію шляхом введення пацієнтові конструкції, що забезпечує спрямований перенос, у фармацевтично ефективній кількості за допомогою зазначених нижче шляхів введення, наприклад, внутрішньоочеревинного, назального, внутрішньовенного, орального, або за допомогою бляшок. Переважно пропоновані у винаході послідовності, інгібуючі JNK, химерні пептиди або нуклеїнові кислоти, пропоновані у винаході, приєднані до антитіл проти клітинокмішеней або специфічним для клітин лігандам, як вони визначені вище, можна вивільняти in vitro або in vivo, наприклад, у результаті гідролізу ковалентного зв'язку, під дією пептидаз або за допомогою будь-якого іншого прийнятного методу. В іншому варіанті, якщо послідовності, інгібуючі JNK, химерні пептиди або нуклеїнові кислоти, пропоновані у винаході, приєднують до невеликого специфічного для клітини ліганду, то можна не здійснювати вивільнення ліганда. При знаходженні на клітинній поверхні пропоновані у винаході химерні пептиди можуть проникати в клітину завдяки активності вхідної в їхній склад транспортуючої послідовності. Спрямований перенос може вимагатися по різних причинах; наприклад, якщо пропоновані у винаході послідовності, інгібуючі JNK, химерні пептиди й нуклеїнові кислоти, пропоновані у винаході, мають неприйнятну токсичність, або якщо існують інші показання до застосування занадто високої дози. Замість безпосереднього введення пропонованих у винаході послідовностей, інгібуючих JNK, і/або химерних пептидів, пропонованих у винаході, їх можна одержувати в клітинкахмішенях шляхом експресії гена, що кодує, інтродукованого в клітини, наприклад, шляхом введення вірусного вектора. Вірусний вектор, як правило, кодує пропоновані у винаході послідовності, інгібуючі JNK, і/або химерні пептиди, пропоновані у винаході. Можна забезпечувати спрямований перенос вектора до специфічних клітин, що підлягають лікуванню. Крім того, вектор може містити регуляторні елементи, які «включаються» більш-менш вибірково клітинками-мішенями при певній регуляції. Ця методика є варіантом VDEPT-методу (virusdirected enzyme prodrug therapy) (опосередковувана вірусом терапія з використанням проліків на основі ферменту), у якій застосовують зрілі білки замість їхніх попередників. В іншому варіанті пропоновані у винаході послідовності, інгібуючі JNK, і/або химерні пептиди можна вводити у формі попередників за допомогою антитіла або вірусу. Пропоновані у винаході послідовності, інгібуючі JNK, і/або химерні пептиди можна потім перетворювати в активну форму за допомогою агента, що активує, що продукується в клітинах, що підлягають лікуванню, або переноситься до них. Такий тип лікування іноді називають ADEPT (antibody-directed enzyme prodrug therapy) (опосередковувана антитілом терапія з використанням проліків на основі ферменту) або VDEPT (опосередковувана вірусом терапія з використанням проліків на основі ферменту); у першому випадку забезпечують спрямований перенос агента, що активує, у клітини шляхом кон'югації зі специфічним для клітини антитілом, а в останньому випадку 19 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержують агент, що активує, наприклад, послідовність, інгібуючу JNK, або химерний пептид, у векторі шляхом експресії що кодує ДНК у вірусному векторі (див., наприклад, EP-A-415731 і WO 90/07936). Даний винахід відноситься також до застосування пропонованих у винаході послідовностей, інгібуючих JNK, пропонованих у винаході химерних пептидів і/або пропонованих у винаході нуклеотидних послідовностей для готування фармацевтичних композицій, наприклад, як вони визначені вище, призначених для попередження й/або лікування пов'язаних із проліферацією клітин порушень, асоційованих з активацією JNK в індивідуума («асоційоване з JNK порушення»). Як правило, така фармацевтична композиція, застосовувана згідно із даним винаходом, містить як активний компонент, наприклад: (I) кожну(і) одну або декілька пропоновану(их) у винаході послідовність(ей), інгібуючу(их) JNK, і/або пропоновані у винаході химерні пептиди й/або їхні варіанти, фрагменти або похідні; і/або (II) нуклеїнові кислоти, що кодують пропоновану у винаході послідовність, інгібуючу JNK, і/або пропонований у винаході химерний пептид і/або їхні варіанти або фрагменти, і/або (III) клітини, що містять кожну(і) одну або декілька пропоновану(і) у винаході послідовність(їй), інгібуючу(їх) JNK, і/або пропоновані у винаході химерні пептиди й/або їхні варіанти, фрагменти або похідні, і/або (IV) клітини, трансфектовані вектором і/або нуклеїновими кислотами, які кодують пропоновану у винаході послідовність, інгібуючу JNK, і/або пропонований у винаході химерний пептид і/або їхні варіанти або фрагменти. Попередження й/або лікування згідно із даним винаходом, як правило, передбачає введення пропонованої у винаході фармацевтичної композиції, як вона визначена вище. Поняття «модулювати» відноситься до придушення експресії JNK у випадку її надеспресії. Воно відноситься також до придушення фосфорилювання c-jun, ATF2 або NFAT4, наприклад, за допомогою пептиду, представленого в будь-якій одній або в декількох SEQ ID NO:1-4 і/або 9-12, як конкурентний інгібітор сайтів, що зустрічаються в природних умовах у клітині, зв'язування cjun, ATF2 і NFAT4. Поняття «модулювати» відноситься також до придушення гетеро- і гомомерних комплексів факторів транскрипції c-jun, ATF2 або NFAT4 і родинних партнерів, таких, наприклад, як AP-1-комплекс, що включає c-jun, AFT2 і c-fos. Коли пов'язане із проліферацією клітин захворювання асоційоване зі надекспресією JNK, такі супресорні послідовності, інгібуючі JNK, можна інтродукувати у клітину. У деяких випадках поняття «модулювати» може включати підвищення рівня експресії JNK, наприклад, при використанні специфічного для IB-пептиду антитіла, що блокує зв'язування IB-пептиду з JNK, попереджаючи тим самим інгібування JNK родинним IB пептидом. Профілактику й/або лікування індивідуума за допомогою пропонованої у винаході фармацевтичної композиції, як вона описана вище, можна, як правило, здійснювати шляхом введення (in vivo) індивідуумові фармацевтичної композиції в певній («терапевтично ефективному») кількості, де індивідуум може являти собою, наприклад, будь-якого ссавця, наприклад, людину, примата, мишу, пацюка, собаку, кішку, корову, коня або свиню. Поняття «терапевтично ефективний» означає, що кількість активного компонента фармацевтичної композиції є достатньою для полегшення асоційованого з JNK порушення. Поняття «пов'язане із проліферацією клітин порушення» або «асоційоване з JNK порушення» у контексті даного опису, як правило, означає популяції злоякісних, а також доброякісних клітин in vivo і in vitro, які часто відрізняються морфологічно й функціонально від клітин навколишньої тканини і які, як правило, характеризуються аномальними рівнями JNK. Поняття «аномальний рівень JNK» має на увазі підвищений або знижений рівень JNK у якійнебудь області індивідуума, що підлягає лікуванню, щодо рівня, що присутній в аналогічній неураженій області організму пацієнта, у якого відсутнє порушення. Наприклад, пропоновані у винаході фармацевтичні композиції можна застосовувати для попередження й/або лікування злоякісних захворювань систем різних органів, у яких часто виявляється активація JNK, наприклад, легені, молочної залози, лімфатичної системи, шлунково-кишкового тракту й сечостатевого шляху, а також аденокарцином, включаючи злоякісні, такі як більшість видів рака ободочної кишки, нирково-клітинна карцинома, рак передміхурової залози, недрібноклітинний рак легені, рак тонкого кишечнику й рак стравоходу. Порушення включають також лейкози, захворювання або патофізіологічні стани, асоційовані з онкогенною трансформацією, а також види раку, пов'язані з онкогенною трансформацією BcrAbl, для чого точно потрібна активація JNK. Пропоновані у винаході фармацевтичні композиції можна застосовувати також для попередження й/або лікування доброякісних або імунологічних пов'язаних із проліферацією клітин захворювань, таких як псоріаз, звичайна пузирчатка, синдром Бехчета, гострий респіраторний дистресс-синдром (ARDS), ішемічне захворювання серця, синдром, пов'язаний зі 20 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 станом після діалізу, ревматоїдний артрит, синдром набутого імунодефіциту, васкулит, септичний шок і інші типи гострого запалення й ліпідний гистоцитоз. Найбільш кращими є імунопатологічні порушення. По суті, будь-яке порушення, що по етиології пов'язане з кіназною активністю JNK, розглядається як чутливе до попередження або лікування, наприклад, порушення або патофізіологічні стани, асоційовані з активацією JNK у клітині або клітинах, як зазначено вище, наприклад, рестеноз, втрата слуху, вушна травма, ішемія, «удар», і/або порушення або патофізіологічні стани, асоційовані з дозріванням і диференціюванням імуноцитів, ушкодження, пов'язані з реперфузією, гіпоксія, пов'язані з апоптозом захворювання (наприклад, що зустрічаються при вірусних інфекціях (наприклад, СНІД), аутоімунні захворювання, нейродегенеративні порушення (наприклад, «удар», травма головного мозку, ушкодження спинного мозку, аміотрофічний бічний склероз (ALS), хвороба Гентінгтона, хвороба Альцгеймера й хвороба Паркінсона), серцево-судинне захворювання, остеопороз і старіння), відповідь на стимули, що викликають стрес, і вторинні ефекти, пов'язані з лікуванням, наприклад, прозапальними цитокінами. Пропоновані у винаході фармацевтичні композиції можна застосовувати також для лікування або попередження впливів, пов'язаних з діабетом або стресом, що порушує клітини, наприклад, при патологічних станах, індукованих артеріальною гіпертензією, включаючи серцеву гіпертрофію й пов'язані з артеріосклерозом ушкодження, і при біфуракції кровоносних судин і т.п., пов'язаних з іонізуючою радіацією, застосовуваної при променевій терапії, ультрафіолетовим світлом (Уф-світло), зв'язаних з вільними радикалами, агентами, що ушкоджують ДНК, включаючи хіміотерапевтичні лікарські засоби, пов'язані з ушкодженнями при ішемії/реперфузії, пов'язані з гіпоксією; і/або гіпо- й гіпертермією. І, нарешті, відносно вищевказаних захворювань, порушень або патофізіологічних станів пропоновану у винаході фармацевтичну композицію можна застосовувати для інгібування експресії генів, експресія яких підвищується в присутності активного поліпептиду JNK. Ці гени й генні продукти, як правило, включають, наприклад, прозапальні цитокіни. Зазначені цитокіни виявлені при всіх формах запальних, аутогенних запальних, імунних і аутоімунних захворювань, дегенеративних захворювань, при міопатіях, кардіоміопатиях і відторгненні трансплантата. Пропоновані у винаході послідовності, інгібуючі JNK, пропоновані у винаході химерні пептиди або пропоновані у винаході нуклеотидні послідовності можна застосовувати також у будь-якій ситуації, при якій потрібно інгібування активності JNK, оскільки JNK і всі їх ізоформи беруть участь у розвитку й створенні патологічних станів, або в їхньому шляху. Таке застосування може включати використання in vitro, ex vivo і in vivo. Таким чином, пропоновані у винаході нуклеїнові кислоти, як вони визначені вище, можна застосовувати в конкретних варіантах здійснення даного винаходу для модуляції активованих JNK шляхів передачі сигналів з використанням генної терапії, переважно для лікування одного зі станів, захворювань і/або порушень, як вони визначені вище. У цьому контексті поняття «генна терапія» відноситься до терапії, що здійснюють шляхом введення індивідуумові специфічної пропонованої у винаході нуклеїнової кислоти, наприклад, у вигляді фармацевтичної композиції, як вона визначена вище, де пропонована(і) у винаході нуклеїнова(і) кислота(и) кодує(ють) винятково L-амінокислоти. У цьому варіанті здійснення даного винаходу нуклеїнова кислота продукує кодуємий(і) пептид(и), що(які) потім служить(ат) для прояву терапевтичної дії шляхом модуляції функції захворювання або порушення. Кожний зі стосовних до генної терапії методів, доступних у даній області, можна застосовувати для втілення на практиці даного винаходу (див., наприклад, Goldspiel і ін., Clin Pharm 12, 1993, сс. 488-505). У кращому варіанті здійснення винаходу пропонована у винаході нуклеїнова кислота, що застосовують для генної терапії, є частиною експресійного вектора, що експресує один або декілька пропонованих у винаході родинних IB-пептидів, тобто пропоновану у винаході послідовність, інгібуючу JNK, і/або пропонований у винаході химерний пептид або їхні фрагменти або похідні, у прийнятному хазяїні. У конкретному варіанті здійснення винаходу зазначений експресійний вектор несе промотор, функціонально пов'язаний із що кодує(мими) областю(ями) послідовності, інгібуючої JNK. Промотор може являти собою зазначений вище промотор, наприклад, індуцибельний або конститутивний промотор, і необов'язково тканеспецифічний промотор. В іншому конкретному варіанті здійснення винаходу для генної терапії використовують пропоновану у винаході молекулу нуклеїнової кислоти, у якій послідовності, що кодують, пропонованої у винаході молекули нуклеїнової кислоти (і будь-яких інших необхідних її послідовностей) фланковані областями, які підсилюють гомологічну рекомбінацію в необхідному сайті в геномі, що потрібно для внутрішньохромосомної експресії нуклеїнових кислот (див., наприклад, Koller і Smithies, Proc Natl Acad Sci USA 86, 1989, сс. 8932-8935). Введення пропонованої у винаході нуклеїнової кислоти пацієнтові при застосуванні генної 21 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 терапії може бути або безпосереднім (тобто пацієнта безпосередньо обробляють нуклеїнової кислотою або вектором, що містить нуклеїнову кислоту), або непрямим (тобто клітини спочатку трансформують нуклеїновою кислотою in vitro, потім трансплантують пацієнтові). Ці два підходи називають відповідно як генна терапія in vivo або ex vivo. У конкретному варіанті здійснення даного винаходу нуклеїнову кислоту вводять безпосередньо in vivo, після чого відбувається її експресія з утворенням кодованого продукту. Для цієї мети можна використати кожний із численних методів, відомих у даній галузі, у тому числі, наприклад, конструювання нуклеїнової кислоти у вигляді частини відповідного експресійного вектора нуклеїнової кислоти й введення його так, щоб він став внутрішньоклітинним (наприклад, шляхом зараження з використанням дефектного або ослабленого ретровірусного або іншого вірусного вектора; див., U. S. 4980286); безпосередню ін'єкцію «оголеної» ДНК; застосування бомбардування мікрочастинками (наприклад, «GeneGun» (генна гармата); Biolistic, фірма DuPont); нанесення нуклеїнових кислот за допомогою ліпідів; застосування асоційованих із клітинною поверхнею рецепторів/трансфектуючих агентів; капсулювання в ліпосомах, мікрочастинках або мікрокапсулах; введення разом з пептидом, для якого відомо, що він має здатність проникати в ядро; або їхнє введення разом з лігандом, схильним до опосередковуваного рецептором ендоцитозу (див., наприклад, Wu і Wu, J Biol Chem, 262, 1987, сс. 4429-4432), якому можна застосовувати для «мічення» клітинний типів, які специфічно експресують рецептори, що представляють інтерес, і т.д. Інший підхід генної терапії, який можна застосовувати для втілення на практиці даного винаходу, включає перенос гена в клітини in vitro у культурі тканини за допомогою таких методів, як електропорація, ліпофекція, опосередковувана фосфатом кальцію трансфекція, вірусне зараження або т.п. Як правило, метод перенос включає супутній перенос у клітини селектуємого маркера. Потім клітини поміщають під тиск добору (наприклад, такого фактора, як стійкість до антибіотиків) так, щоб полегшувати виділення клітин, які одержали й експресують перенесений ген. Потім ці клітини вводять пацієнтові. У конкретному варіанті здійснення винаходу перед введенням in vivo отриманої рекомбінантної клітини нуклеїнову кислоту інтродукують у клітину за допомогою будь-якого методу, відомого в даній області, включаючи, наприклад, трансфекцію, електропорацію, мікроін'єкцію, зараження вірусним вектором або вектором на основі бактеріофага, що містить нуклеотидні послідовності, що представляють інтерес, злиття клітин, опосередковуваний хромосомою перенос гена, опосередковуваний мікрокоміркою перенос гена, злиття сферопластів і аналогічні методи, які гарантують, що при переносі не буде порушено розвиток і фізіологічні функції клітин-реципієнтів (див., наприклад, Loeffler і Behr, Meth Enzymol, 217, 1993, сс. 599-618). Обрана методика повинна забезпечувати стабільний перенос нуклеїнової кислоти в клітину, такий, щоб при цьому нуклеїнова кислота експресувалася клітиною. Переважно перенесена нуклеїнова кислота передається нащадкам й може експресуватися в потомстві клітини. В кращих варіантах здійснення даного винаходу що утворилися рекомбінантні клітини можна вводити пацієнтові за допомогою різних методів, відомих у даній галузі, включаючи, наприклад, ін'єкцію епітеліальних клітин (наприклад, підшкірно), обробку пацієнта рекомбінантними шкірними клітинами як шкірний трансплантат і внутрішньовенна ін'єкція рекомбінантних клітин крові (наприклад, гематопоетичних стовбурних клітин або клітинпопередників). Загальна кількість клітин, яку варто застосовувати, залежить від необхідної дії, стану пацієнта й т.п. і його може визначати фахівець у даній галузі. Клітини, у які можна інтродукувати нуклеїнову кислоту при здійсненні генної терапії, відносяться до будь-якого необхідного доступного типу клітин, і вони можуть бути ксеногенними, гетерогенними, сингенними або автогенними. Типи клітин включають (але, не обмежуючись ними) диференційовані клітини, такі як епітеліальні клітини, ендотеліальні клітини, кератиноцити, фібробласти, м'язові клітини, гепатоцити й кров'яні клітини, або різні стовбурні клітини або клітини-попередники, зокрема, ембріональні клітини серцевого м'яза, стовбурні клітини печінки (опублікована міжнародна заявка на патент WO 94/08598), нервові стовбурні клітини (Stemple і Anderson, Cell 71, 1992, сс. 973-985), гематопоетичні стовбурні клітини або клітинипопередники, наприклад, одержувані з кісткового мозку, клітини крові пуповини, периферичної крові, печінки ембріона й т.п. У кращому варіанті здійснення винаходи застосовувані для генної терапії клітини є аутологічними для пацієнта. Відповідно до іншого варіанта здійснення винаходу пропоновані у винаході послідовності, інгібуючі JNK, пропоновані у винаході химерні пептиди, пропоновані у винаході нуклеотидні послідовності або антитіла до пропонованих у винаході послідовностей, інгібуючим JNK, або до пропонованого у винаході химерним пептидам можна застосовувати для аналізів (in vitro) (наприклад, імуноаналізів) для виявлення, прогнозування, діагностики або моніторингу 22 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 зазначених вище різних станів, захворювань і/або порушень або моніторингу їхнього лікування. Імуноаналіз можна здійснювати за допомогою методу, що передбачає контакт зразка, отриманого з організму пацієнта, з антитілом до пропонованої у винаході послідовності, інгібуючої JNK, пропонованому у винаході химерному пептиду або пропонованої у винаході нуклеотидної послідовності в умовах, при яких може відбуватися імуноспецифічне зв'язування, і наступне виявлення або оцінку кількості будь-якого що характеризується імуноспецифічним зв'язуванням антитіла. У конкретному варіанті здійснення винаходу антитіло, специфічне у відношенні пропонованої у винаході послідовності, інгібуючої JNK, пропонованого у винаході химерного пептиду або пропонованої у винаході нуклеотидної послідовності, можна застосовувати для аналізу зразка тканини або сироватки з організму пацієнта відносно присутності JNK або послідовності, інгібуючої JNK; при цьому аномальний рівень JNK свідчить про наявність хворобливого стану. Імуноаналізи, які можна використати, включають (але, не обмежуючись ними) конкурентні або неконкурентні системи аналізів, засновані на застосуванні таких методик, як Вестерн-блотинг, радіоімуноаналізи (РІА), твердофазний імуноферментний аналіз (ELISA), «сендвич»-імуноаналізи, аналізи на основі імунопреципитації, реакції з використанням преципитину, реакції, засновані на дифузії преципитину в гелі, аналізи імунодифузії, аналізи аглютинації, флуоресцентні імуноаналізи, аналізи фіксації комплементу, імунорадіометричні аналізи й імуноаналізи на білку й т.д. В альтернативному варіанті можна здійснювати аналізи (in vitro) шляхом введення пропонованих у винаході послідовностей, інгібуючих JNK, пропонованих у винаході химерних поліпептидів, пропонованих у винаході нуклеотидних послідовностей або антитіл до пропонованим у винаході послідовностям, інгібуючим JNK, або пропонованим у винаході химерним пептидам у клітини-мішені які, як правило, вибирають, наприклад, з культивованих клітин тварин, людських клітин або мікроорганізмів, і оцінюючи відповідь клітини за допомогою біофізичних методів, як правило, відомих фахівцям у даній області. Клітини-мішені які звичайно застосовують для цієї мети, можуть являти собою культивовані клітини (in vitro) або клітини in vivo, тобто клітини, з яких складаються органи або тканини живих тварин або людей, або мікроорганізмів, що є присутнім у живих тваринах або людях. Даний винахід відноситься також до наборів для діагностичного або терапевтичного застосування, у які входить один або кілька контейнерів, що містять пропоновані у винаході послідовності, інгібуючі JNK, пропоновані у винаході химерні пептиди, пропоновані у винаході нуклеотидні послідовності й/або антитіла до пропонованим у винаході послідовностям, інгібуючим JNK, або до пропонованим у винаході химерним пептидам, наприклад, антитіло до послідовності, інгібуючої JNK, і необов'язково мічений компонент, що зв'язується з антитілом. Мітка, що включають в антитіло, може являти собою (але, не обмежуючись ними) хемілюмінесцентний, ферментний, флуоресцентний, колориметричний або радіоактивний фрагмент. Іншим конкретним варіантом здійснення винаходу є також набори для застосування в діагностиці, що включають один або кілька контейнерів, які містять нуклеїнові кислоти, що кодують або в іншому варіанті комплементарні пропонованої у винаході послідовності, інгібуючої JNK, і/або пропонований у винаході химерному пептиду, необов'язково мічений, що зв'язується із цими нуклеїновими кислотами компонентів, У наступному конкретному варіанті здійснення винаходу до складу набору може входити в один або кілька контейнерів пари олігонуклеотидних праймеров (наприклад, кожний довжиною 6-30 нуклеотидів), які можуть діяти в якості праймеров ампліфікації для полімеразної ланцюгової реакції (ПЦР; див., наприклад, Innis і ін., PCR Protocols, з Academic Press, Inc., San Diego, CA, 1990), лігазної ланцюговій реакції, циклічній реакції із зондом і т.п. або при застосуванні інших методів, відомих у даній галузі, у яких застосовують пропоновані у винаході нуклеїнові кислоти. Набір необов'язково може включати також попередньо певну кількість очищеної пропонованої у винаході послідовності, інгібуючої JNK, пропонованого у винаході химерного пептиду або кодуючих їх нуклеїнових кислот, для застосування як діагностичний агент, стандарту або контролю в аналізах. Обсяг даного винаходу не обмежений наведеними конкретними варіантами його здійснення. Так, різні модифікації винаходу крім представлених у даному описі, повинні стати очевидні фахівцям у даній області після ознайомлення з наведеним вище описом і прикладеними кресленнями. Такі модифікації підпадають під обсяг прикладеної формули винаходу. Різні публікації, процитовані в даному описі, включені в нього як посилання по всій їхній повноті. Якщо не зазначене інше, то всі технічні й наукові поняття, використані в даному описі, мають звичайні значення, відомі звичайному фахівцеві в області, до якої відноситься даний винахід. Хоча для втілення на практиці або оцінки даного винаходу можна застосовувати методи й 23 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 матеріали, аналогічні або еквівалентні представленим у даному описі, прийнятні методи й матеріали будуть описані нижче. Всі публікації, заявки на патент і інші згадані в даному описі посилання включені в нього як посилання у всій їхній повноті. У випадку розбіжності варто опиратися на даний опис, включаючи визначення. Крім того, матеріали, методи й приклади наведені тільки з метою ілюстрації й не спрямовані на обмеження обсягу винаходу. Інші особливості й переваги винаходу стануть очевидними після ознайомлення з наведеним докладним описом і формулою винаходу. Опис креслень На кресленнях показано: на фіг. 1В - діаграма, на якій представлені результати порівняльного аналізу первинної структури областей консервативних доменів JBD зазначених факторів транскрипції. Послідовності, інгібуючі JNK, були ідентифіковані при оцінці структури цих порівнюваних послідовностей. Результати порівняльного аналізу первинної структури як приклад представлені на фіг. 1А-1У. На фіг. 1А показана область найбільш високої гомології між JBD, присутніми в IB1, IB2, c-Jun і ATF2. На панелі Б з метою порівняння представлені амінокислотні послідовності JBD L-IB1(s) і L-IB1. Повністю консервативні залишки позначені зірочками, а залишки із заміною на Ala у векторі GFP-JBD23Mut позначені незафарбованими окружностями. На фіг. 1У показані амінокислотні послідовності химерних білків, що включають послідовність, інгібуючу JNK, і транспортуючу послідовність. У цьому прикладі представлену транспортуючу послідовність виводять із білка ТАТ вірусу імунодефіциту людини (ВІЛ), а послідовність, інгібуючу JNK, виводять із поліпептиду IB1(s). Людська, мишача й щуряча послідовності на панелях Б і В є ідентичними; на фіг. 2 - діаграма, на якій представлені послідовності загальних злитих пептидів TAT-IB, виведених з людських, мишачих і щурячих послідовностей; на фіг. 3 - результати оцінки нейрозахисної дії від осередкової церебральної ішемії, отримані на перманентній MCAO-моделі. Визначення ефективності захисної дії здійснювали при використанні різних доз (див. фіг. 3). Як видно з фіг. 3, дози, що становлять щонайменше 11 мг/кг, 3 мг/кг, 0,3 мг/кг і 0,03 мг/кг, забезпечували захист головного мозку. Найбільш високий рівень захисту виявлений при використанні дози 0,03 мг/кг; на фіг. 4 - результати оцінки нейрозахисної дії пропонованого у винаході химерного пептиду, послідовність якого представлена в SEQ ID NO:11, після i.v.-введення у відношенні осередкової церебральної ішемії на короткочасній MCAO-моделі. Після створення ішемії дорослих мишей забивали через 48 год. після реперфузії. Одержували серійні кріостатичні зрізи й оцінювали обсяг інфаркту. Як видно з фіг. 4, пропонований у винаході химерний пептид забезпечував ефективну нейрозахисну дію; на фіг. 5 - результати аналізу на культурі нейронів по оцінці вивільнення лактатдегідрогенази (ЛДГ) після стимуляції за допомогою N-метил-D-аспартату (NMDA). Результати чітко демонструють нейрозахисну дію пропонованого у винаході химерного D-JNKI1пептиду (SEQ ID NO:11), оскільки дегенеративні зміни, обумовлені обробкою NMDA, повністю інгібувалися, що видно по відсутності значного перевищення вивільнення ЛДГ у порівнянні з контролем; на фіг. 6 - результати інгібування ендогенної JNK-активності в клітинах лінії Hep2 при використанні пропонованих у винаході злитих пептидів, послідовності яких представлені в SEQ ID NO:9 і 11, при застосуванні методу аналізу «в одній лунці». Як видно на фіг. 6, зокрема на панелі г на фіг. 6, D-TAT-IB1(s), послідовність якого представлена в SEQ ID NO:11 (скорочено позначений як D-JNKI) ефективно інгібує активність JNK, навіть краще, ніж L-TAT-IB1(s), послідовність якого представлена в SEQ ID NO:9 (скорочено позначений як L-JNKI); на фіг. 7 - захисна дія D-TAT-IB1(s) відносно перманентної втрати слуху. Представлено дані про зміну в рівні слухового порога (рівень звукового тиску в дБ) на морських свинках після шумової травми (120 дБ при 6 кгц протягом 30 хв.) при максимальній діючій частоті 8 кгц при оцінці протягом 20 хв. (тимчасове зрушення порога, TTS, фарбування сірим кольором) і протягом 15 днів після шумової обробки (перманентне зрушення порога, PTS). Морським свинкам наносили D-TAT-IB1(s), у вигляді гелю на основі гіалуронової кислоти, на мембрану круглого вікна равлика (внутрішнього вуха) або за 30 хв. до, або через 30 хв. або 4 год. після шумової травми; як контроль використали неопрацьовані вуха. TTS оцінювали через 20 хв. після шумової травми, а PTS (фарбування чорним кольором), що відповідає перманентній втраті слуху, визначали через 15 днів. Як видно із представлених даних, D-TAT-IB1(s) не тільки забезпечував помітний захист від втрати слуху, викликаного шумовою травмою, при превентивному застосуванні до шумової обробки, але також і залежно від часу при застосуванні після травми. PTS в оброблених вухах був значно нижче при застосуванні D-TAT-IB1(s) через 30 24 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 хв. і 4 год. після травми в порівнянні з неопрацьованими контрольними вухами. Приклади Приклад 1: Ідентифікація послідовностей, інгібуючих JNK Амінокислотні послідовності, важливі для ефективної взаємодії з JNK, ідентифікували шляхом порівняльного аналізу послідовностей відомих JBD. Порівняння послідовностей JBD, присутніх в IB1 [SEQ ID NO:13], IB2 [SEQ ID NO: 14], c-Jun [SEQ ID NO:15] і ATF2 [SEQ ID NO:16], виявило послідовність, що складається з 8 амінокислот, з певним рівнем консервативності (фіг.1A). Оскільки JBD з IB1 і IB2 приблизно в 100 разів перевищують по ефективності c-Jun або ATF2 відносно зв'язування JNK (Dickens і ін. Science 277, 1997, с. 693), логічно припустити, що консервативні для IB1 і IB2 залишки можуть бути важливі з позицій забезпечення максимального зв'язування. Порівняння JBD, присутніх в IB1 і IB2, дозволило виявити два блоки, що складаються з 7 і 3 амінокислот, які є висококонсервативними для двох послідовностей. Ці два блоки входять у послідовність пептиду, що складається з 19 амінокислот, в L - IB1(s) [SEQ ID NO:1], і показані також з метою порівняння, що складається з 23 амінокислот (ак) пептидної послідовності, виведеної з IB1 [SEQ ID NO:17]. Ці послідовності показані на фіг. 1Б, пунктирною лінією в L-IB1-послідовності позначений пролом у послідовності, уведена для вирівнювання консервативних залишків при порівнянні з L-IB1(s). Приклад 2: Одержання злитих білків, що містять інгібітор JNK Пропоновані у винаході злиті білки-інгібітори JNK, послідовність яких представлена в SEQ ID NO:9, синтезували шляхом ковалентного зв'язування C- кінця SEQ ID NO:1 з N-кінцем пептидуносія, що складається з 10 амінокислот, виведеного з HIV-TAT4g 57 (Vives і ін., J Biol. Chem. 272, 1997, с. 16010), що представлений в SEQ ID NO:5, через лінкер, що складається із двох залишків проліну. Цей лінкер застосовували у зв'язку з тим, що він забезпечує максимальну гнучкість і попереджає небажані зміни вторинної структури. Одержували також основні конструкції, які позначали як L-IB1(s) (SEQ ID NO:1) і L-TAT [SEQ ID NO:5] відповідно. Повністю-D-ретро-інвертовані пептиди, представлені в SEQ ID NO:11, синтезували аналогічним образом. Одержували також основні конструкції, які позначали як D-IB1(s) [SEQ ID NO:2] і D-TAT [SEQ ID NO:6] відповідно. Всі пропоновані у винаході D- і L-злиті пептиди, представлені в SEQ ID NO:9, 10, 11 і 12, одержували шляхом класичного Fmock-синтезу й додатково аналізували за допомогою масспектрометрії. Їх остаточно очищали за допомогою ЖХВР. Для з'ясування дії пролінового лінкера одержували два типи TAT-пептидів, один, доповнений двома залишками проліну, а другий без них. Додавання двох залишків проліну не приводило до помітної модифікації проникнення або локалізації TAT-пептиду усередині клітини. Загальні пептиди, у яких виявлені консервативні амінокислотні залишки, представлені на фіг. 2. Приклад 3: Інгібування загибелі клітин за допомогою JBD19 Вивчали вплив JBD-послідовності, що складається з 19 ак, що присутня в IB1(s), на біологічну активність JNK. Послідовність, що складається з 19 ак, зв'язували через N-кінець із зеленим флуоресцентним білком (конструкція GFP JBD19) і оцінювали вплив цієї конструкції на апоптоз панкреатичних β-клітин, індукований IL-1. Раніше встановлено, що такий механізм апоптоза блокується трансфекцією JBD 1-280, при цьому не відбувається захист специфічними інгібіторами ERK1/2 або r p38 (див., Ammendrup і ін., вище). Синтезували олігонуклеотиди, що відповідають JBD19 і містять ділянки, які кодують консервативну послідовність, що складається з 19 амінокислот, а також послідовність, що несе мутацію в повністю консервативних областях, і безпосередньо вбудовували в сайти EcoRI і Sal вектора pEGFP-N1, що кодує зелений флуоресцентний білок (GFP) (фірма Clontech). Продукуючі інсулін клітини βTC-3 культивували в середовищі RPMI 1640, доповненої 10% фетальної телячої сироватки, 100 мкг/мол стрептоміцину, 100 од./мол пеніциліну й 2мм глутаміном. Продукуючі інсулін клітини βTC-3 трансфектували зазначеними векторами й IL-1β (10 нг/мол) і додавали в середовище для культури клітин. Підраховували кількість знаджуючихся в стані апоптоза клітин через 48 год. після додавання IL-1β за допомогою інвертного флуоресцентного мікроскопа. Знаджуючихся в стані апоптозу клітин відрізнялися від здорових клітин характерним «спучуванням» цитоплазми і їх підраховували через 2 дні. GFP являє собою експресійний вектор зеленого флуоресцентного білка, що застосовують як контроль; JBD19 являє собою вектор, експресуючий химерний GFP, пов'язаний зі складається з 19 ак послідовністю, виведеної з JBD IB1; JBD19Mut являє собою такий же вектор, що й GFPJBD19, але в якому JBD несе мутації 4 консервативних залишків, показаних на фіг. 1Б; і JBD 1-280 являє собою вектор GFP, пов'язаний з повним JBD (ак 1-280). Експресійна конструкція GFPJBD19 перешкоджала індукованому IL-1β апоптозу панкреатичних β-клітин з такою ж 25 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 ефективністю, що й повний JBD1-280. Застосовні як додаткові контролі послідовності, що несуть мутації повністю консервативних залишків IB1(s), мали істотно меншу здатність перешкоджати апоптозу. Приклад 4: Імпорт у клітину пептидів TAT-IB1(s) Оцінювали здатність L-і D-енантіомерних форм TAT і пропонованих у винаході пептидів TAT-IB1(s) («TAT-IB-пептиди») проникати в клітини. L-TAT, D-TAT, пропоновані у винаході LTAT-IB1(s)- і пропоновані у винаході D-TAT-IB1(s)-пептиди [SEQ ID NO:5, 6, 9 і 12 відповідно] мітили, додаючи на N-кінець залишок гліцину, кон’югований із флуоресцеїном. Мічені пептиди (1мкм) додавали в культури клітин βTC-3, які підтримували в умовах, описаних у прикладі 3. У попередньо певні моменти часу клітини промивали ЗФР і фіксували протягом 5 хв. в охолодженому на льоді метанолі-ацетоні (1:1) перед оцінкою за допомогою флуоресцентного мікроскопа. Мічений флуоресцієном БСА (1мкм, 12 молей/моль БСА) застосовували як контроль. Отримані результати свідчать про те, що всі зазначені вище мічені флуоресцеїном пептиди ефективно й швидко (менш чим протягом 5 хв.) проникали в клітини при їхньому додаванні в культуральне середовище. І, навпаки, мічений флуоресцеїном бичачий сироватковий альбумін (1мкм БСА, 12 молей флуоресцеїну/моль БСА) не проникав у клітини. Вивчення залежно від часу показало, що інтенсивність флуоресцентного сигналу при використанні L-енантіомерних форм пептидів знижувалася на 70% через 24 год. Через 48 год. виявлений невеликий сигнал або відсутність сигналу. На противагу цьому, D-TAT і пропоновані у винаході D-TAT-IB1(s) мали дуже високу стабільність у клітинах. Флуоресцентні сигнали цих повністю D-ретро-інвертованих пептидів виявилися ще дуже сильними через 1 тиждень, і сигнал лише злегка знижувався до 2 тижня після обробки. Приклад 5: In vitro інгібування фосфорилювання c-JUN, ATF2 і Elk1 У дослідах in vitro оцінювали вплив пептидів на JNK-опосередковуване фосфорилювання їхніх факторів транскрипцій-мішеней. Рекомбінантні й не активовані JNK1, JNK2 і JNK3 одержували за допомогою набору для транскрипції й трансляції лизатів кролячих ретикулоцитів (TRANSCRIPTION AND TRANSLATION rabbit reticulocyte lysate kit) (фірма Promega) і застосовували для твердофазних аналізів кіназ c-Jun, ATF2 і Elk1 або індивідуально, або після злиття із глутатіон-S-трансферазою (GST) як субстрати. Здійснювали досліди по оцінці залежності відповіді від дози, змішуючи пропоновані у винаході пептиди L-TAT або L-TAT-IB1(s) (0-25мкМ) з рекомбінантними кіназами JNK1, JNK2 або JNK3 у реакційному буфері (20мМ Трисацетат,1мМ ЕГТК (етиленгліколева тетраацетилова кислота), 10мМ п-нітрофенілфосфат (пНФФ), 5мМ пірофосфат натрію, 10мМ п-гліцерофосфат, 1мМ дітіотреитол) протягом 20 хв. 33 Потім ініціювали кіназні реакції, додаючи 10мМ MgCl2 і 5 пКи P--датф і 1 мкг або GST-Jun (aк 1-89), або GST-AFT2 (ак 1-96), або GST-ELK1 (ак 307-428). Злиті з GST білки одержували від фірми Stratagene (Ла-Джолла, шт. Каліфорнія). В суміш додавали 10 мкл покритих глутатіоном агарозних гранул. Продукти реакції потім розділяли за допомогою ДСН-ПААГ, у яких застосовували денатурируючий 10% поліакриламідний гель. Гелі сушили й потім експонували на рентгенівську плівку (фірма Kodak). Практично повне інгібування фосфорилювання c-Jun, ATF2 і Elk1 за допомогою JNK виявлено при використанні пропонованих у винаході пептидів TAT-IB(s) у дозах порядку 2,5 мкм. Однак важливим виключенням була відсутність інгібування пептидом TAT-IB(s) фосфорилювання Elk1 за допомогою JNK3. У цілому, для пептиду, що заявляється у винаході, TAT-IB1(s) виявлена дуже висока ефективність у відношенні інгібування фосфорилювання сімейством JNK їхніх факторів транскрипцій-мішеней. Здатність D-TAT, пропонованого у винаході пептиду D-TATIB1(s) і пропонованого у винаході пептиду L-TAT-IB1(s) (вивчені дози 0-250мкм) інгібувати фосфорилювання GST-Jun (ак 1-73) рекомбінантними JNK1, JNK2 і JNK3 аналізували за допомогою описаного вище методу. У цілому, пептид D-TAT-IB1(s) знижував опосередковуване JNK фосфорилювання c-Jun, але приблизно в 10-20 разів менш ефективно в порівнянні з пептидом L-TAT-IB1(s). Приклад 6: Інгібування фосфорилювання c-JUN активованими JNK Вплив пептидів L-TAT або пропонованого у винаході L-TAT-IB1(s) на JNK, які є стимулами, що активували стрес, оцінювали, використовуючи GST-Jun для оцінки виділення JNK з опромінених УФ-світлом клітин лінії HeLa або оброблених IL-1β клітин лінії PTC. PTC-клітини культивували відповідно до описаного вище методу. HeLa-клітини культивували в середовищі DMEM, доповненої 10% фетальної телячої сироватки, 100 мкг/мол стрептоміцину, 100 од. /мол пеніциліну й 2мМ глутаміном. За 1 год. до одержання клітинного екстракту PTC-клітини 2 активували IL-1β, як описано вище, а HeLa-клітини активували УФ-світлом (20 Дж/м ). Клітинні екстракти одержували з контрольних, опромінених УФ-світлом HeLa-клітин і оброблених IL-1β βTC-3-клітин шляхом розщеплення клітинних культур у лізуючому буфері (20мМ Трис-ацетат, 26 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 1мМ ЕГТК, 1% Triton X-100, 10мМ п-нітрофенілфосфат, 5мМ пірофосфат натрію, 10мМ пгліцерофосфат, 1мМ дитіотреїтол). Клітинний дебрис видаляли центрифугуванням протягом 5 хв. при 15000 об/хв. на роторі типу SS-34 Beckman. 100 мкг екстрактів інкубували протягом 1 год. при кімнатній температурі з 1 мкг GST-Jun (амінокислоти 1-89) і 10 мкл покритих глутатіоном агарозних гранул (фірма Sigma). Після чотирьох відмивань буфером для розщеплення гранули ресуспендували в цьому ж буфері, доповненому пептидами L-TAT або пропонованим у винаході пептидом L-TAT-IB1(s) (25 мкМ), протягом 20 хв. Потім кіназні реакції 33 ініціювали, додаючи 10мМ MgCl2 і 5 пКи P--дАТФ, і інкубували протягом 30 хв. при 30°C. Продукти реакції потім розділяли за допомогою ДСН-ПААГ, у яких застосовували денатуруючий 10%-ний поліакриламідний гель. Гелі сушили й потім експонували на рентгенівську плівку (фірма Kodak). У цих експериментах установлено, що пропоновані у винаході пептиди TAT-IB(s) ефективно попереджали фосфорилювання c-Jun активованими JNK. Приклад 7: In vivo інгібування фосфорилювання c-JUN пропонованими у винаході пептидами TAT-IB(s) Для з'ясування питання про те, чи можуть пропоновані у винаході володіючі здатністю проникати в клітину пептиди блокувати передачу сигналу JNK in vivo, при створенні винаходу використали гетерологічну систему GAL4. HeLa-клітини, які культивували за допомогою описаного вище методу, спільно трансфектували репортерним вектором 5xGAL-LUC у сполученні з експресійною конструкцією GAL-Jun (фірма Stratagene), що містить домен активації c-Jun (амінокислоти 1-89), що зшиті із Днк-єднальним доменом GAL4. Для активації JNK використали спільну трансфекцію векторами, експресуючими кінази MKK4 і MKK7, які знаходяться безпосередньо у зворотному напрямку (див., Whitmarsh і ін., Science 285, 1999, с. 5 1573). У цілому, метод полягав у наступному: 310 клітин трансфектували плазмідами в 3,5сантиметрових чашках з використанням DOTAP (фірма Boehringer Mannheim) відповідно до інструкцій виробника. Для експериментів з використанням GAL-Jun 20 мкг плазміди трансфектували 1 мкг репортерної плазміди pFR-Luc (фірма Stratagene) і 0,5 мкг експресійної плазміди або MKK4, або MKK7. Через 3 год. після трансфекції клітинні середовища заміняли й додавали пептиди TAT і TAT-IB1(s) (1мкм). Люциферазну активність оцінювали через 16 год. за допомогою системи «Dual Reporter System» (фірми Promega) після стандартизації вмісту білка. Додавання пептиду TAT-IB1(s) блокувало активацію c-Jun після опосередковуваної MKK4 і MKK7 активації JNK. Оскільки в клітинах лінії HeLa відбувається експресія ізоформ JNK1 і JNK2, але відсутня експресія JNK3, при створенні винаходу клітини трансфектували JNK3. І в цьому випадку пептид TAT-IB(s) інгібував опосередковувану JNK2 активацію c-Jun. Приклад 8: Інгібування пептидами TAT-IB індукованої IL-1β загибелі панкреатичних β-клітин При створенні винаходу аналізували вплив пропонованих у винаході пептидів L-TAT-IB(s) на розвиток апоптоза β-клітин, викликаного обробкою IL-1. Культури βTC-3-клітин інкубували протягом 30 хв. із 1мкм пропонованими у винаході пептидами L-TAT-IB1(s) з наступним введенням 10 нг/мол IL-1. Друге введення пептиду (1мкм) здійснювали через 24 год. Кількість знаходячихся в стані апоптоза клітин підраховували після інкубації протягом 2 днів з IL-1β з використанням для фарбування ядер йодиду пропидію (клітини, пофарбовані в червоний колір, являють собою загиблі клітини) і Hoechst 33342 (клітини, пофарбовані в синій колір, являють собою клітини з неушкодженою плазматичною мембраною). Додавання пропонованих у винаході пептидів TAT-IB(s) інгібуваво індукований IL-1 апоптоз βTC-3-клітин, культивованих у присутності IL-1β протягом 2 днів. Тривале інгібування індукованої IL-1 загибелі клітин оцінювали шляхом обробки βTC-3клітин аналогічно описаному вище, за винятком того, що інкубацію клітин пептидами й IL-1β здійснювали протягом 12 днів. Щодня вносили додаткову порцію пептидів (1мкм) і кожні два дні вносили додаткову порцію IL-1β (10 нг/мол). Пропоновані у винаході пептиди TAT-IB1(s) у цих умовах мали виражену захисну дію від апоптоза. Ці експерименти в порівнянні один з одним чітко демонструють, що пропоновані у винаході пептиди TAT-IB(s) являють собою біологічно активні молекули, що володіють здатністю попереджати впливи передачі сигналу JNK на загибель клітин. Приклад 9: Синтез пропонованих у винаході повністю-D-ретро-інвертованих пептидів IB(s) Пептиди, пропоновані у винаході, можуть являти собою пептиди, що складаються з повністю-D-амінокислот, які піддавали зворотньому синтезу для попередження природного протеолізу (тобто повністю-D-ретро-інвертовані пептиди). Повністю-D-ретро-інвертований пептид, пропонований у винаході, являє собою пептид з аналогічними нативному пептиду функціями, у якому бічні групи вхідних у його склад амінокислот повинні відповідати полінеаризованій структурі нативному пептиду, але зберігати стійкий до протеаз каркас. 27 UA 98101 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ретро-інвертовані пептиди, пропоновані у винаході, синтезували аналогічно за допомогою D-амінокислот шляхом приєднання амінокислот у пептидному ланцюгу так, щоб послідовність амінокислот у ретро-інвертованому пептидному аналогу була точно протилежна послідовності зворотнього пептиду, що служить як модель. Наприклад, якщо білок, що зустрічається в природних умовах, TAT (що складається з L-амінокислот) має послідовність GRKKRRQRRR [SEQ ID NO:5], те ретро-інвертований пептидний аналог цього пептиду (що складається з Dамінокислот) повинен мати послідовність RRRQRRKKRG [SEQ ID NO:6]. Процедури синтезу ланцюга D-амінокислот для одержання ретро-інвертованих пептидів відомі в даній галузі (див., наприклад, Jameson і ін., Nature, 368, 1994, сс. 744-746; Brady і ін., Nature, 368, 1994, сс. 692693; Guichard і ін., J. Med. Chem. 39, 1996, сс. 2030-2039). Зокрема ретро-пептиди можна одержувати за допомогою класичного F-mock-синтезу й потім аналізувати за допомогою масспектрометрії. Їх остаточно очищають за допомогою ЖХВР. Оскільки особливістю нативних пептидів є їхня чутливість до розщеплення в протеазами, що зустрічаються в природних умовах і їм властива імуногенність, то гетеробівалентні або гетеромультивалентні з'єднання, пропоновані в даному винаході, варто одержувати таким чином, щоб вони являли собою «ретро-інвертований ізомер» необхідного пептиду. Таким чином, захист пептиду від природного протеолізу повинний підвищувати ефективність гетеробівалентного або гетеромультивалентного з'єднання як у результаті подовження часу напівжиття, так і зниження ступеня імунної відповіді, спрямованого на активне руйнування пептидів. Приклад 10: Тривала біологічна активність пропонованих у винаході повністю-D-ретроінвертованих пептидів IB(s) Дані про тривалу біологічну активність, передвіщеної для пропонованого у винаході вміщуючого ретро-інвертований пептид D-TAT-IB(s) гетерокон’югата при порівнянні з нативним L-амінокислотним аналогом, що обумовлено захистом пропонованого у винаході пептиду DTAT-IB(s) від розщеплення нативними протеазами, представлені на фіг. 5. Аналізували інгібування індукованої IL-1β загибелі панкреатичних β-клітин пропонованим у винаході пептидом D-TAT-IB1(s). Клітини лінії βTC-3 інкубували відповідно до описаного вище методу протягом 30 хв. із однократним додаванням зазначеного пептиду (1мкм), після чого додавали IL-1 (10 нг/мол). Потім після інкубації протягом 2 днів з IL-1β підраховували кількість клітин, що перебувають на стадії апоптоза, за допомогою фарбування ядер йодидом пропидію й Hoechst 33342. У кожному експерименті здійснювали підрахунок мінімум 1000 клітин. Представлено середньоквадратичні відхилення середніх значень (СКО) при n=5. Установлено, що пептид DTAT-IB1 знижував індукований IL-1 апоптоз у такому ж ступені, що й пептиди L-TAT-IB. Аналізували також тривале інгібування індукованої IL-1β загибелі клітин за допомогою пептиду D-TAT-IB1. Клітини лінії βTC-3 інкубували за допомогою зазначеного вище методу протягом 30 хв. із однократним додаванням зазначених пептидів (1мкм), після чого додавали IL1β (10 нг/мол), а потім додавали цитокін кожні два дні. Потім після інкубації протягом 15 днів з IL-1 підраховували кількість клітин, що перебувають на стадії апоптоза, за допомогою фарбування ядер йодидом пропідію й Hoechst 33342. Слід зазначити, що однократне додавання пептиду TAT-IB1 не забезпечує тривалий захист. У кожному експерименті здійснювали підрахунок мінімум 1000 клітин. У результаті встановлено, що пропонований у винаході D-TATIB1(s), на відміну від не пропонованого у винаході L-TAT-IB1(s), мав здатність забезпечувати тривалий захист (15 днів). Приклад 11: Інгібування пептидами TAT-IB(s) індукованої опроміненням загибелі панкреатичних β-клітин JNK активували також іонізуючим випромінюванням. Для рішення питання про те, чи можуть пропоновані у винаході пептиди TAT-IB(s) забезпечувати захист від індукованого опроміненням ушкодження JNK, клітини лінії «WiDr» опромінювали (30 Гр) у присутності D-TAT, пропонованого у винаході, або без нього, L-TAT-IB1(s) або пропонованими у винаході пептидами D-TAT-IB1(s) (1мкм вносили за 30 хв. до опромінення). Контрольні клітини (CTRL) не опромінювали. Клітини аналізували через 48 год. за допомогою фарбування ИП (йодид пропідію) і Hoechst 3342 відповідно до описаного вище методу. Представлено середньоквадратичні відхилення середніх значень (СКО) при n=3. Пропоновані у винаході пептиди L-TAT-IB1(s) і D-TAT-IB1(s) обоє мали здатність попереджати індукований опроміненням апоптоз цієї людської лінії клітин рака ободочної кишки. Приклад 12: Радіаційний захист від іонізуючого випромінювання за допомогою пропонованих у винаході пептидів TAT-IB(s) Для виявлення здатності пропонованих у винаході пептидів TAT-IB(s) здійснювати 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCell-permeable peptide inhibitors of the jnk signal transduction pathway
Автори англійськоюBonny Christophe
Назва патенту російськоюПептидные ингибиторы пути трансдукции сигнала jnk, которые имеют способность проникать в клетку
Автори російськоюБонни Кристоф
МПК / Мітки
МПК: C07K 14/47
Мітки: мають, здатність, клітину, інгібітори, сигналу, проникати, шляху, пептидні, трансдукції
Код посилання
<a href="https://ua.patents.su/56-98101-peptidni-ingibitori-shlyakhu-transdukci-signalu-jnk-shho-mayut-zdatnist-pronikati-v-klitinu.html" target="_blank" rel="follow" title="База патентів України">Пептидні інгібітори шляху трансдукції сигналу jnk, що мають здатність проникати в клітину</a>
Попередній патент: Пристрій для вентиляції проходки штреків під час роботи підземного комбайна
Наступний патент: Спосіб інформаційного забезпечення комфорту життєдіяльності громадянина
Випадковий патент: Спосіб очищення стічних вод від прямих барвників