Похідні син-ізомеру цефему, що мають антибактеріальну активність, спосіб їх отримання (варіанти) і фармацевтичний склад
Номер патенту: 37180
Опубліковано: 15.05.2001
Автори: Шанто Жан-Франсуа, ГУЕН Д'АМБРІЕР Соланж, Асзоді Жозеф, ФОБО Патрік
Формула / Реферат
1. Производные син-изомера цефема общей формулы (I):
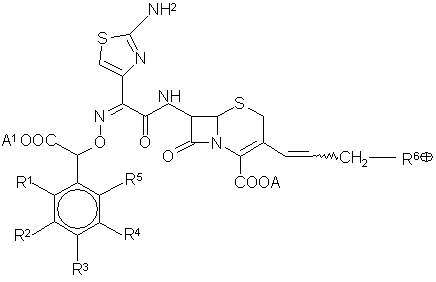 ,
,
(І)
где
R1, R2, R3, R5 = Н, ОН, ОС1-С4-алкил, ОСОС1-С4-алкил, галоген, CN, NО2, независимо друг от друга, причем если R3 = ОН или ОСОС1-С4-алкил, то R1, R2, R5 отличны от Н,
R4 = ОН, ОСОС1-С4-алкил,
А и А1 = Н или эквивалент щелочного или щелочноземельного металла, магния, аммония, либо органического амина, или группы СООА и СООА1 представляют собой группу СОО-,
волнистая линия означает, что группа –CH2R6Å находится в положении Е или Z,
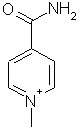
R6Å = тиено[2,3-с]пиридиний, тиено[3,2-с]пиридиний, тиено[2,3-b]пиридиний, тиено[3,2-b]пиридиний и пиридиний, каждая из которых может быть замещена C1-С4алкилом, С1-С4алкилтиогруппой, карбоксильной или карбамоильной группой, 2-аминотиазол[5,4-b]пиридиний, имидазо[2,1-b]тиазолий, тиазолий, имидазо[1,2-а]пиридиний, хинолиний, изохинолиний, 6,7-дигидро-5Н-пиридиний, пиридазиний, 1-(3-метоксипропил)-1Н-пиразолий, 1-(С1-С4)алкил-1Н-бензимидазолий, 5,6,7,8-тетрагидрохинолиний, 5,6,7,8,9,10,11,12,13,14-декагидроциклододека[b]пиридиний, а также группу
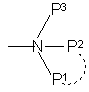 ,
,
где Р1, Р2 и Р3 - одинаковые или различные, представляют собой фенил или С1-С4-алкил, который может быть замещен карбоксильной группой, карбамоильной группой, цианогруппой или гидроксильной группой, и пунктирная линия указывает, что Р1 и Р2 могут образовывать с атомом азота, с которым они связаны, пирролидиновый цикл; в виде R- или S-оптически активных изомеров, или их рацемической смеси,
а также их соли с органическими и неорганическими кислотами, щелочными и щелочноземельными металлами и органическими основаниями, обладающие антибактериальной активностью.
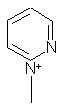
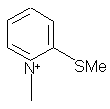
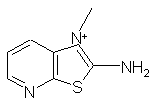
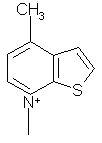
2. Соединения по п.1, в которых R6Å означает одну из нижеследующих групп:
 ,
,  ,
, 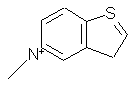 ,
, 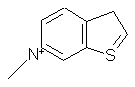 ,
, 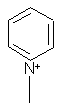 ,
, 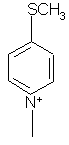 ,
,  ,
,  ,
,  ,
,  ,
, 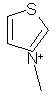 ,
, 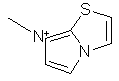 ,
, 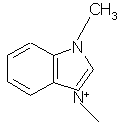 ,
, 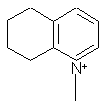 ,
, 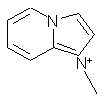 ,
, 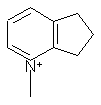 ,
, 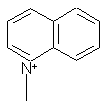 ,
, 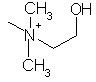 ,
, 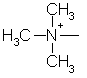 ,
,
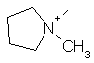 ,
, 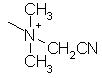 ,
, 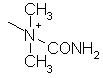 ,
, 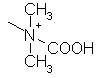 ,
,
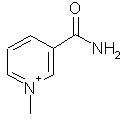 ,
, 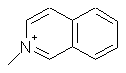 ,
, 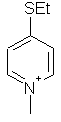 ,
, 
3. Соединения по пп.1 и 2, в которых R6Å представляет собой радикал, такой как хинолиний, изохинолиний, 4-(метилтио)пиридиний, тиено[2,3-b]пиридиний, имидазо[1,2-а]пиридиний или радикал 6,7-дигидро-5Н-пиридиний.
4. Соединения по пп.1-3, в которых каждый из R3 и R4 представляет собой гидроксильный радикал.
5. Соединения по пп.1-4, в которых каждый из R2 и R5 представляет собой атом хлора.
6. Соединения по пп.1-4, в которых каждый из R2 и R5 представляет собой атом фтора.
7. Соединения по пп.1-4, в которых каждый из R1 и R2 представляет собой атом фтора.
8. Соединения по пп.1-4, в которых R2 представляет собой метоксильный радикал и один из R1 или R5 представляет собой атом хлора.
9. Соединения по п.1, выбранные из группы, включающей следующие наименования:
внутрикомплексная соль [6R-[3-(E)6α,7β(Z)]] 1-[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(2,3-дифтор-4,5-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил]имидазо[1,2-а]пиридиний,
внутрикомплексная соль [6R-(3-(E)6α,7β(Z)]] 1-[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(2,5-дифтор-3,4-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]2-пропенил]имидазо[1,2-а]пиридиний,
внутрикомплексная соль [6R-[3-(E)6α,7β(Z)]] 1-[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(2-хлор-4,5-дигидрокси-3-метоксифенил)метокси]имино]ацетил]-амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил]хинолиний,
внутрикомплексная соль [6R-[3-(E)6α,7β(Z)]] 1-[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(2,5-дихлор-3,4-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил]-6,7-дигидро-5Н-пиридиний,
внутрикомплексная соль [6R-[3-(E)6α,7β(Z(S*))]] 1-[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(3,4-дигидрокси-5-фторфенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]пропенил]хинолиний,
внутрикомплексная соль [6R-[3-(E)6α,7β(Z)]] 1-[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(2-хлор-3,4-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил]хинолиний (R) или (S), или смесь (R + S),
внутрикомплексная соль [6R-[3-(E)6α,7β(Z)]] 1-[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(3-циано-4,5-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил]хинолиний (R) или (S),или смесь (R + S),
внутрикомплексная соль [6R-[3-(E)6α,7β(Z)]] 1-[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(3-фтор-4,5-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил]хинолиний (R) или (S),или смесь (R + S),
внутрикомплексная соль [6R-[3-(E)6α,7β(Z)]] 7-[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(2,5-дихлор-3,4-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил]тиено[2,3-b]пиридиний (R) или (S), или смесь (R + S),
внутрикомплексная соль [6R-[3-(E)6α,7α(Z)]] 1-[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(2,5-дихлор-3,4-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил]хинолиний (R) или (S),или смесь (R+S),
внутрикомплексная соль [6R-[3-(E)6α,7β[Z(S*)]]] 1-[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(3-циано-4,5-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил]тиено[2,3-b]пиридиний,
внутрикомплексная соль [6R-[3-(E)6α,7β(Z)]] 1-[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(2,5-дихлор-3,4-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил]изохинолиний (R) или (S),или смесь (R + S),
внутрикомплексная соль [6R-[3-(E)6α,7β(Z)]] 1-[3-[7-[[2-амино-4-тиазолил)-[[карбокси(2,5-дихлор-3,4-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил]-4-(метилтио)-пиридиний (R) или (S) или смесь (R + S).
10. Соединения по пп.1-9 и их кислотно-аддитивные соли, проявляющие антибиотическую активность.
11. Способ получения производных син-изомера цефема общей формулы(I):
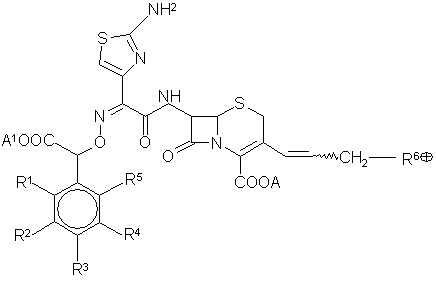 ,
,
(I)
где
R1, R2, R3, R5 = H, OH, ОС1-С4-алкил, ОСОС1-С4-алкил, галоген, CN, NO2, независимо друг от друга, причем если R3 = ОН или ОСОС1-С4-алкил, то R1, R2, R5 отличны от H,
R4 = ОН, ОСОС1-С4-алкил,
А и А1 = Н или эквивалент щелочного или щелочноземельного металла, магния, аммония, либо органического амина, или группы СООА и СООА1 представляют собой группу СОO-,
волнистая линия означает, что группа -CH2R6Å находится в положении Е или Z,
R6Å = тиено[2,3-с]пиридиний, тиено[3,2-с]пиридиний, тиено[2,3-b]пиридиний, тиено[3,2-b]пиридиний и пиридиний, каждая из которых может быть замещена С1- С4алкилом, С1-С4алкилтиогруппой, карбоксильной или карбамоильной группой, 2-аминотиазол[5,4-b]пиридиний, имидазо[2,1-b]тиазолий, тиазолий, имидазо[1,2-а]пиридиний, хинолиний, изохинолиний, 6,7-дигидро-5Н-пиридиний, пиридазиний, 1-(3-метоксипропил)-1Н-пиразолий,1-(С1-С4)алкил-1Н-бензимидазолий, 5,6,7,8-тетрагидрохинолиний, 5,6,7,8,9,10,11,12,13,14-декагидроциклододека[b]пиридиний, а также группу
 ,
,
где Р1, Р2 и Р3 - одинаковые или различные, представляют собой фенил или C1-C4-алкил, который может быть замещен карбоксильной группой, карбамоильной группой, цианогруппой или гидроксильной группой, и пунктирная линия указывает, что Р1 и Р2 могут образовывать с атомом азота, с которым они связаны, пирролидиновый цикл; в виде R- или S-оптически активных изомеров, или их рацемической смеси, а также их соли с органическими и неорганическими кислотами, щелочными и щелочноземельными металлами и органическими основаниями, отличающийся тем, что
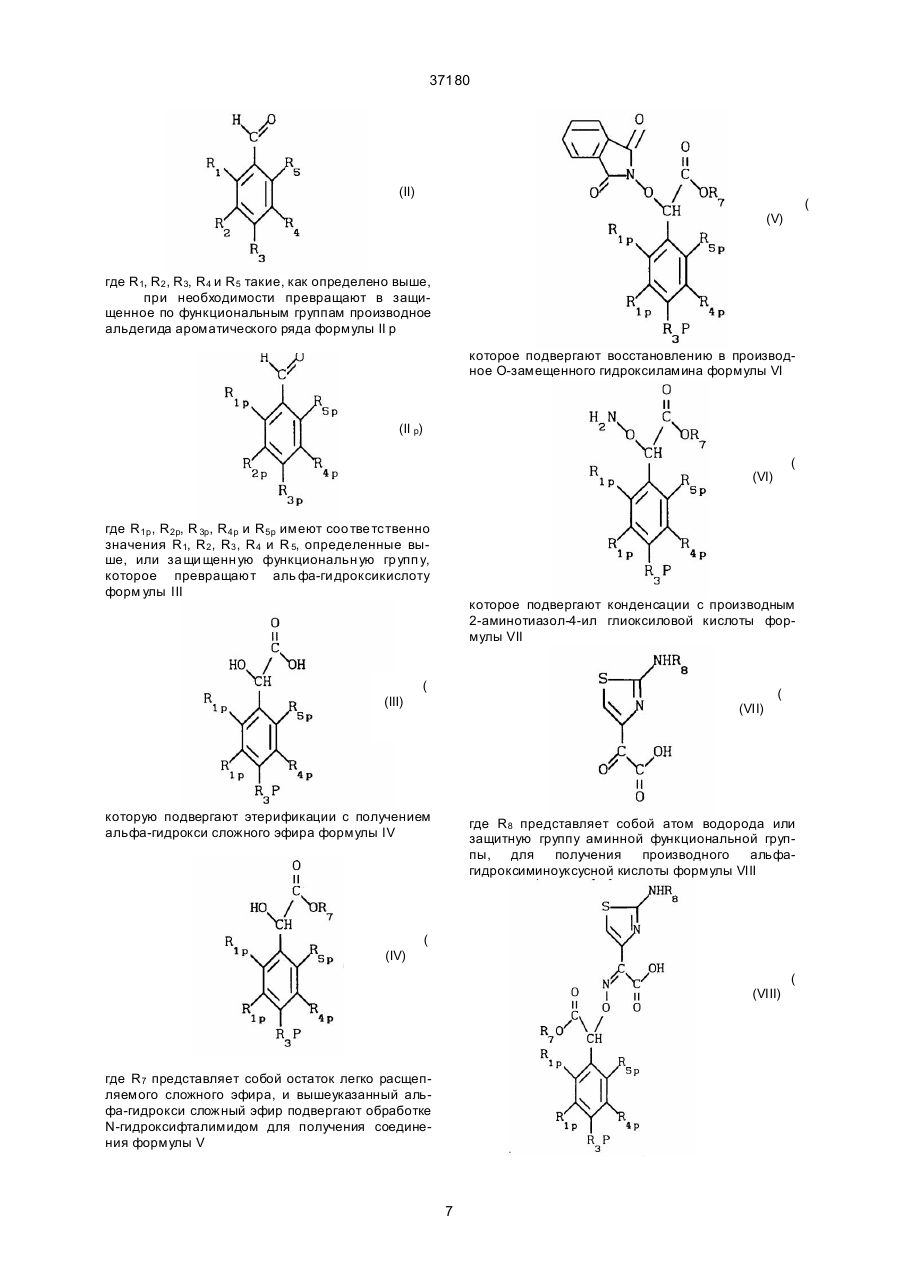
а) альдегид общей формулы (II),
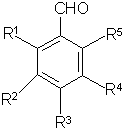 ,
,
(ІІ)
где R1, R2, R3, R4, R5 определены выше, с защищенными, при необходимости, функциональными группами, гомологизируют бромоформом в системе водная щелочь - органический растворитель, затем, при необходимости, выделяют полупродукт;
б) к раствору полученной кислоты общей формулы (III)
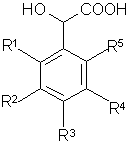
(III)
в органическом растворителе в инертной атмосфере добавляют раствор дифенилдиазометана в органическом растворителе, выделяют полупродукт, при необходимости;
в) раствор полученного сложного эфира общей формулы (IV)
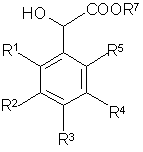 ,
,
(IV)
где R7 = дифенилметил,
в тетрагидрофуране обрабатывают N-гидроксифталимидом и трифенилфосфином, затем диэтилазодикарбоксилатом, затем, при необходимости, выделяют полупродукт;
г) восстанавливают полупродукт общей формулы (V)
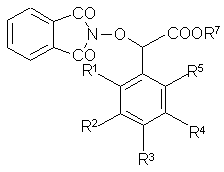
(V)
в органическом растворителе гидразином в инертной атмосфере, затем, при необходимости, выделяют полупродукт;
д) конденсируют соединение общей формулы (VI)
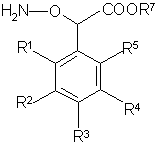
(IV)
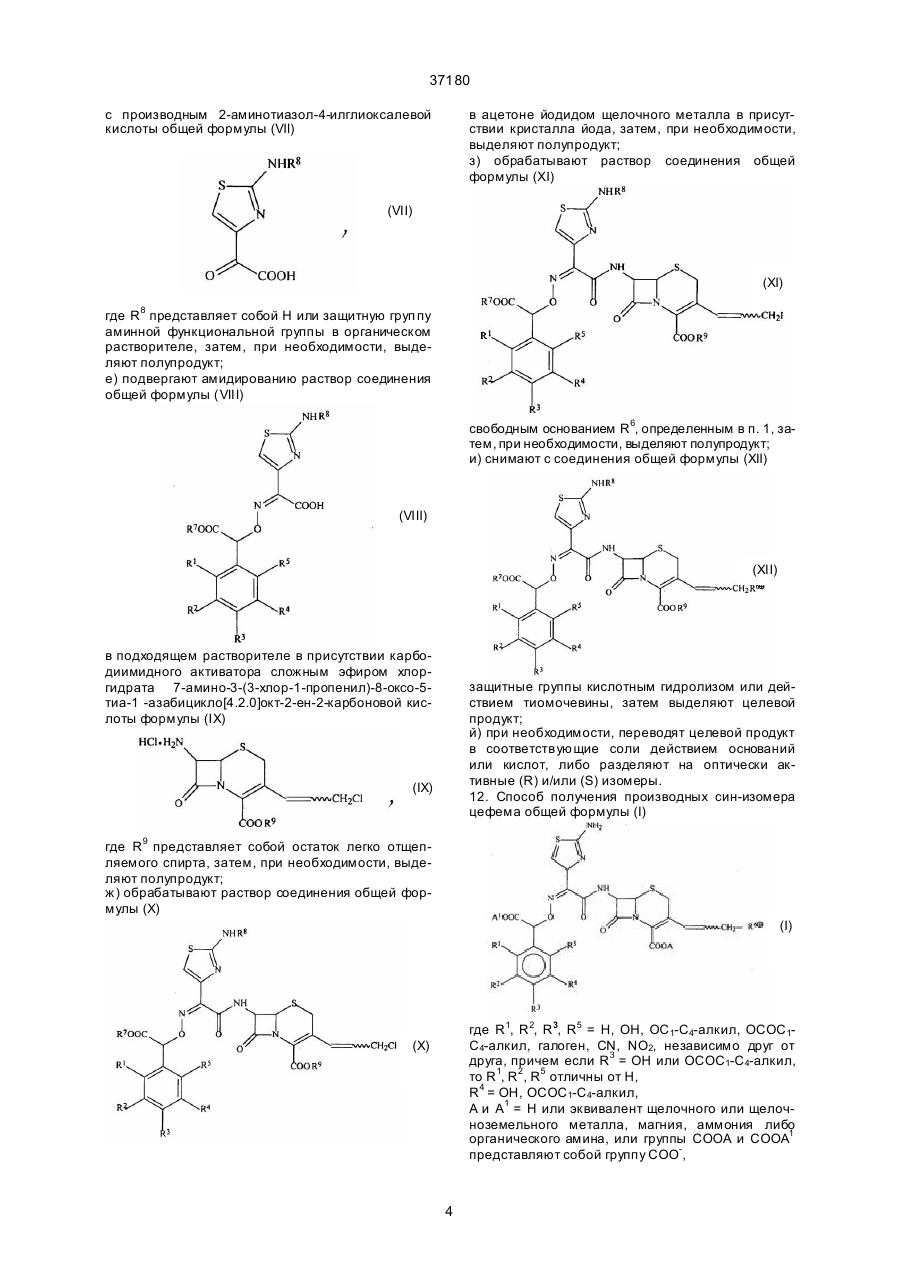
с производным 2-аминотиазол-4-илглиоксалевой кислоты общей формулы (VII)
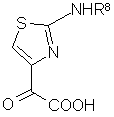 ,
,
(VII)
где R8 представляет собой Н или защитную группу аминной функциональной группы в органическом растворителе, затем, при необходимости, выделяют полупродукт;
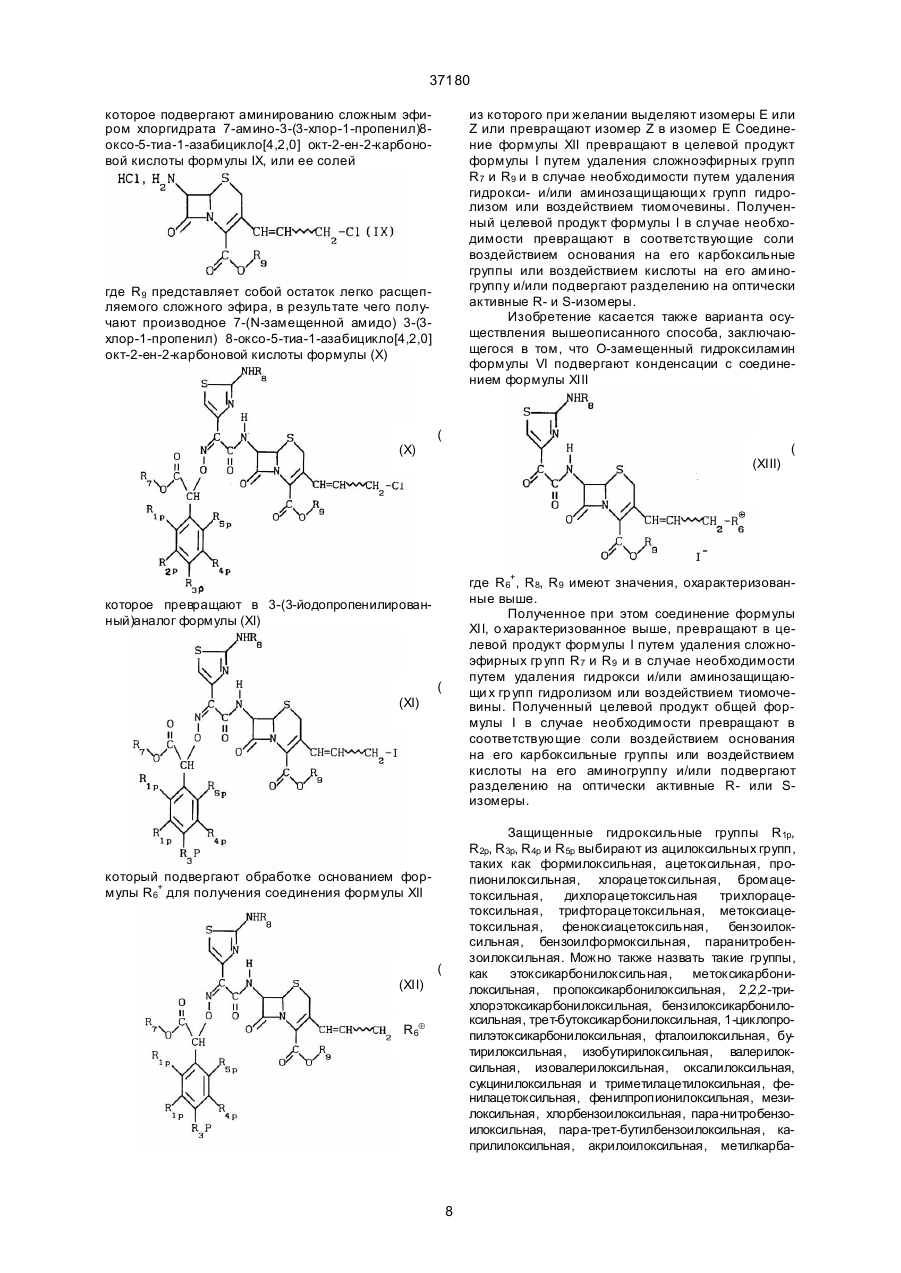
е) подвергают амидированию раствор соединения общей формулы (VIII)
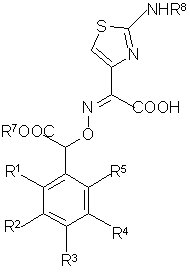
(VIII)
в подходящем растворителе в присутствии карбодиимидного активатора сложным эфиром хлоргидрата 7-амино-3-(3-хлор-1-пропенил)-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты формулы (IX),
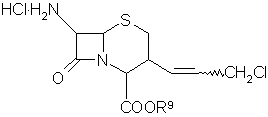
(IX)
где R9 представляет собой остаток легко отщепляемого спирта, затем, при необходимости, выделяют полупродукт;
ж) обрабатывают раствор соединения общей формулы (X)
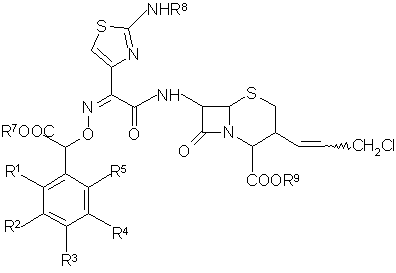
(X)
в ацетоне йодидом щелочного металла в присутствии кристалла йода, затем, при необходимости, выделяют полупродукт;
з) обрабатывают раствор соединения общей формулы (XI)
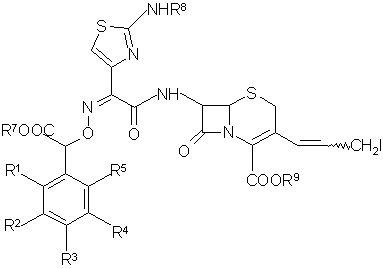
(XI)
свободным основанием R6, определенным в п. 1, затем, при необходимости, выделяют полупродукт;
и) снимают с соединения общей формулы (XII)
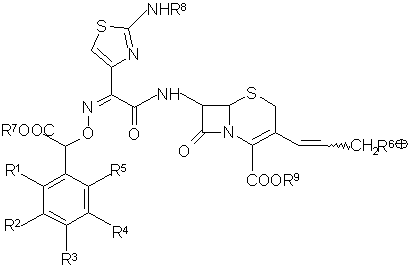
(XII)
защитные группы кислотным гидролизом или действием тиомочевины, затем выделяют целевой продукт;
й) при необходимости, переводят целевой продукт в соответствующие соли действием оснований или кислот, либо разделяют на оптически активные (R) и/или (S) изомеры.
12. Способ получения производных син-изомера цефема общей формулы (I),
 ,
,
(І)
где
R1, R2, R3, R5 = Н, ОН, ОС1-С4-алкил, ОСОС1-С4-алкил, галоген, CN, NО2, независимо друг от друга, причем если R3 = ОН или ОСОС1-С4-алкил, то R1, R2, R5
отличны от Н,
R4 = ОН, ОСОС1-С4-алкил,
А и А1 = Н или эквивалент щелочного или щелочноземельного металла, магния, аммония, либо органического амина, или группы СООА и СООА1 представляют собой группу СОО-,
волнистая линия означает, что группа –CH2R6Å находится в положении Е или Z,
R6Å = тиено[2,3-с]пиридиний, тиено[3,2-с]пиридиний, тиено[2,3-b]пиридиний, тиено[3,2-b]пиридиний и пиридиний, каждая из которых может быть замещена С1- С4алкилом, С1-С4алкилтиогруппой, карбоксильной или карбамоильной группой, 2-аминотиазол[5,4-b]пиридиний, имидазо[2,1-b]тиазолий, тиазолий, имидазо[1,2-а]пиридиний, хинолиний, изохинолиний, 6,7-дигидро-5Н-пиридиний, пиридазиний, 1-(3-метоксипропил)-1Н-пиразолий, 1-(С1-С4)алкил-1Н-бензимидазолий, 5,6,7,8-тетрагидрохинолиний, 5,6,7,8,9,10,11,12,13,14-декагидроциклододека[b]пиридиний, а также группу
 ,
,
где Р1, Р2 и Р3 - одинаковые или различные, представляют собой фенил или С1-С4-алкил, который может быть замещен карбоксильной группой, карбамоильной группой, цианогруппой или гидроксильной группой, и пунктирная линия указывает, что Р1 и Р2 могут образовывать с атомом азота, с которым они связаны, пирролидиновый цикл; в виде R- или S-оптически активных изомеров, или их рацемической смеси, а также их соли с органическими и неорганическими кислотами, щелочными и щелочноземельными металлами и органическими основаниями, отличающийся тем, что
а) конденсируют соединение общей формулы (VI)
 ,
,
(VІ)
где R7 = дифенилметил, с производным 2-аминотиазол-4-илглиоксалевой кислоты общей формулы (XIII)
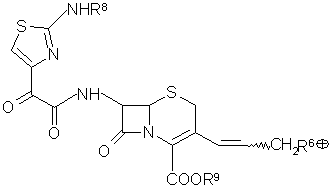 ,
,
(XIII)
где R8 представляет собой Н или защитную группу аминной функциональной группы в подходящем растворителе, затем, при необходимости, выделяют полупродукт;
б) снимают с соединения общей формулы (XII)
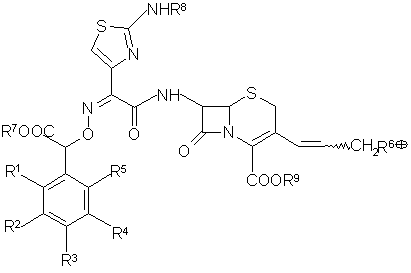
(XII)
защитные группы кислотным гидролизом или действием тиомочевины, затем выделяют целевой продукт;
в) при необходимости, переводят целевой продукт в соответствующие соли действием оснований или кислот, либо разделяют на оптически активные (R) и/или (S) изомеры.
13. Фармацевтический состав антибиотического действия, включающий активное начало на основе производного цефема, содержащего в положении 3 замещенный винил, и целевые добавки, отличающийся тем, что в качестве активного начала содержит по крайней мере одно соединение общей формулы (I), охарактеризованное в п.1, в эффективном количестве.
Текст
1. Производные син-изомера цефема общей формулы (I): Зоя 37180 3. Соединения по пп.1 и 2, в которых R6Å представляет собой радикал, такой как хинолиний, изохи нолиний, 4-(метилтио)пиридиний, тиено[2,3b]пиридиний, имидазо[1,2-а]пиридиний или радикал 6,7-дигидро-5Н-пиридиний. 4. Соединения по пп.1-3, в которых каждый из R 3 и R4 представляет собой гидроксильный радикал. 5. Соединения по пп.1-4, в которых каждый из R 2 и R5 представляет собой атом хлора. 6. Соединения по пп.1-4, в которых каждый из R 2 и R5 представляет собой атом фтора. 7. Соединения по пп.1-4, в которых каждый из R 1 и R2 представляет собой атом фтора. 8. Соединения по пп.1-4, в которых R2 представляет собой метоксильный радикал и один из R1 или R5 представляет собой атом хлора. 9. Соединения по п.1, выбранные из группы, включающей следующие наименования: внутрикомплексная соль [6R-[3-(E)6a,7b(Z)]] 1-[3-[7[[(2-амино-4-тиазолил)-[[карбокси(2,3-дифтор-4,5-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]2-пропенил]имидазо[1,2-а]пиридиний, внутрикомплексная соль [6R-[3-(E)6a,7b(Z)]] 1-[3-[7[[(2-амино-4-тиазолил)-[[карбокси(2,5-дифтор-3,4-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0 ]окт-2-ен-3ил]2-пропенил]имидазо[1,2-а]пиридиний, внутрикомплексная соль [6R-[3-(E)6a,7b(Z)]] 1-[3[7-[[(2-амино-4-тиазолил)-[[карбокси(2-хлор-4,5-дигидрокси-3-метоксифе нил)метокси]имино]ацетил]а мин о ]-2 -к ар бок си-8 -ок со-5 -ти а -1 -а за бицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил]хинолиний, внутрикомплексная соль [6R-[3-(E)6a,7b(Z)]] 1-[3-[7[[(2-амино-4-тиазолил)-[[карбокси(2,5-дихлор-3,4-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]2-пропенил]-6,7-Дигидро-5Н-пиридиний, внутрикомплексная соль [6R-[3-(E)6a,7b(Z(S*))]] 1[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(3,4-дигидрокси-5-фторфенил)метокси]имино]ацетил]амино] 2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2ен-3-ил]пропенил]хинолиний, внутрикомплексная соль [6R-[3-(E)6a,7b(Z)]] 1-[3-[7-[[(2амино-4-тиазолил)-[[карбокси(2-хлор-3,4-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил] хинолиний (R) или (S),или смесь (R + S), внутрикомплексная соль [6R-[3-(E)6a,7b(Z)]] 1-[3[7-[[(2-амино-4-тиазолил)-[[карбокси(3-циано-4,5дигидроксифенил)метокси]имино]ацетил]амино]-2карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен3-ил]-2-пропенил]хинолиний (R) или (S),или смесь (R + S), внутрикомплексная соль [6R-[3-(E)6a,7b(Z)]] 1-[3-[7-[[(2амино-4-тиазолил)-[[карбокси(3-фтор-4,5-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил] хинолиний (R) или (S),или смесь (R + S), внутрикомплексная соль [6R-[3-(E)6a,7b(Z)]] 7-[3-[7[[(2-амино-4-тиазолил)-[[карбокси(2,5-дихлор-3,4-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]2-пропенил]тиено[2,3-b]пиридиний (R) или (S),или смесь (R + S), внутрикомплексная соль [6R-[3-(E)6a,7b(Z)]] 1-[3-[7-[[(2амино-4-тиазолил)-[[карбокси(2,5-дихлор-3,4-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]-2-пропенил] хинолиний (R) или (S),или смесь (R + S), внутрикомплексная соль [6R-[3-(E)6a,7b[Z(S*)]]] 1[3-[7-[[(2-амино-4-тиазолил)-[[карбокси(3-циано4,5-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2ен-3-ил]-2-пропенил]тиено[2,3-b]пиридиний, внутрикомплексная соль [6R-[3-(E)6a,7b(Z)]] 1-[3-[7[[(2-амино-4-тиазолил)-[[карбокси(2,5-дихлор-3,4-дигидроксифенил)метокси]имино]ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3ил]-2-пропенил]изохинолиний (R) или (S), или смесь (R + S), 2 37180 внутрикомплексная соль [6R-[3-(E)6a,7b(Z)]] 1-[3[7-[[2-амино-4-тиазолил)-[[карбокси(2,5-дихлор-3,4дигидроксифе нил)метокси]имино]ацетил]амино]-2карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен3-ил]-2-пропенил]-4-(метилтио)-пиридиний (R) или (S), или смесь (R + S). 10. Соединения по пп.1-9 и их кислотно-аддитивные соли, проявляющие антибиотическую активность. 11. Способ получения производных син-изомера цефема общей формулы (I): (II) где R1, R2, R3, R4, R5 определены выше, с защищенными, при необходимости, функциональными группами, гомологизируют бромоформом в системе водная щелочь - органический растворитель, затем, при необходимости, выделяют полупродукт; б) к раствору полученной кислоты общей формулы (III) (I) (III) в органическом растворителе в инертной атмосфере добавляют раствор дифенилдиазометана в органическом растворителе, выделяют полупродукт, при необходимости; в) раствор полученного сложного эфира общей формулы (IV) где R1, R2, R3, R5 = H, OH, ОС1-С4-алкил, ОСОС1С4-алкил, галоген, CN, NO2, независимо друг от друга, причем если R3 = ОН или ОСОС1-С4-алкил, то R1, R2 , R5 отличны от H, R4 = ОН, ОСОС1-С4-алкил, А и А1 = Н или эквивалент щелочного или щелочноземельного металла, магния, аммония либо органического амина, или группы СООА и СООА1 представляют собой группу СОО-, волнистая линия означает, что группа -CH2R6Å нахо дится в положении Е или Z, R6Å = тиено[2,3-с]пиридиний, тиено[3,2-с]пиридиний, тиено[2,3-b]пиридиний, тиено[3,2-b]пиридиний и пиридиний, каждая из которых может быть замещена С1-С4алкилом, С1-С4алкилтиогруппой, карбоксильной или карбамоильной группой, 2аминотиазол[5,4-b]пиридиний, имидазо[2,1-b]тиазолий, тиазолий, имидазо[1,2-а]пиридиний, хинолиний, изохинолиний, 6,7-дигидро-5Н-пиридиний, пиридазиний, 1-(3-метоксипропил)-1Н-пиразолий, 1(С1-С4)алкил-1Н-бензимидазолий, 5, 6, 7, 8тетрагидрохинолиний, 5, 6, 7, 8, 9,10,11, 12,13, 14декагидроциклододека[b]пиридиний, а также группу , (IV) где R7 = ди фенилметил, в тетрагидрофуране обрабатывают N-гидроксифталимидом и трифенилфосфином, затем диэтилазодикарбоксилатом, затем, при необходимости, выделяют полупродукт; г) восстанавливают полупродукт общей формулы (V) (V) в органическом растворителе гидразином в инертной атмосфере, затем, при необходимости, выделяют полупродукт; д) конденсируют соединение общей формулы (VI) где Р1, Р2 и Р3 - одинаковые или различные, представляют собой фенил или С 1-С4алкил, который может быть замещен карбоксильной группой, карбамоильной группой, цианогруппой или гидроксильной группой, и пунктирная линия указывает, что Р1 и Р2 могут образовывать с атомом азота, с которым они связаны, пирролидиновый цикл; в виде R- или S-оптически активных изомеров, или их рацемической смеси, а также их соли с органическими и неорганическими кислотами, щелочными и щелочноземельными металлами и органическими основаниями, отличающийся тем, что а) альдегид общей формулы (II) (VI) 3 37180 с производным 2-аминотиазол-4-илглиоксалевой кислоты общей формулы (VII) в ацетоне йодидом щелочного металла в присутствии кристалла йода, затем, при необходимости, выделяют полупродукт; з) обрабатывают раствор соединения общей формулы (XI) (VII) (XI) где R8 представляет собой Н или защитную груп пу аминной функциональной группы в органическом растворителе, затем, при необходимости, выделяют полупродукт; е) подвергают амидированию раствор соединения общей формулы (VIII) свободным основанием R6, определенным в п. 1, затем, при необходимости, выделяют полупродукт; и) снимают с соединения общей формулы (XII) (VIII) (XII) в подходящем растворителе в присутствии карбодиимидного активатора сложным эфиром хлоргидрата 7-амино-3-(3-хлор-1-пропенил)-8-оксо-5тиа-1 -азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты формулы (IX) защитные группы кислотным гидролизом или действием тиомочевины, затем выделяют целевой продукт; й) при необходимости, переводят целевой продукт в соответствующие соли действием оснований или кислот, либо разделяют на оптически активные (R) и/или (S) изомеры. 12. Способ получения производных син-изомера цефема общей формулы (I) (IX) где R9 представляет собой остаток легко отщепляемого спирта, затем, при необходимости, выделяют полупродукт; ж) обрабатывают раствор соединения общей формулы (X) (I) где R1, R2, R3, R5 = Н, ОН, ОС1-С4-алкил, ОСОС1С4-алкил, галоген, CN, NO2, независимо друг от друга, причем если R3 = ОН или ОСОС1-С4-алкил, то R1, R2 , R5 отличны от Н, R4 = ОН, ОСОС1-С4-алкил, А и А1 = Н или эквивалент щелочного или щелочноземельного металла, магния, аммония либо органического амина, или группы СООА и СООА1 представляют собой группу СОО-, (X) 4 37180 волнистая линия означает, что группа -CH2R6Å находится в положении Е или Z, R6Å = тиено[2,3-с]пиридиний, тиено[3,2-с]пиридиний, тиено[2,3-b]пиридиний, тиено[3,2-b]пиридиний и пиридиний, каждая из которых может быть замещена С1-С4алкилом, С1-С4алкилтиогруппой, карбоксильной или карбамоильной группой, 2аминотиазол[5,4-b]пиридиний, имидазо[2,1-b]тиазолий, тиазолий, имидазо[1,2-а]пиридиний, хинолиний, изохинолиний, 6,7-дигидро-5Н-пиридиний, пиридазиний, 1-(3-метоксипропил)-1Н-пиразолий, 1-(С1-С4)алкил-1Н-бензимидазолий, 5,6,7,8-тетрагидрохинолиний, 5,6,7,8,9,10,11,12,13,14-декагидроциклододека[b]пиридиний, а также группу (XIII) где R8 представляет собой Н или защитную гр уппу аминной функциональной группы в подходящем растворителе, затем, при необходимости, выделяют полупродукт; б) снимают с соединения общей формулы (XII) где Р1, P2 и Р3 - одинаковые или различные, представляют собой фенил или С 1-С4-алкил, который может быть замещен карбоксильной группой, карбамоильной группой, цианогруппой или гидроксильной группой, и пунктирная линия указывает, что Р1 и Р2 могут образовывать с атомом азота, с которым они связаны, пирролидиновый цикл; в виде R- или S-оптически активных изомеров, или их рацемической смеси, а также их соли с органическими и неорганическими кислотами, щелочными и щелочноземельными металлами и органическими основаниями, отличающийся тем, что а) конденсируют соединение общей формулы (VI) (XII) защитные группы кислотным гидролизом или действием тиомочевины, затем выделяют целевой продукт; в) при необходимости, переводят целевой продукт в соответствующие соли действием оснований или кислот, либо разделяют на оптически активные (R) и/или (S) изомеры. 13. Фармацевтический состав антибиотического действия, включающий активное начало на основе производного цефема, содержащего в положении 3 замещенный винил, и целевые добавки, отличающийся тем, что в качестве активного начала содержит по крайней мере одно соединение общей формулы (I), охарактеризованное в п.1, в эффективном количестве. (VI) где R7 = ди фенилметил, с производным 2-аминотиазол-4-илглиоксалевой кислоты общей формулы (XIII) _______________________ Изобретение относится к синтезу биологически активных соединений, в частности к производным син-изомера цефема, к способам их получения и к фармацевтической композиции на их основе. Из патента FR 2622585 известны антибиотические композиции на основе производных цефема. Задача изобретения - расширить арсенал средств антибиотического действия. Согласно изобретению производными синизомера цефема являются соединения общей формулы I в которой R 1, R2 , R 3 и R 5 , одинаковые или различные, предста вляют собой а том водорода, атом гало гена, гидроксил, С1 -С4-а лкилоксигр упп у, ни трогр упп у, циано гр упп у и С 1-С 8ацилоксигр упп у; R4 представляют собой гидроксил или С 1-С8ацилоксигруппу, причем, если R3 означает гидроксил или ацилоксигруппу, то R1, R2 и R5 имеют значения, отличные от атома водорода; А и А' - одинаковые или различные, представляют собой атом водорода, эквивалент щелочного или щелочно-земельного металла, магния, аммония или аминированного органического основания, или же одна или обе группы -СООА и СООА' представляют собой группу -СОО-; волнистая линия означает, что гр уппа -СН2R6Å может находиться в положении Е или Z; R6Å представляют собой одну из нижеследующи х групп - тиено[2,3-с] пиридиний, тиено[3,2с] пиридиний, тиено[2.3-b] пиридиний, тиено[3,2-b] пиридиний и пиридиний, каждая из которых может быть замещена С 1-С4-алкилом, С1-С4-алкил (I) 5 37180 тиогруппой, карбоксильной или карбамоильной группой; 2-аминотиазол[5,4-b] пиридиний, имидазо[2,1-b] тиазолий, тиазолий, имидазо[1,2-а] пиридиний, хинолиний, изохинолиний, 6,7-дигидро5Н-пиридиний, пиридазиний, 1-(3-метоксипропил)-1Нпиразолий, 1-(С1-С4)алкил-1H-бензимидазолий, 5, 6, 7,8-тетрагидрохинолиний, 5,6,7,8,9,10,11,12,13,14-декагидроциклододека-(b)-пиридиний, а также группу внутрикомплексная соль (6R-(3-(E) 6a, 7b (Z))) 1 -(3-(7-(((2-амино-4-тиазолил) ((карбокси(2-хлор- 4,5дигидрокси-3-метоксифенил)метокси) имино) ацетил)амино)-2-карбокси-8 -оксо-5 -тиа-1 -азабицикло[4,2,0] окт-2-ен-З-ил)-2-пропенил) хинолиний, внутрикомплексная соль (6R-(3-(E) 6a, 7b (Z))) 1-(3-(7-(((2-амино-4-тиазолил)((карбокси(2,5-дихлор3,4-дигидроксифенил)метокси) имино) ацетил) амино)-2-карбокси-8-оксо-5-тиа-1-азабицикло[4,2,0] окт2-ен-З-ил)-2-пропенил) 6,7-дигидро-5-Н-пиридиний, внутрикомплексная соль (6R-(3-(E) 6a, 7b (Z(S*)))) 1-(3-(7-(((2-амино-4-тиазолил) ((карбокси (3,4-дигидрокси- 5-фторфенил) метокси) имино) ацетил)амино)-2-карбокси-8 -оксо-5 -тиа-1 -азабицикло[4,2,0] окт-2-ен-З-ил)-2-пропенил) хинолиний, внутрикомплексная соль [6R-[3-(E) 6a, 7b (Z)] ] 1-[3-(7-[[(2-амино-4-тиазолил) [[карбокси (2-хлор-3,4дигидроксифенил) метокси] имино] ацетил] амино]-2карбокси-8-оксо-5-тиа-1-азабицикло[4,2,0] окт-2-ен-Зил]-2-пропенил] хинолиний R или S или смесь R+S, внутрикомплексная соль [6R-[3-(E) 6a, 7b (Z)] ] 1-[3-[7-([(2-амино-4-тиазолил) [[карбокси (3-циано4,5-дигидроксифенил) метокси] имино] ацетил] амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4,2,0] окт2-ен-З-ил]-2-пропенил] хинолиний R или S или смесь R+S, внутрикомплексная соль [6R-[3-(E) 6a, 7b (Z)] ] 1-(3-(7-[[(2-амино-4-тиазолил) [[карбокси (3-фтор-4,5дигидроксифенил) метокси] имино] ацетил] амино] -2-карбокси-8-оксо-5-тиа-1-азабицикло[4,2,0] окт-2ен-З-ил]-2-пропенил] хинолиний R или S или смесь R+S, внутрикомплексная соль [6R-[3-(E) 6a, 7b (Z)] ] 1-(3-[7-[[(2-амино-4-тиазолил) [[карбокси (2,5-дихлор3,4-дигидроксифенил) метокси] имино] ацетил] амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4,2,0] окт2-ен-З-ил]-2-пропенил] тиено[2,3-b] пиридиний R или S или смесь R+S, внутрикомплексная соль [6R-[3-(E) 6a, 7b (Z)]] 1-[3-[7-[[(2-амино-4-тиазолил) [[карбокси (2,5-дихлор3,4-дигидроксифенил) метокси]имино] ацетил]амино]-2 -карбокси-8-оксо -5-тиа-1-азаби цикло[4,2,0] окт-2-ен-З-ил]-2-пропенил] хинолиний R или S или смесь R+S, внутрикомплексная соль [6R-[3-(E) 6a, 7b (Z(S*)] ] ] 1-(3-(7-[[(2-амино-4-тиазолил) [[карбокси (3-циано-4,5-дигидроксифенил) метокси] имино] ацетил] амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4,2,0] окт-2-ен-З-ил]-2-пропенил] тиено[2,3-b] пиридиний, внутрикомплексная соль [6R-[3-(E) 6a, 7b (Z)] ] 1-[З-[7-[[(2-амино-4-тиазолил) [[карбокси (2,5дихлор-3,4-дигидроксифенил) метокси] имино] ацетил] амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4,2,0] окт-2-ен-З-ил]-2-пропенил] изохинолиний R или S или смесь R+S, внутрикомплексная соль [6R-[3-(E) 6a, 7b (Z)] ] 1-[3-[7-[[(2-амино-4-тиазолил) [[карбокси (2,5дихлор- 3,4-дигидроксифенил) метокси] имино] ацетил] амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4,2,0] окт-2-ен-З-ил]-2-пропенил]-4-(метилтио) пиридиний R или S или смесь R+S. Изобретение относится к способу получения соединений формулы I, описанной выше, заключающемуся в том, что альдегид ароматического ряда формулы II где Р1 , Р2 и Р3 -одинаковые или различные, предста вляют собой фенил и ли С 1-С 4-алкил, который может быть замещен карбоксильной гр уппой, карбамоильной гр уппой, циано гр уппой или гидроксильной гр уппой, и пунктирная линия указывае т, что Р 1 и Р 2 могут образовы вать с атомом азота, с которым они связаны, пирролидиновый цикл; в виде R или S опти чески активных изомеров или в виде и х рацемической смеси, а также и х соли с ор ганическими или неорганическими кислотами, щело чными или щелочно-земельными металлами и органическими основаниями. Продукты формулы I могут также быть представлены в виде чистой внутрикомплексной соли. Среди кислот, с помощью которых можно образовать соль соединений формулы I, можно, в частности, назвать такие кислоты, как уксусная, трифторуксусная, малеиновая, винная, фосфорная, серная, хлористоводородная, метансульфокислота, бензолсульфокислота, паратолуолсульфокислота, бромистый водород, йодистый водород. В предпочтительном варианте изобретения А' представляет собой атом водорода, а СО2А представляет собой СО2-. Предметом настоящего изобретения являются, в частности, продукты общей формулы I, в которой R6+ представляют собой один из радикалов, приведенных в конце текста. В более частном случае изобретение относится к соединениям формулы I, в которой R6+ представляет собой радикал, такой как хинолиний, изохинолиний, 4-(метилтио)пиридиний, тиено[2,3b] пиридиний, имидазо[1,2-а] пиридиний или радикал 6,7-дигидро-5Н-пиридиний. Изобретение относится к соединениям формулы I, в которых каждый из R3 и R4 представляют собой гидроксильный радикал, а R6+ имеет вышеуказанное значение. Настоящее изобретение касается, в частности, следующи х соединений: внутрикомплексная соль (6R-(3-(E) 6a, 7b (Z))) 1 -(3-(7-(((2-амино-4-тиазолил)((карбокси(2,3-дифтор4,5-дигидроксифенил)метокси) имино) ацетил) амино)-2-карбокси-8-оксо-5-тиа-1-азабицикло[4,2,0] окт2-ен-З-ил)-2-пропенил) имидазо[1,2-а] пиридиний, внутрикомплексная соль (6R-(3-(E) 6a, 7b (Z))) 1-(3-(7-(((2-амино-4-тиазолил)((карбокси(2,5-дифтор3,4-дигидроксифенил)метокси) имино) ацетил) амино)-2-карбокси-8-оксо-5-тиа-1-азабицикпо[4,2,0] окт2-ен-З-ил)-2-пропенил) имидазо(1,2-а] пиридиний, 6 37180 (II) ( (V) где R1, R2 , R3, R4 и R5 такие, как определено выше, при необходимости превращают в защищенное по функциональным группам производное альдегида ароматического ряда формулы II р которое подвергают восстановлению в производное O-замещенного гидроксиламина формулы VI (II р) ( (VI) где R1р , R2р, R 3р , R4р и R5р имеют соо тве тственно значения R1, R2 , R3 , R4 и R 5, определенные выше, или за щи щенн ую функциональн ую гр упп у, которое превращают аль фа-ги дроксикислоту форм улы III которое подвергают конденсации с производным 2-аминотиазол-4-ил глиоксиловой кислоты формулы VII ( (III) (VII) которую подвергают этерификации с получением альфа-гидрокси сложного эфира формулы IV ( где R8 представляет собой атом водорода или защитную группу аминной функциональной группы, для получения производного альфагидроксиминоуксусной кислоты формулы VIII ( (IV) (VIII) где R7 представляет собой остаток легко расщепляемого сложного эфира, и вышеуказанный альфа-гидрокси сложный эфир подвергают обработке N-гидроксифталимидом для получения соединения формулы V 7 ( 37180 которое подвергают аминированию сложным эфиром хлоргидрата 7-амино-3-(3-хлор-1-пропенил)8оксо-5-тиа-1-азабицикло[4,2,0] окт-2-ен-2-карбоновой кислоты формулы IX, или ее солей из которого при желании выделяют изомеры Е или Z или превращают изомер Z в изомер Е Соединение формулы XII превращают в целевой продукт формулы I путем удаления сложноэфирных групп R7 и R9 и в случае необходимости путем удаления гидрокси- и/или аминозащищающи х групп гидролизом или воздействием тиомочевины. Полученный целевой продукт формулы I в случае необходимости превращают в соответствующие соли воздействием основания на его карбоксильные группы или воздействием кислоты на его аминогруппу и/или подвергают разделению на оптически активные R- и S-изомеры. Изобретение касается также варианта осуществления вышеописанного способа, заключающегося в том, что O-замещенный гидроксиламин формулы VI подвергают конденсации с соединением формулы XIII где R9 представляет собой остаток легко расщепляемого сложного эфира, в результате чего получают производное 7-(N-замещенной амидо) 3-(3хлор-1-пропенил) 8-оксо-5-тиа-1-азабицикло[4,2,0] окт-2-ен-2-карбоновой кислоты формулы (X) (X) ( (XIII) ( где R6+, R8, R9 имеют значения, охарактеризованные выше. Полученное при этом соединение формулы XII, о характеризованное выше, превращают в целевой продукт формулы I путем удаления сложноэфирных гр упп R7 и R9 и в случае необходимости путем удаления гидрокси и/или аминозащищающи х гр упп гидролизом или воздействием тиомочевины. Полученный целевой продукт общей формулы I в случае необходимости превращают в соответствующие соли воздействием основания на его карбоксильные группы или воздействием кислоты на его аминогруппу и/или подвергают разделению на оптически активные R- или Sизомеры. которое превращают в 3-(3-йодопропенилированный)аналог формулы (XI) ( (XI) Защищенные гидроксильные группы R1р, R2р, R3р, R4р и R5р выбирают из ацилоксильных групп, таких как формилоксильная, ацетоксильная, пропионилоксильная, хлорацетоксильная, бромацетоксильная, дихлорацетоксильная трихлорацетоксильная, трифторацетоксильная, метоксиацетоксильная, феноксиацетоксильная, бензоилоксильная, бензоилформоксильная, паранитробензоилоксильная. Можно также назвать такие группы, как этоксикарбонилоксильная, метоксикарбонилоксильная, пропоксикарбонилоксильная, 2,2,2-трихлорэтоксикарбонилоксильная, бензилоксикарбонилоксильная, трет-бутоксикарбонилоксильная, 1-циклопропилэтоксикарбонилоксильная, фталоилоксильная, бутирилоксильная, изобутирилоксильная, валерилоксильная, изовалерилоксильная, оксалилоксильная, сукцинилоксильная и триметилацетилоксильная, фенилацетоксильная, фенилпропионилоксильная, мезилоксильная, хлорбензоилоксильная, пара-нитробензоилоксильная, пара-трет-бутилбензоилоксильная, каприлилоксильная, акрилоилоксильная, метилкарба который подвергают обработке основанием формулы R6+ для получения соединения формулы XII ( (XII) R6Å 8 37180 моилоксильная, фенилкарбамоилоксильная, нафтилкарбамоилоксильная. Можно также назвать радикалы, такие как феноксильный, 4-хлорфеноксильный, толилоксильный или трет-бутилфеноксильный, тетрагидропиранилоксильный, тетрагидротиопиранилоксильный, метокситетрагидропиранилоксильный, тритилоксильный, бензилоксильный, 4-метоксибензилоксильный, бензогидрилоксильный, трихлорэтоксильный, 1метил-1-метоксиэтоксильный или алкокси-алкоксиметильные радикалы, такие как метоксиэтоксиметильный. Защищенные гидроксильные группы R1р, R2р, R3р, R4р и R5р выбирают, в первую очередь, среди таких групп, метоксиэтоксиметоксильная группа, пропионилоксиметоксильная, ацетоксиметоксильная, бутоксильная, изобутоксильная, трет-бутоксильная, пентоксильная, гексилоксильная, бутирилоксиметоксильная, валерилоксиметоксильная, триметилацетилоксиметоксильная, 2-ацетоксиэтоксильная, 2-пропионилоксиэтоксильная, 2-бутирилоксиэтоксильная, 2-йодоэтоксильная, 2,2,2-трихлорэтоксильная, винилоксильная, аллилоксильная, этинилоксильная, пропинилоксильная, бензилоксильная, 4метоксибензилоксильная, 4-нитробензилоксильная, фенилэтоксильная, тритилоксильная, дифенилметилоксильная или 3,4-диметоксифеноксильная. Предпочтение отдается 2-метоксиэтоксиметоксильной группе (МЭМ-О). Остатки легко расщепляемых сложноэфирных групп R7 и R9 выбирают из таких групп, как бутильная, изобутильная, трет-бутильная, пентильная, гексильная, метоксиметильная, этоксиметильная, изопропилоксиметильная, альфа-метоксиэтильная, альфаэтоксиэтильная, метилтиометильная, этилтиометильная, изопропилтиометильная, триметилацетилоксиметильная, ацетоксиметильная, пропионилоксиметильная, бутирилоксиметильная, изобутирилоксиметильная, валерилоксиметильная, изовалерилоксиметильная, трет-бутилкарбонилоксиметильная, гексадеканоилоксиметильная, триметилацетилоксиметильная, пропионилоксиэтильная, изовалерилоксиэтильная, 1-ацетоксиэтильная, 2-ацетоксиэтильная, 1пропионилоксиэтильная, 2-пропионилоксиэтильная, 1бутирилоксиэтильная, 2-бутирилоксиэтильная, 1(трет-бутилкарбонилокси)этильная, 1-aцетоксипропильная, 1-гексадеканоилоксиэтильная, 1-пропионилоксипропильная, 1-метоксикарбонилоксиэтильная, метоксикарбонилоксиметильная, 1-ацетоксибутильная, 1-ацетоксигексильная, 1-ацетоксигептильная, фталидильная,5,6-диметоксифталидильная, трет-бутилкарбонилметильная, винильная, аллильная, 2хлораллильная, этинильная, пропинильная, метоксикарбонилметильная, бензильная, 4-метоксибензильная, 4-нитробензильная, фенетильная, тритильная, дифенилметильная, фенильная, 4-хлорфенильная, толильная, трет-бутилфенильная, 3,4диметоксифенильная, метоксиэтоксиметильная, диметиламиноэтильная, цианометильная, трет-бутоксикарбонилметильная, 2,2-этилендиоксиэтильная, цианоэтильная, 2,2-диметоксиэтильная, 2-хлорэтоксиметильная, (2-гидроксиэтокси)этильная, 2,3-эпоксипропильная, З-диметиламино-2-гидроксипропильная, 2-гидроксиэтильная, 2-метиламиноэтоксиметильная, (2-аминоэтокси)метильная, З-метокси-2,4тиадиазол-5-ильная тетрагидропиран-2-ильная, 1метокси-1-метилэтильная, 2-гидрокси-1-метилэтиль ная, изопропильная, карбамоилметильная, хлорметильная, 2-хлорэтильная, 2,2,2-трихлорэтильная, 2йодоэтильная, ацетильная, метильная, 2-метилтиоэтильная, тиоцианатометильная, 2-хлор-1-ацетоксиэтильная, 2-бром-1-ацетоксиэтильная, 2-фтор-1ацетоксиэтильная, 2-метокси-1 -ацетоксиэтильная, 2метил-1-ацетоксипропильная, 1-метил-1-ацетоксиэтильная, 1-(метоксиацетокси)этильная, 1-ацетилкарбонилоксиэтильная, 1-гидроксиацетоксиэтильная, 1-(2-тиенил)карбонилоксиэтильная, 1-(2-фурил)карбонилоксиэтильная, 1-(5-нитро-2-фурил)карбонилоксиэтильная, 1 -(2-пирролил) карбонилоксиэтильная, 1(пропионилоксикарбонилокси)этильная, 1-(пропоксикарбонилокси)этильная, 1-(изопропоксикарбонилокси) этильная, 1-(метоксиэтоксикарбонилокси)этильная, 1 (аллилоксикарбонилокси)этильная, изопропоксикарбонилметильная, 1-[(2,3-эпоксипропил)оксикарбонилокси] этильная, 1-[(2-фурил) метоксикарбонилокси] этильная, 1-[(2-фторэтокси) карбонилокси] этильная, 1(метоксикарбонилокси)пропильная, 1-(метоксикарбонилокси) 1 -метилэтильная, (метоксикарбонилокси)хлорметильная, 1-(метоксикарбонилокси)2-хлорэтильная, 1 (метоксикарбонилокси)2-метоксиэтильная, 1-(метоксикарбонилокси)аллильная или 5-метил-2-оксо-1,3-диоксол-4-ильный остаток. Предпочтение отдается дифенилметильному радикалу для R7 и 4-метоксибензильному или дифенилметильному радикалу для R9. Защитной группой аминного радикалa R8 может быть, например, карбамоилметилкарбамоильная, фенилкарбамоильная, нафтилкарбамоильная группа, а также соответствующие тиокарбамоилы, замещенный или незамещенный алкильный радикал из 1 - 6 атомов углерода, такой как, в первую очередь, трихлорэтильный, третбутильный и трет-амильный, аралкильный радикал, такой как бензильный, 4-метоксибензильный, фенетильный, тритильный, 3,4-диметоксибензильный или бензогидрильный, ацильный алифатический, ароматический или гетероциклический радикал, замещенный или незамещенный, такой как, например, формильный, ацетильный, пропионильный, бутирильный, изобутирильный, валерильный, изовалерильный, хлорацетильный, дихлорацетильный, трихлорацетильный, бромацетильный, трифторацетилбензоильный, толуолильный, нафтоильный, хлорбензоильный, паранитробензоильный, пара-трет-бутилбензоильный, феноксиацетильный, каприлильный, деканоильный, акрилоильный, фталоильный, мезильный, фенилацетильный, фенилпропионильный, оксалильный, сукцинильный, триметилацетильный или низший алкоксикарбонильный, или циклоалкоксикарбонильный, такой как, например, метоксикарбонильный, этоксикарбонильный, пропоксикарбонильный, 1-циклопропилэтоксикарбонильный, изопропоксикарбонильный, бутоксикарбонильный, третбутоксикарбонильный, пентоксикарбонильный, гексилоксикарбонильный, трихлорэтоксикарбонильный, аралкоксикарбонильная группа, такая как бензилоксикарбонильная. Предпочтение отдается третичной группе. Функциональным производным кислоты формулы VII может быть, например, галогенид, симметричный или смешанный ангидрид, амид, азид, или активированный сложный эфир. 9 37180 В качестве примера смешанного ангидрида можно назвать, например, ангидрид, образованный с хлорформиатом изобутила, а также ангидрид, образованный с хлоридом триметилацетила, и смешанные карбоксисульфоновые ангидриды, образованные, например, с хлоридом паратолуолсульфонила. В качестве примера активированного сложного эфира можно назвать сложный эфир, образованный с 2,4-динитрофенолом, а также сложный эфир, образованный с гидроксибензотиазолом. В качестве примера галогенида можно назвать хлорид или бромид. Ангидрид может быть образован на месте путем воздействия N,N-двузамещенного карбодиимида, например N,N-дициклогексилкарбодиимида. Реакция ацилирования производится предпочтительно в органическом растворителе, таком как метиленхлорид. Однако использовать можно также и другие растворители, такие как тетрагидрофуран, три хлорметан или диметилформамид. При использовании галогенида кислоты, а также тогда, когда в ходе реакции выделяется молекула галоводородной кислоты, реакция производится преимущественно в присутствии основания, такого как едкий натр, едкое кали, карбонаты и бикарбонаты натрия или калия, ацетат натрия, триэтиламин, пиридин, морфилин или Nметилморфолин. Как правило, температура реакции ниже комнатной температуры или равна ей. Можно также осуществить непосредственно реакцию соединения формулы VIII с соединением формулы IX в присутствии карбодиимида, такого как диизопропилкарбодиимид или 1-(3диметиламинопропил) 3-этилкарбодиимид (EDC). Пример подобного приготовления приводится в нижеследующей экспериментальной части. Действие реактивов, способных ввести радикал R6+, осуществляется при следующи х условиях. Можно ин ситу или отдельно произвести замещение атома хлора атомом йода в присутствии йодида натрия с последующим добавлением желаемого реактива, в присутствии или отсутствии органического растворителя, такого как дихлорметан, ацетонитрил или тетрагидрофуран. Можно также непосредственно осуществить реакцию продукта формулы Х с желаемым реактивом формулы R6+ в присутствии тетрафторбората серебра. Изомерия продуктов формулы XII может отличаться от изомерии продуктов формулы Х или XI. В случае выделения изомера Z указанный изомер может быть превращен в изомер Е с использованием обычно применяемых методом, в частности путем воздействия йодом. В соответствии с характером предпочтительно используемых защитных гр упп: тритила для R8, 2-метоксиэтоксиметила - для защиты гидроксильных функциональных групп, которые могут быть представлены одним или несколькими заместителями R1, R2, R3, R4 и R5, дифенилметила – для R7 и 4-метоксибензила или дифенилметила – для R9, то для и х удаления предпочтительно используют трифтор уксусн ую кислоту без раствори теля или в растворителе, таком как анизол или смесь растворителей, таких как анизол/метиленхлорид. Таким образом получают соль с трифторуксусной кислотой. Вернуться к свободному основанию можно воздействием основания, такого как карбонат триэтиламина. Солеобразование может производиться обычными методами, хорошо известными специалистам; оно может выполняться, например, путем воздействия на продукт в виде кислоты или на сольват, такой как, например, этаноловый сольват или гидрат этой кислоты, минеральным основанием, таким как едкий натр или едкое кали, карбонат или бикарбонат натрия или калия. Использовать можно также кислые минеральные соли, такие как третичный фосфат натрия. Возможно использование и кислых органических солей, таких как, например, натриевые соли алифатических карбоновых кислот, линейных или разветвленных, насыщенных или ненасыщенных с 1-18 или предпочтительно 2-10 атомами углерода. Али фатические цепи указанных кислот могут прерываться одним или несколькими гетероатомами, такими как кислород или сера, или замещены арильными радикалами, такими как фенил, тиенил или фурил, одним или несколькими гидроксильными радикалами или одним или несколькими галогенными атомами, такими как фтор, хлор или бром, в первую очередь хлор, одним или несколькими низшими карбоксильными или алкоксикарбонильными радикалами, в первую очередь метоксикарбонильным, этоксикарбонильным или пропилоксикарбонильным, одним или несколькими арилоксильными радикалами, в первую очередь феноксильным. Кроме того, в качестве органических кислот можно использовать достаточно растворимые ароматические кислоты, такие как, например, бензойные кислоты, замещенные, например, низшими алкильными радикалами. В качестве примеров подобных органических кислот можно назвать такие кислоты, как муравьиная, уксусная, акриловая, бутановая, адипиновая, изомасляная, н-капроновая, изокапроновая, хлорпропионовая, кротоновая, фенилуксусная, (2-тиенил)уксусная, (3-тиенил)уксусная, (4-этилфенил)уксусная, глутаровая, сложный моноэтиловый эфир адипиновой кислоты, 2-гексеновая, гептановая, декановая, олеиновая, стеариновая, пальмитиновая, 3-гидроксипропионовая, 3-метоксипропионовая, 3метилтиобутановая, 4-хлорбутановая, 4-фенилбутановая, 3-феноксибутановая, 4-этилбензойная, 1пропилбензойная кислота. Однако в качестве натриевых солей предпочтительно использование ацетата натрия, 2этилгексаноата натрия или диэтилацетата натрия. Соль можно получить путем воздействия органического основания, такого как триэтиламин, диэтиламин, триметиламин, пропиламин, N, Nдиметилэтаноламин, три(гидроксиметил) амино] метан, метиламин, этаноламин, пиридин, пиколин, дициклогексиламин, морфолин и бензиламин. Можно также использовать аргинин, лизин, прокаин, гистидин, N-метилглюкамин. Указанное солеобразование желательно производить в растворителе или в смеси растворителей, таких как вода, этиловый эфир, метанол, этанол или ацетон. 10 37180 В зависимости от условий реакции полученные соли могут быть аморфными или кристаллическими. Кристаллические соли получают, предпочтительно, путем воздействия кислотами на одну из солей вышеуказанных алифатических карбоновых кислот, предпочтительно на ацетат натрия. Солеобразование с помощью минеральных или органических кислот производится в обычных условиях. Продукты формулы I включают несколько асимметричных атомов углерода. В цефемном ядре, содержащем два асимметричных атома углерода, оба атома расположены в конформации R. Кроме того, радикал, присутствующий в оксииминной функциональной группе, включает также асимметричный атом углерода, который может иметь форму R или S или же форму смеси R+S. Разделение двух диастереоизомеров может производиться известными специалистам методами, например методом хроматографии. Продукты общей формулы I обладают высокой антибиотической активностью в отношении грамположительных бактерий, таких как стафилококки, стрептококки, в частности пенициллинустойчивые стафилококки. Их эффективность в отношении грамотрицательных бактерий, в частности на кишечные палочки, на клебсиеллу, на сальмонеллу, на протеус и на псевдомонас, особенно высока. Перечисленные свойства позволяют использовать указанные продукты, а также их кислые соли, приемлемые с фармацевтической точки зрения, в качестве медикаментов при лечении заболеваний, связанных с чувствительными микробами, в частности при лечении стафилококковых инфекций, таких как стафилококковая септицемия, злокачественные лицевые или кожные стафилококковые инфекции, пиодермии, септические или гнойные раны, карбункулы, флегмоны, рожа, острые первичные или постгриппозные стафилококковые инфекции, бронхопневмонии, легочные нагноения. Вышеуказанные продукты могут также использоваться в качестве медикаментов при лечении коли-инфекций и сочетаний инфекций, в случае протеусных, клебсиелльных и сальмонельных инфекций и иных заболеваний, вызванных грамотрицательными бактериями. Таким образом, настоящее изобретение касается фармацевтического состава антибиотического действия, включающего активное начало на основе производного цефема, содержащего в положении 3 замещенный винил, и целевые добавки, заключающегося в том, что в качестве активного начала он содержит по крайней мере одно соединение общей формулы I, о характеризованное выше, в эффективном количестве. Указанные составы могут вводиться внутрь, ректальным путем, парентеральным путем, в частности внутримышечно, или локально нанесением на кожу или на слизистые оболочки. Продукты формулы I, в частности те из них, в которых А представляет собой расщепляемый сложный эфир, могут применяться внутрь. Указанные составы могут быть твердыми или жидкими и иметь любую фармацевтическую форму, широко применяемую при лечении человека, например, простые или дражевидные таблетки, капсулы, гранулы, свечи, препараты для инъекций, мази, кремы, гели; изготавливаются они в соответствии с общепринятыми у специалистов методами. Действующее начало вводится в основы, обычно используемые при изготовлении фармацевтических составов, такие как тальк, аравийская камедь, лактоза, амидон, стеарат магния, какао-масло, водные или безводные связующие, жиры животного или растительного происхождения, производные парафина, гликоли, различные увлажняющие, диспергирующие или эмульсионные агенты, консерванты. Указанные составы могут, в частности, иметь форму порошка, предназначенного для заблаговременного растворения в соответствующем связующем, например в стерильной апирогенной воде. Применяемые дозы зависят от заболевания, от особенностей больного, способа приема и особенностей используемого препарата. Дозы для человека могут, например, составлять от 0,250 до 4 г в день, при приеме внутрь - в случае продукта, описанного в примере 1, или же от 0,500 до 1 г при трехразовом внутримышечном введении. Продукты формулы I могут также использоваться для дезинфекции хирургических инструментов. Соединения согласно изобретению относятся к категории нетоксичных. Так, тест, проведенный на мышах при концентрации 600 мг/кг, показал отсутствие токсичности (0 смертей на 3 эксперимента). Это относится, в частности, к соединениям примеров 2, 3, 44, 45, 27, 32, 39, 54 и 51. Некоторые соединения формулы II встречаются в торговой сети; другие могут быть получены из продуктов, встречающи хся в торговой сети, с применением методов, описанных в нижеследующих приготовлениях. Для получения продуктов формулы II можно также применять методы, описанные в специализированной литературе, в частности восстановление Розенмунда, восстановление бензойных кислот или формилирование ароматических циклов, например реакция Вильсмейера-Хаака, реакция Гаттермана-Коха, реакция Реймера-Тимана или реакция с хлористым формилом (см. журнал Am. Chem. Soc. 82, 2380 (1960г.)). Продукты формул VII и IX также известны в специализированной литературе, в частности в бельгийской патентной заявке BE 864828 и в патентной заявке ЕЭС ЕР 0333154. Приводимые далее примеры иллюстрируют изобретение, вместе с тем не ограничивая его. Приготовление 1: 2-хлор-3,4-бис[(2-метоксиэтокси)метокси] бензальдегид Этап А: 2-хлор-3,4-дигидроксибензальдегид27,62 г 3,4-дигидроксибензальдегида (торговый продукт) растворяют в 450 см 3 уксусной кислоты, после чего производят барботирование хлора при обычной температуре до израсходования 4,48 дм 3 газа. Взбалтывание продолжают в течение 16 ч, после чего раствор концентрируют, охлаждают до 0°С, а остаток фильтруют, промывают и высушивают. Таким образом получают 7,5 г искомого продукта, который подвергают рекристаллизации из этилацетата (t пл. =196° С). 11 37180 Этап Б: 2-хлор-3,4-бис[(2-метоксиэтокси) метокси] бензальдегид В суспензию, содержащую 11,42 г продукта, полученного на предыдущем этапе, в 120 см 3 метиленхлорида, добавляют 46 см 3 диизопропилэтиламина, охлаждают до -10°С, после чего добавляют 30,14 см 3 хлор(2-метоксиэтокси)метана, взбалтывают в течение 1 ч, разводят в 100 см 3 воды, выделяют и промывают органическую фазу, высушивают и концентрируют. Таким образом получают 22,6 г целевого продукта (Rf = 0,6). Элюант: этилацетат. Спектр ЯМР протона (CDCI3, 250 МГц, в частях на млн): 3,36 (s) и 3,38 (s): -OCH3; 3,58 (m) (4 H), 3,84 (m)(2H) и 4,06 (m)(2H): О-CH2-CH2-О; 5,29 (s) (2Н) и 5,38 (s)(2H): -O-CH 2-O; 7,21 (d) и 7,71 (d): ароматич. протон (Аг-Н); 10,36 (s): -CH= О. Приготовление 2: 3-формил-5,6-бис[(2-метоксиэтокси)метокси] бензонитрил Этап А: З-формил-6-гидрокси-5-метоксибензонитрил При взбалтывании в течение 2 ч нагревают с обратным холодильником смесь, состоящую из 23,1 г 3-бром-4-гидрокси-5-метоксибензальдегида, 9,3 г цианистой меди и 140 см 3 диметилацетамида (ДМА). После охлаждения смесь выливают на лед, экстрагируют с использованием смеси этилацетата и метанола (90:10), промывают органическую фазу, высуши вают и удаляют растворители. Таким образом получают 18 г сырого продукта, используемого на следующем этапе без дополнительной обработки (tпл. = 180° С). Этап Б: 3-формин-5,6-дигидроксибензонитрил В среде азота смешивают 18 г продукта, полученного на п ре ды дуще м этап е , и 400 см 3 ди хлорметана, охлаждают до 0°С, добавляют 150 см 3 молярного раствора трибромида бора в дихлорметане, выдерживают в течение 16 ч при комнатной температуре, концентрируют, вновь охлаждают до 0°С и добавляют 250 см 3 н. раствора хлористоводородной кислоты. Затем центрифугируют продукт, который кристаллизуется, промывают водой, высушивают и подвергают рекристаллизации из смеси изопропанола и воды (1 : 2). Таким образом получают 12 г искомого продукта. Инфракрасный спектр (Вазелиновое масло): Сильное и комплексное поглощение в области -NH/OH: 2245 см-1: º; 1700 см-1: С= О; 1602, 1597, 1520 cм -1: ароматическое ядро. Спектр ЯМР протона (DMCO, 250 МГц, в частях на млн): 7,45 (d) (J = 2): Ar-H; 7,73 (d) (J = =2): Ar-H; 9,74: CH= O; 11,15: мобильное поглощение. Этап В: 3-формил-5,6-бис [(2-метоксиэтокси) метокси] бензонитрил В суспензию, содержащую 12,6 г продукта, полученного на предыдущем этапе, в 500 см 3 дихлорметана, добавляют 53,6 см 3 диизопропилэтиламина, охлаждают до -10°С и добавляют 35,3 см 3 хлор-(2-метоксиэтокси)метана, взбалтывают в течение 1 ч, растворяют в 100 см 3 воды, выделяют и промывают органическую фаз у, высушивают и концентрируют. Таким образом получают 21,4 г целевого продукта. Спектр ЯМР протона (CDCI3, 250 МГц, в частях на млн); 3,37 (s): -OCH3; 3,58 (m) (4H), 3,85 (m) (2H) и 4,06 (m)(2H): O-CH 2-CH2О; 5,39 (s)(2H) и 5,49 (s)(2H): -O-CH 2-О; 7,76 (d) (1H) и 7,92 (d)(1H): Ar-H;9,90(s):-CH= O. Приготовление 3: 3-фтор-4,5-бис [(2-метоксиэтокси) метокси] бензальдегид Этап А: 3-фтор-4-гидрокси-5-метоксибензальдегид В течение около 2,5 ч взбалтывают при температуре 0°С в атмосфере азота смесь, состоящую из 30,4 г 4-гидрокси-5-метоксибензальдегида (ванилина), 100 см 3 ацетонитрила и 250 см 3 фреона, после чего в течение 2,5 ч производят барботирование азота, смешанного с 10% фтора, а затем одного азота. После обработки тиосульфатом, подкисления 2 н. раствором хлористоводородной кислоты и экстрагирования с использованием этилацетата, органическую фазу промывают, высушивают, концентрируют и подвергают хроматографии на двуокиси кремния с элюированием дихлорметаном. В результате получают 2,1 г искомого продукта (Rf = 0,3). Микроанализ FM = С7Н7FO3 : Вычислено, %: С 56,47; Н 4,14; F 11,16 Получено, %: С 56,4; Н 4,1; F 11,0 Этап Б: 3-фтор-4,5-дигидроксибензальдегид В среде азота смешивают 3,72 г продукта, полученного на предыдущем этапе, и 60 см 3 дихлорметана, охлаждают до 0° С, добавляют 32 см 3 молярного раствора трибромида бора в дихлорметане, выдерживают в течение 16 ч при комнатной температуре, концентрируют, вновь охлаждают до 0°С и подкисляют. Затем центрифугируют продукт, который кристаллизуется, промывают водой и высушивают. Таким образом получают 2,83 г искомого сырого продукта, используемого на следующем этапе без дополнительной обработки (Rf = 0,2). Элюант: ацетон-дихлорметан (1:9). Этап В: 3-фтор-4,5-бис [(2-метоксиэтокси) метокси] бензальдегид В суспензию, содержащую 2,8 г продукта, полученного на предыдущем этапе, в 5,6 см 3 дихлорметана, добавляют 17 см 3 диизопропилэтиламина, охлаждают до -10°С, после чего добавляют 6,5 см 3 хлор-(2-метоксиэтокси)метана, взбалтывают в течение 1 ч, разводят в 100 см 3 воды, выделяют и промывают органическую фазу, высушивают и концентрируют. Таким образом получают 5,5 г целевого продукта (Rf = 0,55). Элюант: дихлорметан-ацетон (9: 1). Инфракрасный спектр (СНСl3): ОН отсутствуе т; 1696 и 2730 см-1: СН= О сопряж. Спектр ЯМР протона (CDCI3, 200 МГц, в частях на млн): 3,36 (s) и 3,37 (s): -OCH3; 3,60 (m) (4H), 3,85 (m)(2H) и 3,96 (m)(2H): O-CH 2-CH2-O; 5,33 (s) и 5,36 (s): -O-CH 2-О; 7,32 (dd) 7,51 (m): ArH; 9,90 (m):-CH=O. Приготовление 4: 3-хлор-4,5-бис[(2-метоксиэтокси) метокси] бензальдегид Этап А: 3-хлор-4,5-дигидроксибензальдегид В среде азота смешивают 37,2 г 5хлорванилина (торговый продукт) и 800 см 3 дихлорметана, охлаждают до 0°С, добавляют 300 см 3 молярного раствора трибромида бора в дихлорметане, выдерживают в течение 16 ч при Инфракрасный спектр (СНСl3): ОН отсутствуе т; 2235 см -1: СºN; 1702 и 2730 см-1: СН= О; 1592, 1582 и 1485 см-1: ароматическое ядро. 12 37180 комнатной температуре, концентрируют, вновь охлаждают до 0°С и подкисляют. Затем центрифугируют продукт, который кристаллизуется, промывают водой, высушивают и подвергают рекристаллизации из смеси изопропанола и воды (1: 2 по объему). Таким образом получают 26,6 г искомого продукта (tпл. >260° С). Инфракрасный спектр (Вазелиновое масло): 3425 см -1: -ОН + полное поглощение; 1672 –1660 см -1: С= О; 1595, 1588, 1534, 1500 см-1: ароматич. цикл. Спектр ЯМР протона (DMCO, 250 МГц, в частях на млн): 7,24 (d J = 2 Гц) и 7,44 (d J = 2 Гц): Ar-H; 9,90 (m): -CH= О; 10,40: мобильное поглощение. Этап Б: 3-хлор-4,5-бис [(2-метоксиэтокси) метокси] бензальдегид В суспензию, содержащую 15 г продукта, полученного на предыдущем этапе, в 150 см 3 дихлорметана, добавляют 60,5 см 3 диизопропилэтиламина, охлаждают до -10°С и добавляют за 45 мин 39,7 см 3 хлор-(2-метоксиэтокси)метана, взбалтывают в течение 0,5 ч, разбавляют в 100 см 3 воды, выделяют и промывают органическую фазу, высушивают, концентрируют и подвергают хроматографии на двуокиси кремния с элюированием смесью дихлорметан-метанол (99 : 1). Таким образом получают 15,9 г целевого продукта. Инфракрасный спектр (СНСl3): 1698 и 2735 см -1: СН= О сопряж.; 1591, 1579, 1498 см -1: ароматич. цикл Спектр ЯМР протона (CDCI3, 250 МГц, в частях на млн): 3,38 (s): -ОСН3; 3,57 (m) (4H), 3,87 (m)2H) и 4,03 (m)(2H): O-СН2-СН2-О; 5,36 (s) и 5,38 (s): -O-CH2-О; 7,59 (d) 7,62 (d): Ar-H; 9,85: -CH= О. Приготовление 5: 3-нитро-4,5-бис [(2-метоксиэтокси) метокси] бензальдегид Этап А: 3-нитро-4,5-дигидроксибензальдегид В среде азота смешивают 35 г 5нитрованилина (торговый продукт) и 1200 см 3 дихлорметана, охлаждают до 0°С, добавляют 533 см 3 молярного раствора трибромида бора в дихлорметане, выдерживают в течение 2 сут при комнатной температуре, концентрируют, поглощают остаток в холодном состоянии (ледяная ванна + метанол) 300 см 3 2 н. хлористоводородной кислоты, взбалтывают в течение 2-3 ч при этой температуре и выдерживают в течение 16 ч при комнатной температуре. Затем экстрагируют с использованием этилацетата, промывают органическую фаз у, высушивают и концентрируют. Таким образом получают 18 г искомого продукта (tпл. > 260°С). Инфракрасный спектр (Вазелиновое масло): Полное поглощение в области NH/OH; 1682 см -1: С= О; 1620, 1590, 1580, 1548 и 1525 см -1: ароматич. цикл + -NO2. Этап Б: 3-нитро-4,5-бис [(2-метоксиэтокси) метокси] бензапьдегид В суспензию, содержащую 18 г продукта, полученного на предыдущем этапе, в 50 см 3 дихлорметана, добавляют 13,6 см 3 диизопропилэтиламина, охлаждают и добавляют за 45 мин 39,6 см 3 хлор-(2-метоксиэтокси)метана, взбалтывают в течение 2 ч при температуре 0°С, разбавляют в 100 см 3 воды, выделяют и промывают органическуюфазу, высушивают, концентрируют и подвер гают хроматографии на двуокиси кремния с элюированием смесью дихлорметан-ацетон (9:1). Таким образом получают 22,1 г целевого продукта (Rf = 0,3). Инфракрасный спектр (СНСl3): 1704 см -1: СН=О ; 1608, 1578, 1546, 1496 см-1: ароматич. цикл+ NО2. Спектр ЯМР протона (CDCI3, 300 МГц, в частях на млн): 3,36 и 3,38: -ОСН3; 3,55 (m), 3,87 (m): O-СН2-СН2-О; 5,41 : O-CH 2-О; 7,92 : Ar-H; 9,93 : -CH= O. Приготовление 6: 3-йод-4,5-бис[(2-метоксиэтокси) метокси] бензальдегид Этап А: 3-йод-4,5-дигидроксибензальдегид В среде азота смешивают 37,2 г 5-йодованилина (торговый продукт) и 360 см 3 дихлорметана, охлаждают до 0°С, добавляют 135 см 3 молярного раствора трибромида бора в дихлорметане, выдерживают в течение 16 ч при комнатной температуре, концентрируют, вновь охлаждают до 0°С и подкисляют. Затем центрифугируют продукт, который кристаллизуется, промывают водой, высушивают и подвергают рекристаллизации из смеси изопропанола и воды (1: 2 по объему). Таким образом получают 23,4 г искомого продукта. Инфракрасный спектр (Вазелиновое масло): Полное поглощение в области NH/OH; 1662 (m)1640 (F) см -1: C= О; 1588, 1578, 1516 см -1 : ароматич. цикл. Спектр ЯМР протона (DMCO, 250 МГц, в частях на млн): 7,25 (sl) и 7,44 (sl): Ar-H; 9,68 (m): -CH=О; 10,46, 10,43 см -1: мобильное поглощение. Этап Б: 3-йод-4,5-бис [(2-метоксиэтокси) метокси] бензальдегид В суспензию, содержащую 25,4 г продукта, полученного на предыдущем этапе, в 640 см 3 дихлорметана, добавляют 67 см 3 диизопропилэтиламина, охлаждают до -10°С, после чего добавляют за 45 мин 44 см 3 хлор (2-метоксиэтокси) метана, взбалтывают в течение 1,5 ч, разводят в 100 см 3 воды, выделяют и промывают органическую фазу, высушивают, концентрируют и подвергают хроматографии на двуокиси кремния с элюированием смесью этилацетат-гексан (1 : 1). Таким образом получают 25,5 г целевого продукта. Инфракрасный спектр (СНСl3): ОН отсутствуе т, 1698 и 2730 см-1 : СН= О; 1588, 1562 см -1 : ароматич. цикл. Спектр ЯМР протона (CDCI3, 250 МГц, в частях на млн): 3,38 (sl) (6H): -ОСН3; 3,58 (m) (4H), 3,84 (m) (2Н) и 4,05 (m) (2H): O-СН2-СН2-О; 5,33 (sl) и 5,39 (sl): O-СН2 -О; 7,68 (sl) и 7,96 (sl): Аr-Н; 9,82: -СН= О. Приготовление 7: 3,4,5-трис[(2-метоксиэтокси)метокси] бензальдегид В суспензию, содержащую 8 г 3,4,5тригидроксибензальдегида (торговый продукт) в 160 см 3 дихлорметана, добавляют 52 см 3 диизопропилэтиламина, охлаждают до 0-5°С, после чего добавляют за 1,5 ч 35 см 3 хлор-(2-метоксиэтокси)метана, взбалтывают, разводят в 100 см 3 воды, выделяют и промывают органическую фазу, высушивают и концентрируют. Таким образом получают 21,75 г сырого продукта, используемого в дальнейшем без дополнительной обработки. Инфракрасный спектр (СНСl3): ОН отсутствуе т; 1696 см -1 : СН= О; 1590, 1498 см -1 : ароматич. цикл. 13 37180 Спектр ЯМР протона (CDCI3, 250 МГц, в частях на млн): 3,36 и 3,38 (9Н): -ОСН3; 3,57 (m) (6H), 3,85 (m) (4H) и 3,99 (m) (2H): O-СН2-СН2-О; 5,31 (s) (2H) и 5,34 (s) (4H): O-СН2-О; 7,43 (s): Ar-H; 9,82: -CH= О. Приготовление 8: 2,5-дихлор-3,4-бис[(2-метоксиэтокси)метокси] бензальдегид Этап А: 2,5-ди хлор-3,4-дигидроксибензальдегид 27,6 г 3,4-дигидроксибензальдегида (торговый продукт) растворяют в 300 см 3 уксусной кислоты, после чего производят барботирование хлора при обычной температуре до израсходования 31,24 г газа. Взбалтывание продолжают в течение 42 ч, после чего раствор концентрируют, охлаждают до 0°С, а остаток фильтруют, промывают и высушивают. Таким образом получают 13,7 г искомого продукта (tпл. = 176 - 178° С; Rf = 0,1). Элюант этилацетат-циклогексан (5: 5). Спектр ЯМР протона (DMCO, 250 МГц, в частях на млн): 7,24 (d J= 2 Гц) и 7,44 (d J= 2 Гц): Ar-H; 9,90 (m): -CH= О; 10,40: мобильное поглощение. Этап Б: 2,5-дихлор-3,4-бис[(2-метоксиэтокси)метокси] бензальдегид В раствор, содержащий 6,83 г продукта, полученного на предыдущем этапе, в 265 см 3 ацетонитрила, добавляют 60,5 см 3 диизопропилэтиламина, а затем 11,27 см 3 хлор-(2- метоксиэтокси)метана, взбалтывают в течение 2 ч при температуре 35°С, выпаривают досуха, поглощают с помощью дихлорметана, промывают, высушивают, выпаривают растворитель и подвергают хроматографии на двуокиси кремния с элюированием смесью этилацетат-циклогексан (6:4). Таким образом получают 10,9 г целевого продукта (tпл.
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of sin-isomer of cephem, having antibacterial activity, method for the preparation thereof (variants) and pharmaceutical composition
Автори англійськоюASZODI Joseph, Chanto Jean-Francois, FOBO Patrik, GOUIN D’AMBRIERE Solange
Назва патенту російськоюПроизводные син-изомера цефема, обладающие антибактериальной активни\остью, способ их получения (варианты) и фармацевтический состав
Автори російськоюАСЗОДИ Жозеф, ШАНТО Жан-Франсуа, ФОБО Патрик, ГУЕН Д'АМБРИЭР Соланж
МПК / Мітки
МПК: A61K 31/545, C07C 323/56, C07C 69/734, C07C 239/00, C07C 323/52, C07D 277/42, C07C 229/40, C07C 45/71, C07C 45/67, C07C 311/35, C07C 255/57, C07C 59/00, C07C 205/00, C07D 277/20, C07D 519/00, C07C 291/00, C07D 501/00, C07C 47/52, C07C 45/63, C07C 255/56, A61K 31/546, A61P 31/04, C07C 311/27
Мітки: мають, отримання, варіанти, цефему, спосіб, похідні, антибактеріальну, склад, фармацевтичний, активність, син-ізомеру
Код посилання
<a href="https://ua.patents.su/57-37180-pokhidni-sin-izomeru-cefemu-shho-mayut-antibakterialnu-aktivnist-sposib-kh-otrimannya-varianti-i-farmacevtichnijj-sklad.html" target="_blank" rel="follow" title="База патентів України">Похідні син-ізомеру цефему, що мають антибактеріальну активність, спосіб їх отримання (варіанти) і фармацевтичний склад</a>
Попередній патент: Спосіб виготовлення цирконієвих труб
Наступний патент: Система ідентифікації та відповідач для системи ідентифікації
Випадковий патент: Кормова добавка для птиці