Заміщені спіроциклічні похідні піперидину як ліганди рецепторів гістаміну-3 (h3)
Номер патенту: 100877
Опубліковано: 11.02.2013
Автори: Данду Реддеппаредді, Хадкінз Роберт Л., Сундар Бабу Г.
Формула / Реферат
1. Сполука формули (І)
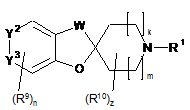 (І)
(І)
або її стереоізомерна форма, суміш стереоізомерних форм або її фармацевтично прийнятна сіль,
де:
R1 являє собою С3-С8-циклоалкіл;
W являє собою -СН2, -СН2СН2- або -СН2-О-;
k дорівнює 0, 1 або 2; m дорівнює 0, 1 або 2; а сума m і k дорівнює 1, 2 або 3;
Y2=Y3 являє собою -С(Х)=СН- або -СН=С(Х)-;
X являє собою R2, -OR2, -(С1-С3-алкіл)-R2, -О-(С1-С3-алкіл)-R2, -NHR2, -NHC(=O)R2 або -NHC(=O)NHR2; де вказаний С1-С3-алкіл необов'язково заміщений -ОН або С1-С4-алкокси;
R2 являє собою
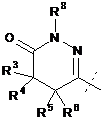 ,
,  ,
, 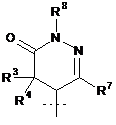 ,
, 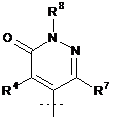 ,
, 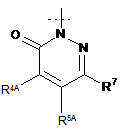 або
або 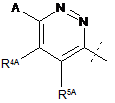 ;
;
А являє собою F, Сl або Br;
R3 являє собою H, F або С1-С4-алкіл;
R4 являє собою Н, F або С1-С4-алкіл;
R4A являє собою Н, F, Сl, Вr або С1-С4-алкіл;
R5 являє собою Н, F або С1-С4-алкіл;
R5A являє собою Н, F, Сl, Вr, С1-С4-алкіл або феніл;
або R4 і R5, взяті разом з атомами вуглецю, з якими вони зв'язані, утворюють конденсоване С3-С6-циклоалкільне кільце, необов'язково заміщене 1, 2 або 3 R14;
або R4A і R5A, взяті разом з атомами вуглецю, з якими вони зв'язані, утворюють конденсоване фенільне кільце, необов'язково заміщене 1, 2 або 3 R14;
С3-С6-циклоалкільне кільце, необов'язково заміщене 1, 2 або 3 R14;
5-6-членну конденсовану гетероарильну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, О та S, де вказана конденсована гетероарильна кільцева система необов'язково заміщена 1, 2 або 3 R14; або
5-6-членну конденсовану гетероциклоалкільну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, О, S, SO та SO2, де вказана гетероциклоалкільна кільцева система необов'язково заміщена 1, 2 або 3 R14;
R6 являє собою Н, F або С1-С4-алкіл;
R7 являє собою Н, F, Сl, Вr або С1-С4-алкіл;
R8 являє собою Н, -C(=O)R27, -CO2R27, С1-С6-алкіл, необов'язково заміщений 1-3 R20;
С3-С8-циклоалкіл, необов'язково заміщений 1-3 R20A;
С6-С10-арил, необов'язково заміщений 1-3 R20A;
С7-С15-арилалкіл, необов'язково заміщений 1-3 R20A; або
5-10-членну гетероарильну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, О та S, де вказана гетероарильна кільцева система необов'язково заміщена 1-3 R20A;
R9, в кожному випадку, незалежно являє собою F, Сl, Вr, С1-С4-алкіл або С1-С4-алкокси;
R10 являє собою F, Сl, Вr, С1-С3-алкіл або С1-С3-алкокси;
R14, в кожному випадку, незалежно являє собою F, Сl, Вr, І, -OR21, -OR22, -NR23R24, -NHOH, -NO2, -CN, -CF3, (=O), -C(=O)R21, -CO2R21, -OC(=O)R21, -C(=O)NR23R24, -NR27C(=O)R21, -NR27C(=O)OR21, -OC(=O)NR23R24, -NR27C(=S)R21, -SR21, -S(O)R21 або -S(O)2R21; С1-С6-алкіл, необов'язково заміщений OR26; С2-С6-алкеніл або С2-С6-алкініл;
R20, в кожному випадку, незалежно являє собою F, Сl, Вr, І, -OR21, -OR22, -NR23R24, -NHOH, -NO2, -CN, -CF3, (=O), -C(=O)R21, -CO2R21, -OC(=O)R21, -C(=O)NR23R24, -NR27C(=O)R21, -NR27C(=O)OR21, -OC(=O)NR23R24, -NR27C(=S)R21, -SR21, -S(O)R21 або -S(O)2R21; С1-С6-алкіл, необов'язково заміщений OR26; С2-С6-алкеніл, С2-С6-алкініл, С3-С7-циклоалкіл, феніл, 3-7-членну гетероциклоалкільну групу або 5- або 6-членну гетероарильну групу;
R20A, в кожному випадку, незалежно являє собою F, Сl, Br, I, -OR21, -OR22, -NR23R24, -NHOH, -NО2, -CN, -CF3, (=O), -C(=O)R21, -CO2R21, -OC(=O)R21, -C(=O)NR23R24, -NR27C(=O)R21, -NR27C(=O)OR21, -OC(-O)NR23R24, -NR27C(=S)R21, -SR21, -S(O)R21 або -S(O)2R21; С1-С6-алкіл, необов'язково заміщений OR26; С2-С6-алкеніл або С2-С6-алкініл;
R21, в кожному випадку, незалежно являє собою Н, С1-С6-алкіл, С6-С10-арил або С7-С15-арилалкіл;
R22, в кожному випадку, незалежно являє собою залишок амінокислоти після видалення гідроксильної групи з карбоксильної групи;
R23 і R24, в кожному випадку, незалежно вибирають з Н, С1-С6-алкілу та С6-С10-арилу;
або R23 і R24, взяті разом з атомом азоту, з яким вони зв'язані, утворюють 3-7-членну гетероциклоалкільну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, О і S, де вказана гетероциклоалкільна кільцева система необов'язково заміщена =O;
R26 являє собою Н або С1-С6-алкіл;
R27 являє собою Н або С1-С6-алкіл;
n дорівнює 0, 1, 2 або 3; і
z дорівнює 0, 1, 2, 3, 4, 5 або 6.
2. Сполука за п.1, де W являє собою -СН2- або -СН2-СН2-.
3. Сполука за п. 1, де R2 являє собою
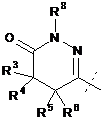 або
або  .
.
4. Сполука за п. 1, де R4 і R5, взяті разом з атомами вуглецю, з якими вони зв'язані, утворюють конденсоване циклопропільне або циклобутильне кільце.
5. Сполука за п. 1, де R4A і R5A, взяті разом з атомами вуглецю, з якими вони зв'язані, утворюють конденсоване фенільне, тієнільне, піролільне, оксазолільне, піридинільне, циклопропільне, циклобутильне, циклопентильне або циклогексильне кільце.
6. Сполука за п. 1, де сума m і k дорівнює 2.
7. Сполука за п. 1, де Y2=Y3 являє собою -С(Х)=СН-.
8. Сполука за п. 1, де X являє собою R2 або -OR2.
9. Сполука за п. 1, де R8 являє собою Н або С1-С6-алкіл, необов'язково заміщений 1-3 R20.
10. Сполука за п. 1, де R9 являє собою С1-С4-алкіл.
11. Сполука за п. 1, де n дорівнює 0 або 1.
12. Сполука за п. 1, де z дорівнює 0.
13. Сполука за п. 1, яка являє собою сполуку формули (II):
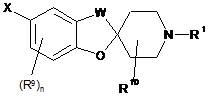 , (II)
, (II)
або її стереоізомерна форма, суміш стереоізомерних форм або її фармацевтично прийнятна сіль, де:
R1 являє собою С3-С8-циклоалкіл;
W являє собою -СН2- або -СН2-СН2-;
X являє собою R2, -OR2 або -NHR2;
R2 являє собою:
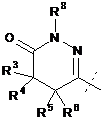 ,
,  ,
, 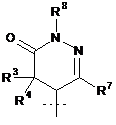 aбo
aбo 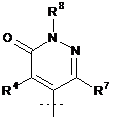 ,
,
R3 являє собою Н або С1-С4-алкіл;
R4 являє собою Н або С1-С4-алкіл;
R4A являє собою Н або С1-С4-алкіл;
R5 являє собою Н або С1-С4-алкіл;
R5A являє собою Н, С1-С4-алкіл або феніл;
або R4 і R5, взяті разом з атомами вуглецю, з якими вони зв'язані, утворюють конденсоване С3-С6-циклоалкільне кільце, необов'язково заміщене 1-3 R14;
або R4A і R5A, взяті разом з атомами вуглецю, з якими вони зв'язані, утворюють конденсоване фенільне кільце, необов'язково заміщене 1-3 R14;
С3-С6-циклоалкільне кільце, необов'язково заміщене 1-3 R14;
5-6-членну конденсовану гетероарильну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, О та S, де вказана гетероарильна кільцева система необов'язково заміщена 1-3 R14;
або 5-6-членну конденсовану гетероциклоалкільну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, О, S, SO та SO2, де вказана гетероциклоалкільна кільцева система необов'язково заміщена 1-3 R14;
R6 являє собою Н або С1-С4-алкіл; і
R7 являє собою Н або С1-С4-алкіл.
14. Сполука за п. 13, де R1 являє собою циклобутил або циклопентил.
15. Сполука за п. 13, де R2 являє собою
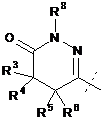 ,
,  aбo
aбo 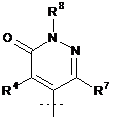 .
.
16. Сполука за п. 13, де R4 і R5, взяті разом з атомами вуглецю, з якими вони зв'язані, утворюють конденсоване циклопропільне або циклобутильне кільце.
17. Сполука за п. 13, де R4А і R5А, взяті разом з атомами вуглецю, з якими вони зв'язані, утворюють конденсоване фенільне, тієнільне, піролільне, оксазолільне, піридинільне, циклопропільне, циклобутильне, циклопентильне або циклогексильне кільце.
18. Сполука за п. 13, де R8 являє собою Н.
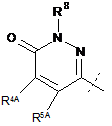
19. Сполука за п. 1, яка являє собою сполуку формули (III):
 , (III)
, (III)
або її стереоізомерна форма, суміш стереоізомерних форм або фармацевтично прийнятна сіль, де:
R1 являє собою С3-С8-циклоалкіл;
W являє собою -СН2- або -СН2-СН2-;
R2 являє собою
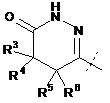 або
або 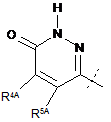 ;
;
R3 являє собою Н, метил або етил;
R4 являє собою Н, метил або етил;
R4A являє собою Н, метил або етил;
R5 являє собою Н, метил або етил;
R5A являє собою Н, метил або етил;
або R4 і R5, взяті разом з атомами вуглецю, з якими вони зв'язані, утворюють конденсоване С3-С6-циклоалкільне кільце;
або R4A і R5A, взяті разом з атомами вуглецю, з якими вони зв'язані, утворюють конденсоване фенільне кільце;
С3-С6-циклоалкільне кільце;
5-6-членну конденсовану гетероарильну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, О і S; або
5-6-членну конденсовану гетероциклоалкільну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, О, S, SO і SO2;
R6 являє собою Н, метил або етил;
R7 являє собою Н, метил або етил;
R9, в кожному випадку, незалежно являє собою, F, Сl, метил, етил, метокси або етокси;
R10 являє собою F, Сl, метил, етил, метокси або етокси; і
n дорівнює 0, 1 або 2.
20. Сполука за п. 1, яка являє собою сполуку формули (III):
 , (III)
, (III)
або її стереоізомерна форма, суміш стереоізомерних форм або фармацевтично прийнятна сіль, де:
R1 являє собою циклобутил або циклопентил;
W являє собою -СН2- або -СН2-СН2-;
R2 являє собою
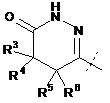 або
або  ;
;
R3 являє собою Н, метил або етил;
R4 являє собою Н, метил або етил;
R4A являє собою Н, метил або етил;
R5 являє собою Н, метил або етил;
R5A являє собою Н, метил або етил;
або R4 і R5, взяті разом з атомами вуглецю, з якими вони зв'язані, утворюють конденсоване циклопропільне, циклобутильне або циклопентильне кільце;
або R4A і R5A, взяті разом з атомами вуглецю, з якими вони зв'язані, утворюють конденсоване фенільне, тієнільне, піролільне, оксазолільне, піридинільне, циклопропільне, циклобутильне, циклопентильне або циклогексильне кільце;
R6 являє собою Н, метил або етил;
R7 являє собою Н, метил або етил;
R9, в кожному випадку, незалежно являє собою F, Сl, метил, етил, метокси або етокси;
R10 являє собою F, Сl, метил, етил, метокси або етокси; і
n дорівнює 0, 1 або 2.
21. Сполука за п. 1, вибрана із групи, яка складається з:
 ,
,
 ,
,
 ,
,
 ,
,
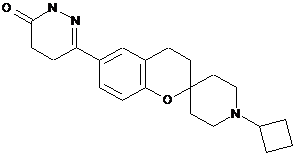 ,
,
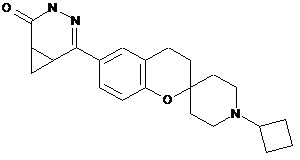 ,
,
 ,
,
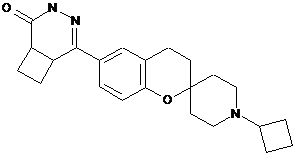 ,
,
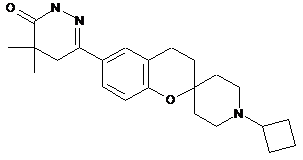 ,
,
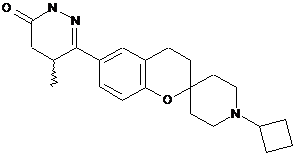 ,
,
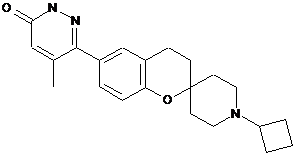 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
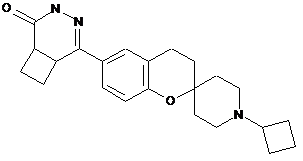 ,
,
 ,
,
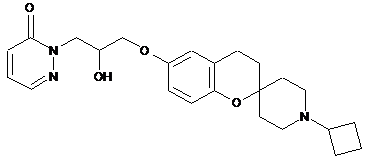 ,
,
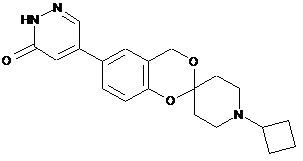 ,
,
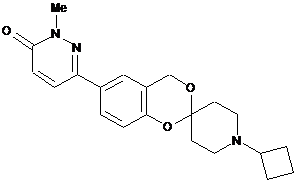 ,
,
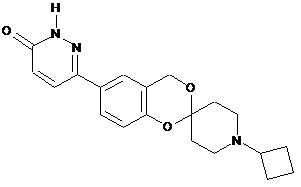 ,
,
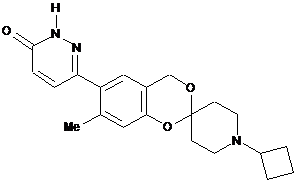 ,
,
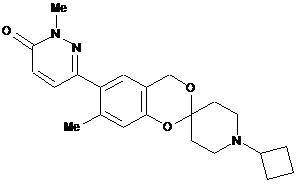 ,
,
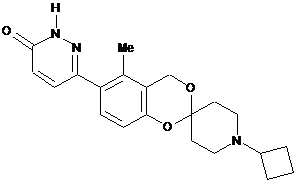
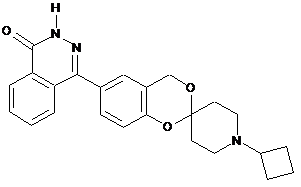 ,
,
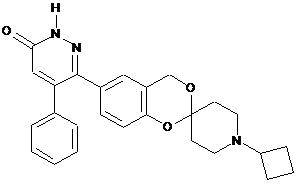 ,
,
 ,
,
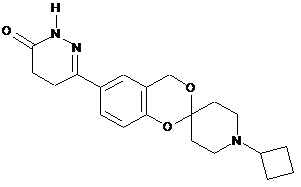 ,
,
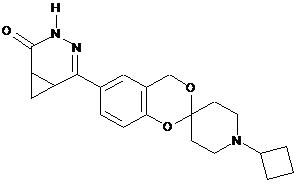 ,
,
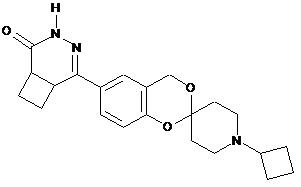 ,
,
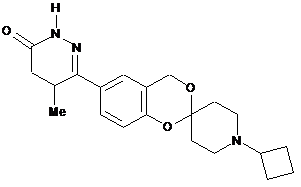 ,
,
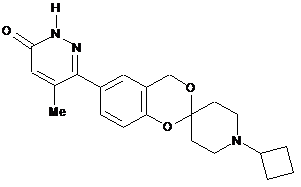 i
i
 ,
,
або її стереоізомерна форма, суміш стереоізомерних форм або фармацевтично прийнятна сіль.
22. Фармацевтична композиція, яка містить сполуку за п. 1 або її стереоізомерну форму, суміш стереоізомерних форм або фармацевтично прийнятну сіль і один або декілька фармацевтично прийнятних наповнювачів.
23. Спосіб лікування захворювання, вибраного з групи, яка складається з нарколепсії або розладу сну/прокидання, розладу харчової поведінки, порушень харчування, ожиріння, розладу пізнавальної здатності, розладу статевого збудження, розладу пам'яті, розладу настрою, зміни настрою/уваги, гіперактивності, асоційованої з синдромом дефіциту уваги (АDHD), захворювання Альцгеймера/деменції, шизофренії, болю, стресу, мігрені, морської хвороби, депресії, психічних розладів, епілепсії, розладів шлунково-кишкового тракту, респіраторних розладів, запальних захворювань та інфаркту міокарда, який включає введення суб'єкту, який потребує лікування, терапевтично ефективної кількості сполуки за п. 1 або її стереоізомерної форми, суміші стереоізомерних форм або фармацевтично прийнятної солі.
24. Спосіб за п. 23, де вказаним захворюванням є нарколепсія або розлад сну/прокидання.
25. Спосіб за п. 23, де вказаним захворюванням є гіперактивність, асоційована з дефіцитом уваги.
26. Спосіб за п. 23, де вказаним захворюванням є порушення пізнавальної здатності.
Текст
Реферат: Даний винахід стосується сполук за формулою (І): Y Y 2 W 3 (R9)n k N O R 1 m (R10)z , (І) їх використання як антагоністів/обернених агоністів Н3, способів їх одержання та їх фармацевтичних композицій. UA 100877 C2 (12) UA 100877 C2 UA 100877 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки Даний винахід стосується заміщених спіроциклічних похідних піридину, їх використання як антагоністів/обернених агоністів H3, способів їх одержання та їх фармацевтичних композицій. Рівень техніки Публікації, цитовані в даному описі, повністю включені в даний винахід через посилання. Гістамін являє собою добре відомий модулятор нейронної активності. В літературі є посилання на, щонайменше, чотири підвиди рецепторів гістаміну - H1, H2, H3, H4. H3-рецептори гістаміну відіграють ключову роль в процесах нейротрансмісії в центральній нервовій системі. H3-рецептор було винайдено в 1983 році, спочатку на нейронах, які містять гістамін, де він проявив себе як здатний до пресинаптичної дії, яка регулює вивільнення та синтез біогенного аміну гістаміну (Arrang et al, 1983), в даний час встановлено як нейротрансміттер. H 3-рецептори переважно експресовані в головному мозку, з локалізацією в церебральному кортексі, мозочку, гіпокампусі, стріатумі, таламусі та гіпоталамусі. H3-рецептори також пресинаптично локалізовані на гістамінергічних кінцях нервів і діють як інгібітори ауторецепторів (Alguacil and Perez-Garcia, 2003; Passani et al, 2004; Leurs at al, 2005; Celanire et al, 2005; Witkin and Nelson, 2004). Якщо такі рецептори активовані гістаміном, то вивільнення гістаміну інгібується. H 3-рецептори також можуть знаходитись у периферійних органах (шкірі, легенях, серцево-судинній системі, кишечнику, шлунково-кишковому тракті тощо). H3-рецептори також приймають участь в пресинаптичній регуляції вивільнення ацетилхоліну, допаміну, гамма-аміномасляної кислоти (ГАМК), глютамату й серотоніну (див. Repka-Ramirez, 2003; Chazot and Hann, 2001; Leurs et al, 1998). The H3-рецептори демонструють високий рівень конститутивної або спонтанної активності (наприклад, рецептор є активним у відсутності стимуляції агоніста) in vitro та in vivo, таким чином, ліганди рецептора можуть виявляти ефекти агоністів, нейтральних антагоністів або обернених агоністів. Знахождення й функціювання гістамінергічних нейронів у ЦНС означає те, що сполуки, які взаємодіють з H3-рецепторами, можна застосувати в кількох терапевтичних прикладеннях, включаючи нарколепсію або порушення сну/прокидання, порушення харчування, вживання їжі, ожиріння, порушення пізнавальної здатності, сексуального збудження, пам'яті, порушення настрою, зміна настрою й уваги, синдром дефіциту уваги й гіперактивності (СДУГ), захворювання Альцгеймера/слабоумство, шизофренія, біль, стрес, мігрень, морська хвороба, депресія, психіатричні порушення й епілепсія (Leurs et al, 2005; Witkin and Nelson, 2004, Hancock and Fox 2004; Esbenshade et al. 2006). H3-антагоніст/обернений агоніст може бути важливим при гастродуоденальних порушеннях, респіраторних порушеннях, таких як астма, запалення та інфаркт міокарду. В Ohtake et al. (Патент США 2006/0178375 A1) розкрито сполуки, що за повідомленнями виявляють поведінку H3-рецептора антагоніста або оберненого агоніста гістаміну і можуть бути корисними при лікуванні або запобіганні ожиріння, діабету, аномальної секреції гормонів або порушення сну. В Celanire et al. (Патенти WO 2006/103057 A1 і WO 2006/103045) розкрито сполуки, які містять групи оксазоліну або тіазоліну, способи їх одержання, їх фармацевтичні композиції та їх застосування в якості лігандів H3. В Bertrand et al. (Патент WO 2006/117609 A2) розкрито нові ліганди H3-рецепторів гістаміну, способи їх одержання та їх терапевтичне застосування. Патент Schwartz et al. (WO 2006/103546 A2) розкриває способи лікування хвороби Паркінсона, обструктивного апное сну, нарколепсії, слабоумства з тільцями Леві та/або судинне слабоумство, використовуючи неімідазольні алкіламінові похідні, що є антагоністами H3рецепторів гістаміну. Патент Apodaca et al. (EP 1 311 482 B1) розкриває неімідазольні арилоксипіперидини в якості лігандів H3-рецепторів, їх синтез та застосування для лікування порушень і хвороб, які опосередковані гістамінним рецептором. Публікація Xu et al. розкриває 6-заміщені феніл-4,5-дигідро-3(2H)-піридазинони, їх синтез та інгібіторну активність щодо агрегації кролячих кров'яних пластинок, викликану АДФ in vitro. Патент Barker et al. (патент США 2006/0217375) розкриває сполуки спіро[бензодіоксану] як активні антагоністи рецептора орексін-1 і потенційне застосування для профілактики й лікування порушень, пов'язаних з рецептором орексін-1 та рецептором орексін -2. Таким чином, існує необхідність в новітньому класі сполук, що взаємодіють з H3-рецептором. Короткий опис винаходу Даний винахід стосується сполук за формулою (I): 1 UA 100877 C2 W 2 Y k 3 Y O 9 (R )n 5 10 1 N R m 10 (R ) z (I) і стереоізомерних форм, сумішей стереоізомерних форм та їх фармацевтично прийнятних солевих форм. де: 1 R являє собою H, C1-C4 алкіл або C3-C8 циклоалкіл; W являє собою –CH2-, -CH2CH2-, або -CH2-O -; k дорівнює 0, 1 або 2; m дорівнює 0, 1 або 2; та сума m і k дорівнює 1, 2 або 3; 2 3 Y =Y являє собою –C(X)=CH- або –CH=C(X)-; 2 2 2 2 2 2 X являє собою R , -OR , -(C1-C3 алкіл)-R , -O-(C1-C3 алкіл)-R , -NHR , -NHC(=O)R , або 2 -NHC(=O)NHR ; причому вказаний C1-C3 алкіл необов'язково містить як замісники –OH або C1-C4 алкокси; 2 R являє собою 8 R R O N 3 O N 8 N R O N R 4 R O N R 20 25 30 35 R , A R7 R5A 5A O N 8 N N 3 R , N R 4 R 7 R , 4 R 7 , N N N R4A 15 R 6 5 R R 4A 8 R4A 5A R або A являє собою F, Cl або Br; 3 R являє собою H, F або C1-C4 алкіл; 4 R являє собою H, F або C1-C4 алкіл; 4A R являє собою H, F, Cl, Br або C1-C4 алкіл; 5 R являє собою H, F або C1-C4 алкіл; 5A R являє собою H, F, Cl, Br, C1-C4 алкіл або феніл; 4 5 альтернативно, R і R разом з атомами вуглецю, до яких вони приєднані, можуть 14 утворювати злите C3-C6 циклоалкільне кільце, яке необов'язково має 1, 2 або 3 замісника R ; 4A 5A альтернативно, R і R разом з атомами вуглецю, до яких вони приєднані, можуть 14 утворювати кондесоване фенільне кільце, яке необов'язково має 1, 2 або 3 замісника R ; 14 C3-C6 циклоалкільне кільце, яке необов'язково має 1, 2 або 3 замісника R ; 5-6-членну конденсовану гетероарильну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O та S, причому вказана конденсована гетероарильна кільцева 14 система необов'язково має 1, 2 або 3 замісника R ; або 5-6-членну конденсовану гетероциклоалкільну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O, S, SO та SO2, причому вказана конденсована 14 гетероциклоалкільна кільцева система необов'язково має 1, 2 або 3 замісника R ; 6 R являє собою H, F або C1-C4 алкіл; 7 R являє собою H, F, Cl, Br або C1-C4 алкіл; 8 27 27 20 R являє собою H, -C(=O)R , -CO2R , C1-C6 алкіл, який необов'язково має 1-3 замісники R ; 20A C3-C8 циклоалкіл, який необов'язково має 1-3 замісники R ; 20A C6-C10 арил, який необов'язково має 1-3 замісники R ; 20A C7-C15 арилалкіл, який необов'язково має 1-3 замісники R ; або 2 UA 100877 C2 5 10 15 20 25 30 35 5-10-членну гетероарильну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O та S, причому вказана гетероарильна кільцева система необов'язково має 1-3 20A замісника R ; 9 R , в кожному випадку, являє собою незалежно F, Cl, Br, C1-C4 алкіл або C1-C4 алкокси; 10 R являє собою F, Cl, Br, C1-C3 алкіл або C1-C3 алкокси; 14 21 22 23 24 R ,в кожному випадку, являє собою незалежно F, Cl, Br, I, -OR , -OR , -NR R , -NHOH, 21 21 21 23 24 -NO2, -CN, -CF3, (=O), -C(=O)R , -CO2R , -OC(=O)R , -C(=O)NR R , 27 21 27 21 23 24 27 21 21 -NR C(=O)R , -NR C(=O)OR , -OC(=O)NR R , -NR C(=S)R , -SR , 21 21 26 -S(O)R або -S(O)2R ; C1-C6 алкіл, необов'язково містиь як замісник OR ; C2-C6 алкініл або C2-C6 алкініл; 20 21 22 23 24 R , в кожному випадку, являє собою незалежно F, Cl, Br, I, -OR , -OR , -NR R , -NHOH, 21 21 21 23 24 -NO2, -CN, -CF3, (=O), -C(=O)R , -CO2R , -OC(=O)R , -C(=O)NR R , 27 21 27 21 23 24 27 21 21 -NR C(=O)R , -NR C(=O)OR , -OC(=O)NR R , -NR C(=S)R , -SR , 21 21 26 -S(O)R або -S(O)2R ; C1-C6 алкіл, необов'язково містить як замісник OR ; C2-C6 алкеніл, C2-C6 алкініл, C3-C7 циклоалкіл, феніл, 3-7-членну гетероциклоалкільну групу або 5-6-членну гетероарильну групу; 20A 21 22 23 24 R , в кожному випадку, являє собою незалежно F, Cl, Br, I, -OR , -OR , -NR R , -NHOH, 21 21 21 23 24 -NO2, -CN, -CF3, (=O), -C(=O)R , -CO2R , -OC(=O)R , -C(=O)NR R , 27 21 27 21 23 24 27 21 21 -NR C(=O)R , -NR C(=O)OR , -OC(=O)NR R , -NR C(=S)R , -SR , 21 21 26 -S(O)R або -S(O)2R ; C1-C6 алкіл, необов'язково містить як замісник OR ; C2-C6 алкініл або C2-C6 алкініл; 21 R , в кожному випадку, являє собою незалежно H, C1-C6 алкіл, C6-C10 арил або C7-C15 арилалкіл; 22 R , в кожному випадку, є незалежно залишком амінокислоти після видалення гідроксильної групи з карбоксильної групи; 23 24 R і R , в кожному випадку, незалежно вибирають з H, C1-C6 алкіла та C6-C10 арила; 23 24 Альтернативно, R і R , разом з атомом азоту, до якого вони приєднані, утворюють 3-7членну гетероциклоалкільну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O й S, причому вказана гетероциклоалкільна кільцева система необов'язково містить як замісник =O; 26 R являє собою H або C1–C6 алкіл. 27 R являє собою H або C1–C6 алкіл. n дорівнює 0, 1, 2 або 3; і z дорівнює 0, 1, 2, 3, 4, 5 або 6. Даний винахід також стосується способу одержання сполук за формулою (I), а також способів їх фармацевтичного застосування. Детальний опис ілюстрованих втілень винаходу В переважальних втіленнях даний винахід надає сполуки за формулою (I): W 2 Y k Y O 9 (R )n 40 45 50 1 N R 3 m 10 (R ) z (I) і стереоізомерних форм, сумішей стереоізомерних форм та їх фармацевтично прийнятних солевих форм. де: 1 R являє собою H, C1-C4 алкіл або C3-C8 циклоалкіл; W являє собою –CH2-, -CH2CH2-, або -CH2-O -; k дорівнює 0, 1 або 2; m дорівнює 0, 1 або 2; та сума m і k дорівнює 1, 2 або 3; 2 3 Y =Y являє собою –C(X)=CH- або –CH=C(X)-; 2 2 2 2 2 2 X являє собою R , -OR , -(C1-C3 алкіл)-R , -O-(C1-C3 алкіл)-R , -NHR , -NHC(=O)R , або 2 -NHC(=O)NHR ; причому вказаний C1-C3 алкіл необов'язково містить як замісники –OH або C1-C4 алкокси; 2 R являє собою 3 UA 100877 C2 8 R R O N 3 O N 8 N R O N R 4 R O N R 15 20 25 30 35 40 45 , 5A O N 8 N N 3 R , N R 4 R 7 R , 4 R 7 , N N N R7 R5A 10 R A R4A 5 R 6 5 R R 4A 8 R4A 5A R або A являє собою F, Cl або Br; 3 R являє собою H, F або C1-C4 алкіл; 4 R являє собою H, F або C1-C4 алкіл; 4A R являє собою H, F, Cl, Br або C1-C4 алкіл; 5 R являє собою H, F або C1-C4 алкіл; 5A R являє собою H, F, Cl, Br, C1-C4 алкіл або феніл; 4 5 альтернативно, R і R разом з атомами вуглецю, до яких вони приєднані, можуть 14 утворювати злите C3-C6 циклоалкільне кільце, яке необов'язково має 1, 2 або 3 замісника R ; 4A 5A альтернативно, R і R разом з атомами вуглецю, до яких вони приєднані, можуть 14 утворювати кондесоване фенільне кільце, яке необов'язково має 1, 2 або 3 замісника R ; 14 C3-C6 циклоалкільне кільце, яке необов'язково має 1, 2 або 3 замісника R ; 5-6-членну конденсовану гетероарильну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O та S, причому вказана конденсована гетероарильна кільцева 14 система необов'язково має 1, 2 або 3 замісника R ; або 5-6-членну конденсовану гетероциклоалкільну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O, S, SO та SO2, причому вказана конденсована 14 гетероциклоалкільна кільцева система необов'язково має 1, 2 або 3 замісника R ; 6 R являє собою H, F або C1-C4 алкіл; 7 R являє собою H, F, Cl, Br або C1-C4 алкіл; 8 27 27 20 R являє собою H, -C(=O)R , -CO2R , C1-C6 алкіл, який необов'язково має 1-3 замісники R ; 20A C3-C8 циклоалкіл, який необов'язково має 1-3 замісники R ; 20A C6-C10 арил, який необов'язково має 1-3 замісники R ; 20A C7-C15 арилалкіл, який необов'язково має 1-3 замісники R ; або 5-10-членну гетероарильну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O та S, причому вказана гетероарильна кільцева система необов'язково має 1-3 20A замісники R ; 9 R , в кожному випадку, являє собою незалежно F, Cl, Br, C1-C4 алкіл або C1-C4 алкокси; 10 R являє собою F, Cl, Br, C1-C3 алкіл або C1-C3 алкокси; 14 21 22 23 24 R в кожному випадку являє собою незалежно F, Cl, Br, I, -OR , -OR , -NR R , -NHOH, 21 21 21 23 24 -NO2, -CN, -CF3, (=O), -C(=O)R , -CO2R , -OC(=O)R , -C(=O)NR R , 27 21 27 21 23 24 27 21 21 -NR C(=O)R , -NR C(=O)OR , -OC(=O)NR R , -NR C(=S)R , -SR , 21 21 26 -S(O)R або -S(O)2R ; C1-C6 алкіл, необов'язково містить як замісник OR ; C2-C6 алкініл або C2-C6 алкініл; 20 21 22 23 24 R , в кожному випадку, являє собою незалежно F, Cl, Br, I, -OR , -OR , -NR R , -NHOH, 21 21 21 23 24 -NO2, -CN, -CF3, (=O), -C(=O)R , -CO2R , -OC(=O)R , -C(=O)NR R , 27 21 27 21 23 24 27 21 21 -NR C(=O)R , -NR C(=O)OR , -OC(=O)NR R , -NR C(=S)R , -SR , 21 21 26 -S(O)R або -S(O)2R ; C1-C6 алкіл, необов'язково містить як замісник OR ; C2-C6 алкеніл, C2-C6 алкініл, C3-C7 циклоалкіл, феніл, 3-7-членну гетероциклоалкільну групу або 5-6-членну гетероарильну групу; 20A 21 22 23 24 R , в кожному випадку, являє собою незалежно F, Cl, Br, I, -OR , -OR , -NR R , -NHOH, 21 21 21 23 24 -NO2, -CN, -CF3, (=O), -C(=O)R , -CO2R , -OC(=O)R , -C(=O)NR R , 27 21 27 21 23 24 27 21 21 -NR C(=O)R , -NR C(=O)OR , -OC(=O)NR R , -NR C(=S)R , -SR , 21 21 26 -S(O)R або -S(O)2R ; C1-C6 алкіл, необов'язково містить як замісник OR ; C2-C6 алкініл або C2-C6 алкініл; 4 UA 100877 C2 21 5 10 R , в кожному випадку, являє собою незалежно H, C1-C6 алкіл, C6-C10 арил або C7-C15 арилалкіл; 22 R , в кожному випадку, є незалежно залишком амінокислоти після видалення гідроксильної групи з карбоксильної групи; 23 24 R і R , в кожному випадку, незалежно вибирають з H, C1-C6 алкіла та C6-C10 арила; 23 24 альтернативно, R і R , разом з атомом азоту, до якого вони приєднані, утворюють 3-7членну гетероциклоалкільну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O й S, причому вказана гетероциклоалкільна кільцева система необов'язково містить як замісник =O; 26 R являє собою H або C1–C6 алкіл. 27 R являє собою H або C1–C6 алкіл. n дорівнює 0, 1, 2 або 3; і z дорівнює 0, 1, 2, 3, 4, 5 або 6. В переважальних втіленнях даний винахід надає сполуки за формулою (I): W 2 Y k N R 3 Y O m 9 (R )n 15 20 25 R 10 (I) і стереоізомерні форми, суміші стереоізомерних форм або фармацевтично прийнятні сольові форми, де: 1 R являє собою H, C1-C4 алкіл або C3-C8 циклоалкіл; W являє собою –CH2-, -CH2CH2-, або -CH2-O -; k дорівнює 0, 1 або 2; m дорівнює 0, 1 або 2; та сума m і k дорівнює 1, 2 або 3; 2 3 Y =Y являє собою –C(X)=CH- або –CH=C(X)-; 2 2 2 2 2 2 X являє собою R , -OR , -(C1-C3 алкіл)-R , -O-(C1-C3 алкіл)-R , -NHR , -NHC(=O)R , або 2 -NHC(=O)NHR ; 2 R являє собою 8 R R O N 3 O 45 O N R 4A 8 N R O N 8 N N 3 R 4 7 R 4 R 7 R R , , або 3 R являє собою H, F або C1-C4 алкіл; 4 R являє собою H, F або C1-C4 алкіл; 4A R являє собою H, F, Cl, Br або C1-C4 алкіл; 5 R являє собою H, F або C1-C4 алкіл; 5А R являє собою H, F, Cl, Br або C1-C4 алкіл; 4 5 альтернативно, R і R разом з атомами вуглецю, до яких вони приєднані, можуть 14 утворювати конденсоване C3-C6 циклоалкільне кільце, яке необов'язково має 1-3 замісники R ; 4A 5A альтернативно, R і R разом з атомами вуглецю, до яких вони приєднані, можуть 14 утворювати кондесоване фенільне кільце, яке необов'язково має 1-3 замісники R ; 14C3-C6 циклоалкільне кільце, яке необов'язково має 1-3 замісники R ; 5-6-членну конденсовану гетероарильну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O та S, причому вказана конденсована гетероарильна кільцева 14 система необов'язково має 1-3 замісники R ; або 5-6-членну конденсовану гетероциклоалкільну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O, S, SO та SO2, причому вказана конденсована 14 гетероциклоалкільна кільцева система необов'язково має 1-3 замісники R ; 6 R являє собою H, F або C1-C4 алкіл; 7 R являє собою H, F, Cl, Br або C1-C4 алкіл; 8 27 27 20 R являє собою H, -C(=O)R , -CO2R , C1-C6 алкіл, який необов'язково має 1-3 замісники R ; 20A C3-C8 циклоалкіл, який необов'язково має 1-3 замісники R ; 20A C6-C10 арил, який необов'язково має 1-3 замісники R ; 20A C7-C15 арилалкіл, який необов'язково має 1-3 замісники R ; або 5 R 40 R R 4 R 35 8 N N R 30 1 6 R 5A 5 UA 100877 C2 5 10 15 20 25 30 35 40 5-10-членну гетероарильну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O та S, причому вказана гетероарильна кільцева система необов'язково має 1-3 20A замісника R ; 9 R , в кожному випадку, є незалежно F, Cl, Br, C1-C4 алкіл або C1-C4 алкокси; 10 R являє собою F, Cl, Br, C1-C3 алкіл або C1-C3 алкокси; 14 21 22 23 24 R , в кожному випадку, являє собоюнезалежно F, Cl, Br, I, -OR , -OR , -NR R , -NHOH, 21 21 21 23 24 -NO2, -CN, -CF3, (=O), -C(=O)R , -CO2R , -OC(=O)R , -C(=O)NR R , 27 21 27 21 23 24 27 21 21 -NR C(=O)R , -NR C(=O)OR , -OC(=O)NR R , -NR C(=S)R , -SR , 21 21 26 -S(O)R або -S(O)2R ; C1-C6 алкіл, необов'язково містить як замісник OR ; C2-C6 алкініл або C2-C6 алкініл; 20 21 22 23 24 R , в кожному випадку, являє собою незалежно F, Cl, Br, I, -OR , -OR , -NR R , -NHOH, 21 21 21 23 24 -NO2, -CN, -CF3, (=O), -C(=O)R , -CO2R , -OC(=O)R , -C(=O)NR R , 27 21 27 21 23 24 27 21 21 -NR C(=O)R , -NR C(=O)OR , -OC(=O)NR R , -NR C(=S)R , -SR , 21 21 26 -S(O)R або -S(O)2R ; C1-C6 алкіл, необов'язково містить як замісник OR ; C2-C6 алкеніл, C2-C6 алкініл, C3-C7 циклоалкіл, феніл, 3-7-членну гетероциклоалкільну групу або 5-6-членну гетероарильну групу; 20А 21 22 23 24 R , в кожному випадку, являє собою незалежно Н, F, Cl, Br, I, -OR , -OR , -NR R , NHOH, 21 21 21 23 24 -NO2, -CN, -CF3, (=O), -C(=O)R , -CO2R , -OC(=O)R , -C(=O)NR R , 27 21 27 21 23 24 27 21 21 -NR C(=O)R , -NR C(=O)OR , -OC(=O)NR R , -NR C(=S)R , -SR , 21 21 26 -S(O)R або -S(O)2R ; C1-C6 алкіл, необов'язково містить як замісник OR ; C2-C6 алкініл або C2-C6 алкініл; 21 R , в кожному випадку, являє собою незалежно H, C1-C6 алкіл, C6-C10 арил або C7-C15 арилалкіл; 22 R , в кожному випадку, є незалежно залишком амінокислоти після видалення гідроксильної групи з карбоксильної групи; 23 24 R і R , в кожному випадку, незалежно вибирають з H, C1-C6 алкіла та C6-C10 арила; 23 24 альтернативно, R і R , разом з атомом азоту, до якого вони приєднані, утворюють 3-7членну гетероциклоалкільну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O й S, причому вказана гетероциклоалкільна кільцева система необов'язково містить як замісник =O; 26 R являє собою H або C1–C6 алкіл. 27 R являє собою H або C1–C6 алкіл. n дорівнює 0, 1, 2 або 3; і 1 В переважальних втіленнях даний винахід надає сполуки, де R являє собою C3-C8 циклоалкіл. 1 В переважальних втіленнях даний винахід надає сполуки, де R являє собою C3-C8 циклобутіл або циклопентіл. В переважальних втіленнях даний винахід надає сполуки, де W являє собою -CH2- або -CH2CH2-. 2 В переважальних втіленнях даний винахід надає сполуки, де R являє собою 8 R R O N 3 O N 8 N N R 4 R 5 50 R R 4A 5A R або 4 5 В переважальних втіленнях даний винахід надає сполуки, де R і R , разом з атомами вуглецю, до яких вони приєднані, утворюють конденсоване циклопропільне або циклобутільне кільце. 4A 5A В переважальних втіленнях даний винахід надає сполуки, де R і R , разом з атомами вуглецю, до яких вони приєднані, утворюють конденсоване фенільне, тієнільне, пірролільне, оксазолільне, піридинільне, циклопропільне, циклобутильне, циклопентильне або циклогексильне кільце. Переважальні втілення даного винаходу включають такі, де k дорівнює 1. Інші втілення включають такі, де m дорівнює 1. Інші втілення включають такі, де сума m і k дорівнює 2. R 45 6 6 UA 100877 C2 2 5 10 3 Також переважальними в даному винаході є такі сполуки, де Y =Y являє собою –C(X)=CH-. 2 Також переважальними є такі сполуки, де X являє собою R . В інших переважальних сполуках 2 за даним винаходом X являє собою –OR . 8 8 В деяких втіленнях даного винаходу R являє собою H. В інших втіленнях R являє собою 20 8 C1-C6 алкіл, який необов'язково мaє 1-3 замісники R . В інших втіленнях R являє собою C1-C6 алкіл. 9 В деяких переважальних втіленнях R являє собою C1-C4 алкіл. В деяких втіленнях даного винаходу n дорівнює 0. В інших втіленнях надається перевага до n рівному 1. В інших втіленнях z переважно дорівнює 0. В переважальних втіленнях даний винахід надає сполуки за формулою (II): X W 1 N R O 9 (R )n 15 10 R (II) і стереоізомерні форми, суміші стереоізомерних форм або фармацевтично прийнятні сольові форми, де: 1 R являє собою C3-C8 циклоалкіл; W являє собою -CH2- або -CH2-CH2-; 2 2 2 X являє собою R , -OR або -NHR ; 2 R являє собою 8 R R O N 3 O 8 N N R O N R 4 R 5 R 20 25 30 35 40 45 R 6 R , R 4A R 5A , 8 N R O N 8 N N 3 R R 4 7 R 4 R 7 або 3 R являє собою H або C1–C4 алкіл. 4 R являє собою H або C1–C4 алкіл. 4А R являє собою H або C1–C4 алкіл. 5 R являє собою H або C1–C4 алкіл. 5А R являє собою H або C1–C4 алкіл. 4 5 альтернативно, R і R разом з атомами вуглецю, до яких вони приєднані, можуть 14 утворювати конденсоване C3-C6 циклоалкільне кільце, яке необов'язково має 1-3 замісники R ; 4A 5A альтернативно, R і R разом з атомами вуглецю, до яких вони приєднані, можуть 14 утворювати кондесоване фенільне кільце, яке необов'язково має 1-3 замісники R ; 14 C3-C6 циклоалкільне кільце, яке необов'язково має 1-3 замісники R ; 5-6-членну конденсовану гетероарильну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O та S, причому вказана конденсована гетероарильна кільцева 14 система необов'язково має 1-3 замісники R ; або 5-6-членну конденсовану гетероциклоалкільну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O, S, SO та SO2, причому вказана конденсована 14 гетероциклоалкільна кільцева система необов'язково має 1-3 замісники R ; 6 R являє собою H або C1–C4 алкіл. 7 R являє собою H або C1–C4 алкіл. 8 27 27 20 R являє собою H, -C(=O)R , -CO2R , C1-C6 алкіл, який необов'язково має 1-3 замісники R ; 20A C3-C8 циклоалкіл, який необов'язково має 1-3 замісники R ; 20A C6-C10 арил, який необов'язково має 1-3 замісники R ; 20A C7-C15 арилалкіл, який необов'язково має 1-3 замісники R ; або 5-10-членну гетероарильну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O та S, причому вказана гетероарильна кільцева система необов'язково має 1-3 20A замісника R ; 9 R , в кожному випадку, являє собою незалежно F, Cl, Br, C1-C4 алкіл або C1-C4 алкокси; 10 R являє собою F, Cl, Br, C1-C3 алкіл або C1-C3 алкокси; 14 21 22 23 24 R , в кожному випадку, являє собою незалежно F, Cl, Br, I, -OR , -OR , -NR R , -NHOH, 7 UA 100877 C2 21 5 10 15 20 25 30 21 21 23 24 -NO2, -CN, -CF3, (=O), -C(=O)R , -CO2R , -OC(=O)R , -C(=O)NR R , 27 21 27 21 23 24 27 21 21 -NR C(=O)R , -NR C(=O)OR , -OC(=O)NR R , -NR C(=S)R , -SR , 21 21 26 -S(O)R або -S(O)2R ; C1-C6 алкіл, необов'язково містить як замісник OR ; C2-C6 алкініл або C2-C6 алкініл; 20 21 22 23 24 R , в кожному випадку, являє собою незалежно H, F, Cl, Br, I, -OR , -OR , -NR R , -NHOH, 21 21 21 23 24 -NO2, -CN, -CF3, (=O), -C(=O)R , -CO2R , -OC(=O)R , -C(=O)NR R , 27 21 27 21 23 24 27 21 21 -NR C(=O)R , -NR C(=O)OR , -OC(=O)NR R , -NR C(=S)R , -SR , 21 21 26 -S(O)R або -S(O)2R ; C1-C6 алкіл, необов'язково містить як замісник OR ; C2-C6 алкеніл, C2-C6 алкініл, C3-C7 циклоалкіл, феніл, 3-7-членну гетероциклоалкільну групу або 5-6-членну гетероарильну групу; 20А 21 22 23 24 R , в кожному випадку, являє собою незалежно Н, F, Cl, Br, I, -OR , -OR , -NR R , NHOH, 21 21 21 23 24 -NO2, -CN, -CF3, (=O), -C(=O)R , -CO2R , -OC(=O)R , -C(=O)NR R , 27 21 27 21 23 24 27 21 21 -NR C(=O)R , -NR C(=O)OR , -OC(=O)NR R , -NR C(=S)R , -SR , 21 21 26 -S(O)R або -S(O)2R ; C1-C6 алкіл, необов'язково містить як замісник OR ; C2-C6 алкініл або C2-C6 алкініл; 21 R , в кожному випадку, являє собою незалежно H, C1-C6 алкіл, C6-C10 арил або C7-C15 арилалкіл; 22 R , в кожному випадку, є незалежно залишком амінокислоти після видалення гідроксильної групи з карбоксильної групи; 23 24 R і R , в кожному випадку, незалежно вибирають з H, C1-C6 алкіла та C6-C10 арила; 23 24 альтернативно, R і R , разом з атомом азоту, до якого вони приєднані, утворюють 3-7членну гетероциклоалкільну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O й S, причому вказана гетероциклоалкільна кільцева система необов'язково містить як замісник =O; 26 R являє собою H або C1–C6 алкіл. 27 R являє собою H або C1–C6 алкіл; і n дорівнює 0, 1, 2 або 3. 1 В переважальних втіленнях даний винахід надає сполуки, де R являє собою циклобутил або цилклопентил. 2 В переважальних втіленнях даний винахід надає сполуки, де R являє собою 8 R R O N 3 O N 8 N N R 4 R 5 40 R 4A 5A R або 4 5 В переважальних втіленнях даний винахід надає сполуки, де R і R , разом з атомами вуглецю, до яких вони приєднані, утворюють конденсоване циклопропільне або циклобутильне кільце. 4A 5A В переважальних втіленнях даний винахід надає сполуки, де R і R , разом з атомами вуглецю, до яких вони приєднані, утворюють конденсоване фенільне, тієнільне, пірролільне, оксазолільне, піридинільне, циклопропільне, циклобутильне, циклопентильне або циклогексильне кільце. 8 В переважальних втіленнях даний винахід надає сполуки, де R являє собою Н. В переважальних втіленнях даний винахід надає сполуки за формулою (III): R 35 R 6 2 R W 1 N R 9 (R )n 45 O 10 R (III) і стереоізомерні форми, суміші стереоізомерних форм або фармацевтично прийнятні сольові форми, де: 1 R являє собою C3-C6 циклоалкіл; W являє собою -CH2- або -CH2-CH2-; 8 UA 100877 C2 2 R являє собою H N O R 3 R H O N 4 N N 4A R 5 R R 6 5A R або 3 5 10 15 20 R являє собою H, метил або етил; 4 R являє собою H, метил або етил; 4А R являє собою H, метил або етил; 5 R являє собою H, метил або етил; 5А R являє собою H, метил або етил; 4 5 альтернативно, R і R разом з атомами вуглецю, до яких вони приєднані, можуть утворювати конденсоване C3-C6 циклоалкільне кільце; 4А 5А альтернативно, R і R разом з атомами вуглецю, до яких вони приєднані, можуть утворювати конденсоване фенільне кільце; C3-C6 циклоалкільне кільце; 5-6-членну конденсовану гетероарильну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O й S; або 5-6-членну конденсовану гетероциклоалкільну кільцеву систему, яка містить один, два або три гетероатоми, вибрані з N, O, S; SO, і SO2; 6 R являє собою H, метил або етил; 7 R являє собою H, метил або етил; 9 R , в кожному випадку, є незалежно, F, Cl, метилом, етилом, метокси або етокси; 10 R являє собою F, Cl, метил, етил, метокси або етокси; і n дорівнює 0, 1 або 2. В переважальних втіленнях даний винахід надає сполуки за формулою (III): 2 R W 1 N R O 9 (R )n 25 30 10 R (III) і стереоізомерні форми, суміші стереоізомерних форм або фармацевтично прийнятні сольові форми, де: 1 R являє собою циклобутил або циклопентил; W являє собою -CH2- або -CH2-CH2-; 2 R являє собою H N O R 3 R H O N 4 N N 4A R 5 R R 6 або 5A R 3 35 R являє собою H, метил або етил; 4 R являє собою H, метил або етил; 4А R являє собою H, метил або етил; 5 R являє собою H, метил або етил; 5А R являє собою H, метил або етил; 4 5 альтернативно, R і R разом з атомами вуглецю, до яких вони приєднані, можуть утворювати конденсоване циклопропільне, циклобутильне або циклопентильне кільце; 9 UA 100877 C2 4А 5 R O R 10 15 20 25 30 35 40 45 50 5А альтернативно, R і R разом з атомами вуглецю, до яких вони приєднані, можуть утворювати конденсоване фенільне, тієнільне, пірролільне, оксазолільне, піридинільне, циклопропільне, циклобутильне, циклопентильне або циклогексильне кільце; 6 R являє собою H, метил або етил; 7 R являє собою H, метил або етил; 9 R , в кожному випадку, являє собою незалежно, F, Cl, метил, етил, метокси або етокси; 10 R являє собою F, Cl, метил, етил, метокси або етокси; і n дорівнює 0, 1 або 2. 2 В переважальних втіленнях даний винахід надає сполуки, де R являє собою 4 8 N N R 7 . В іншому втіленні даний винахід надає фармацевтичні композиції, які включають сполуку згідно даному винаходу та один або більше фармацевтично прийнятних допоміжних засобів. В додатковому втіленні даний винахід надає спосіб лікування порушення, вибраного з групи, яка містить нарколепсію або порушення сну/прокидання, порушення харчової поведінки, вживання їжі, ожиріння, порушення пізнавальної здатності, сексуального збудження, пам'яті, порушення настрою, зміна настрою й уваги, синдром дефіциту уваги й гіперактивності (СДУГ), захворювання Альцгеймера/слабоумство, шизофренія, біль, стрес, мігрень, морська хвороба, депресія, психіатричні порушення, епілепсія, шлунково-кишкові захворювання, респіраторні порушення, запалення й інфаркт міокарду, який включає призначення суб'єкту, який потребує такого лікування, терапевтично ефективної кількості сполуки за даним винаходом. В переважальному втіленні даний винахід надає спосіб лікування нарколепсії або порушень сну/прокидання. В переважальному втіленні даний винахід надає спосіб лікування синдрому дефіциту уваги й гіперактивності. В переважальному втіленні даний винахід надає спосіб лікування порушення пізнавальної здатності. В іншому втіленні даного винаходу йдеться про використання сполук даного винаходу в терапії. В додатковому втіленні даний винахід надає спосіб використання сполук за даним винаходом для виробництва ліків для лікування порушення, вибраного з групи, яка містить нарколепсію або порушення сну/прокидання, порушення харчової поведінки, вживання їжі, ожиріння, порушення пізнавальної здатності, сексуального збудження, пам'яті, порушення настрою, зміну настрою й уваги, синдром дефіциту уваги й гіперактивності (СДУГ), захворювання Альцгеймера/слабоумство, шизофренію, біль, стрес, мігрень, морську хворобу, депресію, психіатричні порушення й епілепсію, шлунково-кишкові захворювання, респіраторні порушення, запалення й інфаркт міокарду, який включає призначення суб'єкту, який потребує такого лікування, терапевтично ефективної кількості сполуки за даним винаходом. Визначення: У наведених та заявлених тут формулах мають на увазі, що коли будь-який символ з'являється більше одного разу в конкретній формулі або заміснику, кожного разу він має значення не залежне від іншого. Наступні терміни та вирази мають позначений зміст. В даному документі термін "приблизно" означає інтервал значень від 10 % вказаної величини. Наприклад, фраза "приблизно 50" включає 10 % від 50, або від 45 до 55.Фраза "приблизно від 10 до 100" включає 10 % від 10 і 10 % від 100, або від 9 до 110. В даному документі величини в вигляді "x-y" або "від x до y", або "від x цілком до y", включають цілі величини x, y і цілі числа між ними. Наприклад, фрази "1-6" або "від 1 до 6", або "від 1 цілком до 6" означають включення цілих чисел 1, 2, 3, 4, 5 і 6. Переважальні втілення ввключають кожне індивідуальне ціле число в інтервалі, а також будь-яку субкомбінацію цілих чисел. Наприклад, переважальні цілі числа для "1-6" можуть включати 1, 2, 3, 4, 5, 6, 1-2, 1-3, 14, 1-5, 2-3, 2-4, 2-5, 2-6 тощо. В даному документі "стабільна сполука" або "стабільна структура" означає сполуку, достатнью стійку для того, щоб витримати виділення до прийнятного ступіню очистки з реакційної суміші, й переважно здатну до формулювання в ефективний терапевтичний засіб. Даний винахід спрямовано на одержання тільки стабільних сполук. 10 UA 100877 C2 5 10 15 20 25 30 35 40 45 50 55 В даному документі "містить як замісник" означає один або більше атомів водню при вказаному атомі, який містить як замісник вибрану групу, на яку посилаються як на "замісник", за умови, що валентність заміщеного атому не перевищується, і що заміщення призводить до одержання стабільної сполуки. Прикладами переважальних замісників є -OH, алкіл, циклоалкіл, алкокси, галоген, галогеналкіл, арил, гетероарил і гетероцикліл. В даному документі термін "алкіл" означає алкільну групу з прямим або розгалуженим ланцюгом, яка має 1-8 атомів вуглецю, такі як метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, трет-бутил, пентил, ізоаміл, неопентил, 1-етилпропіл, 3-метилпентил, 2,2диметилбутил, 2,3-диметилбутил, гексил, октил і.т.д. Алкільний залишок груп, які містять алкіл, означає той же самий алкіл, що визначено вище. Найменування типу "C1-C6 алкіл" означає алкільну групу з прямим або розгалуженим ланцюгом, яка має 1-6 атомів вуглецю, наприклад метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, трет-бутил, пентил, ізоаміл, неопентил, 1-етилпропіл, 3-метилпентил, 2,2-диметилбутил, 2,3-диметилбутил, гексил тощо. Алкільні групи з меншим числом атомів вуглецю, які є переважальними, це такі вище визначені алкільні групи, які містять 1-4 атомів вуглецю. Найменування типу "C1-C4 алкіл" означає алкільний радикал, який містить 1-4 атомів вуглецю, такий як метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил і трет-бутил. Найменування типу "C1-C3 алкіл" означає алкільний радикал, який містить 1-3 атомів вуглецю, такий як метил, етил, пропіл, ізопропіл. Алкільні групи можуть бути заміщені або незаміщені. Переважальні замісники включають –OH і алкокси. В даному документі термін "алкеніл" означає прямий ланцюг або розгалужені вуглеводневі ланцюги з 2-8 атомів вуглецю, які мають, щонайменше, один подвійний зв'язок вуглець до вуглецю. Найменування "C2-C8 алкеніл" означає алкенільний радикал, який містить 2-8 атомів вуглецю. Приклади алкенільних груп включають етеніл, пропеніл, ізопропеніл, 2,4- пентадиеніл і т.д. Алкенільні групи можуть бути заміщеними або незаміщеними. В даному документі термін "алкініл" означає прямий ланцюг або розгалужені вуглеводневі ланцюги з 2-8 атомів вуглецю, які мають, щонайменше, один потрійний зв'язок вуглець до вуглецю. Найменування "C2-C8 алкініл" означає алкінільний радикал, який містить 2-8 атомів вуглецю. Приклади включають етиніл, пропиніл, ізопропиніл, 3,5-гексадиініл і.т.д. Алкінільні групи можуть бути заміщеними або незаміщеними. В даному документі термін "C1-C4 галогеналкіл" означає визначену вище групу "алкіла", заміщену одним або більше атомами галогену, що утворює стабільну сполуку. Приклади галогеналкілу включають, але не обмежуються, -CF3, -CHF2, –CH2F і CF2CF3. В даному документі термін "C1-C4 алкокси" означає визначену вище групу "алкіла", зв'язану з атомом кисню. Алкокси групи можуть бути заміщені або незаміщені. В даному документі термін "галоген" означає F, Cl, Br і I. Переважальними замісниками галогенів є F і Cl. В даному документі термін "арилалкіл" або "аралкіл" означає групу алкіла, заміщену групою арила. Найменування "C7-C15 арилалкіл" означає арилалкільний радикал, який містить 7-15 атомів вуглецю. Приклади арилалкільних груп включають, але не обмежуються, бензилом, фенетилом, діфенілметилом, діфенілетилом, нафтілметилом і.т.д., але переважно, бензил. Арилалкільні групи можуть бути заміщені або незаміщені. В даному документі термін "циклоалкіл" означає насичену або частково насичену моно- або біциклічну алкільну кільцеву систему, яка містить 3-10 атомів вуглецю. Певні втілення містять 36 атомів вуглецю, а інші втілення містять 5-6 атомів вуглецю. Найменування типу "C5-C7 циклоалкіл" означає циклоалкільний радикал, який містить 5-7 кільцевих атомів вуглецю. Приклади циклоалкільних груп включають такі групи, як циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, піненил і адамантил. Циклоалкільні групи можуть бути заміщені або незаміщені. В даному документі термін "арил" означає заміщену або незаміщену моно- або біциклічну вуглеводневу ароматичну кільцеву систему, яка містить 6-12 атомів вуглецю. Приклади включають феніл і нафтил. Переважальні арильні групи ввключають незаміщені або заміщені фенільні й нафтильні групи. Арильні групи можуть бути заміщені або незаміщені. В даному документі термін "гетероцикл", "гетероциклічний" або "гетероцикліл" означає заміщену або незаміщену кабоциклічну групу, в якій один або більше кільцевих атомів вуглецю заміщені, щонайменше, одним гетероатомом, таким як -O-, -N- або -S-. Певні втілення включають 3-6-членні кільця, інші втілення включають 5- або 6-членні кільця. Гетероатоми азоту та сірки можуть бути необов'язково оксидованими, а азот може необов'язково містити замісники в неароматичних кільцях. Відзначають, що гетероцикли можуть включати групи гетероарила та гетероциклоалкіла. Гетероциклічні групи можуть бути заміщені або незаміщені. 11 UA 100877 C2 5 10 15 20 25 30 35 40 45 50 55 В даному документі, термін "гетероарил" означає ароматичну групу або кільцеву систему, яка включає 5-10 кільцевих атомів вуглецю, в якій один або більше атомів вуглецю заміщені, щонайменше, одним гетероатомом, таким як O, N або S. Певні втілення включають 5- або 6членні кільця. Приклади гетероарильних груп включають пірроліл, фураніл, тієніл, піразоліл, імідазоліл, тіазоліл, ізотіазоліл, ізоксазоліл, оксазоліл , оксадіазоліл, триазоліл, оксатриазоліл, фуразаніл, тетразоліл, піридил, піразиніл, піримідиніл, піридазиніл, триазиніл, піколиніл, імідазопіридиніл, індоліл, ізоіндоліл, індазоліл, бензофураніл, ізобензофураніл, пуриніл, хиназолініл, хиноліл, ізохиноліл, бензімідазоліл, бензтіазоліл, бензтіофеніл, тіанафтеніл, бензоксазоліл, бензоксадіазоліл, бензізоксазоліл, цинолініл, фталазиніл, нафтиридиніл і хиноксалиніл. Гетероарильні групи можуть бути заміщені або незаміщені. В даному документі термін "гетероциклоалкіл" означає циклоалкільну групу, в якій один або більше атоів вуглецю заміщені, щонайменше, одним гетероатомом, таким як O, N, S, SO й SO2. Певні втілення включають 3-6-членні кільця, інші втілення включають 5- або 6-членні кільця. Приклади гетероциклоалкільних груп включають ацетидиніл, піролідиніл, пірролініл, імідазолідиніл, імідазолиніл, оксазолідиніл, піразолідиніл, піразолініл, піразалініл, піперидил, піреразиніл, гексагідропіримідиніл, морфолиніл, тіоморфолиніл, дигідроксибензофураніл, тетрагідрофураніл, тетрагідропіраніл, дигідрооксазоліл, дитіоніл, оксатіоніл, диоксазоліл, оксатіазоліл, піраніл, оксазиніл, оксатіазиніл і оксадіазиніл. Визначення "гетероциклоалкіл" включає конденсовані кільцеві системи, включаючі, наприклад, кільцеві системі, в яких ароматичне кільце злите з гетероциклоалкільним кільцем. Приклади таких конденсованих кільцевих систем включають, наприклад, фталамід, фталовий ангідрид, індолін, ізоіндолін, тетрагідроізохинолін, хроман, ізохроман, хромин та ізохромин. Гетероциклоалкільні групи можуть бути заміщені або незаміщені. В даному документі термін "фрагмент піридазин-3он" означає 6-10-членну гетероциклоалкільну кільцеву систему, яка містить групу піридазин-3-ону й необов'язково друге конденсоване кільце. Другим конденсованим кільцем, якщо таке присутнє, є необов'язково заміщене або незаміщене фенільне C3-C6 циклоалкільне кільце, заміщена або незаміщена 5-6членна конденсована гетероарильна кільцева система, яка містить один, два, або три гетероатоми, вибрані з N, O і S, або заміщена або незаміщена 5-6-членна конденсована гетероциклоалкільна кільцева система, яка містить один, два або три гетероатоми, вибрані з N, O й S. Приклади другого конденсованого кільця включають, але не обмежуються, фенілом, тієнілом, пірролілом, оксазолілом, піридинілом, циклопропілом, циклобутилом, циклопентилом і циклогексилом. В даному документі термін "арилалкіл" означає алкільну групу, яка заміщена на арильну групу. Приклади арилалкільних груп включають, але не обмежуються, бензилом, бромбензилом, фенетилом, бензгідрилом, дифенілметилом, трифенілметилом, дифенілетилом, нафтилметилом і.т.д. Арилалкільні групи можуть бути заміщені або незаміщені. В даному документі термін "амінокислота" означає групу, яка містить як аміно групу, так і карбоксильну групу. Втілення амінокислот винаходу включають -аміно, -аміно, амінокислоти. -амінокислоти мають загальну формулу HOOC-CH(боковий ланцюг)-NH2. Амінокислоти можуть бути в D, L або рацемічній конфігураціях. Амінокислоти включають існуючі та не існуючі в природі фрагменти. Природно існуючі амінокислоти включають 20 стандартних -амінокислот, знайдених в протеїнах, таких як гліцин, серін, тирозин, пролін, гістидин, глютамін тощо. Природно існуючі амінокислоти можуть також включати не--амінокислоти (такі як βаланін, γ-амінобутирова кислота, гомоцистеїн тощо), незвичайні амінокислоти (такі як 4гідроксипролін, 5-гидроксилізин, 3-метилгістидин тощо) і непротеїнові амінокислоти (такі як цитруллін, орнітин, канаванін тощо). Не існуючі в природі амінокислоти добре відомі в даній галузі техніки і включають аналоги до природно існуючих амінокислот. Дивись Lehninger, A. L. nd Biochemistry, 2 ed.; Worth Publishers: New York, 1975; 71-77, розкриття якого включене в даний винахід через посилання. Не існуючі в природі амінокислоти також включають амінокислоти, де бокові ланцюги заміщені синтетичними похідними. В певних втіленнях групи замісників в сполуках за даним винаходом включають залишок амінокислоти після видалення гідроксильногофрагменту з її карбоксильної групи, тобто групу за формулою -C(=O)CH(боковий ланцюг)-NH2. Типові бокові ланцюги існуючих і не існуючих в природі -амінокислот приведено нижче в Таблиці A. 12 UA 100877 C2 Таблиця А H CH3HO-CH2C6H5-CH2HO-C6H4-CH2 HS-CH2HO2C-CH(NH2)-CH2-S-S-CH2CH3-CH2CH3-S-CH2-CH2CH3-CH2-S-CH2-CH2HO-CH2-CH2C5H9C6H11C6H11-CH2CH3-CH(OH)HO2C-CH2-NHC(=O)-CH2HO2C-CH2HO2C-CH2-CH2NH2C(=O)-CH2NH2C(=O)-CH2-CH2(CH3)2-CH(CH3)2-CH-CH2CH3-CH2-CH2H2N-CH2-CH2-CH2H2N-C(=NH)-NH-CH2-CH2-CH2H2N-C(=O)-NH-CH2-CH2-CH2CH3-CH2-CH(CH3)CH3-CH2-CH2-CH2H2N-CH2-CH2-CH2-CH2 CH2 HO HO N CH2 HN N H 5 10 15 20 25 В данному документі термін "суб'єкт" означає теплокровну тварину, таку як ссавець, переважно людину або дитину людини, яку турбує або може потенційно турбувати одна або більше з наведених вище хвороб і порушень. В даному документі "терапевтично ефективна кількість" означає кількість сполуки за даним винаходом, яка є ефективною для запобігання або лікування симптомів конкретного порушення. Такі порушення включають, але не обмежуються, такими патологічними й нейрологічними порушеннями, які асоціюються з аномальною активністю рецепторів, описаних в даному документі, причому лікування або запобігання включає інгібування, індукування або підвищення їх активності через приведення рецепторів в контакт із сполукою за даним винаходом. В даному документі термін "фармацевтично прийнятний" означає такі сполуки, матеріали, композиції та/або лікарські форми, які є, з точки зору нормальної медичної практики, придатними для контакту з тканинами людських істот та тварин без надмірної токсичності, подразнення, алергічної реакції або інших ускладнень пропорційно до резонного відношення користь/риск. Фармацевтично прийнятні сполуки, матеріали, композиції та/або лікарські форми повинні бути занесені до реєстру Загально Визнаних як Безпечні (Generally Recognized as Safe (GRAS)). В даному документі термін "одноразова доза" означає єдину дозу, яка може бути введена пацієнту і яку можна тримати й пакувати, й вона залишиться фізично й хімічно стійкою одноразовою дозою, яка включає або активний компонент сам по собі, або фармацевтично прийнятну композицію, яку описано в даному винаході. Всі інші терміни, використовані в описі данного винаходу, означають те, що добре відомо в даній галузі техніки. В іншому аспекті, даний винахід стосується фармацевтично прийнятних солей сполук, описаних вище. В данному документі "фармацевтично прийнятні солі" включають солі сполук за 13 UA 100877 C2 5 10 15 20 25 30 35 40 45 50 55 60 даним винаходом, які одержано за рахунок комбінації таких сполук із нетоксичними додатковими солями кислот і основ. Кислотні додаткові солі включають неорганічні кислоти, такі як соляна, бромистоводнева, йодистоводнева, сірчана, азотна й фосфорна кислоти, а також органічні кислоти, такі як оцтова, лимонна, пропіонова, тартарова, глютамінова, саліцилова, щавлева, метансульфонова, паратолуолсульфонова, янтарна і бензойна кислоти, й зв'язані з ними неорганічні та органічні солі. Основні додаткові солі включають такі, що пішли від неорганічних основ, таких як гідроксиди амонію та лужних і лужноземельних металів, карбонатів, бікарбонатів і т. п., а також солі, які пішли від основних органічних амінів, таких як аліфатичні та ароматичні аміни, аліфатичні діаміни, гідроксиалкаміни тощо. Такі основи, користні при одержанні солей за даним винаходом, включають гідроксид амонію, карбонат калію, бікарбонат натрію, гідроксид кальцію, метиламін, диетиламін, етилендіамін, циклогексиламін, етаноламін тощо. Додатково до фармацевтично-прийнятних солей до даного винаходу включено інші солі. Вони можуть годитися в якості проміжних сполук в процесах очищення сполук, при одержанні інших солей або при ідентифікації та вивченні сполук або проміжних сполук. Фармацевтично прийнятні солі сполук за даним винаходом можуть також існувати як різні сольвати, наприклад, з водою, метанолом, етанолом, диметилформамідом, етилоцетатом тощо. Можливо також приготувати суміші таких сольватів. Джерелом такого сольвату може бути розчинник процесу кристалізації, який є притаманним розчиннику одержання або кристалізації, або побічним продуктом до такого розчинника. Такі сольвати входять в межі данного винаходу. Даний винахід також містить в собі фармацевтично прийнятні проліки сполук, про які йдеться. В даному документі "проліки" охоплюють будь-які сполуки, які перетворюються метаболічними процесами в організмі суб'єкту на активні речовини, які мають формулу, що входить в межі даного винаходу. Оскільки відомо, що проліки підсилюють численні бажані якості фармацевтичних речовин (наприклад, розчинність, біодоступність, виробництво і т. і.), такі сполуки за даним винаходом можуть доставлятися в формі проліків. Традиційні способи вибору і одержання придатних похідних проліків описано, наприклад, в Prodrugs, Sloane, K. B., Ed.; Marcel Dekker: New York, 1992, і їх повністю включено до даного винаходу через посилання. Зрозуміло, що сполуки за даним винаходом можуть існувати в формі різних стереоізомерів. Як такі, сполуки за даним винаходом включають як діастереоізомери, так і енантіомери. Як правило, сполуки одержують як рацемати, і вони можуть бути зручно використані в такій якості, адже й індивідуальні енантіомери можуть бути виділені або синтезовані придатними методами, якщо є така потреба. Такі рацемати й індивідуальні енантіомери та їх суміші утворюють частину даного винаходу. Способи одержання й виділення таких оптично активних форм добре відомі в даній галузі техніки. Специфічні стереоізомери можні одержати способом стереоспецифічного синтезу з використанням енантіометрично чистих або енантіометрично збагачених вихідних матеріалів. Специфічні стереоізомери вихідних матеріалів або продуктів можна розділити й виділити за методами, відомими в даній галузі техніки, такими як розділення рацемічних форм за допомогою традиційної, оберненофазової та хіральної хроматографії, рекристалізація, ензимне розділення або фракційна рекристалізація додаткових солей, одержаних за допомогою реагентів, використаних з цією метою. Придатні способи розділення та виділення специфічних стереоізомерів описано в Eliel, E. L.; Wilen, S.H. Stereochemistry of Organic Compounds; Wiley: New York, 1994, and Jacques, J, et al. Enantiomers, Racemates, and Resolutions; Wiley: New York, 1981, і їх повністю включено до даного винаходу через посилання. Також визнано, що функціональні групи, присутні в сполуках за формулою I, можуть містити захисні групи. Наприклад, замісники бокового ланцюга амінокислоти в сполуках за формулою I можуть бути заміщені на захисні групи, такі як групи бензилоксикарбонілу або третбутоксикарбонілу. Насправді, захисні групи відомі як хімічні функціональні групи, які можуть бути селективно приєднаними до й видаленими від функціональних груп, такі як гідроксильні групи і карбоксильні групи. Такі групи присутні в хімічній сполуці для того, щоб надавати інертність такій функціональності в умовах хімічної реакції, яким піддається сполука. В межах даного винаходу можуть бути використані будь-які з різноманітних захисних груп. Переважальні групи захисних лактамів включають такі групи, як трет-бутилдиметилсиліл (ТБДМС), диметоксибензгідрил (ДМБ), ацил, бензил (Bn) і метоксибензил. Переважальні групи для захисту гідроксильних груп включають трет-бутилсиліл (ТБС), ацил, бензил, бензилоксикарбоніл ("CBZ"), трет-бутилоксикарбоніл ("Boc") і метоксиметил. Багато інших захисних груп, якими користуються спеціалісти в даній галузі техніки, можна знайти в Greene, T.W. and Wuts, P.G.M., "Protective Groups in Organic Synthesis" 2d. Ed., Wiley & Sons, 1991. 14 UA 100877 C2 5 Синтез Сполуки за даним винаходом можна одержати за чисельними способами, відомими спеціалістам в даній галузі техніки, які включають, але не обмежуються такими, що описані нижче, або за модифікаціями таких способів, використовуючи стандартні методики, відомі спеціалістам в галузі органічного синтезу. Передбачається, що всі способи, розкриті у зв'язку з даним винаходом, було випробувано в будь-якому масштабі, включаючи міліграм, грам, багато грамів, кілограм, багато кілограмів або в комерційному промисловому масштабі. Схема 1 8 4 3 Et O O R R O O W 5 6 O R R N R O N R8NHNH2 N 3 R 5 6 R R 8 O 4 R 5 6 R O 4 R N H C O F F F N 3 R W 5 R 1 6 R O N R D 8 R N R N O N W R N 8 3 R O B A R N O W 4 R F F F N 4a W R 1 5a R O N R E 10 15 20 25 Конденсація 4-оксобутирової кислоти або естеру проміжної сполуки загальної структури A, 8 або їх похідної сполуки, з гідразином або похідним R N-заміщеного гідразину в розчиннику типу етанола або 2-пропанола, забезпечує спосіб одержання 4,5-дигідропіридазинона загальної структури B. Відомі і можуть бути легко одержані кето-кислотні проміжні сполуки з замісниками в 3/4a 5/5a 4-му і 5-му положеннях. Піридазинони з R and R , конденсовані з гетероарильними або циклоалкільними групами, синтезують з відповідних ангідридів або кислотних естерів. В тих 1 1 випадках, коли R являє собою захисну групу, її видалення призводить до сполук R =H з загальною структурою C. Стандартні перетворення NH III шляхом реакцій алкілювання або відновлювального амінування призводять до сполук з загальною структурорю D. 4,5дигідропіридазинони структури D можуть бути окислені до ароматичних піридазинонів загальної структури E з використанням MnO2, CuCl2, дихлордиціанохинону (ДДХ), оксиду селену, ДМСО/основи або 3-нітробензолсульфоната натрію в присутності гідроксида натрію. 8 Піридазинони NH (R =H) можна алкілювати алкільними групами або заміщеними алкільними 8 групами з використанням галіда R , основи, наприклад, K2CO3, Cs2CO3 або NaH, в інертному 8 розчиннику, такому як ДМФ, ТГФ або CH3CN. Приклади сполук, де R являє собою H, можна 8 перетворити на аналоги, де R являє собою арил або гетероарил шляхом стандартних реакцій приєднання за допомогою палладію або міді, використовуючи відповідний галід арила або гетероарила. Схема 2 15 UA 100877 C2 5 10 15 Приклади арилпіридазинона за даним винаходом можуть також бути синтезовані з використанням звичайної хімії кросс-спряження Судзукі. Похідні спіроефіру бора загальної структури F підпадають реакції кросс-спряження (реакція Судзукі) на платиновому каталізаторі з 4a похідним піридазина за загальною формулою G або пиридазинона структури H, де група R , 5a 7 R або R може бути галогеном, переважно Br або I, щоб призвести до прикладів сполук загальної структури J і K. Приклади спіро-пірролідіна, -азепіна та -3-піперидина за даним винаходом можна синтезувати з використанням способів, описаних в прикладах для спіро-4-піперидину, починаючи з N-Boc-3-пірролідинону, N-Boc-гексагідро-1H-азепін-4-ону або N-Boc-3-піперидону, відповідно, замість N-Boc-4-піперидону. Приклади Інші особливості даного винаходу стануть яснішими при розгляді наступних описів зразкових втілень, наведених нижче. Ці зразки наведені лише для ілюстрації винаходу й не мають наміру обмежувати його. Приклад 1 6-(1-циклобутил-спіро[бензофуран-2(3H),4’-піперидин]-5-іл)-4,5-дигідро-2H-піридазин-3-он H O N N N O 20 Етап 1: Синтез 1’-трифторацетил-спіро[бензофуран-2(3H)-4’-піперидину] O 25 30 N F F F Розчин спіро[бензофуран-2(3H)-4’-піперидину] (8 г, 40 ммоль) в метилен хлориді (70 мл) було оброблено піридином (8 мл, 100 ммоль) і трифтороцетовим ангідридом (7 мл, 50 ммоль) при 10 °C. Суміш перемішували при 10 °C на протязі 2 годин, потім гасили 1N HCl і двічі екстрагували метилен хлоридом. Об'єднаний органічний шар сушили (Na2SO4), фільтрували й концентрували з виходом 1’трифторацетил-спіро[бензофуран-2(3H)-4’-піперидину] (10,86 г, 91 %), МС м/з = 286 (M+H). Етап 2: Синтез 1’-трифторацетил-5-(етиловий естер 4-оксобутирової кислоти)спіро[бензофуран-2(3H),4’-піперидину] O O O O CH3 O O N F F F 16 UA 100877 C2 5 10 15 20 25 30 35 Суміш продукту етапу 1 (0,51 г, 1,8 ммоль) і етилсукцініл хлориду (0,25 мл, 1,8 ммоль) в метилен хлориді (2 мл) охолоджували до 0 °C. Тетрахлорид олова (1M розчин в метилен хлориді) (2,32 мл, 2,32 ммоль) додавали при 10 °C, перемішували на протязі 30 хв, потім гасили водною 2N HCl при 0 °C. Водний шар двічі екстрагували метилен хлоридом, і об'єднаний органічний шар промивали розсолом, сушили (Na 2SO4), фільтрували й концентрували. Продукт очищали методом хроматографії ISCO на силікагелі (40 г в колонці) з використанням 20 % EtOAc в гексані, щоб одержати 1’-трифторацетил-5-(етиловий естер 4-оксобутирової кислоти)спіро[бензофуран-2(3H),4’-піперидин] (0,61 г, 83 %), МС м/з = 414 (M+H). Етап 3: Синтез 6-(спіро[бензофуран-2(3H),4’-піперидин]-5-іл)-4,5-дигідро-2H-піридазин-3-ону H O N N O Суміш продукта етапу 2 (0,61 г, 1,5 ммоль) і моногідрату гідразину (0,57 мл, 11 ммоль) в ізопропанолі (7 мл) нагрівали при 110 °C на протязі 15 годин. Ізопропанол випаровували при зниженому тиску і розділяли між насиченим водним розчином бікарбонату натрію та метилен хлоридом. Водний шар двічі екстрагували мелитен хлоридом і об'єднані органічні шари промивали розсолом, сушили (Na2SO4), фільтрували і концентрували для одержання 6(спіро[бензофуран-2(3H),4’-піперидин]-5-іл)-4,5-дигідро-2H-піридазин-3-ону (0,4 г, 95 %), МС м/з = 286 (M+H). Сирий матеріал використовували в наступній реакції без подальшого очищення. Етап 4: Синтез 6-(1-циклобутил-спіро[бензофуран-2(3H),4’-піперидин]-5-іл)-4,5-дигідро-2Hпіридазин-3-ону H O N N O N Розчин продукту етапу 3 (0,4 г, 1,4 ммоль) перемішували в суміші ДМФ (2 мл) і MeOH (10 мл) в атмосфері аргону. Циклобутанон (0,42 мл, 6,4 ммоль), ціаноборогідрид натрію (0,35 г, 5,6 ммоль) і оцтової кислоти (0,2 мл, 3,17 ммоль) додавали послідовно і перемішували при 60ºC на протязі 15 годин. Реакційну суміш концентрували під зниженим тиском і розділяли між водним 1M розчином карбонату натрію и метилен хлоридом. Водний шар двічі екстрагували метилен хлоридом і об'єднані органічні сполуки промивали розсолом, сушили (Na2SO4), фільтрували і концентрували з виходом сирого продукту. Сирий продукт очищали методом хроматографії ISCO (40 г колонці) з використанням 5-10 % метанолу в метилен хлориді до 10 % метанолу, який містив 4 мл гідроксиду амонію в метилен хлориді. Виділений чистий продукт розчиняли в метилен хлориді й промивали насиченим водним розчином бікарбонату натрію, розсолом, сушили (Na 2SO4), фільтрували і концентрували. Продукт кристалізували з суміші метилен хлориду, етанолу, ефіру і гексану з виходом сполуки за прикладом 1 (6-(1-циклобутил-спіро[бензофуран-2(3H),4’-піперидин]-5-іл)4,5-дигідро-2H-піридазин-3-ону) (94 мг, 20 %, 96 % чистоти), з точкою плавлення 207-209 ºC 1 (метилен хлорид, етанол, ефір і гексан), МС м/з = 340 (M+H); H ЯМР (400 MГц, CDCl3): δ 1.572.15 (m, 12H), 2.37-2.56 (m, 2H), 2.60 (t, J=16.16 Гц, 2H), 2.76-2.87 (m, 1H), 2.96 (t, J=16.32 Гц, 2H), 3.01 (S, 2H), 6.78 (d, J=8.33 Гц, 1H), 7.46 (d, J=8.36 Гц, 1H), 7.59 (S, 1H), 8.44 (S, 1H). Приклад 2 H O N N O 40 N H N Цю сполуку було одержано за допомогою способа, описаного в Прикладі 1, використовуючи ангідрід циклопропан-дикарбонової кислоти, щоб одержати 1’-циклобутил-5-(3,4-діазабіцикло[4.1.0]гептен-2-он-5-іл)-спіро[бензофуран-2(3H),4’-піперидин]: т.пл. 189-191 ºC, МС м/з = 1 352 (M+H); H ЯМР (400 MГц, CDCl3): δ 0.97 (dt, J1=10.14 Гц, J2=5.31 Гц, 1H), 1.54-2.13 (m, 12H), 17 UA 100877 C2 5 2.17-2.24 (m, 1H), 2.40-2.58 (m, 4H), 2.77-2.89 (m, 1H), 3.03 (s, 2H), 6.81(d, J=8.42 Гц, 1H), 7.57 (d, J=8.50 Гц, 1H), 7.63 (s, 1H), 8.23 (s, 1H). Приклад 3 6-(1-циклобутил-спіро[бензофуран-2(3H),4’-піперидин]-5-іл)-5-метил-4,5-дигідро-2Hпіридазин-3-он H O N N CH3 10 15 20 N O Етап 1: Синтез 1’-трифторацетил-5-(пропаноїл)-спіро[бензофуран-2(3H),4’-піперидину] O O F N F F CH3 O Суміш 1’-трифторацетил-спіро[бензофуран-2(3H)-4’-піперидину] (3,1 г, 11 ммоль) і пропаноїл хлориду (1 мл, 10 ммоль) в метилен хлориді (25 мл) охолоджували при 10 °C. Тетрахлорид олова (1M розчин в метилен хлориді) (14,14 мл, 14,11 ммоль) додавали при 10 °C і перемішували при 10 °C на протязі 30 хв, потім гасили водною 2N HCl при 0 °C. Водний шар двічі екстрагували метилен хлоридом і об'єднані органічні сполуки промивади розсолом, сушили (Na2SO4), фільтрували і концентрували з одержанням сирого продукту. Сирий продукт очищали методом хроматографії ISCO (120 г) з використанням 22 % EtOAc в гексані з виходом 1’-трифторацетил-5-(пропаноїл)-спіро[бензофуран-2(3H)-4’піперидину] (2,2 г, 59 %), МС м/з = 342 (M+H). Етап 2: Синтез 1’-трифторацетил-5- (етиловий естер 3-метил-4-оксобутирової кислоти)спіро[бензофуран-2(3H),4’-піперидину] O O CH3 O CH3 N O O F F 25 30 F Розчин 1’-трифторацетил-5-(пропаноїл)-спіро[бензофуран-2(3H)4’-піперидину] (2,2 г, 6,45 ммоль) в тетрагідрофурані (22 мл) охолоджували при 0 °C. Диізопропіламід літію (2M розчин в ТГФ) (3,56 мл, 7,09 ммоль) додавали по крапляхі нагрівалидокімнатної температури на протязі 30 хв. Реакцію охолоджували до 0 °C і додавали етилбромацетат (0,79 мл, 7,1 ммоль) по краплях і нагрівали до кімнатної температури на протязі 30 хв, потім гасили водною 1M HCl кислотою при 0 °C. Водний шар двічі екстрагували метилен хлоридом і комбіновані органічні сполуки промивали розсолом, сушили (Na 2SO4), фільтрували і концентрували з виходом сирого 1’-трифторацетил-5-(3-метил-4-оксобутирової кислоти естер)спіро[бензофуран-2(3H), 4’-піперидину] (3,34 г), МС m/z=428 (M-55). Етап 3: Синтез 6-(спіро[бензофуран-2(3H)4’-піперидин]-5-іл)-5метил-4,5-дигідро-2Hпіридазин-3-ону H N O N CH3 35 O N H Суміш 1’-трифторацетил-5- (етилового естеру 3-метил-4-оксобутирової кислоти)спіро[бензофуран-2(3H), 4’-піперидину] (3,34 г, 7,8 ммоль) і моногідрату гідразину (3 мл, 60 ммоль) в ізопропанолі (25 мл) нагрівали при 110 °C на протязі 15 годин. Ізопропанол випаровували при зниженому тиску і розділяли між насиченим водним розчином бікарбонату натрію та метилен хлоридом. Водний шар двічі екстрагували метилен хлоридом і об'єднані органічні сполуки промивали розсолом, сушили (Na2SO4), фільтрували і концентрували з 18 UA 100877 C2 5 виходом сирого 6-(спіро[бензофуран-2(3H)4’-піперидин]-5-іл)-5-метил-4,5-дигідро-2H-піридазин3-ону (1,4 г, 60 %), МС м/з = 300 (M+H). Сирий матеріал використовівали для наступної реакції без подальшого очищення. Етап 4: Синтез 6-(1-циклобутил-спіро[бензофуран-2(3H),4’-піперидин]-5-іл)-5-метил-4,5дигідро-2H-піридазин-3-ону H O N N CH3 10 15 20 30 35 40 N Розчин продукту етапу 3 (6-(спіро[бензофуран-2(3H), 4’-піперидин]-5-іл)-5-метил-4,5-дигідро2H-піридазин-3-ону) (1,4 г, 4,7 ммоль) перемішували в суміші ДМФ (2 мл) і MeOH (10 мл) в атмосфері аргону. Циклобутанон (1,4 мл, 19 ммоль), ціаноборогідрид натрію (1,2 г, 19 ммоль) і оцтову кислоту (0,65 мл, 11,36 ммоль) додавали послідовно і перемішували при 60ºC на протязі 13 годин. Реакційну суміш концентрували під зниженим тиском і розділяли між водним 1M розчином карбонату натрію й метилен хлоридом. Водний шар двічі екстрагували метилен хлоридом і поєднані органічні сполуки промивали розсолом, сушили (Na 2SO4), фільтрували і концентрували з виходом сирого продукту. Сирий продукт очищали методом хроматографії ISCO (120 г колонка) з використанням 5-10 % метанола в метилен хлориді для одержання чистого продукту. Чистий продукт кристалізували із суміші метилен хлориду, етанолу, ефіру і гексану з виходом сполуки (6-(1-циклобутил-спіро[бензофуран-2(3H),4’-піперидин]-5-іл)-5-метил4,5-дигідро-2H-піридазин-3-ону) (512 мг, 31 %, 98 % чистоти), з точкою плавлення 213-215 ºC 1 (метилен хлорид, етанол, ефір і гексан), МС м/з = 354 (M+H); H ЯМР (400 MГц, CDCl3): δ 1,25 (dt, J=7,35 Гц, 3H), 1.63-2.14 (m, 10H), 2.36-2.57 (m, 4H), 2.70 (dd, J1=16.90 Гц, J2=6.78 Гц, 1H), 2.76-2.86 (m, 1H), 3.01 (s, 2H), 3.27-3.37 (m, 1H), 6.785 (d, J=8.43 Гц, 1H), 7.50 (d, J=8.47 Гц, 1H), 7.63 (s, 1H), 8.61 (s, 1H) Приклад 4 6-(1-циклобутил-спіро[бензофуран-2(3H),4’-піперидин]-5-іл)-5-метил-2H-піридазин-3-он H O N N CH3 25 O O N Суміш 6-(1-циклобутил-спіро[бензофуран-2(3H), 4’-піперидин]-5-іл)-5-метил-4,5-дигідро-2Hпіридазин-3-ону (202 мг, 0,57 ммоль) і карбонату цезію (372 мг, 1,14 ммоль) в диметилсульфоксиді (8,5 мл) нагрівали при 130 °C 4 години. Суміш охолоджували до кімнатної температури и розділяли між водою й метилен хлоридом. До суміші додавали хлорид натрію і водний шар двічі екстрагували метилен хлоридом. Поєднані органічні сполуки промивали розсолом, сушили (Na2SO4), фільтрували і концентрували з виходом сирого продукту. Сирий продукт очищали методом хроматографії ISCO (80 г колонці) з використанням 5-10 % метанолу в метилен хлориді до 10 % метанолу, який містив 1 % гідроксиду амонію в метилен хлориді. Виділений чистий продукт розчиняли в метилен хлориді і промивали насиченим водним розчином бікарбонату натрію, розсолом, сушили (Na2SO4), фільтрували і концентрували з одержанням чистого продукту. Чистий продукт кристалізували із суміші метилен хлориду, метанолу, ефіру і гексану з виходом сполуки за прикладом 4 (6-(циклобутил-спіро[бензофуран2(3H),4’-піперидин]-5-іл)-5-метил-2H-піридазин-3-ону) (42 мг, 21 %, 96 % чистоти), з точкою 1 плавління 243-245 ºC, МС м/з = 352 (M+H); H ЯМР (400 MГЦ, CDCl3): δ 1.55-2.97 (m, 18H), 3.05 (s, 2H), 6.80-6.86 (m, 2H), 7.14-7.19 (m, 1H), 7.21 (s, 1H), 10.55 (s, 1H). Приклад 5 1’-циклобутил[6-(4,5-дигідро-2H-піридазин-3-он-6-іл)-спіро[3,4-дигідро-бензопіран-2,4’піперидин] 19 UA 100877 C2 O H N N O N Етап 1: Синтез 1’-трифторацетил-спіро[3,4-дигідробензопіран-2,4’-піперидину] O O N F 5 10 F F Розчин 3,4-дигідроспіро[бензопіран-2,4’-піперидину]·HCl (7 г, 30 ммоль) в метилен хлориді (60 мл) було оброблено піридином (10 мл, 100 ммоль) і трифтороцетовим ангідридом (4,5 мл, 32 ммоль) при 10 °C. Суміш перемішували при 10 °C на протязі 3 годин, потім гасили 1N HCl і двічі екстрагували метилен хлоридом. Об'єднані органічні сполуки промивали розсолом, сушили (Na2SO4), фільтрували і концентрували з виходом сирого продукту. Сирий продукт очищали методм хроматографії ISCO (330 г колонці) з використанням 12-18 % етилацетату в гексані для одержання чистого 1’-трифторацетил-3,4-дигідроспіро[бензопіран-2,4’-піперидину] (7,48 г, 72 %), МС м/з = 300 (M+H) Етап 2: Синтез 1’-трифторацетил-6-(4-оксобутирової кислоти)-спіро[3,4-дигідробензопіран2,4’-піперидину] O HO O O N F 15 20 30 F F Суміш 1’-трифторацетил-спіро[3,4-дигідробензопіран-2,4’-піперидину] (0,66 г, 2,20 ммоль) і сукцінового ангідриду (0,24 г, 2,43 ммоль) в 1,2-дихлоретані (8 мл) охолоджували до 0 °C. Алюміній злорид (0,90 г, 7 ммоль) додавали при 0 °C і суміш нагрівали при 80 °C на протязі 16 годин, потім гасили водною 1N HCl при 0 °C. Водний шар двічі екстрагували метилен хлоридом і об'єднані органічні сполуки промивали розсолом, сушили (Na2SO4), фільтрували й концентрували з виходом сирого 1’-трифторацетил-6-(4-оксобутирової кислоти)-спіро[3,4-дигіробензопіран-2,4’-піперидину] (0,97 г), МС м/з = 400 (M+H) і 399 (M-H). Етап 3: Синтез 6-(4,5-дигідро-2H-піридазин-3-он-6-іл)-спіро[3,4-дигідробензопіран-2,4’піперидину] H O N N O 25 O N H Суміш 1’-трифторацетил-6-(4-оксобутирової кислоти)-спіро[3,4-дигідробензопіран-2,4’піперидину] (0,97 г, 2,4 ммоль) і гідразина моногідрату (2,5 мл, 80 ммоль) в ізопропанолі (12 мл) нагрівали при 110 °C протягом 19 годин. Ізопропанол випаровували при зниженому тиску і тричі переганяли як азеотропну суміш з бензолом для одержання сирого 6-(4,5-дигідро-2H-піридазин3-он-6-іл)-спіро[3,4-дигідробензопіран-2,4’-піперидину] (0,92 г), МС м/з = 300 (M+H). Сирий матеріал використовували для наступної реакції без подальшого очищення. Етап 4: 1’-циклобутил- [6-(4,5-дигідро-2H-піридазин-3-он-6-іл)-спіро[3,4-дигідробензопіран2,4’-піперидин] 20 UA 100877 C2 O H N N O 5 10 15 20 N Розчин продукту етапу 3 (0,92 г, 3,10 ммоль) перемішували в суміші ДМФ (2 мл) і MeOH (6 мл) в атмосфері аргону. Циклобутанон (0,9 мл, 10 ммоль), ціаноборогідрид натрію (0,8 г, 10 ммоль) і оцтову кислоту (0,42 мл, 7,4 ммоль) додавали послідовно і перемішували при 60ºC на протязі 20 годин. Реакційну суміш концентрували під зниженим тиском і розділяли між водним 1M розчином карбонату натрію й метилен хлоридом. Водний шар двічі екстрагували метилен хлоридом і поєднані органічні сполуки промивали розсолом, сушили (Na 2SO4), фільтрували і концентрували з виходом сирого продукту. Сирий продукт очищали методом хроматографії ISCO (40 г колонці) з використанням 4,5-10 % метанолу в метилен хлориді до 10 % метанолу, який містив 4 мл гідроксиду амонію в метилен хлориді. Виділений чистий продукт розчиняли в метилен хлориді і промивали насиченим водним розчином бікарбонату натрію, розсолом, сушили (Na2SO4), фільтрували й концентрували. Чистий продукт кристалізували із суміші метилен хлориду, етанолу, ефіру і гексану з виходом сполуки 1’-(1циклобутил-6-(4,5-дигідро-2Н-піридазин-3-он-6-іл)-спіро[3,4-дигідробензопіран-2,4’-піперидину] (39 мг, 95 % чистоти), з точкою плавління 242-243,5ºC (метилен хлорид, етанол, ефір і гексан), 1 МС m/z=354 (M+H); H ЯМР (400 MГц, CDCl3): δ 1.52-2.02 (m, 12H), 2.03-2.14 (m, 2H), 2.19-2.36 (m, 2H), 2.59 (t, J=8.49 Гц, 2H), 2.64-2.75 (m, 1H), 2.79-2.91 (m, 2H), 2.96 (t, J=7.82 Гц, 2H), 6.856.90 (m, 1H), 7.45-7.50 (m, 2H), 8.43 (s, 1H). Наступні приклади було одержано з використанням способів, розкритих в даному винаході. Приклад 6 6-(3,4-діаза-біцикло[4.1.0]гепт-4-ен-2-он-5-іл)-спіро[3,4-дигідробезнопіран-2,4’-піперидин] H O N N O O 25 35 N H 1 Приклад 6: т.пл. 284-287 ºC, МС m/z=312 (M+H); H ЯМР (400 МГц, DMSO): δ 0.71 (dt, J1=9.28 Гц, J2=4.71 Гц, 1H),1.63-1.90 (m, 6H), 1.90-2.09 (m, 1H), 2.56-2.64 (m, 1H), 2.75-2.84 (m, 2H), 2.92-3.02 (m, 4H), 6.82-6.90 (m, 2H), 7.52-7.59 (m, 2H), 10.69 (s, 1H). Приклад 7 1’-циклобутил-6-(3,4-діаза-біцикло[4.1.0]гепт-4-ен-2-он-5-іл)-спіро[3,4-дигідробензопіран-2,4’піперидин] O 30 N H N N 1 Приклад 7: т.пл. 228-230 ºC, МС m/z=366 (M+H); H ЯМР (400 МГц, CDCl3): δ 0,96 (dt, J1=9,75 Гц, J2=4,76 Гц, 1H), 1,57-2,15 (m, 14H), 2.17-2.35 (m, 3H), 2.50-2.58 (m, 1H), 2.79-2.91 (m, 2H), 6.87-6.92 (m, 2H), 7.51-7.58 (m, 2H), 8.29 (s, 1H). Приклад 8 1’-циклопентил-6-(3,4-діаза-біцикло[4.1.0]гепт-4-ен-2-он-5-іл)-спіро[3,4-дигідробензопіран2,4’-піперидин] 21 UA 100877 C2 O H N N O N 1 5 Приклад 8: т.пл. 229-231 ºC, МС m/z=380 (M+H); H ЯМР (400 МГц, CDCl3): δ 0,96 (dt, J1=9,74 Гц, J2=4,83 Гц, 1H), 1,41-1,99 (m, 16H), 2,18-2,25 (m, 1H), 2,41-2,70 (m, 4H), 2,77-2,91 (m, 3H), 6,88-6,93 (m, 1H), 7,51-7,58 (m, 2H), 8,32 (s, 1H), 10.69 (s, 1H). Приклад 9 1’-ізопропіл-[6-(3,4-діаза-біцикло[4.1.0]гепт-4-ен-2-он-5-іл)-спіро[3,4-дигідробензопіран-2,4’піперидин] H O N N O N CH3 CH3 1 10 Приклад 9: т.пл. 160,6-164ºC (метилен хлорид, етанол, ефір і гексан); МС m/z=354 (M+H); H ЯМР (400 МГц, CDCl3): δ 0,96 (dt, J1=10,14 Гц J2=5,21 Гц, 1H)1,10-1,22 (m, 6H), 1,74-1,95 (m, 7H), 2,17-2,26 (m, 1H), 2,50-2,92 (m, 8H), 6,88-6,93 (m, 1H), 7,51-7,59 (m, 2H), 8,31 (s, 1H). Приклад 10 1’-циклобутил-6-(3,4-діаза-біцикло[4.2.0]окт-4-ен-2-он-5-іл)-спіро[3,4-дигідробензопіран-2,4’піперидин] H O N N O 15 20 N 1 Приклад 10: т.пл. 202-204ºC (метилен хлорид, етанол, ефір і гексан); МС m/z=380 (M+H); H ЯМР (400 МГц, CDCl3): δ 1.54-2.93 (m, 23H), 3.32-3.42 (m, 1H), 3.83-3.93 (m, 1H), 6.81-6.87 (m, 1H), 7.32-7.40 (m, 2H), 8.34 (s, 2H). Приклад 11 1’-циклобутил[6-(4,4-диметил-4,5-дигідро-2H-піридазин-3-он-6-іл)-спіро[3,4дигідробензопіран-2,4’-піперидин] H O N N H3C CH3 O N 1 25 Приклад 11: т.пл. 246-248ºC (метилен хлорид, етанол, ефір і гексан); МС m/z=382 (M+H); H ЯМР (400 МГц, CDCl3): δ 1.25 (s, 6H), 1.62-1.93 (m, 8H), 1.95-2.16 (m, 4H), 2.24-2.39 (m, 1H), 2.652.95 (m, 7H), 6.83-6.90 (m, 2H), 7.43-7.52 (m, 2H), 8.44 (s, 1H). Приклад 12 1’-циклобутил- 6-(5-метил-4,5-дигідро-2H-піридазин-3-он-6-іл)-спіро[3,4-дигідробензопіран2,4’-піперидин] 22 UA 100877 C2 O H N N CH3 O N Етап 1: Синтез 1’-трифторацетил-6-(пропаноїл)-спіро[3,4-дигідробензопіран-2,4’-піперидину] O CH3 O O N F 5 10 15 F F Суміш 1’-трифторацетил-спіро[3,4-дигідробензопіран-2,4’-піперидину] (1,49 г, 4,98 ммоль) і пропаноїл хлориду (0,4 мл, 5 ммоль) в метилен хлориді (13 мл) охолоджували при 10 °C. Тетрахлорид олова (1M розчин в метилен хлориді) (0,76 мл, 6,5 ммоль) додавали при 10 °C і перемішували при 10 °C на протязі 20 хв, потім гасили водною 2N HCl при 0 °C. Водний шар двічі екстрагували метилен хлоридом і об'єднані органічні сполуки промивади розсолом, сушили (Na2SO4), фільтрували і концентрували, щоб одержати сирий продукт. Сирий продукт очищали методом хроматографії ISCO (на 80 г колонці) з використанням 17-35 % EtOAc в гексані з виходом 1’-трифторацетил-6-(пропаноїл)-спіро[3,4-дигідробензофуран-2,4’-піперидину] (1,42 г, 81 %), МС м/з = 356 (M+H). Етап 2: Синтез 1’-трифторацетил-6-(етиловий естер 3-метил-4-оксобутирової кислоти)спіро[3,4-дигідробензопіран-2,4’-піперидину] O O CH3 O CH3 O N F 20 25 F F Розчин продукту етапу 1 (1’-трифторацетил-6-(пропаноїл)-спіро[3,4-дигідробензопіран-2,4’піперидину]) (1,4 г, 3,9 ммоль) в тетрагідрофурані (13 мл) охолоджували при 0 °C. Диізопропіламід літію (2M розчин в ТГФ) (2,16 мл, 4,33 ммоль) додавали по краплях і нагрівали до кімнатної температури на протязі 30 хв. Реакцію знов охолоджували до 0 °C і додавали етилбромацетат (0,48 мл, 4,30 ммоль) по краплях і нагрівали до кімнатної температури на протязі 30 хв, потім гасили водною 1M HCl кислотою при 0 °C. Водний шар двічі екстрагували метилен хлоридом і комбіновані органічні сполуки промивали розсолом, сушили (Na 2SO4), фільтрували і концентрували з виходом сирого 1’-трифторацетил-6-(етиловий естер 3-метил-4оксобутирової кислоти)-спіро[3,4-дигідробензопіран-2,4’-піперидину] (2,21 г), МС m/z=442 (M+H). Етап 3: Синтез 6-(5-метил-4,5-дигідро-2H-піридазин-3-он-6-іл)-спіро[3,4-дигідробензопіран2,4’-піперидину] H O N N CH3 30 O O N H Суміш продукта етапу 2 (2,21 г, 5,01 ммоль) і гідразин моногідрату (1,5 мл, 30 ммоль) в ізопропанолі (15 мл) нагрівали при 110 °C на протязі 36 годин. Ізопропанол випаровували при зниженому тиску і сполуку двічі переганяли як азеотропну суміш із бензолом для одержання сирого продукту (2,45 г), МС m/z=314 (M+H). Сирий матеріал використовівали для наступної реакції без подальшого очищення. 23 UA 100877 C2 Етап 4: Синтез 1-циклобутил-6-(5-метил-4,5-дигідро-2H-піридазин-3-он-6-іл)-спіро[3,4дигідробензопіран-2,4’-піперидину] H O N N CH3 5 10 15 20 30 35 40 N Розчин продукту етапу 3 (2,45 г, 7,82 ммоль) в суміші ДМФ (5 мл) і MeOH (15 мл) перемішували в атмосфері аргону. Циклобутанон (1,8 мл, 24 ммоль), ціаноборогідрид натрію (1,2 г, 19 ммоль) і оцтову кислоту (0,90 мл, 20 ммоль) додавали послідовно і перемішували при 60ºC на протязі 24 годин. Реакційну суміш концентрували під зниженим тиском і розділяли між 1M водним розчином карбонату натрію й метилен хлоридом. Водний шар тричі екстрагували метилен хлоридом і поєднані органічні сполуки промивали розсолом, сушили (Na 2SO4), фільтрували і концентрували з виходом сирого продукту. Сирий продукт очищали методом хроматографії ISCO (40 г колонці) з використанням 2-10 % метанолу в метилен хлориді до 10 % метанолу, який містив 4 мл гідроксиду амонію в метилен хлориді для одержання чистого продукту. Виділений чистий продукт розчиняли в метилен хлориді і промивали насиченим водним розчином бікарбонату натрію, розсолом, сушили (Na 2SO4), фільтрували і концентрували. Чистий продукт кристалізували з суміші метилен хлориду, етанолу, ефіру і гексану з виходом 1-циклобутил-6-(5-метил-4,5-дигідро-2H-піридазин-3-он-6-іл)-спіро[3,4дигідробензопіран-2,4’-піперидину]: (550 мг, 19 %, 95 % purity), т.пл. 207-209ºC (метилен хлорид, 1 етанол, ефір і гексан); МС m/z=368 (M+H); H ЯМР (400 МГц, CDCl3): δ 1.26 (d, J=7.33 Гц, 3H), 1.61-2.01 (m, 12H), 2.02-2.14 (m, 2H), 2.19-2.32 (m, 2H), 2.42-2.50 (m, 1H), 2.60-2.74 (m, 2H), 2.772.90 (m, 2H), 3.28-3.39 (m, 1H), 6.84-6.92 (m, 1H), 7.47-7.54 (m, 2H), 8.50 (s, 1H). Приклад 13 1’-циклобутил[6-(5-метил-2H-піридазин-3-он-6-іл)-спіро[3,4-дигідробензопіран-2,4’піперидин] H O N N CH3 25 O O N Суміш сполуки з прикладу 12 (103 мг, 0,28 ммоль) і карбонату цезію (536 мг, 1,60 ммоль) в диметилсульфоксиді (6 мл) нагрівали при 100-110 °C протягом 27 годин. Суміш охолоджували до кімнатної температури й розділяли між водою і метилен хлоридом. До суміші додавали хлорид натрію, і водний шар тричі екстрагували метилен хлоридом. Поєднані органічні сполуки промивали розсолом, сушили (Na2SO4), фільтрували і концентрували з виходом сирого продукту. Сирий продукт очищали методом хроматографії ISCO (40 г колонці) з використанням 5-10 % метанолу в метилен хлориді до 10 % метанолу, який містив 4 % гідроксиду амонію в метилен хлориді. Виділений чистий продукт розчиняли в метилен хлориді і промивали насиченим водним розчином бікарбонату натрію, розсолом, сушили (Na 2SO4), фільтрували і концентрували для одержання чистого продукта. Чистий продукт кристалізували із суміші метилен хлориду, етанолу, ефіру і гексану з виходом сполуки 1’-циклобутил-6-(5-метил-2Нпіридазин-3-он-6-іл)-спіро[3,4-дигідробензопіран-2,4’-піперидину] (32 мг, 21 %, 93 % чистоти), з 1 точкою плавління 270-272ºC (метилен хлорид, етанол, ефір і гексан), МС m/z=366 (M+H); H ЯМР (400 МГц, DMSO-d6):1,56-1,85 (m, 11H), 1,92-2,03 (m, 2H), 2,12 (s, 3H), 2,14-2,26 (m, 1H), 2,45-2,55 (m, 2H), 2,72-2,80 (m, 3H), 6,76-6,82 (m, 2H), 7,15-7,19 (m, 2H), 12,92 (s, 1H). Приклад 14 24 UA 100877 C2 H N O H3C N CH3 O 5 N 1’-ізопропіл[6-(4,4-диметил-4,5-дигідро-2H-піридазин-3-он-6-іл)-спіро[3,4дигідро[бензопіран-2,4’-піперидин] т.пл. 210-213ºC (метилен хлорид, етанол, ефір і гексан); МС 1 m/z=370 (M+H); H ЯМР (400 МГц, CDCl3): δ 1…15 (d, 6H, J=6.5 Гц), 1.25 (s, 6H), 1.8-1.91 (m, 6H), 2.66-2.84 (m, 9H), 6.88 (d, 2H, J=8.1 Гц), 7.47-7.49 (m, 2H), 8.45 (s, 1H). Етап 1: Br 10 15 20 N O До розчину 5-бром-спіро[бензофуран-2-(3H)-4'-піперидин] (260,0 мг, 0,97 ммоль) в метанолі (5,0 мл, 120 ммоль) додавали 100 l (1,75 ммоль) AcOH з наступним додаванням циклобутанону (679,6 мг, 9,7 ммоль;) при кімнатній температурі. До цієї суміші додавали ціаноборогідрид натрію (200 мг, 3,18 ммоль) малими порціями протягом 5 хв. Після 5 хв. ВЕРХ показало присутність приблизно 10 % вихідного матеріалу. Додавали другу порцію 100 l AcOH, після якої додавали наступні 200 мг NaCNBH3. Після перемішування протягом 15 хв, ЖХМС показало повне зникнення вихідного матеріалу. Суміш концентрували й екстрагували CH2Cl2. у насиченому NaHCO3. Після випаровування і сушки (Na2SO4), було одержано блідо-жовту олію, яку очищали методом хроматографії ISCO з використанням CH2Cl2 і 0-10 % MeOH, який містив 1 % водного. NH4OH, щоб одержати названу сполуку в вигляді воскоподібної твердої речовини білого кольору (250 мг, 74 %). 1 Т.пл. 79-80 °C, МС: m/z 322/324 (M+1, піки ізотопів Br). H ЯМР (400 МГц, CDCl3): 7,28(d,j=0.75 Гц, 1H), 7.20 (d, J=8.4 Гц, 1H), 6.64 (d, J=8.4 Гц, 1H), 2.98 (s, 2H), 2.80 (m, 1H), 2.12.6 (br.s, 4H) & 1.6-2.1 (m, 10H). Приклад 15 1'-циклобутил-5-(6-хлорпіридазин-3-іл)спіро[бензофуран-2(3H)-4'-піперидин] Cl N N N O 25 30 35 40 Трис(дибензилиденацетон)дипалладіум(0) (22 мг, 0,024 ммоль) і трициклогексилфосфін (28,0 мг, 0,1 ммоль) було додано в суху круглодонну колбу в атмосфері N2. Додавали діоксан (6 мл) і темний розчин перемішували протягом 30 хв при кімнатній температурі. До цього темнокоричньового розчину було додано 4,4,5,5,4',4',5',5'-октаметил-[2,2']бі[[1,3,2]диоксабороланил] (0,20 г, 0,79 ммоль), оцетат калію (0,10 г, 1,02 ммоль) і розчин 1'-циклобутил-5-бромспіро[бензофуран-2(3H)-4'-піперидину] (245,00 мг, 0,76 ммоль) в діоксані (5 мл) в такому порядку. Суміш барботували N2 протягом 10 хв і нагрівали при 80 °C. Після перегонки з дефлегматором на протязі 14 годин, ВЕРХ показало відсутність броміду з очікуваною масою боролана м/з 370. Сирий проміжний продукт боролану піддавали реакції кросс-спряження Судзукі додаванням 3,6-дихлорпіридазину (0,55 г, 3,69 ммоль), (Ph3P)4Pd (85 мг, 0,073 ммоль), ТГФ (15 мл), EtOH (5 мл) і насиченого водного NaHCO3 (8 мл). Після прохождення 10 годин, ВЕРХ показало присутність головного піку очікуваного продукту. Продукт реакціі концентрували і очищали методом хроматографії ISCO (в DCM/MeOH/NH4OH) з виходом продукту в вигляді 1 твердої речовини бежового кольору (80 мг, 28 %). Т.пл. 193-194 °C, МС: м/з = 356 (M+1). H ЯМР (CDCl3): 7,97(s, 1H), 7.73-7.77 (m, 2H), 7.52 (dd, J=8.8, 1.5 Гц, 1H), 6.9 (d, J=8.4 Гц, 1H), 3.1 (s, 2H), (2.8, m, 1H), 2.4-2.6 (br.s, 4H) & 1.65-2.15 (m, 10H). 25 UA 100877 C2 Приклад 16 1'-циклобутил-5-(6-оксо-1,6-дигідропіридазин-3-іл)спіро[бензофуран-2(3H)-4'-піперидин] H O N N N O 5 10 До сполуки (1'-циклобутил-5-(6-хлорпіридазин-3-іл)спіро[бензофуран-2(3H)-4'-піперидину]) (75,00 мг, 0,2108 ммоль) в оцетовій кислоті (5,0 мл, 88 ммоль) додавали ацетат натрію (100,00 мг, 1,219 ммоль) і проводили перегонку з дефлегматором протягом 3 годин. Суміш випарювали, залишок випаровували вдруге з толуолом (2 × 10 мл) і потім аналізували методом хроматографії ISCO в (DCM/MeOH/NH4OH), щоб одержати названу сполуку в кількості 50 мг 1 (68 %). т.пл. 227-228 °C, МС: м/з 338 (M+1). H ЯМР (CDCl3): 12(s,1H), 7.7(d, J=9.85 Гц, 1H), 7.6 (s, 1H), 7.55 (d, J=8.4 Гц, 1H), 7.05 (d, J=9.85 Гц, 1H), 6.80 (d, J=8.4Hz, 1H), 3.05 (s, 2H), (2.85, m, 1H), 2.4-2.6 (br.s, 4H) & 1.65-2.15 (m, 10H). Приклад 17 6-спіро[3,4-дигідробензопіран-2,4’-піперидин]-6-ілокси)-4-хлорпіридазин Cl N N O O 15 N Етап 1: O HO O O 20 25 N O 1’-трет-бутилоксикарбоніл-4-оксо-6-гідрокси-спіро[3H-бензопіран-2,4’-піперидин] Розчин 2,5-дигідроксиацетофенону (15 г, 98 ммоль), трет-бутилового ефіру 4-оксопіперидин1-карбонової кислоти (20 г, 100 ммоль) і пірролідину (21 мл, 260 ммоль) в метанолі (146 мл) перемішували з дефлегматором протягом 23 годин і концентрували dвакуумs з виходом червоного маслянистого сирого матеріалу. Маслянистий сирий матеріал очищали методом хроматографії ISCO (330 г колонці) з використанням 27-80 % етилацетату в гексані для одержання продукту етапу 1 (27 г, 82 %), т.пл. 72-74 °C (етилацетат, ефір і гексан), МС м/з = 332 (M-H). Етап 2: OH HO O O 30 N O 1’-трет-бутилоксикарбоніл-4,6-дигідрокси-спіро[3H-бензопіран-2,4’-піперидин] Розчин продукту етапу 1(4,51 г, 13,5 ммоль) в метанолі (50 мл) охолоджували до 15 °C і повільно додавали борогідрид натрію, й суміш далі перемішували протягом 30 хв і після того концентрували. Сирий залишок розділяли між метилен хлоридом і водою, і водний шар двічі екстрагували метилен хлоридом. Поєднані органічні сполуки промивали розсолом, сушили (Na2SO4), фільтрували і концентрували з виходом продукту етапу 2 (4,1 г, 90 %), т.пл. 171173 °C (етилацетат, ефір і гексан), МС м/з = 334 (M-H). Етап 3: 26 UA 100877 C2 HO O 5 10 6-гідрокси-спіро[3H-бензопіран-2,4’-піперидин] Розчин продукту етапу 2 (23,5 г, 70,1 ммоль) і триетилсилану (49 мл, 310 ммоль) в метилен хлориді (150 мл) охолоджували до 10 °C. Трифтороцетову кислоту (78 мл, 1000 ммоль) додавали по краплях і далі перемішували при кімнатній температурі протягом 15 годин. Суміш концентрували в вакуумі і після того тричі переганяли як азеотропну суміш з толуолом з виходом маслянистого матеріалу янтарного кольору, який після витримки в вакуумі перетворився на твердий продукт. Сирий продукт титрували сумішшю гексан:ефір (в відношенні 1:1, 175 мл) з виходом чистого продукту, який сушили при 80 °C з виходом твердої речовини рудувато-коричньового кольору, яка відповідала солі ТФО (21 г, 90 %), т.пл. 208-210 °C (ефір і гексан), МС м/з = 220 (M+H). Етап 4: HO O 15 20 25 30 35 45 N 1’-циклобутил-4-гідрокси-спіро[3,4-дигідробензопіран-2,4’-піперидин] Розчин продукту етапу 3 (0,76 г, 3,5 ммоль) в суміші ДМФ (2 мл) і MeOH (10 мл) перемішували в атмосфері аргону. Циклобутанон (1,00 мл, 10 ммоль), оцтову кислоту (0,4 мл, 7 ммоль) і ціаноборогідрид натрію (0,9 г, 10 ммоль) додавали послідовно і перемішували при 60ºC на протязі 15 годин. Реакційну суміш концентрували під зниженим тиском і розділяли між 1M водним розчином карбонату натрію й метилен хлоридом. Водний шар тричі екстрагували метилен хлоридом і поєднані органічні сполуки промивали розсолом, сушили (Na 2SO4), фільтрували і концентрували з виходом сирого продукту. Виділений чистий продукт розчиняли в метилен хлориді і промивали насиченим водним розчином бікарбонату натрію, розсолом, сушили (Na2SO4), фільтрували і концентрували. Продукт кристалізували з суміші метилен хлориду, етанолу, ефіру і гексану з виходом продукту етапу 4 (0,5 г, 53 %), т.пл. 211-213 °C (метилен хлорид, етанол, ефір і гексан), МС м/з = 274 (M+H). Етап 5: Приклад 17 Розчин продукту етапу 4 (200 мг, 0.73 ммоль) в диметилсульфоксиді (10 мл) додавали до гідриду натрію (35 мг, 1,4 ммоль) при кімнатній температурі. Після перемішування протягом 30 хв при кімнатній температурі додавали 3,6-дихлорпіридазин (218 мг, 1,46 ммоль) і реакційну суміш нагрівали до 60 °C протягом 1 години й виливали в розчин розсолу при кімнатній температурі. Водний шар екстрагували чотири рази метилен хлоридом і поєднані органічні сполуки промивали розсолом, сушили (Na2SO4), фільтрували і концентрували з виходом сирого продукту. Сирий матеріал очищали методом хроматографії ISCO (40 г) з використанням суміші метанолу в метилен хлориді, щоб одержати сполуку за Прикладом 17 (250 мг, 87 %), т.пл. 128130 °C (метилен хлорид, метанол, ефір і гексан), МС м/з = 386 (M+H). Приклад 18 6-спіро[3,4-дигідробензопіран-2,4’-піперидин]-6-ілокси)-2Н-піридазин-3-он O N HN O 40 NH O N Суміш за прикладом 17 (209 мг, 0,54 ммоль) і ацетат натрію (32 мг, 0,39 ммоль) в оцтовій кислоті (5 мл) нагрівали до 110-115 °C протягом 7 годин. Реакційну суміш концентрували і двічі переганяли в азеотропній суміші з толуолом, потім розділяли між метилен хлоридом і насиченим водним розчином бікарбонату натрію. Водний шар двічі екстрагували метилен хлоридом і поєднані органічні сполуки промивали розсолом, сушили (Na 2SO4), фільтрували і концентрували з виходом відносно чистого продукту. Чистий продукт кристалізували із суміші метилен хлориду, метанолу, ефіру і гексану з виходом сполуки 6-(3,4-дигідро-спіро[2H-1бензопіран-2,4’-піперидин]-6-ілокси)-2H-піридазин-3-ону у вигляді білої твердої речовини 1 (170 мг, 76 %), т.пл. 233-235℃ (метилен хлорид, етанол, ефір і гексан), МС м/з = 368 (M+H); H ЯМР (400 МГц, CDCl3): δ 1.54-2.01 (m, 10H), 2.03-2.13 (m, 2H), 2.18-2.32 (m, 2H), 2.60-2.71 (m, 27 UA 100877 C2 2H), 2.74-2.89 (m, 3H), 6.82-6.91 (m, 3H), 7.00 (d, J=9.92 Гц, 1H) 7.185 (d, J=9.91 Гц, 1H), 9.84 (br s, 1H). Приклад 19 1’-циклобутил- [6-(2H-піридазин-3-он-5-іл)-спіро[3,4-дигідро-бензопіран-2,4’-піперидин] H N N O O 5 10 15 N У пляшку об'ємом 100 мл додали 2-гідроксиметил-5-іодо-2H-піридазин-3-он (0,19 г, 0,76 ммоль), 1'-циклобутил-6-(4,4,5,5,-тетраметил-1,3,2-діоксаборолан)-спіро[3,4дигідробензопіран-2,4'-піперидин] (0,34 г, 0,89 ммоль), тетракіс(трифенілфосфін)палладій(0) (0,088 г, 0,076 ммоль), K2CO3 (0,53 г, 3,8 ммоль) в 1,2-диметоксиетані (8 мл) і воду (8 мл). Через реакційну суміш пропускали N2 протягом 25 хв і потім нагрівали з дефлегматором на протязі 16 годин. Реакцію охолоджували до кімнатної температури і додавали невелику кількість NaCNBH3 при перемішуванні протягом 5 хв. Реакційну суміш розбавляли CH 2Cl2/MeOH (100 мл, 3:1), потім промивали насиченим NaHCO3, розсолом і сушили (Na2SO4). Продукт очищали методом препаративної тонкошарової хроматографії (ТШХ) (6 % MeOH/CH2Cl2), і продукт 1 збирали і розтирали з CH3CN з виходом 115 мг; т.пл. 216-219 °C; H ЯМР (DMSO): 12.95 (s, 1H), 8.25 (s, 1H), 7.6 (s, 1H), 7.45 (d, 1H), 6.95 (s, 1H), 6.8 (d, 1H), 2.8 (m, 3H), 2.2-2.3 (br, 2H), 1.95-2.0 (br, 2H), 1.6-1.9 (m, 11H). МС м/з 352 (M+1). Наступні приклади бeло синтезовано з використанням способів для прикладу 19 з 6-хлор-2метил-2H-піридазин-3-оном (Прикл. 20) і 3-хлор-6-метоксипіридазином (Прикл. 21). 20 Приклад Структура O N Т.пл. (ºC) МС м/з 147-149 366 (M+H) 273-275 352 (M+H) N O 20 N 1’-циклобутил- [6-(2-метил-піридазин-3-он-6іл)-спіро[3,4-дигідро-бензопіран-2,4’піперидин] O 21 H N N O N 1’-циклобутил[6-(2H-піридазин-3-он-6-іл)спіро[3,4-дигідро-бензопіран-2,4’-піперидин] 25 Рацемат за Прикладом 10 розділяли на два ізомери за допомогою метода хіральної хроматографії; ChiralCel OJ-H і 0,1 % діетиламіну в 35 % метанол/CO2. Індивідуальні ізомери було названо сполуками прикладу 22 (Пік A, елююється першим з хіральної колонки) і Прикладу 23 (Пік B, елююєьбся другим з хіральної колонки). 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted spirocyclic piperidine derivatives as histamine-3 receptor ligands
Автори англійськоюDandu, Reddeppareddy, Hudkins, Robert, L., Suydar, Babu, G.
Назва патенту російськоюЗамещенные спироциклические производные пиперидина как лиганды рецепторов гистамина-3 (h3)
Автори російськоюДанду Реддеппаредди, Хадкинз Роберт Л., Сундар Бабу Г.
МПК / Мітки
МПК: A61P 25/00, C07D 491/10, A61K 31/501
Мітки: гістаміну-3, піперидину, рецепторів, заміщені, спіроциклічні, похідні, ліганди
Код посилання
<a href="https://ua.patents.su/58-100877-zamishheni-spirociklichni-pokhidni-piperidinu-yak-ligandi-receptoriv-gistaminu-3-h3.html" target="_blank" rel="follow" title="База патентів України">Заміщені спіроциклічні похідні піперидину як ліганди рецепторів гістаміну-3 (h3)</a>
Попередній патент: Однореакторний спосіб одержання 3-(2,2,2-триметилгідразиній)пропіонату дигідрату
Наступний патент: Насадкова цегла
Випадковий патент: Індуктивний негасенсор з частотним виходом












