Похідні 1н-1,2,4-триазол-3-карбоксаміду як ліганди рецепторів канабіноїдів-св1
Номер патенту: 80298
Опубліковано: 10.09.2007
Автори: Крузе Корнеліс Г., МакКрірі Ендрю К., Ланге Йозефус Г.М., ван Стьойвенберг Герман Г.
Формула / Реферат
1. Застосування сполуки формули (І)
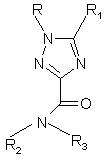 (І),
(І),
де R та R1 незалежно один від одного представляють фенільну, нафтильну, тієнільну, піридильну, піримідильну, піразинільну, піридазинільну або триазинільну групи, причому ці групи можуть бути заміщені 1-4 замісниками X, які можуть бути однаковими або різними, з групи, що містить розгалужений або нерозгалужений (С1-3)-алкіл або алкокси, гідрокси, галоген, трифторметил, трифторметилтіо, трифторметокси, нітро, аміно, моно- або діалкіл(С1-2)-аміно, моно- або діалкіл(С1-2)-амідо, (С1-3)-алкоксікарбоніл, трифторметилсульфоніл, сульфамоїл, (С1-3)-алкілсульфоніл, карбоксил, ціано, карбамоїл, (С1-3)-діалкіламіносульфоніл, (С1-3)-моноалкіламіносульфоніл та ацетил,
R2 - атом водню або розгалужена чи нерозгалужена С1-8 алкільна або С1-8 циклоалкілалкільна група, або фенільна, бензильна або фенетильна група, у яких ароматичне кільце може бути заміщене 1-4 замісниками X, де X має значення, наведені вище, або R2 представляє піридильну або тієнільну групу,
R3 представляє розгалужену чи нерозгалужену С1-8 алкільну, С1-8 алкокси, С3-8 циклоалкільну, C5-10 біциклоалкільну, С6-10 трициклоалкільну, С3-8 алкенільну, С5-8 циклоалкенільну групи, які можуть довільно містити один або кілька гетероатомів з групи (О, N, S) і можуть бути заміщені гідроксигрупою, етинільною групою або 1-3 атомами фтору, або представляє фенільну, бензильну або фенетильну групу, у яких ароматичне кільце може бути заміщене 1-4 замісниками X, де X має значення, наведені вище, або представляє піридильну, піримідильну, піразинільну, піридазинільну, триазинільну або тієнільну групу, у яких гетероароматичні кільця можуть бути заміщені 1-2 замісниками X, де X має значення, наведені вище, або ж R3 представляє групу NR4R5, де
R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену, моноциклічну або біциклічну, гетероциклічну групу з 4-10 кільцевими атомами, причому ця гетероциклічна група містить один або два гетероатоми з групи N, О або S, які можуть бути однакові або різні, причому ця гетероциклічна група може бути заміщена розгалуженою чи нерозгалуженою С1-3 алкільною, гідрокси або трифторметильною групою або атомом фтору, або
R2 та R3 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену, моноциклічну або біциклічну, гетероциклічну групу з 4-10 кільцевими атомами, причому ця гетероциклічна група містить один або два гетероатоми з групи N, О або S, які можуть бути однакові або різні, причому ця гетероциклічна група може бути заміщена розгалуженою чи нерозгалуженою С1-3 алкільною, гідрокси, піперидинільною або трифторметильною групою або атомом фтору, а також їхні пролікарські форми, стереоізомери та солі,
для приготування фармацевтичної композиції для лікування розладів, пов'язаних з нейротрансмісією СВ1 канабіноїдів, таких, як психози, бентежність, депресія, дефіцит уваги, розлади пам'яті, розлади мислення, розлади апетиту, ожиріння, алкоголізм, лібідо, наркозалежність, нейродегенеративні розлади, недоумство, дистонія, еластичність м'язів, тремтіння, епілепсія, розсіяний склероз, травматичні пошкодження мозку, інсульт, хвороба Паркінсона, хвороба Альцгеймера, хвороба Гантінгтона, синдром Туретта, мозкова ішемія, апоплексія мозку, черепно-мозкова травма, пошкодження спинного мозку, нервово-запальні розлади бляшкового склерозу, вірусний енцефаліт, розлади, пов'язані з демієлінізацією, а також больові симптоми, включаючи невропатичні больові симптоми, септичний шок, глаукому, діабет, рак, блювання, нудоту, шлунково-кишкові розлади, виразку шлунка, діарею та серцево-судинні розлади.
2. Сполуки загальної формули (І)
 (І),
(І),
де
R та R1 мають значення за п. 1,
R2 - атом водню або розгалужена чи нерозгалужена С1-8 алкільна група,
R3 - розгалужена чи нерозгалужена С2-8 алкокси, С3-8 циклоалкільна, С5-10 біциклоалкільна, Сб-10 трициклоалкільна, С4-8 алкенільна, С5-8 циклоалкенільна групи, які можуть довільно містити один або кілька гетероатомів з групи (О, N, S) і можуть бути довільно заміщені гідроксигрупою або 1-3 атомами фтору, або R3 представляє С3-8 трифторалкільну або С2-8 фторалкільну групу, або R3 представляє бензильну або фенетильну групу, у яких ароматичне кільце може бути заміщене 1-4 замісниками Y, що можуть бути однаковими або різними, з групи, вибраної з розгалуженої або нерозгалуженої (С1-3)-алкільної або алкокси, гідрокси, галогенної, трифторметильної, трифторметилтіо, трифторметокси, нітро, моно- або діалкіл(С1-2)аміно, (С1-3)-алкоксикарбонільної, трифторметилсульфонільної, сульфамоїльної, (С1-3)-алкілсульфонільної, карбоксильної, ціано, карбамоїльної, (С1-3)-діалкіламіносульфонільної, (С1-3)-моноалкіламіносульфонільної або ацетильної груп, або R3 представляє 3-піридильну, 4-піридильну, піримідильну, піразинільну, піридазинільну, триазинільну або тієнільну групу, у яких гетероароматичні кільця можуть бути заміщені 1-2 замісниками Y, де Y має значення, наведені вище, або ж R3 представляє групу NR4R5, де
R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену, моноциклічну або біциклічну, гетероциклічну групу з 4-10 кільцевими атомами, причому ця гетероциклічна група містить один або два гетероатоми з групи N, О або S, які можуть бути однакові або різні, і зазначена гетероциклічна група може бути заміщена розгалуженою чи нерозгалуженою С1-3 алкільною, гідрокси або трифторметильною групою або атомом фтору, або
R2 та R3 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену, моноциклічну або біциклічну, гетероциклічну групу з 4-10 кільцевими атомами, причому гетероциклічна група містить один або два гетероатоми з групи N, О або S, які можуть бути однакові або різні і зазначена гетероциклічна група може бути заміщена розгалуженою чи нерозгалуженою С1-3 алкільною, гідрокси, піперидинільною або трифторметильною групою або атомом фтору, за умови, що зазначена гетероциклічна група не являє собою незаміщену піперидинільну або незаміщену морфолінільну групу, або 2,2,6,6-тетраалкілпіперидинільну групу, а також їхні пролікарські форми, стереоізомери та солі.
3. Сполуки загальної формули (І)
 (І),
(І),
де
R та R1 незалежно один від одного представляють фенільну, нафтильну, тієнільну, піридильну, піримідильну, піразинільну, піридазинільну або триазинільну групи, причому ці групи можуть бути заміщені 1-4 замісниками X, які мають значення за п. 1,
R2 та R3 мають значення за п. 2,
та їхні пролікарські форми, стереоізомери та солі.
4. Сполуки загальної формули (І)
 (І),
(І),
де
R та R1 незалежно один від одного представляють фенільну групу, яка може бути заміщена 1-4 замісниками, що можуть бути однакові або різні, з групи метил, метокси, галоген, трифторметил або ціан, R та R1 незалежно один від одного представляють фенільну, тієнільну або піридильну групу, яка може бути заміщена 1-4 замісниками, що можуть бути однакові або різні, з групи метил, метокси, галоген, трифторметил або ціан,
R2 має значення за п. 2,
R3 представляє групу NR4R5,
де R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену, моноциклічну або біциклічну, гетероциклічну групу з 4-10 кільцевими атомами, причому ця гетероциклічна група містить один або два гетероатоми з групи N, О або S, які можуть бути однакові або різні, і зазначена гетероциклічна група може бути заміщена розгалуженою чи нерозгалуженою С1-3 алкільною, гідрокси або трифторметильною групою або атомом фтору, та їхні пролікарські форми, стереоізомери та солі.
5. Фармацевтична композиція, що містить фармакологічно активну кількість принаймні однієї зі сполук за пп. 2-4 як діючу речовину.
6. Застосування сполуки за одним із пп. 2-4 для приготування фармацевтичної композиції для лікування розладів, пов'язаних з нейротрансмісією канабіноїдів.
7. Застосування за п. 6, яке відрізняється тим, що зазначеними розладами є: психози, бентежність, депресія, дефіцит уваги, розлади пам'яті, розлади мислення, розлади апетиту, ожиріння, алкоголізм, лібідо, наркозалежність, нейродегенеративні розлади, недоумство, дистонія, спастичність м'язів, тремтіння, епілепсія, розсіяний склероз, травматичні пошкодження мозку, інсульт, хвороба Паркінсона, хвороба Альцгеймера, хвороба Гантінгтона, синдром Туретта, мозкова ішемія, апоплексія мозку, черепно-мозкова травма, пошкодження спинного мозку, нервово-запальні розлади, бляшковий склероз, вірусний енцефаліт, розлади, пов'язані з демієлінізацією, а також больові симптоми, включаючи невропатичні болі, септичний шок, глаукому, діабет, рак, блювання, нудоту, шлунково-кишкові розлади, виразку шлунка, діарею та серцево-судинні розлади.
Текст
1. Застосування сполуки формули (І) C2 2 (19) 1 3 80298 різні, причому ця гетероциклічна група може бути заміщена розгалуженою чи нерозгалуженою С1-3 алкільною, гідрокси, піперидинільною або трифторметильною групою або атомом фтору, а також їхні пролікарські форми, стереоізомери та солі, для приготування фармацевтичної композиції для лікування розладів, пов'язаних з нейротрансмісією СВ1 канабіноїдів, таких, як психози, бентежність, депресія, дефіцит уваги, розлади пам'яті, розлади мислення, розлади апетиту, ожиріння, алкоголізм, лібідо, наркозалежність, нейродегенеративні розлади, недоумство, дистонія, еластичність м'язів, тремтіння, епілепсія, розсіяний склероз, травматичні пошкодження мозку, інсульт, хвороба Паркінсона, хвороба Альцгеймера, хвороба Гантінгтона, синдром Туретта, мозкова ішемія, апоплексія мозку, черепно-мозкова травма, пошкодження спинного мозку, нервово-запальні розлади бляшкового склерозу, вірусний енцефаліт, розлади, пов'язані з демієлінізацією, а також больові симптоми, включаючи невропатичні больові симптоми, септичний шок, глаукому, діабет, рак, блювання, нудоту, шлунково-кишкові розлади, виразку шлунка, діарею та серцево-судинні розлади. 2. Сполуки загальної формули (І) R 4 4-10 кільцевими атомами, причому ця гетероциклічна група містить один або два гетероатоми з групи N, О або S, які можуть бути однакові або різні, і зазначена гетероциклічна група може бути заміщена розгалуженою чи нерозгалуженою С1-3 алкільною, гідрокси або трифторметильною групою або атомом фтору, або R2 та R3 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену, моноциклічну або біциклічну, гетероциклічну групу з 4-10 кільцевими атомами, причому гетероциклічна група містить один або два гетероатоми з групи N, О або S, які можуть бути однакові або різні і зазначена гетероциклічна група може бути заміщена розгалуженою чи нерозгалуженою С1-3 алкільною, гідрокси, піперидинільною або трифторметильною групою або атомом фтору, за умови, що зазначена гетероциклічна група не являє собою незаміщену піперидинільну або незаміщену морфолінільну групу, або 2,2,6,6-тетраалкілпіперидинільну групу, а також їхні пролікарські форми, стереоізомери та солі. 3. Сполуки загальної формули (І) R R1 N R1 N N N N N (І), O N R2 (І), O R3 де R та R1 мають значення за п. 1, R2 - атом водню або розгалужена чи нерозгалужена С1-8 алкільна група, R3 - розгалужена чи нерозгалужена С 2-8 алкокси, С3-8 циклоалкільна, С5-10 біциклоалкільна, Сб-10 трициклоалкільна, С4-8 алкенільна, С5-8 циклоалкенільна групи, які можуть довільно містити один або кілька гетероатомів з групи (О, N, S) і можуть бути довільно заміщені гідроксигрупою або 1-3 атомами фтору, або R3 представляє С3-8 трифторалкільну або С2-8 фторалкільну групу, або R3 представляє бензильну або фенетильну групу, у яких ароматичне кільце може бути заміщене 1-4 замісниками Y, що можуть бути однаковими або різними, з групи, вибраної з розгалуженої або нерозгалуженої (С1-3)алкільної або алкокси, гідрокси, галогенної, трифторметильної, трифторметилтіо, трифторметокси, нітро, моно- або діалкіл(С1-2)аміно, (С1-3)алкоксикарбонільної, трифторметилсульфонільної, сульфамоїльної, (С1-3)-алкілсульфонільної, карбоксильної, ціано, карбамоїльної, (С1-3)діалкіламіносульфонільної, (С1-3)моноалкіламіносульфонільної або ацетильної груп, або R3 представляє 3-піридильну, 4піридильну, піримідильну, піразинільну, піридазинільну, триазинільну або тієнільну групу, у яких гетероароматичні кільця можуть бути заміщені 1-2 замісниками Y, де Y має значення, наведені вище, або ж R3 представляє групу NR4R5, де R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену, моноциклічну або біциклічну, гетероциклічну групу з N R3 R2 де R та R1 незалежно один від одного представляють фенільну, нафтильну, тієнільну, піридильну, піримідильну, піразинільну, піридазинільну або триазинільну групи, причому ці групи можуть бути заміщені 1-4 замісниками X, які мають значення за п. 1, R2 та R3 мають значення за п. 2, та їхні пролікарські форми, стереоізомери та солі. 4. Сполуки загальної формули (І) R R1 N N N (І), O N R2 R3 де R та R1 незалежно один від одного представляють фенільну групу, яка може бути заміщена 1-4 замісниками, що можуть бути однакові або різні, з групи метил, метокси, галоген, трифторметил або ціан, R та R1 незалежно один від одного представляють фенільну, тієнільну або піридильну групу, яка може бути заміщена 1-4 замісниками, що можуть бути однакові або різні, з групи метил, метокси, галоген, трифторметил або ціан, R2 має значення за п.2, R3 представляє групу NR4R5, де R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену, моноциклічну або біциклічну, гетероциклічну групу з 4-10 кільцевими атомами, причому ця гетероциклічна група містить один або два гетероатоми з групи N, О або S, які можуть бути однакові або 5 80298 6 різні, і зазначена гетероциклічна група може бути заміщена розгалуженою чи нерозгалуженою С1-3 алкільною, гідрокси або трифторметильною групою або атомом фтору, та їхні пролікарські форми, стереоізомери та солі. 5. Фармацевтична композиція, що містить фармакологічно активну кількість принаймні однієї зі сполук за пп.2-4 як діючу речовину. 6. Застосування сполуки за одним із пп.2-4 для приготування фармацевтичної композиції для лікування розладів, пов'язаних з нейротрансмісією канабіноїдів. 7. Застосування за п.6, яке відрізняється тим, що зазначеними розладами є: психози, бентежність, депресія, дефіцит уваги, розлади пам'яті, розлади мислення, розлади апетиту, ожиріння, алкоголізм, лібідо, наркозалежність, нейродегенеративні розлади, недоумство, дистонія, спастичність м'язів, тремтіння, епілепсія, розсіяний склероз, травматичні пошкодження мозку, інсульт, хвороба Паркінсона, хвороба Альцгеймера, хвороба Гантінгтона, синдром Туретта, мозкова ішемія, апоплексія мозку, черепно-мозкова травма, пошкодження спинного мозку, нервово-запальні розлади, бляшковий склероз, вірусний енцефаліт, розлади, пов'язані з демієлінізацією, а також больові симптоми, включаючи невропатичні болі, септичний шок, глаукому, діабет, рак, блювання, нудоту, шлунковокишкові розлади, виразку шлунка, діарею та серцево-судинні розлади. Цей винахід стосується групи похідних 1Н1,2,4-триазолу, способів одержання зазначених сполук та фармаційних композицій, що містять одну або кілька таких сполук у якості діючої речовини. Ці похідні 1Н-1,2,4-триазолкарбоксаміду є могутніми агоністами, частковими агоністами, зворотними агоністами або антагоністами рецепторів канабіноїдів-СВі і можуть застосовуватися для лікування психічних та нервових розладів, а також інших захворювань, пов'язаних з нейротрансмісією канабіноїдів-СВ1. Похідні 1,5-діарил-1Н-1,2,4-триазол-3карбоксаміду описані у [ЕР 0346620 та GB 2120665] як гербіциди. Нещодавно повідомлялося про 1,2,4-триазоли як потенційні агоністи та антагоністи рецепторів канабіноїдів-СВ1 та - СВ2 [Jagerovic Н. et al., Drugs Fut. 2002, 27 (Suppl.A): XVIIth Int. Symp. on Medicinal Chemistry, p.284]. Зараз несподівано виявлено, що відомі та нові похідні 1,5-діарил-1Н-1,2,4-триазол-3-карбоксаміду формули (І), а також їхні про лікарські форми, солі та стереоізомери є могутніми агоністами, частковими агоністами, зворотними агоністами або антагоністами рецепторів канабіноїдів-СВі Завдяки могутній агоністичній, частково агоністичній, зворотно агоністичній або антагоністичній активності щодо рецепторів канабіноїдів-СВ1 сполуки за винаходом можуть використовуватися для лікування психозів, бентежності, депресій, дефіциту уваги, розладів пам'яті, розладів мислення, розладів апетиту, ожиріння, алкоголізму, лібідо, наркозалежності, нейродегенеративних розладів, недоумства, дистонії, еластичності м'язів, тремтіння, епілепсії, розсіяного склерозу, травматичних пошкоджень мозку, інсульту, хвороби Паркінсона, хвороби Альцгеймера, епілепсії, хвороби Гантінгтона, синдрому Туретта, мозкової ішемії, апоплексії мозку, черепно-мозкової травми, пошкоджень спинного мозку, нервово-запалювальних розладів, бляшкового склерозу, вірусного енцефаліту, розладів, пов'язаних з демієлінізацією, а також больових симптомів, включаючи невропатичні болі, септичний шок, глаукому, діабет, рак, блювання, нудоту, шлунково-кишкові розлади, виразку шлунку, діарею та серцево-судинні розлади. Спорідненість сполук за винаходом до рецепторів СВ1канабіноїдів визначалася за допомогою препаратів з мембран клітин яєчників китайського хом'яка (ЯКХ), до яких стійко трансфектували людські рецептори СВ1 канабіноїдів з [3Н]СР55,940 в якості радіоліганду. Після інкубації свіжо приготованих препаратів клітинних мембран з [3Н]лігандом з доданням сполук за винаходом або без них зв'язаний та вільний ліганди розділяли фільтрацією на фільтрах із скловолокна. Радіоактивність фільтрів вимірювали лічильником рідинних сцинтиляцій. Антагоністична, агоністична або частково агоністична активність сполук за винаходом щодо СВ1 канабіноїдів визначалася функціональним дослідженням клітин яєчників китайського хом'яка (ЯКХ), до яких були клоновані людські рецептори СВ1. Клітини ЯКХ вирощували у модифікованому за Дульбекко середовищі Ігла (DMEM) з доданням 10% температурно інактивованої сироватки телячого зародку. Середовище піддавали аспірації й замінювали з застосуванням DMEM без сироватки телячого зародку, але з вмістом [3Н] - арахідонової кислоти, після чого інкубували протягом ночі у піч R R1 N N N (І), O N R2 R3 де - R та R1 незалежно один від одного представляють фенільну, нафтильну, тієнильну, піридільну, піримідільну, піразинільну, піридазинільну або триазинільну групи, причому ці групи можуть бути заміщені 1-4 замісниками X, які можуть бути однаковими або різними, з групи, що містить розгалужений або нерозгалужений (С1_3)-алкіл або алкоксі, гідроксі, галоген, трифторметил, трифторметилтіо, трифторметоксі. Група з чотирьох 1,5-діарил-N-(2-піриділ)-1Н1,2,4-триазол-3-карбоксамідів описана у [Harhash A.H. et al., Indian J. Chem., 1976, 14В, 168-272]. 7 ці клітинної культури (5% СO2/95% повітря, 37°С, насичена вологою атмосфера). Протягом цього часу [3Н]- арахідонову кислоту впроваджували до мембранних фосфоліпідів. У день випробувань середовище аспірували і клітини тричі промивали 0,5мл фосфатно-буферного фізрозчину з вмістом 0,2% білка бичачої сироватки. Стимуляція рецептора СВ1 WIN 55,212-2 приводила до активації PLA2 з наступним виділенням [3 Н] – арахідонової кислоти до середовища. Цьому спричиненому WIN 55,212-2 виділенню протидіяли у залежності від концентрації антагоністи рецепторів СВ1. Агоністичну або частково агоністичну активність сполук за винаходом до канабіноїдів можна визначити за опублікованими методиками, як от визначення канабіміметичної активності in vivo [Wiley J.L., Jefferson R.G., Grier M.C., Mahadevan A., Razdan R.K., Martin B.R., J.Pharmacol.Exp.Ther. 2001, 296, 1013]. Винахід стосується як рацематів, сумішей діастереомерів, так і окремих стереоізомерів сполук формули (І). Також і пролікарські форми, тобто сполуки, що після введення до людського організму будь-яким відомим шляхом метаболізуються у сполуки формули (І), охоплюються обсягом винаходу. Зокрема, це стосується сполук з первинними або вторинними аміно- або гідроксігрупами. Такі сполуки можуть реагувати з органічними кислотами, утворюючи сполуки формули (І), де є присутня додаткова група, яка легко усувається після введення; маються на увазі, наприклад, але не обмежуються амідин, енамін, основа Манніха, похідне гідроксилметилену, похідне О(ацілоксіметиленкарбамату), карбамат, ефір, амід або енамінон. Пролікарська форма - це неактивна сполука, яка, будучи поглинутою, перетворюється на активну форму [Medicinal Chemistry: Principles and Practice, 1994, ISBN 0-85186-494-5, ed.F.D.King, p.216]. Сполуки за винаходом можна перевести у форми, придатні для введення до організму, відомими способами з застосуванням допоміжних речовин та/або рідких або твердих носіїв. Придатні шляхи синтезу сполук за винаходом є такі: Шлях синтезу А Етап 1: Ефірний гідроліз сполуки формули (II), де Re - розгалужена або нерозгалужена (Сі_4)алкільна або бензильна група, дає сполуку формули (III) де R та Ri мають значення, що наведені вище. 80298 8 Сполуки за винаходом з формулою (II), де R6 розгалужена або нерозгалужена (С1_4)-алкільна або бензильна група, можна одержати відомими способами, наприклад: a) Sawdey G.W., J.Am.Chem.Soc, 1957, 79, 1955 b) Czoliner L. et al., Arch. Pharm. (Weinheim), 1990, 323, 225 c) Eicher T. and Hauptmann S. The Chemistry of Heterocycles, Thieme Verlag, Stuttgart,1995 (ISBN 313 100511 4), p.208-212. Етап 2: Реакція сполуки формули (III) зі сполукою формули R2R3NH, де R2 та R3 мають значення, що наведені вище, методами активації та сполучення, наприклад, утворення активного ефіру, або у присутності пов'язуючого реагенту, наприклад, DCC, HBTU, ВОР (бензилоктилфталату), СІР (2-хлор-1,3-діметилімідазолінійгексафторфосфату) або РуАОР (7азабензотриазол-1-ілоксітрис (піролідин)фосфонійгексафторфосфату). Такі методи активації та сполучення описані у: a) M.Bodanszky and A.Bodanszky: The Practice of Peptide Synthesis, Springer-Verlag, b) New York, 1994; ISBN: 0-387-57505-7; K.Akaji et al., Tetrahedron Lett (1994), 35, 33153318; c)F.Albericio et al., Tetrahedron Lett. (1997), 38, 4853-4856).Ця реакція дає похідне 1Н-1,2,4триазолу формули (І). Шлях синтезу В Сполука формули (III) реагує з галогенуючою речовиною, наприклад, тіонилхлоридом (SOCb) або оксалілхлоридом. Ця реакція дає відповідний карбнілхлорид (кислий хлорид) (IV). Реакція сполуки формули (IV) зі сполукою формули R2R3NH, де R2 та R3 мають значення, що наведені вище, дає похідне 1Н-1,2,4-триазолу формули (І). Шлях синтезу С Провадять реакцію амідування сполуки формули (II) зі сполукою формули R2R3NH, де R2 та R3 мають значення, що наведені вище, одержуючи похідне 1Н-1,2,4-триазолу формули (І). Реакціям амідування може сприяти застосування триметилалюмінію Al(CHg)3. [Докладніше про медійовану алюмінієм конверсію ефірів у аміди див. J.I.Levin, E.Turos, S.M.Weinreb, Synth.Commun. (1982), 12, 989-993]. Приклад 1 Частина А: До розчину 25г (0,136 моля) діметиламіномалонатгідрохлориду у 200 мл діхлорметану додають з перемішуванням 41,4мл (2,2 молярних еквіваленти) триетиламіну при 0°С. Повільно додають 23,8г (0,136 моля) 4-хлорбензоїлхлориду і одержаний розчин залишають на ніч при кімнатній температурі. Додають воду й відокремлюють органічну фазу. Водну фазу двічі екстрагують діх 9 лорметаном. Органічні фази зливають разом, промивають водою, сушать над MgSO4, фільтрують та концентрують у вакуумі. Осад перекристалізують з 400 мл метанолу, одержуючи 30,5г (вихід 79%) діметил-2-(4-хлорбензоїламін)малонату. Точка топлення 146-148°С, 1H-ЯМР (200МГц, CDC13): d 3,86 (s, 6H), 5,38 (d, J=6Гц, 1Н), 7,15 (br d, J~6Гц, 1Н), 7,43 (d, J=8Гц, 2Н), 7,79 (d, J=8Гц, 2Н). Частина В: До суспензії 19,44г (0,12 моля) 2,4діхлораніліну у 25мл концентрованої НСl та 75мл оцтової кислоти при 0°С додають з перемішуванням розчин 9,0г NaNO2 (0,13 моля) у 50мл води; одержаний розчин перемішують 15 хвилин. Повільно додають розчин 28,55г (0,10 моля) діметил-2(4-хлорбензоїламін)малонату у 200мл ацетону, підтримуючи температуру нижче 0°С. Повільно додають розчин 120г К2СО3 у 200мл води; одержану чорну суміш перемішують 30 хвилин при 0°С. Суміш тричі екстрагують ЕtOАс. Органічні фази зливають разом, промивають відповідно водою, водним розчином NаНСО3 та ще раз водою, сушать над MgSO4, фільтрують та концентрують у вакуумі. Осад розчиняють у 500мл метанолу й додають розчин 1г натрію у 75мл метанолу. Одержану перемішану суміш залишають на ніч при кімнатній температурі та охолоджують у холодильнику. Одержаний осад відфільтровують і промивають метанолом, одержуючи 11,4г метил-5-(4хлорфеніл)-1-(2,4-діхлорфеніл)-1Н-1,2,4-триазол3-карбоксилату (вихід 30%). Точка топлення 153154°С, ЯМР (200МГц, CDC13): d 4,07 (s, 3Н), 7,287,60 (m, 7H). Частина С: До перемішаної суспензії 11,3г (0,0295 моля) метил-5-(4-хлорфеніл)-1-(2,4діхлорфеніл)-1Н-1,2,4-триазол-3-карбоксилату у 100мл метанолу додають 7,5мл 45% водного розчину КОН і нагрівають одержану суміш зі зворотнім холодильником 4 години. Суміш концентрують у вакуумі та 150мл води й додають концентровану НСl. Жовтий осад відфільтровують, промивають водою та сушать у вакуумі, одержуючи 10,0г 5-(4хлорфеніл)-1-(2,4-діхлорфеніл)-1Н-1,2,4-триазол3-карбонової кислоти (вихід 92%). Точка топлення 141-144°С (розклад). Частина D: До розчину 1,48г (4,0 ммоля) 5-(4хлорфеніл)-1-(2,4-діхлорфеніл)-1Н-1,2,4-триазолЗ-карбонової кислоти у 20мл ацетонітрилу послідовно додають з перемішуванням 1,5мл (2,1 молярного еквіваленту) діізопропилетиламіну (ДІПЕА), 1,66г (1,1 молярного еквіваленту) Обензотриазол-1-іл-N,N,N’,N’тетраметилуроншгексафтор-фосфату (HBTU) та 0,44г (1,1 молярного еквіваленту) 1амінопіперидіну. Залишають на ніч при перемішуванні, після чого додають водний розчин NaHCO3. Одержану суміш тричі екстрагують діхлорметаном. Органічні фази зливають разом, промивають водою, сушать над Na2SO4, фільтрують та концентрують у вакуумі, одержуючи 3,6г сирої олії. Цю олію далі очищують колонковою хроматографією (сілікагель; ЕtOАс : петролейний етер (40-60°С) 7:3 обc.) Очищений матеріал обробляють розчином 1М НСl в етанолі, одержуючи 1,50г (вихід 77%) 5(4-хлорфеніл)-1-(2,4-діхлорфеніл)-Н-(піперидін-1іл)-1Н-1,2,4-триазол-3-карбоксамід гідрохлориду. 80298 10 Точка топлення 238-240°С (розклад), 1H-ЯМР (400МГц, DMSO-d6): d 1,46-1,54 (m, 2H), 1,78-1,85 (m, 4H), 3,22-3,28 (m, 4H), 7,50 (s, 4H), 7,70 (dd, J=8 та 2Гц, 1H), 7,85-7,87 (m, 1H), 7,91 (d, J=8Гц, 1Н), (NH не проглядається). Аналогічним чином здійснюють приклади 2-18: 2. 5-(4-хлорфеніл)-1-(2,4-діхлорфеніл)-N(піролідин-1-іл)-1Н-1,2,4-триазол-3-карбоксамід гідрохлорид. Точка топлення 248-255°С (розклад). 3. 5-(4-хлорфеніл)-N-циклогексил-1-(2,4діхлорфеніл)-1Н-1,2,4-триазол-3-карбоксамід. Точка топлення 186-188°С. 4. N-t-бутоксі-5-(4-хлорфеніл)-1-(2,4діхлорфеніл)-1Н-1,2,4-триазол-3-карбоксамід. Точка топлення 150-152°С. 5. 5-(4-хлорфеніл)-1-(2,4-діхлорфеніл)-N-(nпентил)-1Н-1,2,4-триазол-3-карбоксамід. 1Н-ЯМР (400МГц, CDC13): d 0,92 (t, J=7Гц, 3Н), 1,35-1,44 (m, 4H), 1,62-1,70(m, 2Н), 3,48-3,56 (m, 2Н), 7,207,25 (m, 1Н), 7,34 (dt, J=8 та 2Гц, 2H), 7,42-7,50 (m, 4H), 7,54 (d, J=2Гц, 1Н). 6. 5-(4-хлорфеніл)-1-(2,4-діхлорфеніл)-N(морфолін-4-іл)-1Н-1,2,4-триазол-3-карбоксамід. Точка топлення 184-186°С. 7. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N(піперидін-1-іл)-1Н-1,2,4-триазол-3-карбоксамід гідрохлорид. Точка топлення 234-237°С (розклад). 8. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N(піролідин-1-іл)-1Н-1,2,4-триазол-3-карбоксамід гідрохлорид. Точка топлення 234-236°С (розклад). 9. 1-(4-хлорфеніл)-N-циклогексил-5-(2,4діхлорфеніл)-1Н-1,2,4-триазол-3-карбоксамід. 1НЯМР (400МГц, CDC13): d 1,14-1,81 (m, 8H), 2,022,10 (m, 2H), 4,00-4,11 (m, 1Н), 7,08 (br d, J~7Гц, 1Н), 7,26 (br d, J~8Гц, 2Н), 7,34 (br d, J~8 Гц, 2Н), 7,40 (dd, J=8 та 2Гц, 1H), 7,44-7,48 (m, 2H). 10. N-t-бутоксі-1-(4-хлорфеніл)-5-(2,4діхлорфеніл)-1Н-1,2,4-триазол-3-карбоксамід. 1НЯМР (400МГц, CDC13): 5 1,38 (s, 9H), 7,25 (br d, J~8 Гц, 2Н), 7,41 (dd, J=8 та 2Гц, 1H), 7,44-7,48 (m, 2H), 9,18 (br s, 1H). 11. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N-(nпентил)-1Н-1,2,4-триазол-3-карбоксамід. 1Н-ЯМР (400МГц, CDCl3): d 0,91 (t, J=7Гц, 3Н), 1,35-1,41 (m, 4H), 1,60-1,70 (m, 2H), 3,48-3,56 (m, 2H), 7,21 (br t, J~7Гц, 1Н), 7,34 (br d, J~8Гц, 2Н), 7,44 (dd, J=8 та 2Гц, 1Н), 7,44-7,48 (m, 2H). 12. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N(морфолін-4-іл)-1H-1,2,4-триазол-3-карбоксамід гідрохлорид. Точка топлення 224-226°С. 13. 1-(4-хлорфеніл)-5-(піридин-2-іл)-Т(піперидин-1-іл)-1Н-1,2,4-триазол-3-карбоксамід. Точка топлення 191-193°С. 14. 5-(2,4-діхлорфеніл)-N-(піперидін-1-іл)-1-(4(трифторметил)феніл)-1Н-1,2,4-триазол-3карбоксамід. Точка топлення 159-161°С. 15. 1’-[5-(2,4-діхлорфеніл)-1-(4(трифторметил)феніл)-1Н-1,2,4-триазол-3іл)карбоніл] піперидин. Точка топлення 155-156°С. 16. 1-(2,4-діхлорфеніл)-N-(піперидін-1-іл)-5(піридин-3-іл)-1Н-1,2,4-триазол-3-карбоксамід. Точка топлення 219°С. 17. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N(5,5,5-трифторпентил)-1Н-1,2,4-триазол-3карбоксамід. 1Н-ЯМР (400МГц, CDC13): d 1,63-1,80 11 (m, 4H), 2,06-2,22 (m, 2H), 3,54 (q, J~7Гц, 2Н), 7,26 (m, 3Н), 7,34 (br d, J~8Гц, 2Н), 7,40 (dd, J=8 та 2Гц, 1Н), 7,44-7,48 (m, 2H). 18. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N-(5фторпентил)-1H-1,2,4-триазол-3-карбоксамід. 1НЯМР (400МГц, CDC13): d 1,63-1,80 (m, 4Н), 2,062,22 (m, 2Н), 3,54 (q, J~7Гц, 2Н), 7,22-7,28 (m, 3Н), 7,34 (br d, J~8Гц, 2Н), 7,40 (dd, J=8 та 2Гц, 1Н), 7,44-7,48 (m, 2H). Приклад 19 Частина А: 1-(хлорфеніл)-5-(2,4-діхлорфеніл)1Н-1,2,4-триазол-3-карбонову кислоту одержують за методикою, наведеною у прикладі І, частини АС, з вихідних матеріалів відповідно діметиламінмалонатгідрохлориду, 2,4-діхлорбензоїлхлориду та 4-хлораніліну. Точка топлення 102-104°С. 1НЯМР (400МГц, DMSO-d6): d 7,36 (br d, J~8Гц, 2H), 7,50 (br d, J~8Гц, 2H), 7,59 (dd, J=8 та 2Гц, 1H), 7,70 (d, J=2Гц, 1H), 7,75 (d, J=8Гц, 1Н). Протон OH становить частину піку води при d 3,4. Аналогічним чином одержують 1-(хлорфеніл)5-(2,5-діхлорфеніл)-1Н-1,2,4-триазол-3-карбонову кислоту з вихідних матеріалів відповідно діметиламінмалонатгідрохлориду, 2,5діхлорбензоїлхлориду та 4-хлораніліну. Точка топлення 183-188°С. 1Н-ЯМР (400МГц, DMSO-d6): d 7,41 (br d, J~8Гц, 2Н), 7,52 (br d, J~8Гц, 2Н), 7,56 (d, J=8Гц, 1Н), 7,65 (dd, J=8 та 2Гц, 1Н), 7,88 (d, 3=2Гц, 1Н). Протон ОН становить частину піку води при d 3,5. Частина В: До розчину 0,37г (1,00 ммоля) 1(хлорфеніл)-5-(2,4-діхлорфеніл)-1Н-1,2,4-триазол3-карбонової кислоти у 10мл діхлорметану додають 0,254г (2,00 ммоля) оксалілхлориду. Одержану суміш концентрують у вакуумі, одержуючи сирий 1-(хлорфеніл)-5-(2,4-діхлорфеніл)-1Н-1,2,4триазол-3-карбонілхлорид. Частина С: Сирий 1-(хлорфеніл)-5-(2,4діхлорфеніл)-1Н-1,2,4-триазол-3-карбонілхлорид розчинюють у 10мл тетрагідрофурану (ТГФ). Додають 0,40г (3,00 ммоля) 2,3-дігідро-1Н-інден-2іламіну й перемішують одержану суміш протягом 42 годин при 25°С. Суміш концентрують у вакуумі, осад очищують препаративною рідинною хроматографією з одержанням 393мг (вихід 91%) 1-(4хлорфеніл)-5-(2,4-діхлорфеніл)-N-(2,3-дігідро-1Hінден-2-іл)-1Н-1,2,4-триазол-3-карбоксаміду. MS (ESI +) 485,6. 1H-ЯМР (400МГц, DMSO-d6): 3,06 (dd, J=16 та 8Гц, 2H), 3,21 (dd, J=16 та 8Гц, 2Н), 4,714,82 (m, 1Н), 7,12-7,16 (m, 2H), 7,19-7,24(m, 2H), 7,39 (br d, J~8Гц, 2Н), 7,52 (br d, J~8Гц, 2Н), 7,60 (dd, J=8 та 2Гц, 1H), 7,71 (d, J=2Гц, 1H), 7,79 (d, J=8Гц, 1H), 8,93-8,97 (m, 1H, NH). Аналогічним чином одержують у прикладах 20-43: 20. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N-(1етинілциклогексил)-1Н-1,2,4-триазол-3карбоксамід. MS (ESI+) 473,3. 21. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N-(2метилциклогексил)-1Н-1,2,4-триазол-3карбоксамід. MS (ESI+) 465,5. 22. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N-(4метилциклогексил)-1Н-1,2,4-триазол-3карбоксамід. MS (ESI+) 465,5. 80298 12 23. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-Nциклооктил-1Н-1,2,4-триазол-3-карбоксамід. MS (ESI +) 477,3. 24. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N(азепан-1-іл)-1Н-1,2,4-триазол-3-карбоксамід. MS (ESI +) 466,4. 25. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-Nциклогептил-1Н-1,2,4-триазол-3-карбоксамід. MS (ESI +) 465,5. 26. N-t-бутил-1-(4-хлорфеніл)-5-(2,4діхлорфеніл)-1Н-1,2,4-триазол-3-карбоксамід. MS (ESI +) 425,4. 27. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N-(1,1діетилпроп-2-ин-1-ил)-1Н-1,2,4-триазол-Зкарбоксамід. MS (ESI+) 461,5. 28. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N(2,2,2-трифторетил)-1Н-1,2,4-триазол-3карбоксамід. MS (ESI+) 451,3. 29. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N(екзо-біцикло[2.2.1 ]гепт-2-ил)-1Н-1,2,4-триазол-3карбоксамід. MS (ESI+) 461,5. 30. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N-(4(2-пропил)піперазин-1-іл)-1Н-1,2,4-триазол-3карбоксамід. MS (ESI+) 480,3. 1H-ЯМР (400МГц, DMSO-d6): 1,00 (d, J=7Гц, 6Н), 2,46-2,56 (m, 4H), 2,72 (септет, J=7Гц, 1Н), 3,66-3,74 (m, 4H), 7,36 (br d, J=8Гц, 2Н), 7,51 (br d, J=8Гц, 2Н), 7,59 (dd, J=8 та 2Гц, 1Н), 7,72 (d, 3=2 Гц, 1H), 7,75 (d, J=8Гц, 1Н). 31. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N(гексагідроциклопента[с]пірол-2(1Н)-іл)-1H-1,2,4триазол-3-карбоксамід. MS (ESI +) 476,4. 32. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-Nпентил-1H-1,2,4-триазол-3-карбоксамід. MS (ESI +) 435,5. 33.1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N-(2,2діметилпропил)-1H-1,2,4-триазол-3-карбоксамід. MS (ESI+) 439,6. 34. 1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-N-(3(трифторметил)феніл)-1Н-1,2,4-триазол-3карбоксамід. MS (ESI+) 511,7. 35. 1’-[1-(4-хлорфеніл)-5-(2,4-діхлорфеніл)-1Н1,2,4-триазол-3-іл)карбоніл]-1,4-біпіперидин. MS (ESI +) 520,5. 36. 1-(4-хлорфеніл)-N-(4-хлорфеніл)-5-(2,5діхлорфеніл)-N-метил-1H-1,2,4-триазол-3карбоксамід. MS (ESI+) 491,4. 37. 1-(4-хлорфеніл)-5-(2,5-діхлорфеніл)-N-(1етинилциклогексил)-1Н-1,2,4-триазол-3карбоксамід. MS (ESI+) 473,4. 38. 1-(4-хлорфеніл)-5-(2,5-діхлорфеніл)-N-(2метилциклогексил)-1Н-1,2,4-триазол-3карбоксамід. MS (ESI+) 465,5. 39. 1-(4-хлорфеніл)-5-(2,5-діхлорфеніл)-N-(4метилциклогексил)-1Н-1,2,4-триазол-3карбоксамід. MS (ESI+) 465,6. 40. 1-(4-хлорфеніл)-5-(2,5-діхлорфеніл)-Nциклооктил-1H-1,2,4-триазол-3-карбоксамід. MS (ESI +) 477,3. 41. 1-(4-хлорфеніл)-5-(2,5-діхлорфеніл)-Nциклогептил-1Н-1,2,4-триазол-3-карбоксамід. MS (ESI +) 465,6. 42. 1-(4-хлорфеніл)-5-(2,5-діхлорфеніл)-Nциклопентил-1Н-1,2,4-триазол-3-карбоксамід. MS (ESI +) 435,5. 13 80298 43. 1-(4-хлорфеніл)-5-(2,5-діхлорфеніл)-N-(2,2діметилпропил)-1Н-1,2,4-триазол-3-карбоксамід. MS (ESI+) 439,6. 14 Результати фармакологічних випробувань підгрупи сполук за винаходом, одержаних, як описано вище, наведені нижче у таблиці: Таблиця Людські рецептори канабіноїдів СВі Спорідненість in vitro Антагонізм in vitro Значення рК, Значення рА2 Приклад Приклад 2 Приклад 3 Приклад 5 Приклад 9 Приклад 11 6,6 6,9 6,9 7,4 6,3 Комп’ютерна верстка Н. Лисенко Підписне 7,2 8,7 8,2 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською1h-1,2,4-triazole-3-carboxamide derivatives as cannabinoid-cb1 receptor ligands
Автори англійськоюLange Josephus H. M., Kruse, Cornelis G., Kruse Cornelis G., Mccreary Andrew C., van Stuivenberg Herman H.
Назва патенту російськоюПроизводные 1н-1,2,4-триазол-3-карбоксамида как лиганды рецепторов канабиноидов-св1
Автори російськоюЛанге Йозефус Г.М., Крузе Корнелис Г., Маккрири Эндрю К., ван Стёйвенберг Герман Г.
МПК / Мітки
МПК: C07D 249/10, A61K 31/41, A61P 25/18
Мітки: канабіноїдів-св1, рецепторів, ліганди, похідні, 1н-1,2,4-триазол-3-карбоксаміду
Код посилання
<a href="https://ua.patents.su/7-80298-pokhidni-1n-124-triazol-3-karboksamidu-yak-ligandi-receptoriv-kanabinodiv-sv1.html" target="_blank" rel="follow" title="База патентів України">Похідні 1н-1,2,4-триазол-3-карбоксаміду як ліганди рецепторів канабіноїдів-св1</a>











