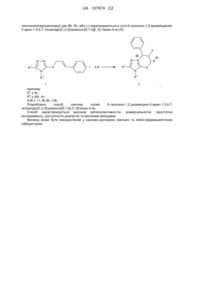
Спосіб одержання солей 6-галогено-1,2-дизаміщений-5-арил-1,5,6,7-тетрагідро[1,2,4]триазоло[5,1-b][1,3]тіазин-4-ію
Номер патенту: 107674
Опубліковано: 10.02.2015
Автори: Сливка Михайло Васильович, Лендєл Василь Георгійович, Усенко Руслан Миколайович
Формула / Реферат
Спосіб одержання солей 6-галогено-1,2-дизаміщений-5-арил-1,5,6,7-тетрагідро[1,2,4]триазоло[5,1-b][1,3]тіазин-4-ію, який включає електрофільну гетероциклізацію цинамілзаміщених 3-тіо-1,2,4-триазолів, який відрізняється тим, що як вихідні сполуки використовують цинамільні тіоетери 4-R-3-тіо-1,2,4-триазолів (І), які при галогеногетероциклізації (дія ІВr, Вr2 або І2) перетворюються в солі 6-галогено-1,2-дизаміщений-5-арил-1,5,6,7-тетрагідро [1,2,4]триазоло[5,1-b][1,3]-тіазин-4-ію (II):
 ,
,
причому
R1 є Ar;
R2 є Alk, Ar;
А-В є I-І, Br-Br, I-Br.
Текст
Реферат: Винахід належить до органічної хімії, а саме до способів одержання конденсованих похідних триазолотіазину. Спосіб одержання солей 6-галогено-1,2-дизаміщений-5-арил-1,5,6,7тетрагідро[1,2,4]триазоло[5,1-b][1,3]тіазин-4-ію, який включає електрофільну гетероциклізацію цинамілзаміщених 3-тіо-1,2,4-триазолів, який відрізняється тим, що як вихідні сполуки використовують цинамільні тіоетери 4-ІІ-3-тіо-1,2,4-триазолів (І), які при UA 107674 C2 (12) UA 107674 C2 галогеногетероциклізації (дія ІВr, Вr2 або I2) перетворюються в солі 6-галогено-1,2-дизаміщений5-арил-1,5,6,7-тетрагідро[1,2,4]триазоло[5,1-b][l, 3]-тіазин-4-ію (II): A N R N N 1 S A-B R 1 2 R I B S N N R + N 2 II , причому 1 R є Аr; 2 R є Alk, Аr; А-В є 1-І, Вr-Вr, І-Вr. Розроблено спосіб синтезу солей 6-галогено-1,2-дизаміщені-5-арил-1,5,6,7тетрагідро[1,2,4]триазоло[5,1-b] [1,3]тіазин-4-ію. Спосіб характеризується високою регіоселективністю, універсальністю, простотою експерименту, доступністю реагентів та високими виходами. Винахід може бути використаний у науково-дослідних хімічних та хіміко-фармацевтичних лабораторіях. UA 107674 C2 5 10 15 20 25 Винахід належить до органічної хімії, а саме до способів одержання конденсованих похідних триазолотіазину. Відомі кілька підходів при створенні поліконденсованих систем на основі симетричного триазолу. Зокрема, взаємодією 2,3H-1,2,4-триазол-3-тіонів із похідними пропінової кислоти можна одержати похідні конденсованої системи [1,2,4]триазоло[5,1-b][1,3]тіазину [1, 2]. Цей прийом успішно використовується для синтезу оксопохідних триазолотіазину і характеризується низькими виходами та низькою регіоселективністю. При дії хлорангідриду коричної кислоти на 2,3H-1,2,4-триазол-3-тіони автори отримали гідроксизаміщені конденсованої системи [1,2,4]триазоло[5,1-b][1,3]тіазину [3, 4]. Цей метод є простим у виконанні, але потребує важкодоступних реактивів і не придатний для синтезу солей 1,2,4]триазоло[5,1-b][1,3]тіазинію. Найбільш близьким за технічною суттю до заявленого є спосіб одержання системи [1,2,4]триазоло[1,3]тіазину, який включає електрофільну гетероциклізацію цинамілзаміщених 3тіо-1,2,4-триазолів і дає можливість синтезу лише регіоізомерної конденсованої системи, а саме [1,2,4]триазоло[3,4-b][1,3]тіазинів [5]. Цей прийом характеризується низькою селективністю 2 процесу гетероциклізації та відсутністю замісників при N-атомові Нітрогену триазольного циклу у вихідних сполуках, що виключає можливість утворення позитивно зарядженого органічного катіону, тобто, солей 6-галогено-1,2-дизаміщений-5-арил-1,5,6,7-тетрагідро [1,2,4]триазоло[5,1b] [1,3]тіазин-4-ію. Завданням винаходу є розробка способу одержання солей 6-галогено-1,2-дизаміщений-5арил-1,5,6,7-тетрагідро [1,2,4]триазоло[5,1-b] [1,3]тіазин-4-ію, який характеризується високою регіоселективністю, універсальністю, простотою експерименту, доступністю реагентів та високими виходами. Поставлена задача досягається таким чином, що в способі одержання солей 6-галогено-1,2дизаміщений-5-арил-1,5,6,7-тетрагідро [1,2,4]триазоло[5,1-b][1,3]тіазин-4-ію, який включає електрофільну гетероциклізацію цинамілзаміщених 3-тіо-1,2,4-триазолів, який відрізняється тим, що як вихідні сполуки використовують цинамільні тіоетери 4-R-3-тіо-1,2,4-триазолів (І), які при галогеногетероциклізації (дія IBr, Br2 або I2) перетворюються в солі 6-галогено-1,2дизаміщений-5-арил-1,5,6,7-тетрагідро [1,2,4]триазоло[5,1-b] [1,3]тіазин-4-ію (II): A N R N N 1 S + A-B 30 35 40 45 1 2 R B S N N R R N 2 I II , причому 1 R є Ar; 2 R є Alk, Ar; А-В є I-I, Br-Br, I-Br. Модельним об'єктом для досліджень було використано цинамільні тіоетери 3-тіо-1,2,4триазолів (2), які можна отримати реакцією алкілування натрієвих солей 3-меркапто-1,2,4триазолу (1). Із тіоетерів (2) методом електрофільної галогеногетероциклізації, який характеризується простотою виконання, доступністю реактивів та високими виходами, отримують солі 6-галогено-1,2-дизаміщений-5-арил-1,5,6,7-тетрагідро[1,2,4]триазоло[5,1-b] [1,3]тіазин-4-ію (3-5), які містять позитивно заряджений гетероатомом. Склад синтезованих сполук (2-5) підтверджено даними елементного аналізу. Індивідуальність доведено методом тонкошарової хроматографії. Будову доведено методом спектроскопії протонного магнітного резонансу (ПМР) високого розрішення (300 МГц) та методом спектроскопії ядерного магнітного 13 резонансу на ядрах Карбону (ЯМР С) (75 МГц). Приклад 1 Схема одержання солей 6-галогено-1,2-дизаміщений-5-арил-1,5,6,7тетрагідро[1,2,4]триазоло[5,1-b][1,3]тіазин-4-ію (3-5): 1 UA 107674 C2 1 1 2 2 1 2 A-B 2 2 1 5 10 15 20 25 30 35 40 B 1 1 2 3-5 R є С6Н5, 4-C6H4NO2; 2 R є СН3, С6Н5; А-В є Br-Br (3), I-I (4), I-Br (5); 4,5-Дизаміщені 3-цинамілтіо-1,2,4-триазоли (2). Калієву сіль (1) (0,054 моль) [6] розчиняють в етанолі при нагріванні. Після охолодження утвореного розчину до кімнатної температури, добавляють цинамілхлорид (0,060 моль) в 5 мл етанолу. Реакційну суміш нагрівають на водяній бані протягом 1 години. Кінцевий продукт, який випадає в осад після охолодження реакційної суміші, відфільтровують і перекристалізовують в етанолі. 4,5-Дифеніл-3-цинамілтіо-1,2,4-триазол (2а). Вихід - 52,4 %, Ттопл. - 152-154 °C. Кристали білого кольору. Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц): 3,97 д (2Н, СН2, 4,2), 6,36 м (1Н, СН), 6,59 д (1Н, СН, 9,3), 7,23-7,24, 7,29-7,38, 7,51-7,52 3м (15Н, 3С6Н5). Знайдено, %: С - 74,69; Н - 5,16; N-11,48; S-8,84, С23Н19N3S. Вирахувано, %: С - 74,80; Н 5,15; N-11,38; S-8.67. 5-(4-Нітрофеніл)-4-феніл-3-цинамілтіо-1,2,4-триазол (26). Вихід -71,6 %, Ттопл. 145-147 °C. Кристали білого кольору. Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц): 3,85 м (1Н, СН), 4,01 м (1Н, СН), 5,27 м (1Н, =СН), 6,22 м (1Н, =СН), 7,51 (5Н, С 6Н5), 7,64 д (2Н, 4-O2NC6H4, 8.7), 7,77 м (5Н, С6Н5), 8,29 д (2Н, 4-O2NC6H4, 8,7). Знайдено, %: С - 66,59; Н - 4,46; N-13,48; S-7,84, C23H18N4O2S. Вирахувано, %: С - 66,67; Н 4,35; N-13,53; S-7,73. 4-Метил-5-феніл-3-цинамілтіо-1,2,4-триазол (2в). Вихід - 82,6 %, Ттопл. 118-120 °C. Кристали білого кольору. Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц):3,52 м (3Н, СН3), 3,87 д (2Н, СН2, 4,2), 6,12 м (1Н, СН), 6,38 д (1Н, СН, 9,3), 7,23-7,28, 7,51-7,67 2м (10Н, 2С6Н5). Знайдено, %: С - 70,39; Н - 5,46; N-13,48; S-10,34, C18H17N3S. Вирахувано, %: С - 70,36; Н 5,54; N-13,68; S-10,42. 6-Бромо-5-феніл-1,5,6,7-тетрагідро [1,2,41триазоло[5,1-b][1,3]тіазин-4-ію бромід (3). Тіоетер (2) (0,001 моль) розчиняють в 20 мл льодяної оцтової кислоти при нагріванні. Після охолодження утвореного розчину до кімнатної температури, по краплях добавляють розчин брому (0,002 моль) в 10 мл льодяної оцтової кислоти. Реакційну суміш перемішують при кімнатній температурі протягом 3 години і залишають на 1 добу. Кінцевий продукт, який випадає в осад, відфільтровують і промивають на фільтрі ацетоном. 6-Бромо-1,2,5-трифеніл-1,5,6,7~тетрагідро [1,2,4]триазоло [5,1-b][1,3], тіазин-4-ію бромід (3а). Вихід - 64,0 %, Ттопл. 181-183 °C. Rf=0,77 (СН3СООН:С2Н5ОН:С6Н14=1:3:2). Жовтий порошок. Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц):3,74 д (1Н, СН2цикл, 8,1), 3,85-3,89 м (1Н, СН2цикл), 5,45 с (1Н, СНBr), 6,33-6,34 д (1Н, CHPh, 3,0), 7,37-7,44, 7,48-7,58, 7,73-7,81 3м (15Н, 13 3С6Н5). Спектр ЯМР С в ДМСО-Д6 (δ, м. ч., J, Гц):32,10 (CH2S); 45,15 (CHBr); 68,95 (CHPh); 128,24, 128,44, 129,60, 129,83, 130,33, 131,60, 133,02, 136,11,153,07 (3С 6Н5, 2Cтриазол). Знайдено, %: С - 52,32; Н - 3,70; Br-29,97; N-7,68; S-6,14, С23Н19Br2N3S. Вирахувано, %: С 52,17; Н - 3,59; Br-30,25; N-7,94; S-6,05. 6-Бромо-2-(4-нітрофеніл)-1-феніл-5-феніл-1,5,6,7-тетрагідро[1,2,4]-триазоло[5,1b][1,3]тіазин-4-ію бромід (36). Вихід 90,0 %, Ттопл. 115-117 °C. Rf=0,68 (СН3СООН:С2Н5ОН:С6Н14=1:3:2). Жовтий порошок. Спектр ПМР в ДМСО- Д6 (δ, м. ч., J, Гц): 3,77 2 UA 107674 C2 5 10 15 20 25 30 35 40 45 50 55 3,81 м (1Н, СНЦИКЛ), 3,98 м (1Н, СНЦИКЛ), 5,50 м (1Н, СНBr), 6,40 д (1Н, CHPh, 3,0), 7,52-7,88 3м, 8,30 д (14Н, 2С6Н5, O2NC6H4, 5,4). Знайдено, %: С - 48,22; Н - 3,24; Br-28.01; N-9,68; S-5,64, C23H18Br2N4O2S. Вирахувано, %: С 48.08; Н - 3,14; Br-27,87; N-9,76; S-5,57. 6-Бромо-2-феніл-1-метил-5-феніл-1,5,6,7-тетрагідро[1,2,4]триазоло[5,1-b][1,3]тіазин-4-ію бромід (3в). Вихід 86,8 %, Ттопл. 148-150 °C. Rf=0,53 (СН3СООН:С2Н5ОН:С6Н14=1:3:2). Жовтий порошок. Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц): 3,68 (1Н, м, CH2S); 3,82 (3Н, с, СН3); 3,98 (1Н, м, CH2S), 5,50 (1Н, м, СНBr); 6,34 (1Н, м, CHPh); 7,46, 7,64-7,77 (10Н, 2м, 2С6Н5). Знайдено, %: С - 46,12; Н - 3,70; Br-34,33; N-9,09; S-6,71, C18H17Br2N3S. Вирахувано, %: С 46,25; Н - 3,64; Br-34,26; N-8,99; S 6,85. 6-Йодо-1,2,5-трифеніл-1,5,6,7-тетрагідро[1,2,4]триазоло[5,1-b][1,3]-тіазин-4-ію йодид (4а). Тіоетер (2а) (0,001 моль), натрію перхлорат (0,001 моль) розчиняють в 20 мл льодяної оцтової кислоти при нагріванні. Після охолодження до кімнатної температури до утвореного розчину порціями по 4-5 мл добавляють розчин йоду (0,002 моль) в 50 мл льодяної оцтової кислоти. Реакційну суміш перемішують при кімнатній температурі протягом 72 години. Кінцевий продукт, який випадає в осад, відфільтровують і промивають на фільтрі діетиловим етером. Вихід - 91,0 %, Ттопл. - 150 °C. Rf=0,82 (СН3СООН:С2Н5ОН:С6Н14=1:3:2) Коричневий порошок. Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц):3,80-3,85 м (1Н, СН2цикл), 3,92-4,00 м (1Н, СН2цикл), 5,23 м (1Н, СНІ), 6,18 д (1Н, CHPh, 9,0), 7,34-7,62 м, 7,78 с (15Н, 3С6Н5). Знайдено, %: С - 44,58; Н - 3,20; І - 40,83; N-6,70; S-5,24, C23H19I2N3S. Вирахувано, %: С 44,30; Н - 3,05; І - 40,77; N-6,74; S-5,14. 6-Йодо-2-(4-нітрофеніл)-1-феніл-5-феніл-1,5,6,7-тетрагідро[1,2,4]-триазоло[5,1-b][1,3]тіазин4-ію йодид (46). Тіоетер (26) (0,001 моль) розчиняють в 20 мл льодяної оцтової кислоти при нагріванні. Після охолодження утвореного розчину до кімнатної температури, порціями по 4-5 мл добавляють розчин йоду (0,002 моль) в 50 мл льодяної оцтової кислоти. Реакційну суміш перемішують при кімнатній температурі протягом 72 годин. Продукт циклізації, який випадає в осад, відфільтровують і промивають на фільтрі діетиловим етером. Отриманий три йодид обробляють калій йодидом в ДМФ при перемішуванні. Цільовий продукт випадає в осад, який фільтрують, промивають ацетоном. Вихід - 66,8 %, Ттопл. - 174-176 °C. Rf=0,42 (СН3СООН:С2Н5ОН:С6Н14=1:3:2). Жовтий порошок. Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц): 3,86 м (1Н, СН2цикл), 3,97 м (1Н, СН2цикл), 5,26 м (1Н, СНІ), 6,24 д (1Н, CHPh, 6,0), 7,53-7,61 м, 7,77, 8.27 3м (14Н, С6Н5, 4-О2NС6Н4). Знайдено, %: С - 44,38; Н - 3,20; І - 40,83; N-9,00; S-5,25. C23H18I2N4O2S. Вирахувано, %: С 44,30; Н - 3,05; І - 40,77; N-8,99; S-5,14. 6-Йодо-1,2,5-трифеніл-1,5,6,7-тетрагідро[1,2,4]триазоло[5,1-b][1,3]-тіазин-4-ію бромід (5а). До 0,001 моль дрібно розтертого йоду додають 0,001 моль брому в 10 мл льодяної оцтової кислоти і гріють до розчинення; реакційну суміш залишають на одну добу для кількісного утворення броміду йоду. Тіоетер (2а) (0,001 моль) розчиняють в 20 мл льодяної оцтової кислоти при нагріванні. Після охолодження утвореного розчину до кімнатної температури, порціями по 4-5 мл добавляють попередньо приготований розчин броміду йоду (0,001 моль) в 10 мл льодяної оцтової кислоти. Реакційну суміш перемішують при кімнатній температурі протягом 24 години. Кінцевий продукт, який випадає в осад, відфільтровують і промивають на фільтрі діетиловим етером. Вихід - 91,3 %, Ттопл. - 165-166 °C. Rf=0,65 (СН3СООН: С2Н5ОН:С6Н14=1:3:2) Оранжевий порошок. Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц): 3,80-3,84 м (1Н, СН2цикл), 3,94-4,02 м (1Н, СН2цикл), 5,22 м (1Н, СHI), 6,18 д (1Н, CHPh, 9,0), 7,34-7,60 м, 7,79 с (15Н, 3С6Н5). Таким чином, було розроблено спосіб синтезу солей 6-галогено-1,2-дизаміщений-5-арил1,5,6,7-тетрагідро[1,2,4]триазоло[5,1-b][1,3]тіазин-4-ію. Спосіб характеризується високою регіоселективністю, універсальністю, простотою експерименту, доступністю реагентів та високими виходами. Винахід може бути використаний у науково-дослідних хімічних та хіміко-фармацевтичних лабораторіях. Джерела інформації: 1. N.A. Danilkina, S.V. Vershilov, M.B. Ganina, I.E. Mikhailov, B.A. Ivin. Synthesis of Perfluoroalkyl[1,2,4]triazolo[1,3]thiazinones. // Russ. J. of General Chem. - 2004. - V. 74. - № 3, - P. 520-522. 3 UA 107674 C2 5 10 2. G. Giammona, M. Neri, B. Carlisi, A. Pallazo, C. La Rosa. Reactions of azoesters and dimethyl acetylenedicarboxylate with 3-methyl-l, 2,4-triazole-5-thione. // J. Heterocyclic Chem.-1991. - V. 28. P. 325. 3. V.N. Britsun and M.O. Lozinskii. 2-R-5-Ar(Het)-5,6-dihydro-7H- [1,2,4]triazolo[5,1-b][1,3]-thiazin7-ones. // Chemistry of Heterocyclic Compounds.-2004. - V. 40. - № 8. - P. 1092-1096. 4. V.N. Britsun, A.N. Esipenko, A.A. Kudryavtsev, M.O. Lozinskii. Synthesis and transformations of 2-R-5-aryl-5,6-dihydro-7H-[1, 2,4]triazolo[5,1-b][1,3]thiazin-7-ones. // Russ. J. of Org. Chem.-2004. V. 40. - № 2. - P. 260-265. 5. V. I. Shmygarev and D. G. Kim. Study of the products of iodocyclization of 4-allyl-5-phenyl-l, 2,4-triazole-3-thione. // Chemistry of Heterocyclic Compounds.-2004. - Vol. 40, No. 8. - P. 1077-1081. - Прототип. 6. Хрипак С.М, Сталинец В.И., Сливка M.B., Зборовский Ю.Л… Окислительная гетероциклизация натриевых солей 3-меркапто-4-фенил-3//-1,2,4-триазолов. // Укр. Хім. Журн. 2001. - Т. 67, № 4. - С. 110-113. 15 ФОРМУЛА ВИНАХОДУ 20 Спосіб одержання солей 6-галогено-1,2-дизаміщений-5-арил-1,5,6,7тетрагідро[1,2,4]триазоло[5,1-b][1,3]тіазин-4-ію, який включає електрофільну гетероциклізацію цинамілзаміщених 3-тіо-1,2,4-триазолів, який відрізняється тим, що як вихідні сполуки використовують цинамільні тіоетери 4-R-3-тіо-1,2,4-триазолів (І), які при галогеногетероциклізації (дія ІВr, Вr2 або І2) перетворюються в солі 6-галогено-1,2-дизаміщений5-арил-1,5,6,7-тетрагідро [1,2,4]триазоло[5,1-b][1,3]-тіазин-4-ію (II): A N R N N 1 S + A-B R 2 R I 25 B S N N R N 1 2 II , причому 1 R є Ar; 2 R є Alk, Ar; А-В є I-І, Br-Br, I-Br. Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Автори англійськоюUsenko Ruslan Mykolaiovych, Slyvka Mykhailo Vasyliovych, Lendiel Vasyl Heorhiiovych
Автори російськоюУсенко Руслан Николаевич, Сливка Михаил Васильевич, Лендел Василий Георгиевич
МПК / Мітки
МПК: C07D 513/04, A61K 31/542, C07D 249/10
Мітки: спосіб, одержання, солей, 6-галогено-1,2-дизаміщений-5-арил-1,5,6,7-тетрагідро[1,2,4]триазоло[5,1-b][1,3]тіазин-4-ію
Код посилання
<a href="https://ua.patents.su/6-107674-sposib-oderzhannya-solejj-6-galogeno-12-dizamishhenijj-5-aril-1567-tetragidro124triazolo51-b13tiazin-4-iyu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання солей 6-галогено-1,2-дизаміщений-5-арил-1,5,6,7-тетрагідро[1,2,4]триазоло[5,1-b][1,3]тіазин-4-ію</a>
Попередній патент: Антиоксидантна композиція
Випадковий патент: Абразивний інструмент