Похідні 9а-n-/n`-карбамoїлу/ та 9а-n-/n`-тіокарбамoїлу/ від 9-деоксо-9а-а3а-9а гомоеритроміцину а, спосіб одержання та фармацевтична композиція
Номер патенту: 39870
Опубліковано: 16.07.2001
Автори: Кобрехел Габрієла, КЕЛНЕРІЧ Желько, Куюнджич Неджелько
Формула / Реферат
1. 9a-N-(N'-кap6aмоил)- и 9a-N-(N'-тиокap6aмоил) - производные 9-деоксо-9а-аза-9а-гомоэритромицина А формулы (I):
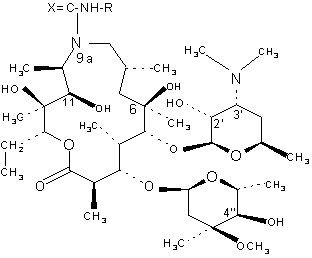 , (I)
, (I)
где R представляет собой С1-С3-алкильную группу, арильную или аралкильную группу, а Х представляет собой О или S, а также фармацевтически переносимые соли присоединения таких соединений с неорганическими или органическими кислотами.
2. Соединение по п.1, отличающееся тем, что R представляет собой С1-С3-алкильную группу, а Х представляет собой О.
3. Соединение по п. 2, отличающееся тем, что С1-С3-алкильная группа представляет собой изопропильную группу.
4. Соединение по п.1, отличающееся тем, что R представляет собой арильную группу, а Х представляет собой О.
5. Соединение по п. 4, отличающееся тем, что арильная группа представляет собой фенильную группу.
6. Соединение по п. 4, отличающееся тем, что арильная группа представляет собой 1-нафтильную группу.
7. Соединение по п. 4, отличающееся тем, что арильная группа представляет собой незамещенное или содержащее заместители 5-членное или 6-членное, кольцо, содержащее один или два гетероатома, а Х представляет собой О.
8. Соединение по п. 7, отличающееся тем, что гетероарильная группа представляет собой 4-метил-5-оксазоильную группу.
9. Соединение по п. 7, отличающееся тем, что гетероарильная группа представляет собой фурильную группу.
10. Соединение по п. 7, отличающееся тем, что гетероарильная группа представляет собой 4-пиридильную группу.
11. Соединение по п.1, отличающееся тем, что R представляет собой аралкильную группу, а Х представляет собой О.
12. Соединение по п. 11, отличающееся тем, что R представляет собой бензильную группу.
13. Соединение по п.1, отличающееся тем, что R представляет собой аралкильную группу, а Х представляет собой S.
14. Соединение по п. 13, отличающееся тем, что R представляет собой бензильную группу.
15. Способ получения 9а-N-(N'-карбамоил)- и 9а-N-(N'-тиокарбамоил)-производных 9-деоксо-9а-аза-9а-гомоэритромицина А формулы (I):
 , (I)
, (I)
где R представляет собой С1-С3-алкильную группу, арильную или аралкильную группу, а Х представляет собой О или S, отличающийся тем, что проводят реакцию 9-деоксо-9а-аза-9а-гомоэритромицина А с изоцианатами или
изотиоцианатами общей формулы (II):
R-N=C=X , (II)
где R и Х имеют указанные выше значения, в толуоле, ксилоле или каком-либо другом апротонном растворителе при температуре от 20 до 110°С, причем соединения общей формулы (II), в которых R представляет собой фенильную группу, 1-нафтильную группу или незамещенное или содержащее заместители 5-членное или 6-членное кольцо, содержащее один или два гетероатома, а Х представляет собой О или S, получают in situ по реакции перегруппировки Курциуса соответствующего азида кислоты при повышенной температуре.
16. Фармацевтическая композиция, включающая фармацевтически переносимый носитель и активное вещество, отличающаяся тем, что в качестве активного вещества содержит антибактериально эффективное количество соединения по п. 1.
17. Соединение по любому из пп. 1-14 для приготовления фармацевтических композиций для лечения бактериальных инфекций.
Текст
1. 9a-N-(N'-Карбaмoил)- и 9а-N-(N'-тиокарбамоил) - производные 9-деоксо-9а-аза-9а-гомоэритромицина А формулы (I): C2 (54) ПОХІДНІ 9А-N-/N`-КАРБАМOЇЛУ/ ТА 9А-N-/N`-ТІОКАРБАМOЇЛУ/ ВІД 9-ДЕОКСО-9 А-А3 А-9А ГОМОЕРИТРОМІЦ ИНУ А, СПОСІБ ОД ЕРЖАН НЯ ТА ФАРМАЦ ЕВТИЧНА КОМПОЗИЦІЯ где R представляет собой С1-С3-алкильную груп 39870 пу, арильную или аралкильную гр уппу, а Х представляет собой О или S, отличающийся тем, что проводят реакцию 9-деоксо-9а-аза-9а-гомоэритромицина А с изоцианатами или изотиоцианатами общей формулы (II): R-N=C=X , (II) где R и Х имеют указанные выше значения, в толуоле, ксилоле или каком-либо другом апротонном растворителе при температуре от 20 до 110°С, причем соединения общей формулы (II), в которых R представляет собой фенильную группу, 1-нафтильную группу или незамещенное или содержащее заместители 5-членное или 6-членное кольцо, содержащее один или два гетероатома, а Х представляет собой О или S, получают in situ по реакции перегруппировки Курциуса соответствующего азида кислоты при повышенной температуре. 16. Фармацевтическая композиция, включающая фармацевтически переносимый носитель и активное вещество, отличающаяся тем, что в качестве активного вещества содержит антибактериально эффективное количество соединения поп. 1. 17. Соединение по любому из пп. 1-14 для приготовления фармацевтических композиций для лечения бактериальных инфекций. Настоящее изобретение описывает 9а-N-(N'карбамоил)- и 9a-N-(N'-тиокарбамоил)- производные 9-деоксо-9а-аза-9а-гомоэритромицина А новые макролидные антибиотики группы азалида, обладающие антибактериальным действием, имеющие общую формулу (I): X=C-NH-R 9 кето- или гидроксильных гр упп в положения С-6 и/или С-12. Путем проведения реакции оксимации С-9-кетонов (Djokic S. и др.. Tetrahedron Lett., 1967, с.. 1945) с последующим превращением полученного 9(Е)-оксима в 9[0-(2-метоксиэтокси)метилоксим]-эритроми-цин A (ROKSITROMICIN) (Ambrieres G.S., патент Франции N 2473525, 1981) или 9(8)-эритромициламин (Egan R.S. и др., J. Org. Chem., 1974, 39, с.2492) или в его более сложное оксазиновое производное, 9-деоксо-11-деокси9,11-{имино-[2-(2-метоксиэтил)-этилиден]-окси}9(8)-эритромицин A (DIRITROMICIN) (Lugar Р. и др., J. Grist. Мої. Struct., 1979, 9, с.329) были синтезированы новые полусинтетические макролиды, основной характеристикой которых, помимо повышенной устойчивости в кислой среде, является улучшенная фармакокинетика и большая величина периода полусуществования по сравнению с исходным антибиотиком эритромицином А. По третьему способу модифицирования С-9-кетонов используют перегруппировку Бекмана 9(е)-оксима и проводят восстановление полученного простого иминоэфира (Kobrehel G. и др., патент США N 4328334, 5/1982) до 11-аза-Ю-деоксоЮдигидроэритромицина А (9-деок-со-9а-аза-9агомоэритромицина А) с расширением 14-членного кетолактонового кольца до 15-членного азалактонового кольца. Посредством проведения восстановительного N-метилирования 9а-аминогруппы по реакции Эшвейлера-Кларка (Kobrehel G. и др., патент Бельгии N 892357, 7/1982) или посредством предварительной защиты аминогруппы путем превращения ее в соответствующий М-оксид с последующим алкилированием и восстановлением (Bright G.M., патент США N 4474768, 10/1984). был синтезирован N-метил-11-аза-10-деоксо-10дигидроэритромицин А (9-деоксо-9а-метил-9а-аза9а-гомоэритромицин A, AZITROMICIN) - прототип азалидных антибиотиков, которые, кроме широкого спектра антимикробного действия, включающего грамотрицательные бактерии и внутриклеточные микроорганизмы, характеризуются специфическим механизмом транспорта к месту применения, большой величиной периода биологического полураспада и коротким периодом действия. В патенте ЕР А 0316128 (Bright G.M.) описаны новые 9а-аллил- и 9а-пропа'ргил-производные 9-деоксо9а-аза9а-го-моэритромицина А, а в патенте США N 4492688 (Bright G.M.) описаны синтез и бактерицидная активность соответствующих циклических где R представляет собой С 1-С3-алкильную группу, арильную или аралкильную групп у, а Х представляет собой 0 или S, а также фармацевтически переносимые соли присоединения таких соединений с неорганическими или органическими кислотами, способ получения таких соединений, способ получения фармацевтических композиций, а также использование полученных фармацевтических композиций для лечения бактериальных инфекций. Эритромицин А является макролидным антибиотиком, структура которого характеризуется 14членным макролактоновым кольцом, содержащим в положении 9 карбонильную гр уппу. Как было обнаружено McGuire в 1952 году (Antibiot. Chemother., 1952. 26 с.281). и на протяжении более 40 лет он считается надежным и эффективным антимикробным средством при лечении болезней, вызываемых грамположительными и некоторыми грамотрицательными микроорганизмами. Однако, в кислой среде он легко превращается в ангидроэритромицин А - неактивный С-6/С-12 метаболит со спирокетальной структурой (Kurath Р. и др., Experientia, 1971, 27, с.362). Хорошо известно, что спироциклизация агликонового кольца эритромицина А успешно ингибируется химическим превращением находящихся в положении С 2 39870 простых эфиров. В заявке Хорватии N 381-03/9305/041 (559-93-1) описаны синтез и спектр активности новых 9а,11-циклокарбаматов 9-деоксо-9ааза-11-деокси-9а-гомоэритромицина А и их 0метилированных производных. До настоящего времени не были описаны 9аN-(N'-карбамоил)- и 9a-N-(N'-тиокарбамоил)-производные 9-деоксо-9а-аза-9а-гомоэритромицина А и его фармацевтически переносимые соли присоединения с неорганическими или органическими кислотами, способ их получения, а также способы получения и использования фармацевтических препаратов. Было обнаружено, и целью настоящего изобретения является то, что 9а-N-(N'-карбамоил)- и 9а-N-(N'-тиокарбамоил)-производные 9-деоксо-9ааза-9а-томоэритромицина А и его фармацевтически переносимые соли присоединения с неорганическими или органическими кислотами могут быть получены путем проведения реакции 9-деоксо-9ааза-9а-гомоэритро-мицина А с изоцианатами или изотиоцианатами и, при необходимости, проведения реакции полученных 9а-N-(N'-карбамоил)- и 9а-N-(N'-тиокарбамоил)- производных 9-деоксо-9ааза-9а-гомоэритромицина А с неорганическими или органическими кислотами. Было обнаружено, что новые 9а-Н-(N'карбамоил)и 9а-N-(N'-тиокарбамоил)-производные 9-деоксо-9а-аза-9а-гомоэритромицина А формулы (I): Фармацевтически переносимые соли присоединения с кислотами, которые также представляют собой цель настоящего изобретения, получают путем проведения реакции 9а-МНМ'-карбамоил)- и 9а-N-(N'-тиокарбамоил)- производных 9-деоксо-9ааза-9а-гомоэритромицина А с не менее чем эквимолярным количеством соответствующей неорганической или органической кислоты, такой как соляной кислоты, -йодистоводородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, пропионовой кислоты, бензойной кислоты, бензолсульфокислоты, метансульфокислоты, лаурилсульфокислоты, стеариновой кислоты, пальмитиновой кислоты, янтарной кислоты, этилянтарной кислоты, лактобионо-вой кислоты, оксалиновой кислоты, салициловой кислоты и других аналогичных кислот, в инертном по отношению к данной реакции растворителе. Соли присоединения выделяют путем выпаривания растворителя или, по другому методу, отделением на фильтре спонтанно образующегося осадка или осадка, образующегося при добавлении неполярного ко-растворителя. 9а-N-(N'-карбамоил)- и 9а-N-(N'-тиокарбамоил) -производные 9-деоксо-9а-аза-9агомоэритромицина А формулы (I) и их фармацевтически переносимые соли присоединения с неорганическими или органическими кислотами обладают бактерицидной активностью in vitro. Минимальная ингибирующая концентрация (МІС, мкг/мл) определялась методом разбавления на микропластинах в соответствии с рекомендациями Национального Комитета по Стандартам для Клинических Лабораторий (NCCLS, М7-А2). Из Таблицы 1 видно, что стандартные штаммы и клинически выделенные испытанные культуры микроорганизмов восприимчивы к новым синтезированным соединениям. Таким образом, они могут быть использованы для дезинфекции помещений, хирургических инструментов и людей, а также в качестве лекарственных средств при лечении инфекционных болезней животных, особенно млекопитающи х и человека, вызываемых широким спектром грамположительных бактерий, микоплазм и вообще патогенными микроорганизмами, восприимчивыми к соединениям формулы (I). С этой целью описанные выше соединения и их фармацевтически переносимые соли присоединения могут быть назначены для перорального приема в обычных дозах от 0,2 мг/кг веса тела в день до 250 мг/кг веса тела в день, наиболее предпочтительно от 5 до 50 мг/кг веса тела в день, или для парентерального введения в виде подкожной или внутримышечной инъекции. Способ получения 9а-N-(N'-карбамоил)- и 9аN-(N'-тиокарбамоил)-производных 9-деоксо-9ааза-9а-гомоэритромицина А по настоящему изобретению иллюстрируется следующими Примерами, которые не могут рассматриваться как ограничивающие объем изобретения. Пример 1 9-деоксо-9а-N-(N'-изопропил-карбамоил)-9ааза-9а-гомоэритромицин А Смесь 9-деоксо-9а-аза-9а-гомоэритромицина А (7,27 г; 0,01 моль), изопропилизоцианата (0,94 г; 0,011 моль) и толуола (40 мл) перемешивают в течение 1 часа при температуре 30°С. Реакцион где R представляет собой С 1-С3-алкильную группу, арильную или аралкильную групп у, а Х представляет собой O или S, а также фармацевтически переносимые соли присоединения таких соединений с неорганическими или органическими кислотами могут быть получены путем проведения реакции 9-деоксо-9а-аза-9а-гомоэритромицина А с изоцианатами или изотиоцианатами общей формулы (II): R-N=C=X (II), где R и Х имеют указанные выше значения, в толуоле, ксилоле или каком-либо другом апротонном растворителе, при температуре от 20 до 110 "С, причем изоцианаты формулы (II), где R представляет собой фенильную группу, 1-нафтильную группу или незамещенное или содержащее заместители 5- или 6-членные ароматические кольца, содержащие один или два гетероатома, получают in situ путем проведения перегруппировки Курциуса соответствующего азида кислоты при повышенной температуре. 3 39870 ную смесь упаривают при пониженном давлении (40°C) до сухого остатка, получая неочищенный 9деоксо-9а-N-(N'-изопропил-карбамоил)-9а-аза-9агомоэритро-мицин А (7,0 г; 86,2%), Тпл 128-136°С. Путем перекристаллизации полученного продукта из водно-метанольной смеси было получено хроматографически гомогенное вещество, имеющее следующие физико-химические характеристики: Тпл 135-144°С. Тонкослойная хроматография: ЕtАс-(н-С6Н6)-МНЕt 2 (100:100:20), Rf 0,351; СНСІ3-СН3ОН-конц.NH4ОН (6:1:0,1), Rf 0,553. ИК-спектроскопия (КВr), см-1: 1730, 1625, 1515, 1455, 1380, 1270, 1165, 1050, 950. 1 H ЯМР (300 Мгц, CDCL3), d: 5,00 (1Н, Н-13), 4,85 (1Н, H-1''), 4,47 (1Н, Н-1'), 4,02 (1Н. Н-3), 3,91 [1Н, -СН(СН2)2]. 3,50 (1Н, Н-5), 3,43 (1Н, Н-9а), 3,28 (3Н, 3''-ОСНз), 2.49 (1Н, Н-9b), 2,32 [6Н, 3'-N(СН3)2], 2,31 (1Н, Н-8), 1,62 (1Н, Н-7а), 1,29 (3Н, 10-СН3), 1,14 [6Н, -СН(СН 3)2], 1,13 (1Н, Н7b), 1,04 (3Н, 8-СН3). 13 С Я МР (75 МГц, СDСl3), d: 175,5 (С-1), 158,2 (9a-NCONH), 103,8 (С-1'), 96,0 (C-1''), 87,9 (С-5), 78,8 (С-3), 48,8 (3''-ОСН3), 45,5 (C-2), 42,2 [-СH(СН3)2], 39,9 [3'-N(CH3)2], 27,4 (С-8), 22,9 [-СН(СН 3)2], 20,5 (8-СН3), 12,2 (10-СН3). Пример 2 9-деоксо-9а-М-{ГГ -[(4-метил-5-оксазол)карбамоил]}-9а-аза-9а-гомоэритромицин А Смесь 9-деоксо-9а-аза-9а-гомоэритромицина А (4,8 г; 0,0065 моль), азида 4-метил-5оксазолкарбоновой кислоты (1,0 г; 0,0066 моль) и безводного толуола (30 мл) нагревают в течение 15 минут при температуре кипения, а затем упаривают до сухого остатка методом перегонки при пониженном давлении (40°С). Полученный остаток суспендируют в ацетоне (20 мл), перемешивают при комнатной температуре и отделяют на фильтре образовавшиеся кристаллы, получая 9-деоксо9а-N-{N'-[(4-метил-5-оксазол) -карбамоил]}-9а-аза9а-гомоэритромицин А (5,4 г; 93,3%), Тпл 174177°С. Путем перекристаллизации из горячего ацетона получают хроматографически гомогенное вещество , имеющее следующие физикохимические характеристики: Тпд 181-183°С. Тонкослойная хроматография: ЕtАс-(н-С6Н6)-NHЕt2 (100:100:20), Rf 0,149; СНСІ3-СН3ОН-конц.NH4ОН (6:1:0,1), Rf 0,491. ИК-спектроскопия (КВr), см-1: 1730, 1680, 1655, 1490, 1460, 1380, 1170, 1050, 755. 660. 1 H ЯМР (300 МГц. Py d5 , 50°С), d: 9,02 (9a-N-CONH), 7,95 (-CH=N), 5,71 (1Н, Н13), 5,15 (1Н, H-1''), 4,94 (1Н, Н-1'), 4,77 (1Н, Н-3), 4,07 (1Н, H-5), 3,96 (1Н, Н-9а), 3,44 (ЗН, 3''-ОСН3). 2,50 (1Н, H-9b), 2,32 [6Н, 3'-N(СН3)2], 2,34 (1Н, Н-8), 2,35 (1Н, H-7a), 1,68 (ЗН, 10-СНз), 1,97 (1Н, H-7b), 1,09 (3Н, 8-СНз). 13 С Я МР (75 МГц, Ру d5, 50°С), d: 177,2 (C-1), 157,2 (9a-NCONH), 104,2 (С-1'). 96,9 (C-1''), 86,6 (C-5), 80,5 (C-3), 50,1 (3''-ОСН3), 46,5 (С-2), 42,2 (С-4). 41,0 [3'-N(СН3)2], 29,1 (С-8), 21,2 (8-СН3), 14,1 (10-СН3), 149,9, 142,2, 128,4 и 12,2 (4-метил-5-оксазол). Пример 3 9-деоксо-9а-М-[N'-(2-фурил)-карбамоил]-9ааза-9а-гомо-эритромицин А Аналогично способу, описанному по Примеру 2, из 9-деоксо-9а-аза-9а-гомоэритромицина А (2,18 г; 0,003 моль), азида 2-фуранкарбоновой кислоты (0,5 г; 0,0036 моль) и толуола (15 мл) получают смолистый остаток (2,1 г), из которого методом хроматографии на колонках с силикагелем с использованием в качестве растворителя смеси СНСІ3-СН3ОН (7:3) получают 9-деоксо-9а-N-[N'-(2фурил)-карбамоил]-9а-аза-9а-гомоэритромицин А (1,7 г; 77,0%), имеющий следующие физикохимические характеристики: Тпл 155-159°С. Тонкослойная хроматография: EtAc-(H-C 6H6)-NHEt2 (100:100:20), Rf 0,262; СНСl3-СН3ОН-конц.NH4OН (6:1:0,1), Rf 0,574. ИК-спектроскопия (КВr), см-1: 1730, 1655, 1520, 1460, 1380. 1270, 1165, 1050. 1000, 955, 900, 830, 730. 1 H ЯМР (300 МГц, ДМСО), d: 8,51 (9a-N-CONH), 7,24 (-0-CH=), 6,34 (-0СН= СН-), 6.00 (-CH=C-NH), 5,04 (1Н, Н-13), 4,77 (1Н. H-1''), 4,47 (1Н, Н-1'), 4,01 (1Н, Н-3), 3,42 (1Н, Н-5). 3,47 (1Н, Н-9а), 3,35 (3Н, 3''-ОСН3), 3,25 (1Н, Н-9b), 2,50 [6Н, 3'-N(CH3)2], 2,07 (1Н, Н-8), 1,45 (1Н, Н-7а), 1,20 (1Н, Н-7b), 1,15 (3Н, 10-СН3), 0,90 (3Н, 8-СН3). 13 С Я МР (75 МГц, ДМСО), d: 175,5 (С-1), 155,4 (9a-NCONH), 101,9 (С-1'), 95,3 (C-1''), 84,4 (С-5), 78,6 (С-3), 48,8 (3''-ОСН3). 44,6 (С-2), 40,0 (С-4), 40,1 [3''-N(СН3)2], 27,7 (С-8), 19,7 (8-СН3), 13,2 (10-СН3), 147,7, 136,5, 118,9 и 98,0 (5-фураноил). Пример 4 9-деоксо-9а-N-[N'-(4-пиридил)-карбамоил]-9ааза-9а-гомо-эритромицин А Аналогично способу, описанному по Примеру 2, из 9-деоксо-9а-аза-9а-гомоэритромицина А (2,18 г; 0,003 моль), азида изоникотиновой кислоты (0,53 г; 0,0036 моль) и толуола (15 мл) получают смолистый остаток (2,26 г), из которого методом перекристаллизации из водно-метанольной смеси был получен 9-деоксо-9а-N-[N'-(4-пиридил)карбамоил]-9а-аза-9а-гомоэритромицин А (1,9 г; 74,8%), имеющий следующие физико-химические характеристики: Тпл 149-153°С. Тонкослойная хроматография: ЕtАс-(н-С6Н6)-NНЕt2 (100:100:20), Rf 0.089; СНСІ3-СН3ОН-конц. NH4ОН (6:1:0,1). Rf 0,441. ИК-спектроскопия (КВr), см-1: 1730, 1650, 1590, 1510, 1460, 1380. 1330, 1280,. 1165, 1050, 1000, 955, 900, 830, 730. 1 H ЯМР (300 МГц, ДМСО), d: 8,66 (9a-N-CONH), 8,25, 7,35 (4-пиридил), 5,16 (1Н, Н-13), 4,89 (1Н, Н-1''), 4,52 (1Н, Н-1'), 4,15 (1Н, Н-3), 3,53 (1Н, Н-5), 3,51 (1Н, Н-9а), 3,33 (3Н, 3''ОСН3), 3,28 (1Н, H-9b), 2,34 [6H, 3'-N(СН3)2], 2,28 (1Н, Н-8), 1,62 (1Н, Н-7а), 1,23 (1Н, Н-7b), 1,36 (3Н,10-СН3), 1,04 (3Н, 8-СН3). 13 С Я МР (75 МГц, ДМСО), d: 176,1 (C-1), 155,5 (9a-NCONH), 102,2 (С-1'), 95,5 (C-1''), 84,3 (С-5), 78,7 (С-3), 48,9 (3''-ОСН3), 44,8 (С-2), 40,2 (С-4), 40,4 [3'-N(СНз)2], 27,8 (С-8), 20,2 (8-СН3), 14,4 (10-СН3). 149,8, 148,0, и 113,9 (4пиридил). 4 39870 Пример 5 9-деоксо-9а-N-(N'-фенил-карбамоил)-9а-аза9а-гомоэритромицин А Аналогично способу, описанному по Примеру 2, из 9-деоксо-9а-аза-9а-гомоэритромицина А (2,00 г; 0,0027 моль), азида бензойной кислоты (0,5 г; 0,0034 моль) й толуола (15 мл) получают смолистый остаток (2,43 г), из которого методом хроматографии на колонках с силикагелем при использованием в качестве растворителя смеси СН2С2-СH3ОН (85:15) получают 9-деоксо-9а-N-(N'фенил-карбамоил)-9а-аза-9а-гомоэритромицин А (1,4 г; 61,4%), имеющий следующие физикохимические характеристики: Тпл 126-130°С. Тонкослойная хроматография: ЕtАс-(н-С6Н6)-NНЕt2 (100:100:20), Rf 0,345; СНСІ3-СН3ОН-конц. NH4ОН (6:1:0,1), Rf 0,637. ИК-спектроскопия (КВr), см-1: 1730, 1645, 1600, 1539, 1510, 1455, 1380. 1315, 1240, 1165, 1045, 950, 895, 755, 690. 1 H ЯМР (300 МГц, ДМСО), d: 8,11 (9a-N-CONH), 7,30, 7,35 (фенил), 5,05 (1Н, Н-13), 4,79 (1Н, Н-1''), 4,46 (1Н, Н-1' ), 4,04 (1Н, Н3), 3,46 (1Н, Н-5), 3,28 (1Н, Н-9а), 3,23 (3Н, 3''ОСН3), 3,16 (1Н, H-9b), 2,34 [6Н, 3'-N(CН3)2], 2,16 (1Н, Н-8), 1,58 (1Н, Н-7а), 1,15 (1Н, H-7b), 1,25 (3Н,10-СН3), 0,90 (3Н, 8-СН3). 13 С Я МР (75 МГц, ДМСО), d: 175,6 (С-1), 156,1 (9a-NCONH), 102,0 (С-Г), 95.4 (C-1''), 84,4 (С-5), 78,5 (С-3), 48.9 (3''-ОСН3), 44,6 (С-2), 39,4 (С-4), 40,1 [3'-N(CH3)2], 27,3 (С-8), 20,0 (8-СН3), 14,0 (10-СН3), 140,6, 127,9 и 114,4 (фенил). Пример 6 9-деоксо-9а-N-(N'-бензил-карбамоил) -9а-аза9а-гомоэритромицин А Аналогично способу, описанному по Примеру 1, из 9-деоксо-9а-аза-9а-гомоэритромицина А (7,27 г; 0,01 моль), бензилизоцианата (1,33 г; 0,01 моль) и толуола (15 мл) получают смолистый остаток (8,4 г), из которого методом хроматографии на колонках с силикагелем при использованием в качестве растворителя смеси СНСІ3-СН3ОН (7:3) получают 9-деоксо-9а-N-(N'-бензил-карбамоил)9а-аза-9а-гомоэритромицин А (6,5 г; 75,6%), имеющий следующие физико-химические характеристики: Тпл 142-144°С. Тонкослойная хроматография: ЕtАс-(н-С6Н6)-NНЕt2 (100:100:20), Rf 0,355; СНСІ3-СН3ОН-конц.NH4ОН (6:1:0,1), Rf 0,621. ИК-спектроскопия (КВr), см-1: 1730, 1630, 1525, 1410, 1380, 1270, 1165, 1045, 950, 895, 755, 700. 1 H ЯМР (300 МГц, СDСІ3), d: 7,30, 5,00, 4,40 (-CH2-CH5), 5,04 (1Н, Н-13), 4,83 (1Н, Н-1''), 4,48 (1Н, Н-Г), 4,00 (1Н. Н-3), 3,52 (1Н, Н-5), 3,48 (1Н. Н-9а), 3,28 (3Н, 3''-ОСНз), 2,51 (1Н, H-9b), 2,56 [6H, 3'-N(СН3)2], 2,34 (1Н, Н-8), 1,66 (1Н, Н-7а), 1,10 (1Н, Н-7b), 0,99 (3Н,10-СН3), 1,36 (3Н, 8-СН3). 13 С Я МР (75 МГц, СDСІ3), d: 175,7 (С-1), 159,3 (9a-NCONH), 103,8 (С-1'), 96,5 (С-1''), 88,8 (С-5), 78,8 (С-3). 48,9 (3''-ОСН3), 45,9 (С-2), 40,4 (0-4), 40,2 [3'-N(СН3)2], 27,3 (C-8), 20,5 (8-СН3), 12,3 (10-СН3), 139,1, 128,3, 127,2, 126,8 и 45,9 (-CH2-C6H5). Пример 7 9-деоксо-9а-N-(N'-бензил-тиокарбамоил)-9ааза-9а-гомо-эритромицин А Аналогично способу, описанному по Примеру 1, из 9-деоксо-9а-аза-9а-гомоэритромицина А (7,27 г; 0,01 моль), бензилизотиоцианата (1,50 г; 0,01 моль) и толуола (30 мл) при перемешивании реакционной смеси в течение 8 часов при температуре 30 "С выделяют смолистый остаток (8,6 г), из которого методом хроматографии на колонках с силикагелем при использованием в качестве растворителя смеси СНСІ3-СН3ОН (7:3) получают 9деоксо-9а-N-(N'-бензил-тиокарбамоил)-9а-аза-9агомоэритромицин А (7,2 г; 82,1%), имеющий следующие физико-химические характеристики: Тпл 119-122°С. Тонкослойная хроматография: ЕtАс-(н-С6Н6)-NHЕt2 (100:100:20), Rf 0,370; СНСІ3-СНзОН-конц. NH4ОН (6:1:0,1), Rf 0,689. ИК-спектроскопия (KBr), см-1: 1730, 1630, 1525, 1410, 1380, 1270, 1165, 1045, 950. 895. 755, 700. 1 H ЯМР (300 МГц, СDСІ3), d: 7,36, 4,85, 4,72 (-CH2-C6H5), 4,75 (1H, H-13), 4,87 (1H, H-1''), 4,41 (1H, Н-1'), 4,10 (1H, H-3), 3,81 (1H, H-11), 3,49 (1H, H-5), 3,30 (3Н, 3''-ОСН3), 3,03 (1H, Н-4''), 2,34 [6Н, 3'-N(СНз)2], 2,31 (1H, Н-8), 1,52 (1H, Н-7а), 1,26 (1H, Н-7b), 1,31 (3Н, 10-СН3), 0,96 (3Н, 8-СН3). Пример 8 9-деоксо-9а-N-[N'-(1-нафтил)-карбамоил]-9ааза-9а-гомоэритромицин А Аналогично способу, описанному по Примеру 1, из 9-деоксо-9а-аза-9а-гомоэритромицина А (7.27 г; 0,01 моль), 1-нафтилизоцианата (1,7 г; 0,01 моль) и толуола (40 мл) путем перемешивания реакционной смеси в течение 1 часа при температуре 20°С выделяют смолистый остаток (9,0 г), из которого методом хроматографии на колонках с силикагелем при использованием в качестве растворителя смеси СНСІ3-СН3ОН-конц.NH4ОН (6:1:0,1) получают 9-деоксо-9а-N-[N'-(1-нафтил)карбамоил]-9а-аза-9а-гомоэритромицин А (7,8 г; 86,6%), имеющий следующие физико-химические характеристики: Тпл 134-137°С. Тонкослойная хроматография: ЕtАс-(н-С6Н6)-NНЕt2 (100:100:20), Rf 0,335; СНСl3-СН3ОН-конц.NН4OН (6:1:0,1). Rf 0,658. ИК-спектроскопия (КВr), см-1: 1740, 1635, 1530. 1500, 1455, 1380, 1340, 1265, 1160, 1050, 1010, 960, 890. 795, 775, 735, 700. 5 39870 Таблица 1 Антибактериальная активность in vitro новых 9а-N-(N'-карба-моил)- и 9а-N-(N'-тиокарбамоил)- производных 9-деоксо-9а-аза-9а-гомоэритромицина А по сравнению с исходным амином MIC (мкг/мл) Тестируемый организм 9a-NH* 1 4 5 6 7** Staphytococcus epider midis, ATCC 3,12 6,25 25,0 3,12 6,25 6,25 12228 Staphyiococcus aureus ATCC 6538P 3,12 1,56 12,5 6,25 3,12 3,12 Micrococcus ftavus, АТСС 10240 1,56 3,12 12,5 6,25 3,12 1,56 Streptococcus taecaUs, АТСС 8043 3,12 3,12 6,25 3,12 3,12 1,56 Bacillus subtitis, NGTC 8236 12,5 1,56 25,0 6,25 3,12 1,56 В. pumitus, NCTC 8241 12,5 6,25 12,5 6,25 3,12 1,56 В. cererus. АТСС 11778 3,12 6,25 12,5 12,5 6,25 6,25 Pseudomonas aeruginosa, NCTC 25,0 25,0 50,0 50,0 50,0 50,0 10490 Esterichia coU, АТСС 10536 3,12 12,5 12,5 12,5 25,0 12,5 SatmoneUa Panama, 6117 3,12 6,25 25,0 25,0 >100 >100 BHS-A Streptococcus pyogenes J-21 3,12 12,5 3,12 BHS-A Streptococcus Agalactiae J-22 1,56 12,5 1,56 *- 9-деоксо-9а-аза-9а-гомоэритромицин А ** - нумерация соответствует номерам Примеров получения соответствующи х новых синтезированных соединений __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 6
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61P 31/04, C07H 17/08, C07H 17/00, A61K 31/7048, A61K 31/70, A61K 31/7052, A61K 31/7042
Мітки: спосіб, похідні, фармацевтична, 9-деоксо-9а-а3а-9а, одержання, композиція, гомоеритроміцину
Код посилання
<a href="https://ua.patents.su/6-39870-pokhidni-9a-n-n-karbamolu-ta-9a-n-n-tiokarbamolu-vid-9-deokso-9a-a3a-9a-gomoeritromicinu-a-sposib-oderzhannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Похідні 9а-n-/n`-карбамoїлу/ та 9а-n-/n`-тіокарбамoїлу/ від 9-деоксо-9а-а3а-9а гомоеритроміцину а, спосіб одержання та фармацевтична композиція</a>
Попередній патент: Похідні аспартаму або їх фізіологічно прийнятні солі, спосіб їх отримання та підсолоджувальна композиція
Наступний патент: Пристрій для неперервного виробництва плит пінополіуретану(варіанти)
Випадковий патент: Мармелад "айвовий"










