Сполука n-пара-бромфеніл-3-(уридин-5′-аміно)-сукцинімід з потенційними фізіологічними властивостями
Формула / Реферат
Сполука N-пара-бромфеніл-3-(уридин-5'-аміно)-сукцинімід загальної формули:
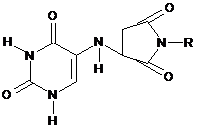 ,
,
де R=пара-BrPh,
з потенційними фізіологічними властивостями.
Текст
Реферат: Сполука N-пара-бромфеніл-3-(уридин-5'-аміно)-сукцинімід загальної формули: O O H O N N H N R O N H , де R=пара-BrPh, з потенційними фізіологічними властивостями. ПОТЕНЦІЙНИМИ UA 79620 U (54) СПОЛУКА N-ПАРА-БРОМФЕНІЛ-3-(УРИДИН-5'-АМІНО)-СУКЦИНІМІД ФІЗІОЛОГІЧНИМИ ВЛАСТИВОСТЯМИ UA 79620 U UA 79620 U 5 10 15 20 Корисна модель належить до хімії гетероциклічних сполук, а саме: до N-пара-бромфеніл-3(уридин-5'-аміно)-сукциніміду (далі - сполука), яка може бути фізіологічно активною за рахунок наявності в будові фрагменту молекули циклічного іміду. Дані вітчизняних і зарубіжних наукових робіт свідчать про залежність і спрямованість фізіологічної дії речовини від будови введеного замісника в молекулу малеїніміду [1,2]. Було синтезовано похідні малеїніміду з анксіолітичним типом дії; що впливають на постсинаптичні рецептори; психотропні агенти та з іншими типами дії. Давно відомими і найбільш перспективними є похідні малеїнімідів, що мають протисудомну активність, на основі яких були розроблені і успішно застосовуються у медичній практиці такі лікарські засоби, як етосуксімід, фенсуксімід, морсуксімід, метсуксімід, пуфемід. Їх застосовують при лікуванні малих приступів епілепсії, а також при міоклонічних приступах, пікнолептичних приступах та непікнолептичних приступах у підлітків, які супроводжуються короткочасною втратою свідомості, короткочасних втратах свідомості у маленьких дітей, атипових загальних приступах при вторинній епілепсії, тяжких комплексних приступах. Сполуки із ряду заміщених малеїнімідів у порівнянні з похідними барбітурової кислоти, гідатоіна та оксазолідин 2,4-діону у меншому ступені проявляють побічну та токсичну дію, а також їх можна отримувати за допомогою відносно простих методів синтезу. Зацікавленість до цього класу сполук, як до потенційного джерела протиепілептичних препаратів, виникла після експериментальних досліджень, проведених науковцями у 1936 році [3]. Описано метод синтезу поліциклічних гетероарилпіперазінілімідів реакцією арил-або гетероарилпіперазинів з поліциклічними алкілімідами [1] (схема 1). Схема 1. O O NH NH O 25 O . Реакцією сульфалену з малеїнімідом в ацетоні в умовах фотолізу за допомогою L-ртутної лампи типу Hanovia 450-W синтезовано тетрагідротієноциклобутапіроледіон-2,2-діоксид [1] (схема 2). Схема 2. O O O O S O h, ацетон + NH O NH S O 30 O , який вступає в реакції заміщення по атому водню при гетероатомі азоту (схема 3). Схема 3. O O O O NH S + HN H R Br(CH2 )4Br O N S (CH2 )4 N O O O N 35 R . N-вмісні гетероциклічні сполуки менш нуклеофільні, у порівнянні з аліфатичними та ароматичними амінами, але їх нуклеофільність достатня для здійснення реакції Міхаеля [4]. Встановлено, що N-(R-аніліно) малеїніміди при кип'ятінні в спирті з морфоліном, піролідином і піперидином утворюють 3-морфоліл-, 3-піролідил- і 3-піперидилпохідні сукциніміду (схема 4). Схема 4. R1 O O N HN C6 H4 R 40 + R! H O O N NH C6 H4 R При взаємодії N-заміщених імідів малеїнової кислоти з піперазином у розчинах абсолютного спирту або толуолу утворюються дііміди алкілен-біс-аспарагінової кислоти. 1 UA 79620 U 5 10 Таким чином навіть при проведенні реакції в абсолютному спирті відбувається розкриття імідного ядра. Раніше нами були отримані інші нові гетероциклічні похідні малеїнімідів шляхом нуклеофільного приєднання по подвійному зв'язку [5]. Структурні аналоги продуктів реакції між N-пара-бромфенілмалеїніміду та 5-(6)аміноурацилами з потенційними фізіологічними властивостями на сьогодні не відомі (літературний опис відсутній). В основу корисної моделі поставлено хімічну будову молекули сполуки N-пара-бромфеніл-3(уридин-5'-аміно)-сукциніміду (далі - сполука) з потенційними фізіологічними властивостями шляхом взаємодії N-пара-бромфенілмалеїніміду та 5-аміноурацилом у молярному співвідношенні 1:1. Реакції проводилися у системі розчинників (вода-ізопропіловий спирт, 1:1,5) при постійному нагріванні та перемішуванні реакційної суміші 12-14 години з метою забезпечення отримання сполуки з потенційними фізіологічними властивостями (схема 5). Схема 5. H O N 15 20 25 30 35 40 45 50 55 O R i-PrOH,H2O O H N NH2 N H O O O O N N H N R O N H , де R=пара-BrPh. Варіювання умов проведення реакцій та внесення змін до методики синтезу, а саме: заміна вказаної системи розчинників на систему (вода-етиловий спирт, 1:1,5), промивання кінцевих продуктів реакцій під час фільтрування в вакуумі сухим гексаном без перекристалізації дозволили збільшити практичний вихід сполуки до 44 %. Ознаки способу. Методика синтезу N-пара-бромфеніл-3-(уридин-5'-аміно)-сукциніміду. До гарячого розчину 0,5 г N-пара-бромфенілмалеїніміду (0,0019 моль) в 50 мл ізопропілового спирту додають по краплях розчин 0,3 г (0,002 моль) 5-аміноурацилу в 450 мл суміші вода-ізопропіловий спирт (1:1,5), перемішують реакційну суміш при кипінні 14 годин, при цьому її забарвлення стає світло-коричневим та випадає осад світло-гірчичного кольору. Залишають реакційну суміш охолоджуватися при кімнатній температурі, фільтрують. Осад промивають сухим гексаном, сушать на повітрі. Практичний вихід 0,39 г (44 %). Т. пл. 270-275° С. С14Н11N4O4Вr. Індивідуальність сполуки контролювали методом тонкошарової хроматографії, склад підтверджували даними елементного аналізу. УФ-спектри сполуки записували на спектрофотометрі Mel Temp II (USA). ІЧ-спектри записували на спектрофотометрі UR-20 (виробник "Charles Ceise Hena", Germany). Спектри ПМР сполуки записували на приладах "Bruker WP-200" (виробник "Bruker", Switzerland), "Varian T-60" (виробник "Varian", USA) з робочою частотою 200-132 МГц у виді розчинів ДМСО-D6 (внутрішні стандарти ТМС та ГМДС). ТШХ виконували на пластинах Silufol254. ГРХ визначали на газорідинному хроматографі "Perkin Е1тег'з УФ-детектором (виробник "Perkin", Germany). Хроматограма, УФ-, ІЧ-, ПМР-спектри сполуки ідентифікували у порівнянні з хроматограмами, УФ-, ІЧ-, ПМР-спектрами вихідних сполук. Синтезована сполука - це кристалічний порошок від світло гірчичного кольору, ізолюється без кристалізації, з метою очистки промиваються сухим гексаном. Дані елементного аналізу на С, Н, N сполуки відповідають розрахованим значенням. УФ-спектри сполуки характеризуються загальним показником - наявністю mах, положення яких коливаються в широкому інтервалі від 218 до 267 нм у зв'язку із спряженням фрагменту молекули заміщеного урацилу з додатковими хромофорами - N-фенілзаміщеним циклом малеїніміду з групами С=О та вторинною -1 аміногрупою. В 14-спектрі сполуки смуги NH спостерігаються в області 1450, 1490, 1540 см . Валентні коливання групи (С=О) проявляються високоінтенсивним максимумом в області 1660-1 1750 см та є найбільш характеристичними, оскільки інші сигнали в цій області практично відсутні. Крім того, в низькочастотній області спектрів легко визначити в результаті високої -1 інтенсивності смугу зв'язку С-Вr при 505-550 см , хоча цінність даної ідентифікації обмежена, оскільки присутність брому в молекулах доводиться за допомогою якісних реакцій. Співвідношення інтегральних інтенсивностей сигналів в ПМР-спектрах сполуки підтверджує відсутність протонів первинної групи (-NH2) при 6,14 м.д. в молекулі, спостерігається сигнал у вигляді синглету при 5,098-5,196 м.д. протону вторинної групи (-NH-). Сигнали протонів при N(1) та N(3) молекул урацилу ідентифікуються в області 10,307 та 11,247 м. д. у вигляді синглетів. t сполука 2 UA 79620 U Віднесення сигналів в УФ-, ІЧ-, ПМР-спектрах, дані елементного аналізу сполуки наведено в табл. 1. Таблиця 1 Віднесення сигналів в УФ-, ІЧ-, ПМР-спектрах, дані елементного аналізу сполуки. Знайдено, у % Сполука І 5 10 15 20 25 С Н Розраховано, у % С N 43,85 3,2 13,82 Н N 44,23 3,18 14,7 УФ-спектр mах, ЕtOН, нм Спектр ПМР (ДМСО-D6), , м.д. (J, Гц) 2,716, 3,180 (с.,с., -СН22Н),4,509 (с., 505-550 (-Вr), HCN, 1H), 5,106 600-900 (С(д., NH, 1H), 6,66 Н, Ph), 1490 218, 252, 267 (с., С(5)Н, 1Н), (-NH-), 1660, 7,259, 7,723 (с., 1710, 1750 с., Ph, 4H), (С=О) 10,307 (с., N(3)H, 1H), 11,247 (с., N(1)H, 1H) 14-спектр -1 (КВr), cм , Таким чином, можна зробити висновок, що сполука з потенційними фізіологічними властивостями може бути перспективною у розробці нових лікарських засобів з протисудомною активністю, з анксіолітичним типом дії, що впливають на постсинаптичні рецептори, психотропних агентів та з іншими типами дії. Задачею корисної моделі є опис хімічної будови нової сполуки N-пара-бромфеніл-3-(уридин5'-аміно)-сукцинімід, яка може бути фізіологічно активною за рахунок наявності в будові фрагменту молекули циклічного іміду. Джерела інформації: 1 Magid Abou-Gharbia. Polycyclic aryl-and heteroarylpiperazinyl imides as 5-HTia receptor ligands and potential anxiolytic agents: synthesis and structure-activity relationship studies / AbouGharbia Magid, R.P. Usha et al. // J. Med. Chem.-1988. - Vol. 31, № 7. - P. 1382-1385. 2 Агбалян С.Г., Хачикян Р.Д., Лулукян К.К. Реакции нуклеофильного присоединения производных индола к имидам малеиновой кислоты / С.Г. Агбалян, Р.Д. Хачикян, К.К. Лулукян // Арм. хим. журн.-1976. - Т. 29, - № 4. - С. 362-364. 3 Титаренко І.П. Реакції N-арилмалеїнімідів з ароматичними амінами / І.П. Титаренко, І.Й. Кузьменко, Л.С. Кулик, А.С. Семенихіна // Фарм. журн.-2002. - № 2. – С. 63-65. 4 Вельчинская Е.В. Синтез новых производных замещенных урацилов и пиримидинов / Е.В. Вельчинская, И.Й. Кузьменко, Л.С. Кулик // Химико-фармацевтический журнал. Росс. Федерация.-1999. - № 3. - С. 40-42. 5 Вельчинська О.В., Кузьменко І.Й., Драпайло А.Б. Синтез нових похідних заміщених малеїнімідів як потенційних фізіологічно активних агентів. Тези. доп. XVIII-ої Укр. конф. з орг. хімії.-1998. – Дніпропетровськ. - С. 369. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 30 Сполука N-пара-бромфеніл-3-(уридин-5'-аміно)-сукцинімід загальної формули: O O H O N N H N R O N H , де R=пара-BrPh, з потенційними фізіологічними властивостями. 3 UA 79620 U Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Назва патенту англійськоюCompound n-para-bromophenyl-3-(uridine-5'-amino)-succinimide with potential physiological properties
Автори англійськоюVelchynska Olena Vasylivna
Назва патенту російськоюСоединение n-пара-бромфенил-3-(уридин-5'-амино)-сукцинимид с потенциальными физиологическими свойствами
Автори російськоюВельчинская Елена Васильевна
МПК / Мітки
МПК: C07D 239/553, C07C 21/00, A61K 33/16
Мітки: n-пара-бромфеніл-3-(уридин-5'-аміно)-сукцинімід, фізіологічними, сполука, потенційними, властивостями
Код посилання
<a href="https://ua.patents.su/6-79620-spoluka-n-para-bromfenil-3-uridin-5-amino-sukcinimid-z-potencijjnimi-fiziologichnimi-vlastivostyami.html" target="_blank" rel="follow" title="База патентів України">Сполука n-пара-бромфеніл-3-(уридин-5′-аміно)-сукцинімід з потенційними фізіологічними властивостями</a>
Попередній патент: Спосіб діагностики жовтяниць
Наступний патент: Спосіб унілатеральної спінальної анестезії
Випадковий патент: Пристрій для визначення густини ковбасних виробів










