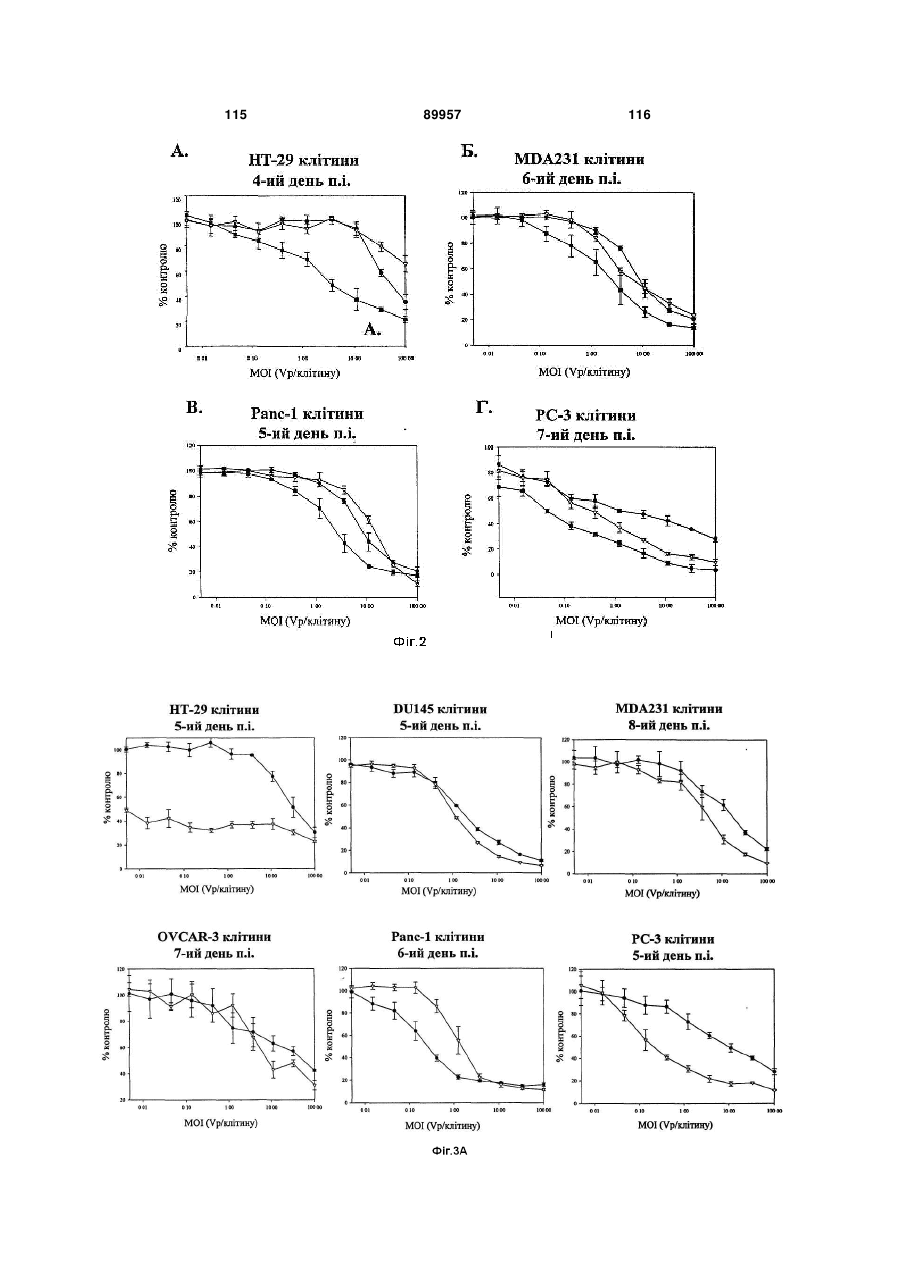
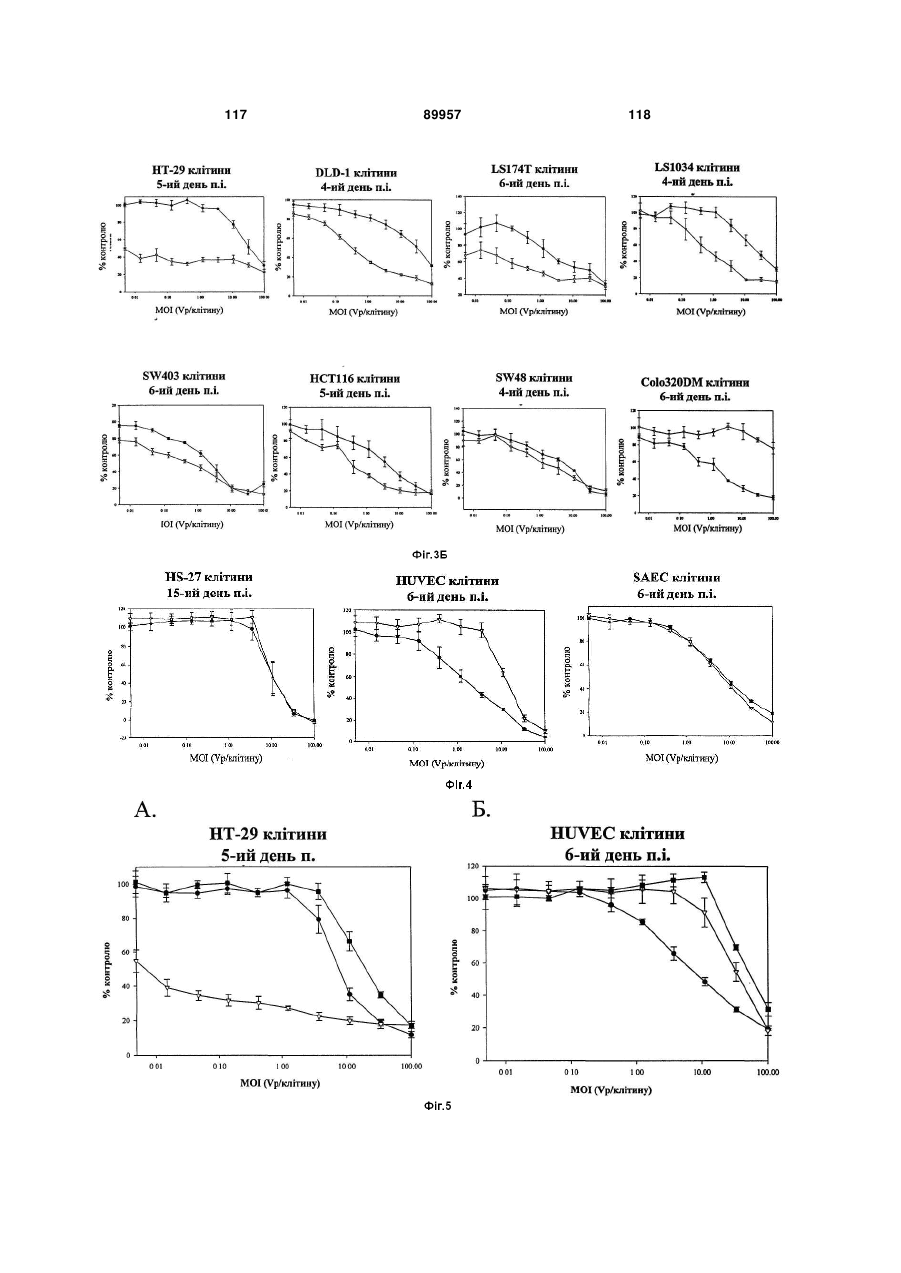
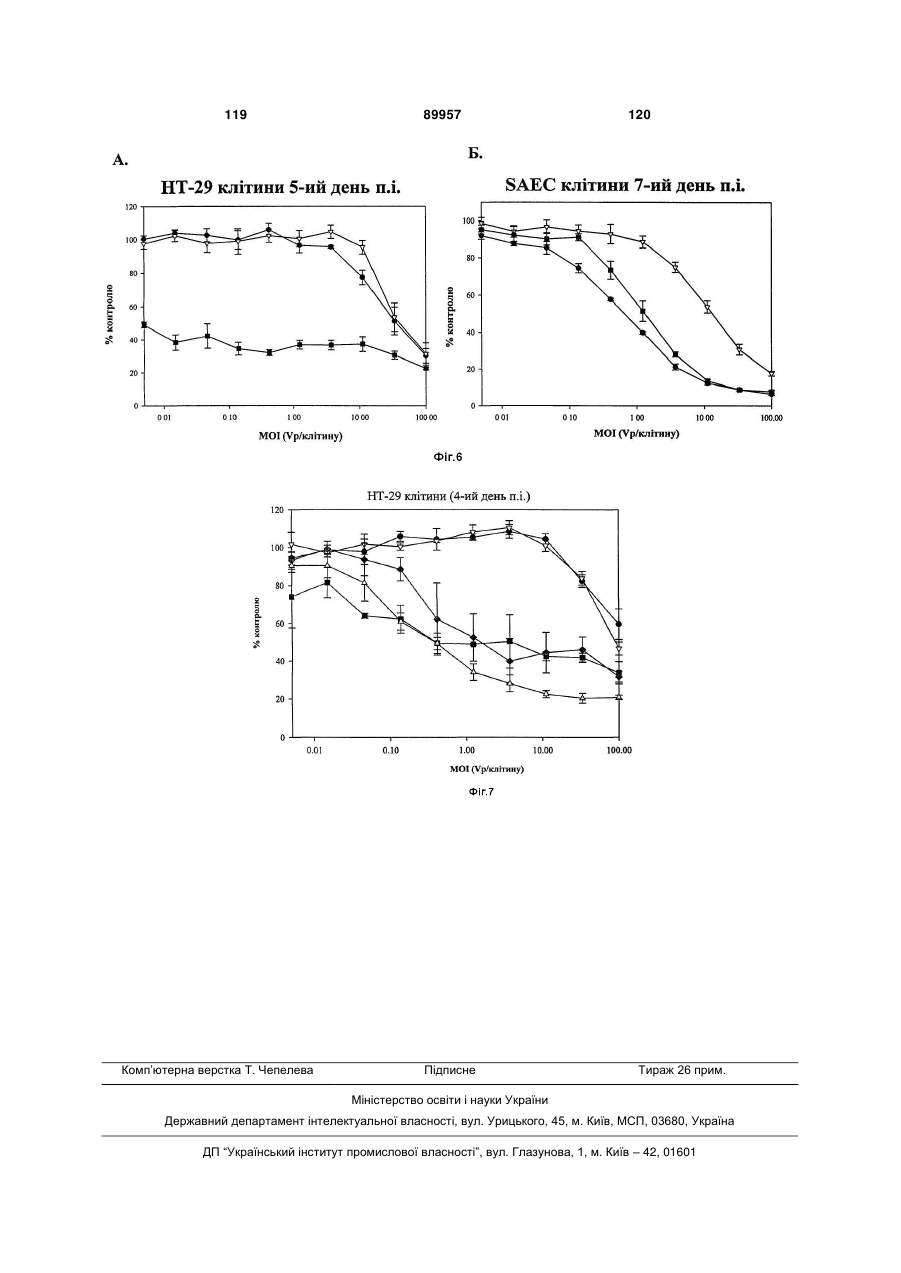
Химерні аденовіруси для застосування для лікування злоякісного новоутворення
Формула / Реферат
1. Рекомбінантний химерний аденовірус або його варіант або похідне, який має геном, що містить ділянку Е2В,
де вказана ділянка Е2В містить нуклеотидну послідовність, яка має походження від першого аденовірусного серотипу, і нуклеотидну послідовність, яка має походження від другого аденовірусного серотипу;
де вказані перший і другий серотипи кожний вибирають із підгруп аденовірусів В, С, D, Е або F, і вони відрізняються один від одного; і
де вказаний химерний аденовірус є онколітичним і проявляє підвищений терапевтичний індекс у пухлинній клітині.
2. Аденовірус за пунктом 1, який додатково містить ділянки, які кодують фібрилярні, гексонові й пентонові білки, де нуклеїнова кислота, яка кодує фібрилярні, гексонові й пентонові білки вказаного аденовірусу, отримана з того самого аденовірусного серотипу.
3. Аденовірус за пунктом 1, який додатково містить модифіковану ділянку Е3.
4. Аденовірус за пунктом 1, який додатково містить модифіковану ділянку Е4.
5. Аденовірус за пунктом 1, у якому вказана пухлинна клітина являє собою пухлинну клітину ободової кишки, молочної залози, підшлункової залози, легень, передміхурової залози, яєчника або пухлинну кровотворну клітину.
6. Аденовірус за пунктом 5, у якому вказана пухлинна клітина являє собою пухлинну клітину ободової кишки.
7. Аденовірус за пунктом 1, у якому нуклеотидна послідовність ділянки Е2В вказаного аденовірусу містить SEQ ID NO: 3 або її частину.
8. Аденовірус за пунктом 1, у якому нуклеотидна послідовність вказаного аденовірусу містить SEQ ID NO: 1.
9. Рекомбінантний химерний аденовірус або його варіант або похідне, який має геном, що містить ділянку Е2В,
де вказана ділянка Е2В містить нуклеотидну послідовність, яка має походження від першого аденовірусного серотипу, і нуклеотидну послідовність, яка має походження від другого аденовірусного серотипу;
де вказані перший і другий аденовірусні серотипи кожний вибирають із підгруп аденовірусів В, С, D, Е або F, і вони відрізняються один від одного;
а вказаний химерний аденовірус є онколітичним і проявляє підвищений терапевтичний індекс у пухлинній клітині; і
де вказаному химерному аденовірусу надавали недостатність реплікації шляхом видалення однієї або більше аденовірусних ділянок, які кодують білки, залучені в реплікацію аденовірусу, вибрані із групи, яка включає Е1, Е2, Е3 або Е4.
10. Аденовірус із недостатністю реплікації за пунктом 9, у якому ділянки Е1 і Е3 вилучені.
11. Аденовірус із недостатністю реплікації за пунктом 10, який додатково включає делецію ділянки Е4.
12. Аденовірус за пунктом 1 або 9, який додатково містить гетерологічний ген, де вказаний гетерологічний ген експресується в клітині, інфікованій вказаним аденовірусом.
13. Аденовірус за пунктом 12, де вказаний гетерологічний ген являє собою тимідинкіназу.
14. Аденовірус за пунктом 12, де вказаний гетерологічний ген кодує терапевтичний білок, вибраний із групи, яка включає цитокіни й хемокіни, антитіла, ферменти, які перетворюють проліки, і імунорегуляторні білки.
15. Спосіб інгібування росту злоякісної клітини, який включає інфікування вказаної злоякісної клітини аденовірусом за пунктом 1.
16. Спосіб за пунктом 15, у якому вказана злоякісна клітина являє собою ракову клітину ободової кишки.
17. Спосіб за пунктом 16, у якому нуклеотидна послідовність вказаного аденовірусу містить SEQ ID NO: 1.
18. Спосіб доставки терапевтичного білка в клітину, який передбачає інфікування клітини аденовірусом за пунктом 14.
19. Спосіб виділення аденовірусу за пунктом 1, який передбачає
а) об'єднання аденовірусних серотипів, які представляють підгрупи аденовірусів B-F, у такий спосіб одержуючи суміш аденовірусів;
б) пасивування об'єднаної суміші аденовірусів зі стадії (а) в активно зростаючій культурі пухлинних клітин при співвідношенні частинок на клітину, достатньо великому для стимуляції рекомбінації між серотипами, але не настільки великому, щоб викликати передчасну загибель клітин;
в) збір супернатанту зі стадії (б);
г) інфікування спочиваючої культури пухлинних клітин супернатантом, зібраним на стадії (в);
д) збір супернатанту клітинної культури зі стадії (г) до появи будь-яких ознак СРЕ;
e) інфікування спочиваючої культури пухлинних клітин супернатантом, зібраним на стадії (д); і
є) виділення вірусу за пунктом 1 із супернатанту, зібраного на стадії (е), шляхом очищення бляшки.
20. Спосіб за пунктом 19, у якому стадію (б) здійснюють два рази перед збиранням супернатанту на стадії (в).
21. Спосіб за пунктом 19, у якому стадії (д) і (e) повторюють аж до 20 разів перед стадією (є).
22. Спосіб за пунктом 19, у якому другий цикл очищення бляшки здійснюють після етапу (є).
23. Спосіб за пунктом 19, у якому пухлинна клітина являє собою пухлинну клітину ободової кишки, молочної залози, підшлункової залози, легень, передміхурової залози, яєчника або пухлинну кровотворну клітину.
24. Рекомбінантний химерний аденовірус або його варіант або похідне, який має геном, що містить ділянку Е2В,
де вказана ділянка Е2В містить нуклеотидну послідовність, яка має походження від першого аденовірусного серотипу, і нуклеотидну послідовність, яка має походження від другого аденовірусного серотипу;
де вказані перший і другий аденовірусні серотипи кожний вибирають із підгруп аденовірусів В, С, D, Е або F, і вони відрізняються один від одного; і
де вказаний химерний аденовірус є онколітичним і проявляє підвищений терапевтичний індекс у пухлинній клітині;
отриманий способом
а) об'єднання аденовірусних серотипів, які представляють підгрупи аденовірусів B-F, у такий спосіб одержуючи суміш аденовірусів;
б) пасивування об'єднаної суміші аденовірусів зі стадії (а) в активно зростаючій культурі пухлинних клітин при співвідношенні частинок на клітину, достатньо великому для стимуляції рекомбінації між серотипами, але не настільки великому, щоб викликати передчасну загибель клітин;
в) збору супернатанту зі стадії (б);
г) інфікування спочиваючої культури пухлинних клітин супернатантом, зібраним на стадії (в);
д) збору супернатанту клітинної культури зі стадії (г) до появи будь-яких ознак СРЕ;
e) інфікування спочиваючої культури пухлинних клітин супернатантом, зібраним на стадії (д); і
є) виділення вказаного химерного аденовірусу із супернатанту, зібраного на стадії (е), шляхом очищення бляшки.
25. Спосіб за пунктом 24, у якому стадію (б) здійснюють два рази перед збиранням супернатанту на стадії (в).
26. Спосіб за пунктом 24, у якому стадії (д) і (e) повторюють аж до 20 разів перед стадією (є).
27. Спосіб за пунктом 24, у якому другий цикл очищення бляшки здійснюють після етапу (є).
Текст
1. Рекомбінантний химерний аденовірус або його варіант або похідне, який має геном, що містить ділянку Е2В, де вказана ділянка Е2В містить нуклеотидну послідовність, яка має походження від першого аденовірусного серотипу, і нуклеотидну послідовність, 2 (19) 1 3 89957 4 а вказаний химерний аденовірус є онколітичним і проявляє підвищений терапевтичний індекс у пухлинній клітині; і де вказаному химерному аденовірусу надавали недостатність реплікації шляхом видалення однієї або більше аденовірусних ділянок, які кодують білки, залучені в реплікацію аденовірусу, вибрані із групи, яка включає Е1, Е2, Е3 або Е4. 10. Аденовірус із недостатністю реплікації за пунктом 9, у якому ділянки Е1 і Е3 вилучені. 11. Аденовірус із недостатністю реплікації за пунктом 10, який додатково включає делецію ділянки Е4. 12. Аденовірус за пунктом 1 або 9, який додатково містить гетерологічний ген, де вказаний гетерологічний ген експресується в клітині, інфікованій вказаним аденовірусом. 13. Аденовірус за пунктом 12, де вказаний гетерологічний ген являє собою тимідинкіназу. 14. Аденовірус за пунктом 12, де вказаний гетерологічний ген кодує терапевтичний білок, вибраний із групи, яка включає цитокіни й хемокіни, антитіла, ферменти, які перетворюють проліки, і імунорегуляторні білки. 15. Спосіб інгібування росту злоякісної клітини, який включає інфікування вказаної злоякісної клітини аденовірусом за пунктом 1. 16. Спосіб за пунктом 15, у якому вказана злоякісна клітина являє собою ракову клітину ободової кишки. 17. Спосіб за пунктом 16, у якому нуклеотидна послідовність вказаного аденовірусу містить SEQ ID NO: 1. 18. Спосіб доставки терапевтичного білка в клітину, який передбачає інфікування клітини аденовірусом за пунктом 14. 19. Спосіб виділення аденовірусу за пунктом 1, який передбачає а) об'єднання аденовірусних серотипів, які представляють підгрупи аденовірусів B-F, у такий спосіб одержуючи суміш аденовірусів; б) пасивування об'єднаної суміші аденовірусів зі стадії (а) в активно зростаючій культурі пухлинних клітин при співвідношенні частинок на клітину, достатньо великому для стимуляції рекомбінації між серотипами, але не настільки великому, щоб викликати передчасну загибель клітин; в) збір супернатанту зі стадії (б); г) інфікування спочиваючої культури пухлинних клітин супернатантом, зібраним на стадії (в); д) збір супернатанту клітинної культури зі стадії (г) до появи будь-яких ознак СРЕ; e) інфікування спочиваючої культури пухлинних клітин супернатантом, зібраним на стадії (д); і є) виділення вірусу за пунктом 1 із супернатанту, зібраного на стадії (е), шляхом очищення бляшки. 20. Спосіб за пунктом 19, у якому стадію (б) здійснюють два рази перед збиранням супернатанту на стадії (в). 21. Спосіб за пунктом 19, у якому стадії (д) і (e) повторюють аж до 20 разів перед стадією (є). 22. Спосіб за пунктом 19, у якому другий цикл очищення бляшки здійснюють після етапу (є). 23. Спосіб за пунктом 19, у якому пухлинна клітина являє собою пухлинну клітину ободової кишки, молочної залози, підшлункової залози, легень, передміхурової залози, яєчника або пухлинну кровотворну клітину. 24. Рекомбінантний химерний аденовірус або його варіант або похідне, який має геном, що містить ділянку Е2В, де вказана ділянка Е2В містить нуклеотидну послідовність, яка має походження від першого аденовірусного серотипу, і нуклеотидну послідовність, яка має походження від другого аденовірусного серотипу; де вказані перший і другий аденовірусні серотипи кожний вибирають із підгруп аденовірусів В, С, D, Е або F, і вони відрізняються один від одного; і де вказаний химерний аденовірус є онколітичним і проявляє підвищений терапевтичний індекс у пухлинній клітині; отриманий способом а) об'єднання аденовірусних серотипів, які представляють підгрупи аденовірусів B-F, у такий спосіб одержуючи суміш аденовірусів; б) пасивування об'єднаної суміші аденовірусів зі стадії (а) в активно зростаючій культурі пухлинних клітин при співвідношенні частинок на клітину, достатньо великому для стимуляції рекомбінації між серотипами, але не настільки великому, щоб викликати передчасну загибель клітин; в) збору супернатанту зі стадії (б); г) інфікування спочиваючої культури пухлинних клітин супернатантом, зібраним на стадії (в); д) збору супернатанту клітинної культури зі стадії (г) до появи будь-яких ознак СРЕ; e) інфікування спочиваючої культури пухлинних клітин супернатантом, зібраним на стадії (д); і є) виділення вказаного химерного аденовірусу із супернатанту, зібраного на стадії (е), шляхом очищення бляшки. 25. Спосіб за пунктом 24, у якому стадію (б) здійснюють два рази перед збиранням супернатанту на стадії (в). 26. Спосіб за пунктом 24, у якому стадії (д) і (e) повторюють аж до 20 разів перед стадією (є). 27. Спосіб за пунктом 24, у якому другий цикл очищення бляшки здійснюють після етапу (є). Даний винахід має пріоритет попередньої заявки на патент US 60/574,851, поданої 26 травня 2004 року, яка повністю включена в даний опис як посилання. Винахід, описаний у даній заявці, у цілому стосується молекулярної біології, і, зокрема, онколі тичних аденовірусів, які мають терапевтичні застосування. Злоякісні новоутворення є основною причиною смертності як у США, так і в інших країнах світу. Залежно від типу злоякісного новоутворення, для лікування звичайно застосовують хірургічні методи, хіміотерапію та/або променеву терапію. Часто 5 ці методи є неефективними й, отже, існує необхідність нових видів лікування, які можуть використовуватися окремо або в комбінації із класичними методами. Одним з підходів є застосування аденовірусів, окремо або як векторів, здатних доставляти протиракові терапевтичні білки до пухлинних клітин. Аденовіруси являють собою безоболонкові ікосаедричні віруси із дволанцюговою молекулою ДНК, лінійний геном яких містить близько 36тис. пар основ. На кожному кінці вірусного геному присутня коротка послідовність, відома як інвертований кінцевий повтор (або ITR), яка необхідна для реплікації вірусу. Геноми всіх аденовірусів людини, досліджених дотепер, мають однакову загальну організацію; тобто гени, які кодують специфічні функції, розташовані в тому самому положенні вірусного геному. Вірусний геном містить п'ять ранніх одиниць транскрипції (Е1А, Е1В, Е2, Е3 і Е4), дві відстрочені-ранні одиниці (IX і Iva2), і одну пізню одиницю (головну пізню), що приводить до утворення п'яти сімейств пізніх мРНК (L1-L5). Білки, кодовані ранніми генами, залучені в реплікацію, тоді як пізні гени кодують вірусні структурні білки. Частини вірусного геному легко можуть бути заміщені за допомогою ДНК чужорідного походження й такі рекомбінантні аденовіруси є структурно стабільними, а властивості, які набуваються такими вірусами, потенційно роблять їх придатними для генної терапії (див. Jolly, D. (1994) Cancer Gene Therapy 1: 51-64). У даний час спроби дослідників одержати аденовіруси, придатні для лікування, зосереджені на серотипі аденовірусу Ad5. Генетика цього аденовірусу людини добре вивчена, також описані системи для його молекулярної маніпуляції. Для підтримання клінічного застосування розроблені високоефективні способи одержання й доступні деякі досліди використання цього агента в клініці. Див., Jolly, D. (1994) Cancer Gene Therapy, 1: 5164. Дослідження, які стосуються застосування аденовірусів людини (Ad) для лікування злоякісного новоутворення, сконцентровані на розробці аденовірусів на основі Ad5, які є особливо ефективними в, або переважно націлені на, специфічні типи пухлинних клітин і існує потреба одержання більш ефективних онколітичних вірусів, для того, щоб лікування за допомогою аденовірусів знайшло практичне застосування в клінічних умовах. Ad5 e тільки одним з 51 відомих зараз аденовірусних серотипів, які поділяються на підгрупи A-F на основі різних характерних ознак, включаючи їх гемаглютуючі властивості ((див., Shenk, "Adenoviridae: The Viruses and Their Replication," в Fields Virology, том 2, 4-е видання, Knipe, ea., Lippincott, Williams & Wilkins, cтop.2265-2267 (2001)). Ці серотипи відрізняються на різних рівнях, наприклад, патологією, яку вони викликають в людей і гризунів, клітинними рецепторами, використовуваними для прикріплення, але ці відмінності в значній мірі ігноруються як ефективні засоби розвитку більш сильнодіючих онколітичних аденовірусів (за винятком змін волокон, див. Stevenson і ін. (1997) J.Virol. 71: 4782-4790; Krasnykh і ін. (1996) J. Virol. 70: 6839-6846; Wickham і ін. (1997) 89957 6 J.Virol. 71: 8221-8229; Legrand і ін. (2002) Curr. Gene Ther. 2: 323-329; Bamett і ін. (2002) Biochim. Biophys. Acta 1-3: 1-14; заявка на патент US 2003/0017138). Використання відмінностей між серотипами аденовірусів може забезпечувати джерело більш ефективних лікарських засобів на основі аденовірусів при використанні нових аденовірусів з підвищеною селективністю й активністю. Існує потреба в такому поліпшеному лікуванні на основі аденовірусів. Даний винахід забезпечує нові химерні аденовіруси або їх варіанти або похідні, придатні для лікування з використанням вірусів. Зокрема, винахід забезпечує химерні аденовіруси або їх варіанти або похідні, які мають геном, що містить ділянку Е2В, де вказана ділянка Е2В містить нуклеотидну послідовність, яка має походження від першого аденовірусного серотипу, і нуклеотидну послідовність, яка має походження від другого аденовірусного серотипу; де вказані перший і другий аденовірусні серотипи кожний вибирають із підгруп аденовірусів В, С, D, Е, або F і відрізняються один від одного; і де вказаний химерний аденовірус є онколітичним і проявляє підвищений терапевтичний індекс у пухлинній клітині. В одному варіанті здійснення винаходу, химерний аденовірус додатково містить ділянки, які кодують фібрилярні, гексонові й пентонові білки, де нуклеїнові кислоти, які кодують вказані білки, усі отримані з одного й того аденовірусного серотипу. В іншому варіанті здійснення винаходу, химерний аденовірус за винаходом містить модифіковану ділянку Е3 або Е4. В іншому варіанті здійснення винаходу, химерний аденовірус проявляє підвищений терапевтичний індекс у пухлинних клітинах ободової кишки, молочноТ залози, підшлункової залози, легень, передміхурової залози, яєчника або пухлинних кровотворних клітин. У більш переважному варіанті здійснення винаходу, химерний аденовірус проявляє підвищений терапевтичний індекс у пухлинних клітинах ободової кишки. У переважному варіанті здійснення винаходу, ділянка Е2В химерного аденовірусу містить SEQ ID NO: 3. У більш переважному варіанті здійснення винаходу, химерний аденовірус містить SEQ ID NO: 1. Даний винахід забезпечує рекомбінантний химерний аденовірус або його варіант або похідне, що має геном, що містить ділянку Е2В де вказана ділянка Е2В містить нуклеотидні послідовності, які мають походження від першого аденовірусного серотипу, і другу нуклеотидну послідовність, яка має походження від другого аденовірусного серотипу; де вказані перший і другий аденовірусні серотипи кожний вибирають із підгруп аденовірусів В, С, D, Е, або F і відрізняються один від одного; а вказаний химерний аденовірус є онколітичним і проявляє підвищений терапевтичний індекс у пухлинній клітині; і 7 де вказаному химерному аденовірусу надавали недостатність реплікації шляхом видалення однієї або більше аденовірусних ділянок, які кодують білки, залучені в реплікацію аденовірусу, вибрані із групи, які включає Е1, Е2, Е3 або Е4. В одному варіанті здійснення винаходу, химерний аденовірус за винаходом додатково містить гетерологічний ген, який кодує терапевтичний білок, де вказаний гетерологічний ген експресується в клітині, інфікованій вказаним аденовірусом. У переважному варіанті здійснення винаходу, терапевтичний білок вибирають із групи, які включає цитокіни й хемокіни, антитіла, ферменти, які перетворюють проліки, і імунорегуляторні білки. Даний винахід забезпечує способи застосування химерних аденовірусів за винаходом для терапевтичних цілей. В одному варіанті здійснення винаходу, химерні аденовіруси можуть застосовуватися для інгібування росту злоякісних клітин. У переважному варіанті здійснення винаходу, химерний аденовірус, який містить SEQ ID NO: 1, придатний для інгібування росту злоякісних клітин ободової кишки. В іншому варіанті здійснення винаходу, аденовіруси за винаходом придатні як вектори для доставки терапевтичних білків у клітини. Даний винахід забезпечує спосіб одержання химерних аденовірусів за винаходом, який передбачає а) об'єднання аденовірусних серотипів, які представляють підгрупи аденовірусів B-F, у такий спосіб одержуючи суміш аденовірусів; б) пасивування об'єднаної суміші аденовірусів зі стадії (а) в активно зростаючій культурі пухлинних клітин при співвідношенні частинок на клітину, достатньо великому для стимуляції рекомбінації між серотипами, але не настільки великому, щоб викликати передчасну загибель клітин; в) збір супернатанту зі стадії (б); г) інфікування спочиваючої культури пухлинних клітин супернатантом, зібраним на стадії (в); д) збір супернатанту клітинної культури зі стадії (г) до появи будь-яких ознак СРЕ; є) інфікування спочиваючої культури пухлинних клітин супернатантом, зібраним на стадії (д); і е) виділення химерного аденовірусу із супернатанту, зібраного на стадії (є), шляхом очищення бляшки. Фіг.1. Профілі часу утримання Ad на ВЕРХколонці ТМАЕ. А) Профілі утримання для окремих серотипів Ad, використовуваних для одержання оригінального вихідного вірусного пула. Б) Профілі утримання пулів 20 пасажу, які мають походження від клітинних ліній НТ-29, Panc-1, MDA-231 і РС-3, відповідно. Фіг.2. Цитолітична активність окремих вірусних пулів. А) НТ-29, Б) MDA-231, В) Рапс-1 і Г) РС-3 клітини інфікували їх відповідними вірусними пулами при VP на співвідношення клітин від 100 до 0,01. У різні дні після інфікування проводили MTSдослідження (як вказано), залежно від клітинної лінії. Кожна точка даних на панелі являє собою дослідження, здійснене в чотирьох повторах, результати виражали у вигляді середніх значень +/СВ. На панелі наведений один характерний прик 89957 8 лад і всі вірусні пули досліджували принаймні три незалежних рази на цільовій клітинній пухлинній лінії. (Позначення на фігурі: —●— Ad5; —— вихідний вірусний пул; — — пул, який має походження від специфічних клітин, пасаж 20). Фіг.3. Цитолітична активність ColoAd1 і Ad5 на клітинних лініях пухлин людини. MTS-аналіз здійснювали на А) широкої панелі клітинних ліній пухлин людини й Б) на панелі клітинних ліній раку ободової кишки людини для визначення можливої специфічної активності. MTS-аналіз здійснювали в різні дні залежно від клітинної лінії. Кожна панель представляє собою типовий експеримент, який повторювали принаймні три рази. Кожна точка даних на панелі являє собою дослідження, здійснене в чотирьох повторах, результати виражали у вигляді середніх значень +/- СВ (Позначення на фігурі: —●—Ad5; —— ColoAd1). Фіг.4. Цитолітична активність ColoAd1 і Ad5 на панелі нормальних клітин. Клітини HS-27, HUVEC і SAEC (первинні фібробласті, ендотеліальні й епітеліальні клітини, відповідно) інфікували ColoAd1 ї Ad5 при VP на співвідношення клітин від 100 до 0,01. MTS-аналіз здійснювали в різні дні залежно від клітини й кожна панель представляє собою типовий експеримент, який повторювали принаймні три рази. Кожна точка даних на панелі являє собою дослідження, здійснене в чотирьох повторах, результати виражали у вигляді середніх значень +/- СВ (Позначення на фігурі: —●—Ad5; — — ColoAd1). Фіг.5. Цитолітична активність ColoAd1, Ad5 і ONYX-015 на первинних нормальних ендотеліапьних клітинах (HUVEC) і клітинної лінії пухлини ободової кишки (НТ-29). Кожна панель представляє собою типовий експеримент, який повторювали принаймні три рази. Кожна точка даних на панелі являє собою дослідження, здійснене в чотирьох повторах, результати виражали у вигляді середніх значень +/- СВ (Позначення на фігурі: —●—Ad5; — — ColoAd1; — —Onyx-015). Фіг.6. Цитолітична активність ColoAd1, Ad11p і Ad5 на нормальній епітеліальній клітинній лінії (SAEC) і клітинній лінії раку ободової кишки людини (НТ-29). Кожна панель представляє собою типовий експеримент, який повторювали принаймні три рази. Кожна точка даних на панелі являє собою дослідження, здійснене в чотирьох повторах, результати виражали у вигляді середніх значень +/- СВ (Позначення на фігурі: —●—Ad5; —— Ad11p; — — ColoAd1). Фіг.7. Цитолітична активність рекомбінантних вірусів. Конструювали рекомбінантні віруси, які представляють чотири вірусні популяції (Adp11, ColoAd1, лівий кінець Ad11p/правий кінець ColoAd1 (ColoAd1.1) і лівий кінець ColoAd1/правий кінець Ad11p (ColoAd1.2)), як описано в прикладі 6. Визначали цитолітичну активність кожної популяції в НТ29 клітинах, як було описано раніше. (Позначення на фігурі:—●—Ad5; ——Ad11p; — — ColoAd1;— —טּColoAd1.1; —▲— ColoAd1.2). Всі публікації, включаючи патенти й патентні заявки, згадані в даному описі, включені в даний винахід як посилання в такому обсязі, якби кожна 9 89957 окрема публікація була специфічно й окремо повністю включена як посилання. Визначення Якщо спеціально не вказано інакше, то всі технічні й наукові терміни, використовувані в даному винаході, мають такі ж значення, що звичайно маються на увазі середнім фахівцем в галузі техніки, до якої належить даний винахід. Як правило, номенклатура, використовувана в даному винаході, і лабораторні методики, описані нижче, є добре відомими й звичайно використовуваними в даній галузі. Як використовується в даному винаході, термін "аденовірус", "серотип" або "аденовірусний серотип" стосується кожного з 51 аденовірусних серотипів людини, відомих у цей час або виділених у майбутньому. Див., наприклад, Strauss, "Adenovirus infections in humans," в The Adenoviruses, Ginsberg, ea., Plenum Press, НьюЙорк, NY, cc.451-596 (1984). Ці серотипи класифікують на підгрупи A-F (див., Shenk, "Adenoviridae: The Viruses and Their Replication," в Fields Virology, том 2,4-oi видання, Knipe, ea., Lippincott Williams & Wilkins, стор.2265-2267 (2001), як показано в таблиці. Таблиця Підгрупа А В С D Ε F Аденовірусний серотип 12. 18, 31 3,7,11,14,16,21,34,35, 51 1,2,5,6 8-10,13,15.17,19,20,22-30, 32, 33, 36-39, 42-49, 50 4 40,41 Як використовується в даному винаході, "химерний аденовірус" стосується аденовірусу, нуклеотидна послідовність якого містить нуклеотидні послідовності принаймні двох аденовірусних серотипів, описаних вище. Як використовується в даному винаході, "батьківський аденовірусний серотип" стосується аденовірусного серотипу, який представляє собою серотип, з якого має походження більшість геному химерного аденовірусу. Як використовується в даному винаході, термін "гомологічна рекомбінація" стосується двох молекул нуклеїнової кислоти, кожна з яких має гомологічні послідовності, де дві молекули нуклеїнової кислоти піддаються кросинговеру або рекомбінації в ділянці гомології. Як використовується в даному винаході, термін "ефективність" стосується літичного потенціалу вірусу й характеризує його здатність до реплікації, лізису й поширенню. Для цілей даного винаходу, ефективність являє собою величину, за допомогою якої порівнюється цитолітична активність даного аденовірусу за винаходом з такою Ad5 в аналогічній клітинній лінії, тобто ефективність =ІС50Ad/IC50Ad5, де X являє собою певний аденовірусний серотип, який піддається дослідженню, і де для ефективності Ad5 заданим значенням є 1. 10 Як використовується в даному винаході, термін "онколітичний вірус" стосується вірусу, який переважно вбиває ракові клітини в порівнянні з нормальними клітинами. Як використовується в даному винаході, термін "терапевтичний індекс" або "терапевтичне вікно" стосується числа, яке вказує онколітичний потенціал даного аденовірусу, і визначається шляхом ділення ефективності аденовірусу в лінії ракових клітин на ефективність того ж самого аденовірусу у звичайній (тобто не злоякісній) клітинної лінії. Як використовується в даному винаході, термін "модифікована" стосується молекули нуклеотидної або амінокислотної послідовності, які відрізняється від нуклеотидної або амінокислотної послідовності, яка зустрічається в природних умовах, наприклад, дикого типу. Модифікована молекула може зберігати функцію або активність молекули дикого типу, тобто модифікований аденовірус може зберігати свою онколітичну активність. Модифікації включають мутації нуклеїнових кислот, як описано нижче. Як використовується в даному винаході, "мутація" стосовно полінуклеотиду або поліпептиду, стосується природної, синтетичної, рекомбінантної або хімічної зміни або відмінності первинної, вторинної або третинної структури полінуклеотиду або поліпептиду, у порівнянні з полінуклеотидом або поліпептидом відповідно, з яким проводять порівняння (наприклад, у порівнянні з полінуклеотидом або поліпептидом дикого типу). Мутації включають такі зміни, як, наприклад, делеції, вставки або заміни. Полінуклеотиди й поліпептиди, які мають такі мутації, можуть бути виділені або отримані за допомогою способів, добре відомих у даній галузі. Як використовується в даному винаході, "делеція" визначається як зміна в полінукпеотидних або в амінокислотних послідовностях, при якому один або декілька полінуклеотидів або амінокислотних залишків, відповідно, відсутні. Як використовується в даному винаході, "інсерція" або "додавання" являє собою таку зміну в полінуклеотидній або в амінокислотній послідовності, яка приводить до додавання одного або декількох полінуклеотидів або амінокислотних залишків, відповідно, у порівнянні із полінуклеотидною або амінокислотною послідовністю, яка зустрічається в природних умовах. Як використовується в даному винаході, "заміна" є наслідком заміни одного(ой) або декількох полінуклеотидів або амінокислот іншими полінуклеотидами або амінокислотами, відповідно. Як використовується в даному винаході, термін "похідне аденовірусу" стосується аденовірусу за винаходом, який модифікований таким чином, що здійснено додавання, делеція або заміна до або у вірусному геномі, при цьому отримане похідне аденовірусу проявляє ефективність і/або терапевтичний індекс, що перевищує такий у батьківського аденовірусу, або в інших аспектах є більш терапевтично придатним (тобто менший імуногенний, з поліпшеним профілем виведення). Наприклад, похідне аденовірусу за винаходом може ма 11 ти делецію в одному з ранніх генів вірусного геному, включаючи, але не обмежуючись тільки ними, ділянка Е1А або Е2В вірусного геному. Як використовується в даному винаході, "варіант" стосовно полінуклеотиду або поліпептиду, стосується полінуклеотиду або поліпептиду, які можуть відрізнятися за первинною, вторинною або третинною структурою, у порівнянні з полінуклеотидом або поліпептидом відповідно, з яким проводять порівняння (наприклад, у порівнянні з полінуклеотидом або поліпептидом дикого типу). Наприклад, амінокислотна або нуклеотидна послідовність може містити мутацію або модифікацію, що відрізняється від амінокислотної або нуклеотидної послідовності, з якою проводять порівняння. У деяких варіантах здійснення винаходу аденовірусний варіант може відрізнятися ізоформою або поліморфізмом. Варіанти можуть являти собою природні, синтетичні, рекомбінантні або хімічно модифіковані полінуклеотиди або поліпептиди, виділені або отримані за допомогою способів, відомих у даній галузі. Зміни у варіантах полінуклеотидної послідовності можуть бути мовчазними. Це відбувається в тому випадку, якщо вони не змінюють амінокислотну послідовність, яка кодується полінуклеотидом. Якщо варіації обмежені мовчазними змінами цього типу, то такий варіант буде кодувати поліпептид, який має амінокислотну послідовність, ідентичну до послідовності, з якою проводять порівняння. Альтернативно, такі зміни в полінуклеотидній послідовності варіанта можуть змінювати амінокислотну послідовність поліпептиду, який кодується полінуклеотидом, з яким проводять порівняння, що приводить до консервативних або неконсервативних змін амінокислот, як описано нижче. Такі зміни в полінуклеотиді можуть приводити до амінокислотних замін, додавань, делецій, злиття і усікання амінокислот у поліпептиді, який кодується послідовністю, з якою проводять порівняння. Для оптимізації клонування в плазмід і або вірусному векторі або експресування в конкретній прокаріотичній або еукаріотичній системі можуть здійснюватися різні зміни кодонів, такі як, мовчазні зміни, які утворюють різні рестрикційні ділянки. Як використовується в даному винаході, "аденовірусний варіант" стосується аденовірусу, полінуклеотидна послідовність якого відрізняється від полінуклеотиду, з яким проводять порівняння, наприклад, аденовірусу дикого типу, як описано вище. Відмінності можуть бути обмежені таким чином, що батьківська полінуклеотидна послідовність і полінуклеотидна послідовність варіанта є в цілому подібними й, у більшості ділянок, ідентичними. Як використовується в даному винаході, перша нуклеотидна або амінокислотна послідовність є подібною до другої послідовності, якщо при порівнянні двох послідовностей виявлено, що вони можуть мати декілька відмінностей у послідовності (тобто перша й друга послідовності є практично ідентичними). Як використовується в даному винаході, розходження полінуклеотидної послідовності в аденовірусного варіанта й аденовірусу, з яким проводять порівняння, не приводять 89957 12 до відмінностей в ефективності та/або терапевтичному індексі. Як використовується в даному винаході, термін "консервативний" стосується заміни амінокислотного залишку на інший амінокислотний залишок, що має подібні хімічні властивості. Консервативні амінокислотні заміни включають заміну лейцину на ізолейцин або валін, аспартату на глутамат, або треоніну на серин. Вставки або делеції звичайно перебувають у діапазоні приблизно 1-5 амінокислот. Як використовується в даному винаході, термін "неконсервативний* стосується заміни амінокислотного залишку на інший амінокислотний залишок, який має інші хімічні властивості. Неконсервативні заміни включають, але не обмежуючись тільки ними, заміну аспарагінової кислоти (D) на гліцин (G); аспарагіну (N) на лізин (K); або аланина (А) на аргінін (R). Однобуквений код для амінокислотних залишків включає наступні позначення: А= аланін, R= аргінін, N= аспарагін, D= аспарагінова кислота, С= цистеїн, Q= глутамін, Ε= глутамінова кислота, G= гліцин, Η= гістидин, І= ізолейцин, L= лейцин, K= лізин, Μ= метіонін, F= фенілаланін, Ρ= пролін, S= серин, Τ= треонін, W= триптофан, Υ= тирозин, V= валин. Варто взяти до уваги, що поліпептиди часто містять амінокислоти, які відрізняються від тих 20ти амінокислот, які звичайно позначають як 20 амінокислот, які зустрічаються в природних умовах, і що в даному поліпептиді багато амінокислот, включаючи кінцеві амінокислоти, можуть бути модифіковані або в результаті здійснення природних процесів, таких як глікозилування й інші посттрансляційні модифікації, або за допомогою методик хімічної модифікації, які добре відомі в даній галузі техніки. Навіть загальновідомих модифікацій, які відбуваються в поліпептидах, що зустрічаються в природних умовах, дуже багато, і перелічити їх тут повністю неможливо, але вони докладно описані в основних посібниках і більш докладних монографіях, а також у великій дослідницькій літературі, і вони добре відомі фахівцеві в даній галузі. Серед відомих модифікацій, які можуть бути присутні у поліпептидах згідно із даним винаходом, можна згадати, але тільки як ілюстрація, ацетилування, ацилування, АДФ-рибозилування, амідування, ковалентне приєднання флавіну, ковалентне приєднання молекули гему, ковалентне приєднання полінуклеотиду або похідного полінуклеотиду, ковалентне приєднання ліпіду або похідного ліпіду, ковалентне приєднання фосфотидилінозитолу, поперечне зшивання, циклізація, утворення дисульфідного зв'язку, деметилування, утворення ковалентних поперечних зв'язків, утворення цистину, утворення піроглутамату, форматування, гаммакарбоксилування, гліцирування, глікозилування, утворення GPI-якоря, гідроксилування, йодування, метилування, міристоїлування, окислення, протеолітична обробка, фосфорилування, пренілування, рацемізація, селеноїлування, сульфатування, опосередковане тРНК додавання амінокислот до білків, таке як аргінілування й убіквітинізація. 13 Такі модифікації добре відомі фахівцеві в даній галузі й дуже докладно описані в науковій літературі. Деякі переважні поширені модифікації, глікозилування, приєднання ліпідів, сульфатування, гамма-карбоксилування залишків глутамінової кислоти, гідроксилування й АДФ-рибозилування, описані, наприклад, у більшості основних посібників, таких як, наприклад, І. Е. Creighton, ProteinsStnicture and Molecular Properties, 2-е вид., W.H. Freeman і Company, Нью-Йорк, 1993. По даному питанню доступні різні докладні огляди, такі як, наприклад, підготовлені Wold, F., в Posttranslational Covalent Modification of Proteins, пo ред. В. С. Johnson, Academic Press, New York, стор.1-12,1983; Seifter i ін., Meth. Enzymol. 182: 626-646,1990 і Rattan і ін., Protein Synthesis: Posttranslational Modifications and Aging, Ann. N.Y. Acad. Sci. 663: 48-62, 1992. Також варто взяти до уваги, як добре відомо й описано вище, що поліпептиди не заведи є повністю лінійними. Наприклад, поліпептиди можуть бути розгалуженими внаслідок убіквітинізації, і вони можуть бути кільцевими з розгалуженнями або без них, звичайно внаслідок пострансляційних впливів, включаючи впливи, які зустрічаються в природних умовах, і впливи, здійснювані людьми, які не відбуваються в природних умовах. Кільцеві, розгалужені й розгалужені кільцеві поліпептиди можуть бути синтезовані за допомогою нетрансляційних природних процесів, а також за допомогою повністю синтетичних способів. Модифікації можуть здійснюватися в будь-якій ділянці поліпептиду, включаючи скелет пептиду, бокові ланцюги амінокислот і аміно- або карбоксильні кінцеві ділянки. У дійсності найбільш частими модифікаціями, які звичайно зустрічаються в природних умовах або при синтезі поліпептидів, є блокування аміногрупи або карбоксильної групи поліпептиду, або обох цих груп шляхом ковалентної модифікації, і такі модифікації можуть бути присутнім у поліпептидах згідно із даним винаходом. Наприклад, амінокінцевий залишок поліпептидів, отриманих з Е. соІі, перед протеолітичною обробкою практично завжди являють собою Nформілметіонін. Модифікації, які відбуваються в поліпептиді, дуже часто будуть залежати від того, яким чином він був отриманий. Для поліпептидів, одержуваних шляхом експресування клонованого гена в організмі-хазяїні, наприклад, природа й ступінь модифікацій в основному буде визначатися здатністю клітини хазяїна до посттрансляційних модифікацій і модифікацій сигнальної послідовності, яка міститься в амінокислотній послідовності поліпептиду. Наприклад, добре відомо, що в бактеріальних клітинах-хазяїнах, таких як Ε. соlі, глікозилування дуже часто не здійснюється. Отже, якщо бажано одержати глікозилований поліпептид, то такий поліпептид необхідно експресувати у хазяїн і, здатному здійснювати глікозилування, звичайно в еукаріотичній клітині. Клітини комах дуже часто забезпечують таке ж посттрансляційне глікозилування, як і клітини ссавців, тому, зокрема, для ефективної експресії білків ссавців, що мають природні схеми глікозилування, розвиваються екс 89957 14 пресійні системи на основі клітин комах. Аналогічні міркування застосовуються й для інших модифікацій. Також варто взяти до уваги, що аналогічний тип модифікацій може мати місце в однаковому або різному ступені у декількох сайтах даного поліпептиду. Також даний поліпептид може містити модифікації різних типів. Як використовується в даному винаході, для опису співвідношень послідовностей між двома або більше полінуклеотидними або амінокислотними послідовностями використовують наступні терміни: "послідовність, з якою проводять порівняння", "вікно порівняння", "ідентичність послідовностей", "відсоток ідентичності послідовностей", "практично ідентична", "подібність" і "гомологічність". Під "послідовністю, з якою проводять порівняння", розуміють послідовність, використовувану як основу для порівнюваної послідовності; послідовність, з якою проводять порівняння, може являти собою підмножину більш довгої послідовності, наприклад, сегмент повнорозмірної кДНК або послідовності гена, наведених у переліку послідовностей, або вона може включати повну кДНК або послідовність гена. Як правило, послідовність, з якою проводять порівняння, містить принаймні 18 нуклеотидів або 6 амінокислот, часто принаймні 24 нуклеотиди або 8 амінокислот, більш переважно 48 нуклеотидів або 16 амінокислот. Оскільки кожна із двох полінуклеотидних або амінокислотних послідовностей містити (1) послідовність (тобто частину повної полінуклеотидної або амінокислотної послідовності), яка є подібною для двох молекул, і (2) може містити додаткову послідовність, яка відрізняється у двох полінуклеотидних або амінокислотних послідовностей, то порівняння послідовностей двох (або більше) молекул звичайно здійснюють шляхом порівняння послідовностей двох молекул в "вікні порівняння", ідентифікуючи й порівнюючи локальні ділянки подібних послідовностей. Термін "вікно порівняння", як він використовується в даному описі, стосується абстрактного сегмента, який включає принаймні 18 суміжних нуклеотидів або 6 амінокислот, де полінуклеотидна послідовність або амінокислотна послідовність може бути порівняна з послідовністю, з якою проводять порівняння, що складається принаймні з 18 суміжних нуклеотидів або 6 амінокислот, і де ділянка полінуклеотидної послідовності у вікні порівняння може включати 20% або менше вставок, делецій, замін і т.п. (тобто проломів), відносно послідовності, з якою проводять порівняння (яка не має вставок або делецій) для оптимального суміщення двох послідовностей. Оптимальне суміщення послідовностей для суміщення вікна порівняння можна здійснювати, наприклад, за допомогою алгоритму локальної гомології Smith і Waterman, Adv. Appl. Math. 2:482 (1981), за допомогою алгоритму збігу гомологи Needleman і Wunsch, J. Моl. ВіоІ. 48: 443 (1970), за допомогою методу пошуку подібності Pearson і Lipman, Proc. Natl. Acad. Sci. (USA) 85:2444 (1988), за допомогою комп'ютерних реалізацій цих алгоритмів (GAP, BESTFIT, FASTA і TFASTA, що входять у пакет програм Wisconsin Genetics, версія 7,0, (Genetics 15 Computer Group, 575 Science Dr., Медісон, Вісконсин), VectorNTI від Informatix, Geneworks, або програмного забезпечення MacVector), або шляхом перевірки, і вибирають найбільш переважне суміщення (тобто, що дає в результаті найвищий відсоток гомології у вікні порівняння), отримане при здійсненні різних способів. Як використовується в даному винаході, термін "ідентичність послідовностей" означає, що дві полінуклеотидні або амінокислотні послідовності є ідентичними (тобто за своїми послідовно розташованим нуклеотидам або амінокислотним залишкам) у вікні порівняння. "Відсоток ідентичності послідовностей" розраховують шляхом порівняння двох оптимально суміщених послідовностей у вікні порівняння, визначаючи кількість положень, у яких ідентичні основи нуклеїнових кислот (наприклад, А, Т, С, G, U або І) або амінокислотні залишки зустрічаються в обох послідовностях, у результаті чого одержують кількість співпадаючих положень, ділення кількості положень, що збіглися, на загальну кількість положень у вікні порівняння (тобто на розмір вікна), і множення результату на 100 для одержання відсотка ідентичності послідовностей. Термін "практично ідентична", як він використовується в даному винаході, стосується характеристики полінуклеотидної або амінокислотної послідовності й означає, що полінуклеотидна або амінокислотна послідовність має послідовність, яка принаймні на 85%, переважно принаймні на 90-95%, більш переважно принаймні на 99% Ідентична до послідовності, з якою проводять порівняння, у вікні порівняння, що включає принаймні 18 положень нуклеотидів (6 амінокислот), часто у вікні порівняння, що включає принаймні 24-48 положень нуклеотидів (8-16 амінокислот), де відсоток ідентичності послідовностей розраховують шляхом порівняння послідовності, з якою проводять порівняння, з послідовністю, яка може включати делеції або вставки, що становлять у цілому 20% або менше послідовності, з якою проводять порівняння, у вікні порівняння. Послідовність, з якою проводять порівняння, може являти собою підмножину більш довгої послідовності. Термін "подібність", коли він застосовується для позначення поліпептиду, визначається шляхом порівняння амінокислотної послідовності й консервативних амінокислотних замін одного поліпептиду з послідовністю другого поліпептиду. Термін "гомологічний", коли він використовується для опису полінуклеотиду, вказує на те, що дві полінуклеотиди або їх позначені послідовності при оптимальному збігу й порівнянні є ідентичними з відповідними вставками або делеціями нуклеотидів принаймні для 70% нуклеотидів, звичайно приблизно для 75%-99% і найбільше переважно принаймні для 98-99% нуклеотидів. Як використовується в даному винаході, "гомологічний", коли він використовується для опису полінуклеотиду, вказує на те, що два полінуклеотиди або їх позначені послідовності при оптимальному збігу й порівнянні є ідентичними з відповідними вставками або делеціями нуклеотидів принаймні для 70% нуклеотидів, звичайно прибли 89957 16 зно для 75%-99% і найбільш переважно принаймні для 98-99% нуклеотидів. Як використовується в даному винаході, "полімеразна ланцюгова реакція" або "ПЛР" стосується методики ампліфікації специфічних ділянок ДНК, як описано в патенті US 4,683,195. Як правило, необхідна наявність інформації про кінцеві послідовності фрагмента поліпептиду, що представляє інтерес, або про послідовності, розташовані далі, з використанням таких відомостей можуть бути створені олігонуклеотидні праймери; потім ці праймери направляють друг до друга й ампліфікують ідентичні або подібні послідовності в протилежних ланцюгах матриці. 5'-Кінцеві нуклеотиди двох праймерів сполучають із кінцями ампліфікованої речовини. ПЛР може використовуватися для ампліфікації специфічних послідовностей ДНК із загальної геномної ДНК, кДНК, транскрибованої із загальної клітинної РНК, плазмідних послідовностей і т.д. (більш докладно див. Mullis і ін., Cold Spring Harbor Symp. Quant. Biol., 51: 263, 1987; під ред. Eriich, PCR Technology, Stockton Press, НьюЙорк, 1989). Як використовується в даному винаході, "строгість" звичайно спостерігається в інтервалі приблизно від Τпл (температура плавлення) -5°С (5°С нижче Тпл зонда) приблизно до 20°С-25°С нижче Тm. Як очевидно для фахівця в даній галузі, строга гібридизація може застосовуватися для ідентифікації або визначення ідентичних полінуклеотидних послідовностей або для ідентифікації або визначення подібних або споріднених полінуклеотидних послідовностей. Як використовується в даному винаході, термін "строгі умови" означає, що гібридизація відбувається тільки при наявності принаймні 95% і переважно принаймні 97% ідентичності між послідовностями. Як використовується в даному винаході, термін "гібридизація", як він використовується в даному винаході, включає "будь-який процес, за допомогою якого полінуклеотидний ланцюг з'єднується з комплементарним ланцюгом шляхом спарювання основ" (Coombs, J., Dictionary of Biotechnology, Stockton Press, Нью-Йорк, N.Y., 1994). Як використовується в даному винаході, "терапевтично ефективна доза" або "ефективна кількість" стосується кількості аденовірусу, яка зменшує інтенсивність симптомів або полегшує хворобливий стан. Доза є терапевтично ефективною дозою для лікування раку або його метастаз, якщо ріст пухлини або метастаз уповільнюється або зупиняється, або якщо виявляється зменшення розміру пухлини або метастаз, що приводить до збільшення тривалості життя суб'єкта. Аденовіруси за винаходом Даний винахід забезпечує химерні аденовіруси або їх варіанти або похідні, які мають геном, у якому нуклеотидна послідовність ділянки Е2В химерного аденовірусу містить нуклеотидну послідовність, яка має походження від принаймні двох аденовірусних серотипів, кожний з яких вибирають із підгруп аденовірусів В, С, D, Ε і F і відрізняються один від одного. Химерний аденовірус за винаходом є онколітичним і проявляє підвищений терапевтичний індекс у пухлинній клітині. 17 Виділення химерних аденовірусів Химерні аденовіруси за винаходом або їх варіанти або похідні можуть бути отримані за допомогою модифікації методики, на яку тут посилаються як "біоселекція", відповідно до якої аденовірус із необхідними властивостями, такими як збільшена онкогенність або специфічність до типу клітин, одержують шляхом застосування генетичної селекції в контрольованих умовах (Yan і ін. (2003) J. Virol. 77: 2640-2650). У даному винаході, суміш аденовірусів різних серотипів об'єднують і пасивують, переважно принаймні два рази, у субконфлюентній культурі пухлинних клітин при співвідношенні частинок на клітину, достатньо великому для стимуляції рекомбінації між серотипами, але не настільки великому, щоб викликати передчасну загибель клітин. Переважне співвідношення частинок на клітину становить приблизно 500 частинок на клітину й легко може бути визначено фахівцем у даній галузі. Як використовується в даному винаході, "субконфлюентна культура" клітин стосується моношарової або суспензійної культури, у якій клітини активно ростуть. Для росту клітин у вигляді моношару, прикладом може бути культура, у якій близько 50%-80% площі, доступної для росту клітин, покрито клітинами. Переважною є культура, у якій близько 75% ростової площі покрито клітинами. У переважному варіанті здійснення винаходу, сумішшю аденовірусів є суміш, яка включає аденовірусні серотипи, що представляють адновірусні підгрупи В, С, D, Ε і F. Група аденовірусів А не включена в суміш, тому що вони зв'язані з утворенням пухлин у гризунів. Переважними лініями пухлинних клітин, придатними для біоселекції, є, але не обмежуючись тільки ними, ті, які мають походження від молочної залози, ободової кишки, підшлункової залози, легені й передміхурової залози. Деякими прикладами клітинних ліній солідних пухлин, придатних для "біоселективного" пасивування суміші аденовірусів включають, але не обмежуючись тільки ними, клітини MDA231, НТ29, ΡΑΝ-1 і РС-3. Гемопоетичні клітинні лінії включають, але не обмежуючись тільки ними, В-лімфоїдні клітини Raji і Daudi, еритробластоїдні клітини K562, мієлоєдні клітини U937 і Т-лімфоїдні клітини HSB2. Аденовіруси, одержувані при таких вихідних пасажах, використовують для інфікування спочиваючих пухлинних клітин при співвідношенні частинок на клітину, нижче необхідного для можливості інфікування клітини, але не більше ніж один аденовірус. Після здійснення аж до 20 пасажів у цих умовах, супернатант із останнього пасажу збирають до видимої цитопатичної дії (СРЕ, див. Fields Virology, том 2, четверте вид., Knipe, ea., Lippincott Williams & Wilkins, стор.135-136) для підвищення селекції сильнодіючих вірусів. Зібраний супернатант може бути концентрований за допомогою методик, добре відомих фахівцеві в даній галузі. Переважним способом одержання спочиваючих клітин, тобто таких, у яких зупинений активний ріст клітин, у моношаровій культурі є надання можливості культурі рости протягом 3 днів з на 89957 18 ступним злиттям, де злиття означає, що вся площа, доступна для росту клітин, зайнята (покрита клітинами). Подібним чином, суспензійні культури можуть рости до щільностей, які характеризують відсутність активного росту клітин. Профіль серотипу концентрованого супернатанту, що містить біоселектований аденовірусний пул, можна досліджувати шляхом вимірювання часу утримання зібраного вірусного пулу на аніонообмінній колонці, де відомо, що різні аденовірусні серотипи мають характерні часи утримання (Blanche і ін. (2000) Gene Therapy 7: 1055-1062); див. приклад 3, фігури 1А і В. Аденовіруси за винаходом можуть бути виділені з концентрованого супернатанту шляхом розведення й очищення бляшок або інших методик, добре відомих у даній галузі, і росту для подальшої характеристики. Добре відомі в даній галузі методики застосовуються для визначення послідовностей виділених химерних аденовірусів (див. приклад 5). Прикладом химерного аденовірусу за винаходом є химерний аденовірус ColoAd1, який виділений за допомогою клітин ободової кишки НТ29 у способі біоселекції. ColoAd1 має нуклеотидну послідовність SEQ ID NO: 1. Більша частина нуклеотидної послідовності ColoAd1 ідентична до нуклеотидної послідовності серотипу Ad11 (SEQ ID NO: 2) (Stone і ін. (2003) Virology 309:152-165; Mei і ін. (2003) J. Gen. Virology 84: 2061-2071). У нуклеотидній послідовності ColoAd1 присутні дві делеції в порівнянні з Ad11, перша довжиною 2444 пар основ у межах ділянки одиниці транскрипції Е3 геному (пари основ 27979-30423 SEQ ID NO: 2) і друга, менша делеція, довжиною 25 пар основ (пари основ 33164-33189 SEQ ID NO: 2), у межах гена Е4оrf4. Ділянка одиниці транскрипції Е2В (SEQ ID NO: 3) ColoAd1, яка кодує аденовірусні білки ДНКполімеразу й термінальний білок, розташована між парами основ 5067 і 10354 SEQ ID NO: 1, і являє собою ділянку гомологічної рекомбінації між серотипами Ad 11 і Ad3. У межах цієї ділянки ColoAd1 присутня зміна 198 пар основ у порівнянні з послідовністю Ad11 (SEQ ID NO: 1). Зміни приводять до подовження нуклеотидів у межах ділянки Е2В ColoAd1, які є гомологічними до частини ділянки Е2В Ad3 (SEQ ID NO: 8), з найбільшим подовженням гомології між ColoAd1 і Ad3, що має довжину 414 по. Ділянка Е2В ColoAd1 (SEQ ID NO: 3) надає збільшену ефективність аденовірусу ColoAd1 у порівнянні з немодифікованим аденовірусом Ad11 (див. приклад 6; Фіг.7). В інших варіантах здійснення винаходу, химерний аденовірус за винаходом може містити нуклеотидні послідовності більш ніж із двох аденовірусних серотипів. Химерний аденовірус за винаходом або його варіант або похідне може бути досліджений відносно його селективності в характерному типі пухлини шляхом оцінки його літичного потенціалу на панелі пухлинних клітин, які мають походження від однієї й тієї ж тканини, де аденовірусний пул був підданий вихідному пасивуванню. Наприклад, химерний аденовірус ColoAd1 (SEQ ID NO: 1), який початково мав походження від аденовірусного пула, пасивованого на клітинних лініях пухлини ободової кишки НТ-29, повторно досліджували як 19 на клітинах НТ-29, так і на панелі інших клітинних ліній, які мають походження від пухлини ободової кишки, включаючи DLD-1, LS174T, LS1034, SW403, НСТ116, SW48 і Colo320DM (див. Фіг.3Б). Будь-які доступні клітинні лінії пухлини ободової кишки так само можуть бути придатними для такої оцінки. Аденовірусні клони, виділені з аденовірусних пулів, вибраних на клітинних лініях пухлин інших типів, аналогічно можна тестувати на підходящій панелі пухлинних клітин, включаючи, але не обмежуючись тільки ними, клітинні лінії передміхурової залози (наприклад, клітинні лінії DU145 і РС-3); клітинні лінії підшлункової залози (наприклад, клітинна лінія Рапс-1); клітинні лінії пухлин молочної залози (наприклад, клітинна лінія MDA231) і клітинні лінії яєчників (наприклад, клітинна лінія OVCAR-3). Інші доступні клітинні лінії пухлин так само придатні для виділення й ідентифікації аденовірусів за винаходом. Химерні аденовіруси за винаходом мають підвищений терапевтичний індекс у порівнянні з аденовірусними серотипами, похідними яких вони є (див. Фіг.6, де порівнюється цитолітична активність химерного аденовірусу ColoAd1 з Ad11p). Винахід також охоплює химерні аденовіруси, які сконструйовані за допомогою рекомбінантних методик, добре відомих фахівцеві в даній галузі. Такі химерні аденовіруси містять ділянку нуклеотидної послідовності, яка має походження від одного аденовірусного серотипу, що вбудований за допомогою рекомбінантних методик у геном другого аденовірусного серотипу. Вбудована послідовність надає батьківському аденовірусному серотипу властивість, наприклад, пухлинну специфічність або підвищену ефективність. Наприклад, ділянка Е2В ColoAd1 (SEQ ID NO: 3) може бути вбудована у геном Ad35 або Ad9. Похідні аденовірусів Винахід також охоплює химерний аденовірус за винаходом, який модифікований для забезпечення інших терапевтично придатних химерних аденовірусів. Модифікації включають, але не обмежуючись тільки ними, ті, які описані нижче. Однією з модифікацій є одержання похідних химерного аденовірусу за винаходом з по суті відсутньою здатністю зв'язувати р53, у результаті мутації в аденовірусному гені, який кодує білок Е1В-55К. У таких вірусах, як правило, вилучені деякі або всі ділянки Е1В-55К. (см. патент US 5,677,178). У патенті US 6,080,578 описані, зокрема, Ad5 мутанти, які мають делеції в ділянці білка Е1В-55К, яка відповідає за зв'язування р53. Іншими переважними модифікаціями химерних аденовірусів згідно із даним винаходом є мутації в ділянці Е1А, як описано в патентах US 5,801,029 і 5,972,706. Ці типи модифікацій забезпечують похідні химерних аденовірусів за винаходом зі збільшеною селективністю до пухлинних клітин. Іншим прикладом модифікації, яка підпадає під обсяг винаходу, є химерний аденовірус, який має підвищений ступінь тканинної специфічності завдяки розміщенню реплікації вірусу під контролем тканиноспецифичного промотору, як описано в патенті US 5,998,205. Реплікація химерного аде 89957 20 новірусу за винаходом також може знаходитися під контролем чутливого елемента E2F, як описано в заявці на патент US 09/714,409. Ця модифікація забезпечує контрольований механізм реплікації вірусу, ґрунтуючись на присутності E2F, що приводить до підвищеної специфічності до пухлинної тканини й відрізняється від контролю, здійснюваної тканинноспецифічним промотором. У цих обох варіантах здійснення винаходу тканинноспецифічний промотор і чутливий елемент E2F функціонально зв'язані з аденовірусним геном, необхідним для реплікації аденовірусу. Іншою модифікацією, яка підпадає під обсяг винаходу, є застосування химерного аденовірусу за винаходом, наприклад ColoAd1, як основи одержання нових аденовірусних векторів з недостатністю реплікації. Як описано в Lai і ін. ((2002) DNA Cell Bio. 21:895-913), аденовірусні вектори з недостатністю реплікації можуть використовуватися для доставки й експресії терапевтичних генів. Перше покоління (у якому вилучені ділянки Е1 і Е3) і друге покоління (у якому додатково вилучена ділянка Е4) аденовірусних векторів, які мають походження від химерних аденовірусів за винаходом, обидва забезпечуються даним винаходом. Такі вектори легко одержують за допомогою методик, добре відомих фахівцеві в даній галузі (див. Imperiale і Kochanek (2004) Curr. Top. Microbiol. Immunol. 273: 335-357; Vogels і ін. (2003) J. Virol. 77: 8263-8271). Подальшою модифікацією, яка підпадає під обсяг винаходу, є вставка гетерологічного гена, придатного як маркер або репортер для відстеження ефективності інфікування вірусом. Одним варіантом здійснення цього типу модифікації є вставка гена тимідинкінази (ТK). Експресія ТK в інфікованих клітинах може використовуватися для відстеження рівня вірусів, які залишилися в клітинах, після інфікування вірусом, за допомогою радіоактивно мічених субстратів ТK реакції (Sangro і ін. (2002) Моl. Imaging Biol. 4: 27-33). Способи конструювання модифікованих химерних аденовірусів добре відомі в даній галузі. Див., Mittal, S. K. (1993) Virus Res. 28: 67-90 і Hermiston, Т. і ін. (1999) Methods in Molecular Medicine: Adenovirus Methods and Protocols, під ред. W.S.M. Wold,, Humana Press. У стандартних методиках використовують методи рекомбінантної нуклеїнової кислоти, синтез полінуклеотидів і культивування й трансформацію мікроорганізмів (наприклад, електропорацію, ліпофекцію). Звичайно ферментативні реакції й етапи очищення здійснюють відповідно до рекомендацій виробника. Техніки й методики здійснюють відповідно до методів, загальноприйнятих у даній галузі, різним поширеним посиланням (див. в основному, Sambrook і ін., Molecular Cloning: A Laboratory Manual, 2-е вид. (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.), які описані в цьому джерелі. Номенклатура, використовувана в даному описі, і лабораторні методики аналітичної хімії, хімії органічного синтезу й приготування лікарських засобів, є добре відомими й звичайно використовуються в даній галузі. 21 Визначення терапевтичного потенціалу Химерні аденовіруси за винаходом або їх варіанти або похідні можуть бути оцінені щодо їх терапевтичної корисності шляхом визначення їх літичного потенціалу на пухлинних клітинах, які мають походження від терапевтичних мішеней, що представляють інтерес. Лінії пухлинних клітин, придатні для тестування таких аденовірусів, включають, але не обмежуючись тільки ними, клітинні лінії ободової кишки, включаючи, але не обмежуючись тільки ними, клітинні лінії DLD-1, HCT116, НТ29, LS1034 і SW48; клітинні лінії передміхурової залози, включаючи, але не обмежуючись тільки ними, клітинні лінії OU145 і РС-3; клітинні лінії підшлункової залози, включаючи, але не обмежуючись тільки ними, клітинну лінію Раnс-1; клітинні лінії пухлин молочної залози, включаючи, але не обмежуючись тільки ними, клітинну лінію MDA231, і клітинні лінії яєчника, включаючи, але не обмежуючись тільки ними, клітинну лінію OVCAR-3. Гемопоетичні клітинні лінії включають, але не обмежуючись тільки ними, клітини В-лімфоїдні клітини Raji і Daudi, еритробластоїдні клітини K562, мієлоєдні клітини U937 і Т-лімфоїдні клітини HSB2. Інші доступні клітинні лінії пухлин так само придатні для виділення й ідентифікації аденовірусів за винаходом для застосування для лікування новоутворення. Цитолітична активність аденовірусів за винаходом може бути визначена в характерних пухлинних клітинних лініях і отримані при вимірюванні дані перетворені в ефективність, використовуючи як стандарт аденовірус, який належить до підгрупи С, переважно Ad5 (тобто дана ефективність дорівнює 1). Переважним способом визначення цитолітичної активності є MTS-анапіз (див. приклад 4, Фіг.2). Терапевтичний індекс аденовірусу за винаходом в конкретній пухлинній клітинній лінії може бути визначений шляхом порівняння ефективності даного аденовірусу в пухлинній клітинній лінії з ефективністю цього ж аденовірусу в незлоякісній клітинній лінії. Переважними незлоякісними клітинними лініями є клітини SAEC (епітеліального походження) і клітини HUVEC (ендотеліального походження) (див. Фіг.4 ). Ці два типи клітин представляють нормальні клітини, які мають походження від органів і судинної сітки, відповідно, і характеризують імовірні ділянки токсичності при здійсненні аденовірусної терапії, залежно від способу доставки аденовірусу. Проте, практичне здійснення за винаходом не обмежується застосуванням цих клітин, також можна використовувати інші незлоякісні клітинні лінії (наприклад, В-клітини, Тклітини, макрофаги, моноцити, фібробласти). Химерні аденовіруси за винаходом додатково можуть бути оцінені щодо їх здатності націлювати ріст пухлинних клітин (тобто ракових) за їх здатністю зменшувати пухлиноутворення або навантаження пухлинними клітинами в безшерстих мишей, що несуть трансплантовані пухлинні клітини в порівнянні з мишами, що несуть пухлинні клітини в еквівалентному навантаженні, але не одержують лікування (див. приклад 7). 89957 22 Оцінку аденовірусів за винаходом також можна здійснювати за допомогою первинних експлантатів пухлин людини (Lam і ін. (2003) Cancer Gene Therapy; Grill і ін. (2003) МоІ. Therapy 6: 609-614), які забезпечують тестовані умови, які присутні у пухлині, що звичайно не можуть бути отримані при дослідженні ксенотрансплантованих пухлин. Корисність для лікування Даний винахід забезпечує застосування химерних аденовірусів за винаходом для інгібування росту пухлинних клітин, а також застосування аденовірусних векторів, які мають походження від цих химерних аденовірусів, для доставки терапевтично корисних білків, придатних для лікування новотворів і інших хворобливих станів. Фармацевтичні композиції й введення Даний винахід також стосується фармацевтичних композицій, які містять химерні аденовіруси за винаходом, включаючи їх варіанти й похідні, приготовлені для терапевтичного введення пацієнтові. Для терапевтичного застосування стерильну композицію, яка містить фармакологічно ефективну дозу аденовірусу, вводять людині або у ветеринарії пацієнтові, крім людини, для лікування, наприклад, новоутворення. Звичайно композиція 11 буде містити близько 10 або більше частинок аденовірусу в одній суспензії. Часто в таких стерильних умовах використовують фармацевтично прийнятний носій або наповнювач. Можна використовувати різні водні розчини, наприклад, воду, буферизовану воду, 0,4% сольовий розчин, 0,3% гліцин і подібні. Ці розчини є стерильними й практично вільні від інших частинок, що не представляють собою необхідний аденовірусний вектор. Композиції можуть містити фармацевтично прийнятні допоміжні речовини, необхідні для підтримання фізіологічних умов, такі як речовини для встановлення значення рН і буферні речовини, речовини, які регулюють токсичність, і подібні, наприклад, ацетат натрію, хлорид натрію, хлорид калію, хлорид кальцію, лактат натрію й т.д. Можна включати наповнювачі, які підвищують інфікованість клітин аденовірусом (див. патент US6,392,069). Аденовіруси за винаходом також можуть доставляти до пухлинних клітин за допомогою ліпосом або імуноліпосом, така доставка може бути селективно націлена на пухлинні клітини на основі властивостей клітинної поверхні, присутніх у популяції пухлинних клітин (наприклад, присутність білка клітинної поверхні, який зв'язується з імуноглобуліном на ліпосомі). Звичайно водну суспензію, яка містить віріони, інкапсулюють у ліпосоми або імуноліпосоми. Наприклад, суспензія аденовірусних віріонів може бути інкапсульована в міцели з утворенням ліпосом за допомогою загальноприйнятих способів (патент US 5,043,164, патент US 4,957,735, патент US 4,925,661; Connor i Huang, (1985) J. Cell Biol. 101: 581; Lasic D.D. (1992) Nature 355: 279; Novel Drug Delivery (під ред. Prescott і Nimmo, Wiley, Нью-Йорк, 1989); Reddy і ін. (1992) J. Immunol. 148: 1585). Імуноліпосоми, що містять антитіло, які специфічно зв'язується з антигеном злоякісної клітини (наприклад, CALLA, СЕА), який знаходиться на злоякісних клітинах 23 пацієнта, можна використовувати для націлювання віріонів на ці клітини (Fisher (2001) Gene Therapy 8: 341-348). Для подальшого підвищення ефективності аденовірусів за винаходом їх можна модифікувати для прояву підвищеного тропізму до переважних типів пухлинних клітин. Наприклад, як показано в заявці PCT/US98/04964, протеїн на зовнішній оболонці аденовірусу можна модифікувати для виявлення хімічного агента, переважно поліпептиду, який зв'язується з рецептором, що знаходиться на пухлинних клітинах, більшою мірою, ніж з нормальними клітинами (див. також патенти US 5,770,442 і 5,712,136). Поліпептид може являти собою антитіло, переважним є одноланцюгове антитіло. Лікування за допомогою аденовірусів Аденовіруси за винаходом або їх фармацевтичних композиціях можуть вводитися для терапевтичного лікування пухлинного захворювання або злоякісного новоутворення. Для терапевтичних показань композиції вводять пацієнтові, у якого вже розвинулося пухлинне захворювання, у кількості, достатній для лікування або принаймні частково купірування стану і його ускладнень. Кількість, достатня для здійснення такої дії, визначається згідно із даним винаходом як "терапевтично ефективна доза" або "діюча доза". Кількість, ефективна для такого застосування, буде залежати від тяжкості стану, загального стану пацієнта й шляху введення. Як приклад, але не обмежуючись тільки ним, людину або ссавця, який відрізняється від людини, що має солідне або гематологічне пухлинне захворювання, (наприклад, рак підшлункової залози, ободової кишки, яєчників, легень або молочної залози, лейкоз або множинну мієлому) можна піддавати лікуванню шляхом введення терапевтично ефективної дози підходящого аденовірусу за винаходом, тобто такого аденовірусу, який проявляє поліпшений терапевтичний індекс для цього типу тканини. Наприклад, переважним химерним аденовірусом для лікування раку ободової кишки буде аденовірус ColoAd1 (SEQ ID NO: 1). Суспензії інфікуючих частинок аденовірусу можуть доставлятися до пухлинної тканини різними шляхами, включаючи внутрішньовенний, внутрішньоочеревинний, внутрішньом'язовий, підшкірний і місцевий. Адено3 12 вірусна суспензія,яка містить близько 10 -10 або більше частинок віріону на мл може вводитися шляхом інфузії (наприклад, у порожнину очеревини для лікування раку яєчника, у ворітну вену для лікування гепатокарциноми або метастаз у печінці з інших первинних пухлин непечінкового походження) або іншим підходящим шляхом, включаючи пряму ін'єкцію в пухлинне утворення (наприклад, пухлина молочної залози), клізми (наприклад, рак ободової кишки) або катетер (наприклад, рак сечового міхура). Інші шляхи введення будуть підходящими для карцином іншого походження, тобто інгаляції у вигляді аерозолю (наприклад, для доставки в легені при раку бронха, дрібноклітинному раку легені, недрібноклітинному раку легені, аденокарциномі легені або раку гортані) або безпосереднього введення в пухлинну 89957 24 ділянку (наприклад, рак бронха, рак носоглотки, рак гортані, рак шийки матки). Аденовірусну терапію із застосуванням аденовірусів за даним винаходом можна комбінувати з іншими протипухлинними протоколами, такими як загальноприйнята хіміотерапія або променева терапія, для лікування конкретного злоякісного новоутворення. Лікування може бути одночасним або послідовним. Переважним хіміотерапевтичним засобом є цисплатин, і переважна доза може бути вибрана лікарем, виходячи із природи злоякісного новоутворення, яке піддається лікуванню, і інших факторів, які звичайно беруть до уваги при призначенні цисплатину. Переважно, цисплатин вво2 дять внутрівенно в дозі 50-120мг/м протягом 3-6 годин. Більш переважно його вводять внутрівенно 2 в дозі 80мг/м протягом 4 годин. Іншим переважним хіміотерапевтичним засобом є 5-фторурацил, який часто вводять у комбінації із цисплатином. Переважна доза 5-фторурацилу становить 8002 1200мг/м на добу протягом 5 послідовних днів. Аденовірусну терапію із застосуванням аденовірусів за даним винаходом як аденовірусних векторів також можна комбінувати з іншими генами, для яких відома корисність для лікування при генній терапії. Див. патент US 5,648,478. У таких випадках, химерний аденовірус додатково містить гетерологічний ген, який кодує терапевтичний білок, вбудований у вірусний геном, таким чином, що гетерологічний ген експресується в інфікованій клітині. Терапевтичний білок, як використовується в даному винаході, стосується білка, який, як припускають, буде забезпечувати деякі терапевтичні переваги при експресії в даній клітині. В одному варіанті здійснення винаходу, гетерологічний ген являє собою проліки генаактиватора, такий як дезаміназа цитозину (CD) (див. патенти US 5,631,236; 5,358,866 і 5,677,178). В інших варіантах здійснення винаходу, гетерологічний ген відомий як індуктор клітинної загибелі, наприклад, апоптин або аденовірусний протеїн загибелі (ADP), або злитий білок, наприклад, злитий мембранний глікопротеїн (Danen-Van Oorschot і ін. (1997) Proc. Nat. Acad. Sci. 94: 5843-5847; Tollefson і ін. (1996) J. Virol. 70: 2296-2306; Fu і ін (2003) МоІ. Therapy 7: 48-754, 2003; Ahmed і ін. (2003) Gene Therapy 10: 1663-1671; Galanis і ін. (2001) Human Gene Therapy 12(7): 811-821). Подальшими прикладами гетерологічних генів або їхніх фрагментів є ті, які кодують імуномодулюючі білки, такі як цитокіни або хемокіни. Прикладами є інтерлейкін 2, патенти US 4,738,927 або 5,641,665; інтерлейкін 7, патенти US 4,965,195 або 5,328,988; і інтерлейкін 12, патент US 5,457,038; фактор некрозу пухлини альфа, патент US 4,677,063 або 5,773,582; гамма-інтерферон, патент US 4,727,138 або 4,762,791; або GM CSF, патент US 5,393,870 або 5,391,485, Mackensen і ін. (1997) Cytokine Growth Factor Rev. 8: 119-128). Додаткові імуномодуляторні білки, крім того, включають макрофагові запальні білки, включаючи МІР-3. Також можна використовувати моноцитний хемотоксичний білок (МСР-3 альфа); переважним варіантом здійснення гетерологічного гена є химерний ген, який складається з гена, що кодує білок, 25 який проходить клітинні мембрани, наприклад, VP22 або ТАТ, злитого з геном, який кодує білок, переважно токсичний по відношенню до ракових, але не нормальним клітин. Химерні аденовіруси за винаходом також можна використовувати як вектори для доставки генів, які кодують терапевтично придатні молекули РНК, тобто міРНК (Dorsett і Tuschl (2004) Nature Rev Drug Disc 3: 318-329). В деяких випадках, гени можна вбудовувати в химерний аденовірус за винаходом для додаткового посилення здатності онколітичного вірусу знищувати пухлину, хоча він не має прямий вплив на саму пухлину - такий варіант включає гени, що кодують білки, які порушують презентацію МНСІ класу (Hewitt і ін. (2003; Immunology 110: 163-169), блокують комплемент, інгібують інтерферони й механізми, індуковані інтерфероном, хемокіни й цитокіни, загибель на основі NK клітин (Orange і ін., (2002) Nature Immunol. 3: 1006-1012; Mireille і ін. (2002) Immunogenetics 54: 527-542; Alcami (2003) Nature Rev. Immunol. 3: 36-50; знижують відповідну імунну реакцію (наприклад IL-10, TGF-бета, Khong і Restifo (2002) Nature Immunol. 3: 999-1005; 2002) і металопротеази, які можуть руйнувати позаклітинний матрикс і підсилювати поширення вірусів у пухлині (Bosman і Stamenkovic (2003) J. Pathol. 2000: 423-428; Visse і Nagase (2003) Circulation Res. 92: 827-839). Набори Винахід також стосується фармацевтичних упаковок і наборів, які складаються з одного або декількох контейнерів, заповнених одним або декількома компонентами вказаних вище композицій, запропонованих у винаході. Такий(і) контейнер(и) повинен(ні) бути мати вкладиш у формі, встановленій урядовим органом, відповідальним за виробництво, застосування або продаж фармацевтичних або біологічних продуктів, у якому вказаний дозвіл цього органа на виробництво, застосування або продаж продукту для введення людині. Надалі даний винахід описаний за допомогою наступних прикладів, які ілюструють специфічні варіанти здійснення винаходу і їх різні застосування. Ці наведені приклади, які ілюструють окремі специфічні варіанти здійснення винаходу, не можуть розглядатися як такі, які яким-небудь чином обмежують обсяг розкритого винаходу. Якщо спеціально не вказано інакше, при практичному здійсненні винаходу використовують загальноприйняті техніки культури клітин, молекулярної біології, мікробіології, методики рекомбінантної ДНК, імунології, які знаходяться в компетенції середнього фахівця в даній галузі. Такі методики докладно пояснюються в літературі. Див., наприклад Cell Biology: a Laboratory Handbook: J. Celis (peд.). Academic Press. N.Y. (1996); Graham, F.L. і Prevec, L Adenovirus-based expression vectors and recombinant vaccines. B: Vaccines: New Approaches to Immunological Problems. R.W. Ellis (ред.) Butterworth. cтop.363390; Grahan and Prevec Manipulation of adenovirus vectors. B: Methods in Molecular Biology, том 7: Gene Transfer and Expression Techniques. E.J. Murray і J.M. Walker (ред.) Humana Press Inc., 89957 26 Clifton, N.J. стор.109-128, 1991; Sambrook і ін. (1989), Molecular Cloning, A Laboratory Manual, 2-е вид., Cold Spring Harbor Laboratory Press; Sambrook і ін. (1989), і Ausubel і ін. (1995), Short Protocols in Molecular Biology, John Wiley and Sons. Приклади Методи Стандартні методики використовуються для методів рекомбінантної нуклеїнової кислоти, синтезу полінуклеотидів і культивування й трансформації мікроорганізмів (наприклад, електропорація, ліпофекція). Звичайно ферментативні реакції й етапи очищення здійснюють відповідно до рекомендацій виробника. Техніки й методики здійснюють відповідно до методів, загальноприйнятим у даній галузі, різним розповсюдженим посиланням (див., в основному, Sambrook і ін., Molecular Cloning: A Laboratory Manual, 2-е видання (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.), які описані в цьому джерелі. Номенклатура, використовувана в даному описі, і лабораторні методики аналітичної хімії, хімії органічного синтезу й приготування лікарських засобів і доставки й лікування пацієнтів. Способи конструювання мутантів аденовірусів добре відомі в даній галузі. See, Mittal, S. K., Virus Res., 1993, том 28, стор.67-90; і Hermiston, T. і ін., Methods in Molecular Medicine: Adenovirus Methods and Protocols, під ред. W.S.M. Wold., Humana Press, 1999. Крім того, геном аденовірусу 5 зареєстрований у банку генів 10 під №М73260, і вірус доступний з Американської колекції типових культур, Rockville, Maryland, USA, під реєстраційним номером VR-5. Віруси й клітинні лінії Серотипи Ad Ad3 (штам GB), Ad4 (штам RI-67), Ad5 (штам Adenoid 75), Ad9 (штам Hicks), Ad11p (штам Slobitski), Ad16 (штам Ch.79) і всі клітинні лінії, за винятком наступних, одержували з АТСС: MDA231-mt1 (похідне, виділене Dr. Deb Zajchowski зі швидко зростаючих підшкірно ксенотрансплантованих клітин MDA231) і Pane1-set (отриманих Dr. Sandra Biroc зі швидко зростаючих підшкірно ксенотрансплантованих клітин Pane1), HUVEC (Vec Technologies, Rensselaer, NY), і SAEC (Clonetics, Walkersville, MD) Ad40 був люб'язно наданий Dr. William S.M. Wold із Сент-Луіського університету. Приклад 1 - Очищення й кількісний аналіз вірусів Маточні вірусні розчини розмножували на клітинах 293 і очищали на градієнтах CsCI (Hawkins і ін., 2001). Спосіб, використовуваний для кількісного аналізу вірусів, ґрунтувався на способі Shabram і ін. (1997) Human Gene Therapy 8: 453-465, за винятком того, що аніонообмінний ТМАЕ Fractogel використовували замість Resource Q. Коротко, колонку 1,25л завантажували Fractogel EMD ТМАЕ-650 (S) (кат. №116887-7 EM Science, Gibbstown, NJ 08027). Здійснювали ВЕРХрозділення на Agilent HP 1100 ВЕРХ у наступних умовах: буфер А=50мМ HEPES, рН7,5; буфер В= 1,0Μ NaCI у буфері А; швидкість потоку 1мл/хв. Після зрівноважування колонки протягом не мен9 11 ше 30 хвилин у буфері А, приблизно 10 -10 вірусних частинок зразка завантажували на колонку в 10-100мкл об'єму, потім завантажували 4 об'єми 27 колонки буфером А. Використовували лінійний градієнт, який простирається на 16 об'єми колонки, і завершували 100% буфером В. За витікаючими потоками із колонки спостерігали при А260 і А280нм, площі піків підраховували й визначали співвідношення 260 до 280нм. Вірусні піки ідентифікували як піки, що мають співвідношення А260/А280, близьке до 1,33. У кожну серію зразків включали вірусний стандарт. Кількість вірусних частинок на мл стандарту визначали за допомогою способу Lehmberg і ін. (1999) J. Chrom. В, 732: 411-423}. У діапазоні використовуваних вірусних концентрацій, площа піка при А260нм кожного зразка була прямо пропорційна до кількості вірусних частинок у зразку. Кількість вірусних частинок на мл у кожному тестованому зразку розраховували шляхом множення відомої кількості вірусних частинок на мл у стандарті на співвідношення площі вірусного піка зразка при А260нм до площі вірусного піка стандарту при А260нм. Колонку регенерували після градієнта кожного зразка шляхом промивання двома об'ємами колонки 0,5н. NaOH, потім двома об'ємами колонки 100% буфером А, 3 об'ємами колонки 100% буфером В, і після цього 4 об'ємами колонки 100% буфером А. Приклад 2 - Біоселекція Вірусні серотипи, які представляють підгрупи Ads B-F, об'єднували й пасивували на субконфлюентних культурах цільових пухлинних клітинних ліній при високому співвідношенні частинок на клітину протягом двох циклів для сприяння здійснення рекомбінації між серотипами. Потім супернатант (1,0; 0,1; 0,01; 0,001мл) із другого циклу інфікування при високому співвідношенні вірусних частинок на клітину, субконфлюентні культури, використовували для інфікування серій понадконфлюентних колб пухлинної культури Т-75 цільових пухлинних клітинних ліній РС-3, НТ-29, Раnс-1 і MDA-231 Для досягнення понадконфлюентності кожну клітинну лінію висівали при співвідношеннях розщеплення, що дозволяють досягти конфлюентності клітинними лініями протягом 24-40 годин після висівання, і клітини залишали рости в цілому протягом 72 годин після висівання перед інфікуванням. Це здійснювали для максимізування конфлюентності клітин для відтворення умов росту солідних пухлин у людей. Супернатант клітинної культури збирали з першої колби в серіях з 10-ти кратним розведенням, які не проявляли ніяких ознак СРЕ на 3-ій або 4-ий день після інфікування (у випадку НТ-29 і РС3, їх модифікували для пасажів 10-20 для збору із другої колби, тобто збирали при 100-кратному розведенням нижче розведення, при якому виявляється СРЕ на 3-ій день після інфікування). Кожний збір служив як вихідний матеріал для наступного пасажу вірусу. Цей процес повторювали до тих пір, поки вірусний пул не досягав 20 біоселективних пасажів. Характерні віруси для кожного біоселектованого пулу виділяли шляхом здійснення очищення бляшок у два етапи на клітинах А549 за допомогою стандартних способів (Tollefson, Α., Hermiston, T.W., і Wold, W.S.M.; "Preparation and Titration of 89957 28 CsCI-banded Adenovirus Stock" в Adenovirus Methods and Protocols. Humana Press, 1999, стор. 1-10, під ред. W.S.M. Wold). Коротко, для інфікування клітин А549 використовували розведення супернатанту, зібраного з 20-ого пасажу, на кожній цільовій пухлинній клітинній лінії в стандартному аналізі бляшкоутворення. Добре видимі бляшки збирали й аналогічний метод бляшкоутворення використовували для одержання другого циклу характерних бляшок із цих зборів. Ретельно виділені бляшки із другого циклу очищення бляшок вважали чистими, інфіковані культури готували за допомогою цих очищених бляшок, і визначали онколітичну ефективність цих культуральних супернатантів за допомогою MTS-аналізу, як описано. Приклад 3 - Характеристика серотипу Батьківські аденовірусні серотипи, які містять вірусні пули або виділений аденовірус ColoAd1, ідентифікували за допомогою аніонообмінної хроматографії аналогічно до описаного в Shabram і ін. (1997) Human Gene Therapy 8 453:465, за винятком того, що використовували аніонообмінне середовище ТМАЕ Fractogel (EM Industries, Gibbstown, NJ) замість Resource Q, як описано в прикладі 1 (див. Фіг.1). Аденовірус 5 типу елюювався приблизно при 60% буфері В при градієнті. Інші серотипи (3, 4, 9, 11р, 16, 35, і 40) кожний елююювався при характерному часі утримання, що відповідає часам утримання на Q Sepharose XL, опублікованим Blanche і ін. (2000) Gene Therapy 7: 1055-1062. Приклад 4 - Цитолітичний аналіз Літичну здатність вірусів визначали за допомогою модифікованого МТТ-аналізу (Shen і ін., 2001). Коротко, MTS-аналіз (Promega, CellTiter 96® водний нерадіоактивний аналіз проліферації клітин) використовували замість МТТ-аналізу, тому що перетворення клітинами MTS у водному, розчинному формазані зменшує час і дозволяє уникнути використання летучого органічного розчинника, пов'язаного з МТТ-аналізом. Для здійснення цього дослідження клітини висівали при заданій щільності для кожної пухлинної клітинної лінії таким чином, щоб одержати моношар протягом 24 годин. Цим щільно висіяним клітинам дозволяли рости додатково протягом 2 днів перед обробкою тестованим (йми) вірусом (ами). Інфікування як пухлинних, так і первинних нормальних клітин здійснювали в чотирьох повторах при серійних трикратних розведеннях вірусів, починаючи зі співвідношення частинок на клітину 100 і закінчуючи співвідношенням частинок на клітину 0,005. Інфіковані клітини інкубували при 37°С і здійснювали MTS-аналіз у моменти часу, вказані для конкретних ліній первинних або пухлинних клітин. Несправжньо-інфіковані клітини були негативним контролем і встановлювали точку 100% виживання в даному дослідженні. Приклад 5 - Секвенування ДНК Секвенування ДНК Ad11p (SEQ ID NO: 2) і Colo Ad 1 (SEQ ID NO: 1) геномних ДНК здійснювали в такий спосіб. Коротко, очищену кДНК аденовірусу з ColoAd1 і Ad11p частково розщеплювали за допомогою рестрикційної ендонулкеази Sau3A1 і зроблений навмання фрагмент клону вал 29 и в плазмідному векторі pBluescript II (Stratagene, La Jolla, CA). Позитивні клони розмножували й секвенуовали за допомогою праймерів M13R і KS (Stratagene, La Jolla, СА). Окремі послідовності реакцій обрізали, відкоригували й збирали за доlm помогою Sequencher (Gene Codes Corp., Ann Arbor, Мічиган). Проломи в покритті амліфікували за допомогою звичайних олігонуклеотидних праймерів і секвенували. Кінці вірусних геномів відсеквеновували безпосередньо з аденовірусної ДНК. У підсумку, кожний геном секвенували при 3Х+ покриття й 431 основ при 2Х покритті. Для визначення початку Е2В ділянки ColoAd1 одержували два набори праймерів, один до гена рТР Е2В (п.о.9115, S'GGGAGTTTCGCGCGGACACGGS' (SEQ ID NO: 4) і п.о. 9350, 5' GCGCCGCCGCCGCGGAGAGGT3' (SEQ ID NO: 5)) і один до гена ДНК-полімерази (п.о. 7520 5'CGAGAGCCCATTCGTGCAGGTGAG3' (SEQ ID NO: 6) і по 7982, 5'GCTGCGACTACTGCGGCCGTCTGT3' (SEQ ID NO: 7) і використовували ПЛР для виділення фрагментів ДНК із різних серотипів (Ad3,4,5,9,11p,16 і 40), застосовуючи реагенти із ПЛР-набору Advantage 2 PCR (Clonetics, Walkersville, MD; кат. №K1910-Y) і проганяючи в термоциклі РТС-200 від MJ Research (Watertown, MA). Потім ці фрагменти секвенували вздовж послідовності ДНК Ad3, використовуючи барвник термінатора секвенування на генетичному аналізаторі АВІ 3100. Ділянку Е2В Ad3 секвенували за допомогою виділеної ДНК Ad3 і праймерів, які перекриваються. Інформацію, отриману при секвенуванні, аналізували за допомогою програми Vector NTI (Informatix). Приклад 6 - Конструювання рекомбінантних вірусів Геномні ДНК Ad11p (SEQ ID NO: 2) і ColoAd1 (SEQ ID NO: 1) очищали від вірусних частик у стрічковому градієнті CsCI. Геномні ДНК розщеплювали за допомогою Расі, що розрізає кожну молекулу тільки один раз у межах вірусного гена. Розрізання Pad відбувається на основі 18141 у нуклеотидній послідовності ColoAd1 (SEQ ID NO: 1) і на основі 18140 у нуклеотидній послідовності Ad11 (SEQ ID NO: 2). Розщеплені ДНК змішували в рівних кількостях і лігували в присутності ДНК-лігази Т4 при 16°С протягом ночі. Цю лігуючу суміш трасфектували в клітини А549 за допомогою СаРО4 набору для трансфекції від Invitrogen, Carlsbad, СА (кат. 89957 30 №K2780-01). Виділені бляшки знімали й скринували шляхом розщеплення рестрикційним ферментом і аналізували за допомогою ПЛР для розрізнення чотирьох вірусних популяцій (Ad11p, ColoAd1, лівий кінець AdHp/правий кінець ColoAd1 (ColoAd1.1) і лівий кінець ColoAd1/правий кінець Ad11p(ColoAd1.2)). Літичну здатність вірусів кожної популяції визначали в декількох клітинних лініях, включаючи клітинні лінії НТ29 і HUVEC, як описано в прикладі 3. Отримані результати свідчать про наявність діапазону ефективності, від найменш сильнодіючих до найбільш сильнодіючих, як Ad11p, ColoAd1.2, ColoAd1.1, ColoAd1 (див. Фіг.7 для результатів у клітинах НТ29). Також конструювали химерні аденовіруси рСЛ44 і pCJ146, що містять повнорозмірний геном ColoAd1, у якому відновлювали ділянки дикого типу Ad11 ρ ЕЗ і Е4, відповідно. Ці модифікації вносили шляхом гомологічної рекомбінації в BJ5183 Е. Coli (Chartier і ін. (1996) J. Virol. 70: 48054810). Обидва ці химерні аденовірусу демонстрували зменшену літичну активність у клітинах НТ29 і HUVEC у порівнянні з ColoAd1 або ColoAd1.2. Приклад 7 - Ефективність аденовірусів в умовах in vivo У характерному дослідженні на ксенотрансплантованої пухлини людини в безшерстих мишей, тварин інфікували шляхом підшкірного введення 6 мишам 5 10 клітин у задній бік. При досягненні пухлинами розміру 100-200 мкл їм вводили напов10 нювач (ФСБР) або вірус у кількості 2 10 частинок 11 протягом п'яти послідовних днів (усього 1 10 частинок). Слід відзначити зменшення розміру пухлини відносно ФСБР контролю й додаткових контрольних вірусів (Ad5, ONYX-015). Приклад 8 - Селективність ColoAd1 на первинних експлантатах пухлини людини Зразки тканини, вилучені при хірургічному втручанні з колоректальних пухлин і сусідніх нормальних тканин, поміщали в культуральне середовище й інфікували однаковою кількістю вірусів ColoAd1 або Ad5. Через 24 години після інфікування збирали культуральні супернатанти й визначали утворену кількість вірусних частинок. ColoAd1 утворювали більшу кількість вірусних частинок відносно введених частинок, ніж Ad5, у тканині пухлини, але меншу кількість частинок відносно введених частинок, ніж Ad5, у нормальній тканині. 31 89957 32 33 89957 34 35 89957 36 37 89957 38 39 89957 40 41 89957 42 43 89957 44 45 89957 46 47 89957 48 49 89957 50 51 89957 52 53 89957 54 55 89957 56 57 89957 58 59 89957 60
ДивитисяДодаткова інформація
Назва патенту англійськоюChimeric adenoviruses for use in cancer treatment
Автори англійськоюHARDEN PAUL, HERMINSTON TERRY, KUHN IRENE
Назва патенту російськоюХимерные аденовирусы для применения для лечения злокачественного новообразования
Автори російськоюХарден Пол, Хермистон Тэрри, Кун Ирене
МПК / Мітки
МПК: C12N 7/01, C12N 7/02, C12N 15/861, A61K 48/00
Мітки: аденовіруси, химерні, лікування, новоутворення, злоякісного, застосування
Код посилання
<a href="https://ua.patents.su/60-89957-khimerni-adenovirusi-dlya-zastosuvannya-dlya-likuvannya-zloyakisnogo-novoutvorennya.html" target="_blank" rel="follow" title="База патентів України">Химерні аденовіруси для застосування для лікування злоякісного новоутворення</a>
Попередній патент: Пристрій для перетворення енергії згустку плазми сферичної форми у електроенергію за о.о.нахабою
Наступний патент: Спосіб та пристрій для спрощеного здійснення електронних покупок за допомогою домашніх терміналів здійснення покупок
Випадковий патент: Розбірна ложка для приготування напоїв