Сполуки-інгібітори parp, композиції та їх застосування
Номер патенту: 99483
Опубліковано: 27.08.2012
Автори: Вай Лінґ, Су Вайженґ, Жанґ Джі, Делаханті Ґреґ
Формула / Реферат
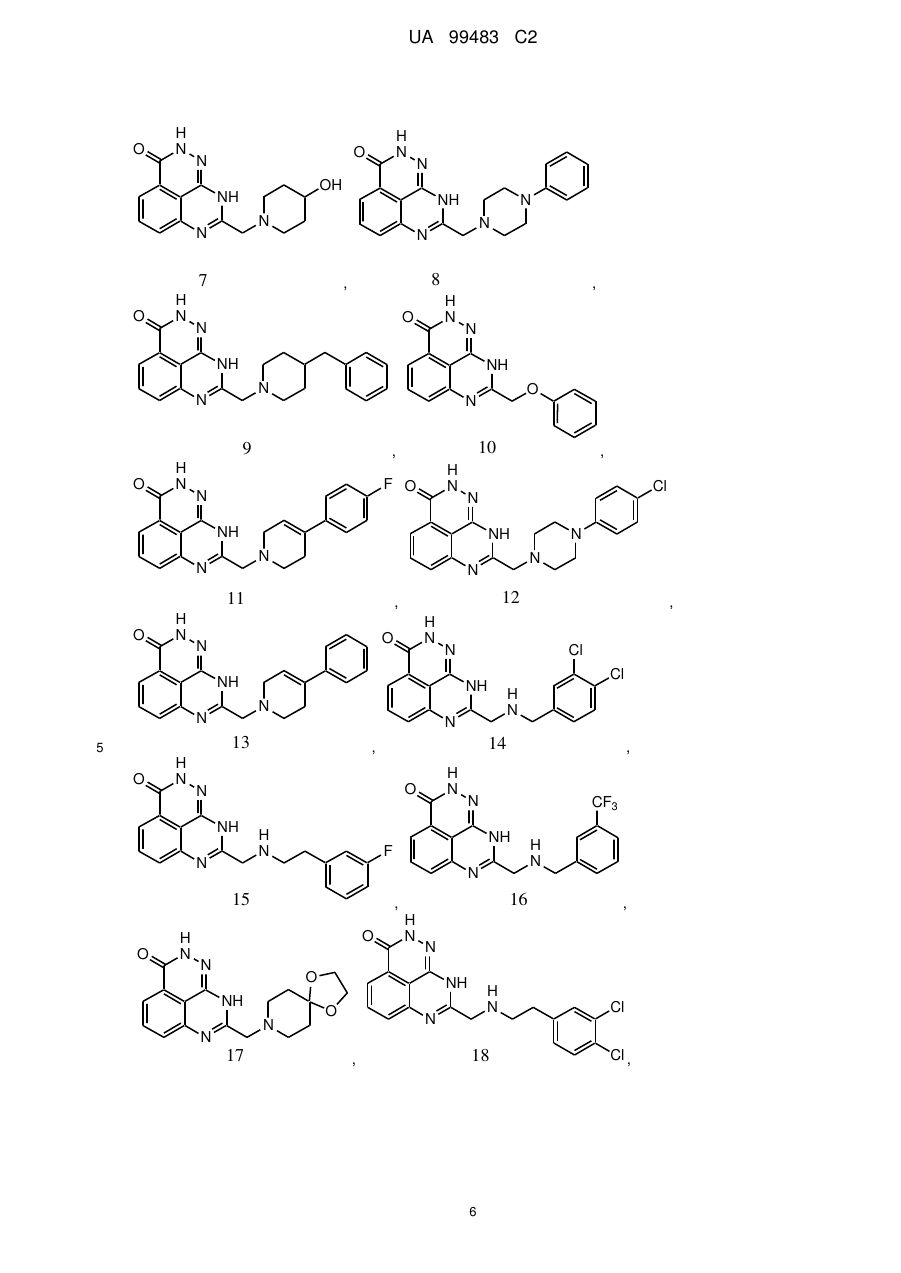
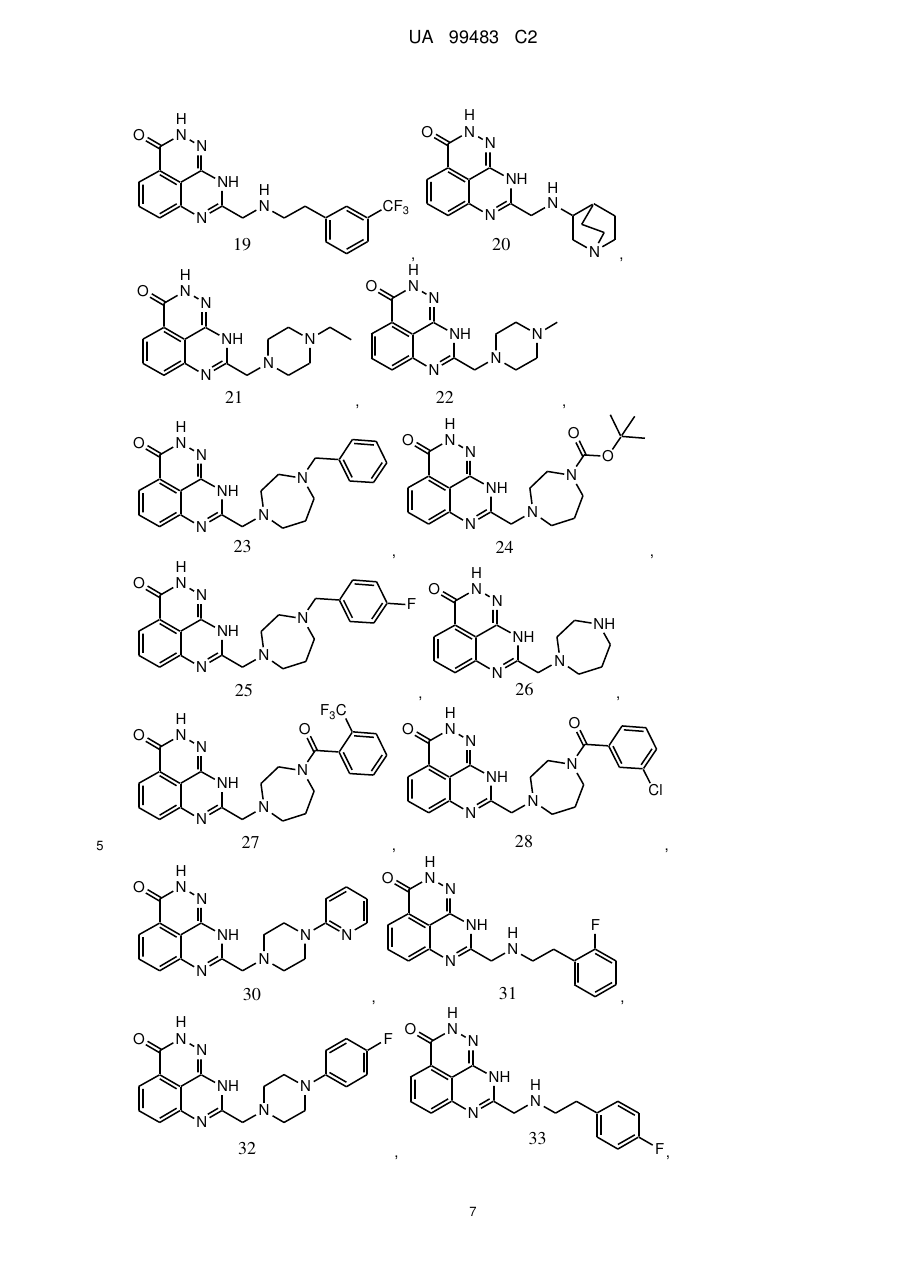
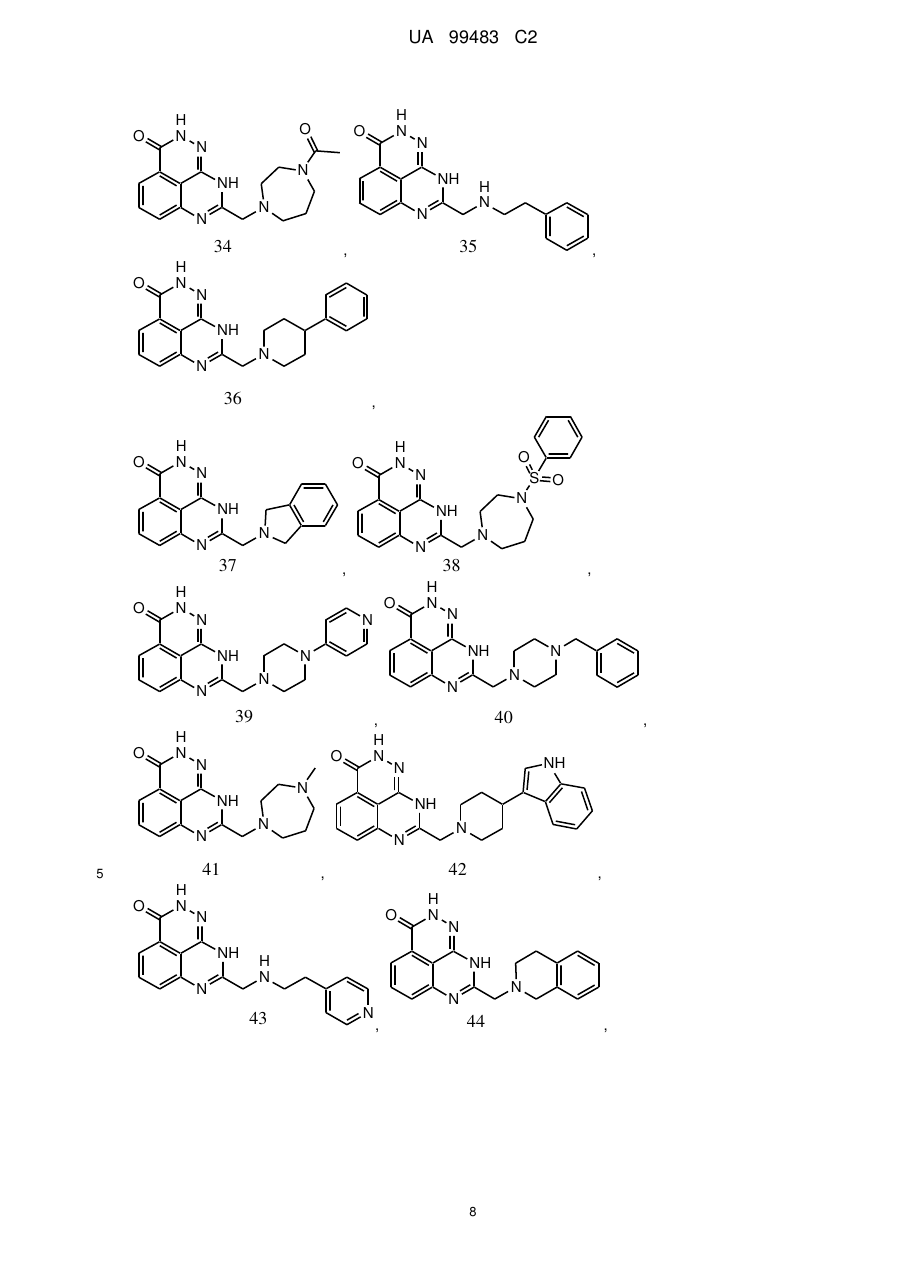
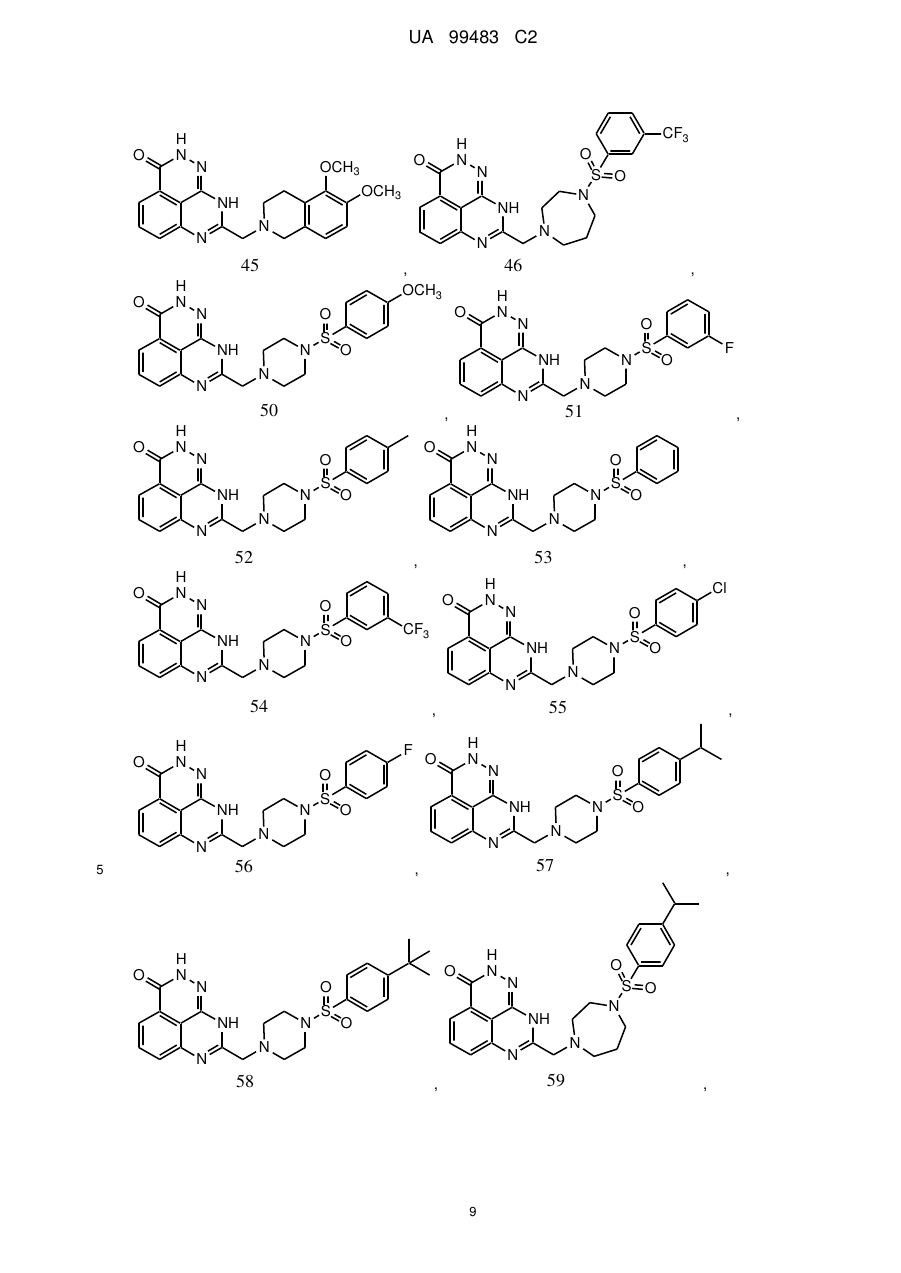
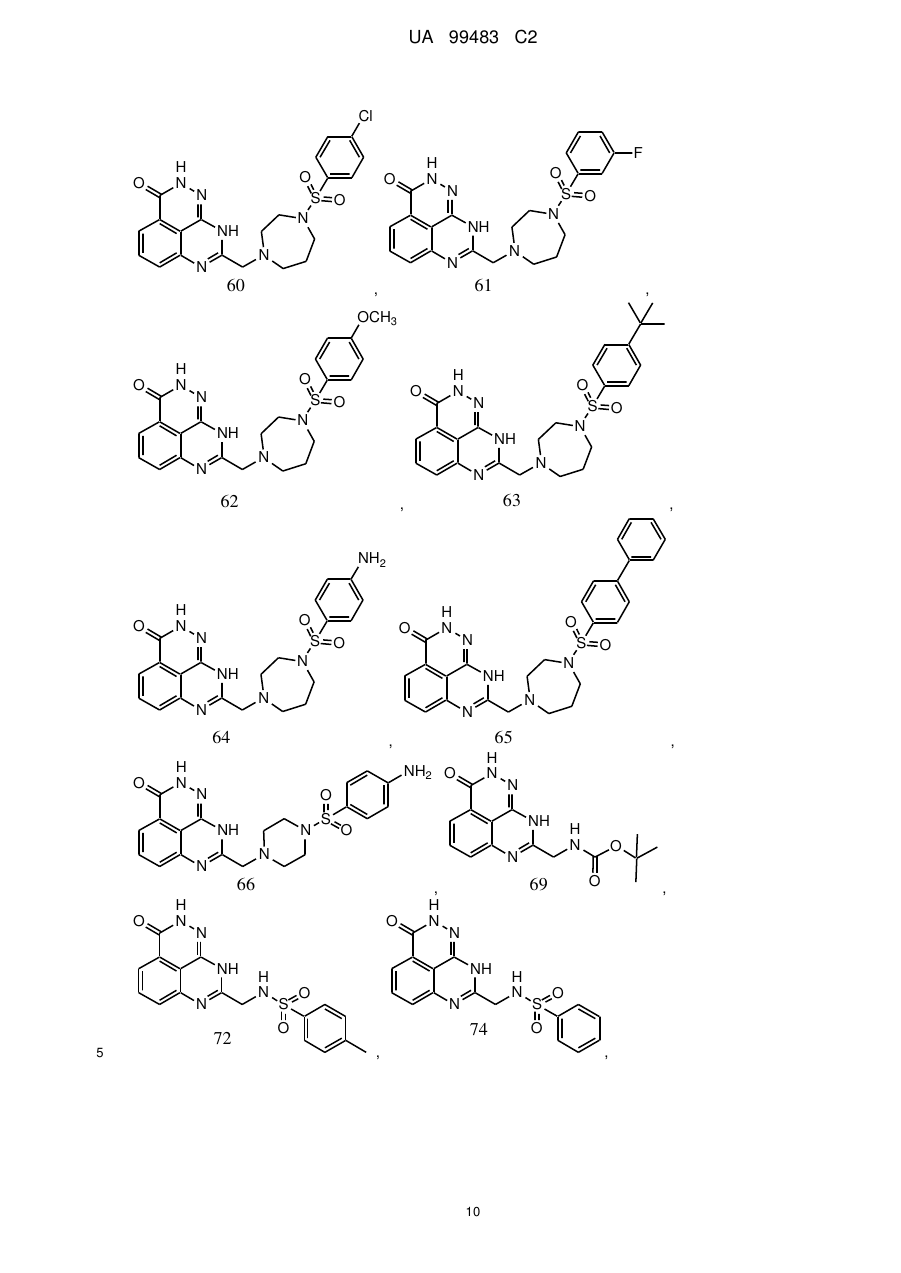
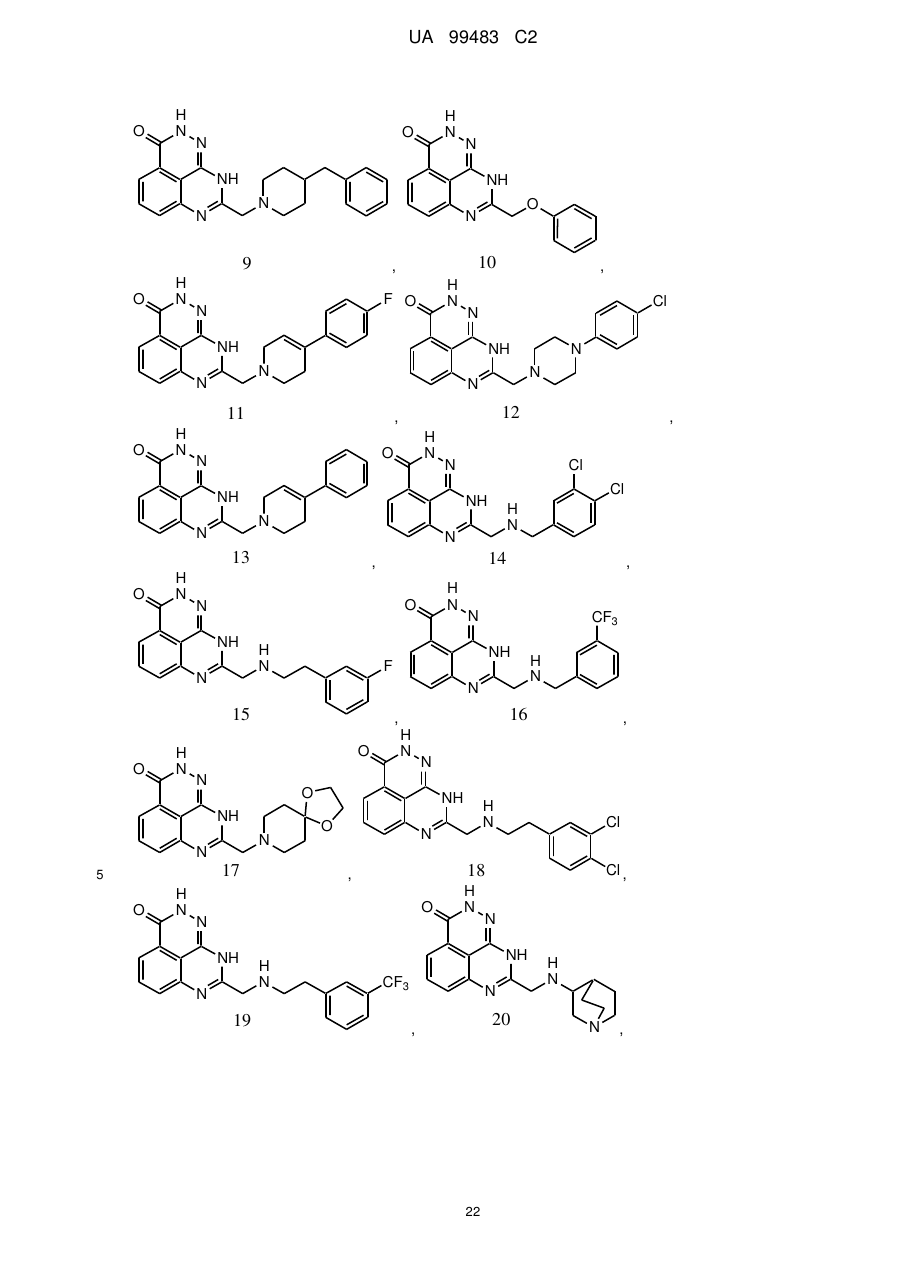
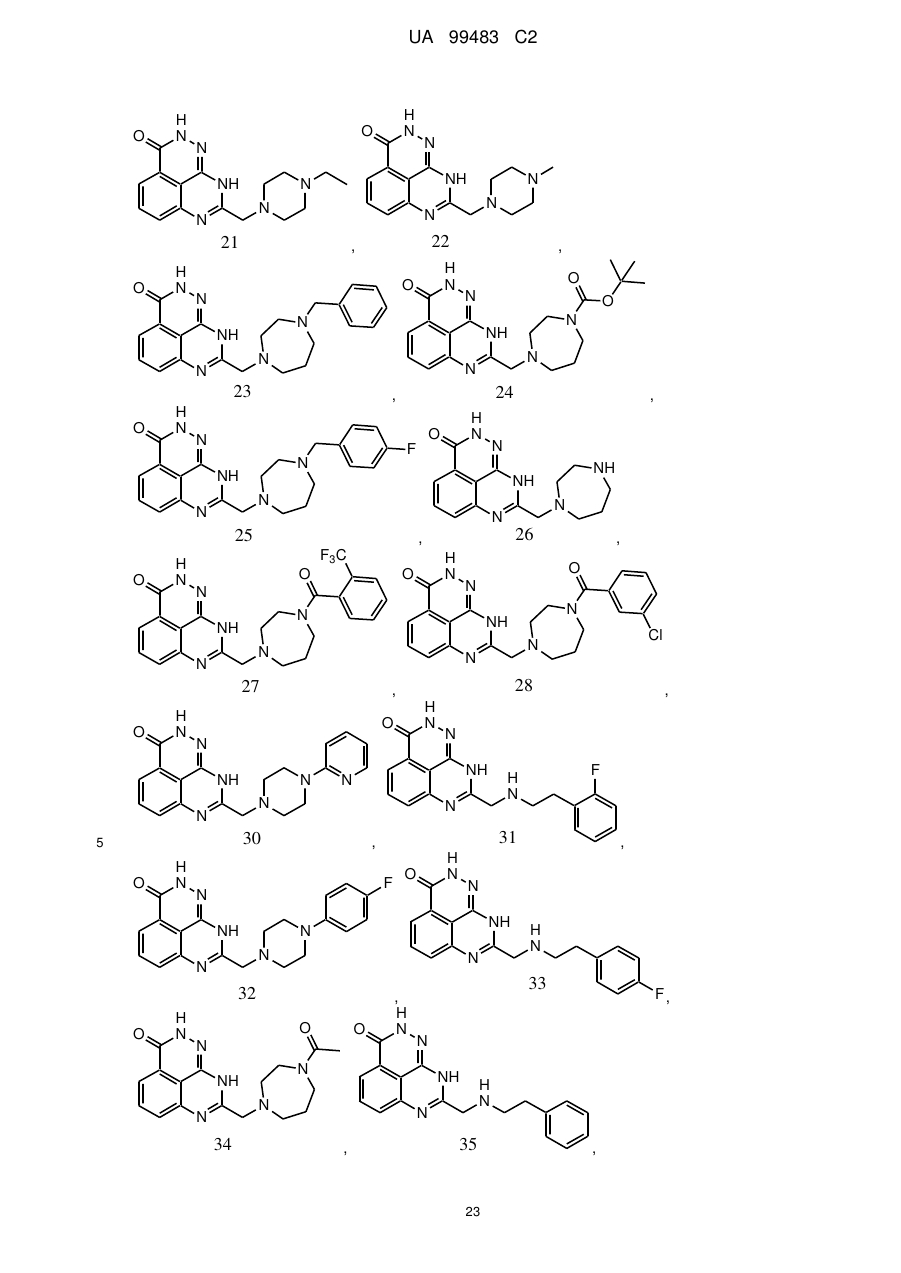
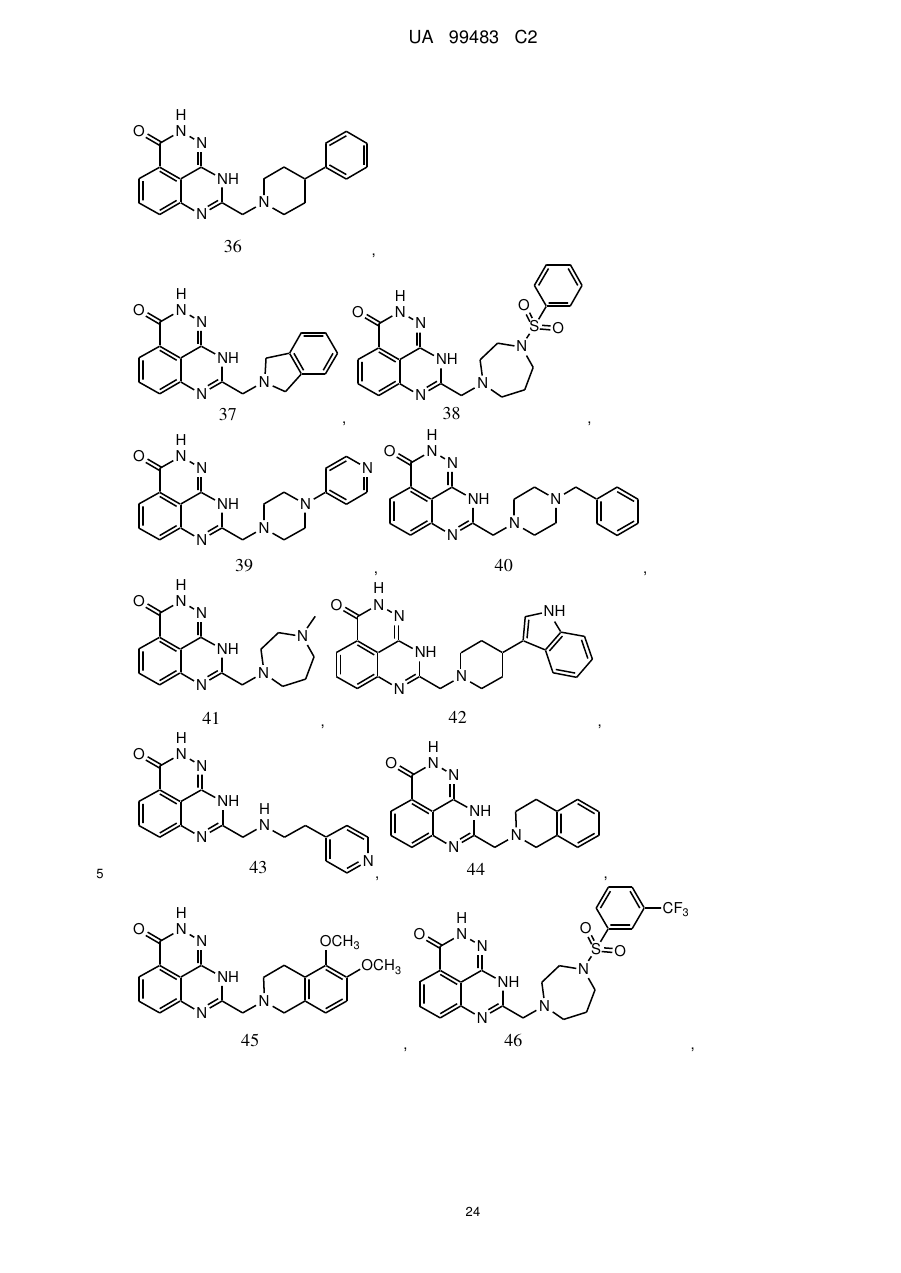
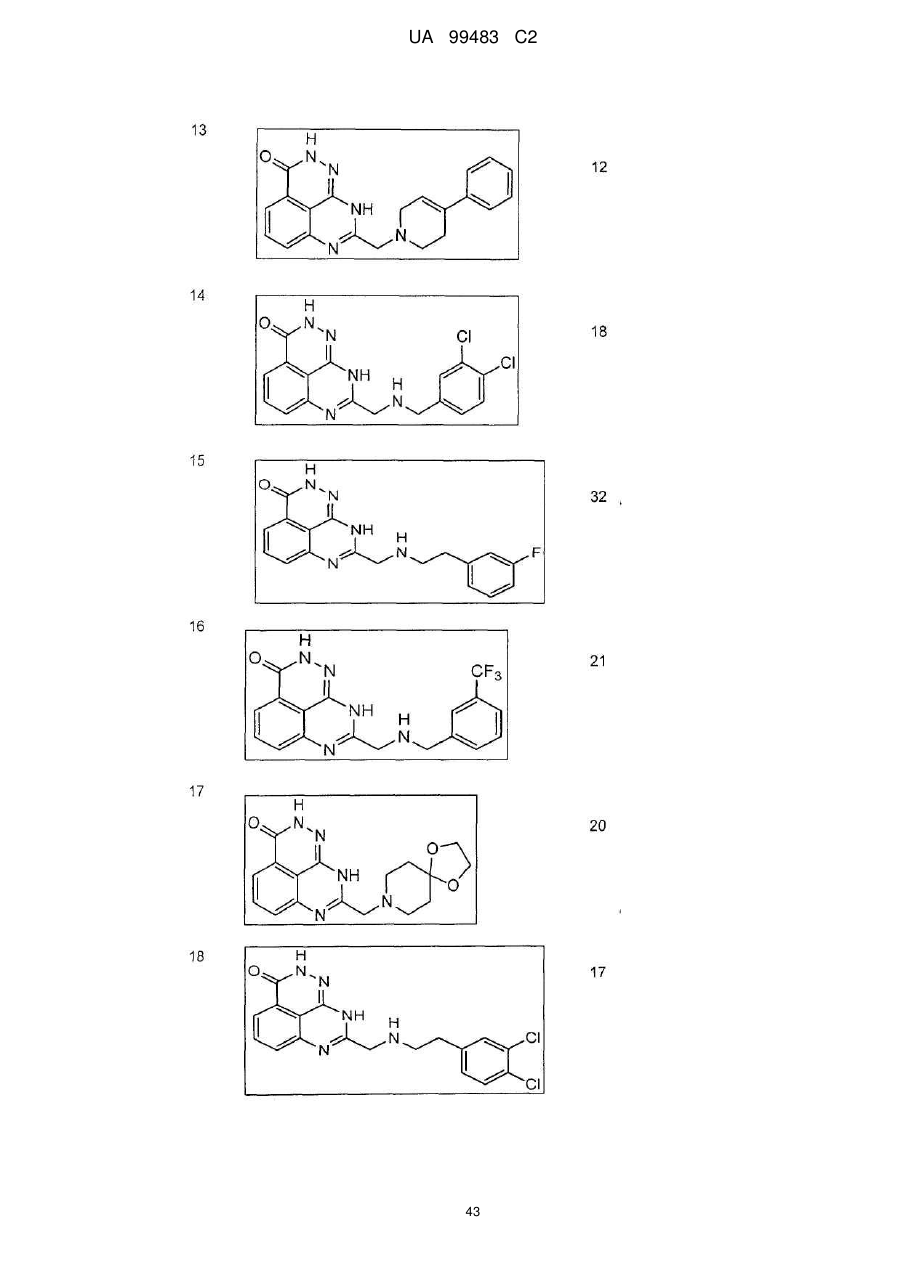
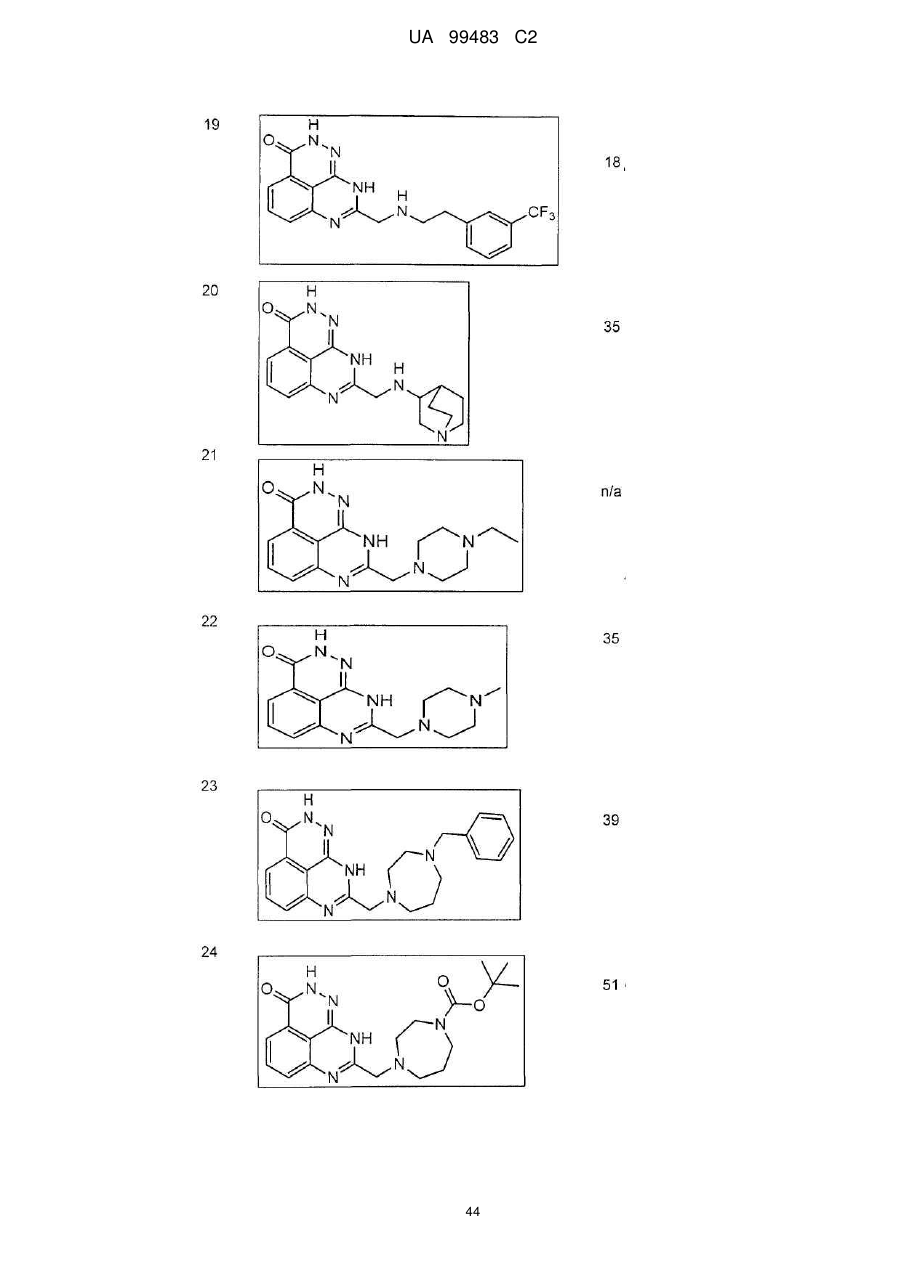
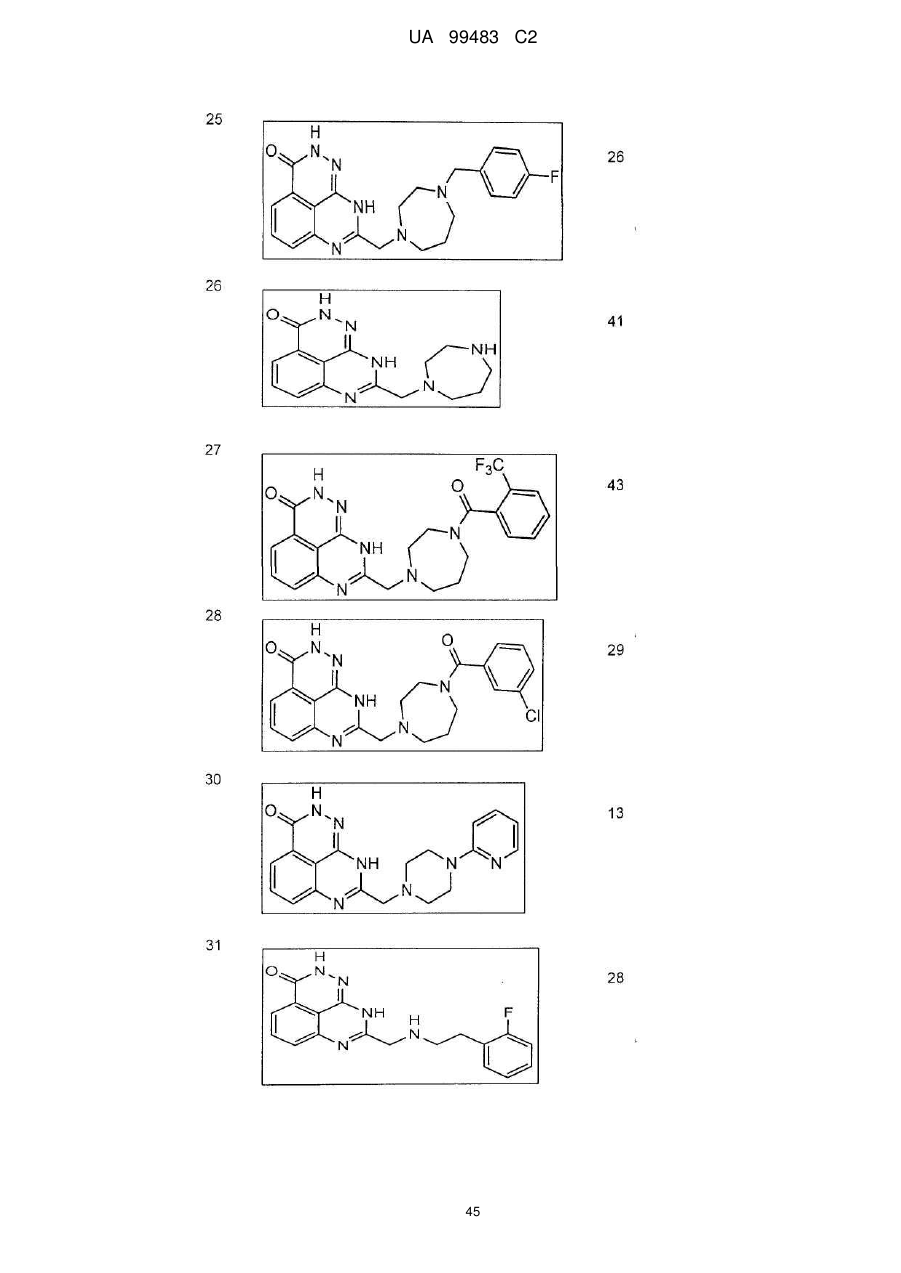
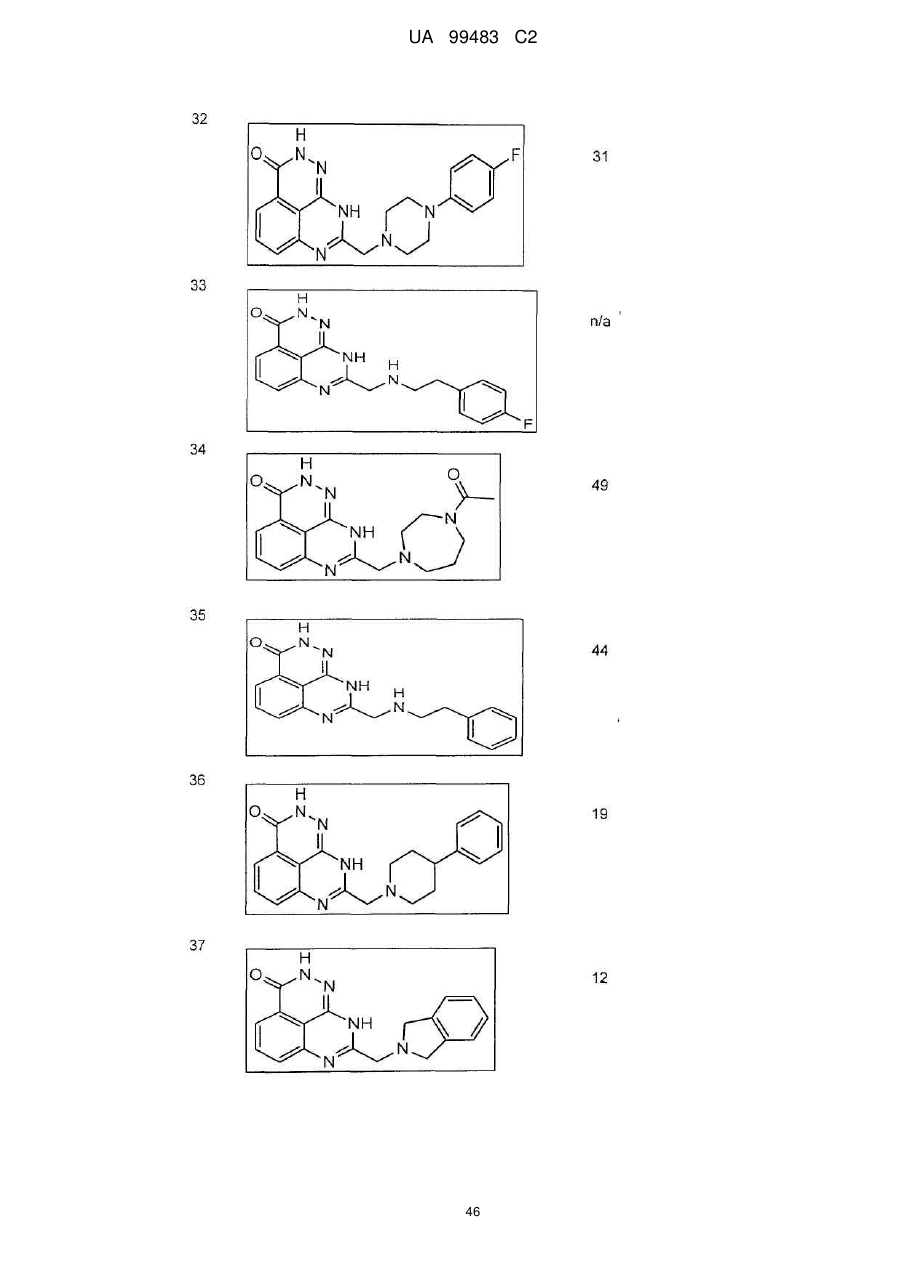
1. 8-(1,3-Дигідроізоіндол-2-ілметил)-2,9-дигідро-1,2,7,9-тетраазафенален-3-он формули
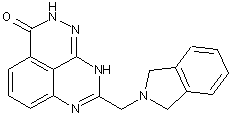
або його фармацевтично прийнятна сіль, естер, сольват або гідрат.
2. Сполука за п. 1, де сполука являє собою фармацевтично прийнятну сіль, естер, сольват або гідрат 8-(1,3-дигідроізоіндол-2-ілметил)-2,9-дигідро-1,2,7,9-тетраазафенален-3-ону.
3. Сполука за п. 1, де сполука являє собою фармацевтично прийнятну сіль 8-(1,3-дигідроізоіндол-2-ілметил)-2,9-дигідро-1,2,7,9-тетраазафенален-3-ону.
4. Сполука за п. 3, де фармацевтично прийнятна сіль включає органічну кислоту.
5. Сполука за п. 1, де сполука являє собою по суті 8-(1,3-дигідроізоіндол-2-ілметил)-2,9-дигідро-1,2,7,9-тетраазафенален-3-он.
6. Сполука за будь-яким з пп. 1-5, яку застосовують для хімічної або радіоактивної сенсибілізації ракових клітин у ссавця, якому потрібна хіміотерапія або радіаційна терапія, відповідно.
7. Сполука за п. 6, де згаданий ссавець - це людина.
8. Сполука за п. 6 або п. 7, де ракові клітини вибрані з групи, що складається з пухлин, що виробляють АСТН (адренокортикотропний гормон - АКТГ), гострого лімфолейкозу, гострого нелімфоцитарного лейкозу, раку кори надниркових залоз, раку сечового міхура, раку головного мозку, раку молочної залози, раку шийки матки, хронічного лімфолейкозу, хронічного мієлолейкозу, раку товстої кишки, Т-клітинної лімфоми шкіри, ендометріального раку (раку внутрішності матки), раку стравоходу, саркоми Евінга, раку жовчного міхура, волосатоклітинного лейкозу, раку шиї та голови, лімфоми Ходжкіна, саркоми Капоші, раку нирки, раку печінки, раку легенів (дрібноклітинного та/або недрібноклітинного), злоякісної перитонеальної ефузії, злоякісної плевральної ефузії, меланоми, мезотеліоми, множинної мієломи, нейробластоми, неходжкінської лімфоми, остеосаркоми, раку яєчника, яєчникового раку (статевих клітин), раку простати, раку підшлункової залози, раку статевого члена, ретинобластоми, раку шкіри, саркоми м'якої тканини, плоскоклітинного раку, раку шлунка, раку яєчка, раку щитовидної залози, трофобластичних пухлин, раку матки, вагінального раку, раку піхви та пухлини Уїлма.
9. Сполука за п. 8, де ракові клітини вибрані з Т-клітинної лімфоми шкіри, лімфоми Ходжкіна та неходжкінської лімфоми.
10. Сполука за п. 8, де ракові клітини вибрані з гострого лімфолейкозу, гострого нелімфоцитарного лейкозу, хронічного лімфолейкозу та хронічного мієлолейкозу.
11. Сполука за п. 8, де ракові клітини являють собою множинну мієлому.
12. Сполука за будь-яким з пп. 1-5, яку застосовують при лікуванні ссавця, який має рак, що характеризується як рак, який має дефект у гомологічному рекомбінаційному (HR) шляху репарації дволанцюгової ДНК.
13. Сполука за п. 12, де згаданий ссавець - це людина.
14. Сполука за п. 12 або 13, де рак має фенотип, вибраний з групи, що складається з і) дефекту BRCA-1, іі) дефекту BRCA-2, ііі) дефекту BRCA-1 та BRCA-2, та iv) анемії Фанконі.
15. Сполука за будь-яким з пп. 12-14, де рак вибраний з раку молочної залози або раку яєчника.
16. Сполука за будь-яким з пп. 1-5, яку застосовують для лікування раку.
17. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-5 та фармацевтично прийнятний носій.
18. Фармацевтична композиція за п. 17, яка додатково містить хіміотерапевтичний засіб, вибраний з групи, що складається з темозоломіду, адріаміцину, камптотецину, карбоплатину, цисплатину, даунорубіцину, доцетакселу, доксорубіцину, інтерферону-альфа, інтерферону-бета, інтерферону-гамма, інтерлейкіну 2, іринотекану, паклітакселу, топотекану, таксоїдів, дактиноміцину, данорубіцину, 4'-дезоксидоксорубіцину, блеоміцину, пілкаміцину, мітоміцину, неоміцину, гентаміцину, етопозиду, 4-ОН циклофосфаміду, платинового координаційного комплексу та їх сумішей.
19. Фармацевтична композиція за п. 18, де згаданий хіміотерапевтичний засіб - це темозоломід або його сіль.
20. Фармацевтична композиція за п. 18, де згаданий хіміотерапевтичний засіб - це паклітаксел та карбоплатин.
21. Фармацевтична композиція за будь-яким з пп. 17-19, яку застосовують для хімічної або радіоактивної сенсибілізації ракових клітин у ссавця, якому потрібна хіміотерапія або радіаційна терапія, відповідно.
22. Фармацевтична композиція за п. 21, де згаданий ссавець - це людина.
23. Фармацевтична композиція за п. 21 або 22, де ракові клітини вибрані з групи, що складається з пухлин, що виробляють АСТН (адренокортикотропний гормон - АКТГ), гострого лімфолейкозу, гострого нелімфоцитарного лейкозу, раку кори надниркових залоз, раку сечового міхура, раку головного мозку, раку молочної залози, раку шийки матки, хронічного лімфолейкозу, хронічного мієлолейкозу, раку товстої кишки, Т-клітинної лімфоми шкіри, ендометріального раку (раку внутрішності матки), раку стравоходу, саркоми Евінга, раку жовчного міхура, волосатоклітинного лейкозу, раку шиї та голови, лімфоми Ходжкіна, саркоми Капоші, раку нирки, раку печінки, раку легенів (дрібноклітинного та/або недрібноклітинного), злоякісної перитонеальної ефузії, злоякісної плевральної ефузії, меланоми, мезотеліоми, множинної мієломи, нейробластоми, неходжкінської лімфоми, остеосаркоми, раку яєчника, яєчникового раку (статевих клітин), раку простати, раку підшлункової залози, раку статевого члена, ретинобластоми, раку шкіри, саркоми м'якої тканини, плоскоклітинного раку, раку шлунка, раку яєчка, раку щитовидної залози, трофобластичних пухлин, раку матки, вагінального раку, раку піхви та пухлини Уїлма.
24. Фармацевтична композиція за п. 23, де ракові клітини вибрані з Т-клітинної лімфоми шкіри, лімфоми Ходжкіна або неходжкінської лімфоми.
25. Фармацевтична композиція за п. 23, де ракові клітини вибрані з гострого лімфолейкозу, гострого нелімфоцитарного лейкозу, хронічного лімфолейкозу або хронічного мієлолейкозу.
26. Фармацевтична композиція за п. 23, де ракові клітини являють собою множинну мієлому.
27. Фармацевтична композиція за будь-яким з пп. 17-19, яку застосовують для лікування ссавця, який має рак, що характеризується як рак, який має дефект у гомологічному рекомбінаційному (HR) шляху репарації дволанцюгової ДНК.
28. Фармацевтична композиція за п. 27, де згаданий ссавець - це людина.
29. Фармацевтична композиція за п. 27 або 28, де рак має фенотип, вибраний з групи, що складається з і) дефекту BRCA-1, іі) дефекту BRCA-2, ііі) дефекту BRCA-1 та BRCA-2, та iv) анемії Фанконі.
30. Фармацевтична композиція за будь-яким з пп. 13-15, яку застосовують для лікування раку.
Текст
Реферат: Представлений винахід стосується 8-(1,3-дигідроізоіндол-2-ілметил)-2,9-дигідро-1,2,7,9тетраазафенален-3-ону формули O H N N NH N N , який інгібує полі(АDР-рибоза)полімеразу (PARP) та який застосовують для хімічної сенсибілізації протиракових терапевтичних засобів, для підвищення ефективності хіміотерапевтичних засобів, таких як темозоломід, для радіоактивної сенсибілізації пухлинних клітин до іонізуючої радіації, для лікування різних видів раку з дефектами репарації ДНК. UA 99483 C2 (12) UA 99483 C2 UA 99483 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід стосується сполук тетраазафенален-3-ону, які інгібують полі(ADPрибоза)полімеразу (PARP). Цей винахід стосується інгібіторів ядерної ферментної полі(аденозин 5’-дифосфорибоза)полімерази ["полі(ADP-рибоза)полімерази" або "PARP"], яка також позначається як ADPRT (NAD:білок-(ADP-рибозилтрансфераза (полімеризаційна)) та PARS (полі(ADPрибоза)синтетаза), та ним пропонуються сполуки та композиції, що містять описані сполуки. Крім того, цим винаходом пропонуються способи застосування описаних інгібіторів PARP для лікування раку. Існує суттєвий інтерес щодо розробки інгібіторів PARP як хімічних сенсибілізуючих засобів для застосування при лікуванні раку та для обмеження руйнування клітин після ішемії або ендотоксичного стресу. Зокрема, підсилення цитотоксичності темозоломіду, яке спостерігалося під час доклінічних досліджень з сильними інгібіторами PARP-1, відбиває інігібування репарації шляхом вищеплення основи (ексцизійної репарації) та наступну цитотоксичність внаслідок 7 3 неповного процесингу N -метилгуаніну та N -метиладеніну. Зараз існує набір доклінічних даних, які демонструють, що цитотоксичність темозоломіду підсилюється внаслідок спільного введення інгібітору PARP або in vitro, або in vivo. Plummer, et al., Clin. Cancer Res., 11(9), 3402 (2005). Темозоломід, ДНК-метилуючий агент, індукує руйнування ДНК, яка відновлюється внаслідок 6 репарації шляхом вищеплення основи, що залежить від О -алкілгуанін-алкілтрансферази (АТази) та полі(ADP-рибоза)полімерази-1 (PARP-1). Темозоломід - це пероральний доступний монофункціональний ДНК-алкілуючий агент, що застосовується для лікування гліом та злоякісних меланом. Темозоломід швидко абсорбується та зазнає спонтанного розпаду, внаслідок чого утворюється активний монометилтриазен, 5-(3-метил-1-триазено)імідазол-4карбоксамід. Монометилтриазен утворює декілька продуктів метилування ДНК, при цьому домінуючими 7 3 6 продуктами є N -метилгуанін (70%), N -метиладенін (9%) та O -метилгуанін (5%). Якщо він не 6 6 відновлюється О -алкілгуанін-алкілтрансферазою, О -метилгуанін є цитотоксичним внаслідок неправильного з’єднання з тиміном під час реплікації ДНК. Це неправильне з’єднання розпізнається на дочірньому ланцюгу білками невідповідної репарації та вирізаним тиміном. 6 Проте, якщо оригінальний нуклеотид О -метилгуаніну у батьківському ланцюгу не відновлюється внаслідок АТаза-опосередкованого видалення метилового адукту, тимін можна знов вставити. Повторні марні раунди вирізання та включення тиміну стосовно невідновленого 6 нуклеотиду О -метилгуаніну стають причиною стану постійного руйнування ланцюга, та гілка MutS системи невідповідної репарації сигналізує про припинення клітинного циклу G2-M та про 7 початок апоптозу. Кількісно більш важливі продукти алкілування нуклеотиду, N -метилгуанін та 3 N -метиладенін, утворені темозоломідом, швидко відновлюються завдяки репарації шляхом вищеплення основи. Plummer, et al., Clin. Cancer Res., 11(9), 3402 (2005). Хімічна сенсибілізація інгібіторами PARP не обмежується темозоломідом. Взагалі, цитотоксичні ліки або радіація можуть індукувати активацію PARP-1, та було продемонстровано, що інгібітори PARP-1 можуть підсилювати руйнування ДНК та цитотоксичні ефекти хіміотерапії та опромінювання. Kock, et al., 45 J. Med. Chem. 4961 (2002). Опосередкована PARP-1 репарація ДНК як реакція на засоби, що руйнують ДНК, представляє механізм стійкості до ліків у пухлинах, та було продемонстровано, що інгібування цього ферменту підсилює активність іонізуючої радіації та декількох цитотоксичних протипухлинних засобів, які включають темозоломід та топотекан. Suto зі співавторами у патенті США № 5177075 описують декілька ізохінолінів, що застосовуються для підсилення летального впливу іонізуючої радіації або хіміотерапевтичних засобів на пухлинні клітини. Weltin зі співавторами у роботі "Effect of 6(5H)Phenanthridinone, an Inhibitor of Poly(ADP-ribose) Polymerase, on Cultured Tumor Cells", Oncol. Res., 6:9, 399-403 (1994) описують інгібування активності PARP, зменшення проліферації пухлинних клітин та помітний синергічний ефект, коли пухлинні клітини обробляються разом з алкілуючими ліками. PARP-1, отже, - це потенційно важлива терапевтична ціль для сприяння протираковій терапії, зумовленій руйнуванням ДНК. Інгібітори PARP можуть також інгібувати зростання клітин, що мають дефекти у гомологічному рекомбінаційному (HR) шляху репарації дволанцюгової ДНК. Дивись Bryant et al., "Specific killing of BRCA2-deficient tumours with inhibitors of poly(ADP-ribose) polymerase," Nature 434, 913 (2005); Farmer et al., "Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy," Nature 434, 917 (2005). Цей ефект існує без присутності хімічних сенсибілізуючих засобів. Id. Відомі стани, пов’язані з дефектами гомологічної рекомбінації (HR), включають дефекти BRCA-1, дефекти BRCA-2, та види раку, пов’язані з анемією Фанконі. McCabe et al., "Deficiency in the Repair of DNA Damage by Homologous Recombination and Sensitivity to Poly(ADP-Ribose) Polymerase Inhibition," Cancer Res. 66. 8109 (2006). Білки, 1 UA 99483 C2 5 10 15 20 25 30 35 40 45 50 55 60 визначені як такі, що пов’язані з анемією Фанконі, включають FANCA, FANCB, FANCC, FANCD2, FANCE, FANCF, FANCG, FANCL та FANCM. Id. Для огляду дивись Zaremba et al., "PARP Inhibitor Development for Systemic Cancer Targeting," Anti-Cancer Agents in Medicinal Chemistry 7, 515 (2007) та Lewis et al., "Clinical poly(ADP-ribose) polymerase inhibitors for the treatment of cancer," Curr. Opin. Investigational Drugs 8, 1061 (2007). Велику кількість відомих інгібіторів PARP було описано у Banasik et al., "Specific Inhibitors of Poly(ADP-Ribose) Synthetase and Mono(ADP-Ribosyl)-Transferase", J. Biol. Chem., 267:3, 1569-75 (1992), та у Banasik et al., "Inhibitors and Activators of ADP-Ribosylation Reactions", Molec. Cell. Biochem., 138, 185-97 (1994). Проте, ефективне застосування цих інгібіторів PARP, згідно зі способами, що обговорюються вище, було обмежено супроводжувальними небажаними побічними ефектами. Дивись Milam et al., "Inhibitors of Poly(Adenosine Diphosphate-Ribose) Synthesis; Effect on Other Metabolic Processes," Science, 223, 589-91 (1984). Окрім вищезгаданих публікацій інгібітори PARP були розкриті та описані у наступних міжнародних патентних публікаціях: WO 00/42040; WO 00/39070; WO 00/39104; WO 99/11623; WO 99/11628; WO 99/11622; WO 99/59975; WO 99/11644; WO 99/11945; WO 99/11649 та WO 99/59973. Вичерпний огляд стану галузі було опубліковано Li та Zhang у IDrugs 2001, 4(7): 804812 (PharmaPress Ltd ISSN 1369-7056). Про спроможність інгібіторів PARP підсилювати летальність від цитотоксичних засобів шляхом хімічної сенсибілізації пухлинних клітин до цитотоксичного впливу хіміотерапевтичних засобів повідомлялося у, серед іншого, US 2002/0028815; US 2003/0134843; US 2004/0067949; White AW, et al., 14 Bioorg. and Med. Chem Letts. 2433 (2004); Canon Koch SS, et al., 45 J. Med. Chem. 4961 (2002); Skalitsky DJ, et al., 46 J. Med. Chem. 210 (2003); Farmer H, et al., 434 Nature 917 (14 April 2005); Plummer ER, et al., 11(9) Clin. Cancer Res. 3402 (2005); Tikhe JG, et al., 47 J. Med. Chem. 5467 (2004); Griffin R.J., et al., WO 98/33802 та Helleday T, et al., WO 2005/012305. Індукція периферійної невропатії - це звичайний фактор, що обмежує лікування хіміотерапевтичними ліками. Quasthoff and Hartung, J. Neurology, 249, 9-17 (2002). Індукована хіміотерапією невропатія - це побічний ефект, з яким стикаються після застосування багатьох традиційних (наприклад, таксолу, вінкритину, цисплатину) та нових хіміотерапевтичних ліків (наприклад, велкаду, епотилону). Залежно від речовини, що застосовується, наслідком може бути чиста сенсорна та болісна невропатія (при застосуванні цисплатину, оксаліплатину, карбоплатину) або змішана сенсорно-моторна невропатія, у яку залучається або не залучається автономна нервова система (при застосуванні вінкристину, таксолу, сураміну). Нейротоксичність залежить від загальної сумарної дози та типу ліків, що застосовуються. В окремих випадках невропатія може виникати навіть після одноразового застосування ліків. Видужання від симптомів часто не є повним, та для відновлення функції необхідним є тривалий період регенерації. На цей час доступними є лише невелика кількість ліків, які надійно попереджають або лікують індуковану хіміотерапією невропатію. Отже, все ще існує потреба в ефективних та сильних інгібіторах PARP, які підсилюють летальний вплив хіміотерапевтичних засобів на пухлинні клітини і при цьому спричиняють мінімальні побічні ефекти. Крім того, повідомлялося, що інгібітори PARP є ефективними при радіоактивній сенсибілізації гіпоксичних пухлинних клітин та є ефективними стосовно запобігання тому, щоб пухлинні клітини відновлювалися від потенційно летального руйнування ДНК після радіотерапії, що ймовірно є наслідком їх спроможності запобігати репарації ДНК. Патенти США № 5032617; 5215738 та 5041653. Нещодавні публікації говорять про те, що інгібітори PARP вбивають клітини раку молочної залози, які мають дефіцит гена-1 та гена-2, пов’язаних з раком молочної залози (BRCA1/2). Ці дослідження дозволяють припустити, що інгібітори PARP можуть бути ефективними для лікування BRCA1/2-пов’язаних видів раку молочної залози. [Farmer et al., Nature 2005, 434, 917; DeSoto and Deng, Intl. J. Med. Sci. 2006, 3, 117; Bryant et al., Nature, 2005, 434, 913]. Отже, все ще існує потреба в ефективних та сильних інгібіторах PARP, які підсилюють летальну дію іонізуючої радіації та/або хіміотерапевтичних засобів на пухлинні клітини або інгібують зростання клітин, що мають дефекти у гомологічному рекомбінаційному (HR) шляху репарації дволанцюгової ДНК, та які при цьому спричиняють мінімальні побічні ефекти. Цим винаходом пропонуються сполуки, описані у цьому описі винаходу, їх похідні та застосування їх для інгібування полі(ADP-рибоза)полімерази ("PARP"), композиції, що містять ці сполуки, та способи отримання та застосування цих інгібіторів PARP для лікування ефектів станів, описаних у цьому описі винаходу. Цим винаходом також пропонуються сполуки тетраазафенален-3-ону Формули (І) або їх фармацевтично прийнятні солі: 2 UA 99483 C2 O H N N (I) NH R N 5 10 15 20 25 30 35 40 45 50 де R - являє собою 1 2 1 (a) NR R , де R вибраний з групи, яка складається з водню, C 1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом, C3-C8 циклоалкілу, C1-C6 алкокси, C2-C6 алкенілокси, фенілу, фенокси, бензилокси, A B A B NR R (C1-C6 алкіл з прямим або розгалуженим ланцюгом), NR R (C2-C6 алкеніл з прямим або розгалуженим ланцюгом), (C1-C6 алкіл з прямим або розгалуженим ланцюгом)карбонілу, (C2-C6 алкеніл з прямим або розгалуженим ланцюгом)карбонілу, (C 3-C8 циклоалкіл)карбонілу, (C1-C6 алкіл з прямим або розгалуженим ланцюгом)оксикарбонілу, (C 2-C6 алкеніл з прямим або розгалуженим ланцюгом)оксикарбонілу, (C3-C8 циклоалкіл)оксикарбонілу, арилкарбонілу, сульфонілу, арилсульфонілу, арил(C1-C6 алкіл з прямим або розгалуженим ланцюгом), арил(C2-C6 алкеніл з прямим або розгалуженим ланцюгом), арил(C 3-C8 циклоалкіл), (C1-C6 алкіл з прямим або розгалуженим ланцюгом)арилу, (C 2-C6 алкеніл з прямим або розгалуженим ланцюгом)арилу, (C3-C8 циклоалкіл)арилу, арилу, гетероциклілу, гетероцикліл(C1-C6 алкіл з прямим або розгалуженим ланцюгом) та гетероцикліл(C2-C6 алкеніл з прямим або розгалуженим ланцюгом); де кожен гетероцикліл має від 1 до 7 гетероатомів, які незалежно вибрані з O, N або S, та де A B кожен з R та R незалежно вибраний з групи, яка складається з водню, C 1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом та C3-C8 циклоалкілу; 2 та R вибраний з групи, яка складається з C1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом, C3-C8 циклоалкілу, C1-C6 X Y алкокси, C2-C6 алкенілокси, фенілу, фенокси, бензилокси, NR R (C1-C6 алкіл з прямим або X Y розгалуженим ланцюгом), NR R (C2-C6 алкеніл з прямим або розгалуженим ланцюгом), (C1-C6 алкіл з прямим або розгалуженим ланцюгом)карбонілу, (C2-C6 алкеніл з прямим або розгалуженим ланцюгом)карбонілу, (C3-C8 циклоалкіл)карбонілу, (C1-C6 алкіл з прямим або розгалуженим ланцюгом)оксикарбонілу, (C 2-C6 алкеніл з прямим або розгалуженим ланцюгом)оксикарбонілу, (C3-C8 циклоалкіл)оксикарбонілу, арилкарбонілу, сульфонілу, арилсульфонілу, арил(C 1-C6 алкіл з прямим або розгалуженим ланцюгом), арил(C 2-C6 алкеніл з прямим або розгалуженим ланцюгом), арил(C3-C8 циклоалкіл), (C1-C6 алкіл з прямим або розгалуженим ланцюгом)арилу, (C2-C6 алкеніл з прямим або розгалуженим ланцюгом)арилу, (C3-C8 циклоалкіл)арилу, арилу, гетероциклілу, гетероцикліл(C1-C6 алкіл з прямим або розгалуженим ланцюгом) та гетероцикліл(C2-C6 алкеніл з прямим або розгалуженим ланцюгом); де кожен гетероцикліл має від 1 до 7 гетероатомів, які незалежно вибрані з O, N або S, та де X Y кожен з R та R незалежно вибраний з групи, яка складається з водню, C 1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом та C3-C8 циклоалкілу; 1 2 де R та R незалежно заміщені 0 - 4 замісниками, при цьому кожен з них незалежно вибраний з галогену, C1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом, C1-C6 алкокси, трифторметилу, трифторетилу та аміно; за 1 2 2 умови, що R та R не можуть обидва бути метилом, та R не може бути (феніл)проп-1-ілом, 1 коли R являє собою водень; або (b) арилокси, заміщений 0 - 4 замісниками, при цьому кожен з них незалежно вибраний з групи, яка складається з галогену, C1-C6 алкокси, трифторметилу, трифторетилу, C1-C6 алкілу з прямим або розгалуженим ланцюгом, C 2-C6 алкенілу з прямим або розгалуженим ланцюгом, C3C D C D C D C8 циклоалкілу, NR R , NR R (C1-C6 алкіл з прямим або розгалуженим ланцюгом) та NR R (C2 3 UA 99483 C2 C 5 10 15 20 25 30 35 40 45 50 55 60 D C6 алкеніл з прямим або розгалуженим ланцюгом), де кожен з R та R незалежно вибраний з групи, яка складається з водню, C1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом та C3-C8 циклоалкілу; та коли більш ніж один C D C D замісник знаходяться у формі NR R , тоді кожний випадок R та R незалежно вибраний з групи, яка складається з водню, C1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом та C3-C8 циклоалкілу; або (c) гетероцикліл, який має від 1 до 7 гетероатомів, незалежно вибраних з O, N або S; та який має від 0 до 4 замісників, незалежно вибраних з групи, яка складається з галогену, галогеналкілу, гідроксилу, нітро, трифторметилу, трифторетилу, C1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом, C1-C6 алкокси, E F C2-C6 алкенілокси, фенілу, фенокси, бензилокси, аміно, тіокарбонілу, ціано, іміно, NR R (C1-C6 E F алкіл з прямим або розгалуженим ланцюгом), NR R (C2-C6 алкеніл з прямим або розгалуженим ланцюгом), сульфгідрилу, тіоалкілу, діокса-спіроетилу, (C1-C6 алкіл з прямим або розгалуженим ланцюгом)карбонілу, (C2-C6 алкеніл з прямим або розгалуженим ланцюгом)карбонілу, (C1-C6 алкіл з прямим або розгалуженим ланцюгом)оксикарбонілу, (C2-C6 алкеніл з прямим або розгалуженим ланцюгом)оксикарбонілу, арилкарбонілу, сульфонілу, арилсульфонілу, арил(C1C6 алкіл з прямим або розгалуженим ланцюгом), арил(C2-C6 алкеніл з прямим або розгалуженим ланцюгом), арил(C3-C8 циклоалкіл), (C1-C6 алкіл з прямим або розгалуженим ланцюгом)арилу, (C2-C6 алкеніл з прямим або розгалуженим ланцюгом)арилу, (C 3-C8 циклоалкіл)арилу, арилу, гетероциклілу, гетероцикліл(C1-C6 алкіл з прямим або розгалуженим ланцюгом), та гетероцикліл(C2-C6 алкеніл з прямим або розгалуженим ланцюгом), де кожен E гетероцикліл має від 1 до 7 гетероатомів, незалежно вибраних з O, N або S, та де кожен з R та F R незалежно вибраний з групи, яка складається з водню, C 1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом та C3-C8 E F циклоалкілу; та коли більш ніж один замісник знаходяться у формі NR R , тоді кожний випадок E F R та R незалежно вибраний з групи, яка складається з водню, C 1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом та C3-C8 циклоалкілу; де кожен зі згаданих 0 - 4 замісників незалежно заміщений 0 - 4 наступними замісниками, та кожен згаданий наступний замісник незалежно вибраний з галогену, C1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом, C3-C8 циклоалкілу, C1-C6 алкокси, трифторметилу, трифторетилу та аміно; за умови, що R має принаймні одного замісника, коли R являє собою N-піперидинільну, N-піролідинільну або N-морфолінільну групу. У деяких варіантах здійснення кожне кільце кожного гетероциклілу Формули (І) незалежно має розмір у 5 - 7 атомів. Деякі варіанти здійснення включають один, два або три атоми азоту у принаймні одному кільці гетероциклілу Формули (І). У деяких варіантах здійснення гетероцикліл Формули (І) включає 1 - 3 кільця. У деяких варіантах здійснення гетероцикліл має 1 - 7 гетероатомів, незалежно вибраних з O, N та S. У деяких варіантах здійснення гетероцикліл включає 1 - 2 кільця. У деяких варіантах здійснення гетероцикліл включає одне кільце. У деяких варіантах здійснення кожний з різних випадків гетероциклілу Формули (І) незалежно включає 1 - 3 кільця. У деяких варіантах здійснення кожний з різних випадків гетероциклілу Формули (І) незалежно включає 1 - 2 кільця. У деяких варіантах здійснення кожний з різних випадків гетероциклілу Формули (І) незалежно включає одне кільце. У деяких варіантах здійснення гетероцикліл Формули (І) вибраний з групи, яка складається з піперидинілу, піперазинілу, піридазинілу, дигідропіридилу, тетрагідропіридилу, піридинілу, піримідинілу, дигідропіримідинілу, тетрагідропіримідинілу, гексагідропіримідинілу, дигідропіразинілу, тетрагідропіразинілу, піролідинілу, імідазолідинілу, піразолідинілу, піролілу, дигідропіролілу, імідазолілу, дигідроімідазолілу, піразолілу, дигідропіразолілу, азепанілу, [1,2]діазепанілу, [1,3]діазепанілу, [1,4]діазепанілу, індолілу, дигідроіндолілу, ізоіндолілу, дигідроізоіндолілу, дигідрохінолілу, тетрагідрохінолілу, дигідроізохінолілу та тетрагідроізохінолілу; або з їх підгруп. Цей винахід також стосується фармацевтичної композиції, яка включає (і) терапевтичну кількість сполуки Формули (І) та (іі) фармацевтично прийнятний носій. Цим винаходом пропонуються сполуки, які інгібують in vitro та/або in vivo полімеразну активність полі(ADP-рибоза)полімерази (PARP), та композиції, які містять описані сполуки. Цим винаходом пропонуються способи інгібування, обмеження та/або регулювання полімеразної активності in vitro та/або in vivo полі(ADP-рибоза)полімерази (PARP) у розчинах, клітинах, тканинах, органах або системі органів. В одному варіанті здійснення цим винаходом 4 UA 99483 C2 5 10 15 20 25 30 35 40 45 50 55 60 пропонуються способи обмеження або інгібування активності PARP у ссавця, такого як людина, або місцево, або системно. В одному варіанті здійснення цим винаходом пропонується спосіб хімічної сенсибілізації для лікування раку, який включає контактування ракових клітин зі сполукою Формули (І) тетраазафенален-3-ону, яка підсилює цитотоксичність, або її фармацевтично прийнятною сіллю, та подальше контактування пухлинних або ракових клітин з протираковим засобом. Варіантом здійснення цього винаходу пропонується спосіб хімічної сенсибілізації, де першу дозу принаймні однієї сполуки Формули (І) або її фармацевтично прийнятної солі вводять одноразово або багаторазово пацієнту, якому це потрібно, та де наступну другу дозу принаймні одного хіміотерапевтичного засобу вводять одноразово або багаторазово згаданому пацієнтові після деякого періоду часу, щоб забезпечити ефективний ступінь хімічної сенсибілізації. В одному аспекті цим винаходом пропонується фармацевтичний склад, який включає сполуку Формули (І), яка має форму, вибрану з групи, яка складається з необмежувальних прикладів таких хіміотерапевтичних засобів, які перелічено нижче, їх фармацевтично прийнятних вільних основ, солей, гідратів, естерів, сольватів, стереоізомерів та їх сумішей. Згідно з наступним аспектом фармацевтичний склад далі включає фармацевтично прийнятний носій та необов'язково хіміотерапевтичний засіб. Наступні варіанти здійснення наведено з метою лише проілюструвати, а не обмежити будь-яким чином обсяг цього винаходу. В одному варіанті здійснення фармацевтичний склад винаходу включає сполуку цього винаходу у фармацевтично прийнятному носії. В іншому варіанті здійснення фармацевтичний склад винаходу включає фармацевтично прийнятну сіль сполуки цього винаходу у фармацевтично прийнятному носії. В іншому варіанті здійснення фармацевтичний склад цього винаходу включає сполуку винаходу та один або більше хіміотерапевтичних засобів у фармацевтично прийнятному носії. В іншому варіанті здійснення фармацевтичний склад цього винаходу включає фармацевтично прийнятну сіль сполуки винаходу та один або більше хіміотерапевтичних засобів у фармацевтично прийнятному носії. Необмежувальні приклади таких хіміотерапевтичних засобів наведено нижче. Згідно з додатковими аспектами винаходу сполуку-хімічний сенсибілізатор та хіміотерапевтичний засіб вводять по суті одночасно. Згідно з аспектом винаходу хіміотерапевтичний засіб вибирають з групи, яка складається з темозоломіду, адріаміцину, камптотецину, карбоплатину, цисплатину, даунорубіцину, доцетакселу, доксорубіцину, інтерферону-альфа, інтерферону-бета, інтерферону-гама, інтерлейкіну 2, іринотекану, паклітакселу, таксоїдів, дактиноміцину, данорубіцину, 4’дезоксидоксорубіцину, блеоміцину, пілкаміцину, мітоміцину, неоміцину та гентаміцину, етопозиду, 4-ОН циклофосфаміду, платинового координаційного комплексу, топотекану, їх терапевтично ефективних аналогів та похідних та їх сумішей. Згідно зі специфічним аспектом хіміотерапевтичний засіб являє собою темозоломід. В іншому варіанті здійснення цим винаходом пропонуються способи лікування дії раку та/або надання раковим клітинам, які піддають радіосенсибілізації, більшої сприйнятливості до радіаційної терапії, що дозволяє тим самим запобігти відновленню пухлинних клітин після потенційно летального руйнування ДНК після радіаційної терапії, при цьому способи включають введення суб’єкту ефективної кількості сполуки Формули (І) або її фармацевтично прийнятної солі. Спосіб цього варіанту здійснення спрямований на специфічну та переважну радіоактивну сенсибілізацію ракових клітин, тим самим надаючи раковим клітинам більшої сприйнятливості до радіаційної терапії порівняно з непухлинними клітинами. Цим винаходом пропонується спосіб лікування раку у суб’єкта, якому це потрібно, який включає введення суб’єктові терапевтично ефективної кількості сполуки Формули (І) або її фармацевтично прийнятної солі, де ракові клітини мають дефект у ексцизійній репарації дволанцюгової ДНК. В одному варіанті здійснення дефект у ексцизійній репарації дволанцюгової ДНК - це дефект у гомологічній рекомбінації. В одному варіанті здійснення ракові клітини мають фенотип, вибраний з групи, яка складається з дефекту BRCA-1, дефекту BRCA-2, дефекту BRCA-1 та BRCA-2 та анемії Фанконі. В іншому варіанті здійснення цим винаходом пропонуються способи лікування BRCA1/2пов’язаного раку молочної залози, який включає введення сполуки Формули (І) або її фармацевтично прийнятної солі. Згідно з одним варіантом здійснення винаходу сполука для використання у способі хімічної сенсибілізації цього винаходу, способі радіоактивної сенсибілізації цього винаходу або у способі лікування раку цього винаходу, де ракові клітини мають дефект у ексцизійній репарації дволанцюгової ДНК, являє собою сполуку, вибрану із сполук Формули (І) або їх фармацевтично прийнятних солей. В іншому аспекті сполука вибрана з групи, яка складається з: 5 UA 99483 C2 O H N N NH N N N N N 7 O N OH NH H N H N O 8 , O N , H N N NH NH N N 9 O H N O N 10 , H N F O N Cl N NH NH N N O 12 , H N O N 5 O H N N 14 , H N O N N H N , N CF3 NH F N 15 H N Cl H N N NH O Cl NH 13 16 , O N H N NH O N 17 H N N N , H N , N O NH , N NH N N N N 11 H N , 18 6 Cl Cl , UA 99483 C2 O H N N NH CF3 19 H N N O N N N 24 H N N F N , NH NH N N N 26 , F3C O H N O N O 28 , H N O N NH N 30 O F NH 32 H N , N NH N N N F H N 31 , N , N N N N Cl N N N NH N NH 27 , N N N 5 H N N N O N O O , NH H N O N NH 25 O , N N H N H N N NH O N 22 23 H N N N O N , N , NH N NH 21 H N 20 N N O , H N O H N N N NH N NH H N N O H N O N H N 33 , 7 F, UA 99483 C2 O H N O N NH N N H N N 34 O N N NH H N H N O 35 , , N NH N N 36 O H N , H N O N NH NH N N O O N O NH N N N N 42 , O NH , NH N N 40 N 41 O , H N N N N N NH H N N NH N N , N 39 5 H N N N O 38 , NH H N N N 37 H N O S O N N H N N H N 43 , NH N N N , 44 8 , UA 99483 C2 O H N N NH N S O N S NH N N H N Cl N O NH N N H N O O NH N S NH N N S H N O , O S O N N NH O N 58 S 57 O NH N N , O N O N 56 , N O N N O 55 , F S N N N , CF3 54 O 53 O O S N , O N O O N S , N O N N F O 51 H N O S N N , O NH H N O NH 52 5 N N N N H N , N NH O H N O O 50 O 46 , OCH3 N N H N N N NH O O S O N N N 45 H N CF3 OCH3 N O O OCH3 NH H N H N N N 59 , 9 , UA 99483 C2 Cl O H N O S O N N NH H N O N NH N N F O S O N N N 60 61 , , OCH3 O H N O S O N N NH H N O O S O N N NH N N N N 62 63 , , NH2 O H N O S O N N NH NH N O N S NH N O N 72 H N H N N N NH , N O 66 5 H N NH2 O N O 65 , NH H N N N 64 H N O S O N N N N O H N O , H N S , N N O O 69 NH O O 74 , H N S O O , 10 UA 99483 C2 O H N N O NH N 75 5 10 15 20 25 30 35 40 45 50 H N S O H N N NH O N NO2 H N 76 O , та їх фармацевтично прийнятних солей. Цим винаходом також пропонуються засоби для лікування індукованої хіміотерапією периферійної невропатії. Згідно з аспектом винаходу сполуки цього винаходу вводять до початку або одночасно з введенням принаймні одного хіміотерапевтичного засобу, щоб запобігти розвитку симптомів невропатії або полегшити суворість таких симптомів. Згідно з наступним аспектом сполуки цього винаходу вводять після введення принаймні одного хіміотерапевтичного засобу, щоб лікувати у пацієнта симптоми невропатії або полегшити суворість таких симптомів. В іншому аспекті цим винаходом пропонується спосіб затримання, уповільнення або припинення росту ракових клітин у ссавця, при цьому спосіб включає введення хіміотерапевтичного засобу та далі включає введення сполуки Формули (І) або її фармацевтично прийнятної солі у кількості, що є достатньою для підсилення протиракової активності згаданого хіміотерапевтичного засобу. Іще інші аспекти та переваги цього винаходу стануть очевидними фахівцям у галузі завдяки наступному докладному опису, у якому показано та описано переважні варіанти здійснення винаходу, проілюстровано передбачений найкращий режим здійснення винаходу. Як буде зрозуміло, винахід можна здійснювати іншими та відмінними варіантами, та деякі деталі винаходу можна модифікувати різними очевидними способами, при цьому не відхиляючись від винаходу. Отже, опис слід розглядати, по суті, як ілюстрацію, а не обмеження. Стислий опис ілюстративних матеріалів Фігура 1. Пероральне введення сполуки 13, яка є інгібітором PARP-1, + темозоломід (TMZ), при якому спостерігається підвищення виживаності мишей, що є носіями моделі меланоми В16. Фігура 2. Пероральне введення сполуки 13, яка є інгібітором PARP-1, + TMZ, при якому спостерігається підвищення виживаності у моделі внутрічерепної гліоми SJGBM. Фігура 3. Пероральне введення сполуки 37, яка є інгібітором PARP-1, + TMZ, при якому спостерігається підвищення виживаності мишей, що є носіями моделі меланоми В16. Фігура 4. Пероральне введення сполуки 37, яка є інгібітором PARP-1, + TMZ, при якому спостерігається підвищення виживаності у моделі внутрічерепної гліоми SJGBM. Фігура 5. Пероральне введення сполуки 37, яка є інгібітором PARP-1, + радіація, де спостерігається інгібування росту пухлини у моделі раку голови та шиї. Фігура 6. Пероральне введення сполуки 37, яка є інгібітором PARP-1, при якому спостерігається інгібування росту мутантних пухлин BRCA1. Цим винаходом пропонуються сполуки, описані у цьому описі винаходу, їх похідні та їх застосування для інгібування полі(ADP-рибоза)полімерази ("PARP"), композиції, що містять ці сполуки, та способи отримання та застосування цих сполук для лікування, профілактики та/або ослаблення дії різних видів раку шляхом підсилення цитотоксичної дії іонізуючої радіації на пухлинні клітини. Цим винаходом пропонуються сполуки, описані у цьому описі винаходу, їх похідні та їх застосування для інгібування полі(ADP-рибоза)полімерази ("PARP"), композиції, що містять ці сполуки, та способи отримання та застосування цих сполук для лікування, профілактики та/або ослаблення дії різних видів раку шляхом підсилення цитотоксичної дії хіміотерапевтичних засобів на пухлинні клітини. Цим винаходом пропонується спосіб хімічної сенсибілізації для лікування пухлинних та/або ракових клітин, який включає контактування згаданих ракових клітин зі сполукою Формули (І) та наступне контактування згаданих ракових клітин з протираковим засобом. Цим винаходом пропонуються сполуки, описані у цьому описі винаходу, їх похідні та їх застосування для інгібування полі(ADP-рибоза)полімерази ("PARP"), композиції, що містять ці сполуки, та способи отримання та застосування цих сполук для інгібування зростання клітин, що мають дефекти у гомологічному рекомбінаційному (HR) шляху репарації дволанцюгової ДНК. Сполуки та композиції цього винаходу можна застосовувати для лікування раку у присутності або відсутності радіоактивних або хімічних сенсибілізуючих засобів. Ці сполуки та композиції переважно застосовуються у відсутності радіоактивних або хімічних сенсибілізуючих 11 UA 99483 C2 5 10 15 20 25 30 35 40 45 50 55 60 засобів, де рак має дефект у гомологічному рекомбінаційному (HR) шляху репарації дволанцюгової ДНК. Такі дефекти є пов’язаними з дефектами BRCA-1, дефектами BRCA-2, подвійними дефектами BRCA-1/BRCA-2 та анемією Фанконі та мають фенотипи дефектів BRCA-1, дефектів BRCA-2, подвійних дефектів BRCA-1/BRCA-2 та анемії Фанконі. Анемія Фанконі - це генетично гетерогенна хвороба, та пацієнти з анемією Фанконі мають надзвичайно високий ризик захворювання на рак. Одинадцять пацієнтів були пов’язані з анемією Фанконі. FANCA, FANCB, FANCC, FANCE, FANCF, FANCG та FANCM утворюють ядерний стрижневий комплекс. Комплекс взаємодіє з FANCL, внаслідок чого включається убіхінон FANCD2. Модифікований FANCD2 є необхідним для репарації перехресних ланок ДНК. FANCd2 акумулюється на ділянках руйнування ДНК та пов'язується з BRCA-1 та BRCA-2. Приклади раку, які можуть пов’язуватися з дефектами гомологічної рекомбінації (HR), включають рак молочної залози та рак яєчника. Рак молочної залози, який передбачається лікувати згідно зі способами винаходу, може включати усі типи раку молочної залози, та переважно включає інвазивний проточний рак та інвазивний дольковий рак. Рак яєчника, який передбачається лікувати згідно зі способами цього винаходу, включає усі типи раку яєчника, переважно пухлини епітелію яєчника, пухлини статевих клітин яєчника та стромальні пухлини зародкових шнурів. Сполуки цього винаходу можна синтезувати, застосовуючи початкові матеріали та способи, описані у патентній заявці США за серійним номером 10/853,714, яку включено у цей опис шляхом посилання у її повному обсязі. Зазвичай, сполуки, такі як сполуки Формули (І), що застосовуються у композиціях винаходу, будуть мати ІС50 для інгібування полі(ADP-рибоза)полімерази in vitro, яка буде становити приблизно 20 мкМ або менше, переважно менш ніж приблизно 10 мкМ, більш переважно менш ніж приблизно 1 мкМ або переважно менш ніж приблизно 0,1 мкМ, найбільш переважно менш ніж приблизно 0,01 мкМ. Традиційний спосіб визначення ІС50 сполуки-інгібітору PARP - це аналіз PARP, який застосовує очищену рекомбінантну PARP людини від Trevigan (Gaithersburg, Md.) та який полягає у наступному. Ферментний аналіз PARP виконується на льоду в об’ємі 100 мікролітрів, що складається з 100 мМ Tris-HCl (pH 8,0), 1 мM MgCl2, 28 мM KCl, 28 мM NaCl, 3,0 мкг/мл 3 ДНКазою I-активованої ДНК сперми оселедця (Sigma, Mo.), 30 мікромолярного [ H]нікотинамідаденін-динуклеотиду (62,5 мКі/ммоль), 15 мкг/мл ферменту PARP та різних концентрацій сполук, які слід тестувати. Реакція розпочинається з додавання ферменту та інкубування суміші при 25°С. Після 2 хвилин інкубації реакцію припиняють шляхом додавання 500 мікролітрів льодяної 30% (мас./об’єм) трихлороцтової кислоти. Утворений осад переносять до фільтру зі скловолокна (Packard Unifilter-GF/C) та промивається тричі 70% етанолом. Після висушування фільтра визначають радіоактивність за допомогою сцинтиляційного лічильника. Визначили, що сполуки цього винаходу мають сильну ферментативну активність у діапазоні від декількох наномолів до 20 мікромолів ІС50 у цьому аналізі інгібування. Як застосовується у цьому описі винаходу, "алкіл" означає розгалужений або нерозгалужений насичений вуглеводневий ланцюг, який включає позначену кількість атомів вуглецю. Наприклад, прямий або розгалужений алкіловий вуглеводневий ланцюг C 1-C6 містить від 1 до 6 атомів вуглецю та включає, проте необмежується лише ними, замісники, такі як метил, етил, пропіл, ізо-пропіл, бутил, ізо-бутил, трет-бутил, n-пентил, n-гексил та їм подібні, якщо інше не вказано. У деяких варіантах здійснення алкіловий ланцюг - це розгалужений або нерозгалужений вуглецевий ланцюг С1 - С6. У деяких варіантах здійснення алкіловий ланцюг це розгалужений або нерозгалужений вуглецевий ланцюг C 2 - C5. У деяких варіантах здійснення алкіловий ланцюг - це розгалужений або нерозгалужений вуглецевий ланцюг С1 - C4. У деяких варіантах здійснення алкіловий ланцюг - це розгалужений або нерозгалужений вуглецевий ланцюг C2 - C4. У деяких варіантах здійснення алкіловий ланцюг - це розгалужений або нерозгалужений вуглецевий ланцюг C3 - C5. У деяких варіантах здійснення алкіловий ланцюг це розгалужений або нерозгалужений вуглецевий ланцюг C 1 - C2. У деяких варіантах здійснення алкіловий ланцюг - це розгалужений або нерозгалужений вуглецевий ланцюг C 2 - C3. "Алкеніл" означає розгалужений або нерозгалужений ненасичений вуглеводневий ланцюг, що включає вказану кількість атомів вуглецю. Наприклад, прямий або розгалужений алкеніловий вуглеводневий ланцюг C2 - C6 містить від 2 до 6 атомів вуглецю, який має принаймні один подвійний зв'язок, та включає, проте не обмежується лише ними, замісники, такі як етеніл, пропеніл, ізопропеніл, бутеніл, ізо-бутеніл, трет-бутеніл, n-пентеніл, n-гексеніл та їм подібні, якщо інше не вказано. У деяких варіантах здійснення алкеніловий ланцюг - це розгалужений або нерозгалужений вуглецевий ланцюг C2 - C6. У деяких варіантах здійснення алкеніловий ланцюг - це розгалужений або нерозгалужений вуглецевий ланцюг C 2 - C5. У деяких 12 UA 99483 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантах здійснення алкеніловий ланцюг - це розгалужений або нерозгалужений вуглецевий ланцюг C2 - C4. У деяких варіантах здійснення алкеніловий ланцюг - це розгалужений або нерозгалужений вуглецевий ланцюг C3 - C5. "Алкокси" означає групу OZ, де Z - це алкіл, як визначено у цьому описі винаходу. Z також може бути розгалуженим або нерозгалуженим насиченим вуглеводневим ланцюгом, що містить від 1 до 6 атомів вуглецю. "Цикло", що застосовується у цьому описі винаходу як префікс, означає структуру, що характеризується замкнутим кільцем. "Галоген" означає принаймні один з наступного: фтор, хлор, бром або йод, якщо інше не вказано. A B X Y C D E F Кожен з "NR R ", "NR R ", "NR R " та "NR R ", як описано у цьому описі винаходу, A B незалежно охоплює аміно (NH2), а також заміщений аміно. Наприклад, NR R може бути NH(CH3), -NH(циклогексил) та -N(CH2CH3)(CH3). Коли більш ніж один замісник має форму A B X Y C D E F A B C D X Y "NR R ", "NR R ", "NR R " або "NR R ", тоді кожний випадок R , R , R , R , R або R незалежно вибраний з групи, яка складається з водню, C 1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом та C3-C8 циклоалкілу. Такі приклади призначені лише для ілюстративних цілей та в жодному випадку не для обмеження. "Арилкарбоніл" означає радикал карбонілу, заміщений арилом, як описано у цьому описі винаходу. Необмежувальні приклади включають фенілкарбоніл та нафтилкарбоніл. "Алкілкарбоніл" означає радикал карбонілу, заміщений алкілом, як описано у цьому описі винаходу. Необмежувальні приклади включають ацил та пропілкарбоніл. "Алкоксикарбоніл" означає радикал карбонілу, заміщений алкокси, як описано у цьому описі винаходу. Необмежувальні приклади включають метоксикарбоніл та трет-бутилоксикарбоніл. "Ar" або "арил" означає ароматичну карбоциклічну складову, що має одне або більше замкнутих кілець. Приклади включають, без обмеження, феніл, нафтил, антраценіл, фенантраценіл, біфеніл та піреніл. "Гетероцикліл" означає циклічну складову, що має одне або більше замкнутих кілець з одним або більше гетероатомами (наприклад, кисень, азот або сірка) у принаймні одному з кілець, та де кільце або кільця можуть незалежно бути ароматичними, неароматичними, злитими та/або з’єднаними містковим зв’язком. Приклади включають, без обмеження, піперидиніл, піперазиніл, піридазиніл, дигідропіридил, тетрагідропіридил, піридиніл, піримідиніл, дигідропіримідиніл, тетрагідропіримідиніл, гексагідропіримідиніл, дигідропіразиніл, тетрагідропіразиніл, піролідиніл, імідазолідиніл, піразолідиніл, піроліл, дигідропіроліл, імідазоліл, дигідроімідазоліл, піразоліл, дигідропіразоліл, азепаніл, [1,2]діазепаніл, [1,3]діазепаніл, [1,4]діазепаніл, індоліл, дигідроіндоліл, ізоіндоліл, дигідроізоіндоліл, дигідрохіноліл, тетрагідрохіноліл, дигідроізохіноліл та тетрагідроізохіноліл. "Арилалкіл" означає радикал алкілу, заміщений арилом. Необмежувальні приклади включаютьбензил, фенілетил та фенілпропіл. "Алкіларил" означає радикал арилу, заміщений алкілом. Необмежувальні приклади включають толіл та диметилфеніл. "Циклоалкіл" означає вуглеводневу циклічну складову, що є неароматичною. Приклади включають, без обмеження, циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклооктан, циклопентен, циклогексен, циклогептен та циклооктен. Термін "нервове ураження" означає будь-яке ураження нервової тканини та будь-яку недієздатність або смерть, які є наслідком цього. Причини нервового ураження можуть бути метаболічними, токсичними, нейротоксичними, ятрогенними, термічними або хімічними, та вони включають без обмеження ішемію, гіпоксію, інсульт, травму, хірургічне лікування, тиск, вплив маси, кровотечу, радіацію, вазоспазм, нейродегенеративну хворобу, інфекцію, хворобу Паркінсона, бічний аміотрофічний склероз (ALS), процес мієлінізації/демієлінізації, епілепсію, когнітивний розлад, глютаматний розлад та їх вторинні ефекти. Термін "нейрозахисний" означає ефект зменшення, припинення або полегшення нервового ураження та захист, реанімування та оживлення нервової тканини, яка зазнала нервового ураження. Термін "профілактика нервової деградації" включає спроможність попереджати нейродегенеративну хворобу або профілактику подальшої нервової деградації у пацієнтів, які вже страждають від нейродегенеративної хвороби або мають її симптоми. Термін "лікування" означає: (і) профілактику хвороби, розладу або стану у тварини, яка може бути схильною до хвороби, розладу та/або стану, проте в неї іще не діагностували їх; та/або (іі) інгібування хвороби, розладу або стану, тобто, припинення їх розвитку; та/або 13 UA 99483 C2 5 10 15 20 25 30 (ііі) полегшення хвороби, розладу або стану, тобто, спричинення регресії хвороби, розладу та/або стану. Термін "хімічний сенсибілізуючий засіб", як застосовується у цьому описі винаходу, визначається як молекула, така як молекула з низькою молекулярною масою, яку вводять тваринам у терапевтично ефективній кількості з метою підвищення протипухлинної активності хіміотерапевтичних засобів. Такі хімічні сенсибілізуючі засоби є корисними, наприклад, для підсилення ефекту уповільнення або припинення росту пухлини при заданій дозі хіміотерапевтичного засобу або для покращення профілю побічних ефектів хіміотерапевтичного засобу шляхом зменшення його дози, при цьому зберігаючи його протипухлинну ефективність. Термін "радіоактивний сенсибілізуючий засіб", як застосовується у цьому описі винаходу, визначається як молекула, така як молекула з низькою молекулярною масою, яку вводять тваринам у терапевтично ефективній кількості для підвищення чутливості клітин, які слід сенсибілізувати радіацією, до електромагнітного випромінювання та/або для сприяння лікуванню хвороб, які можна лікувати електромагнітним випромінюванням. Хвороби, які можна лікувати електромагнітним випромінюванням, включають хвороби новоутворювань, доброякісні та злоякісні пухлини та ракові клітини. Також передбачається лікування за допомогою електромагнітного випромінювання інших хвороб, не перелічених у цьому описі винаходу. "Ефективна кількість" означає кількість, необхідну для отримання бажаного ефекту. "Заміщений" означає, що принаймні один водень на позначеній групі заміщений іншим радикалом за умови, що не перебільшується звичайна валентність позначеної групи. Стосовно будь-якої групи, що містить один або більше замісників, такі групи не призначені для введення будь-якого заміщення, яке не можна здійснити на практиці з точки зору простору, синтез якого не можна виконати та/або яке по суті є нестійким. У деяких варіантах здійснення винаходу, як описано у цьому описі винаходу, замісник може заміщувати радикал, при цьому згаданий радикал сам є замісником. Наприклад, у сполуці, яку зображено нижче лише з метою ілюстрації, кільце піперазинілу - це гетероцикліл, який можна замістити 0 - 4 замісниками, як описано у цьому описі винаходу. У цьому прикладі сполуки кільце піперазинілу заміщене арилсульфонілом, де арил являє собою феніл, та де арилсульфоніл можна далі замістити 0 - 4 рази, як описано у цьому описі винаходу. У цьому прикладі сполуки фенілсульфонілова складова далі заміщена трет-бутилом. Такий приклад наведено лише з метою ілюстрації, та його в жодному разі не можна розглядати як обмежувальний. O H N N O NH N N S O N 35 40 45 50 "Суб’єкт" означає клітину або тканину, in vitro або in vivo, тварину або людину. Суб’єкта, що є твариною або людиною, можна також назвати "пацієнтом". "Тварина" означає живий організм, який має почуття та спроможність довільно рухатися та якому для існування необхідні кисень та органічна їжа. Приклади включають, без обмеження, членів видів приматів, ссавців та людину. У широкому сенсі, сполуки та композиції цього винаходу можна застосовувати для лікування або профілактики руйнування або смерті клітин, що є наслідком некрозу або апоптозу, церебральної ішемії та реперфузійного пошкодження або нейродегенеративних хвороб у тварини, такої як людина. Сполуки та композиції цього винаходу можна застосовувати для подовження тривалості життя та спроможності клітин до проліферації, та внаслідок цього їх можна застосовувати для лікування або профілактики хвороб, пов'язаних з цими клітинами; вони змінюють експресію генів клітин, що старіють; та вони радіоактивно сенсибілізують гіпоксичні пухлинні клітини. Переважно, сполуки та композиції цього винаходу можна застосовувати для лікування або профілактики руйнування тканини, яке є наслідком руйнування або смерті клітин, що, у свою чергу, спричинено некрозом або апоптозом, та/або для впливу на нейронну активність, або опосередковану, або не опосередковану токсичністю NMDA. Сполуки цього винаходу не обмежуються застосуванням тільки для лікування опосередкованої глютаматом нейротоксичності та/або NO-опосередкованих біологічних шляхів. Далі, сполуки цього винаходу можна застосовувати для лікування або профілактики іншого руйнування 14 UA 99483 C2 5 10 15 20 25 30 35 40 45 50 55 60 тканини, пов’язаного з активацією PARP, як описано у цьому описі винаходу. Цим винаходом пропонуються сполуки, які інгібують полімеразну активність in vitro та/або in vivo полі(ADP-рибоза)полімерази (PARP), та композиції, що містять описані сполуки. Цим винаходом пропонуються способи інгібування, обмеження та/або регулювання полімеразної активності in vitro та/або in vivo полі(ADP-рибоза)полімерази (PARP) у будь-яких розчинах, клітинах, тканинах, органах або системах органів. В одному варіанті здійснення цим винаходом пропонуються способи обмеження або інгібування активності PARP у ссавця, такого як людина, або місцево, або системно. Сполуки винаходу діють як інгібітори PARP для лікування або профілактики різних видів раку шляхом хімічного підсилення цитотоксичних ефектів хіміотерапевтичних засобів. Сполуки винаходу діють як інгібітори PARP для лікування або профілактики різних видів раку шляхом сенсибілізації клітин до цитотоксичної дії радіації. Сполуки винаходу діють як інгібітори PARP для лікування або профілактики BRCA1/2-пов’язаного раку молочної залози. Сполуки цього винаходу можуть мати один або більше асиметричних центрів, та, отже, їх можна виробляти як суміші (рацемічні або нерацемічні) стереоізомерів або як окремі енантіомери або діастереомери. Окремі стереоізомери можна отримати, застосовуючи оптично активний початковий матеріал, шляхом розчинення рацемічної або нерацемічної суміші проміжного матеріалу на деякій відповідній стадії синтезу або шляхом розчинення сполуки Формули (І). Зрозуміло, окремі стереоізомери, а також суміші (рацемічні або нерацемічні) стереоізомерів охоплюються обсягом цього винаходу. Сполуки винаходу є корисними у формі вільної основи, у формі фармацевтично прийнятних солей, фармацевтично прийнятних гідратів, фармацевтично прийнятних естерів, фармацевтично прийнятних сольватів, фармацевтично прийнятних проліків, фармацевтично прийнятних метаболітів та у формі фармацевтично прийнятних стереоізомерів. Усі ці форми знаходяться в обсязі розкриття суті винаходу. "Фармацевтично прийнятна сіль", "гідрат", "естер" або "сольват" означає сіль, гідрат, естер або сольват сполук винаходу, які мають бажану фармакологічну активність та які не є небажаними ані біологічно, ані іншим чином. Органічні кислоти можна застосовувати для отримання солей, гідратів, естерів або сольватів, таких як ацетат, адипат, альгінат, аспартат, бензоат, бензолсульфонат, р-толуолсульфонат, бісульфат, сульфамат, сульфат, нафтилат, бутират, цитрат, камфорат, камфорсульфонат, циклопентан-пропіонат, диглюконат, додецилсульфат, етансульфонат, фумарат, глюкогептаноат, гліцерофосфат, гемісульфату гептаноат, гексаноат, 2-гідроксіетансульфонат, лактат, малеат, метансульфонат, 2нафталенсульфонат, нікотинат, оксалат, тозилат та ундеканоат. Неорганічні кислоти можна застосовувати для виробництва солей, гідратів, естерів або сольватів, таких як гідрохлорид, гідробромід, гідройодид та тіоціанат. Приклади придатних лужних солей, гідратів, естерів або сольватів включають гідроксиди, карбонати та бікарбонати аміаку, солі лужних металів, таких як солі натрію, літію та калію, солі лужноземельних металів, такі як солі кальцію та магнію, солі алюмінію та солі цинку. Солі, гідрати, естери або сольвати можна також утворити з органічних основ. Органічні основи, придатні для утворення фармацевтично прийнятних основно-адитивних солей, гідратів, естерів або сольватів сполук цього винаходу включають ті, що є нетоксичними та достатньо сильними, щоб утворювати такі солі, гідрати, естери або сольвати. Для ілюстрації, клас таких органічних основ може включати моно-, ди- та триалкіламіни, такі як метиламін, диметиламін, триетиламін та дициклогексиламін; моно-, ди- та тригідроксіалкіламіни, такі як моно-, ді- та триетаноламін; амінокислоти, такі як аргінін та лізин; гуанідин; N-метил-глюкозамін; N-метилглюкамін; L-глютамін; N-метил-піперазин; морфолін; етилендіамін; N-бензил-фенетиламін; (тригідрокси-метил)аміноетан; та їм подібні. Дивись, наприклад, "Pharmaceutical Salts," J. Pharm. Sci., 66:1, 1-19 (1977). Отже, з основних груп, що містять азот, можна утворити четвертинні основи за допомогою реагентів, які включають: галогеніди нижчих алкілів, такі як метил-, етил-, пропіл- та бутилхлориди, -броміди та -йодиди; діалкілсульфати, такі як диметил-, діетил-, дибутил- та діамінсульфати; галогеніди з довгим ланцюгом, такі як децил-, лаурил-, міристил- та стеарилхлориди, -броміди та -йодиди; та аралкілгалогеніди, такі як бензилбромід та фенетилбромід. Кислотно-адитивні солі, гідрати, естери або сольвати основ сполук можна одержати шляхом розчинення вільної основи сполуки цього винаходу у водному розчині або водно-спиртовому розчині або іншому придатному розчиннику, що містить відповідну кислоту або основу, та шляхом виділення солі випаровуванням розчину. Альтернативно, вільна основа сполуки цього винаходу може реагувати з кислотою, а також сполука цього винаходу, що має на собі кислотну групу, може реагувати з основою, так що реакції відбуваються в органічному розчиннику, у 15 UA 99483 C2 5 10 15 20 25 30 35 40 45 50 55 60 цьому випадку сіль відокремлюється безпосередньо, або її можна отримати шляхом концентрування розчину. "Фармацевтично прийнятні проліки" означають похідне сполук винаходу, яке зазнає біологічної трансформації до початку прояву його фармакологічного (фармакологічних) ефекту (ефектів). Проліки утворюють з метою підвищення хімічної стабільності, покращення сприймання пацієнтом та покращеної відповідності для пацієнта, покращення біодоступності, пролонгації дії, покращення селективності стосовно органу, покращення складу (наприклад, підвищення водорозчинності) та/або зменшення побічних ефектів (наприклад, токсичності). Проліки можна легко отримати зі сполук винаходу, застосовуючи способи, відомі у галузі, що описані у Burgers Medicinal Chemistry and Drug Chemistry, Fifth Ed, Vol. 1, pp. 172-178, 949-982 (1995). Наприклад, сполуки винаходу можна перетворити на проліки шляхом перетворення однієї або більше гідрокси- або карбоксигруп на естери. "Фармацевтично прийнятний метаболіт" означає ліки, що зазнали метаболічного перетворення. Після потрапляння у організм більшість ліків стають субстратами для хімічних реакцій, які можуть змінювати їхні фізичні властивості та біологічні ефекти. Ці метаболічні конверсії, які звичайно впливають на полярність сполуки, змінюють шлях, яким ліки розповсюджуються у тілі та виводяться з тіла. Проте, у деяких випадках метаболізм ліків є необхідним для терапевтичного ефекту. Наприклад, протиракові ліки класу антиметаболітів повинні перетворюватися на їх активні форми після того, як вони доставлені у ракову клітину. Оскільки більшість ліків зазнають певного метаболічного перетворення, біохімічні реакції, що відіграють роль у метаболізмі ліків, можуть бути численними та різноманітними. Головна ділянка метаболізму ліків - це печінка, хоча інші тканини можуть також брати участь у метаболізмі. Іще далі, способи винаходу можна використовувати для лікування раку та для хімічної сенсибілізації та радіоактивної сенсибілізації ракових та/або пухлинних клітин. Термін "рак", як застосовується у цьому описі винаходу, має широке визначення. Сполуки цього винаходу можуть підсилювати ефекти "протиракових засобів", при цьому цей термін також охоплює "засоби проти росту пухлинних клітин", "хіміотерапевтичні засоби", "цитостатичні засоби", "цитотоксичні засоби" та "засоби проти новоутворювань". Термін "BRCA1/2-пов’язаний рак молочної залози" охоплює рак молочної залози, у якому клітини раку молочної залози мають дефіцит генів-супресорів ракової пухлини молочної залози BRCA1 та/або BRCA2. Наприклад, способи винаходу є корисними для лікування різних видів раку, таких як пухлини, що виробляють ACTH (адренокортикотропний гормон - АКТГ), гострий лімфолейкоз, гострий нелімфоцитарний лейкоз, рак кори надниркових залоз, рак сечового міхура, рак головного мозку, рак молочної залози, рак шийки матки, хронічний лімфолейкоз, хронічний мієлолейкоз, рак товстої кишки, Т-клітинна лімфома шкіри, ендометріальний рак (рак внутрішності матки), рак стравоходу, саркома Евінга, рак жовчного міхура, волосяноклітинний лейкоз, рак шиї та голови, лімфома Ходжкіна, саркома Капоши, рак нирки, рак печінки, рак легенів (дрібноклітинний та/або недрібноклітинний), злоякісна перитонеальна ефузія, злоякісна плевральна ефузія, меланома, мезотеліома, множинна мієлома, нейробластома, лімфома не Ходжкіна, остеосаркома, рак яєчника, яєчниковий рак (статевих клітин), рак простати, рак підшлункової залози, рак статевого члена, ретинобластома, рак шкіри, саркома м’якої тканини, плоскоклітинний рак, рак шлунку, рак яєчка, рак щитовидної залози, трофобластичні пухлини, рак матки, вагінальний рак, рак піхви та пухлина Уїлма. У деяких необмежувальних варіантах здійснення ракові та/або пухлинні клітини вибрані з групи, що складається з раку головного мозку, меланоми, раку шиї та голови, недрібноклітинного раку легенів, раку яєчка, раку яєчника, раку товстої кишки та раку прямої кишки. Цей винахід також стосується фармацевтичної композиції, яка включає (і) терапевтично ефективну кількість сполуки Формули (І) та (іі) фармацевтично прийнятний носій. Вищенаведене обговорення щодо застосування та введення сполук переважних варіантів здійснення цього винаходу також стосується фармацевтичної композиції цього винаходу. Термін "фармацевтично прийнятний носій", як застосовується у цьому описі винаходу, означає будь-який носій, розріджувач, ексципієнт, суспендувальний агент, змащувальний агент, ад’ювант, наповнювач, систему доставки, емульгатор, розщеплювальний агент, абсорбент, консервант, сурфактант, барвник, ароматизатор або підсолоджувач. Для цих цілей композицію винаходу можна вводити перорально, парентерально, шляхом розпилення для інгаляції, шляхом адсорбції, абсорбції, місцево, ректально, назально, букально, вагінально, інтравентрикулярно, за допомогою імплантованого резервуару у дозованих формах, 16 UA 99483 C2 5 10 15 20 25 30 35 40 45 50 55 60 які містять традиційні нетоксичні фармацевтично прийнятні носії, або за допомогою будь-якої іншої зручної лікарської форми. Термін "парентеральний", як застосовується у цьому описі винаходу, включає способи підшкірної, внутрішньовенної, внутрішньом’язової, інтраперитонеальної, інтратекальної, інтравентрикулярної, надчеревної, внутрічерепної ін’єкції або інфузії. При парентеральному введенні композиція зазвичай буде у стерильній стандартній лікарській формі для ін’єкції (розчин, суспензія або емульсія), яка переважно є ізотонічною з кров’ю реципієнта, з фармацевтично прийнятний носієм. Приклади таких стерильних форм для ін’єкцій - це стерильні водні або масляні суспензії для ін’єкцій. Ці суспензії можуть бути у формі складів, вироблених згідно зі способами, відомими у галузі, у яких застосовуються диспергувальні або зволожувальні засоби та суспендувальні засоби. Стерильні форми для ін'єкцій можуть також бути стерильними розчинами або суспензіями для ін'єкцій у нетоксичних розріджувачах або розчинниках, придатних для парентерального введення, наприклад, такими як розчини у 1,3-бутандіолі. До придатних наповнювачів та розчинників, які можна застосовувати, відносяться вода, сольовий розчин, розчин Рингера, розчин декстрози, ізотонічний розчин хлориду натрію, розчин Ханкса. Крім того, стерильні нелеткі олії традиційно застосовуються як розчинники або суспендувальні середовища. З цією метою можна застосовувати будь-яку чисту нелетку олію, включаючи синтетичні моно- або дигліцериди, кукурудзяну, бавовняну, арахісову та кунжутну олії. Для приготування препаратів, які можна вводити шляхом ін’єкції, корисними є жирні кислоти, такі як етилолеат, ізопропілміристат та олеїнова кислота та її гліцеридні похідні, які включають оливкову олію, рицинову олію, особливо їх поліоксіетиловані варіанти. Ці масляні розчини або суспензії можуть також містити розріджувачі або диспергувальні агенти на основі спиртів з коротким ланцюгом. Стерильний сольовий розчин - це переважний носій, та сполуки часто є розчинними у воді достатньо, щоб вони мали форму розчину. Носій може містити мінімальну кількість домішок, таких як речовини, що підсилюють розчинність, ізотонічність та хімічну стабільність, наприклад, антиоксиданти, буфери та консерванти. Склади, придатні для назального або букального введення (такі як порошкові склади, що саморозпилюються дозувальним пристроєм), можуть включати від приблизно 0,1% до приблизно 5%, за масою, наприклад 1%, за масою, активного інгредієнта. Отже, склади цього винаходу для медичного застосування для людей включають активний інгредієнт у поєднанні з фармацевтично прийнятним носієм та необов'язково іншим (іншими) терапевтичним (терапевтичними) інгредієнтом (інгредієнтами). Для перорального введення композиції будуть зазвичай виготовлятися у стандартних лікарських формах, таких як пігулки, саше, порошок, гранули, кульки, жувальні таблетки, капсули, рідини, водні суспензії або розчини або подібні лікарські форми, із застосуванням традиційного обладнання та способів, відомих у галузі. Такі склади зазвичай включають твердий, напівтвердий або рідкий носій. Приклади носіїв включають лактозу, декстрозу, цукрозу, сорбіт, маніт, крохмалі, аравійську камедь, фосфат кальцію, мінеральну оливу, масло какао, олія шоколадного дерева, альгінати, трагакант, желатин, сироп, метилцелюлозу, поліоксіетиленсорбітанмонолаурат, метилгідроксибензоат, пропілгідроксибензоат, тальк, магнію стеарат тощо. Композицію винаходу переважно вводять у вигляді капсули або таблетки, що містить одиничну або розділену дозу сполуки Формули (І) або її фармацевтично прийнятної солі. Композицію можна вводити у вигляді стерильного розчину, суспензії або емульсії в одиничній або розділеній дозі. Таблетки можуть містити носії, такі як лактоза та кукурудзяний крохмаль, та/або змащувальні засоби, такі як магнію стеарат. Капсули можуть містити розріджувачі, включаючи лактозу та висушений кукурудзяний крохмаль. Таблетку можна виготовити шляхом пресування або формування активного інгредієнта необов'язково з одним або більше допоміжними інгредієнтами. Пресовані таблетки можна виробляти шляхом пресування у придатному пристрої активного інгредієнта у вільноплинній формі, такій як порошок або гранули, необов'язково змішаного зі зв’язувальним агентом, змащувальним агентом, інертним розріджувачем, поверхнево-активною речовиною або диспергувальним агентом. Сформовані таблетки можна виготовляти шляхом формування у придатному пристрої суміші порошкоподібного активного інгредієнта та придатного носія, зволоженого інертним рідким розріджувачем. Сполуки цього винаходу можна також вводити ректально у формі супозиторіїв. Ці композиції можна виробляти шляхом змішування ліків з придатним неподразнюючим ексципієнтом, який є твердим при кімнатній температурі, проте рідким при температурі прямої кишки, та, отже, він буде розплавлюватися у прямій кишці, вивільняючи при цьому ліки. Такі матеріали включають 17 UA 99483 C2 5 10 15 20 25 30 35 40 45 50 55 60 масло какао, бджолиний віск та поліетиленгліколі. Композиції та способи винаходу також можуть застосовувати технологію регульованого вивільнення. Отже, наприклад, описані сполуки можуть бути включеними у гідрофобну полімерну матрицю, щоб здійснити регульоване вивільнення протягом періоду в декілька днів. Композицію винаходу можна потім впресувати у твердий імплантат або пластир для зовнішнього застосування, який є придатним утворювати ефективні концентрації інгібіторів PARP протягом пролонгованого періоду часу, що усуває необхідність частого повторного введення дози. Такі плівки регульованого вивільнення є добре відомими у галузі. Особливо переважними є системи трансдермальної доставки. Інші приклади полімерів, які зазвичай застосовуються з цією метою та які можна застосовувати у цьому винаході, включають етиленвінілацетатний сополімер, який не розкладається, сополімери молочної кислоти-гліколевої кислоти, які розкладаються, - які усі можна застосовувати зовнішньо або внутрішньо. Певні гідрогелі, такі як полі(гідроксіетилметакрилат) або полівініловий спирт, можна також застосовувати, але для більш коротких циклів вивільнення у порівнянні з іншими полімерними системами вивільнення, такими, які згадані вище. У варіанті здійснення носій - це твердий полімер, що біологічно розкладається, або суміш полімерів, що біологічно розкладаються, з відповідними часовими характеристиками вивільнення та відповідною кінетикою вивільнення. Композицію цього винаходу можна потім впресувати у твердий імплантат, що є придатним утворити ефективні концентрації сполук цього винаходу протягом пролонгованого періоду часу, що усуває необхідність частого повторного введення дози. Композицію цього винаходу можна включити у полімер, що біологічно розкладається, або у суміш полімерів будь-яким придатним способом, відомим для фахівця у галузі, та вона може утворювати гомогенну матрицю з полімером, що біологічно розкладається, або її можна деяким способом інкапсулювати у полімер, або її можна впресувати у твердий імплантат. В одному варіанті здійснення полімер, що біологічно розкладається, або суміш полімерів застосовується для утворення м’якого "депо", що містить фармацевтичну композицію цього винаходу, яку можна вводити як плинну рідину, наприклад, шляхом ін’єкції, проте яка залишається достатньо в’язкою, щоб утримувати фармацевтичну композицію у межах локалізованої ділянки навколо ділянки ін’єкції. Час розпаду таким чином утвореного депо може змінюватися від декількох днів до декількох років, залежно від полімеру, який вибрали, та його молекулярної маси. Застосовуючи полімерну композицію у формі для ін’єкції, можна навіть усунути необхідність робити розчинення. У будь-якому випадку, "депо" для гнучкої або плинної доставки пристосується до форми простору, який воно займає у тілі, при цьому мінімально травмуючи навколишні тканини. Фармацевтична композиція цього винаходу застосовується у кількості, яка є терапевтично ефективною, та ця кількість може залежати від бажаного профілю вивільнення, концентрації фармацевтичної композиції, необхідної для ефекту сенсибілізації, та тривалості часу, протягом якого фармацевтична композиція повинна вивільнитися для лікування. Сполуки винаходу застосовуються у композиції у кількості, яка є терапевтично ефективною. Композиції можуть бути стерилізованими та/або містити ад’юванти, такі як консерванти, стабілізатори, емульгатори або засоби, що утворюють комірки, стимулятори розчину, солі для регулювання осмотичного тиску та/або буфери. Крім того, вони можуть також містити інші терапевтично цінні речовини, такі як, без обмеження, специфічні хіміотерапевтичні засоби, перелічені у цьому описі винаходу. Композицію виготовляють згідно з традиційними способами змішування, гранулювання або нанесення покриття, та вони містять від приблизно 0,1% до приблизно 75%, за масою, переважно від приблизно 1% до приблизно 50%, за масою, сполуки винаходу. Для того, щоб бути терапевтично ефективними, улучаючими у центральну нервову систему, сполуки цього винаходу повинні легко проникати крізь гематоенцефалічний бар’єр, коли їх вводять периферійно. Сполуки, які не можуть проникнути крізь гематоенцефалічний бар’єр, можна ефективно вводити інтравентрикулярним шляхом або за допомогою іншої відповідної системи доставки, придатної для введення у мозок. Для медичного застосування кількість активного інгредієнта, необхідна для того, щоб досягти терапевтичного ефекту, буде варіюватися залежно від певної сполуки, способу введення, ссавця, якого лікують, та певної хвороби або розладу, що слід лікувати. Придатна системна доза сполуки цього винаходу або її фармацевтично прийнятної солі для ссавця, який страждає на, або ймовірно страждає на будь-який стан, як описано вище у цьому описі винаходу, становить діапазон від приблизно 0,1 мг/кг до приблизно 100 мг/кг сполуки активного інгредієнта, при цьому звичайна доза становить від приблизно 1 до приблизно 10 мг/кг. 18 UA 99483 C2 5 10 15 20 25 30 35 40 45 50 Проте зрозуміло, що рівень специфічної дози для певного пацієнта буде залежати від різноманітних факторів, включаючи активність специфічної сполуки, що застосовується, вік, масу тіла, загальний стану здоров’я, стать, режим харчування, час введення, швидкість виведення, комбінацію ліків та суворість певної хвороби, яку лікують, та форми введення. Зрозуміло, що звичайний лікар-фахівець або ветеринар-фахівець легко визначить та призначить ефективну кількість сполуки для профілактичного або терапевтичного лікування стану, для лікування якого здійснюється введення. Таким чином, лікар або ветеринар може, наприклад, застосовувати внутрішньовенний болюс з наступною внутрішньовенною інфузією та повторними введеннями, парентерально або перорально, залежно від того, що вважається відповідним. Незважаючи на те, що активний інгредієнт можна вводити самий по собі, переважно презентувати його як фармацевтичний склад. При приготуванні лікарської форми, яка включає композиції винаходу, сполуки можна також змішати з традиційними ексципієнтами, такими як зв’язувальні засоби, включаючи желатин, попередньо желатинований крохмаль та їм подібне; змащувальні засоби, такі як гідрована рослинна олія, стеаринова кислота та їм подібне; розріджувачі, такі як лактоза, маноза та цукроза; дезінтегратори, такі як карбоксиметилцелюлоза та натрію крохмальгліколат; суспендувальні засоби, такі як повідон, полівініловий спирт та їм подібне; абсорбенти, такі як діоксид кремнію; консерванти, такі як метилпарабен, пропілпарабен та натрію бензоат; сурфактанти, такі як лаурилсульфат натрію, полісорбат 80 та їм подібне; барвники; ароматизатори та підсолоджувачі. Фармацевтично прийнятні ексципієнти є добре відомими у фармацевтичній галузі, та їх описано, наприклад, у Remington’s Pharmaceutical Sciences, Mack th Publishing Co., Easton, Pa (наприклад, 20 Ed., 2000), та Handbook of Pharmaceutical Excipients, st nd rd American Pharmaceutical Association, Washington, D.C., (наприклад, 1 , 2 та 3 Eds., 1986, 1994 та 2000, відповідно). Цей винахід стосується застосування сполуки Формули (І) для приготування медикаменту для лікування будь-якої хвороби або розладу у тварини, описаних у цьому описі винаходу. У варіанті здійснення сполуку цього винаходу застосовують для лікування раку. У переважному варіанті здійснення сполуки цього винаходу застосовуються для підсилення цитотоксичної дії іонізуючої радіації. У такому варіанті здійснення сполуки цього винаходу діють як радіоактивний сенсибілізатор. В альтернативному переважному варіанті здійснення сполуки цього винаходу застосовуються для підсилення цитотоксичної дії хіміотерапевтичних засобів. У такому варіанті здійснення сполуки цього винаходу діють як хімічний сенсибілізатор. В іншому переважному варіанті здійснення сполуки цього винаходу застосовуються для інгібування росту клітин, що мають дефекти у гомологічному рекомбінаційному (HR) шляху репарації дволанцюгової ДНК. Будь-який фармакологічно прийнятний хіміотерапевтичний агент, що діє шляхом руйнування ДНК, є придатним як хіміотерапевтичний засіб цього винаходу. Зокрема, цей винахід передбачає застосування хіміотерапевтично ефективної кількості принаймні одного хіміотерапевтичного засобу, який включає, проте не обмежується ними: темозоломід, адріаміцин, каптотецин, карбоплатин, цисплатин, даунорубіцин, доцетаксел, доксорубіцин, інтерферон-альфа, інтерферон-бета, інтерферон-гамма, інтерлейкін 2, іринотекан, паклітаксел, топотекан, таксоїди, актиноміцин, данорубіцин, 4’-дезоксидоксорубіцин, блеоміцин, пілкаміцин, мітоміцин, неоміцин, гентаміцин, етопозид, 4-ОН циклофосфамід, платиновий координаційний комплекс, топотекан та їх суміші. Згідно з переважним аспектом, хіміотерапевтичний засіб - це темозоломід. Винахід, описаний у цьому описі винаходу, демонструє корисність сполук та композицій цього винаходу для лікування та/або профілактики раку, наприклад радіоактивною сенсибілізацією та/або хімічною сенсибілізацією пухлинних та/або ракових клітин до хіміотерапевтичних засобів, та щоб інгібувати зростання клітин, що мають дефекти у гомологічному рекомбінаційному (HR) шляху репарації дволанцюгової ДНК. Наступні приклади призначено лише для ілюстрації, а не для обмеження обсягу цієї заявки. В одному варіанті здійснення цим винаходом пропонуються сполуки тетраазафенален-3-ону Формули (І) або їх фармацевтично прийнятні солі: 19 UA 99483 C2 O H N N (I) NH R N 5 10 15 20 25 30 35 40 45 50 де R являє собою 1 2 1 (a) NR R , де R вибраний з групи, що складається з водню, C 1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом, C3-C8 циклоалкілу, C1-C6 алкокси, C2-C6 алкенілокси, фенілу, фенокси, бензилокси, A B A B NR R (C1-C6 алкіл з прямим або розгалуженим ланцюгом), NR R (C2-C6 алкеніл з прямим або розгалуженим ланцюгом), (C1-C6 алкіл з прямим або розгалуженим ланцюгом)карбонілу, (C2-C6 алкеніл з прямим або розгалуженим ланцюгом)карбонілу, (C 3-C8 циклоалкіл)карбонілу, (C1-C6 алкіл з прямим або розгалуженим ланцюгом)оксикарбонілу, (C 2-C6 алкеніл з прямим або розгалуженим ланцюгом)оксикарбонілу, (C3-C8 циклоалкіл)оксикарбонілу, арилкарбонілу, сульфонілу, арилсульфонілу, арил(C 1-C6 алкіл з прямим або розгалуженим ланцюгом), арил(C2-C6 алкеніл з прямим або розгалуженим ланцюгом), арил(C 3-C8 циклоалкіл), (C1-C6 алкіл з прямим або розгалуженим ланцюгом)арилу, (C 2-C6 алкеніл з прямим або розгалуженим ланцюгом)арилу, (C3-C8 циклоалкіл)арилу, арилу, гетероциклілу, гетероцикліл(C1-C6 алкіл з прямим або розгалуженим ланцюгом) та гетероцикліл(C2-C6 алкеніл з прямим або розгалуженим ланцюгом); де кожен гетероцикліл має від 1 до 7 гетероатомів, незалежно вибраних з O, N або S, та де A B кожен з R та R незалежно вибраний з групи, яка складається з водню, C1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом та C3-C8 циклоалкілу; 2 та R вибраний з групи, яка складається з C1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом, C3-C8 циклоалкілу, C1-C6 X Y алкокси, C2-C6 алкенілокси, фенілу, фенокси, бензилокси, NR R (C1-C6 алкіл з прямим або X Y розгалуженим ланцюгом), NR R (C2-C6 алкеніл з прямим або розгалуженим ланцюгом), (C 1-C6 алкіл з прямим або розгалуженим ланцюгом)карбонілу, (C2-C6 алкеніл з прямим або розгалуженим ланцюгом)карбонілу, (C3-C8 циклоалкіл)карбонілу, (C1-C6 алкіл з прямим або розгалуженим ланцюгом)оксикарбонілу, (C 2-C6 алкеніл з прямим або розгалуженим ланцюгом)оксикарбонілу, (C3-C8 циклоалкіл)оксикарбонілу, арилкарбонілу, сульфонілу, арилсульфонілу, арил(C 1-C6 алкіл з прямим або розгалуженим ланцюгом), арил(C 2-C6 алкеніл з прямим або розгалуженим ланцюгом), арил(C3-C8 циклоалкіл), (C1-C6 алкіл з прямим або розгалуженим ланцюгом)арилу, (C2-C6 алкеніл з прямим або розгалуженим ланцюгом)арилу, (C3-C8 циклоалкіл)арилу, арилу, гетероциклілу, гетероцикліл(C1-C6 алкіл з прямим або розгалуженим ланцюгом) та гетероцикліл(C2-C6 алкеніл з прямим або розгалуженим ланцюгом); де кожен гетероцикліл має від 1 до 7 гетероатомів, незалежно вибраних з O, N або S, та де X Y кожен з R та R незалежно вибраний з групи, що складається з водню, C 1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом та C3-C8 циклоалкілу; 1 2 де R та R незалежно заміщені 0 - 4 замісниками, при цьому кожен з них незалежно вибраний з галогену, C1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом, C1-C6 алкокси, трифторметилу, трифторетилу та аміно; за 1 2 2 умови, що R та R не можуть обидва бути метилом, та R не може бути (феніл)проп-1-ілом, 1 коли R являє собою водень; або (b) арилокси, заміщений 0 - 4 замісниками, при цьому кожен з них незалежно вибраний з групи, що складається з галогену, C1-C6 алкокси, трифторметилу, трифторетилу, C1-C6 алкілу з прямим або розгалуженим ланцюгом, C 2-C6 алкенілу з прямим або розгалуженим ланцюгом, C3C D C D C D C8 циклоалкілу, NR R , NR R (C1-C6 алкіл з прямим або розгалуженим ланцюгом) та NR R (C2C D C6 алкеніл з прямим або розгалуженим ланцюгом), де кожен з R та R незалежно вибраний з 20 UA 99483 C2 5 10 15 20 25 30 35 40 45 групи, що складається з водню, C1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом та C3-C8 циклоалкілу; та коли більш ніж один C D C D замісник знаходяться у формі NR R , тоді кожний випадок R та R незалежно вибраний з групи, що складається з водню, C1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом та C3-C8 циклоалкілу; або (c) гетероцикліл, який має від 1 до 7 гетероатомів, незалежно вибраних з O, N або S; та який має від 0 до 4 замісників, незалежно вибраних з групи, що складається з галогену, галогеналкілу, гідроксилу, нітро, трифторметилу, трифторетилу, C 1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом, C1-C6 алкокси, E F C2-C6 алкенілокси, фенілу, фенокси, бензилокси, аміно, тіокарбонілу, ціано, іміно, NR R (C1-C6 E F алкіл з прямим або розгалуженим ланцюгом), NR R (C2-C6 алкеніл з прямим або розгалуженим ланцюгом), сульфгідрилу, тіоалкілу, діокса-спіроетилу, (C1-C6 алкіл з прямим або розгалуженим ланцюгом)карбонілу, (C2-C6 алкеніл з прямим або розгалуженим ланцюгом)карбонілу, (C1-C6 алкіл з прямим або розгалуженим ланцюгом)оксикарбонілу, (C2-C6 алкеніл з прямим або розгалуженим ланцюгом)оксикарбонілу, арилкарбонілу, сульфонілу, арилсульфонілу, арил(C1C6 алкіл з прямим або розгалуженим ланцюгом), арил(C2-C6 алкеніл з прямим або розгалуженим ланцюгом), арил(C3-C8 циклоалкіл), (C1-C6 алкіл з прямим або розгалуженим ланцюгом)арилу, (C2-C6 алкеніл з прямим або розгалуженим ланцюгом)арилу, (C 3-C8 циклоалкіл)арилу, арилу, гетероциклілу, гетероцикліл(C1-C6 алкіл з прямим або розгалуженим ланцюгом) та гетероцикліл(C2-C6 алкеніл з прямим або розгалуженим ланцюгом), де кожен E гетероцикліл має від 1 до 7 гетероатомів, незалежно вибраних з O, N або S, та де кожен з R та F R незалежно вибраний з групи, що складається з водню, C 1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом та C3-C8 E F циклоалкілу; та коли більш ніж один замісник знаходяться у формі NR R , тоді кожний випадок E F R та R незалежно вибраний з групи, що складається з водню, C 1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом та C3-C8 циклоалкілу; де кожен зі згаданих 0 - 4 замісників незалежно заміщений 0 - 4 наступними замісниками, та кожен згаданий наступний замісник незалежно вибраний з галогену, C1-C6 алкілу з прямим або розгалуженим ланцюгом, C2-C6 алкенілу з прямим або розгалуженим ланцюгом, C3-C8 циклоалкілу, C1-C6 алкокси, трифторметилу, трифторетилу та аміно; за умови, що R має принаймні одного замісника, коли R являє собою N-піперидинільну, N-піролідинільну або N-морфолінільну групу. У деяких варіантах здійснення кожне кільце кожного гетероциклу Формули (І) незалежно має розмір у 5 - 7 атомів. Деякі варіанти здійснення включають один, два або три атоми азоту у принаймні одному кільці гетероциклу Формули (І). У деяких варіантах здійснення гетероцикліл Формули (І) включає 1 - 3 кільця. У деяких варіантах здійснення гетероцикліл має 1 - 7 гетероатомів, незалежно вибраних з O, N та S. У деяких варіантах здійснення гетероцикліл Формули (І) вибраний з групи, що складається з піперидинілу, піперазинілу, піридазинілу, дигідропіридилу, тетрагідропіридилу, піридинілу, піримідинілу, дигідропіримідинілу, тетрагідропіримідинілу, гексагідропіримідинілу, дигідропіразинілу, тетрагідропіразинілу, піролідинілу, імідазолідинілу, піразолідинілу, піролілу, дигідропіролілу, імідазолілу, дигідроімідазолілу, піразолілу, дигідропіразолілу, азепанілу, [1,2]діазепанілу, [1,3]діазепанілу, [1,4]діазепанілу, індолілу, дигідроіндолілу, ізоіндолілу, дигідроізоіндолілу, дигідрохінолілу, тетрагідрохінолілу, дигідроізохінолілу та тетрагідроізохінолілу. В іншому варіанті здійснення цим винаходом пропонується сполука, вибрана з групи, що складається з: O H N O N 50 7 N OH NH N H N NH N N N , N 8 , 21 UA 99483 C2 O H N H N O N N NH NH N N 9 O H N O N 10 , H N F O N Cl N NH NH N N O 12 , H N O N O H N , N CF3 NH F N O N H N NH O 17 H N N N H N N N 19 H N Cl 18 , O NH , N O N H N 16 , NH H N H N O 15 O 14 , N 5 H N N N H N Cl N NH O Cl NH 13 H N , N NH N N N N 11 H N , Cl , N NH CF3 N 20 , 22 H N N , UA 99483 C2 O H N NH N N N N 24 N 26 , F3C O H N O N N 28 H N NH N 31 , F NH H N O NH N 32 O O N H N N , F, N NH N H N 33 N NH 34 , H N , N N N N F H N N N , N N 30 Cl N , O N N N N N O NH N , N N NH H N N N 5 NH NH 27 O , N F N N H N H N O NH O N , 25 H N O N N N N O O N NH N NH H N , N 23 O H N O N O N 22 , NH H N N N 21 H N N N NH O H N O 35 23 , UA 99483 C2 O H N N NH N N 36 O H N , H N O N NH NH N N H N N O NH 42 , H N O N , N H N NH N 43 5 N N N 44 , O OCH3 H N , CF3 O S O N N OCH3 NH N N N N , NH N N NH O 40 N 41 H N , H N N N N N NH O N NH N N , N 39 H N H N O N N O 38 , NH H N N N 37 O O S O N N NH N N N 45 46 , 24 , UA 99483 C2 O H N OCH3 N NH N S O N S N N S O N S H N O NH N S H N , O S O N N NH O N N N 58 O 57 O N S N N O N O , NH , N O N N O 55 O N S N , 56 5 N NH F N H N Cl N NH , CF3 54 O H N O O O N N N S 53 O N H N N N , NH O O NH 52 , N O N N O 51 H N O 59 , , Cl O H N O S O N N NH O 60 H N F O S O N N NH N N N N , F O N , O S N N N NH H N O NH 50 O N N N H N H N O O 61 25 , UA 99483 C2 OCH3 O H N O S O N N NH H N O O S O N N NH N N N N 62 63 , , NH2 O H N O S O N N NH NH 65 , N O N S NH N 66 N H N O S O NH N H N , H N 75 S H N O N NH N , 5 S , O O , O 74 O O N N N H N O 69 NH O 72 H N , H N O N NH , N O N N O H N NH2 O NH H N N N 64 H N O S O N N N N O H N O 76 NO2 H N O та їх фармацевтично прийнятних солей. У деяких варіантах здійснення цим винаходом пропонується сполука, яка являє собою 26 UA 99483 C2 O H N N NH N N 13 , або її фармацевтично прийнятна сіль. У деяких варіантах здійснення цим винаходом пропонується сполука, яка являє собою 5 O H N N NH N N 37 10 15 20 25 30 35 40 45 , або її фармацевтично прийнятна сіль. У деяких варіантах здійснення цим винаходом пропонується спосіб хімічної сенсибілізації ракових клітин у ссавця, якому потрібна хіміотерапія, який включає введення згаданому ссавцеві сполуки Формули (І), як описано у цьому описі винаходу, або її фармацевтично прийнятної солі. У деяких варіантах здійснення згаданий ссавець - це людина. У деяких варіантах здійснення згадане введення - це введення фармацевтичної композиції, яка містить згадану сполуку та фармацевтично прийнятний носій. У деяких варіантах здійснення спосіб хімічної сенсибілізації далі включає введення згаданому ссавцеві хіміотерапевтичного засобу. У деяких варіантах здійснення згадана сполука, що є хімічним сенсибілізатором, та згаданий хіміотерапевтичний засіб вводять по суті одночасно. У деяких варіантах здійснення цим винаходом пропонується спосіб хімічної сенсибілізації ракових клітин у ссавця, якому потрібна хіміотерапія, який включає введення згаданому ссавцеві сполуки, вибраної з групи, що складається зі сполук 7-28, 30-46, 50-66, 69, 72, 74-76 та їх фармацевтично прийнятних солей, як описано у цьому описі винаходу. У деяких варіантах здійснення згаданий ссавець - це людина. У деяких варіантах здійснення згадане введення - це введення фармацевтичної композиції, яка містить згадану сполуку та фармацевтично прийнятний носій. У деяких варіантах здійснення спосіб хімічної сенсибілізації далі включає введення згаданому ссавцеві хіміотерапевтичного засобу. У деяких варіантах здійснення згадана сполука, що є хімічним сенсибілізатором, та згаданий хіміотерапевтичний засіб вводять по суті одночасно. У деяких варіантах здійснення хіміотерапевтичний засіб винаходу вибраний з групи, що складається з темозоломіду, адріаміцину, камптотецину, карбоплатину, цисплатину, даунорубіцину, доцетакселу, доксорубіцину, інтерферону-альфа, інтерферону-бета, інтерферону-гамма, інтерлейкіну 2, іринотекану, паклітакселу, топотекану, таксоїдів, дактиноміцину, данорубіцину, 4’-дезоксидоксорубіцину, блеоміцину, пілкаміцину, мітоміцину, неоміцину, гентаміцину, етопозиду, 4-ОН циклофосфаміду, платинового координаційного комплексу, та їх сумішей. У деяких варіантах здійснення хіміотерапевтичний засіб - це темозоломід або його сіль. У деяких варіантах здійснення цим винаходом пропонується спосіб радіоактивної сенсибілізації ракових клітин у ссавця, якому потрібна радіотерапія, який включає введення згаданому ссавцеві сполуки Формули (І), як описано у цьому описі винаходу, або її фармацевтично прийнятної солі. У деяких варіантах здійснення згаданий ссавець - це людина. У деяких варіантах здійснення згадане введення - це введення фармацевтичної композиції, яка містить згадану сполуку та фармацевтично прийнятний носій. У деяких варіантах здійснення цим винаходом пропонується спосіб радіоактивної сенсибілізації ракових клітин у ссавця, якому потрібна радіотерапія, який включає введення згаданому ссавцеві сполуки, вибраної з групи, що складається зі сполук 7-28, 30-46, 50-66, 69, 72, 74-76 та їх фармацевтично прийнятних солей, як описано у цьому описі винаходу. У деяких варіантах здійснення згаданий ссавець - це людина. У деяких варіантах здійснення згадане 27 UA 99483 C2 5 10 15 20 25 30 35 40 45 50 введення - це введення фармацевтичної композиції, яка містить згадану сполуку та фармацевтично прийнятний носій. У деяких варіантах здійснення цим винаходом пропонується фармацевтична композиція, яка містить сполуку Формули (І), як описано у цьому описі винаходу, або її фармацевтично прийнятну сіль, та фармацевтично прийнятний носій. У деяких варіантах здійснення фармацевтична композиція далі містить хіміотерапевтичний засіб, як описано у цьому описі винаходу. У деяких варіантах здійснення цим винаходом пропонується фармацевтична композиція, яка містить сполуку, вибрану з групи, що складається зі сполук 7-28, 30-46, 50-66, 69, 72, 74-76 та їх фармацевтично прийнятних солей, як описано у цьому описі винаходу. У деяких варіантах здійснення фармацевтична композиція далі містить хіміотерапевтичний засіб, як описано у цьому описі винаходу. У деяких варіантах здійснення ракові клітини, які лікуються за допомогою способів хімічної сенсибілізації та/або радіоактивної сенсибілізації цього винаходу, вибрані з групи, яка складається з пухлин, що виробляють ACTH (адренокортикотропний гормон - АКТГ), гострого лімфолейкозу, гострого нелімфоцитарного лейкозу, раку кори надниркових залоз, раку сечового міхура, раку головного мозку, раку молочної залози, раку шийки матки, хронічного лімфолейкозу, хронічного мієлолейкозу, раку товстої кишки, Т-клітинної лімфоми шкіри, ендометріального раку (раку внутрішності матки), раку стравоходу, саркоми Евінга, раку жовчного міхура, волосяноклітинного лейкозу, раку шиї та голови, лімфоми Ходжкіна, саркоми Капоши, раку нирки, раку печінки, раку легенів (дрібноклітинного та/або недрібноклітинного), злоякісної перитонеальної ефузії, злоякісної плевральної ефузії, меланоми, мезотеліоми, множинної мієломи, нейробластоми, лімфоми не Ходжкіна, остеосаркоми, раку яєчника, яєчникового раку (статевих клітин), раку простати, раку підшлункової залози, раку статевого члена, ретинобластоми, раку шкіри, саркоми м’якої тканини, плоскоклітинного раку, раку шлунку, раку яєчка, раку щитовидної залози, трофобластичних пухлин, раку матки, вагінального раку, раку піхви та пухлини Уїлма. У деяких варіантах здійснення ракові клітини, які лікуються за допомогою способів хімічної сенсибілізації та/або радіоактивної сенсибілізації цього винаходу, вибрані з групи, що складається з раку головного мозку, меланоми, раку шиї та голови, раку яєчка, раку яєчника, раку молочної залози, недрібноклітинного раку легенів та раку прямої кишки. У деяких варіантах здійснення цим винаходом пропонується спосіб лікування ссавця, що має рак, який характеризується наявністю дефекту у гомологічному рекомбінаційному (HR) шляху репарації дволанцюгової ДНК, при цьому спосіб включає введення згаданому ссавцеві сполуки Формули (І), як описано у цьому описі винаходу, або її фармацевтично прийнятної солі. У деяких варіантах здійснення ссавець - це людина. У деяких варіантах здійснення згадане введення - це введення фармацевтичної композиції, яка містить згадану сполуку та фармацевтично прийнятний носій. У деяких варіантах здійснення ракові клітини мають фенотип, вибраний з групи, що складається з і) дефекту BRCA-1, іі) дефекту BRCA-2, ііі) дефекту BRCA-1 та BRCA-2 та iv) анемії Фанконі. У деяких варіантах здійснення ракові клітини вибрані з раку молочної залози або раку яєчника. У деяких варіантах здійснення цим винаходом пропонується спосіб лікування ссавця, що має рак, який характеризується наявністю дефекту у гомологічному рекомбінаційному (HR) шляху репарації дволанцюгової ДНК, при цьому спосіб включає введення згаданому ссавцеві сполуки, вибраної з групи, що складається зі сполук 7-28, 30-46, 50-66, 69, 72, 74-76 та їх фармацевтично прийнятних солей, як описано у цьому описі винаходу. У деяких варіантах здійснення ссавець - це людина. У деяких варіантах здійснення згадане введення - це введення фармацевтичної композиції, яка містить згадану сполуку та фармацевтично прийнятний носій. У деяких варіантах здійснення ракові клітини мають фенотип, вибраний з групи, що складається з і) дефекту BRCA-1, іі) дефекту BRCA-2, ііі) дефекту BRCA-1 та BRCA-2 та iv) анемії Фанконі. У деяких варіантах здійснення ракові клітини вибрані з раку молочної залози або раку яєчника. Процедури синтезу описаних сполук Схема 1 55 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds-inhibitors parp, compositions and use thereof
Автори англійськоюXu, Weizheng, Delahanty, Greg, Wei, Ling, Zhang, Jie
Назва патенту російськоюСоединения-ингибиторы parp, композиции и их применение
Автори російськоюСу Вайженг, Делаханти Грег, Вай Линг, Жанг Джи
МПК / Мітки
МПК: A01N 43/54
Мітки: застосування, композиції, parp, сполуки-інгібітори
Код посилання
<a href="https://ua.patents.su/62-99483-spoluki-ingibitori-parp-kompozici-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Сполуки-інгібітори parp, композиції та їх застосування</a>
Попередній патент: Пристрій для отримання коптильної рідини
Випадковий патент: Лобовий фрикційний варіатор