Похідні піридину, заміщені гетероциклічним кільцем і фосфоноксиметильною групою, і протигрибковий засіб, що їх містить
Формула / Реферат
1. Сполука, представлена наступною формулою (І):
 , (І)
, (І)
де
R1 являє собою атом водню, атом галогену, аміногрупу, R11-NH- (де R11 являє собою С1-6алкільну групу, гідроксіС1-6алкільну групу, С1-6алкоксіС1-6алкільну групу або С1-6алкоксикарбонілС1-6алкільну групу), R12-(CO)-NH- (де R12 являє собою С1-6алкільну групу або С1-6алкоксіС1-6алкільну групу), С1-6алкільну групу, гідроксіС1-6алкільну групу, ціаноС1-6алкільну групу, С1-6алкокси групу або С1-6алкоксіС1-6алкільну групу;
R2 являє собою атом водню, С1-6алкільну групу, аміногрупу або ді-С1-6алкіламіногрупу;
один з X і Υ являє собою атом азоту, а інший являє собою атом азоту або атом кисню;
кільце А являє собою 5- або 6-членне гетероарильне кільце або бензольне кільце, що може мати один або два атоми галогену або С1-6алкільні групи;
Ζ являє собою одинарний зв'язок, метиленову групу, етиленову групу, атом кисню, атом сірки, -СН2О-, -ОСН2-, -ΝΗ-, -CH2NH-, -NHCH2-, -CH2S- або -SCH2-;
R3 являє собою атом водню або атом галогену, або С1-6алкільну групу, С3-8циклоалкільну групу, С6-10арильну групу, 5- або 6-членну гетероарильну групу або 5- або 6-членну неароматичну гетероциклічну групу, причому ці групи можуть мати один або два замісники, вибрані із групи замісників α; і
R4 являє собою атом водню або атом галогену;
група замісників α:
атом галогену, ціаногрупа, С1-6алкільна група, С1-6алкоксигрупа, С1-6алкоксикарбонільна група, С3-8циклоалкільна група, С2-6алкенільна група і С2-6алкінільна група),
або їїсіль.
2. Сполука або її сіль за п. 1, де сіль сполуки, представленою формулою (І), є сіллю, представленою наступною формулою (ІА):
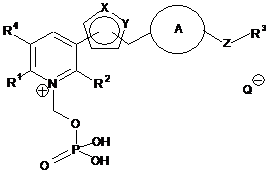 , (ІА)
, (ІА)
де
Q- являє собою фармацевтично прийнятний аніон.
3. Сполука або її сіль за п. 1, де сіль сполуки, представленою формулою (І), є сіллю, представленою наступною формулою (IB):
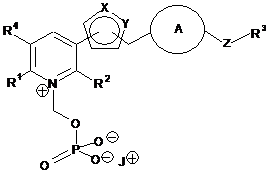 , (IB)
, (IB)
де
J+ являє собою фармацевтично прийнятний катіон.
4. Сполука або її сіль за будь-яким одним з пп. 1-3, де часткова структура, представлена наступною формулою (II):
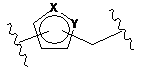 , (II)
, (II)
сполуки, представленої формулою вище (І), (ІА) або (IB), являє собою часткову структуру, вибрану з наступної групи:
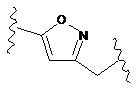 , (III)
, (III) 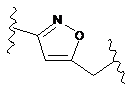 , (IV)
, (IV)
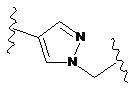 , (V)
, (V) 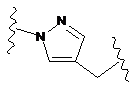 (VI).
(VI).
5. Сполука або її сіль за будь-яким одним з пп. 1-4, де один з X і Υ являє собою атом азоту та інший являє собою атом кисню.
6. Сполука або її сіль за п. 4, де часткова структура, представлена наступною формулою (II):
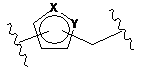 , (II)
, (II)
сполуки, представленої формулою вище (І), (ІА) або (IB), являє собою часткову структуру, представлену наступною формулою (III):
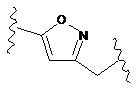 , (III)
, (III)
або часткову структуру, представлену наступною формулою (IV):
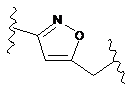 (IV).
(IV).
7. Сполука або її сіль за будь-яким одним з пп. 1-4, де обидва з X і Υ являють собою атоми азоту.
8. Сполука або її сіль за п. 7, де часткова структура, представлена наступною формулою (II):
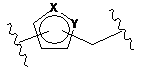 , (II)
, (II)
сполуки, представленої формулою вище (І), (ІА) або (IB), являє собою часткову структуру, представлену наступною формулою (V):
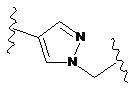 , (V)
, (V)
або часткову структуру, представлену наступною формулою (VI):
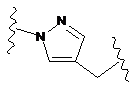 (VI).
(VI).
9. Сполука або її сіль за будь-яким одним з пп. 1-8, де R2 являє собою аміногрупу.
10. Сполука або її сіль за п. 9, де R1 являє собою атом водню, аміногрупу або С1-6алкоксіС1-6алкільну групу.
11. Сполука або її сіль за будь-яким одним з пп. 1-8, де R1 являє собою аміногрупу і R2 являє собою атом водню.
12. Сполука або її сіль за будь-яким одним з пп. 1-11, де кільце А являє собою піридинове кільце, бензольне кільце, фуранове кільце, тіофенове кільце або пірольне кільце.
13. Сполука або її сіль за п. 12, де кільце А являє собою піридинове кільце або бензольне кільце.
14. Сполука або її сіль за будь-яким одним з пп. 1-13, де Ζ являє собою атом кисню, -СН2О- або -ОСН2-.
15. Сполука 2-аміно-1-((фосфонокси)метил)-3-(3-((4-((2-піридинілокси)метил)феніл)-метил)-5-ізоксазоліл)-піридиніуму, представлена наступною формулою
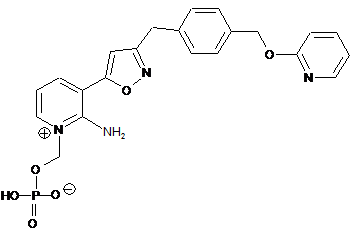 ,
,
або її сіль.
16. Фармацевтична композиція, що містить як активний інгредієнт сполуку або її сіль за будь-яким одним з пп. 1-15.
17. Лікарський засіб, що містить сполуку або її сіль за будь-яким одним з пп. 1-15.
18. Протигрибковий засіб, що включає як активний інгредієнт сполуку або її сіль за будь-яким одним з пп. 1-15.
19. Спосіб профілактики і/або лікування грибкового захворювання шляхом введення суб'єкту, який цього потребує, фармацевтично ефективної кількості сполуки або її солі за будь-яким одним з пп. 1-15.
20. Застосування сполуки або її солі за будь-яким одним з пп. 1-15 для виготовлення протигрибкового засобу.
Текст
Реферат: Даний винахід стосується протигрибкового засобу, який має відмінну протигрибкову дію та відзначається відмінними фізичними властивостями, а саме його розчинністю у воді та безпекою водних розчинів, це також стосується утилізації відходів. Відповідно до даного винаходу, описано сполуку та її солі, представлені формулою (І). В цій 1 формулі R являє собою атом водню, атом галогену, аміногрупу, алкільну групу, 2 гідроксіалкільну групу, ціаноалкільну групу, алкоксигрупу, алкоксіалкільну групу і т. і.; R являє собою атом водню, алкільну групу, аміногрупу і т. і.; один з X і Υ являє собою атом азоту, а інший являє собою атом азоту або атом кисню; кільце А являє собою гетероарильне кільце або 3 бензольне кільце; Ζ являє собою одинарний зв'язок, метиленову групу, -СН2О- і т. і.; R являє собою атом водню, атом галогену, алкільну групу, циклоалкільну групу, арильну групу, 4 гетероарильну групу або неароматичну гетероциклічну групу; і R являє собою атом водню або атом галогену. UA 99637 C2 (12) UA 99637 C2 X Y 4 R R1 A z R3 R2 N (I) O O P O OH UA 99637 C2 5 10 15 20 25 30 35 Галузь винаходу Даний винахід стосується нових похідних піридину, заміщених гетероциклічним кільцем і фосфоноксиметильною групою, і протигрибкових засобів, що їх містять. Передумови винаходу В останні роки способи керування опортуністичними інфекціями як ніколи стають усе більш і більш важливими через зростання числа осіб літнього віку і пацієнтів з ослабленим імунітетом у результаті сучасних хіміотерапій або подібного. Тому що дійсно продемонстровано, що опортуністичні інфекції виникають одна за іншою під дією різних авірулентних патогенів, то показано, що проблема інфекційного захворювання не закінчиться доти, поки існують зазначені захворювання, що послабляють імунні функції пацієнтів. Отже, нові стратегії контролю над інфекційними хворобами, включаючи проблему патогену, резистентного до лікарських засобів, будуть однією з важливих проблем швидко старіючого суспільства. В галузі протигрибкових засобів, для лікування глибоких мікозів раніше були розроблені, наприклад, амфотерицин B, заснований на полієновому кістяку, флюконазол, ітраконазол і вориконазол, що засновані на азольному кістяку, або подібні. Більшість вже існуючих лікарських препаратів, що вже є комерційно доступними, мають подібний механізм дії, і в даний час з'явилися проблеми з тим, що виникли гриби, резистентні до азолів або подібного. В останні роки був розроблений як інгібітор 1,3-β-глюкан синтетази з новим механізмом, похідні сполук, що зустрічаються в природі, циклічні гексапептиди каспофунгін і микафунгін або подібне; однак, через те, що ці засоби існують тільки у формі ін'єкцій, вони дотепер незначно використовуються як протигрибкові засоби. Тому що виникали ситуації, у яких вже існуючі протигрибкові засоби є несуттєвими для лікування глибоких мікозів, існує потреба і необхідність для розробки засобів, що засновані на новому механізмі і мають високий ступінь безпеки. Як матеріали, використані при експертизі заявки, у відношенні протигрибкових засобів, заснованих на такому новому механізмі, Патентні Документи 1 і 2 описують похідні піридину, що демонструють ефекти проти появи, прогресу і персистування інфекцій шляхом інгібування експресії протеїнів клітинної стінки, інгібування зборки клітинної стінки, а також адгезії на клітинах, і запобігання прояву патогенами своєї патогенності, у процесі, в якому інгібується транспорт GPI (глікозилфосфатидилінозитол)прикріплених протеїнів до клітинного стінки. У світлі даної ситуації, у Патентному документі 3 була запропонована гетероциклічнозаміщена похідна піридину як протигрибковий засіб, що має відмінну протигрибкову дію, що не спостерігалася в традиційних протигрибкових засобах, і також вона є чудовою у відношенні його властивостей, безпеки і метаболичної стабільності. З іншого боку, Патентні документи 4 і 5 описують пролікарські засоби Nфосфорилоксиметилу, сполуки яких представлені наступною формулою, як водорозчинні пролікарські засоби: 40 45 50 (де R1, R2, і R3 являють собою замісники, включаючи первинний четвертинний або вторинний амін, кожний з R4 і R5 являє собою органічний або неорганічний залишок, і X являє собою катіонну органічну або неорганічну сіль.) Проте, водорозчинні пролікарські засоби, відомі на даний час, не володіють чудовою протигрибковою дією, заснованою на інгібуванні процесу транспорту GPI-прикріплених протеїнів, а також не мають відмінних характеристик розчинності у воді, стабільності у водному розчині, так само як і характеристик безпеки і in vivo кінетичних характеристик, і створення кращого протигрибкового засобу є бажаним. Патентний документ 1: видання Публікації Міжнародної Заявки WO 02/04626 Патентний документ 2: видання Публікації Міжнародної Заявки WO 05/033079 1 UA 99637 C2 5 10 Патентний документ 3: видання Публікації Міжнародної Заявки WO 07/052615 Патентний документ 4: Патент США № 6235728 B1 Патентний документ 5: Публікація Патенту Японії № 2001-527083 Опис винаходу Проблеми, які потрібно вирішити даним винаходом У світлі даних ситуацій, об'єктом даного винаходу є забезпечення протигрибкового засобу, що має відмінну протигрибкову дію, і також є відмінним у відношенні розчинності у воді, своєї стабільності у водному розчині і своєї безпеки та in vivo кінетичним характеристикам. У результаті кропіткого дослідження, проведеного у світлі викладених вище ситуацій, автори винаходу удосконалили даний винахід, відкривши дані, що сполуки, представлені наступною формулою (I): X Y 4 R A z R1 R3 R2 N (I) O O 15 P O OH і що мають групу фосфоноксиметилу на атомі азоту на похідній піридину, мають відмінну протигрибкову дію і є також відмінними у відношенні розчинності у воді, своєї стабільності у водному розчині і своєї безпеки та in vivo кінетичним характеристикам. Зокрема, у першому аспекті даного винаходу, забезпечують: [1] Сполуку, представлену наступною формулою (I): 20 X Y 4 R R1 A z R3 R2 N (I) O O 25 30 35 40 P O OH (де 1 11 11 R являє собою атом водню, атом галогену, аміногрупу, R -NH- (де R являє собою C1-6 алкільну групу, гідрокси C1-6 алкільну групу, C1-6 алкокси C1-6 алкільну групу або C1-6 12 12 алкоксикарбоніл C1-6 алкільну групу), R -(СО)-NH- (де R являє собою C1-6 алкільну групу або C1-6 алкокси C1-6 алкільну групу), C1-6 алкільну групу, гідрокси C1-6 алкільну групу, ціано C1-6 алкільну групу, C1-6 алкокси групу або C1-6 алкокси C1-6 алкільну групу; 2 R являє собою атом водню, C1-6 алкільну групу, аміногрупу або ди- C1-6 алкіламіно групу; один з X і Y являє собою атом азоту, а інший являє собою атом азоту або атом кисню; кільце A являє собою 5- або 6-членне гетероарильне кільце або бензольне кільце, що може мати один або два атоми галогену або C1-6 алкільні групи; Z являє собою одинарний зв'язок, метиленову групу, етиленову групу, атом кисню, атом сірки, -CH2O-, -OCH2-, - NH-, -CH2 NH-, - NHCH2-, -CH2S- або -SCH2-; 3 R являє собою атом або водню атом галогену, або C1-6 алкільну групу, C3-8 циклоалкільну групу, C6-10 арильну групу, 5- або 6-членну гетероарильну групу, або 5- або 6-членну неароматичну гетероциклічну групу, де ці групи можуть мати один або два замісники, вибраних із групи замісників ; і 4 R являє собою атом водню або атом галогену; [група замісників ] 2 UA 99637 C2 атом галогену, ціано група, C1-6 алкільна група, C1-6 алкокси група, C1-6 алкоксикарбонільна група, C3-8 циклоалкільна група, C2-6 алкенільна група, і C2-6 алкінільна група), або її сіль. [2] Сполука або її сіль за пунктом [1], де сіль сполуки, представленої наступною формулою (I), є сіллю, представленою наступною формулою (IA): 5 X R Y 4 A R3 z R1 R2 N (IA) Q O P OH O OH 10 де Q являє собою фармацевтично прийнятний аніон. [3] Сполука або її сіль за пунктом [1], де сіль сполуки, представленої наступною формулою (I), є сіллю, представленою наступною формулою (IB): X Y R4 A R3 z R1 R2 N (IB) O P O O J O 15 де + J являє собою фармацевтично прийнятний катіон. [4] Сполука або її сіль за будь-яким із пунктів [1] – [3], де часткова структура, представлена наступною формулою (II): 20 X Y (II) сполуки, представленої вище формулою (I), (IA), або (IB), являє собою часткову структуру, вибрану з наступних груп: 25 O N N O (III) (IV) N N N N (V) (VI) . 3 UA 99637 C2 5 [5] Сполука або її сіль за кожним із пунктів [1] - [4], де один з X і Y являє собою атом азоту, а інший являє собою атом кисню. [6] Сполука або її сіль за пунктом [4], де часткова структура, представлена наступною формулою (II): X Y 10 (II) сполуки, представленої вище формулою (I), (IA) або (IB) являє собою часткову структуру, представлену наступною формулою (III): O N (III) чи часткову структуру, представлену наступною формулою (IV): 15 N O (IV) 20 . [7] Сполука або її сіль за кожним із пунктів [1] - [6], де обидва X і Y являють собою атоми азоту. [8] Сполука або її сіль за пунктом [7], де часткова структура, представлена наступною формулою (II): X Y 25 (II) сполуки, представленої вище формулою (I), (IA) або (IB), являє собою часткову структуру, представлену наступною формулою (V): N N (V) 30 чи часткову структуру, представлену наступною формулою (VI): N N (VI) . 4 UA 99637 C2 2 5 10 15 20 [9] Сполука або її сіль за кожним із пунктів [1] - [8], де R являє собою аміногрупу. 1 [10] Сполука або її сіль за пунктом [9], де R являє собою атом водню, аміногрупу або C1-6 алкокси C1-6 алкільну групу. 1 2 [11] Сполука або її сіль за кожним із пунктів [1] - [8], де R являє собою аміногрупу і R являє собою атом водню. [12] Сполука або її сіль за кожним із пунктів [1] - [11], де кільце A являє собою піридинове кільце, бензольне кільце, фуранове кільце, тіофенове кільце або пірольне кільце. [13] Сполука або її сіль за пунктом [12], де кільце A являє собою піридинове або кільце бензольне кільце. [14] Сполука або її сіль за кожним із пунктів [1] - [13], де Z являє собою атом кисню, -CH2Oабо -OCH2-. [15] Фармацевтична композиція, що включає: сполуку або її сіль за кожним із пунктів [1] [14]. [16] Лікарський засіб, що включає: сполуку або її сіль за кожним із пунктів [1] - [14]. [17] Протигрибковий засіб, що включає як активний інгредієнт сполуку або її сіль за кожним із пунктів [1] - [14]. [18] Спосіб профілактики і/або лікування грибкового захворювання шляхом введення фармацевтично ефективної кількості сполуки або її солі за кожним із пунктів [1] - [14]. [19] Застосування сполуки або її солі за кожним із пунктів [1] - [14] для виробництва протигрибкового засобу. Крім того, у другому аспекті даного винаходу, забезпечують: [20] Спосіб одержання сполуки, представленої наступною формулою (I): X Y 4 R R1 A z R3 R2 N (I) O O P O OH 25 30 35 40 45 (де 1 11 11 R являє собою атом водню, атом галогену, аміногрупу, R -NH- (де R являє собою C1-6 алкільну групу, гідрокси C1-6 алкільну групу, C1-6 алкокси C1-6 алкільну групу або C1-6 12 12 алкоксикарбоніл C1-6 алкільну групу), R -(СО)-NH- (де R являє собою C1-6 алкільну групу або C1-6 алкокси C1-6 алкільну групу), C1-6 алкільну групу, гідрокси C1-6 алкільну групу, ціано C1-6 алкільну групу, C1-6 алкокси групу або C1-6 алкокси C1-6 алкільну групу; 2 R являє собою атом водню, C1-6 алкільну групу, аміногрупу або ді- C1-6 алкіламіно групу; один з X і Y являє собою атом азоту, а інший являє собою атом азоту або атом кисню; кільце A являє собою 5- або 6-членне гетероарильне кільце або бензольне кільце, що може мати один або два атоми галогену або C1-6 алкільні групи; Z являє собою одинарний зв'язок, метиленову групу, етиленову групу, атом кисню, атом сірки, -CH2O-, -OCH2-, - NH-, -CH2 NH-, - NHCH2-, -CH2S- або -SCH2-; 3 R являє собою атом водню або атом галогену, або C1-6 алкільну групу, C3-8 циклоалкільну групу, C6-10 арильну групу, 5- або 6-членну гетероарильну групу, або 5- або 6-членну неароматичну гетероциклічну групу, де ці групи можуть мати один або два замісники, вибраних із групи замісників ; і 4 R являє собою атом водню або атом галогену; [група замісників ] атом галогену, ціано група, C1-6 алкільна група, C1-6 алкокси група, C1-6 алкоксикарбонільна група, C3-8 циклоалкільна група, C2-6 алкенільна група і C2-6 алкінільна група), що включає стадії, на яких: проводять реакцію сполуки, представленої наступною формулою (1) і хлорметилового ефіру ди-трет-бутилового ефіру фосфорної кислоти у присутності основи; і 5 UA 99637 C2 X R4 R1 N A Y Z R3 NH2 (1) 1 5 3 4 (де кільце A, R , R , R , X, Y і Z мають такі ж значення, як позначено вище) піддають обробці кислотою. [21] Спосіб за пунктом [20], де основою є йодид натрію. [22] Спосіб за пунктом [20] або [21], де кислотою є трифтороцтова або кислота соляна кислота. [23] Спосіб одержання солі сполуки, представленої наступною формулою (IA): X R Y 4 A z R1 R3 R2 N Q (IA) O O 10 P OH OH 1 15 3 4 (де кільце A, R , R , R , X, Y і Z мають такі ж значення, як позначено вище, і Q являє собою фармацевтично прийнятний аніон) включає реакцію сполуки, отриманої способом за кожним із пунктів [20] - [22], і кислоти. [24] Спосіб за пунктом [23], де кислоту вибирають із групи, що містить соляну кислоту, бромисто-водневу кислоту, азотну кислоту і сірчану кислоту. [25] Спосіб одержання солі сполуки, представленої наступною формулою (IB): X Y 4 R A z R1 R3 R2 N (IB) O P O O O J 20 25 30 1 3 4 + (де кільце A, R , R , R , X, Y і Z мають такі ж значення, як позначено вище, і J являє собою фармацевтично прийнятний катіон) що включає проведення реакції сполуки, отриманої способом за кожним із пунктів [20] - [22], і основи. [26] Спосіб за пунктом [25], де основа вибрана з групи, що включає гідроксид літію, гідроксид натрію, гідроксид калію, гідроксид кальцію і лізин. Переважні ефекти винаходу Сполука, представлена формулою (I), (IA) або (IB) (далі в даному описі названа для простоти "сполука відповідно до даного винаходу") 1) діє проти виникнення, розвитку і персистування інфекцій шляхом інгібування біосинтезу грибкового GPI, тим самим, інгібування експресії протеїнів клітинної стінки і блокування зборки клітинної стінки, тим самим, перешкоджаючи прикріпленню гриба до клітин, так що патоген не може стати патогенним, і 2) є чудовим у відношенні фізичних властивостей, і, зокрема, своєї розчинності у воді, своєї стабільності у водному розчині і своєї безпеки та in vivo кінетичним характеристикам, що робить 6 UA 99637 C2 5 10 15 20 25 30 35 40 45 50 55 60вищезгадані сполуки особливо корисними як профілактичний або терапевтичний засіб для грибкових інфекцій. Короткий опис фігур Фіг. 1 показує рентгенограму безводної форми 2-аміно-1-((фосфонокси)метил)-3-(3-((4-((2піридинілокси)метил)феніл)метил)-5-ізоксазоліл)піридинію (тип 1), отриманої в Прикладі 2 даного винаходу; Фіг. 2 показує рентгенограму безводної форми 2-аміно-1-((фосфонокси)метил)-3-(3-((4-((2піридинілокси)метил)феніл)метил)-5-ізоксазоліл)піридинію (тип 2), отриманої в Прикладі 3 даного винаходу; Фіг. 3 показує рентгенограму безводної форми 2-аміно-1-((фосфонокси)метил)-3-(3-((4-((2піридинілокси)метил)феніл)метил)-5-ізоксазоліл)-піридинію (тип 3), отриманої в Прикладі 4 даного винаходу; Фіг. 4 показує рентгенограму гідрату 2-аміно-1-((фосфонокси)метил)-3-(3-((4-((2піридинілокси)метил)феніл)метил)-5-ізоксазоліл)-піридинію, отриманого в Прикладі 5 даного винаходу; Фіг. 5 показує рентгенограму сольвату оцтової кислоти 2-аміно-1-((фосфонокси)метил)-3-(3((4-((2-піридинілокси)метил)феніл)метил)-5-ізоксазоліл)-піридинію, отриманого в Прикладі 6 даного винаходу; Фіг. 6 показує рентгенограму аморфного 2-аміно-1-((фосфонокси)метил)-3-(3-((4-((2піридинілокси)метил)феніл)метил)-5-ізоксазоліл)-піридинію, отриманого в Прикладі 7 даного винаходу; Фіг. 7 показує рентгенограму моногідрохлорида 2-аміно-1-((фосфонокси)метил)-3-(3-((4-((2піридинілокси)метил)феніл)метил)-5-ізоксазоліл)-піридинію, отриманого в Прикладі 8 даного винаходу; Фіг. 8 показує рентгенограму гемісульфату 2-аміно-1-((фосфонокси)метил)-3-(3-((4-((2піридинілокси)метил)феніл)метил)-5-ізоксазоліл)-піридинію, отриманого в Прикладі 10 даного винаходу; Фіг. 9 показує рентгенограму мононітрата 2-аміно-1-((фосфонокси)метил)-3-(3-((4-((2піридинілокси)метил)феніл)метил)-5-ізоксазоліл)-піридинію, отриманого в Прикладі 11 даного винаходу; Фіг. 10 показує рентгенограму моногідроброміду 2-аміно-1-((фосфонокси)метил)-3-(3-((4-((2піридинілокси)метил)феніл)метил)-5-ізоксазоліл)-піридинію, отриманого в Прикладі 12 даного винаходу; Фіг. 11 показує рентгенограму натрієвої солі 2-аміно-1-((фосфонокси)метил)-3-(3-((4-((2піридинілокси)метил)феніл)метил)-5-ізоксазоліл)-піридинію, отриманої в Прикладі 13 даного винаходу; Фіг. 12 показує рентгенограму гемікальцієвої солі 2-аміно-1-((фосфонокси)метил)-3-(3-((4((2-піридинілокси)метил)феніл)метил)-5-ізоксазоліл)-піридинію, отриманої в Прикладі 14 даного винаходу; Фіг. 13 показує рентгенограму літієвої солі 2-аміно-1-((фосфонокси)метил)-3-(3-((4-((2піридинілокси)метил)феніл)метил)-5-ізоксазоліл)-піридинію, отриманої в Прикладі 15 даного винаходу; Фіг. 14 показує рентгенограму калієвої солі 2-аміно-1-((фосфонокси)метил)-3-(3-((4-((2піридинілокси)метил)феніл)метил)-5-ізоксазоліл)-піридинію, отриманої в Прикладі 16 даного винаходу; Фіг. 15 показує графік результатів виміру концентрації в плазмі сполуки Прикладу 1 і активної форми (вихідна сполука для сполуки Прикладу 1), обмірюваних шляхом фармакокинетического аналізу у мишей в одному аспекті даного винаходу; і Фіг. 16 показує графік результатів виміру концентрації в плазмі сполуки Прикладу 1 і активної форми (вихідна сполука для сполуки Прикладу 1), обмірюваних шляхом фармакокинетического аналізу у мавп в іншому аспекті даного винаходу. Кращий варіант для здійснення даного винаходу Даний винахід пояснюється нижче більш детально шляхом посилань на символи і визначення термінів, використовуваних у даному описі, і наступних прикладів. Однак даний винахід не обмежується наступними варіантами здійснення винаходу, і різні модифікації можуть бути зроблені, не відхиляючись від його суті. У даному описі структурна формула сполуки іноді являє собою певний ізомер для зручності опису. Однак сполуки відповідно до даного винаходу можуть включати всі можливі ізомери, такі як структурно можливі геометричні ізомери, оптичні ізомери, утворені в результаті присутності асиметричних атомів вуглецю, стереоізомери, таутомери і суміші ізомерів, і не обмежуються 7 UA 99637 C2 5 10 15 20 25 30 35 40 45 50 55 60 формулами, використовуваними для зручності опису, і можуть бути як одним з двох ізомерів, так і сумішшю обох ізомерів. Таким чином, сполуки відповідно до даного винаходу можуть бути як оптично активними сполуками, що мають асиметричний атом вуглецю у своїх молекулах, так і їх рацематами, і не обмежуються яким-небудь одним з них, але включають як одні так і інші. Більш того, сполуки відповідно до даного винаходу можуть виявляти кристалічний поліморфізм, але також не обмежуються яким-небудь з них, але можуть бути в будь-якій з цих кристалічних форм або існувати як суміш двох або більше кристалічних форм. Сполуки відповідно до даного винаходу також включають як безводну форму, так і сольвати, такі як гідратовані форми. Термін "C1-6 алкільна група", що використовується у даному описі, стосується алкільної групи з нерозгалуженим або розгалуженим ланцюгом з від 1 до 6 атомами вуглецю, що є одновалентною групою, включеною шляхом видалення будь-якого атому водню з аліфатичного вуглеводню з атомами вуглецю від 1 до 6. Зокрема, приклади "C1-6 алкільної групи" можуть включати метильну групу, етильну групу, N-пропільну групу, ізопропільну групу, N-бутильну групу, ізобутильну групу, втор-бутильну групу, трет-бутильну групу, N-пентильну групу, ізопентильну групу, втор-пентильну групу, неопентильну групу, 1-метилбутильну групу, 2метилбутильну групу, 1,1-диметилпропільну групу, 1,2-диметилпропільну групу, N-гексильну групу, ізогексильну групу, 1-метилпентильну групу, 2-метилпентильну групу, 3-метилпентильну групу, 1,1-диметилбутильну групу, 1,2-диметилбутильну групу, 2,2-диметилбутильну групу, 1,3диметилбутильну групу, 2,3-диметилбутильну групу, 3,3-диметилбутильну групу, 1етилбутильну групу, 2-етилбутильну групу, 1,1,2,-триметилпропільну групу, 1,2,2триметилпропільну групу, 1-етил-1-метилпропільну групу, 1-етил-2-метилпропільну групу або подібне, переважно метильну групу, етильну групу, N-пропільну групу, ізопропільну групу, Nбутильну групу, ізобутильну групу, втор-бутильну групу або трет-бутильну групу, або подібне. Термін "C2-6 алкенільна група", що використовується у даному описі, стосується алкенільної групи з нерозгалуженим або розгалуженим ланцюгом з 2-6 атомами вуглецю, що може містити 1 або 2 подвійні зв'язки. Зокрема, приклади "C2-6 алкенільной групи" можуть включати етенільну групу, 1-пропенільну групу, 2-пропенільну групу, 1-бутенільну групу, 2-бутенільну групу, 3бутенільну групу, 2-метил-1-пропенільну групу, пентенільну групу, 3-метил-2-бутенільну групу, гексенільну групу, гександієнільну групу або подібне, переважно етенільну групу, 1-пропенільну групу, 2-пропенільну групу, 1-бутенільну групу, 2-бутенільну групу, 3-бутенільну групу, 2-метил1-пропенільну групу, 3-метил-2-бутенільну групу або подібне. Термін "C2-6 алкінільна група", що використовується у даному описі, стосується алкінільної групи з нерозгалуженим або розгалуженим ланцюгом з 2-6 атомами вуглецю, що може містити 1 або 2 потрійні зв'язки. Зокрема, приклади "C2-6 алкінільної групи" можуть включати етинільну групу, 1-пропінільну групу, 2-пропінільну групу, 1-бутинільну групу, 2-бутинільну групу, 3бутинільну групу, пентинільну групу, гексинільну групу, гександіінільну групу або подібне, переважно етинільну групу, 1-пропінільну групу, 2-пропінільну групу, 1-бутинільну групу, 2бутинільну групу, 3-бутинільну групу або подібне. Термін "C3-8 циклоалкільна група", що використовується у даному описі, стосується циклічної аліфатичної вуглеводної групи з 3-8 атомами вуглецю. Зокрема, приклади "C3-8 циклоалкільної групи" можуть включати циклопропільну групу, циклобутильну групу, циклопентильну групу, циклогексильну групу, циклогептильну групу, циклооктильну групу або подібне, переважно циклопропільну групу, циклобутильну групу, циклопентильну групу, циклогексильну групу або подібне. Термін "C1-6 алкокси група", що використовується у даному описі, стосується групи, де атом кисню з'єднаний із закінченням "C1-6 алкільної групи", як визначено вище. Зокрема, приклади "C1-6 алкокси групи" можуть включати метокси групу, етокси групу, N-пропокси групу, ізопропокси групу, N-бутокси групу, ізобутокси групу, втор-бутокси групу, трет-бутокси групу, N-пентилокси групу, ізопентилокси групу, втор-пентилокси групу, неопентилокси групу, 1-метилбутокси групу, 2-метилбутокси групу, 1,1-диметилпропокси групу, 1,2-диметилпропокси групу, N-гексилокси групу, ізогексилокси групу, 1-метилпентилокси групу, 2-метилпентилокси групу, 3метилпентилокси групу, 1,1-диметилбутокси групу, 1,2-диметилбутокси групу, 2,2диметилбутокси групу, 1,3-диметилбутокси групу, 2,3-диметилбутокси групу, 3,3диметилбутокси групу, 1-етилбутокси групу, 2-етилбутокси групу, 1,1,2-триметилпропокси групу, 1,2,2-триметилпропокси групу, 1-етил-1-метилпропокси групу, 1-етил-2-метилпропокси групу або подібне, переважно метокси групу, етокси групу, N-пропокси групу, ізопропокси групу, Nбутокси групу, ізобутокси групу, втор-бутокси групу, трет-бутокси групу або подібне. Термін "гідроксил C1-6 алкільна група", що використовується у даному описі, стосується групи, в якій кожний з атомів водню в "C1-6 алкільній групі", як визначено вище, заміщений на гідроксильну групу. Зокрема, приклади "гідроксил C 1-6 алкільної групи" можуть включати 8 UA 99637 C2 510 15 20 25 30 35 40 45 50 55 60 гідроксиметильну групу, 1-гідроксиетильну групу, 2-гідроксиетильну групу, 1-гідрокси- Nпропільну групу, 2-гідрокси- N-пропільну групу, 3-гідрокси- N-пропільну групу, 1-гідроксиізопропільну групу, 2-гідрокси-ізопропільну групу, 3-гідрокси-ізопропільну групу, 1-гідрокси-третбутильну групу або подібне, переважно гідроксиметильну групу, 1-гідроксиетильну групу, 2гідроксиетильну групу або подібне. Термін "ціано C1-C6 алкільна група", що використовується у даному описі, стосується групи, в якій будь-який атом водню в "C1-6 алкільній групі", як визначено вище, заміщений ціано групою. Конкретні приклади "ціано C1-C6 алкільної групи" включають ціанометильну групу, 1ціаноетильну групу, 2-ціаноетильну групу, 1-ціано- N-пропільну групу, 2-ціано- N-пропільну групу, 3-ціано- N-пропільну групу, 1-ціано-ізопропільну групу, 2-ціано-ізопропільну групу, 3-ціаноізопропільну групу і 1-ціано-трет-бутильну групу, переважно ціанометильну групу, 1ціаноетильну групу, 2-ціаноетильну групу або подібне. Термін "C1-6 алкоксикарбонільна група", що використовується у даному описі, стосується групи, в якій карбонільна група приєднана до закінчення "C1-6 алкокси групи", позначеної вище. Зокрема, приклади "C1-6 алкоксикарбонільної групи" можуть включати метоксикарбонільну групу, етоксикарбонільну групу, N-пропоксикарбонільну групу, ізопропоксикарбонільну групу або подібне. Термін "C1-6 алкоксикарбоніл C1-6 алкільна група", що використовується у даному описі, стосується групи, в якій "C1-6 алкільна група", позначена вище, приєднана до закінчення "C 1-6 алкоксикарбонільної групи", позначеної вище. Зокрема, приклади "C 1-6 алкоксикарбоніл C1-6 алкільної групи" можуть включати метоксикарбоніл метильну групу, метоксикарбоніл етильну групу, етоксикарбоніл метильну групу, етоксикарбоніл етильну групу або подібне. Термін "C6-10 арильна група", що використовується у даному описі, стосується ароматичної вуглеводневої циклічної групи з 6-10 атомами вуглецю. Зокрема, приклади "C6-10 арильної групи" можуть включати фенільну групу, 1-нафтильну групу, 2-нафтильну групу, інденільну групу, азуленільну групу, гепталенільну групу або подібне, переважно фенільну групу, 1нафтильну групу, 2-нафтильну групу або подібне. Термін "C1-6 алкокси C1-6 алкільна група", що використовується у даному описі, стосується групи, в якій кожний з атомів водню в "C1-6 алкільній групі", як позначено вище, заміщений на "C1-6 алкокси групу", як позначено вище. Зокрема, приклади "C1-6 алкокси C1-6 алкільної групи" можуть включати метоксиметильну групу, етоксиметильну групу, N-пропоксиметильну групу, метоксиетильну групу, етоксиетильну групу або подібне. Термін "атом галогену", що використовується у даному описі, стосується атому фтору, атому хлору, атому брому або атому йоду. Термін "гетероатом", що використовується у даному описі, стосується атому азоту, атому сірки або атому кисню. Термін "5- або 6-членне гетероарильне кільце", що використовується у даному описі, стосується ароматичного кільця, в якому кількість атомів, що утворюють кільце, складає 5 або 6, і 1 або більше гетероатомів включені в атоми, що утворюють кільце. Зокрема, приклади "5- або 6-членного гетероарильного кільця" можуть включати фуранове кільце, тіофенове кільце, пірольне кільце, піридинове кільце, піразинове кільце, піридазинове кільце, піримідинове кільце, триазольне кільце (1,2,3-триазольне кільце, 1,2,4-триазольне кільце і т.і.), тетразольне кільце (1H- тетразольне кільце, 2H- тетразольне кільце і т.і.), тіазольне кільце, піразольне кільце, оксазольне кільце, ізоксазольне кільце, ізотіазольне кільце, оксадіазольне кільце, тіадіазольне кільце або подібне. Термін "5- або 6-членна гетероарильна група", що використовується у даному описі, стосується одновалентної групи, включеної шляхом видалення 1 атому водню з будь-якого положення в ароматичному кільці, в якій кількість атомів, що утворюють кільце, складає 5 або 6 і один або більше гетероатомів включені в атоми, що утворюють кільце. Зокрема, приклади "5або 6-членної гетероарильної групи" можуть включати фурильну групу (2-фурильну групу або 3фурильну групу і т.і.), тієнільну групу (2-тієнільну групу або 3-тієнільну групу і т.і.), піролільну групу (1-піролільну групу, 2-піролільну групу або 3-піролільну групу і т.і.), піридильну групу (2піридильну групу, 3-піридильну групу, 4-піридильну групу і т.і.), піразинільну групу, піридазинільну групу (3-піридазинільну групу або 4-піридазинільну групу і т.і.), піримідинільну групу (2-піримідинільну групу, 4-піримідинільну групу або 5-піримідинільну групу і т.і.), триазолільну групу (1,2,3-триазолільну групу або 1,2,4-триазолільну групу і т.і.), тетразолільну групу (1H-тетразолільну групу або 2H-тетразолільну групу і т.і.), тіазолільну групу (2-тіазолільну групу, 4-тіазолільну групу або 5-тіазолільну групу і т.і.), піразолільну групу (3-піразолільну групу або 4-піразолільну групу і т.і.), оксазолільну групу (2-оксазолільну групу, 4-оксазолільну групу або 5-оксазолільну групу і т.і.), ізоксазолільну групу (3-ізоксазолільну групу, 4-ізоксазолільну 9 UA 99637 C2 5 10 15 20 25 30 35 40 45 групу або 5-ізоксазолільну групу і т.і.), ізотіазолільну групу (3-ізотіазолільну групу, 4ізотіазолільну групу або 5-ізотіазолільну групу т.і.), оксадіазолільну групу, тіадіазолільну групу або подібне. Термін "5- або 6-членна неароматична гетероциклічна група", що використовується у даному описі, стосується одновалентної групи, включеної шляхом видалення 1 атому водню з будь-якого положення в неароматичному кільці, в якій кількість атомів, що утворюють кільце, складає 5 або 6 і 1 або більше гетероатомів включені в атоми, що утворюють кільце. Зокрема, приклади "5- або 6-членної неароматичної гетероциклічної групи" можуть включати піролідинільну групу, піперадинільну групу, піперидинільну групу, морфолінільну групу, тетрагідрофурильну групу, тетрагідропіранільну групу або подібне. Термін "ді C1-6 алкіламіно група", що використовується у даному описі, стосується групи, в якій 2 атоми водню аміногрупи заміщені на "C 1-6 алкільні групи", позначені вище, які є однаковими або відмінними одна від одної. Зокрема, приклади терміну "ді C 1-6 алкіламіно групи" можуть включати N,N-диметиламіно групу, N,N-діетиламіно групу, N,N-ди- N-пропіламіно групу, N,N-ді-ізопропіламіно групу, N,N-ди- N-бутиламіно групу, N,N-ізобутиламіно групу, N,N-ди-вторбутиламіно групу, N,N-ди-трет-бутиламіно групу, N-етил- N-метиламіно групу, N-N-пропіламіноN-метиламіно групу, N-ізопропіл- N-метиламіно групу, N-N-бутил- N-метиламіно групу, Nізобутил- N-метиламіно групу, N-втор-бутил- N-метиламіно групу, N-трет-бутил- N-метиламіно групу або подібне, переважно N,N-диметиламіно групу, N,N-діетиламіно групу, N-етил- Nметиламіно групу або подібне. Термін "можуть мати 1 або 2 замісників", що використовується у даному описі, означає, що може бути присутнім 1 або 2 замісники в будь-якій комбінації в місцях, прийнятних для заміщення. Термін "Q ", що використовується у даному описі, стосується фармацевтично прийнятного аніону, і оскільки він походить від фармацевтично прийнятної органічної або неорганічної кислоти, він не обмежений специфічними аніонами. Приклади цих органічних кислот або неорганічних кислот можуть включати наступне. Зокрема, приклади органічних кислот можуть включати аліфатичні, ароматичні й інші подібні кислоти, такі як метансульфонова кислота, бензолсульфонова кислота, малеїнова кислота, лимонна кислота, бурштинова кислота, фумарова кислота, толуолсульфонова кислота, трифторметансульфонова кислота і подібне. Приклади неорганічних кислот можуть включати соляну кислоту, сірчану кислоту, фосфорну кислоту, фтористо-водневу кислоту, бромисто-водневу кислоту, йодисто-водневу кислоту і подібне. + Термін "J ", що використовується у даному описі, стосується фармацевтично прийнятного катіону, і при цьому не обмежується наступними катіонами. Їх конкретні приклади можуть включати іони лужних металів, такі як іони натрію, іони калію, іони літію і подібне; лужноземельні іони, такі як іони кальцію, іони магнію і подібне; алкіламіни, такі як метиламін, етиламін, циклогексиламін і подібне; алкіламіни, що були заміщені гідроксильною групою, такі як діетаноламін, триетаноламін, тріс (гідроксиметил)-амінометан і подібне; амінокислоти, такі як лізин, аргінін, гістидин і подібне; і амонійні іони - похідні органічних основ, такі як піперидин, морфолін і подібне. 1 R являє собою атом водню, атом галогену, аміногрупу, C1-6 алкільну групу, C1-6 алкокси групу, C1-6 алкіламіно групу, гідрокси C1-6 алкіламіно групу або C1-6 алкокси C1-6 алкільну групу, причому атом водню, аміногрупа або C1-6 алкокси C1-6 алкільна група є найбільш переважними, і при цьому метоксиметил група є більш переважною як C1-6 алкокси C1-6 алкільна група. 2 R являє собою атом водню, аміногрупу або ді-C1-6 алкіламіно групу, при цьому атом водню або аміногрупа є переважною. Один з X і Y являє собою атом азоту, а інший являє собою атом азоту або атом кисню. Часткова структура, представлена наступною формулою (II), включаючи X і Y: 50 X Y 55 (II) переважно має структуру, представлену нижче, у якій кожен лівий кінець з'єднаний з 3положенням піридинового кільця за допомогою одинарного зв'язку, і правий кінець з'єднаний з A кільцем через метиленову групу: 10 UA 99637 C2 O N N O (III) (IV) N N N N (VI) (V) 5 Наприклад, у випадку часткової структури формули (III), структура вихідної сполуки відповідно до даного винаходу, тобто, сполуки до вбудовування фосфоноксиметильної групи, представлена наступною формулою: O R1 R2 15 N A N 10 . z R3 . Переважним є те, що коли один з X і Y являє собою атом азоту, а інший являє собою атом кисню, або коли обидва X і Y являють собою атоми азоту, і коли один з X і Y являє собою атом азоту, а інший являє собою атом кисню, то часткова структура, представлена наступною формулою (II), що включає X і Y переважно має структуру, що являє собою наступну формулу (III) або (IV), у якій кожен лівий кінець з'єднаний з 3-положенням піридинового кільця через одинарний зв'язок, і правий кінець з'єднаний з A кільцем через метиленову групу: 20 Також, коли обидва з X і Y являють собою атоми азоту, то часткова структура, представлена наступною формулою (II), включаючи X і Y 25 переважно має структуру, представлену наступною формулою (V) або (VI), у якій кожен лівий кінець з'єднаний з 3-положенням піридинового кільця через одинарний зв'язок, і правий кінець з'єднаний з A кільцем через метиленову групу: 11 UA 99637 C2 . 5 10 15 20 25 30 35 40 45 50 55 Кільце A являє собою 5- або 6-членне гетероарильне кільце або бензольне кільце, що може мати один або два атоми галогену або C1-6 алкільні групи, і переважно являє собою піридинове кільце, бензольне кільце, фуранове кільце, тіофенове кільце або пірольне кільце, причому піридинове кільце, бензольне кільце або тіофенове кільце є більш переважним, і піридинове кільце або бензольне кільце є найбільш переважним. Z являє собою одинарний зв'язок, метиленову групу, етиленову групу, атом кисню, атом сірки, -CH2O-, -OCH2-, - NH-, - NHCH2-, -CH2 NH-, -CH2S- або -SCH2-, з яких метиленова група, атом кисню, -CH2O- або -OCH2- є переважними, причому атом кисню, -CH2O- або -OCH2- є найбільш переважними. 3 R являє собою атом водню або атом галогену, або являє собою C 1-6 алкільну групу, C3-8 циклоалкільну групу, C6-10 арильну групу, або 5- або 6-членну гетероарильну групу, кожна з який може мати один або два замісники, вибраних із групи замісників . [Група замісників ] атом галогену, ціано група, C1-6 алкільна група, C1-6 алкокси група, C1-6 алкоксикарбоніл, C3-8 циклоалкільна група, C2-6 алкенільна група і C2-6 алкінільна група. 3 Переважні приклади R можуть включати N-бутильну групу, циклопропільну групу, фенільну групу, фторфенільну групу, фурильну групу, хлорфурильну групу, метилфурильну групу, тієнільну групу, бромтієнільну групу, метилтієнільну групу, піридильну групу і метилпіридильну групу, причому N-бутильна група, циклопропільна група, фенільна група, фторфенільна група, піридильна група і метилпіридильна група є найбільш переважними. 3 Z і R можуть поєднуватися при необхідності для того, щоб сформувати замісники для кільця 3 A. Переважні приклади R -Z- як замісники кільця A, сформовані таким чином, можуть включати фенокси групу, бензилокси групу, 2-фтор-бензилокси групу, 3-фтор-бензилокси групу, 4-фторбензилокси групу, піридин-2-ілоксиметил групу, 6-метил-піридин-2-ілоксиметильну групу, піридин-2-ілметокси групу, 6-метил-піридин-2-ілметокси групу, 4-метил-піридин-2-ілметокси групу, бутоксиметильну групу і циклопропілметокси групу. Термін "сіль", що використовується у даному описі, стосується солі зі сполукою або атомом, здатним формувати одновалентний протиіон або двовалентний протиіон. Їх приклади можуть включати солі неорганічної кислоти (наприклад, соляна кислота, бромисто-воднева кислота, фосфорна кислота, сірчана кислота, азотна кислота і подібне), і солі органічної кислоти (наприклад, метансульфонова кислота, етансульфонова кислота, бензолсульфонова кислота, п-толуолсульфонова кислота, фумарова кислота, малеїнова кислота, бурштинова кислота, лимонна кислота, яблучна кислота, трифтороцтова кислота і подібне), або солі неорганічних основ (наприклад, сіль натрію, сіль калію, сіль кальцію, сіль літію і подібне), і солі органічних основ (наприклад, сіль метиламіну, сіль етиламіну, сіль трет-бутиламіну сіль циклогексиламіну, сіль N-метил-D-глюкаміну, сіль лізину, сіль піперидину, сіль морфоліну і подібне). Термін "сіль" включає моно- і біс- солі. Сіль сполуки відповідно до даного винаходу включає сольвати цієї солі, такі як безводна форма і гідрат цієї солі. Термін "протигрибковий засіб", що використовується у даному описі, стосується профілактичного засобу або терапевтичному засобу для грибкової інфекції. Сполуки відповідно до даного винаходу можуть бути сформульовані у вигляді таблеток, порошків, дрібних гранул, гранул, таблеток в оболонці, капсул, сиропів, пастилок, лікарських форм для інгаляцій, супозиторіїв, ін'єкцій, мазей, очних мазей, пластирів, очних крапель, назальних крапель, вушних крапель, припарок, лосьйонів або подібного, традиційними способами. Такий склад можна одержати з використанням звичайних розріджувачів, засобів, що зв'язують, змащувальних засобів, барвників, ароматизаторів і, при необхідності, стабілізаторів, емульсифікаторів, засобів, що підсилюють абсорбцію, поверхнево-активних речовин, pH модуляторів, консервантів, антиоксидантів або подібного, і матеріалів, що звичайно використовуються як інгредієнти фармацевтичних препаратів відповідно до традиційних способів. Наприклад, пероральний препарат може бути отриманий шляхом комбінування сполуки даного винаходу або його фармацевтично прийнятної солі з розріджувачем, і якщо необхідно, засобом, що зв'язує, розпушувачем, змащувальним засобом, барвником, 12 UA 99637 C2 5 10 15 20 25 30 35 40 45 50 55 60 ароматизатором або подібним, і формулювання суміші в порошки, дрібні гранули, гранули, таблетки, таблетки в оболонці, капсули або подібне традиційними способами. Приклади цих матеріалів можуть включати олії тваринного і рослинного походження, такі як олія соєвих бобів, яловичий жир і синтетичний гліцерид; вуглеводні, такі як рідкий парафін, сквален і твердий парафін; ефірні олії, такі як октилдодецил міристат і ізо-пропіл міристат; вищі спирти, такі як цетостеариловий спирт і бегеніловий спирт; силіконові смоли; силіконові змащення; поверхнево-активні речовини, такі як складний ефір поліоксиетилен і жирної кислоти, складний ефір сорбіту і жирної кислоти, поліоксиетиленовий складний ефір сорбіту і жирної кислоти, поліоксиетилен гідрогенізована касторова олія і блок спів-полімер поліоксиетилену і поліоксипропілeну; водорозчинні полімери, такі як гідроксиетилцелюлоза, поліакрилова кислота, карбоксивініловий полімер, поліетиленгліколь, полівінілпіролідон і метилцелюлоза; нижчі спирти, такі як етанол і ізопропанол; багатоатомні спирти, такі як гліцерол, пропіленгліколь, дипропіленгліколь і сорбітол; цукри, такі як глюкоза і сахароза; неорганічний порошок, такий як безводна кремнієва кислота, алюмосилікат магнію і силікат алюмінію; і чисту воду. Приклади розріджувачів можуть включати лактозу, кукурудзяний крохмаль, білий цукор, глюкозу, манітол, сорбітол, кристалічну целюлозу, діоксид кремнію або подібне. Приклади сполучних засобів можуть включати полівініловий спирт, полівініловий ефір, метилцелюлозу, етилцелюлозу, гуміарабік, трагакант, желатин, шелак, гідроксипропілметилцелюлозу, гідроксипропілцелюлозу, полівінілпіролідон, блок спів-полімер поліпропіленгліколю і поліоксиетилену, меглюмін або подібне. Приклади розпушувачів можуть включати крохмаль, агар, желатиновий порошок, кристалічну целюлозу, карбонат кальцію, гідрокарбонат натрію, цитрат кальцію, декстрин, пектин, карбоксиметилцелюлозу кальцію або подібне. Приклади змащувальних засобів можуть включати стеарат магнію, тальк, поліетиленгліколь, кремній, гідрогенізовану рослинну олію або подібне. Приклади барвників можуть включати фармацевтично прийнятні барвники. Приклади ароматизаторів можуть включати порошок какао, ментол, ароматичний порошок м'ятної олії, борнеол, порошок кориці або подібне. Таблетки і гранули можуть бути покриті цукром або, якщо необхідно, іншими прийнятними оболонками. Розчини, такі як сиропи або препарати для ін'єкцій, які необхідно ввести, можуть бути сформульовані шляхом комбінування сполуки відповідно до даного винаходу або його фармацевтично прийнятної солі з pН модулятором, засобом, що розчиняє, засобом, що ізотонізує або подібним, і якщо необхідно, із допоміжним засобом, що розчиняє, стабілізатором або подібним, відповідно до традиційних способів. Способи одержання препаратів для зовнішнього застосування є необмеженими, і такі препарати можуть бути отримані традиційними способами. Зокрема, різні матеріали, що звичайно використовуються для одержання фармацевтичних препаратів, лікувально-профілактичної косметики, косметичних препаратів або подібного, можуть бути використані як основні матеріали для складу для зовнішнього застосування. Більш конкретно, приклади основних матеріалів для використання можуть включати тваринні і рослинні олії, мінеральні олії, складноефірні синтетичні олії, віск, вищі спирти, жирні кислоти, силіконове змащення, поверхнево-активні речовини, фосфоліпіди, спирти, багатоатомні спирти, водорозчинні полімери, глинисті мінерали, чисту воду або подібне. Більш того, препарати для зовнішнього застосування даного винаходу можуть містити, при необхідності, pН модулятори, антиоксиданти, хелатуючі засоби, антибактеріальні/протигрибкові засоби, барвники, пахучі речовини або подібне. Але це не обмежує тип основних матеріалів, що використовуються в препаратах для зовнішнього застосування даного винаходу. Якщо необхідно, препарат може містити стимулятори диференціювання, покращувачі струму крові, протимикробні засоби, протизапальні засоби, клітинні активатори, вітаміни, амінокислоти, зволожувачі, кератолітичні засоби або подібне. Кількість основних матеріалів, перерахованих вище, відповідає концентраційному діапазону, використовуваному для виробництва типових препаратів для зовнішнього застосування. При введенні сполуки відповідно до даного винаходу, конкретні форми сполук не є обмеженими, і сполука може бути введена перорально або парентерально традиційним способом. Наприклад, сполука може бути введена як дозована форма, така як таблетки, порошки, гранули, капсули, сиропи, пастилки, лікарські форми для інгаляцій, супозиторії, ін'єкції, мазі, очні мазі, пластири, очні краплі, назальні краплі, вушні краплі, припарки і лосьйони. Доза медикаменту відповідно до даного винаходу може бути вибрана відповідно до ваги симптому, віку, статі, маси тіла, форми введення, типу солей, специфічного типу захворювання або подібного. Дози значно варіюють у залежності від захворювання пацієнта, ваги симптому, віку і статі, лікарської чутливості або подібного. Пероральний препарат відповідно до даного винаходу може бути загалом введений один раз або кілька разів у дозі від 1 до 10000 мг/дорослий/день, 13 UA 99637 C2 5 переважно від 10 до 2000 мг/дорослий/день. Ін'єкція відповідно до даного винаходу може бути загалом введена в дозі від 0,1 до 10000 мг/дорослий/день, переважно від 1 до 2000 мг/дорослий/день. Типовий спосіб одержання Далі буде описаний спосіб одержання сполук, представлених формулами (I), (IA) і (IB) (далі тут позначених як сполука (I), сполука (IA) і сполука (IB)). Типовий спосіб одержання ефіру фосфорної кислоти Спосіб одержання 1 – Спосіб одержання сполук (I), (IA) і (IB) 10 1 15 20 25 30 35 3 4 + де кільце A, R , R , R , X, Y, Z, Q і J мають такі ж значення, як визначено вище. Сполуку (1-1) можна отримати способами, описаними в наступних довідкових прикладах і т.і. Сполука (1-1) також може бути отримана способом, описаним у Патенті США 2007/0105904 (A1). [Стадія 1-1] Ця стадія є стадією, де спочатку сполука (1-1) і хлорметиловий ефір ди-трет-бутилового ефіра фосфорної кислоти реагують у присутності йодиду натрію, потім сполуку (I) одержують за допомогою кислотної обробки. Не існує особливих обмежень відносно розчинника, що використовується при реакції сполуки (1-1) і хлорметилового ефіру ди-трет-бутилового ефіру фосфорної кислоти у присутності йодиду натрію, оскільки він може розчинити початкові матеріали до визначеного ступеня без перешкоди протіканню реакції. Приклади розчинників, що використовуються, можуть включати галогеновані розчинники на основі вуглеводнів, такі як хлорид метилену, хлороформ і подібне; розчинники на ефірній основі, такі як тетрагідрофуран, діетиловий ефір і подібне; розчинники на основі складних ефірів, такі як етилацетат і подібне; ацетонітрил; сульфонат тетраметилену; і суміші цих розчинників. Використання етилацетатуу, тетрагідрофурану або ацетонітрилу є переважним. Хлорметиловий ефір ди-трет-бутилового ефіру фосфорної кислоти може використовуватися в кількості від 1 до 10 еквівалентів, і переважно від 1 до 2 еквівалентів, беручи за основу сполуку (1-1). Йодид натрію може використовуватися в кількості від 1 до 10 еквівалентів, і переважно від 1 до 2 еквівалентів, беручи за основу сполуку (1-1). Температура реакції складає від 0 до 60 °C, і переважно від 4 °C до кімнатної температури. Час реакції складає від 4 до 216 годин. Кислота, що використовується в кислотній обробці, може бути органічними кислотами, такими як трифтороцтова кислота або подібне; або мінеральними кислотами, такими як соляна кислота або подібне, із переважним використанням соляної кислоти або трифтороцтової кислоти. При кислотній обробці кислоту можна додавати як є до розчинника реакції на попередній стадії, або розчинник можна сконцентрувати при зниженому тиску, і кислоту потім додати після заміни на прийнятний розчинник, такий як дихлорметан. Температура реакції складає від -10 °C до кімнатної температури, і час реакції складає від 5 хвилин до 2 годин. 14 UA 99637 C2 5 10 15 20 25 30 35 [Стадія 1-2] Ця стадія є стадією, де сполука (I) реагує з кислотою для одержання сполуки (IA). Не існує особливих обмежень відносно кислоти, використовуваної в цій реакції, крім того, що вона повинна бути фармацевтично прийнятною. Її приклади можуть включати одноосновні кислоти, такі як соляна кислота, бромисто-воднева кислота, азотна кислота і подібне; і двоосновні кислоти, такі як сірчана кислота і подібне. Не існує особливих обмежень відносно розчинника, використовуваного в реакції, крім того, що він повинен розчиняти початкові матеріали до визначеного ступеня без перешкоди протіканню реакції. Приклади розчинників, що можуть використовуватися, можуть включати розчинники на основі амідів, такі як N,Nдиметилформамід, N-метилпіролідинон і подібне, розчинники на основі спиртів, такі як метанол, етанол і подібне; тетрагідрофуран; ацетонітрил; вода; і суміші цих розчинників. Одноосновна кислота використовується в кількості 1 еквівалента, беручи за основу сполуку (I), і двоосновна кислота використовується в кількості 1 або 0,5 еквівалента, беручи за основу сполуку (I). Температура реакції складає від 0 °C до кімнатної температури, і час реакції складає від 5 хвилин до 4 годин. [Стадія 1-3] Ця стадія є стадією, де сполука (I) і основа реагують для одержання сполуки (IB). Не існує особливих обмежень відносно основи, використовуваної в реакції, крім того, що вона повинна бути фармацевтично прийнятною. Її приклади можуть включати неорганічні основи, такі як гідроксид натрію, гідроксид калію і подібне; і органічні основи, такі як лізин і подібне. Не існує особливих обмежень відносно розчинника, використовуваного в реакції, крім того, що він повинен розчиняти початкові матеріали до визначеного ступеня без перешкоди протіканню реакції. Приклади розчинників, що можуть використовуватися, можуть включати розчинники на основі амідів, такі як N,N-диметилформамід, N-метилпіролідинон і подібне, розчинники на основі спиртів, такі як метанол, етанол і подібне; тетрагідрофуран; ацетонітрил; вода; і суміші цих розчинників. Однокислотна основа використовується в кількості 1 еквівалента, беручи за основу сполуку (I), і двоосновна кислота використовується в кількості 1 або 0,5 еквівалента, беручи за основу сполуку (I). Температура реакції складає від 0 °C до кімнатної температури, і час реакції складає від 5 хвилин до 4 годин. Приклади Сполуки відповідно до даного винаходу можуть бути отримані, наприклад, способами, описаними в наступних прикладах, довідкових прикладах і прикладах одержання. Однак вони використовуються з метою ілюстрації, і сполуки відповідно до даного винаходу ні в якому разі не обмежуються наступними конкретними прикладами. [Довідковий приклад 1] 3-(3-(4-(піридин-2-ілоксиметил)-бензил)-ізоксазол-5-іл)-піридин-2іламін O N N O N 40 45 50 NH2 До розчину тетрагідрофурану (5 мл) (4-(піридин-2-ілоксиметил)-феніл)-ацетогідроксимоїл хлориду (510 мг, 1,84 ммоль), описаного в Прикладі одержання 1-1-5 і 3-етинїл-піридин-2іламіну (150 мг, 1,27 ммоль), описаного в Прикладі одержання 1-2-3 Публікації Міжнародної Заявки WO 07/052615, додавали триетиламін (708 мкл, 5,08 ммоль) при кімнатній температурі, що перемішували протягом 95 хвилин при кімнатній температурі. Воду додавали в реакційний розчин при кімнатній температурі, і екстрагували етилацетатом. Органічний шар відмили насиченим сольовим розчином і висушували безводним сульфатом магнію, і розчинник потім випаровували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на NH-силікагелі (гептан: етилацетат = 2:1) для одержання зазначеної сполуки (120 мг, 26 %). 1 H-ЯМР (ядерно-магнітний резонанс) спектр (СDCl3) (м.ч.): 4,08 (2H, с), 5,37 (2H, с), 6,33 (1H, с), 6,45 (2H, шс), 6,79-6,82 (2H, м), 6,88-6,91 (1H, м), 7,30 (2H, д, J=8,1 Гц), 7,45 (2H, д, J=8,1 Гц), 7,57-7,61 (1H, м), 7,85 (1H, д, J=7,3 Гц), 8,03 (1H, д, J=5,5 Гц), 8,17 (1H, м). Початковий матеріал, (4-(піридин-2-ілоксиметил)-феніл)-ацетогідроксимоїл хлорид синтезували в такий спосіб. Приклад одержання 1-1-1: (4-(піридин-2-ілоксиметил)-феніл)-метанол 15 UA 99637 C2 N O HO 5 10 До суміші 1,4-бензолдиметанолу (5,5 г, 40 ммоль), 2-фторпіридину (1,3 г, 13 ммоль) і N,Nдиметилформаміду (15 мл) додавали гідрид натрію (1,4 г, 40 ммоль, 66 % в олії) при 0C, що перемішували 20 хвилин при кімнатній температурі і 1 годину при 70C. Воду додавали в реакційну суміш, і екстрагували етилацетатом. Органічний шар відмили насиченим сольовим розчином, і розчинник випаровували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на NH-силікагелі (етилацетат: гептан = 1:1) для одержання зазначеної сполуки (1,9 г, 66 %). 1 H-ЯМР спектр (СDCl3) (м.ч.): 4,71 (2H, с), 5,38 (2H, с), 6,81 (1H, ттд, J=0,9, 8,4 Гц), 6,89 (1H, ддд, J=0,9, 5,1, 7,1 Гц), 7,37-7,47 (4H, м), 7,59 (1H, ддд, J=2,0,7,1, 8,3 Гц), 8,17 (1H, ддд, J=0,7, 2,0, 5,1 Гц). Приклад одержання 1-1-2: 4-(піридин-2-ілоксиметил)-бензальдегід 15 H N O O 20 25 До суміші (4-(піридин-2-ілоксиметил)-феніл)-метанолу (1,9 г, 8,6 ммоль), описаного в Прикладі одержання 1-1-1, і метиленхлориду (30 мл) додавали діоксид марганцю (15 г, 17 ммоль) при кімнатній температурі, що перемішували протягом ночі при цій температурі. Реакційну суміш відфільтровували крізь целітний фільтр, і розчинник випаровували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (етилацетат: гептан = 1:4), для одержання зазначеної сполуки (770 мг, 42 %). 1 H-ЯМР спектр (СDCl3) (м.ч.): 5,48 (2H, с), 6,85 (1H, д, J=8,2 Гц), 6,90-6,93 (1H, м), 7,60-7,64 (3H, м), 7,89 (2H, д, J=8,1 Гц), 8,16 (1H, дд, J=1,3, 4,9 Гц), 10,0 (1H, с). Приклад одержання 1-1-3: 2-(4-((E)-2-Нітро-вініл)-бензилокси)-піридин O + N N O O 30 35 Суміш 4-(піридин-2-ілоксиметил)-бензальдегіду (23,4 г, 110 ммоль), описаного в Прикладі одержання 1-1-2, нітрометану (33,6 г, 550 ммоль), ацетату амонію (17,0 г, 220 ммоль), і оцтової кислоти (200 мл) перемішували 1 годину і 45 хвилин при 100C. Невелику кількість води додавали туди, поки реакційний розчин перемішували на льоді, і тверді осади збирали фільтрацією, для того, щоб одержати зазначену сполуку (21,0 г, 74,5 %). 1 H-ЯМР спектр (ДМСО-d6) (м.ч.): 5,41 (2H, с), 6,91 (1H, дд, J=0,8, 8,4 Гц), 6,99-7,10 (1H, м), 7,53 (2H, д, J=8,0 Гц), 7,72-7,79 (1H, м), 7,86 (2H, д, J=8,0 Гц), 8,13 (1H, д, J=10 Гц), 8,15-8,20 (1H, м), 8,23 (1H, д, J=10 Гц). Приклад одержання 1-1-4: 2-(4-(2-Нітро-етил)-бензилокси)-піридин O + N N O O 40 45 До розчину 2-(4-((E)-2-нітро-вініл)-бензилокси)-піридину (21,0 г, 81,9 ммоль), описаного в Прикладі одержання 1-1-3, оцтової кислоти (21 мл) і диметилсульфоксиду (200 мл) додавали борогідрид натрію (4,96 г, 131 ммоль) при кімнатній температурі при відповідному охолодженні. Після додавання борогідриду натрію, забирали крижану баню, з наступним перемішуванням протягом 15 хвилин при кімнатній температурі. Реакційний розчин розділили на воду і етилацетат. Шар етилацетату відмивали водою двічі й один раз сольовим розчином, і цей продукт висушували безводним сульфатом магнію, і розчинник випаровували при зниженому 16 UA 99637 C2 5 тиску. Залишок очищали за допомогою колонкової хроматографії на NH-силікагелі (етилацетат: гептан = 1:3) для одержання зазначеної сполуки (16,3 г, 77,1 %). 1 H-ЯМР спектр (ДМСО-d6) (м.ч.): 3,23 (2H, т, J=6,8 Гц), 4,85 (2H, т, J=6,8 Гц), 5,32 (2H, с), 6,82-6,88 (1H, м), 6,96-7,01 (1H, м), 7,28 (2H, д, J=8,0 Гц), 7,38 (2H, д, J=8,0 Гц), 7,69-7,74 (1H, м), 8,15-8,19 (1H, м). Приклад одержання 1-1-5: 4-(піридин-2-ілоксиметил)-феніл-ацетогідроксимоїл хлорид N O Cl N HO 10 15 20 25 Літієвий дріт (323 мг, 46,6 ммоль) додавали до і розчиняли в метанолі (75 мл). До цього розчину додавали 2-(4-(2-нітро-етил)-бензилокси)-піридин (6,0 г, 23,3 ммоль)), описаний у Прикладі одержання 1-1-4, і реакційний розчин концентрували при зниженому тиску. Толуол додавали до залишку, і цей розчинник концентрували при зниженому тиску. Розчин отриманого залишку в хлориді метилену (90 мл) і тетрагідрофурані (45 мл) охолоджували до -78 °C, і хлорид титану (IV) (8,15 мл, 74,4 ммоль) додавали до нього. Як тільки завершувалося додавання хлориду титану (IV), реакційний розчин перемішували 10 хвилин при 0 °C, і потім 30 хвилин при кімнатній температурі. Реакційний розчин поміщали на крижану воду й екстрагували етилацетатом. Органічний шар висушували безводним сульфатом магнію, і сульфат магнію відфільтровували. Фільтрат пропускали крізь скляний фільтр (елюйований етилацетатом), промитий нейтральним силікагелем. Елюат, отриманий таким чином, концентрували при зниженому тиску. Невелику кількість етилацетату додавали до залишку, і тверді осади збирали фільтрацією, так щоб одержати зазначену сполуку (1,86 г, 28,8 %). 1 H-ЯМР спектр (ДМСО-d6) (м.ч.): 3,82 (2H, с), 5,33 (2H, с), 6,84-6,89 (1H, м), 6,97-7,01 (1H, м), 7,25 (2H, д, J=8,4 Гц), 7,41 (2H, д, J=8,4 Гц), 7,70-7,76 (1H, м), 8,15-8,18 (1H, м), 11,7 (1H, с). Зазначена сполука Прикладу одержання 1-1-5 може також бути синтезованою іншим способом. Приклад одержання 1-2-1: 2-(4-бром-бензилокси)-піридин Br O N 30 35 40 До розчину в N,N-диметилформаміді (125 мл) 4-бромбензилового спирту (25 г, 130 ммоль) додавали трет-бутоксид калію (15,8 г, 141 ммоль) при кімнатній температурі, що перемішували 10 хвилин при 54C. До цього реакційного розчину додавали 2-фторпіридин (15 мл, 154 ммоль) при температурі в діапазоні від 40 °C до 58 °C, що перемішували наступні 30 хвилин при 65 °C. Реакційний розчин охолоджували до кімнатної температури, воду і етилацетат додавали до розчину, що був розділений. Водний шар далі екстрагували етилацетатом двічі. Шари етилацетату комбінували, промивали водою тричі й один раз сольовим розчином, і потім висушували безводним сульфатом магнію і відфільтровували. Фільтрат концентрували при зниженому тиску. Діетиловий ефір додавали до залишку, і його концентрували при зниженому тиску, так щоб одержати сирий продукт зазначеної сполуки (34 г). 1 H-ЯМР спектр (ДМСО (диметилсульфоксид)-d6) (м.ч.): 5,33 (2H, с), 6,87-6,90 (1H, м), 6,987,02 (1H, м), 7,38-7,44 (2H, м), 7,55-7,60 (2H, м), 7,71-7,76 (1H, м), 8,15-8,18 (1H, м) Приклад одержання 1-2-2: 4-(піридин-2-ілоксиметил)-бензальдегід H N O O 45 17 UA 99637 C2 5 10 До розчину в тетрагідрофурані (120 мл) 2-(4-бром-бензилокси)піридину (34 г, 128 ммоль), описаного в Прикладі одержання 1-2-1, додавали N-бутил літію (50 мл, 2,6 M, розчин гексану 134 ммоль) краплями при -78C. Після перемішування протягом 30 хвилин, N,Nдиметилформамід (10 мл, 134 ммоль)) додавали краплями при -78 °C до реакційного розчину, що перемішували при кімнатній температурі. Воду і етилацетат додавали до розчину, що розділяли. Шар етилацетату промивали водою двічі і сольовим розчином один раз. Водні шари поєднували й екстрагували етилацетатом. Шар етилацетату, отриманий таким чином, промивали водою двічі і сольовим розчином один раз. Попередньо отриманий шар етилацетату і шар етилацетату, отриманий у цей раз, поєднували, висушували безводним сульфатом магнію, і відфільтровували. Цей фільтрат концентрували при зниженому тиску, так щоб одержати сирий продукт зазначеної сполуки (26,8 г). Приклад одержання 1-2-3: 2-(4-((E)-2-нітро-вініл)-бензилокси)-піридин O + N N O O 15 20 Суміш 4-(піридин-2-ілоксиметил)-бензальдегіду (26,8 г, 126 ммоль)), описаного в Прикладі одержання 1-2-2, нітрометану (34 мл, 630 ммоль), ацетату амонію (19 г, 252 ммоль) і оцтової кислоти (90 мл) перемішували 1 годину і 30 хвилин при 100C. Етилацетат і воду додавали до суміші, що розділяли. Органічний шар промивали водою п'ять разів і водою, насиченою бікарбонатом натрію один раз, висушували безводним сульфатом магнію і відфільтровували. Цей фільтрат концентрували при зниженому тиску, так щоб одержати сирий продукт зазначеної сполуки (31 г). Приклад одержання 1-2-4: 2-(4-(2-нітро-етил)-бензилокси)-піридин O + N N O O 25 30 35 До розчину в диметилсульфоксиді (150 мл) оцтової кислоти (7,4 мл) і 2-(4-((E)-2-нітро-вініл)бензилокси)-піридину (30,8 г, 120 ммоль)), описаного в Прикладі одержання 1-2-3, додавали борогідрид натрію (2,45 г, 64,8 ммоль) при 30C або нижче. Реакційний розчин перемішували 40 хвилин при кімнатній температурі. Воду, етилацетат і діетиловий ефір додавали при 30 °C або нижче до реакційного розчину для того, щоб розділити реакційний розчин на воду й органічний шар. Водний шар екстрагували етилацетатом. Попередньо отриманий органічний шар і шар етилацетату, отриманий у цей раз, поєднували, промивали водою тричі і сольовим розчином один раз, висушували безводним сульфатом магнію і відфільтровували. Цей фільтрат концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на NH-силікагелі (етилацетат: гептан = 1:4) для одержання зазначеної сполуки (15,2 г). Приклад одержання 1-2-5: 4-(піридин-2-ілоксиметил)-феніл-ацетогідроксимоїл хлорид N O Cl N HO 40 45 До розчину в метанолі (80 мл) 2-(4-(2-нітро-етил)-бензилокси)-піридину (15,2 г, 59 ммоль)), описаного в Прикладі одержання 1-2-4, додавали метоксид літію (4,49 г, 118 ммоль), перемішували 3 хвилини. Реакційний розчин концентрували при зниженому тиску. Толуол додавали до залишку, і розчинник концентрували при зниженому тиску. Розчин залишку, отриманого таким чином, у метиленхлориді (100 мл) і тетрагідрофурані (50 мл) охолоджували до -66 °C, і хлорид титану (IV) (20,8 мл, 189 ммоль) додавали до нього при перемішуванні. 18 UA 99637 C2 5 10 Реакційний розчин перемішували 10 хвилин при 0 °C, і потім перемішували 30 хвилин при кімнатній температурі. Реакційний розчин виливали в крижану воду і перемішували 30 хвилин при кімнатній температурі. Етилацетат і діетиловий ефір додавали до реакційного розчину, що розділяли. Органічний шар промивали водою тричі і сольовим розчином один раз. Водні шари поєднували і екстрагували етилацетатом двічі. Шари етилацетату поєднували і промивали водою тричі і сольовим розчином один раз. Попередньо отриманий органічний шар і шар етилацетату, отриманий у цей раз, поєднували, висушували безводним сульфатом магнію і сульфаті натрію та відфільтровували. Цей фільтрат концентрували при зниженому тиску, так щоб одержати сирий продукт зазначеної сполуки (11,5 г). Зазначена сполука довідкового прикладу 1 може також бути синтезованою наступними іншими способами 1-3. Інший спосіб 1 довідкового прикладу 1: 3-(3-(4-(піридин-2-ілоксиметил)-бензил)-ізоксазол-5іл)-піридин-2-іламін O N N O 15 20 25 30 35 N NH2 До суміші хлориду цинку (8,82 г) і тетрагідрофурану (130 мл) додавали 3-етинил-піридин-2іламін (3,00 г, 98 % чистоти), описаний у Прикладі одержання 1-2-3 Публікації Міжнародної Заявки WO 07/052615, і хлорид 4-(піридин-2-ілоксиметил)-феніл-ацетогідроксимоїлу (17,4 г, 94 % чистоти), описаний у Прикладі одержання 1-2-5, при 0C. Реакційну суміш нагрівали до кімнатної температури, і триетиламін (9,02 мл) додавали краплями при підтримуванні внутрішньої температури близько 28C або нижче за допомогою теплової бані. Реакційну суміш перемішували 20 хвилин при кімнатній температурі, і потім перемішували 1 годину при 35C. Реакційну суміш переносили в кімнатну температуру, водний розчин хлориду амонію і етилацетату додавали в реакційну суміш, і потім додавали водний розчин аміаку для доведення pН до приблизно 8, і проводили екстракцію. Органічний шар промивали насиченим сольовим розчином і висушували безводним сульфатом магнію, і розчинник випаровували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на NH-силікагелі (гептан: етилацетат = 3:2), потім поводили кристалізацію, використовуючи змішаний розчинник метилового ефіру трет-бутилу і гептану, так щоб одержати зазначену сполуку (5,32 г). 1 H-ЯМР спектр (СDCl3) (м.ч.): 4,07 (2H, с), 5,37 (4H, шс), 6,25 (1H, с), 6,71 (1H, дд, J=4,8, 7,7 Гц), 6,79-6,81 (1H, м), 6,89 (1H, ддд, J=0,8, 5,0, 7,0 Гц), 7,30 (2H, д, J=7,9 Гц), 7,44 (2H, д, J=8,1 Гц), 7,58 (1H, ддд, J=2,0, 7,1, 8,4 Гц), 7,70 (1H, дд, J=1,8, 7,7 Гц), 8,14 (1H, дд, J=1,8, 4,9 Гц), 8,17-8,18 (1H, м). В іншому способі 1 довідкового прикладу 1, початковий матеріал, хлорид 4-(піридин-2ілоксиметил)-феніл-ацетогідроксимоїлу, синтезували в такий спосіб. Приклад одержання 1-3-1: Метил 3-(4-(піридин-2-ілоксиметил)-феніл)-оксиран-2карбоксилат N O O O 40 45 O До суміші 4-(піридин-2-ілоксиметил)-бензальдегіду (24,8 г), описаного в Прикладі одержання 1-1-2, і тетрагідрофурану (160 мл) додавали метил хлорацетат (10,2 мл) при -15C, і потім метоксид натрію (23,7 мл, 28 % розчин метанолу) додавали до нього при тій же температурі. Реакційну суміш перемішували 1 годину при 0 °C, і потім перемішували 2 години при кімнатній температурі. Реакційну суміш додавали до 800 мл крижаної води, що містить оцтову кислоту (6 мл), і реакційну суміш нагрівали до кімнатної температури. Етилацетат додавали до реакційної суміші для екстракції, і потім органічний шар відокремлювали, промивали насиченим сольовим 19 UA 99637 C2 5 розчином, і висушували безводним сульфатом магнію. Розчинник випаровували при зниженому тиску для одержання зазначеної сполуки (30,2 г). 1 H-ЯМР спектр (СDCl3) (м.ч.): 3,51 (1H, д, J=1,8 Гц), 3,83 (3H, с), 4,11 (1H, д, J=1,8 Гц), 5,38 (2H, с), 6,81 (1H, тд, J=0,9, 8,4 Гц), 6,89 (1H, ддд, J=0,9, 5,1, 7,1 Гц), 7,29-7,31 (2H, м), 7,47 (2H, д, J=8,2 Гц), 7,59 (1H, ддд, J=2,0, 7,1, 8,4 Гц), 8,17 (1H, ддд, J=0,8, 2,0, 5,1 Гц). Приклад одержання 1-3-2: 3-(4-(піридин-2-ілоксиметил)-феніл)-оксиран-2-карбоксилат натрію N O O Na + O O 10 15 20 До суміші метил 3-(4-(піридин-2-ілоксиметил)-феніл)-оксиран-2-карбоксилату (19,9 г), описаного в Прикладі одержання 1-3-1, і етанолу (300 мл) додавали метоксид натрію (14,2 мл, 28 % розчин метанолу), воду (1,3 мл) і тетрагідрофуран (100 мл) у цьому порядку при 0C, перемішували 1 годину при кімнатній температурі. Діетиловий ефір (200 мл) додавали в реакційну суміш, і тверді осади збирали фільтрацією, так щоб одержати зазначену сполуку (14,3 г). 1 H-ЯМР спектр (СD3OD) (м.ч.): 3,31 (1H, д, J=1,8 Гц), 3,88 (1H, д, J=1,8 Гц), 5,33 (2H, с), 6,84 (1H, тд, J=0,9, 8,2 Гц), 6,94 (1H, ддд, J=0,9, 5,1, 7,1 Гц), 7,29-7,31 (2H, м), 7,42 (2H, д, J=8,2 Гц), 7,68 (1H, ддд, J=2,0, 7,1, 8,4 Гц), 8,12 (1H, ддд, J=0,7, 2,0, 5,1 Гц). Приклад одержання 1-3-3: 4-(піридин-2-ілоксиметил)-феніл-ацетальдегід O N H O 25 30 35 Суміш 3-(4-(піридин-2-ілоксиметил)-феніл)-оксиран-2-карбоксилату натрію (9,95 г), описаного в Прикладі одержання 1-3-2, толуолу (200 мл), води (120 мл) і оцтової кислоти (16 мл) перемішували 90 хвилин при 73C. Реакційну суміш охолоджували до кімнатної температури, додавали до реакційної суміші етилацетат для екстракції, і органічний шар відокремлювали, промивали насиченим сольовим розчином, і висушували безводним сульфатом магнію. Розчинник випаровували при зниженому тиску для одержання зазначеної сполуки (6,82 г). 1 H-ЯМР спектр (СDCl3) (м.ч.): 3,70 (2H, д, J=2,2 Гц), 5,38 (2H, с), 6,81 (1H, тд, J=0,8, 8,2 Гц), 6,89 (1H, ддд, J=0,9, 5,1, 7,1 Гц), 7,24 (2H, д, J=8,1), 7,48 (2H, д, J=8,1 Гц), 7,59 (1H, ддд, J=2,0, 7,1, 8,4 Гц), 8,18 (1H, ддд, J=0,6, 2,0, 5,0 Гц), 9,75 (1H, т, J=2,4). Приклад одержання 1-3-4: 4-(піридин-2-ілоксиметил)-фенілу-ацетальдегіду оксим (E/Z суміш) HO N N H O 40 До суміші сульфату гідроксиламіну (19,7 г) і води (250 мл) додавали 1 N водний гідроксид натрію (240 мл) при 0C, що перемішували 15 хвилин при тій же температурі. До реакційної суміші потім додавали суміш 4-(піридин-2-ілоксиметил)-феніл)-ацетальдегіду (27,3 г), описаного в Прикладі одержання 1-3-3, і метанолу (250 мл) краплями, перемішували протягом ночі при кімнатній температурі. Тверді осади збирали фільтрацією, так щоб одержати зазначену сполуку (20,3 г) як суміш E і Z ізомерів. 20 UA 99637 C2 H-ЯМР спектр (СDCl3) (м.ч.): 3,54 (2H, д, J=6,2 Гц), 3,74 (2H, д, J=5,3 Гц), 5,36 (2H+2H, с), 6,79-6,81 (1H+1H, м), 6,87-6,90 (1H+2H, м), 7,22-7,24 (2H+2H, м), 7,42-7,44 (2H+2H, м), 7,53 (1H, т, J=6,3 Гц), 7,56-7,61 (1H+1H, м), 8,17-8,18 (1H+1H, м) (підкреслення = E або Z). Приклад одержання 1-3-5: 4-(піридин-2-ілоксиметил)-феніл-ацетогідроксимоїлу хлорид 1 5 HO N N Cl O 10 15 20 До суміші 4-(піридин-2-ілоксиметил)-фенілу-ацетальдегіду оксиму (E/Z суміш) (132 мг), описаного в Прикладі одержання 1-3-4, і N,N-диметилформаміду (2 мл) додавали Nхлорсукцинімід (72,8 мг) при кімнатній температурі. Соляно-кислий газ потім продували крізь реакційну суміш при тій же температурі, перемішували 90 хвилин при тій же температурі. Етилацетат і вода додавали до реакційної суміші для екстракції, і потім органічний шар відокремлювали, промивали насиченим сольовим розчином, і висушували безводним сульфатом магнію. Розчинник випаровували при зниженому тиску, і отриманий залишок промивали змішаним розчинником діетилового ефіру і гептану, так щоб одержати зазначену сполуку (123 мг). 1 H-ЯМР спектр (СDCl3) (м.ч.): 3,81 (2H, с), 5,36 (2H, с), 6,81 (1H, д, J=8,2 Гц), 6,88-6,91 (1H, м), 7,28 (2H, д, J=8,1), 7,43 (2H, д, J=8,1 Гц), 7,57-7,62 (1H, м), 8,17-8,19 (1H, м). Інший спосіб 2 довідкові приклади 1: 3-(3-(4-(піридин-2-ілоксиметил)-бензил)-ізоксазол-5-іл)піридин-2-іламін O N N O N 25 30 35 NH2 До розчину в дихлорметані (120 мл) ди-трет-бутил (3-(3-(4-((піридин-2ілокси)метил)бензил)ізоксазол-5-іл)піридин-2-іл)іміда дикарбонату (11,8 г, приблизно 70 % чистоти), описаного в Прикладі одержання 1-4-2, додавали трифтороцтову кислоту (40 мл) при 0C, що перемішували 14 години при кімнатній температурі. Воду, насичену бікарбонатом натрію додавали при 20C або нижче до реакційного розчину, екстракцію проводили етилацетатом, і потім цей продукт очищали NH колонковою хроматографією на силікагелі (гептан: етилацетат = 1:1). Розчинник концентрували при зниженому тиску і до отриманого залишку додавали метил-трет-бутиловий ефір, з наступним фільтруванням твердого осаду, і одержували зазначену сполуку (7,29 г). 1 H-ЯМР спектр (ДМСО-d6) (м.ч.): 4,04 (2H, с), 5,32 (2H, с), 6,26 (2H, шс), 6,69 (1H, дд, J=4,8, 8,0 Гц), 6,81 (1H, с), 6,83-6,87 (1H, м), 6,97-7,00 (1H, м), 7,33 (2H, д, J=8,0 Гц), 7,40 (2H, д, J=8,0 Гц), 7,69-7,74 (1H, м), 7,87 (1H, дд, J=2,0, 7,6 Гц), 8,08 (1H, дд, J=2,0, 7,6 Гц), 8,15-8,17 (1H, м). Початковий матеріал, ди-трет-бутил (3-(3-(4-((піридин-2-ілокси)метил)бензил) ізоксазол-5іл)піридин-2-іл)іміду дикарбонат був синтезований у такий спосіб. Приклад одержання 1-4-1: ди-трет-бутил (3-етинилпіридин-2-іл)іміду дикарбонат O N O N O O 40 21 UA 99637 C2 5 10 3-Етиніл-піридин-2-іламін (6,34 г), описаний у Прикладі одержання 1-2-3 Публікації Міжнародної Заявки WO 07/052615, ди-трет-бутилу дикарбонат (58,5 г), триетиламін (27,1 г), 4диметиламінопіридин (655 мг) і тетрагідрофуран (254 мл) перемішували 18 годин при кімнатній температурі. Силікагель додавали до реакційного розчину, і розчинник концентрували при зниженому тиску. Силікагель, отриманий у такий спосіб очищали хроматографією на силікагелі (гептан: етилацетат = 3:1) для одержання зазначеної сполуки (15 г) у вигляді білої твердої речовини. 1 H-ЯМР спектр (ДМСО-d6) (м.ч.): 1,32 (18H, с), 4,59 (1H, с), 7,39-7,44 (1H, м), 7,99-8,03 (1H, м), 8,46-8,48 (1H, м). Приклад одержання 1-4-2: ди-трет-бутил (3-(3-(4-((піридин-2-ілокси)метил)бензил)ізоксазол5-іл)піридин-2-іл)іміду дикарбонат O N N O O N O 15 20 25 O N O До розчину в тетрагідрофурані (200 мл) ди-трет-бутил (3-етинілпіридин-2-іл)іміду дикарбонату (12 г), описаного в Прикладі одержання 1-4-1, 2-(4-(2-нітро-етил)-бензилокси)піридину (19,4 г), описаного в Прикладі одержання 1-1-4, і 4-диметиламінопіридину (230 мг) додавали ди-трет-бутилу дикарбонат (28,8 г) у період, що складає 8 годин і в чотири серії, при кімнатній температурі при перемішуванні. Після завершення додавання реакційну суміш перемішували наступні 22 години при кімнатній температурі. Силікагель додавали до реакційного розчину, і розчинник концентрували при зниженому тиску. Силікагель, отриманий у такий спосіб, очищали хроматографією на силікагелі (гептан: етилацетат = 3:1, і потім 2:1) для одержання маслянистої речовини (11,8 г, що містить приблизно 70 % цільової речовини), що містить зазначену сполуку. Ди-трет-бутил (3-(3-(4-((піридин-2-ілокси)метил)бензил)ізоксазол-5-іл)піридин-2-іл)іміду дикарбонат Прикладу одержання 1-4-2 може також бути синтезований наступним іншим Способом 1 або 2. Приклад одержання 1-5-1: ди-трет-бутил (3-(3-(4-((піридин-2-ілокси)метил)бензил)ізоксазол5-іл)піридин-2-іл)іміду дикарбонат (Інший Спосіб 1 Прикладу одержання 1-4-2) O N N O O N O N O O 30 35 До розчину в тетрагідрофурані (20 мл) ди-трет-бутил (3-етинилпіридин-2-іл)іміду дикарбонату (2,0 г), описаного в Прикладі одержання 1-4-1, 2-(4-(2-нітро-етил)-бензилокси)піридину (2,44 г), описаного в Прикладі одержання 1-1-4, і триетиламіну (0,086 мкл) додавали фенілізоціанат (2,8 мл) за період, що складає 5,5 годин і за чотири серії, при 50 °C при перемішуванні. Після завершення додавання реакційну суміш перемішували наступні 2 години при 50 °C. NH-силікагель додавали до реакційного розчину, і розчинник концентрували при зниженому тиску. NH-силікагель, отриманий таким чином, очищали за допомогою хроматографії на NH-силікагелі (гептан: етилацетат = 3:1). Розчин, отриманий таким чином, концентрували при 22 UA 99637 C2 5 зниженому тиску й очищали за допомогою хроматографії на силікагелі (гептан: етилацетат = 3:1, і потім 2:1) для одержання зазначеної сполуки (2,2 г) у вигляді маслянистої речовини. 1 H-ЯМР спектр (ДМСО-d6) (м.ч.): 1,18 (18H, с), 4,07 (2H, с), 5,32 (2H, с), 6,58 (1H, с), 6,836,86 (1H, м), 6,96-7,01 (1H, м), 7,29 (2H, д, J=8,0 Гц), 7,40 (2H, д, J=8,0 Гц), 7,58 (1H, дд, J=4,8, 7,6 Гц), 7,69-7,74 (1H, м), 8,15-8,18 (1H, м), 8,34 (1H, дд, J=2,0, 7,6 Гц), 8,59 (1H, дд, J=2,0, 5,2 Гц). Приклад одержання 1-6-1: ди-трет-бутил (3-(3-(4-((піридин-2-ілокси)метил)бензил)ізоксазол5-іл)піридин-2-іл)іміду дикарбонат (Інший Спосіб 2 Прикладу одержання 1-4-2) O N N O O N O N O O 10 15 20 25 Складний ефір трет-бутилу і 4-метилен-2-оксо-4H-піридо[2,3-d][1,3]оксазин-1-карбонової кислоти (1,48 г), описаного в Прикладі одержання 1-6-2, 2-(4-(2-нітро-етил)-бензилокси)піридину (2,9 г), описаного в Прикладі одержання 1-1-4, ди-трет-бутилу дикарбонат (6,14 г), 4диметиламінопіридин (68,6 мг) і тетрагідрофуран (50 мл) перемішували 2 години при кімнатній температурі. Силікагель додавали до реакційного розчину, і розчинник концентрували при зниженому тиску. Силікагель, отриманий таким чином, очищали за допомогою хроматографії на силікагелі (гептан: етилацетат = 3:1, потім 1:1, і потім 1:2) для одержання зазначеної сполуки (2,1 г) у вигляді маслянистої речовини. 1 H-ЯМР спектр (ДМСО-d6) (м.ч.): 1,18 (18H, с), 4,07 (2H, с), 5,32 (2H, с), 6,58 (1H, с), 6,836,86 (1H, м), 6,96-7,01 (1H, м), 7,29 (2H, д, J=8,0 Гц), 7,40 (2H, д, J=8,0 Гц), 7,58 (1H, дд, J=4,8, 7,6 Гц), 7,69-7,74 (1H, м), 8,15-8,18 (1H, м), 8,34 (1H, дд, J=2,0, 7,6 Гц), 8,59 (1H, дд, J=2,0, 5,2 Гц). Початковий матеріал, складний ефір трет-бутилу і 4-метилен-2-оксо-4H-піридо[2,3d][1,3]оксазин-1-карбонової кислоти, синтезували в такий спосіб. Приклад одержання 1-6-2: Складний ефір трет-бутила і 4-метилен-2-оксо-4H-піридо[2,3d][1,3]оксазин-1-карбонової кислоти O N O N O O 30 35 1-(2-аміно-піридин-3-іл)-етанон (990 мг), ди-трет-бутилу дикарбонат (7,92 г), 4диметиламінопіридин (88,8 мг), триетиламін (4,95 мл) і тетрагідрофуран (16,5 мл) перемішували 24 години при кімнатній температурі. Силікагель додавали до реакційного розчину, і розчинник концентрували при зниженому тиску. Силікагель, отриманий таким чином, очищали за допомогою хроматографії на силікагелі (гептан: етилацетат = 2:1) для одержання зазначеної сполуки (1,48 г) у вигляді маслянистої речовини. 1 H-ЯМР спектр (ДМСО-d6) (м.ч.): 1,56 (9H, с), 5,01 (1H, д, J=3,6 Гц), 5,45 (1H, д, J=3,6 Гц), 7,28 (1H, дд, J=4,8, 8,0 Гц), 8,25 (1H, дд, J=1,6, 8,0 Гц), 8,36 (1H, дд, J=1,6, 4,8 Гц). 23 UA 99637 C2 Інший Спосіб 3 довідкового прикладу 1: 3-(3-(4-(піридин-2-ілоксиметил)-бензил)-ізоксазол-5іл)-піридин-2-іламін O N N O N NH2 5 10 15 Суміш 2-(4-(5-йод-ізоксазол-3-ілметил)-бензилокси)-піридину (200 мг), описаного в Прикладі одержання 1-8-2, 2-N-бутоксикарбоніл-3-піридинборонової кислоти (134 мг), описаної в Прикладі одержання 1-7-2, карбонату натрію (82 мг), тетракіс (трифенілфосфин) паладію (59 мг), 1,2диметоксиетану (6 мл) і води (1 мл) перемішували в атмосфері азоту 2 години при 80C. Цю суміш охолоджували до кімнатної температури, і додавали етилацетат і воду. Органічний шар відокремлювали, промивали водою і насиченим сольовим розчином, висушували безводним сульфатом магнію, і потім відфільтровували. Після того, як фільтрат адсорбували на силікагелі, його очищали колонкової хроматографії на силікагелі (гептан: етилацетат = 4:1 до 1:1 етилацетату) для одержання зазначеної сполуки (116 мг). Початковий матеріал, 2-N-бутоксикарбоніл-3-піридинборонову кислоту, синтезували в такий спосіб. Приклад одержання 1-7-1: Складний ефір трет-бутилу і піридин-2-іл-карбамінової кислоти O N O N H 20 25 До розчину трет-бутилового спирту (650 мл) і ди-трет-бутил карбонату (24 г) повільно додавали 2-амінопіридин (9,4 г). Цю суміш перемішували 24 години при кімнатній температурі. Цей реакційний розчин концентрували при зниженому тиску, і залишок очищали за допомогою хроматографії на силікагелі (гептан: етилацетат = 1:1) для одержання зазначеної сполуки (18 г). 1 H-ЯМР спектр (ДМСО-d6) (м.ч.): 1,47 (9H, с), 6,99-7,03 (1H, м), 7,70-7,74 (1H, м), 7,77-7,80 (1H, м), 8,23-8,24 (1H, м), 9,72 (1H, шс). Приклад одержання 1-7-2: 2-N-бутоксикарбоніл-3-піридинборонова кислота HO B N N H OH O O 30 35 40 Розчин у тетрагідрофурані (400 мл) складного ефіру піридин-2-іл-карбамінової кислоти і трет-бутилу (16 г), описаного в Прикладі одержання 1-7-1, і N,N, N',N'-тетраметилетилендіаміну (25 г) охолоджували до -70C, потім додавали краплями протягом 1 години N-бутил літію (78 мл, 2,64 M розчин гептану), що перемішували 10 хвилин. Цю суміш нагрівали до температури між 10 °C і -6 °C, що перемішували 2 години при цій температурі. Розчин знову охолоджували до 70 °C, і триізобутил борат (58 г) додавали краплями протягом 1 години. Цю суміш нагрівали до 0C, і потім до неї додавали насичений водний розчин хлориду амонію. Ефір додавали до твердого продукту жовтого кольору, отриманому таким чином, який перемішували, і твердий продукт потім збирали шляхом фільтрації і промивали ефір і воду. Цей твердий продукт висушували при зниженому тиску, так щоб одержати зазначену сполуку (14 г). 1 H-ЯМР спектр (ДМСО-d6) (м.ч.): 1,32-1,41 (9H, м), 6,80-6,84 (1H, м), 7,95-8,13 (2H, м). В іншому Способі 3 довідкового прикладу 1, початковий матеріал, 2-(4-(5-йод-ізоксазол-3ілметил)-бензилокси)-піридин, синтезували в такий спосіб. 24 UA 99637 C2 Приклад піридин одержання 1-8-1: 2-(4-(5-три-н-бутилстаніл-ізоксазол-3-ілметил)-бензилокси) Sn O N O N 5 10 15 До розчину в тетрагідрофурані (90 мл) три-н-бутилетинілтину (3 г), 2-(4-(2-нітро-етил)бензилокси)-піридину (4,9 г), описаного в Прикладі одержання 1-1-4, і 4-диметиламінопіридину (116 мг) додавали розчин у тетрагідрофурані (30 мл) ди-трет-бутил дикарбонату (7,3 г), що перемішували 15 годин при кімнатній температурі. Етилацетат і воду додавали до цієї суміші. Органічний шар відокремлювали, промивали водою і насиченим сольовим розчином, висушували безводним сульфатом магнію, і відфільтровували. Фільтрат адсорбували на силікагелі, і потім очищали колонковою хроматографією на силікагелі (гептан: етилацетат = 4:1) для одержання зазначеної сполуки (5,3 г). 1 H-ЯМР спектр (ДМСО-d6) (м.ч.): 0,81-0,85 (9H, м), 1,08-1,12 (6H, м), 1,23-1,30 (6H, м), 1,461,54 (6H, м), 4,00 (2H, с), 5,30 (2H, с), 6,40 (1H, с), 6,83-6,86 (1H, м), 6,97-7,00 (1H, м), 7,25-7,26 (2H, м), 7,36-7,38 (2H, м), 7,69-7,74 (1H, м), 8,15-8,17 (1H, м). Приклад одержання 1-8-2: 2-(4-(5-йод-ізоксазол-3-ілметил)-бензилокси)-піридин I O N O N 20 25 30 До розчину в тетрагідрофурані (15 мл) 2-(4-(5-три-н-бутилстаніл-ізоксазол-3-ілметил)бензилокси)-піридину (5,1 г), описаного в Прикладі одержання 1-8-1, додавали йодин (2,5 г) при 0C. Цю суміш перемішували при цій температурі 20 хвилин. 10 % водний розчин тіосульфату натрію і етилацетат додавали до цієї суміші. Органічний шар відокремлювали, промивали насиченим сольовим розчином, висушували безводним сульфатом магнію, і потім відфільтровували. Фільтрат концентрували, і залишок очищали за допомогою колонкової хроматографії на силікагелі (гептан: етилацетат = 10:1-4:1) для одержання зазначеної сполуки (2,4 г). 1 H-ЯМР спектр (ДМСО-d6) (м.ч.): 3,99 (2H, с), 5,31 (2H, с), 6,66 (1H, с), 6,84-6,87 (1H, м), 6,97-7,00 (1H, м), 7,26 (2H, д, J=8 Гц), 7,39 (2H, д, J=8 Гц), 7,70-7,74 (1H, м), 8,16-8,17 (1H, м). Інший спосіб для прикладу одержання 3-(3-(4-(піридин-2-ілоксиметил)-бензил)-ізоксазол-5іл)-піридин-2-іламіну, описаний у Довідковому прикладі 1, буде описаний нижче. [Довідковий приклад 2] Синтез трет-бутил (3-ацетилпіридин-2-іл)карбам ату O N 35 40 NH O O Суміш 1-(2-амінопіридин-3-іл)етанону (50 г, 368 ммоль), ди-трет-бутилдикарбонату (120 г, 552 ммоль) і трет-бутанолу (200 мл) перемішували при 90C протягом трьох годин в атмосфері азоту. Після охолодження розчинник випаровували при зниженому тиску, N-гептан (500 мл) додавали до залишку й твердий продукт, що випав, відфільтровували для одержання зазначеної сполуки (77 г) у вигляді твердого продукту жовтого кольору. 1 H-ЯМР Спектр (СDCl3) (м.ч.):1,54 (9H, с), 2,64 (3H, с), 7,03 (1H, дд, J=4,8, 8,0 Гц), 8,16 (1H, дд, J=2,0, 8,0 Гц), 8,63 (1H, дд, J=2,0, 4,8 Гц), 10,82 (1H, шс). [Довідковий приклад 3] Синтез етил 5-(2-амінопіридин-3-іл)ізоксазол-3-карбоксилату 25 UA 99637 C2 O O N O N 5 10 15 20 NH2 До розчину трет-бутил (3-ацетилпіридин-2-іл)карбамату (600 мг, 2,29 ммоль) і діетил оксалату (669 мг, 4,58 ммоль) у толуолі (5,0 мл) додавали трет-бутоксид калію (514 мг, 4,58 ммоль) при кімнатній температурі в атмосфері азоту, перемішували дві години. Після додавання толуолу (5,0 мл) і перемішування протягом однієї години, до нього додавали третбутоксид калію (257 мг, 2,29 ммоль) і розчин перемішували дві години. До реакційної суміші додавали гідроксиламіну гідрохлорид (477 мг, 6,87 ммоль) і етанол (10 мл), перемішували одну годину, додавали туди воду (1,0 мл) і розчин перемішували протягом ночі при кімнатній температурі. Туди додавали воду (30 мл) і розчин екстрагували етилацетатом. Після того, як органічний шар промивали водою, насиченою хлоридом натрію і висушували безводним сульфатом магнію, розчин концентрували. Концентрований залишок розчиняли в N,Nдиметилформаміді (5 мл), туди додавали триетиламін (192 мг) і розчин перемішували при 80C шість година Після охолодження, туди додавали воду, і розчин екстрагували етилацетатом. Після того, як органічний шар промивали водою, насиченою хлоридом натрію і висушували безводним сульфатом магнію, розчинник випаровували при зниженому тиску для одержання зазначеної сполуки (443 мг) у вигляді твердого продукту білого кольору. 1 H-ЯМРСпектр (СDCl3) (м.ч.):1,45 (3H, т, J=7,2 Гц), 4,49 (2H, к, J=7,2 Гц), 5,40 (2H, шс), 6,79 (1H, дд, J=5,2, 7,6 Гц), 6,91 (1H, с), 7,81 (1H, дд, J=2,0, 7,6 Гц), 8,21 (1H, дд, J=2,0, 5,2 Гц). [Довідковий приклад 4] Синтез [5-(2-амінопіридин-3-іл)ізоксазол-3-іл]метанолу OH N O N 25 30 35 40 45 NH2 До суспензії етил 5-(2-амінопіридин-3-іл)ізоксазол-3-карбоксилату (381 мг, 1,63 ммоль) у тетрагідрофурані (3,8 мл) і етанолі (3,8 мл) додавали борогідрид натрію (201 мг, 4,89 ммоль) при 0C в атмосфері азоту, перемішували при 0C одну годину і при 20C протягом 21 години. При охолодженні на водяній крижаній бані до реакційної суміші додавали 2 N соляну кислоту (2,46 мл, 4,89 ммоль) краплями, перемішували при 0 °C 10 хвилин і при кімнатній температурі 30 хвилин. При охолодженні на водяній крижаній бані після додавання краплями водного розчину 5 % бікарбонату натрію для встановлення лужного рН, розчин екстрагували етилацетатом. Після того, як органічний шар висушували безводним сульфатом магнію, розчинник випаровували при зниженому тиску. Залишок суспендували в тетрагідрофурані (1,4 мл), до реакційної суміші додавали борогідрид натрію (67 мг, 1,63 ммоль) при 0 °C, промивали метанолом (1,4 мл). Після перемішування при кімнатній температурі протягом години розчин перемішували при 60 °C п'ять годин. При охолодженні на водяній крижаній бані до реакційної суміші додавали 1 N соляну кислоту (1,63 мл, 1,63 ммоль) краплями, що перемішували при 0C 10 хвилин і при кімнатній температурі 30 хвилин. При охолодженні на водяній крижаній бані після додавання 1 N водного гідроксиду натрію краплями для встановлення лужного рН, розчин екстрагували етилацетатом. Після того, як органічний шар висушували безводним сульфатом магнію, розчинник випаровували при зниженому тиску для одержання зазначеної сполуки (258 мг) у вигляді твердого продукту палевого кольору. 1 H-ЯМР Спектр (ДМСО-d6) (м.ч.):4,56 (2H, д, J=5,6 Гц), 5,54 (1H, т, J=5,6 Гц), 6,27 (2H, шс), 6,72 (1H, дд, J=4,8, 7,6 Гц), 6,90 (1H, с), 7,90 (1H, дд, J=2,0, 7,6 Гц), 8,10 (1H, дд, J=2,0, 4,8 Гц). Довідкові приклади 5-10 являють собою способи синтезу для Довідкових прикладів 3 і 4. [Довідковий приклад 5] Синтез N-(3-ацетилпіридин-2-іл)-2,2-диметилпропанаміду 26 UA 99637 C2 O O O O NH2 N N N O NH N O 5 10 15 До суміші 1-(2-амінопіридин-3-іл)етанону (272 мг, 2 ммоль), 4-диметиламінопіридину (24 мг, 0,2 ммоль), триетиламіну (0,64 мл, 4,6 ммоль) і толуолу (2 мл) додавали півалоїл хлорид (0,52 мл, 4,2 ммоль) краплями при кімнатній температурі, перемішували при кімнатній температурі одну годину і при 60C п'ять годин. Після того, як завершувалося утворення 2-трет-бутил-4* метил-4H-піридо[2,3-d][1,3]оксазин-4-іл півалату , до реакційної суміші додавали воду (2 мл) і 5 N соляну кислоту (0,8 мл), що перемішували при кімнатній температурі 30 хвилин. Після того, як реакційну суміш розділяли, до водного шару додавали 5 N водний гідроксид натрію (1 мл) і екстрагували толуолом. Розчинник випаровували при зниженому тиску, і твердий продукт, що випав, відфільтровували для одержання зазначеної сполуки (415 мг). 1 H-ЯМР Спектр (СDCl3) (м.ч.):1,33 (9H, с), 2,64 (3H, с), 7,10 (1H, дд, J=4,8, 8,0 Гц), 8,17 (1H, дд, J=2,0, 7,6 Гц), 8,64 (1H, дд, J=2,0, 4,8 Гц). * 2-трет-бутил-4-метил-4H-піридо[2,3-d][1,3]оксазин-4-іл півалат 1 H-ЯМР Спектр (СDCl3) (м.ч.):1,09 (9H, с), 1,32 (9H, с), 2,05 (3H, с), 7,14 (1H, дд, J=4,8, 7,6 Гц), 7,71 (1H, дд, J=2,0, 7,6 Гц), 8,51 (1H, дд, J=2,0, 4,8 Гц). Довідкові приклади 6-7 являють собою способи синтезу для Довідкового прикладу 5. [Довідковий приклад 6] Синтез 2-трет-бутил-4H-піридо[2,3-d][1,3]оксазин-4-ону O O N N 20 25 30 До суміші 2-аміноникотинової кислоти (13,8 г, 100 ммоль), 4-диметиламінопіридину (1,2 г, 10 ммоль), триетиламіну (55,8 мл, 400 ммоль) і N-метилпіролідону (140 мл, 42 ммоль) додавали півалоїлу хлорид (24,1 г, 200 ммоль) краплями при 0C, і після того, як додавання краплями завершували, перемішували протягом ночі при кімнатній температурі. До реакційної суміші додавали воду, екстрагували толуолом, і органічний шар промивали водою і водою, насиченою хлоридом натрію. Після того, як розчин висушували безводним сульфатом магнію і відфільтровували, розчинник випаровували при зниженому тиску. До залишку додавали Nгептан, суспендували і перемішували при 0C, відфільтровували для одержання зазначеної сполуки (16,6 г). 1 H-ЯМР Спектр (СDCl3) (м.ч.):1,45 (9H, с), 7,48 (1H, дд, J=4,8, 8,0 Гц), 8,52 (1H, дд, J=2,0, 7,6 Гц), 8,97 (1H, дд, J=2,0, 4,8 Гц). [Довідковий приклад 7] Синтез N-(3-ацетилпіридин-2-іл)-2,2-диметилпропанаміду O NH N O 35 40 До суміші 2-трет-бутил-4H-піридо[2,3-d][1,3]оксазин-4-ону (10,2 г, 50 ммоль) і тетрагідрофурану (50 мл) додавали бромід метилмагнію (0,97 M розчин у тетрагідрофурані, 100 мл, 97 ммоль) краплями при -78C, після завершення додавання краплями суміш перемішували при -78C протягом 30 хвилин. До реакційної суміші додавали насичений водний розчин хлориду амонію і воду, суміш екстрагували етилацетатом, і органічнийшар промивали водним 27 UA 99637 C2 5 розчином хлориду амонію. Розчинник випаровували при зниженому тиску, і твердий продукт, що випав, відфільтровували для одержання зазначеної сполуки (9,1 г). 1 H-ЯМР Спектр (СDCl3) (м.ч.):1,33 (9H, с), 2,64 (3H, с), 7,10 (1H, дд, J=4,8, 8,0 Гц), 8,17 (1H, дд, J=2,0, 7,6 Гц), 8,64 (1H, дд, J=2,0, 4,8 Гц). [Довідковий приклад 8] Синтез етил 5-{2-[(2,2-диметилпропаноїл)аміно]піридин-3іл}ізоксазол-3-карбоксилату O O N O N NH O 10 15 20 До суміші N-(3-ацетилпіридин-2-іл)-2,2-диметилпропанаміду (8,08 г, 36,7 ммоль), діетил оксалату (10,0 мл, 73,4 ммоль) і етанолу (36 мл) додавали трет-бутоксид калію (8,23 г, 73,4 ммоль) при -25C, суміш перемішували при -25C одну годину. У реакційну суміш додавали воду (72 мл), перемішували при кімнатній температурі, додавали толуол (36 мл), розділяли, і отриманий водний шар далі промивали толуолом (36 мл). До розчину додавали 5 N соляну кислоту (14 мл) і гідрохлорид гідроксиламіну (5,10 г, 73,4 ммоль), перемішували при кімнатній температурі 30 хвилин. До реакційної суміші додавали 5 N водний гідроксид натрію (14 мл), суміш екстрагували толуолом, розчинник випаровували при зниженому тиску. До отриманого залишку додавали етанол (35 мл) і триетиламін (5 мл), перемішували при 80C-85C шість годин. До реакційної суміші додавали N-гептан (105 мл) і твердий продукт, що випав, відфільтровували для одержання зазначеної сполуки (6,90 г). 1 H-ЯМР Спектр (ДМСО-d6) (м.ч.):1,19 (9H, с), 1,32 (3H, т), 4,37 (4H, к), 7,12 (1H, с), 7,46 (1H, дд, J=4,8, 8,0 Гц), 8,25 (1H, дд, J=2,0, 8,0 Гц), 8,58 (1H, дд, J=2,0, 4,8 Гц), 10,03 (1H, с). [Довідковий приклад 9] Синтез N-{3-[3-(гідроксиметил)ізоксазол-5-іл]піридин-2-іл}-2,2 диметилпропанаміду 25 OH N O N NH O 30 35 40 До суміші етил 5-{2-[(2,2-диметилпропаноїл)аміно]піридин-3-іл}ізоксазол-3-карбоксилату (111 г, 350 ммоль), етанолу (110 мл) і тетрагідрофурану (350 мл) додавали борогідрид натрію (13,2 г, 350 ммоль) при кімнатній температурі, суміш перемішували при кімнатній температурі 6 годин. До реакційної суміші додавали воду (350 мл) і 5 N соляну кислоту (90 мл), перемішували при кімнатній температурі 30 хвилин, 5 N водний гідроксид натрію (110 мл) додавали до суміші, розчин екстрагували сумішшю етилацетату і тетрагідрофурану, і органічний шар промивали водою і водою, насиченою хлоридом натрію. Розчинник випаровували при зниженому тиску для одержання зазначеної сполуки (83,8 г) у вигляді твердого продукту жовтого кольору, частково забрудненого [5-(2-амінопіридин-3-іл)ізоксазол-3-іл]метанолом. 1 H-ЯМР Спектр (ДМСО-d6) (м.ч.):1,20 (9H, с), 4,52 (2H, д, J=6,0 Гц), 5,53 (1H, т, J=6,0 Гц), 6,70 (1H, с), 7,44 (1H, дд, J=4,8, 8,0 Гц), 8,19 (1H, дд, J=5,6, 7,6 Гц), 8,53 (1H, дд, J=2,0, 4,8 Гц), 9,89 (1H, шс). [Довідковий приклад 10] Синтез [5-(2-амінопіридин-3-іл)ізоксазол-3-іл]метанолу 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPyridine derivative substituted with heterocycle and phosphonoxymethyl group and antifungal agent containing the same
Автори англійськоюMatsukura, Masayuki
Назва патенту російськоюПроизводные пиридина, замещенные гетероциклическим кольцом и фосфоноксиметильной группой, и содержащее их противогрибковое средство
Автори російськоюМацукура Масаюки
МПК / Мітки
МПК: A61K 31/661, C07F 9/6558, A61P 31/10
Мітки: гетероциклічним, засіб, протигрибковий, кільцем, похідні, піридину, групою, заміщені, фосфоноксиметильною, містить
Код посилання
<a href="https://ua.patents.su/63-99637-pokhidni-piridinu-zamishheni-geterociklichnim-kilcem-i-fosfonoksimetilnoyu-grupoyu-i-protigribkovijj-zasib-shho-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Похідні піридину, заміщені гетероциклічним кільцем і фосфоноксиметильною групою, і протигрибковий засіб, що їх містить</a>
Попередній патент: Рослина brassica, яка містить мутантний алель нерозкривання
Наступний патент: Оксазолідинони для лікування та/або профілактики серцевої недостатності
Випадковий патент: Планетарний редуктор з паралелограмним приводом