Похідні бензотіазинів, їх одержання та застосування як ліків
Номер патенту: 105040
Опубліковано: 10.04.2014
Автори: Перес Мішель, Рівал Ів, Ламот Марі, Жюнкро Дідьє
Формула / Реферат
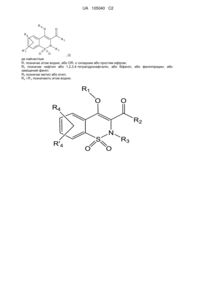
1. Сполуки загальної Формули (І):
 , I
, I
де
R1 позначає атом водню; С1-C6алкіл; COR5; SO2R5; CO(CH2)mR6; CO(CH2)mOR6; (CH2)mR6; (CH2)mCONR7R8; (CH2)nNR7R8; (CH2)nOR6; CHR7OR9; (CH2)mR10;
m має значення від 1 до 6;
n має значення від 2 до 6;
R2 позначає феніл, що має як замісники одну чи більше ніж одну групу, вибрану з атома галогену, С1-C6алкілу, CN, OH, CF3, OCF3, SMe, COMe, CMe(OH)CF3, CH(OH)CF3, COOR7, CONR7R11; нафтил, 1,2,3,4-тетрагідронафталін, біфеніл, фенілпіридин або гетероцикл, відмінний від індолу, у випадку, коли R1, R4 і R'4 позначають атоми водню, незаміщені або такі, що мають як замісники одну чи більше ніж одну групу, вибрану з атома галогену або С1-C6алкілу, CN, ОН, CF3, OCF3, ОМе, SMe; циклоалкіл, незаміщений або такий, що має як замісники ОН, CONH2, SO2Me, SO2NH2; С1-C6алкіларил або циклоалкіларил,
за умови, що група R2 завжди зв'язана з карбонілом через атом вуглецю,
і, коли R2 позначає феніл, замісник COOR7 ніколи не знаходиться в положенні 4 відносно карбонілу;
R3 позначає метил або етил;
R4 і R'4 є однаковими або різними і позначають атом водню; атом галогену; С1-C6алкіл; CN; CF3; OCF3; SMe; OMe; NR7R8; SO2Me;
R5 позначає С1-C6алкіл; феніл, незаміщений або такий, що має як замісники одну чи більше ніж одну групу, вибрану з атома галогену, С1-C6алкілу, CN, OH, CF3, OCF3, SMe; нафтил, незаміщений або такий, що має як замісники одну чи більше ніж одну групу, вибрану з атома галогену або С1-C6алкілу, CN, OH, CF3, OCF3, SMe; циклоалкіл, незаміщений або такий, що має як замісники CONH2, SO2Me, SO2NH2, гетероарил, незаміщений або такий, що має як замісники одну чи більше ніж одну групу, вибрану з атома галогену, С1-C6алкілу, CN, OH, CF3, OCF3, SMe;
R6 позначає атом водню; С1-C6алкіл; феніл, незаміщений або такий, що має як замісники одну чи більше ніж одну групу, вибрану з атома галогену, С1-C6алкілу, CN, ОН, CF3, OCF3, SMe; нафтил або гетероцикл, незаміщені або такі, що мають як замісники одну чи більше ніж одну групу, вибрану з атома галогену або С1-C6алкілу, CN, OH, CF3, OCF3, SMe; циклоалкіл, незаміщений або такий, що має як замісники CONH2, SO2Me, SO2NH2;
R7 позначає атом водню, С1-C6алкіл;
R8 позначає атом водню, С1-C6алкіл, феніл, незаміщений або такий, що має як замісники одну чи більше ніж одну групу, вибрану з атома галогену, С1-C6алкілу, CN, ОН, CF3, OCF3, SMe; нафтил або гетероцикл, незаміщені або такі, що мають як замісники одну чи більше ніж одну групу, вибрану з атома галогену, С1-C6алкілу, CN, OH, CF3, OCF3, SMe; циклоалкіл, незаміщений або такий, що має як замісники CONH2, SO2Me, SO2NH2;
R7 і R8, разом з атомом азоту, до якого вони приєднані, можуть утворювати 6-членне кільце, яке може містити один або більше ніж один гетероатом, вибраний з N, S або О, і може бути незаміщеним або мати як замісники одну чи більше ніж одну групу, вибрану з С1-C6алкілу, С1-C6алкіларилу або арилу;
R9 позначає COOMe, COOEt;
R10 позначає атом галогену, СООН, COOR7;
R11 позначає атом водню, С1-C6алкіл, С1-C6алкілциклоалкіл, циклоалкіл, арил, С1-C6алкіларил;
а також їх стереоізомери, солі та сольвати, прийнятні для терапевтичного використання.
2. Сполука за п. 1, де R1 позначає атом водню.
3. Сполука за п. 1, де OR1 є складним або простим ефіром.
4. Сполука за будь-яким з пп. 1-3, де R2 позначає нафтил або 1,2,3,4-тетрагідронафталін, або біфеніл, або фенілпіридин, незаміщені або такі, що мають як замісники одну чи більше ніж одну групу, вибрану з атома галогену, С1-C6алкілу, CN, OH, CF3, OCF3, OMe, SMe, або феніл, що має як замісники один або більше ніж один атом галогену, CN, CF3 або С1-C6алкіл.
5. Сполука за будь-яким з пп. 1-3, де R4 і R'4 позначають атом водню.
6. Сполука за п. 1, вибрана з:
(4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(адамантан-1-іл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(4-метилфеніл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(4-хлорфеніл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(4-ціанофеніл)метанону,
біфеніл-4-іл-(4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(2,4-дихлорфеніл)метанону,
(4-гідроксі-2-етил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(адамантан-1-іл)метанону,
(4-гідроксі-2-етил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)метанону,
(4-гідроксі-2-етил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(4-метилфеніл)метанону,
(4-гідроксі-2-етил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(4-хлорфеніл)метанону,
біфеніл-4-іл-(4-гідроксі-2-етил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)метанону,
(5-хлор-4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)-метанону,
(5-хлор-4-гідроксі-2-етил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)метанону,
(6-фтор-4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)-метанону,
(6-фтор-4-гідроксі-2-етил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)метанону,
(7-фтор-4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)-метанону,
(7-фтор-4-гідроксі-2-етил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)метанону,
бензойної кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
циклогексанкарбонової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
трет-бутилкарбонової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
4-метилбензойної кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілового ефіру,
4-хлорбензойної кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілового ефіру,
трет-бутилкарбонової кислоти 16-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
циклогексанкарбонової кислоти 6-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
бензойної кислоти 6-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо-[е][1,2]тіазин-4-ілового ефіру,
4-метилбензойної кислоти 6-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
трет-бутилкарбонової кислоти 6-фтор-2-етил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
циклогексанкарбонової кислоти 6-фтор-2-етил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
бензойної кислоти 6-фтор-2-етил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілового ефіру,
4-метилбензойної кислоти 6-фтор-2-етил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
4-хлорбензойної кислоти 6-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
4-хлорбензойної кислоти 6-фтор-2-етил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
нафталін-1-ілкарбонової кислоти 2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
нафталін-2-ілкарбонової кислоти 2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
нафталін-1-ілкарбонової кислоти 2-метил-3-(4-ціанобензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
нафталін-2-ілкарбонової кислоти 2-метил-3-(4-ціанобензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
4-хлорбензойної кислоти 2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
4-хлорбензойної кислоти 2-метил-3-(4-ціанобензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
(нафталін-2-ілоксі)оцтової кислоти 2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
(нафталін-2-ілоксі)оцтової кислоти 2-метил-3-(4-ціанобензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
(нафталін-1-ілоксі)оцтової кислоти 2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
(нафталін-1-ілоксі)оцтової кислоти 2-метил-3-(4-ціанобензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
(4-хлорфеноксі)оцтової кислоти 2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
(4-хлорфеноксі)оцтової кислоти 2-метил-3-(4-ціанобензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
оцтової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
2,4-дихлорбензойної кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо-[е][1,2]тіазин-4-ілового ефіру,
4-фторбензойної кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілового ефіру,
циклопентанової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілового ефіру,
2-фуранової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
тіофен-2-карбонової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілового ефіру,
3-хлорбензойної кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілового ефіру,
2-хлорбензойної кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілового ефіру,
феноксіоцтової кислоти 2-метил-3-(нафталін-2-ілкарбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілового ефіру,
(4-метокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)метанону,
(4-етокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)метанону,
(4-пропілокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)метанону,
(4-бутилокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)метанону,
(4-(2-хлоретокси)-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(пара-толіл)метанону,
(4-[2-(нафталін-2-ілоксі)етокси]-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(пара-толіл)метанону,
(4-(2-феноксіетокси)-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)-метанону,
метил-2-(2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілоксі)ацетату,
2-(2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілоксі)оцтової кислоти,
2-(2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілокси)-N-(нафталін-1-іл)ацетаміду,
2-(2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілоксі)-N-(адамантан-1-іл)ацетаміду,
2-(2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілоксі)-N-(адамантан-2-іл)ацетаміду,
метил-2-(1,1-діоксо-2-метил-3-(4-метилбензоїл)-2Н-бензо[e][1,2]тіазин-4-ілоксі)ацетату,
(1,1-діоксо-2-метил-3-(4-метилбензоїл)-2Н-бензо[е][1,2]тіазин-4-ілоксі)оцтової кислоти,
2-[2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілокси]-1-піперидин-1-ілетанону,
2-[2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілокси]-1-(4-метилпіперазин-1-іл)етанону,
1-(4-бензилпіперазин-1-іл)-2-[2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілоксі]етанону,
(4-хлорфеноксі)оцтової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
(нафталін-1-ілоксі)оцтової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
(нафталін-2-ілоксі)оцтової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
(4-[2-(нафталін-1-ілоксі)етокси]-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(пара-толіл)метанону,
(4-[2-(4-хлорфенілоксі)етокси]-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(пара-толіл)метанону,
оцтової кислоти 2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
пропанової кислоти 2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
(4-метилокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(пара-толіл)метанону,
(4-етилокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(пара-толіл)метанону,
[4-(2-брометокси)-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл]нафталін-2-ілметанону,
{4-[2-(4-хлорфеноксі)етокси]-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл}нафталін-2-ілметанону,
вугільної кислоти етил-1-[2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілоксі]етилового ефіру,
[2-метил-4-(2-піперидин-1-ілетокси)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл]нафталін-2-ілметанону,
4-хлорбензойної кислоти 5-хлор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
циклогексанкарбонової кислоти 5-хлор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
бензойної кислоти 5-хлор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілового ефіру,
4-хлорбензойної кислоти 6-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
циклогексанкарбонової кислоти 6-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
бензойної кислоти 6-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілового ефіру,
4-хлорбензойної кислоти 7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
циклогексанкарбонової кислоти 7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
бензойної кислоти 7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілового ефіру,
оцтової кислоти 7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]-тіазин-4-ілового ефіру,
феноксіоцтової кислоти 7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
(4-хлорфеноксі)оцтової кислоти 7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
(5-хлор-4-етокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)нафталін-2-ілметанону,
(5-хлор-4-пропокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)нафталін-2-ілметанону,
(6-фтор-4-метокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)нафталін-2-ілметанону,
(6-фтор-4-етокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)нафталін-2-ілметанону,
(6-фтор-4-пропокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)нафталін-2-ілметанону,
(7-фтор-4-метокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)нафталін-2-ілметанону,
(7-фтор-4-етокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)нафталін-2-ілметанону,
(7-фтор-4-пропокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)нафталін-2-ілметанону,
[7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілоксі]оцтової кислоти метилового ефіру,
[7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілоксі]оцтової кислоти метилового ефіру,
2-[7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілокси]-1-піперидин-1-ілетанону,
2-[7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілокси]-1-(4-метилпіперазин-1-іл)етанону,
1-(4-бензилпіперазин-1-іл)-2-[7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілоксі]етанону,
бензолсульфонової кислоти 7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
бензолсульфонової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
4-хлорбензолсульфонової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
4-метилбензолсульфонової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
4-ціанобензолсульфонової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
4-хлорбензолсульфонової кислоти 7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
4-метилбензолсульфонової кислоти 7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
4-ціанобензолсульфонової кислоти 7-фтор-2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Н-бензо[е][1,2]тіазин-4-ілового ефіру,
(4-гідрокси-2-метил-1,1-діоксо-7-піперидин-1-іл-2Н-бензо[е][1,2]тіазин-3-іл)-нафталін-2-ілметанону,
(7-диметиламіно-4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-нафталін-2-ілметанону,
(4-гідрокси-2-метил-1,1-діоксо-7-піролідин-1-іл-2Н-бензо[е][1,2]тіазин-3-іл)-нафталін-2-ілметанону,
[4-гідрокси-2-метил-1,1-діоксо-7-(4-фенілпіперазин-1-іл)-2Н-бензо[е][1,2]тіазин-3-іл]-нафталін-2-ілметанону,
(7-трет-бутил-4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(нафталін-2-іл)-метанону,
(4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(3,4-дихлорфеніл)метанону,
(4-гідроксі-2-етил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(3,4-дихлорфеніл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(бензофуран-2-іл)метанону,
(4-гідроксі-2-етил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)(бензофуран-2-іл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(5,6,7,8-тетрагідронафталін-2-іл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(5,5,8,8-тетраметил-5,6,7,8-тетрагідронафталін-2-іл)метанону,
(7-фтор-4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(5,6,7,8-тетрагідронафталін-2-іл)метанону,
(7-фтор-4-гідрокси-2-метил-1,1-діоксо-2Н-бензо[е][1,2]тіазин-3-іл)-(5,5,8,8-тетраметил-5,6,7,8-тетрагідронафталін-2-іл)метанону,
(2,3-дигідробензофуран-5-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2Н-бензо[е][1,2]-тіазин-3-іл)метанону,
(2,3-дигідробензофуран-5-іл)-(4-гідроксі-2-етил-1,1-діоксо-1,2-дигідро-2Н-бензо[е][1,2]-тіазин-3-іл)метанону,
бензо[1,3]діоксол-5-іл-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2Н-бензо[е][1,2]тіазин-3-іл)метанону,
бензо[1,3]діоксол-5-іл-(4-гідроксі-2-етил-1,1-діоксо-1,2-дигідро-2Н-бензо[е][1,2]тіазин-3-іл)метанону,
(2,3-дигідробензо[1,4]діоксин-6-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2Н-бензо[е][1,2]тіазин-3-іл)метанону,
(2,3-дигідробензо[1,4]діоксин-6-іл)-(4-гідроксі-2-етил-1,1-діоксо-1,2-дигідро-2Н-бензо[е][1,2]тіазин-3-іл)метанону,
бензо[b]тіофен-5-іл-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)метанону,
бензофуран-5-іл-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-(1-метил-1H-бензоімідазол-5-іл)метанону,
бензо[b]тіофен-2-іл-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)метанону,
(4-трет-бутилфеніл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[e][1,2]тіазин-3-іл)метанону,
(3-бромфеніл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-метанону,
3-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-карбоніл)-бензонітрилу,
(3,4-диметилфеніл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-(3-трифторметилфеніл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-(4-трифторметилфеніл)метанону,
адамантан-2-іл-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-метанону,
хроман-6-іл-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-метанону,
(4-хлор-3-трифторметилфеніл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)метанону,
(7-бром-4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-нафталін-2-ілметанону,
(7-хлор-4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[e][1,2]тіазин-3-іл)-нафталін-2-ілметанону,
(4-гідрокси-2,7-диметил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-нафталін-2-ілметанону,
біфеніл-3-іл-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-метанону,
(2'-фторбіфеніл-3-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)метанону,
(3'-фторбіфеніл-3-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)метанону,
(4'-фторбіфеніл-3-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)метанону,
(2'-хлорбіфеніл-3-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)метанону,
(3'-хлорбіфеніл-3-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)метанону,
(4'-хлорбіфеніл-3-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)метанону,
(2'-метилбіфеніл-3-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)метанону,
(3'-метилбіфеніл-3-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)метанону,
(4'-метилбіфеніл-3-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)метанону,
(2'-метоксибіфеніл-3-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]-тіазин-3-іл)метанону,
(3'-метоксибіфеніл-3-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]-тіазин-3-іл)метанону,
(4'-метоксибіфеніл-3-іл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]-тіазин-3-іл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-(3'-трифторметилбіфеніл-3-іл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-(4'-трифторметилбіфеніл-3-іл)метанону,
3'-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-карбоніл)-біфеніл-3-карбонітрилу,
3'-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-карбоніл)-біфеніл-4-карбонітрилу,
(4-гідрокси-7-метансульфоніл-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-нафталін-2-ілметанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-(1-феніл-циклопропіл)метанону,
1-[3-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-карбоніл)-феніл]етанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-[3-(2,2,2-трифтор-1-гідрокси-1-метилетил)феніл]метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-[3-(2,2,2-трифтор-1-гідроксіетил)феніл]метанону,
3-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[e][1,2]тіазин-3-карбоніл)-бензойної кислоти,
3-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-карбоніл)-N-метилбензаміду,
3-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-карбоніл)-N,N-диметилбензаміду,
N-етил-3-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2Н-бензо[е][1,2]тіазин-3-карбоніл)-бензаміду,
3-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2Н-бензо[е][1,2]тіазин-3-карбоніл)-N,N-діетилбензаміду,
N-циклопропіл-3-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2Н-бензо[е][1,2]тіазин-3-карбоніл)бензаміду,
N-циклопропілметил-3-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-карбоніл)бензаміду,
3-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-карбоніл)-N-фенілбензаміду,
N-бензил-3-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-карбоніл)-бензаміду,
3-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-карбоніл)бензаміду,
3-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-карбоніл)бензойної кислоти етилового ефіру,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-(3-піридин-3-ілфеніл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-(3-піридин-4-ілфеніл)метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-[3-(6-метилпіридин-3-іл)феніл]метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[e][1,2]тіазин-3-іл)-[3-(5-метилпіридин-3-іл)феніл]метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-[3-(4-метилпіридин-3-іл)феніл]метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-[3-(2-метилпіридин-3-іл)феніл]метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-[3-(4-метоксипіридин-3-іл)феніл]метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-[3-(6-фторпіридин-3-іл)феніл]метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-[3-(2-метоксипіридин-3-іл)феніл]метанону,
(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-[3-(6-метоксипіридин-3-іл)феніл]метанону,
(3-хлорфеніл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-метанону,
(3-фторфеніл)-(4-гідрокси-2-метил-1,1-діоксо-1,2-дигідро-2H-бензо[е][1,2]тіазин-3-іл)-метанону.
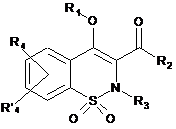
7. Спосіб одержання сполук загальної Формули (Іа), що відповідають Формулі І, за будь-яким з пп. 1-6, де R1 позначає атом водню, який відрізняється тим, що проміжну сполуку загальної Формули (IV)
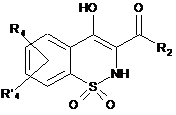 , IV
, IV
де R2, R4 і R'4 є такими, як визначено в п. 1,
конденсують із проміжною сполукою загальної Формули R3-Y, де R3 є таким, як визначено в п. 1, і Y позначає відхідну групу.
8. Спосіб одержання сполук загальної Формули (Іb), що відповідають Формулі І, за будь-яким з пп. 1-6, де R1 не є атомом водню, який відрізняється тим, що проміжну сполуку загальної Формули (Іа)
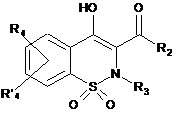 , Ia
, Ia
де R2, R3, R4 і R'4 є такими, як визначено в п. 1,
конденсують із проміжною сполукою загальної Формули R1-Z, де R1 є таким, як визначено вище, і Z позначає відхідну групу.
9. Спосіб одержання сполук загальної Формули (Іс), що відповідають Формулі І, за будь-яким з пп. 1-6, де R1 позначає (CH2)nNR7R8 або (СН2)nOR6, який відрізняється тим, що проміжну сполуку загальної Формули (V)
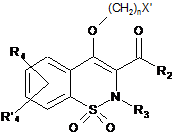 , V
, V
де R2, R3, R4, R'4, n є такими, як визначено в п. 1, і X' позначає відхідну групу, конденсують із проміжною сполукою загальної Формули R7R8NH або R6OH, де R7, R8 і R9 є такими, як визначено в п. 1.
10. Спосіб одержання сполук загальної Формули (Id), що відповідають Формулі І, за будь-яким з пп. 1-6, де R1 позначає (CH2)nCONR7R8, який відрізняється тим, що проміжну сполуку загальної Формули (VII)
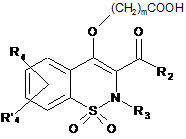 , VII
, VII
де R2, R3, R4, R'4 і m є такими, як визначено в п. 1,
конденсують із проміжною сполукою загальної Формули R7R8NH, де R7 і R8 є такими, як визначено в п. 1.
11. Спосіб одержання сполук загальної Формули (If), що відповідають Формулі І, за будь-яким з пп. 1-6, де R4 позначає NR7R8, який відрізняється тим, що проміжну сполуку загальної Формули (Іе)
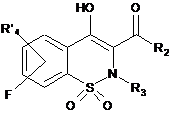 , Іе
, Іе
де R2, R3 і R'4 є такими, як визначено в п. 1,
конденсують із проміжною сполукою загальної Формули R7R8NH, де R7 і R8 є такими, як визначено в п. 1.
12. Спосіб одержання сполук загальної Формули (Ih), що відповідають Формулі І, за будь-яким з пп. 1-6, де R2 позначає біфеніл або фенілпіридин, заміщені або незаміщені, який відрізняється тим, що проміжну сполуку загальної Формули (Ig)
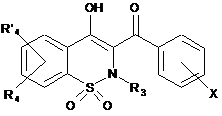 , Ig
, Ig
де R3, R4, R'4 є такими, як визначено в п. 1, і X позначає відхідну групу,
конденсують із бороновою кислотою.
13. Спосіб одержання сполук загальної Формули (Ik), що відповідають Формулі І, за будь-яким з пп. 1-6, де R2 позначає феніл, що має як замісник амід в орто- або мета-положенні, який відрізняється тим, що проміжну сполуку загальної Формули (Ij)
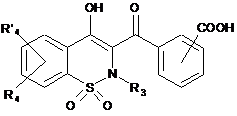 , Ij
, Ij
де R3, R4, R'4 є такими, як визначено в п. 1,
конденсують із аміном загальної Формули R7R11NH, де R7 і R11 є такими, як визначено в п. 1.
14. Сполука за будь-яким з пп. 1-6 для застосування як ліків.
15. Фармацевтична композиція, що містить як активний інгредієнт щонайменше одну сполуку за будь-яким з пп. 1-6 у комбінації з фармацевтично прийнятним носієм,як ліки.
16. Фармацевтична композиція за п. 15 як інгібітор 11b-гідроксистероїддегідрогенази типу 1 (11bHSD1).
17. Фармацевтична композиція за п. 15 для лікування та профілактики діабету типу 2.
18. Фармацевтична композиція за п. 15 для лікування та профілактики розладів, пов'язаних з 11b-гідроксистероїддегідрогеназою типу 1 (11bHSD1); або ожиріння; або дисліпідемій; або артеріальної гіпертензії; або атеросклерозу та клінічних патологій, які є наслідком даного захворювання, таких як коронарні інсульти або цереброваскулярні інсульти, або артерій нижніх кінцівок; або гіперглікемій; або інтолерантності до глюкози; або резистентності до інсуліну; або гіпертригліцеридемій; або гіперхолестеринемій; або рестенозів; або панкреатитів; або ретинопатій; або нефропатій; або невропатій; або деяких типів раку або глауком.
19. Фармацевтична композиція за п. 15, у комбінації з фармацевтично прийнятним носієм, для введення в комбінації із протидіабетичним агентом, таким як бігуаніди, різні форми інсуліну, сульфонілсечовини, меглітиніди, модулятори PPAR, інгібітори альфа-глюкозидази, аналоги GLP-1, інгібітори DPP-4, аналоги аміліну.
20. Фармацевтична композиція за п. 15, у комбінації з фармацевтично прийнятним носієм, для введення в комбінації з агентом, що протидіє ожирінню, таким як, наприклад, орлістат або сибутрамін.
Текст
Реферат: Об’єктом даного винаходу є похідні бензотіазинів, що виявляють здатність інгібувати 11-HSD1 не лише на ферментативному рівні, але також на клітинному рівні. Сполуки за даним винаходом є сполуками загальної Формули (І): UA 105040 C2 (12) UA 105040 C2 R1 O O R4 R2 R' 4 S O N O R3 , (I) де найчастіше R1 позначає атом водню, або OR1 є складним або простим ефіром; R2 позначає нафтил або 1,2,3,4-тетрагідронафталін, або біфеніл, або фенілпіридин, або заміщений феніл; R3 позначає метил або етил; R4 і R'4 позначають атом водню. UA 105040 C2 5 10 15 20 25 30 35 40 45 50 55 60 Метою даного винаходу є похідні бензотіазинів, спосіб одержання зазначених похідних, фармацевтичні композиції, що містять дані сполуки, та їх застосування як ліків, призначених для лікування та/або попередження діабету типу 2, ожиріння, дисліпідемій, артеріальної гіпертензії та атеросклерозу. Дані сполуки також можуть знайти застосування в лікуванні та/або попередженні гіперглікемій, інтолерантності до глюкози, резистентності до інсуліну, гіпертригліцеридемій, гіперхолестеринемій, рестенозів, панкреатитів, ретинопатій, нефропатій, невропатій (Reichard et al., N. Engl. J. Med. 1993, 329:304-309), деяких типів раку (Strickler et al., Diabetes Technology & Therapeutics 2001, 3(2): 263-274) або глауком (Pascale et al., Ophtalmology 2006, 113(7): 1081-86). Даний винахід також стосується комбінацій описаних сполук та інших агентів, використовуваних у лікуванні даних патологій. Дійсно, лікування таких патологій, як діабет типу 2, часто вимагає використання одночасно декількох класів сполук, щоб добитися рекомендованих показників глікемії та підтримувати баланс глюкози (Nathan et al., Diabetes Care 2009 32:193-203). Зазначені комбінації також можуть бути використані у комбінованому лікуванні ожиріння та діабетів типу 2 (Grundy et al., Circulation 2005, 112: 2735-2752). Метаболічний синдром є ранньою стадією декількох серйозних серцево-судинних патологій. Він розвивається як наслідок резистентності до інсуліну та характеризується вісцеральним ожирінням (Després et al., Nature 2006 444(14): 881-87), асоційованим з деякими факторами ризику, такими як інтолерантність до глюкози та деякі типи дисліпідемії, які можуть бути асоційовані з артеріальною гіпертензією (Grundy, Nat. Rev. Drug Discov. 2006, 5:295-309). Діабет типу 2 є документованою патологією, тому що глікемічні розлади можуть бути пояснені трьома основними механізмами: недостатністю функції β-клітин острівців Лангерганса підшлункової залози, зменшенням використання глюкози в периферичних тканинах і надлишковою продукцією глюкози в печінці (Monnier et al., Diabetes & Metabolism 2008, 34: 207216). Однак існуючі методики лікування не дозволяють досягти рекомендованих цільових показників глікемії (особливо Hba1c) у багатьох пацієнтів, що страждають діабетом типу 2. Тому завжди існує висока потреба в методиках лікування даної патології, основаних на нових механізмах. Ожиріння є недугою, що вражає дедалі більшу кількість людей в усьому світі. Дане захворювання часто асоційоване з підвищеним ризиком розвитку діабету типу 2, серцевосудинних захворювань, цереброваскулярних інсультів і деяких типів раку. Тому ожиріння є основним чинником ризику для патологій, асоційованих з високим рівнем захворюваності або смертності. Глюкокортикоїди (кортизол у людини, кортикостерон у гризунів) є всюдисущими гормонами, які відіграють домінуючу роль у регуляції енергетичного метаболізму. Вони індукують глюконеогенез та інгібують секрецію інсуліну бета-клітинами підшлункової залози, а також периферичне поглинання глюкози (Dallman et al., Front Neuroendocrinol. 1993, 14: 303-347). Недавно встановлено, що 11β-гідроксистероїд-дегідрогенази (11β-HSD) регулюють рівень глюкокортикоїдів у деяких тканинах-мішенях (печінки, жирової тканини, нирки, головного мозку і т.д.). У людини даний механізм може викликати локальне підвищення рівня кортизолу. Підвищення рівня кортизолу в жировій тканині може приводити до збільшення маси вісцеральної жирової тканини внаслідок впливу глюкокортикоїдів на диференцировку преадипоцитів в адипоцити та на ліпогенез; у деяких випадках глюкокортикоїди індукують ліполіз та шкідливу дію вільних жирних кислот плазми на печінку, підшлункову залозу, кістякові м'язи (ліпотоксичність). Підвищення рівня кортизолу в печінці може викликати збільшення глікемії, що може призводити до розвитку діабету типу 2. Відомі дві ізоформи 11β-HSD: тип 1 і тип 2. 11β-HSD2 локалізований в основному в нирках. Даний фермент каталізує перетворення активних глюкокортикоїдів на неактивні глюкокортикоїди (у людини - перетворення кортизолу на кортизон) і, отже, по суті бере участь у захисті мінералокортикоїдних рецепторів (MR) від активації кортизолом (Edwars et al., Lancet, 1988, 2: 986-989). І навпаки, 11β-HSD1 в основному діє подібно до кеторедуктази та перетворює неактивні глюкокортикоїди на активні глюкокортикоїди в тканинах, де цей фермент має високий рівень експресії (у печінці та жировій тканині). Тому інгібування даного ферменту на рівні печінки та адипоцитів має виражатися в зменшенні описаних вище ефектів. Ряд досліджень, у яких використано моделювання ожиріння та/або діабету у тварин, підтвердили залучення 11βHSD1 у ці захворювання. Так, рівень експресії 11β-HSD1 є підвищеним у діабетичних щурів лінії Zucker, і дане підвищення корелює із прогресуванням патології, модельованої у цих щурів (Duplomb et al., Biochem. Biophys. Res. Commun., 2004, 313: 594-599). Доведено, що миші з нульовою мутацією в гені, що кодує 11β-HSD1 (нокаут-миші), є стійкими до гіперглікемії, викликуваної ожирінням або стресом (Kotelevtsev Y. et al. PNAS 1997, 94: 14924-14929). І 1 UA 105040 C2 5 10 15 навпаки, у трансгенних мишей з вибірковою надекспресією 11β-HSD1 у жировій тканині розвивається вісцеральне ожиріння, інсулін-резистентний діабет і гіперліпідемія (Masuzika et al., Science, 2001, 294: 2166-2170). Наведені експериментальні дані вказують на перевагу, яку дає інгібування 11β-HSD1 як терапевтичної мішені (Wamil et al., Drug Discovery Today, 2007, 12: 504520). Сполуки за даним винаходом мають здатність вибірково інгібувати 11β-HSD1 у порівнянні з 11β-HSD2, у людини це повинно впливати на діабет типу 2, ожиріння, гіперліпідемії, артеріальну гіпертензію, атеросклероз і на всі патології, які із цим асоційовані, такі як коронарні інсульти, цереброваскулярні інсульти або артеріїт нижніх кінцівок (Wilcox et al., Stroke, 2007, 38: 865-873; Wilcox et al., Am. Heart J. 2008, 155:712-7). Дані сполуки відрізняються від сполук, відомих у даній області техніки, своєю хімічною структурою та винятковими біологічними властивостями. Метою даного винаходу є похідні бензотіазинів, які володіють здатністю інгібувати 11β-HSD1 не тільки на ферментному рівні, але також на клітинному рівні. Сполуки за даним винаходом є сполуками загальної Формули (I): I, 20 25 30 35 40 45 50 де R1 позначає атом водню; C1-C6 алкіл; COR5; SO2R5; CO(CH2)mR6; CO(CH2)mOR6; (CH2)mR6; (CH2)mCONR7R8; (CH2)nNR7R8; (CH2)nOR6; CHR7OR9; (CH2)mR10; m має значення від 1 до 6; n має значення від 2 до 6; R2 позначає феніл, що має як замісники одну чи більш ніж одну групу, вибрану з атома галогену, C1-C6 алкілу, CN, OH, CF3, OCF3, SMe, COMe, CMe(OH)CF3, CH(OH)CF3, COOR7, CONR7R11; нафтил, 1,2,3,4-тетрагідронафталін, біфеніл, фенілпіридин або гетероцикл, відмінний від індолу, у випадку, коли R1, R4 і R'4 є атомами водню, незаміщені або такі, що мають як замісники одну чи більш ніж одну групу, вибрану з атома галогену або C 1-C6 алкілу, CN, OH, CF3, OCF3, OMe, SMe; циклоалкіл, незаміщений або такий, що має як замісники OH, CONH2, SO2Me, SO2NH2; C1-C6 алкіларил або циклоалкіларил, за умови, що група R2 завжди зв'язана з карбонілом через атом вуглецю, і, коли R2 є фенілом, замісник COOR7 ніколи не знаходиться в положенні 4 відносно карбонілу; R3 позначає метил або етил; R4 і R'4 є однаковими або різними і позначають атом водню; атом галогену; C 1-C6 алкіл; CN; CF3; OCF3; SMe; OMe; NR7R8; SO2Me; R5 позначає C1-C6 алкіл; феніл, незаміщений або такий, що має як замісники одну чи більш ніж одну групу, вибрану з атома галогену, C 1-C6 алкілу, CN, OH, CF3, OCF3, SMe; нафтил, незаміщений або такий, що має як замісники одну чи більш ніж одну групу, вибрану з атома галогену або C1-C6 алкілу, CN, OH, CF3, OCF3, SMe; циклоалкіл, незаміщений або такий, що має як замісники CONH2, SO2Me, SO2NH2, гетероарил, незаміщений або такий, що має як замісники одну чи більш ніж одну групу, вибрану з атома галогену, C 1-C6 алкілу, CN, OH, CF3, OCF3, SMe; R6 позначає атом водню; C1-C6 алкіл; феніл, незаміщений або такий, що має як замісники одну чи більш ніж одну групу, вибрану з атома галогену, C1-C6 алкілу, CN, OH, CF3, OCF3, SMe; нафтил або гетероцикл, незаміщені або такі, що мають як замісники одну чи більш ніж одну групу, вибрану з атома галогену або C1-C6 алкілу, CN, OH, CF3, OCF3, SMe; циклоалкіл, незаміщений або такий, що має як замісники CONH2, SO2Me, SO2NH2; R7 позначає атом водню, C1-C6 алкіл; R8 позначає атом водню, C1-C6 алкіл, феніл, незаміщений або такий, що має як замісники одну чи більш ніж одну групу, вибрану з атома галогену, C 1-C6 алкілу, CN, OH, CF3, OCF3, SMe; нафтил або гетероцикл, незаміщені або такі, що мають як замісники одну чи більш ніж одну групу, вибрану з атома галогену, C1-C6 алкілу, CN, OH, CF3, OCF3, SMe; циклоалкіл, незаміщений або такий, що має як замісники CONH2, SO2Me, SO2NH2; R7 і R8 разом з атомом азоту, до якого вони приєднані, можуть утворювати 6-членне кільце, 2 UA 105040 C2 5 10 15 20 25 30 35 40 45 50 55 60 яке може містити один або більш ніж один гетероатом, вибраний з N, S або O, і може бути незаміщеним або мати як замісники одну чи більш ніж одну групу, вибрану з C 1-C6 алкілу, C1-C6 алкіларилу або арилу; R9 позначає COOMe, COOEt; R10 позначає атом галогену, COOH, COOR7; R11 позначає атом водню, C1-C6 алкіл, C1-C6 алкіл, циклоалкіл, циклоалкіл, арил, C1-C6 алкіларил; а також стереоізомери, солі та сольвати зазначених сполук, прийнятні для терапевтичного використання. У вищезгаданих визначеннях можливі усі комбінації замісників або змінних за умови, що вони дають стабільні сполуки; терміни, використані у визначеннях, мають такі значення. Термін "галоген" стосується атомів фтору, хлору, брому або йоду. Термін "алкіл" стосується насиченого або ненасиченого нормального або розгалуженого аліфатичного вуглеводневого ланцюга, що містить зазначену кількість атомів вуглецю. Термін "циклоалкіл" стосується циклічного або поліциклічного вуглеводневого ланцюга, що містить 3-12 атомів вуглецю. Як приклад можна навести адамантил, циклогексил. Термін "арил" стосується будь-якого моноциклічного або бициклічного вуглецевого кільця, яке може містити до 7 кільцевих атомів, де щонайменше одне з кілець є ароматичним кільцем. Як приклад можна навести феніл, біфеніл, нафтил. Термін "гетероарил" стосується стабільного моноциклу, що містить 5-7 атомів, або стабільного біциклу, що містить 8-11 атомів, які є ненасиченими та складаються з атомів вуглецю та 1-4 гетероатомів, вибраних з N, O або S. Як приклад можна навести фуран, тіофен, піридин, бензотіофен. Термін "гетероцикл" стосується стабільного моноциклу, що містить 5-7 атомів, або стабільного бициклу, що містить 8-11 атомів, які можуть бути насиченими або ненасиченими та складатися з атомів вуглецю та 1-4 гетероатомів, вибраних з N, O або S. Визначення біциклу також включає моноциклічні гетероцикли, конденсовані з бензольним кільцем, за винятком індолу, коли у Формулі I радикали R1, R4 і R'4 позначають атоми водню. Як приклад можна навести фуран, пірол, тіофен, тіазол, ізотіазол, оксадіазол, імідазол, оксазол, ізоксазол, піридин, піримідин, хіназолін, хінолін, хіноксалін, бензофуран, бензотіофен, індолін, індолізин, бензотіазол, бензотієніл, бензопіран, бензоксазол, бензо[1,3]діоксол, бензоізоксазол, бензимідазол, хроман, хромен, дигідробензофуран, дигідробензотієніл, дигідроізоксазол, ізохінолін, дигідробензо[1,4]діоксин, імідазо[1,2-a]піридин, фуро[2,3-c]піридин, 2,3-дигідро-1Hінден, [1,3]діоксоло[4,5-c]піридин, піроло[1,2-c]піримідин, піроло[1,2-a]піримідин, тетрагідронафталін, бензо[b][1,4]оксазин. OR1 у контексті даного винаходу означає складний або простий ефір, де R 1 позначає C1-C6 алкіл, або COR5, або CO(CH2)mR6, або CO(CH2)mOR6, або (CH2)mR6, або (CH2)mCONR7R8, або (CH2)nNR7R8, або (CH2)nOR6, або CHR7OR9, або (CH2)mR10, такі як визначено вище. Солі сполук за даним винаходом, прийнятні для терапевтичного використання, включають стандартні нетоксичні солі сполук за винаходом, наприклад, солі, утворені з органічними чи неорганічними кислотами або з органічними чи неорганічними основами. Як приклад можна навести солі, утворені з неорганічними кислотами, такими як соляна, бромистоводнева, фосфорна, сірчана кислота, і солі, утворені з органічними кислотами, такими як оцтова, трифтороцтова, пропіонова, бурштинова, фумарова, яблучна, винна, лимонна, аскорбінова, малеїнова, глутамінова, бензойна, саліцилова, толуолсульфонова, метансульфонова, стеаринова, молочна кислота. Як приклад можна навести солі, утворені з неорганічними основами, такими як карбонат натрію, поташ або гідроксид кальцію, і солі, утворені з органічними основами, такими як лізин або аргінін. Дані солі можуть бути синтезовані зі сполук за винаходом, що містять основну або кислотну групу, та відповідних кислот або основ, згідно зі стандартними хімічними методиками. Сольвати сполук за даним винаходом, прийнятні для терапевтичного використання, включають стандартні сольвати, наприклад, сольвати, утворені на останній стадії одержання сполук за винаходом внаслідок присутності розчинників. Як приклад можна навести сольвати, утворені внаслідок присутності води або етанолу. До обсягу даного винаходу також включені всі стереоізомери, включаючи усі оптичні ізомери сполук загальної Формули (I), а також їх рацемічні суміші. Відповідно до однієї з ознак винаходу, сполуки загальної Формули (I) є сполуками, у яких R2 позначає феніл, що має як замісники одну чи більш ніж одну групу, вибрану з атома галогену, C1-C6 алкілу, CN, OH, CF3, OCF3, SMe; нафтил, 1,2,3,4-тетрагідронафталін, біфеніл або гетероцикл, відмінний від індолу, у випадку, коли R 1, R4 і R'4 позначають атоми водню, 3 UA 105040 C2 5 10 15 20 25 30 35 40 45 50 незаміщені або такі, що мають як замісники одну чи більш ніж одну групу, вибрану з атома галогену або C1-C6 алкілу, CN, OH, CF3, OCF3, OMe, SMe; циклоалкіл, незаміщений або такий, що має як замісники CONH2, SO2Me, SO2NH2, за умови, що група R2 завжди зв'язана з карбонілом через атом вуглецю; R4 і R'4 є однаковими або різними і позначають атом водню; атом галогену; C 1-C6 алкіл; CN; CF3; OCF3; SMe; OMe; NR7R8; R8 позначає атом водню, C1-C6 алкіл, феніл, незаміщений або такий, що має як замісники одну чи більш ніж одну групу, вибрану з атома галогену, C 1-C6 алкілу, CN, OH, CF3, OCF3, SMe; нафтил або гетероцикл, незаміщені або такі, що мають як замісники одну чи більш ніж одну групу, вибрану з атома галогену, C1-C6 алкілу, CN, OH, CF3, OCF3, SMe; циклоалкіл, незаміщений або такий, що має як замісники CONH2, SO2Me, SO2NH2; R7 і R8 разом з атомом азоту, до якого вони приєднані, можуть утворювати 6-членне кільце, яке може містити один або більш ніж один гетероатом, вибраний з N, S або O, і може бути незаміщеним або мати як замісники одну чи більш ніж одну групу, вибрану з C 1-C6 алкілу або арилу, R1 є таким, як визначено вище, або таким, як визначено в даному описі нижче. Згідно з одним з варіантів втілення винаходу сполуки загальної Формули (I) є сполуками, у яких R1 позначає атом водню. Згідно з іншим варіантом втілення винаходу сполуки загальної Формули (I) є сполуками, у яких OR1 є складним або простим ефіром, де R1 позначає C1-C6 алкіл, або COR5, або CO(CH2)mR6, або CO(CH2)mOR6, або (CH2)mR6, або (CH2)mCONR7R8, або (CH2)nNR7R8, або (CH2)nOR6, або CHR7OR9, або (CH2)mR10. Згідно з одним з варіантів втілення винаходу OR 1 є складним ефіром, де R 1 позначає COR5, або CO(CH2)mR6, або CO(CH2)mOR6. Метою даного винаходу також є сполуки загальної Формули (I), у яких R 2 позначає нафтил, або 1,2,3,4-тетрагідронафталін, або біфеніл, або фенілпіридин, незаміщені або такі, що мають як замісники одну чи більш ніж одну групу, вибрану з атома галогену, C1-C6 алкілу, CN, OH, CF3, OCF3, OMe, SMe; або феніл, що має як замісники один або більш ніж один атом галогену, CN, CF3 або C1-C6 алкіл. Згідно з одним з варіантів втілення винаходу сполуки загальної Формули (I) є сполуками, у яких R4 і R'4 позначають атоми водню. Поміж сполук загальної Формули (I) за даним винаходом кращим класом сполук є сполуки загальної Формули (I), де R1 позначає атом водню і R2 позначає нафтил або 1,2,3,4тетрагідронафталін. Даний винахід також стосується сполук загальної Формули (I), де OR1 є складним або простим ефіром і R2 позначає нафтил або 1,2,3,4-тетрагідронафталін. Інший кращий клас сполук складають сполуки загальної Формули (I), де R 1 позначає атом водню і R2 позначає феніл, що має як замісники один або більш ніж один атом галогену, CN, CF3 або C1-C6 алкіл. Інший кращий клас сполук складають сполуки загальної Формули (I), де R 1 позначає атом водню і R2 позначає біфеніл або фенілпіридин, незаміщені або такі, що мають замісники, як визначено в описі загальної Формули (I). Даний винахід також стосується сполук загальної Формули (I), де OR 1 є складним або простим ефіром і R2 позначає феніл, що має як замісники один або більш ніж один атом галогену, CN, CF3 або C1-C6 алкіл. Інший кращий клас сполук складають сполуки загальної Формули (I), де OR1 є складним або простим ефіром і R2 позначає біфеніл або фенілпіридин, незаміщені або такі, що мають замісники, як визначено в описі загальної Формули (I). Даний винахід також стосується одержання сполук загальної Формули (I) з використанням загальних методик, описаних далі на схемах синтезу та при необхідності доповнених іншими стандартними процедурами, описаними в літературі або добре відомими фахівцям в даній області техніки, або додатково проілюстрованих в експериментальній частині. 4 UA 105040 C2 Схема 1 5 10 15 20 На Схемі 1 наведена перша загальна методика, яка може бути використана для одержання сполук загальної Формули (Ia). На загальних формулах, наведених вище, R 2, R3, R4 і R'4, є такими, як визначено в попередньому описі загальної Формули (I), і R1 позначає атом водню. X може позначати відхідну групу, таку як, наприклад, Cl, Br, I, OSO 2CH3, OSO2CF3 або O-тозил. У цьому випадку реакцію за участю сполуки загальної Формули (II) проводять у присутності неорганічної основи, такої як, наприклад, NaH, у полярному безводному розчиннику, такому як ТГФ (тетрагідрофуран) або ДМФА (N,N-диметилформамід), при температурі в діапазоні від -20 до 100 °C. Проміжну сполуку загальної Формули (III) перетворюють на проміжну сполуку загальної Формули (IV) шляхом перегрупування в присутності основи, такої як, наприклад, MeONa, EtONa, у полярному безводному розчиннику, такому як MeOH або EtOH (можливо змішаному з неполярним розчинником, таким як толуол), при температурі в діапазоні від 25 до 100 °C. Проміжну сполуку загальної Формули (IV) перетворюють на продукт загальної Формули (Ia) в результаті взаємодії з R3Y, де Y може позначати відхідну групу, таку як, наприклад, Cl, Br, I, OSO2CH3, OSO2CF3 або O-тозил, і R3 є таким, як визначено вище. У цьому випадку перетворення сполуки загальної Формули (IV) проводять у присутності неорганічної основи, такої як, наприклад, NaH, у полярному безводному розчиннику, такому як ТГФ або ДМФА, при температурі в діапазоні від -20 до 100 °C. На Схемі 2 наведена загальна методика, яка може бути використана для одержання сполук загальної Формули (Ib). На загальних формулах, наведених нижче, R 1, R2, R3, R4 і R'4 є такими, як визначено в попередньому описі загальної Формули (I), за тим винятком, що R 1 не є атомом водню. Схема 2 25 30 35 Проміжну сполуку загальної Формули (Ia) перетворюють на сполуку загальної Формули (Ib) в результаті взаємодії з R1-Z. Коли R1 позначає C1-C6 алкіл, (CH2)mR6, (CH2)mCONR7R8, (CH2)nNR7R8, (CH2)nOR6, CHR7OR9 або (CH2)mR10, де R6, R7, R8, R9, R10, m і n є такими, як визначено в попередньому описі загальної Формули (I), за тим винятком, що R 10 не є кислотою, і Z позначає відхідну групу, таку як, наприклад, Cl, Br, I, OSO 2CH3, OSO2CF3 або O-тозил, перетворення енолу загальної Формули (Ia) може бути проведене в присутності органічної або неорганічної основи, такої як, наприклад, Et3N, iPr2NEt, NaH, піридин, Cs2CO3, K2CO3, у полярному безводному розчиннику, такому як ТГФ, ДМФА, ДМСО (диметилсульфоксид), ацетон, при температурі в діапазоні від -20 до 140 °C з використанням як каталізатора солі, яка може бути вибрана з KI, Bu4NI, LiI, AgBF4, AgClO4, Ag2CO3, KF, Bu4NF або CsF, або без використання такої солі. Дану реакцію також можна проводити в пробірці, запаяній або закритій гвинтовою кришкою, при температурі в діапазоні від 80 до 180 °C, використовуючи для нагрівання теплову або мікрохвильову енергію. Z також може бути спиртом. У цьому випадку 5 UA 105040 C2 5 10 15 20 25 перетворення проміжної сполуки (Ia) може бути здійснене з використанням реакції типу реакції Міцунобу, яка може бути проведена в присутності діетилазодикарбоксилату (DEAD) і трифенілфосфіну в полярному безводному розчиннику, такому як ТГФ, при температурі в діапазоні від 0 до 60 °C. Коли R1 позначає COR5, SO2R5 або CO(CH2)mR6, де R5, R6 і m є такими, як визначено в попередньому описі загальної Формули (I), Z може бути атомом хлору. У цьому випадку перетворення енолу загальної Формули (Ia) буде зводитися до взаємодії хлорангідриду та сульфонілхлориду зі спиртом. Дана взаємодія може бути здійснена в присутності органічної або неорганічної основи, такої як, наприклад, Et3N, iPr2NEt, NaH, піридин, Cs2CO3, K2CO3, у полярному безводному розчиннику, такому як ТГФ, ДМФА, ДМСО, дихлорметан, при температурі в діапазоні від -20 до 140 °C. Коли R1 позначає COR5, CO(CH2)mR6 або CO(CH2)mOR6, де R5, R6 і m є такими, як визначено в попередньому описі загальної Формули (I), Z також може бути гідроксилом. У цьому випадку перетворення енолу загальної Формули (Ia) буде зводитися до взаємодії кислоти зі спиртом. Дана взаємодія може бути здійснена з використанням методик і заходів, добре відомих фахівцю в даній області техніки. Особливо кращою є методика, яка передбачає проведення даної реакції конденсації в присутності 1-(3диметиламінопропіл)-3-етилкарбодііміду (EDC), 3-гідрокси-1,2,3-бензотриазин-4(3H)-ону, третинного аміну, такого як діізопропілетиламін, у полярному апротонному розчиннику, такому як дихлорметан, при температурі в діапазоні від -15 до 40 °C. На Схемі 3 наведена загальна методика, яка може бути використана для одержання сполук загальної Формули (Ic), де R1 позначає (CH2)nNR7R8 або (CH2)nOR6 і R6, R7, R8, n та R2, R3, R4 і R'4 є такими, як визначено в попередньому описі загальної Формули (I). Проміжну сполуку загальної Формули (Ia) перетворюють на проміжну сполуку загальної Формули (V) в результаті взаємодії з реагентом загальної Формули X(CH 2)nX', де X і X' є однаковими або різними відхідними групами, такими як, наприклад, Cl, Br, I, OSO 2CH3, OSO2CF3 або O-тозил, і n має таке значення, як визначено вище. Схема 3 30 35 40 45 50 Взаємодія даного реагенту та енолу загальної Формули (Ia), що приводить до одержання проміжної сполуки загальної Формули (V), може бути здійснена в присутності органічної або неорганічної основи, такої як, наприклад, Et3N, iPr2NEt, NaH, піридин, Cs2CO3, K2CO3, у полярному безводному розчиннику, такому як ТГФ, ДМФА, ДМСО, ацетон, при температурі в діапазоні від -20 до 140 °C з використанням як каталізатора солі, яка може бути вибрана з KI, Bu4NI, LiI, AgBF4, AgClO4, Ag2CO3, KF, Bu4NF або CsF, або без використання такої солі. Дана взаємодія також може бути здійснена без розчинника з використанням великого надлишку реагенту X(CH2)nX'. Дану реакцію також можна проводити в пробірці, запаяній або закритій гвинтовою кришкою, при температурі в діапазоні від 80 до 180 °C, використовуючи для нагрівання теплову або мікрохвильову енергію. X або X' також можуть бути спиртом. У цьому випадку для одержання проміжної сполуки (V) може бути використана реакція типу реакції Міцунобу, яка може бути проведена в присутності діетилазодикарбоксилату (DEAD) і трифенілфосфіну в полярному безводному розчиннику, такому як ТГФ, при температурі в діапазоні від 0 до 60 °C. Проміжну сполуку загальної Формули (V) перетворюють на продукт загальної Формули (Ic) в результаті взаємодії з HNR7R8 або HOR6, де R6, R7 і R8 є такими, як визначено в попередньому описі загальної Формули (I). Дане перетворення може бути проведене в присутності органічної або неорганічної основи, такої як, наприклад, Et3N, iPr2NEt, NaH, піридин, Cs2CO3, K2CO3, у полярному безводному розчиннику, такому як ТГФ, ДМФА, ДМСО, ацетон, при температурі в діапазоні від -20 до 140 °C з використанням як каталізатора солі (solvent), яка може бути вибрана з KI, Bu4NI, LiI, AgBF4, AgClO4, Ag2CO3, KF, Bu4NF або CsF, або без її використання. Вибір експериментальних умов та реагентів, необхідних для проведення даної реакції, звичайно, залежить від природи замісників R 6, R7 і R8 і здійснюється відповідно до методик і заходів, добре відомих фахівцю в даній області техніки. 6 UA 105040 C2 На Схемі 4 наведена загальна методика, яка може бути використана для одержання сполук загальної Формули (Id), де R1 позначає (CH2)mCONR7R8, і R7, R8, m і R2, R3, R4 та R'4 є такими, як визначено в попередньому описі загальної Формули (I). Схема 4 5 10 15 20 25 30 35 40 Проміжну сполуку загальної Формули (Ia) перетворюють на проміжну сполуку загальної Формули (VI) в результаті взаємодії з реагентом загальної Формули Y(CH 2)mCOOY', де Y позначає відхідну групу, таку як, наприклад, Cl, Br, I, OSO 2CH3, OSO2CF3 або O-тозил, m має таке значення, як визначено вище, і Y' позначає C1-C4 алкільний радикал. Дане перетворення може бути здійснене в присутності органічної або неорганічної основи, такої як, наприклад, Et 3N, iPr2NEt, NaH, піридин, Cs2CO3, K2CO3, у полярному безводному розчиннику, такому як ТГФ, ДМФА, ДМСО, ацетон, при температурі в діапазоні від -20 до 140 °C, з використанням як каталізатора солі, яка може бути вибрана з KI, Bu4NI, LiI, AgBF4, AgClO4, Ag2CO3, KF, Bu4NF або CsF, або без використання такої солі. Дану реакцію також можна проводити в пробірці, запаяній або закритій гвинтовою кришкою, при температурі в діапазоні від 80 до 180 °C, використовуючи для нагрівання теплову або мікрохвильову енергію. Проміжну сполуку загальної Формули (VI) перетворюють на проміжну сполуку загальної Формули (VII) в результаті взаємодії з неорганічною основою, такою як, наприклад, NaOH, KOH, LiOH, у полярному розчиннику, такому як метанол, етанол, ТГФ і вода, при температурі в діапазоні від 20 до 80 °C. Отримана карбонова кислота (VII) може бути піддана взаємодії з аміном з одержанням сполук загальної Формули (Id). Дана взаємодія може бути здійснена з використанням методик і заходів, добре відомих фахівцю в даній області техніки. Особливо кращою є методика, згідно з якою реакцію конденсації двох зазначених сполук проводять у присутності 1-(3-диметиламінопропіл)-3-етилкарбодііміду (EDC), гідрокси-1,2,3-бензотриазин-4(3H)-ону, третинного аміну, такого як діізопропілетиламін, у полярному апротонному розчиннику, такому як дихлорметан або ДМФА, при температурі в діапазоні від -15 °C до 50 °C, або, наприклад, з використанням бензотриазол1-ілокси-трис(диметиламіно)фосфонію гексафторфосфату (BOP) у присутності 1гідроксибензотриазолу, третинного аміну, такого як діізопропілетиламін, у полярному розчиннику, такому як ДМФА, CH2Cl2 або ДМСО, при температурі в діапазоні від 10 до 50 °C. Іншою особливо кращою методикою є перетворення карбонової кислоти на хлорангідрид в результаті взаємодії з оксалілхлоридом або тіонілхлоридом у присутності основи, такої як піридин або триетиламін, або без використання основи, у розчиннику, такому як толуол або дихлорметан, або без використання розчинника, при температурі в діапазоні від 20 до 100 °C. Потім отриманий хлорангідрид може бути підданий взаємодії з аміном HNR 7R8 у присутності основи, такої як піридин або триетиламін, у такому розчиннику, як дихлорметан, при температурі в діапазоні від 0 до 100 °C. На Схемі 5 наведена загальна методика, яка може бути використана для перетворення сполук загальної Формули (Ie), де R4 є атомом фтору і R2, R3 та R'4 є такими, як визначено в попередньому описі загальної Формули (I), на сполуки загальної Формули (If), де R 4 позначає NR7R8 і R7, R8 та R2, R3 і R'4 є такими, як визначено в попередньому описі загальної Формули (I). 7 UA 105040 C2 Схема 5 5 10 Сполуки загальної Формули (Ie) можуть бути перетворені на сполуки загальної Формули (If) в результаті взаємодії з аміном загальної Формули HNR7R8 у присутності органічної або неорганічної основи, такої як, наприклад, Et3N, iPr2NEt, NaH, Cs2CO3, K2CO3, у полярному безводному розчиннику, такому як ДМФА, ДМСО, при температурі в діапазоні від 20 до 140 °C. На Схемі 6 наведена загальна методика, яка може бути використана для перетворення сполук загальної Формули (Ig), де R3, R4 і R'4 є такими, як визначено в попередньому описі загальної Формули (I), і де R2 позначає феніл, що має як замісник групу X, яка є атомом брому, атомом хлору або OTf, на сполуки загальної Формули (Ih), де R 2 позначає біфеніл або фенілпіридин, заміщені або незаміщені, і де R 3, R4 та R'4 є такими, як визначено в попередньому описі загальної Формули (I). Схема 6 15 20 25 Сполуки загальної Формули (Ig) можуть бути перетворені на сполуки загальної Формули (Ih) в результаті взаємодії з бороновою кислотою з використанням реакції типу реакції Сузуки, у присутності органічної або неорганічної основи, такої як, наприклад, Et3N, NMP, iPr2NEt, NaH, Cs2CO3 K2CO3, K3PO4, у присутності каталізатора, такого як, наприклад, ацетат паладію, тетракістрифенілфосфін паладію, трис(дибензилиденацетон)дипаладій, у полярному розчиннику, такому як, наприклад, ацетон, метилетилкетон, етанол, ДМЕ (диметоксіетан), вода, діоксан, і можливо в присутності фосфіну, такого як трифенілфосфін або трициклогексилфосфін, при температурі в діапазоні від 20 до 140 °C. На Схемі 7 наведена загальна методика, яка може бути використана для перетворення сполук загальної Формули (Ii), де R 3, R4 і R'4 є такими, як визначено в попередньому описі загальної Формули (I), і де R2 позначає феніл, що має як замісник групу CN в орто- або метаположенні, на сполуки загальної Формули (Ij), де R2 позначає феніл, що має як замісник карбонову кислоту в орто- або мета-положенні, і потім на сполуки загальної Формули (Ik), де R 2 позначає феніл, що має як замісник амід Формули CONR7R11, і де R3, R4, R7, R11 та R'4 є такими, як визначено в попередньому описі загальної Формули (I). Схема 7 30 Сполуки загальної Формули (Ii) можуть бути перетворені на сполуки загальної Формули (Ij) шляхом обробки неорганічною основою, такою як, наприклад, NaOH, KOH, LiOH, у полярному розчиннику, такому як етанол, метанол, ТГФ, вода, при температурі в діапазоні від 20 до 140 °C, 8 UA 105040 C2 5 10 15 20 25 30 35 40 45 50 і наступного окиснення шляхом обробки кислотою, такою як HCl, H 2SO4, HCOOH. Сполуки загальної Формули (Ij) можуть бути перетворені на сполуки загальної Формули (Ik) в результаті взаємодії з аміном Формули HNR7R11. Дана взаємодія може бути здійснена з використанням методик і заходів, добре відомих фахівцю в даній області техніки. Особливо кращою є методика, згідно з якою реакцію конденсації двох зазначених сполук проводять у присутності 1(3-диметиламінопропіл)-3-етил-карбодііміду (EDC), гідрокси-1,2,3-бензотриазин-4(3H)-ону, третинного аміну, такого як діізопропілетиламін, у полярному апротонному розчиннику, такому як дихлорметан або ДМФА, при температурі в діапазоні від -15 °C до 50 °C, або, наприклад, з використанням бензотриазол-1-ілокси-трис(диметиламіно)фосфонію гексафторфосфату (BOP) у присутності 1-гідроксибензотриазолу, третинного аміну, такого як діізопропілетиламін, у полярному розчиннику, такому як ДМФА, CH2Cl2 або ДМСО, при температурі в діапазоні від 10 до 50 °C. Іншою особливо кращою методикою є перетворення карбонової кислоти на хлорангідрид в результаті взаємодії з оксалілхлоридом або тіонілхлоридом у присутності основи, такої як піридин або триетиламін, або без використання основи, у розчиннику, такому як толуол або дихлорметан, або без використання розчинника, при температурі в діапазоні від 20 до 100 °C. Потім отриманий хлорангідрид може бути підданий взаємодії з аміном HNR 7R11 у присутності основи, такої як піридин або триетиламін, у такому розчиннику, як дихлорметан, при температурі в діапазоні від 0 до 100 °C. Коли бажано виділити сполуку загальної Формули (I), що містить щонайменше одну кислотну або основну функціональну групу, у вигляді солі шляхом додавання основи або кислоти, бажана сіль може бути отримана шляхом обробки вільної основи або кислоти загальної Формули (I) (яка містить щонайменше одну кислотну або основну функціональну групу) придатною основою або кислотою, краще, еквівалентною кількістю основи або кислоти. Наведені далі приклади ілюструють даний винахід, не обмежуючи його обсягу. Примітка: чистоту всіх сполук (якщо не зазначено окремо) визначали шляхом ВЕРХ з використанням таких умов: колонка: Waters Xterra MS C18, 4,6×50 мм, 5 мкм; l = 220 нм; градієнт 100% H2O (+ 0,05% ТФОК (трифтороцтова кислота)) - 100% CH3CN (+ 0,05% ТФОК) протягом 6 хв. і потім 100% CH3CN (+ 0,05% ТФОК) протягом 1 хв.; помпа: Waters 600E; швидкість потоку: 3 мл/хв. Приклад 1 (4-Гідрокси-2-метил-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)-(нафталін-2іл)метанон Приклад 1A - 2-(2-(Нафталін-2-іл)-2-оксоетил)бензо[d]ізотіазол-3(2H)-он-1,1-діоксид У тригорлу колбу, обладнану термометром і холодильником, вносили сахарин (25 г, 136 ммоль) і ДМФА (350 мл). Дану суміш промивали інертним газом шляхом послідовного вакуумування та заповнення азотом (3×). Повільно додавали гідрид натрію (6 г, 150 ммоль) і потім 2-бром-1-(нафталін-2-іл)етанон (37,4 г, 150 ммоль). Дану реакційну суміш нагрівали до 65 °C протягом 4 год. і потім охолоджували до кімнатної температури. Осад, що утворювався, відокремлювали фільтруванням, промивали водою та сушили до постійної маси з одержанням 37 г продукту 1A у вигляді блідо-бежевого (pale being) твердої речовини (ВЕРХ: RT (час утримання) = 4,97 хв., 100%). Другу порцію продукту одержували шляхом додавання у фільтрат води. Осад, що утворювався, відокремлювали фільтруванням, промивали водою і потім мінімальною кількістю етилового спирту (ethyl) та сушили з одержанням 10 г продукту (ВЕРХ: RT = 4,97 хв., 93%). Загальний вихід реакції становив 96%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 5.62 (s, 2H); 7.68 (t, 1H); 7.73 (t, 1H); 8.00-8.25 (m, 7H); 8.39 (d, 1H); 8.92 (s, 1H). + + + Мас-спектр (ESI ): m/z 352 (MH , 100%); 369 (MNH4 , 24%). Приклад 1B - (4-Гідрокси-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)(нафталін-2-іл)метанон У двогорлу колбу, обладнану холодильником, в атмосфері інертного газу вводили етанол (165 мл), і потім повільно додавали натрій, нарізаний тонкими шарами та промитий гептаном (8 г, 347 ммоль). Після додавання натрію реакційну суміш нагрівали до 70 °C доти, поки реакція за участю натрію не була завершена. Потім реакційну суміш охолоджували до кімнатної температури, і швидко додавали сполуку 1A (47 г, 131 ммоль). Суміш офарблювалася спочатку в інтенсивний багряно-червоний колір, потім у червоний колір, і випадав рясний осад. Реакційну 9 UA 105040 C2 5 10 15 20 25 30 35 40 45 суміш швидко нагрівали до 60 °C, при даній температурі суміш загусає. Потім суміш охолоджували до кімнатної температури та розбавляли етилацетатом (500 мл). Потім додавали 1 н. водний розчин HCl доти, поки не одержували суспензію канаркового кольору. Осад відокремлювали фільтруванням, промивали водою та мінімальною кількістю суміші вода/EtOH (50/50). Потім осад сушили під вакуумом до постійної маси з одержанням продукту 1B у вигляді твердої речовини канаркового кольору (40,9 г, 88%). ВЕРХ: RT = 5,15 хв., 100%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 7.66 (t, 1H); 7.72 (t, 1H); 7.95 (розширений s, 3H); 8.05 (d, 2H); 8.11 (розширений s, 2H); 8.22 (розширений s, 1H); 8.64 (s, 1H); 9.99 (s, 1H); 15.59 (s, 1H). + + + Мас-спектр (ESI ): m/z 352 (MH , 100%); 369 (MNH4 , 31%). Приклад 1 (1,1-Діоксо-4-гідрокси-2-метил-2H-бензо[e][1,2]тіазин-3-іл)(нафталін-2іл)метанон Сполуку 1B (40,9 г, 116 ммоль) розчиняли в ДМФА (409 мл) у двогорлій колбі в атмосфері інертного газу. Додавали NaH (6,05 г, 151 ммоль). В ході реакції виділялася невелика кількість тепла, і реакційна суміш набувала інтенсивного червоного забарвлення. Додавали йодметан (10,8 мл, 174 ммоль), і дану реакційну суміш перемішували протягом 2 год. при кімнатній температурі. Додавали воду (10 мл), і реакційну суміш концентрували. Залишок переносили в етилацетат, і осад відокремлювали фільтруванням, промивали водою та мінімальною кількістю етилацетату (перша порція твердої речовини). Отриманий фільтрат двічі промивали напівнасиченим водним розчином NaCl, потім концентрували до половини об'єму та фільтрували. Осад (друга порція твердої речовини) промивали мінімальною кількістю суміші EtOAc/Et2O (50/50). Отриманий фільтрат концентрували. Залишок фільтрували на силікагелі (элюент: гептан/CH2Cl2 (50/50) і потім гептан/CH2Cl2 (25/75)) з одержанням після випарювання розчинників жовтого порошку (третя порція твердої речовини). Усі 3 порції твердої речовини об’єднували з одержанням продукту 1 у вигляді твердої речовини канаркового кольору (40,1 г, 89%). ВЕРХ: RT = 5,65 хв., 99%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 2.65 (s, 3H); 7.66 (t, 1H); 7.72 (t, 1H); 8.00 (розширений s, 3H); 8.02 (d, 1H); 8.12 (розширений s, 3H); 8.22 (розширений s, 1H); 8.67 (s, 1H). + + Мас-спектр (ESI ): m/z 366 (MH , 100%). Одержання натрієвої солі 4-гідрокси-2-метил-1,1-діоксо-2H-бензо[e][1,2]-тіазин-3іл)(нафталін-2-іл)метанону Фракцію, що містить сполуки 1, розчиняли в метанолі та обробляли при кімнатній температурі 1 н. водним розчином карбонату натрію (1,05 екв.). Дану реакційну суміш концентрували і тверду речовину, що утворювалася в залишку, промивали сумішшю дихлорметану та діетилового ефіру. Отриману в результаті тверду речовину канаркового кольору сушили під вакуумом протягом декількох діб. ВЕРХ: RT = 11,73 хв., 99,71% (колонка: Xbridge C8, 5 мкМ, 4,6×250 мм (Waters); елюент: CH3CN/H2O/KH2PO4 (600/400/6,8 г), pH 4, 25 °C; 1 мл/хв.; 220 нм). 1 H ЯМР, ДМСО-d6, δ (м.ч.): 2.61 (s, 3H); 7.50 (розширений s, 2H); 7.62 (розширений s, 2H); 7.65-7.72 (m, 2H); 7.80 (d, 1H); 7.89 (розширений s, 2H); 7.93-7.98 (m, 2H). + + Мас-спектр (ESI ): m/z 366 (MH , 100%). Приклади 2-12 Сполуки 2-12 синтезували відповідно до методики одержання похідного 1, з використанням на першій стадії сахарину та різних бром-1-(алкіл чи арил)етанонів і на третій стадії йодистого метилу або йодистого етилу. Протокол перегрупування, використовуваний на другій стадії, не змінювали. 10 UA 105040 C2 Приклад** 2 3 4 5 6 7 R ВЕРХ Маса + MH 30% 374 5,33' 99% 49% 330 5,43' 99% 38% 350 4,97' 99% 82% 339* 5,86' 98% 57% 392 5,52' 98% (4-гідрокси-2-метил-2H-1,1діоксобензо[e][1,2]тіазин-3іл)(адамантан-1-іл)метанон (4-гідрокси-2-метил-2H-1,14-метилфеніл діоксобензо[e][1,2]тіазин-3-іл)(4-метилфеніл)метанон (4-гідрокси-2-метил-2H-1,14-хлорфеніл діоксобензо[e][1,2]тіазин-3-іл)(4-хлорфеніл)метанон (4-гідрокси-2-метил-2H-1,14-ціанофеніл діоксобензо[e][1,2]тіазин-3-іл)(4-ціанофеніл)метанон біфеніл-4-іл-(4-гідрокси-2біфеніл-4-іл метил-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)метанон (4-гідрокси-2-метил-1,1-діоксо2,4-дихлорфеніл 2H-бензо[e][1,2]тіазин-3-іл)(2,4дихлорфеніл)метанон адамантан-1-іл Вихід (3 стадії) 6,11' 98,9% Назва сполук 14% 384 * ESI (електророзпилювання) у режимі негативних іонів (M-H) 1 5 ** H ЯМР, ДМСО-d6, Приклад 2: 1.72 (розширений s, 6H); 2.05 (розширений s, 3H); 2.10 (розширений s, 6H); 2.83 (s, 3H); 7.91 (розширений s, 3H); 8.10 (t, 1H); 16.1 (s, 1H). Приклад 5: 2.63 (s, 3H); 7.99 (s, 3H); 8.11 (s, 4H); 8.19 (розширений s, 1H); 14.5-15.5 (m, 1H, обмінний). Приклад 6: 2.70 (s, 3H); 7.46 (t, 1H); 7.54 (t, 2H); 7.82 (d, 2H); 7.95-8.00 (m, 5H); 8.18-8.23 (m, 3H); 15.65 (розширений s, 1H, обмінний). Приклад 7: 2.67 (s, 3H); 7.54-7.64 (m, 2H); 7.83 (s, 1H); 7.93 (розширений s, 3H); 8.11 (розширений s, 1H); 13.5-14.5 (розширений s, 1H). 10 Приклад* R 8 адамантан-1-іл 9 нафталін-2-іл 10 4-метилфеніл 11 4-хлорфеніл 12 біфеніл-4-іл Назва сполук (4-гідроксі-2-етил-1,1-діоксо2H-бензо[e][1,2]тіазин-3-іл)(адамантан-1-іл)метанон (4-гідроксі-2-етил-1,1-діоксо2H-бензо[e][1,2]тіазин-3-іл)(нафталін-2-іл)метанон (4-гідроксі-2-етил-1,1-діоксо2H-бензо[e][1,2]тіазин-3-іл)-(4метилфеніл)метанон (4-гідроксі-2-етил-1,1-діоксо2H-бензо[e][1,2]тіазин-3-іл)-(4хлорфеніл)метанон біфеніл-4-іл-(4-гідроксі-2-етил1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)метанон 11 ВЕРХ Вихід (3 стадії) Маса + (M+H) 6,24' 99% 32% 388 5,72' 99% 55% 380 5,49' 99% 40% 344 5,58' 99% 35% 364 6,06' 99% 61% 406 UA 105040 C2 1 5 10 15 20 25 30 35 40 45 50 * H ЯМР, ДМСО-d6, Приклад 8: 0.68 (t, 3H); 1.71 (розширений s, 6H); 2.05 (розширений s, 3H); 2.09 (розширений s, 6H); 3.44 (q, 2H); 7.89 (розширений s, 3H); 8.05 (розширений s, 1H); 15.00 (s, 1H, обмінний). Приклад 9: 0.51 (t, 3H); 3.13 (q, 2H); 7.66 (t, 1H); 7.72 (t, 1H); 7.99 (розширений s, 3H); 8.05 (d, 1H); 8.12 (розширений s, 3H); 8.22 (розширений s, 1H); 8.64 (s, 1H); 15.39 (s, 1H, обмінний). Приклад 11: 0.53 (t, 3H); 3.13 (q, 2H); 7.71 (d, 2H); 7.98 (розширений s, 3H); 8.03 (d, 1H); 8.19 (розширений s, 1H). Приклад 12: 0.56 (t, 3H); 3.18(q, 2H); 7.45 (t, 1H); 7.53 (t, 2H); 7.82 (d, 2H); 7.94-7.98 (m, 5H); 8.16 (d, 2H); 8.20-8.21 (m, 1H); 15.46 (s, 1H, обмінний) Приклад 13 - (5-Хлор-4-гідрокси-2-метил-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)(нафталін-2іл)метанон Приклад 13A - 2-Хлор-6-сульфамоїлбензойна кислота У тригорлу колбу, обладнану холодильником, вводили 2-метилбензолсульфонамід (13,27 г, 64,5 ммоль) у присутності 5% водного розчину карбонату натрію (385 мл). Повільно додавали перманганат калію (25,5 г, 161 ммоль), і потім реакційну суміш нагрівали до 100 °C протягом 4 год. Температуру реакційної суміші доводили до кімнатної температури, суміш фільтрували, підкисляли до pH 1 і 3 рази екстрагували етилацетатом. Органічні фази об’єднували, промивали один раз насиченим водним розчином NaCl і потім сушили сульфатом магнію, фільтрували та концентрували з одержанням продукту 13A у вигляді білої твердої речовини (12,87 г, 83%). ВЕРХ: RT = 1,55 хв., 98%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 7.48 (s, 2H, обмінний); 7.62 (t, 1H); 7.75 (d, 1H); 7.87 (d, 1H); 11-15 (ml, 1H, обмінний). \Мас-спектр (ESI ): m/z 234 (M-H , 55%). Приклад 13B - 4-Хлорсахарин У колбу вводили сполуку 13A (12,87 г, 54,6 ммоль) і потім 38,8 мл концентрованої сірчаної кислоти. Дану реакційну суміш перемішували протягом 1,5 год. при кімнатній температурі і потім вливали в суміш води з льодом. Осад, що утворювався, відокремлювали фільтруванням, промивали водою та сушили до постійної маси з одержанням сполуки 13B у вигляді білої твердої речовини (9,16 г, 77%). ВЕРХ: RT = 2,57 хв., 100%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 7.91 (розширений s, 2H); 8.08 (розширений s, 1H). Приклад 13C - 4-Хлор-2-(2-(нафталін-2-іл)-2-оксоетил)бензо[d]ізотіазол-3(2H)-он-1,1-діоксид Сполуку 13C синтезували зі сполуки 13B (2,2 г, 10 ммоль) відповідно до методики, використаної для одержання похідного 1A, сполуку 13C одержували у вигляді блідо-бежевої твердої речовини (3,3 г, 84%). ВЕРХ: RT = 5,11 хв., 99%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 5.62 (s, 2H); 7.69 (t, 1H), 7.74 (t, 1H); 7.95-8.20 (m, 6H); 8.38 (d, 1H); 8.92 (s, 1H). + + Мас-спектр (ESI ): m/z 386 (MH , 100%). Приклад 13D (5-Хлор-1,1-діоксо-4-гідрокси-2H-бензо[e][1,2]тіазин-3-іл)-(нафталін-2іл)метанон Сполуку 13D синтезували зі сполуки 13C (3,3 г, 8,5 ммоль) відповідно до методики, використаної для одержання похідного 1B, сполуку 13D одержували у вигляді золотисто-жовтої твердої речовини (1,7 г, 51%). ВЕРХ: RT = 5,3 хв., 99%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 7.68 (t, 1H), 7.72 (t, 1H); 7.85-8.15 (m, 8H); 8.59 (s, 1H); 10.11 (s, 1H). + + Мас-спектр (ESI ): m/z 386 (MH , 100%). Приклад 13 - Сполуку 13 синтезували зі сполуки 13D (3 г, 7,7 ммоль) відповідно до методики, використаної для одержання похідного 1. Сполуку 13 одержували у вигляді жовтої твердої речовини (2,3 г, 70%). ВЕРХ: RT = 5,75 хв., 95%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 2.69 (s, 3H); 7.66 (t, 1H); 7.72 (t, 1H); 7.9-8.2 (m, 7H); 8.60 (розширений s, 1H); 16.15 (розширений s, 1H, обмінний). 12 UA 105040 C2 + + Мас-спектр (ESI ): m/z 400 (MH , 100%). Приклад 14 - (5-Хлор-4-гідроксі-2-етил-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)(нафталін-2іл)метанон 5 10 15 20 25 30 35 40 Сполуку 14 синтезували зі сполуки 13D (1 г, 2,6 ммоль) та йодетану відповідно до методики, використаної для одержання похідного 1, з виходом 805 мг (60%) бажаного продукту. ВЕРХ: RT = 5,77 хв., 81%. Фракцію, що містить даний продукт (200 мг), очищали на колонці зі сферичним силікагелем (12 г) (швидкість потоку: 12 мл/хв.; 100% гептан (2 хв.), градієнт 0-50% EtOAc/гептан (30 хв.), 50% EtOAc/гептан (5 хв.)), з одержанням 64 мг бажаного продукту у вигляді жовтої твердої речовини. ВЕРХ: RT = 5,77 хв., 97%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 0.51 (t, 3H); 3.11 (q, 2H); 7.66 (t, 1H); 7.72 (t, 1H); 7.85-8.2 (m, 7H); 8.60 (s, 1H); 15.9 (s, 1H, обмінний). + + Мас-спектр (ESI ): m/z 414 (MH , 100%). Приклад 15 - (6-Фтор-4-гідрокси-2-метил-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)(нафталін-2іл)метанон Приклад 15A (6-Фтор-4-гідрокси-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)-(нафталін-2іл)метанон Сполуку 15A синтезували з 2-метилбензолсульфонаміду, використовуючи послідовність стадій, описану в методиці одержання сполуки 13D. Бажаний продукт одержували у вигляді жовтої твердої речовини із загальним виходом 79%. ВЕРХ: RT = 5,26 хв., 96%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 7.66 (t, 1H); 7.72 (t, 1H); 7.80 (t, 1H); 7.94-8.11 (m, 6H); 8.64 (s, 1H); 10.18 (s, 1H, обмінний); 15.2 (розширений s, 1H, обмінний). Мас-спектр (ESI ): m/z 368 (M-H-, 100%). Приклад 15 - (6-Фтор-4-гідрокси-2-метил-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)(нафталін-2іл)метанон Сполуку 15 синтезували зі сполуки 15A (1,5 г, 4 ммоль) відповідно до методики, використаної для одержання похідного 1, з виходом бажаного продукту (1,47 г, 89%) у вигляді жовтої твердої речовини. ВЕРХ: RT = 5,6 хв., 93%. Фракцію, що містить даний продукт, перекристалізовували з етанолу з одержанням 186 мг сполуки 15 більш високої чистоти (ВЕРХ: RT = 5,6 хв., 99,4%). 1 H ЯМР, ДМСО-d6, δ (м.ч.): 2.68 (s, 3H); 7.66 (t, 1H); 7.72 (t, 1H); 7.84 (t, 1H); 7.97 (d, 1H); 8.02-8.15 (m, 5H); 8.66 (s, 1H); 15.22 (розширений s, 1H, обмінний). + + Мас-спектр (ESI ): m/z 384 (MH , 100%). Приклад 16 - (6-Фтор-4-гідроксі-2-етил-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)(нафталін-2іл)метанон 13 UA 105040 C2 5 10 15 20 25 30 35 40 45 Сполуку 16 синтезували зі сполуки 15A (1,5 г, 4 ммоль) та йодетану відповідно до методики, використаної для одержання похідного 1, з виходом бажаного продукту (520 мг, 29%) у вигляді жовтої твердої речовини. ВЕРХ: RT = 5,8 хв., 91%. Фракцію, що містить даний продукт, перекристалізовували з етанолу з одержанням 71 мг сполуки 16 більш високої чистоти. ВЕРХ: RT = 5,8 хв., 97%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 0.56 (t, 3H); 3.15 (q, 2H); 7.66 (t, 1H); 7.72 (t, 1H); 7.82 (t, 1H); 7.97 (d, 1H); 8.00-8.2 (m, 5H); 8.63 (s, 1H); 14.95 (розширений s, 1H). + + Мас-спектр (ESI ): m/z 398 (MH , 100%). Приклад 17 - (7-Фтор-4-гідрокси-2-метил-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)(нафталін-2іл)метанон Приклад 17A - 5-Фтор-2-метилбензолсульфонамід До концентрованого розчину аміаку (23 мл) повільно додавали при 0 °C 5-фтор-2метилбензолсульфоніл хлорид (5,00 г, 23,9 ммоль). Потім дану реакційну суміш нагрівали до 100 °C протягом 1 год. і потім охолоджували до кімнатної температури. Осад, що утворювався, відокремлювали фільтруванням, промивали водою та сушили до постійної маси. Сполуку 17A одержували у вигляді білого порошку (4,55 г, 100%). ВЕРХ: RT = 3,10 хв., 96%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 2.54 (s, 3H); 7.35-7.45 (m, 2H); 7.53 (розширений s, 2H, обмінний); 7.58 (de, 1H). Мас-спектр (ESI ): m/z 188 (M-H , 100%). Приклад 17B (7-Фтор-4-гідрокси-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)-(нафталін-2іл)метанон Сполуку 17B синтезували зі сполуки 17A, використовуючи послідовність стадій, описану в методиці одержання сполуки 13D. Бажаний продукт одержували у вигляді жовтої твердої речовини із загальним виходом 73%. ВЕРХ: RT = 5,18 хв., 98%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 7.66 (t, 1H); 7.72 (t, 1H); 7.81 (t, 1H); 7.90 (d, 1H); 8.04 (d, 2H); 8.11 (розширений s, 2H); 8.30 (dd, 1H); 8.63 (s, 1H); 10.19 (розширений s, 1H); 15.63 (розширений s, 1H). Мас-спектр (ESI ): m/z 368 (M-H , 100%). + + Мас-спектр (ESI ): m/z 370 (MH , 100%). Приклад 17 - (7-Фтор-4-метил-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)(нафталін-2-іл)метанон Сполуку 17 синтезували зі сполуки 17B (4,00 г, 10,8 ммоль) відповідно до методики, використаної для одержання похідного 1, одержували дві порції бажаного продукту різного ступеня очищення. Перша порція: 3,79 г, блідо-коричнева тверда речовина; ВЕРХ: RT = 5,65 хв., 94%. Друга порція: 320 мг, жовта тверда речовина; ВЕРХ: RT = 5,65 хв., 99%. Вихід реакції становив 93%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 2.68 (s, 3H); 7.66 (t, 1H); 7.72 (t, 1H); 7.83 (t, 1H); 7.92 (d, 1H); 8.02-8.15 (m, 4H); 8.28 (dd, 1H); 8.62 (s, 1H); 15.62 (розширений s, 1H, обмінний). + + Мас-спектр (ESI ): m/z 384 (MH , 100%). Приклад 18 - (7-Фтор-4-гідроксі-2-етил-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)(нафталін-2іл)метанон 14 UA 105040 C2 5 10 15 20 25 30 35 40 Сполуку 18 синтезували зі сполуки 17A (1,0 г, 2,7 ммоль) та йодетану відповідно до методики, використаної для одержання похідного 1, одержували дві порції бажаного продукту різного ступеня очищення. Перша порція: 716 мг, блідо-коричнева тверда речовина; ВЕРХ: RT = 5,78 хв., 89%. Друга порція: 68 мг, жовта тверда речовина; ВЕРХ: RT = 5,78 хв., 99%. Вихід реакції становив 65%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 0.54 (t, 3H); 3.14 (q, 2H); 7.66 (t, 1H); 7.71 (t, 1H); 7.82 (t, 1H); 7.92 (d, 1H); 8.00-8.15 (m, 4H); 8.29 (dd, 1H); 8.60 (s, 1H); 15.45 (розширений s, 1H, обмінний). + + Мас-спектр (ESI ): m/z 398 (MH , 100%). Приклад 19 Бензойної кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір Сполуку 1 (86 мг, 0,18 ммоль) розчиняли в дихлорметані (0,5 мл) і піридині (0,5 мл) в атмосфері інертного газу. Дану реакційну суміш охолоджували до 0 °C, і потім додавали бензоїлхлорид (33 мкл, 0,27 ммоль) Охолодну баню видаляли, і реакційну суміш перемішували протягом 4 год. при кімнатній температурі. Оскільки реакція була не завершена, додавали ще одну порцію бензоїлхлориду (16 мкл, 0,14 ммоль), реакційну суміш перемішували при кімнатній температурі додатково протягом 20 год. і потім концентрували. Залишок переносили в етилацетат, промивали один раз водою та один раз насиченим водним розчином NaCl, сушили сульфатом натрію, фільтрували та концентрували. Одержаний залишок упарювали три рази з толуолом з метою видалення піридину, що залишився. Отриманий в результаті жовтий сироп очищали на колонці зі сферичним силікагелем (12 г; швидкість потоку: 12 мл/хв.; градієнт: 20100% CH2Cl2/гептан (30 хв.)) з виходом сполуки 19 у вигляді жовтої піни (38 мг, 44%). ВЕРХ: RT = 5,65 хв., 96%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 3.10 (s, 3H); 7.32 (t, 2H); 7.55-7.30 (m, 6H); 7.86 (dd, 2H); 7.90-8.05 (m, 5H); 8.70 (s, 1H). Приклад 20 - Циклогексанкарбонової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір Сполуку 1 (86 мг, 0,18 ммоль) розчиняли в 0,5 мл піридину в атмосфері інертного газу. Дану реакційну суміш охолоджували до 0 °C, і потім додавали циклогексанкарбонілхлорид (62 мкл, 0,46 ммоль). Охолодну баню видаляли, і реакційну суміш перемішували протягом 18 год. при кімнатній температурі і потім нагрівали до 60 °C протягом 8 год. Потім реакційну суміш концентрували та три рази упарювали з толуолом. Отриманий в результаті залишок очищали на колонці зі сферичним силікагелем (12 г; швидкість потоку: 12 мл/хв.; градієнт: 20-100% CH2Cl2/гептан (20 хв.)) з виходом сполуки 20 у вигляді жовтої піни (65 мг, 28%). ВЕРХ: RT = 5,99 хв., 95%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 0.85-1.00 (m, 6H); 1.38 (de, 2H); 1.49 (de, 2H); 2.28 (tt, 1H); 3.06 (s, 3H); 7.66 (t, 2H); 7.75 (t, 1H); 7.83 (t, 1H); 7.88 (t, 1H); 7.95-8.15 (m, 5H); 8.66 (s, 1H). + + Мас-спектр (ESI ): m/z 493 (MNH4 , 100%). 15 UA 105040 C2 Приклад 21 - Трет-бутилкарбонової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір 5 10 15 20 25 Сполуку 1 (86 мг, 0,18 ммоль) розчиняли в піридині (0,5 мл) в атмосфері інертного газу. Дану реакційну суміш охолоджували до 0 °C, і потім додавали трет-бутилкарбонілхлорид (57 мкл, 0,46 ммоль). Охолодну баню видаляли, і реакційну суміш перемішували протягом 18 год. при кімнатній температурі. Потім реакційну суміш концентрували і три рази упарювали з толуолом. Отриманий в результаті залишок очищали на колонці зі сферичним силікагелем (12 г; швидкість потоку: 12 мл/хв.; градієнт: 20-100% CH2Cl2/гептан (20 хв.)) з виходом сполуки 21 у вигляді жовтої піни (47 мг, 53%). ВЕРХ: RT = 5,71 хв., 98%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 0.88 (s, 9H); 3.07 (s, 3H); 7.59 (d, 1H); 7.66 (t, 1H); 7.75 (t, 1H);7.84 (t, 1H); 7.89 (t, 1H); 8.00-8.09 (m, 4H); 8.12 (d, 1H); 8.69 (s, 1H). + + Мас-спектр (ESI ): m/z 467 (MNH4 , 100%). Приклад 22 - 4-Метилбензойної кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір Сполуку 22 синтезували зі сполуки 1 (86 мг, 0,18 ммоль) і 4-метилбензоїлхлориду (62 мкл, 0,46 ммоль) відповідно до методики, використаної для одержання сполуки 21. Бажаний продукт одержували у вигляді жовтої піни (27 мг, 31%). ВЕРХ: RT = 5,82 хв., 95%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 2.28 (s, 3H); 3.10 (s, 3H); 7.11 (d, 2H); 7.54 (d, 2H); 7.65 (t, 1H); 7.73 (te, 2H); 7.86 (dd, 2H); 7.95 (d, 1H); 7.97-8.05 (m, 4H); 8.69 (s, 1H). + + Мас-спектр (ESI ): m/z 501 (MNH4 , 100%). Приклад 23 - 4-Хлорбензойної кислоти 2- метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір 4-Хлорбензойну кислоту (87 мг, 0,55 ммоль) розчиняли в толуолі (2 мл) в атмосфері 16 UA 105040 C2 5 10 15 інертного газу. Додавали при кімнатній температурі оксалілхлорид (100 мкл, 1,1 ммоль). Дану реакційну суміш нагрівали протягом 2 год. до 80 °C і потім концентрували та три рази упарювали з толуолом. Залишок знову поміщали в атмосферу інертного газу та охолоджували до 0 °C. Додавали сполуку 1 (86 мг, 0,18 ммоль), яку попередньо розчиняли в піридині (0,5 мл) в атмосфері інертного газу та охолоджували до 0 °C. Охолодну баню видаляли, і реакційну суміш перемішували протягом 2 год. при кімнатній температурі. Потім реакційну суміш концентрували та три рази упарювали з толуолом. Отриманий в результаті залишок очищали на колонці зі сферичним силікагелем (12 г; швидкість потоку: 12 мл/хв.; градієнт: 20-100% CH2Cl2/гептан (20 хв.)) з виходом сполуки 23 у вигляді жовтої піни (51 мг, 42%). ВЕРХ: RT = 5,92 хв., 97%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 3.10 (s, 3H); 7.37 (d, 2H); 7.63-7.67 (m, 3H); 7.72 (t, 1H); 7.79 (розширений s, 1H); 7.86 (розширений s, 2H); 7.94 (d, 1H); 7.95-8.07 (m, 4H); 8.66 (s, 1H). + + + Мас-спектр (ESI ): m/z 521 (MNH4 , 100%); 523 (MNH4 , 37%). Приклади 24-27 Сполуки 24-27 синтезували зі сполуки 15 та різних хлорангідридів відповідно до описаної вище методики одержання сполуки 21. Приклад* R 24 трет-бутил 25 циклогексан 26 феніл 27 4-метилфеніл Назва сполук трет-бутилкарбонової кислоти 6-фтор-2-метил-3-(нафталін-2карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір циклогексанкарбонової кислоти 6-фтор-2-метил-3(нафталін-2-карбоніл)-1,1діоксо-2H-бензо[e][1,2]тіазин4-іловий ефір бензойної кислоти 6-фтор-2метил-3-(нафталін-2карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір 4-метилбензойної кислоти 6фтор-2-метил-3-(нафталін-2карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір 1 20 25 ВЕРХ Вихід Маса + MNH4 5,82' 98% 61% 485 6,09' 90% 36% 511 5,73' 96% 64% 505 5,91' 95% 56% 519 * H ЯМР, ДМСО-d6, Приклад 24: 0.87 (s, 9H); 3.08 (s, 3H); 7.32 (d, 1H); 7.63-7.80 (m, 3H); 7.95-8.15 (m, 5H); 8.69 (s, 1H). Приклад 25: 0.80-1.10 (m, 5H); 1.15-1.55 (m, 5H); 2.39 (te, 1H); 3.08 (s, 3H); 7.56 (d, 1H); 7.65-7.70 (m, 2H); 7.76 (t, 1H); 7.95-8.15 (m, 5H); 8.67 (s, 1H). Приклад 26: 3.12 (s, 3H); 7.29 (t, 2H); 7.55-7.75 (m, 7H); 7.94 (d, 1H); 7.98-8.15 (m, 3H); 8.15 (dd, 1H); 8.69 (s, 1H). Приклад 27: 2.28 (s, 3H); 3.11 (s, 3H); 7.09 (d, 2H); 7.51 (d, 2H); 7.60-7.76 (m, 4H); 7.94 (d, 1H); 7.99-8.08 (m, 3H); 8.13 (dd, 1H); 8.69 (s, 1H). Приклади 28-31 Сполуки 28-31 синтезували зі сполуки 16 та різних хлорангідридів відповідно до описаної вище методики одержання сполуки 21. 17 UA 105040 C2 Приклад* Назва сполук R 28 трет-бутил 29 циклогексан 30 феніл 31 4-метилфеніл трет-бутилкарбонової кислоти 6фтор-2-етил-3-(нафталін-2карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір циклогексанкарбонової кислоти 6-фтор-2-етил-3-(нафталін-2карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір бензойної кислоти 6-фтор-2етил-3-(нафталін-2-карбоніл)1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір 4-метилбензойної кислоти 6фтор-2-етил-3-(нафталін-2карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір ВЕРХ Вихід Маса + MNH4 6,00' 98% 53% 499 6,26' 95% 42% 525 5,90' 99% 40% 519 6,08' 95% 59% 533 1 5 10 * H ЯМР, ДМСО-d6, Приклад 28: 0.92 (розширений s, 12H); 3.56 (q, 2H); 7.34 (d, 1H); 7.637.80 (m, 3H); 8.00-8.15 (m, 5H); 8.68 (s, 1H). Приклад 29: 0.80-1.10 (m, 8H); 1.38 (розширений s, 3H); 1.53 (de, 2H); 2.45 (te, 1H); 3.55 (q, 2H); 7.56 (d, 1H); 7.65-7.70 (m, 2H); 7.76 (t, 1H); 7.95-8.15 (m, 5H); 8.67 (s, 1H). Приклад 30: 0.95 (t, 3H); 3.58 (q, 2H); 7.35 (t, 2H); 7.55-7.75 (m, 7H); 7.96 (d, 1H); 7.98-8.10 (m, 3H); 8.14 (dd, 1H); 8.69 (s, 1H). Приклад 31: 0.95 (t, 3H); 2.30 (s, 3H); 3.57 (q, 2H); 7.15 (d, 2H); 7.60-7.76 (m, 6H); 7.95 (d, 1H); 7.99-8.08 (m, 3H); 8.14 (dd, 1H); 8.68 (s, 1H). Приклади 32 і 33 Сполуки 32 і 33 синтезували з 4-хлорбензойної кислоти та сполук 15 і 16, відповідно, з використанням описаної вище методики одержання сполуки 23. Приклад* R 32 метил 33 етил Назва сполук 4-хлорбензойної кислоти 6-фтор-2-метил3-(нафталін-2-карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір 4-хлорбензойної кислоти 6-фтор-2-етил-3(нафталін-2-карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір 1 ВЕРХ Вихід Маса + MNH4 6,00' 95% 18% 539 6,16' 95% 19% 553 * H ЯМР, ДМСО-d6, Приклад 32: 3.12 (s, 3H); 7.34 (d, 2H); 7.55-7.76 (m, 6H); 7.92 (d, 1H); 18 UA 105040 C2 7.95-8.05 (m, 3H); 8.14 (dd, 1H); 8.65 (s, 1H). Приклад 33: 0.95 (t, 3H); 3.58 (q, 2H); 7.40 (d, 2H); 7.60-7.80 (m, 6H); 7.94 (d, 1H); 7.00-8.05 (m, 3H); 8.14 (dd, 1H); 8.65 (s, 1H). Приклад 34 - Нафталін-1-ілкарбонової кислоти 2-метил-3-(4-метилбензоїл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір 5 10 15 20 25 30 35 40 45 Сполуку 3 (150 мг, 0,455 ммоль) розчиняли в тетрагідрофурані (3 мл) в атмосфері інертного газу. Додавали гідрид натрію (27 мг, 0,68 ммоль) і потім, через 30 хв., нафталін-2ілкарбонілхлорид (105 мкл, 0,68 ммоль). Дану реакційну суміш перемішували протягом 4 годин при кімнатній температурі. Потім реакційну суміш нейтралізували шляхом додавання води, і водну фазу двічі екстрагували етилацетатом. Органічні фази об’єднували, сушили сульфатом магнію, фільтрували та концентрували. Отриманий в результаті залишок очищали на колонці зі сферичним силікагелем (12 г; швидкість потоку: 12 мл/хв.; градієнт 0-45% EtOAc у гептані (20 хв.)). Бажаний продукт одержували у вигляді жовтої твердої речовини (134 мг, 61%). ВЕРХ: RT = 6,59 хв., 98%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 2.35 (s, 3H); 3.08 (s, 3H); 7.36 (d, 2H); 7.54 (t, 1H); 7.58-7.63 (m, 2H); 7.79-7.87 (m, 3H); 7.92 (d, 2H); 8.00 (d, 1H); 8.04-8.07 (m, 2H); 8.27 (d, 1H); 8.50-8.55 (m, 1H). + + Мас-спектр (ESI ): m/z 501 (MNH4 , 100%). Приклади 35-45 Сполуки 35-45 синтезували зі сполуки 3 або зі сполуки 5 та різних хлорангідридів відповідно до описаної вище методики одержання сполуки 34. Хлорангідриди, необхідні для синтезу сполук у Прикладах 40-45, одержували у дві стадії з відповідних ароматичних спиртів. Одержання (нафталін-2-ілоксі)ацетилхлориду наведене як приклад. 2-Нафтол (3,0 г, 20 ммоль) розчиняли в 95 мл метилетилкетону (MEK) у присутності карбонату натрію (40 г, 93 ммоль) у двогорлій колбі, обладнаній холодильником, в атмосфері інертного газу, і потім нагрівали до 50 °C протягом 30 хв. У нагріту суміш додавали по краплях 2-брометанову кислоту (5,76 г, 41 ммоль), розчинену в MEK (23 мл). Нагрівання продовжували ще протягом 4 год. Потім реакційну суміш охолоджували до кімнатної температури та фільтрували. Тверду речовину збирали шляхом фільтрування, переносили в суміш етилацетату та 1 н. водного розчину HCl. Дві фази розділяли, і водну фазу один раз екстрагували етилацетатом. Органічні фази збирали, сушили сульфатом магнію, фільтрували та концентрували до появи перших кристалів. Додавали гептан (приблизно 20% від об'єму, що залишився) і осад, що утворився, відокремлювали, промивали гептаном і сушили до постійної маси з одержанням (нафталін-2-ілокси)оцтової кислоти (3,04 г, 72%) у вигляді білої твердої речовини. ВЕРХ: RT = 4,10 хв., 99%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 4.80 (s, 2H); 7.20 (dd, 1H); 7.26 (d, 1H); 7.35 (td, 1H); 7.45 (td, 1H); 7.79 (d, 1H); 7.80-7.86 (m, 2H); 13.07 (розширений s, 1H, обмінний). + + Мас-спектр (ESI ): m/z 203 (MH , 100%). Мас-спектр (ESI ): m/z 201 (M-H, 100%). Кислоту, отриману на попередній стадії (3,04 г, 15 ммоль), частково розчиняли в дихлорметані (34 мл) в атмосфері інертного газу при кімнатній температурі. Додавали оксалілхлорид (1,35 мл, 15,7 ммоль) і потім ДМФА (100 мкл). Увага: при додаванні ДМФА відбувається бурхлива реакція. Реакційну суміш перемішували протягом 1 год., потім концентрували, двічі упарювали з толуолом і сушили до постійної маси з одержанням 19 UA 105040 C2 (нафталін-2-ілоксі)ацетилхлориду (3,4 г, 100%) у вигляді оранжевої твердої речовини. Отриманий в результаті хлорангідрид використовували як є для синтезу сполук 40 і 41. Приклад R R' 35 нафталін-1-карбоніл CN 37 нафталін-2-карбоніл CN 38 4-хлор-бензоїл CH3 39 4-хлор-бензоїл CN 40 (нафталін-2-ілоксі)ацетил CH3 41 (нафталін-2-ілоксі)ацетил CN 42 (нафталін-1-ілоксі)ацетил CH3 43 (нафталін-1-ілоксі)ацетил CN 44 (4-хлор-феноксі)ацетил CH3 45 10 CH3 36 5 нафталін-2-карбоніл (4-хлор-феноксі)ацетил CN Назва сполук нафталін-2-ілкарбонової кислоти 2-метил-3-(4-метилбензоїл)-1,1діоксо-2H-бензо[e][1,2]тіазин-4іловий ефір нафталін-1-ілкарбонової кислоти 2-метил-3-(4-ціанобензоїл)-1,1діоксо-2H-бензо[e][1,2]тіазин-4іловий ефір нафталін-2-ілкарбонової кислоти 2-метил-3-(4-ціанобензоїл)-1,1діоксо-2H-бензо[e][1,2]тіазин-4іловий ефір 4-хлорбензойної кислоти 2-метил3-(4-метилбензоїл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір 4-хлорбензойної кислоти 2-метил3-(4-ціанобензоїл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір (нафталін-2-ілокси)оцтової кислоти 2-метил-3-(4метилбензоїл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір (нафталін-2-ілокси)оцтової кислоти 2-метил-3-(4ціанобензоїл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір (нафталін-1-ілокси)оцтової кислоти 2-метил-3-(4метилбензоїл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір (нафталін-1-ілокси)оцтової кислоти 2-метил-3-(4ціанобензоїл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір (4-хлорфенокси)оцтової кислоти 2-метил-3-(4-метилбензоїл)-1,1діоксо-2H-бензо[e][1,2]тіазин-4іловий ефір (4-хлорфенокси)оцтової кислоти 2-метил-3-(4-ціанобензоїл)-1,1діоксо-2H-бензо[e][1,2]тіазин-4іловий ефір 1 ВЕРХ Вихід Маса + MNH4 5,89' 99% 81% 501 5,59' 98% 85% 512 5,58' 93% 30% 512 5,82' 96% 24% 485 5,48' 91% 19% 496 5,87' 98% 85% 531 5,59' 98% 21% 542 5,89' 98% 60% 531 5,64' 97% 29% 542 5,76' 99% 64% 515 5,50' 90% 31% 526 * H ЯМР, ДМСО-d6, Приклад 35: 2.34 (s, 3H); 3.07 (s, 3H); 7.35 (d, 2H); 7.65 (t, 1H); 7.72 (t, 1H); 7.75-7.92 (m, 6H); 7.95-8.06 (m, 4H); 8.39 (s, 1H). Приклад 36: 3.07 (s, 3H); 7.58 (t, 1H); 7.617.68 (m, 2H); 7.89 (розширений s, 3H); 7.98 (d, 2H); 8.00-8.10 (m, 5H); 8.31 (d, 1H); 8.60 (dd, 1H). Приклад 37: 3.08 (s, 3H); 7.67 (t, 1H); 7.71-7.79 (m, 2H); 7.90 (розширений s, 3H); 7.99-8.11 (m, 8H); 8.40 (s, 1H). Приклад 38: 2.38 (s, 3H); 3.04 (s, 3H); 7.35 (d, 2H); 7.58 (d, 2H); 7.70-7.80 (m, 3H); 7.83-8.88 (m, 4H); 8.02 (розширений s, 1H). Приклад 39: 3.04 (s, 3H); 7.59 (d, 2H); 7.79 (d, 2H); 7.83-7.90 (m, 3H); 7.99-8.07 (m, 5H). Приклад 40: 2.38 (s, 3H); 2.97 (s, 3H); 5.10 (s, 2H); 7.13 (dd, 1H); 7.20 (d, 1H); 7.36-7.41 (m, 3H); 7.48 (t, 1H); 7.67 (d, 1H); 7.80-7.99 (m, 7H); 8.00 (розширений s, 1H). Приклад 41: 2.94 (s, 3H); 5.14 (s, 2H); 7.15 (dd, 1H); 7.25 (d, 1H); 7.38 (t, 1H); 20 UA 105040 C2 5 10 15 20 7.47 (t, 1H); 7.69 (d, 1H); 7.81-7.94 (m, 5H); 7.99-8.10 (m, 5H). Приклад 42: 2.38 (s, 3H); 2.99 (s, 3H); 5.14 (s, 2H); 6.70 (d, 1H); 7.28 (t, 1H); 7.40 (d, 2H); 7.47-7.55 (m, 3H); 7.81-7.88 (m, 4H); 7.92 (d, 2H); 8.00 (d, 1H); 8.08 (d, 1H).). Приклад 43: 2.96 (s, 3H); 5.20 (s, 2H); 6.82 (d, 1H); 7.34 (t, 1H); 7.49-7.56 (m, 3H); 7.88-7.56 (m, 4H); 8.00-8.02 (m, 1H); 8.05-8.11 (m, 5H). Приклад 44: 2.42 (s, 3H); 2.97 (s, 3H); 4.98 (s, 2H); 6.81 (d, 2H); 7.23 (d, 2H); 7.42 (d, 2H); 7.81-7.92 (m, 5H); 7.99 (d, 1H). Приклад 45: 2.95 (s, 3H); 5.01 (s, 2H); 6.90 (d, 2H); 7.28 (d, 2H); 7.85-8.15 (m, 8H). Приклад 46 Оцтової кислоти 2-метил-3-(нафталін-2-карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір Сполуку 1 (100 мг, 0,274 ммоль) розчиняли в дихлорметані (2 мл) в атмосфері інертного газу. Додавали при 0 °C триетиламін (230 мкл, 1,64 ммоль) і потім ацетилхлорид (78 мкл, 1,09 ммоль). Дану реакційну суміш перемішували протягом 18 год. при кімнатній температурі і потім концентрували. Отриманий в результаті залишок очищали на колонці зі сферичним силікагелем (12 г) з виходом сполуки 46 (21 мг, 30%). ВЕРХ: RT = 5,34 хв., 97%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 1.96 (s, 3H); 3.03 (s, 3H); 7.66 (t, 1H); 7.75 (t, 1H); 7.80-7.91 (m, 3H); 7.99-8.08 (m, 4H); 8.12 (d, 1H); 8.67 (s, 1H). + + Мас-спектр (ESI ): m/z 425 (MNH4 , 100%). Приклади 47-54 Сполуки 47-54 синтезували зі сполуки 1 та різних хлорангідридів відповідно до описаної вище методики одержання сполуки 46. Приклад R 47 2,4-дихлор-феніл 48 4-фторфеніл 49 циклопентил 50 фуран-2-іл 51 тіофен-2-іл 52 3-хлорфеніл 53 2-хлорфеніл 54 феноксиметил Назва сполук 2,4-дихлорбензойної кислоти 2-метил-3(нафталін-2-карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір 4-фторбензойної кислоти 2-метил-3-(нафталін-2карбоніл)-1,1-діоксо-2H-бензо[e][1,2]тіазин-4іловий ефір циклопентанової кислоти 2-метил-3-(нафталін-2карбоніл)-1,1-діоксо-2H-бензо[e][1,2]тіазин-4іловий ефір 2-фуранової кислоти 2-метил-3-(нафталін-2карбоніл)-1,1-діоксо-2H-бензо[e][1,2]тіазин-4іловий ефір тіофен-2-карбонової кислоти 2-метил-3-(нафталін2-карбоніл)-1,1-діоксо-2H-бензо[e][1,2]тіазин-4іловий ефір 3-хлорбензойної кислоти 2-метил-3-(нафталін-2карбоніл)-1,1-діоксо-2H-бензо[e][1,2]тіазин-4іловий ефір 2-хлорбензойної кислоти 2-метил-3-(нафталін-2карбоніл)-1,1-діоксо-2H-бензо[e][1,2]тіазин-4іловий ефір феноксиоцтової кислоти 2-метил-3-(нафталін-2ілкарбоніл)-1,1-діоксо-2H-бензо[e][1,2]тіазин-4іловий ефір 21 ВЕРХ Вихід Маса MNH4+ 6,05' 98% 47% 555 5,86' 98% 69% 505 5,99' 91% 48% 479 5,33' 97% 68% 477 5,68' 99% 61% 493 5,87' 98% 45% 521 5,74' 96% 63% 521 5,63' 97% 71% 517 UA 105040 C2 1 5 10 15 20 25 30 35 * H ЯМР, ДМСО-d6, Приклад 47: 3.11 (s, 3H); 7.29 (d, 1H); 7.58 (d, 1H); 7.62-7.68 (m, 2H); 7.72 (t, 1H); 7.82-7.92 (m, 3H); 7.95-8.09 (m, 5H); 8.66 (s, 1H). Приклад 48: 3.10 (s, 3H); 7.15 (t, 2H); 7.63-8.08 (m, 12H); 8.67 (s, 1H). Приклад 49: 1.20-1.31 (m, 6H); 1.50-1.58 (m, 2H); 2.75 (quintet, 1H); 3.07 (s, 3H); 7.64-7.70 (m, 2H); 7.74 (t, 1H); 7.84 (t, 1H); 7.89 (t, 1H); 7.99-8.08 (m, 4H); 8.12 (d, 1H); 8.67 (s, 1H). Приклад 50: 3.08 (s, 3H); 6.60 (d, 1H); 7.19 (d, 1H); 7.65 (t, 1H); 7.72-7.77 (m, 2H); 7.88 (розширений s, 2H); 7.95-8.08 (m, 6H); 8.69 (s, 1H). Приклад 51: 3.09 (s, 3H); 7.09 (dd, 1H); 7.62-8.04 (m, 12H); 8.20 (s, 1H). Приклад 52: 3.12 (s, 3H); 7.6 (t, 1H); 7.41 (s, 1H); 7.60-7.67 (m, 3H); 7.72 (t, 1H); 7.82-8.08 (m, 8H); 8.69 (s, 1H). Приклад 53: 3.11 (s, 3H); 7.20 (t, 1H); 7.49-7.57 (m, 3H); 7.65 (t, 1H); 7.73 (t, 1H); 7.80 (d, 1H); 7.85-7.93 (m, 2H); 7.98-8.09 (m, 5H); 8.71 (s, 1H). Приклад 51: 3.04 (s, 3H); 4.89 (s, 2H); 6.66 (d, 2H); 6.86 (t, 1H); 7.09 (t, 2H); 7.65 (t, 1H); 7.76 (t, 1H); 7.83-7.92 (m, 3H); 8.03-8.09 (m, 4H); 8.14 (d, 1H); 8.71 (s, 1H). Приклад 55 (4-Метокси-2-метил-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)-(нафталін-2іл)метанон Сполуку 1 (159 мг, 0,435 ммоль) розчиняли в ДМФА (2 мл) в атмосфері інертного газу. Додавали гідрид натрію (26 мг, 0,65 ммоль) і потім, через 30 хв., йодметан (30 мкл, 0,48 ммоль). Дану реакційну суміш перемішували протягом 2 год. при кімнатній температурі і потім протягом 26 год. при 60 °C. На даному етапі реакція була не завершена. Додавали карбонат цезію (213 мг, 0,65 ммоль) та йодметан (150 мкл, 2,1 ммоль). Дану реакційну суміш перемішували протягом 24 год. при кімнатній температурі і потім нейтралізували шляхом додавання води, водну фазу двічі екстрагували етилацетатом. Органічні фази об’єднували, сушили сульфатом магнію, фільтрували та концентрували. Отриманий в результаті залишок очищали на колонці зі сферичним силікагелем (12 г; швидкість потоку: 12 мл/хв.; градієнт 20-60% дихлорметану в гептані) з виходом сполуки 55 у вигляді жовтої піни (70 мг, 38%). ВЕРХ: RT = 5,27 хв., 90%. + + Мас-спектр (ESI ): m/z 380 (MH , 100%). Приклади 56-58 Сполуки 56-58 одержували відповідно до такої методики. Сполуку 1 (150 мг, 0,42 ммоль) розчиняли в ДМФА (0,3 мл) в атмосфері інертного газу. Додавали карбонат цезію (201 мг, 0,61 ммоль) і необхідний алкілйодид (4 ммоль). Дану реакційну суміш перемішували протягом 18 год. при кімнатній температурі, протягом 4 год. при 50 °C, і потім нейтралізували шляхом додавання води, водну фазу двічі екстрагували етилацетатом. Органічні фази об’єднували, сушили сульфатом магнію, фільтрували та концентрували. Отриманий в результаті залишок очищали на колонках зі сферичним силікагелем (12 г; швидкість потоку: 12 мл/хв.; градієнт 20-60% дихлорметану в гептані) з виходом бажаних продуктів. 22 UA 105040 C2 Приклад R 56 етил 57 н-пропіл 58 н-бутил Назва сполук (4-етокси-2-метил-1,1-діоксо-2Hбензо[e][1,2]-тіазин-3-іл)(нафталін-2іл)метанон (4-пропілокси-2-метил-1,1-діоксо-2Hбензо-[e][1,2]тіазин-3-іл)(нафталін-2іл)метанон (4-бутилокси-2-метил-1,1-діоксо-2Hбензо-[e][1,2]тіазин-3-іл)(нафталін-2іл)метанон ВЕРХ Вихід Маса + MH 5,43' 99% 66% 394 5,61' 99% 65% 408 5,81' 97% 24% 422 1 5 10 15 20 25 30 35 * H ЯМР, ДМСО-d6, Приклад 56: 0.87 (t, 3H): 2.98 (s, 3H); 3.74 (q, 2H); 7.64 (t, 1H); 7.72 (t, 1H); 7.80-7.93 (m, 3H); 7.95-8.15 (m, 5H); 8.67 (s, 1H). Приклад 57: 0.49 (t, 3H): 1.28 (sextet, 2H); 2.97 (s, 3H); 3.63 (t, 2H); 7.64 (t, 1H); 7.72 (t, 1H); 7.80-7.93 (m, 3H); 7.95-8.15 (m, 5H); 8.68 (s, 1H). Приклад 58: 0.50 (t, 3H): 0.89 (sextet, 2H); 1.23 (quintet, 2H); 2.97 (s, 3H); 3.66 (t, 2H); 7.64 (t, 1H); 7.72 (t, 1H); 7.80-7.93 (m, 3H); 7.95-8.15 (m, 5H); 8.67 (s, 1H). Приклад 59 (4-(2-Хлоретокси)-2-метил-1,1-діоксо-2H-бензо[e][1,2]тіазин-3-іл)-(паратоліл)метанон Сполуку 3 (100 мг, 0,3 ммоль) розчиняли в ТГФ (3 мл) в атмосфері інертного газу в присутності 2-хлоретанолу (100 мкл, 1,5 ммоль). Дану реакційну суміш охолоджували до 0 °C, потім додавали по краплях послідовно трифенілфосфін (318 мг, 1,2 ммоль) і діетилдіазен-1,2дикарбоксилат (DEAD, 211 мг, 1,2 ммоль). Перемішування продовжували протягом 20 год. при кімнатній температурі, і потім реакційну суміш нейтралізували шляхом додавання насиченого водного розчину хлориду амонію. Отриману водну фазу двічі екстрагували етилацетатом. Органічні фази об’єднували, сушили сульфатом магнію, фільтрували та концентрували. Отриманий в результаті залишок очищали на колонці із силікагелем (35 г; швидкість потоку: 20 мл/хв.; градієнт 0-100% етилацетату в гептані) з виходом сполуки 59 (70 мг, 58%). ВЕРХ: RT = 5,28 хв., 99%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 2.41 (s, 3H); 2.91 (s, 3H); 3.57 (t, 2H); 3.92 (t, 2H); 7.40 (d, 2H,); 7.75-7.98 (m, 6H). + + + Мас-спектр (ESI ): m/z 392 (MH , 100%); 394 (MH , 42%). Приклад 60 - (4-[2-(Нафталін-2-ілокси)етокси]-2-метил-1,1-діоксо-2H-бензо-[e][1,2]тіазин-3іл)-(пара-толіл)метанон Сполуку 59 (70 мг, 0,17 ммоль) розчиняли в ДМФА (2 мл) в атмосфері інертного газу в присутності карбонату калію (64 мг, 0,53 ммоль), йодиду калію (31 мг, 0,19 ммоль) і 2-нафтолу (38 мг, 0,27 ммоль). Дану реакційну суміш нагрівали до 65 °C протягом 22 год., потім нейтралізували шляхом додавання води та двічі екстрагували етилацетатом. Органічні фази об’єднували, сушили сульфатом магнію, фільтрували та концентрували. Отриманий в результаті залишок очищали на колонці Waters Sunfire (19×100 мм, 5 мкм) шляхом напівпрепаративної ВЕРХ (швидкість потоку: 20 мл/хв.; градієнт 10-100% ацетонітрилу у воді (0,1% ТФОК-буфер) протягом 15 хв.) з виходом сполуки 60 (30 мг, 29%). 23 UA 105040 C2 5 10 15 20 25 30 35 ВЕРХ: RT = 5,95 хв., 99%. 1 H ЯМР, ДМСО-d6, δ (м.ч.) 2.26 (s, 3H); 2.90 (s, 3H); 4.03 (d, 2H); 4.10 (d, 2H); 6.92 (dd, 1H); 7.06 (d, 1H); 7.24 (d, 2H); 7.33 (t, 1H); 7.44 (t, 1H); 7.70-7.90 (m, 7H); 7.94-7.98 (m, 2H). + + Мас-спектр (ESI ): m/z 500 (MH , 100%). Приклад 61 - (4-(2-Феноксіетокси)-2-метил-1,1-діоксо-2H-бензо[e][1,2]-тіазин-3-іл)(нафталін2-іл)метанон Сполуку 1 (100 мг, 0,274 ммоль) розчиняли в ДМФА (0,5 мл) у присутності карбонату калію (90 мг, 0,55 ммоль) і 2-феноксіетилброміду (110 мг, 0,55 ммоль). Дану реакційну суміш нагрівали в герметично закритій пробірці до 80 °C протягом 16 год. Суміш переносили в етилацетат і потім промивали водою та насиченим розчином NaCl. Органічні фази об’єднували, сушили сульфатом натрію, фільтрували та концентрували. Отриманий в результаті залишок очищали на колонці із силікагелем (12 г; швидкість потоку: 20 мл/хв.; градієнт 0-10% дихлорметану в гептані) з виходом сполуки 61 у вигляді жовтого сиропу (45 мг, 34%). ВЕРХ: RT = 5,88 хв., 98%. 1 H ЯМР, ДМСО-d6, δ (м.ч.) 2.97 (s, 3H); 3.85-3.87 (m, 2H); 4.01-4.05 (m, 2H); 6.59 (d, 2H); 6.82 (t, 1H); 7.11 (t, 2H); 7.62 (t, 1H); 7.71 (t, 1H); 7.83 (t, 1H); 7.88 (t, 1H); 7.91-8.04 (m, 6H); 8.62 (s, 1H). + + Мас-спектр (ESI ): m/z 486 (MH , 100%). Приклад 62 - Метил-2-(2-метил-3-(4-метилбензоїл)-1,1-діоксо-2H-бензо[e][1,2]тіазин-4ілоксі)ацетат Сполуку 62 синтезували зі сполуки 3 (300 мг, 0,91 ммоль) і метилгліколяту (350 мкл, 4,5 ммоль) відповідно до методики, використаної для одержання сполуки 59, бажаний продукт одержували у вигляді жовтого сиропу (300 мг, 79%). ВЕРХ: RT = 4,97 хв., 97%. 1 H ЯМР, ДМСО-d6, δ (м.ч.): 2.42 (s, 3H); 2.88 (s, 3H); 3.47 (s, 3H); 4.42 (s, 2H); 7.40 (d, 2H,); 7.75-7.98 (m, 6H). + + + Мас-спектр (ESI ): m/z 402 (MH , 100%); 419 (MNH4 , 42%). Приклад 63 - (2-Метил-3-(4-метилбензоїл)-1,1-діоксо-2H-бензо[e][1,2]тіазин-4-ілокси)оцтова кислота Сполуку 62 (75 мг, 0,18 ммоль) розчиняли в ТГФ (1 мл), і додавали гідроксид літію (1M/H 2O, 0,37 ммоль). Дану реакційну суміш перемішували протягом 2 год. при кімнатній температурі і потім розбавляли водою та двічі екстрагували дихлорметаном. Органічні фази об’єднували, сушили сульфатом магнію, фільтрували та концентрували з одержанням 22 мг бажаного продукту (ВЕРХ: RT = 4,55 хв., 97%). Вихід реакції становив 30%. 24 UA 105040 C2 1 5 10 H ЯМР, ДМСО-d6, δ (м.ч.) 2.41 (s, 3H); 2.88 (s, 3H); 4.28 (s, 2H); 7.39 (d, 2H); 7.81 (t, 1H); 7.85-7.95 (m, 5H); 12.96 (se, 1H, обмінний). + + + Мас-спектр (ESI ): m/z 388 (MH , 100%); 405 (MNH4 , 54%). Приклади 64-66 Сполуку 63 (110 мг, 0,28 ммоль) розчиняли в ДМФА (3 мл). Додавали різні аміни (0,23 ммоль), DIEA (N,N-діізопропілетиламін) (82 мкл, 0,472 ммоль), HOOBT (3-гідрокси-1,2,3бензотриазин-4-он) (35 мг, 0,26 ммоль), EDCI (N-етил-N'-(3-диметиламінопропіл)карбодііміду гідрохлорид) (50 мг, 0,26 ммоль). Дану реакційну суміш перемішували протягом 18 год. при кімнатній температурі. Суміш переносили в дихлорметан і потім промивали 1 н. розчином карбонату натрію, водою та насиченим розчином NaCl. Органічні фази об’єднували, сушили сульфатом магнію, фільтрували та концентрували. Отримані в результаті залишки очищали на колонках зі сферичним силікагелем (12 г; швидкість потоку: 12 мл/хв.; 0-50% AcOEt у гептані) з виходом бажаних продуктів. 15 Приклад 64 65 66 R1R2N Назва сполук 2-(2-метил-3-(4-метилбензоїл)-1,1діоксо-2H-бензо[e][1,2]тіазин-4ілокси)-N-(нафталін-1-іл)ацетамід 2-(2-метил-3-(4-метилбензоїл)-1,1адамантан-1-іл діоксо-2H-бензо[e][1,2]тіазин-4ілокси)-N-(адамантан-1-іл)ацетамід 2-(2-метил-3-(4-метилбензоїл)-1,1адамантан-2-іл діоксо-2H-бензо[e][1,2]тіазин-4ілокси)-N-(адамантан-2-іл)ацетамід нафталін-1-іл ВЕРХ Вихід Маса + MNH4 5,45' 95% 40% 530 5,90' 99% 72% 538 5,83' 99% 85% 538 1 20 25 30 * H ЯМР, ДМСО-d6, Приклад 64: 2.33 (s, 3H); 2.93 (s, 3H); 4.55 (s, 2H); 7.35 (d, 2H); 7.43-7.55 (m, 4H); 7.76 (d, 1H); 7.82-7.85 (m, 2H); 7.91-7.99 (m, 5H); 8.12 (d, 1H); 7.76 (s, 1H, обмінний). 65: 1.51-1.59 (m, 6H); 1.71 (s, 6H); 1.94 (s, 3H); 2.41(s, 3H); 2.88 (s, 3H); 4.05 (s, 2H); 6.78 (s, 1H); 7.42 (d, 2H); 7.81 (t, 1H); 7.87-7.95 (m, 4H); 7.99 (d, 1H). 66: 1.39-1.41 (m, 2H); 1.64-1.77 (m, 12H); 2.41 (s, 3H); 2.88 (s, 3H); 3.65-3.75 (m, 1H); 4.21 (s, 2H); 7.39 (d, 3H); 7.81 (t, 1H); 7.87-7.95 (m, 4H); 8.0 (d, 1H). Приклад 67 - Метил-2-(2-метил-3-(4-метилбензоїл)-1,1-діоксо-2H-бензо[e][1,2]-тіазин-4ілоксі)ацетат Сполуку 1 (1,0 г, 2,74 ммоль) розчиняли в ДМФА (2 мл) у присутності карбонату калію (682 мг, 4,1 ммоль) і метилового ефіру бромоцтової кислоти (1,26 мл, 13,68 ммоль). Дану реакційну суміш перемішували протягом 5 год. при кімнатній температурі, і потім додавали ще одну таку ж порцію метилового ефіру бромоцтової кислоти. Суміш залишали на ніч при кімнатній температурі, потім переносили в етилацетат і потім промивали водою та насиченим розчином NaCl. Органічні фази об’єднували, сушили сульфатом натрію, фільтрували та концентрували. 25 UA 105040 C2 5 10 15 20 25 30 Отриманий в результаті залишок очищали на колонці із силікагелем (90 г; швидкість потоку: 32 мл/хв.; градієнт 40-100% дихлорметану в гептані) з виходом сполуки 67 у вигляді жовтого сиропу (486 мг, 41%). ВЕРХ: RT = 5,23 хв., 86%. 1 H ЯМР, ДМСО-d6, δ (м.ч.) 2.95 (s, 3H); 3.39 (s, 3H); 4.45 (s, 2H); 7.64 (t, 1H); 7.72 (t, 1H); 7.817.89 (m, 1H); 7.93 (d, 2H); 7.97 (d, 1H); 7.99-8.11 (m, 4H); 8.66 (s, 1H). + + Мас-спектр (ESI ): m/z 438 (MH , 100%). Приклад 68 2-(2-Метил-3-(4-метилбензоїл)-1,1-діоксо-2H-бензо[e][1,2]тіазин-4ілокси)оцтова кислота Сполуку 67 (480 мг, 1,1 ммоль) розчиняли в суміші ТГФ/вода (5:1) (6 мл) і потім обробляли LiOH (103 мг, 4,39 ммоль) протягом 15 хв. при кімнатній температурі. Суміш переносили в етилацетат і потім промивали 1 н. HCl, водою та насиченим розчином NaCl. Органічні фази об’єднували, сушили сульфатом натрію, фільтрували та концентрували. Отриманий в результаті залишок очищали на колонці із силікагелем (30 г; елюент: дихлорметан/метанол/оцтова кислота (95/4,5/0)) з виходом сполуки 68 у вигляді жовтої піни (321 мг, 69%). ВЕРХ: RT = 4,86 хв., 99%. 1 H ЯМР, ДМСО-d6, δ (м.ч.) 2.93 (s, 3H); 4.29 (s, 2H); 7.64 (t, 1H); 7.72 (t, 1H); 7.83 (t, 1H); 7.898.09 (m, 7H); 8.66 (s, 1H). + + Мас-спектр (ESI ): m/z 424 (MH , 100%). Приклади 69-71 Сполуки 69-71 одержували відповідно до такої методики. Сполуку 1 (100 мг, 0,23 ммоль) розчиняли в дихлорметані (1,5 мл). Додавали різні аміни (0,23 ммоль), DIEA (82 мкл, 0,472 ммоль), HOOBT (35 мг, 0,26 ммоль) і EDCI (50 мг, 0,26 ммоль). Дану реакційну суміш перемішували протягом 24 год. при кімнатній температурі, потім додавали надлишок аміну (0,07 ммоль), і отриману суміш перемішували ще протягом 5 год. Суміш переносили в дихлорметан і промивали 1 н. розчином карбонату натрію, водою та насиченим розчином NaCl. Органічні фази об’єднували, сушили сульфатом натрію, фільтрували та концентрували. Отримані в результаті залишки очищали на колонках зі сферичним силікагелем (12 г; швидкість потоку: 12 мл/хв.; суміш 1% метанол/аміак (9:1) у дихлорметані) з виходом бажаних продуктів. 26 UA 105040 C2 Приклад NR1R2 Назва сполук 2-[2-метил-3-(нафталін-2-карбоніл)1,1-діоксо-2H-бензо[e][1,2]тіазин-4ілокси]-1-піперидин-1-ілетанон 2-[2-метил-3-(нафталін-2-карбоніл)1,1-діоксо-2H-бензо[e][1,2]тіазин-4ілокси]-1-(4-метилпіперазин-1іл)етанон 69 70 1-(4-бензилпіперазин-1-іл)-2-[2-метил3-(нафталін-2-карбоніл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-ілокси]етанон 71 ВЕРХ Вихід Маса + MH 5,26' 98% 49% 491 3,93' 98% 47% 506 4,28' 98% 20% 582 1 5 10 * H ЯМР, ДМСО-d6, Приклад 69: 1.08-1.31 (m, 6H): 2.87 (t, 2H); 2.95 (s, 3H); 3.04 (t, 2H); 4.41 (s, 2H); 7.64 (t, 1H); 7.72 (t, 1H); 7.84 (m, 1H); 7.92 (d, 2H); 7.97-8.10 (m, 5H); 8.65 (s, 1H). Приклад 70: 1.85 (t, 2H): 1.92 (t, 2H); 1.95 (s, 3H); 2.94 (розширений s, 5H); 3.04 (розширений s, 2H); 4.44 (s, 2H); 7.64 (t, 1H); 7.72 (t, 1H); 7.84 (m, 1H); 7.92 (m, 2H); 7.97-8.10 (m, 5H); 8.65 (s, 1H). Приклад 71: 1.88 (розширений s, 2H); 1.96 (розширений s, 2H); 2.92 (m, 5H); 3.08 (розширений s, 2H); 3.22 (s, 2H); 4.42 (s, 2H); 7.16 (d, 2H); 7.21-7.31 (m, 3H); 7.63 (t, 1H); 7.72 (t, 1H); 7.82 (m, 1H); 7.78 (m, 2H); 7.97-8.09 (m, 5H); 8.65 (s, 1H). Приклади 72-74 Сполуки 72-74 синтезували зі сполуки 1 та різних хлорангідридів відповідно до описаної вище методики одержання сполуки 46. Приклад 72 73 74 15 20 R Назва сполук (4-хлорфеноксі)оцтової кислоти 24-хлорфеніл- метил-3-(нафталін-2-карбоніл)-1,1оксіацетил діоксо-2H-бензо[e][1,2]тіазин-4-іловий ефір (нафталін-1-ілоксі)оцтової кислоти 2нафталін-1- метил-3-(нафталін-2-карбоніл)-1,1ілоксіацетил діоксо-2H-бензо[e][1,2]тіазин-4-іловий ефір (нафталін-2-ілоксі)оцтової кислоти 2нафталін-2- метил-3-(нафталін-2-карбоніл)-1,1ілоксіацетил діоксо-2H-бензо[e][1,2]тіазин-4-іловий ефір 1 ВЕРХ Вихід Маса + MNH4 6,02' 94% 77% 551 6,16' 98% 84% 567 6,11' 96% 83% 567 * H ЯМР, ДМСО-d6, Приклад 72: 3.04 (s, 3H); 4.94 (s, 2H); 6.67 (d, 2H); 7.07 (d, 2H); 7.64 (t, 1H); 7.72 (t, 1H); 7.84-7.93 (m, 3H); 8.02 (m, 3H); 8.08 (d, 1H); 8.14 (d, 1H); 8.69 (s, 1H). Приклад 73: 3.05 (s, 3H); 5.10 (s, 2H); 6.59 (d, 1H); 7.12 (t, 1H); 7.38-7.41 (m, 2H); 7.49 (t, 1H); 7.66 (t, 1H); 7.75 (t, 1H); 7.81-7.90 (m, 4H); 7.98 (d, 1H); 8.02-8.08 (m, 4H); 8.13 (d, 1H); 8.72 (s, 1H). Приклад 74: 3.02 (s, 3H); 5.07 (s, 2H); 7.01 (dd, 1H); 7.12 (d, 1H); 7.32-7.41 (m, 2H); 7.57 (d, 1H); 7.63 (t, 1H); 7.70-7.79 (m, 3H); 7.85-7.94 (m, 3H); 8.02-8.12 (m, 5H); 8.71 (s, 1H). Приклади 75 і 76 Сполуки 75 і 76 синтезували зі сполуки 59 та різних спиртів відповідно до описаної вище методики одержання сполуки 60. 27 UA 105040 C2 Приклад 75 76 R Назва сполук (4-[2-(нафталін-1-ілоксі)етокси]-2метил-1,1-діоксо-2Hнафталін-1-іл бензо[e][1,2]тіазин-3-іл)-(паратоліл)метанон (4-[2-(4-хлорфенілоксі)етокси]-2метил-1,1-діоксо-2H4-хлорфеніл бензо[e][1,2]тіазин-3-іл)-(паратоліл)метанон ВЕРХ Вихід Маса + MH 6,00' 97% 38% 500 5,87' 98% 48% 484 1 5 * H ЯМР, ДМСО-d6, Приклад 75: 2.31 (s, 3H); 2.90 (s, 3H); 4.10-4.20 (m, 4H); 6.75 (d, 1H); 7.21 (d, 2H); 7.33 (t, 1H); 7.40-7.44 (m, 2H); 7.51 (t, 1H); 7.78-7.85 (m, 6H); 7.97 (t, 2H).Приклад 76: 2.37 (s, 3H); 2.89 (s, 3H); 3.85-3.95 (m, 2H); 4.00-4.05 (m, 2H); 6.69 (d, 2H); 7.23 (d, 2H); 7.29 (d, 2H); 7.78-7.96 (m, 6H). Приклади 77 і 78 Сполуки 77 і 78 синтезували зі сполуки 3 та з ацетилхлориду і пропаноїлхлориду, відповідно, з використанням описаної вище методики одержання сполуки 34. 10 Приклад R 77 метил 78 етил Назва сполук оцтової кислоти 2-метил-3-(4метилбензоїл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір пропанової кислоти 2-метил-3-(4метилбензоїл)-1,1-діоксо-2Hбензо[e][1,2]тіазин-4-іловий ефір 1 15 ВЕРХ Вихід Маса + MNH4 5,05' 99% 81% 389 5,25' 99% 88% 403 * H ЯМР, ДМСО-d6, Приклад 77: 2.04 (s, 3H); 2.42 (s, 3H);2.98 (s, 3H); 7.42 (d, 2H); 7.76-7.90 (m, 5H); 7.98 (d, 1H). Приклад 78: 0.86 (t, 3H); 2.33 (q, 2H); 2.42 (s, 3H); 2.99 (s, 3H); 7.41 (d, 2H); 7.73 (d, 1H); 7.79-7.89 (m, 4H); 7.98 (d, 1H). Приклади 79 і 80 Сполуки 79 і 80 синтезували зі сполуки 3 та з метанолу і етанолу, відповідно, з використанням описаної вище методики одержання сполуки 59. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of benzothiazines, preparation thereof and application thereof as drugs
Автори англійськоюPerez, Michel, Lamothe, Marie, Junquero, Didier, Rival, Yves
Автори російськоюПерес Мишель, Ламот Мари, Жюнкро Дидье, Ривал Ив
МПК / Мітки
МПК: A61K 31/5415, C07D 275/06
Мітки: бензотіазинів, похідні, одержання, ліків, застосування
Код посилання
<a href="https://ua.patents.su/69-105040-pokhidni-benzotiaziniv-kh-oderzhannya-ta-zastosuvannya-yak-likiv.html" target="_blank" rel="follow" title="База патентів України">Похідні бензотіазинів, їх одержання та застосування як ліків</a>
Попередній патент: Похідні індолу як антагоністи рецептора crth2
Наступний патент: Щілинний мундштук для випуску сталевого розплаву в кристалізатор у горизонтальній установці для безперервної розливки у сталеву стрічку
Випадковий патент: Спосіб виготовлення холоднокатаної стрічки із сплавів на основі міді