Застосування нових 4,5,9-функціонально заміщених похідних акридину як ефективних інгібіторів ферменту топоізомерази i in vitro
Номер патенту: 117194
Опубліковано: 26.06.2017
Автори: Костина Валентина Григорівна, Алексєєва Інна Володимирівна, Негруцька Валентина Володимирівна, Дубей Ігор Ярославович, Лисенко Надія Антонівна
Формула / Реферат
Застосування нових 4,5,9-функціонально заміщених похідних акридину як ефективних інгібіторів ферменту топоізомерази І in vitro, що містять дві ДНК-зв'язувальні групи основного характеру в положеннях С-4 і С-9 та модулюючий біологічну активність замісник у положенні С-5 молекули, загальної формули:
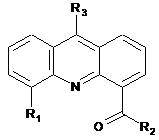 ,
,
де R1=Н, метил, метокси, хлор; R2= о-, м-, п-амінопіридил, о-, м-, п-амінометилпіридил; R3=N,N-диметиламіноетил(пропіл-)аміно-, о-, м-, п-амінометилпіридил, 1-(4-метилпіперазил), і за рахунок цього виявляють підвищену афінність до ДНК.
Текст
Реферат: Застосування нових 4,5,9-функціонально заміщених похідних акридину як ефективних інгібіторів ферменту топоізомерази І in vitro, що містять дві ДНК-зв'язувальні групи основного характеру в положеннях С-4 і С-9 та модулюючий біологічну активність замісник у положенні С5 молекули, загальної формули: R3 N R1 O R2 , де R1=Н, метил, метокси, хлор; R2= о-, м-, п-амінопіридил, о-, м-, п-амінометилпіридил; R3=N,Nдиметиламіноетил(пропіл-)аміно-, о-, м-, п-амінометилпіридил, 1-(4-метилпіперазил), і за рахунок цього виявляють підвищену афінність до ДНК. UA 117194 U (12) UA 117194 U UA 117194 U 5 10 15 20 25 30 35 40 Корисна модель належить до області медичної хімії й біохімії, а більш конкретно до застосування нових похідних акридину як інгібіторів ферменту топоізомерази І in vitro та може бути застосована в фармакології, біохімії, молекулярній біології та ін. Топоізомерази - ключові ферменти системи біосинтезу нуклеїнових кислот, відповідальні за релаксацію ДНК і, таким чином, за принципово важливі для клітини процеси реплікації, транскрипції та репарації ДНК [1]. Рівень експресії вказаних ферментів значно підвищений у клітинах, що швидко діляться. Так, активність топоізомераз набагато вища в пухлинних клітинах порівняно з нормальними, що дозволяє розглядати топоізомерази, зокрема топоізомеразу І, як важливу біологічну мішень для пошуку новітніх протипухлинних засобів [2-8]. Відомі протипухлинні інгібітори топоізомераз, що довгий час застосовуються в клінічній онкології (камптотецин, топотекан, етопозид та ін.). Для топоізомераз характерний і високий рівень активності в бактеріальних клітинах, тому специфічні інгібітори ферментів даного класу часто виявляють антибактеріальну дію [5, 6, 9, 10]. Відомі способи пригнічення активності топоізомерази І за допомогою інгібіторів на основі конденсованих гетероциклічних сполук. До основних класів інгібіторів ферменту належать інденоізохіноліни, 3-арилізохіноліни, індолокарбазоли, біс-бензімідазоли, похідні бензофенантридину, антрахінону та ін. [2-7, 11, 12] з замісниками гідрофільного та гідрофобного характеру. Недоліком відомих інгібіторів топоізомерази І є складність структури (побудовані переважно на основі 4-5-циклічних конденсованих систем), важкодоступність, недостатня біологічна активність і/або специфічність дії, значні побічні ефекти при терапевтичному застосуванні, швидке набуття бактеріальними та раковими клітинами резистентності до лікарських засобів, що приводить до неефективності існуючих препаратів та схем лікування. Це зумовлює необхідність пошуку нових ефективних, селективних і при цьому толерантних до нормальних клітин лікарських засобів, що діють шляхом специфічного інгібування топоізомерази І [11, 12]. Одним із класів інгібіторів топоізомерази І є похідні більш простої гетероциклічної системи акридину. Акридини давно привертають до себе увагу як речовини із широким спектром біологічної дії. Серед них відомі численні протимікробні та противірусні засоби [5, 6, 9, 10, 13-16] та речовини із протипухлинною активністю [2-8], механізм дії яких ґрунтується на інгібуванні топоізомерази І. До останніх зокрема належать препарати амсакрин, мепакрин, АНМА (3-(9акридиламіно)-5-гідроксиметиланілін), DACA (N-диметиламіноетилакридин-4-карбоксамід) та інші, які, як правило, містять замісник основного характеру [17-20]. Таким чином, літературні дані засвідчують перспективність пошуку біологічно активних речовин поміж нових похідних акридину, що можуть бути застосовані як інгібітори топоізомерази І із потенційною протипухлинною та протимікробною дією. В основу пропонованої корисної моделі поставлена задача розширити арсенал речовин, що можуть бути використані для інгібування топоізомерази І, за рахунок нових похідних акридину. Поставлена задача вирішується тим, що застосування нових 4,5,9-функціонально заміщених похідних акридину як ефективних інгібіторів фермента топоізомерази І, що містять дві ДНКзв'язувальні групи основного характеру в положеннях С-4 і С-9 та модулюючий біологічну активність замісник у положенні С-5 молекули, загальної формули: R3 N R1 45 50 O R2 , де R1=Н, метил, метокси, хлор; R2= о-, м-, п-амінопіридил, о-, м-, п-амінометилпіридил; R3=N,N-диметиламіноетил(пропіл-)аміно-, о-, м-, п-амінометилпіридил, 1-(4-метилпіперазил), і за рахунок цього виявляють підвищену афінність до ДНК. Вказане у формулі поєднання двох основних груп забезпечує ефективну взаємодію молекули інгібітора з ДНК і/або ДНК-топоізомеразним ферментативним комплексом, що. як відомо, і є головними молекулярними мішенями інгібіторів топоізомерази І [2, 3, 11, 12]. Виходили з того, що акридон-4-карбоксаміди, що містять піридильні фрагменти, виявили інгібувальну активність щодо топоізомерази І [21]. Додаткова основна, зокрема N,Nдиалкіламіногрупа (замісник R3), здатна протонуватись у воді й тим самим взаємодіяти з фосфат-аніонами ДНК, підсилюючи зв'язування інгібітора з біологічною мішенню. Введення в 1 UA 117194 U 5 10 15 20 25 30 35 40 45 50 55 молекулу інгібітора основного піридильного фрагмента R2 забезпечує додаткові гідрофобні взаємодії з ДНК і ферментативним комплексом. Електронодонорний або електроноакцепторний замісник R1 впливає на основність акридинового ядра і може модулювати біологічну активність інгібіторів ферменту. В запропонованій корисній моделі рівень інгібування новими сполуками топоізомерази І визначали шляхом дослідження їхнього впливу на ефективність ферментативної реакції in vitro в тест-системі релаксації ДНК. У процесі реакції суперспіралізована ДНК переводилася ферментом у релаксовану форму, яка добре відділяється від вихідної при гель-електрофорезі. Співвідношення цих форм визначає активність інгібіторів. Процес тестування включав інкубування ферментативної системи у присутності певної концентрації інгібітора при 37 °C протягом 30 хв. з подальшим розділенням реакційної суміші за допомогою електрофорезу в агарозному гелі. Визначення кількості суперспіралізованої та релаксованої форм ДНК здійснювали за допомогою візуалізації смуг ДНК в гелі шляхом його обробки ДНК-специфічним флуоресцентним барвником, таким, як етидійбромід або SYBR Green І. Концентрацію інгібітора, за якої досягається пригнічення 50 % активності ферменту (величина IC50), визначали шляхом аналізу залежності рівня інгібування ферменту від концентрації інгібітора, порівняно з контрольною реакцією, яку проводили за відсутності інгібіторів. Суть корисної моделі ілюструється даними таблиці, в якій показано залежність біологічної активності похідних акридину від структури та положення замісників. Результати біологічного тестування in vitro показали, що низькомолекулярні інгібітори на основі 4,5,9-заміщених акридинів ефективно пригнічують топоізомеразу І. Інгібітори, що містили одночасно аліфатичну основну групу в положенні С-9 та гетероароматичну основну групу в положенні С-4, виявили активність у низьких мікромолярних концентраціях. Введення в положення С-5 акридину електронодонорного замісника (метил, метокси) в кілька разів підвищило біологічну активність, тоді як електроноакцепторний атом хлору знижував активність інгібітора порівняно з 5-незаміщеним аналогом. При цьому, якщо інгібітор не містив основного замісника в положенні С-9 (похідні акридону 1-3), його біологічна активність різко знижувалася. її зниження спостерігалось за наявності в положення С-9 залишку менш гнучкого циклічного аліфатичного аміну (сполука 7) замість ациклічного. Інгібувальна активність сполук різко падала і в тому випадку, коли в положенні С-4 знаходився не піридильний, а аліфатичний основний замісник (наприклад сполука 4), або ароматичний чи аліфатичний неосновний замісник. Дані тестування нових сполук in vitro підтвердили коректність застосованого принципу дизайну структур заміщених похідних акридину як інгібіторів топоізомерази І. Це відкриває перспективи розробки на основі сполук даного класу нових ефективних протипухлинних і протимікробних хіміотерапевтичних засобів. Запропоновану корисну модель ілюструють наступні приклади. Приклад 1. Проведення реакції релаксації ДНК топоізомеразою І in vitro. Перевірку впливу інгібіторів на процес релаксації ДНК під дією топоізомерази І людини проводили в тест-системі in vitro згідно з протоколом, рекомендованим виробником ферменту - фірмою "Invitrogen" (США). Реакційна суміш містила 30 мкг/мл БСА (бичачий сироватковий альбумін), 1,25 мкл розчину досліджуваної речовини в ДМСО, 1 од.акт. ферменту у присутності 50 мМ тріс-НСl (рН 7,5), 50 мМ КСl, 10 мМ MgCl2, 0,5 мМ дитіотреїтол і воду, вільну від нуклеаз, до кінцевого об'єму 50 мкл. Розчин інгібітора певної концентрації додавали після приготування загальної суміші компонентів. Реакцію ініціювали внесенням субстрату - 0,5 мкг суперспіралізованої ДНК плазміди pBR322 (1 мкл). Процес проводили в термостаті при 37 °C протягом 30 хв. Кожен інгібітор тестували в концентраціях від 80 до 0,3 мкМ, використовуючи серійні 2-кратні розведення. Реакцію зупиняли нагріванням при температурі 65 °C протягом 10 хв. при додаванні буферу для нанесення проб (0,03 % бромфеноловий синій, 0,03 % ксиленціанол, 1 % додецилсульфат натрію, 60 % гліцерин, 17 мМ ЕДТА, рН 7,6), після чого швидко охолоджували на льоду. Отриману суміш аналізували за допомогою електрофорезу в 0,9-1 % агарозному гелі з наступною візуалізацією смуг ДНК шляхом фарбування гелю після проведення електрофорезу флуоресцентним барвником етидійбромідом. Гелі готували в 0,5-кратному буфері ТВЕ (трісборат-ЕДТА), який слугував і електродним буфером. Цифрові зображення гелів для кількісного аналізу отримували за допомогою лазерного сканера, або ж УФ-трансілюмінатора й цифрової фотокамери. 2 UA 117194 U 5 10 15 Приклад 2. Визначення інгібувальної дії сполук щодо топоізомерази І. Ефективність перебігу реакції визначали з електрофореграми продуктів ферментативної реакції. Кількість нерелаксованої суперспіралізованої ДНК в суміші відповідає рівню інгібування реакції релаксації. Ступінь релаксації Р розраховували як відношення відстані між смугою суперспіралізованої форми ДНК (СС) та центром смуги (групи смуг) частково релаксованої форми ДНК (ЧР) до відстані між смугами суперспіралізованої форми ДНК та повністю релаксованої форми (ПР) за формулою: Р=(СС-ЧР)/(СС-ПР)х100 % Відповідно, ступінь інгібування реакції І=100-Р (%), що становить різницю між часткою релаксованої ферментом ДНК в суміші, отриманій за відсутності інгібітора (100 %) та у присутності інгібітора [22, 23]. З отриманих даних будували криві залежності ступеня інгібування реакції від концентрації досліджуваної сполуки. З цих графіків визначали величини ІС50 інгібіторів. Визначення проводили щонайменше у 3-х незалежних повторах реакції релаксації для кожної концентрації інгібітора. Величини ІС50 сполук наведено у таблиці. Таблиця Інгібувальна активність деяких похідних акридину щодо топоізомерази І in vitro 1 R3 N R1 Сполука 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 R1 Н Н Me Н Н Н Н Н Н Н Н Н Me Me Me Me Me OMe OMe OMe Cl O R2 o-NHCH2-Py м-NHCH2-Py NH(CH2)3NMe2 NH(CH2)3NMe2 o-NHPy o-NHPy o-NHPy м-NHPy м-NHPy o-NHCH2-Py o-NHCH2-Py м-NHCH2-Py o-NHPy м-NHPy м-NHPy o-NHCH2-Py м-NHCH2-Py o-NHPy м-NHPy o-NHCH2-Py o-NHCH2-Py 1 R2 R3 OH OH OH NH(CH2)3NMe2 NH(CH2)2NMe2 NH(CH2)3NMe2 3 Pip NH(CH2)2NMe2 NH(CH2)3NMe2 o-NHCH2-Py NH(CH2)3NMe2 NH(CH2)2NMe2 NH(CH2)3NMe2 NH(CH2)2NMe2 NH(CH2)3NMe2 NH(CH2)3NMe2 NH(CH2)3NMe2 NH(CH2)3NMe2 NH(CH2)3NMe2 NH(CH2)3NMe2 NH(CH2)3NMe2 IC50, mkM 2 н.а. н.а. н.а. н.а. 11,9 14,6 н.а. 5,8 6,1 -50 2,5 20,2 3,8 2,8 1,1 1,6 3,1 1,2 2,3 3,2 7,1 стандартне відхилення не перевищує 5 % н.а. - неактивний (для сполук, у яких величина ІС50 вища, ніж найбільша досліджувана концентрація 80 мкМ) 3 Pip-1-(4-метилпіперазил) 2 3 UA 117194 U 5 10 15 20 25 30 35 40 45 50 55 Наведені результати тестування підтверджують, що запропоноване застосування нових 4,5,9-функціонально заміщених похідних акридину як ефективних інгібіторів ферменту топоізомерази І забезпечує високий рівень інгібування активності топоізомерази І, що досягається навіть за низьких мікромолярних концентрацій інгібіторів (8 сполук із найвищою активністю мають показники ІС50 в межах 1,1-3,2 мкМ). Заявлені низькомолекулярні інгібітори топоізомерази І розширили арсенал препаратів із потенційною терапевтичною дією, які можуть бути використані для інгібування цього фермента і за рахунок цього потенційно володіють протипухлинною та протимікробною активністю. Джерела інформації: 1. Champoux J.J. DNA topoisomerases: structure, function, and mechanism // Annu. Rev. Biochem. - 2001. - V. 70. - P. 369-413. 2. Pommier Y. Topoisomerase I inhibitors: camptothecins and beyond // Nature Rev. Cancer. 2006. - V. 6. - P. 789-802. 3. Pommier Y. DNA topoisomerase I inhibitors: chemistry, biology, and interfacial inhibition // Chem. Rev. - 2009. - V. 109. - P. 2894-2902. 4. Salerno S., Da Settimo F., Taliani S., Simorini F., La Motta C, Fornaciari G., Marini A.M. Recent advances in the development of dual topoisomerase I and II inhibitors as anticancer drugs // Curr. Med. Chem. - 2010. - V. 17. - P. 4270-4290. 5. Pommier Y., Leo E., Zhang H.-L., Marchand C. DNA topoisomerases and their poisoning by anticancer and antibacterial drugs // Chem. Biol. - 2010. - V. 17. - P. 421-433. 6. Kathiravan M.K., Khilare M.M., Nikoomanesh K., Chothe A.S., Jain K.S. Topoisomerase as target for antibacterial and anticancer drug discovery // J. Enzyme Inhib. Med. Chem. - 2013. - V. 28.P. 419-435. 7. Khadka D.B., Cho W.J. Topoisomerase inhibitors as anticancer agents: a patent update // Expert Opin. Ther. Pat. - 2013. - V. 23. - P. 1033-1056. 8. Xu Y., Her С. Inhibition of topoisomerase (DNA) I (TOP1): DNA damage repair and anticancer therapy // Biomolecules. - 2015. - V. 5. - P. 1652-1670. 9. Tse-Dinh Y.-C. Bacterial topoisomerase I as a target for discovery of antibacterial compounds // Nucleic Acids Res. - 2009. - V. 37. - P. 731-737. 10. Sanyal G., Doig P. Bacterial DNA replication enzymes as targets for antibacterial drug discovery // Expert Opin. Drug Discov. - 2012. - V. 7. - P. 327-339. 11. Sheng C., Miao Z., Zhang W. New strategies in the discovery of novel non-camptothecin topoisomerase I inhibitors // Curr. Med. Chem. - 2011. - V. 18. - P. 4389-4409. 12. Pommier Y. Drugging topoisomerases: lessons and challenges // ACS Chem. Biol. - 2013. - V. 8.-P. 82-95. 13. Wainwright M. Acridine-a neglected antibacterial chromophore // J. Antimicrob. Chemother. 2001. - V.47.-P. 1-13. 14. Goodell J.R., Madhok A.A., Hiasa H., Ferguson D.M. Synthesis and evaluation of acridine-and acridone-based anti-herpes agents with topoisom.erase activity // Bioorg. Med. Chem. - 2006. -V. 14. P. 5467-5480. 15. Stankiewicz-Drogon A., Palchykovska L.G., Kostina V.G., Alexeeva I.V., Shved A.D., Boguszewska-Chachulska A. M. New acridone-4-carboxylic acid derivatives as potential inhibitors of Hepatitis С virus infection // Bioorg. Med. Chem. - 2008. - V. 16. - P. 8846-8852. 16. Stankiewicz-Drogon A., Dorner В., Erker Т., Boguszewska-Chachulska A. M. Synthesis of new acridone derivatives, inhibitors of NS3 helicase, which efficiently and specifically inhibit subgenomic HCV replication // J. Med. Chem. - 2010. - V. 53. - P. 3117-3126. 17. Rewcastle G. W., Atwell G.J., Ghambers D., Baguley B. C, Denny W.A. Potential antitumor agents. 46. Structure-activity relationships for acridine monosubstituted derivatives of the antitumor agent N-[2-(dimethylamino)ethyl]-9-aminoacridine-4-carboxamide // J. Med. Chem. - 1986. - V. 29. P. 472-477. 18. Minura Т., Kato N., Sugaya Т., Ikuta M., Kato S., Kuge Y., Tomioka S., Kasai M. An efficient synthesis of a new class of DNA intercalating antitumor 7,10-dihydroxy-6H-pyrazolo[4,5,l-de]acridin-6ones //Synthesis. - 1999. - V. 6. - P. 947-952. 19. Ferreira R., Avino A., Mazzini S., Eritja R. Synthesis, DNA-binding and antiproliferative properties of acridine and 5-methylacridine derivatives // Molecules. - 2012. - V. 17. - P. 7067-7082. 20. Lafayette E.A., Vitalino de Almeida S.M. Synthesis, DNA binding and topoisomerase I inhibition activity of thiazacridine and imidazacridine derivatives // Molecules. - 2013. - V. 18. - P. 15035-15050. 4 UA 117194 U 5 21. Kostina V.G., Alexeeva I.V., Lysenko N.A., Negrutska V.V., Dubey I.Ya. Synthesis and biological evaluation of new derivatives of tricyclic heteroaromatic carboxamides as potential topoisomerase I inhibitors // Ukr. Bioorg. Acta. - 2016. - V. 14-P. 3-8. 22. Domanico P.L., Tse-Dinh Y.C. Mechanistic studies on E. coli DNA topoisomerase I: divalent ion effects // J. Inorg. Biochem. - 1991. - V. 42. - P. 87-96. 23. Bansal S., Sinha D., Singh M., Cheng B. 3,4-Dimethoxyphenyl bis-benzimidazole, a novel DNA topoisomerase inhibitor that preferentially targets Escherichia coli topoisomerase I // J. Antimicrob. Chemother. - 2012. - V. 67. - P. 2882-2891. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 10 15 Застосування нових 4,5,9-функціонально заміщених похідних акридину як ефективних інгібіторів ферменту топоізомерази І in vitro, що містять дві ДНК-зв'язувальні групи основного характеру в положеннях С-4 і С-9 та модулюючий біологічну активність замісник у положенні С-5 молекули, загальної формули: R3 N R1 O R2 , де R1=Н, метил, метокси, хлор; R2= о-, м-, п-амінопіридил, о-, м-, п-амінометилпіридил; R3=N,Nдиметиламіноетил(пропіл-)аміно-, о-, м-, п-амінометилпіридил, 1-(4-метилпіперазил), і за рахунок цього виявляють підвищену афінність до ДНК. 20 Комп’ютерна верстка О. Рябко Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/473
Мітки: застосування, інгібіторів, 4,5,9-функціонально, ферменту, нових, акридину, заміщених, ефективних, похідних, vitro, топоізомерази
Код посилання
<a href="https://ua.patents.su/7-117194-zastosuvannya-novikh-459-funkcionalno-zamishhenikh-pokhidnikh-akridinu-yak-efektivnikh-ingibitoriv-fermentu-topoizomerazi-i-in-vitro.html" target="_blank" rel="follow" title="База патентів України">Застосування нових 4,5,9-функціонально заміщених похідних акридину як ефективних інгібіторів ферменту топоізомерази i in vitro</a>
Попередній патент: Спосіб ідентифікації квіток шипшини
Наступний патент: Робот-тренажер для відпрацювання навичок першої та реанімаційної допомоги
Випадковий патент: Пристрій для обпирання тіл довільної форми











